Опухоли печени: современные подходы к диагностике и лечению
Печень – большой и жизненно важный орган, выполняющий множество функций. Диспансерные обследования практически всегда включают оценку функции печени по анализам крови, а также УЗИ брюшной полости и, в т.ч. печени. Однако находки, сделанные в ходе плановых или прицельных медицинских осмотров, нередко ставят в сложное положение и врачей, и пациентов.
Что мы знаем об опухолях печени? Всегда ли их необходимо лечить? Достаточно ли УЗИ, чтобы обнаружить рак? Являются ли приговором метастазы в печени? Рассказывает доктор медицинских наук, хирург-онколог Владимир Лядов, заведующий отделением общей онкологии Городской клинической онкологической больницы №1 г. Москвы.
Первично и вторично: какими бывают опухоли
Опухоли печени – огромная медицинская и общественная проблема. Статистика не отражает в полной мере сложившуюся ситуацию. Мы представляем, сколько каждый год появляется пациентов со злокачественными опухолями печени, желчного пузыря и желчных протоков. Однако немало людей страдают от вторичного рака – метастазов, то есть отсевов других опухолей в печень. И тут мы можем опираться только на очень приблизительные цифры.
Однако немало людей страдают от вторичного рака – метастазов, то есть отсевов других опухолей в печень. И тут мы можем опираться только на очень приблизительные цифры.
Кроме того, в отличие, например, от поджелудочной железы, где практически каждая выявленная опухоль требует лекарственного лечения или хирургического удаления, образования печени нередко являются доброкачественными и не требуют никакого вмешательства. Такие ситуации вообще не отражены в статистике, но все равно являются сложной клинической задачей для врачей и поводом для беспокойства пациента.
Если все же попытаться как-то оценить выраженность проблемы, получится следующее: ежегодно в нашей стране выявляется около 20 тысяч пациентов, страдающих первичными злокачественными опухолями печени и желчных протоков. Также каждый год по приблизительным оценкам у 30 тысяч пациентов обнаруживают метастазы рака толстой кишки в печень. Можно предположить, что число пациентов с метастазами в печень других опухолей не уступает, а скорее превосходит эти цифры.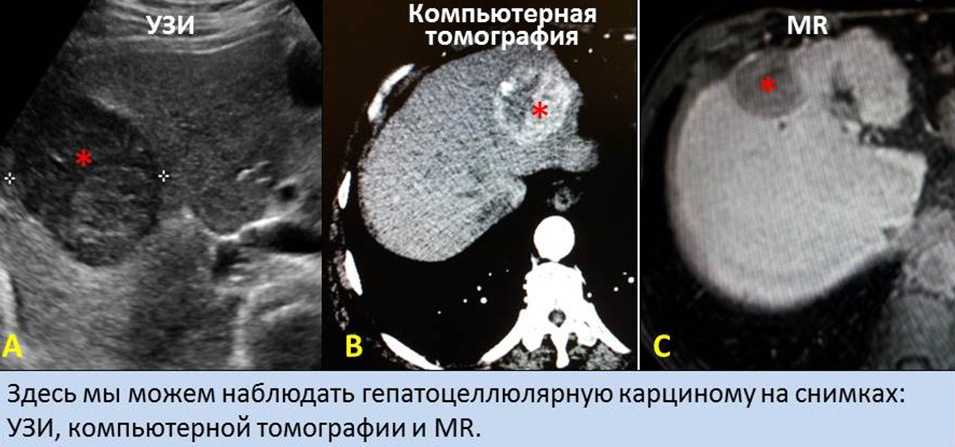 Доброкачественные образования (кисты, гемангиомы, узловая гиперплазия) очень распространены. Таким образом, можно уверенно говорить, что каждый год в нашей стране более 100 тысяч пациентов сталкиваются с необходимостью поиска врача в связи с образованиями в печени, в том числе злокачественными.
Доброкачественные образования (кисты, гемангиомы, узловая гиперплазия) очень распространены. Таким образом, можно уверенно говорить, что каждый год в нашей стране более 100 тысяч пациентов сталкиваются с необходимостью поиска врача в связи с образованиями в печени, в том числе злокачественными.
УЗИ, КТ, МРТ: что точнее
Несмотря на то, что печень довольно часто оценивают при обследовании, выявление опухолей в этом органе – задача сложная. Долгое время в нашей стране основным способом оценки подобных образований являлось ультразвуковое исследование (УЗИ). Это самый доступный и распространенный метод, однако допускающий большое количество неточностей и ошибок. У целого ряда пациентов УЗИ не позволяет выявить образование либо судить о его происхождении, а это чрезвычайно важно, чтобы успокоить пациента, которому не нужно лечение, или, наоборот, вовремя это лечение начать.
В последние десятилетия был разработан целый ряд более точных томографических методик – КТ, МРТ, ПЭТ, которые могут использоваться для обследования пациентов с образованиями в печени. Компьютерная томография является наиболее распространенным методом и в России, и во всем мире, но она тоже, к сожалению, не всегда позволяет точно поставить диагноз. Существуют опухоли, которые имеют такую же рентгеновскую плотность, как и обычная ткань печени, потому плохо видны на КТ. Кроме того, не всем пациентам правильно проводят исследование с контрастированием – введением внутривенного контрастного препарата, а без этой части исследования КТ становится бессмысленной при оценке образований печени.
Компьютерная томография является наиболее распространенным методом и в России, и во всем мире, но она тоже, к сожалению, не всегда позволяет точно поставить диагноз. Существуют опухоли, которые имеют такую же рентгеновскую плотность, как и обычная ткань печени, потому плохо видны на КТ. Кроме того, не всем пациентам правильно проводят исследование с контрастированием – введением внутривенного контрастного препарата, а без этой части исследования КТ становится бессмысленной при оценке образований печени.
Золотым стандартом при диагностике таких опухолей является магнитно-резонансная томография. К сожалению, пока не во всех городах страны есть возможность оперативно пройти МРТ, желательно опять же с контрастированием. Еще одной проблемой является то, что результат МРТ очень сильно зависит от качества проведения исследования, а подготовка лаборантов и врачей, работающих на этом оборудовании, не всегда является достаточной. Что касается ПЭТ – метода, основанного на использовании радиоактивного вещества, которое накапливается в быстро растущих клетках злокачественных опухолей, нередко мы используем его при обследовании пациентов, страдающих от местастазов в печени или для оценки эффективности лечения. Однако для первичной диагностики ПЭТ не всегда подходит – не все опухоли печени хорошо видны в этом случае.
Однако для первичной диагностики ПЭТ не всегда подходит – не все опухоли печени хорошо видны в этом случае.
Что же делать пациенту, у которого при УЗИ обнаружили образование в печени? В первую очередь помнить, что само по себе заключение – не диагноз и тем более не приговор. Нужно искать возможность пройти углубленное обследование – либо для собственного спокойствия, либо для того, чтобы вовремя поставить правильный диагноз и начать лечение.
Что лучше – химиотерапия, операция, а может быть «кибернож»?
В странах Азии первичные опухоли печени (гепатоцеллюлярный рак) встречаются часто, но для России это заболевание менее характерно. Большинство пациентов, которые у нас приходят к онкологам с образованиями в этом органе, страдают от метастазов рака кишечника, желудка, иногда других органов. Тут основная задача хирурга – определить, может ли он что-то добавить к уже проводимой химиотерапии. Если говорить о раке толстой кишки, хирургическое лечение является важнейшим этапом, который позволяет вылечить многих пациентов. Другая ситуация с опухолями желудка или поджелудочной железы: это более агрессивные заболевания и лишь очень редким пациентам, которые очень хорошо реагируют на химиотерапию, можно предложить хирургическое вмешательство. Тактика зависит от того, откуда метастазы.
Другая ситуация с опухолями желудка или поджелудочной железы: это более агрессивные заболевания и лишь очень редким пациентам, которые очень хорошо реагируют на химиотерапию, можно предложить хирургическое вмешательство. Тактика зависит от того, откуда метастазы.
Пациенты с образованиями в печени часто попадают в ситуацию, когда им предлагают излишне агрессивное лечение. Врачи рекомендуют, например, удаление небольших доброкачественных образований – таких, как кисты (это всего лишь пузырек с жидкостью) или гемангиомы (сосудистые опухоли, чаще всего врожденные и не требующие лечения). В то же время у пациентов со злокачественными опухолями – первичными или вторичными – возникает другая проблема: к сожалению, по грубым оценкам, в нашей стране не более четверти пациентов предлагается активное – например, хирургическое – лечение, позволяющее намного продлить жизнь, а иногда и излечить. Это связано во многом с дефицитом специалистов в области хирургии печени. В некоторых регионах нет специализированных отделений, где выполняются такие хирургические вмешательства. Длительное время онкологическая школа в нашей стране была ориентирована на лекарственное лечение этой группы пациентов – только химиотерапию. Но важность совместного использования разных методов подчеркивается одним простым обстоятельством: у каждого четвертого пациента, страдающего раком толстой кишки, а это одно из самых частых онкологических заболеваний, на момент выявления опухоли в кишечнике уже есть метастазы в печени. Приблизительно у такого же количества они появляются впоследствии. Так вот, если таким пациентам по какой-то причине не проводится хирургическое лечение, шансов на излечение практически нет. Химиотерапия позволяет некоторым пациентам прожить несколько лет, но практически никогда не приводит к полному излечению от рака. В то же время, если удается полностью удалить как опухоль кишечника, так и метастазы – в частности, в печени – то 40 процентов пациентов переживают пятилетний период, который мы нередко считаем критерием полного излечения. Эта цель достижима, но только если пациенты имеют возможность получать комплексное лечение (сочетание операции, лекарственного, иногда лучевого лечения).
Длительное время онкологическая школа в нашей стране была ориентирована на лекарственное лечение этой группы пациентов – только химиотерапию. Но важность совместного использования разных методов подчеркивается одним простым обстоятельством: у каждого четвертого пациента, страдающего раком толстой кишки, а это одно из самых частых онкологических заболеваний, на момент выявления опухоли в кишечнике уже есть метастазы в печени. Приблизительно у такого же количества они появляются впоследствии. Так вот, если таким пациентам по какой-то причине не проводится хирургическое лечение, шансов на излечение практически нет. Химиотерапия позволяет некоторым пациентам прожить несколько лет, но практически никогда не приводит к полному излечению от рака. В то же время, если удается полностью удалить как опухоль кишечника, так и метастазы – в частности, в печени – то 40 процентов пациентов переживают пятилетний период, который мы нередко считаем критерием полного излечения. Эта цель достижима, но только если пациенты имеют возможность получать комплексное лечение (сочетание операции, лекарственного, иногда лучевого лечения).
Развитие хирургии и анестезиологии приводят к тому, что на печени выполняются все более сложные операции. Если 10-15 лет назад хирургическое лечение проводилось лишь у пациентов с несколькими метастазами, то сегодня число очагов не является определяющим. Важно сохранить достаточно ткани печени, чтобы пациент мог перенести операцию и качественно жить дальше. Это требует сложной хирургической техники. Иногда приходится, если требуется удалить метастаз в глубине органа, применять метод абляции (выжигание очага) или специально сфокусированной, так называемой стереотаксической радиохирургии, которая проводится дистанционно, без повреждения тканей органа. Такие варианты лечения называются паренхимо-сохраняющими. Мы в своем отделении в ГКОБ№1 города Москвы их используем – например, ведем совместную работу со специалистами компании «ПЭТ-технолоджи», которые на сегодня владеют значительным для России опытом современной лучевой хирургии метастазов в печени. Уверен, что будущее в онкологии – за сочетанием различных методик..jpg)
Выбор медучреждения: где лечиться
Сочетание методов лечения, к сожалению, может предложить далеко не каждое медучреждение. У нас немало хирургических отделений, где активно проводят оперативные вмешательства, или онкологических, где больше внимания уделяют химиотерапии. Для пациента, столкнувшего с опухолью печени, очень важно обратиться в медучреждение, которое занимается комплексной диагностикой и терапией этого заболевания. Необходимо, чтобы его лечение обсуждалось междисциплинарно – и хирургами, и химиотерапевтами, и специалистами по лучевой терапии. Различные способы воздействия на опухоль – возможность увеличить шансы на выздоровление или как минимум подарить годы жизни, превратив острое тяжелое онкологическое заболевание в хроническое, по поводу которого пациент время от времени или постоянно проходит лечение.
Принципиальный момент – обращение в такое учреждение, где в постоянном режиме проводится лечение большого количества пациентов с такой проблемой. Опыт, который есть у работающих там специалистов, позволяет совместно выработать индивидуальную и максимально эффективную стратегию лечения. Это и есть так называемый персонализированный подход, который максимально приветствуется в современной медицине, в том числе при лечении образований печени.
Опыт, который есть у работающих там специалистов, позволяет совместно выработать индивидуальную и максимально эффективную стратегию лечения. Это и есть так называемый персонализированный подход, который максимально приветствуется в современной медицине, в том числе при лечении образований печени.
Пожилой пациент: когда еще могут помочь?
Говоря о важности персонализированного подхода, нужно обязательно сказать несколько слов о проблеме возраста пациентов. Реальный случай: недавно к нам обратился мужчина, годом ранее оперированный по поводу опухоли толстого кишечника. В ходе операции у него были выявлены метастазы в печени, по поводу которых он в дальнейшем прошел несколько курсов химиотерапии. Лечащий врач посчитал, что хирургическое лечение метастазов ему не показано –на основании того, что пациенту около 70 лет. При пересмотре снимков мы выяснили, что выявленное во время первой операции образование в печени вообще не являлось метастазом – это была киста, не имевшая отношения к раку толстой кишки. Однако в глубине ткани печени действительно обнаружились два очага опухоли вместе с еще несколькими кистами. Это сложная ситуация для диагностики. Пациент был прооперирован: нам удалось как удалить метастазы, так и закрыть сформированную в другом учреждении кишечную стому. Операция прошла гладко, не только дав больному хорошие шансы на полное излечение от рака, но и вернув прежнее качество жизни. Сейчас химиотерапия ему не проводится, он живет обычной жизнью.
Однако в глубине ткани печени действительно обнаружились два очага опухоли вместе с еще несколькими кистами. Это сложная ситуация для диагностики. Пациент был прооперирован: нам удалось как удалить метастазы, так и закрыть сформированную в другом учреждении кишечную стому. Операция прошла гладко, не только дав больному хорошие шансы на полное излечение от рака, но и вернув прежнее качество жизни. Сейчас химиотерапия ему не проводится, он живет обычной жизнью.
Чем старше пациенты, тем чаще им отказывают в лечении только на основании биологического возраста. Между тем многие из них могут перенести достаточно агрессивную терапию и прожить еще долго, будучи вылеченными. Каждый третий мой пациент – старше 75 лет. Если говорить об опухолях печени, самым пожилым из успешно прооперированных в моей практике был 85-летний, а по поводу других опухолей мы в отделении регулярно оперируем и 90-летних. Все определяется общим состоянием, но никак не возрастом, и врачам, определяющим тактику лечения, нужно смотреть на самого пациента, а не на цифры в его паспорте..jpg)
Что делать при метастазах в печени – лечение и прогноз жизни
Доктор Вадим Бережной
General practitioner, Medical expert, Head of the department of medical assistance.
1. Что означают метастазы в печени? |
2. Что делать при метастазах в печени? |
3. Как диагностировать метастазы в печени? |
4. Как бороться с метастазами в печени? |
5. Лечение метастазов в печени без операции |
6. Хирургия метастазов в печениг |
7. Сколько живут люди с метастазами в печени? |
8. Где лечат метастазы печени? |
9. Жизнь с метастазами в печени |
Время чтения – 9 минут
25% метастазов обнаруживают в печени. Этот орган часто становится локацией для раковых клеток из-за своего богатого кровоснабжения и присутствия гуморальных факторов, которые способствуют их росту. Лечение метастазов печени зависит от того, из какого типа рака образовались вторичные опухоли.
Этот орган часто становится локацией для раковых клеток из-за своего богатого кровоснабжения и присутствия гуморальных факторов, которые способствуют их росту. Лечение метастазов печени зависит от того, из какого типа рака образовались вторичные опухоли.
Достижения современной медицины в иностранных клиниках дают надежду на благоприятный прогноз. Из этой статьи вы можете узнать, как и с каким успехом метастазы печени лечат в зарубежных клиниках. Попасть на лечение в одну из них можно с помощью MediGlobus.
Что означают метастазы в печени?
Метастазы в печени возникают когда рак достиг 4 стадии. Это клетки первичной опухоли, которые по кровеносным сосудам попали в печень и проросли в ней. Чаще всего метастазы в печени образуются при раке толстой и прямой кишки. Также они встречаются у людей с раком груди, пищевода, желудка, поджелудочной железы, легких, почек и кожи.
Около 20-25% пациентов с колоректальным раком имеют метастазы в печени.
Метастазы печени встречаются в 18-40 раз чаще, чем первичный рак печени. Они возникают чаще у мужчин, чем у женщин, и большинство пациентов – старше 50 лет.
90% метастазов печени присутствуют в виде множественных опухолей. У более чем трех четвертей пациентов с метастазами в печени наблюдается поражение обеих долей органа.
Лечение метастазов печени за рубежом
Для эффективной терапии метастазов печени необходима экспертиза целой команды врачей, которые имеют опыт в лечении этого заболевания. Такой уход доступен в зарубежных онкоцентрах, лечение в которых может организовать наша команда. Оставляйте свои заявки, нажав на кнопку “Записаться на лечение метастазов печени”
Записаться на лечение метастазов печени
Что делать при метастазах в печени?
При обнаружении метастазов в печени не следует опускать руки. В сравнении с другими органами, метастазы печени хорошо поддаются лечению. В многих случаях врачам удается эффективно остановить их рост, что дает пациенту еще несколько месяцев или даже лет жизни. Кроме того, удаление метастазов позволяет избавиться от негативных симптомов, которые их вызывают.
Кроме того, удаление метастазов позволяет избавиться от негативных симптомов, которые их вызывают.
Онкобольным, у которых диагностировали метастазы, важно получить поддержку от окружающих и близких. Им поможет работа с психологом или обращение в группу поддержки, где они смогут пообщаться с другими пациентами с таким же диагнозом. Это поможет найти в себе силы продолжить лечение.
Как диагностировать метастазы в печени?
Метастазы печени не имеют конкретной симптоматики, поэтому их сложно диагностировать без тщательного обследования врача. Иногда пациенты жалуются на боль в животе, потерю аппетита, жар, отечность ног и желтуху; но у некоторых метастазы появляются бессимптомно.
Пациентам, которые болеют раком с высоким риском возникновения метастазов, нужно каждые 3-5 месяцев проходить обследования для того, чтобы обнаружить новообразования вовремя.
Метастазы печени важно отличать от доброкачественных опухолей. Также при планировании лечения нужно точно знать количество и расположение образований. С этой целью врачи назначают:
С этой целью врачи назначают:
УЗИ
С помощью ультразвука врачи осматривают портальные и печеночные вены и выясняют, не переросла ли опухоль в другие части тела. Также этот метод позволяет эффективно отличить доброкачественные новообразования от злокачественных.
МРТ и КТ
Методы визуализации используют для получения детальных изображений печени, желчного пузыря, желчных протоков, близлежащих лимфатических узлов и других внутренних органов. Обычно МРТ более чувствительна к метастазам печени, чем КТ. Однако, этот вид опухолей может выглядеть по-разному, поэтому иногда использование нескольких методов обследования обоснованно.
ПЭТ-КТ
Перед началом ПЭТ-КТ пациенту вводится небольшое количество радиоактивного сахара. Он активнее поглощается раковыми тканями, благодаря чему их становится хорошо видно на снимке. Этот метод полезен для обнаружения точного размера и расположения метастазов.
Биопсию
Лабораторный анализ опухоли позволяет надежно определить тип и степень злокачественности клеток, тем самым – отличить метастазы печени от других карцином и доброкачественных образований. В зависимости от расположения опухоли, биопсию возможно провести лапароскопическим путем, то есть без открытой операции.
В зависимости от расположения опухоли, биопсию возможно провести лапароскопическим путем, то есть без открытой операции.
Кроме того, выделение клеток опухоли позволяет провести их генетический анализ и подобрать наиболее эффективные медицинские препараты.
Можно ли метастазы в печени перепутать с гемангиомой?
Опухоли печени легко перепутать друг с другом специалисту, который не имеет большого опыта в диагностике этих заболеваний. MediGlobus может помочь получить экспертное мнение ведущих мировых онкологов. Для этого нажмите на кнопку “Получить второе врачебное мнение”, и мы поможем организовать диагностику в надежном онкоцентре
Получить второе врачебное мнение
Как бороться с метастазами в печени?
В настоящее время для терапии метастазов печени используется несколько вариантов. В большинстве случаев лечение будет паллиативным. Это означает, что оно будет использоваться для контроля симптомов рака и продления жизни, но вряд ли приведет к излечению. Обычно выбор методов зависит от:
Обычно выбор методов зависит от:
- возраста и общего состояния здоровья человека; размера, местоположения и количества метастатических опухолей; местоположения и типа первичного рака; того, какие виды терапии пациент проходил в прошлом.
Лечение метастазов печени с помощью сочетания хирургии и химиотерапии имеет самый высокий процент выживаемости. Конкретный протокол лечения зависит от типа первичного рака, так как разные типы клеток по-разному реагируют на лекарства.
Лечение метастазов в печени без операции
Химиотерапия
Химиотерапия – это лекарства, способные убивать раковые клетки. Они нацелены на ткани, которые быстро растут и размножаются.
Лучевая терапия
Лучевая терапия использует высокоэнергетическое излучение, чтобы убить раковые клетки и уменьшить опухоли.
Радиочастотная абляция
Радиочастотная абляция – это процедура, которая использует электрический ток для разрушения раковых клеток.
BRM терапия
BRM-терапия использует антитела, факторы роста и вакцины для повышения или восстановления иммунной системы. Это помогает бороться с раком. BRM-терапия не имеет обычных побочных эффектов, как при других методах лечения рака, и в большинстве случаев хорошо переносится.
Таргетная терапия
Таргетная терапия убивает раковые клетки, но делает это точнее, чем химиотерапия. Таргетная терапия оставляет здоровые клетки нетронутыми.
Гормональная терапия
Гормональная терапия может замедлить или остановить рост определенных типов опухолей, зависящих от гормонов, таких как рак молочной железы и простаты.
Лечение метастазов печени за рубежом
В зарубежных клиниках используют современные протоколы терапии, а также в них доступны методы лечения, которые еще не используют в клиниках СНГ. MediGlobus может рекомендовать клиники, в которых вы сможете сэкономить 20-30%, не снижая качества лечения. Оставьте свою заявку, нажав на кнопку ниже
Записаться на лечение метастазов печени
Хирургия метастазов в печени
Хирургическая резекция остается “золотым стандартом” для лечения метастазов печени. Согласно клиническим рекомендациям, врач должен оставить не менее 40% печени при циррозе, 30% – при печеночной дисфункции легкой или умеренной степени тяжести, и 20% – при здоровом органе.
Согласно клиническим рекомендациям, врач должен оставить не менее 40% печени при циррозе, 30% – при печеночной дисфункции легкой или умеренной степени тяжести, и 20% – при здоровом органе.
Для того чтобы повысить успешность операции, проводят:
- 4-6 месяцев химиотерапии; эмболизацию портальных вен; двухэтапную резекцию печени.
Наблюдательное исследование, проведенное в клинике Асан в Корее, показало, что дооперационная химиотерапия повышает трехлетнюю безболезненную выживаемость с 20,4% до 31,7%.
Сколько живут люди с метастазами в печени?
То, насколько эффективно лечение метастазов печени, зависит от расположения исходного рака и от того, насколько он распространился. В небольшом числе случаев операция по удалению опухолей печени может привести к излечению. Обычно это возможно только у пациентов с определенными типами опухолей (например, раком толстой кишки) при ограниченном числе опухолей печени. Около 20% пациентам удается полностью вылечить рак после такой операции.
Около 20% пациентам удается полностью вылечить рак после такой операции.
Позитивный прогноз лечения наблюдается у пациентов:
- Без первичных метастазов в лимфоузлах; С одной опухолью в печени размером меньше 5 см; При уровне КЭА <200 нг/мл; При периоде без признаков заболевания более 1 года.
Где лечат метастазы печени?
Метастазы в печени – есть ли шанс?
В большинстве случаев рак, распространившийся на печень, не поддается лечению. Однако вышеописанные методы лечения могут помочь уменьшить количество опухолей, увеличить продолжительность жизни и облегчить симптомы.
Самые распространенные проблемы, с которыми имеют дело пациенты с метастазами печени – это усталость и потеря аппетита. Медицинская команда может помочь адаптироваться к такой жизни, с помощью лекарств и физиотерапии. Также полезными могут быть советы от других онкобольных о том, как лучше справиться с негативными симптомами в каждодневной жизни. Метастазы в печени редко вызывают сильную боль, и в таких случаях назначаются обезболивающие.
Метастазы в печени редко вызывают сильную боль, и в таких случаях назначаются обезболивающие.
Резюме
Метастазы в печени это – клетки первичной опухоли 4 стадии, которые по кровеносным сосудам попали в печень и проросли в ней. Чаще всего метастазы в печени возникают при раке прямой и толстой кишки. Онкобольным, у которых диагностировали метастазы, важно получить поддержку от окружающих и близких. Им поможет работа с психологом или обращение в группу поддержки, где они смогут пообщаться с другими пациентами с таким же диагнозом. Для диагностики метастазов в печени используют УЗИ, МРТ, КТ, ПЭТ-КТ и биопсию. Самый эффективный метод лечения метастазов опухоли – это сочетание операции вместе с сопровождающим лечением: химиотерапией, лучевой терапией, таргетной терапией, BRM терапией. Некоторые опухоли также можно удалить с помощью радиочастотной абляции. В большинстве случаев лечение пациентов с метастазами в печени будет паллиативным. Средняя пятилетняя выживаемость составляет 11%. Паллиативная может продлить жизнь больного на месяцы. Лечение метастазов в печени доступно в передовых онкоцентрах Турции, Израиля, Испании, Германии и Кореи.
Средняя пятилетняя выживаемость составляет 11%. Паллиативная может продлить жизнь больного на месяцы. Лечение метастазов в печени доступно в передовых онкоцентрах Турции, Израиля, Испании, Германии и Кореи. Получить бесплатную консультацию
Источники:
- 1. Мемориальный онкологический центр имени Слоуна — Кеттеринга о метастазах печени
- 2. Калифорнийский университет Сан-Франциско о метастазах печени
- 3. Американское Общество Онкологов
- 4. Отделение Радиологии университета Мельборна
- 5.Университет Тенесси-Нэшвилль
- 6. Журнал “Medicine”
- 7. Журнал “Anals of Surgery”
Онкология
Доктор Вадим Бережной
General practitioner, Medical expert, Head of the department of medical assistance.
Victoria Kulyk
Занимается медицинским копирайтингом с 2019 года. Имеет образование в сфере клинической психологии. С 2010 года изучает медицину, окончила подготовительные курсы медшколы. Свободное время посвящает изучению современного положения медицинской сферы в мире и научных инноваций. В сферу интересов входят нейронауки, биология, генетика, физиология, медтехнологии. Свободно владеет украинским, английским и русским, изучает немецкий.
Свободное время посвящает изучению современного положения медицинской сферы в мире и научных инноваций. В сферу интересов входят нейронауки, биология, генетика, физиология, медтехнологии. Свободно владеет украинским, английским и русским, изучает немецкий.
Похожие посты
Протонная терапия рака предстательной железы
Читать дальше
Часто задаваемые вопросы онкологу о раке шейки матки
Читать дальше
Насколько улучшилось лечение рака печени за последние десятилетия?
Читать дальше
Злокачественные новообразования печени: корреляция между сонографическими данными и патологическими особенностями
1. Маруяма К., Йошикава М., Йокосука О. Ультрасонография с контрастным усилением: недавнее применение для диагностики и лечения гепатоцеллюлярной карциномы. JNMA J Nepal Med Assoc. 2008; 47: 156–166. [PubMed] [Google Scholar]
2. Кудо М. Визуальная диагностика гепатоцеллюлярной карциномы и предраковых/пограничных поражений. Семин Печень Дис. 1999; 19: 297–309. [PubMed] [Академия Google]
Семин Печень Дис. 1999; 19: 297–309. [PubMed] [Академия Google]
3. Кудо М. Контрастное гармоническое ультразвуковое исследование – революционная технология в диагностике и лечении гепатоцеллюлярной карциномы. Джей Мед Ультрасон. 2001; 28:79–81. [Google Scholar]
4. Ding H, Kudo M, Onda H, Suetomi Y, Minami Y, Maekawa K. Гепатоцеллюлярная карцинома: изображение паренхиматозного потока опухоли с помощью прерывистой гармонической допплерографии в ранней артериальной фазе в режиме двойного отображения . Радиология. 2001; 220:349–356. [PubMed] [Google Scholar]
5. Ding H, Kudo M, Maekawa K, Suetomi Y, Minami Y, Onda H. Обнаружение опухолевого паренхиматозного кровотока в опухолях печени: ценность визуализации второй гармоники с контрастом на основе галактозы агент. Гепатол рез. 2001; 21: 242–251. [PubMed] [Академия Google]
6. Ding H, Kudo M, Onda H, Suetomi Y, Minami Y, Chung H, Kawasaki T, Maekawa K. Оценка ответа после лечения гепатоцеллюлярной карциномы с контрастным усилением кодированной фазовой инверсии гармонического УЗИ: сравнение с динамической КТ . Радиология. 2001; 221:721–730. [PubMed] [Google Scholar]
Радиология. 2001; 221:721–730. [PubMed] [Google Scholar]
7. Minami Y, Kudo M, Kawasaki T, Kitano M, Chung H, Maekawa K, Shiozaki H. Транскатетерная артериальная химиоэмболизация гепатоцеллюлярной карциномы: полезность гармонической сонографии с кодированной фазовой инверсией. AJR Am J Рентгенол. 2003; 180:703–708. [PubMed] [Академия Google]
8. Wen YL, Kudo M, Zheng RQ, Minami Y, Chung H, Suetomi Y, Onda H, Kitano M, Kawasaki T, Maekawa K. Радиочастотная абляция гепатоцеллюлярной карциномы: терапевтический ответ с использованием кодированной фазовой инверсии с контрастным усилением гармоническая сонография. AJR Am J Рентгенол. 2003; 181:57–63. [PubMed] [Google Scholar]
9. Wen YL, Kudo M, Maekawa K, Minami Y, Chung H, Suetomi Y, Onda H, Kitano M, Kawasaki T. Контрастная расширенная динамическая визуализация потока и контрастная визуализация вычитания импульсов: предварительная приводит к опухолям печени. Джей Мед Ультрасон. 2002;29: 195–204. [PubMed] [Google Scholar]
10. Wen YL, Kudo M, Minami Y, Chung H, Suetomi Y, Onda H, Kitano M, Kawasaki T, Maekawa K. Визуализация обнаружения агента с контрастным усилением: ранний опыт лечения гепатоцеллюлярной карциномы . Джей Мед Ультрасон. 2003; 30:77–84. [PubMed] [Google Scholar]
Wen YL, Kudo M, Minami Y, Chung H, Suetomi Y, Onda H, Kitano M, Kawasaki T, Maekawa K. Визуализация обнаружения агента с контрастным усилением: ранний опыт лечения гепатоцеллюлярной карциномы . Джей Мед Ультрасон. 2003; 30:77–84. [PubMed] [Google Scholar]
11. Вен Ю.Л., Кудо М., Минами Ю., Чунг Х., Суэтоми Ю., Онда Х., Китано М., Кавасаки Т., Маэкава К. Значение нового контрастного гармонического метода для выявления васкуляризации опухоли в гепатоцеллюлярной ткани. карцинома: предварительные результаты. Джей Мед Ультрасон. 2003; 30: 85–9.2. [PubMed] [Google Scholar]
12. Вен Ю.Л., Кудо М., Минами Ю., Чанг Х., Суэтоми Ю., Онда Х., Китано М., Кавасаки Т., Маэкава К. Обнаружение васкуляризации опухоли при гепатоцеллюлярной карциноме с контрастированием. улучшенная динамическая визуализация потока: сравнение с контрастной допплеровской визуализацией. Джей Мед Ультрасон. 2003; 30: 141–151. [PubMed] [Google Scholar]
13. Wang WP, Ding H, Qi Q, Mao F, Xu ZZ, Kudo M. Характеристика очаговых поражений печени с помощью ультрасонографии в серой шкале C-cube с контрастированием. Мир J Гастроэнтерол. 2003;9: 1667–1674. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мир J Гастроэнтерол. 2003;9: 1667–1674. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Вэнь Ю.Л., Кудо М., Чжэн Р.К., Дин Х., Чжоу П., Минами Ю., Чунг Х., Китано М., Кавасаки Т., Маэкава К. Характеристика опухолей печени : значение кодированной фазовой инверсии гармоники с контрастным усилением. AJR Am J Рентгенол. 2004; 182:1019–1026. [PubMed] [Google Scholar]
15. Вэнь Ю.Л., Чжоу П., Кудо М. Обнаружение внутриопухолевой васкуляризации в небольшой гепатоцеллюлярной карциноме с помощью закодированных гармоник инверсии фазы. Интервирусология. 2004;47:169–178. [PubMed] [Google Scholar]
16. Чжэн Р. К., Чжоу П., Кудо М. Гепатоцеллюлярная карцинома с появлением узла в узле: демонстрация с помощью кодированной фазовой гармоники с контрастным усилением. Интервирусология. 2004; 47: 184–190. [PubMed] [Google Scholar]
17. Кудо М. Раннее выявление и радикальное лечение гепатоцеллюлярной карциномы на ранней стадии. Клин Гастроэнтерол Гепатол. 2005;3:S144–S148.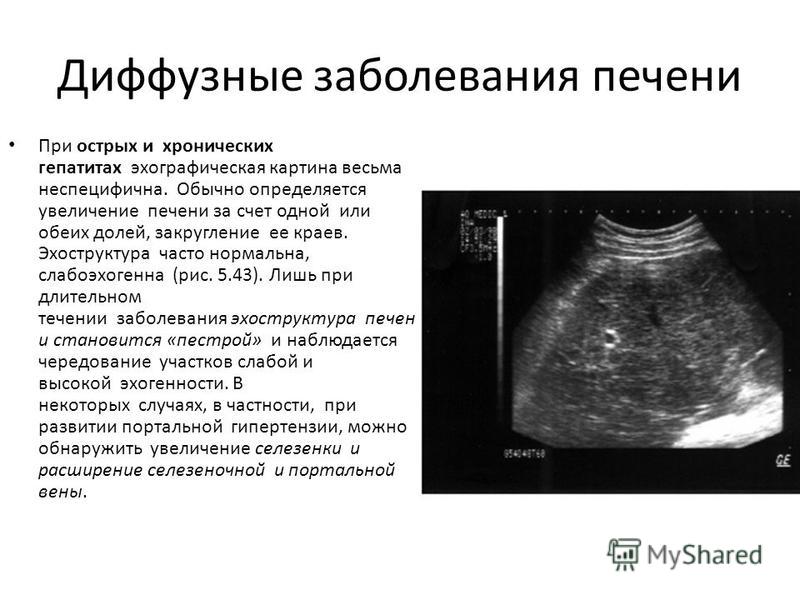 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
18. Zheng RQ, Kudo M. Ангиомиолипома печени: идентификация эфферентного сосуда как печеночной вены с помощью гармонического ультразвука с контрастным усилением. Бр Дж Радиол. 2005;78:956–960. [PubMed] [Google Scholar]
19. Zheng RQ, Zhang B, Kudo M, Sakaguchi Y. Гемодинамические и морфологические изменения периферической печеночной сосудистой сети при циррозе печени: предварительное исследование с использованием гармонической ультрасонографии с кодированной фазой и инверсией контраста. Мир J Гастроэнтерол. 2005; 11: 6348–6353. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Иноуэ Т., Китано М., Кудо М., Сакамото Х., Кавасаки Т., Ясуда С., Маэкава К. Диагностика заболеваний желчного пузыря с помощью гармонического ультразвукового исследования с инверсией фазы с контрастированием . Ультразвук Медицина Биол. 2007; 33: 353–361. [PubMed] [Академия Google]
21. Кудо М. Новые сонографические методы диагностики и лечения гепатоцеллюлярной карциномы. Гепатол рез. 2007;37 Приложение 2:S193–S199. [PubMed] [Google Scholar]
Гепатол рез. 2007;37 Приложение 2:S193–S199. [PubMed] [Google Scholar]
22. Zhou P, Kudo M, Minami Y, Chung H, Inoue T, Fukunaga T, Maekawa K. Какое лучшее время для оценки ответа на лечение после радиочастотной абляции гепатоцеллюлярной карциномы с использованием контраста? расширенная сонография? Онкология. 2007; 72 Приложение 1:92–97. [PubMed] [Google Scholar]
23. Кудо М., Хатанака К., Маекава К. Ультразвук с усилением соназоидов в диагностике и лечении опухолей печени. J Med Ультразвук. 2008; 16: 130–139.. [Google Scholar]
24. Кудо М., Хатанака К., Маекава К. Реперфузионная визуализация дефектов — недавно разработанная новая технология с использованием соназоида для лечения гепатоцеллюлярной карциномы. J Med Ультразвук. 2008; 16: 169–176. [Google Scholar]
25. Иноуэ Т., Кудо М., Хатанака К., Такахаши С., Китаи С., Уэда Т., Исикава Э., Хагивара С., Минами Й., Чунг Х. и др. Визуализация гепатоцеллюлярной карциномы: качественный и количественный анализ постваскулярной фазы контрастного УЗИ с соназоидом.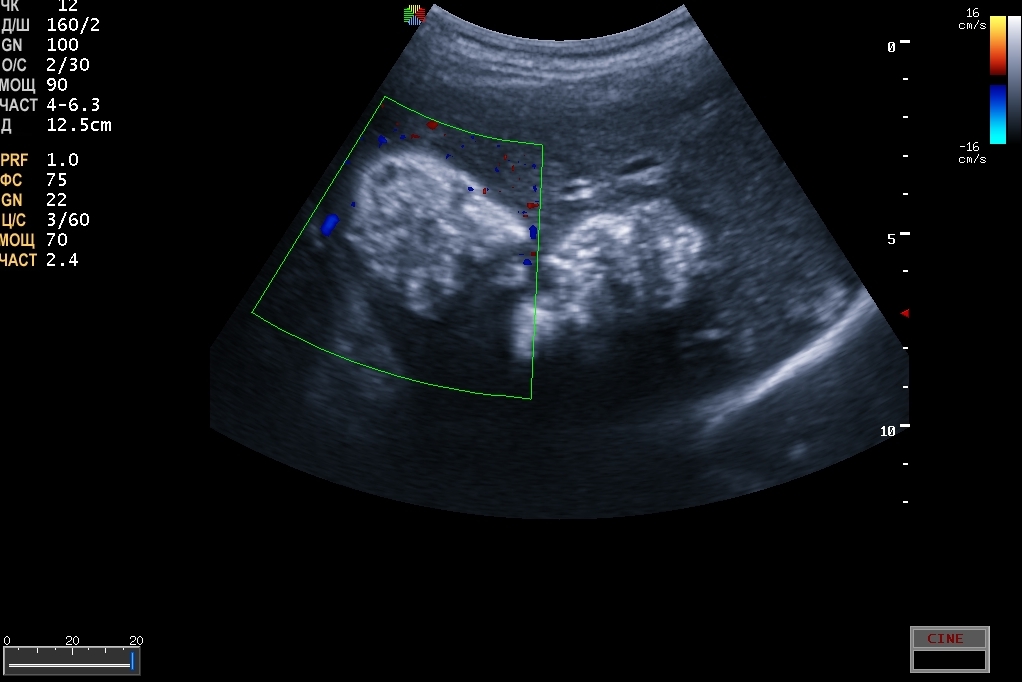 Сравнение с магнитно-резонансными изображениями суперпарамагнитного оксида железа. Онкология. 2008; 75 Приложение 1:48–54. [PubMed] [Академия Google]
Сравнение с магнитно-резонансными изображениями суперпарамагнитного оксида железа. Онкология. 2008; 75 Приложение 1:48–54. [PubMed] [Академия Google]
26. Xia Y, Kudo M, Minami Y, Hatanaka K, Ueshima K, Chung H, Hagiwara S, Inoue T, Ishikawa E, Kitai S, et al. Оценка ответа на транскатетерную артериальную химиоэмболизацию при гепатоцеллюлярной карциноме: полезность гармонической сонографии с усилением соназоидов. Онкология. 2008; 75 Приложение 1:99–105. [PubMed] [Google Scholar]
27. Кудо М., Минами Ю. Радиочастотная абляционная терапия под контролем гармонической визуализации при рецидивирующем раке после локальной терапии ГЦК: рандомизированное контролируемое исследование с РЧА под контролем B-режима. Ультразвук Медицина Биол. 2003;29:S145. [Google Scholar]
28. Minami Y, Kudo M, Kawasaki T, Chung H, Ogawa C, Shiozaki H. Лечение гепатоцеллюлярной карциномы с помощью чрескожной радиочастотной абляции: полезность контрастной гармонической сонографии для поражений, плохо определяемых с помощью сонографии в B-режиме. AJR Am J Рентгенол. 2004; 183:153–156. [PubMed] [Google Scholar]
AJR Am J Рентгенол. 2004; 183:153–156. [PubMed] [Google Scholar]
29. Minami Y, Kudo M, Chung H, Kawasaki T, Yagyu Y, Shimono T, Shiozaki H. Контрастная гармоническая сонография под контролем радиочастотной аблационной терапии по сравнению с B-режимом сонографии при гепатоцеллюлярной карциноме: перспектива рандомизированное контролируемое исследование. AJR Am J Рентгенол. 2007;188:489–494. [PubMed] [Google Scholar]
30. Minami Y, Kudo M, Kawasaki T, Chung H, Ogawa C, Shiozaki H. Чрескожная радиочастотная абляция под контролем гармонической сонографии с контрастным усилением и искусственным плевральным выпотом при гепатоцеллюлярной карциноме в куполе печени . AJR Am J Рентгенол. 2004; 182:1224–1226. [PubMed] [Google Scholar]
31. Kono Y, Lucidarme O, Choi SH, Rose SC, Hassanein TI, Alpert E, Mattrey RF. Ультразвуковое исследование с контрастированием как предиктор эффективности лечения в первые 2 недели после трансартериальной химиоэмболизации гепатоцеллюлярной карциномы. J Vasc Interv Radiol. 2007; 18:57–65. [PubMed] [Академия Google]
J Vasc Interv Radiol. 2007; 18:57–65. [PubMed] [Академия Google]
32. Kanai T, Hirohashi S, Upton MP, Noguchi M, Kishi K, Makuuchi M, Yamasaki S, Hasegawa H, Takayasu K, Moriyama N. Патология мелкой гепатоцеллюлярной карциномы. Предложение по новой общей классификации. Рак. 1987; 60: 810–819. [PubMed] [Google Scholar]
33. Накашима О., Кодзиро М. Рецидив гепатоцеллюлярной карциномы: мультицентрическое возникновение или внутрипеченочное метастазирование? Взгляд с точки зрения патологии. J Hepatobiliary Pancreat Surg. 2001; 8: 404–409. [PubMed] [Академия Google]
34. Кодзиро М. Внешний вид «узелка в узле» при гепатоцеллюлярной карциноме: его значение как морфологического маркера дедифференцировки. Интервирусология. 2004; 47: 179–183. [PubMed] [Google Scholar]
35. Кодзиро М. Диагностическое несоответствие ранней гепатоцеллюлярной карциномы между Японией и Западом. Гепатол рез. 2007;37 Приложение 2:S121–S124. [PubMed] [Google Scholar]
36. Kojiro M, Roskams T.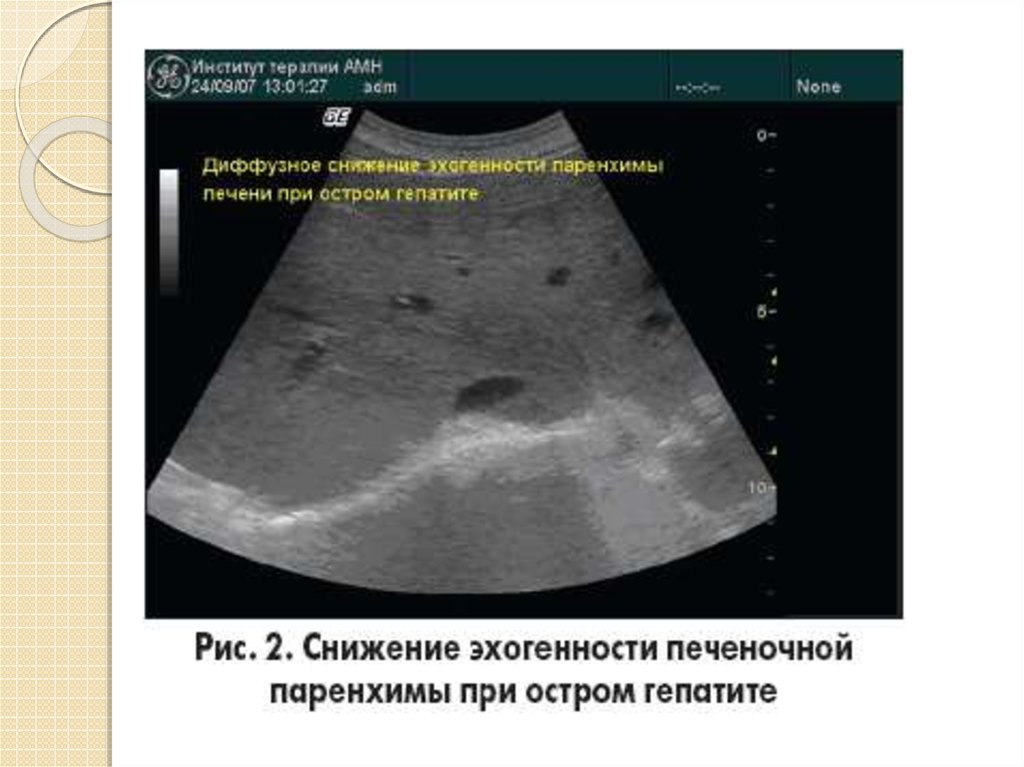 Ранняя гепатоцеллюлярная карцинома и диспластические узлы. Семин Печень Дис. 2005; 25: 133–142. [PubMed] [Академия Google]
Ранняя гепатоцеллюлярная карцинома и диспластические узлы. Семин Печень Дис. 2005; 25: 133–142. [PubMed] [Академия Google]
37. Шимада М., Рикимару Т., Хамацу Т., Ямасита Ю., Тераши Т., Тагучи К., Танака С., Ширабе К., Сугимати К. Роль макроскопической классификации при гепатоцеллюлярной карциноме узлового типа. Am J Surg. 2001; 182: 177–182. [PubMed] [Google Scholar]
38. Hui AM, Takayama T, Sano K, Kubota K, Akahane M, Ohtomo K, Makuuchi M. Прогностическое значение общей классификации гепатоцеллюлярной карциномы в отношении рецидива и выживаемости после гепатэктомии. J Гепатол. 2000; 33: 975–979. [PubMed] [Академия Google]
39. Макуучи М., Хасегава Х., Ямазаки С., Бандай Ю., Ватанабэ Г., Ито Т. Ультразвуковые характеристики мелкой гепатоцеллюлярной карциномы. Ультразвук Медицина Биол. 1983; Приложение 2: 489–491. [PubMed] [Google Scholar]
40. Мацуи О. Обнаружение и характеристика мелкой гепатоцеллюлярной карциномы. J Гастроэнтерол Гепатол. 2004; 19: С266–С269. [Google Scholar]
[Google Scholar]
41. Shibata T, Sakahara H, Kawakami S, Konishi J. Сонографические характеристики рецидивирующей гепатоцеллюлярной карциномы. Евро Радиол. 1996;6:443–447. [PubMed] [Google Scholar]
42. Choi BI, Kim CW, Han MC, Kim CY, Lee HS, Kim ST, Kim YI. Сонографические характеристики мелкой гепатоцеллюлярной карциномы. Гастроинтест Радиол. 1989; 14: 255–261. [PubMed] [Google Scholar]
43. Tochio H, Kudo M. Афферентные и эфферентные сосуды предраковой и явной гепатоцеллюлярной карциномы: наблюдение с помощью цветной допплерографии. Интервирусология. 2004; 47: 144–153. [PubMed] [Google Scholar]
44. Kudo M, Tochio H. Внутриузловое кровоснабжение хорошо коррелирует с биологической степенью злокачественности, определяемой скоростью роста опухоли при патологически доказанной гепатоцеллюлярной карциноме. Онкология. 2008; 75 Дополнение 1:55–64. [PubMed] [Академия Google]
45. Танака С., Китамура Т., Имаока С., Сасаки Ю., Танигучи Х., Исигуро С. Гепатоцеллюлярная карцинома: сонографическая и гистологическая корреляция..jpg) AJR Am J Рентгенол. 1983; 140: 701–707. [PubMed] [Google Scholar]
AJR Am J Рентгенол. 1983; 140: 701–707. [PubMed] [Google Scholar]
46. Кудо М. Многостадийный гепатокарциногенез человека: корреляция визуализации с патологией. J Гастроэнтерол. 2009; 44 Дополнение 19:112–118. [PubMed] [Google Scholar]
47. Ogata R, Majima Y, Tateishi Y, Kuromatsu R, Shimauchi Y, Torimyra T, Tanaka M, Kumashiro R, Kojiro M, Sata M. Яркий внешний вид петли; характерный ультразвуковой признак ранней гепатоцеллюлярной карциномы. Онкол Респ. 2000;7:1293–1298. [PubMed] [Google Scholar]
48. Точио Х., Томита С., Кудо М., Ивасаки Н., Тамура С., Накамура Х., Сога Т., Фукунага Т., Окабе Й., Кашида Х. и др. Эфферентный кровоток при ранней гепатоцеллюлярной карциноме и пограничных поражениях: демонстрация с помощью цветной допплерографии. Джей Мед Ультрасон. 2002; 29: 205–209. [PubMed] [Google Scholar]
49. Завадский К.Е., Ли Ю.Т. Метастазы колоректального рака в печень: частота, резектабельность и результаты выживаемости. Am Surg. 1994; 60: 929–933. [PubMed] [Академия Google]
[PubMed] [Академия Google]
50. Рукос Д.Х. Современные достижения и изменения в стратегии лечения могут улучшить выживаемость и качество жизни пациентов с потенциально излечимым раком желудка. Энн Сург Онкол. 1999; 6: 46–56. [PubMed] [Google Scholar]
51. Лазаридис Г., Пентерудакис Г., Фунцилас Г., Павлидис Н. Метастазы в печень рака неизвестной первичной стадии (CUPL): ретроспективный анализ клинических проявлений, лечения и прогноза у 49 пациентов и систематический обзор литература. Лечение рака, ред. 2008; 34:693–700. [PubMed] [Google Scholar]
52. Roach H, Whipp E, Virjee J, Callaway MP. Наглядный обзор разнообразного внешнего вида атипичных метастазов рака молочной железы в печень. Бр Дж Радиол. 2005; 78: 1098–1103. [PubMed] [Google Scholar]
53. Робинсон П.Дж. Визуализация метастазов в печень: текущие ограничения и перспективы на будущее. Бр Дж Радиол. 2000; 73: 234–241. [PubMed] [Google Scholar]
54. Marchal GJ, Pylyser K, Tshibwabwa-Tumba EA, Verbeken EK, Oyen RH, Baert AL, Lauweryns JM. Анэхогенный ореол в солидных опухолях печени: сонографическая, микроангиографическая и гистологическая корреляция. Радиология. 1985;156:479–483. [PubMed] [Google Scholar]
Анэхогенный ореол в солидных опухолях печени: сонографическая, микроангиографическая и гистологическая корреляция. Радиология. 1985;156:479–483. [PubMed] [Google Scholar]
55. Machi J, Isomoto H, Kurohiji T, Yamashita Y, Shirouzu K, Kakegawa T, Sigel B, Zaren HA, Sariego J. Точность интраоперационного УЗИ в диагностике метастазов колоректального рака в печень: оценка результатов послеоперационного наблюдения. Мир J Surg. 1991;15:551–556; обсуждение 557. [PubMed] [Google Scholar]
56. Choti MA, Kaloma F, de Oliveira ML, Nour S, Garrett-Mayer ES, Sheth S, Pawlik TM. Вариабельность пациентов в интраоперационных ультразвуковых характеристиках метастазов колоректального рака в печень. Арка Сур. 2008;143:29–34; обсуждение 35. [PubMed] [Google Scholar]
57. Yoshida T, Matsue H, Okazaki N, Yoshino M. Ультрасонографическая дифференциация гепатоцеллюлярной карциномы от метастатического рака печени. Дж. Клин Ультразвук. 1987; 15: 431–437. [PubMed] [Google Scholar]
58..jpg) Чой Б.И., Ким Т.К., Хан Дж.К., Чанг Дж.В., Пак Дж.Х., Хан МС. Энергетическая допплерография по сравнению с обычной цветной допплерографией: сравнение изображения сосудистой сети в опухолях печени. Радиология. 1996; 200: 55–58. [PubMed] [Академия Google]
Чой Б.И., Ким Т.К., Хан Дж.К., Чанг Дж.В., Пак Дж.Х., Хан МС. Энергетическая допплерография по сравнению с обычной цветной допплерографией: сравнение изображения сосудистой сети в опухолях печени. Радиология. 1996; 200: 55–58. [PubMed] [Академия Google]
59. Konopke R, Kersting S, Bergert H, Bloomenthal A, Gastmeier J, Saeger HD, Bunk A. УЗИ с контрастным усилением для выявления метастазов в печени: проспективное исследование по сравнению чрескожного УЗИ без усиления и УЗИ с контрастированием у пациентов, перенесших лапаротомию. Int J Colorectal Dis. 2007; 22: 201–207. [PubMed] [Google Scholar]
60. Nicolau C, Vilana R, Catalá V, Bianchi L, Gilabert R, García A, Brú C. Важность оценки всех сосудистых фаз при УЗИ с контрастным усилением при дифференциации доброкачественных новообразований от злокачественных. очаговые поражения печени. AJR Am J Рентгенол. 2006; 186: 158–167. [PubMed] [Академия Google]
61. Furuse J, Nagase M, Ishii H, Yoshino M. Модели усиления контраста опухолей печени во время сосудистой фазы с использованием кодированной гармонической визуализации и Levovist для дифференциации гепатоцеллюлярной карциномы от других очаговых поражений. Бр Дж Радиол. 2003; 76: 385–392. [PubMed] [Google Scholar]
Бр Дж Радиол. 2003; 76: 385–392. [PubMed] [Google Scholar]
62. Хатанака К., Кудо М., Минами Ю., Уэда Т., Тацуми С., Китаи С., Такахаши С., Иноуэ Т., Хагивара С., Чанг Х. и др. Дифференциальная диагностика опухолей печени: значение гармонической сонографии с контрастным усилением с использованием недавно разработанного контрастного вещества Соназоид. Интервирусология. 2008; 51 Дополнение 1:61–69.. [PubMed] [Google Scholar]
63. Хатанака К., Кудо М., Минами Ю., Маэкава К. Ультрасонография с усилением соназоида для диагностики злокачественных новообразований печени: сравнение с КТ с контрастированием. Онкология. 2008; 75 Приложение 1:42–47. [PubMed] [Google Scholar]
64. Dietrich CF, Ignee A, Trojan J, Fellbaum C, Schuessler G. Улучшенная характеристика гистологически подтвержденных опухолей печени с помощью ультрасонографии с контрастным усилением во время портальной венозной и специфической поздней фазы SHU 508A. Кишка. 2004; 53: 401–405. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Альбрехт Т., Хоффманн К.В., Шмитц С.А., Шеттлер С., Оверберг А., Гермер С.Т., Вольф К.Дж. Инверсионная сонография во время специфичной для печени поздней фазы контрастного усиления: улучшенное обнаружение метастазов в печени. AJR Am J Рентгенол. 2001; 176:1191–1198. [PubMed] [Google Scholar]
Альбрехт Т., Хоффманн К.В., Шмитц С.А., Шеттлер С., Оверберг А., Гермер С.Т., Вольф К.Дж. Инверсионная сонография во время специфичной для печени поздней фазы контрастного усиления: улучшенное обнаружение метастазов в печени. AJR Am J Рентгенол. 2001; 176:1191–1198. [PubMed] [Google Scholar]
66. Nakajima T, Kondo Y, Miyazaki M, Okui K. Гистопатологическое исследование 102 случаев внутрипеченочной холангиокарциномы: гистологическая классификация и способы распространения. Хум Патол. 1988; 19: 1228–1234. [PubMed] [Академия Google]
67. Клеметт А.Р. Рак крупных желчных протоков. Радиология. 1965; 84: 894–903. [PubMed] [Google Scholar]
68. Khan SA, Davidson BR, Goldin R, Pereira SP, Rosenberg WM, Taylor-Robinson SD, Thillainayagam AV, Thomas HC, Thursz MR, Wasan H. Руководство по диагностике и лечению холангиокарцинома: консенсусный документ. Кишка. 2002; 51 Приложение 6: VI1–VI9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Яманака Н., Окамото Э. , Андо Т., Орияма Т., Фудзимото Дж., Фурукава К., Танака Т., Танака В., Нишигами Т. Клинико-патологический спектр резецированного экстрадуктального образования. формирование внутрипеченочной холангиокарциномы. Рак. 1995;76:2449–2456. [PubMed] [Google Scholar]
, Андо Т., Орияма Т., Фудзимото Дж., Фурукава К., Танака Т., Танака В., Нишигами Т. Клинико-патологический спектр резецированного экстрадуктального образования. формирование внутрипеченочной холангиокарциномы. Рак. 1995;76:2449–2456. [PubMed] [Google Scholar]
70. Colli A, Cocciolo M, Mumoli N, Cesarini L, Prisco A, Gaffuri I, Martinez E. Периферическая внутрипеченочная холангиокарцинома: данные УЗИ и дифференциальная диагностика с гепатоцеллюлярной карциномой. Евро J Ультразвук. 1998; 7: 93–99. [PubMed] [Google Scholar]
71. Сайнани Н.И., Каталано О.А., Холалкере Н.С., Чжу А.С., Хан П.Ф., Сахани Д.В. Холангиокарцинома: современные и новые методы визуализации. Рентгенография. 2008; 28: 1263–1287. [PubMed] [Академия Google]
72. Donato F, Gelatti U, Tagger A, Favret M, Ribero ML, Callea F, Martelli C, Savio A, Trevisi P, Nardi G. Внутрипеченочная холангиокарцинома и вирусные инфекции гепатита C и B, употребление алкоголя и гепатолитиаз: исследование случай-контроль в Италии. Рак вызывает контроль. 2001; 12: 959–964. [PubMed] [Google Scholar]
Рак вызывает контроль. 2001; 12: 959–964. [PubMed] [Google Scholar]
73. Японская группа по изучению рака печени. 1-е изд. Токио: Канехара Шуппан; 1997. [Google Scholar]
74. Ямамото М., Такасаки К., Йошикава Т., Уэно К., Накано М. Указывает ли макроскопическая картина на прогноз при внутрипеченочной холангиокарциноме? Дж. Хирург Онкол. 1998;69:162–167. [PubMed] [Google Scholar]
75. Lim JH. Холангиокарцинома: морфологическая классификация по характеру роста и данным визуализации. AJR Am J Рентгенол. 2003; 181:819–827. [PubMed] [Google Scholar]
76. Yoon KH, Ha HK, Kim CG, Roh BS, Yun KJ, Chae KM, Lim JH, Auh YH. Злокачественные папиллярные новообразования внутрипеченочных желчных протоков: КТ и гистопатологические особенности. AJR Am J Рентгенол. 2000;175:1135–1139. [PubMed] [Google Scholar]
77. Terada T, Kida T, Nakanuma Y, Noguchi T. Обширные портальные опухолевые тромбы с портальной гипертензией при вскрытии внутрипеченочной холангиокарциномы. Am J Гастроэнтерол. 1992;87:1513–1518. [PubMed] [Google Scholar]
Am J Гастроэнтерол. 1992;87:1513–1518. [PubMed] [Google Scholar]
78. Neumaier CE, Bertolotto M, Perrone R, Martinoli C, Loria F, Silvestri E. Стадирование внутригрудной холангиокарциномы с помощью ультразвука. Дж. Клин Ультразвук. 1995; 23: 173–178. [PubMed] [Google Scholar]
79. Xu HX, Lu MD, Liu GJ, Xie XY, Xu ZF, Zheng YL, Liang JY. Визуализация периферической холангиокарциномы с контрастным усилением с низким механическим индексом и SonoVue: начальный опыт. J УЗИ Мед. 2006; 25:23–33. [PubMed] [Академия Google]
Улучшенное обнаружение метастазов с помощью цветной допплерографии
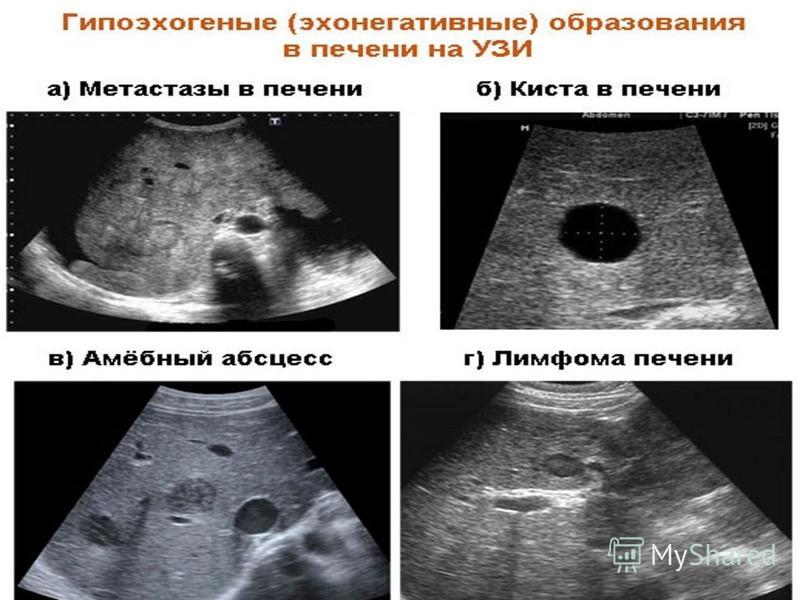
Метастазы являются наиболее частым злокачественным поражением печени и наиболее показанием для ультразвукового исследования в В-режиме. Метастазы в печень встречаются в 14-40 раз чаще, чем первичные опухоли печени [1]. Одной из основных трудностей визуализации печени при метастазах является высокая распространенность доброкачественных поражений печени, которые могут быть неверно истолкованы как свидетельство метастатического заболевания. Основными источниками путаницы являются гемангиомы печени, фокальная узловая гиперплазия и, кроме того, псевдопоражения (преходящие различия в печеночном затухании, очаговое жировое сохранение/очаговое жировое изменение) [2].
Основными источниками путаницы являются гемангиомы печени, фокальная узловая гиперплазия и, кроме того, псевдопоражения (преходящие различия в печеночном затухании, очаговое жировое сохранение/очаговое жировое изменение) [2].
Очень трудно локализовать очаговые поражения печени и метастазы. Кроме того, может быть очень трудно отличить изоэхогенные узелки и метастазы от прилегающей ткани печени [3,4]. Ультразвук является быстрой, недорогой, безопасной и простой процедурой, но цветная допплерография может предоставить дополнительную информацию о васкуляризации поражения [4]. В целом, однако, метастазы могут выглядеть округлыми и четко очерченными, гипоэхогенными, положительным масс-эффектом с искажением соседних сосудов, гипоэхогенным ореолом из-за сжатой и обезжиренной печени, возможны кистозные, кальцифицированные, инфильтративные и эхогенные проявления [1,2]. ].
Печень необычна тем, что имеет двойную васкуляризацию, функциональный и питательный кровоток, организованный через систему печеночной артерии и воротной вены соответственно. Большинство нормальных клеток печени питаются ветвями воротной вены, тогда как раковые клетки в печени обычно питаются ветвями печеночной артерии [5]. Ультрасонография с цветным допплеровским сканированием позволяет легко обнаружить кровеносные сосуды, определить скорость и направление кровотока, объем и форму волны кровотока, будь то пульсирующая или непрерывная.
Большинство нормальных клеток печени питаются ветвями воротной вены, тогда как раковые клетки в печени обычно питаются ветвями печеночной артерии [5]. Ультрасонография с цветным допплеровским сканированием позволяет легко обнаружить кровеносные сосуды, определить скорость и направление кровотока, объем и форму волны кровотока, будь то пульсирующая или непрерывная.
В опухолях или опухолеподобных поражениях мы можем обнаружить три или четыре различных типа цветовых доплеровских сигналов:
- A питающий сигнал с непрерывной или пульсирующей волной. Этот сигнал поступает в очаг поражения извне (рис. 1).
- Доплеровский сигнал с непрерывной или пульсирующей волной, который определяется в поражении как точечный или короткий линейный сигнал (рис. 2).
- Третий дренажный сигнал с непрерывной волной, идущей изнутри наружу очага поражения (рис. 3).
- A проникающий сигнал с пульсирующей или непрерывной волной, которая проникает через всю область поражения.

Питающие сигналы
Цветное ультразвуковое допплеровское изображение, представленное на рис. 1, показало гепатоцеллюлярную карциному (ГЦК), осложненную циррозом печени (подтверждено вскрытием), с эмболами в воротной вене, обнаруженными ранее с помощью обычного УЗИ в В-режиме. Округлое образование с гипоэхогенным «ореолом» наибольшего диаметра, локализованное в левой части изображения, представлено как ГЦР. Небольшие гипоэхогенные очаги представляют собой вторичные метастатические отложения. Цветной допплер произвольно отображает поток крови к датчику красным цветом, и он генерируется кровотоком в воротной вене. Кровь оттекает от датчика голубым цветом и относится к печеночным венам. Иногда для описания потока в этом контексте мы использовали термины «антеградный» и «ретроградный». При спектральной допплерографии кровоток (ангиодинограмма) в направлении датчика отображается выше базовой линии (антеградный поток), а кровоток в направлении от датчика отображается ниже базовой линии (ретроградный поток) [7]. Ветвь печеночной вены представлена синим сосудом на 8-9часовая позиция, поверхностно встроенная в HCC, является питающим сосудом. Небольшой участок полумесяца красного цвета в положении 2 часов представлен печеночной артерией.
Ветвь печеночной вены представлена синим сосудом на 8-9часовая позиция, поверхностно встроенная в HCC, является питающим сосудом. Небольшой участок полумесяца красного цвета в положении 2 часов представлен печеночной артерией.
Рисунок 1. Изображение изо/гипоэхогенного круглого, гетерогенного и умеренно четко очерченного образования, на котором виден сосуд, питающий поражение (гепатоцеллюлярная карцинома).
Ореол в метастазах печени соответствует сосудистому потоку [8,9], но не присутствует на этом изображении. Только допплеровское исследование с правильно введенным контрастным препаратом Левовист может показать поток в ореоле. Обнаружение периферического гало-потока улучшается с помощью энергетического допплера вместо обычного цветного допплера с частотой обнаружения от 34% до 77%. Использование контрастных веществ увеличило частоту обнаружения энергетического допплера до 98% (р < 0,005) [8].
Пятнистые сигналы
Сигналы, принимаемые нерегулярным неоваскулярным кровотоком, не имеющие какой-либо закономерности в амплитудах, частоте или продолжительности распространения и случайно возникающие в хаотичном временном континууме, независимо от фазы сердечного цикла (систолы и диастолы) называются хаотическими или пятнистыми сигналами. Сигналы, подобные этим, не характерны ни для одного известного сосудистого кровотока и не похожи ни на какой венозный или артериальный кровоток. Это сигналы, генерируемые новообразованными кровеносными сосудами внутри метастаза в процессе неоангиогенеза.
Сигналы, подобные этим, не характерны ни для одного известного сосудистого кровотока и не похожи ни на какой венозный или артериальный кровоток. Это сигналы, генерируемые новообразованными кровеносными сосудами внутри метастаза в процессе неоангиогенеза.
Медленные и хаотичные пятнистые сигналы возможны для визуализации только при правильной ручной настройке фильтра низких частот. Результаты низкого притока с пропущенным сигналом и высокие результаты притока с цветовым сигналом несуществующего потока [3,9].
На рис. 2 показаны два метастаза с центральной анэхогенной структурой. Объем образца располагался в центре левого метастаза. Мы использовали значение пиковой частоты повторения (PRF) 4 кГц и угол озвучивания 41°. Использование малой частоты повторения импульсов при высокоскоростном кровотоке некорректно и приводит к наложению спектров и другим артефактам. В таком случае мы можем поставить неверный диагноз на наличие метастазов, гемангиом и других несосудистых структур. Высокая ЧПИ снижает глубину проникновения ультразвуковых сигналов [3]. Обнаружение центральной анэхогенной зоны и периферической васкуляризации, а также признаков инвазии в соседние кровеносные сосуды являются дополнительными признаками злокачественного новообразования [10].
Высокая ЧПИ снижает глубину проникновения ультразвуковых сигналов [3]. Обнаружение центральной анэхогенной зоны и периферической васкуляризации, а также признаков инвазии в соседние кровеносные сосуды являются дополнительными признаками злокачественного новообразования [10].
Рис. 2. Доплеровская кривая потока внутри метастазированной васкуляризации показала точечные сигналы.
Дренажные сигналы
Гепатоцеллюлярная карцинома должна иметь венозную дренажную систему в воротную вену, что делает возможным внутрипеченочное метастазирование [11]. На изображении 3 показан ГЦК в начальной стадии с гиперэхогенной гетерогенной сонографической экспрессией и анэхогенным «ореолом». Красная сосудистая область показывает инвазию в портальную вену, но ни одна из них не показала микроскопическую инвазию в печеночную вену. Низкая скорость кровотока в печеночной вене (см. отмеченную часть рисунка 3 белой маленькой стрелкой) и относительно высокое значение выбранной ЧПИ (4 кГц) не дают возможности окрашивания сосуда.
Рис. 3. Изображение гиперэхогенного гетерогенного урока с анэхогенным «ореолом» и спектром течения портального кровотока.
Маркер объема образца расположен внутри воротной вены, чтобы показать спектр портального кровотока дренажного сосуда. Изоэхогенная овальная область под гиперэхогенным ГЦР представляет собой регенеративный узел на измененной циррозом паренхиме печени. Спектр дренажного старения портального сосуда представляет собой типичный пульсирующий портальный кровоток с уплощенной кривой и высокой пульсацией, представленный в виде прерывистого нулевого потока между концом диастолы и началом систолы.
Мицунобу, и др. продемонстрировали, что воротная вена служит эфферентным сосудом при распространенном ГЦР путем прямой инъекции рентгеноконтрастных сред в узлы ГЦК резецированных образцов [11,12]. Они обнаружили, что распространение опухоли при ГЦК прогрессирует от капсулярной инвазии до внутрипеченочной инвазии и что воротная вена может действовать как эфферентный опухолевой сосуд. На рисунке 3 мы представляем воротную вену, которая представляет собой трубку красного цвета, как эфферентный сосуд ГЦК.
На рисунке 3 мы представляем воротную вену, которая представляет собой трубку красного цвета, как эфферентный сосуд ГЦК.
Гемагиомы печени, также известные как печеночные венозные мальформации, представляют собой доброкачественные неопухолевые и гиперваскулярные поражения печени. Наиболее частой доброкачественной гиперваскулярной опухолью печени, требующей дифференциальной диагностики, является гемангиома [13]. С клинической точки зрения важно дифференцировать гемангиомы от новообразований печени. В 9В 8% гемангиом печени цветная или энергетическая допплерография не показывает внутреннего кровотока. Около половины этих случаев показывают, что картина периферического кровотока не отражает кровотока в смещенных кровеносных сосудах. Небольшой процент гемагиом (<3%), которые имеют необычный центральный фиброз с крупными сосудами, показывает диффузно увеличенный кровоток при энергетической допплерографии в периферических сосудах, а также во внутренних сосудах [14]. Очаговая узловая гиперплазия (ФНГ), аденома печени (ГА) и гемангиома представляют собой наиболее частые несосудистые доброкачественные опухоли печени.
На рис. 4 показана гиперэхогенная гемагиома печени. Поток не является свидетельством внутри поражения. У этой пациентки 43 лет гемангиомы сопровождались тромбоцитопенией и гипофибриногенемией, что получило название синдрома Казабаха-Меррита. Высокая эхогенность внутри гемангиомы обусловлена большим процентом жировых отложений. Эта гемангиома относится к группе гемангиом печени с жировой инфильтрацией (разрешена биопсия).
Рисунок 4. Изображение несосудистого поражения печени, гемангиомы печени.
Не следует отказываться от УЗИ в В-режиме (оттенки серого) в качестве метода оценки очаговой оценки печени. Его необходимо дополнить методом дуплексного сканирования и цветным допплеровским сканированием. Традиционное измерение скорости кровотока на периферии и в центре очаговых поражений печени недостаточно точно и надежно, чтобы реально различать доброкачественные и злокачественные поражения печени.
При метастатическом поражении и ГЦР мы можем доверять некоторым надежным критериям выявления и дифференциации, специфичным для злокачественного новообразования: обнаружение центрального пятна, знак ореола без определяемого кровотока, васкуляризация очагового поражения печени, хаотическая архитектура кровеносных сосудов, обнаружение питания , дренажные и пятнистые сигналы и т. д. Таким образом, применение цветного допплеровского и дуплексного ультразвукового исследования настоятельно рекомендуется как традиционный, недорогой, быстрый, надежный и неинвазивный метод визуализации первого выбора при очаговом поражении печени.
д. Таким образом, применение цветного допплеровского и дуплексного ультразвукового исследования настоятельно рекомендуется как традиционный, недорогой, быстрый, надежный и неинвазивный метод визуализации первого выбора при очаговом поражении печени.
2021 Copyright ОАТ. Все права защищены
- Namasivayam S, Martin DR, Saini S (2007) Визуализация метастазов в печени: МРТ. Визуализация рака 7: 2-9. [Перекрестная ссылка]
- Lencioni R, Cioni D, Bartolozzi C (2005)Очаговые поражения печени, обнаружение, характеристика, абляция. Спрингер Верлаг.
- Петар Аврамовски (2009) Значение оптимизации настроек аппарата УЗИ для лучшей диагностики очаговых поражений печени. Maced J Med Sci 2: 149-152.
- Semelka RC, Martin DR, Balci NC (2005)Очаговые поражения в нормальной печени. J Гастроэнтерол Гепатол 20: 1478-1487. [Перекрестная ссылка]
- DuradoB, William C, Colleen D, Koerner YJ, Lichtenfeld L, et al.
 (2016)Эмболизационная терапия рака печени. амер Рак соц 3:7-9.
(2016)Эмболизационная терапия рака печени. амер Рак соц 3:7-9. - Такаёси Т., Харуо К., Масахико О., Масао О., Ясуо Э. и др. (1992)Первичный рак печени в Японии. Токио: Springer Japan 123-124.
- Макнотон Д.А., Абу-Юсеф М.М. (2011)Доплеровское УЗИ печени стало проще.
- Rafaelsen SR, Solvig J (2004) Ультразвуковая визуализация структур потока при метастазах колоректального рака в печень. Scand J Gastroenterol 39: 761-765. [Перекрестная ссылка]
- Григоров Н., Николова С. (1997) Клиническая доплерэхография. София: Медицинско издательство 94-95.
- Scholbach T, Scholbach J, Krombach GA, Gagel B, Maneschi P, Di Martino E (2005)Новый метод количественной оценки динамического цветового допплеровского сигнала в метастатических лимфатических узлах по сравнению с прямыми полярографическими измерениями оксигенации тканей.
 Int J Cancer 114: 957-962. [Перекрестная ссылка]
Int J Cancer 114: 957-962. [Перекрестная ссылка] - Миядзаки К., Сояма А., Хидака М., Хамааки К., Яманучи К. и др. (2011)Фенография печени ex vivo при гепатоцеллюлярной карциноме в печени, эксплантированной для трансплантации печени. World J Surg Oncol 9: 111. [Crossref]
- Мицунобу М., Тойосака А., Орияма Т., Окамото Э., Накао Н. (1996) Внутрипеченочные метастазы при гепатоцеллюлярной карциноме: роль воротной вены как эфферентного сосуда. Clin Exp Metastasis 14: 520-529. [Перекрестная ссылка]
- Мураками Т., Цурусаки М. (2014)Гиперваскулярные доброкачественные и злокачественные опухоли печени, требующие дифференциации от гепатоцеллюлярной карциномы: ключевые моменты диагностики изображений. Рак печени 3: 85-96. [Перекрестная ссылка]
- Перкинс А.Б., Имам К., Смит В.Дж., Кронан Дж.Дж. (2000) Цветная и мощная допплерография гемангиом печени: несбывшаяся мечта? J Clin Ultrasound 28: 159-165.
 [Перекрестная ссылка]
[Перекрестная ссылка] - Maillette de Buy Wenniger L, Terpstra V, Beuers U (2010)Очаговая узловая гиперплазия и аденома печени: эпидемиология и патология.
Тип статьи
Обзор статьи
История публикации
Дата получения: 21 мая 2017 г.
Дата принятия: 09 июня 2017 г.
Дата публикации: 12 июня 2017 г. -доступ к статье, распространяемой в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания оригинального автора и источника.
Цитата
Avramovski P, Avramovska M, Sikole E (2017)Улучшенное обнаружение метастазов с помощью цветной допплерографии. Res Rev Insights1: DOI: 10.15761/RRI.1000102
Рис. 1. Изображение изо/гипоэхогенного круглого, гетерогенного и умеренно четко очерченного поражения, на котором виден сосуд, питающий поражение (гепатоцеллюлярная карцинома).


