Гипертрофия левого желудочка и возможности антигипертензивной терапии uMEDp
Гипертрофия (от греч. hyper – много и trophē – питание) миокарда – компенсаторный процесс, развивающийся вследствие изменения гемодинамических условий работы сердца. Длительное повышение нагрузки на миокард сопровождается его морфологическими, структурно-функциональными и цито-биохимическими изменениями, которые заключаются в увеличении размеров сердца вследствие возрастания объема и числа кардиомиоцитов, а также в значительном увеличении количества сократительных и вспомогательных белков. Формирование дополнительного количества и массы миокардиальных структур дают сердцу возможность адекватно функционировать в условиях повышенных гемодинамических нагрузок.
Рисунок 1. Различные типы геометрии левого желудочка: а – норма; б – концентрическая ГЛЖ; в – эксцентрическая ГЛЖ
Рисунок 2. Сравнительное влияние рамиприла (а) и атенолола (б) на массу миокарда ЛЖ через 3 и 6 месяцев с момента начала лечения
Первое описание гипертрофии левого желудочка (ГЛЖ) было сделано еще в 1748 г.
Проведенные в дальнейшем крупные эпидемиологические исследования показали, что общая и сердечно-сосудистая смертность нарастают по мере увеличения выраженности ГЛЖ. Например, согласно результатам Корнельского и Фремингемского исследований, у лиц с признаками ГЛЖ общая смертность в 4 раза выше, а смертность от сердечно-сосудистых причин в 7-9 раз выше по сравнению с лицами без признаков ГЛЖ. У мужчин в возрасте до 65 лет ГЛЖ увеличивает риск смерти в 7 раз по сравнению с общей популяцией. Среди лиц без клинических симптомов сердечно-сосудистой патологии, но с признаками ГЛЖ на электрокардиограмме (ЭКГ) 33% мужчин и 21% женщин умирают в течение 5 лет (10, 14, 23, 28, 30).
Природа формирования ГЛЖ носит мультифакториальный характер. Важное значение в патогенезе ГЛЖ имеют пол, масса тела, повышенное потребление соли и алкоголя. По мере увеличения возраста отмечается рост частоты встречаемости ГЛЖ – за каждые 10 лет жизни риск развития ГЛЖ возрастает на 15%. Расовая принадлежность также имеет значение при определении распространенности ГЛЖ: исследование, проводившееся в США, показало практически четырехкратное увеличение встречаемости ГЛЖ у афроамериканского населения по сравнению с белым (13, 30).
В современных представлениях о патогенезе ГЛЖ важнейшую роль отводят многочисленным нейрогенным и гуморальным факторам, и в первую очередь – симпатоадреналовой (САС) и ренин-ангиотензин-альдостероновой (РААС) системам, активация которых способна как индуцировать гипертрофию, так и ускорять ее развитие (1, 11, 27).
Наконец, накопление новых данных по эпидемиологии сердечно-сосудистого ремоделирования и внедрение методов молекулярной кардиологии привели к формированию концепции существенной роли генетических факторов в развитии изменений в сердечно-сосудистой системе.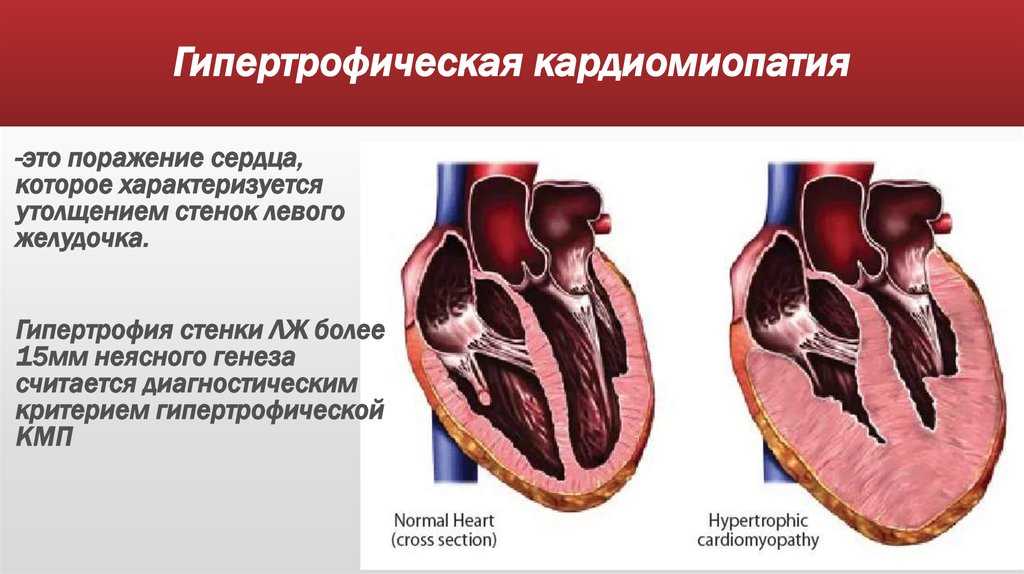 Среди генов, структурный полиморфизм которых обсуждается как фактор развития гипертрофии миокарда и сосудистой стенки, на первом месте стоят гены белков РААС и гены других факторов роста и регуляторных пептидов, участвующих в передаче гипертрофических стимулов (39).
Среди генов, структурный полиморфизм которых обсуждается как фактор развития гипертрофии миокарда и сосудистой стенки, на первом месте стоят гены белков РААС и гены других факторов роста и регуляторных пептидов, участвующих в передаче гипертрофических стимулов (39).
Имеется тесная связь между ГЛЖ и уровнем артериального давления (АД) – ГЛЖ выявляется примерно у половины больных с артериальной гипертензией (АГ). Доказано, что ГЛЖ при АГ является независимым фактором риска сердечно-сосудистой заболеваемости (ССЗ) и смертности, а также основным доклиническим проявлением поражения сердечно-сосудистой системы, которое повышает риск ишемической болезни сердца (ИБС) и инфаркта миокарда (ИМ), инсульта и застойной сердечной недостаточности, внезапной смерти и общей смертности (26). Термин «гипертоническое сердце», предложенный еще в середине XX в., определяет все многообразие функциональных и морфологических изменений в сердце как органе-мишени при АГ (4).
Сущность гипертрофии может быть определена как увеличение сердца вследствие увеличения объема и/или числа кардиомиоцитов.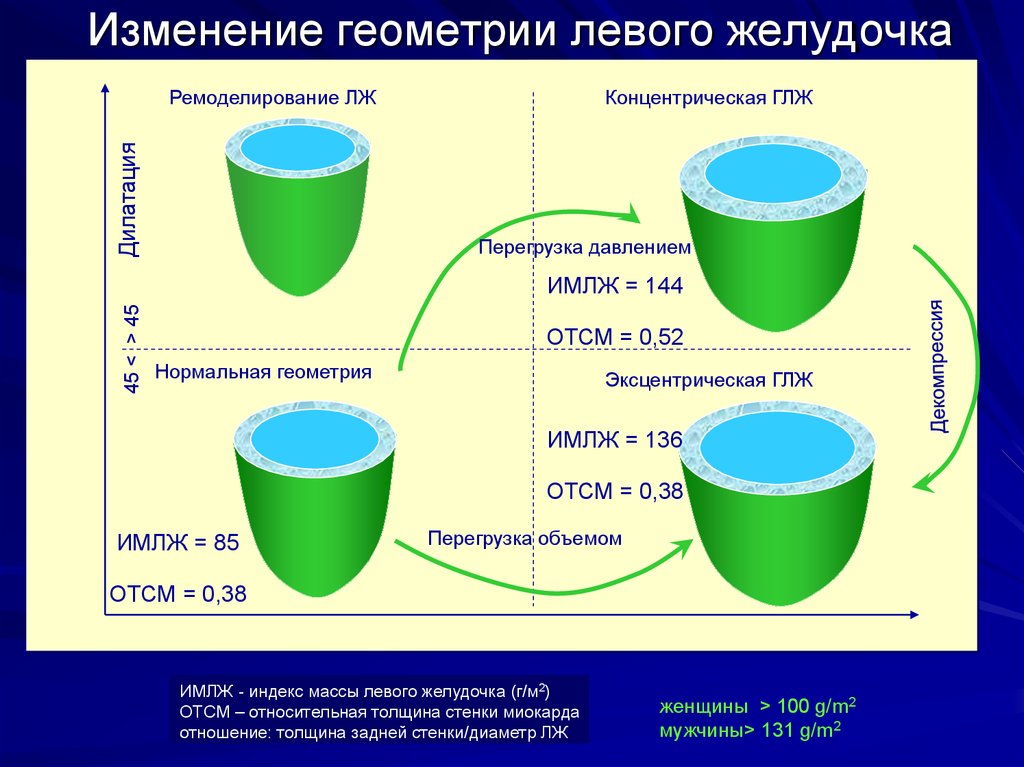 Этот процесс сопровождается увеличением количества сократительных и вспомогательных белков выше нормального уровня. До настоящего времени имеются противоречивые мнения о том, связан ли прирост массы миоцитов исключительно с гипертрофией (увеличением размера клеток) или в некоторых случаях также имеется элемент гиперплазии (деления клеток и увеличения их количества). Гипертрофированный миокард характеризуется значительным количеством электрофизиологических нарушений: во многих исследованиях показаны замедление реполяризации, нарушение распространения волны электрического возбуждения при ГЛЖ (8, 11, 18).
Этот процесс сопровождается увеличением количества сократительных и вспомогательных белков выше нормального уровня. До настоящего времени имеются противоречивые мнения о том, связан ли прирост массы миоцитов исключительно с гипертрофией (увеличением размера клеток) или в некоторых случаях также имеется элемент гиперплазии (деления клеток и увеличения их количества). Гипертрофированный миокард характеризуется значительным количеством электрофизиологических нарушений: во многих исследованиях показаны замедление реполяризации, нарушение распространения волны электрического возбуждения при ГЛЖ (8, 11, 18).
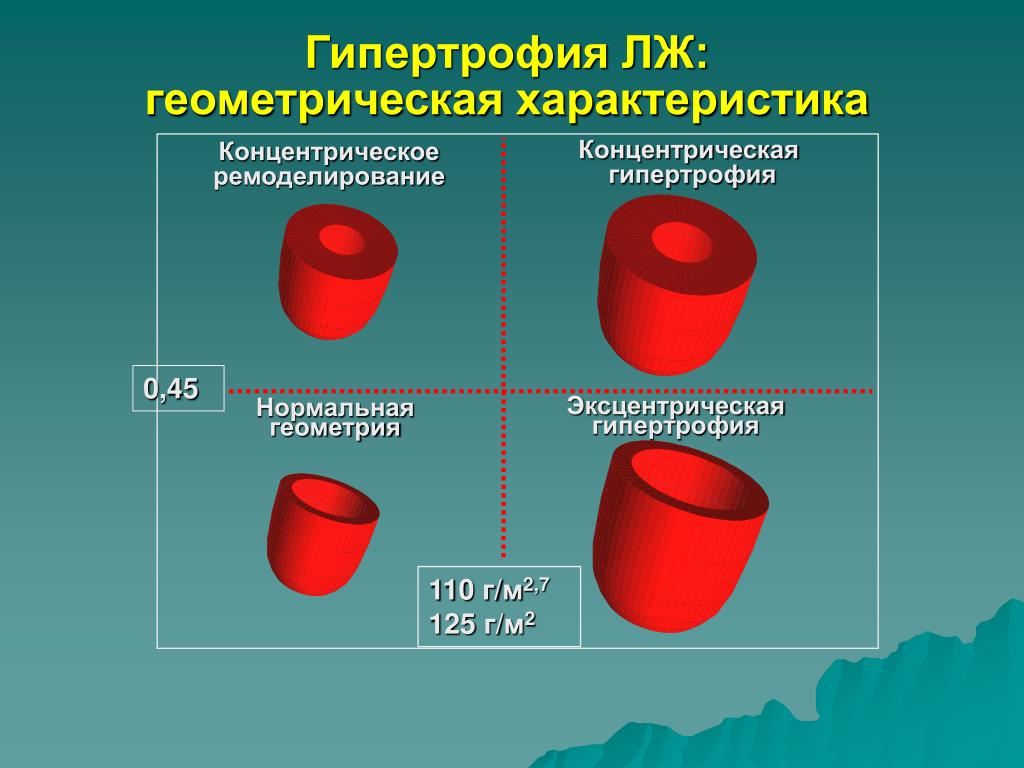
Традиционно выделяют два типа ГЛЖ (рисунок 1): концентрическую и эксцентрическую. Концентрическая ГЛЖ характеризуется утолщением стенки ЛЖ вследствие функциональной нагрузки давлением, при этом гипертрофия кардиомиоцитов развивается преимущественно за счет утолщения миофибриллярных пучков, в то время как длина кардиомиоцитов заметно не изменяется. Для этого типа ГЛЖ характерны высокое общее периферическое сосудистое сопротивление (ОПСС), субнормальный ударный объем и повышенное пульсовое АД, обусловленное значительной ригидностью артерий.
Эксцентрическая ГЛЖ развивается вследствие нагрузки объемом и характеризуется увеличением объема полости левого желудочка (ЛЖ), при этом кардиомиоциты удлиняются за счет добавления новых саркомеров к предшествующим миофибриллам, а поперечные размеры сердечных миоцитов и длина саркомера в этом случае не изменяются. Для пациентов с эксцентрической гипертрофией свойственно увеличение полости левого желудочка, высокий ударный выброс, сравнительно низкое пульсовое АД, что обусловлено податливостью артериального сосудистого русла в отсутствие выраженных вазоспастических реакций (5).
Геометрия ЛЖ является индикатором развития жизнеугрожающих нарушений ритма. Согласно данным J. Ghali (18, 19), концентрическая гипертрофия сопряжена с высоким риском желудочковых аритмий: при динамическом наблюдении в течение 9 лет за пациентами с ГЛЖ концентрическая гипертрофия сопровождалась более высоким риском смерти вследствие развития жизнеугрожающих аритмий, чем эксцентрическая, причем эта закономерность была выявлена как при наличии сопутствующей ИБС, так и без нее (12).
В Фремингемском исследовании был проведен анализ прогноза больных с различными типами геометрии ЛЖ, который показал, что наличие концентрической ГЛЖ является самостоятельным фактором риска неблагоприятного прогноза, прежде всего в плане развития ИБС и ее осложнений. В рекомендациях Европейского кардиологического общества по лечению АГ (2007) подчеркнута важность определения типа геометрии ЛЖ для стратификации риска больных с АГ (22).
ГЛЖ сопровождается снижением коронарного резерва вследствие уменьшения в гипертрофированном миокарде количества резистивных артериол. Такое несоответствие отражает нарушение способности артериолярной сети к росту адекватно увеличению количества кардиомиоцитов. В норме во время систолы происходит уменьшение коронарного кровотока из-за компрессии, обусловленной периваскулярными силами сжатия. В условиях гипертрофии действие сил сжатия на коронарный кровоток в систолу увеличивается, чему способствует и усиление напряженности стенки миокарда ЛЖ, связанное с повышением АД.
В настоящее время установлено, что изменение морфологии сердца одновременно сопровождается нарушением морфологии крупных сосудов: у больных с более выраженными гипертрофическими изменениями миокарда утолщение стенок крупных сосудов также выражено гораздо больше. Эта зависимость, скорее всего, является следствием общности регуляторных механизмов, лежащих в основе формирования и ГЛЖ, и утолщения сосудистой стенки (2, 5).
По мере нарастания гипертрофии стенок ЛЖ возникает и усугубляется его диастолическая дисфункция, усиливается внутримиокардиальное напряжение, повышается конечное диастолическое давление. Вслед за диастолической начинает страдать и систолическая функция, и при увеличении массы миокарда ЛЖ выше критического уровня (200 г) возникает латентная сердечная недостаточность.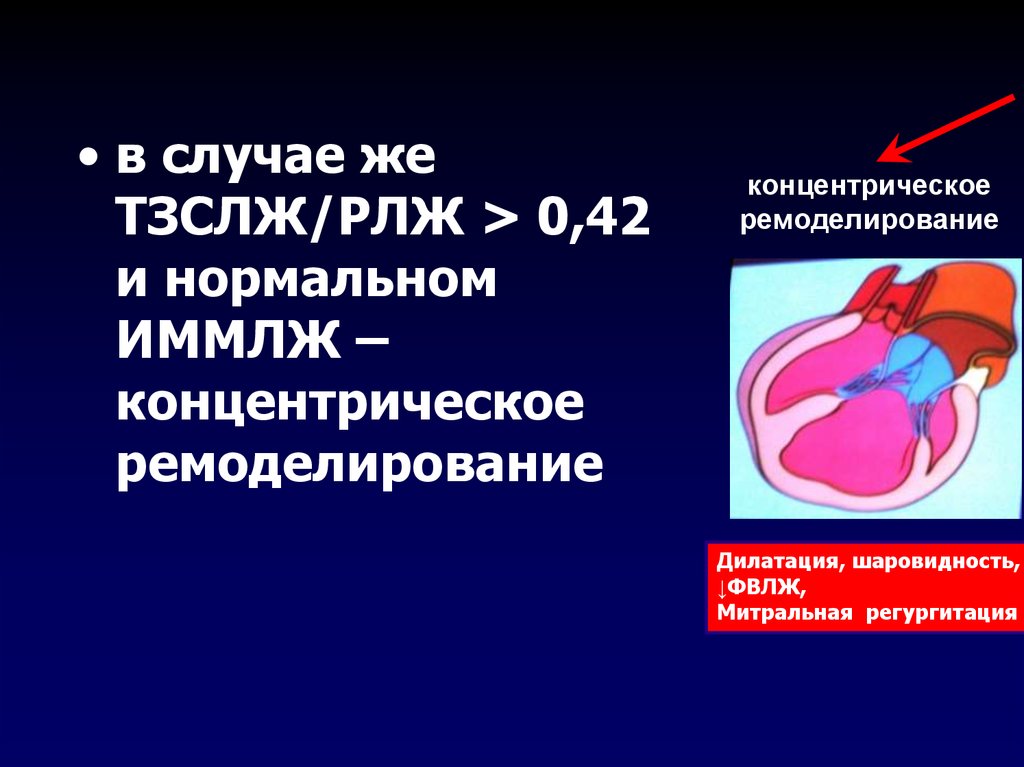
Вследствие описанных патологических моментов развивается комплекс механизмов, приводящих в итоге к развитию сердечно-сосудистых осложнений и значительному ухудшению прогноза у больных с ГЛЖ. Так, ГЛЖ является независимым фактором риска ИБС и ИМ. У пациентов с ГЛЖ риск ИМ в 4 раза выше, чем у людей с нормальной геометрией сердца. Более того, у пациентов с ГЛЖ ИМ протекают тяжелее и характеризуются большим количеством осложнений. Столь значимая связь между ГЛЖ и риском ишемических событий объясняется прежде всего снижением коронарного резерва на фоне ГЛЖ и относительной ишемией гипертрофированного миокарда при недостаточном его кровоснабжении, а также сопутствующей эндотелиальной дисфункцией и микроангиопатией коронарных сосудов.
При наличии ГЛЖ в 6-12 раз увеличивается риск инсульта, что, скорее всего, обусловлено сопутствующими изменениями в системе мозговых сосудов, поскольку между ГЛЖ и поражением крупных сосудов имеется неразрывная связь. Согласно результатам исследования, проведенного в Японии K. Kohara и соавт. (25), концентрическая ГЛЖ является маркером доклинического поражения ЦНС. ГЛЖ ассоциирована также с риском развития атеросклероза сосудов нижних конечностей.
Kohara и соавт. (25), концентрическая ГЛЖ является маркером доклинического поражения ЦНС. ГЛЖ ассоциирована также с риском развития атеросклероза сосудов нижних конечностей.
ГЛЖ в настоящее время рассматривается как основное звено в цепи сердечно-сосудистого континуума и в развитии сердечной недостаточности. Признаки гипертрофии на ЭКГ сопровождаются увеличением частоты развития синдрома ХСН в 14 раз. При этом такие клинические состояния, как ИМ и инсульт, успешно предотвращаются на фоне адекватного контроля АД, в то время как профилактика сердечной недостаточности требует более пристального внимания именно к поражению сердца.
Оригинальные исследования продемонстрировали, что ГЛЖ на ЭКГ является важным независимым фактором риска внезапной смерти как у мужчин (6-кратное увеличение риска), так и у женщин (3-кратное увеличение риска). Результаты проведенных исследований свидетельствуют в целом о большей частоте желудочковых аритмий у больных с ГЛЖ, чем без нее. Это справедливо и для желудочковой экстрасистолии, и для более сложных нарушений ритма по типу парных экстрасистол, ранних желудочковых экстрасистол и коротких пробежек желудочковой тахикардии (8).
Это справедливо и для желудочковой экстрасистолии, и для более сложных нарушений ритма по типу парных экстрасистол, ранних желудочковых экстрасистол и коротких пробежек желудочковой тахикардии (8).
Механизмы развития нарушений ритма при ГЛЖ включают в себя как непосредственные изменения электрофизиологических свойств сердечной мышцы вследствие ее гипертрофии и фиброза, так и снижение коронарного резерва, систолическую и диастолическую дисфункцию, активацию симпатической нервной системы и других нейрогуморальных систем. Данные оригинальных исследований подтверждены результатами Фремингемского исследования, которое продемонстрировало увеличение частоты фибрилляции предсердий в 1,5 раза при увеличении индекса массы ЛЖ на каждые 40 г/м2. ГЛЖ увеличивает риск фибрилляции предсердий (ФП) в 3-4 раза при одинаковом возрасте пациентов, и каждые 4 мм утолщения стенки ЛЖ приводят к увеличению ФП на 28% (40).
Исходя из всего вышеизложенного, ГЛЖ должна быть объектом лечения и профилактики, и современные принципы терапии ССЗ во многом направлены на то, чтобы остановить прогрессирующую ГЛЖ или уменьшить ее степень.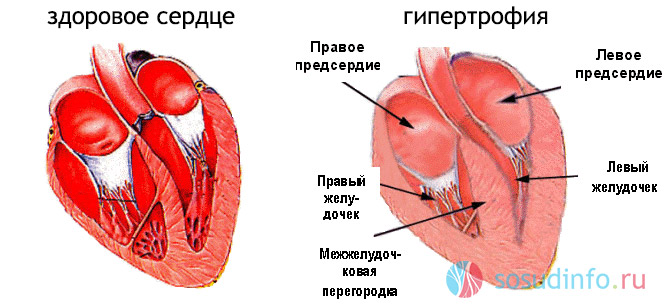 Как было показано во многих клинических исследованиях, в ряде случаев удается не только затормозить, но и добиться определенной регрессии нарушений геометрии ЛЖ.
Как было показано во многих клинических исследованиях, в ряде случаев удается не только затормозить, но и добиться определенной регрессии нарушений геометрии ЛЖ.
Способность благотворно влиять на процессы ремоделирования ЛЖ была продемонстрирована для ряда медикаментозных препаратов. При этом для снижения общей заболеваемости и смертности не менее важно корригировать модифицируемые факторы риска, влияющие на ГЛЖ и ее распространенность, такие как уровень АД, масса тела, количество потребляемой соли и алкоголя (3, 4, 7).
Антигипертензивные препараты оказывают различное влияние на обратное развитие ГЛЖ при равном гипотензивном эффекте, что может быть обусловлено их особым воздействием на САС, РААС и факторы роста. У больных АГ при наличии ГЛЖ необходимо отдавать предпочтение антигипертензивным препаратам, обладающим способностью вызывать обратное развитие ГЛЖ, так как препараты, снижающие АД без изменения массы миокарда ЛЖ, не уменьшают риска развития сердечно-сосудистых осложнений и внезапной смерти (34).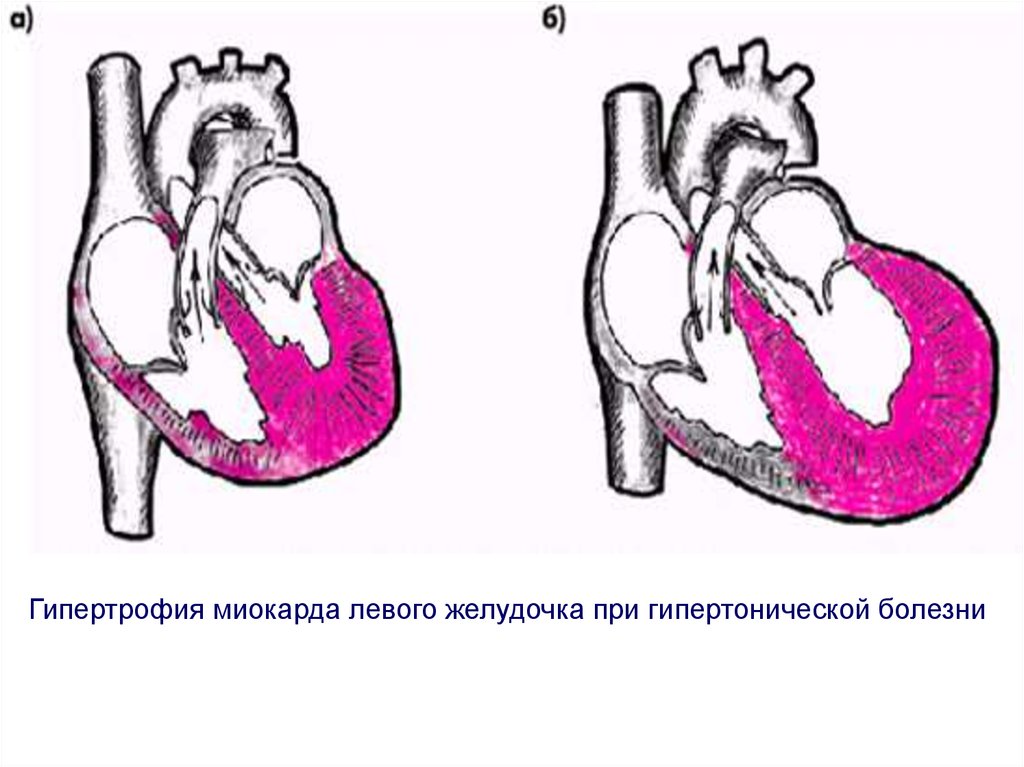 Наиболее эффективны для лечения больных АГ с ГЛЖ ингибиторы АПФ (иАПФ) и/или блокаторы рецепторов к ангиотензину II (БРА), а также антагонисты кальция. Далее по убывающей – b-адреноблокаторы и диуретики (16, 41).
Наиболее эффективны для лечения больных АГ с ГЛЖ ингибиторы АПФ (иАПФ) и/или блокаторы рецепторов к ангиотензину II (БРА), а также антагонисты кальция. Далее по убывающей – b-адреноблокаторы и диуретики (16, 41).
Лидирующая роль иАПФ в снижении массы миокарда ЛЖ была выявлена B. Dahlof c соавт. (16) по результатам проведенного метаанализа 109 исследований и подтверждена метаанализами, выполненными Shmieder R.E. с соавт. (41) и Klingbeil A.U. с соавт. (24) и включившими в общей сложности 12142 пациента. Необходимо отметить, что все гипотензивные препараты примерно одинаково уменьшают механическую нагрузку на миокард путем снижения АД, в то время как иАПФ оказывают непосредственное действие на ангиотензин II. Причем в большей степени регрессу ГЛЖ способствуют иАПФ, имеющие повышенное сродство к тканевой РААС, – квинаприл, периндоприл, рамиприл и трандалоприл. Эти препараты, обладающие большей тканевой аффинностью, устраняют дисфункцию эндотелия, замедляя распад брадикинина – мощного вазодилататора, вызывающего образование простациклина, оксида азота и эндотелиального гиперполяризующего фактора. Они также уменьшают продукцию супероксидного аниона и деградацию оксида азота, препятствуют пролиферации гладкомышечного слоя сосудов, предупреждая таким образом действие ангиотензина II в тканях.
Они также уменьшают продукцию супероксидного аниона и деградацию оксида азота, препятствуют пролиферации гладкомышечного слоя сосудов, предупреждая таким образом действие ангиотензина II в тканях.
В исследованиях RACE (33) доказано, что при одинаковом влиянии на АД иАПФ рамиприл вызывает более выраженный регресс ГЛЖ, чем b-адреноблокатор атенолол (рисунок 2). В рандомизированном двойном слепом плацебо-контролируемом исследовании HYCAR (31), сравнивавшим применение рамиприла в дозах 1,25 мг/сут., 5 мг/сут. и плацебо, было установлено, что через 6 месяцев лечения масса миокарда ЛЖ (ММЛЖ) достоверно увеличивалась в группе плацебо и достоверно уменьшалась в группах рамиприла. Более выраженное снижение было получено в группе с большей (5 мг/сут.) дозой рамиприла.
В исследовании HEART (36) было доказано, что раннее применение рамиприла (с первых суток) в дозе 10 мг/сут. у больных острым инфарктом миокарда предупреждает ремоделирование ЛЖ и вызывает более значительное увеличение его фракции выброса по сравнению как с низкими дозами (0,625 мг/сут.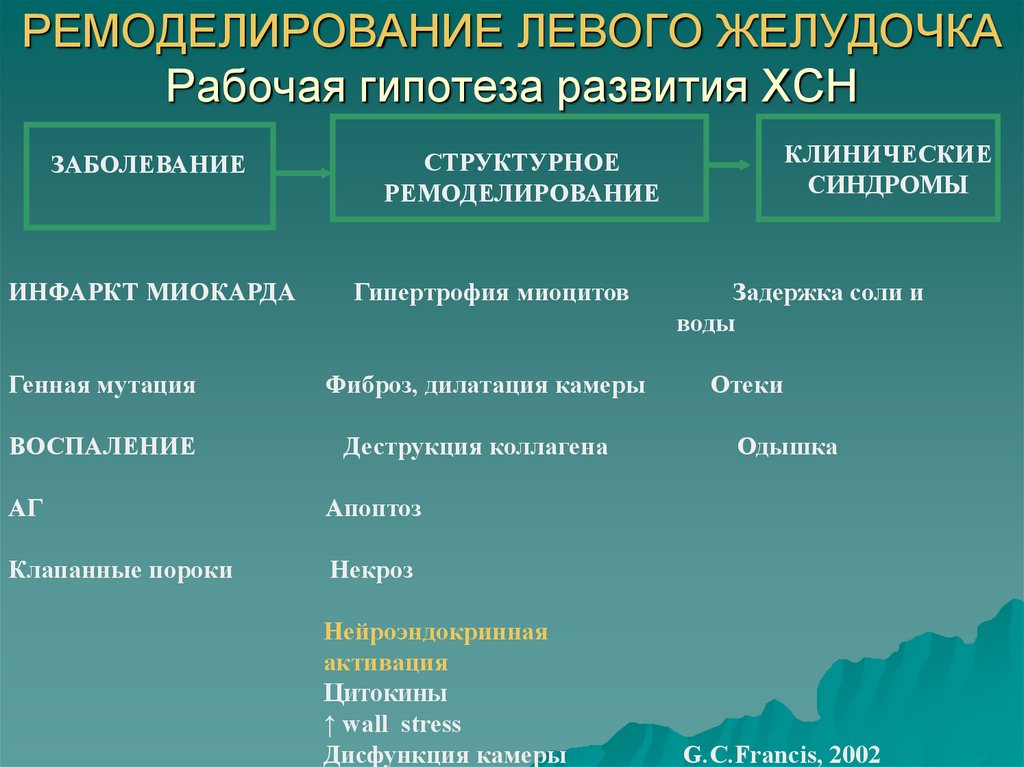 ), так и с отсроченным назначением препарата (на 14-е сутки).
), так и с отсроченным назначением препарата (на 14-е сутки).
Ряд российских исследований также подтвердил достоверное положительное действие иАПФ на структурно-функциональное состояние миокарда. Так, на базе Ростовского государственного медицинского университета (9) оценивалось влияние рамиприла (Хартил, EGIS) на процессы ремоделирования сердца у пациентов с сочетанным течением АГ и ИБС (n = 40). Дополнительное назначение этого препарата к аспирину, статину и b-адреноблокатору сопровождалось тенденцией к более выраженному уменьшению толщины задней стенки ЛЖ, снижению миокардиального стресса (на 12,2%, р = 0,001) и повышению фракции выброса (на 7,3%, p = 0,002) к концу 12-недельного периода наблюдения.
Сотрудники Московского государственного медико-стоматологического университета обследовали 60 женщин, страдающих ХСН неклапанной этиологии, находящихся в постменопаузе (6). Пациентки были рандомизированы в группы приема рамиприла (Хартил, EGIS) и эналаприла в дополнение к стандартной терапии. Исходно и через 6 месяцев у пациенток определяли тяжесть ХСН и морфо-функциональные изменения сердца. Терапия ХСН во всех группах привела к некоторому уменьшению толщины стенок и размеров левого желудочка. Однако в группе рамиприла к концу исследования отмечено достоверное уменьшение степени диастолической дисфункции (р = 0,062), а также улучшение переносимости физической нагрузки, снижение функционального класса ХСН, улучшение качества жизни и снижение степени эндотелиальной дисфункции. Применение рамиприла сопровождалось низкой частотой развития побочных эффектов, что повышало приверженность к лечению и его эффективность.
Исходно и через 6 месяцев у пациенток определяли тяжесть ХСН и морфо-функциональные изменения сердца. Терапия ХСН во всех группах привела к некоторому уменьшению толщины стенок и размеров левого желудочка. Однако в группе рамиприла к концу исследования отмечено достоверное уменьшение степени диастолической дисфункции (р = 0,062), а также улучшение переносимости физической нагрузки, снижение функционального класса ХСН, улучшение качества жизни и снижение степени эндотелиальной дисфункции. Применение рамиприла сопровождалось низкой частотой развития побочных эффектов, что повышало приверженность к лечению и его эффективность.
Антагонисты рецепторов ангиотензина также оказывают выраженное действие на тканевую РААС, что ассоциируется со значительным органопротективным эффектом. В настоящее время накоплен достаточный клинический опыт по оценке их влияния на гипертрофированный миокард ЛЖ.
В исследовании LIFE (15, 17) было показано достоверное преимущество лозартана перед атенололом в снижении массы миокарда ЛЖ.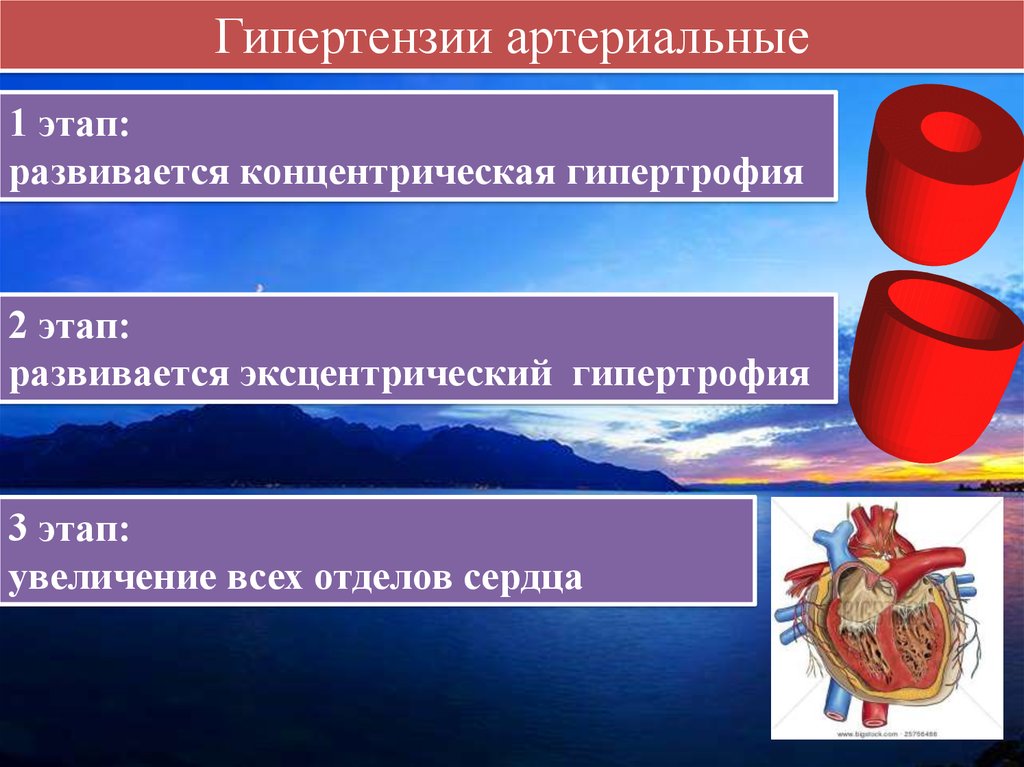 В этом исследовании принимали участие 9193 пациента в возрасте 55-80 лет с АГ и ЭКГ-признаками ГЛЖ. Лозартан по сравнению с атенололом приводил к уменьшению относительного риска смерти от сердечно-сосудистых причин на 11%, инсульта – на 25%, новых случаев сахарного диабета – на 25%. Назначение лозартана сопровождалось более выраженным, чем при использовании атенолола, уменьшением ГЛЖ – на 10,2% и 4,4% по Корнельскому индексу и на 15,3% и 9,0% по индексу Соколова–Лайона соответственно. Аналогичные результаты получены и при использовании телмисартана в сравнительных исследованиях с гидрохлортиазидом, эналаприлом и карведилолом.
В этом исследовании принимали участие 9193 пациента в возрасте 55-80 лет с АГ и ЭКГ-признаками ГЛЖ. Лозартан по сравнению с атенололом приводил к уменьшению относительного риска смерти от сердечно-сосудистых причин на 11%, инсульта – на 25%, новых случаев сахарного диабета – на 25%. Назначение лозартана сопровождалось более выраженным, чем при использовании атенолола, уменьшением ГЛЖ – на 10,2% и 4,4% по Корнельскому индексу и на 15,3% и 9,0% по индексу Соколова–Лайона соответственно. Аналогичные результаты получены и при использовании телмисартана в сравнительных исследованиях с гидрохлортиазидом, эналаприлом и карведилолом.
Антагонисты кальция также оказывают влияние на регресс ГЛЖ. Уменьшение гипертрофии миокарда на фоне их применения обусловлено ингибицией фосфориляции рецепторов эпидермального ростового фактора. Метаанализ, проведенный Dahlof с соавт. (16), показал, что антагонисты кальция (нифедипин) уменьшают массу ЛЖ на 10%, а иАПФ – на 16% (32, 37). Однако в большинстве проанализированных работ использовался нифедипин короткого действия, который, как известно, недостаточно эффективен при редукции ГЛЖ, что связывают с повторными эпизодами симпатической стимуляции.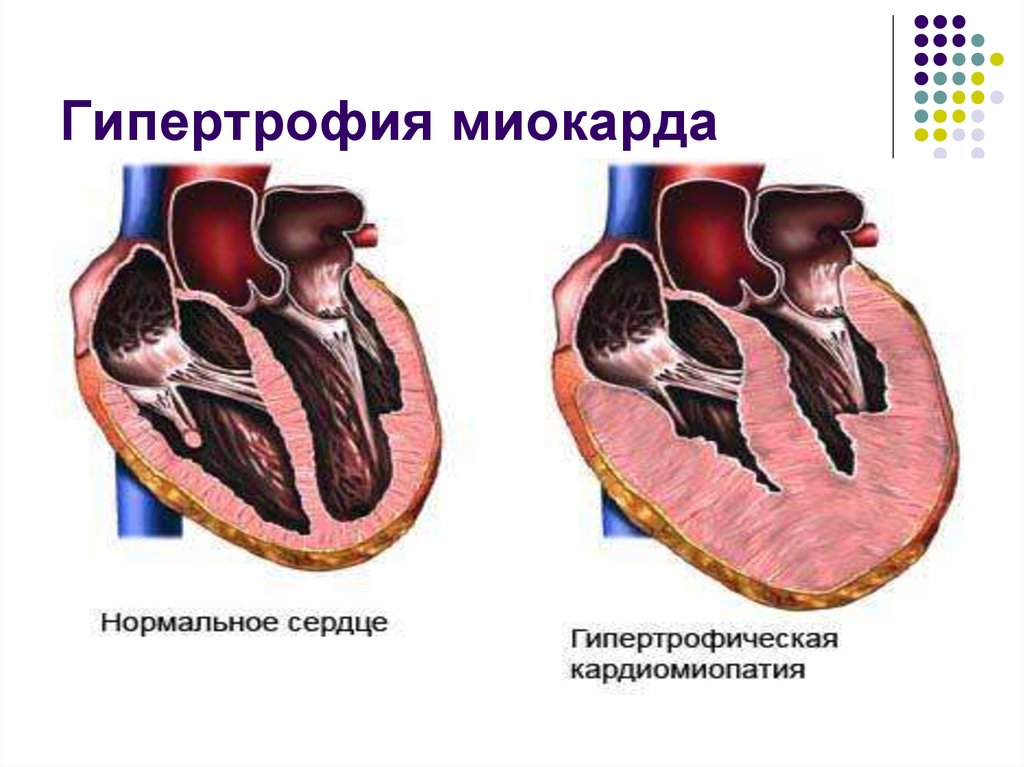
В то же время при использовании нифедипина ультрадлительного действия ММЛЖ в течение года уменьшилась на 19%, что сопоставимо с эффектом иАПФ (37). Аналогичные данные получены Picca с соавт. (38), показавшими одинаковый гипотензивный эффект и достоверное снижение ММЛЖ в группах больных, принимавших амлодипин (10 мг/сут.) или эналаприл (20 мг/сут.).
Однако не все антагонисты кальция также эффективны в отношении влияния на ГЛЖ, как амлодипин. Например, фелодипин обладает гораздо более низкой активностью, скорее всего, вследствие повышения уровня норадреналина и увеличения ЧСС на фоне его приема (29).
Остальные группы гипотензивных препаратов (b-адреноблокаторы, антагонисты a-рецепторов, диуретики) вызывают менее выраженный регресс ГЛЖ, чем иАПФ, антагонисты рецепторов ангиотензина II или антагонисты кальция. Однако ряд исследований, оценивавших эффективность мочегонных препаратов (хлорталидон, индапамид-ретард, гидрохлортиазид) в сопоставлении с иАПФ (эналаприл) и β-адреноблокаторами (ацебутолол, атеналол) (TOMHS, 1993; Veterans Administration Study, 1997; LIVE, 2000) (20, 21, 35) по влиянию на регресс ГЛЖ, существенно усилили позиции диуретиков.
Следовательно, определенная коррекция геометрических изменений ЛЖ представляется возможной и реально достижимой. Уменьшение ГЛЖ сопровождается увеличением коронарного резерва, улучшением систолической и диастолической функций ЛЖ, а также уменьшением числа желудочковых нарушений ритма. Таким образом, снижение массы миокарда ЛЖ в результате лечения сопровождается улучшением прогноза и снижением риска смерти, и именно это доказанное свойство должно быть определяющим критерием в выборе медикаментозного препарата.
Дифференциальная диагностика гипертрофической кардиомиопатии и гипертрофий миокарда вторичного происхождения | Шапошник И.И., Богданов Д.В.
ГКМП является генетически обусловленным заболеванием миокарда, обычно приводящим к выраженной гипертрофии стенок ЛЖ, преимущественно МЖП, без увеличения размера полости ЛЖ, с развитием диастолической дисфункции миокарда [1, 2]. Это самая частая из генетически обусловленных кардиомиопатий (до 20 на 10 000).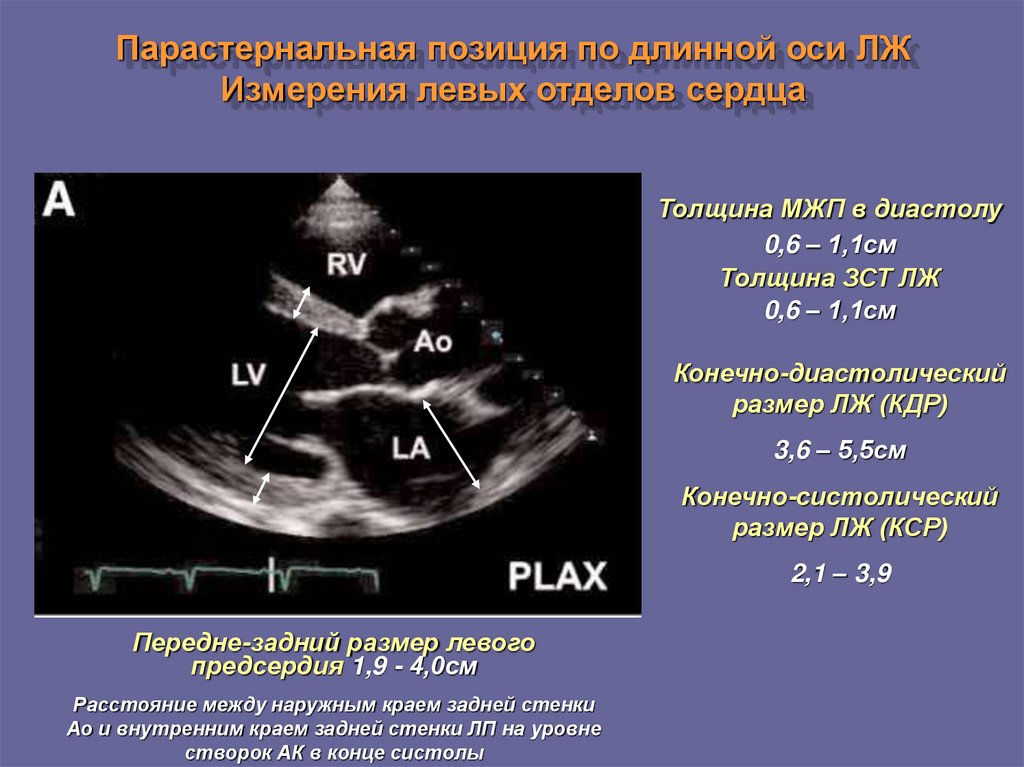 Критерием ГКМП является утолщение стенок ЛЖ более 1,5 см. Выделяют обструктивную форму заболевания (ГОКМП) с наличием градиента обструкции в выносящем тракте ЛЖ в покое более 30 мм рт. ст., чаще всего в сочетании с выраженной асимметричной гипертрофией МЖП. Толщина миокарда может достигать 3–4 см [3]. Возможна скрытая обструкция — в таком случае указанный градиент появляется лишь при нагрузке. Менее изучена необструктивная ГКМП (ГНКМП), при этом градиент обструкции — ниже 30 мм рт. ст. в покое и при нагрузке.
Критерием ГКМП является утолщение стенок ЛЖ более 1,5 см. Выделяют обструктивную форму заболевания (ГОКМП) с наличием градиента обструкции в выносящем тракте ЛЖ в покое более 30 мм рт. ст., чаще всего в сочетании с выраженной асимметричной гипертрофией МЖП. Толщина миокарда может достигать 3–4 см [3]. Возможна скрытая обструкция — в таком случае указанный градиент появляется лишь при нагрузке. Менее изучена необструктивная ГКМП (ГНКМП), при этом градиент обструкции — ниже 30 мм рт. ст. в покое и при нагрузке.
К ГНКМП относится и апикальная форма ГКМП, при которой гипертрофия локализована преимущественно в области верхушки ЛЖ. ГКМП является аутосомно-доминантным заболеванием. В настоящее время известны уже более 40 основных мутаций генов, кодирующих белки саркомера, связанные с развитием ГКМП. Прямой взаимосвязи генотипа и фенотипа при ГКМП может не быть, возможно бессимптомное носительство соответствующих мутаций. Основную опасность для пациентов с ГКМП представляет внезапная сердечная смерть в молодом возрасте, она отмечена у 1–4% больных. В большинстве случаев ГКМП проявляется синдромом «малого сердечного выброса» — головокружениями, синкопальными состояниями, приступами стенокардии.
В большинстве случаев ГКМП проявляется синдромом «малого сердечного выброса» — головокружениями, синкопальными состояниями, приступами стенокардии.
Другим важным синдромом являются нарушения сердечного ритма, преимущественно желудочковые. Выраженная хроническая сердечная недостаточность (ХСН) для ГКМП нехарактерна. В то же время, примерно у 7–20% больных может возникать дилатация полости ЛЖ со снижением фракции выброса и развитием тяжелой ХСН. У 47% больных отмечают медленное прогрессирование ГКМП, в основном в виде усугубления клинических проявлений и нарастания нарушений диастолической функции ЛЖ [3]. Увеличение выраженности ГЛЖ для ГКМП нехарактерно. В целом заболевание течет относительно благоприятно, есть наблюдения, что выживаемость сопоставима с таковой в общей популяции [3].
Следует определиться с критериями, позволяющими выявить гипертрофию миокарда с помощью ЭХО-КГ. Прежде всего, речь идет о гипертрофии левого желудочка (ГЛЖ). Существуют критерии ГЛЖ, основанные как на толщине стенок, так и на оценке индекса массы миокарда (т.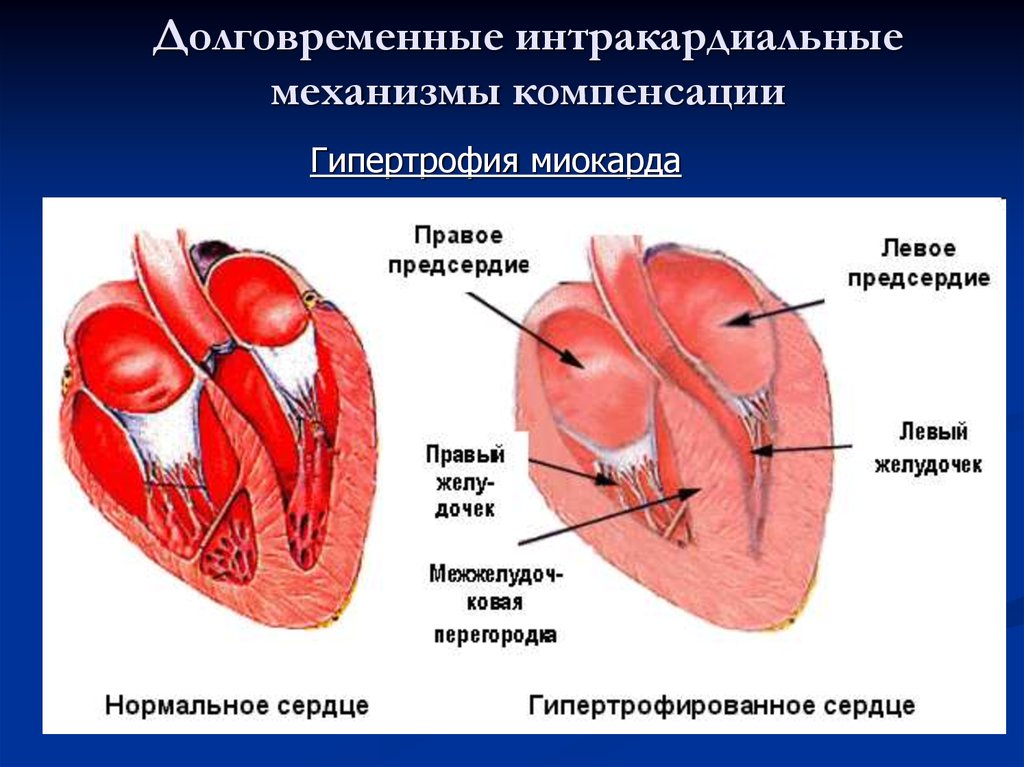 е. массы миокарда, отнесенной к площади тела больного — ИММЛЖ). В Российских рекомендациях по диагностике и лечению артериальной гипертензии (АГ) критериями ГЛЖ являются для мужчин ИММЛЖ ≥125 г/м2, для женщин — ИММЛЖ ≥110 г/м2 [4]. В последние годы произошел пересмотр критериев ГЛЖ в сторону их понижения. Для мужчин ГЛЖ диагностируется при ИММЛЖ ≥115 г/м2, для женщин — ИММЛЖ ≥95 г/м2 [5]. Более подробно вопросы ремоделирования ЛЖ описаны в Рекомендациях по количественной оценке структуры и функции камер сердца [5]. Здесь оговариваются критерии толщины стенок ЛЖ — увеличением считается толщина стенок ≥1,0 см для женщин и 1,1 см — для мужчин. Большое внимание уделяется вариантам ремоделирования ЛЖ. Для этого вводится понятие индекса относительной толщины стенок (ИОТ), ИОТ = (2хТЗС ЛЖ)/КДР ЛЖ. В норме ИОТ — менее 0,42. Если у пациента нормальный ИММЛЖ и нормальный ИОТ, то речь идет о нормальной геометрии ЛЖ. Увеличение ИММЛЖ и увеличение ИОТ ≥0,42 соответствует концентрической ГЛЖ, увеличение только ИММЛЖ при нормальном ИОТ отражает наличие эксцентрической ГЛЖ.
е. массы миокарда, отнесенной к площади тела больного — ИММЛЖ). В Российских рекомендациях по диагностике и лечению артериальной гипертензии (АГ) критериями ГЛЖ являются для мужчин ИММЛЖ ≥125 г/м2, для женщин — ИММЛЖ ≥110 г/м2 [4]. В последние годы произошел пересмотр критериев ГЛЖ в сторону их понижения. Для мужчин ГЛЖ диагностируется при ИММЛЖ ≥115 г/м2, для женщин — ИММЛЖ ≥95 г/м2 [5]. Более подробно вопросы ремоделирования ЛЖ описаны в Рекомендациях по количественной оценке структуры и функции камер сердца [5]. Здесь оговариваются критерии толщины стенок ЛЖ — увеличением считается толщина стенок ≥1,0 см для женщин и 1,1 см — для мужчин. Большое внимание уделяется вариантам ремоделирования ЛЖ. Для этого вводится понятие индекса относительной толщины стенок (ИОТ), ИОТ = (2хТЗС ЛЖ)/КДР ЛЖ. В норме ИОТ — менее 0,42. Если у пациента нормальный ИММЛЖ и нормальный ИОТ, то речь идет о нормальной геометрии ЛЖ. Увеличение ИММЛЖ и увеличение ИОТ ≥0,42 соответствует концентрической ГЛЖ, увеличение только ИММЛЖ при нормальном ИОТ отражает наличие эксцентрической ГЛЖ. Существует понятие концентрического ремоделирования — в этом случае ИОТ ≥0,42, но ИММЛЖ в норме. Для ГКМП часто используют показатель коэффициента асимметрии гипертрофии (отношение ТМЖП к ТЗС ЛЖ), который при асимметричной ГЛЖ превышает 1,3. Концентрическая ГЛЖ более характерна для нагрузки давлением, эксцентрическая — для нагрузки объемом или изотонической гиперфункции.
Существует понятие концентрического ремоделирования — в этом случае ИОТ ≥0,42, но ИММЛЖ в норме. Для ГКМП часто используют показатель коэффициента асимметрии гипертрофии (отношение ТМЖП к ТЗС ЛЖ), который при асимметричной ГЛЖ превышает 1,3. Концентрическая ГЛЖ более характерна для нагрузки давлением, эксцентрическая — для нагрузки объемом или изотонической гиперфункции.
Для правого желудочка (ПЖ) в указанных рекомендациях приводят норматив толщины свободной стенки менее 0,5 см. Поперечный размер полости ПЖ различен на разных уровнях, для базальной части он должен быть менее 2,9 см, для срединной — менее 3,4 см [5].
Отметим некоторые особенности ГЛЖ при ГКМП у пациентов с явными фенотипическими проявлениями заболевания, по нашим собственным данным и данным литературы [1–3].
- При ГКМП толщина стенок ЛЖ больше или равна 1,5 см. При этом явные причины ГЛЖ должны отсутствовать. Возраст больных в большинстве случаев относительно молодой, хотя выявление заболевания возможно в любом возрасте.

- Полость ЛЖ не увеличена, а при выраженной ГЛЖ — уменьшена. При локализации гипертрофии в средних отделах стенок ЛЖ последний может приобретать форму «песочных часов».
- Если у пациента с ГКМП развивается «финальная», или дилатационная стадия заболевания, то полость ЛЖ увеличивается, но гипертрофия стенок сохраняется.
- Для большинства пациентов с ГКМП (независимо от наличия обструкции) характерна асимметрия ГЛЖ, с преобладанием утолщения МЖП. Коэффициент асимметрии в таких случаях — больше 1,3 и может достигать 2,0 и более. По нашим данным, у 67% больных с ГКМП имела место преимущественная гипертрофия МЖП, у 12% — гипертрофия верхушки и нижней трети МЖП, у 21% — диффузная гипертрофия [3]. Локализация гипертрофии МЖП может быть различной, в ряде случаев это может создавать иллюзию опухоли сердца. Наиболее часто утолщена базальная часть МЖП. При апикальной ГНКМП утолщена верхушка ЛЖ.
- МЖП при ГКМП малоподвижна. Это заметно при визуальной оценке МЖП в двухмерном режиме.
 Для расчета подвижности можно использовать как показатель экскурсии (ЭМЖП), так и параметр фракции утолщения (ФУМЖП). ЭМЖП в такой ситуации — ниже 0,5 см, ФУМЖП — ниже 50%. Напротив, подвижность задней стенки ЛЖ при ГКМП относительно сохранена.
Для расчета подвижности можно использовать как показатель экскурсии (ЭМЖП), так и параметр фракции утолщения (ФУМЖП). ЭМЖП в такой ситуации — ниже 0,5 см, ФУМЖП — ниже 50%. Напротив, подвижность задней стенки ЛЖ при ГКМП относительно сохранена. - При ГКМП имеет место нарушение хода мышечных волокон в гипертрофированных участках миокарда. На ЭХО-КГ эти изменения отражаются как некоторая неоднородность, «пестрый» вид гипертрофированного миокарда, особенно в области малоподвижной МЖП.
- Гипертрофия может захватывать и переднюю стенку ПЖ, в наших исследованиях это выявлено у 59,5% больных ГКМП [3].
- Градиент обструкции (обычно в области выносящего тракта ЛЖ, хотя возможна также среднежелудочковая и правожелудочковая обструкция) обусловлен при ГКМП как наличием утолщенной МЖП, так и переднесистолическим движением передней створки митрального клапана. Градиент обструкции весьма лабилен, для его точной оценки могут потребоваться нагрузочные или фармакологические пробы.
 Клинически при наличии выраженного градиента обструкции возможен систолический шум с эпицентром в V точке аускультации, зависящий от нагрузки и натуживания.
Клинически при наличии выраженного градиента обструкции возможен систолический шум с эпицентром в V точке аускультации, зависящий от нагрузки и натуживания. - Диастолическая дисфункция ЛЖ всегда имеет место при ГКМП. Часто у таких пациентов определяется рестриктивный тип нарушения расслабления ЛЖ. Однако этот признак недиагностичен. Сократимость ЛЖ по показателю фракции выброса при ГКМП обычно сохранена или повышена (более 60%), несмотря на снижение подвижности МЖП. При использовании других методик расчета сократимости (например, фракции утолщения средних волокон) возможно выявление нарушений систолической функции у 35% больных с ГКМП. При дилатационной стадии ГКМП фракция выброса ЛЖ снижается менее 45%.
- Увеличение левого предсердия имеет место у 55–70% больных с ГКМП. Сократимость предсердия при этом снижается, сферичность его увеличивается.
- В динамике при ГКМП обычно отсутствует увеличение степени ГЛЖ, хотя нарушения преимущественно диастолической функции ЛЖ могут прогрессировать.

Следует обратить внимание и на особенности ЭКГ при ГКМП. ЭКГ-признаки ГЛЖ неспецифичны и не позволяют определить причину ГЛЖ. ЭКГ не позволяет дифференцировать гипертрофию и дилатацию желудочков. ЭКГ можно использовать для скрининга ГЛЖ как при АГ, так и при других причинах ГЛЖ. При обсуждении ЭКГ-признаков различных заболеваний, сопровождающихся ГЛЖ, мы обратим внимание не столько на сами признаки ГЛЖ, сколько на другие изменения ЭКГ.
ЭКГ при ГКМП не может быть нормальной. В большинстве случаев у пациентов обнаруживают признаки гипертрофии левого (а иногда и правого) желудочка. Интересно, что ЭКГ-признаки гипертрофии ПЖ при ГКМП являются в большинстве случаев «ложными» — высокая амплитуда зубцов R в правых грудных отведениях и глубокие зубцы S в левых грудных отведениях отражают, скорее, гипертрофию МЖП. Следует помнить, что среди пациентов с ГКМП чаще встречаются лица молодого возраста, для которых необходимо использовать другие критерии ГЛЖ (в частности, индекс Sokolov-Lyon для ЛЖ ≥45 мм).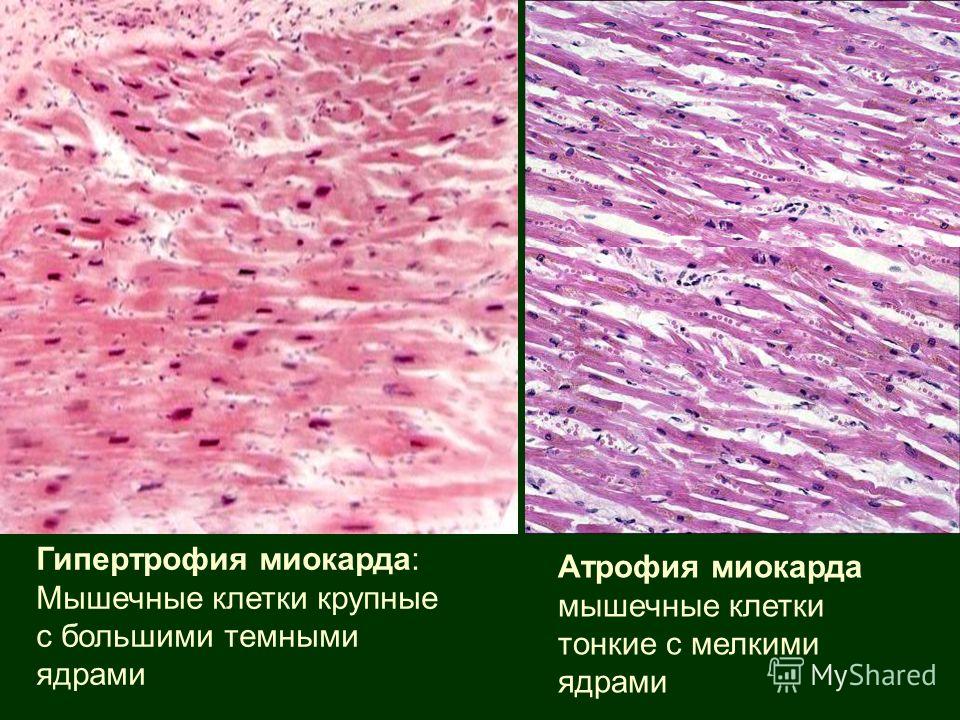 Обычным при ГКМП является наличие нарушений реполяризации в виде отрицательных зубцов Т и/или депрессии сегмента ST во многих отведениях. При этом амплитуда зубцов Т может быть очень велика. Выявление таких изменений ЭКГ у молодого пациента (иногда даже у детей) заставляет думать о ГКМП. При вторичных гипертрофиях миокарда столь выраженные нарушения реполяризации обычно отражают тяжелую ГЛЖ, часто с присоединением фиброза миокарда, характерную для пациентов более старших возрастов. Локализация отрицательных зубцов Т и/или депрессии сегмента ST при АГ — левые грудные отведения. Еще одним необычным признаком ЭКГ при ГКМП является появление глубоких зубцов Q, чаще в отведениях V2-V5. При значительной глубине (обычно более ¼ R) ширина таких зубцов может не превышать 0,03 с. Такие зубцы Q отражают преимущественно гипертрофию МЖП. В отличие от патологических зубцов Q при ИБС при ГКМП отсутствует четкое соответствие локализации зубцов Q и зон гипокинезии по данным ЭХО-КГ [3]. Обычными для ГКМП являются нарушения ритма и проводимости, хотя фибрилляция предсердий встречается нечасто.
Обычным при ГКМП является наличие нарушений реполяризации в виде отрицательных зубцов Т и/или депрессии сегмента ST во многих отведениях. При этом амплитуда зубцов Т может быть очень велика. Выявление таких изменений ЭКГ у молодого пациента (иногда даже у детей) заставляет думать о ГКМП. При вторичных гипертрофиях миокарда столь выраженные нарушения реполяризации обычно отражают тяжелую ГЛЖ, часто с присоединением фиброза миокарда, характерную для пациентов более старших возрастов. Локализация отрицательных зубцов Т и/или депрессии сегмента ST при АГ — левые грудные отведения. Еще одним необычным признаком ЭКГ при ГКМП является появление глубоких зубцов Q, чаще в отведениях V2-V5. При значительной глубине (обычно более ¼ R) ширина таких зубцов может не превышать 0,03 с. Такие зубцы Q отражают преимущественно гипертрофию МЖП. В отличие от патологических зубцов Q при ИБС при ГКМП отсутствует четкое соответствие локализации зубцов Q и зон гипокинезии по данным ЭХО-КГ [3]. Обычными для ГКМП являются нарушения ритма и проводимости, хотя фибрилляция предсердий встречается нечасто. ЭКГ при ГКМП признана значимым методом скрининга заболевания, в т. ч. и у родственников больного.
ЭКГ при ГКМП признана значимым методом скрининга заболевания, в т. ч. и у родственников больного.
Среди форм ГКМП существует достаточно необычный вариант, характеризующийся выраженной гипертрофией области верхушки сердца. Это верхушечная, или апикальная, ГКМП (АГКМП), описанная в 1976 г. в Японии, но выявленная впоследствии и в европейских популяциях. Она характерна преимущественно для мужчин 40–60 лет, протекает благоприятно со стертой симптоматикой [1]. Обструкции выносящего тракта ЛЖ у таких больных обычно не возникает.
Существенные трудности может представлять дифференциальная диагностика поражения сердца при гипертонической болезни (ГБ) и ГКМП. ГЛЖ имеет место у 68% больных АГ. Для ГБ на ранних этапах ремоделирования более характерна некоторая асимметрия ГЛЖ, на более поздних стадиях — симметричная ГЛЖ. Все основные типы ремоделирования ЛЖ могут иметь место при АГ. Наиболее неблагоприятными в плане сердечно-сосудистых осложнений являются концентрическая и эксцентрическая ГЛЖ. У молодых мужчин с ГБ в 5% случаев имело место концентрическое ремоделирование ЛЖ, изолированная гипертрофия МЖП — у 6%, изолированная гипертрофия задней стенки ЛЖ — у 2%, эксцентрическая гипертрофия ЛЖ — у 9%, концентрическая гипертрофия — у 13% [6]. У пациентов более старших возрастов концентрическая ГЛЖ отмечена в 20% случаев, эксцентрическая — также в 20% случаев. Описаны случаи апикальной ГЛЖ при ГБ. При АГ может иметь место и гипертрофия свободной стенки ПЖ. В исследовании Е. П. Гладышевой и соавт. у 34% больных при ГБ имело место увеличение полости ПЖ со снижением его систолической и диастолической функции [7]. Увеличение полости ПЖ и его дисфункция выявлялись уже при ГБ I стадии. Умеренное снижение сократимости ПЖ обнаружено у 75% больных с ГБ I стадии. Дилатация полости ПЖ выявлена в 27% случаев при ГБ I стадии [7].
У молодых мужчин с ГБ в 5% случаев имело место концентрическое ремоделирование ЛЖ, изолированная гипертрофия МЖП — у 6%, изолированная гипертрофия задней стенки ЛЖ — у 2%, эксцентрическая гипертрофия ЛЖ — у 9%, концентрическая гипертрофия — у 13% [6]. У пациентов более старших возрастов концентрическая ГЛЖ отмечена в 20% случаев, эксцентрическая — также в 20% случаев. Описаны случаи апикальной ГЛЖ при ГБ. При АГ может иметь место и гипертрофия свободной стенки ПЖ. В исследовании Е. П. Гладышевой и соавт. у 34% больных при ГБ имело место увеличение полости ПЖ со снижением его систолической и диастолической функции [7]. Увеличение полости ПЖ и его дисфункция выявлялись уже при ГБ I стадии. Умеренное снижение сократимости ПЖ обнаружено у 75% больных с ГБ I стадии. Дилатация полости ПЖ выявлена в 27% случаев при ГБ I стадии [7].
При вторичных причинах ГЛЖ (ИБС и АГ) встречается ГЛЖ с толщиной стенок более 1,5 см. В группе из 77 пациентов с ИБС и ГБ гипертрофия МЖП более 1,5 см обнаружена нами у 26 (34%) больных, а такая же гипертрофия ЗСЛЖ — у 5 (6,5%) больных [3].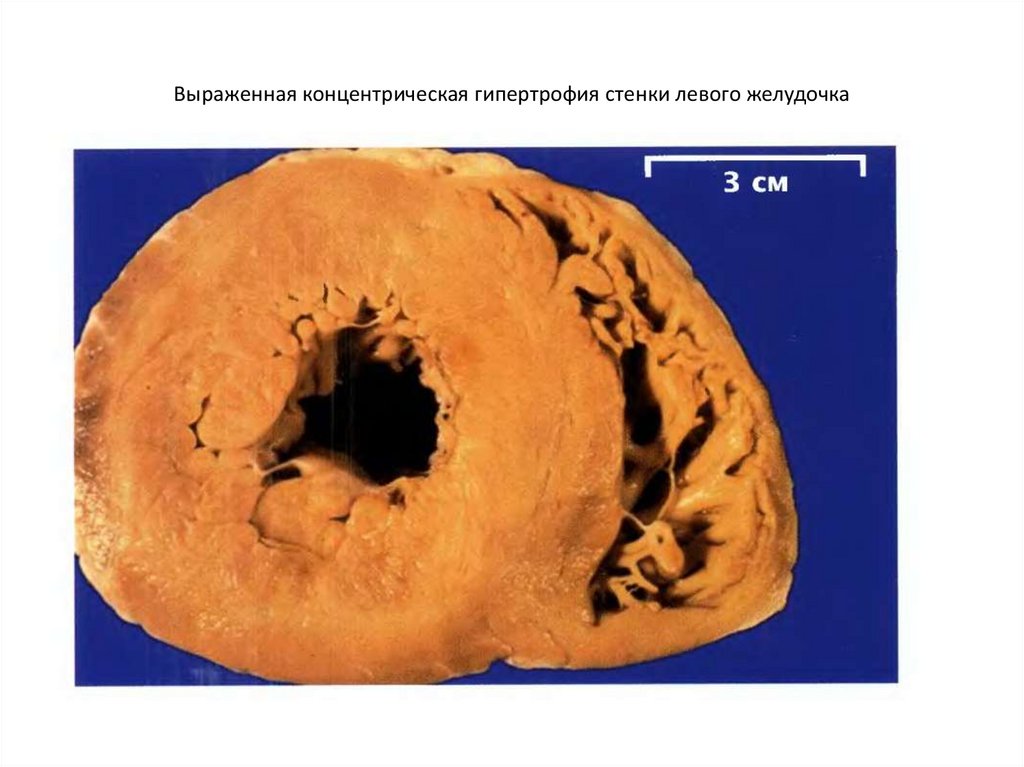 При АГ встречается развитие асимметричной ГЛЖ с градиентом обструкции и переднесистолическим движением створки митрального клапана у 4–6% больных [3]. Анамнестические данные (гипертензивный анамнез) не всегда могут оказать помощь в диагностике. Изменения ЭКГ, столь характерные для ГКМП (в частности, глубокие отрицательные зубцы Т и появление патологических зубцов Q), могут встречаться при ГБ, в т. ч. и в сочетании с ИБС.
При АГ встречается развитие асимметричной ГЛЖ с градиентом обструкции и переднесистолическим движением створки митрального клапана у 4–6% больных [3]. Анамнестические данные (гипертензивный анамнез) не всегда могут оказать помощь в диагностике. Изменения ЭКГ, столь характерные для ГКМП (в частности, глубокие отрицательные зубцы Т и появление патологических зубцов Q), могут встречаться при ГБ, в т. ч. и в сочетании с ИБС.
Описано возникновение ГЛЖ у лиц с отягощенной по ГБ наследственностью до появления стойкого повышения АД. Подобные данные приводят А. В. Сорокин и соавт. [8]. Однако эти изменения никогда не достигали такой выраженности, как при истинной ГКМП. Кроме того, они описаны у лиц с высокой напряженностью труда — таким образом, речь идет скорее о варианте «рабочей гипертрофии ЛЖ», по аналогии со «спортивным сердцем». С клинической точки зрения, невысокий уровень АД при недлительном гипертоническом анамнезе и выраженной ГЛЖ заставляет предполагать наличие ГКМП. В ряде случаев отмечено возникновение АГ у больных с ГКМП [3]. Однако достоверно судить о наличии сочетания двух заболеваний возможно либо при ДНК-диагностике ГКМП, либо при длительном наблюдении больного. Мы располагаем подобными наблюдениями, когда у пациентов с диагностированной в молодом возрасте ГКМП позднее присоединялась ГБ. Следует отметить, что «омоложение» АГ затрудняет дифференциальную диагностику с учетом того, что клиническая манифестация ГКМП может происходить в любом возрасте. Основные критерии дифференциальной диагностики ГКМП и гипертонического сердца приведены в таблице 1.
Однако достоверно судить о наличии сочетания двух заболеваний возможно либо при ДНК-диагностике ГКМП, либо при длительном наблюдении больного. Мы располагаем подобными наблюдениями, когда у пациентов с диагностированной в молодом возрасте ГКМП позднее присоединялась ГБ. Следует отметить, что «омоложение» АГ затрудняет дифференциальную диагностику с учетом того, что клиническая манифестация ГКМП может происходить в любом возрасте. Основные критерии дифференциальной диагностики ГКМП и гипертонического сердца приведены в таблице 1.
Сочетание ГБ и ИБС с ГКМП не является чем-то необычным ввиду возможности длительной выживаемости пациентов. Учитывая сходство клинических проявлений ГКМП и ИБС, в частности наличие стенокардии, представляется важным дифференцировать ГЛЖ при данных заболеваниях (табл. 2).
Выраженная ГЛЖ с диастолической дисфункцией достаточно часто имеет место при ИБС. Развитие диастолической дисфункции при ИБС может быть связано как с рецидивирующими эпизодами ишемии, так и с развитием ГЛЖ. Следует отметить, что асимметричная ГЛЖ может иметь место у 6,6–41% больных ИБС, чаще после повторных, преимущественно нижних, ОИМ [3]. Асимметричная ГЛЖ и диастолическая дисфункция ЛЖ характерны и для бессимптомно протекающей ИБС. При ИБС часто выявляются участки нарушенной сократимости миокарда ЛЖ, преимущественно гипокинезии. В то же время гипокинезия может быть принципиально обратимой в ответ на медикаментозные воздействия. При ГКМП можно ожидать необратимости гипокинезии миокарда, обусловленной не наличием участков «оглушенного» миокарда, а его структурными нарушениями.
Следует отметить, что асимметричная ГЛЖ может иметь место у 6,6–41% больных ИБС, чаще после повторных, преимущественно нижних, ОИМ [3]. Асимметричная ГЛЖ и диастолическая дисфункция ЛЖ характерны и для бессимптомно протекающей ИБС. При ИБС часто выявляются участки нарушенной сократимости миокарда ЛЖ, преимущественно гипокинезии. В то же время гипокинезия может быть принципиально обратимой в ответ на медикаментозные воздействия. При ГКМП можно ожидать необратимости гипокинезии миокарда, обусловленной не наличием участков «оглушенного» миокарда, а его структурными нарушениями.
Асимметричная ГЛЖ при ИБС часто обусловлена компенсаторной гипертрофией МЖП вследствие перенесенного ОИМ свободной стенки ЛЖ, т. е. при ИБС будет иметь место гипокинезия ЗСЛЖ, а не МЖП. Компенсаторная гипертрофия возможна как в зоне интактного миокарда, так и в зоне ишемии. В исследовании В. Л. Дмитриева показано, что процент суммарного поражения коронарных артерий напрямую коррелирует с ИММЛЖ, независимо от наличия АГ у пациентов с ИБС [9].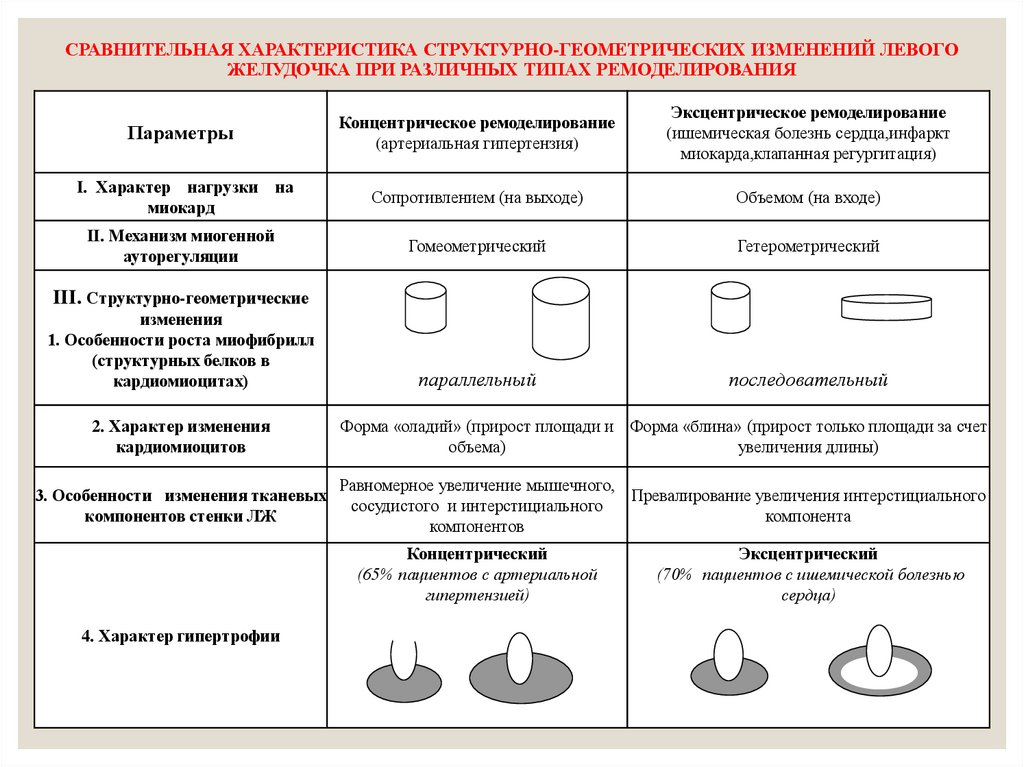 При этом чем выше был функциональный класс стенокардии, тем выше оказался ИММЛЖ и выше индекс сферичности ЛЖ. Таким образом, для ИБС более характерен эксцентрический тип ремоделирования ЛЖ, с увеличением его сферичности [9]. При ИБС весьма часто отмечается снижение систолической функции ЛЖ, особенно при асимметричной ГЛЖ. Для ГКМП это не характерно. При ИБС асимметричная ГЛЖ часто сочетается с развитием аневризмы сердца. Изменения аорты и клапанного аппарата при ИБС (уплотнение стенок аорты, кальцинаты, клапанные стенозы аорты) также позволяют исключить ГКМП, хотя у больных пожилого возраста ГКМП может сочетаться с возрастными атеросклеротическими изменениями. При ИБС и АГ возможно эксцентрическое ремоделирование миокарда, достигающее критериев дилатационной кардиомиопатии. В сложных диагностических ситуациях помощь может оказать визуализация коронарных артерий (коронароангиография либо методики, основанные на компьютерной томографии высокого разрешения). При коронароангиографии у больных ГКМП стенозы коронарных артерий обычно не характерны.
При этом чем выше был функциональный класс стенокардии, тем выше оказался ИММЛЖ и выше индекс сферичности ЛЖ. Таким образом, для ИБС более характерен эксцентрический тип ремоделирования ЛЖ, с увеличением его сферичности [9]. При ИБС весьма часто отмечается снижение систолической функции ЛЖ, особенно при асимметричной ГЛЖ. Для ГКМП это не характерно. При ИБС асимметричная ГЛЖ часто сочетается с развитием аневризмы сердца. Изменения аорты и клапанного аппарата при ИБС (уплотнение стенок аорты, кальцинаты, клапанные стенозы аорты) также позволяют исключить ГКМП, хотя у больных пожилого возраста ГКМП может сочетаться с возрастными атеросклеротическими изменениями. При ИБС и АГ возможно эксцентрическое ремоделирование миокарда, достигающее критериев дилатационной кардиомиопатии. В сложных диагностических ситуациях помощь может оказать визуализация коронарных артерий (коронароангиография либо методики, основанные на компьютерной томографии высокого разрешения). При коронароангиографии у больных ГКМП стенозы коронарных артерий обычно не характерны.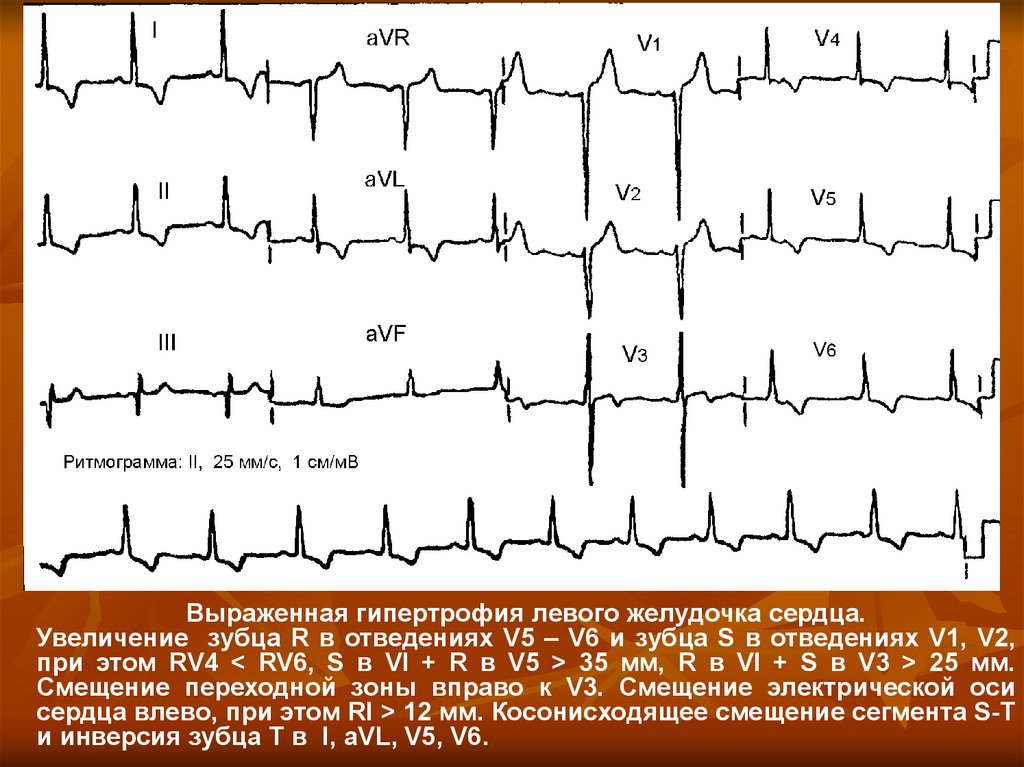 Для асимметричной ГЛЖ при ИБС характерно поражение правой коронарной артерии.
Для асимметричной ГЛЖ при ИБС характерно поражение правой коронарной артерии.
Приведем клинический пример пациентки с выраженной асимметричной ГЛЖ вторичного происхождения.
Больная Ш., 64 лет. Жалобы на давящие боли за грудиной, возникающие при ходьбе до 15 м, с иррадиацией в шею. Боли проходят в покое в течение 5 мин, купируются приемом изосорбида динитрата. Отмечает эпизоды сердцебиений вне связи с физической нагрузкой, сопровождающиеся «предобморочным состоянием». Инспираторная одышка при небольших физических нагрузках. Изредка — приступы экспираторного удушья, сопровождающиеся кашлем, с эффектом от ипратропия и фенотерола. Из анамнеза заболевания известно, что повышение АД до 160/100 мм рт. ст. более 15 лет. «Привычные» цифры АД — 110/70 мм рт. ст. Последние несколько лет регулярно принимает дилтиазем 120 мг/сут, достигнут контроль АД. С 2005 г. отмечает приступы стенокардии. Из прочих кардиологических препаратов регулярно принимает АСК 75 мг, аторвастатин — 10 мг, триметазидин — 70 мг. Из анамнеза жизни: отец умер от инсульта в 38 лет, старшая сестра перенесла ОНМК, младший брат страдал ИБС. Работала в контакте со сварочным аэрозолем, наблюдается у профпатолога с диагнозом «Пневмокониоз, узелковая форма». Из сопутствующих заболеваний: с 2003 г. выставлен диагноз гормонозависимой бронхиальной астмы. В 2013 г. выявлен аутоиммунный тиреоидит, декомпенсированный гипотиреоз.
Из анамнеза жизни: отец умер от инсульта в 38 лет, старшая сестра перенесла ОНМК, младший брат страдал ИБС. Работала в контакте со сварочным аэрозолем, наблюдается у профпатолога с диагнозом «Пневмокониоз, узелковая форма». Из сопутствующих заболеваний: с 2003 г. выставлен диагноз гормонозависимой бронхиальной астмы. В 2013 г. выявлен аутоиммунный тиреоидит, декомпенсированный гипотиреоз.
Объективный статус. Общее состояние удовлетворительное. В легких дыхание везикулярное, побочных дыхательных шумов нет. Область сердца при осмотре не изменена, перкуторные границы в норме. Тоны сердца приглушены, ритмичны, ЧСС — 78 уд./мин, мягкий систолический шум во всех точках аускультации с эпицентром на верхушке, без иррадиации. Отмечается снижение пульсации на артериях стоп. Больная обследована в ФЦССХ г. Челябинска. При проведении ЭКГ — синусовая брадикардия, ЧСС — 54 уд./мин. Гипертрофия миокарда ЛЖ с гемодинамической перегрузкой. Нельзя исключить очаговые изменения перегородки. При проведении холтеровского мониторирования ЭКГ в январе 2013 г. на фоне синусового ритма зарегистрированы 4 эпизода фибрилляции предсердий, на фоне физической нагрузки — эпизоды депрессии ST до 2 мм от исходной.
на фоне синусового ритма зарегистрированы 4 эпизода фибрилляции предсердий, на фоне физической нагрузки — эпизоды депрессии ST до 2 мм от исходной.
Судя по данным амбулаторной карты, в 2009 г. при проведении ЭХО-КГ выявлена толщина МЖП 1,72 см, задней стенки ЛЖ — 1,15 см, градиент обструкции — 19,6 мм рт. ст.
В динамике ЭХО-КГ в ФЦССХ в марте 2013 г. — увеличение толщины МЖП до 2,2 см, градиента обструкции — до 39–43 мм рт. ст., в июле 2013 г. — 71–78 мм рт. ст., после 25 приседаний градиент достиг 141 мм рт. ст. Постоянно определялся поток регургитации 2–3 степени на митральном клапане, аортальная и трикуспидальная регургитация 1 степени. Выявлена умеренная гипокинезия МЖП в базальном и среднем сегментах. Стенки аорты уплотнены, яркие. В июле 2013 г. пациентке проведена коронароангиография. Заключение — правый тип коронарного кровотока, стеноз до 50% средней трети ПМЖВ, в прочих коронарных артериях достоверных стенозов нет. Уровень BNP составил 1038 пкг/мл, при норме менее 100 пкг/мл.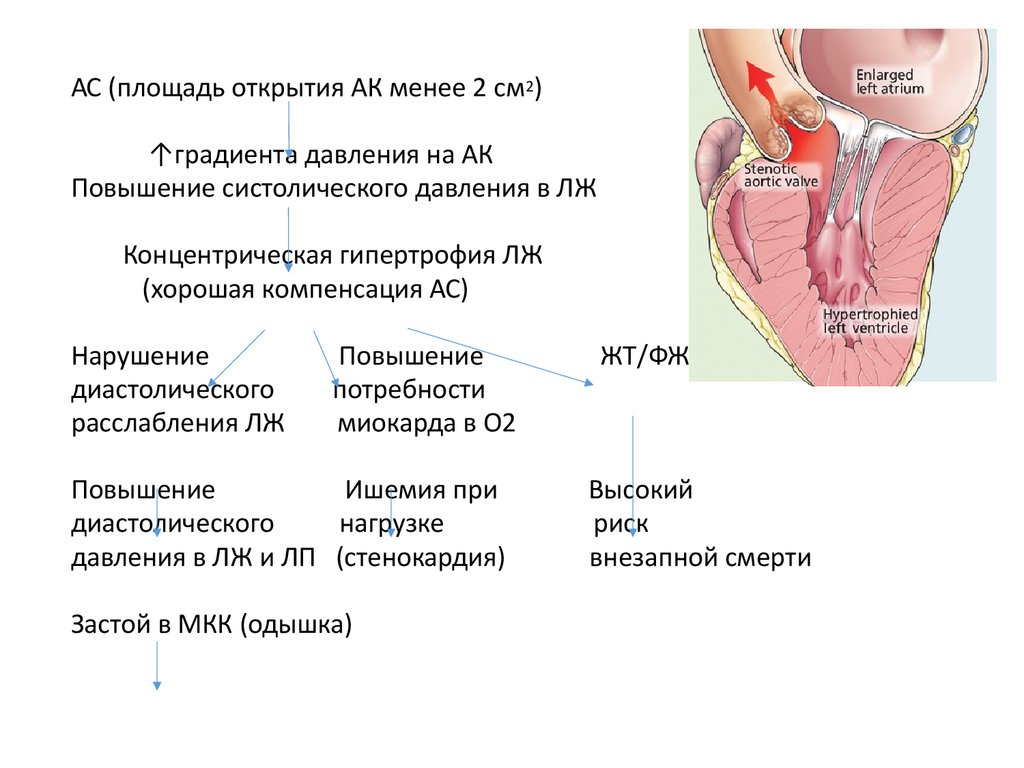 Уровень общего холестерина — 5,1 ммоль/л. Креатинин крови — 109 мкмоль/л; СКФ (MDRD) — 47 мл/мин/1,73 м², что соответствует ХБП 3 стадии. По результатам обследования в ФЦССХ было высказано предположение о наличии у больной ГОКМП в сочетании с ГБ. Однако против диагноза ГОКМП свидетельствовали следующие факты:
Уровень общего холестерина — 5,1 ммоль/л. Креатинин крови — 109 мкмоль/л; СКФ (MDRD) — 47 мл/мин/1,73 м², что соответствует ХБП 3 стадии. По результатам обследования в ФЦССХ было высказано предположение о наличии у больной ГОКМП в сочетании с ГБ. Однако против диагноза ГОКМП свидетельствовали следующие факты:
- длительный гипертонический анамнез, наследственный анамнез инсульта, ИБС, АГ;
- наличие сопутствующей легочной патологии, способствующей развитию гипертрофии МЖП, а также патологии щитовидной железы;
- нарастание выраженности ГЛЖ и градиента обструкции за время наблюдения.
- Таким образом, заключительный диагноз:
Гипертоническая болезнь III стадии, достигнутое нормальное АД, риск 4.
ИБС. Стенокардия напряжения III ФК. Безболевая ишемия миокарда. Пароксизмальная форма фибрилляции предсердий, EHRA-1, CHA2DS2-VASc — 4 балла, HAS-BLED — 1 балл. ХСН IIа, III ФК. Оперативное лечение пациентке не показано. Рекомендовано продолжить прием дилтиазема, статинов. Показан прием оральных антикоагулянтов.
Показан прием оральных антикоагулянтов.
Учитывая тот факт, что у атлетов толщина миокарда ЛЖ может достигать 16 мм (в большей степени у мужчин), весьма актуальна дифференциальная диагностика ГКМП и «спортивного сердца». Это важно ввиду молодого возраста спортсменов и опасности внезапной смерти на высоте физических нагрузок. В последнее время предлагается подозревать ГКМП у спортсменов при толщине миокарда более 1,2–1,3 см. Большое внимание уделяется ЭКГ-скринингу. Выявление гипертрофии левого предсердия, признаков ГЛЖ, патологических зубцов Q, блокад ножек пучка Гиса, удлинения QТ, нарушений ритма и проводимости требует исключения у спортсменов заболевания сердца [1]. По нашим данным, у пациентов со «спортивным сердцем» имела место наименее выраженная ГЛЖ, без нарушения функции сердца и проявлений ремоделирования [3]. При «спортивном сердце» преобладает эксцентрическое ремоделирование с сохранной функцией ЛЖ. Лишь силовые виды спорта с изометрической нагрузкой способствуют развитию концентрического ремоделирования. Для «спортивного сердца» характерно обратное развитие после прекращения спортивных занятий не менее чем на 3 мес. Не исключено, что именно этим объясняется описание обратного развития ГЛЖ на ранних этапах изучения ГКМП, когда диагностические критерии данного заболевания были малоизучены [10]. В таблице 3 представлены критерии дифференциальной диагностики ГКМП и «спортивного сердца».
Для «спортивного сердца» характерно обратное развитие после прекращения спортивных занятий не менее чем на 3 мес. Не исключено, что именно этим объясняется описание обратного развития ГЛЖ на ранних этапах изучения ГКМП, когда диагностические критерии данного заболевания были малоизучены [10]. В таблице 3 представлены критерии дифференциальной диагностики ГКМП и «спортивного сердца».
Гипертрофия МЖП возникает также при легочном сердце. Это заболевание поражает преимущественно правые отделы сердца, но общая стенка двух желудочков — МЖП, также подвергается ремоделированию. Кроме того, при легочном сердце происходят изменения и ЛЖ, в частности его диастолическая дисфункция. В таблице 4 приводятся основные дифференциально-диагностические признаки ГКМП и легочного сердца.
Таким образом, дифференциальная диагностика гипертрофий миокарда различного происхождения представляет существенные трудности. Тем не менее, можно выделить некоторые отличительные особенности различных гипертрофий миокарда, пригодные для использования в повседневной клинической практике.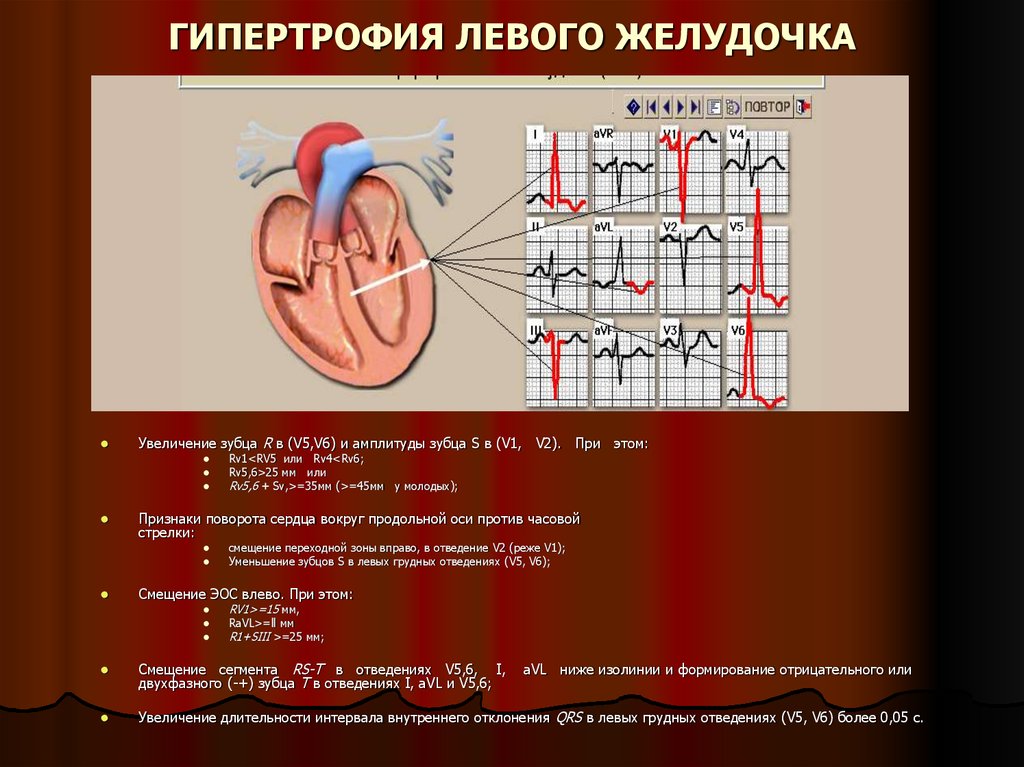
Литература
Гипертензия и гипертрофия левого желудочка — Аронов
От редакции
Wilbert S. Aronow
Отделение кардиологии, медицинский факультет Вестчестерского медицинского центра и Нью-Йоркского медицинского колледжа Valhalla, NY, USA
Адрес для связи: Wilbert S. Aronow, MD, FACC, FAHA. Профессор медицины, отделение кардиологии, Вестчестерский медицинский центр и Нью-Йоркский медицинский колледж, Macy Pavilion, Room 141, Valhalla, NY 10595, США. Электронная почта: [email protected].
Поступила в редакцию 10.04.2017. Принята к печати 01.05.2017.
doi: 10.21037/atm.2017.06.14
Гипертрофия левого желудочка (ГЛЖ) представляет собой аномальное увеличение массы левого желудочка. который является маркером коронарных событий, инсульта, сердечной недостаточности, заболеваний периферических артерий и смертности от сердечно-сосудистых заболеваний у пациентов с артериальной гипертензией (1–12) и способствует им (1–12). ГЛЖ обычно измеряют с помощью электрокардиографии, эхокардиографии и магнитно-резонансной томографии. Концентрическая ГЛЖ представляет собой увеличение индекса массы левого желудочка с относительной толщиной стенки ≥0,45 (1). Эксцентрическая ГЛЖ представляет собой увеличение индекса массы левого желудочка с относительной толщиной стенки <0,45 (1). Концентрическое ремоделирование левого желудочка — это относительная толщина стенки ≥0,45 при нормальном индексе массы левого желудочка. Факторы, влияющие на геометрию левого желудочка у лиц с артериальной гипертензией, включают: (I) тяжесть, продолжительность и быстроту начала повышения нагрузки давлением; (II) объемная нагрузка; (III) возраст, раса/этническая принадлежность и пол; (IV) сопутствующие заболевания, такие как ишемическая болезнь сердца, сахарный диабет, ожирение и пороки клапанов сердца; (V) нейрогормональная среда; (VI) изменения внеклеточного матрикса; и (VII) генетические факторы (13). У чернокожих с гипертонией чаще, чем у белых с гипертонией, развивается концентрическая ГЛЖ (13).
ГЛЖ обычно измеряют с помощью электрокардиографии, эхокардиографии и магнитно-резонансной томографии. Концентрическая ГЛЖ представляет собой увеличение индекса массы левого желудочка с относительной толщиной стенки ≥0,45 (1). Эксцентрическая ГЛЖ представляет собой увеличение индекса массы левого желудочка с относительной толщиной стенки <0,45 (1). Концентрическое ремоделирование левого желудочка — это относительная толщина стенки ≥0,45 при нормальном индексе массы левого желудочка. Факторы, влияющие на геометрию левого желудочка у лиц с артериальной гипертензией, включают: (I) тяжесть, продолжительность и быстроту начала повышения нагрузки давлением; (II) объемная нагрузка; (III) возраст, раса/этническая принадлежность и пол; (IV) сопутствующие заболевания, такие как ишемическая болезнь сердца, сахарный диабет, ожирение и пороки клапанов сердца; (V) нейрогормональная среда; (VI) изменения внеклеточного матрикса; и (VII) генетические факторы (13). У чернокожих с гипертонией чаще, чем у белых с гипертонией, развивается концентрическая ГЛЖ (13). У женщин с АГ чаще, чем у мужчин с АГ, развивается концентрическая ГЛЖ (13). Увеличение возраста у пациентов с артериальной гипертензией связано с концентрической ГЛЖ (13). Сахарный диабет у пациентов с артериальной гипертензией связан с концентрической ГЛЖ, тогда как ожирение, которое представляет собой состояние перегрузки объемом, и ишемическая болезнь сердца у пациентов с артериальной гипертензией чаще связаны с эксцентрической ГЛЖ (13).
У женщин с АГ чаще, чем у мужчин с АГ, развивается концентрическая ГЛЖ (13). Увеличение возраста у пациентов с артериальной гипертензией связано с концентрической ГЛЖ (13). Сахарный диабет у пациентов с артериальной гипертензией связан с концентрической ГЛЖ, тогда как ожирение, которое представляет собой состояние перегрузки объемом, и ишемическая болезнь сердца у пациентов с артериальной гипертензией чаще связаны с эксцентрической ГЛЖ (13).
Электрокардиограмма менее чувствительна, чем эхокардиограмма или магнитно-резонансная томография при диагностике ГЛЖ. В слепом проспективном исследовании 476 пациентов в возрасте 62 лет и старше эхокардиографическая ГЛЖ была от 67% до 71% у 167 пациентов (35%) (14). Чувствительность 5 различных электрокардиографических критериев в диагностике ГЛЖ варьировала от 12 до 29 %, специфичность от 93 до 96 %, положительная прогностическая ценность от 62 до 71 % и отрицательная прогностическая ценность от 67 до 71 %. 14). Критерии Корнелла (15) имели наибольшую чувствительность (29%) в прогнозировании ГЛЖ, специфичность 93%, положительная прогностическая ценность 69% и отрицательная прогностическая ценность 71% (14).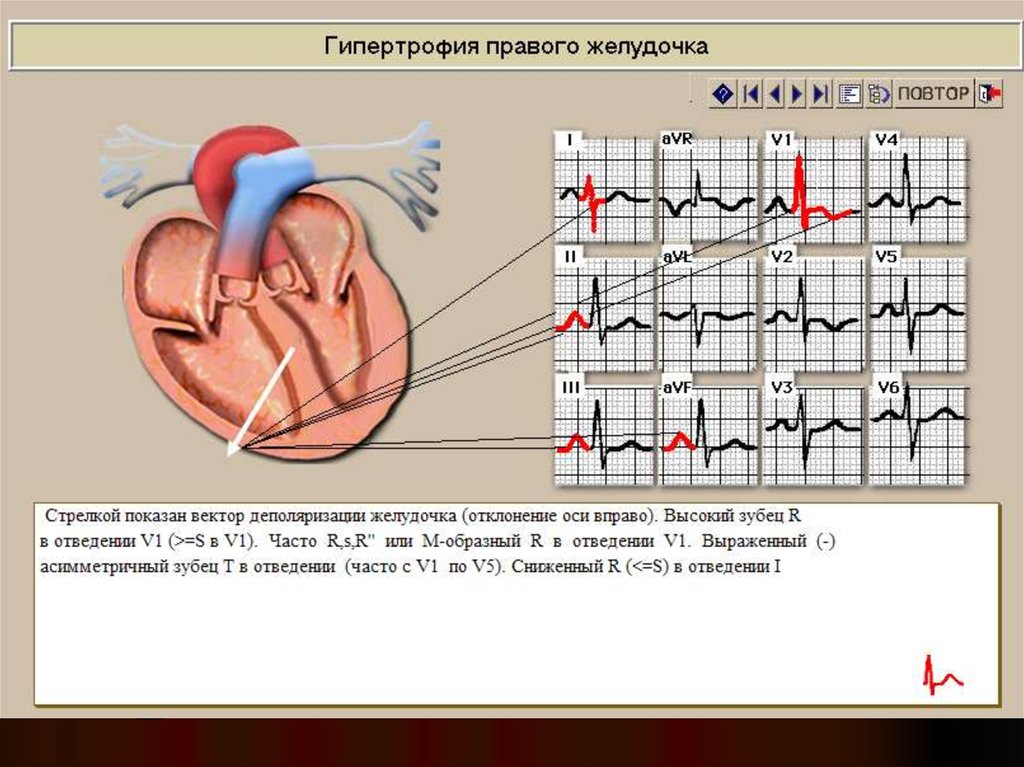
В проспективном исследовании 84 чернокожих и 326 белых старше 62 лет с артериальной гипертензией эхокардиографическая ГЛЖ была обнаружена у 71% чернокожих и у 56% белых (1). Электрокардиографическая ГЛЖ присутствовала у 20% чернокожих и у 15% белых (1). Концентрическая ГЛЖ присутствовала у 60% чернокожих и у 40% белых (1). Эксцентрическая ГЛЖ присутствовала у 12% чернокожих и у 17% белых (1). При 37-месячном наблюдении чернокожих эхокардиографическая ГЛЖ увеличивала частоту новых коронарных событий в 3,33 раза, новых инсультов в 2,76 раза и новых случаев застойной сердечной недостаточности в 3,69 раза.раз (1). При 43-месячном наблюдении за белыми эхокардиографическая ГЛЖ увеличивала частоту новых коронарных событий в 2,72 раза, новых инсультов в 2,76 раза и новых случаев застойной сердечной недостаточности в 3,69 раза (1). При 37-месячном наблюдении за чернокожими электрокардиографическая ГЛЖ увеличивала частоту новых коронарных событий в 1,49 раза, новых инсультов в 1,79 раза и новых случаев застойной сердечной недостаточности в 1,31 раза (1).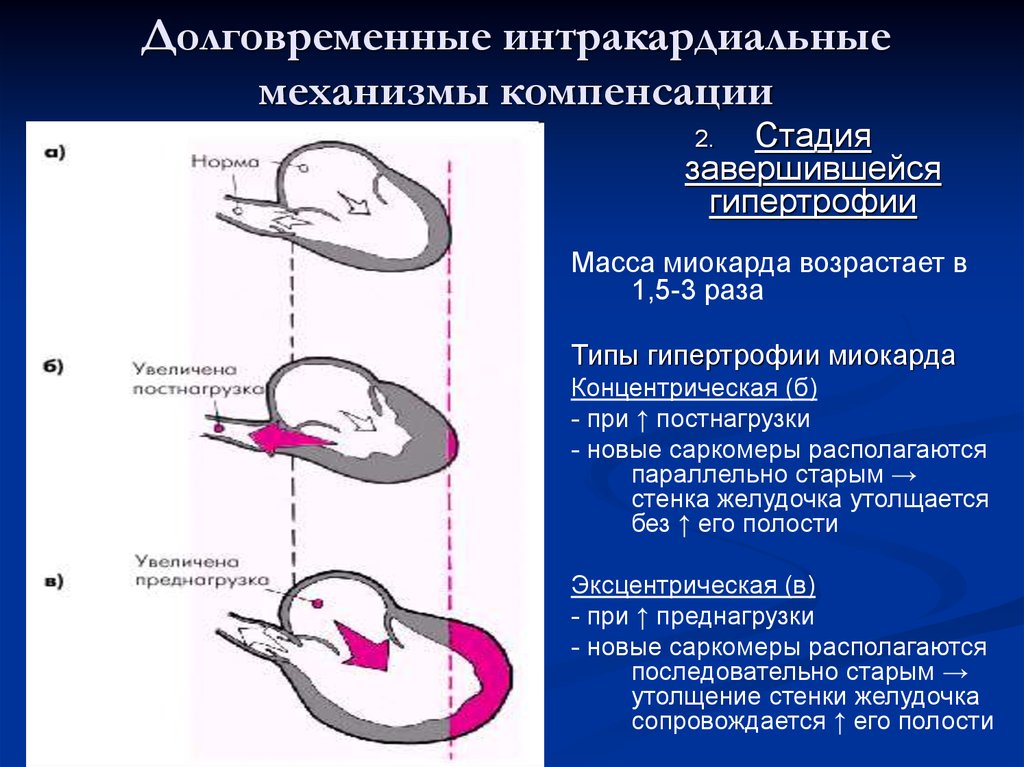 При 43-месячном наблюдении за белыми электрокардиографическая ГЛЖ увеличивала частоту новых коронарных событий в 1,41 раза, новых инсультов в 1,9 раза.4 раза, а новая застойная сердечная недостаточность 1,58 раза (1). У пожилых чернокожих по сравнению с эксцентрической ГЛЖ концентрическая ГЛЖ увеличивала частоту новых коронарных событий в 1,48 раза, новых инсультов в 1,2 раза и новых случаев застойной сердечной недостаточности в 1,73 раза (1). У пожилых белых по сравнению с эксцентрической ГЛЖ концентрическая ГЛЖ увеличивала частоту новых коронарных событий в 1,42 раза, новых случаев застойной сердечной недостаточности в 1,82 раза и имела аналогичную частоту новых инсультов (1). Эхокардиографическая ГЛЖ (отношение шансов 3,21) и концентрическая ГЛЖ (отношение шансов = 2,63) были значимыми независимыми переменными для новых коронарных событий в окончательной модели множественной логистической регрессии для всех пациентов с АГ (1). Эхокардиографическая ГЛЖ (отношение шансов 4,17) и электрокардиографическая ГЛЖ (отношение шансов = 2,10) были значимыми независимыми переменными для нового инсульта в окончательной модели множественной логистической регрессии для всех пациентов с артериальной гипертензией (1).
При 43-месячном наблюдении за белыми электрокардиографическая ГЛЖ увеличивала частоту новых коронарных событий в 1,41 раза, новых инсультов в 1,9 раза.4 раза, а новая застойная сердечная недостаточность 1,58 раза (1). У пожилых чернокожих по сравнению с эксцентрической ГЛЖ концентрическая ГЛЖ увеличивала частоту новых коронарных событий в 1,48 раза, новых инсультов в 1,2 раза и новых случаев застойной сердечной недостаточности в 1,73 раза (1). У пожилых белых по сравнению с эксцентрической ГЛЖ концентрическая ГЛЖ увеличивала частоту новых коронарных событий в 1,42 раза, новых случаев застойной сердечной недостаточности в 1,82 раза и имела аналогичную частоту новых инсультов (1). Эхокардиографическая ГЛЖ (отношение шансов 3,21) и концентрическая ГЛЖ (отношение шансов = 2,63) были значимыми независимыми переменными для новых коронарных событий в окончательной модели множественной логистической регрессии для всех пациентов с АГ (1). Эхокардиографическая ГЛЖ (отношение шансов 4,17) и электрокардиографическая ГЛЖ (отношение шансов = 2,10) были значимыми независимыми переменными для нового инсульта в окончательной модели множественной логистической регрессии для всех пациентов с артериальной гипертензией (1). Эхокардиографическая ГЛЖ (отношение шансов 2,57) и концентрическая ГЛЖ (отношение шансов = 2,44) были значимыми независимыми переменными для новых коронарных событий в окончательной модели множественной логистической регрессии для всех пациентов с АГ (1).
Эхокардиографическая ГЛЖ (отношение шансов 2,57) и концентрическая ГЛЖ (отношение шансов = 2,44) были значимыми независимыми переменными для новых коронарных событий в окончательной модели множественной логистической регрессии для всех пациентов с АГ (1).
При 4-летнем наблюдении 406 мужчин, средний возраст 68 лет, и 735 женщин, средний возраст 69 лет, в исследовании Framingham Heart Study эхокардиографическая ГЛЖ повышала риск новых коронарных событий в 1,67 раза для мужчин и в 1,60 раза для женщин. на 50 грамм/метр увеличения массы/высоты левого желудочка (3). Эхокардиографическая ГЛЖ была в 15,3 раза более чувствительной для прогнозирования новых коронарных событий у пожилых мужчин и в 4,3 раза более чувствительной для прогнозирования новых коронарных событий у пожилых женщин, чем электрокардиографическая ГЛЖ (3).
При 10,2-летнем наблюдении за 253 пациентами с артериальной гипертензией эхокардиографическая ГЛЖ увеличивала частоту сердечно-сосудистых осложнений в 2,17 раза, сердечно-сосудистую смерть в 28 раз и смертность от всех причин в 8 раз (4). Пациенты с концентрической ГЛЖ имели самую высокую частоту сердечно-сосудистых событий и смертность. Электрокардиографическая ГЛЖ не предсказывала риск (4). При 37-месячном наблюдении за 360 пожилыми пациентами с артериальной гипертензией или ишемической болезнью сердца эхокардиографическая ГЛЖ увеличила частоту новых коронарных событий в 2,0 раза и новых инсультов в 2,8 раза (6). Электрокардиографическая ГЛЖ увеличивала частоту новых коронарных событий в 1,4 раза и новых инсультов в 1,7 раза (6). Эхокардиографическая ГЛЖ была в 4,3 раза более чувствительной для прогнозирования новых коронарных событий и в 4,0 раза более чувствительной для прогнозирования нового инсульта, чем электрокардиографическая ГЛЖ (6).
Пациенты с концентрической ГЛЖ имели самую высокую частоту сердечно-сосудистых событий и смертность. Электрокардиографическая ГЛЖ не предсказывала риск (4). При 37-месячном наблюдении за 360 пожилыми пациентами с артериальной гипертензией или ишемической болезнью сердца эхокардиографическая ГЛЖ увеличила частоту новых коронарных событий в 2,0 раза и новых инсультов в 2,8 раза (6). Электрокардиографическая ГЛЖ увеличивала частоту новых коронарных событий в 1,4 раза и новых инсультов в 1,7 раза (6). Эхокардиографическая ГЛЖ была в 4,3 раза более чувствительной для прогнозирования новых коронарных событий и в 4,0 раза более чувствительной для прогнозирования нового инсульта, чем электрокардиографическая ГЛЖ (6).
При 4-летнем наблюдении 3220 человек в возрасте 40 лет и старше в исследовании Framingham Heart Study эхокардиографическая ГЛЖ повышала риск сердечно-сосудистых событий в 1,49 раза для мужчин и в 1,57 раза для женщин на 50 г/метр увеличения массы левого желудочка/ роста, риск смерти от сердечно-сосудистых заболеваний в 1,73 раза у мужчин и в 2,12 раза у женщин на 50 г/м прирост массы/роста левого желудочка, а также риск смертности от всех причин в 1,49 раза у мужчин и в 2,01 раза у женщин на 50 г/м метра увеличение массы/высоты левого желудочка (7). При 6-7-летнем наблюдении 5888 человек, средний возраст 73 года, в исследовании сердечно-сосудистых заболеваний, по сравнению с нижним квартилем эхокардиографической массы левого желудочка, наивысший квартиль эхокардиографической массы левого желудочка увеличивал частоту коронарных событий. 1,43 раза, частота инсульта 1,52 раза, а частота застойной сердечной недостаточности 3,36 раза (8). По сравнению с нормальной геометрией левого желудочка эксцентрическая ГЛЖ увеличивала частоту коронарных событий в 2,05 раза и застойной сердечной недостаточности в 2,9 раза.5 раз. По сравнению с нормальной геометрией левого желудочка концентрическая ГЛЖ увеличивает частоту коронарных событий в 1,61 раза и застойной сердечной недостаточности в 3,32 раза (8).
При 6-7-летнем наблюдении 5888 человек, средний возраст 73 года, в исследовании сердечно-сосудистых заболеваний, по сравнению с нижним квартилем эхокардиографической массы левого желудочка, наивысший квартиль эхокардиографической массы левого желудочка увеличивал частоту коронарных событий. 1,43 раза, частота инсульта 1,52 раза, а частота застойной сердечной недостаточности 3,36 раза (8). По сравнению с нормальной геометрией левого желудочка эксцентрическая ГЛЖ увеличивала частоту коронарных событий в 2,05 раза и застойной сердечной недостаточности в 2,9 раза.5 раз. По сравнению с нормальной геометрией левого желудочка концентрическая ГЛЖ увеличивает частоту коронарных событий в 1,61 раза и застойной сердечной недостаточности в 3,32 раза (8).
При 42-месячном наблюдении за 2638 пациентами со средним возрастом 81 год частота новых случаев застойной сердечной недостаточности увеличилась в 2,73 раза у лиц с персистирующей электрокардиографической ГЛЖ по сравнению с лицами без электрокардиографической ГЛЖ (9). При 4,8-летнем наблюдении за 922 пациентами с артериальной гипертензией у пациентов с эхокардиографической и электрокардиографической ГЛЖ частота госпитализаций по поводу застойной сердечной недостаточности была в 5,3 раза выше, чем у пациентов без электрокардиографической или эхокардиографической ГЛЖ (10). У пациентов с эхокардиографической и электрокардиографической ГЛЖ частота госпитализаций по поводу застойной сердечной недостаточности была в 2,6 раза выше, чем у пациентов без электрокардиографической ГЛЖ, но с эхокардиографической ГЛЖ (10).
При 4,8-летнем наблюдении за 922 пациентами с артериальной гипертензией у пациентов с эхокардиографической и электрокардиографической ГЛЖ частота госпитализаций по поводу застойной сердечной недостаточности была в 5,3 раза выше, чем у пациентов без электрокардиографической или эхокардиографической ГЛЖ (10). У пациентов с эхокардиографической и электрокардиографической ГЛЖ частота госпитализаций по поводу застойной сердечной недостаточности была в 2,6 раза выше, чем у пациентов без электрокардиографической ГЛЖ, но с эхокардиографической ГЛЖ (10).
При 10-летнем наблюдении за 2577 проживающими по месту жительства взрослыми, средний возраст 72 года, в исследовании «Здоровье сердечно-сосудистой системы» добавление эхокардиографического индекса массы левого желудочка на 1 стандартное отклонение к 10-летним моделям прогнозирования риска, содержащим традиционный риск факторы улучшили прогнозирование риска возникновения ишемической болезни сердца на 25%, возникновения ишемической болезни сердца, сердечной недостаточности или инсульта на 24% и возникновения застойной сердечной недостаточности на 51% (11). В рамках многоэтнического исследования атеросклероза (MESA) проводилась магнитно-резонансная томография сердца для измерения массы и геометрии левого желудочка для прогнозирования сердечно-сосудистых событий в 5,09 случаях.8 человек в возрасте от 45 до 84 лет (12). Через 4 года наблюдения концентрическая ГЛЖ увеличивала частоту ишемической болезни сердца в 2,1 раза на грамм/мл отношения массы левого желудочка к объему и частоту инсульта в 4,2 раза на грамм/мл отношения массы левого желудочка к объему (12). ). Масса левого желудочка сама по себе увеличивает частоту застойной сердечной недостаточности в 1,4 раза на 10% увеличения массы левого желудочка (12). Нет данных, сравнивающих прогностическое значение массы и геометрии левого желудочка, полученных с помощью магнитно-резонансной томографии и эхокардиографии.
В рамках многоэтнического исследования атеросклероза (MESA) проводилась магнитно-резонансная томография сердца для измерения массы и геометрии левого желудочка для прогнозирования сердечно-сосудистых событий в 5,09 случаях.8 человек в возрасте от 45 до 84 лет (12). Через 4 года наблюдения концентрическая ГЛЖ увеличивала частоту ишемической болезни сердца в 2,1 раза на грамм/мл отношения массы левого желудочка к объему и частоту инсульта в 4,2 раза на грамм/мл отношения массы левого желудочка к объему (12). ). Масса левого желудочка сама по себе увеличивает частоту застойной сердечной недостаточности в 1,4 раза на 10% увеличения массы левого желудочка (12). Нет данных, сравнивающих прогностическое значение массы и геометрии левого желудочка, полученных с помощью магнитно-резонансной томографии и эхокардиографии.
При 2,71-летнем наблюдении за 694 людьми со средним возрастом 50 лет с артериальной гипертензией эхокардиографическое концентрическое ремоделирование левого желудочка увеличило сердечно-сосудистые события в 2,56 раза по сравнению с эхокардиографической нормальной геометрией левого желудочка (16). Эхокардиограммы были получены у 9771 пациента старше 70 лет с нормальной фракцией выброса левого желудочка, за которыми наблюдали в течение 3,1 года (17). Смертность от всех причин составила 15,9% у пациентов с концентрической ГЛЖ, 15,5% у пациентов с концентрическим ремоделированием левого желудочка, 13,7% у пациентов с эксцентрической ГЛЖ и 11,5% у пациентов с нормальной геометрией левого желудочка (17).
Эхокардиограммы были получены у 9771 пациента старше 70 лет с нормальной фракцией выброса левого желудочка, за которыми наблюдали в течение 3,1 года (17). Смертность от всех причин составила 15,9% у пациентов с концентрической ГЛЖ, 15,5% у пациентов с концентрическим ремоделированием левого желудочка, 13,7% у пациентов с эксцентрической ГЛЖ и 11,5% у пациентов с нормальной геометрией левого желудочка (17).
В проспективном когортном субисследовании 941 пациента в возрасте от 55 до 80 лет, участвовавших в исследовании Losartan Intervention for Endpoint Reduction in Hypertension (LIFE) с артериальной гипертензией и электрокардиографической ГЛЖ, массу левого желудочка измеряли с помощью эхокардиографии (18). При 4,8-летнем наблюдении снижение эхокардиографического индекса массы левого желудочка за счет антигипертензивной медикаментозной терапии снижало частоту сердечно-сосудистой смертности на 38%, инсульта на 24%, инфаркта миокарда на 15% и смертности от всех причин на 28%, независимо.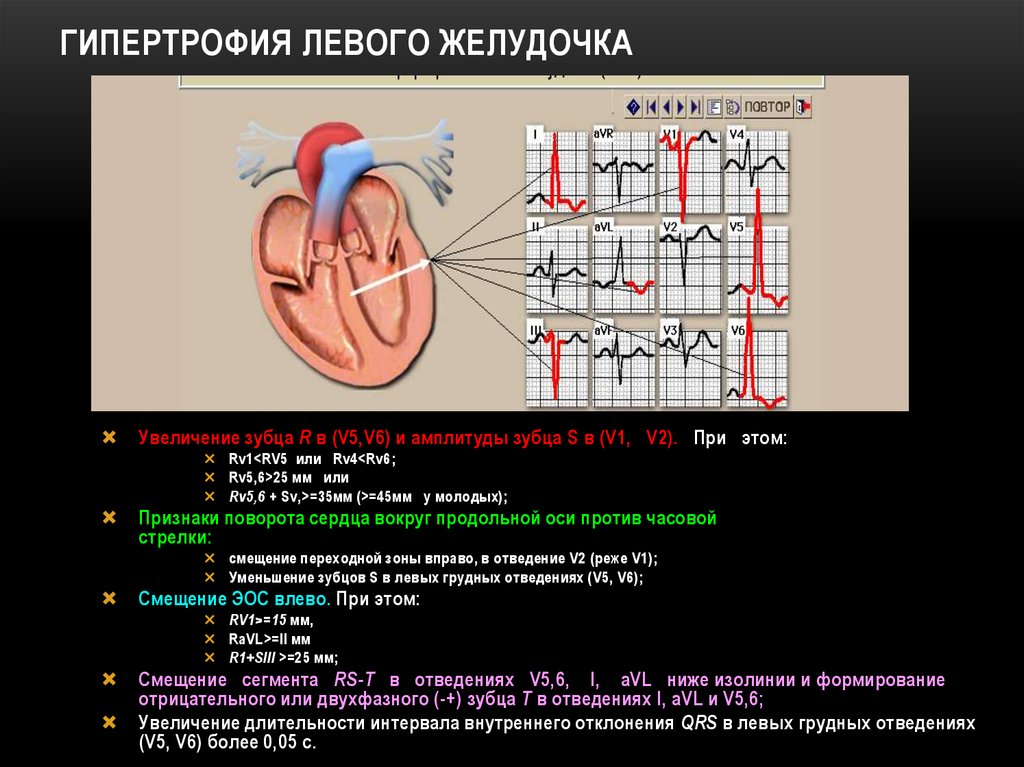 систолического артериального давления и назначенного лечения (18). При 4-летнем наблюдении 9193 человека в возрасте от 55 до 80 лет с артериальной гипертензией и электрокардиографической ГЛЖ, диагностированной по критериям Корнелла или по вольтажным критериям Соколова-Лайона в исследовании LIFE, менее выраженная электрокардиографическая ГЛЖ по критериям Корнелла и по вольтажным критериям Соколова-Лайона была связана с 14% и 17%, соответственно, снижение комбинированной конечной точки смерти от сердечно-сосудистых заболеваний, инфаркта миокарда или инсульта (19). При 4,7-летнем наблюдении 8479 человек, средний возраст 67 лет, с артериальной гипертензией и электрокардиографической ГЛЖ, диагностированной по критериям Корнелла, менее тяжелая электрокардиографическая ГЛЖ была связана с 19% снижения числа госпитализаций по поводу сердечной недостаточности на каждые 817 мм·мс ниже продукта Корнелла (20). В амбулаторных условиях при 67-месячном наблюдении за пациентами с артериальной гипертензией и эхокардиографической ГЛЖ регресс ГЛЖ имел место у 23% пациентов, получавших антигипертензивные препараты (21).
систолического артериального давления и назначенного лечения (18). При 4-летнем наблюдении 9193 человека в возрасте от 55 до 80 лет с артериальной гипертензией и электрокардиографической ГЛЖ, диагностированной по критериям Корнелла или по вольтажным критериям Соколова-Лайона в исследовании LIFE, менее выраженная электрокардиографическая ГЛЖ по критериям Корнелла и по вольтажным критериям Соколова-Лайона была связана с 14% и 17%, соответственно, снижение комбинированной конечной точки смерти от сердечно-сосудистых заболеваний, инфаркта миокарда или инсульта (19). При 4,7-летнем наблюдении 8479 человек, средний возраст 67 лет, с артериальной гипертензией и электрокардиографической ГЛЖ, диагностированной по критериям Корнелла, менее тяжелая электрокардиографическая ГЛЖ была связана с 19% снижения числа госпитализаций по поводу сердечной недостаточности на каждые 817 мм·мс ниже продукта Корнелла (20). В амбулаторных условиях при 67-месячном наблюдении за пациентами с артериальной гипертензией и эхокардиографической ГЛЖ регресс ГЛЖ имел место у 23% пациентов, получавших антигипертензивные препараты (21).
Был проведен метаанализ 5 исследований, включающих 3149 пациентов со средним возрастом от 48 до 66 лет с артериальной гипертензией, в которых изучалось влияние регрессии эхокардиографической ГЛЖ на сердечно-сосудистые события (22). Последующие действия варьировались от 3 до 9годы. Регрессия эхокардиографической ГЛЖ была связана с уменьшением сердечно-сосудистых событий на 46% (22).
Потеря веса и снижение потребления натрия у пациентов с артериальной гипертензией эффективно снижают эхокардиографическую ГЛЖ (23). Чтобы вызвать регрессию ГЛЖ, следует использовать агрессивный контроль артериального давления (21). Мета-анализ 109 исследований лечения, включая 2357 пациентов с артериальной гипертензией, показал, что ингибиторы ангиотензинпревращающего фермента были наиболее эффективными антигипертензивными препаратами для снижения массы левого желудочка (24). Этот анализ показал, что ингибиторы ангиотензинпревращающего фермента, бета-блокаторы и блокаторы кальциевых каналов уменьшают массу левого желудочка за счет уменьшения толщины стенки, тогда как диуретики уменьшают массу левого желудочка за счет уменьшения объема левого желудочка (24).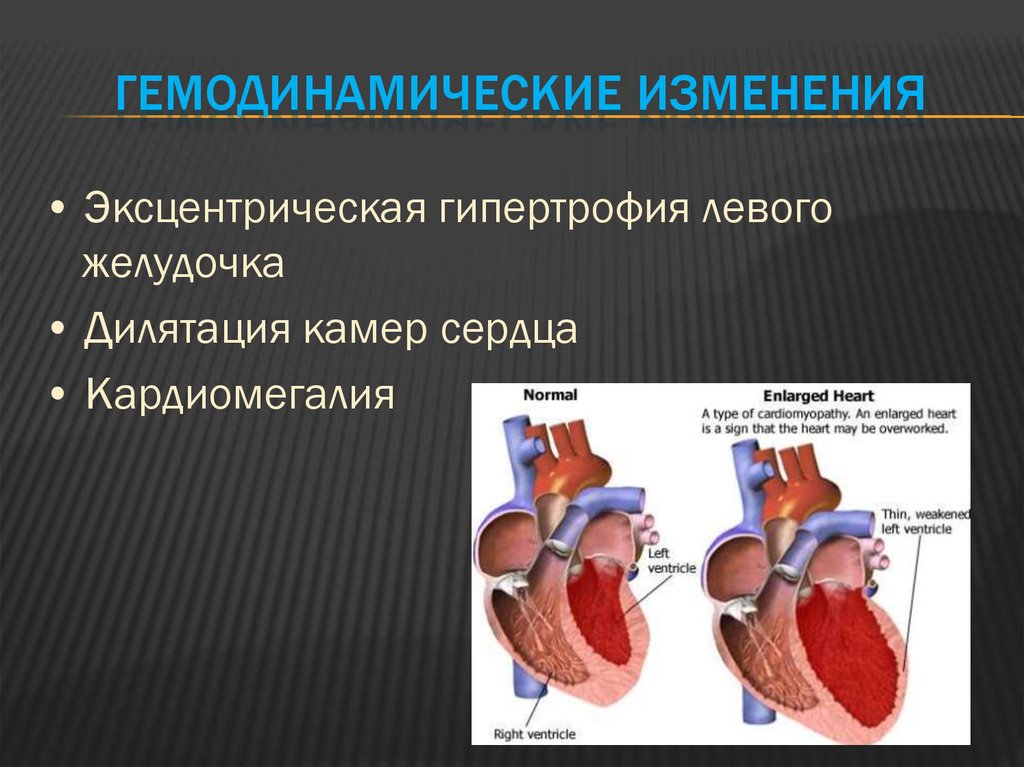 Альфа-адреноблокаторы (25) и вазодилататоры прямого действия (26) не уменьшали массу левого желудочка.
Альфа-адреноблокаторы (25) и вазодилататоры прямого действия (26) не уменьшали массу левого желудочка.
Благодарности
Нет.
Сноска
Конфликт интересов: У автора нет конфликта интересов, о котором следует заявить.
Каталожные номера
- Аронов В.С., Ан С., Кронзон И. и др. Застойная сердечная недостаточность, коронарные события и атеротромботический инфаркт головного мозга у пожилых чернокожих и белых с системной гипертензией и с эхокардиографическими и электрокардиографическими признаками гипертрофии левого желудочка и без них. Ам Джей Кардиол 1991;67:295-99. [Перекрестная ссылка] [PubMed]
- Aronow WS, Fleg JL, Pepine CJ, et al. Консенсусный документ экспертов ACCF/AHA 2011 по гипертонии у пожилых людей: отчет Целевой группы Фонда Американского колледжа кардиологов по клиническим экспертным консенсусным документам. Тираж 2011; 123:2434-506.
 [Перекрестная ссылка] [PubMed]
[Перекрестная ссылка] [PubMed] - Леви Д., Гарнизон Р.Дж., Сэвидж Д.Д. и др. Масса левого желудочка и заболеваемость ишемической болезнью сердца в пожилой когорте. Фремингемское исследование сердца. Энн Интерн Мед 1989;110:101-7. [Перекрестная ссылка] [PubMed]
- Koren MJ, Devereux RB, Casale PN, et al. Связь массы и геометрии левого желудочка с заболеваемостью и смертностью при неосложненной эссенциальной гипертензии. Энн Интерн Мед 1991;114:345-52. [Перекрестная ссылка] [PubMed]
- Kannel WB, Dannenberg AL, Levy D. Популяционные последствия электрокардиографической гипертрофии левого желудочка. Am J Cardiol 1987; 60:85I-93I. [Перекрестная ссылка] [PubMed]
- Аронов В.С., Кенигсберг М., Шварц К.С. Полезность эхокариографической гипертрофии левого желудочка для прогнозирования новых коронарных событий и атеротромботического инфаркта головного мозга у пациентов старше 62 лет. Am J Cardiol 1988;61:1130-2. [Перекрестная ссылка] [PubMed]
- Леви Д.
 , Гарнизон Р.Дж., Сэвидж Д.Д. и др. Прогностические последствия эхокардиографически определенной массы левого желудочка в исследовании сердца Framingham. N Engl J Med 1990;322:1561-6. [Перекрестная ссылка] [PubMed]
, Гарнизон Р.Дж., Сэвидж Д.Д. и др. Прогностические последствия эхокардиографически определенной массы левого желудочка в исследовании сердца Framingham. N Engl J Med 1990;322:1561-6. [Перекрестная ссылка] [PubMed] - Гардин Дж. М., Макклелланд Р., Китцман Д. и др. М-режим эхокардиографических предикторов заболевания от шести до семи лет заболеваемости ишемической болезнью сердца, инсультом, застойной сердечной недостаточностью и смертностью в пожилой когорте (исследование сердечно-сосудистого здоровья). Am J Cardiol 2001;87:1051-7. [Перекрестная ссылка] [PubMed]
- Aronow WS, Ahn C. Связь электрокардиографической гипертрофии левого желудочка с частотой возникновения новой застойной сердечной недостаточности. J am Geriatr Soc 1998;46:1280-1. [Перекрестная ссылка] [PubMed]
- Гердц Э., Окин П.М., Боман К. и др. Ассоциация госпитализаций по поводу сердечной недостаточности с комбинированными электрокардиографическими и эхокардиографическими критериями гипертрофии левого желудочка.
 Am J Hypertens 2012; 25: 678-83. [Перекрестная ссылка] [PubMed]
Am J Hypertens 2012; 25: 678-83. [Перекрестная ссылка] [PubMed] - Desai CS, Bartz TM, Gottdiener JS, et al. Полезность массы и геометрии левого желудочка для определения 10-летнего прогноза сердечно-сосудистых заболеваний у взрослых старше 65 лет (из исследования сердечно-сосудистых заболеваний). Am J Cardiol 2016; 118: 684-90. [Перекрестная ссылка] [PubMed]
- Bluemke DA, Kronmal RA, Lima JA, et al. Взаимосвязь массы и геометрии левого желудочка с сердечно-сосудистыми событиями. исследование MESA (Мультиэтническое исследование атеросклероза). J Am Coll Cardiol 2008; 52: 2148-55. [Перекрестная ссылка] [PubMed]
- Дразнер МХ. Прогрессирование гипертонической болезни сердца. Тираж 2011; 123:327-34. [Перекрестная ссылка] [PubMed]
- Аронов В.С., Шварц К.С., Кенигсберг М. Значение пяти электрокардиографических критериев коррелирует с эхокардиографической гипертрофией левого желудочка у пожилых пациентов. Am J Noninvas Кардиология 1987;1:152-4.

- Casale PN, Devereux RB, Kligfield P, et al. Электрокардиографическое выявление гипертрофии левого желудочка. Разработка и перспективная валидация улучшенных критериев. J Am Coll Cardiol 1985; 6: 572-80. [Перекрестная ссылка] [PubMed]
- Verdecchia P, Schillaci G, Borgioni C, et al. Неблагоприятное прогностическое значение концентрического ремоделирования левого желудочка у больных гипертонической болезнью с нормальной массой левого желудочка. J Am Coll Кардиол 1995;25:871-8. [Перекрестная ссылка] [PubMed]
- Lavie CJ, Milani RV, Ventura HO и др. Геометрия левого желудочка и смертность у пациентов старше 70 лет с нормальной фракцией выброса. Am J Cardiol 2006; 98: 1396-9. [Перекрестная ссылка] [PubMed]
- Devereux RB, Wachtell K, Gerdis E, et al. Прогностическое значение изменения массы левого желудочка при лечении артериальной гипертензии. ДЖАМА 2004; 292:2350-6. [Перекрестная ссылка] [PubMed]
- Окин П.
 М., Деверо Р.Б., Джерн С. и др. Регресс электрокардиографической гипертрофии левого желудочка на фоне антигипертензивного лечения и прогноз основных сердечно-сосудистых событий. ЯМА 2004; 292:2343-9. [Перекрестная ссылка] [PubMed]
М., Деверо Р.Б., Джерн С. и др. Регресс электрокардиографической гипертрофии левого желудочка на фоне антигипертензивного лечения и прогноз основных сердечно-сосудистых событий. ЯМА 2004; 292:2343-9. [Перекрестная ссылка] [PubMed] - Окин П.М., Деверо Р.Б., Харрис К.Е. и др. Регресс электрокардиографической гипертрофии левого желудочка связан с меньшим количеством госпитализаций по поводу сердечной недостаточности у пациентов с артериальной гипертензией. Энн Интерн Мед 2007;147:311-9. [Перекрестная ссылка] [PubMed]
- Lønnebakken MT, Izzo R, Mancusi C, et al. Регресс гипертрофии левого желудочка во время антигипертензивного лечения в амбулаторной клинике (Campania Salute Network. J Am Heart Assoc 2017; 6:e004152. [Crossref] [PubMed]
- Pierdomenico SD, Cuccurullo F. Снижение риска после регресса эхокардиографической гипертрофии левого желудочка при гипертонии: метаанализ. Am J Hypertens 2010; 23:876-81. [Перекрестная ссылка] [PubMed]
- Liebson PR, Grandits GA, Dianzumba S, et al.
 Сравнение пяти антигипертензивных монотерапий и плацебо по изменению массы левого желудочка у пациентов, получающих питательно-гигиеническую терапию в исследовании лечения легкой гипертензии (TOMHS). Тираж 1995;91:698-706. [Перекрестная ссылка] [PubMed]
Сравнение пяти антигипертензивных монотерапий и плацебо по изменению массы левого желудочка у пациентов, получающих питательно-гигиеническую терапию в исследовании лечения легкой гипертензии (TOMHS). Тираж 1995;91:698-706. [Перекрестная ссылка] [PubMed] - Dahlöf B, Pennert K, Hansson L. Реверсия гипертрофии левого желудочка у пациентов с гипертонией. Метаанализ 109 исследований лечения. Am J Hypertens 1992; 5:95-110. [Перекрестная ссылка] [PubMed]
- Драйер ДЖИМ, Гардин Дж.М., Вебер М.А. и др. Сердечная мышечная масса при вазодилатационном лечении артериальной гипертензии. Clin Pharmacol Ther 1983;33:727-32. [Перекрестная ссылка] [PubMed]
- Julien J, Dufloux MA, Prasquier R, et al. Влияние каптоприла и миноксидила на гипертрофию левого желудочка у пациентов с резистентной гипертензией: 6-месячное двойное слепое сравнение. J Am Coll Кардиол 1990;16:137-42. [Crossref] [PubMed]
Цитируйте эту статью как: Aronow WS.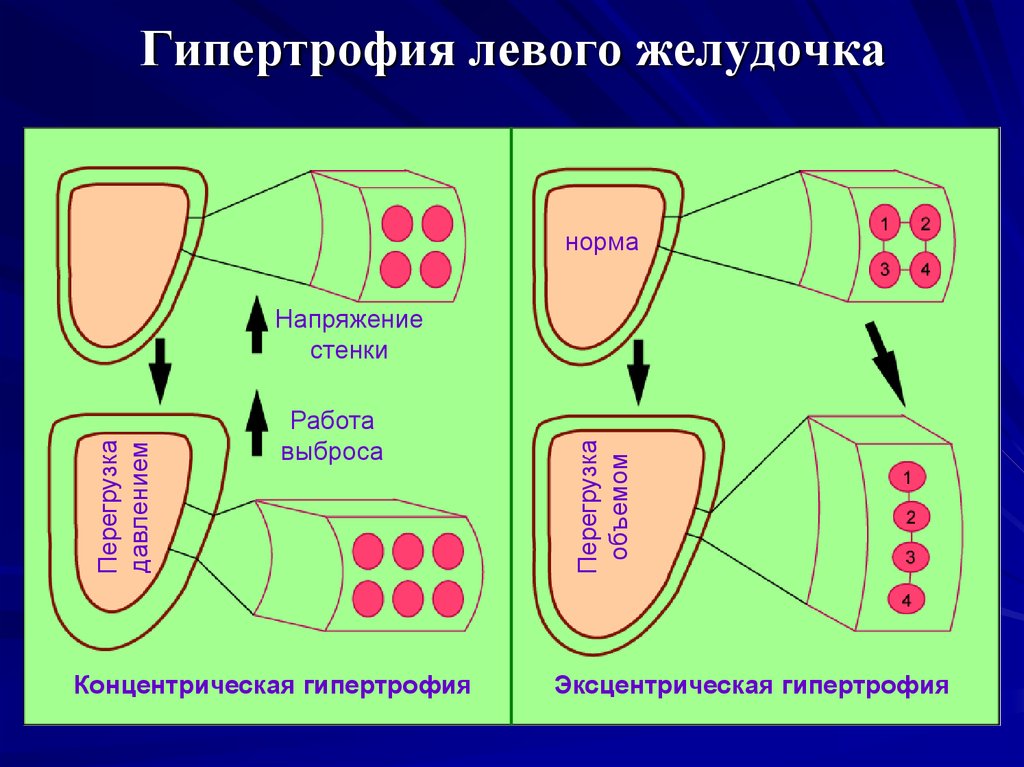 Артериальная гипертензия и гипертрофия левого желудочка. Энн Трансл Мед 2017;5(15):310. doi: 10.21037/атм.2017.06.14
Артериальная гипертензия и гипертрофия левого желудочка. Энн Трансл Мед 2017;5(15):310. doi: 10.21037/атм.2017.06.14
Концентрическое, эксцентрическое и концентрическое ремоделирование Cardioserv
02
Март
2017
Автор: Джудит Бакленд, RDCS, FASE, MBA и Андреа Филдс, MHA, RDCS
Понимание концентрической модели LVH и E0125
Прошлый месяц был объявлен Американским месяцем сердца, чтобы повысить осведомленность о сердечно-сосудистых заболеваниях, которые являются основной причиной смерти американцев. AHA призывает наших пациентов контролировать свои факторы риска сердечно-сосудистых заболеваний, в том числе знать свои цифры, связанные с артериальным давлением. Невылеченная гипертензия может оказывать долгосрочное воздействие на сердце, вызывая гипертоническую болезнь сердца, которая может включать ишемическую болезнь сердца (ИБС), гипертрофию левого желудочка (ГЛЖ) и гипертрофическую кардиомиопатию (ГКМП).
Эхокардиография играет важную роль в прогностической оценке артериальной гипертензии (АГ). Основным вкладом эхокардиографии в лечение гипертонии является оценка массы левого желудочка (МЛЖ). В этом блоге мы описываем гипертрофию левого желудочка (ГЛЖ) и определяем различные категории концентрического, эксцентрического и концентрического ремоделирования. Во второй части блога мы подробно остановимся на массе левого желудочка (LVM) и относительной толщине стенки (RWT). Мы предоставим пошаговые инструкции о том, как получить эти значения во время обычной эхокардиограммы.
Основным вкладом эхокардиографии в лечение гипертонии является оценка массы левого желудочка (МЛЖ). В этом блоге мы описываем гипертрофию левого желудочка (ГЛЖ) и определяем различные категории концентрического, эксцентрического и концентрического ремоделирования. Во второй части блога мы подробно остановимся на массе левого желудочка (LVM) и относительной толщине стенки (RWT). Мы предоставим пошаговые инструкции о том, как получить эти значения во время обычной эхокардиограммы.
Гипертрофия левого желудочка — это форма ремоделирования сердца, которая вызывает утолщение сердечной стенки, что приводит к увеличению массы ЛЖ (МЛЖ). Существуют различные подкатегории, подпадающие под диагноз ГЛЖ, которые включают концентрическое, эксцентрическое и концентрическое ремоделирование.
Существуют ключевые факторы, которые играют важную роль в определении наличия ГЛЖ:
Мы не можем охватить все из них в этой серии блогов, но важно знать, что 9Размер сердца 0009 зависит от размера тела .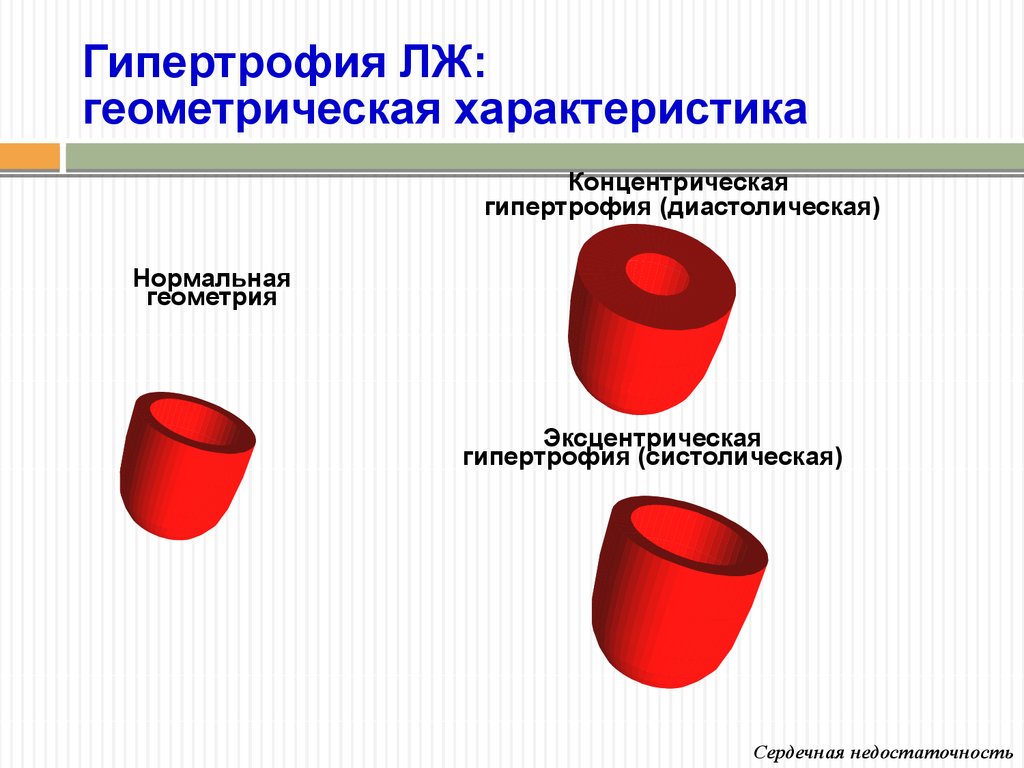 Помните:
Помните:
- У мужчин сердце больше, чем у женщин
- У спортсменов сердце больше, чем у неспортсменов
- У пациентов с ожирением сердце больше, чем у пациентов без ожирения
Кратко поговорим о том, что происходит при увеличении сердца.
Увеличенные сердца:
|
Концентрическая ГЛЖ
Концентрическая ГЛЖ является результатом адаптации сердца к перегрузке высоким системным давлением, вызванной гипертензией или другими заболеваниями, такими как аортальный стеноз. Периферическое сопротивление повышено. Концентрическая ГЛЖ поражает как мужчин, так и женщин, независимо от возраста. Это связано с изменениями геометрии ЛЖ, диастолической функции, продольной и радиальной функции миокарда и размеров предсердий.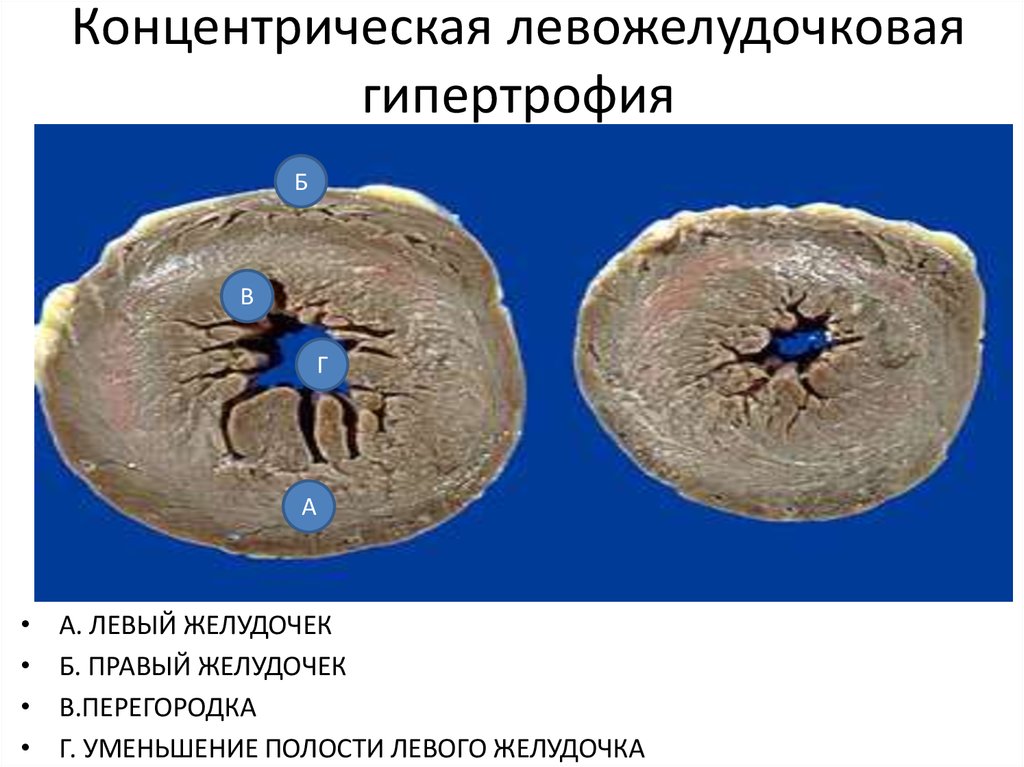
Отличительные эхокардиографические признаки концентрической ГЛЖ включают:
- Глобальное увеличение толщины стенки
- Нормальный размер полости ЛЖ
- Увеличение МЛЖ (масса левого желудочка)
- Увеличенный RWT (относительная толщина стенки)
Эксцентрическая ГЛЖ
С другой стороны, эксцентрическая гипертрофия имеет дело с перегрузкой объемом из-за значительной клапанной регургитации или высокого сердечного индекса. Системное давление будет нормальным, а периферическое сопротивление не повышено. У этой категории пациентов будут изменения как диастолической функции, так и продольной и лучевой функции. У них будет либо низкая нормальная, либо слегка нарушенная систолическая функция из-за хронической перегрузки объемом. Форма ЛЖ изменится, став более сферической, так как ЛЖ будет увеличен..
Отличительными эхокардиографическими признаками эксцентрической ГЛЖ являются:
- Нормальная толщина стенки ЛЖ
- Увеличенный размер полости ЛЖ
- Увеличение МЛЖ (масса левого желудочка)
- Уменьшенный RWT (относительная толщина стенки)
Концентрическое ремоделирование
Концентрическое ремоделирование представляет собой позднюю стадию реакции на гипертрофию ЛЖ; вызванный либо хроническим давлением, объемной перегрузкой, либо ИМ (который обычно связан с ИБС, но может быть связан с длительной гипертензией, особенно без лечения). Концентрическое ремоделирование будет демонстрировать систолическую дисфункцию наряду с изменениями геометрии ЛЖ. Форма ЛЖ меняется и становится более округлой, чем пулевидной. Вы заметите быстрое ухудшение диастолической дисфункции и потерю радиальной и продольной функции.
Концентрическое ремоделирование будет демонстрировать систолическую дисфункцию наряду с изменениями геометрии ЛЖ. Форма ЛЖ меняется и становится более округлой, чем пулевидной. Вы заметите быстрое ухудшение диастолической дисфункции и потерю радиальной и продольной функции.
Отличительные эхокардиографические признаки концентрического ремоделирования включают:
- Обычно увеличенная толщина стенки ЛЖ
- Нормальный или малый размер полости ЛЖ
- Нормальный МЛЖ (масса левого желудочка)
- Увеличенный RWT (относительная толщина стенки)
- Концентрический LVH = перегрузка по давлению (BP)
- Эксцентрическая ГЛЖ = перегрузка объемом (регургитация)
- Ремоделирование = ХРОНИЧЕСКАЯ перегрузка давлением и объемом или ИМ
Наша цель на этой неделе состояла в том, чтобы предоставить вам лучшее понимание патофизиологии различных категорий ГЛЖ. Эта таблица поможет вам лучше понять эхокардиографические данные, обнаруженные в подкатегориях гипертрофии левого желудочка (ГЛЖ). Мы обсудили, как масса левого желудочка (LVM) и относительная толщина стенки (RWT) играют роль в определении категорий LVH. Но что такое LVM и RWT?? Как мы их получаем? Во второй части нашей серии блогов о LVH мы предоставим пошаговые инструкции о том, как получить эти значения.
Мы обсудили, как масса левого желудочка (LVM) и относительная толщина стенки (RWT) играют роль в определении категорий LVH. Но что такое LVM и RWT?? Как мы их получаем? Во второй части нашей серии блогов о LVH мы предоставим пошаговые инструкции о том, как получить эти значения.
- Алам, С. (без даты). Эдинбургский кардиологический веб-сайт. Получено 1 марта 2017 г. с http://webservice1.mvm.ed.ac.uk/imaging/demo/cases/cardiac-amyloid-echo.html .
- Марвик, Т. Х., доктор философии, Гиллеберт, Т. С., доктор медицины, и Г. А., доктор медицины. (2015). Рекомендации по использованию эхокардиографии при артериальной гипертензии у взрослых. JASE, 28 (7), 1-12. Получено 1 марта 2017 г. с http://asecho.org/wordpress/wp-content/uploads/2015/07/2015_Hypertension.pdf .
- Ланг, Р. М., доктор медицины, Бадано, Л. П., доктор медицины, и Мор-Ави, В., доктор философии. (2015). Рекомендации по количественному определению сердечной камеры с помощью эхокардиографии у взрослых: обновленная информация Американского общества эхокардиографии и Европейской ассоциации визуализации сердечно-сосудистых заболеваний.



 Для расчета подвижности можно использовать как показатель экскурсии (ЭМЖП), так и параметр фракции утолщения (ФУМЖП). ЭМЖП в такой ситуации — ниже 0,5 см, ФУМЖП — ниже 50%. Напротив, подвижность задней стенки ЛЖ при ГКМП относительно сохранена.
Для расчета подвижности можно использовать как показатель экскурсии (ЭМЖП), так и параметр фракции утолщения (ФУМЖП). ЭМЖП в такой ситуации — ниже 0,5 см, ФУМЖП — ниже 50%. Напротив, подвижность задней стенки ЛЖ при ГКМП относительно сохранена.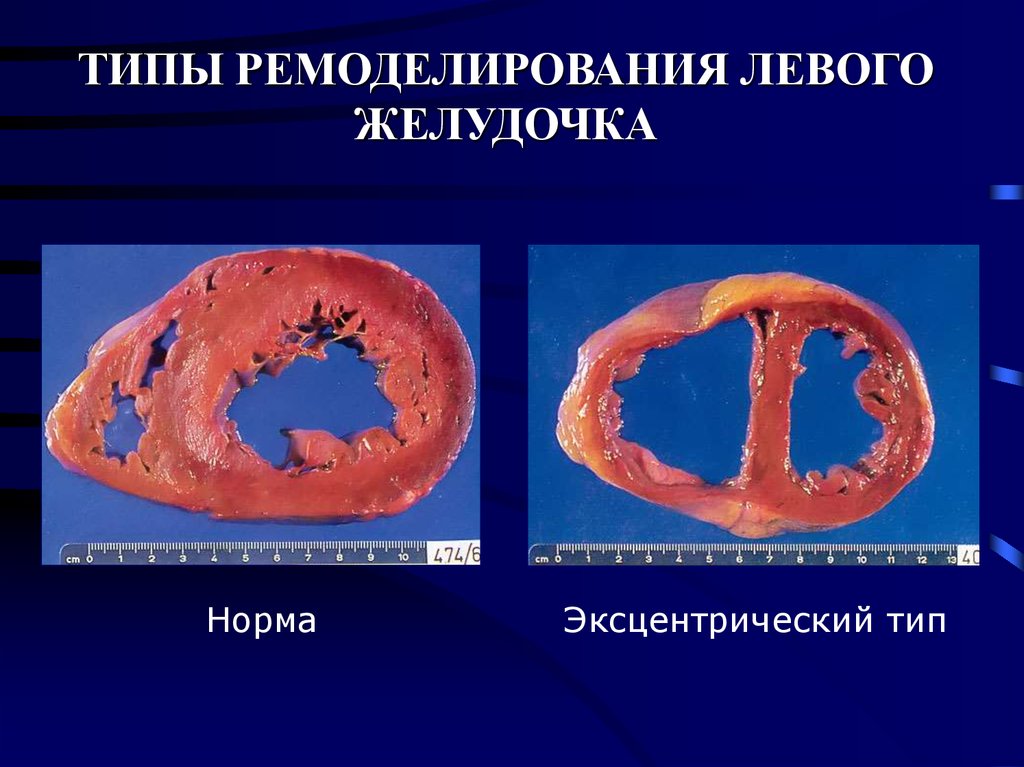 Клинически при наличии выраженного градиента обструкции возможен систолический шум с эпицентром в V точке аускультации, зависящий от нагрузки и натуживания.
Клинически при наличии выраженного градиента обструкции возможен систолический шум с эпицентром в V точке аускультации, зависящий от нагрузки и натуживания.
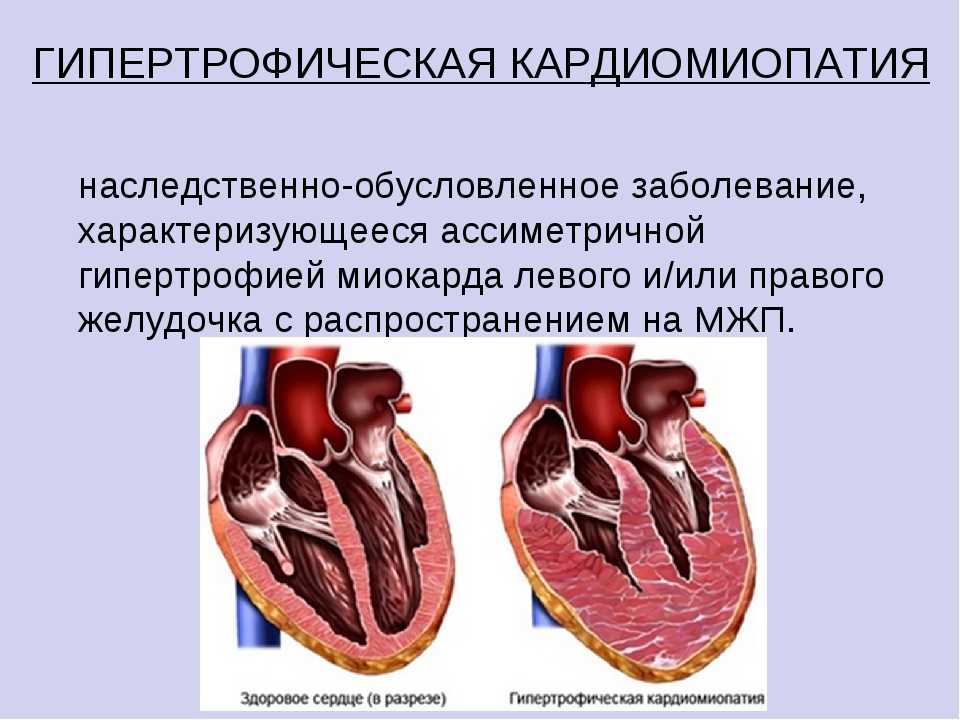 [Перекрестная ссылка] [PubMed]
[Перекрестная ссылка] [PubMed] , Гарнизон Р.Дж., Сэвидж Д.Д. и др. Прогностические последствия эхокардиографически определенной массы левого желудочка в исследовании сердца Framingham. N Engl J Med 1990;322:1561-6. [Перекрестная ссылка] [PubMed]
, Гарнизон Р.Дж., Сэвидж Д.Д. и др. Прогностические последствия эхокардиографически определенной массы левого желудочка в исследовании сердца Framingham. N Engl J Med 1990;322:1561-6. [Перекрестная ссылка] [PubMed] Am J Hypertens 2012; 25: 678-83. [Перекрестная ссылка] [PubMed]
Am J Hypertens 2012; 25: 678-83. [Перекрестная ссылка] [PubMed]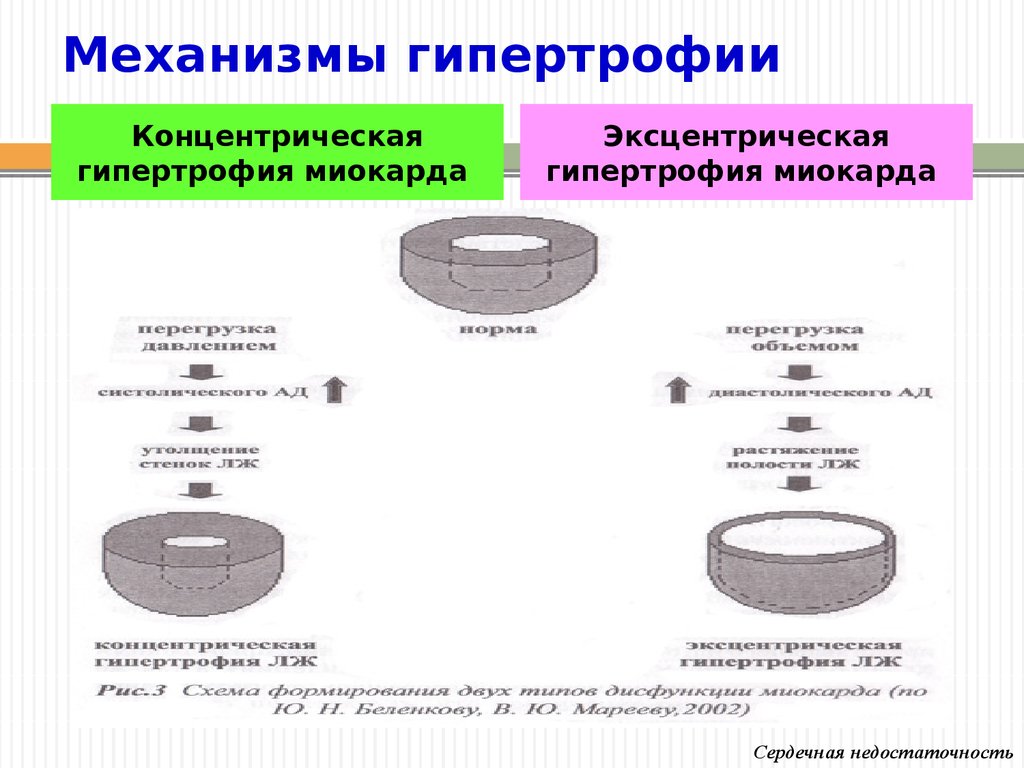
 М., Деверо Р.Б., Джерн С. и др. Регресс электрокардиографической гипертрофии левого желудочка на фоне антигипертензивного лечения и прогноз основных сердечно-сосудистых событий. ЯМА 2004; 292:2343-9. [Перекрестная ссылка] [PubMed]
М., Деверо Р.Б., Джерн С. и др. Регресс электрокардиографической гипертрофии левого желудочка на фоне антигипертензивного лечения и прогноз основных сердечно-сосудистых событий. ЯМА 2004; 292:2343-9. [Перекрестная ссылка] [PubMed]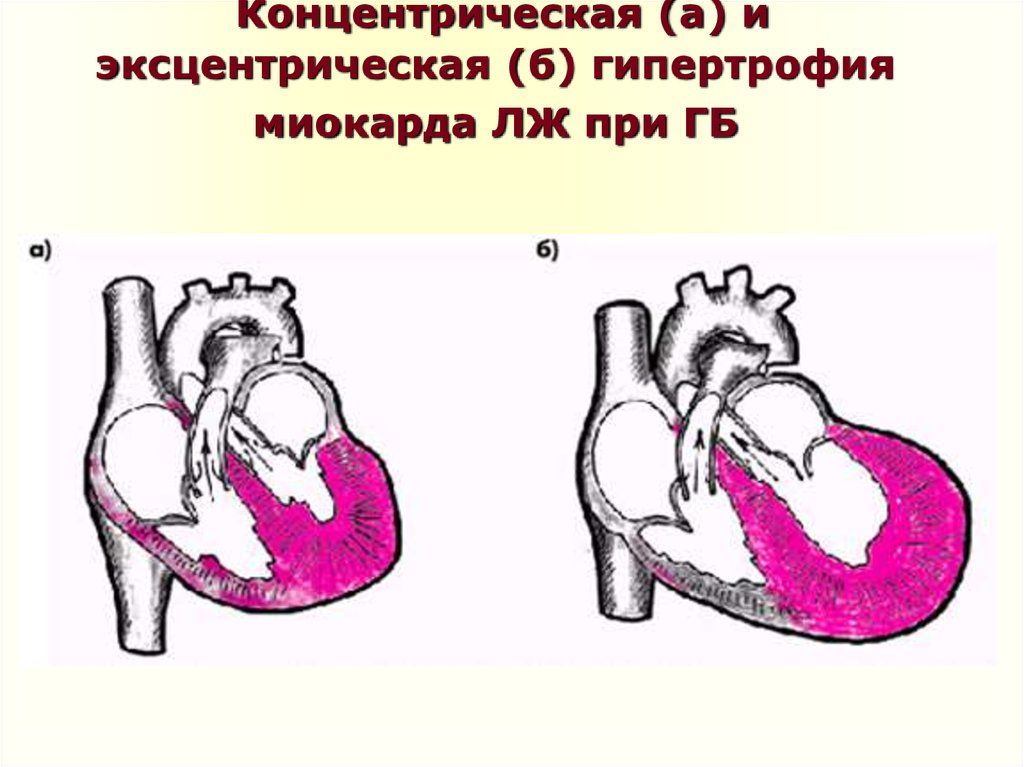 Сравнение пяти антигипертензивных монотерапий и плацебо по изменению массы левого желудочка у пациентов, получающих питательно-гигиеническую терапию в исследовании лечения легкой гипертензии (TOMHS). Тираж 1995;91:698-706. [Перекрестная ссылка] [PubMed]
Сравнение пяти антигипертензивных монотерапий и плацебо по изменению массы левого желудочка у пациентов, получающих питательно-гигиеническую терапию в исследовании лечения легкой гипертензии (TOMHS). Тираж 1995;91:698-706. [Перекрестная ссылка] [PubMed]