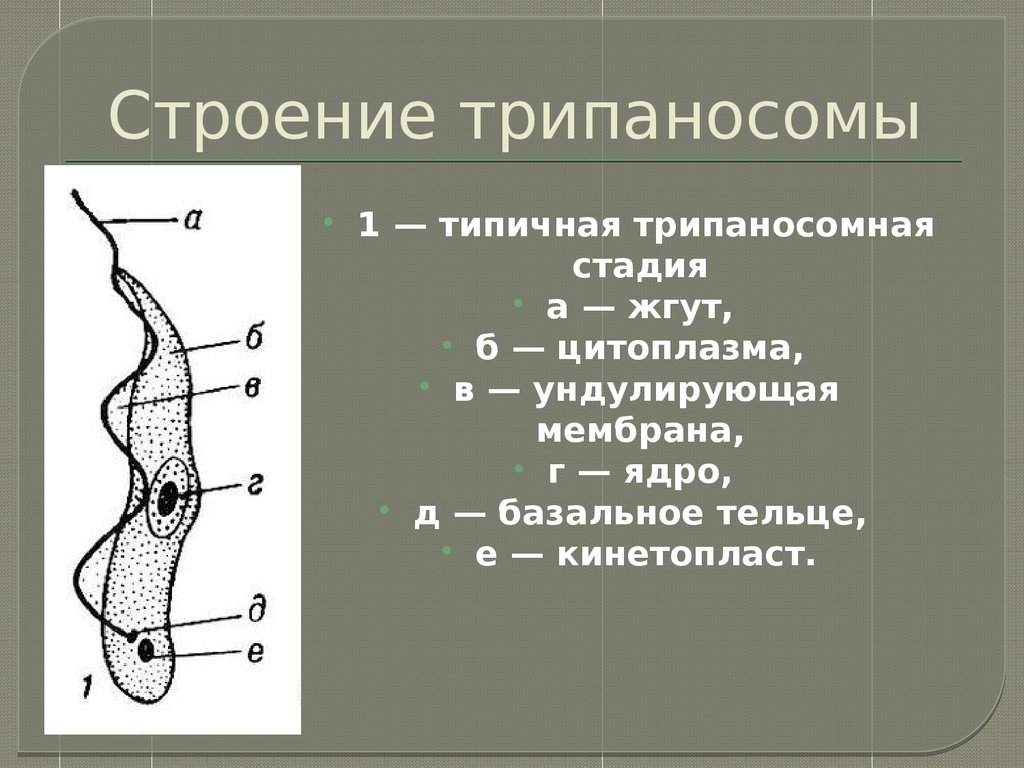
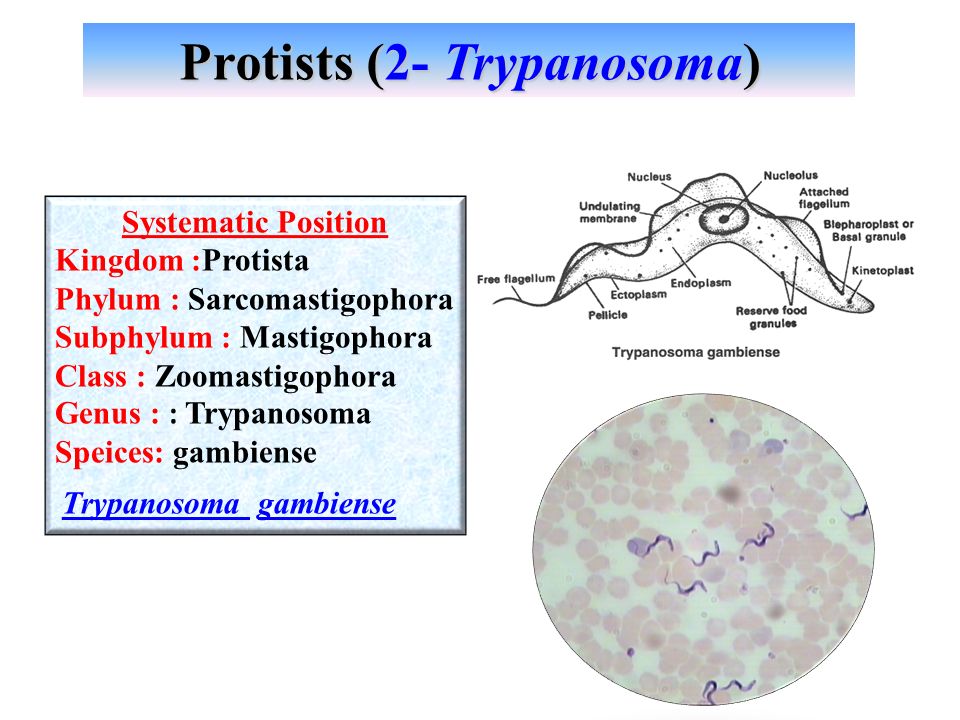
Трипаносомы (Trypanosoma)
ТРИПАНОСОМЫ
Возбудителями африканской сонной болезни (африканский трипаносомоз) являются Trypanosoma brucei gambiense (западная Африка) и Trypanosoma brucei rhodеsiense (восточная Африка). В Южной Америке распространен американский трипаносомоз (болезнь Шагаса), вызываемый Trypanosoma cruzi. Трипаносомозы – это трансмиссивные заболевания с природной очаговостью.
Вцикле развития трипаносом существует следующие стадии:
-трипомастигота имеет удлиненную форму, длинный жгутик, ундулирующую мембрану, подвижна; паразитирует в организме позвоночных хозяев (человек и животные) и является для них инвазионной стадией;
-эпимастигота похожа на трипомастиготу, но ее жгутик более короткий и ундулирующая мембрана выражена слабо; существует только в организме переносчика и способна превращаться в трипомастиготу;
-амастигота неподвижна, так как отсутствует и жгутик и ундулирующая мембрана, паразитирует в организме позвоночных хозяев, внутриклеточный паразит; способна превращаться в трипомастиготу.
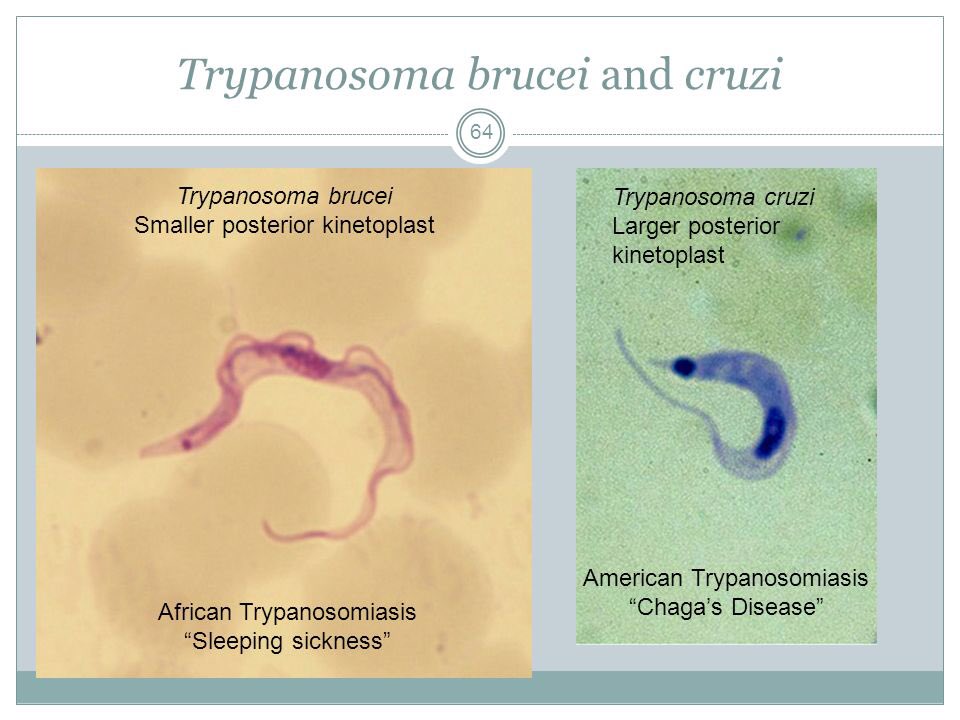
Морфологические особенности возбудителей африканского трипаносомоза (рис.5).
Рис. 5. Морфология возбудителей трипаносомозов и их переносчиков.
А – схема, Б – T. cruzi (7х40), В – T. brucei (7х40), Г – Triatoma infestans, Д –
Glossina palpalis. 1 – эритроциты, 2 – жгутик, 3 – ядро, 4 – ундулирующая мембрана
Тело изогнутое, сплющенное в одной плоскости, сужено на обоих концах, имеет жгутик, который идет по краю ундулирующей мембраны. У основания жгутика имеется кинетопласт. Длина тела трипаносом 13-40 мкм, ширина – 1,5-2 мкм. Питаются осмотически. Размножаются продольным делением надвое.
Жизненный цикл: возбудители африканского трипаносомоза проходят 2 стадии развития: трипомастигота и эпимастигота (рис.6).
Первая часть жизненного цикла трипаносом проходит в пищеварительном тракте специфического переносчика – мухи це-це (р. Glossina). При сосании мухой крови больного человека трипомастиготы попадают в ее желудок.
Здесь они превращаются в эпимастиготы, размножаются и затем накапливаются в слюнных железах (продолжительность развития 20 дней). При укусах мухами здоровых людей (трансмиссивный путь) происходит заражение. Заражение человека также возможно при переливании крови (трансфузионно) и при использовании нестерильных шприцов. Возможен и трансплацентарный путь передачи трипаносом.
При укусах мухами здоровых людей (трансмиссивный путь) происходит заражение. Заражение человека также возможно при переливании крови (трансфузионно) и при использовании нестерильных шприцов. Возможен и трансплацентарный путь передачи трипаносом.
Рис. 6. Жизненный цикл возбудителей африканского трипаносомоза
Вторая часть жизненного цикла паразитов проходит в организме человека и резервуарных хозяев (для гамбийской трипаносомы – свиньи, а для родезийской – антилопы и рогатый скот). Первые 9-10 дней трипомастиготы обитают в подкожной клетчатке, затем постепенно накапливаются в лимфатической системе, размножаются и через 20-25 дней поступают в кровь и разносятся во все ткани и органы. Преимущественная локализация трипаносом – спинномозговая жидкость, откуда они попадают в головной и спинной мозг.
Патогенное действие:
Механическое (разрушение клеток и тканей пораженных органов). Токсико-аллергическое (отравление организма продуктами
жизнедеятельности).
Инкубационный период продолжается от 1-3-х недель до 2-х и более
лет.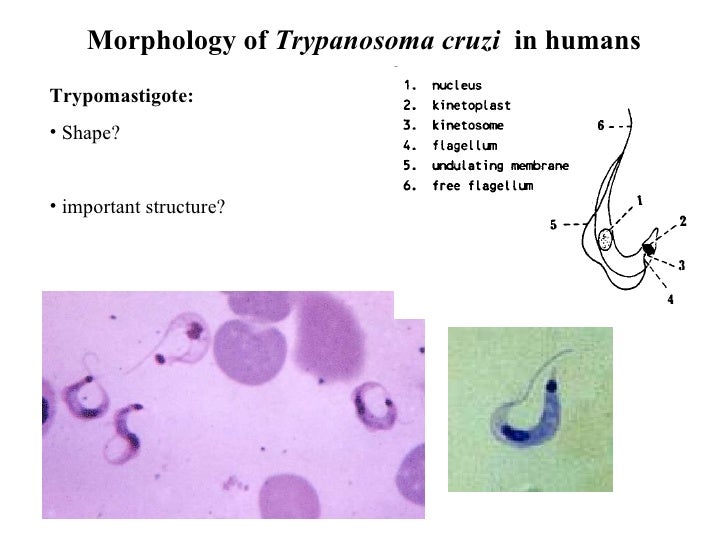
Характерные симптомы: трипаносомозный шанкр в месте укуса мухи (очаг воспаления около 10 см в диаметре), увеличение лимфатических узлов на задней поверхности шеи, повышение температуры, слабость, истощение. Позже появляются симптомы поражения ЦНС: сонливость, прогрессирующее слабоумие, сопорозное (заторможенное), а затем коматозное состояние (потеря сознания).
При гамбийском варианте характерен прогрессирующий энцефалит, характеризующийся сонливостью («сонная болезнь»). Заболевание при гамбийском варианте длиться 6-10 лет, а при родезийском – несколько месяцев. При отсутствии лечения наблюдается летальный исход.
Лабораторная диагностика: обнаружение трипаносом в мазках периферической крови, пунктатах лимфатических узлов, спинномозговой жидкости.
Используются иммунологические реакции (определение антител в сыворотке крови больных).
Профилактика: защита от укусов мухой це-це, прием лекарственных препаратов, предохраняющих от заражения при укусе мухой це-це (химиопрофилактика).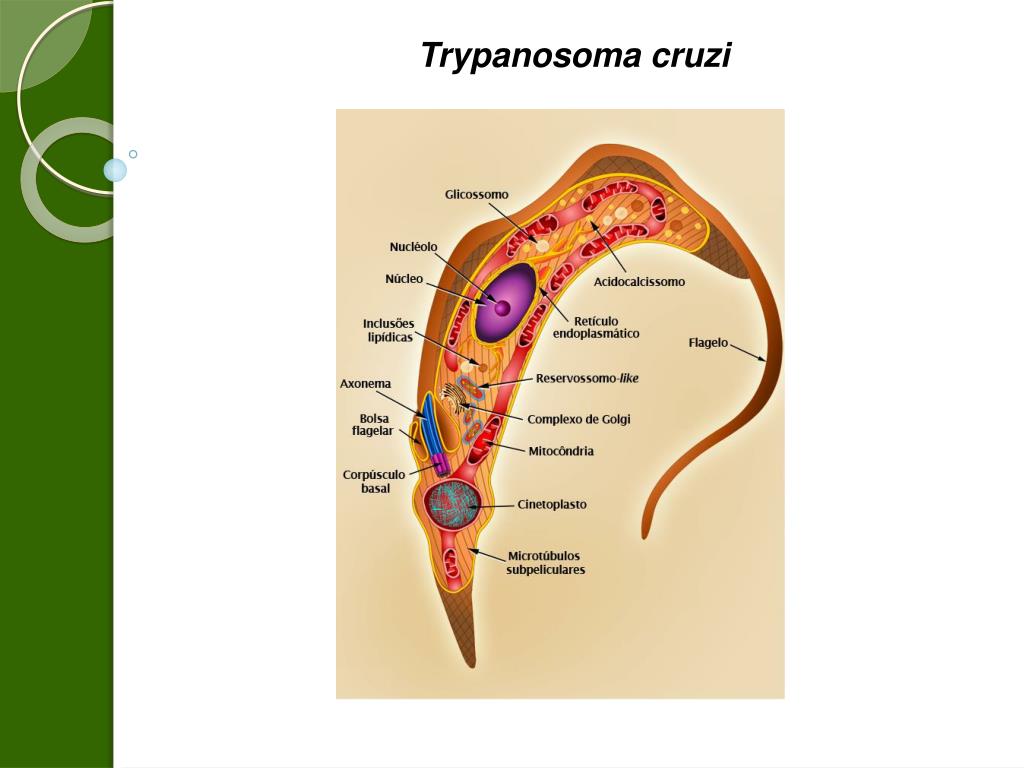 Общественная профилактика: уничтожение мух це-це, выявление и лечение больных и паразитоносителей, санитарно-
Общественная профилактика: уничтожение мух це-це, выявление и лечение больных и паразитоносителей, санитарно-
просветительная работа.
Морфологические особенности возбудителя американского трипаносомоза: паразит не отличается от возбудителей африканского трипаносомоза.
Жизненный цикл: возбудитель болезни Шагаса паразитирует у человека и многих млекопитающих (броненосцев, опоссумов, муравьедов, морских свинок, собак, кошек и др.), которые являются природными резервуарами возбудителя (рис.7). Специфические переносчики — поцелуйные клопы р. Triatoma.
Рис. 7. Цикл развития возбудителя американского трипаносомоза
T. cruzi проходит стадии развития: трипомастигота, эпимастигота и амастигота. При сосании крови больного человека или животных, трипомастиготы попадают в кишечник клопов, трансформируются в эпимастиготы, размножаются, превращаются в трипомастиготы и через некоторое время выделяются с его экскрементами. Заражение человека (трансмиссивный путь) происходит при попадании экскрементов с возбудителями на поврежденную кожу (ранки от укусов, расчесы). Заражение
Заражение
также возможно при переливании крови, трансплацентарно и через молоко больной матери. В организме человека трипомастиготы проникают в клетки кожи или слизистых оболочек, превращаются в амастиготы и размножаются.
Через 1-2 недели внутри пораженных клеток амастиготы превращаются в трипомастиготы и выходят в кровяное русло, циркулируют по организму, инвазируют клетки различных органов (сердечной и скелетной мускулатуры, нервной системы и др.), где цикл повторяется.
Патогенное действие:
Механическое (разрушение клеток и тканей пораженных органов, отек тканей).
Токсико-аллергическое (отравление организма продуктами жизнедеятельности).
Инкубационный период продолжается 7-14 дней.
Характерные симптомы: на месте проникновения трипаносом в кожу появляются гиперемия и отек (шагома, диаметром 10-15 см). Через 1-2 недели (выход паразитов в кровь) появляются лихорадка, головная боль, отек лица, боли в области сердца, признаки сердечной недостаточности.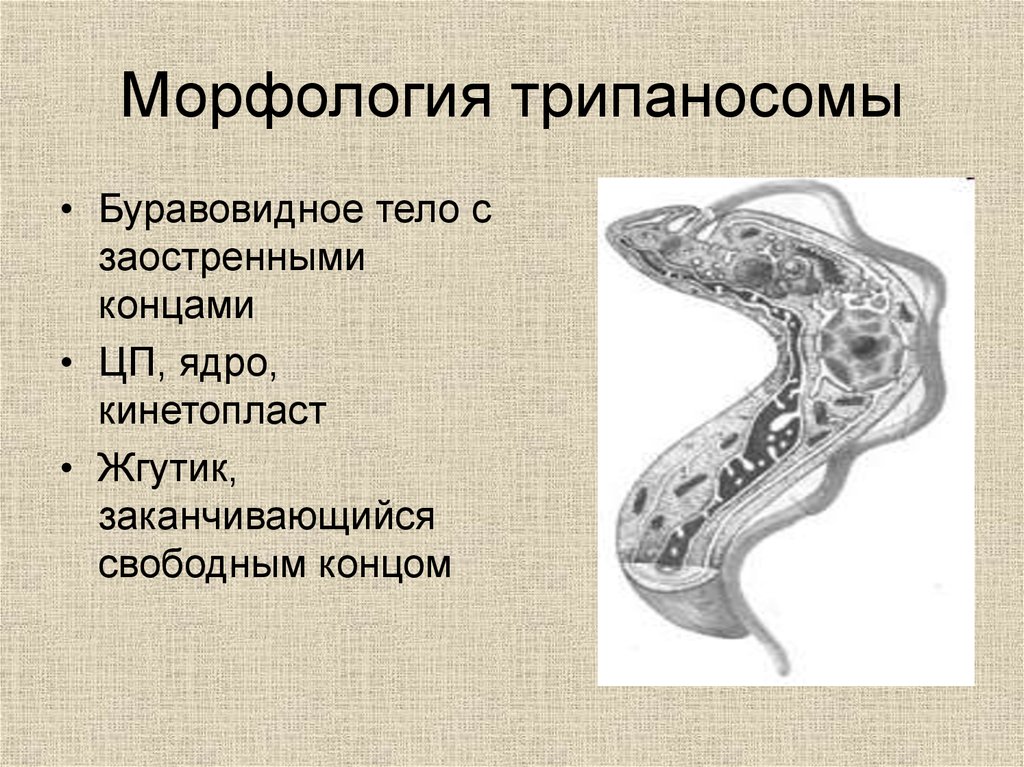
Наиболее тяжело заболевание протекает у детей, смертность достигает
14%.
Осложнения: менингоэнцефалит, поражения вегетативной нервной системы, сердца, печени, селезенки, кишечника, почек, надпочечников.
Лабораторная диагностика: обнаружение трипаносом в мазках крови, спинномозговой жидкости, пунктатах лимфатических узлов, селезенки, костного мозга.
Используются иммунологические реакции (определение антител в сыворотке крови больных).
Профилактика: выявление и лечение больных, уничтожение и защита от укусов поцелуйных клопов (отпугивающие средства и др.), санитарно-просветительная работа.
Паразитические простейшие
Автор статьи Азбукина Н.В.
- Excavata
Мы начнем знакомство с паразитическими простейшими с жгутиконосцев.
Одним из самых известных представителей является трипаносома (Trypanosoma). Этот организм обладает особой органеллой – кинетопластом, являющимся видоизмененной огромной митохондрией. Кинетопласт содержит митохондриальный геном, представляющий собой множество копий ДНК, организованной в макси- и миникольца. В миникольцах закодирована РНК, редактирующая генетическую информацию максиколец. Кроме того, в зрелой форме трипаносомы имеют ундулирующуя мембрану – пластинку, натягивающуюся между жгутиком и клеточной мембраной паразита, служащую для движения. По мере развития жгутик и кинетопласт смещаются с заднего конца тела на передний. Еще одной особенностью трипаносом является их способность к антигенной вариабельности. Другими словами, паразиты время от времени меняют состав гликопротеинового слоя на мембране, и из-за этого иммунная система тратит больше времени на их распознавание. Размножаются они, как и все жгутиконосцы, продольным делением надвое. Самими известными представителями этого отряда являются
В миникольцах закодирована РНК, редактирующая генетическую информацию максиколец. Кроме того, в зрелой форме трипаносомы имеют ундулирующуя мембрану – пластинку, натягивающуюся между жгутиком и клеточной мембраной паразита, служащую для движения. По мере развития жгутик и кинетопласт смещаются с заднего конца тела на передний. Еще одной особенностью трипаносом является их способность к антигенной вариабельности. Другими словами, паразиты время от времени меняют состав гликопротеинового слоя на мембране, и из-за этого иммунная система тратит больше времени на их распознавание. Размножаются они, как и все жгутиконосцы, продольным делением надвое. Самими известными представителями этого отряда являются 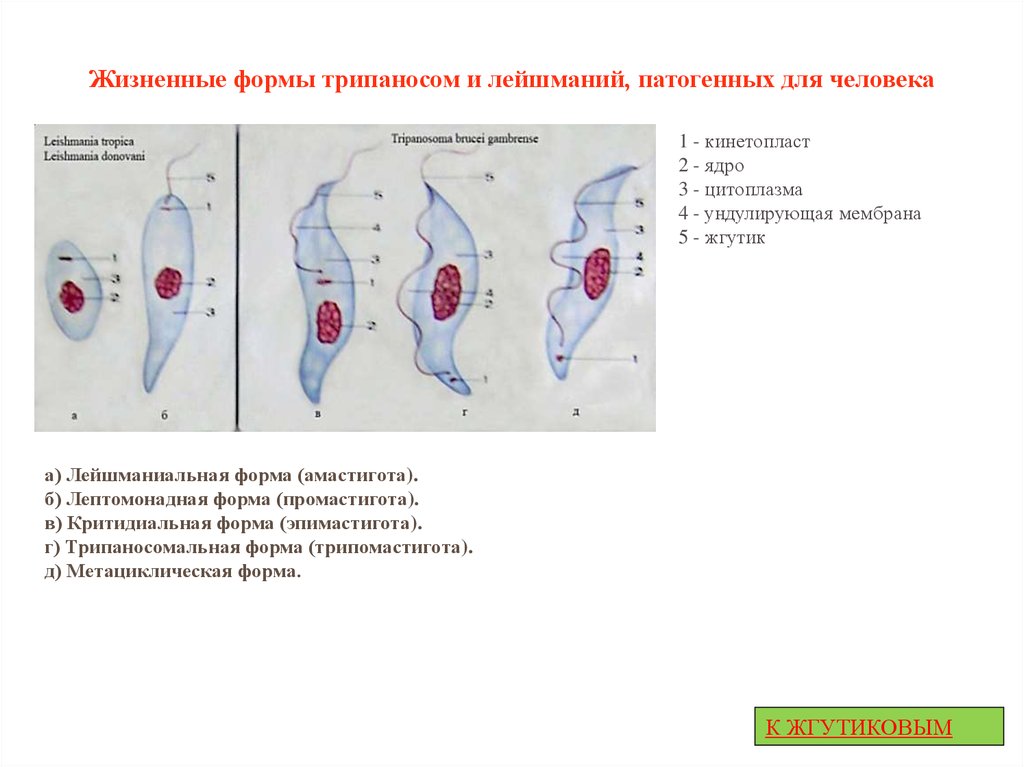 Природным резервуаров этих паразитов служат антилопы, а переносчиком – муха цеце. Вначале человек чувствует головную боль и боль в суставах, а через несколько недель появляется спутанность в сознании, онемение.
Природным резервуаров этих паразитов служат антилопы, а переносчиком – муха цеце. Вначале человек чувствует головную боль и боль в суставах, а через несколько недель появляется спутанность в сознании, онемение.
Trypanosoma среди клеток крови
Другой представитель жгутиконосцев Лямблия (Giardia) паразитирует в верхнем отделе тонкого кишечника человека – на ворсинках двенадцатиперстной кишки. Они имеют тело грушевидной формы, 8 жгутиков, 2 ядра, присоску на брюшной стороне. Питаются полупереваренным содержимым кишечника путем пиноцитоза. Так как они обитают в микроаэрофильной среде просвета кишечника, то являются анаэробами и утратили митохондрии и аппарат Гольджи. Делятся продольным делением надвое, для распространения имеют расселительную стадию цист.
Жизненный цикл лямблий
Лейшмании (Leishmania) являются внутриклеточными паразитами и переносятся москитами. Основными хозяевами являются люди, собаки, лошади. Эти паразиты фагоцитируются сначала нейтрофилами, потом макрофагами и обитают в их фагосомах, поэтому невидимы для клеток иммунной системы.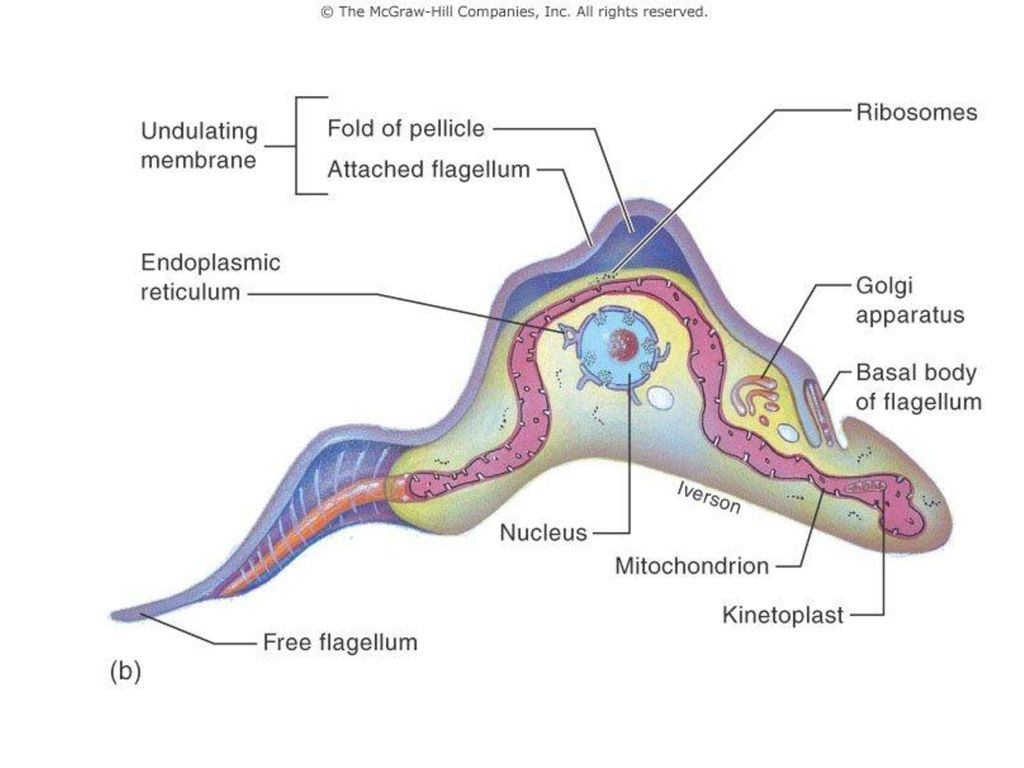 Вызывают лейшманиозы – кожные язвы.
Вызывают лейшманиозы – кожные язвы.
- Alveolata
Следующие представители простейших относятся к типу Apicomplexa, названному так из-за наличия у этих организмов апикального комплекса, состоящего из кольца, коноида, роптрий и микронем, обеспечивающие проникновение в клетки хозяина. Форма тела этих организмов постоянна за счет белковой пелликулы. Кроме того, эти организмы раньше были фотосинтезирующими, а сейчас у них остался апикопласт, содержащий кольцевую молекулу ДНК и сохранивший функцию синтеза жирных кислот. Сейчас этот метаболический путь является перспективной мишенью для разработки препаратов от малярии. Жизненный цикл этих представителей имеет общую структуру и называется лейкартовской триадой. Начинается она с попадания в организм спороцист, из которых выходят спорозоиты. Активно питающийся спорозоит называется трофозоитом. После увеличения в размерах трофозоит попадает внутрь клеток кишечного эпителия (с помощью апикального аппарата они заставляют себя фагоцитировать) и становится мерозоитом.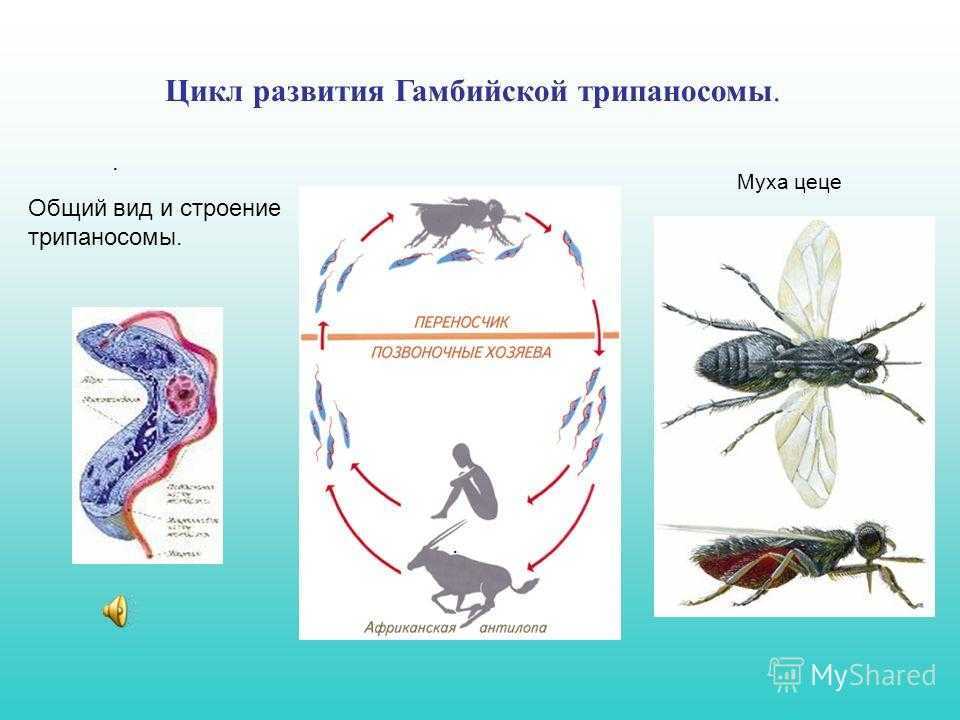
Тип Apicomplexa делится на два класса: Conoidasida и Aconoidasida. Приставка A- в латинских корнях обозначает отрицание, то есть у одних представителей есть коноид, а у других нет. К Коноидным относят подкласс Грегарин, паразитов насекомых. Как правило, это внеклеточные паразиты размер которых может достигать 16 мм, обитающие в кишечнике.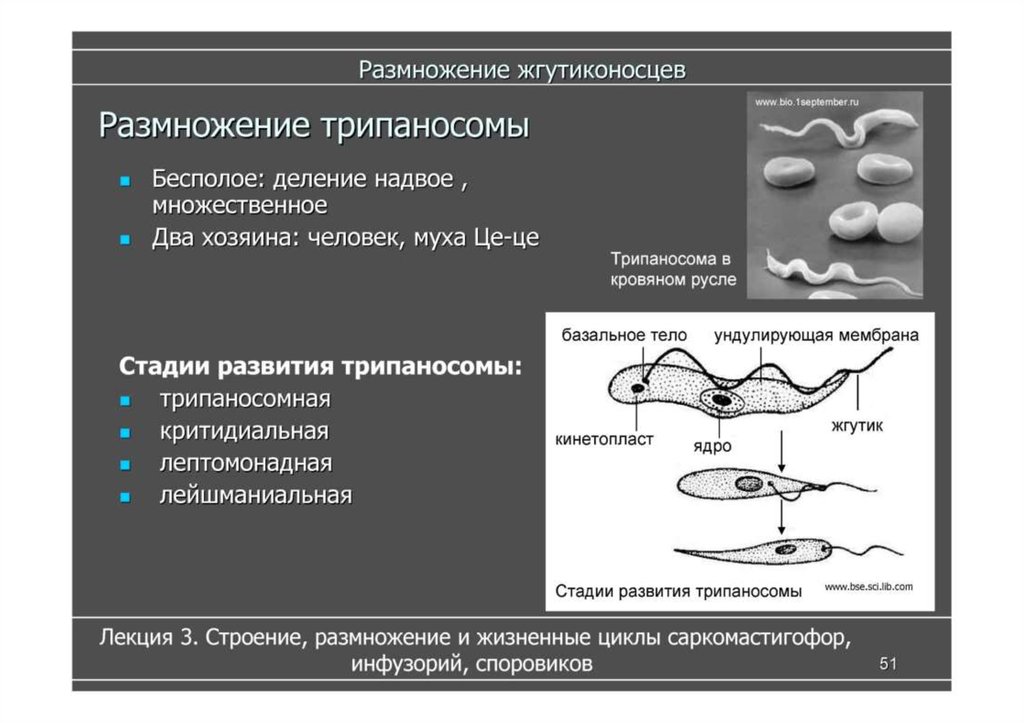
Кроме Грегарин к Коноидным относится подкласс Кокцидий, включающих в себя паразитов позвоночных, например кроликов Eimeria magna. Все стадии развития этого организма проходят в кролике. Цисты очень «живучи», их можно убить только крутым кипятком или выжиганием, на пастбищах сохраняются годами. Поэтому этот паразит приносит колоссальный ущерб сельскому хозяйству.
Еще одним распространенными представителеми этого подкласса являются организмы рода Toxoplasma. Основным хозяином (то есть в котором происходит половое размножение) является кошка, а промежуточным – мыши, свиньи, люди.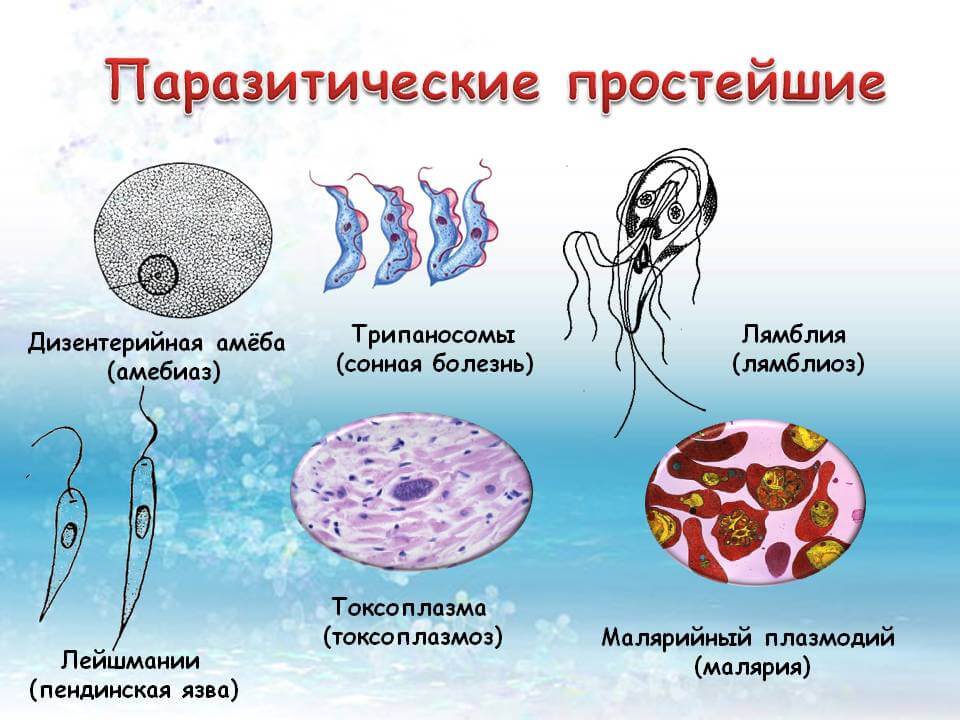 Особо опасно заражение женщин во время беременности, так как происходит также и заражение плода.
Особо опасно заражение женщин во время беременности, так как происходит также и заражение плода.
Доказано, что мыши, зараженные токсоплазмой, перестают бояться кошек, их даже превлекает запах кошачьей мочи. Также имеются исследования о влиянии токсоплазмы на поведение людей, а также на развитие шизофрении. По предварительной оценке около 65% населения Земли является носителем токсоплазмы, многие из которых даже не подозревают об этом!
Жизненный цикл Toxoplasma
К второму классу Aconoidasida относятся преставители кровяных споровиков, к которым относится знакомый всем малярийный плазмодий. Промежуточным хозяином является человек, а окончательным- комар. У малярийного комара необычная зигота, имеющая псевдоподии и обладающая подвижностью.
Жизненный цикл соответствует лейкартовской триаде, стадии мерогонии сопряжены с приступами лихорадки. Если говорить подробнее, то когда плазмоий выхоит в кровоток, имунная система обнаруживает его, начинает бороться, поэтому повышается температура и проч.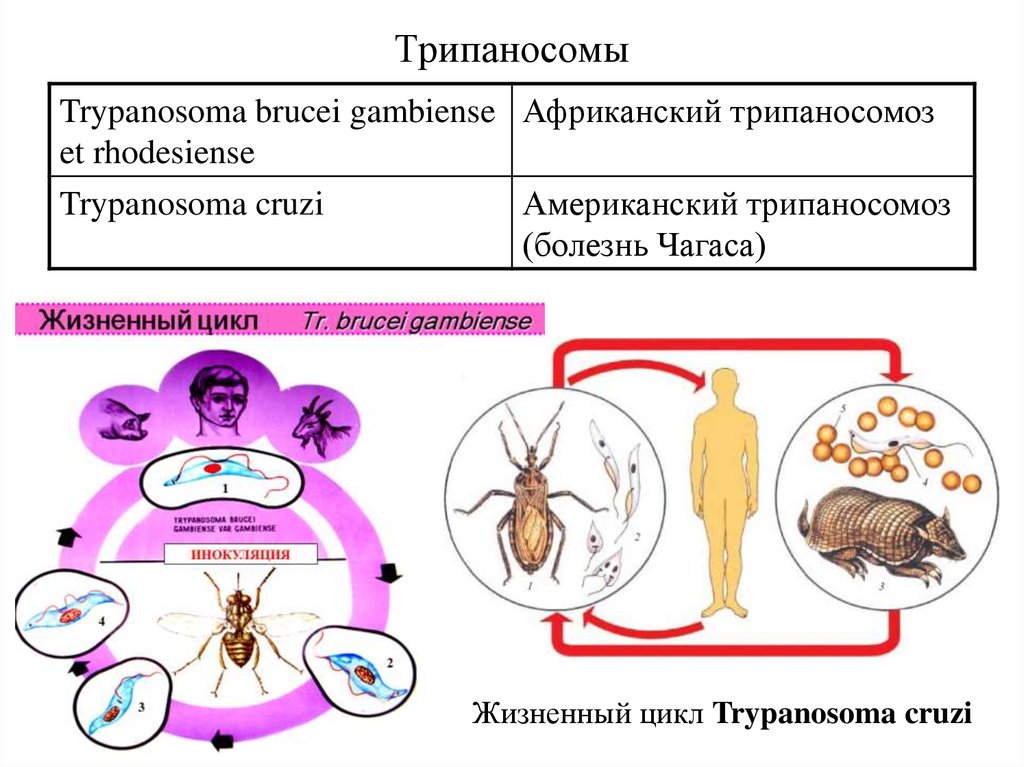 Потом мерозоиты снова возвращаются в эритроциты, там размножаются и через какое-то время снова синхронно выходят в кровоток. Для разных видов плазмодиев характерна разная продолжительность этого периода, поэтому различают трех- семидневные лихорадки.
Потом мерозоиты снова возвращаются в эритроциты, там размножаются и через какое-то время снова синхронно выходят в кровоток. Для разных видов плазмодиев характерна разная продолжительность этого периода, поэтому различают трех- семидневные лихорадки.
Малярия – очень опасное и по сей день распространенное заболевание, по оценке ВОЗ около 200 млн людей в год заражаются малярией, и 700 тысяч людей умирают от этого заболевания. Интересно, что за изучение малярии и лекарства от нее было присуждено 4 Нобелевские премии по физиологии и медицине.
Совсем недавно этих организмов определяли как один из классов споровиков (Apocomplexa), но сейчас выделили в отдельный тип, так как у них нет чередования мерогонии и спорогони, кроме того они имеют особые споры со створками, обеспечивающими плавучесть, и стрекательными капсулами, позволяющими им прикрепляться к стенке кишечника хозяина.
Хозяином этих организмов чаше всего выступают рыбы и амфибии, однако некоторые паразитируют и на насекомых. Взрослый организм диполоиен, представлен многоклеточным плазмодием, образует шишки на внутренних органах хозяина. У взрослого организма есть вегетативные ядра (там, где идет транскрипция белков, необходимых для жизнедеятельности) и генеративные, служащие для размножения. Генеративные ядра делятся несколько раз (причем один раз мейозом, то есть споры – гаплоидны), продуцируя двуядерные споры. Через заднюю кишку они попадают в воду, где заглатываются другими организмами. В новом хозяине оболочки спор разрываются, выходит двуядерная амеба, ядра которой впоследствии сливаются, образуя диплоидный набор хромосом. Эта амеба впоследствии даст начало новому плазмодию. Книдоспоридии наносят массовый ущерб рыбоводческим хозяйствам, вызывая массовую гибель рыб, особеннно молоди.
Взрослый организм диполоиен, представлен многоклеточным плазмодием, образует шишки на внутренних органах хозяина. У взрослого организма есть вегетативные ядра (там, где идет транскрипция белков, необходимых для жизнедеятельности) и генеративные, служащие для размножения. Генеративные ядра делятся несколько раз (причем один раз мейозом, то есть споры – гаплоидны), продуцируя двуядерные споры. Через заднюю кишку они попадают в воду, где заглатываются другими организмами. В новом хозяине оболочки спор разрываются, выходит двуядерная амеба, ядра которой впоследствии сливаются, образуя диплоидный набор хромосом. Эта амеба впоследствии даст начало новому плазмодию. Книдоспоридии наносят массовый ущерб рыбоводческим хозяйствам, вызывая массовую гибель рыб, особеннно молоди.
Тип Микроспоридии.
Это особые внутриклеточные паразиты, раньше относившиеся к споровикам, обладающие очень маленьким геномом (сопоставимым с бактериальным). Кроме того у них редуцированы многие органеллы (митохондрии, лизососмы, аппарат Гольджи).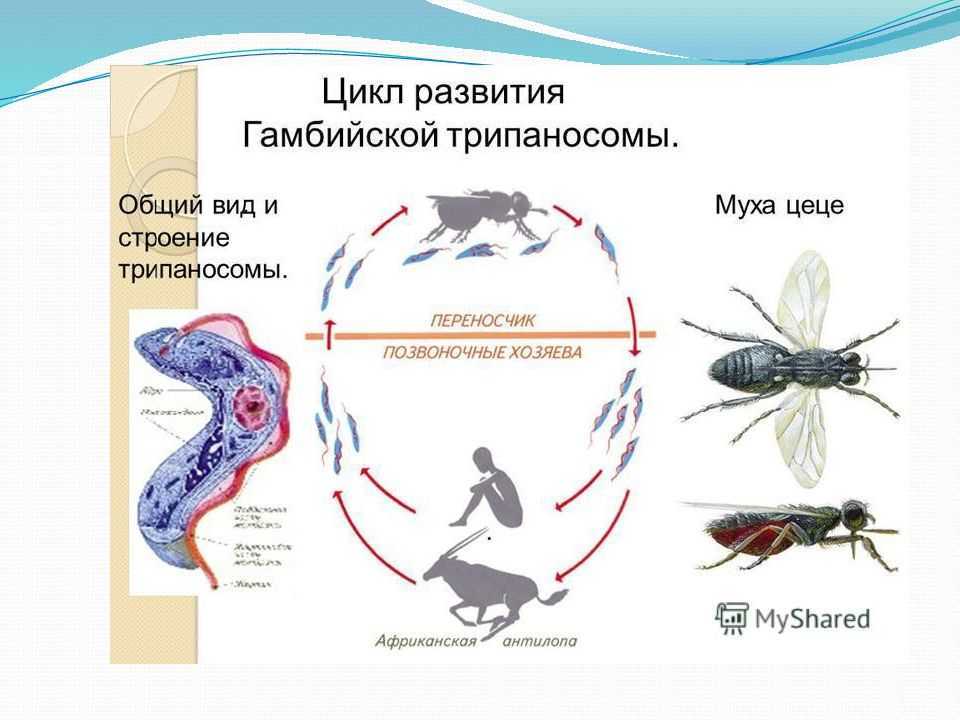
# Зоология беспозвоночных
Biology and Mechanism of Trypanosome Cell Motility
1. Balber, A.E. 1990. Пелликула и мембрана жгутика, зона жгутиковой адгезии и жгутиковый карман: функционально дискретные поверхностные домены формы кровотока африканских трипаносом. крит. Преподобный Иммунол. 10 : 177-201. [PubMed] [Google Scholar]
2. Bastin, P., K. Ellis, L. Kohl, and K.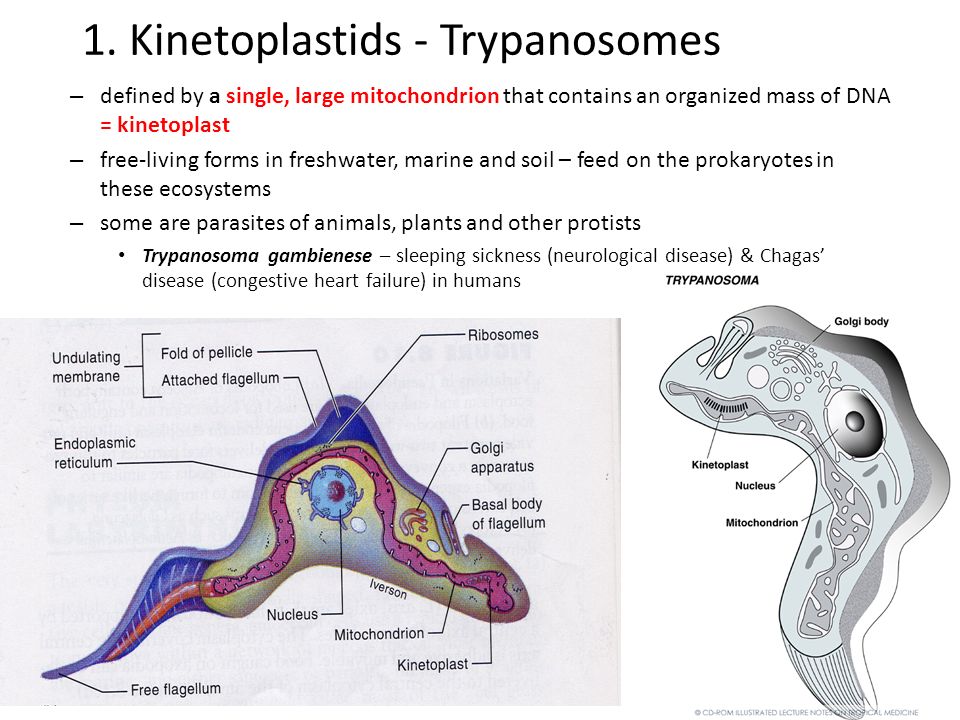 Gull. 2000. Онтогенез жгутика в трипаносомах изучен с помощью наследуемой и регулируемой системы РНК-интерференции. Дж. Клеточные науки. 113 : 3321-3328. [PubMed] [Google Scholar]
Gull. 2000. Онтогенез жгутика в трипаносомах изучен с помощью наследуемой и регулируемой системы РНК-интерференции. Дж. Клеточные науки. 113 : 3321-3328. [PubMed] [Google Scholar]
3. Bastin, P., K.R. Matthews, and K. Gull. 1996. Паражгутиковый стержень Kinetoplastida: решенные и нерешенные вопросы. Паразитол. Сегодня 12 : 302-307. [PubMed] [Google Scholar]
4. Бастин П., Т. Дж. Пуллен, Ф. Ф. Морейра-Лейт и К. Галл. 2000. Внутри и снаружи жгутика трипаносомы: многофункциональная органелла. микробы заражают. 2 : 1865-1874. [PubMed] [Академия Google]
5. Бастин П., Т. Дж. Пуллен, Т. Шервин и К. Галл. 1999. Динамика транспорта белков и сборки жгутика, выявленная при анализе парализованной мутантной трипаносомы snl-1 . Дж. Клеточные науки. 112 : 3769-3777. [PubMed] [Google Scholar]
6. Bastin, P., T.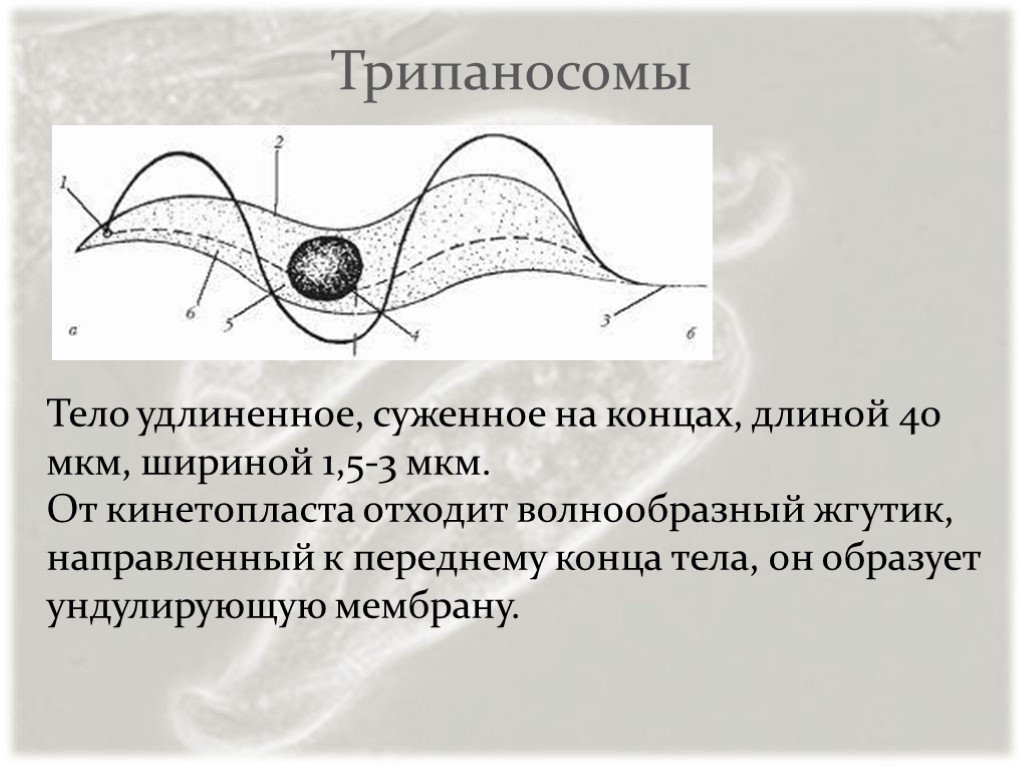 Sherwin, and K. Gull. 1998. Паражгутиковый стержень жизненно важен для подвижности трипаносом. Nature 391 : 548.. [PubMed] [Google Scholar]
Sherwin, and K. Gull. 1998. Паражгутиковый стержень жизненно важен для подвижности трипаносом. Nature 391 : 548.. [PubMed] [Google Scholar]
7. Bray, D. 2001. Движения клеток: от молекул к подвижности. Garland Publishing, Нью-Йорк, штат Нью-Йорк,
8. Brazelton, WJ, C.D. Amundsen, C.D. Silflow, and P.A. Lefebvre. 2001. Мутация bld1 идентифицирует гомолог Chlamydomonas osm-6 как ген, необходимый для сборки жгутиков. Курс. биол. 11 : 1591-1594. [PubMed] [Google Scholar]
9. Brokaw, C. 1966. Влияние повышенной вязкости на движение сперматозоидов некоторых беспозвоночных. Дж. Эксп. биол. 45 : 113-139. [PubMed] [Академия Google]
10. Кашон, Ж., М. Кашон, М.-П. Коссон и Дж. Коссон. 1988. Паражгутиковый стержень: структура в поисках функции. биол. Сотовый 63 : 169-181. [Google Scholar]
11. Clayton, CE 1999. Генетические манипуляции с кинетопластидами. Паразитол. Сегодня 15 : 372-378. [PubMed] [Google Scholar]
Clayton, CE 1999. Генетические манипуляции с кинетопластидами. Паразитол. Сегодня 15 : 372-378. [PubMed] [Google Scholar]
12. Коул, Д. Г., Д. Р. Динер, А. Л. Химельблау, П. Л. Бич, Дж. К. Фустер и Дж. Л. Розенбаум. 1998. Хламидомонада кинезин-II-зависимый внутрижгутиковый транспорт (IFT): частицы IFT содержат белки, необходимые для сборки ресничек в сенсорных нейронах Caenorhabditis elegans . Дж. Клеточная биология. 141 : 993-1008. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Купер Р., А. Р. де Хесус и Г. А. Кросс. 1993. Делеция иммунодоминантного поверхностного гликопротеина Trypanosoma cruzi нарушает адгезию клеток жгутика. Дж. Клеточная биология. 122 : 149-156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Cosson, J. 1996. Движущееся изображение жгутиков: новости и взгляды на механизмы, участвующие в биении аксонем.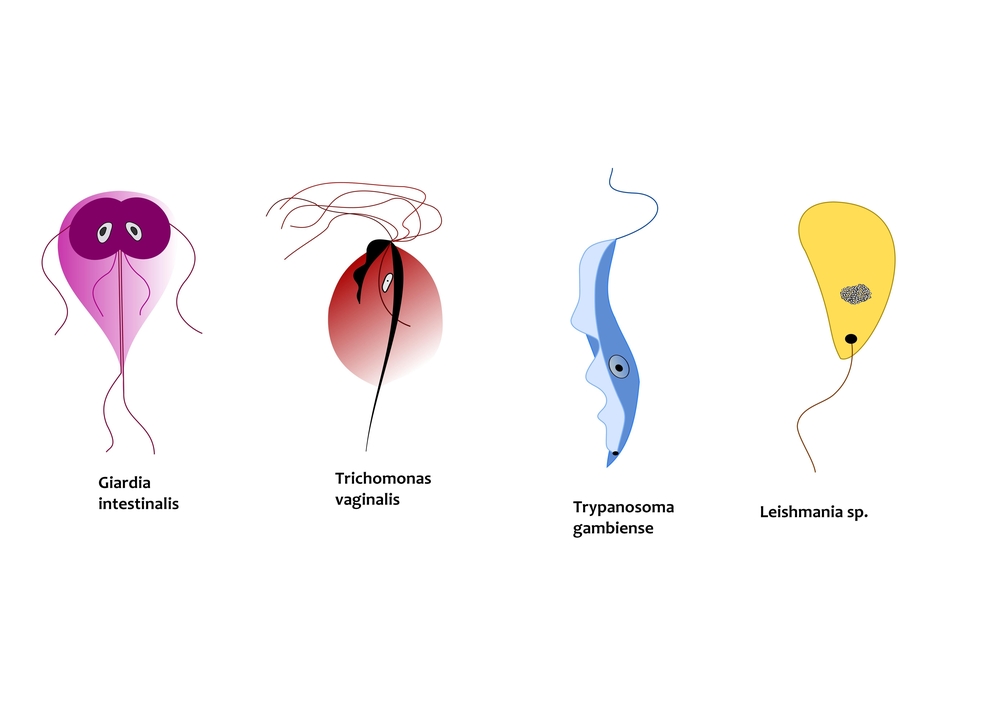 Клетка. биол. Междунар. 20 : 83-94. [PubMed] [Google Scholar]
Клетка. биол. Междунар. 20 : 83-94. [PubMed] [Google Scholar]
15. Коссон М.П., Дж. Коссон, Ф. Андре и Р. Биллард. 1995. Взаимосвязь цАМФ/АТФ в активации подвижности сперматозоидов форели: их взаимодействие в моделях без мембран и в живых сперматозоидах. Селл Мотил. Цитоскелет 31 : 159-176. [PubMed] [Академия Google]
16. Дин, Дж. А., Д. Г. Коул, Э. С. Сили, Д. Р. Динер и Дж. Л. Розенбаум. 2001. Локализация внутрижгутикового транспортного белка IFT52 идентифицирует переходные волокна базального тела как место стыковки частиц IFT. Курс. биол. 11 : 1586-1590. [PubMed] [Google Scholar]
17. Degrave, WM, S. Melville, A. Ivens, and M. Aslett. 2001. Инициативы по геному паразитов. Междунар. Дж. Паразитол. 31 : 532-536. [PubMed] [Академия Google]
18. де Хесус, А. Р., Р. Купер, М. Эспиноса, Х. Э. Гомес, Э. С. Гарсия, С. , Пол и Г. А. Кросс. 1993. Делеция гена предполагает роль поверхностного гликопротеина GP72 Trypanosoma cruzi на стадиях жизненного цикла насекомых и млекопитающих. Дж. Клеточные науки. 106 : 1023-1033. [PubMed] [Google Scholar]
, Пол и Г. А. Кросс. 1993. Делеция гена предполагает роль поверхностного гликопротеина GP72 Trypanosoma cruzi на стадиях жизненного цикла насекомых и млекопитающих. Дж. Клеточные науки. 106 : 1023-1033. [PubMed] [Google Scholar]
19. Dessens, JT, A.L. Beetsma, G. Dimopoulos, K. Wengelnik, A. Crisanti, FC Kafatos и R.E. Sinden. 1999. CTRP необходим для заражения комаров малярией ookinetes. EMBO J. 18 : 6221-6227. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Dobrowolski, JM, VB Carruthers, and LD Sibley. 1997. Участие миозина в скользящей подвижности и инвазии клетки-хозяина Toxoplasma gondii . Мол. микробиол. 26 : 163-173. [PubMed] [Google Scholar]
21. Добровольски, Дж. М. и Л. Д. Сибли. 1996. Инвазия Toxoplasma в клетки млекопитающих обеспечивается актиновым цитоскелетом паразита. Сотовый 84 : 933-939.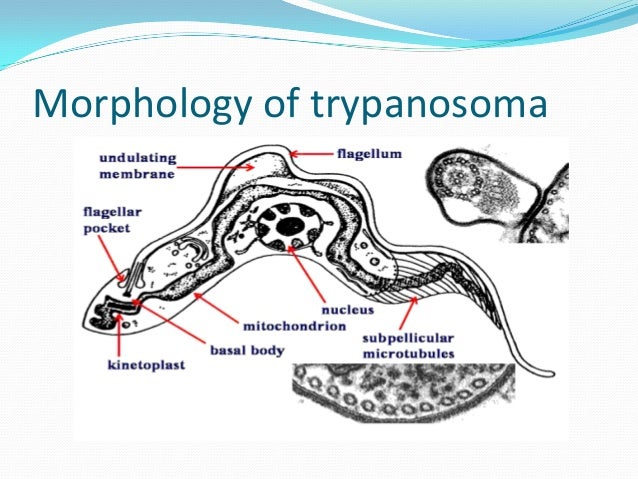 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
22. Dupuis-Williams, P., A. Fleury-Aubusson, N.G. de Loubresse, H. Geoffroy, L. Vayssie, A. Galvani, A. Espigat, and J. Rossier. 2002. Функциональная роль эпсилон-тубулина в сборке каркаса центриолярных микротрубочек. Дж. Клеточная биология. 158 : 1183-1193. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Dutcher, S.K. 1995. Сборка жгутика за двести пятьдесят простых шагов. Тенденции Жене. 11 : 398-404. [PubMed] [Google Scholar]
24. Эль-Сайед, Н. М., П. Хегде, Дж. Квакенбуш, С. Э. Мелвилл и Дж. Э. Донельсон. 2000. Геном африканской трипаносомы. Междунар. Дж. Паразитол. 30 : 329-345. [PubMed] [Google Scholar]
25. Гиббонс, И. Р. 1995. Семейство моторных белков динеина: текущее состояние и вопросы будущего. Селл Мотил. Цитоскелет 32 : 136-144. [PubMed] [Google Scholar]
26. Галл, К. 1999. Цитоскелет трипаносоматидных паразитов. Анну. Преподобный Микробиолог. 53 : 629-655. [PubMed] [Google Scholar]
Галл, К. 1999. Цитоскелет трипаносоматидных паразитов. Анну. Преподобный Микробиолог. 53 : 629-655. [PubMed] [Google Scholar]
27. Haynes, P.A., D.G. Russell, and G.A. Cross. 1996. Субклеточная локализация Trypanosoma cruzi гликопротеина Gp72. Дж. Клеточные науки. 109 : 2979-2988. [PubMed] [Google Scholar]
28. Хилл, К. Л., Н. Р. Хатчингс, П. М. Грандженетт и Дж. Э. Донельсон. 2000. Триггерный фактор Т-лимфоцитов африканских трипаносом связан с жгутиковой фракцией цитоскелета и представляет собой новое семейство белков, которые присутствуют у нескольких дивергентных эукариот. Дж. Биол. хим. 275 : 39369-39378. [PubMed] [Google Scholar]
29. Holwill, ME 1974. Некоторые физические аспекты подвижности реснитчатых и жгутиковых микроорганизмов. науч. прог. 61 : 63-80. [PubMed] [Google Scholar]
30. Holwill, ME J.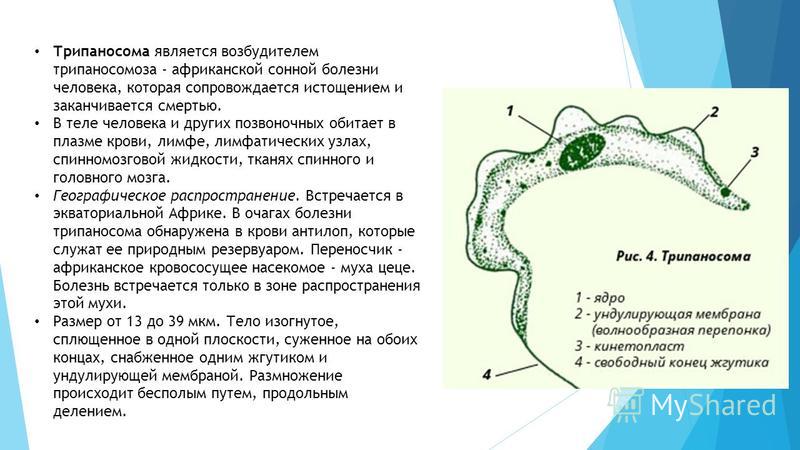 1965. Деформация эритроцитов трипаносомами. Эксп. Сотовый рез. 37 : 306-311. [PubMed] [Google Scholar]
1965. Деформация эритроцитов трипаносомами. Эксп. Сотовый рез. 37 : 306-311. [PubMed] [Google Scholar]
31. Holwill, ME J. 1965. Движение Strigomona oncopelti . Дж. Эксп. биол. 42 : 125-137. [Google Scholar]
32. Хунгерглазер И. и Т. Зеебек. 1997. Делеция генов белка паражгутиковых палочек PFR-A у Trypanosoma brucei , вероятно, приводит к летальному исходу. Мол. Биохим. Паразитол. 90 : 347-351. [PubMed] [Google Scholar]
33. Хатчингс Н. Р., Дж. Э. Донельсон и К. Л. Хилл. 2002. Трипанин является цитоскелетным линкерным белком и необходим для подвижности клеток в африканских трипаносомах. Дж. Клеточная биология. 156 : 867-877 [бесплатная статья PMC] [PubMed] [Google Scholar]
34. Ян Т. Л. и Э. К. Бови. 1968. Передвижение кровяных простейших, с. 393-436. В Д. Вайнман и М. Ристик (ред.), Инфекционные болезни крови человека и животных, т. 1, с. 1. Academic Press, Лондон, Англия.
Ристик (ред.), Инфекционные болезни крови человека и животных, т. 1, с. 1. Academic Press, Лондон, Англия.
35. Коль Л. и К. Чайка. 1998. Молекулярная архитектура трипаносомного цитоскелета. Мол. Биохим. Паразитол. 93 : 1-9. [PubMed] [Академия Google]
36. Коль, Л., Т. Шервин и К. Галл. 1999. Сборка паражгутикового стержня и комплекса зоны прикрепления жгутика во время клеточного цикла Trypanosoma brucei . Дж. Эукариот. микробиол. 46 : 105-109. [PubMed] [Google Scholar]
37. Козмински К. Г., П. Л. Бич и Дж. Л. Розенбаум. 1995. Chlamydomonas кинезиноподобный белок FLA10 участвует в подвижности, связанной с жгутиковой мембраной. Дж. Клеточная биология. 131 : 1517-1527. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Козмински, К. Г., К. А. Джонсон, П. Форшер и Дж. Л. Розенбаум. 1993. Подвижность жгутика эукариот, не связанная с биением жгутиков. проц. Натл. акад. науч. США 90 : 5519-5523. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США 90 : 5519-5523. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. LaCount, D. J., B. Barrett, and J. E. Donelson. 2002. Trypanosoma brucei FLA1 необходим для прикрепления жгутика и цитокинеза. Дж. Биол. хим. 277 : 17580-17588. [PubMed] [Google Scholar]
40. LaCount, D. J., S. Bruse, K. L. Hill, and J. E. Donelson. 2000. Интерференция двухцепочечной РНК в Trypanosoma brucei с использованием промоторов «голова к голове». Мол. Биохим. Паразитол. 111 : 67-76. [PubMed] [Google Scholar]
41. LaCount, D. J., and J. E. Donelson. 2001. РНК-интерференция в африканских трипаносомах. Протист 152 : 103-111. [PubMed] [Академия Google]
42. Lindemann, C.B., and K.S. Kanous. 1997. Модель жгутиковой подвижности. Междунар. Преподобный Цитол. 173 : 1-72.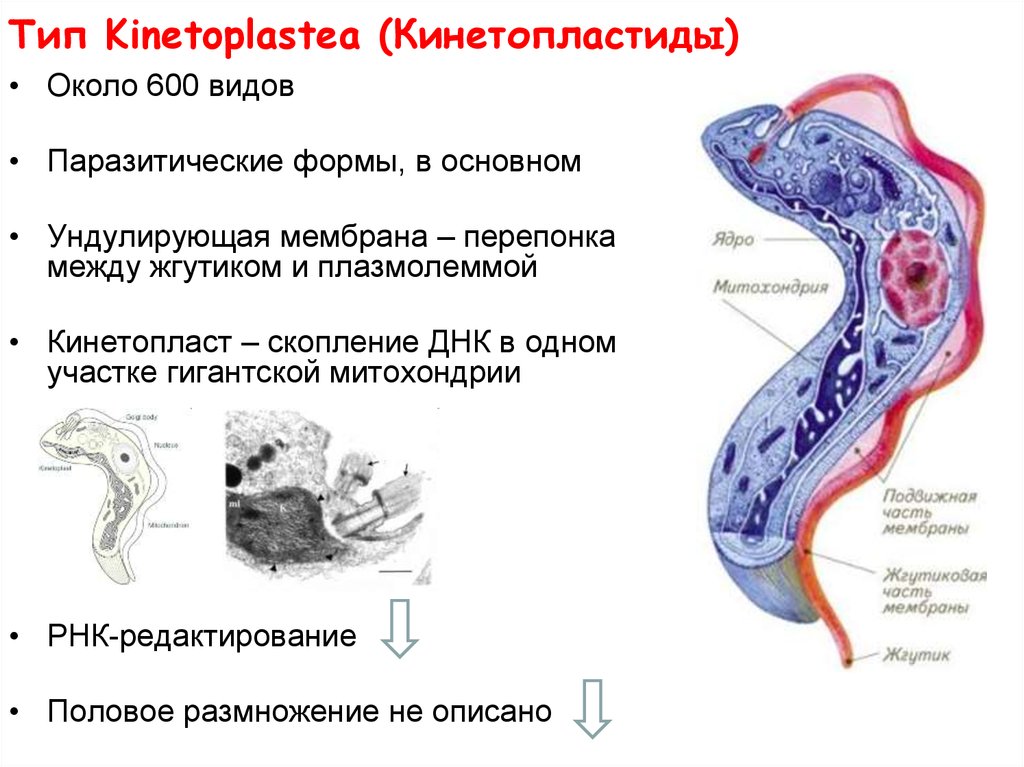 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
43. Лак Д., Г. Пиперно, З. Раманис и Б. Хуанг. 1977. Жгутиковые мутанты Chlamydomonas : исследования штаммов с дефектом радиальных спиц с помощью дикарионного и ревертантного анализа. проц. Натл. акад. науч. США 74 : 3456-3460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Maga, JA, and JH LeBowitz. 1999. Распутывание кинетопластидного паражгутикового стержня. Тенденции клеточной биологии. 9 : 409-413. [PubMed] [Google Scholar]
45. Мага, Дж. А., Т. Шервин, С. Фрэнсис, К. Галл и Дж. Х. ЛеБовиц. 1999. Генетическое рассечение паражгутиковой палочки Leishmania , уникальной структуры жгутикового цитоскелета. Дж. Клеточные науки. 112 : 2753-2763. [PubMed] [Google Scholar]
46. Manson, MD, JP Armitage, JA Hoch и RM Macnab. 1998. Бактериальная локомоция и передача сигналов. Дж.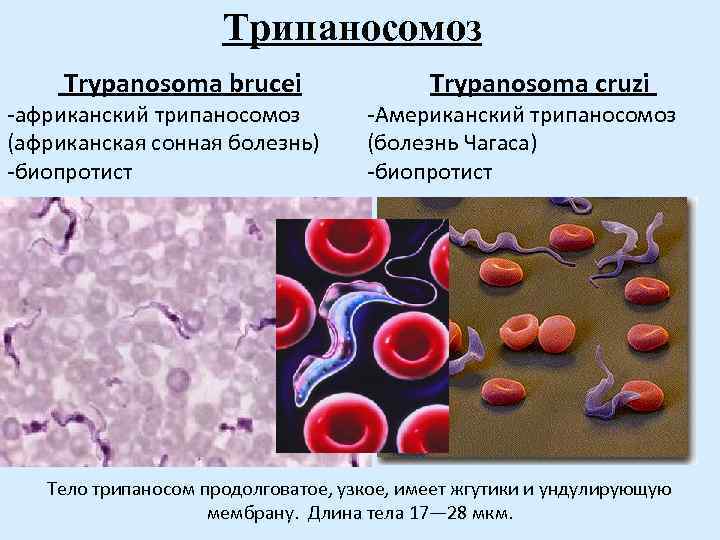 Бактериол. 180 : 1009-1022. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Бактериол. 180 : 1009-1022. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Морейра-Лейте, Ф. Ф., Т. Шервин, Л. Коль и К. Галл. 2001. Трипаносомная структура, участвующая в передаче цитоплазматической информации во время клеточного деления. Наука 294 : 610-612. [PubMed] [Google Scholar]
48. Morris, JC, Z. Wang, ME Drew, and PT Englund. 2002. Гликолиз модулирует экспрессию трипаносомного гликопротеина, как показано с помощью библиотеки РНКи. EMBO J. 21 : 4429-4438. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Мосс Б. и Б. М. Уорд. 2001. Высокоскоростной массовый перенос поксвирусов на микротрубочках. Нац. Клеточная биол. 3 : E245-E246. [PubMed] [Google Scholar]
50. Нго, Х., К. Чуди, К. Галл и Э. Уллу. 1998. Двухцепочечная РНК индуцирует деградацию мРНК у Trypanosoma brucei . проц.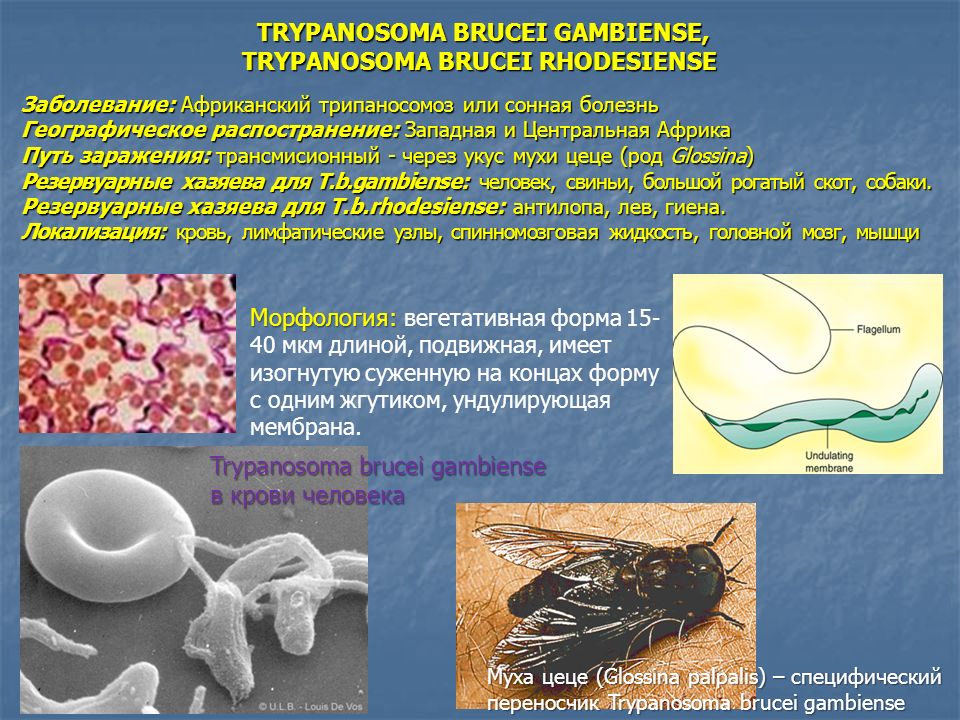 Натл. акад. науч. США 95 : 14687-14692. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Натл. акад. науч. США 95 : 14687-14692. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Нодзаки Т., П. А. Хейнс и Г. А. Кросс. 1996. Характеристика гомолога Trypanosoma brucei гликопротеина Trypanosoma cruzi , связывающего жгутик. Мол. Биохим. Паразитол. 82 : 245-255. [PubMed] [Google Scholar]
52. Opitz, C., and D. Soldati. 2002. «Глидеосома»: динамический комплекс, обеспечивающий скользящее движение и инвазию клетки-хозяина Toxoplasma gondii . Мол. микробиол. 45 : 597-604. [PubMed] [Google Scholar]
53. Оттеманн, К. М. и Дж. Ф. Миллер. 1997. Роль подвижности во взаимодействиях бактерия-хозяин. Мол. микробиол. 24 : 1109-1117. [PubMed] [Google Scholar]
54. Пазур, Г. Дж., С. А. Бейкер, Дж. А. Дин, Д. Г. Коул, Б. Л. Диккерт, Дж. Л. Розенбаум, Г. Б. Уитман и Дж. К. Бешарс. 2002.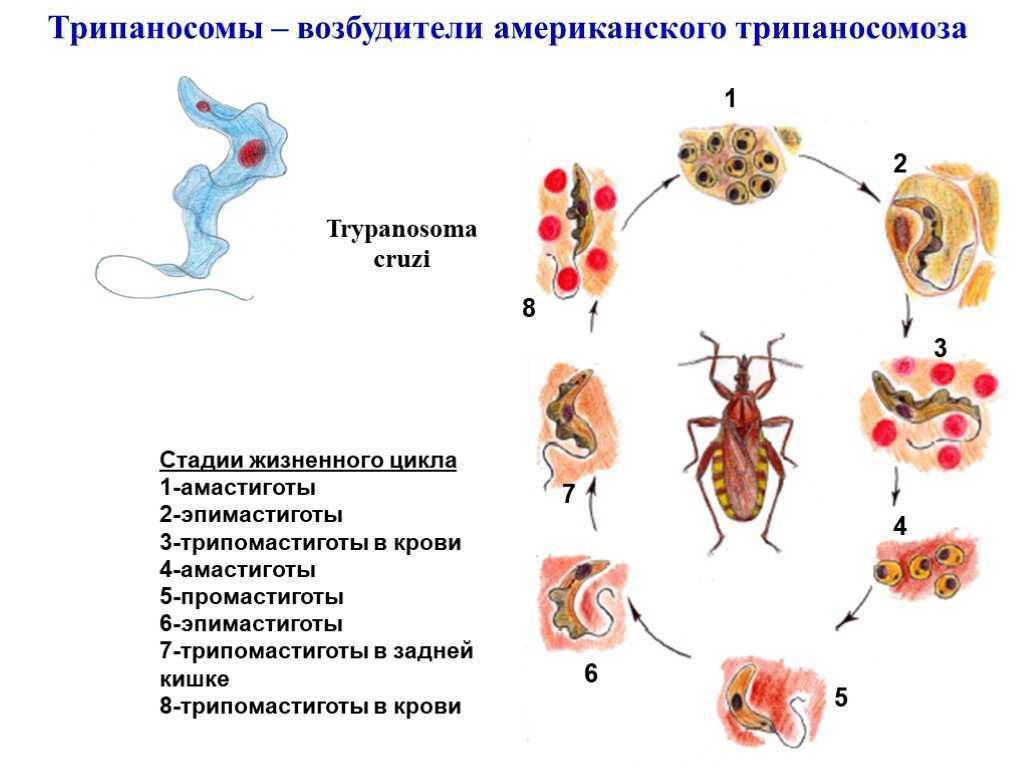 Внутрижгутиковый транспортный белок IFT88 необходим для сборки и поддержания фоторецепторов позвоночных. Дж. Клеточная биология. 157 : 103-113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Внутрижгутиковый транспортный белок IFT88 необходим для сборки и поддержания фоторецепторов позвоночных. Дж. Клеточная биология. 157 : 103-113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Pazour, GJ, B.L. Dickert, Y. Vucica, E.S. Seeley, J.L. Rosenbaum, G.B. Witman, and D.G. Cole. 2000. Chlamydomonas IFT88 и ее мышиный гомолог, ген поликистоза почек tg737 , необходимы для сборки ресничек и жгутиков. Дж. Клеточная биология. 151 : 709-718. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Пазур, Г. Дж., К. Г. Вилкерсон и Г. Б. Витман. 1998. Легкая цепь динеина необходима для ретроградного движения частиц внутрижгутикового транспорта (IFT). Дж. Клеточная биология. 141 : 979-992. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Пепин Дж. и Дж. Э. Донельсон. 1999. Африканский трипаносомоз (сонная болезнь), с. 774-784. В R. Guerrant et al. (ред.), Тропические инфекционные болезни: принципы, возбудители и практика, том. 1. Черчилль Ливингстон, Эдинбург, Шотландия.
В R. Guerrant et al. (ред.), Тропические инфекционные болезни: принципы, возбудители и практика, том. 1. Черчилль Ливингстон, Эдинбург, Шотландия.
58. Пиндер, Дж., Р. Фаулер, Л. Баннистер, А. Длужевски и Г. Х. Митчелл. 2000. Подвижные системы у мерозоитов малярии: как происходит инвазия эритроцитов? Паразитол. Сегодня 16 : 240-245. [PubMed] [Google Scholar]
59. Пиперно Г. и К. Мид. 1997. Транспорт нового комплекса в цитоплазматическом матриксе жгутиков Chlamydomonas . проц. Натл. акад. науч. США 94 : 4457-4462. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Портер М.Э. и В.С. Сейл. 2000. Аксонема 9 + 2 закрепляет множественные динеины внутренней части руки и сеть киназ и фосфатаз, которые контролируют подвижность. Дж. Клеточная биология. 151 : F37-F42. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Риджли Э.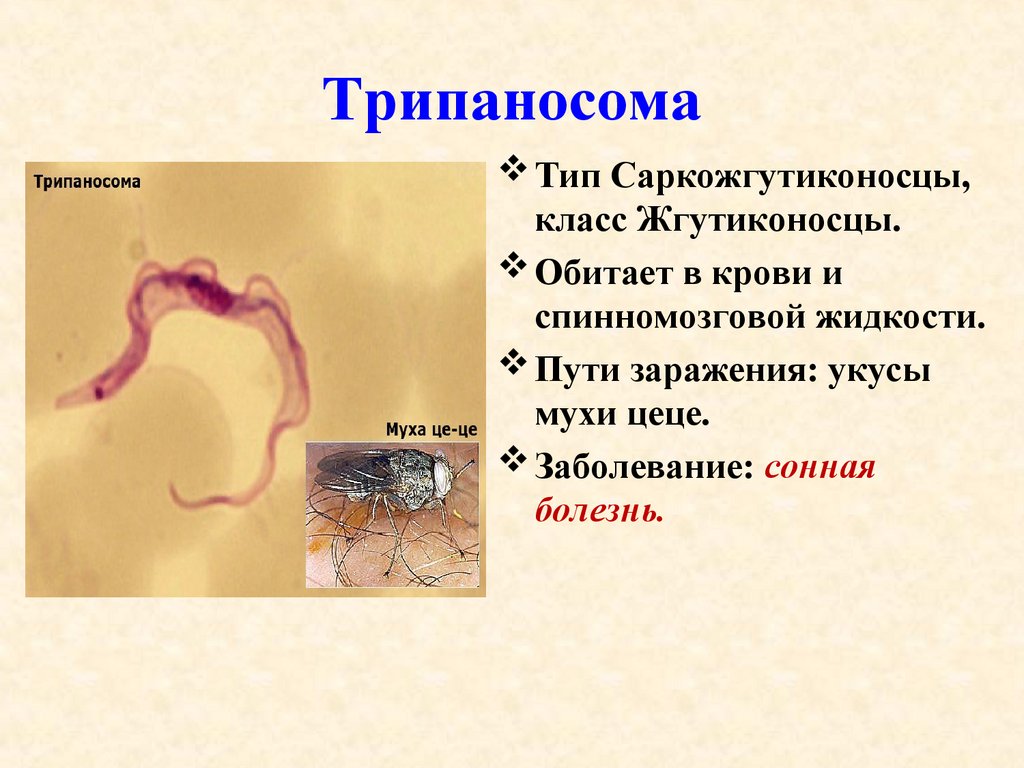 , П. Вебстер, К. Паттон и Л. Рубен. 2000. Свойства связывания кальмодулина комплекса паражгутиковых стержней из Trypanosoma brucei . Мол. Биохим. Паразитол. 109 : 195-201. [PubMed] [Академия Google]
, П. Вебстер, К. Паттон и Л. Рубен. 2000. Свойства связывания кальмодулина комплекса паражгутиковых стержней из Trypanosoma brucei . Мол. Биохим. Паразитол. 109 : 195-201. [PubMed] [Академия Google]
62. Робинсон Д., П. Битти, Т. Шервин и К. Галл. 1991. Микротрубочки, тубулин и связанные с микротрубочками белки трипаносом. Методы Энзимол. 196 : 285-299. [PubMed] [Google Scholar]
63. Робинсон Д. Р., Т. Шервин, А. Плубиду, Э. Х. Байярд и К. Галл. 1995. Полярность и динамика микротрубочек в контроле позиционирования органелл, сегрегации и цитокинеза в трипаносомном клеточном цикле. Дж. Клеточная биология. 128 : 1163-1172. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Розенбаум Дж. Л., Д. Г. Коул и Д. Р. Динер. 1999. Внутрижгутиковый транспорт: глаза видят. Дж. Клеточная биология. 144 : 385-388. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Rosenbaum, JL, and G.B. Witman. 2002. Внутрижгутиковый транспорт. Нац. Преподобный Мол. Клеточная биол. 3 : 813-825. [PubMed] [Google Scholar]
Rosenbaum, JL, and G.B. Witman. 2002. Внутрижгутиковый транспорт. Нац. Преподобный Мол. Клеточная биол. 3 : 813-825. [PubMed] [Google Scholar]
66. Рудзинска, М. А., и К. Викерман. 1968. Тонкая структура, с. 217-306. В Д. Вайнман и М. Ристик (ред.), Инфекционные болезни крови человека и животных, т. 1, с. 1. Academic Press, Лондон, Англия.
67. Сантрич, К., Л. Мур, Т. Шервин, П. Бастин, К. Брокоу, К. Галл и Дж. Х. ЛеБовиц. 1997. Подвижная функция паражгутиковой палочки паразитов Leishmania , выявленная с помощью нокаутов гена PFR-2. Мол. Биохим. Паразитол. 90 : 95-109. [PubMed] [Академия Google]
68. Satir, P. 1995. Ориентиры в исследованиях ресничек от Левенгука до нас. Селл Мотил. Цитоскелет 32 : 90-94. [PubMed] [Google Scholar]
69. Шервин Т. и К. Галл. 1989. Цикл клеточного деления Trypanosoma brucei brucei : синхронизация маркеров событий и модуляции цитоскелета.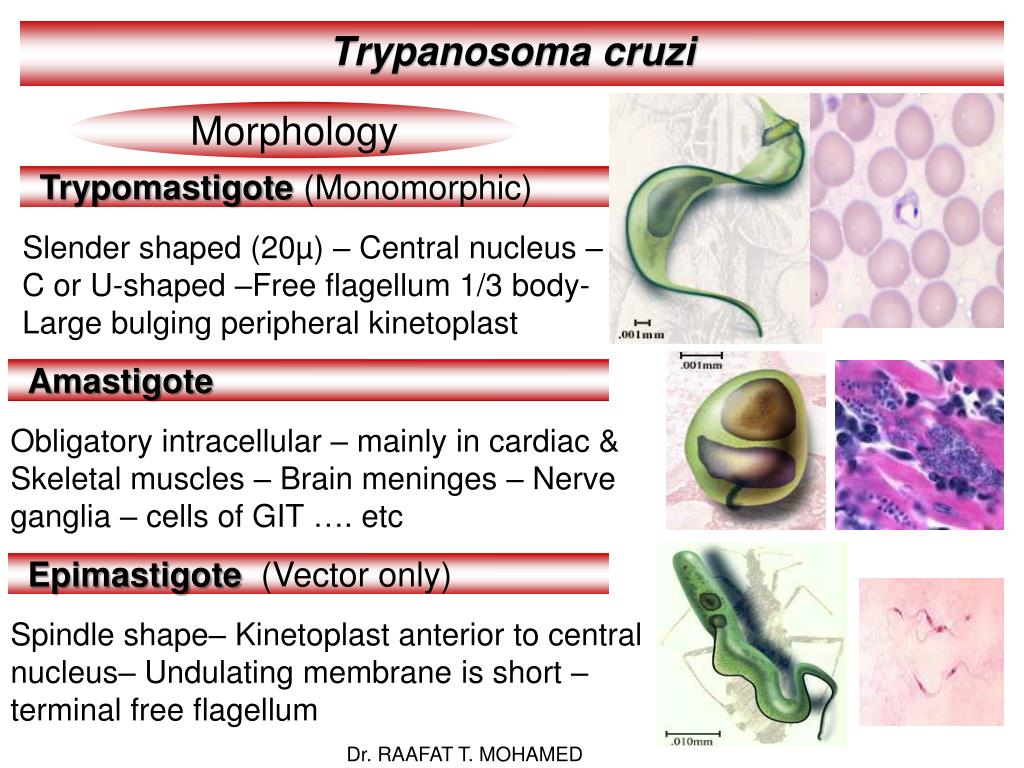 Филос. Транс. Р. Соц. Лонд. сер. Б 323 : 573-588. [PubMed] [Google Scholar]
Филос. Транс. Р. Соц. Лонд. сер. Б 323 : 573-588. [PubMed] [Google Scholar]
70. Сибли, Л. Д. и Н. В. Эндрюс. 2000. Инвазия клеток неприятными паразитами. Трафик 1 : 100-106. [PubMed] [Google Scholar]
71. Silflow, C.D., and P.A. Lefebvre. 2001. Сборка и подвижность эукариотических ресничек и жгутиков. Уроки Chlamydomonas reinhardtii . Завод Физиол. 127 : 1500-1507. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Снари, Д., М. А. Фергюсон, М. Т. Скотт и А. К. Аллен. 1981. Антигены клеточной поверхности Trypanosoma cruzi : использование моноклональных антител для идентификации и выделения эпимастигот-специфического гликопротеина. Мол. Биохим. Паразитол. 3 : 343-356. [PubMed] [Google Scholar]
73. Stock, JB, and MG Surette. 1996. Хемотаксис, с. 1103-1129. In F.C. Neidhardt, R. Curtiss III, JL Ingraham, ECC Lin, KB Low, B. Magasanik, WS. Reznikoff, M. Riley, M. Schaechter и H.E. Umbarger (ed.), Escherichia coli и Salmonella : клеточная и молекулярная биология. Американское общество микробиологии, Вашингтон, округ Колумбия
Curtiss III, JL Ingraham, ECC Lin, KB Low, B. Magasanik, WS. Reznikoff, M. Riley, M. Schaechter и H.E. Umbarger (ed.), Escherichia coli и Salmonella : клеточная и молекулярная биология. Американское общество микробиологии, Вашингтон, округ Колумбия
74. Sugrue, P., M.R. Hirons, JU Adam и M.E. Holwill. 1988. Инверсия жгутиковых волн у жгутиковых кинетопластид Crithidia oncopelti . биол. Сотовый 63 : 127-131. [PubMed] [Google Scholar]
75. Тетли Л. и К. Викерман. 1985. Дифференциация Trypanosoma brucei : соединения клеток хозяина и паразита и их устойчивость во время приобретения вариабельной антигенной оболочки. Дж. Клеточные науки. 74 : 1-19. [PubMed] [Google Scholar]
76. Уллу, Э., А. Джикенг, Х. Ши и К. Чуди. 2002. РНК-интерференция: успехи и вопросы. Филос. Транс. Р. Соц. Лонд. сер. Б 357 : 65-70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Van Den Abbeele, J., Y. Claes, D. van Bockstaele, D. Le Ray и M. Coosemans. 1999. Trypanosoma brucei spp. развитие мухи цеце: характеристика постмезоциклических стадий передней кишки и хоботка. Паразитология 118 : 469-478. [PubMed] [Google Scholar]
Van Den Abbeele, J., Y. Claes, D. van Bockstaele, D. Le Ray и M. Coosemans. 1999. Trypanosoma brucei spp. развитие мухи цеце: характеристика постмезоциклических стадий передней кишки и хоботка. Паразитология 118 : 469-478. [PubMed] [Google Scholar]
78. Vickerman, K. 1969. О поверхностной оболочке и адгезии жгутиков трипаносом. Дж. Клеточные науки. 5 : 163-193. [PubMed] [Google Scholar]
79. Vickerman, K. 1985. Циклы развития и биология патогенных трипаносом. бр. Мед. Бык. 41 : 105-114. [PubMed] [Google Scholar]
80. Vickerman, K., and TM Preston. 1976. Сравнительная клеточная биология кинетопластидных жгутиконосцев, с. 35-130. В У. Х. Р. Ламсден и Д. А. Эванс (ред.), Биология Кинетопластида , том. 1. Academic Press, Лондон, Англия.
81. Викерман К., Л. Тетли, К. А. Хендри и К. М. Тернер. 1988. Биология африканских трипаносом мухи цеце. биол. Сотовый 64 : 109-119. [PubMed] [Google Scholar]
1988. Биология африканских трипаносом мухи цеце. биол. Сотовый 64 : 109-119. [PubMed] [Google Scholar]
82. Уокер, П. Дж. и Дж. К. Уокер. 1963. Движение жгутиков трипаносом. Дж. Протозол. 10(Suppl.) : 32. [Google Scholar]
83. Walker, P. J. 1961. Организация функций трипаносомных жгутиков. Природа 189 : 1017-1018. [PubMed] [Google Scholar]
84. Webster, P., and D.G. Russell. 1993. Жгутиковый карман трипаносоматид. Паразитол. Сегодня 9 : 201-206. [PubMed] [Google Scholar]
85. Welburn, S.C., and I. Maudlin. 1999. Взаимодействия цеце-трипаносомы: обряды посвящения. Паразитол Сегодня 15 : 399-403. [PubMed] [Google Scholar]
86. Ву, Ю., Дж. Дефорд, Р. Бенджамин, М. Г. Ли и Л. Рубен. 1994. Семейство генов EF-ручных кальцийсвязывающих белков из жгутика Trypanosoma brucei .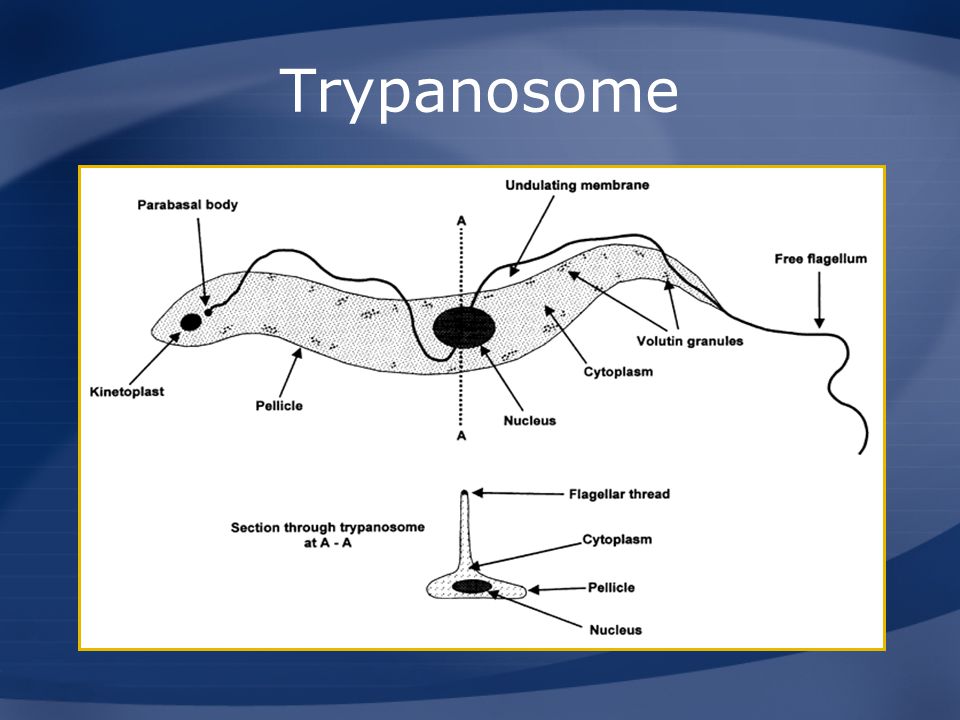 Биохим. Дж. 304 : 833-841. [PMC free article] [PubMed] [Google Scholar]
Биохим. Дж. 304 : 833-841. [PMC free article] [PubMed] [Google Scholar]
CDC — DPDx — Trypanosomasis, African
Возбудители
в подроде Трипанозон . Два подвида, которые морфологически неразличимы, вызывают у людей различные формы заболевания: Т. б. gambiense , вызывающий хронический африканский трипаносомоз («западноафриканская сонная болезнь»), и T. b. rhodesiense , вызывающий острый африканский трипаносомоз («восточноафриканская сонная болезнь»). Третий подвид T. b. brucei является паразитом преимущественно крупного рогатого скота, а иногда и других животных, и в нормальных условиях не заражает человека.
Жизненный цикл
Во время кормления кровью млекопитающего инфицированная муха цеце (род Glossina ) вводит метациклические трипомастиготы в ткани кожи. Паразиты попадают в лимфатическую систему и попадают в кровоток.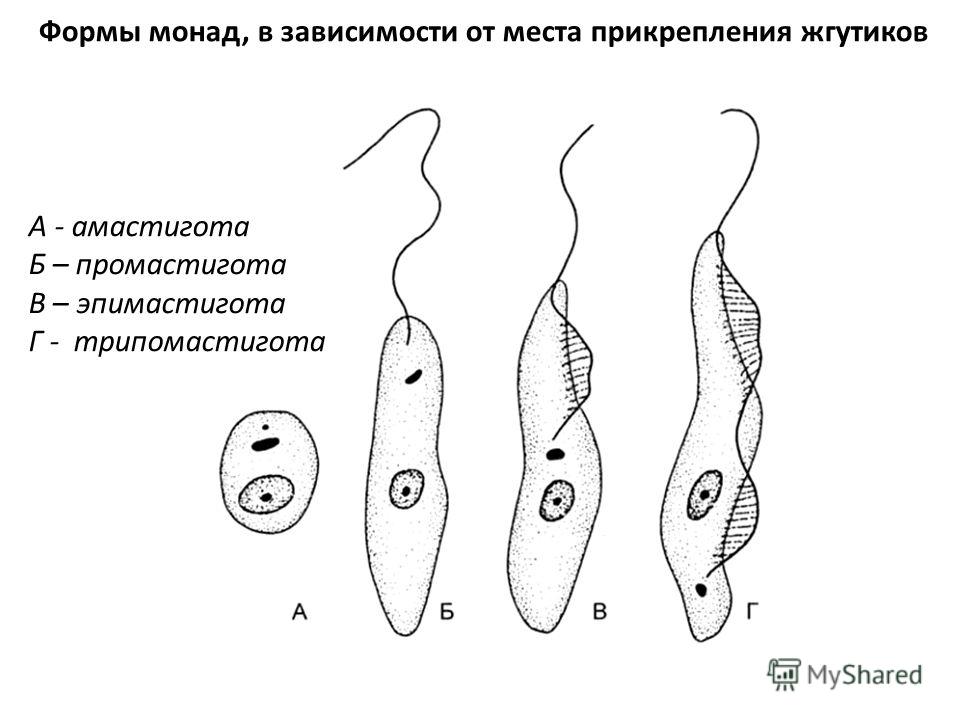 Внутри хозяина они трансформируются в трипомастиготы кровотока, переносятся в другие места по всему телу, достигают других жидкостей организма (например, лимфы, спинномозговой жидкости) и продолжают репликацию путем бинарного деления. Весь жизненный цикл африканских трипаносом представлен внеклеточными стадиями. Муха цеце заражается трипомастиготами кровотока при приеме пищи с кровью инфицированного хозяина-млекопитающего. В средней кишке мухи паразиты превращаются в проциклических трипомастигот, размножаются бинарным делением, покидают среднюю кишку и превращаются в эпимастиготы. Эпимастиготы достигают слюнных желез мух и продолжают размножаться путем бинарного деления. Цикл на лету занимает примерно 3 недели. Редко,
Внутри хозяина они трансформируются в трипомастиготы кровотока, переносятся в другие места по всему телу, достигают других жидкостей организма (например, лимфы, спинномозговой жидкости) и продолжают репликацию путем бинарного деления. Весь жизненный цикл африканских трипаносом представлен внеклеточными стадиями. Муха цеце заражается трипомастиготами кровотока при приеме пищи с кровью инфицированного хозяина-млекопитающего. В средней кишке мухи паразиты превращаются в проциклических трипомастигот, размножаются бинарным делением, покидают среднюю кишку и превращаются в эпимастиготы. Эпимастиготы достигают слюнных желез мух и продолжают размножаться путем бинарного деления. Цикл на лету занимает примерно 3 недели. Редко,
Хозяева и переносчики
Люди считаются основным резервуаром для Trypanosoma brucei gambiense , но этот вид также может быть обнаружен у животных, включая приматов и копытных.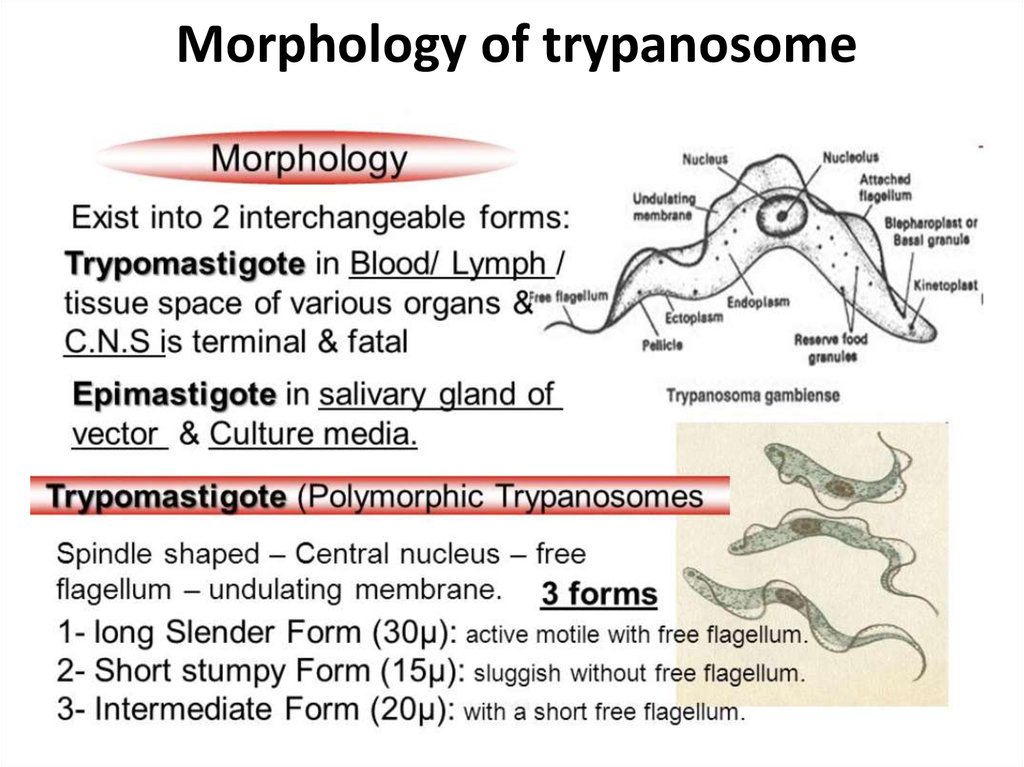 Считается, что домашний крупный рогатый скот является наиболее эпидемиологически значимым животным-резервуаром T. b. родезийский . Единственным известным переносчиком каждого из них является муха цеце ( Glossina 9).0030 видов).
Считается, что домашний крупный рогатый скот является наиболее эпидемиологически значимым животным-резервуаром T. b. родезийский . Единственным известным переносчиком каждого из них является муха цеце ( Glossina 9).0030 видов).
Географическое распространение
T. b. gambiense является эндемиком Западной и Центральной Африки. Т.б. rhodesiense ограничен Восточной и Юго-Восточной Африкой. Эти ареалы не перекрываются, хотя в Уганде оба подвида являются коэндемичными, с T. b. gambiense обнаружен у северной границы, а T. b. rhodesiense встречается в центральных и южных районах этой страны.
Клиническая картина
Инфекция протекает в две стадии, которым иногда может предшествовать развитие трипаносомного шанкра на месте инокуляции в течение нескольких дней после укуса инфицированной мухой (чаще всего происходит при Т. б. родезийский ). Первая стадия болезни (гемолимфатическая) характеризуется неспецифическими признаками и симптомами, такими как перемежающаяся лихорадка, зуд и лимфаденопатия.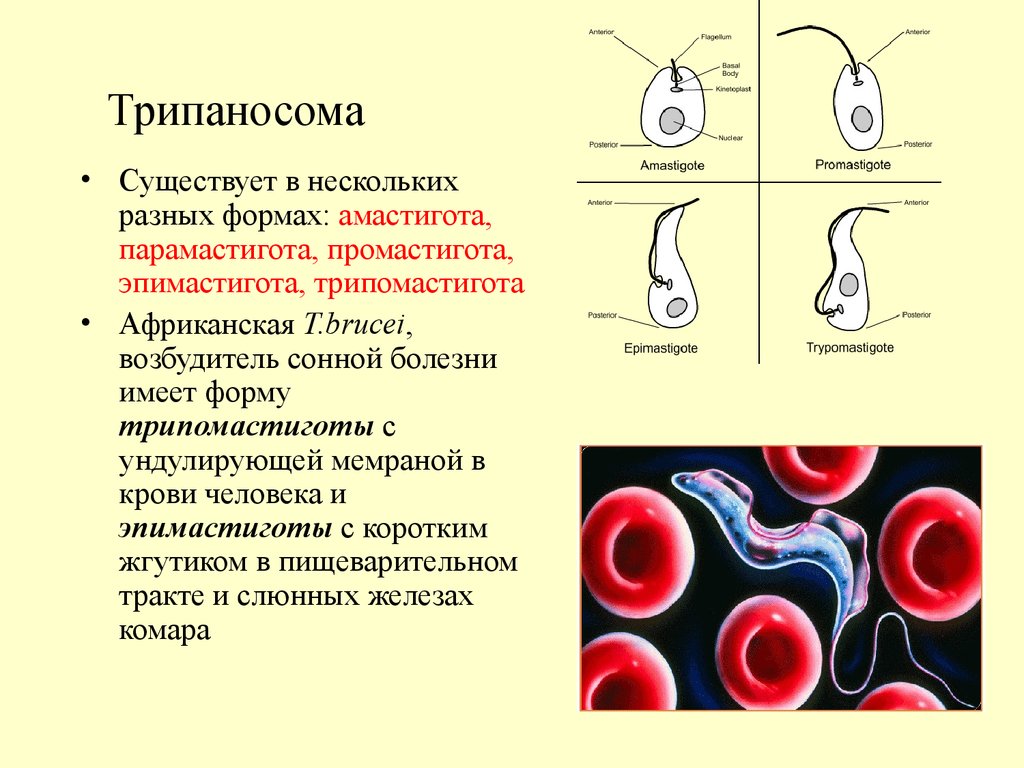 Шейная лимфаденопатия заднего треугольника, или «признак Уинтерботтома», обычно наблюдается у T. b. gambiense , но лимфаденопатию также можно наблюдать в подмышечной, паховой и эпитрохлеарной областях. Увеличенные лимфатические узлы имеют тенденцию быть подчелюстными, подмышечными и паховыми у T. b. родезийский .
Шейная лимфаденопатия заднего треугольника, или «признак Уинтерботтома», обычно наблюдается у T. b. gambiense , но лимфаденопатию также можно наблюдать в подмышечной, паховой и эпитрохлеарной областях. Увеличенные лимфатические узлы имеют тенденцию быть подчелюстными, подмышечными и паховыми у T. b. родезийский .
При второй стадии болезни (менингоэнцефалитической) инвазия в центральную нервную систему вызывает разнообразные нервно-психические проявления, в том числе нарушения сна, отсюда и общее название «африканская сонная болезнь». Также наблюдаются тяжелые поражения сердца с отклонениями на электрокардиограмме, характерными для перимиокардита. Эти изменения, как правило, легкие в Т. б. gambiense , но они более тяжелые и появляются раньше у T. b. rhodesiense инфекции . Течение инфекции гораздо более острое и быстрое у T. b. rhodesiense чем T. b. gambien se, , и обе инфекции без лечения почти всегда приводят к летальному исходу.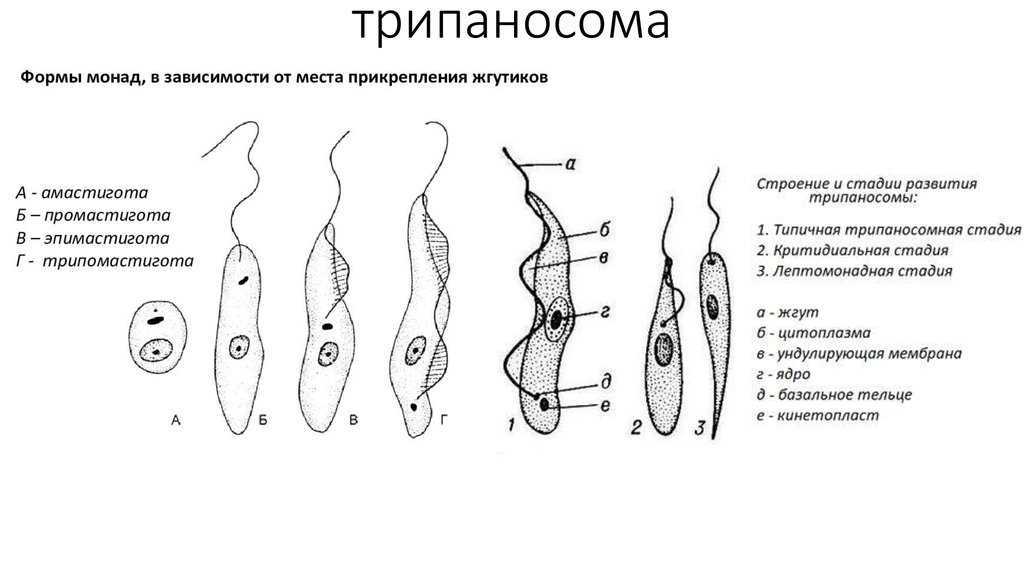
Два подвида Trypanosoma brucei , вызывающие африканский трипаносомоз, T. b. гамбиенс и Т. б. rhodesiense , морфологически неразличимы. Типичный трипомастигот имеет небольшой кинетопласт, расположенный на заднем конце, центрально расположенное ядро, ундулирующую мембрану и жгутик, идущий вдоль ундулирующей мембраны, отходящий от тела на переднем конце. Трипомастиготы — единственная стадия, обнаруживаемая у пациентов. Трипаносомы имеют длину от 14 до 33 мкм.
Trypanosoma brucei подвид. в толстом мазке крови, окрашенном по Гимзе.
Рисунок А: Trypansoma brucei ssp. в толстом мазке крови, окрашенном по Гимзе.
Рисунок B: Trypansoma brucei ssp. в толстом мазке крови, окрашенном по Гимзе.
Рисунок C: Trypansoma brucei подвид. в толстом мазке крови, окрашенном по Гимзе.
Trypanosoma brucei подвид. в тонких мазках крови, окрашенных по Гимзе.
Рисунок A: Trypanosoma brucei ssp.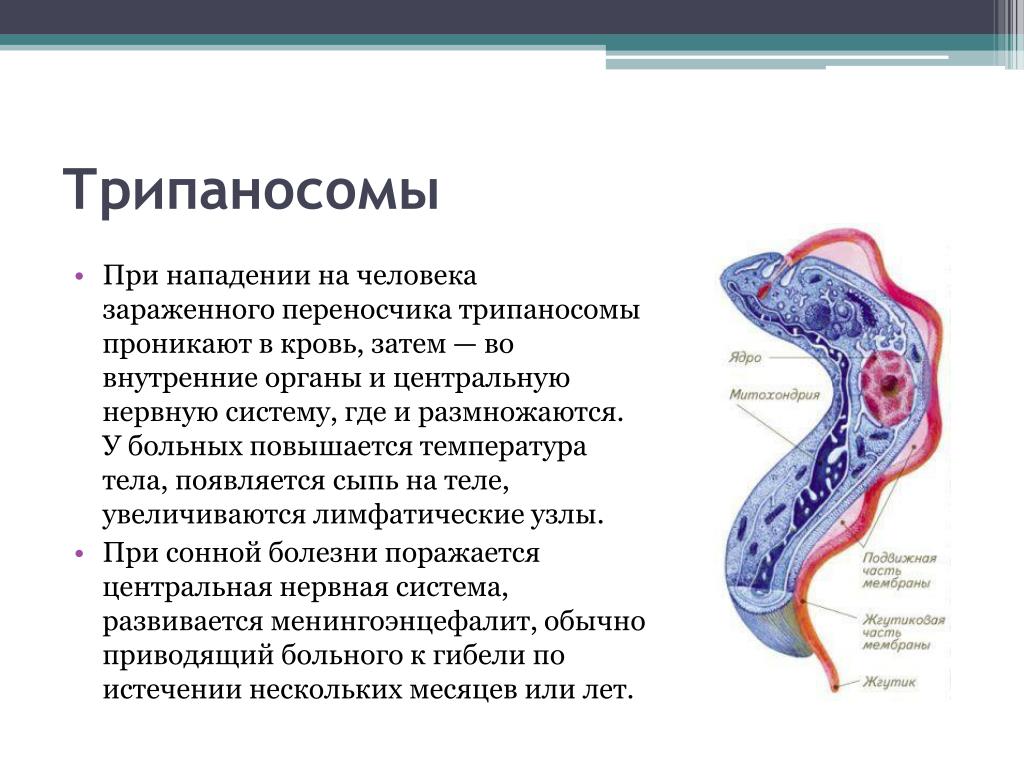 в тонком мазке крови, окрашенном по Гимзе.
в тонком мазке крови, окрашенном по Гимзе.
Рисунок Б: Trypanosoma brucei ssp. в тонком мазке крови, окрашенном по Гимзе.
Рисунок C: Trypomastigotes T. brucei ssp. в мазке крови, окрашенном по Гимзе.
Рисунок D: Trypomastigotes T. brucei ssp. в мазке крови, окрашенном по Гимзе.
Trypanosoma brucei подвид. в тонких мазках крови, окрашенных по Райту-Гимзе.
Рисунок A: Trypanosoma brucei ssp. в тонком мазке крови, окрашенном по Райту-Гимзе.
Рисунок B: Trypanosoma brucei ssp. в тонком мазке крови, окрашенном по Райту-Гимзе.
Рисунок C: Trypanosoma brucei подвид. в тонком мазке крови, окрашенном по Райту-Гимзе.
Рисунок D: Trypanosoma brucei подвид. в тонком мазке крови, окрашенном по Райту-Гимзе.
Рисунок E: Trypanosoma brucei в тонком мазке крови, окрашенном по Райту-Гимзе.
Рисунок F: Trypanosoma brucei ssp.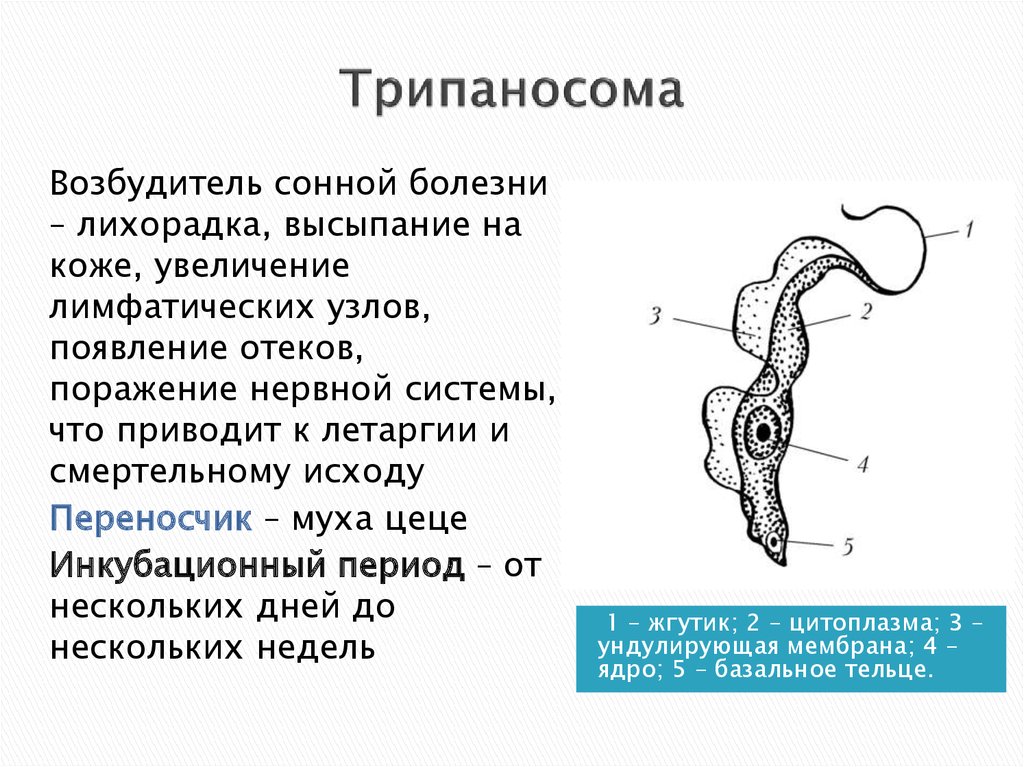 в тонком мазке крови, окрашенном по Райту-Гимзе.
в тонком мазке крови, окрашенном по Райту-Гимзе.
Trypanosoma brucei подвид. в тонком мазке крови, начинающем делиться.
Рисунок A: Trypanosoma brucei ssp. в тонком мазке крови, окрашенном по Гимзе. Трипомастигота начинает делиться; делящиеся формы наблюдаются у африканских трипаносом, но не у американских трипаносом.
Лабораторная диагностика
Диагноз ставится при обнаружении трипаносом при микроскопическом исследовании жидкости шанкра, аспиратов лимфатических узлов, крови, костного мозга или, на поздних стадиях инфекции, спинномозговой жидкости. Влажный препарат исследуют на наличие подвижных трипаносом, дополнительно фиксируют мазок крови (тонкий или толстый), окрашивают его по Гимзе (или по Филду) и исследуют. Перед микроскопическим исследованием можно использовать методы концентрирования. Для образцов крови они включают центрифугирование с последующим исследованием лейкоцитарной пленки; мини-анионообмен/центрифугирование; и метод количественного лейкоцитарного слоя (QBC).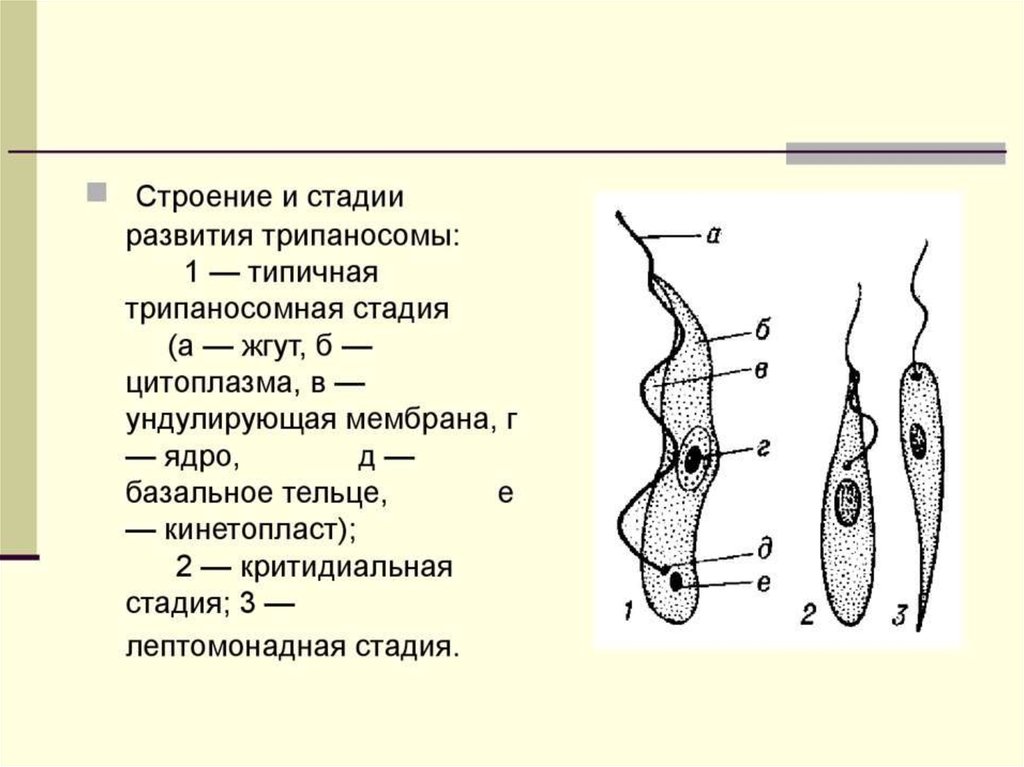 Для других образцов, таких как спинномозговая жидкость, методы концентрирования включают центрифугирование с последующим исследованием осадка. Выделение паразита путем инокуляции крыс или мышей является чувствительным методом, но его применение ограничено Т. б. родезийский .
Для других образцов, таких как спинномозговая жидкость, методы концентрирования включают центрифугирование с последующим исследованием осадка. Выделение паразита путем инокуляции крыс или мышей является чувствительным методом, но его применение ограничено Т. б. родезийский .
Обнаружение антител
Экспресс-тесты на T. b. gambiense используются для скрининга цельной крови для контроля/исключения; производительность варьируется в зависимости от эндемичности. Некоторые из этих наборов имеются в продаже и включают тест-полоски и карточки для агглютинации. Однако с T. b. rhodesiense , сероконверсия происходит после появления клинических симптомов, поэтому обнаружение антител имеет ограниченное применение.
Молекулярное обнаружение
Тесты на основе нуклеиновых кислот не утверждены для диагностики африканского трипаносомоза, и диагностическая эффективность этих тестов значительно различается.
Лабораторная безопасность
Стандартные протоколы безопасности при обращении с кровью и острыми предметами (https://www.