Нарушения секреции и действия антидиуретического гормона
27.03.2015
Поддержание нормального объема внеклеточной жидкости крайне важно для полноценной функции клеток организма. Внеклеточная осмолярность влияет на форму клетки и распределение ионов по обе стороны клеточной мембраны. Адекватные концентрации ионов во внеклеточных средах необходимы для нормального функционирования ионных каналов, формирования мембранных потенциалов и других процессов межклеточного взаимодействия.За регуляцию водно-солевого обмена и стабильность осмотического давления плазмы
крови в организме отвечает комплексная регуляторная система, включающая эндокринные, нервные и паракринные механизмы.
Компонентами данной системы являются ось гипоталамус-нейрогипофиз, осморецепторная и барорецепторная сенсорные системы и почки.

Приоритет в поддержании водного баланса имеют гипоталамо-нейрогипофизарная ось и ее ключевой гормон — антидиуретический гормон (АДГ), вазопрессин.
Физиологические эффекты АДГ
АДГ на уровне почки повышает реабсорбцию воды в дистальных канальцах и собирательных
трубочках. Данный эффект вазопрессина осуществляется посредством его связывания со
специфическими G-протеинассоциированными рецепторами на базолатеральной мембране
интерстициальной поверхности клеток канальцев почки и повышения активности
аденилатциклазы, с последующим синтезом циклического аденозинмонофосфата АМФ
(цАМФ). Известно три типа рецепторов к вазопрессину – V1, V2, V3. Водный баланс
регулируется вазопрессином через рецепторы V2. Проницаемость клеток дистальных
канальцев и собирательных трубочек определяется числом водных каналов (аквапоринов) в
апикальной мембране. При отсутствии АДГ число аквапоринов невелико, и эпителий
практически непроницаем для воды, поэтому из организма выводится большое количество
гипотонической мочи.
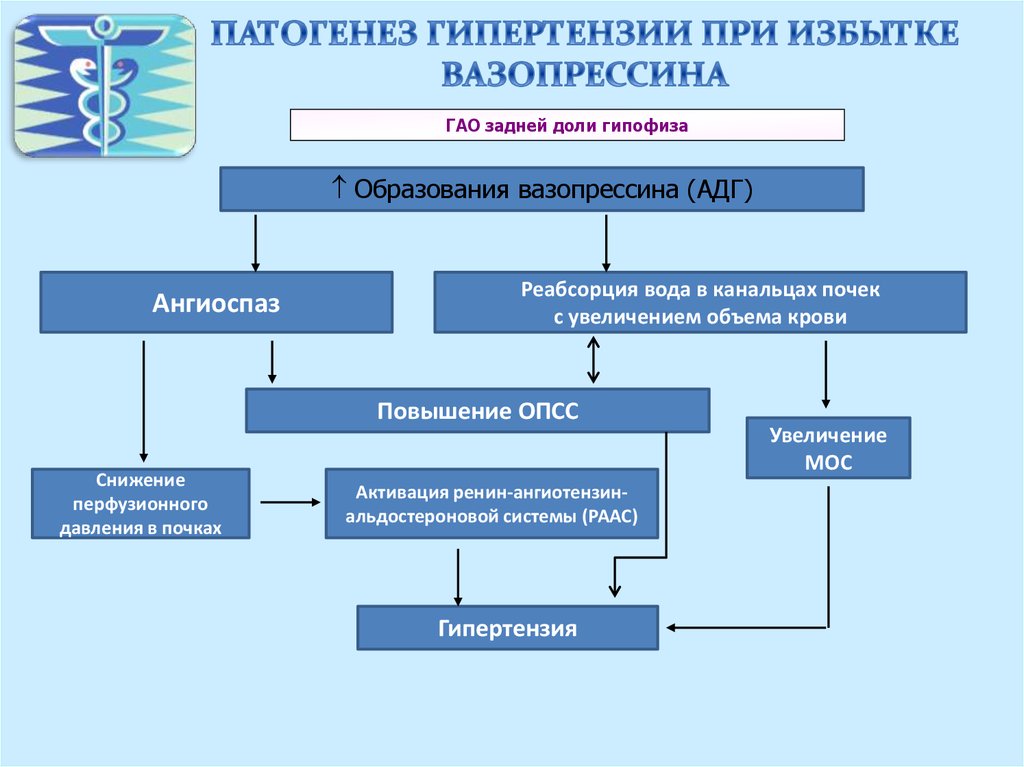
Основное место экспрессии V1-рецепторов, приводящей к вазоконстрикции, – гладкая мускулатура сосудов. В физиологических концентрациях АДГ не влияет на АД, а вазопрессорный эффект проявляется при выбросе больших количеств гормона на фоне резкого падения АД (при кровопотере, шоке). V1-рецепторы найдены также в мозговом слое почек, печени и мозге (гипокамп, гипоталамус). В гепатоцитах АДГ стимулирует гликогенолиз и глюконеогенез. Кроме того, АДГ, взаимодействуя с V1-рецепторами в ЦНС, усиливает память. Активация тромбоцитарных V1-рецепторов способствует их агрегации. V3-рецепторы локализованы в кортикотрофах аденогипофиза, их стимуляция способствует повышению секреции адренокортикотропного гормона.
Регуляция секреции АДГ
Вазопрессин синтезируется в супраоптических и паравентрикулярных ядрах гипоталамуса.
Далее гормон образует комплексы со специфическими белками-носителями (нейрофизинами)
и транспортируется по аксонам через супраоптикогипофизарный тракт в нейрогипофиз, где
происходит его освобождение под действием различных стимулов.
В физиологических условиях главным фактором, регулирующим секрецию вазопрессина,
является осмолярность плазмы. Осморецепторы гипоталамуса чувствительны к колебаниям
осмолярности – сдвиг всего на 1% приводит к заметным изменениям секреции вазопрессина.
При снижении осмолярности плазмы ниже порогового уровня (около 280 мосм/кг) секреция
гормона тормозится, что приводит к выведению большого объема максимально разведенной
мочи. Когда осмолярность достигает приблизительно 295 мосм/кг, концентрация АДГ
становится достаточной для обеспечения максимального антидиуретического эффекта (объем
мочи
Секреция АДГ зависит от объема циркулирующей крови (ОЦК) и регулируется
барорецепторами легочных артерий (барорецепторы системы низкого давления), аорты и
сонных артерий (барорецепторы системы высокого давления).
При вазовагальных приступах, кетоацидозе, острой гипоксии и укачивании, проявляющихся таким основным симптомом, как тошнота, уровень АДГ может возрастать в 100-1000 раз. К факторам, стимулирующим выделение АДГ, также относят острую гипогликемию, стресс (болевой, эмоциональный), физическую нагрузку, повышение температуры ядра тела, никотин, некоторые лекарственные препараты (стимуляторы β-адренорецепторов, холиномиметики, цитостатики, фенобарбитал, карбамазепин, клофибрат, хлорпропамид). Угнетают его секрецию снижение температуры тела, предсердный натрийуретический гормон, глюкокортикоиды, алкоголь, блокаторы β-адренорецепторов, холинолитики, морфин.
Абсолютная или относительная недостаточность АДГ и несахарный диабет
Под этими названиями объединяют несколько заболеваний с разной этиологией, для которых
характерна гипотоническая полиурия – выделение большого количества мочи с низким
удельным весом. Это может быть обусловлено дефицитом АДГ (центральный несахарный
диабет), резистентностью почек к АДГ (нефрогенный несахарный диабет), чрезмерным
потреблением воды (нервная полидипсия).
Это может быть обусловлено дефицитом АДГ (центральный несахарный
диабет), резистентностью почек к АДГ (нефрогенный несахарный диабет), чрезмерным
потреблением воды (нервная полидипсия).
Диагностика
В диагностике несахарного диабета существенное место занимают анамнестические данные и
жалобы. Так, в первую очередь необходимо убедиться, имеют ли место патологическая
полиурия и полидипсия (превышающая 2 л/м2/сут).
Полиурия возникает, когда секреция АДГ становится недостаточной для обеспечения концентрационной способности почек, т. е. снижается более чем на 75%. Гиперосмолярность плазмы, обусловленная полиурией, компенсируется полидипсией. Независимо от тяжести полиурии полидипсия может поддерживать осмолярность плазмы на нормальном уровне. Нарушение механизма формирования ощущения жажды или ограничение потребления жидкости являются причинами гиперосмолярности плазмы и гипернатриемии у больного несахарным диабетом.
Таким образом, главные симптомы несахарного диабета – полиурия и полидипсия.
 Объем
мочи колеблется от нескольких литров в сутки при парциальном центральном несахарном
диабете (с частичным дефицитом АДГ) до 20 литров в сутки при полном центральном
несахарном диабете (с отсутствием АДГ), причем полиурия возникает, как правило,
внезапно. Больные пьют очень много и обычно предпочитают холодные напитки. Если
потребление жидкости ограничивают, то осмолярность плазмы быстро возрастает и
появляются симптомы поражения ЦНС (раздражительность, заторможенность, атаксия,
гипертермия и кома).
Объем
мочи колеблется от нескольких литров в сутки при парциальном центральном несахарном
диабете (с частичным дефицитом АДГ) до 20 литров в сутки при полном центральном
несахарном диабете (с отсутствием АДГ), причем полиурия возникает, как правило,
внезапно. Больные пьют очень много и обычно предпочитают холодные напитки. Если
потребление жидкости ограничивают, то осмолярность плазмы быстро возрастает и
появляются симптомы поражения ЦНС (раздражительность, заторможенность, атаксия,
гипертермия и кома). Неврологические симптомы при несахарном диабете гипоталамического генеза включают головные боли, рвоту, ограничение полей зрения. Гипопитуитаризм гипоталамического происхождения часто ассоциирован с несахарным диабетом. 70% пациентов с несахарным диабетом вследствие опухолей гипофиза/гипоталамуса имеют дефицит соматотропного гормона (СТГ) и 30% – дефицит других гормонов аденогипофиза.
 Новорожденные с несахарным диабетом вследствие перинатальных гипоталамических
повреждений теряют в весе, развивается гипернатриемия. У детей грудного возраста
ведущими симптомами являются повторные эпизоды гипернатриемии и рвоты. Летальные
исходы связаны с комой и судорогами. Дети плохо растут, страдают от анорексии и рвоты
при приеме пищи. Дети могут предпочитать воду молоку. Частой причиной обращения к
врачу становится задержка умственного развития. Эти симптомы – следствие хронической
гиповолемии и гиперосмолярности плазмы крови. Осмолярность мочи никогда не бывает
высокой. К моменту установления диагноза ребенок обычно имеет выраженный дефицит
веса, сухую и бледную кожу, у него отсутствуют потоотделение и слезоотделение. Полиурия
может вызывать энурез, никтурия нарушает сон, приводит к усталости. Явная
гипертоническая дегидратация возникает только при недостатке питья.
Новорожденные с несахарным диабетом вследствие перинатальных гипоталамических
повреждений теряют в весе, развивается гипернатриемия. У детей грудного возраста
ведущими симптомами являются повторные эпизоды гипернатриемии и рвоты. Летальные
исходы связаны с комой и судорогами. Дети плохо растут, страдают от анорексии и рвоты
при приеме пищи. Дети могут предпочитать воду молоку. Частой причиной обращения к
врачу становится задержка умственного развития. Эти симптомы – следствие хронической
гиповолемии и гиперосмолярности плазмы крови. Осмолярность мочи никогда не бывает
высокой. К моменту установления диагноза ребенок обычно имеет выраженный дефицит
веса, сухую и бледную кожу, у него отсутствуют потоотделение и слезоотделение. Полиурия
может вызывать энурез, никтурия нарушает сон, приводит к усталости. Явная
гипертоническая дегидратация возникает только при недостатке питья.Лабораторные диагностические критерии несахарного диабета: большой объем мочи (как правило, > 3 л/сут), гипостенурия, то есть удельный вес мочи во всех порциях за сутки меньше 1008 при отсутствии азотемии, низкий уровень АДГ в плазме крови, не соответствующий ее осмолярности.
Существенное значение в диагностике центрального несахарного диабета имеет МРТ головного мозга. В норме нейрогипофиз представляет собой область яркого свечения на Т1- взвешенных снимках. Яркое пятно нейрогипофиза отсутствует или слабо прослеживается при центральной форме несахарного диабета вследствие сниженного синтеза вазопрессина. Кроме того, с помощью МРТ выявляют опухоли, пороки развития гипоталамо-гипофизарной области, при которых может иметь место несахарный диабет.
Лечение
Цель лечения – возмещение дефицита АДГ, чаще всего для этого используют десмопрессин –
препарат АДГ пролонгированного действия. Антидиуретический эффект его длится 8-20
часов, вазопрессорный эффект минимален. Детям и взрослым препарат назначают в виде
капель в нос или в виде аэрозоля для интраназального введения. Лучше начинать лечение
вечером, чтобы подобрать наименьшую эффективную дозу, предотвращающую никтурию.
Обычно достаточно 5-10 мкг десмопрессина 1-2 раза в сутки.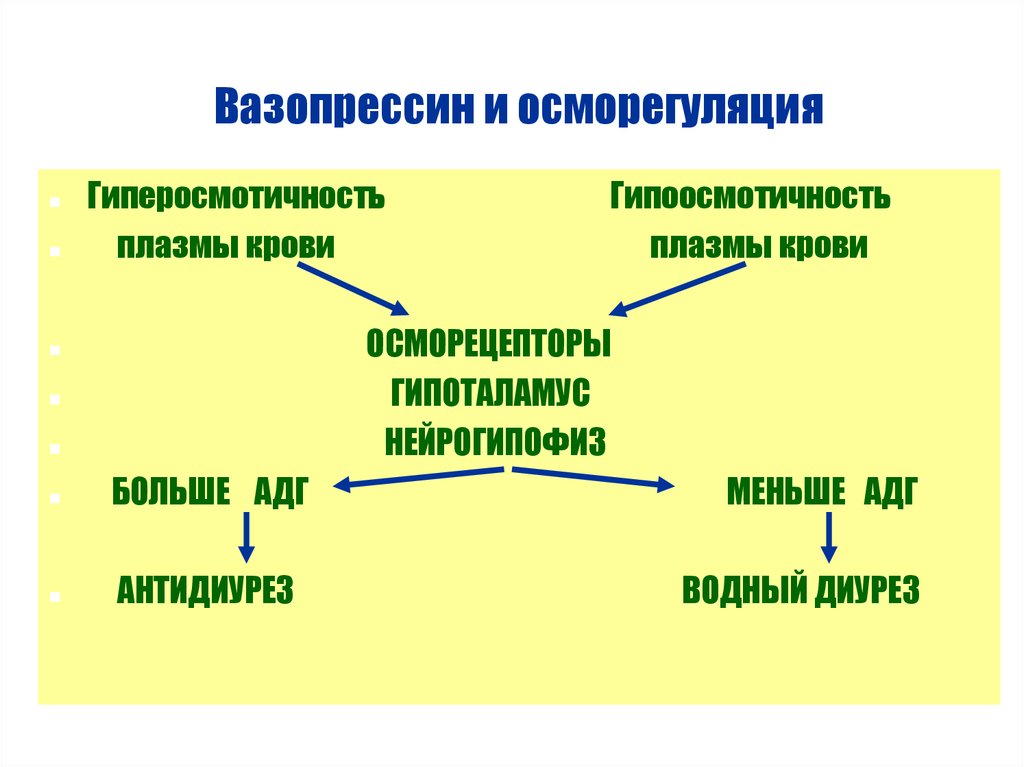
Можно назначать хлорпропамид, так как он не только усиливает действие АДГ на почечные
канальцы, но и стимулирует секрецию АДГ. Хлорпропамид назначают внутрь в дозах 250-
500 мг/сут. Стимулируют секрецию АДГ клофибрат и карбамазепин, последний также
повышает чувствительность почек к АДГ.
Нефрогенный несахарный диабет
Это – синдром гипотонической полиурии, обусловленный резистентностью почек к
антидиуретическому действию АДГ. Полиурия возникает, когда чувствительность почек к
АДГ снижается настолько, что физиологические концентрации вазопрессина не могут
обеспечить концентрирование мочи. Основные признаки таковы:
1. Нормальная скорость клубочковой фильтрации и канальцевой экскреции.
2. Гипостенурия.
3. Нормальный или повышенный уровень АДГ.
4. Лечение препаратами АДГ не повышает осмолярности и не уменьшает объема мочи.
Как и центральный несахарный диабет, нефрогенный несахарный диабет может быть
наследственным или приобретенным. Наследственная форма заболевания проявляется, как
правило, уже у грудных детей. Возможные причины приобретенного нефрогенного
несахарного диабета: гипокалиемия, гиперкальциемия, серповидноклеточная анемия,
обструкция мочевых путей, а также прием лекарственных средств (например, лития,
демеклоциклина или метоксифлурана).
Наследственная форма заболевания проявляется, как
правило, уже у грудных детей. Возможные причины приобретенного нефрогенного
несахарного диабета: гипокалиемия, гиперкальциемия, серповидноклеточная анемия,
обструкция мочевых путей, а также прием лекарственных средств (например, лития,
демеклоциклина или метоксифлурана).
Главная черта нефрогенного несахарного диабета – пассивная реабсорбция воды в
дистальных канальцах и собирательных трубочках не усиливается под влиянием АДГ, что
приводит к гипостенурии. Нефрогенный несахарный диабет может быть обусловлен
нарушением связывания АДГ с рецепторами типа V2, нарушением передачи сигнала от
рецепторов либо обоими дефектами.
При наследственном нефрогенном несахарном диабете нарушена передача сигнала от
рецепторов АДГ к аденилатциклазе, продукция цАМФ в ответ на действие АДГ снижена,
количество водных каналов в клетках дистальных канальцев и собирательных трубочек не
увеличивается под воздействием АДГ. Гиперкальциемия и гипокалиемия также нарушают
концентрационную способность почек. Гипокалиемия стимулирует образование
простагландина E2 и тем самым препятствует активации аденилатциклазы. Гиперкальциемия
уменьшает содержание растворенных веществ в мозговом веществе почек и блокирует
взаимодействие рецепторов АДГ с аденилатциклазой. Демеклоциклин и литий подавляют
образование цАМФ, стимулированное АДГ.
Гиперкальциемия и гипокалиемия также нарушают
концентрационную способность почек. Гипокалиемия стимулирует образование
простагландина E2 и тем самым препятствует активации аденилатциклазы. Гиперкальциемия
уменьшает содержание растворенных веществ в мозговом веществе почек и блокирует
взаимодействие рецепторов АДГ с аденилатциклазой. Демеклоциклин и литий подавляют
образование цАМФ, стимулированное АДГ.
При нефрогенном несахарном диабете неэффективны ни препараты АДГ (вазопрессин,
аргипрессин, липрессин, десмопрессин), ни препараты, которые стимулируют секрецию АДГ
или усиливают его действие на почки. Наиболее действенный метод лечения – назначение
тиазидных диуретиков и умеренное ограничение потребления соли. Тиазидные диуретики
можно использовать также при центральном несахарном диабете. Эти препараты блокируют
реабсорбцию хлорида в дистальных извитых канальцах и тем самым уменьшают содержание
натрия в крови. В ответ на снижение концентрации натрия реабсорбция воды в
проксимальных отделах нефрона усиливается, а объем жидкости, поступающей в
собирательные трубочки, уменьшается. Ограничение потребления соли увеличивает эффект
тиазидных диуретиков.
Ограничение потребления соли увеличивает эффект
тиазидных диуретиков.
Ингибиторы синтеза простагландинов (ибупрофен, индометацин, аспирин) уменьшают
поступление растворенных веществ в дистальные отделы нефрона, тем самым снижая объем
и увеличивая осмолярность мочи. Эти препараты можно использовать как дополнительное
средство лечения нефрогенного несахарного диабета.
Несахарный диабет у беременных
Это преходящее состояние, обусловленное разрушением АДГ в крови плацентарными
ферментами, например цистиниламинопептидазой. Несахарному диабету у беременных
свойственны признаки как центрального, так и нефрогенного несахарного диабета. Полиурия
возникает обычно в третьем триместре, а после родов проходит без лечения. Уровень АДГ
снижен. Полиурия не уменьшается при лечении вазопрессином или аргипрессином, но
поддается лечению десмопрессином.
Нервная полидипсия
Это заболевание называют также первичной полидипсией, или дипсогенным несахарным
диабетом.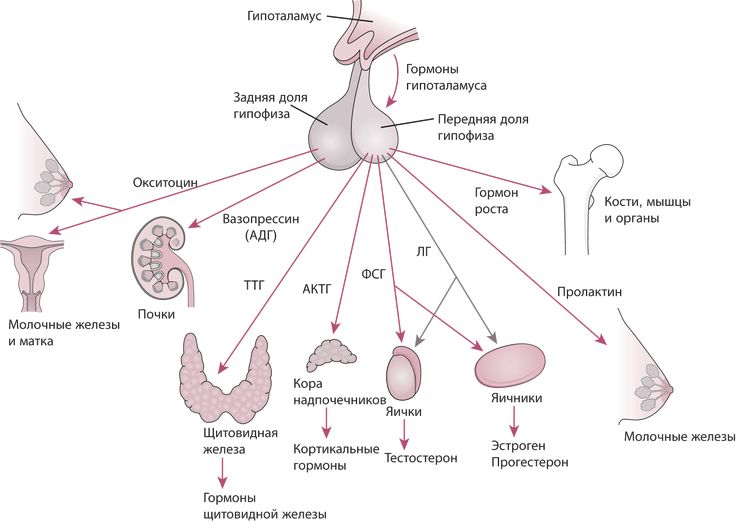
Заболевание может быть обусловлено как органическими, так и функциональными
нарушениями отделов ЦНС, контролирующих секрецию АДГ и утоление жажды.
Полидипсия возникает, когда порог осмолярности плазмы для утоления жажды становится
более низким, чем порог осмолярности для запуска секреции АДГ (в норме порог
осмолярности плазмы для утоления жажды выше, чем для секреции АДГ). Такое извращение
нормального соотношения между жаждой и секрецией АДГ обусловливает стойкую
полидипсию и полиурию.
Диагностические критерии нервной полидипсии: гипоосмолярность плазмы, мочи,
сниженный уровень АДГ в плазме.
Для лечения нервной полидипсии препараты АДГ и тиазидные диуретики применять нельзя,
так как они ограничивают выведение воды, не уменьшая ее потребления, и потому могут
вызывать тяжелую водную интоксикацию. Основные усилия врача должны быть направлены
на коррекцию поведения и психики больного с тем, чтобы уменьшить потребление жидкости.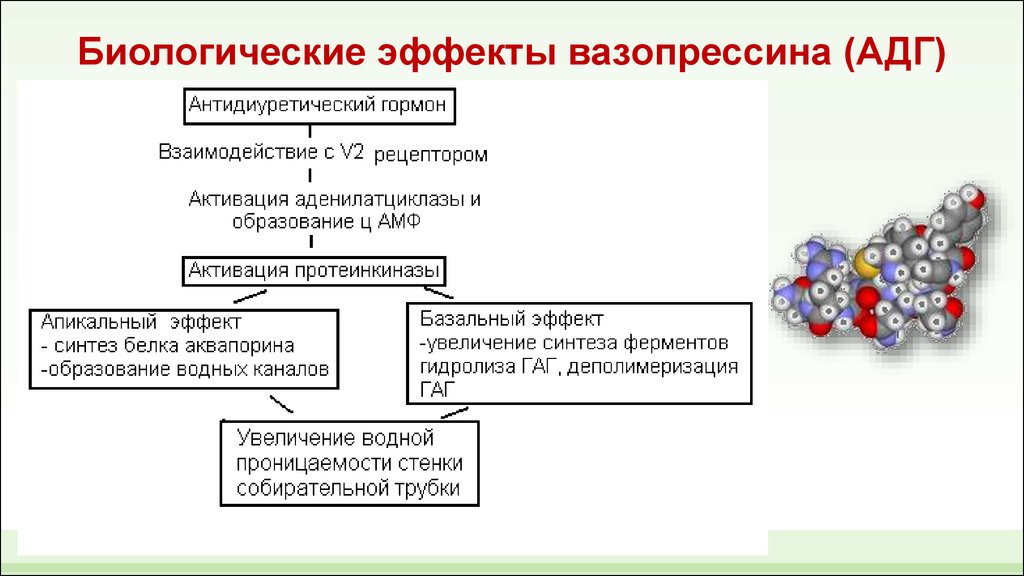
Дифференциальная диагностика полиурических синдромов
Без специальных проб трудно определить причину полиурии, но некоторые симптомы все же
помогают установить предварительный диагноз. Большой объем мочи, гипоосмолярность
плазмы (
Проба с ограничением жидкости – самый распространенный и надежный метод
дифференциальной диагностики полиурических синдромов. Ограничение потребления
жидкости приводит к дегидратации, которая в норме стимулирует максимальную секрецию
АДГ, что, в свою очередь, обусловливает максимальное концентрирование мочи. Поэтому
введение АДГ не повышает осмолярности мочи.
В норме и при нервной полидипсии на фоне дегидратации осмолярность мочи превышает
осмолярность плазмы. После введения АДГ осмолярность мочи повышается незначительно
(менее чем на 10%). Если осмолярность мочи, несмотря на явную дегидратацию, не
превышает осмолярность плазмы, нервную полидипсию можно исключить. При центральном
или нефрогенном несахарном диабете осмолярность мочи на фоне дегидратации не
превышает осмолярности плазмы. После введения АДГ у здоровых людей и больных с
нервной полидипсией осмолярность мочи возрастает менее чем на 10%, у больных с
центральным несахарным диабетом – более чем на 50%, а у больных с нефрогенным
несахарным диабетом – менее чем на 50%.
При центральном
или нефрогенном несахарном диабете осмолярность мочи на фоне дегидратации не
превышает осмолярности плазмы. После введения АДГ у здоровых людей и больных с
нервной полидипсией осмолярность мочи возрастает менее чем на 10%, у больных с
центральным несахарным диабетом – более чем на 50%, а у больных с нефрогенным
несахарным диабетом – менее чем на 50%.
Если диагноз центрального несахарного диабета установлен, обязательно проводят КТ или
МРТ гипоталамо-гипофизарной области, чтобы исключить краниофарингиому, менингиому и
инфильтративный процесс.
Синдром гиперсекреции АДГ
Другие названия: синдром неадекватной продукции АДГ, гипергидропексический синдром,
синдром Пархона, несахарный антидиабет.
Этот синдром характеризуется гипонатриемией, гипоосмолярностью плазмы и выведением
достаточно концентрированной мочи (осмолярность мочи обычно > 300 мосмоль/кг).
Синдром может быть обусловлен избыточной нерегулируемой секрецией АДГ или
усилением его действия на клетки дистальных отделов нефрона. Судя по результатам
определения АДГ в плазме больных с гипонатриемией, синдром гиперсекреции АДГ – самая
частая причина гипонатриемии. Действительно, уровень АДГ повышен у 95% больных с
гипонатриемией.
Судя по результатам
определения АДГ в плазме больных с гипонатриемией, синдром гиперсекреции АДГ – самая
частая причина гипонатриемии. Действительно, уровень АДГ повышен у 95% больных с
гипонатриемией.
Постоянная секреция АДГ или повышение чувствительности клеток почек к АДГ вызывают
задержку потребляемой жидкости, гипонатриемию и некоторое увеличение объема
внеклеточной жидкости, которое приводит к торможению абсорбции натрия в
проксимальных почечных канальцах и к натрийурезу. Кроме того, увеличение ОЦК
стимулирует секрецию предсердного натрийуретического гормона, который также
способствует натрийурезу. Усиливается экскреция мочевой кислоты, вследствие чего
развивается гипоурикемия, часто наблюдаемая при синдроме гиперсекреции АДГ.
Причиной синдрома могут быть любые поражения ЦНС, включая объемные процессы,
инфекции, сосудистые и метаболические нарушения. Синдром гиперсекреции АДГ может
быть обусловлен усилением физиологических неосмотических стимулов секреции АДГ
(например, при острых психозах, стрессах и болях).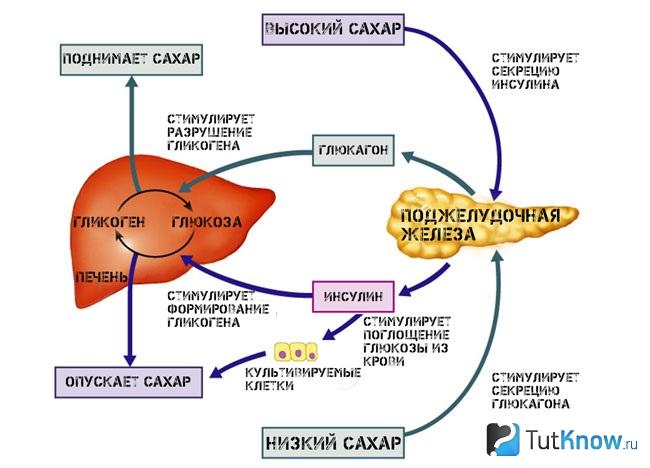
Способность почек выводить воду нарушена почти у 66% больных с мелкоклеточным раком
легкого. Клетки опухоли секретируют АДГ или АДГ-подобные пептиды (обладающие
иммунологическими и биологическими свойствами АДГ), а также нейрофизин. Дыхание под
постоянным положительным давлением, активируя барорецепторы системы низкого
давления, также может вызывать синдром гиперсекреции АДГ.
В клинической картине на первом плане – симптомы водной интоксикации. Выраженность
симптомов зависит от степени и скорости развития гипонатриемии и гипергидратации. При
острой гипонатриемии, когда концентрация натрия в сыворотке падает ниже 120 ммоль/л,
синдром гиперсекреции АДГ проявляется сонливостью, судорогами, комой и часто
заканчивается смертью. Содержание воды в головном мозге при хронической гипонатриемии
увеличивается не столь значительно, как при острой гипонатриемии (при снижении
концентрации натрия до одного и того же уровня), поэтому хроническая гипонатриемия
характеризуется меньшей смертностью, чем острая. При хронической гипонатриемии, даже
если концентрация натрия не достигает 125 ммоль/л, у половины больных симптомы
отсутствуют, а частота смертельных исходов очень мала. Когда концентрация натрия у таких
больных снижается до 115-120 ммоль/л, возникают тошнота, рвота, головная боль и боль в
животе, пропадает аппетит.
При хронической гипонатриемии, даже
если концентрация натрия не достигает 125 ммоль/л, у половины больных симптомы
отсутствуют, а частота смертельных исходов очень мала. Когда концентрация натрия у таких
больных снижается до 115-120 ммоль/л, возникают тошнота, рвота, головная боль и боль в
животе, пропадает аппетит.
Диагноз синдрома гиперсекреции АДГ устанавливают, если у больного обнаружена
гипонатриемия на фоне разведения мочи ниже максимального. Исключают гиповолемию,
болезни щитовидной железы, надпочечников, печени, сердца и почек. У больных с тяжелой
сердечной, почечной недостаточностью и циррозом печени с асцитом, а также после
введения больших объемов гипотонических растворов обычно развивается гипонатриемия
разведения. Гипонатриемия наблюдается и при состояниях, сопровождающихся потерей
соли, таких, как диарея, болезни почек, сахарный диабет. Однако в этих случаях (за
исключением болезней почек) обычно имеются признаки дегидратации и снижение
экскреции натрия с мочой.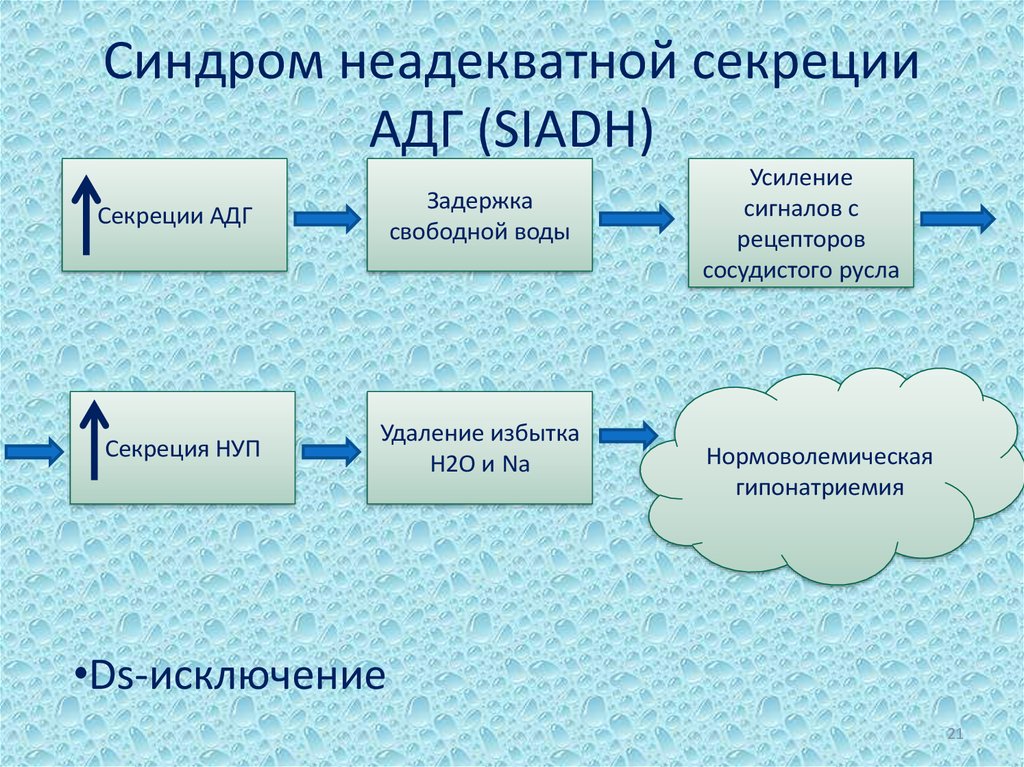 При синдроме гиперсекреции АДГ и почечной недостаточности
уровень натрия в моче превышает 20 мэкв/л, а его экскреция выше 1%. У больных с
синдромом гиперсекреции АДГ ограничение жидкости до 600-800 мл/сут на протяжении 2-3
суток должно приводить к снижению веса на 1,8-2,7 кг, исчезновению гипонатриемии и
прекращению потери натрия с мочой. В то же время при сольтеряющих формах почечной
недостаточности ограничение жидкости не устраняет ни гипонатриемию, ни потерю соли с
мочой.
При синдроме гиперсекреции АДГ и почечной недостаточности
уровень натрия в моче превышает 20 мэкв/л, а его экскреция выше 1%. У больных с
синдромом гиперсекреции АДГ ограничение жидкости до 600-800 мл/сут на протяжении 2-3
суток должно приводить к снижению веса на 1,8-2,7 кг, исчезновению гипонатриемии и
прекращению потери натрия с мочой. В то же время при сольтеряющих формах почечной
недостаточности ограничение жидкости не устраняет ни гипонатриемию, ни потерю соли с
мочой.
Цель лечения при синдроме гиперсекреции АДГ – нормализация осмолярности плазмы и
устранение гипергидратации. Тактика лечения зависит от скорости развития гипонатриемии
(острая или хроническая), концентрации натрия в сыворотке и состояния больного.
При острой гипонатриемии или обострении хронической гипонатриемии (концентрация
натрия в сыворотке
Ограничение потребления жидкости – лучший способ лечения хронического синдрома
гиперсекреции АДГ, который позволяет нормализовать концентрацию натрия в сыворотке
практически у всех больных с исходной концентрацией натрия > 120 ммоль/л. Объем
потребляемой жидкости должен быть равен сумме объема выделяемой мочи и скрытых
потерь жидкости. Если больному трудно выдерживать такой режим, можно назначить
демеклоциклин или литий. Оба препарата блокируют действие АДГ на собирательные
трубочки, но литий для лечения синдрома гиперсекреции АДГ применяют редко, поскольку
он вызывает много побочных эффектов. Демеклоциклин безопаснее, но при его применении
необходимо обращать особое внимание на функцию печени, так как при печеночной
недостаточности препарат накапливается в организме и оказывает нефротоксическое
действие. Следует подчеркнуть, что лечить надо основное заболевание, обусловливающее
гипонатриемию.
Объем
потребляемой жидкости должен быть равен сумме объема выделяемой мочи и скрытых
потерь жидкости. Если больному трудно выдерживать такой режим, можно назначить
демеклоциклин или литий. Оба препарата блокируют действие АДГ на собирательные
трубочки, но литий для лечения синдрома гиперсекреции АДГ применяют редко, поскольку
он вызывает много побочных эффектов. Демеклоциклин безопаснее, но при его применении
необходимо обращать особое внимание на функцию печени, так как при печеночной
недостаточности препарат накапливается в организме и оказывает нефротоксическое
действие. Следует подчеркнуть, что лечить надо основное заболевание, обусловливающее
гипонатриемию.
- Номер:
- № 107 ноябрь — Общетерапевтический номер
24. 03.2023
Пульмонологія та оториноларингологіяТерапія та сімейна медицинаГоловний і лицевий біль при риносинуситі: диференційна діагностика та лікування
03.2023
Пульмонологія та оториноларингологіяТерапія та сімейна медицинаГоловний і лицевий біль при риносинуситі: диференційна діагностика та лікування
Запальні захворювання приносових пазух часто супроводжуються больовими відчуттями – головним і лицевим болем [1]. Неконтрольований гострий біль значно знижує якість життя пацієнтів із цими захворюваннями: спричиняє психоемоційні розлади, знижує працездатність і соціальну активність, сприяє хронізації больового синдрому і збільшує вартість лікування [2]. Призначаючи знеболювальний засіб пацієнту з риносинуситом (РС), варто враховувати не лише аналгетичну ефективність препарату, а й швидкість початку дії, частоту побічних ефектів, вплив на основні ланки патогенезу захворювання тощо….
24.03.2023 ПсихіатріяТерапія та сімейна медицинаБуспірон у нейропсихіатрії: огляд літератури
Буспірон є новим анксіолітичним препаратом із додатковим слабким антидепресивним і антипсихотичним ефектами (на українському фармацевтичному ринку представлений препаратом Спітомін® компанії «Егіс»). Наразі це єдиний представник класу серотонінергічних анксіолітиків – азапіронів.
…
Наразі це єдиний представник класу серотонінергічних анксіолітиків – азапіронів.
…
24.03.2023 ДіагностикаТерапія та сімейна медицинаРоль тромбоцитів у запаленні й інфекції
Тромбоцити являють собою без’ядерні гемопоетичні клітини дископодібної форми. Вони відіграють значну роль у системі гемостазу [1]. Проте останнім десятиліттям з’явилися наукові дані про те, що їхні функції виходять за рамки системи згортання крові. Нещодавні дослідження показують їхню участь як одного із ключових регуляторів у запаленні та внутрішньосудинному імунітеті….
24.03.2023 НеврологіяДосвід застосування піримідинових нуклеотидів у разі периферичних нейропатій
Периферична нейропатія є одним із найпоширеніших неврологічних порушень, що супроводжує гетерогенну групу етіологічно різних захворювань і зумовлена ураженням або дисфункцією периферичних нервів. Хронічний больовий синдром і розлад моторних функцій при цьому кваліфікують як руйнівний стан, що негативно позначається на якості життя через його тяжкість, хронічний перебіг і резистентність до традиційних анальгетиків….
Хронічний больовий синдром і розлад моторних функцій при цьому кваліфікують як руйнівний стан, що негативно позначається на якості життя через його тяжкість, хронічний перебіг і резистентність до традиційних анальгетиків….
Фруктоза, соль и недостаток питья: главные факторы, вызывающие ожирение
Разбираемся, почему чрезмерное потребление фруктозы ведет к ожирению и что еще может усугубить проблему
Фруктоза в рационе человека и ее вред
Фруктоза — это один из типов углеводов, который не только дает организму энергию, но и активирует ускоренную генерацию и накопление жира и настраивает организм на поиск пищи. По сути фруктоза запускает эволюционный механизм, который помогал нашим предкам выживать и запасаться жиром перед зимним сезоном, когда добывать пищу становилось сложнее. Правда, в современных условиях, когда у людей есть практически неограниченный доступ к пище, этот механизм скорее вредит.
Фруктоза, полученная из фруктов, в небольших количествах безвредна для человека. Но проблема в том, что огромное количество фруктозы люди получают из столового сахара и продуктов, которые его содержат. Их потребление составляет 15% калорий в рационе среднестатистического американца.
Но проблема в том, что огромное количество фруктозы люди получают из столового сахара и продуктов, которые его содержат. Их потребление составляет 15% калорий в рационе среднестатистического американца.
Кроме того, фруктоза может вырабатываться внутри организма, и ее производство увеличивается при высоком уровне глюкозы в крови. Он, в свою очередь, повышается, когда мы едим много углеводной пищи: риса, круп, картофеля и белого хлеба.
В общем, современный человек потребляет гораздо больше фруктозы, чем было задумано природой, а метаболизм плохо справляется с такой нагрузкой. Это может привести к целому ряду последствий для здоровья:
- повышению давления;
- повышению уровня холестерина, который «забивает» артерии и ведет к проблемам с сердцем;
- скоплению жира в печени;
- развитию ожирения и диабета.
Соль тоже повышает выработку фруктозы
Помимо того, что люди получают чрезмерное количество фруктозы из сладостей, есть еще одна проблема. Ученые обнаружили, что избыток соли в организме тоже увеличивает уровень фруктозы. Это открытие они совершили, изучая дневную песчанку — полукилограммового грызуна, который живет в соленых болотах и пустынях Северной Африки. Он питается стеблями солероса — растения, немного похожего на спаржу. И это довольно странный выбор: сок солероса по концентрации соли не уступает морской воде, а питательных веществ в нем крайне мало. Но недавние исследования позволили понять, почему дневная песчанка может испытывать тягу к этому растению.
Ученые обнаружили, что избыток соли в организме тоже увеличивает уровень фруктозы. Это открытие они совершили, изучая дневную песчанку — полукилограммового грызуна, который живет в соленых болотах и пустынях Северной Африки. Он питается стеблями солероса — растения, немного похожего на спаржу. И это довольно странный выбор: сок солероса по концентрации соли не уступает морской воде, а питательных веществ в нем крайне мало. Но недавние исследования позволили понять, почему дневная песчанка может испытывать тягу к этому растению.
Песчаная крыса получает с пищей совсем немного углеводов. А диета с высоким содержанием соли помогает ей преобразовать их во фруктозу. Это помогает животному выжить в условиях нехватки пищи и пресной воды. Когда песчанку помещают в неволю и дают ей обычный рацион грызунов, примерно на 50% состоящий из углеводов, у нее быстро развивается ожирение и диабет.
Исследователи отметили, что соль оказывает аналогичный эффект и на людей. При ее увеличенном потреблении она ускоряет преобразование других видов углеводов во фруктозу, что ведет ко всем сопутствующим проблемам со здоровьем.
Высокий уровень фруктозы притупляет жажду
Кроме соли ученые выявили еще один механизм набора веса. Дело в том, что переизбыток фруктозы влияет на потребление жидкости — пить хочется меньше. Из-за недостатка питья повышается уровень вазопрессина — гормона, который помогает почкам удерживать воду для регулирования объема мочи. Он также стимулирует производство жира. Другие исследования подтверждают: большинство людей с избыточным весом действительно употребляют недостаточно воды.
Порочный круг ожирения
Из-за фруктозы, нехватки воды и чрезмерного употребления соли формируется порочный круг.
- Люди потребляют слишком много фруктозы.
- Соленая пища еще сильнее увеличивает выработку фруктозы в организме.
- Фруктоза активизирует накопление жира и заставляет пить меньше воды.
- Нехватка воды повышает уровень вазопрессина.
- Вазопрессин стимулирует производство жира.
- В итоге вес повышается.
Вазопрессин: дефицит, избыток и синдром неадекватной секреции антидуретического гормона
. 1979; 23(2-3):125-9.
1979; 23(2-3):125-9.
дои: 10.1159/000181621.
H H Ньюсом-младший
- PMID: 108606
- DOI: 10.1159/000181621
Х. Х. Ньюсом-младший. Нефрон. 1979.
. 1979; 23(2-3):125-9.
дои: 10.1159/000181621.
Автор
H H Ньюсом-младший
- PMID: 108606
- DOI:
10.
 1159/000181621
1159/000181621
Абстрактный
Гипоталамо-нейрогипофизарная система поддерживает осмоляльность плазмы в узких пределах. Это также важный механизм поддержания нормального объема жидкости в организме. Система оказывает свое влияние посредством высвобождения или ингибирования вазопрессина (антидиуретического гормона, АДГ), который действует на почки, уменьшая экскрецию воды. Дефицит АДГ обычно обусловлен гипоталамо-нейрогипофизарным поражением (центральный несахарный диабет) или нечувствительностью почек к АДГ (нефрогенный несахарный диабет). Эти пациенты, если их не лечить, имеют предсказуемый результат обезвоживания, гиперосмоляльности, гиповолемии и возможной смерти в тяжелых случаях. С другой стороны, избыток АДГ при синдроме неадекватной секреции АДГ по разным причинам способствует задержке воды, гипоосмоляльности и гипонатриемии, которые, если их не лечить, могут прогрессировать до судорог, комы и смерти. Очевидно, важно точно диагностировать эти патологические состояния гидратации. Мало того, что начало лечения в целом зависит от распознавания заболевания, но каждый тип патологического состояния гидратации имеет специфическое лечение, которое вознаграждает как пациента, так и врача за эффективное исправление проблемы.
Очевидно, важно точно диагностировать эти патологические состояния гидратации. Мало того, что начало лечения в целом зависит от распознавания заболевания, но каждый тип патологического состояния гидратации имеет специфическое лечение, которое вознаграждает как пациента, так и врача за эффективное исправление проблемы.
Похожие статьи
[Гормональная диснатриемия].
Караджа П., Десайлуд Р. Караджа П. и др. Энн Эндокринол (Париж). 2013 Октябрь 74 Приложение 1:S42-51. doi: 10.1016/S0003-4266(13)70020-9. Энн Эндокринол (Париж). 2013. PMID: 24356291 Французский.
Нарушения эффективной регуляции осмоляльности при заболеваниях центральной нервной системы и возможные методы мониторинга.
Балик М.
 , Казда А.
Балик М. и др.
Кас Лек Ческ. 1998 г., 24 августа; 137 (16): 488–92.
Кас Лек Ческ. 1998.
PMID: 9748751
Обзор.
Чешский язык.
, Казда А.
Балик М. и др.
Кас Лек Ческ. 1998 г., 24 августа; 137 (16): 488–92.
Кас Лек Ческ. 1998.
PMID: 9748751
Обзор.
Чешский язык.[Заболевания задней доли гипофиза].
Йошида С. Йошида С. Нихон Найка Гаккай Засси. 1988 г., сен; 77 (9): 1373-7. doi: 10.2169/naika.77.1373. Нихон Найка Гаккай Засси. 1988. PMID: 2977609 Японский язык. Аннотация недоступна.
Предсердный натрийуретический пептид у больных с синдромом неадекватной секреции антидиуретического гормона и несахарным диабетом.
Камои К., Эбе Т., Кобаяши О., Исида М., Сато Ф., Араи О., Тамура Т., Такаги А., Ямада А., Исибаши М. и др. Камои К. и др.
 J Clin Endocrinol Metab. 1990 май; 70 (5): 1385-90. doi: 10.1210/jcem-70-5-1385.
J Clin Endocrinol Metab. 1990.
PMID: 2139879
J Clin Endocrinol Metab. 1990 май; 70 (5): 1385-90. doi: 10.1210/jcem-70-5-1385.
J Clin Endocrinol Metab. 1990.
PMID: 2139879Несахарный диабет и синдром неадекватного антидиуретического гормона у пациентов в критическом состоянии.
Харруа А., Ансти Дж. Р. Харроис А. и др. Крит Уход Клин. 2019 апр; 35(2):187-200. doi: 10.1016/j.ccc.2018.11.001. Epub 2019 28 января. Крит Уход Клин. 2019. PMID: 30784603 Обзор.
Посмотреть все похожие статьи
термины MeSH
вещества
Антидиуретический гормон | Вы и ваши гормоны от Общества эндокринологов
Альтернативные названия антидиуретического гормона
Вазопрессин; аргинин вазопрессин; АВП; АДГ
Что такое антидиуретический гормон?
Антидиуретический гормон вырабатывается особыми нервными клетками, находящимися в области основания мозга, известной как гипоталамус. Нервные клетки транспортируют гормон вниз по своим нервным волокнам (аксонам) к задней доле гипофиза, где гормон высвобождается в кровоток. Антидиуретический гормон помогает контролировать кровяное давление, действуя на почки и кровеносные сосуды. Его наиболее важная роль заключается в сохранении объема жидкости в организме за счет уменьшения количества воды, выделяемой с мочой. Он делает это, позволяя воде из мочи возвращаться в организм в определенной области почек. Таким образом, больше воды возвращается в кровоток, повышается концентрация мочи и снижается потеря воды. Более высокие концентрации антидиуретического гормона вызывают сужение (сужение) кровеносных сосудов, что приводит к повышению артериального давления. Дефицит жидкости в организме (обезвоживание) может быть окончательно восстановлен только за счет увеличения потребления воды.
Нервные клетки транспортируют гормон вниз по своим нервным волокнам (аксонам) к задней доле гипофиза, где гормон высвобождается в кровоток. Антидиуретический гормон помогает контролировать кровяное давление, действуя на почки и кровеносные сосуды. Его наиболее важная роль заключается в сохранении объема жидкости в организме за счет уменьшения количества воды, выделяемой с мочой. Он делает это, позволяя воде из мочи возвращаться в организм в определенной области почек. Таким образом, больше воды возвращается в кровоток, повышается концентрация мочи и снижается потеря воды. Более высокие концентрации антидиуретического гормона вызывают сужение (сужение) кровеносных сосудов, что приводит к повышению артериального давления. Дефицит жидкости в организме (обезвоживание) может быть окончательно восстановлен только за счет увеличения потребления воды.
Как контролируется антидиуретический гормон?
Высвобождение антидиуретического гормона из гипофиза в кровоток контролируется рядом факторов. Уменьшение объема крови или низкое кровяное давление, возникающие при обезвоживании или кровотечении, обнаруживаются датчиками (барорецепторами) в сердце и крупных кровеносных сосудах. Они стимулируют выброс антидиуретического гормона. Секреция антидиуретического гормона происходит также при повышении концентрации солей в кровотоке, например, в результате недостаточного употребления воды в жаркий день. Это обнаруживается специальными нервными клетками в гипоталамусе (осморецепторами), которые имитируют высвобождение антидиуретического гормона из гипофиза. . Антидиуретический гормон также высвобождается при жажде, тошноте, рвоте и боли и поддерживает объем жидкости в кровотоке во время стресса или травмы. Алкоголь препятствует высвобождению антидиуретического гормона, что вызывает увеличение образования мочи и обезвоживание.
Уменьшение объема крови или низкое кровяное давление, возникающие при обезвоживании или кровотечении, обнаруживаются датчиками (барорецепторами) в сердце и крупных кровеносных сосудах. Они стимулируют выброс антидиуретического гормона. Секреция антидиуретического гормона происходит также при повышении концентрации солей в кровотоке, например, в результате недостаточного употребления воды в жаркий день. Это обнаруживается специальными нервными клетками в гипоталамусе (осморецепторами), которые имитируют высвобождение антидиуретического гормона из гипофиза. . Антидиуретический гормон также высвобождается при жажде, тошноте, рвоте и боли и поддерживает объем жидкости в кровотоке во время стресса или травмы. Алкоголь препятствует высвобождению антидиуретического гормона, что вызывает увеличение образования мочи и обезвоживание.
Что произойдет, если у меня слишком много антидиуретического гормона?
Высокий уровень антидиуретического гормона заставляет почки удерживать воду в организме. Существует состояние, называемое синдромом неадекватной секреции антидиуретического гормона (SIADH; тип гипонатриемии), при котором выделяется избыток антидиуретического гормона, когда он не нужен (дополнительную информацию см. в статье о гипонатриемии). При этом состоянии чрезмерная задержка воды разжижает кровь, что приводит к характерно низкой концентрации солей. Чрезмерный уровень антидиуретического гормона может быть вызван побочными эффектами лекарств и заболеваниями легких, грудной клетки, гипоталамуса или гипофиза. Некоторые опухоли (особенно рак легких) могут продуцировать антидиуретический гормон.
Существует состояние, называемое синдромом неадекватной секреции антидиуретического гормона (SIADH; тип гипонатриемии), при котором выделяется избыток антидиуретического гормона, когда он не нужен (дополнительную информацию см. в статье о гипонатриемии). При этом состоянии чрезмерная задержка воды разжижает кровь, что приводит к характерно низкой концентрации солей. Чрезмерный уровень антидиуретического гормона может быть вызван побочными эффектами лекарств и заболеваниями легких, грудной клетки, гипоталамуса или гипофиза. Некоторые опухоли (особенно рак легких) могут продуцировать антидиуретический гормон.
Что произойдет, если у меня слишком мало антидиуретического гормона?
Низкий уровень антидиуретического гормона приводит к тому, что почки выделяют слишком много воды. Объем мочи увеличивается, что приводит к обезвоживанию организма и падению артериального давления. Низкий уровень антидиуретического гормона может указывать на поражение гипоталамуса или гипофиза или на первичную полидипсию (компульсивное или чрезмерное питье воды).

 1159/000181621
1159/000181621 , Казда А.
Балик М. и др.
Кас Лек Ческ. 1998 г., 24 августа; 137 (16): 488–92.
Кас Лек Ческ. 1998.
PMID: 9748751
Обзор.
Чешский язык.
, Казда А.
Балик М. и др.
Кас Лек Ческ. 1998 г., 24 августа; 137 (16): 488–92.
Кас Лек Ческ. 1998.
PMID: 9748751
Обзор.
Чешский язык. J Clin Endocrinol Metab. 1990 май; 70 (5): 1385-90. doi: 10.1210/jcem-70-5-1385.
J Clin Endocrinol Metab. 1990.
PMID: 2139879
J Clin Endocrinol Metab. 1990 май; 70 (5): 1385-90. doi: 10.1210/jcem-70-5-1385.
J Clin Endocrinol Metab. 1990.
PMID: 2139879