Трипаносома: меры предупреждения заражения человека
Тропические заболевания не входят в число патологий, с которыми ежедневно приходится сталкиваться жителям европейских стран. Однако отдых в странах Африки и Южной Америки приобретает все большую популярность, поэтому каждому человеку не помешает знать, что за паразит трипаносома и какую болезнь он может вызвать.
СодержаниеПоказать
- 1 О возбудителе
- 1.1 Опасность для людей
- 1.2 Особенности трипаносом
- 2 Формы заболевания у человека
- 2.1 Признаки заражения и стадии болезни
- 3 Распространение инфекции
- 4 Меры по предупреждению
- 4.1 Последние эпидемии
- 4.2 Работа ВОЗ
- 5 Диагностика
- 6 Лечение
О возбудителе
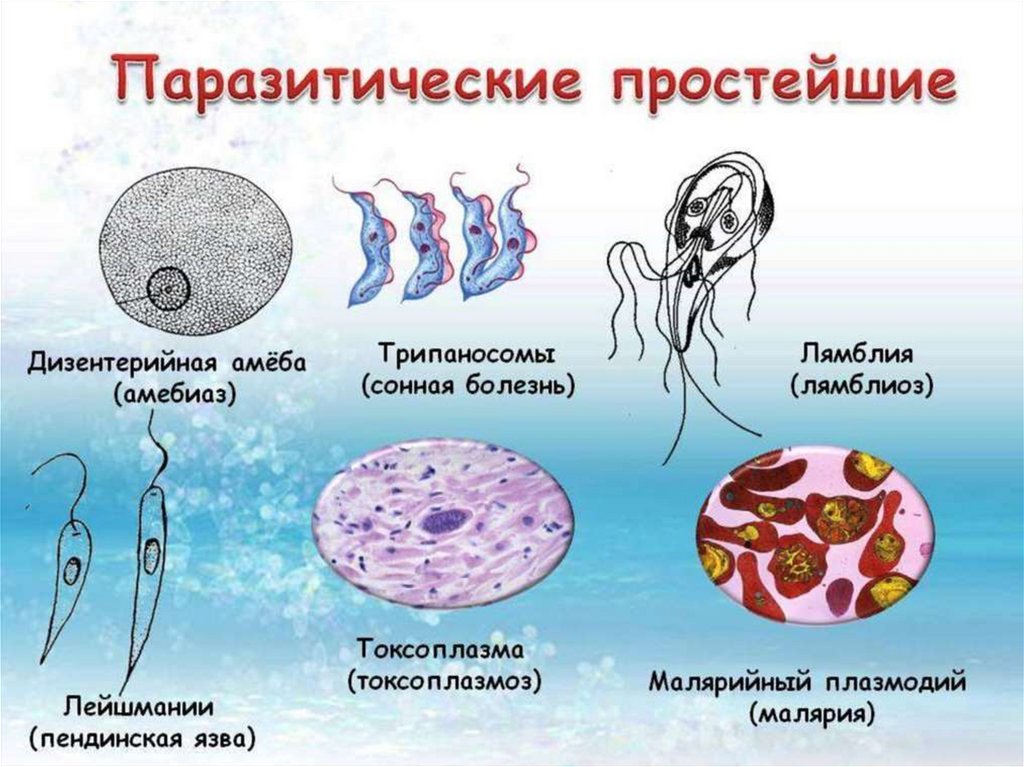
Что такое Трипаносома (trypanosoma sp)? Это простейшие одноклеточные паразиты, представители класса жгутиковых. Микроорганизмы имеют вытянутую форму.
Рассмотреть их можно только под микроскопом, размер взрослой особи составляет 12-70 микрон.
На рисунках и фото можно увидеть, что эти одноклеточные имеют довольно сложное строение. В единственной клетке содержится полный набор ДНК с генетическим материалом.
Как передвигается трипаносома? На поверхности клетки расположено множество жгутиков, которые позволяют микроорганизму достаточно быстро перемещаться.
Систематическое положение – классификация паразитов
| Царство | Одноклеточные простейшие или протозойные |
|---|---|
| Подцарство | Саркожгутиконосцы |
| Класс | Жгутиковые |
| Подкласс | Животные жгутиконосцы |
| Отряд | Трипаносомы |
Какую болезнь вызывает трипаносома? При заражении людей или животных диагностируют опасное заболевание, которое называется трипаносомоз.
Опасность для людей
Систематика трипаносом включает в себя несколько видов, но для человека опасными являются три разновидности микроорганизмов.
Автор:
Трофимова Ирина
Не разобрался в материале статьи или нужна помощь? Задай вопрос сейчас и получи на него ответ.
Виды трипаносом:
- brucei gambiense – возбудитель гамбийской формы африканского трипаносомоза. Обитает в западной части африканского континента, Габон, Ангола, Камерун.
- brucei rhodesiense – провоцирует развитие родезийской формы патологии. Где обитают? Танзания, Эфиопия, Замбия.
- cruzi – вызывает американский трипаносомоз. Места обитания паразитов – Чили, Мексика, Боливия, Аргентина, Парагвай.
Все виды трипаносом относятся к облигатным паразитам. Это означает, что вне организма человека или животного их размножение невозможно. Только хозяин обеспечивает их необходимым питанием.
Особенности трипаносом
Весь род возбудителей трипаносомоза обладает механизмом защиты от иммунной системы хозяина. При обнаружении паразитов защитными антителами у них активизируются гены, которые отвечают за выработку гликопротеина.
В результате на поверхности клетки микроорганизма происходит смена гликопротеинов, иммунная системы не может обнаружить паразитов, что дает им возможность свободно размножаться.
Особенности жизненного цикла и строения разных видов трипаносом
| Стадии развития | Возбудители африканского трипаносомоза | Возбудители американского трипаносомоза |
|---|---|---|
| I | Эпимастигота – паразитирует в организме насекомых | Подвижная промастигота |
| II | Трипомастигота – имеет удлиненную форму, передвигается при помощи жгутиков. Может жить и размножаться только в организме человека или других позвоночных животных | Амастигота – имеет круглую форму, жгутики отсутствуют. Живет и размножается только в клетках промежуточного хозяина, постепенно разрывает оболочку, заражает соседние клетки |
| III | Эпимастигота – промежуточный этап развития | |
| IV | Трипомастигота – агент заражения, в этом виде возвращается в тело насекомого |
Трипаносомы размножаются только при помощи продольного деления.
Как и всяким анаэробным паразитам, им не нужно потреблять кислород из крови, они обходятся цитохромным дыханием. Нет у микроорганизмов и рта, поскольку они впитывают питательные вещества всем телом.
Формы заболевания у человека
Африканские виды трипаносомоза называются сонной болезнью, американская форма – болезнью Шагаса. Клинические проявления обоих видов патологий во многом схожи.
Средняя продолжительность инкубационного периода составляет 7-21 день.
В организм человека проникают метациклические трипомастиготы – инвазионная стадия развития трипаносом. Они быстро разносятся с кровотоком по всему организму, попадают в лимфу и спинномозговую жидкость, где происходит бинарное деление микроорганизмов.
Признаки заражения и стадии болезни
Симптомы:
- На начальном этапе в месте укуса образуется узелок с плотной структурой – трипаносомный шанкр. При африканской форме болезни – на любом участке тела, при американской – преимущественно на лице.

- Через 20-25 дней паразиты минуют защитный барьер, проявляются симптомы интоксикации и воспалительного процесса. Повышение температурных показателей, частые приступы лихорадки, увеличение лимфоузлов. Когда трипаносомы поражают нервную систему, возникает сильная головная боль, парестезия, нарушение сна.
- Постепенно трипаносомы проникают в головной мозг, развивается последняя стадия патологии, для которой характерны разнообразные неврологические симптомы. Бессонница ночью, но сильная сонливость днем, заторможенность, судорожный синдром, паралич.
У больного меняется походка, лицо становится похожим на маску, наблюдается обильное слюнотечение, беспокоят постоянная головная боль, нарушение слухового, обонятельного, вкусового восприятия.
Трипаносомы проникают практически во все внутренние органы человека, возбудители американской формы поражают миокард. По этой причине при болезни Шагаса помимо основных симптомов наблюдаются признаки сердечных патологий – боль в груди, одышка, тахикардия, обмороки.
Уровень смертности при заражении трипаносомами довольно высокий, особенно без правильного и своевременного лечения. Летальный исход болезни наступает из-за критического снижения массы тела или сердечной недостаточности.
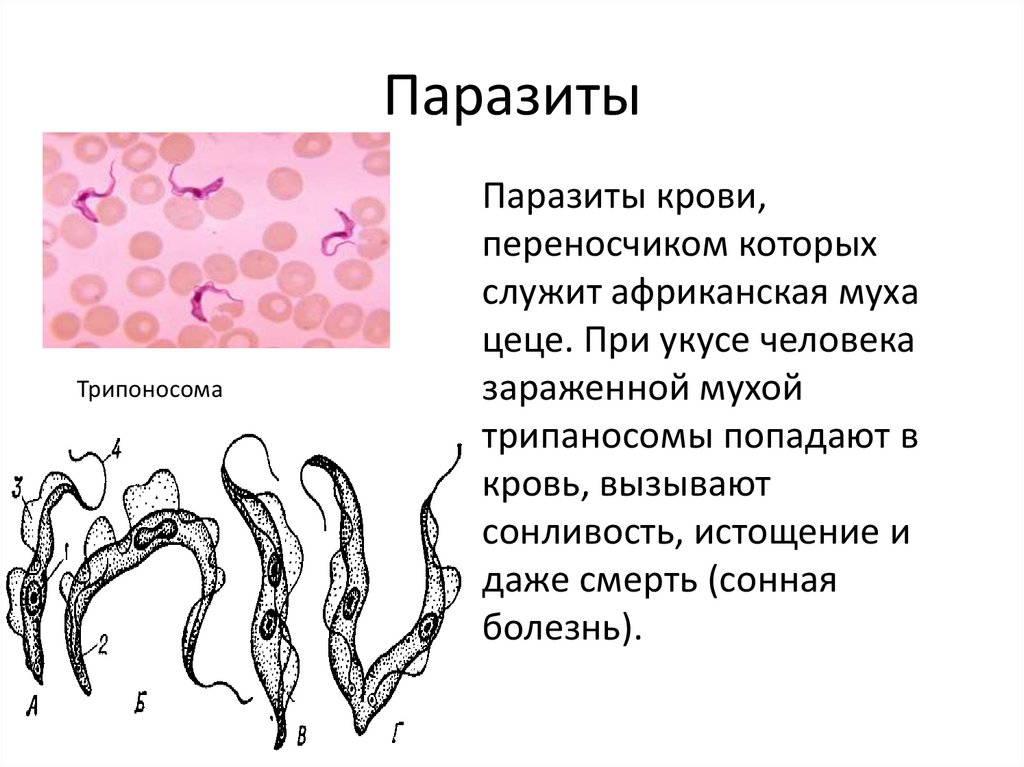
Переносчик африканских разновидностей трипаносом – муха цеце, американской формы – триатомовый клоп. Инфицирование людей и животных происходит после укуса зараженным насекомым.
Распространение инфекции
Трипаносомоз носит эндемический характер в 36 странах африканского континента. В группу риска попадает более 70 млн. человек. Чаще всего случаи сонной болезни выявляют у жителей Демократической Республики Конго.
В странах Южной Америки эпидемии случаются значительно реже, хотя инфекция распространена в 21 латиноамериканской стране.
Меры по предупреждению
Чтобы избежать заражения трипаносомами, при посещении стран необходимо пользоваться специальными защитными средствами от насекомых. После возвращения обязательно пройти обследование, даже если явные симптомы заболевания отсутствуют.
Эффективный метод профилактики болезни – инъекции Пентамидина. Однако этот метод имеет существенное ограничение, поскольку защищает только от возбудителей гамбийской формы сонной болезни.
Последние эпидемии
Последняя эпидемия сонной болезни была зарегистрирована в Африке в 1970 году и длилась более 20 лет. До этого было еще 2 крупных пандемии – в 1896 и 1920 году.
Работа ВОЗ
Для предупреждения распространения трипаносомоза ВОЗ предпринимает различные меры. Раньше заболевание ежегодно диагностировали у 25 тысяч человек. Примерно 70% заболевших умирали без своевременной терапии.
Благодаря постоянной борьбе с паразитами число заболевших сейчас значительно уменьшилось. В 2015 году было зафиксировано всего 2804 случая болезни.
Методы профилактики:
- своевременное выявление носителей инфекции среди людей и животных;
- борьба с насекомыми, переносчиками трипаносом;
- обработка помещений, близлежащих территорий инсектицидными препаратами;
- установка москитных сеток в местах отдыха;
- обеспечение медицинской помощи больным людям;
- применение эффективных и современных лекарственных средств в терапии.

ВОЗ постоянно занимается бесплатным распространением лекарств против трипаносомоза на территории эндемичных регионов.
Диагностика
Для постановки точного диагноза врач учитывает эпидемиологические факторы, особенности симптоматики болезни.
Для определения типа возбудителя инфекции назначают следующие анализы:
- микроскопическое исследование мазка крови;
- общий и биохимический анализ крови;
- изучение содержимого пораженных лимфатических узлов, спинномозговой жидкости;
- биопсию тканей трипаносомного шанкра;
- иммунологические тесты на выявление антител к трипаносомам.
В ходе диагностики трипаносомоз дифференцируют от тропической малярии, клещевого боррелиоза, серозного менингита, сердечно-сосудистых патологий.
Лечение
Терапию трипаносомоза проводят при помощи противопротозойных лекарственных препаратов. Все средства имеют высокий уровень токсичности, применять их можно только под наблюдением врача.
Биология жгутиковых простейших существ, включая трипаносом:
Краткое описание эффективных лекарств против африканского вида болезни:
- Меларсопрол – эффективен на любом этапе развития болезни, но лекарство может спровоцировать развитие реактивной энцефалопатии, что в 10% случаев приводит к летальному исходу;
- Эфлорнитин – самое современное средство против сонной болезни, негативные реакции во время терапии возникают редко;
- Сурамин – назначают при начальной стадии сонной болезни, препарат негативно влияет на работу мочевого пузыря, нередко вызывает сильные аллергические реакции;
- Пентамидин – подходит только для лечения начальной стадии заболевания, хорошо переносится, но побочные эффекты возникают часто;
- Нитрофуран и его производные.

При диагностировании болезни Шагаса назначают Нифуртимокс, Бензнидазол.
Медикаментозное лечение помогает добиться стойкой ремиссии болезни, но полностью избавиться от трипаносом невозможно, поскольку паразиты заражают клетки.
Все методы профилактики не позволяют уничтожить трипаносому повсеместно и избежать заражения паразитами. Поэтому при составлении маршрута поездки в экзотические страны необходимо проконсультироваться с паразитологом, специалистом по тропическим заболеваниям.
При появлении первых неприятных симптомов не откладывать визит к врачу. Только внимательное отношение к собственному здоровью поможет избежать опасных последствий сонной болезни.
Сонная болезнь (африканский трипаносомоз) и ее симптомы
Чтобы проверить, есть ли у вас паразиты — добавьте в стакан воды всего 1 ложку…
Читать далее
Тёплый, влажный климат Африки способствует комфортному самочувствию трипаносомы. Попадая в тело нового хозяина, паразит провоцирует развитие сонной, часто приводящей к летальному исходу, болезни. Согласно данным Всемирной организации здоровья, ежегодно обращаются за помощью около 40 тыс. пострадавших. Информация о симптомах, методах лечения, мерах профилактики необходима для своевременного предупреждения инфекции.
Попадая в тело нового хозяина, паразит провоцирует развитие сонной, часто приводящей к летальному исходу, болезни. Согласно данным Всемирной организации здоровья, ежегодно обращаются за помощью около 40 тыс. пострадавших. Информация о симптомах, методах лечения, мерах профилактики необходима для своевременного предупреждения инфекции.
Что провоцирует патологические изменения?
Существует два похожих вида паразитарных микроорганизмов, провоцирующих африканский трипаносомоз. Проникая внутрь организма при укусе мухи цеце, Tr. Gambiense приводит к развитию гамбийской формы поражения, называемой ещё западноафриканской. Tr. Rhoresiense вызывает его родезийский (восточноафриканский) вариант.
Возбудителя смертельно опасного африканского трипаносомоза относят к протистам. Тело одноклеточного паразита, состоящего из клетки-митохондрии, напоминающее веретено, достигает длины 12-70 мкм.
Элементы строения – это:
- Цитоплазма, заполняющая клетку.

- Ядро.
- Кинетопласт, содержащий молекулы ДНК.
- Кинетосома, служащая началом флагеллоподия.
- Мембрана ундулирующая, придающая паразитарному микроорганизму гибкость, нужную для перемещения.
Покрытием является оболочка высокой прочности, состоящая из гликопротеина. Она обладает свойством полного изменения мембраны. Таким образом, одноклеточный паразит защищается от иммунной системы инфицированного, внутри организма коего происходит бесконтрольное размножение болезнетворных микроорганизмов.
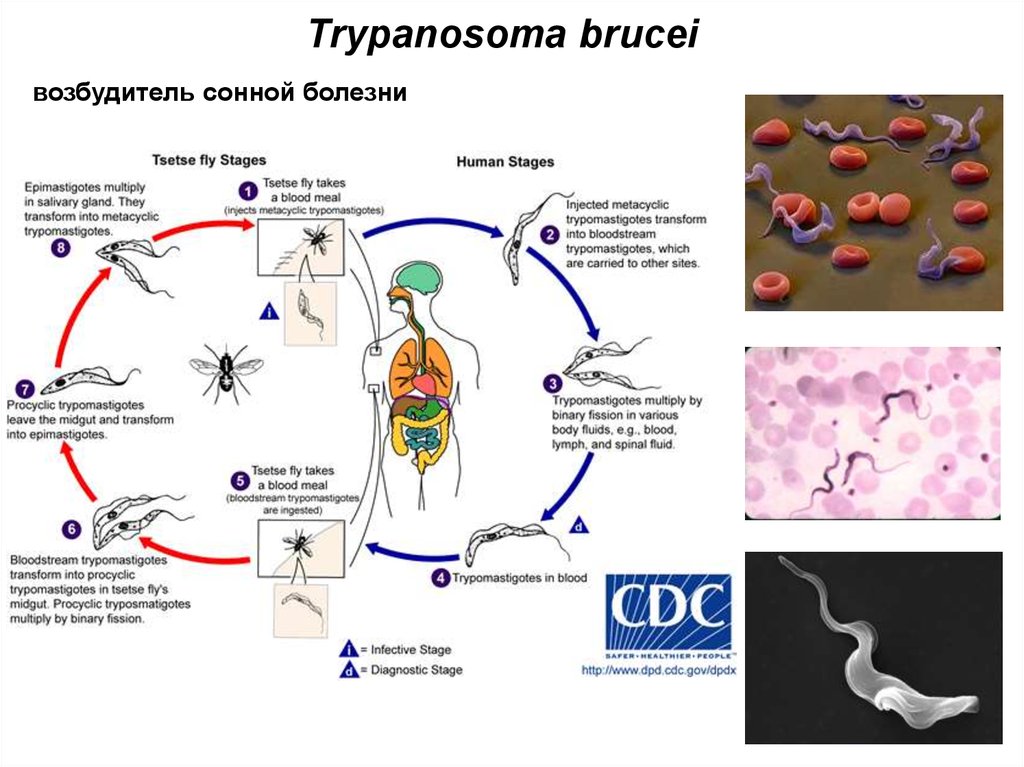
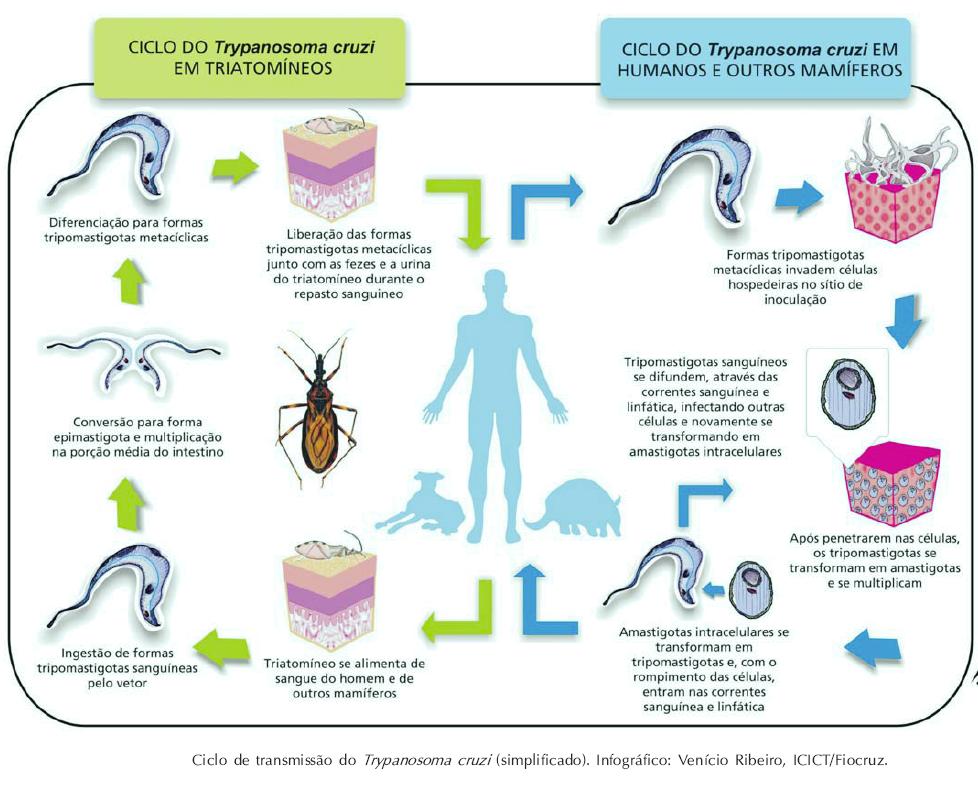
Жизненный цикл паразитирующего одноклеточного невозможен вне тела млекопитающего или мухи. Трипаносома не требует кислорода, развивается двумя этапами:
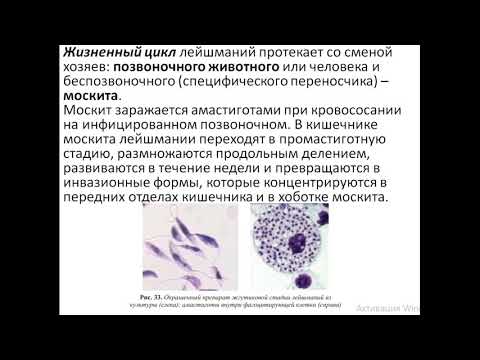
- Муха цеце – переносчик сонной болезни – становится опасной, кусая заражённых людей или животных. В результате в кишечник попадают болезнетворные микроорганизмы, начинают размножение, заканчивающееся переходом в эпимастиготы. На протяжении трёх недель паразит, вызывающий любую из форм трипаносомоза, перемещается в слюнные железы, где процесс деления не прекращается, приобретая инвазивную форму.
 Заканчивается рассматриваемый этап проникновением одноклеточного в хоботок насекомого.
Заканчивается рассматриваемый этап проникновением одноклеточного в хоботок насекомого. - При укусе заражённой мухой зрелые особи, возбуждающие сонную болезнь, из её хоботка попадают под кожу здорового человека. По истечению 10 дней начинают своё движение к лимфатической системе, а далее в кровь. Прикрепляясь к эритроцитам и лейкоцитам, могут попасть в любой орган.
Дойдя до лимфы, головного мозга или спинномозговой жидкости, паразитирующие микроорганизмы запускают процесс отравления, разрушения организма, что проявляется как африканская сонная болезнь. Высокая изменчивость поверхностных антигенов, которыми обладают простейшие, – причина частых рецидивов паразитемии.
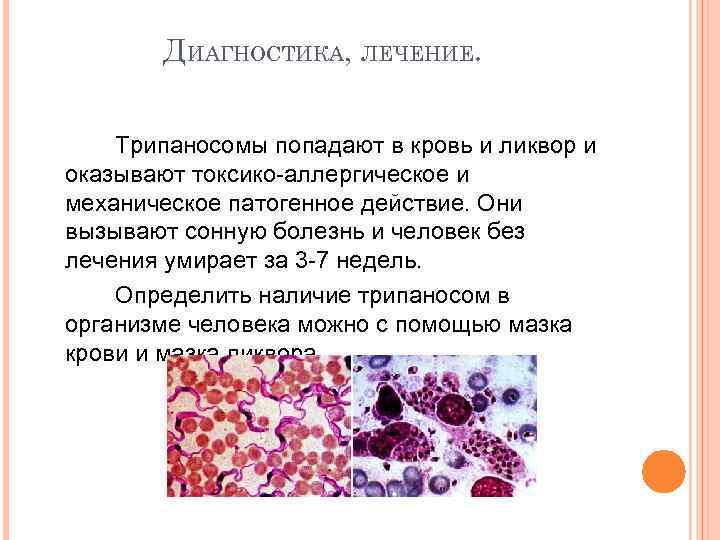
Диагностировать сонную болезнь не трудно, достаточно сдать анализ крови.
Будьте осторожны
По данным ВОЗ в мире заражены какими либо паразитарными болезнями более 4,5 млрд человек. Около двух сотен различных видов паразитов могут находится в организме человека, считают учёные. Среди них: гельминты, аскариды, острицы, лямблии, токсоплазмы, хламидии… Человек может не подозревать о болезни много лет. Поэтому число заражённых паразитами гораздо больше выявленных больных.
Поэтому число заражённых паразитами гораздо больше выявленных больных.
Самый распространенный симптом указывающий на присутствие паразитов в организме — неприятный запах изо рта. Узнайте от своих близких, пахнет ли у вас изо рта утром (до того, как почистите зубы). Если да, то с вероятностью 99% вы заражены паразитами.
80% всех существующих заболеваний либо напрямую вызваны паразитами, либо являются следствием жизнедеятельности паразитов в нашем организме!
Заражение паразитами приводит к неврозам, быстрой утомляемости, резкими перепадами настроениями, в дальнейшим начинаются и более серьезные заболевания.
У мужчин: паразиты вызывают: простатит, импотенцию, аденому, цистит, песок, камни в почках и мочевом пузыре.
У женщин: боли и воспаление яичников. Развиваются фиброма, миома, фиброзно-кистозная мастопатия, воспаление надпочечников, мочевого пузыря и почек.
Спокойно, не нужно бежать в аптеку и скупать дорогие лекарства, которые, по словам фармацевтов, вытравят всех паразитов. Большинство этих лекарств малоэффективны, Для полного избавления от паразитов придется принимать препараты купленные в аптеке, несколько раз, что нанесет вред организму..
Большинство этих лекарств малоэффективны, Для полного избавления от паразитов придется принимать препараты купленные в аптеке, несколько раз, что нанесет вред организму..
Хотите знать что делать? Для начала советуем почитать статью
Проявления патологии
Африканский трипаносомоз подразделяется на гамбийский и родезийский виды. Они обладают сходной симптоматикой, но имеют отличительные черты. Протекание болезни второй разновидности более острое. Заболевание развивается стремительно, истощая организм еще до проявления поражения лимфоузлов.
Гамбийский тип характеризуется периодической сменой обострений с латентным спокойствием. Иногда страдающий сонной болезнью, согласно латинской транскрипции [sonnaya bolezn], не ощущает симптомов патологических изменений. Они могут проявляться уже на стадии разрушения основных функций нервной системы.
Наличие болезнетворных микроорганизмов определяют при следующих признаках:
- В месте укуса формируется трипаносомный шанкр – болезненный узелок, где наблюдается воспалительный процесс.
 Через несколько недель происходит самозаживление.
Через несколько недель происходит самозаживление. - Лихорадка ремитирующего характера.
- Сильные головные боли, усиливающаяся слабость, бессонница.
- Стремительно развивающаяся тахикардия, артралгия.
- Район шеи становится местом локализации плотных увеличенных лимфатических узлов, по размерам напоминающих голубиное яйцо.
- Подкожная отёчность, вызывающая болевые ощущения.
Больные со светлым типом кожи наблюдают специфические, так называемые покраснения кольцевидной формы. Для всех инфицированных характерна высокая температура. Данная гемолимфатическая стадия патологии характеризуется резким уменьшением массы тела, при этом селезёнка, печень увеличиваются. Наблюдаются глазные поражения, которые выражаются кровоизлияниями, помутнениями, появлением рубцов.
Патология быстро развивается, поражает центральную нервную систему, провоцирует менингоэнцефалический период. Его основными симптомами являются особые, ярко выраженные состояния, среди которых:
- На лице у заболевшего отсутствующее выражение, он не проявляет желания к общению, нелюдим.

- Координация движений при данной патологии имеет значительные нарушения.
- Ухудшается состояние слуха, проблемы с обонянием, вкусовые ощущения отсутствуют, заболевшие безразлично относятся к пище.
Больной претерпевает значительные нарушения соотношения времени сна, бодрствования. Именно это дало название «сонная болезнь» данной патологии, её симптомы будут только усугубляться, если не оказать должной медицинской помощи.
Развитие инфекции ведёт к поражению всех органов, систем, что делает течение африканского трипаносомоза особо тяжёлым. Результатом сонной болезни являются судороги, транзиторные параличи. Нередки эпилептические припадки, кома. Итог – гибель инфицированного.
Методы диагностирования патологии
Своевременное диагностирование – залог успешного излечения любых патологий, среди них африканский трипаносомоз. Малярия, менингит, туберкулёз являются схожими по симптоматике с гамбийским типом, требуют определённой дифференциации. Нужно убрать из перечня патологий возможность заражения энцефалитом, токсоплазмозом. Перечисленные выше заболевания, септицемию, брюшной тиф необходимо исключить при установлении родезийской формы.
Нужно убрать из перечня патологий возможность заражения энцефалитом, токсоплазмозом. Перечисленные выше заболевания, септицемию, брюшной тиф необходимо исключить при установлении родезийской формы.
Больной сонной болезнью становится нелюдимым, постоянно спит и теряет обоняние.
Изучение спинномозговой жидкости, состояния крови, лимфы на возможность поражения их возбудителями рассматриваемого недуга производят путём микроскопических наблюдений за однородным и центрифугированным материалом. Используют серологическое тестирование. При подозрении на родезийский тип сонной болезни производят инфицирование грызунов. Положительный результат проявляется через день, когда возбудитель обнаруживается в их крови.
Проводя диагностику, обращают внимание на нахождение пациента в районах, имеющих эпидемическую опасность. Чаще всего это западные регионы африканского континента, восточные. Визуально устанавливают наличие увеличенных лимфатических узлов в области шеи. Подозрение усиливается, если наблюдаются приступы лихорадки, отёчности, постоянной сонливости. Сонная болезнь, выявленная на ранних этапах, излечивается быстрее. Глубокие стадии требуют длительного времени терапии, вот почему важно своевременно обратиться за медицинской помощью при появлении первых недомоганий, особенно при подозрении на трипаносомоз.
Сонная болезнь, выявленная на ранних этапах, излечивается быстрее. Глубокие стадии требуют длительного времени терапии, вот почему важно своевременно обратиться за медицинской помощью при появлении первых недомоганий, особенно при подозрении на трипаносомоз.
Методы терапии и предупреждения болезни
От степени развития инфицирования организма зависит использование медицинских препаратов, способных оказать нужное влияние на источник патологических изменений. На ранних стадиях африканский трипаносомоз преодолевают с помощью Пентамидина, Сурамина. Обладая побочными эффектами, они удовлетворительно переносятся больными.
Неврологические нарушения, определяющие вторую стадию, требуют применения Меларсопрола, основой для получения его является мышьяк. Тяжёлые побочные эффекты – не повод для отказа от лекарственного препарата, поскольку это действенное средство для спасения жизни. Хороший результат при лечении африканского трипаносомоза даёт терапевтическое воздействие Эфлорнитина, Нифурмитокса на инфицирование гамбийской формы. Дезинтоксикационное воздействие на патологию, а также гипосенсибилизирующую, симптоматическую терапию используют как важное дополнение.
Дезинтоксикационное воздействие на патологию, а также гипосенсибилизирующую, симптоматическую терапию используют как важное дополнение.
Наблюдение врача, точное выполнение рекомендаций крайне важно для выздоровления после данной смертельно опасной болезни. Пройдя лечение, пациенты на протяжении 2 лет находятся под постоянным медицинским контролем. Чтобы избежать рецидивов сонной болезни, производится периодическое исследование спинномозговой жидкости, поскольку инфекция ещё несколько месяцев может присутствовать.
Главнейшее из профилактических мероприятий, помогающее предупредить сонную болезнь, – это отказ от посещения эндемически опасных регионов, где в основном обитает муха цеце. Использование средств от укусов насекомых, а также инъекции Пентамидина внутримышечно, производимые один раз в 6 месяцев, помогут сохранить здоровье. Важно носить закрытую светлую одежду. Данные правила безопасности требуют беспрекословного выполнения, поскольку способствуют предупреждению смертельной инфекции, которую называют сонной.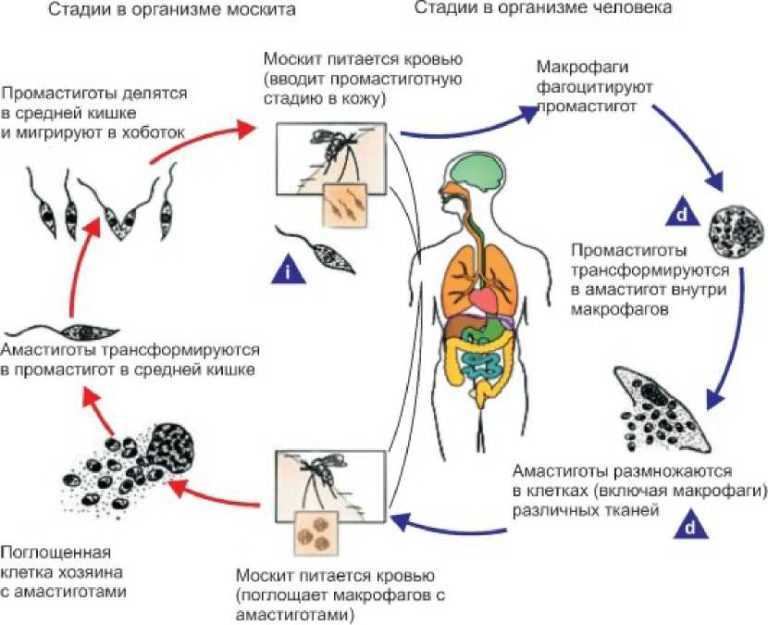
Рекомендации по борьбе с восточноафриканской сонной болезнью в Уганде
J Glob Infect Dis. 2010 янв-апрель; 2(1): 43–48.
doi: 10.4103/0974-777X.59250
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности
Восточноафриканская сонная болезнь, вызываемая Trypanosoma brucei rhodesiense , широко распространена в Уганде и представляет серьезную проблему для общественного здравоохранения в этом регионе. В этой публикации предпринята попытка предоставить ключевые компоненты для разработки стратегии общенациональной инициативы по обработке инсектицидами животных-резервуаров для борьбы с Т. б. родезийский .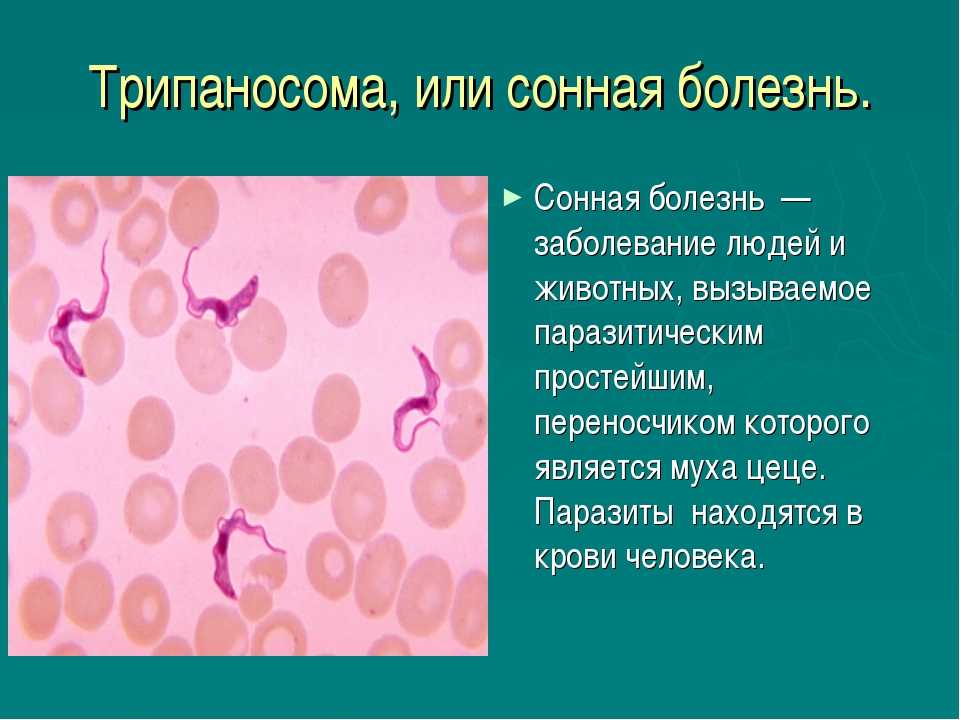 Содержание этой статьи будет сосредоточено на стратегиях борьбы с переносчиками на основе инсектицидов, системе мониторинга и оценки, а также на пробелах в знаниях, необходимых для будущих инициатив.
Содержание этой статьи будет сосредоточено на стратегиях борьбы с переносчиками на основе инсектицидов, системе мониторинга и оценки, а также на пробелах в знаниях, необходимых для будущих инициатив.
Ключевые слова: Восточноафриканская сонная болезнь, обработка инсектицидами, животный резервуар, мониторинг и оценка . Эпидемии произошли в течение 1901–1915, 1940–1946 и 1976–1989 гг.[1] В последнее время распространение сонной болезни в районы, которые ранее считались свободными от этой болезни, усилило потребность в эффективных стратегиях контроля, чтобы предотвратить будущие вспышки и ограничить лесные и человеческие очаги передачи. Спорадические вспышки сонной болезни недавно наблюдались за историческими географическими границами юго-востока Уганды, при этом сообщения в районе Сороти были связаны с занесением болезни в результате поголовья скота из эндемичных южных районов. Кроме того, исторические данные свидетельствуют о распространении сонной болезни со скоростью 5 км в год за последние 34 года на юго-востоке Уганды. [1] Эти тенденции предполагают изменение взаимодействия человека и переносчика и/или проникновение паразитов в ранее не затронутые регионы. Последние данные свидетельствуют о том, что внутреннее перемещение, свертывание программ контроля, изменение окружающей среды и миграция скота являются основными факторами, способствующими вышеупомянутым тенденциям.[1–5]
[1] Эти тенденции предполагают изменение взаимодействия человека и переносчика и/или проникновение паразитов в ранее не затронутые регионы. Последние данные свидетельствуют о том, что внутреннее перемещение, свертывание программ контроля, изменение окружающей среды и миграция скота являются основными факторами, способствующими вышеупомянутым тенденциям.[1–5]
Целью данного обзора является выделение ключевых компонентов для разработки национальной программы по обработке инсектицидами животных-резервуаров для борьбы с T. b. Родезийский. В этом отчете основное внимание будет уделено стратегиям борьбы с переносчиками на основе инсектицидов, системе мониторинга и оценки, а также пробелам в знаниях, необходимых для будущих инициатив.
Т. б. rhodesiense Африканский трипаносомоз человека (HAT) является эндемическим заболеванием на юге и востоке Уганды более 100 лет и является зоонозным заболеванием, резервуаром которого являются дикие животные и домашний скот. Паразит передается мухами Glossina tsetse, которые очень зоофильны и потребляют лишь небольшой процент пищи с кровью (16–23%) у людей.[6] Данные предыдущих исследований на юго-востоке Уганды показали распространенность T. brucei видов в поголовье домашнего скота составляет 5%, причем 23% из них приходится на инфекционную форму человека, T. b. розовая.[7]
Паразит передается мухами Glossina tsetse, которые очень зоофильны и потребляют лишь небольшой процент пищи с кровью (16–23%) у людей.[6] Данные предыдущих исследований на юго-востоке Уганды показали распространенность T. brucei видов в поголовье домашнего скота составляет 5%, причем 23% из них приходится на инфекционную форму человека, T. b. розовая.[7]
Национальная программа борьбы с сонной болезнью при Министерстве здравоохранения Уганды собирает эпиднадзор и первичные данные о заболеваемости сонной болезнью в Уганде с 1999 г. Ретроспективные перекрестные данные за период 1973–2003 гг. книги. Надежность данных считается от умеренной до высокой для 1986 – 2003 г.; однако оценки, вероятно, сильно занижают истинную заболеваемость: по оценкам, на каждую зарегистрированную смерть от сонной болезни приходится 12 невыявленных смертей. Кластерно выявленные случаи сонной болезни на юге Уганды за 1973–2003 гг. представлены в . Последние данные для новых T.b. rhodesiense случаев в Уганде, зарегистрированных во Всемирной организации здравоохранения (ВОЗ) за 1997–2006 гг. [], показывают относительно стабильную заболеваемость зарегистрированным заболеванием. Всего было затронуто 14 районов с заметным распространением случаев на север.[9]]
[], показывают относительно стабильную заболеваемость зарегистрированным заболеванием. Всего было затронуто 14 районов с заметным распространением случаев на север.[9]]
Открыть в отдельном окне
Новый Т.б. rhodesiense случаев, зарегистрированных в ВОЗ, Уганда, 1997–2006 гг. (ВОЗ 2007)
Таблица 1
Кластерное выявление сонной болезни. Юго-Восток, Уганда, 1970-2003 гг. *

Открыть в отдельном окне Источник: Berranget Ford
* Наблюдается № случаев/ожидаемое количество случаи,
** Несколько кластеров были выявлены в течение 1998-2003 гг. ,
,
*** Кластер включал только 1 наблюдение, представляющее 5 объединенных округов.
Вспышки HAT в ранее незатронутых северных районах были связаны с миграцией крупного рогатого скота и близостью людей к резервуару для животных.[2] В одном исследовании методом случай-контроль в 17 деревнях на юго-востоке Уганды факторы риска HAT включали: наличие члена семьи с историей HAT (OR 16,23 CI95 2,97–88,74), присутствие крупного рогатого скота вокруг фермы (OR 3,08 CI95 1,16–8,14), работа в подворье (OR 12,52 CI95 1,48–106,4), буфер водно-болотных угодий < 500 м ( P <0,05) и мужской пол (63%).[5]
Последствия трипаносомоза выходят за рамки воздействия HAT, так как ветеринарные последствия оказывают существенное влияние на средства к существованию и поголовье сельских фермеров. Трипаносомоз животных снижает потребление животного белка, снижает производство молока и, по оценкам, ежегодно обходится животноводам и потребителям в 1,3 миллиарда долларов США. [3,10] Ветеринарная борьба с трипаносомозом на уровне отдельного фермера, вероятно, дуэльная выгода снижена Т. б. rhodesiense среди людей и улучшение условий жизни скота. животный резервуар значителен.
[3,10] Ветеринарная борьба с трипаносомозом на уровне отдельного фермера, вероятно, дуэльная выгода снижена Т. б. rhodesiense среди людей и улучшение условий жизни скота. животный резервуар значителен.
Меры по борьбе с сонной болезнью столкнулись со значительными проблемами устойчивости. Основные широкомасштабные стратегии, которые использовались, включают: (1) удаление восприимчивых людей из зон риска, (2) массовую химиопрофилактику человеческих популяций, (3) активное наблюдение и лечение для борьбы с существующими инфекциями у людей. Это прямое вмешательство человека сопровождалось попытками сократить популяции переносчиков за счет модификации среды обитания и отлова цеце [3]. Подходы, основанные на элиминации T. brucei из животного резервуара, были в значительной степени экспериментальными и показали многообещающие результаты.[13–16]
Хотя было показано, что обработка инсектицидами эффективна для сокращения популяций мух цеце и сопутствующей инфекции T. brucei у животных, воздействие на T. b. rhodesiense у людей не было четко продемонстрировано. [13–16] Аналогичные подходы к борьбе с малярией среди людей посредством обработки крупного рогатого скота инсектицидами доказали свою эффективность в снижении инфекции Plasmodium в районах с зоофильными видами Anopheles. [17] Кроме того, математические модели продемонстрировали ограниченное снижение базовой репродуктивной способности (R0) в течение 9 лет.0009 Т. б. rhodesiense при лечении больных и почти линейное снижение R0 при химиопрофилактике животных-резервуаров, что позволяет предположить, что оптимальный подход к борьбе с восточноафриканской сонной болезнью может заключаться в сокращении заболеваемости в животных-резервуарах [4].
brucei у животных, воздействие на T. b. rhodesiense у людей не было четко продемонстрировано. [13–16] Аналогичные подходы к борьбе с малярией среди людей посредством обработки крупного рогатого скота инсектицидами доказали свою эффективность в снижении инфекции Plasmodium в районах с зоофильными видами Anopheles. [17] Кроме того, математические модели продемонстрировали ограниченное снижение базовой репродуктивной способности (R0) в течение 9 лет.0009 Т. б. rhodesiense при лечении больных и почти линейное снижение R0 при химиопрофилактике животных-резервуаров, что позволяет предположить, что оптимальный подход к борьбе с восточноафриканской сонной болезнью может заключаться в сокращении заболеваемости в животных-резервуарах [4].
Открыть в отдельном окне
Экспериментальная модель снижения репродуктивной способности (R0) для лечения больных по сравнению с химиопрофилактикой скота. T.b.r = Trypanosoma brucei rhodesiensse . Т.б.г. = Trypanosoma brucei gambiense . Адаптировано из Welburn et al . 2001.
Адаптировано из Welburn et al . 2001.
Синтетические пиретроиды использовались для борьбы с широким спектром эктопаразитов у крупного рогатого скота с 1970-х годов.[18] Из всех проверенных синтетических пиретроидов дельтаметрин оказался наиболее сильнодействующим, фотостабильным и стойким, с безопасностью и эффективностью в очень низких дозах.[14] Его влияние на борьбу с мухами цеце, клещами и комарами хорошо задокументировано, а погружение крупного рогатого скота в дельтаметрин считается приемлемой формой борьбы с переносчиками [14,17,19].,20] Множество переменных влияет на эффективность применения дельтаметрина у крупного рогатого скота для борьбы с переносчиком мухи цеце в районах с высокой нагрузкой мухами. Тем не менее, было замечено, что лечение дельтаметрином снижает бремя цеце на 70–100 % в течение трех-шести месяцев в ряде условий. %.[21,24] Экономическая эффективность может быть значительно повышена за счет ограниченного применения инсектицида на животе и ногах крупного рогатого скота без заметного снижения эффективности. [25,26]
[25,26]
Методы и протоколы, используемые для применения дельтаметрина у крупного рогатого скота, варьируются и зависят от спецификаций производителей, концентрации, температуры и сезонности (сухой сезон или сезон дождей). Потенциальные дополнительные преимущества применения включают снижение числа заболеваний, переносимых клещами и комарами, улучшение здоровья скота и повышение урожайности от животноводства.
Хотя известно, что воздействие стратегий борьбы с переносчиками болезней на основе инсектицидов у крупного рогатого скота снижает бремя мух цеце и трипаносомоз крупного рогатого скота, влияние на человеческую форму болезни не выяснено.[14,21–24] Предполагается, что уменьшение бремени переносчиков и снижение заболеваемости среди животных-резервуаров приведет к положительным эффектам в виде снижения заболеваемости человека. Однако еще предстоит определить, уменьшит ли это силу заражения в достаточной степени или нет, и это зависит от степени охвата резервуара. Остаются вопросы относительно роли передачи от человека к человеку, степени, в которой играют роль другие животные-резервуары, и возникающего потенциала устойчивости к инсектицидам. Было показано, что дельтаметрин и другие инсектициды снижают заболеваемость малярией среди людей при применении к крупному рогатому скоту в зоофильных очагах, и постулируется аналогичный эффект для борьбы с ГАТ в Восточной Африке.[17]
Было показано, что дельтаметрин и другие инсектициды снижают заболеваемость малярией среди людей при применении к крупному рогатому скоту в зоофильных очагах, и постулируется аналогичный эффект для борьбы с ГАТ в Восточной Африке.[17]
Следующие исследовательские вопросы, касающиеся борьбы с Glossina в Уганде, могут помочь в планировании будущего:
Снижает ли борьба с переносчиками крупного рогатого скота инсектицидную заболеваемость T. b. rhodesiense в человеческой популяции?
Какова экономическая эффективность массовой обработки инсектицидами?
Приемлема ли массовая обработка скота для местных пастухов и фермеров в Уганде?
Какова распространенность Т. б. rhodesiense в других резервуарах домашних и лесных животных?
Следует ли распространить аналогичные подходы с обработкой инсектицидами на другой домашний скот?
Какие доказательства устойчивости видов Glossina к обычным синтетическим пиретроидам?
Вопросы 1–3 следует выяснить до начала общенациональной программы контроля. Остальные вопросы могут относиться к контексту сбора и оценки данных на этапе реализации программы. Учитывая обширное зоонозное распространение T. brucei rhodesiense , ликвидация паразита маловероятна. Будущие исследования должны быть сосредоточены на эффективных методах борьбы с переносчиками, рентабельном надзоре за болезнями, а также на раннем выявлении и лечении случаев заболевания.
Остальные вопросы могут относиться к контексту сбора и оценки данных на этапе реализации программы. Учитывая обширное зоонозное распространение T. brucei rhodesiense , ликвидация паразита маловероятна. Будущие исследования должны быть сосредоточены на эффективных методах борьбы с переносчиками, рентабельном надзоре за болезнями, а также на раннем выявлении и лечении случаев заболевания.
Долгосрочные рекомендации по программе борьбы с переносчиками инфекции на основе инсектицидов основаны на успешном осуществлении пилотных программ и будут зависеть от местных факторов и переменных, выявленных в ходе реализации пилотной программы. Более широкое развертывание и эффективное расширение существующих программ на низовом уровне следует проводить, когда будут доступны исследования эффективности и технико-экономического обоснования. Нижеследующие рекомендации касаются такой первоначальной пилотной программы, которая должна сформировать основу для подхода с нуля к успешному внедрению в масштабах всей страны.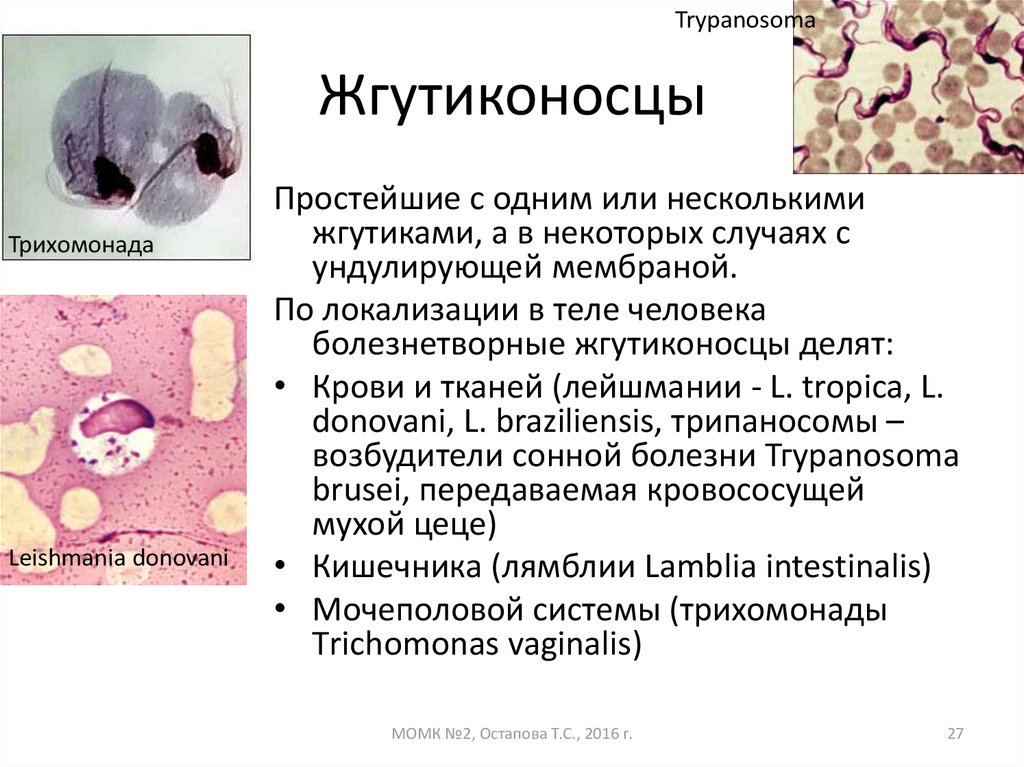
Первоначальные пилотные программы должны быть нацелены на эпидемические очаги болезни. Пространственный анализ заболеваемости за 2003 г. выявил пять районов с очагами эпидемии T. b. родезийские []. Первоначальные пилотные программы по обработке крупного рогатого скота инсектицидами должны быть нацелены на эти пять районов (Муконо, Иганга, Тороро, Камули и Сороти). На районные медицинские бригады, ответственные за реализацию программы, должна быть возложена задача координации выдачи лекарств на уровне округов и округов, просветительских кампаний, сбора данных и отчетности.
Открыть в отдельном окне
Среднегодовая заболеваемость сонной болезнью по округам, 1998-2003 гг. Берранг-Форд и др. др. 2006
Должна быть созвана региональная целевая группа, состоящая из представителей общественности округа, экспертов в области общественного здравоохранения, ветеринаров, поставщиков медицинских услуг, неправительственных партнеров и руководства Министерства здравоохранения (МЗ) Уганды.
Целевой группе следует разработать подробную методологию для таких пилотных программ, состоящую из:
Подробная методология и планы анализа для компонентов, изложенных в схеме мониторинга и оценки
Сроки и методы внедрения на уровне округов и деревень
Список необходимых материалов и расходных материалов
5 и рецептура дельтатрина25 методология примененияОценка бюджетов районного уровня
По завершении первоначальных пилотных программ необходимо провести анализ эффективности и рентабельности. На основе данных эпиднадзора из других районов, информации, полученной в ходе пилотных программ, и материалов исследований, как указано в разделе «Пробелы в знаниях», можно принять долгосрочное решение относительно осуществимости и стратегии.
Эффективное внедрение и долгосрочная осуществимость программы борьбы с переносчиками инфекции с помощью инсектицидов в значительной степени зависят от способности успешно внедрить надежную и последовательную систему мониторинга и оценки. Необходимо разработать подробные планы и методы для следующих показателей:
Необходимо разработать подробные планы и методы для следующих показателей:
Эпидемиологический мониторинг:
Количество зарегистрированных случаев сонной болезни в пилотных районах (заболеваемость)
Успешный мониторинг случаев сонной болезни требует эффективного диагностического надежное выявление случаев с микроскопической идентификацией трипаносом в крови, лимфе и спинномозговой жидкости. Поскольку нет сероскринингового теста на Т. б. rhodesiense , анализ чувствительности и меры контроля качества ограничены.[27]
Энтомологический мониторинг:
Плотность популяции мухи цеце
Для единообразного мониторинга популяции мухи цеце следует регулярно применять стандартные методы ловушек. Необходимо единообразно применять корреляцию с моделями сезонной миграции и миграции скота.
Ветеринарный мониторинг:
Распространенность трипаносомоза крупного рогатого скота
Изменения веса и надой у крупного рогатого скота
Следует провести мониторинг случайной когорты крупного рогатого скота на наличие серологических признаков трипаносомоза крупного рогатого скота на этапах до и после лечения.
 В течение пилотного периода также следует проводить регулярный мониторинг веса и надоя молока.
В течение пилотного периода также следует проводить регулярный мониторинг веса и надоя молока.Эпиднадзор:
Заболеваемость сонной болезнью в масштабах страны
Расследование и борьба с региональными вспышками
Надзор за заболеваниями, осуществляемый Национальной программой борьбы с сонной болезнью Министерства здравоохранения Уганды, должен быть интегрирован с аналитической структурой программы борьбы с переносчиками. Следует использовать общие структуры отчетности и базы данных.
Принятие и отношение населения:
Восприятие фермерами влияния на производительность
Готовность лечить животных инсектицидами
Польза для общества
Анкеты должны быть разработаны на основе местных данных после фокус-групп и выявления барьеров и ограничений. Необходимо разработать показатели, относящиеся к знаниям, отношению и практике, с учетом восприятия фермерами влияния на производительность, готовности лечить и пользы для общества.

Воздействие на окружающую среду:
Концентрация дельтаметрина в региональных источниках воды
Учитывая характер предлагаемого вмешательства, существует возможность внесения больших количеств синтетических пиретроидов в почву и водоснабжение. Руководящие принципы качества воды для дельтаметрина устанавливают предел безопасности на уровне 0,0004 мкг на л. симбиотические виды.
Эффективная борьба с восточноафриканской сонной болезнью является сложной задачей, учитывая характер взаимодействия переносчик-хозяин-резервуар. Обработка инсектицидами домашних животных-резервуаров может обеспечить снижение заболеваемости человека и остановить распространение болезни на ранее незараженные регионы. Применение дельтаметрина для крупного рогатого скота снижает бремя мух цеце и трипаносомоз крупного рогатого скота. Необходимы дальнейшие исследования, чтобы определить, имеют ли такие вмешательства потенциал для снижения HAT у человека и является ли такой подход экономически эффективным. Пилотные программы должны быть запущены в эпидемических очагах Т. б. Коробка передач родезиенс . Необходимо собрать основные показатели для оценки воздействия и осуществимости общенациональной стратегии борьбы с переносчиками для снижения заболеваемости восточноафриканской сонной болезнью в Уганде.
Пилотные программы должны быть запущены в эпидемических очагах Т. б. Коробка передач родезиенс . Необходимо собрать основные показатели для оценки воздействия и осуществимости общенациональной стратегии борьбы с переносчиками для снижения заболеваемости восточноафриканской сонной болезнью в Уганде.
Источник поддержки: Нет
Конфликт интересов: Не заявлено.
1. Берранг-Форд Л., Берке О., Абдельрахман Л., Уолтнер-Тэйвз Д., Макдермотт Дж. Пространственный анализ сонной болезни, юго-восток Уганды, 1970–2003 гг. Эмердж Инфекция Дис. 2006; 12:813–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Fèvre EM, Coleman PG, Odiit M, Magona JW, Welburn SC, Woolhouse ME. Происхождение новой вспышки сонной болезни Trypanosoma brucei rhodesiense в восточной Уганде. Ланцет. 2001; 358: 625–8. [PubMed] [Google Scholar]
3. Welburn SC, Coleman PG, Maudlin I, Fèvre EM, Odiit M, Eisler MCCrisis. Борьба с родезийской сонной болезнью? Тенденции Паразитол.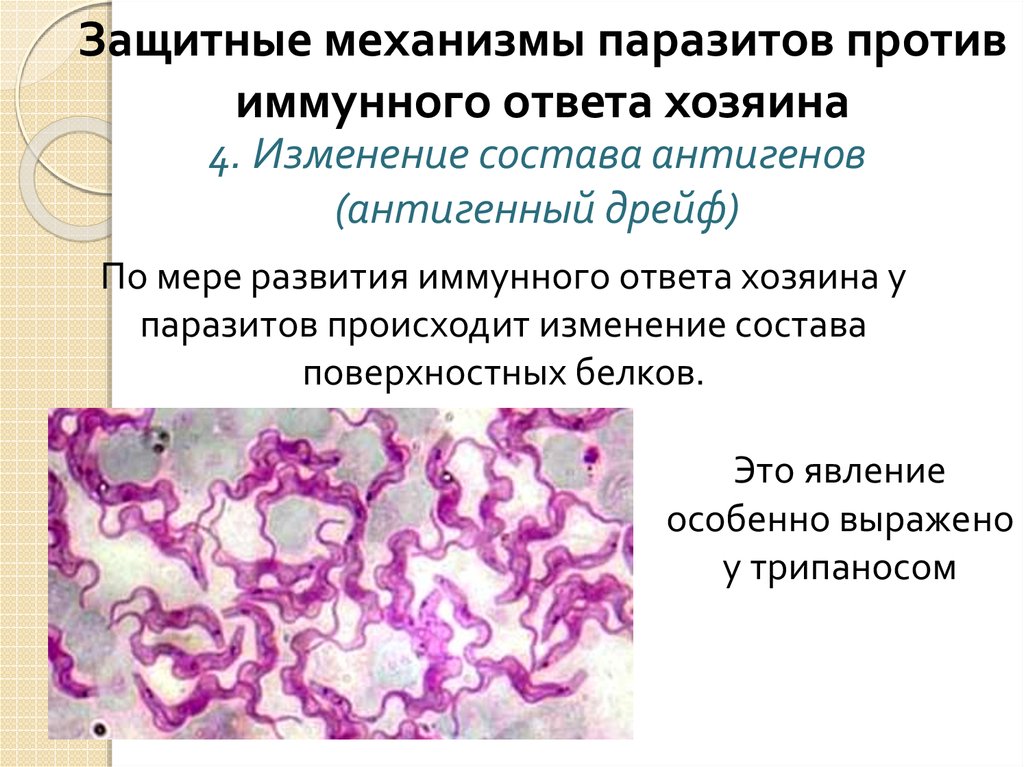 2006; 22: 123–8. какой кризис? [PubMed] [Google Scholar]
2006; 22: 123–8. какой кризис? [PubMed] [Google Scholar]
4. Welburn SC, Fèvre EM, Coleman PG, Odiit M, Maudlin I. Сонная болезнь: рассказ о двух болезнях. Тенденции Паразитол. 2001;17:19–24. [PubMed] [Google Scholar]
5. Zoller T, Fèvre EM, Welburn SC, Odiit M, Coleman PG. Анализ факторов риска сонной болезни T. brucei rhodesiense в деревнях на юго-востоке Уганды. BMC Infect Dis. 2008; 8:88. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Okoth JO, Kapaata R. Хозяева Glossina fuscipes fuscipes. Энн Троп Мед Паразитол. 1988; 82: 517–8. [PubMed] [Google Scholar]
7. Hide G, Tait A, Maudlin I, Welburn SC. Истоки, динамика и поколение Trypanosoma brucei rhodesiense эпидемии в Восточной Африке. Паразитол Сегодня. 1996; 12:50–5. [PubMed] [Google Scholar]
8. Odiit M, Coleman PG, Liu WC, McDermott JJ, Fèvre EM, Welburn SC, et al. Количественная оценка уровня недообнаружения случаев сонной болезни Trypanosoma brucei rhodesiense . Троп Мед Int Health. 2005; 10:840–9. [PubMed] [Google Scholar]
Троп Мед Int Health. 2005; 10:840–9. [PubMed] [Google Scholar]
9. ВОЗ. Отчет неофициальной консультации ВОЗ по устойчивой борьбе с африканским трипаносомозом человека. Женева, Швейцария: 2007 г. [Google Scholar]
10. Кристьянсон П.М. Измерение затрат на африканский трипаносомоз животных, потенциальных выгод от контроля и отдачи от исследований. Сельскохозяйственная система 1999; 59: 79–98. [Google Scholar]
11. Kamuanga M, Sigué H, Swallow B, Bauer B, d’Ieteren G. Восприятие фермерами воздействия борьбы с цеце и трипаносомозом на животноводство: данные из южной части Буркина-Фасо. Trop Anim Health Prod. 2001; 33: 141–53. [PubMed] [Google Scholar]
12. Бауэр Б., Амслер-Делафоссе С., Клаузен П.Х., Каборе И., Петрич-Бауэр Дж. Успешное применение дельтаметрина для крупного рогатого скота в кампании против мух цеце (Glossina spp.) в пасторальная зона Саморогуана, Буркина-Фасо. Троп Мед Паразитол. 1995;46:183–189. [PubMed] [Google Scholar]
13. Бауэр Б.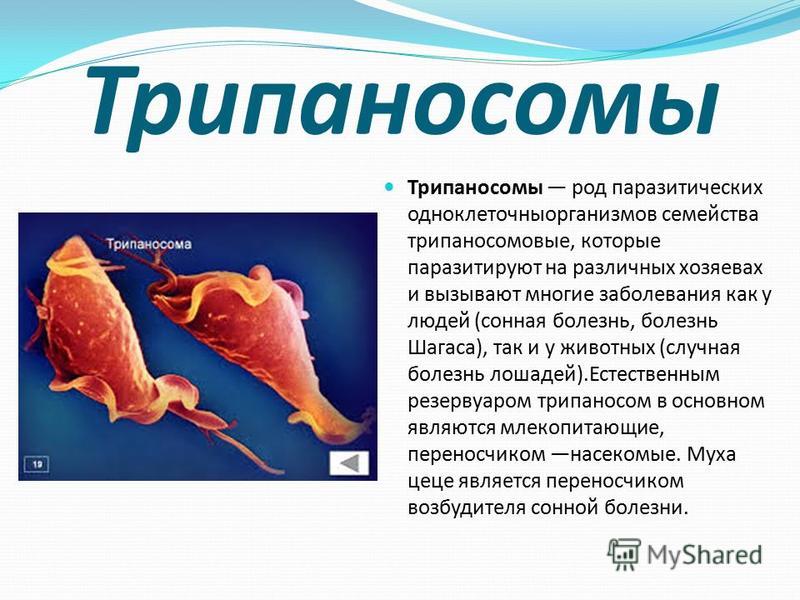 , Каборе И., Либиш А., Мейер Ф., Петрич-Бауэр Дж. Одновременная борьба с клещами и мухами цеце в Сатири, Буркина-Фасо, с помощью флуметрина для крупного рогатого скота. . Троп Мед Паразитол. 1992; 43:41–6. [PubMed] [Google Scholar]
, Каборе И., Либиш А., Мейер Ф., Петрич-Бауэр Дж. Одновременная борьба с клещами и мухами цеце в Сатири, Буркина-Фасо, с помощью флуметрина для крупного рогатого скота. . Троп Мед Паразитол. 1992; 43:41–6. [PubMed] [Google Scholar]
14. Окелло-Онен Дж., Хейнонен Р., Ссекитто С.М., Мвайи В.Т., Какайре Д., Кабарема М. Борьба с мухами цеце в Уганде путем погружения крупного рогатого скота в дельтаметрин. Trop Anim Health Prod. 1994; 26:21–7. [PubMed] [Академия Google]
15. Утечка SGA. Испытание инсектицида на основе циперметрина для борьбы с Glossina pallidipes, G. fuscipes fuscipes и Glossina morsitans submorsitans на юго-западе Эфиопии. Бык Энтомол Рез. 1995; 85: 241–51. [Google Scholar]
16. Томсон Дж. В., Уилсон А. Борьба с мухой цеце и трипаносомозом путем применения дельтаметрина к крупному рогатому скоту. Бык Ани Прод в Афр Бык. 1992;40:5–8. [Google Scholar]
17. Роуленд М., Дуррани Н., Кенворд М., Мохаммед Н., Урахман Х., Хьюитт С. Борьба с малярией в Пакистане путем применения инсектицида дельтаметрин для крупного рогатого скота: рандомизированное исследование. Ланцет. 2001; 357:1837–41. [PubMed] [Академия Google]
Ланцет. 2001; 357:1837–41. [PubMed] [Академия Google]
18. Эллиотт М., Фарнхэм А.В., Джейнс Н.Ф., Нидхэм П.Х., Пулман Д.А., Стивенсон Дж.Х. Фотостабильный пиретроид. Природа. 1973; 246: 169–70. [PubMed] [Google Scholar]
19. Чизюка Х.Г., Лугуру С.М. Погружение для борьбы с переносчиками паразитов крупного рогатого скота. Паразитол Сегодня. 1986; 2:123. [PubMed] [Google Scholar]
20. Хьюитт С., Роуленд М. Борьба с зоофильными переносчиками малярии путем применения пиретроидных инсектицидов к крупному рогатому скоту. Троп Мед Int Health. 1999; 4: 481–6. [PubMed] [Google Scholar]
21. Окирия Р., Окуна Н.М., Магона Дж.В., Майенде Дж.С. Устойчивость борьбы с цеце путем последующей обработки 10% ранее обработанного поголовья крупного рогатого скота Уганды 1% масс./об. дельтаметрина. Trop Anim Health Prod. 2002; 34: 105–14. [PubMed] [Академия Google]
22. Гоа MKMF, Бакули Б., Чакале Б. Эффективность Decatix (дельтаметрин 5%) для крупного рогатого скота против мух цеце на ранчо Мкваджа, регион Танга. Рес и Тра Новости. 1990; 5: 3–5. [Google Scholar]
Рес и Тра Новости. 1990; 5: 3–5. [Google Scholar]
23. Vale GAMG, Lovermore DF. Крупный рогатый скот, обработанный инсектицидом, для борьбы с мухой цеце (Diptera: Glossinidae): ответы на некоторые вопросы, многие заданные. Бык Ent Res. 1999; 89: 569–78. [Google Scholar]
24. Rowlands GJ, Leak SG, Mulatu W, Nagda SM, Wilson A, d’Ieteren GD. Использование инсектицида дельтаметрин для борьбы с трипаносомозом крупного рогатого скота в условиях высокой инвазии цеце. Мед Вет Энтомол. 2001; 15: 87–9.6. [PubMed] [Google Scholar]
25. Буйер Дж., Стахурски Ф., Каборе И., Бауэр Б., Ланселот Р. Борьба с Цеце у крупного рогатого скота с помощью пиретроидных ножных ванн. Пред. Вет. мед. 2007; 78: 223–38. [PubMed] [Google Scholar]
26. Torr SJ, Maudlin I, Vale GA. Чем меньше, тем лучше: ограниченное применение инсектицидов для крупного рогатого скота для повышения стоимости и эффективности борьбы с цеце. Мед Вет Энтомол. 2007; 21:53–64. [PubMed] [Google Scholar]
27. Heymann DL. Типаносомоз. В: Хейманн Д.Л., редактор. Руководство по борьбе с инфекционными заболеваниями. 19изд. Вашингтон, округ Колумбия: Am Publ Hel Ass; 2008. С. 630–9. [Google Scholar]
Heymann DL. Типаносомоз. В: Хейманн Д.Л., редактор. Руководство по борьбе с инфекционными заболеваниями. 19изд. Вашингтон, округ Колумбия: Am Publ Hel Ass; 2008. С. 630–9. [Google Scholar]
28. Макнамара П. Дельтаметрин — хроническая токсичность для Daphnia magna в проточных условиях. 1991.
29. ВОЗ. Дельтаметрин. Критерии гигиены окружающей среды. 1990.
Борьба с африканским трипаносомозом человека: достижения и проблемы
(2012). Оценка и картирование населения, подверженного риску сонной болезни. PLoS Negl Trop Dis 6, e185910.1371/journal.pntd.0001859 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Barrett M.P. (1999). Падение и подъем сонной болезни. Ланцет 353, 1113–1114. 10.1016/С0140-6736(98)00416-4 [PubMed] [CrossRef] [Google Scholar]
3. Хедрик Д.Р. (2014). Эпидемии сонной болезни и колониальные меры в Восточной и Центральной Африке, 1900–1940 гг. PLoS Negl Trop Dis 8, е2772 10.1371/journal.pntd.0002772 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Алсан М. (2015). Влияние мухи ЦеЦе на развитие Африки. Американский экономический обзор
382–410. [Google Scholar]
Алсан М. (2015). Влияние мухи ЦеЦе на развитие Африки. Американский экономический обзор
382–410. [Google Scholar]
5. Франко Дж.Р., Симарро П.П., Диарра А., Руис-Постиго Дж.А., Джаннин Дж.Г. (2014). Путь к элиминации африканского трипаносомоза человека gambiense: не далек и не легок. Паразитология 141, 748–760. 10.1017/S0031182013002102 [PubMed] [CrossRef] [Google Scholar]
6. Лехейн М., Альфарух И., Бучетон Б., Камара М., Харрис А., Каба Д., Лумбала С., Пека М., Райайс Дж. Б., Вайсва С. и др. (2016). Борьба с цеце и искоренение гамбийской сонной болезни. PLoS Negl Trop Dis 10, e0004437 10.1371/journal.pntd.0004437 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Molyneux D., Ndung’u J. и Maudlin I. (2010). Борьба с сонной болезнью — «Когда они когда-нибудь научатся?». PLoS Negl Trop Dis 4(5), е609 10.1371/журнал.pntd.0000609 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Buscher P., and Deborggraeve S. (2015). Как молекулярная диагностика может способствовать ликвидации африканского трипаносомоза человека?
Экспертиза молекулярной диагностики
15, 607–615. 10.1586/14737159.2015.1027195
[PubMed] [CrossRef] [Академия Google]
10.1586/14737159.2015.1027195
[PubMed] [CrossRef] [Академия Google]
9. Магнус Э., Вервоорт Т. и Ван Мейрвенн Н. (1978). Карточный тест агглютинации с окрашенными трипаносомами (C.A.T.T.) для серологической диагностики трипаносомоза T. B. gambiense. Анналы бельжийского общества тропической медицины 58, 169–176. [PubMed] [Google Scholar]
10. Коффи М., Н’Джетчи М., Илбудо Х., Каба Д., Кулибали Б., Н’Гуан Э., Куаку Л., Бучетон Б., Солано П. , Кортин Ф. и др. (2016). Целенаправленная стратегия поквартирного выявления сонной болезни в условиях низкой распространенности в Кот-д’Ивуаре. Паразит 23, 51 10.1051/паразит/2016059[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Jamonneau V., Camara O., Ilboudo H., Peylhard M., Koffi M., Sakande H., N’Dri L., Sanou Д., Дама Э., Камара М. и др. (2015). Точность индивидуальных экспресс-тестов для серодиагностики сонной болезни гамбиенса в Западной Африке. PLoS Negl Trop Dis 9, e0003480 10.1371/журнал.pntd.0003480 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Мумба Нгойи Д., Али Экангу Р., Мумвемба Коди М.Ф., Пьяна П.П., Балхарби Ф., Дек М., Канде Бету В., Ван дер Векен В., Сесе К., Ментен Дж. и др. (2014). Применение паразитологических и молекулярных методов диагностики и наблюдения за сонной болезнью гамбиенса. PLoS Negl Trop Dis
8, е2954
10.1371/journal.pntd.0002954
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мумба Нгойи Д., Али Экангу Р., Мумвемба Коди М.Ф., Пьяна П.П., Балхарби Ф., Дек М., Канде Бету В., Ван дер Векен В., Сесе К., Ментен Дж. и др. (2014). Применение паразитологических и молекулярных методов диагностики и наблюдения за сонной болезнью гамбиенса. PLoS Negl Trop Dis
8, е2954
10.1371/journal.pntd.0002954
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Приотто Г., Каспарян С., Мутомбо В., Нгуама Д., Горашян С., Арнольд У., Габри С., Баудин Э. , Буард В., Казади-Кьянза С. и др. (2009). Комбинированная терапия нифуртимоксом-эфлорнитином для второй стадии африканского трипаносомоза Trypanosoma brucei gambiense : многоцентровое, рандомизированное, фаза III, исследование не меньшей эффективности. Ланцет 374, 56–64. 10.1016/С0140-6736(09)61117-Х [PubMed] [CrossRef] [Академия Google]
14. Куртин Ф., Камара М., Райайс Дж. Б., Кагбадоуно М., Дама Э., Камара О., Траоре И. С., Руамба Дж., Пейлхард М., Сомда М. Б. и др. (2015). Сокращение контакта человека с цеце значительно повышает эффективность активных кампаний по выявлению сонной болезни: многообещающий результат в контексте ликвидации. PLoS Negl Trop Dis
9, e0003727
10.1371/journal.pntd.0003727
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS Negl Trop Dis
9, e0003727
10.1371/journal.pntd.0003727
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Solano P., Torr SJ, and Lehane MJ (2013). Нужна ли борьба с переносчиками для ликвидации гамбийского африканского трипаносомоза человека? Front Cell Infect Microbiol 3, 33 10.3389/fcimb.2013.00033 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Ilboudo H., Jamonneau V., Camara M., Camara O., Dama E., Leno M., Ouendeno F., Courtin F. , Саканде Х., Санон Р. и др. (2011). Разнообразие ответов на инфекции
17. Molyneux D.H. (1973). Животные-резервуары и гамбийский трипаносомоз. Анналы бельжийского общества тропической медицины 53, 605–618. [PubMed] [Google Scholar]
18. Рок К. С., Торр С.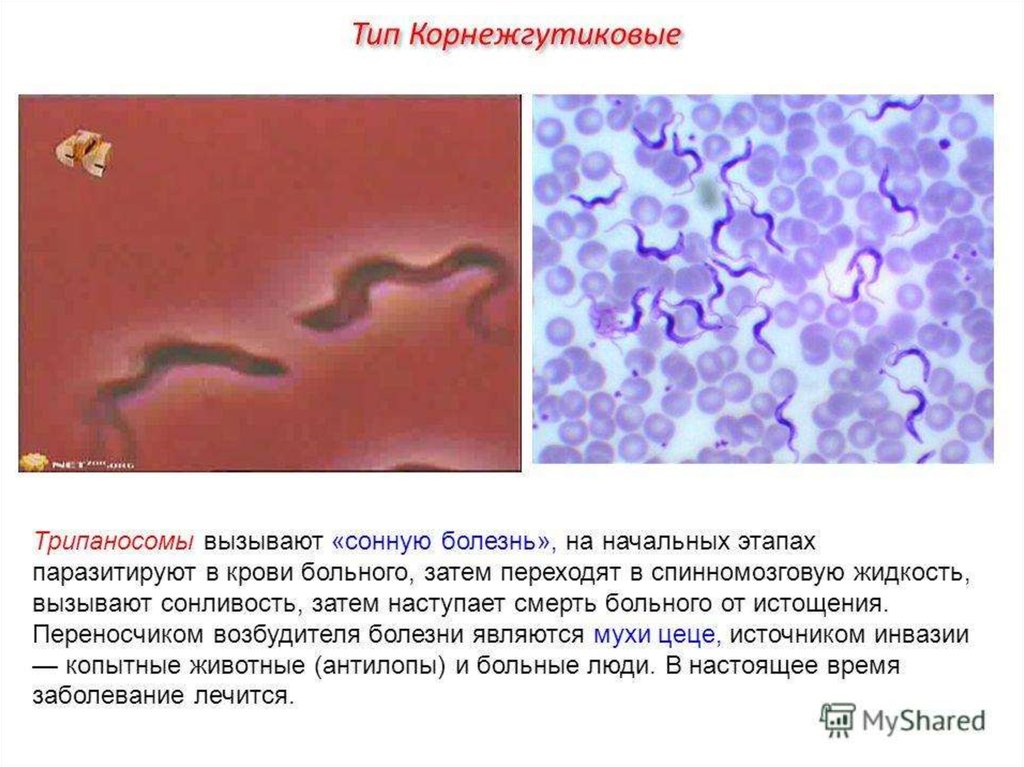 Дж., Лумбала С. и Килинг М. Дж. (2015). Количественная оценка стратегии ликвидации африканского трипаносомоза человека в Демократической Республике Конго. Векторы паразитов
8 532
10.1186/с13071-015-1131-8
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж., Лумбала С. и Килинг М. Дж. (2015). Количественная оценка стратегии ликвидации африканского трипаносомоза человека в Демократической Республике Конго. Векторы паразитов
8 532
10.1186/с13071-015-1131-8
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Каннингем Л.Дж., Лингли Дж.К., Хейнс Л.Р., Ндунгу Дж.М., Торр С.Дж. и Адамс Э.Р. (2016). Освещение распространенности Trypanosoma brucei s . л . в Glossina Использование LAMP в качестве инструмента для ксеномониторинга. PLoS Negl Trop Dis 10, e0004441 10.1371/журнал.pntd.0004441 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Kabayo JP (2002). Стремление уничтожить цеце из Африки. Тенденции Паразитол 18, 473–475. [PubMed] [Google Scholar]
21. Роджерс Д.Дж. и Рэндольф С.Е. (2002). Ответ на цель искоренения цеце в Африке. Тенденции Паразитол 18, 534–536. [PubMed] [Академия Google]
22. Shaw A.P., Tirados I., Mangwiro C.T., Esterhuizen J. , Lehane M.J., Torr S.J. и Kovacic V. (2015). Затраты на использование «крошечных мишеней» для борьбы с Glossina fuscipes fuscipes , переносчиком сонной болезни gambiense в округе Аруа в Уганде. PLoS Negl Trop Dis
9, e0003624
10.1371/journal.pntd.0003624
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Lehane M.J., Torr S.J. и Kovacic V. (2015). Затраты на использование «крошечных мишеней» для борьбы с Glossina fuscipes fuscipes , переносчиком сонной болезни gambiense в округе Аруа в Уганде. PLoS Negl Trop Dis
9, e0003624
10.1371/journal.pntd.0003624
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Van Den Abbeele J., Caljon G., De Ridder K., De Baetselier P., and Coosemans M. (2010). Trypanosoma brucei изменяет состав слюны цеце, изменяя кормовое поведение мух, что способствует передаче паразитов. PLoS Патог 6, е1000926 10.1371/журнал.ppat.1000926 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Аксой С., Аттардо Г., Берриман М., Кристоффелс А., Лехан М., Масига Д. и Туре Ю. (2014a) . Исследования африканского трипаносомоза человека получают импульс: расшифровка генома цеце. PLoS Negl Trop Dis 8, е2624. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Мачария Р., Миреджи П., Мурунги Э., Мурилла Г.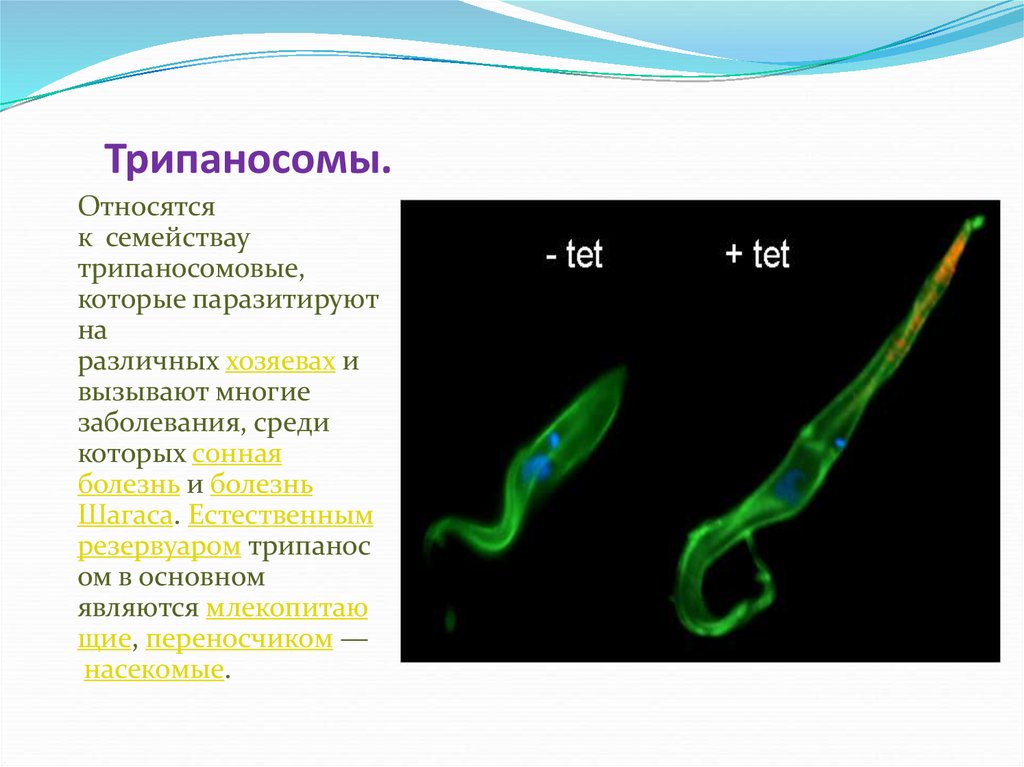 , Кристоффельс А., Аксой С. и Масига Д. (2016). Полногеномный сравнительный анализ семейств хемосенсорных генов у пяти видов мух цеце. PLoS Negl Trop Dis
10, e0004421
10.1371/журнал.pntd.0004421
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Кристоффельс А., Аксой С. и Масига Д. (2016). Полногеномный сравнительный анализ семейств хемосенсорных генов у пяти видов мух цеце. PLoS Negl Trop Dis
10, e0004421
10.1371/журнал.pntd.0004421
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Обьеро Г.Ф., Миреджи П.О., Ньянджом С.Р., Кристоффелс А., Робертсон Х.М. и Масига Д.К. (2014). Одорантные и вкусовые рецепторы у мухи цеце Glossina morsitans morsitans . PLoS Negl Trop Dis 8, е2663 10.1371/journal.pntd.0002663 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
27. Михалкова В., Бенуа Дж.Б., Вайс Б.Л., Аттардо Г.М., Аксой С. (2014). Витамин B6, вырабатываемый облигатными симбионтами, имеет решающее значение для поддержания гомеостаза пролина и плодовитости мух цеце. Appl Environ Microbiol 80, 5844–5853. 10.1128/АЭМ.01150-14 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Бенуа Дж.Б., Аттардо Г.М., Бауманн А.А., Михалкова В., Аксой С. (2015). Аденотрофное живорождение мух цеце: потенциал для контроля над популяцией и как модель насекомых для лактации.
29. Аксой С., Какконе А., Гальвани А.П. и Океди Л.М. (2013). Glossina fuscipes популяций дают представление о передаче африканского трипаносомоза человека в Уганде. Тенденции Паразитол 29, 394–406. 10.1016/j.pt.2013.06.005 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Солано П., Равель С. и де Меус Т. (2010). Как генетика популяции цеце может способствовать борьбе с африканским трипаносомозом? Тенденции Паразитол 26, 255–263. 10.1016/j.pt.2010.02.006 [PubMed] [CrossRef] [Академия Google]
31. Аксой С., Гибсон В. К. и Лехейн М. Дж. (2003). Взаимодействия между цеце и трипаносомами с последствиями для борьбы с трипаносомозом. Ад Паразитол 53, 1–83. [PubMed] [Google Scholar]
32. Дайер Н.А., Роуз С., Эджех Н.О. и Акоста-Серрано А. (2013). Летающие трипсы: выживание и созревание трипаносом у мух цеце. Тенденции Паразитол
29, 188–196. 10.1016/j.
33. Аксой Э., Виньерон А., Бинг Х., Чжао Х., О’Нил М., Ву Ю.Н., Бангс Дж.Д., Вайс Б.Л., Аксой С. ( 2016). Оболочка трипаносом VSG африканских млекопитающих усиливает способность цеце переносчика. Proc Natl Acad Sci U S A 113, 6961–6966. 10.1073/пнас.1600304113 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Mantilla B.S., Marchese L., Casas-Sanchez A., Dyer N.A., Ejeh N., Biran M., Bringaud F., Lehane M.J., Акоста-Серрано А. и Зильбер А.М. (2017). Метаболизм пролина необходим для выживания Trypanosoma brucei brucei в переносчике цеце. PLoS Патог 13, е1006158 10.1371/журнал.ppat.1006158 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Caljon G., Van Den Abbeele J., Sternberg J.M., Coosemans M., De Baetselier P., and Magez S. (2006). Слюна мухи цеце искажает иммунный ответ на Th3 и индуцирует анти-векторные антитела, которые являются полезным инструментом для оценки воздействия.
36. Аксой С., Вайс Б.Л., Аттардо Г.М. (2014б). Динамика трипаносомной передачи у цеце. Curr Opin Insect Sci 3, 43–49. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Weiss B., and Aksoy S. (2011). Микробиом влияет на компетентность насекомых-хозяев-переносчиков. Тенденции Паразитол 27, 514–522. 10.1016/j.pt.2011.05.001 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Аксой С., Вайс Б. и Аттардо Г. (2008). Паратрансгенез применяется для борьбы с сонной болезнью, передающейся цеце. Adv Exp Мед Биол 627, 35–48. 10.1007/978-0-387-78225-6_3 [PubMed] [CrossRef] [Google Scholar]
39. De Vooght L., Caljon G., De Ridder K. and Van Den Abbeele J. (2014). Доставка функционального антитрипаносомного нанотела в различные ткани мухи цеце через бактериальный симбионт Sodalis glossinidius . Факт микробной клетки 13, 156 10.1186/с12934-014-0156-6 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40.



 Заканчивается рассматриваемый этап проникновением одноклеточного в хоботок насекомого.
Заканчивается рассматриваемый этап проникновением одноклеточного в хоботок насекомого. Через несколько недель происходит самозаживление.
Через несколько недель происходит самозаживление.
 В течение пилотного периода также следует проводить регулярный мониторинг веса и надоя молока.
В течение пилотного периода также следует проводить регулярный мониторинг веса и надоя молока.