Анатомия и физиология пищевода, физиология пищевода, верхняя часть пищевода, физиологическая кардия, анатомия пищевода, кардиальный жом, пищевод анатомия, физиологические сужения пищевода, сужения пищевода анатомия
Главная > Пациентам > Пищевод > Анатомия и физиология пищевода
Пищевод (лат. esophagus – эзофагус) представляет собой полую мышечную трубку, соединяющую глотку с желудком. Стенка пищевода имеет трехслойное строение: наружная оболочка – адвентиция, средняя — мышечная, внутренняя – слизистая. Ее толщина составляет всего 3-4 мм. Длина пищевода взрослого человека достигает в среднем 24-25 см, ширина просвета – 2,0-3,0 см.
В области шеи верхняя часть пищевода располагается позади трахеи. Физиология пищевода такова, что место перехода глотки в пищевод у взрослого соответствует уровню VI шейного позвонка или нижнему краю перстневидного хряща. Затем пищевод опускается вдоль позвоночника в грудную полость, залегая глубоко в заднем средостении. Спереди к нему прилежит трахея и левый главный бронх, сзади — аорта и позвоночник. И, наконец, через собственное отверстие в диафрагме пищевод проникает в полость живота, где практически сразу переходит в кардиальную часть желудка. Место перехода пищевода в желудок проецируется на уровне XI грудного позвонка (анатомическая кардия). Соответственно топографии пищевода различают три его отдела: шейный (5-8 см), грудной (15-18 см) и брюшной (1-3 см).
Спереди к нему прилежит трахея и левый главный бронх, сзади — аорта и позвоночник. И, наконец, через собственное отверстие в диафрагме пищевод проникает в полость живота, где практически сразу переходит в кардиальную часть желудка. Место перехода пищевода в желудок проецируется на уровне XI грудного позвонка (анатомическая кардия). Соответственно топографии пищевода различают три его отдела: шейный (5-8 см), грудной (15-18 см) и брюшной (1-3 см).
Пищевод имеет три постоянных сужения, называемых «физиологическими». Верхнее (диаметром 14 мм) – на уровне глоточно-пищеводного перехода, среднее (диаметром 16 мм) – в заднем средостении на уровне бифуркации трахеи в месте прилежания к пищеводу аорты и левого главного бронха, нижнее (диаметром 16-19 мм) — соответствует пищеводному отверстию диафрагмы. Физиологические сужения пищевода могут явиться местом застревания инородных тел, возникновения стриктур и дивертикулов.
Функция пищевода состоит в продвижении пищевого комка от глотки до желудка.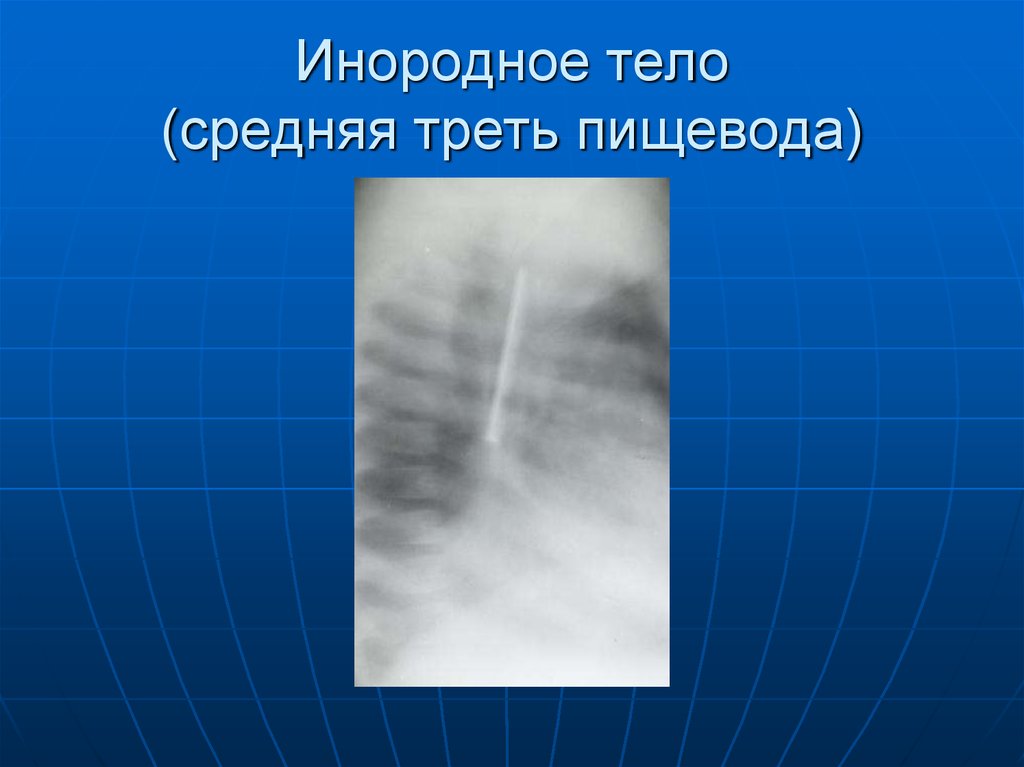 В его обеспечении основную роль играет мускулатура пищевода, обладающая собственной перистальтической активностью. После попадания пищи в пищевод глоточно-пищеводный сфинктер смыкается, а кардиальный жом (физиологическая кардия) расслабляется. Регуляция функции кардии осуществляется как центральной нервной системой (т.н. глоточно-кардиальный рефлекс), так и периферической (центры в самой кардии и дистальной трети пищевода). Кроме того, на тонус кардии влияют гастроинтестинальные гормоны.
В его обеспечении основную роль играет мускулатура пищевода, обладающая собственной перистальтической активностью. После попадания пищи в пищевод глоточно-пищеводный сфинктер смыкается, а кардиальный жом (физиологическая кардия) расслабляется. Регуляция функции кардии осуществляется как центральной нервной системой (т.н. глоточно-кардиальный рефлекс), так и периферической (центры в самой кардии и дистальной трети пищевода). Кроме того, на тонус кардии влияют гастроинтестинальные гормоны.
Другие направления: язвенная болезнь желудка и двенадцатиперстной кишки, хирургия желудка, симптомы грыжы пищеводного отверстия диафрагмы, грыжа передней брюшной стенки, пупочная грыжа у детей.
Более
1000 операций
из них более 300 на пищеводе
Автор более
120 научных работ
в т. ч. двух монографий
Премия
Б.В. Петровского
за лучшую научную работу в области хирургии
Редкие опухоли пищевода
Введение
В последнее время отмечается неуклонный рост злокачественных новообразований пищевода, среди которых лидирующие позиции занимают плоскоклеточный рак и аденокарцинома пищевода.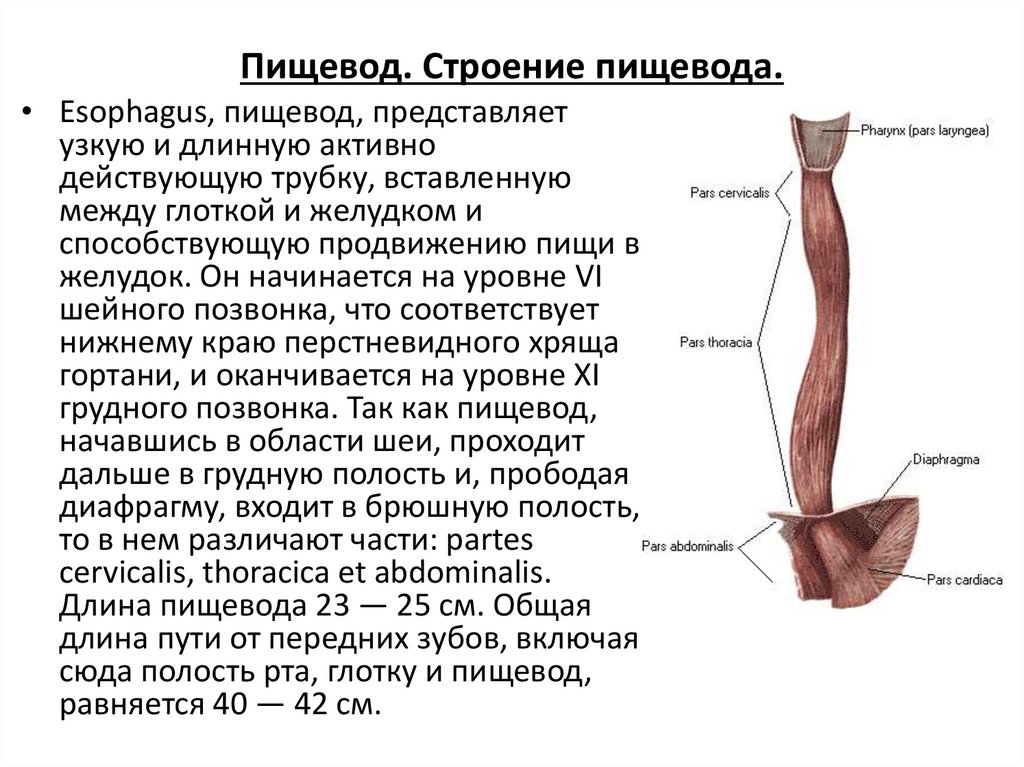 Нами были проанализированы редкие опухоли пищевода за период с 2000 по 2017 г., частота возникновения которых не превышает 2% от общего числа опухолей данной локализации и морфологическая диагностика которых может вызывать сложности у патологоанатомов. К таким опухолям относятся первичная меланома пищевода, нейроэндокринные и гастроинтестинальные стромальные опухоли пищевода, а также зернистоклеточная опухоль.
Нами были проанализированы редкие опухоли пищевода за период с 2000 по 2017 г., частота возникновения которых не превышает 2% от общего числа опухолей данной локализации и морфологическая диагностика которых может вызывать сложности у патологоанатомов. К таким опухолям относятся первичная меланома пищевода, нейроэндокринные и гастроинтестинальные стромальные опухоли пищевода, а также зернистоклеточная опухоль.
Проанализированы данные мировой литературы, а также собственные наблюдения в МНИОИ им. П.А. Герцена за период с 2000 по 2018 г.
Первичная меланома пищевода
Традиционно меланома рассматривается в группе опухолей кожи, поскольку наиболее часто онкологи и патологоанатомы сталкиваются в своей рутинной работе именно с этой локализацией. Внекожные формы, по данным разных авторов [3, 4], составляют менее 1—1,5%. Меланома ЖКТ в сравнении с другими злокачественными опухолями данной локализации является редким заболеванием. На его долю приходится менее 1% от числа всех диагностируемых в мире меланом слизистых оболочек.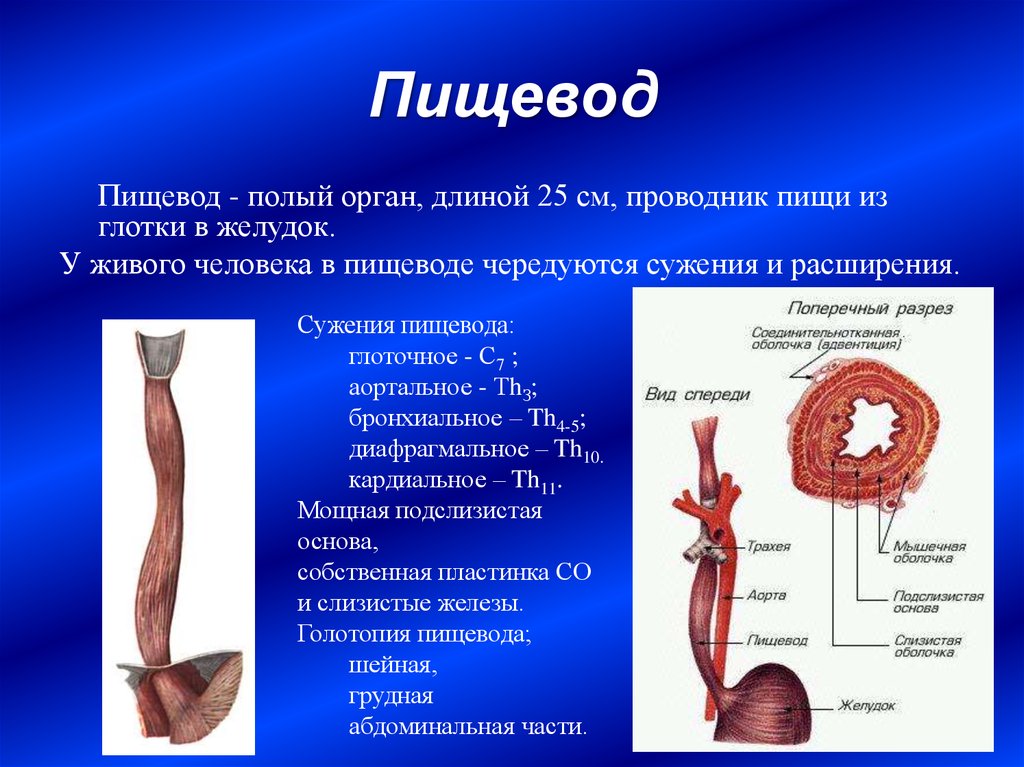
Меланома пищевода чаще бывает метастатическая, чем первичная, которая составляет 0,1—0,2% от всех злокачественных опухолей пищевода и 0,18% от всех меланом слизистых оболочек. В мировой литературе на данный момент описано всего 300 наблюдений. Ежегодная заболеваемость данной патологией составляет около 0,02—0,036 на 1 млн населения [5]. Пик заболеваемости приходится на шестую-седьмую декаду жизни, а соотношение заболевших мужчин и женщин равно 2:1 [1].
Первоначальные клинические проявления заболевания скудные, не имеют специфических черт и становятся более выраженными в более поздней стадии заболевания. Больные жалуются на дисфагию, боли в эпигастрии или за грудиной, связанные с приемом пищи. Эпизоды желудочно-кишечного кровотечения и резкая значительная потеря массы тела характерны для запущенных стадий заболевания.
В момент постановки диагноза метастазы выявляются у 30—40% больных.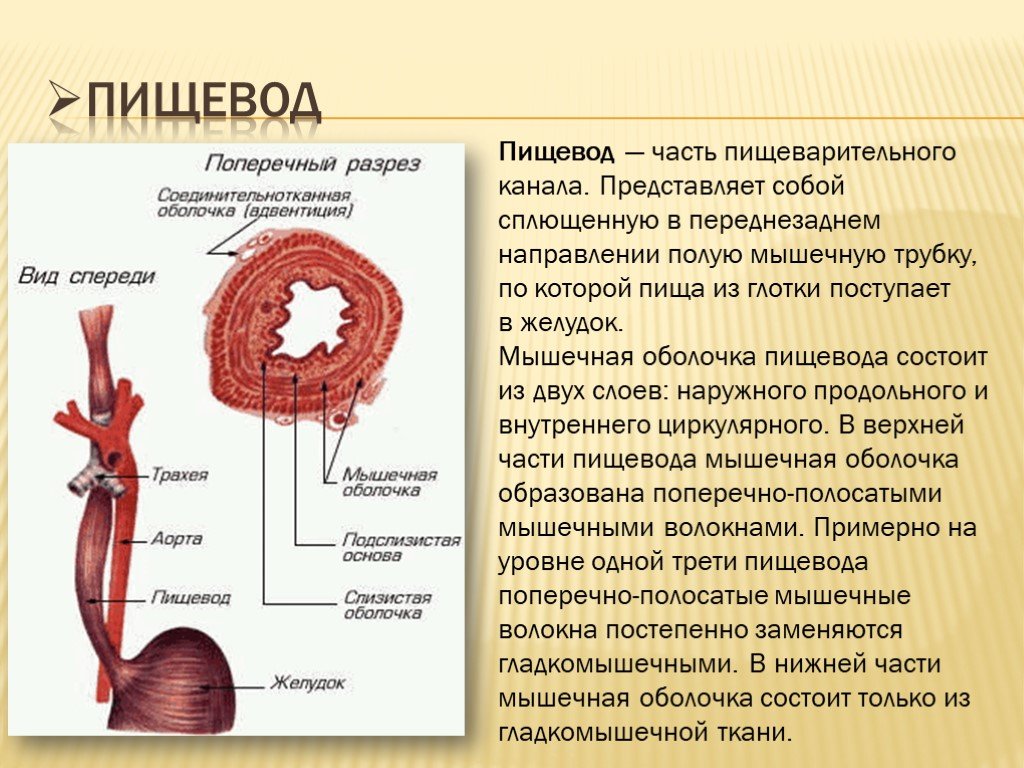 Частота появления метастазов в региональных лимфатических узлах достигает 40—80%. Чаще других поражаются параэзофагеальные и чревные лимфатические узлы, а также лимфатические узлы средостения.
Частота появления метастазов в региональных лимфатических узлах достигает 40—80%. Чаще других поражаются параэзофагеальные и чревные лимфатические узлы, а также лимфатические узлы средостения.
Гематогенное метастазирование происходит в основном в печень, легкие и головной мозг [5].
Опухоль наиболее часто локализуется в средней и нижней трети пищевода. Лишь в 10% всех описанных в литературе наблюдений меланома обнаруживалась в верхней трети пищевода. Опухоль имеет вид одиночного полиповидного образования на широком основании, с гладкой или изъязвленной поверхностью, либо солитарного плоского образования, от светло-коричневого до черного цвета в зависимости от содержания пигмента. Возможно обнаружение видимых глазом «отсевов» на некотором расстоянии от основной опухоли. В 25% случаев меланомы пищевода не имееют окраски. Чаще всего опухоль растет экзофитно, однако имеется тенденция опухоли распространяться в продольном направлении вдоль подслизистой оболочки стенки пищевода.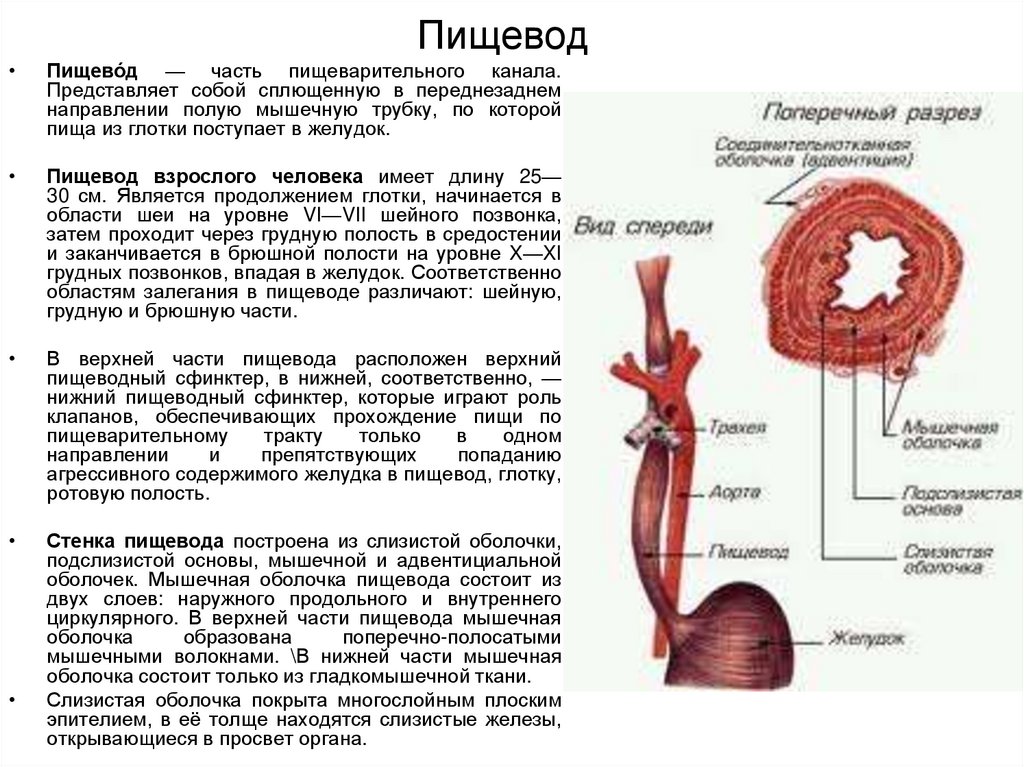
Гистологически меланома пищевода не отличима от меланомы кожи (рис. 1). Рис. 1. Меланома пищевода. Рис. 1. Меланома пищевода. Выделяют эпителиоклеточный, веретеноклеточный, невоклеточный, смешанный варианты меланомы. Необходимо отметить, что меланома пищевода зачастую развивается на фоне атипичной меланоцитарной пролиферации, и очень часто такие участки обнаруживаются рядом с инвазивной опухолью, что подтверждает первичное, а не метастатическое поражение.
Для установления диагноза первичной меланомы пищевода помогает метод иммуногистохимического исследования, особенно в таких случаях, когда диагноз меланомы не является однозначным. В клетках опухоли выявляется положительная экспрессия с антителами к Виментину, S-100 протеину, HMB-45, Melan-A, Tyrosinase в сочетании с отсутствием экспрессии кератинов и общего лейкоцитарного антигена (рис. 2). Рис. 2. Первичная меланома пищевода. Рис. 2. Первичная меланома пищевода.
Средняя продолжительность жизни при первичной меланоме пищевода составляет 10 мес (диапазон от 4—6 до 9—14,5 мес).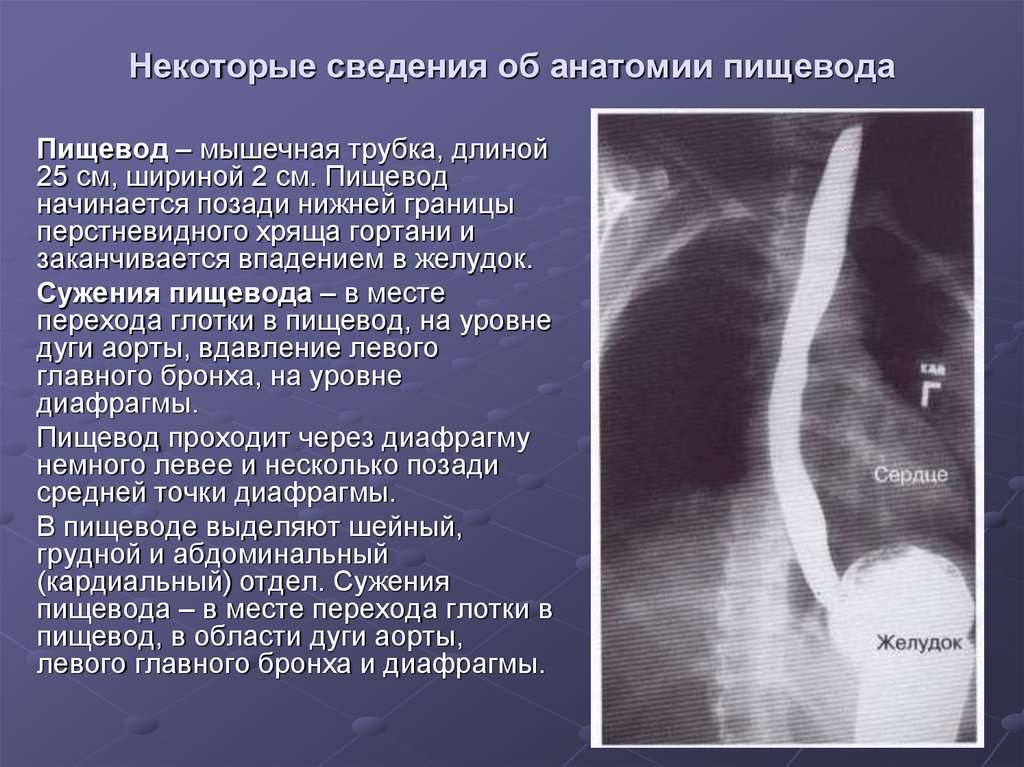 В МНИОИ им. П.А. Герцена за период с 2000 по 2017 г. диагностированы два наблюдения первичной меланомы пищевода у женщин в возрасте 59 лет и 61 года. Обе пациентки обратились к врачу по месту жительства с жалобами на боли за грудиной, которые появлялись непосредственно после приема пищи. При обследовании выявлена опухоль в средней трети пищевода, и с диагнозом: рак пищевода, направлены в наш институт. При ЭГДС и КТ органов грудной полости — картина, расценена как лейомиосаркома пищевода, исходящей из заднеправой стенки, без признаков выхода в клетчатку. Выполнена операция в объеме одномоментной резекции и пластики пищевода желудочным стеблем с лимфаденэктомией.
В МНИОИ им. П.А. Герцена за период с 2000 по 2017 г. диагностированы два наблюдения первичной меланомы пищевода у женщин в возрасте 59 лет и 61 года. Обе пациентки обратились к врачу по месту жительства с жалобами на боли за грудиной, которые появлялись непосредственно после приема пищи. При обследовании выявлена опухоль в средней трети пищевода, и с диагнозом: рак пищевода, направлены в наш институт. При ЭГДС и КТ органов грудной полости — картина, расценена как лейомиосаркома пищевода, исходящей из заднеправой стенки, без признаков выхода в клетчатку. Выполнена операция в объеме одномоментной резекции и пластики пищевода желудочным стеблем с лимфаденэктомией.
При патологоанатомическом исследовании операционного материала в нижней трети пищевода визуализировалась крупнобугристая опухоль темно-багрового цвета с изъязвленной поверхностью, размером 2×1,5×1,5 см, обтурирующая просвет пищевода на ¾ его окружности. При микроскопическом исследовании: злокачественная пигментная меланома смешанного эпителио-веретено-невоклеточного строения, с инвазией мышечного слоя стенки пищевода, участками лентиго-меланомы в краях опухоли.
В дальнейшем проведено три курса иммунотерапии. Спустя 3 мес у пациентки возник рецидив в области послеоперационного рубца, в связи с чем она была госпитализирована в МНИОИ им. П.А. Герцена.
При обследовании: в проекции верхней трети желудочного трансплантата определяется пигментное образование, диаметром до 2 см, с изъязвлением, с нарушением целостности стенки трансплантата. Выявлено метастатическое поражение печени, селезенки.
Проведено три курса ПХТ с некоторым положительным эффектом: изъязвление на коже в проекции верхней трети желудочного трансплантата эпителизировалось, также отмечалось уменьшение размеров метастаза в печени на 25%.
Однако при контрольном УЗИ органов брюшной полости обнаружены увеличение количества и размеров метастазов в печени до 10 см в диаметре, появление множественных узловых образований в селезенке диаметром до 6 см. В области стебля желудочного трансплантата — рецидив изъязвления, появление участков гиперпигментации кожи; при пальпации описанной области — в парастебельчатой клетчатке два плотных лимфатических узла, диаметром по 0,5 см.
В области стебля желудочного трансплантата — рецидив изъязвления, появление участков гиперпигментации кожи; при пальпации описанной области — в парастебельчатой клетчатке два плотных лимфатических узла, диаметром по 0,5 см.
Проведен курс полихимиотерапии с последующей операцией в объеме: резекция стенки желудочного трансплантата, иссечение узлов парастебельчатой клетчатки. При гистологическом исследовании: метастаз меланомы смешанного строения.
Течение послеоперационного периода осложнилось несостоятельностью швов анастомоза, формированием желудочного свища.
Спустя 5 мес больная умерла.
Нейроэндокринные опухоли пищевода
Нейроэндокринные опухоли (НЭО) относят к числу редких новообразований желудочно-кишечного тракта (ЖКТ). Повышенный интерес к этой проблеме у морфологов объясняется несомненным ростом их выявляемости, наличием многих нерешенных вопросов, касающихся терминологии, клинической и морфологической классификации. Однако НЭО пищевода встречаются исключительно редко и составляют примерно 0,04—0,05% НЭО всех локализаций, включая ЖКТ [6].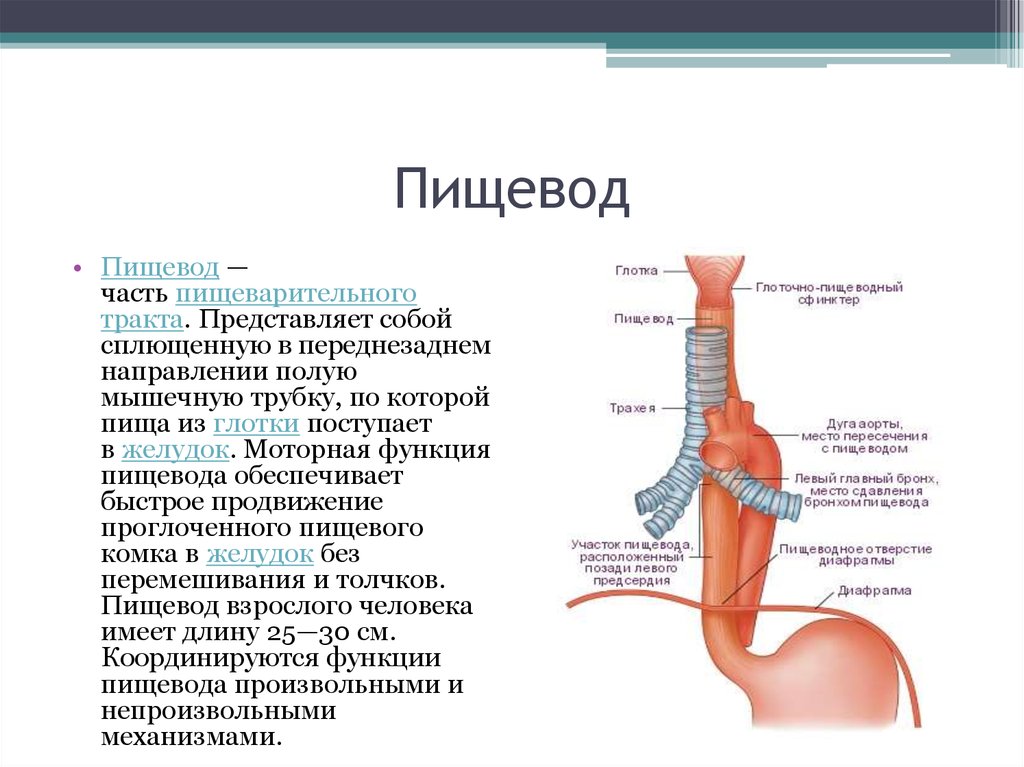 Их частота среди всех злокачественных опухолей пищевода 0,05—7,6% [1]. Согласно данным мировых источников литературы [6, 7], описано не более 100 случаев нейроэндокринных карцином пищевода (НЭК).
Их частота среди всех злокачественных опухолей пищевода 0,05—7,6% [1]. Согласно данным мировых источников литературы [6, 7], описано не более 100 случаев нейроэндокринных карцином пищевода (НЭК).
Несмотря на столь редкие наблюдения, в классификации ВОЗ (2010) НЭО пищевода выделены в самостоятельную нозологическую форму [1], которая предлагает стандартные определения «нейроэндокринная опухоль» и «нейроэндокринный рак». Все высокодифференцированные новообразования, независимо от того, ведут ли они себя «доброкачественно» или дают метастазы, обозначают термином «нейроэндокринная опухоль» (neuroendocrine tumor — NET), и они имеют градацию G1 или G2. Все низкодифференцированные новообразования называют термином «нейроэндокринный рак» (neuroendocrine carcinoma— NEC), они имеют градацию G3. В соответствии с классификацией (WHO, 2010), для обозначения всей группы опухолей данного типа предложен термин «нейроэндокринные неоплазии» (neuroendocrine neoplasm — NEN), который объединяет опухоли всех степеней злокачественности (низкой, промежуточной, высокой).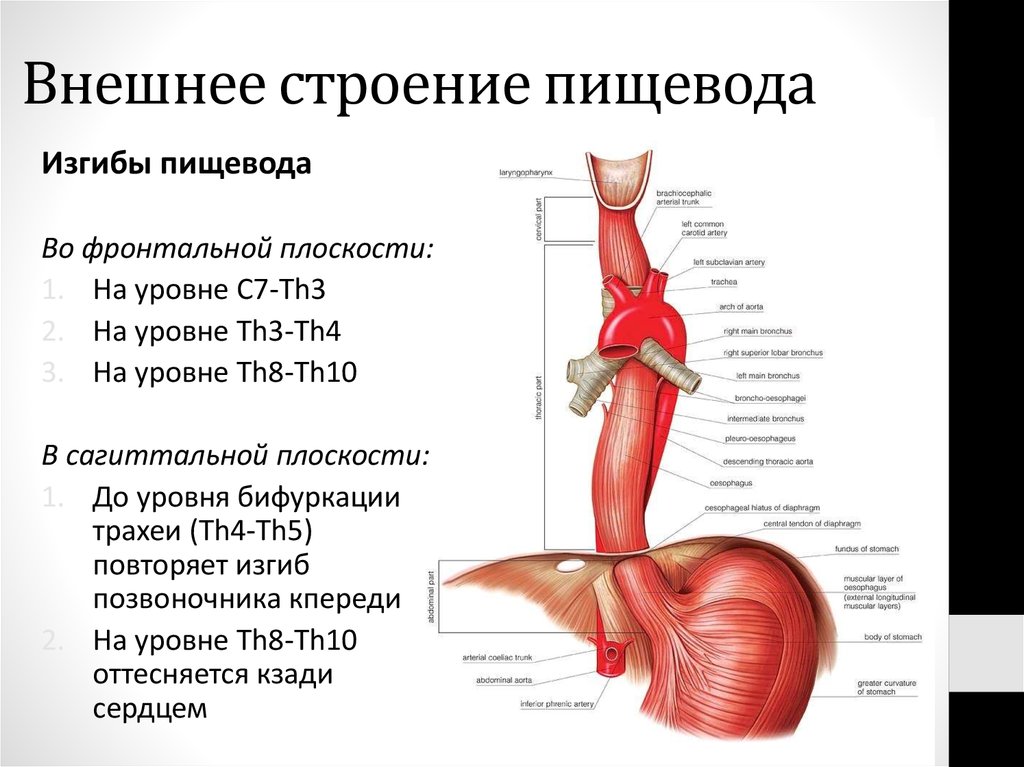
НЭО пищевода выявляют у лиц в возрасте от 30 до 82 лет, но чаще на шестой-седьмой декаде жизни. Средний возраст больных 56 лет. Мужчины поражаются в 6 раз чаще, чем женщины.
Большинство нейроэндокринных опухолей пищевода — высокодифференцированные, нефункционирующие и не сопровождаются специфическими гормональными синдромами, редко метастазируют в лимфатические узлы, отличаются медленным ростом и поэтому не имеют развернутой клинической картины, часто являясь случайной находкой. Иногда в более редких случаях сочетаются с пищеводом Барретта, аденокарциномой [7]. Дисфагия, потеря массы тела, боли за грудиной являются основными симптомами НЭО.
НЭО пищевода обычно локализуются в нижней трети пищевода, что скорее всего связано с большим количеством эндокринных клеток в этом отделе. Сравнительно реже опухоль обнаруживают в средней трети пищевода [8, 9].
Макроскопически высокодифференцированные НЭО мелкие, полиповидные, редко бывают изъязвленными. Умеренно дифференцированные НЭО имеют более крупные размеры, чаще встречается изъязвление.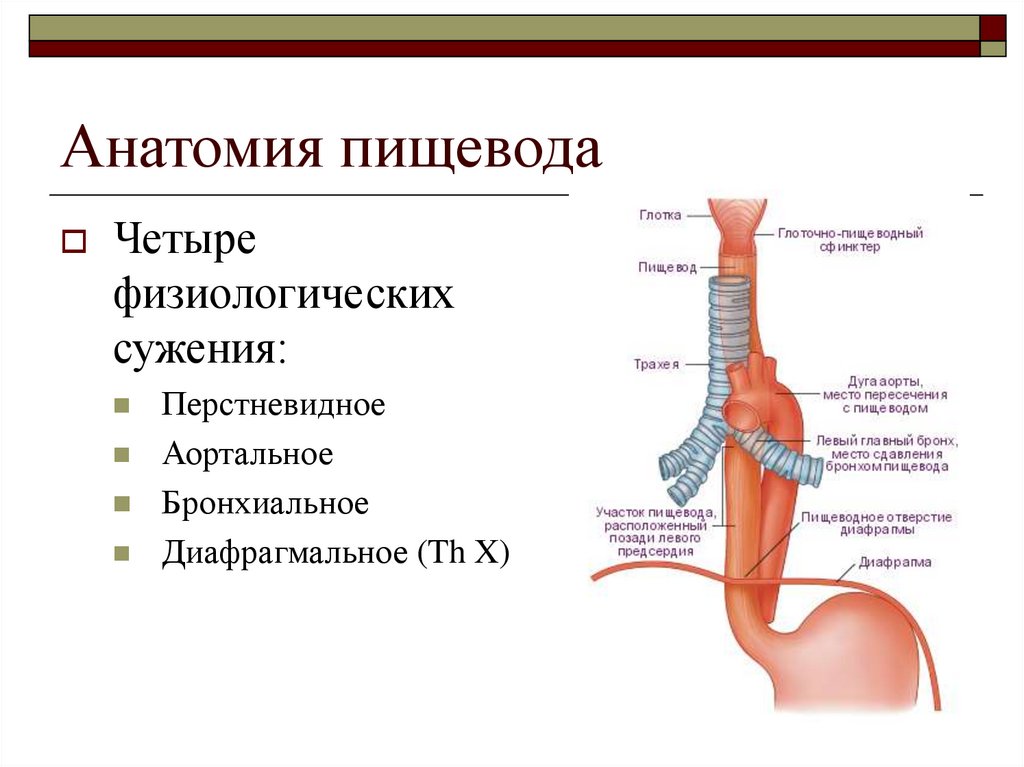
При микроскопическом исследовании НЭО G1 состоит из округлых мономорфных клеток, расположенных диффузно, или формирующих комплексы железистоподобных структур в виде «розеток», «палисада», а также криброзные структуры. Клетки опухоли с центрально расположенным ядром без полиморфизма и митозов со своеобразной структурой хроматина в виде «соли и перца». В отличие от мелкоклеточного рака отсутствуют признаки некроза, синдрома раздавливания клеток. При иммуногистохимическом исследовании клетки опухоли дают положительную реакцию с хромогранином, синаптофизином, NSE, цитокератинами. Необходимо отметить, что индекс пролиферативной активности Ki-67 в высокодифференцированных НЭО не превышает 5%.
НЭО G2 гистологически построены из солидных, ацинарных, трабекулярных структур. Клетки опухоли имеют более выраженный полиморфизм с очевидными многочисленными митозами. Часто присутствуют очаги некроза. Эти опухоли также экспрессируют нейроэндокринные маркеры.
Эти опухоли также экспрессируют нейроэндокринные маркеры.
Низкодифференцированная нейроэндокринная карцинома (НЭК) агрессивная, инфильтративно растущая опухоль, как правило, с одновременным метастазированием, построенная из мелких или крупных клеток.
Крупноклеточный нейроэндокринный рак пищевода в подавляющем большинстве случаев сочетается с пищеводом Барретта. Клетки больших и средних размеров, с широкой эозинофильной цитоплазмой, низким ядерно-цитоплазматическим соотношением, наличием нуклеол. Мелкоклеточный же вариант неотличим от мелкоклеточного рака легкого и составляет 1% от всех злокачественных опухолей пищевода. Макроскопически представляет собой опухоль больших размеров, экзофитно растущую в просвет пищевода, однако может быть выражен и инфильтративный рост опухоли. Клетки опухоли с малозаметной цитоплазмой, гиперхромными ядрами с наличием или отсутствием мелких нуклеол формируют солидные пласты и гнезда. Обращает на себя внимание значительное количество митозов. В 50% случаев наблюдается очаговая плоскоклеточная или железистая дифференцировка. Обнаруживается некроз, синдром раздавливания клеток. Клетки опухоли дают положительную реакцию с хромогранином, CD-56, Р-53, цитокератинами. Возможна положительная экспрессия NSE, синаптофизина.
В 50% случаев наблюдается очаговая плоскоклеточная или железистая дифференцировка. Обнаруживается некроз, синдром раздавливания клеток. Клетки опухоли дают положительную реакцию с хромогранином, CD-56, Р-53, цитокератинами. Возможна положительная экспрессия NSE, синаптофизина.
Мелкоклеточный рак пищевода имеет плохой прогноз. Выживаемость при данном заболевании составляет от 6 до 12 мес. В МНИОИ им. П.А. Герцена за период с 2000 по 2017 г. диагностированы 48 нейроэндокринных опухолей пищевода, в 15 случаях это высокодифференцированные неактивные клинически опухоли.
Крупноклеточный нейроэндокринный рак пищевода мы диагностировали в 11 наблюдениях. В подавляющем большинстве — это были мужчины в возрасте от 59 до 80 лет. Средний возраст больных составил 69 лет.
Мелкоклеточный рак пищевода диагностирован в 22 наблюдениях. В основном это были мужчины в возрасте от 49 до 77 лет. Средний возраст больных составил 65 лет.
У женщин было 3 наблюдения мелкоклеточного рака пищевода и 1 — крупноклеточного рака.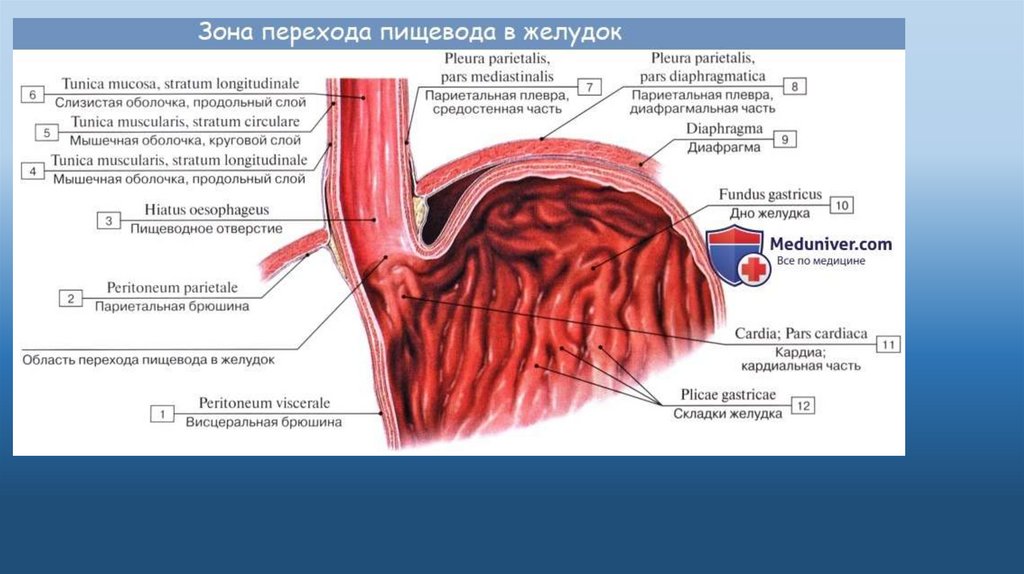 Возраст заболевших женщин от 49 до 79 лет. Около 2/3 больных не предъявляли никаких жалоб, а другая 1/3 больных жаловались на длительно существующую изжогу и дискомфорт за грудиной, связанный с приемом пищи.
Возраст заболевших женщин от 49 до 79 лет. Около 2/3 больных не предъявляли никаких жалоб, а другая 1/3 больных жаловались на длительно существующую изжогу и дискомфорт за грудиной, связанный с приемом пищи.
Во всех описанных наблюдениях опухоль располагалась в нижней трети пищевода и выглядела как экзофитный узел на широком основании, с гладкой серой поверхностью, в части случаев — с изъязвлением по поверхности. Микроскопически наиболее часто мы наблюдали эпителиоидный вариант нейроэндокринных опухолей, представленный относительно одноморфными овальной или округлой формы клетками, формирующими трабекулярные, розеткоподобные структуры, а также солидные поля. Веретеноклеточный вариант нейроэндокринных опухолей пищевода встречается гораздо реже, по нашим данным, не более чем в 1% случаев от всех нейроэндокринных опухолей ЖКТ. В низкодифференцированных опухолях обращают на себя внимание выраженный полиморфизм, очень высокая митотическая активность, наличие некроза, синдрома «раздавливания клеток». В каждом конкретном случае диагноз нейроэндокринной опухоли подтверждался иммуногистохимическим исследованием.
В каждом конкретном случае диагноз нейроэндокринной опухоли подтверждался иммуногистохимическим исследованием.
Опухоль Абрикосова
Зернисто-клеточная опухоль, или опухоль Абрикосова, в качестве самостоятельной нозологической единицы выделена А.И. Абрикосовым в 1925 г. в докладе на Всероссийском съезде патологоанатомов в Москве. Он же в 1931 г. впервые диагностировал поражение гортани, пищевода и отметил возможность злокачественного перерождения.
Зернисто-клеточная опухоль ранее включалась в группу миогенных опухолей на основании некоторого морфологического сходства ее клеточных элементов с эмбриональными мышечными клетками. В дальнейшем появился ряд работ, на основании результатов которых высказана гипотеза, что зернистые клетки опухоли скорее всего берут свое начало из оболочки нерва, а не из мышц. J. Garancis в 1970 г. предположил, что зернистые клетки представляют собой разновидность шванновских клеток. Происхождение опухоли из шванновских клеток было также подтверждено и другими авторами, обнаружившими в клетках опухолей экспрессию протеина основного миелина (S100) и других протеинов миелиновых волокон периферических нервов; мышечные же белки, напротив, при этом выявлялись не всегда [10, 11].
Чаще всего опухоль Абрикосова встречается у взрослых 30—60 лет, причем пик заболевания приходится на 39 лет. Женщины поражаются в три раза чаще, чем мужчины. Опухоли Абрикосова у детей казуистически редки [10]. Зернисто-клеточная опухоль наиболее часто поражает кожу, слизистую оболочку полости рта [11, 12]. Как правило, эти опухоли представляют собой единичные поражения, однако в 10% случаев встречаются и множественные поражения, которые могу быть синхронными и метахронными. Желудочно-кишечный тракт поражается редко, всего в 6—10% случаев, однако в большинстве случаев (30—60%) опухоль обнаруживалась в пищеводе [13].
В 65% случаев опухоль локализуется в нижней трети пищевода. Средняя и проксимальная треть пищевода поражаются в 20 и 15% случаев соответственно. Клинические проявления зернисто-клеточной опухоли пищевода не имеют каких-либо специфических черт, но имеют прямую взаимосвязь с размером опухолевого узла. Так, опухоли, не достигающие размеров 10 мм, могут протекать бессимптомно и быть случайной находкой при обследовании пациента по поводу другой патологии ЖКТ [14].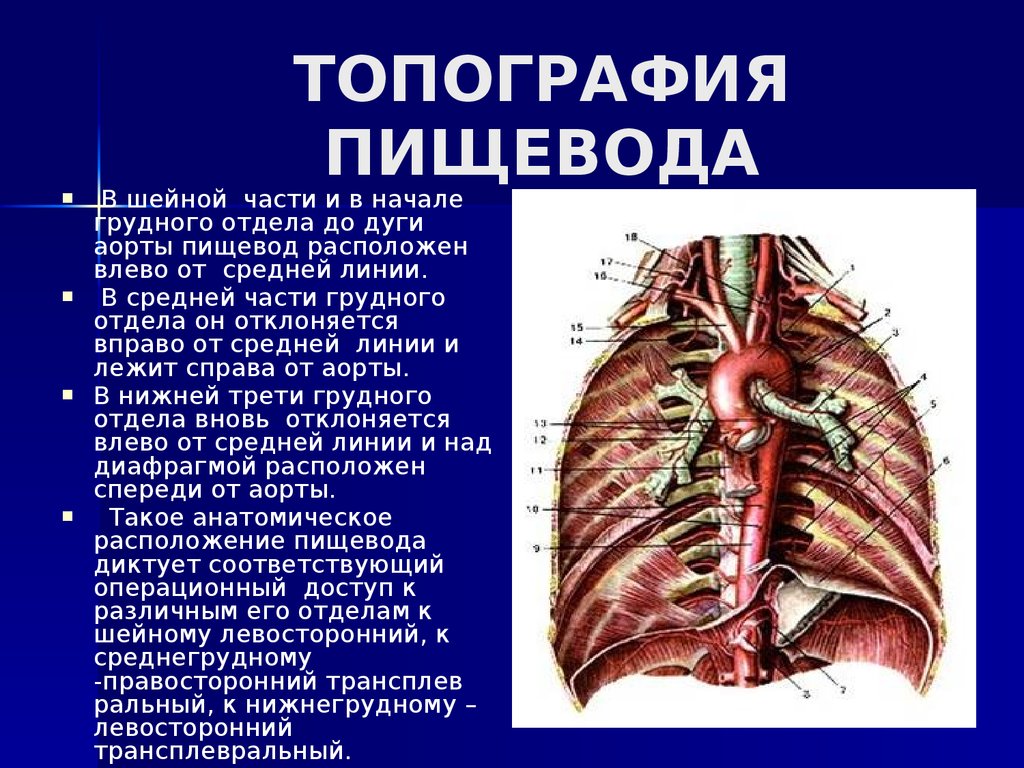 При увеличении опухоли более 10—20 мм больные обычно жалуются на дисфагию, загрудинные боли.
При увеличении опухоли более 10—20 мм больные обычно жалуются на дисфагию, загрудинные боли.
Макроскопически опухоль имеет вид одиночного опухолевого узла плотной консистенции, располагающегося в субмукозном слое стенки пищевода. На разрезе опухоль желтовато-серого цвета, с инфильтративным типом роста. В процесс вовлекается слизистая оболочка. Следует обратить особое внимание на то, что опухоль в большинстве случаев является доброкачественной, несмотря на инфильтративный тип роста. Злокачественные варианты встречаются крайне редко.
При микроскопическом исследовании опухоль представлена полигональными эпителиоподобными и вытянутыми веретенообразными клетками с обильной эозинофильной гранулярной цитоплазмой, содержащей фаголизосомы. Клетки содержат центрально расположенные, мелкие пикнотичные ядра (рис. 3). Рис. 3. Опухоль Абрикосова. Рис. 3. Опухоль Абрикосова.
Иммуногистохимическое исследование играет немаловажную роль в постановке диагноза зернисто-клеточной опухоли.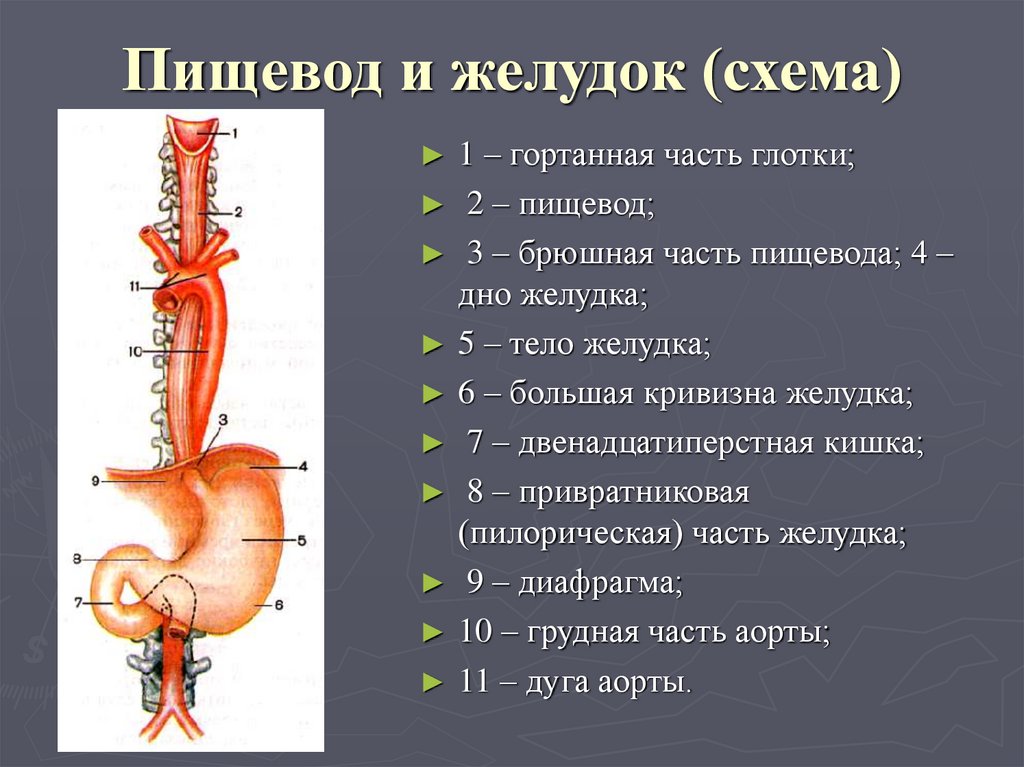 В соответствии с нейрогенным происхождением опухоль Абрикосова дает положительную реакцию с кислотой Шифа (ШИК-реакция), экспрессирует S100, нестин, CD-68 и не экспрессирует гладкомышечный актин, десмин, CD-117, CD-34 [13]. Согласно последним исследованиям, рекомендуется дополнительно использовать Ki-67 для классификации опухоли как доброкачественной, атипичной или злокачественной.
В соответствии с нейрогенным происхождением опухоль Абрикосова дает положительную реакцию с кислотой Шифа (ШИК-реакция), экспрессирует S100, нестин, CD-68 и не экспрессирует гладкомышечный актин, десмин, CD-117, CD-34 [13]. Согласно последним исследованиям, рекомендуется дополнительно использовать Ki-67 для классификации опухоли как доброкачественной, атипичной или злокачественной.
Злокачественные зернисто-клеточные опухоли, как уже было сказано выше, крайне редки. По данным мировой литературы, они встречаются всего в 1—2% всех случаев зернисто-клеточных опухолей. Тем не менее выявление признаков злокачественности важно из-за потенциально агрессивного поведения этих опухолей и плохого прогноза, связанного с метастатическим поражением.
В 1998 г. Fanburg-Smith и соавт. предложили 6 гистологических критериев для выделения доброкачественных и атипичных или злокачественных зернистоклеточных опухолей. Эти гистологические критерии определяются следующими характеристиками: повышенное ядерно-цитоплазматическое соотношение, ядерный полиморфизм, наличие везикулярных ядер с заметными ядрышками, некроз опухоли, веретеноклеточное строение и повышенная митотическая активность.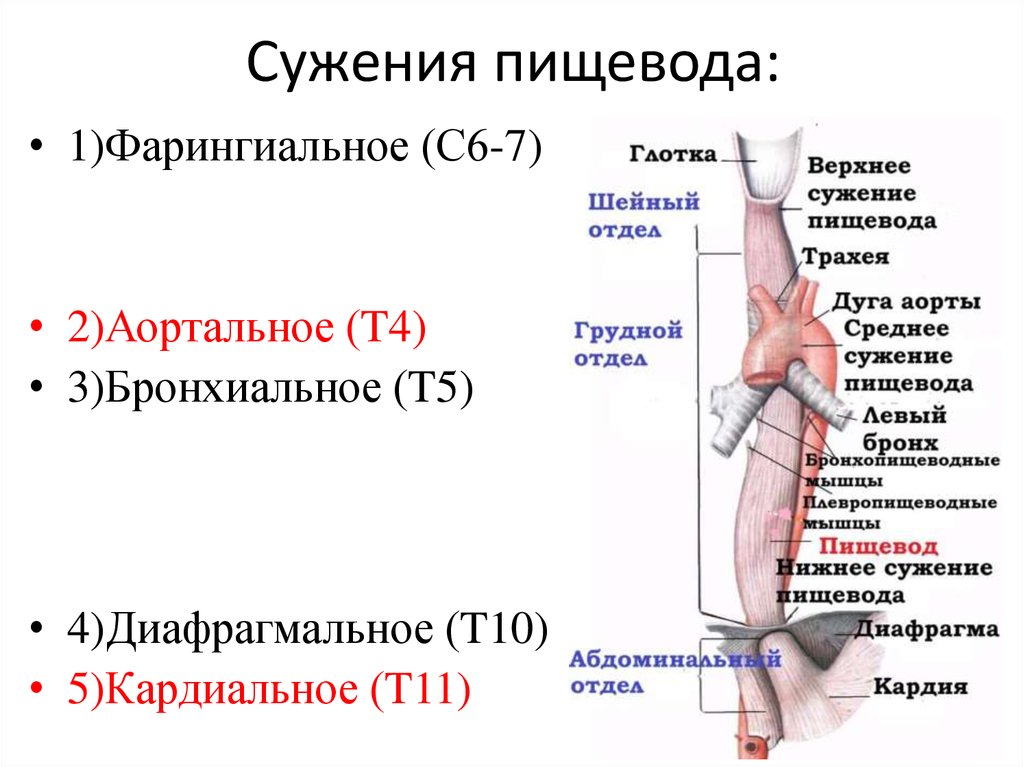 Опухоли с сочетанием 3 и более из указанных критериев следует относить к злокачественным, в то время как опухоли с 1—2 критериями классифицируются как атипичные. Опухоли, не удовлетворяющие ни одному из предложенных критериев, являются доброкачественными.
Опухоли с сочетанием 3 и более из указанных критериев следует относить к злокачественным, в то время как опухоли с 1—2 критериями классифицируются как атипичные. Опухоли, не удовлетворяющие ни одному из предложенных критериев, являются доброкачественными.
Эндоскопическая резекция считается безопасным и эффективным вариантом лечения зернисто-клеточной опухоли пищевода. Рецидивы заболевания при условии радикального удаления встречаются крайне редко. Атипичные и злокачественные варианты опухоли Абрикосова имеют худший прогноз и требуют более тщательного обследования и наблюдения пациента.
Мы наблюдали зернисто-клеточную опухоль пищевода у мужчины 46 лет.
В течение года больной отмечал появление дискомфорта и болей за грудиной после приема пищи, в связи с чем обратился к гастроэнтерологу по месту жительства. По результатам ЭГДС-исследования выявлено образование в нижнегрудном отделе пищевода диаметром до 0,5 см.
В течение последующих 5 лет регулярно наблюдался. При очередном контрольном ЭГДС-исследовании образование в пищеводе увеличилось в диаметре до 2 см. Самостоятельно обратился в наш институт.
При очередном контрольном ЭГДС-исследовании образование в пищеводе увеличилось в диаметре до 2 см. Самостоятельно обратился в наш институт.
По результатам обследования в МНИОИ им. П.А. Герцена, при КТ органов грудной полости — в ретроперикардиальном сегменте пищевода, по правой стенке, определяется полиповидное образование, размером 1,6×1,5 см, пролабирующее в просвет пищевода, инфильтрирующее все слои его стенки. Эндоскопически и эндосонографически — картина неэпителиальной опухоли нижнегрудного отдела пищевода с признаками инвазии подслизистого слоя, увеличение параэзофагеальных лимфатических узлов неясного генеза.
Выполнена лапароскопическая резекция пищевода. Макроскопически в пищеводе в 34 см от резцов на передней стенке визуализируется подслизистая опухоль, умеренно подвижная, плотная, размером до 2 см, слизистая оболочка над ней разрыхлена, гиперемирована.
При гистологическом исследовании с учетом иммуногистохимического исследования был поставлен диагноз зернистоклеточной опухоли (опухоль Абрикосова).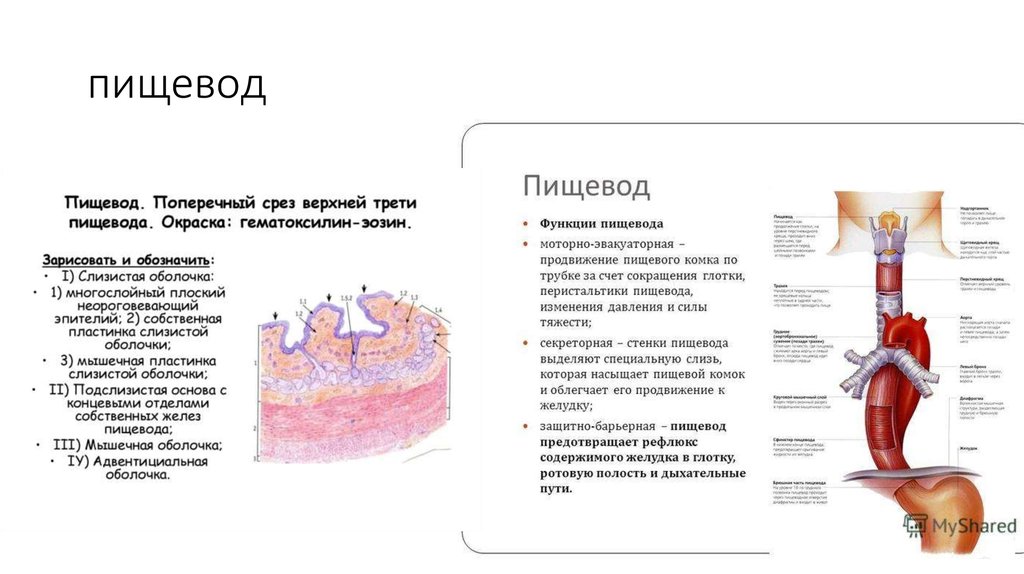
Течение послеоперационного периода без осложнений.
Выписан в удовлетворительном состоянии под наблюдение онколога, хирурга по месту жительства. При контрольном обследовании спустя 3 и 6 мес — без признаков рецидива.
ГИСО пищевода
Гастроинтестинальные стромальные опухоли (ГИСО) являются наиболее распространенными мезенхимальными опухолями желудочно-кишечного тракта. По данным разных авторов [15], они составляют от 0,1 до 3% от всех злокачественных новообразований ЖКТ и могут локализоваться в любом его отделе — от пищевода до ануса, однако чаще всего эти опухоли встречаются в желудке (50—60%) и в тонкой кишке (30—40%).
В 1998 г. L. Kindblom и соавт. установили, что GIST развивается из интерстициальных клеток Кахаля, формирующих сеть в мышечной оболочке стенки ЖКТ и регулирующих его вегетативную двигательную активность, т. е. являются пейсмекерными клетками, обеспечивающими связь между гладкомышечными клетками и нервными окончаниями [16, 17].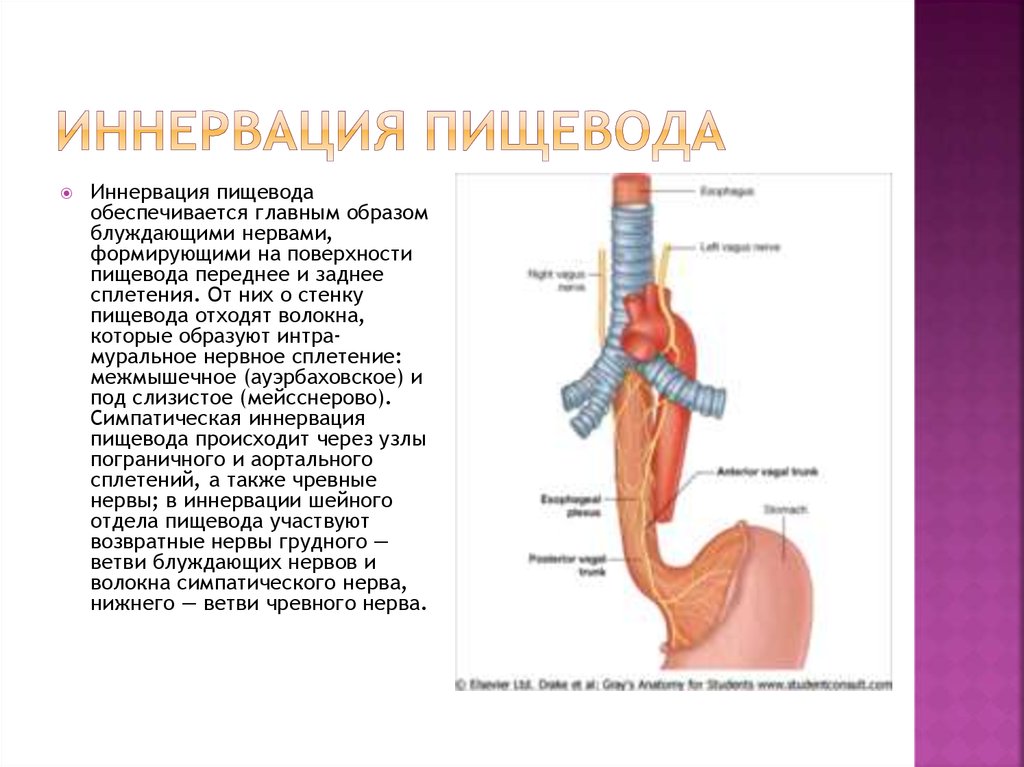 В настоящее время к ГИСО относят мезенхимальные опухоли, в клетках которых отмечается положительная иммуногистохимическая реакция на CD-117 и CD-34, DOG-1.
В настоящее время к ГИСО относят мезенхимальные опухоли, в клетках которых отмечается положительная иммуногистохимическая реакция на CD-117 и CD-34, DOG-1.
ГИСО развиваются у лиц старше 40 лет и не имеют гендерной предрасположенности. Средний возраст больных 55—65 лет. До 40 лет эти опухоли обнаруживаются крайне редко. Все ГИСО считаются потенциально злокачественными. В ходе проведенных исследований показано, что ни пол, ни первичная локализация опухоли не влияют на уровень общей выживаемости [16].
Первичные ГИСО пищевода крайне редки и составляют менее 1% всех ГИСО. В литературе [18] упоминания о первичной ГИСО пищевода очень ограниченны: в основном это описания конкретных клинических случаев. Редкость этого заболевания является основным препятствием для всестороннего изучения ГИСО пищеводной локализации и его правильной диагностики.
В МНИОИ им. П.А. Герцена за период с 2000 по 2017 г. мы наблюдали 7 пациентов, среди которых преобладали лица мужского пола (4 наблюдения) в возрасте от 39 до 65 лет; у женщин — 3 ГИСО, возраст от 54 до 74 лет.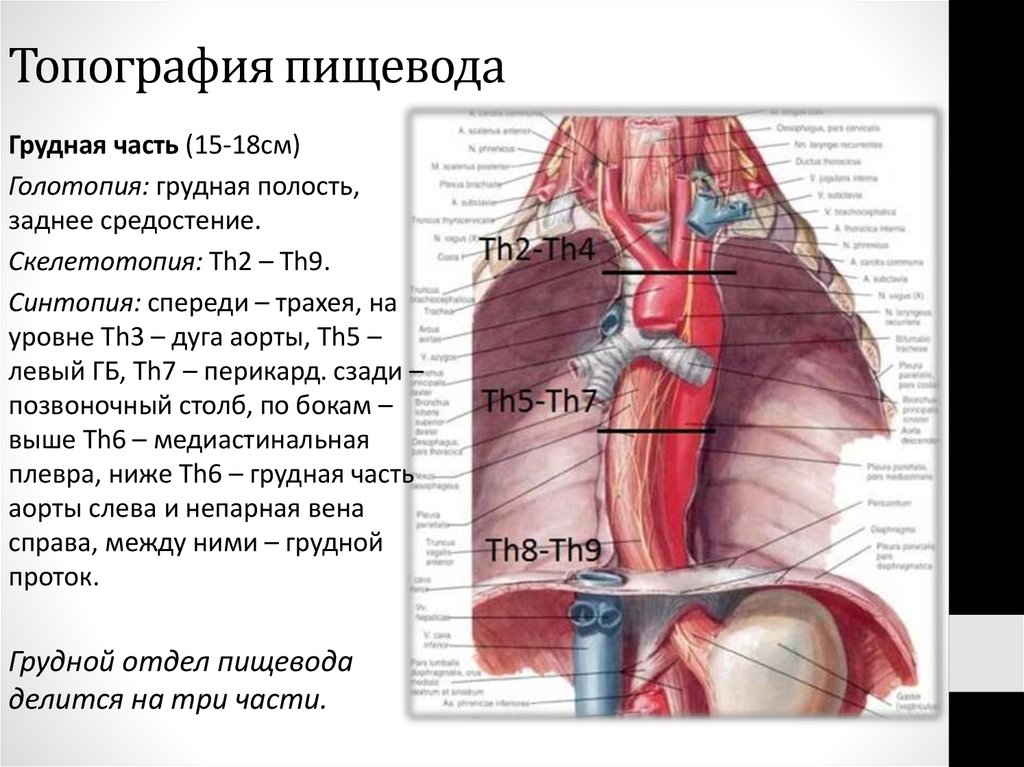 Средний возраст больных составил 59 лет.
Средний возраст больных составил 59 лет.
Клиническая картина ГИСО пищевода зависит от локализации и размеров опухоли. Чаще всего опухоли локализуются в дистальной части пищевода, нередко вовлекая эзофагогастросоединение. Небольшие образования чаще всего не дают клинических симптомов и являются случайными находками при проведении эндоскопических исследований или могут быть выявлены при обычном рентгенологическом исследовании органов грудной полости. В запущенной стадии заболевания основной жалобой больных, при локализации опухоли в пищеводе, является расстройство глотания. Часто у больных с ГИСО пищевода наблюдаются боль в эпигастрии, анемия и связанная с ней повышенная утомляемость.
ГИСО пищевода выглядит как подслизистый интрамуральный узел, как правило, с четкими внешними контурами, однако нередко над ним обнаруживается изъязвление слизистой (20—30%). Более крупные опухоли могут подвергаться массивному некрозу, оставляя лишь узкий ободок жизнеспособной ткани по периферии узла, возможно образование кист [19].
Гистологически ГИСО пищевода могут напоминать гладкомышечные опухоли этой же локализации. В связи с этим в первую очередь необходимо дифференцировать ГИСО и лейомиому пищевода (табл. 1). Таблица 1. Дифференциальная диагностика лейомиомы и ГИСО пищевода
В подавляющем большинстве случаев ГИСО пищевода с умеренной клеточностью имеют веретеноклеточный тип строения, со слабым или умеренным полиморфизмом. Могут обнаруживаться участки с палисадообразным расположением ядер, напоминающие опухоли из оболочек периферических нервов (рис. 4). Рис. 4. ГИСО пищевода. Рис. 4. ГИСО пищевода.
Эпителиоидное строение опухоли в пищеводе встречается реже, чем веретеноклеточное, и более характерно для локализации опухоли в области пищеводно-желудочного перехода. Ранее этот тип опухоли обозначался как лейомиобластома или эпителиоидная лейомиосаркома.
Как уже оговаривалось ранее, все ГИСО позитивны на CD-117 и 70—80% из них дают положительную реакцию на CD-34, DOG-1, 30–40% опухолей могут быть очагово или диффузно позитивны на SMA20.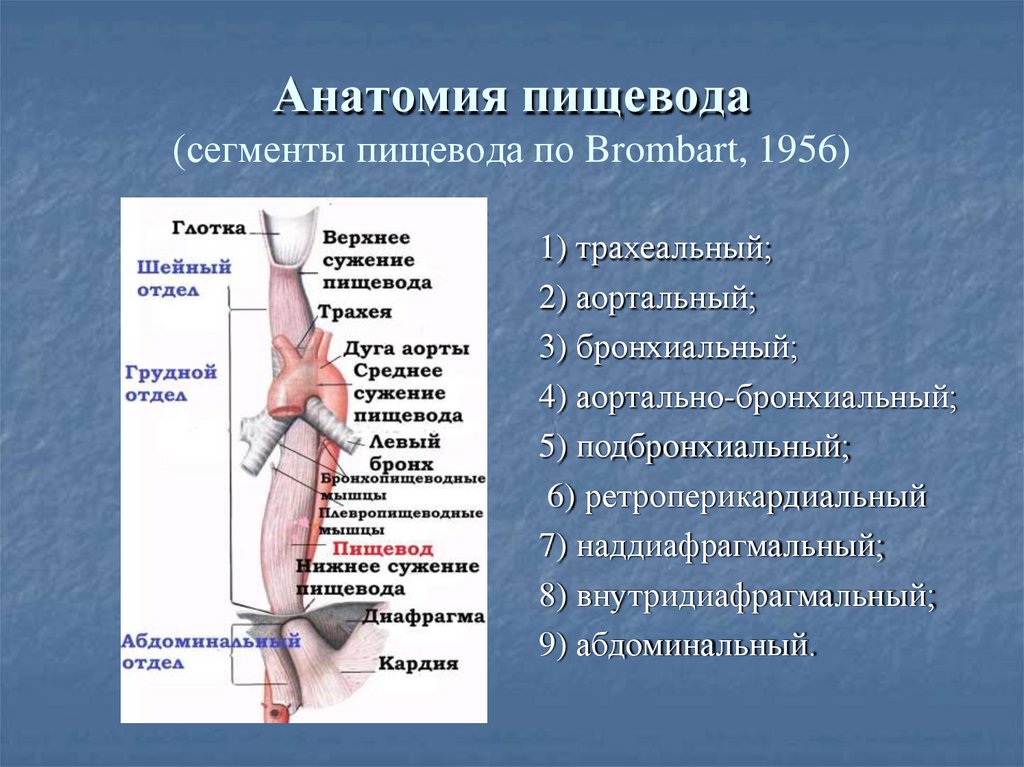 Количество опухолей экспрессирующих десмин и S100, не превышает 5% от числа всех ГИСО. Также рекомендуется использовать маркер пролиферативной активности Ki-67.
Количество опухолей экспрессирующих десмин и S100, не превышает 5% от числа всех ГИСО. Также рекомендуется использовать маркер пролиферативной активности Ki-67.
Оценка риска агрессивного показателя опухоли основана на таких показателях, как митотическая активность и размер опухоли (табл. 2). Таблица 2. Риск агрессивного поведения ГИСО Опухоли размером менее 5 см с низкой митотической активностью (менее 5 фигур митоза в 50 полях зрения, ×400) рассматриваются как условно доброкачественные, с низким и очень низким риском злокачественного течения процесса. Опухоли более 5 см, но с менее чем 5 митозами в 50 полях зрения, относят к опухолям с неопределенным злокачественным потенциалом и средним риском агрессивного поведения. Большие опухоли (более 10 см в диаметре) без митотической активности, либо опухоли малых размеров, но с высокой митотической активностью (более 10 митозов в 50 полях зрения, ×400), считаются злокачественными и сопряжены с высоким риском метастазирования и местных рецидивов.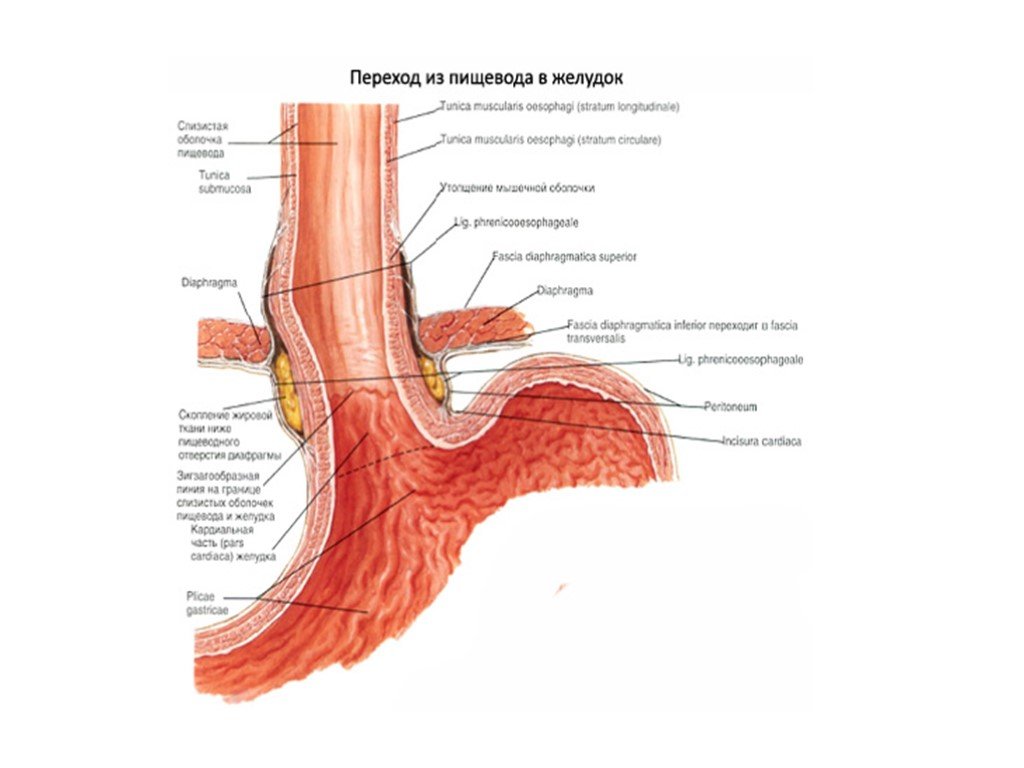
Пятилетняя выживаемость больных после хирургического лечения варьирует от 35 до 65%; медиана выживаемости — 40%.
В случае рецидива заболевания или при первичном диагностировании диссеминированного/неоперабельного процесса медиана выживаемости не превышает 10—20 мес. Хирургическое удаление рецидивных образований в целом не приводит к улучшению выживаемости больных.
Заключение
Таким образом, к редким злокачественным новообразованиям пищевода относится довольно гетерогенная группа опухолей, представляющая немалые трудности диагностики как для врачей-клиницистов, так и для патологоанатомов. Необходимо дальнейшее накопление опыта и наблюдений для улучшения своевременной выявляемости таких опухолей, что в свою очередь улучшает выживаемость больных.
Участие авторов:
Концепция и дизайн исследования — Н.Н.В., А.С.М.
Сбор и обработка материала — Н.С.Г.
Статистическая обработка — Н.С.Г., Н.Н.В.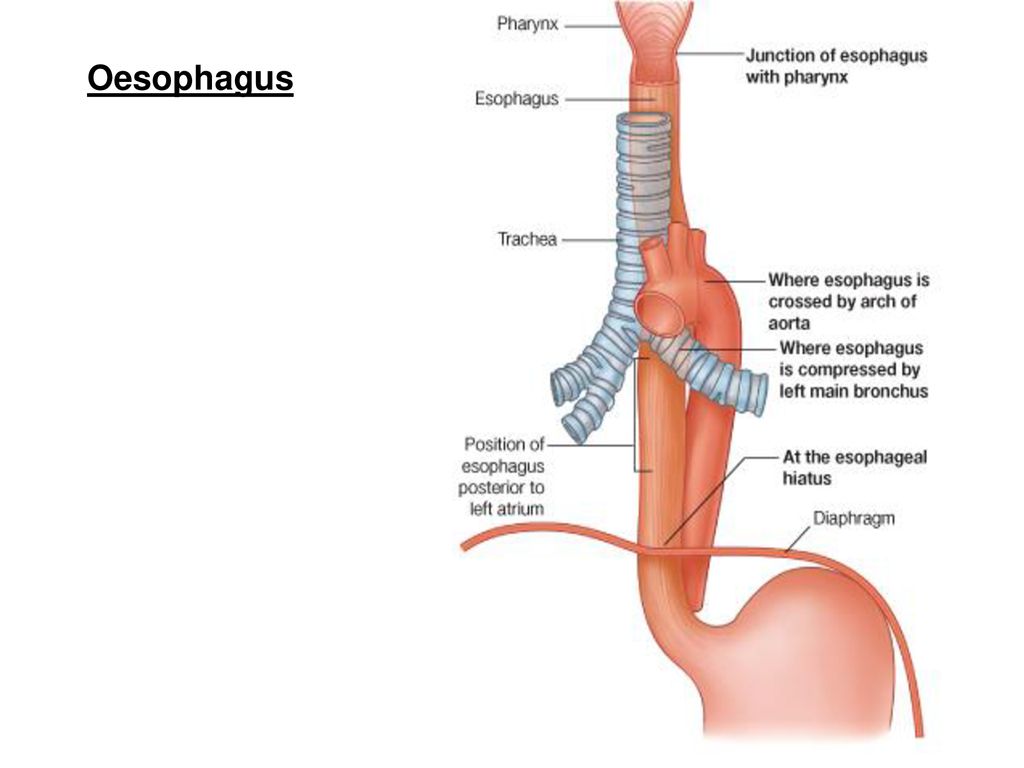
Написание текста — Н.С.Г.
Редактирование — Н.Н.В., А.С.М.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Волченко Н.Н. — https://orcid.org/0000-0002-4873-4455
Мамонтов А.С. — e-mail: [email protected]
Гоева Н.С. — https://orcid.org/0000-0002-6023-2300
Автор, ответственный за переписку: Гоева Наталья Сергеевна — e-mail: [email protected]
Волченко Н.Н., Мамонтов А.С., Гоева Н.С. Редкие опухоли пищевода. Онкология. Журнал им. П.А. Герцена. 2019;8(6):453-459. https://doi.org/10.17116/onkolog20198061453
Злокачественное новообразование средней трети пищевода (Идентификатор концепции: C0153414) — MedGen
Первичное или метастатическое злокачественное новообразование, поражающее среднюю треть сегмента пищевода. [из NCI]
PubMed
Лечение плоскоклеточного рака среднего и проксимального отделов пищевода.
Вонг И,
Закон S
Best Pract Res Clin Gastroenterol
2018 окт-дек;36-37:85-90.
Epub 2018 30 ноября
doi: 10.1016/j.bpg.2018.11.012.
PMID: 30551861
Клинические характеристики и лечение рака желудка после эзофагэктомии.
Ширакава Ю.,
Нома К,
Маэда Н,
Ниномия Т,
Танабэ С,
Кикучи С,
Курода С,
Нисидзаки М,
Кагава С,
Кавахара Ю,
Окада Х,
Fujiwara T
Пищевод
2018 июль; 15(3):180-189.
Epub 2018 27 марта
doi: 10.1007/s10388-018-0611-2.
PMID: 29951985
Излечивающее лечение рака пищевода: текущие возможности и будущие разработки.
Волк МЦ,
Шталь М,
Краузе Б.Дж.,
Бонавина Л,
Брунс С,
Белка С,
Zehentmayr F
Radiat Oncol
2011 26 мая; 6:55.
дои: 10.1186/1748-717X-6-55.
PMID: 21615894Free PMC Статья
Просмотреть все (53)
Этиология
Идентификация подтипов пищевода Барретта и аденокарциномы пищевода на основе профилей метилирования ДНК и интеграции данных транскриптома и генома.
Джаммула С,
Кац-Саммеркорн AC,
Ли Х,
Линосси С,
Смит Э,
Киллкойн С,
Биаски Д,
Субаш В. В.,
Аббас С,
Бласко А,
Девоншир Г,
Грэнтэм А,
Вроновский Ф,
О’Донован М.,
Грехан Н,
Элдридж, доктор медицины,
Таваре С.;
Консорциум по клинической и молекулярной стратификации рака пищевода (OCCAMS),
Фицджеральд RC
В.,
Аббас С,
Бласко А,
Девоншир Г,
Грэнтэм А,
Вроновский Ф,
О’Донован М.,
Грехан Н,
Элдридж, доктор медицины,
Таваре С.;
Консорциум по клинической и молекулярной стратификации рака пищевода (OCCAMS),
Фицджеральд RC
Гастроэнтерология
2020 май;158(6):1682-1697.e1.
Epub 2020 4 фев.
doi: 10.1053/j.gastro.2020.01.044.
PMID: 32032585Free PMC Article
Безопасность и эффективность дурвалумаба и тремелимумаба по отдельности или в комбинации у пациентов с распространенной аденокарциномой желудка и желудочно-пищеводного соединения.
Келли Р.Дж.,
Ли Дж,
Банг Ю.Дж.,
Альманна К,
Блюм-Мерфи М,
Катеначчи ДВТ,
Чанг ХК,
Вайнберг З.А.,
Гибсон МК,
Ли КВ,
Бенделл Дж.С.,
Денлингер КС,
Чи СЕ,
Омори Т,
Лейднер Р,
Ленц Х.Дж.,
Чао Ю,
Ребелатто MC,
Брохоун ПЗ,
Он П,
Макдевит Дж,
Шет С,
Энглерт Дж. М.,
Ку GY
Клин Рак Рес
2020 15 февраля; 26 (4): 846-854.
Epub 2019 1 нояб.
doi: 10.1158/1078-0432.CCR-19-2443.
PMID: 31676670Free PMC Article
Безопасность и эффективность ниволумаба в комбинации с S-1/капецитабином плюс оксалиплатин у пациентов с ранее нелеченым, нерезектабельным, распространенным или рецидивирующим раком желудка/пищеводного перехода: промежуточные результаты рандомизированного исследования II фазы ( ПРИВЛЕЧЕНИЕ-4).
Боку Н,
Рю МХ,
Като К,
Чанг ХК,
Минаши К,
Ли КВ,
Чо Х,
Кан ВК,
Комацу Ю,
Цуда М,
Ямагучи К,
Хара Х,
Фумита С,
Адзума М,
Чен ЛТ,
Кан ЮК
Энн Онкол
2019 1 февраля; 30 (2): 250-258.
doi: 10.1093/annonc/mdy540.
PMID: 30566590Free PMC Article
Заболеваемость раком и смертность: когортное исследование в Китае, 2008–2013 гг.
Пан R,
Чжу М,
Ю С,
уровень Дж,
Го Ю,
Биан З,
Ян Л,
Чен Ю,
Ху З,
Чен З,
Ли Л,
Шен Х;
China Kadoorie Biobank Collaborative Group
Int J Рак
2017 1 октября; 141(7):1315-1323.
Epub 2017 26 июня
doi: 10.1002/ijc.30825.
PMID: 28593646
Рандомизированное двойное слепое плацебо-контролируемое исследование фазы III апатиниба у пациентов с рефрактерной к химиотерапии распространенной или метастатической аденокарциномой желудка или желудочно-пищеводного соединения.
Ли Дж,
Цинь С,
Сюй Дж,
Сюн Дж,
Ву С,
Бай Ю,
Лю В,
Тонг Дж,
Лю Ю,
Сюй Р,
Ван З,
Ван Кью,
Оуян Х,
Ян Ю,
Залив,
Лян Дж,
Лин Х,
Ло Д,
Чжэн Р,
Ван Х,
Солнце Г,
Ван Л,
Чжэн Л,
Го Х,
Ву Дж,
Сюй Н,
Ян Дж,
Чжан Х,
Ченг Ю,
Ван Н,
Чен Л,
Фан Z,
Солнце П,
Ю Х
Дж Клин Онкол
2016 1 мая; 34 (13): 1448-54. Epub 2016 16 февраля
doi: 10.1200/JCO.2015.63.5995.
PMID: 26884585
Epub 2016 16 февраля
doi: 10.1200/JCO.2015.63.5995.
PMID: 26884585
Посмотреть все (586)
Диагностика
Прогностическая оценка больных раком пищевода I-III стадий.
Цю MJ,
Ян С.Л.,
Ван ММ,
Ли ЮН,
Цзян Х,
Хуан ЗЗ,
Xiong ZF
Старение (Олбани, Нью-Йорк)
2020 23 июля; 12 (14): 14736-14753.
doi: 10.18632/aging.103532.
PMID: 32701062Free PMC Article
Идентификация подтипов пищевода Барретта и аденокарциномы пищевода на основе профилей метилирования ДНК и интеграции данных транскриптома и генома.
Джаммула С,
Кац-Саммеркорн AC,
Ли Х,
Линосси С,
Смит Э,
Киллкойн С,
Биаски Д,
Субаш В.В.,
Аббас С,
Бласко А,
Девоншир Г,
Грэнтэм А,
Вроновский Ф,
О’Донован М.,
Грехан Н,
Элдридж, доктор медицины,
Таваре С.;
Консорциум по клинической и молекулярной стратификации рака пищевода (OCCAMS),
Фицджеральд RC
Гастроэнтерология
2020 май;158(6):1682-1697.e1.
Epub 2020 4 фев.
doi: 10.1053/j.gastro.2020.01.044.
PMID: 32032585Бесплатно PMC Артикул
Расширенная хирургия рака пищевода и желудочно-пищеводного перехода.
Лерут Т,
Кусманс В,
Декер Г,
Де Лейн П.,
Луны Дж,
Нафте П,
Van Raemdonck D
J Surg Res
2004 март; 117(1):58-63.
doi: 10.1016/j.jss.2003.12.012.
PMID: 15013715
Вторичные новообразования молочной железы: обзор ХХ века.
Грузианос С.Н.,
Чин Дж,
Гуд А.В.,
Шифф М
Рак
2001 1 ноября; 92 (9): 2259-66.
doi: 10.1002/1097-0142(20011101)92:9<2259::aid-cncr1571>3.0.co;2-o.
PMID: 11745279
Опухоли пищевода.
Люк GF 3-й,
Вертхаймер-Хэтч Л,
Люк КФ,
Дэвис ГБ,
Бланшар Д.К.,
Фостер Р.С. младший,
Skandalakis JE
World J Surg
2000 апр; 24(4):401-11.
doi: 10.1007/s002689910065.
PMID: 10706912
Просмотреть все (359)
Терапия
Безопасность и активность трифлуридина/типирацила и рамуцирумаба при ранее леченном распространенном раке желудка: открытое, одногрупповое, фаза 2 исследования.
Кавазоэ А,
Андо Т,
Хосака Х,
Фудзита Дж,
Коеда К,
Нишикава К,
Амагай К,
Фуджитани К,
Огата К,
Ватанабэ К,
Ямамото Ю,
Shitara K
Ланцет Гастроэнтерол Гепатол
2021 март; 6(3):209-217.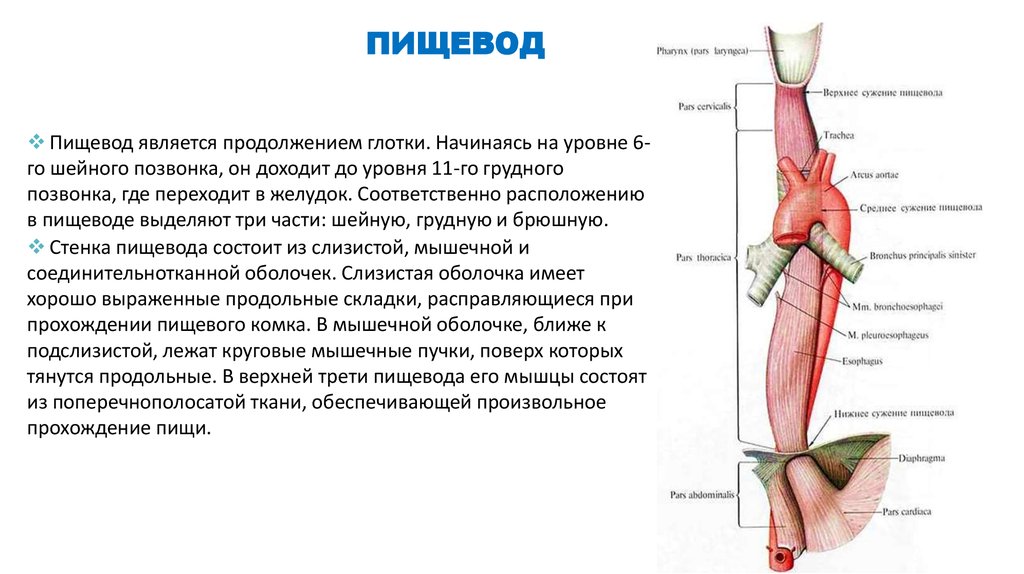 Epub 2021 Янв 26
doi: 10.1016/S2468-1253(20)30396-4.
PMID: 33508242
Epub 2021 Янв 26
doi: 10.1016/S2468-1253(20)30396-4.
PMID: 33508242
Прогностическая оценка больных раком пищевода I-III стадий.
Цю М.Дж.,
Ян С.Л.,
Ван ММ,
Ли ЮН,
Цзян Х,
Хуан ЗЗ,
Xiong ZF
Старение (Олбани, Нью-Йорк)
2020 23 июля; 12 (14): 14736-14753.
doi: 10.18632/aging.103532.
PMID: 32701062Free PMC Статья
Идентификация подтипов пищевода Барретта и аденокарциномы пищевода на основе профилей метилирования ДНК и интеграции данных транскриптома и генома.
Джаммула С,
Кац-Саммеркорн AC,
Ли Х,
Линосси С,
Смит Э,
Киллкойн С,
Биаски Д,
Субаш В.В.,
Аббас С,
Бласко А,
Девоншир Г,
Грэнтэм А,
Вроновский Ф,
О’Донован М.,
Грехан Н,
Элдридж, доктор медицины,
Таваре С.;
Консорциум по клинической и молекулярной стратификации рака пищевода (OCCAMS),
Fitzgerald RC
Гастроэнтерология
2020 Май; 158 (6): 1682-1697.e1.
Epub 2020 4 фев.
doi: 10.1053/j.gastro.2020.01.044.
PMID: 32032585Free PMC Article
Безопасность и эффективность ниволумаба в комбинации с S-1/капецитабином плюс оксалиплатин у пациентов с ранее нелеченым, неоперабельным, распространенным или рецидивирующим раком желудка/пищеводного соединения: промежуточные результаты рандомизированного исследования II фазы ( ПРИВЛЕЧЕНИЕ-4).
Боку Н,
Рю МХ,
Като К,
Чанг ХК,
Минаши К,
Ли КВ,
Чо Х,
Кан ВК,
Комацу Ю,
Цуда М,
Ямагучи К,
Хара Х,
Фумита С,
Адзума М,
Чен ЛТ,
Кан ЮК
Энн Онкол
2019 1 февраля; 30 (2): 250-258.
doi: 10.1093/annonc/mdy540.
PMID: 30566590Free PMC Article
Рандомизированное двойное слепое плацебо-контролируемое исследование фазы III апатиниба у пациентов с рефрактерной к химиотерапии распространенной или метастатической аденокарциномой желудка или желудочно-пищеводного перехода.
Ли Дж,
Цинь С,
Сюй Дж,
Сюн Дж,
Ву С,
Бай Ю,
Лю В,
Тонг Дж,
Лю Ю,
Сюй Р,
Ван З,
Ван Кью,
Оуян Х,
Ян Ю,
Залив,
Лян Дж,
Лин Х,
Ло Д,
Чжэн Р,
Ван Х,
Солнце Г,
Ван Л,
Чжэн Л,
Го Х,
Ву Дж,
Сюй Н,
Ян Дж,
Чжан Х,
Ченг Ю,
Ван Н,
Чен Л,
Фан Z,
Солнце П,
Ю Х
Дж Клин Онкол
2016 1 мая; 34 (13): 1448-54.
Epub 2016 16 февраля
doi: 10.1200/JCO.2015.63.5995.
PMID: 26884585
Посмотреть все (286)
Прогноз
Прогностическая оценка больных раком пищевода I-III стадий.
Цю М.Дж.,
Ян С.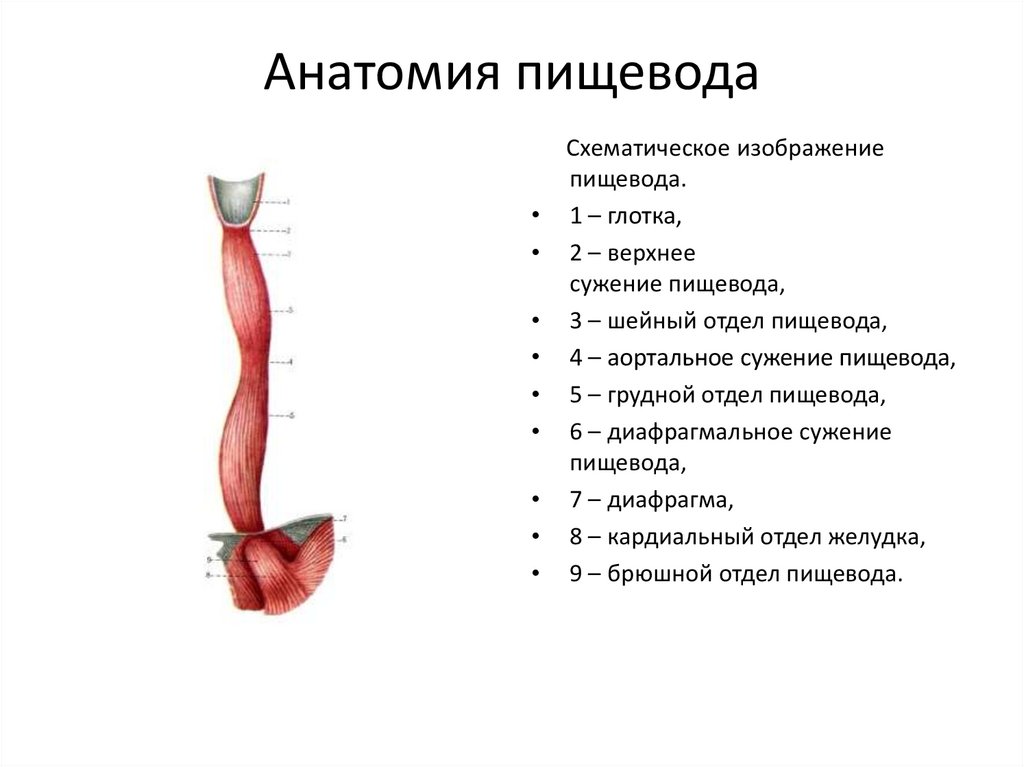 Л.,
Ван ММ,
Ли ЮН,
Цзян Х,
Хуан ЗЗ,
Xiong ZF
Л.,
Ван ММ,
Ли ЮН,
Цзян Х,
Хуан ЗЗ,
Xiong ZF
Старение (Олбани, Нью-Йорк)
2020 23 июля; 12 (14): 14736-14753.
doi: 10.18632/aging.103532.
PMID: 32701062Free PMC Article
Идентификация подтипов пищевода Барретта и аденокарциномы пищевода на основе профилей метилирования ДНК и интеграции данных транскриптома и генома.
Джаммула С,
Кац-Саммеркорн AC,
Ли Х,
Линосси С,
Смит Э,
Киллкойн С,
Биаски Д,
Субаш В.В.,
Аббас С,
Бласко А,
Девоншир Г,
Грэнтэм А,
Вроновский Ф,
О’Донован М.,
Грехан Н,
Элдридж, доктор медицины,
Таваре С.;
Консорциум по клинической и молекулярной стратификации рака пищевода (OCCAMS),
Fitzgerald RC
Гастроэнтерология
2020 май;158(6):1682-1697.e1.
Epub 2020 4 фев.
doi: 10.1053/j.gastro.2020.01.044.
PMID: 32032585Free PMC Article
Безопасность и эффективность дурвалумаба и тремелимумаба по отдельности или в комбинации у пациентов с распространенной аденокарциномой желудка и желудочно-пищеводного соединения.
Келли Р.Дж.,
Ли Дж,
Банг Ю.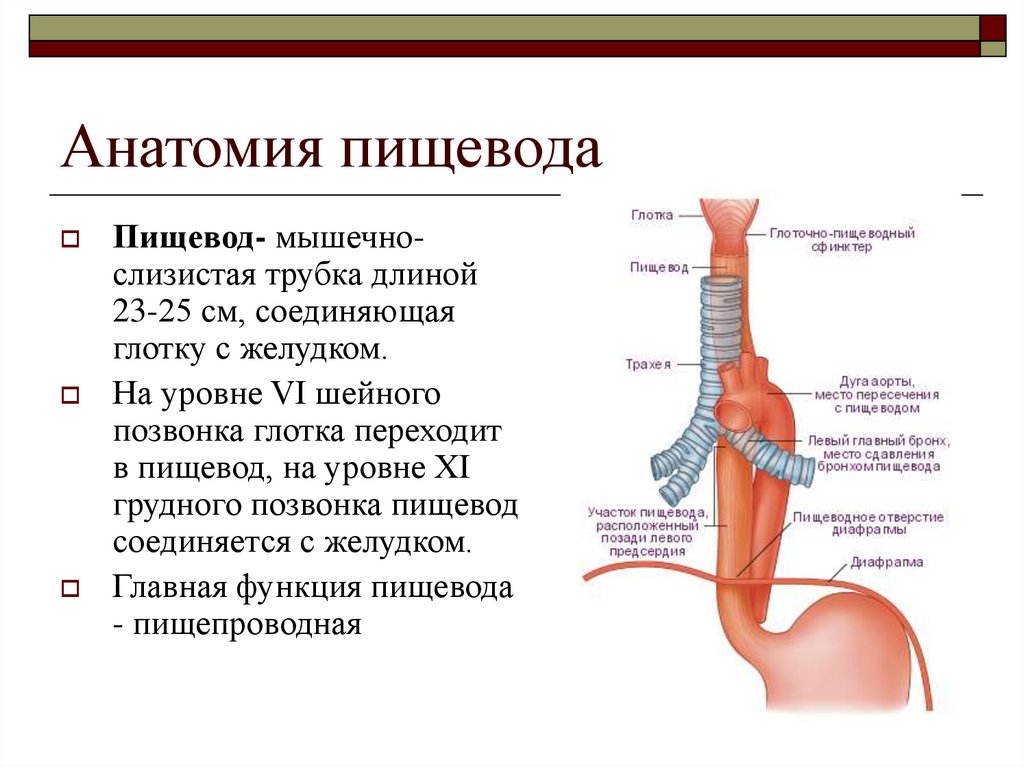 Дж.,
Альманна К,
Блюм-Мерфи М,
Катеначчи ДВТ,
Чанг ХК,
Вайнберг З.А.,
Гибсон МК,
Ли КВ,
Бенделл Дж.С.,
Денлингер КС,
Чи СЕ,
Омори Т,
Лейднер Р,
Ленц Х.Дж.,
Чао Ю,
Ребелатто MC,
Брохоун ПЗ,
Он П,
Макдевит Дж,
Шет С,
Энглерт Дж. М.,
Ku GY
Дж.,
Альманна К,
Блюм-Мерфи М,
Катеначчи ДВТ,
Чанг ХК,
Вайнберг З.А.,
Гибсон МК,
Ли КВ,
Бенделл Дж.С.,
Денлингер КС,
Чи СЕ,
Омори Т,
Лейднер Р,
Ленц Х.Дж.,
Чао Ю,
Ребелатто MC,
Брохоун ПЗ,
Он П,
Макдевит Дж,
Шет С,
Энглерт Дж. М.,
Ku GY
Clin Рак Res
2020 15 февраля; 26 (4): 846-854.
Epub 2019 1 нояб.
doi: 10.1158/1078-0432.CCR-19-2443.
PMID: 31676670Бесплатная статья PMC
Гибридная минимально инвазивная эзофагэктомия при раке пищевода.
Мариэтт С,
Маркар С.Р.,
Дабакуё-Ёнли Т.С.,
Менье Б,
Пезе Д,
Цанга Д,
Д’Журно XB,
Разбойник С,
Перничень Т,
Каррер Н,
Мабрут Ж.Ю.,
Мсика С,
Пешо Ф,
Прюдом М,
Боннетайн Ф,
Писсен Г;
Fédération de Recherche en Chirurgie (FRENCH) и Французская рабочая группа по эзогастральным опухолям (FREGAT)
N Английский J Med
2019 10 января; 380 (2): 152-162.
дои: 10.1056/NEJMoa1805101.
PMID: 30625052
Безопасность и эффективность ниволумаба в комбинации с S-1/капецитабином плюс оксалиплатин у пациентов с ранее нелеченым, нерезектабельным, распространенным или рецидивирующим раком желудка/пищеводного перехода: промежуточные результаты рандомизированного исследования II фазы (ATTRACTION- 4).
Боку Н,
Рю МХ,
Като К,
Чанг ХК,
Минаши К,
Ли КВ,
Чо Х,
Кан ВК,
Комацу Ю,
Цуда М,
Ямагучи К,
Хара Х,
Фумита С,
Адзума М,
Чен ЛТ,
Кан ЮК
Энн Онкол
2019 1 февраля; 30 (2): 250-258.
doi: 10.1093/annonc/mdy540.
PMID: 30566590Бесплатная ЧВК Артикул
Посмотреть все (457)
Справочники по клиническому прогнозированию
Хирургия рака пищевода в Греции в эпоху финансового кризиса.
Шизас Д,
Милонас К.С.,
Хасэмаки Н,
Мпаили Э,
Нтоми В,
Михалинос А,
Теохари Н.А.,
Теочари КА,
Мпура М,
Бакопулос А,
Liakakos T
Dis пищевода
2021 10 февраля; 34 (2)
дои: 10.1093/доте/доаа067.
PMID: 32766686
Прогностическая оценка больных раком пищевода I-III стадий.
Цю MJ,
Ян С.Л.,
Ван ММ,
Ли ЮН,
Цзян Х,
Хуан ЗЗ,
Xiong ZF
Старение (Олбани, Нью-Йорк)
2020 23 июля; 12 (14): 14736-14753.
doi: 10.18632/aging.103532.
PMID: 32701062Free PMC Article
Безопасность и эффективность дурвалумаба и тремелимумаба по отдельности или в комбинации у пациентов с распространенной аденокарциномой желудка и желудочно-пищеводного перехода.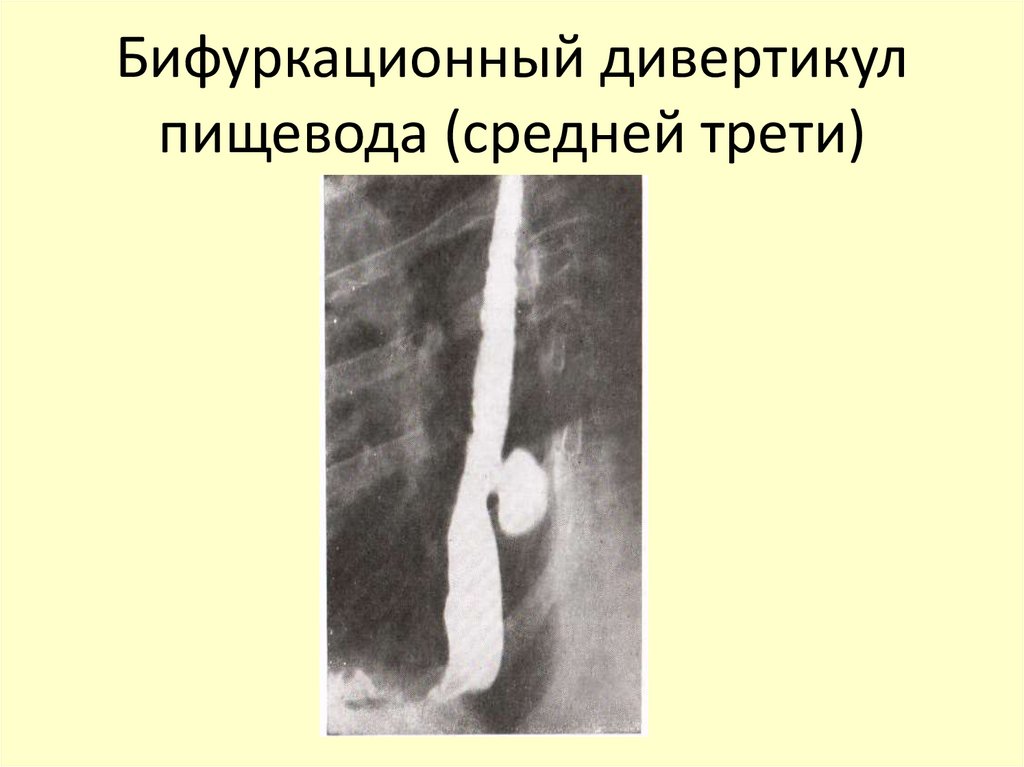
Келли Р.Дж.,
Ли Дж,
Банг Ю.Дж.,
Альманна К,
Блюм-Мерфи М,
Катеначчи ДВТ,
Чанг ХК,
Вайнберг З.А.,
Гибсон МК,
Ли КВ,
Бенделл Дж.С.,
Денлингер КС,
Чи СЕ,
Омори Т,
Лейднер Р,
Ленц Х.Дж.,
Чао Ю,
Ребелатто MC,
Брохоун ПЗ,
Он П,
Макдевит Дж,
Шет С,
Энглерт Дж. М.,
Ку GY
Клин Рак Рес
2020 15 февраля; 26 (4): 846-854.
Epub 2019 1 нояб.
doi: 10.1158/1078-0432.CCR-19-2443.
PMID: 31676670Free PMC Article
Излечивающее лечение карциномы пищевода: текущие возможности и будущие разработки.
Волк МЦ,
Шталь М,
Краузе Б.Дж.,
Бонавина Л,
Брунс С,
Белка С,
Zehentmayr F
Radiat Oncol
2011 26 мая; 6:55.
дои: 10.1186/1748-717X-6-55.
PMID: 21615894Free PMC Артикул
Рак пищевода: пневмо-64-МДКТ.
Улла М,
Кавадас Д,
Муньос I,
Бесков А,
Зехаус А,
Гарсия-Монако R
Визуализация брюшной полости
2010 авг; 35 (4): 383-9.
Epub 2009 30 июня
doi: 10.1007/s00261-009-9554-3.
PMID: 19568806
Просмотреть все (262)
Взаимосвязь между метаболическим синдромом и повышенным риском пищевода Барретта: обновленный систематический обзор и метаанализ.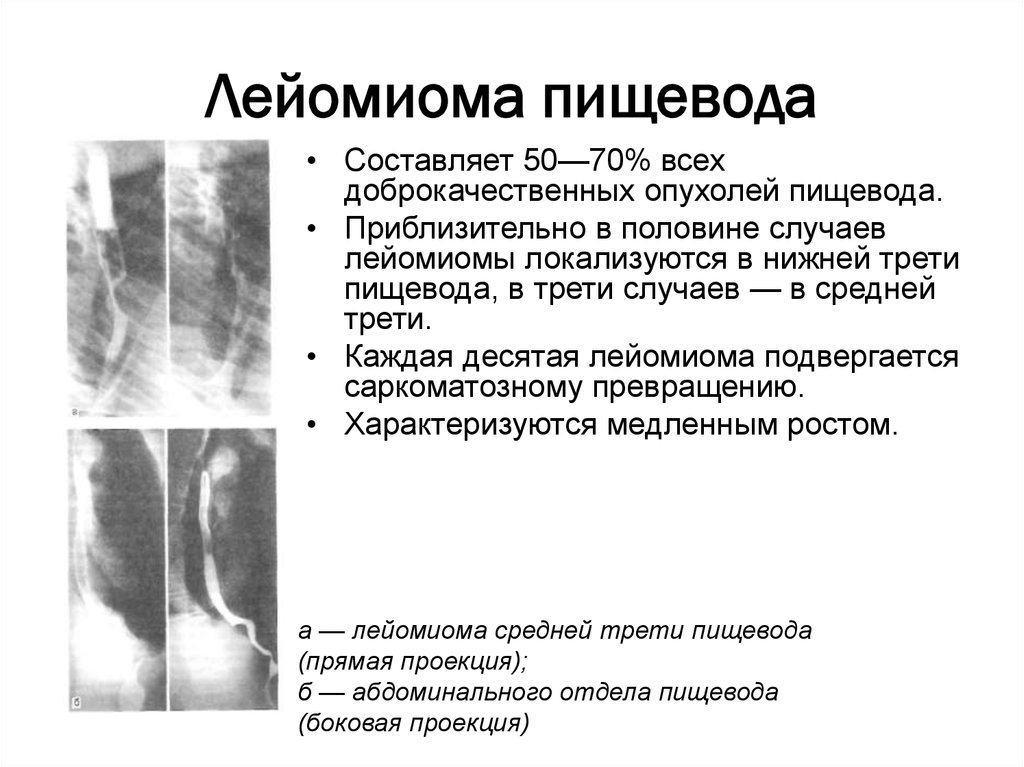
Каримян М,
Саламати М,
Азами М
BMC Гастроэнтерол
2020 6 мая; 20 (1): 138.
doi: 10.1186/s12876-020-01267-2.
PMID: 32375671Free PMC Article
Эффективность голосовой реабилитации при вокализации у пациентов после ларингэктомии: систематический обзор.
Xi S
Int J Evid на основе Healthc
2010 дек.;8(4):256-8.
doi: 10.1111/j.1744-1609.2010.00177.x.
PMID: 21091891
Просмотреть все (2)
ЯзвА В СРЕДНЕЙ ТРЕТИ ПИЩЕВОДА: С АНАТОМИЧЕСКОЙ СТРИКТУРОЙ И ЭЗОФАГОСПАЗМОМ. | JAMA
Язва в средней трети пищевода: с анатомической структурой и спазмом пищевода. | ДЖАМА | Сеть ДЖАМА [Перейти к навигации]Эта проблема
- Скачать PDF
- Полный текст
Поделиться
Твиттер Фейсбук Электронная почта LinkedIn
- Процитировать это
- Разрешения
Артикул
4 апреля 1908 г.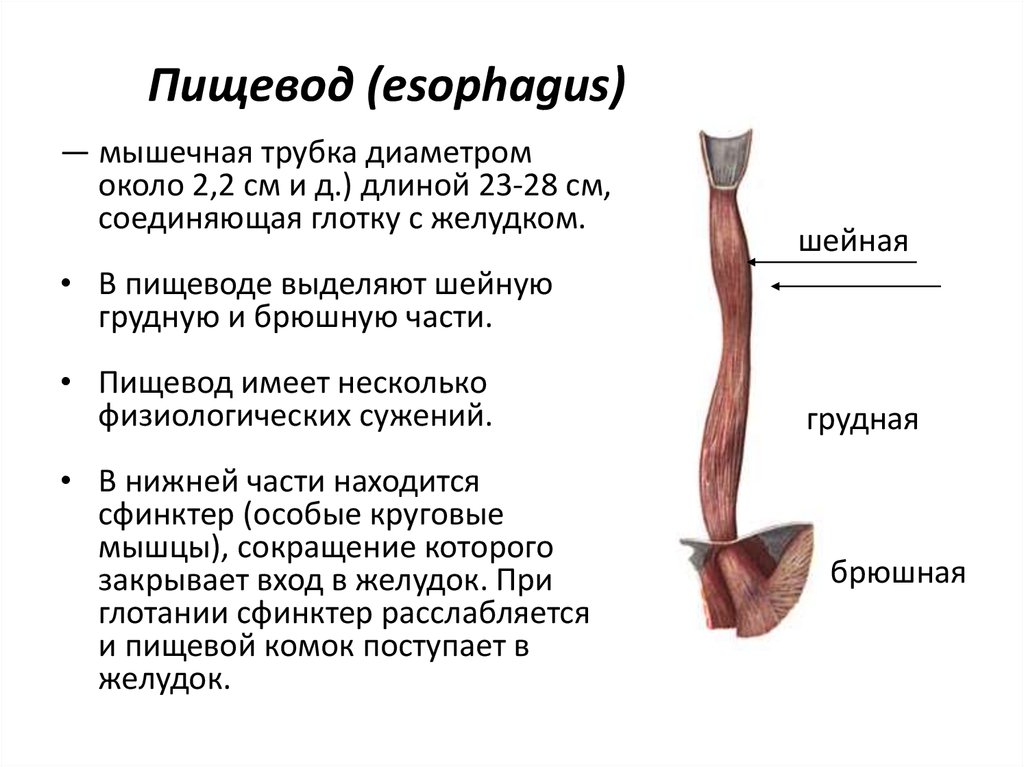
УИЛЬЯМ ЛЕРШ, MD
Принадлежность авторов
ST. ПОЛ, МИН.
ДЖАМА. 1908; Л(14):1122-1123. дои: 10.1001/jama.1908.25310400034004с
Полный текст
Абстрактный
Редкость зарегистрированных случаев такого рода оправдывает, я думаю, сообщение о следующем случае:
История. -Миссис. С. Э., 56 лет, пара, один раз выкидыш; отрицает сифилис; много лет назад перенес плеврит и рожу. Пять лет назад у нее был гнойный тромбофлебит правой ноги, из-за которого она провела в постели четыре месяца. Примерно через шесть месяцев после этого у нее случился приступ удушья во время еды, и пища отрыгнулась. С тех пор такие припадки случались более или менее часто; иногда между приступами был интервал в несколько недель. Как жидкости, так и твердые тела были немедленно отрыгнуты; они никогда не оставались внизу на какое-то время.

