Капсулы (гранулы) Lianhua Qingwen получили новое официальное применение
В ходе эпидемии на территории КНР капсулы (гранулы) Lianhua Qingwen стали самым часто рекомендуемым запатентованным препаратом китайской медицины для COVID 19. В четвертой-седьмой редакции официального протокола диагностики и лечения новой коронавирусной пневмонии государственный комитет по вопросам здравоохранения и государственное управление традиционной китайской медицины рекомендуют принимать данный препарат для профилактики и лечения пациентов с признаками усталости и лихорадки в период медицинской обсервации.
Эффективность капсул (гранул) Lianhua Qingwen при лечении COVID-19 подтверждается базовыми экспериментами и клиническими исследованиями. Команда д-ра Чжуна Наньшаня недавно опубликовала в международном издании «Pharmacology Research» научную статью под названием «Противовирусное и противовоспалительное воздействие жаропонижающих средств на новый коронавирус». Эта статья стала первой исследовательской работой, посвященной эффективности запатентованных средств китайской медицины в борьбе с SARS-Cov-2.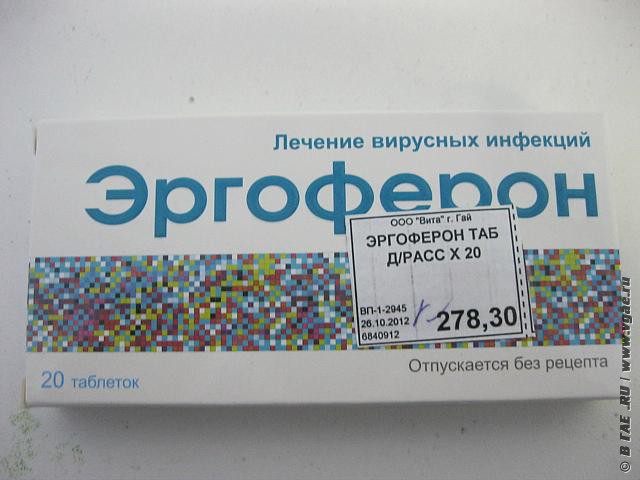
Сообщается, что новое одобрение относится к первоначально утвержденным показаниям к применению препарата и предполагает добавление к ним возможности лечения «СOVID-19 в легкой и средней степени». Вместе с этим, обновленный спектр показаний к применению средства не отменяет его позиционирования в качестве нерецептурного препарата.
На сегодняшний день, капсулы Lianhua Qingwen уже успешно зарегистрированы в Гонконге (САР КНР), Макао (САР КНР), Бразилии, Индонезии, Канаде, Мозамбике, Румынии и других регионах мира как «запатентованный препарат традиционной китайской медицины», «лекарственный препарт», «препарат растительного происхождения» и «профилактический продукт природного происхождения».
Фото — https://mma.prnewswire.com/media/1155048/Yiling.jpg
SOURCE Shijiazhuang Yiling Pharmaceutical Co,Ltd.
Инструкция по медицинскому применениюлекарственного препарата Ингавирин® для взрослых
Фармакодинамика
Противовирусный препарат.
В доклинических и клинических исследованиях показана эффективность препарата Ингавирин® в отношении вирусов гриппа типа A (A(h2N1), в т.ч. пандемический штамм A(h2N1)pdm09 («свиной»), A(h4N2), A(H5N1)) и типа В, аденовируса, вируса парагриппа, респираторно-синцитиального вируса; в доклинических исследованиях: коронавируса, метапневмовируса, энтеровирусов, в том числе вируса Коксаки и риновируса.
Механизм действия реализуется на уровне инфицированных клеток за счет активации факторов врожденного иммунитета, подавляемых вирусными белками. В экспериментальных исследованиях, в частности, показано, что препарат Ингавирин® повышает экспрессию рецептора интерферона первого типа IFNAR на поверхности эпителиальных и иммунокомпетентных клеток. Увеличение плотности интерфероновых рецепторов приводит к повышению чувствительности клеток к сигналам эндогенного интерферона. Процесс сопровождается активацией (фосфорилированием) белка-трансмиттера STAT1, передающего сигнал в ядро клетки для индукции синтеза противовирусных генов. Показано, что в условиях инфекции препарат активирует синтез антивирусного эффекторного белка МхА (ранний фактор противовирусного ответа, ингибирующий внутриклеточный транспорт рибонуклеопротеиновых комплексов различных вирусов) и фосфорилированной формы PKR, подавляющей трансляцию вирусных белков, таким образом замедляя и останавливая процесс вирусной репродукции.
В экспериментальных исследованиях, в частности, показано, что препарат Ингавирин® повышает экспрессию рецептора интерферона первого типа IFNAR на поверхности эпителиальных и иммунокомпетентных клеток. Увеличение плотности интерфероновых рецепторов приводит к повышению чувствительности клеток к сигналам эндогенного интерферона. Процесс сопровождается активацией (фосфорилированием) белка-трансмиттера STAT1, передающего сигнал в ядро клетки для индукции синтеза противовирусных генов. Показано, что в условиях инфекции препарат активирует синтез антивирусного эффекторного белка МхА (ранний фактор противовирусного ответа, ингибирующий внутриклеточный транспорт рибонуклеопротеиновых комплексов различных вирусов) и фосфорилированной формы PKR, подавляющей трансляцию вирусных белков, таким образом замедляя и останавливая процесс вирусной репродукции.
Действие препарата Ингавирин® заключается в значительном уменьшении признаков цитопатического и цитодеструктивного действия вируса, снижении количества инфицированных клеток, ограничении патологического процесса, нормализации состава и структуры клеток и морфологической картины тканей в зоне инфекционного процесса, как на ранних, так и на поздних его стадиях.
Противовоспалительное действие обусловлено подавлением продукции ключевых провоспалительных цитокинов (фактора некроза опухоли (TNF-α), интерлейкинов (IL-1β и IL-6)), снижением активности миелопероксидазы.
В экспериментальных исследованиях показано, что совместное использование препарата Ингавирин® с антибиотиками повышает эффективность терапии на модели бактериального сепсиса, в том числе вызванного пенициллин-резистентными штаммами стафилококка.
Проведенные экспериментальные токсикологические исследования свидетельствуют о низком уровне токсичности и высоком профиле безопасности препарата.
По параметрам острой токсичности препарат Ингавирин® относится к 4 классу токсичности — «Малотоксичные вещества» (при определении LD50 в экспериментах по острой токсичности летальные дозы препарата определить не удалось).
Препарат не обладает мутагенными, иммунотоксическими, аллергизирующими и канцерогенными свойствами, не оказывает местнораздражающего действия.
Отсутствует влияние препарата Ингавирин® на систему кроветворения при приеме соответствующей возрасту дозы рекомендованными схемой и курсом.
Фармакокинетика
Всасывание и распределение.
В эксперименте с использованием радиоактивной метки установлено: препарат быстро поступает в кровь из желудочно-кишечного тракта, распределяясь по внутренним органам. Максимальные концентрации в крови, плазме крови и большинстве органов достигаются через 30 минут после введения препарата. Величины AUC (площадь под фармакокинетической кривой «концентрация — время») почек, печени и легких незначительно превышают AUC крови (43,77 мкг.ч/г). Величины AUC для селезенки, надпочечников, лимфатических узлов и тимуса ниже AUC крови.
При курсовом приеме препарата один раз в сутки происходит его накопление во внутренних органах и тканях. При этом качественные характеристики фармакокинетических кривых после каждого введения препарата тождественны: быстрое повышение концентрации препарата после каждого введения через 0,5-1 час после приема и затем медленное снижение к 24 часам.
Метаболизм.
Препарат не метаболизируется в организме и выводится в неизмененном виде.
Выведение.
Основной процесс выведения происходит в течение 24 часов. За этот период выводится 80 % принятой дозы: 34,8 % выводится во временном интервале от 0 до 5 часов и 45,2 % во временном интервале от 5 до 24 часов. Из них 77 % выводится через кишечник и 23 % — через почки.
6 эффективных лекарств китайской народной медицины против коронавируса, которыми пользуются врачи в Ухани
6 эффективных лекарств китайской народной медицины против коронавируса, которыми пользуются врачи в Ухани
CentralAsia (CA) — Традиционная китайская медицина (ТКМ) играет важную роль в профилактике, лечении и реабилитации вируса COVID-19.
Официальные данные показывают, что до 15 марта 91,6% пациентов в провинции Хубэй, эпицентре вспышки, и 92,4% пациентов по всей стране лечились с помощью ТКМ.
По данным государственного управления традиционной китайской медицины, «три формулы и три лекарства» доказали свою эффективность в борьбе с вирусом. О 6 эффективных методов ТКМ рассказывает Zhang Yangfei в China Daily, один из разделов которых посвящен коронавирусу.
1. Гранула Цзиньхуа Цинган
Аптекарь взвешивает китайские фитопрепараты для пациентов, инфицированных новым коронавирусом, в провинциальной больнице традиционной китайской медицины Аньхой в Хэфэе, провинция Аньхой, 18 февраля 2020 года. [Фото/Синьхуа].
Гранула Цзиньхуа Цинган была разработана во время пандемии гриппа h2N1 2009 года (свиной грипп). Он состоит из 12 растительных компонентов, включая жимолость, мяту и лакрицу, и поможет снизить жар и детоксифицировать легкие.
Он оказывает лечебное действие при лечении больных легкой и средней степени тяжести, может улучшить скорость восстановления лимфоцитов и лейкоцитов, а также снизить частоту развития более тяжелой формы заболевания.
В начале февраля 102 пациента с легкими симптомами в Ухане принимали гранулу Цзиньхуа Цинган при лечении. Ухудшилось состояние только у 11,8% пациентов и им потребовалось всего полтора дня, чтобы снизить температуру.
Сравнительный эксперимент показал, что пациенты, принимавшие гранулу Цзиньхуа Цинган, получили отрицательный результат на коронавирус на два с половиной дня раньше, чем группа, которая не принимала гранулу. Группе, получавшей гранулу, также потребовалось 8 дней, чтобы показать улучшение, в то время как другой группе потребовалось 10 дней.
2. Lianhua Qingwen Капсула/Гранула
Коробка с капсулой Lianhua Qingwen [Фото/IC]
Лекарство LianhuaQingwen — это очень распространенная традиционная китайская медицина, используемая для лечения простуды и гриппа. Составленный из 13 растительных компонентов, он оказывает целебное действие на пациентов с легкими и средними симптомами, особенно при лечении лихорадки, кашля и усталости. Он может уменьшить возникновение ухудшения состояния и помочь пациентам получить отрицательный результат на тест Covid-19.
3. Инъекция Xuebijing
Инъекция Xuebijing [Photo/chasesun. cn]
cn]
Эта инъекция была разработана и продавалась во время эпидемии тяжелого острого респираторного синдрома (SARS) в 2003 году. Он состоит из пяти растительных экстрактов, и его основная функция заключается в детоксикации и устранении застоя крови. Он обычно используется для лечения сепсиса.
Он эффективен в подавлении синдрома системного воспалительного ответа, индуцированного инфекцией, при лечении тяжелобольных пациентов, а также при восстановлении нарушенной функции органов.
Начальные клинические исследования показали, что инъекция в сочетании с западной медициной может увеличить скорость выписки из больницы и уменьшить скорость ухудшения состояния.
Новый коронавирус также имеет тенденцию вызывать чрезмерное свертывание крови в организме, что приводит к эмболии органов и повреждению тканей, а эта инъекция может помочь предотвратить чрезмерную свертываемость и образование тромбов.
Сравнительный эксперимент из 710 случаев, совместно проведенный более чем 30 больницами, показал, что инъекция в сочетании с регулярным лечением может снизить смертность тяжелых пациентов на 8,8 процента и сократить сроки госпитализации в отделение интенсивной терапии на 4 дня.
Еще один проект предусматривал клиническое применение инъекций к пациентам с критическим состоянием с конца января, когда было пролечено 156 пациентов в 32 больницах. Все они показали улучшение ситуации.
Исследование клинической безопасности инъекции также показало, что частота побочных реакций составляет около 0,3%, что является очень безопасным показателем, и не будет отрицательно реагировать на другие антибиотики или лечение.
4. Отвар для очищения и детоксикации легких
Фармацевты распределяют лекарства в соответствии с рецептами для очищения легких и детоксикации с помощью отвара в Университете китайской медицины Аньхой 21 февраля 2020 года. [Фото/Синьхуа]
Отвар для очищения и детоксикации легких получен из нескольких классических рецептов в работе традиционной китайской медицины, известной на английском языке как «Cold Damage Diseases» (Shang Han Za Bing Lun), который был написан Чжан Чжунцзином незадолго до 220 года нашей эры.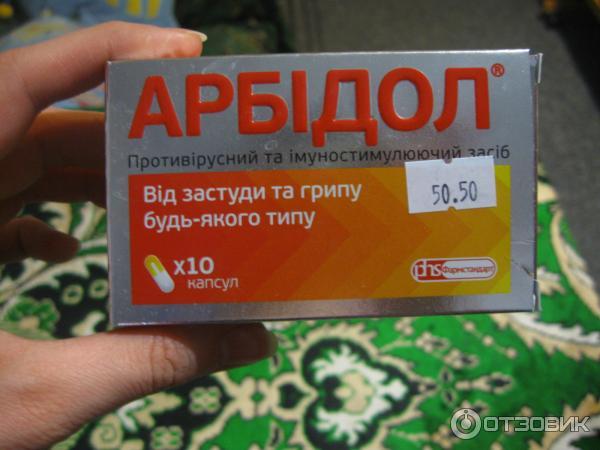 Он содержит 21 растительный компонент и в основном эффективен для улучшения симптомов лихорадки, кашля и усталости, а также состояния легких, как показано на компьютерной томографии, у тяжелых пациентов.
Он содержит 21 растительный компонент и в основном эффективен для улучшения симптомов лихорадки, кашля и усталости, а также состояния легких, как показано на компьютерной томографии, у тяжелых пациентов.
Исследования доказали, что отвар может регулировать множество клеточных сигнальных путей –поскольку клетки взаимодействуют друг с другом, получая и обрабатывая химические сигналы в ответ на изменения окружающей среды, — чтобы подавить репликацию вируса и избежать или смягчить цитокиновые бури, которые являются чрезмерной реакцией клеток, повреждающих иммунную систему.
Гиперцитокинемия (цитокиновый шторм, цитокиновый каскад) — это потенциально летальная реакция иммунной системы, суть которой состоит в неконтролируемой и не несущей защитной функции активации цитокинами иммунных клеток в очаге воспаления и высвобождении последними новой порции цитокинов, вследствие наличия прямой связи между этими процессами.
Отвар нацелен на легкие и может также защитить другие органы. Его можно использовать как общий рецепт для лечения легких, умеренных, тяжелых и критических пациентов.
Его можно использовать как общий рецепт для лечения легких, умеренных, тяжелых и критических пациентов.
Тонг Сяолин, главный научный сотрудник Китайской академии китайских медицинских наук, рассказал, что 1261 новый пациент с коронавирусом в 10 провинциях приняли данный отвар. 1122 человек выздоровели и симптомы больше не появлялись, у 71 были улучшения без дальнейших случаев ухудшения.
Было также 40 пациентов в тяжелом состоянии, которые принимали этот отвар. После приема лекарства 28 человек были выписаны из больницы, а состояние 10 улучшилось, причем их симптомы менялись от тяжелых до легких.
5. Формула HuaShiBaiDu (Хуашибайду)
Фармацевт обрабатывает гранулы традиционной китайской медицины в провинциальной больнице Ганьсу TCM в Ланьчжоу, провинция Ганьсу, 20 февраля 2020 года. [Фото/Синьхуа]
Формула HuaShiBaiDu — это основной рецепт, разработанный национальной командой традиционной китайской медицины из Китайской академии медицинских наук (China Academy of Chinese Medical Sciences) . Составленная из 14 растительных компонентов, формула основана на рекомендациях раннего Национального плана диагностики и лечения, а также на опыте клинической практики в больнице Ухань Цзиньтань.
Составленная из 14 растительных компонентов, формула основана на рекомендациях раннего Национального плана диагностики и лечения, а также на опыте клинической практики в больнице Ухань Цзиньтань.
Его основное применение заключается в детоксикации, удалении «сырости и тепла» из организма и облегчении кашля для достижения внутреннего баланса тела. Его можно использовать для лечения легких, умеренных и тяжелых пациентов.
Этот рецепт обладает комплексным лечебным эффектом на различных стадиях новой коронавирусной пневмонии и может значительно сократить продолжительность пребывания в стационаре и улучшить клинические симптомы и состояние легких, как показали компьютерная томография и другие исследования. Исследования на морских свинках показали, что эта формула может снизить вирусную нагрузку на легкие на 30 процентов.
6. Гранула XuanFeiBaiDu
Фармацевт готовит рецепт ТКМ в шестой больнице Уханя, провинция Хубэй. [Фото Wang Jing/China Daily]
Гранула Xuanfeibaidu, содержащая 13 травяных компонентов, происходит из нескольких классических традиционных рецептов.
Он может детоксикировать легкие, а также используется для лечения пациентов с легкими и тяжелыми симптомами. Исследования показали, что рецепт может сократить время, необходимое для исчезновения клинических симптомов и возвращения температуры к норме, и может эффективно предотвращать ухудшение состояния пациентов.
Лечение и профилактика орви и гриппа у беременных
Грипп и другие острые респираторные вирусные инфекции (ОРВИ) занимают особое место среди инфекционных заболеваний беременных. Эти заболевания не являются такими безобидными, как многие думают.
Особенно это касается беременных женщин. Актуальность проблемы острых респираторных заболеваний вирусной природы определяется их распространенностью, неуправляемостью, высокой заразностью.
Современные условия урбанизации создают основу для частой встречи женщин с различными респираторными вирусами в течение всего срока беременности. Среди патологии беременных ОРВИ занимают первое место по распространенности — более 2/3 от общей заболеваемости острыми инфекциями. Это связано с высокой восприимчивостью беременных к вирусным инфекциям, что обусловлено особенностями иммунитета беременных.
Это связано с высокой восприимчивостью беременных к вирусным инфекциям, что обусловлено особенностями иммунитета беременных.
Влияние вирусной инфекции на течение беременности и состояние плода характеризуется возможным инфицированием плаценты, околоплодных оболочек, а также самого плода, косвенным влиянием в результате развития у беременной лихорадки, нарушения равновесия, постоянства в организме и др. Многообразие клинических эффектов объясняется временем инфицирования к сроку беременности, свойствами и вирулентностью вируса, состоянием плацентарного барьера и защитных сил, как матери, так и плода.
Для беременных характерно затяжное течение ОРВИ при отсутствии тяжелых клинических проявлений. Это объясняется способностью вирусов респираторной группы к репродукции в плаценте, а также особенностью иммунной системы беременной (состояние физиологического иммунодефицита).
Основные клинические симптомы ОРВИ: недомогание, слабость, повышенная утомляемость на фоне субфебрильной или нормальной температуры, заложенность носа, насморк, першение в горле, переходящее в поверхностный кашель.
Наиболее характерная для беременных стертая клиника ОРВИ часто является причиной недостаточного внимания к самому факту заболевания, полагая, что «банальная простуда совершенно безвредна».
Но это не так. Вирусная инфекция может оказать на течение беременности негативное воздействие, вплоть до преждевременного отхождения околоплодных вод. Кроме того, вирус, проникая через плаценту к плоду, может вызвать инфицирование плода.
ЧТО ТАКОЕ ГРИПП?
Симптомы гриппа известны всем — это высокая температура, общая слабость, головная боль, боль в мышцах рук, ног, пояснице, боль в глазах, заложенность носа, першение в горле, сухой кашель. Могут беспокоить головокружение, тошнота, рвота, понос. Гриппом нельзя заразиться, просто промочив ноги — эта инфекция проникает в организм воздушно-капельным путем от зараженного человека.
Вирус гриппа, попав в организм, поражает эпителий респираторного тракта, особенно трахеи, начинает быстро размножаться. Повышение проницаемости сосудистой стенки приводит к появлению петехиальной сыпи на коже и слизистой оболочке щек и мягкого неба, кровоизлиянию в склеры глаз, реже — к кровохарканью, носовым кровотечениям. Грипп снижает иммунитет и тем самым способствует обострению хронических заболеваний, таких как бронхиальная астма и хронический бронхит, сердечно-сосудистые заболевания, нарушения обмена веществ, заболевания почек и др.
Грипп снижает иммунитет и тем самым способствует обострению хронических заболеваний, таких как бронхиальная астма и хронический бронхит, сердечно-сосудистые заболевания, нарушения обмена веществ, заболевания почек и др.
Кроме пневмонии грипп вызывает и такие осложнения, как воспаление мышцы сердца, которое может привести к развитию сердечной недостаточности, синусит, отит и др. Кроме этого, на ослабленный гриппом организм нередко присоединятся бактериальная инфекция — пневмококковая, гемофильная, стафилококковая. Своими осложнениями и опасен грипп во время беременности, так как он может вызвать нарушение функций всех систем организма беременной.
Самое неприятное — это угроза выкидыша или преждевременных родов. Вирус гриппа вызывает кислородное голодание плода вследствие развития комплекса нарушений со стороны плода и плаценты (фетоплацетарная недостаточность), внутриутробное инфицирование (септическое состояние, врожденная пневмония и др.) и гибель плода, отклонения в физическом и психическом развитии малыша.
ЛЕЧЕНИЕ ОРВИ И ГРИППА ВО ВРЕМЯ БЕРЕМЕННОСТИ
При появлении первых признаков ОРВИ (общая слабость, утомляемость, потеря аппетита, головная боль, подъем температуры, першение и боль в горле, кашель, насморк) необходимо обратиться за консультацией к врачу-терапевту, врачу общей практики или вызвать врача на дом, а не заниматься самолечением. Врач оценит состояние и назначит обследование и лечение.
При легком течении простудных заболеваний лечение можно начинать с использования народных средств. Рекомендуется теплое обильное питье (зеленый чай с лимоном, малиновым вареньем, медом, клюквенный и брусничный морсы, настой из цветков ромашки, липы, ягод и листьев черной смородины). Полезен напиток из шиповника, который готовят из пропорции 5 столовых ложек измельченных сухих плодов на 1 л кипятка. Смесь настаивают в термосе 8-12 часов. Теплый настой употребляют по 1 стакану 3-4 раза в день. Шиповник и черная смородина являются богатыми источниками аскорбиновой кислоты (витамина С).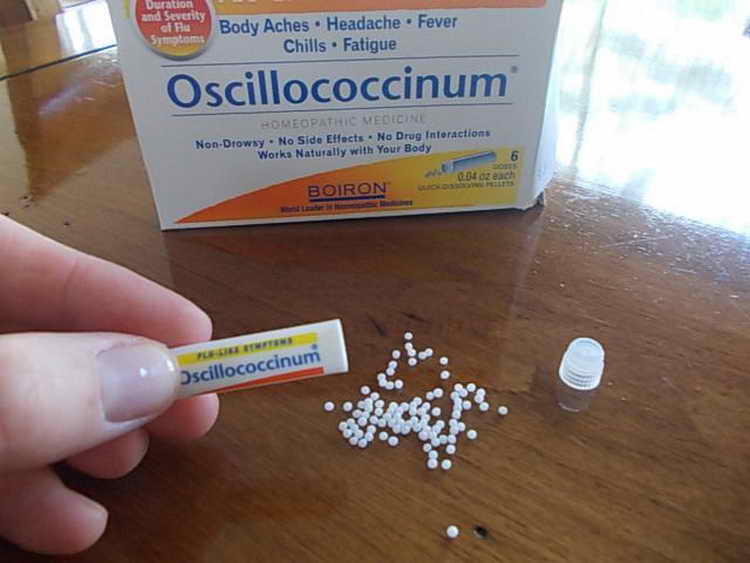 Необходимо помнить, что на поздних сроках беременности обильное питье может спровоцировать появление отеков.
Необходимо помнить, что на поздних сроках беременности обильное питье может спровоцировать появление отеков.
При заболевании ОРВИ и гриппом питание должно быть калорийным и легкоусвояемым (предпочтение отдается углеводам). В рацион необходимо включать каши (манную, овсяную, гречневую и др.), картофельное и овощное пюре, мед, варенье, джем, фрукты (киви, апельсины, бананы и др.). Исключаются острые, жареные, соленые продукты. Полезным дополнением к блюдам может стать свежий лук и чеснок.
Лук и чеснок необходимо использовать при первых признаках болезни. Если по каким-то причинам нельзя употреблять эти овощи внутрь, достаточно разложить в помещении мелко нарезанные на кусочки эти ароматные продукты и вдыхать пары, в которых содержатся фитонциды, губительно действующие на вирусы и бактерии.
Если нет аллергии, рекомендуется проводить ароматерапию с использованием эфирных масел, пары которых убивают болезнетворные микроорганизмы, освежают дыхание, уменьшают отечность слизистой.
В качестве растительного иммуностимулятора можно использовать хрен. Корень хрена натереть на мелкой терке, смешать в равных пропорциях с сахаром, смесь поставить в теплое место на 12 часов, отжать выделившийся сок и принимать в первые 2 дня болезни по 1 столовой ложке через каждый час.
При ОРВИ помогает теплая ванна для рук, воздействуя на рецепторы ладоней. При использовании ванны происходит вдыхание паров воды, которые увлажняют дыхательные пути. Для усиления эффекта в воду можно добавить морскую соль, настои лекарственных трав. После приема ванны необходимо надеть варежки и теплые шерстяные носки.
При першении в горле, заложенности носа и кашле полезно назначение ингаляций с Боржоми, содовым раствором, с настоем из цветков ромашки, календулы, листьев шалфея, эвкалипта, и др. с использованием небулайзера или широких емкостей. Ингаляции рекомендуется делать 2-3 раза в день в течение 7-10 минут.
При першении и боли в горле рекомендуется полоскание горла настоем травы (ромашка, эвкалипт, календула, кора дуба), раствором соли и йода (на стакан теплой воды 1 чайная ложка соли и 2-3 капли йода). Полоскание горла необходимо до улучшения самочувствия.
Полоскание горла необходимо до улучшения самочувствия.
При насморке обязательно регулярное проветривание и увлажнение помещения, промывание носа физиологическим раствором хлорида натрия, который можно приготовить самостоятельно (в стакане теплой кипяченой воды растворить ½ чайной ложки кухонной или морской соли) или купить физиологический раствор в аптеке. Можно использовать медицинские препараты из морской соли и воды, такие как Салин, Аква Марис, Хьюмер, Долфин и др. Промывание необходимо повторять 4-6 раз в сутки.
При подъеме температуры выше 38° помогут прохладные водные компрессы на лоб, растирание областей подмышечных и подколенных впадин, запястья, локтевых сгибов раствором уксуса (на одну часть уксуса берется три части воды).
При назначении народных средств необходимо учитывать наличие аллергических реакций на лекарственные травы, мед, лимон и др.
Во время беременности запрещается парить ноги, накладывать горчичники, посещать бани и сауны, принимать горячие ванны, использовать корень солодки при кашле, так как солодка (лакрица) вызывает отеки и подъем артериального давления. Не приветствуется активное лечение медом и малиной, так как это может привести к повышению тонуса матки, спровоцировать развитие аллергии у ребенка.
Не приветствуется активное лечение медом и малиной, так как это может привести к повышению тонуса матки, спровоцировать развитие аллергии у ребенка.
При неэффективности лечения народными средствами, но только по рекомендации врача, при ОРВИ и гриппе можно применять ряд медикаментозных препаратов, разрешенных во время беременности.
Для снижения температуры тела показан парацетомол, противопоказаны аспирин, комплексные препараты (колдрекс, фервекс, терафлю и др.), ибупрофен, нестероидные противовоспалительные препараты.
Сосудосуживающие капли в нос беременным противопоказаны, так как они вызывают сужение сосудов плаценты, повышают артериальное давление. Для лечения насморка у беременных можно использовать пиносол, если у пациентки отсутствует аллергия на эфирные масла, а также синупрет в форме драже и таблеток.
При кашле разрешается использовать мукалтин, со 2-го и 3-го триместров беременности допускается амброксол.
При боли в горле безопасны для беременных женщин спреи для горла и растворы для полоскания: Хлоргексидин, Мирамистин, Ингалипт, Аргенто Септ, Люголь, Стрепсилс Плюс, Тантум Верде, Стопангин (разрешен со 2-го триместра беременности).
Не все лекарственные средства с противовирусным действием могут быть назначены беременным, так как некоторые из них обладают токсическим действием на плод, а о безопасности применения других недостаточно информации. Для лечения и профилактики ОРВИ в течение всей беременности можно принимать Оциллококцинум, Инфлюцид. Начинать прием данных препаратов необходимо при первых симптомах заболевания.
Показаны препараты группы интерферона и индукторы интерферонов, обладающие противовирусным и иммуномодулирующим действием. Из этих препаратов допускаются к применению во время беременности следующие: со 2-го триместра беременности можно использовать свечи Виферон, на протяжении беременности допускается прием Гриппферона и Генферона (спрей назальный и капли назальные).
Умифеновир (арпетол, арбидол) обладает широким спектром противовирусного действия, кроме того, он обладает низкой токсичностью, что позволяет использовать его в качестве противовирусного средства для лечения гриппа у беременных.
Назначаемая доза умифеновира по 200 мг 4 раза в день (каждые 6 часов) 5 дней.
Вопрос о назначении антибиотиков при ОРВИ и гриппе решает врач. Во время беременности разрешены для приема антибактериальные средства пенициллинового и цефалоспоринового ряда, а также макролиды. При беременности противопоказаны тетрациклины (доксициклин), фторхинолоны (ципрофлоксацин, левофлоксацин), ко-тримоксазол и другие сульфаниламиды, аминогликозиды (канамицин, гентамицин, амикацин).
СПОСОБЫ ПРОФИЛАКТИКИ ОРВИ И ГРИППА ВО ВРЕМЯ БЕРЕМЕННОСТИ:
А. Неспецифическая профилактика
1.Соблюдение правил личной гигиены:
- «Этикет кашля» — прикрывать нос и рот салфеткой во время кашля или чихания. После использования выбрасывать салфетку в мусор. Если салфетка отсутствует чихать и кашлять в локтевой изгиб.
- Частое мытье рук с мылом и водой, особенно после кашля и чихания.

- Использование спиртсодержащих средств для мытья рук.
- Избегать близкого контакта с заболевшими (расстояние не менее 1 метра), объятий, поцелуев и рукопожатий.
- Избегать касаний руками глаз, носа, рта.
- Обязательное промывание носа и полоскание рта после возвращения домой.
2.Предупреждение инфицирования и распространения инфекций:
- Изоляция заболевших, использование отдельной посуды.
- Влажная уборка и частое проветривание помещений.
- Частые прогулки на свежем воздухе.
- Избегать пребывания в людных местах и контакта с заболевшими.
- Отмена массовых мероприятий.
- Использование средств защиты (марлевые повязки, респираторные маски).
- Смазывание слизистой носа оксолиновой мазью перед выходом на улицу во время эпидемий ОРВИ.
3.Повышение устойчивости организма:
- Прием витаминных препаратов, настоев трав, богатых витамином С (настои из шиповника и черной смородины), лимона, клюквенного и брусничного морсов).

- Рациональное питание с включением свежих овощей и фруктов, прием растительных фитонцидов (лук, чеснок, хрен).
- Лекарственная профилактика после контакта с заболевшим лицом (Гриппферон, Виферон, Оциллококцинум).
В. Специфическая профилактика гриппа.
Наиболее эффективным методом профилактики гриппа является иммунизация беременных женщин и их близких родственников.
Прививку лучше сделать на стадии планирования беременности. Если этого не произошло, прививаться можно, начиная со 2-го триместра беременности. Современные вакцины второго поколения – Флюваксин (Китай), Бегривак (Германия), Ваксигрип (Франция), Флюарикс (Бельгия) и третьего поколения – Гриппол и Гриппол плюс (РФ), Агриппал SI (Италия), Инфлювак (Нидерланды) разрешены к применению у беременных, начиная со 2-го триместра беременности, в период лактации и у детей с 6-месячного возраста.
Сделать выбор в пользу профилактической прививки – это шаг к сохранению здоровья в эпидемию гриппа.
Микша Ядвига Станиславовна, доцент кафедры поликлинической терапии БГМУ, канд. мед. наук
ᐉ Аптека Низких Цен • Интернет аптека, которая всегда рядом
Интернет-каталог лекарственных товаров от Аптека АНЦ
Аптека АНЦ — это специализированная компания, осуществляющая деятельность по розничной и оптовой торговли лекарственными средствами и товарами медицинского назначения, у которой есть собственный online сервис, и в которой представлен широкий ассортимент лекарственных средств, лечебной и декоративной косметики, товаров для ухода за кожей и телом с выгодным ценам. Аптека АНЦ сотрудничает с другими аптечными заведениями, благодаря чему заказ можно получить в ближайшей Вам аптеке.
ПРЕИМУЩЕСТВА АПТЕК АНЦ
Цель Аптеки АНЦ — улучшить качество жизни и здоровья людей, посредством предоставления наиболее выгодных медикаментов, которые можно купить рядом с домом. Аптека АНЦ имеет одно из основных преимуществ, а именно возможность осуществить заказ в режиме online.
ВЫГОДНЫЕ ЦЕНЫ
Стоимость товаров в различных аптечных заведениях Аптека АНЦ и партнеров варьируется. Online сервис осуществляет автоматический подбор необходимых Вам товаров сразу по нескольким критериям: цена, местонахождение аптеки, наличие товара. На нашем сайте Вы можете первыми узнавать об акциях и скидках на товары. Информация обновляется постоянно, что позволяет всегда быть в курсе действующих акций и скидок.
Аптека АНЦ также имеет широкую бонусную программу «АНЦ ЛАЙК», что позволяет накапливать бонусы и рассчитываться ими за приобретенные товары.
ШИРОКИЙ АССОРТИМЕНТ
Специализированный online сервис позволяет ознакомиться с широким ассортиментом лекарственных средств, косметических средств, медицинской техники, средств гигиены, средств для ухода за младенцем и других аптечных товаров.
ЗАКАЗ ОНЛАЙН
Благодаря online сервису Аптеки АНЦ необходимые товары можно заказать не выходя из дома. Сайт автоматически найдет и предложит Вам ближайшую аптеку, где необходимый товар есть в наличии. Вам останется только ознакомиться на нашем сайте с ассортиментом, дойти до ближайшей аптеки и оплатить заказ. Осуществить оплату можно непосредственно на месте приобретения: наличными или бесконтактно.
Вам останется только ознакомиться на нашем сайте с ассортиментом, дойти до ближайшей аптеки и оплатить заказ. Осуществить оплату можно непосредственно на месте приобретения: наличными или бесконтактно.
НАДЕЖНОСТЬ
Аптека АНЦ осуществляет свою деятельность исключительно в правовом пространстве, не нарушая действующего законодательства Украины. Аптека АНЦ имеет все необходимые разрешения и лицензии на осуществление деятельности по розничной и оптовой торговли лекарственными средствами. Весь товар перед реализацией конечному потребителю проходит тщательную проверку на срок годности.
ПОМОЩЬ СПЕЦИАЛИСТА
Если Вам нужна помощь специалиста, Вы можете обратиться в аптечную справку и задать все вопросы, которые Вас волнуют. Наши консультанты и провизоры обладают высоким профессионализмом, регулярно повышают свой уровень квалификации и ответят на все вопросы.
Формирование противовирусных цитоплазматических гранул во время ортопоксвирусной инфекции
РЕЗЮМЕ
Мутанты вируса осповакцины (VV), лишенные двухцепочечной РНК (dsRNA) -связывающего белка E3L (Δ E3L мутант VV), демонстрируют ограниченную репликацию, как и в большинстве типов клеток. дцРНК, продуцируемая VV, активирует протеинкиназу R (PKR), что приводит к фосфорилированию eIF2α и нарушению инициации трансляции. Здесь мы показываем, что клетки, инфицированные Δ E3L мутантным VV, собирают цитоплазматические гранулярные структуры, которые окружают репликационные фабрики VV на ранней стадии непродуктивной инфекции.Эти структуры содержат связанные со стрессовыми гранулами белки G3BP, TIA-1 и USP10, а также поли (A) -содержащую РНК. В этих структурах отсутствуют белки крупных рибосомных субъединиц, что позволяет предположить, что они трансляционно неактивны. Формирование этих точечных структур коррелирует с ограниченной репликацией, поскольку они встречаются в> 80% клеток, инфицированных мутантным VV Δ E3L , но только в 10% клеток, инфицированных VV дикого типа. Поэтому мы называем эти структуры противовирусными гранулами (AVG).Для образования AVG требуются PKR и фосфорилированный eIF2α, поскольку эмбриональные фибробласты мыши (MEFs), лишенные PKR, обнаруживают сниженное образование гранул, а MEFs, лишенные фосфорилируемого eIF2α, не обнаруживают образования гранул.
дцРНК, продуцируемая VV, активирует протеинкиназу R (PKR), что приводит к фосфорилированию eIF2α и нарушению инициации трансляции. Здесь мы показываем, что клетки, инфицированные Δ E3L мутантным VV, собирают цитоплазматические гранулярные структуры, которые окружают репликационные фабрики VV на ранней стадии непродуктивной инфекции.Эти структуры содержат связанные со стрессовыми гранулами белки G3BP, TIA-1 и USP10, а также поли (A) -содержащую РНК. В этих структурах отсутствуют белки крупных рибосомных субъединиц, что позволяет предположить, что они трансляционно неактивны. Формирование этих точечных структур коррелирует с ограниченной репликацией, поскольку они встречаются в> 80% клеток, инфицированных мутантным VV Δ E3L , но только в 10% клеток, инфицированных VV дикого типа. Поэтому мы называем эти структуры противовирусными гранулами (AVG).Для образования AVG требуются PKR и фосфорилированный eIF2α, поскольку эмбриональные фибробласты мыши (MEFs), лишенные PKR, обнаруживают сниженное образование гранул, а MEFs, лишенные фосфорилируемого eIF2α, не обнаруживают образования гранул. В обоих случаях эти пониженные уровни образования AVG коррелировали с увеличением репликации мутантного VV Δ E3L . Удивительно, но MEF, лишенные компонентного белка AVG TIA-1, поддерживали повышенную репликацию мутантного VV Δ E3L , несмотря на повышенное фосфорилирование eIF2α и сборку AVG, в которых отсутствовал TIA-1.Эти данные показывают, что для эффективного PKR-опосредованного ограничения репликации мутантного VV Δ E3L требуется образование AVG после фосфорилирования eIF2α. Это новое открытие, которое подтверждает гипотезу о том, что образование агрегатов субклеточного белка является важным компонентом успешного клеточного противовирусного ответа.
В обоих случаях эти пониженные уровни образования AVG коррелировали с увеличением репликации мутантного VV Δ E3L . Удивительно, но MEF, лишенные компонентного белка AVG TIA-1, поддерживали повышенную репликацию мутантного VV Δ E3L , несмотря на повышенное фосфорилирование eIF2α и сборку AVG, в которых отсутствовал TIA-1.Эти данные показывают, что для эффективного PKR-опосредованного ограничения репликации мутантного VV Δ E3L требуется образование AVG после фосфорилирования eIF2α. Это новое открытие, которое подтверждает гипотезу о том, что образование агрегатов субклеточного белка является важным компонентом успешного клеточного противовирусного ответа.
Эукариотические клетки развили чувствительные к стрессу пути, позволяющие справляться с различными экологическими проблемами. Центральным признаком клеточного стрессового ответа является перепрограммирование трансляции мРНК (21).Одним из нескольких сигнальных путей, которые контролируют трансляцию во время стресса, является путь eIF2α, который регулирует рекрутирование инициатора метионина фактором инициации трансляции eIF2. Семейство протеинкиназ фосфорилирует общий сайт в eIF2α (серин 51), регуляторной субъединице eIF2. Это фосфорилирование ингибирует функцию eIF2, ограничивая образование преинициативного комплекса и уменьшая инициацию трансляции (48). Каждая из киназ eIF2α, включая протеинкиназу R (PKR), регулируемую гемом киназу eIF2α, общую контрольную недерепрессируемую 2 и PKR-подобную киназу эндоплазматического ретикулума (ER), активируется в ответ на различные стрессы окружающей среды, такие как окислительный и ER стресс, тепловой шок, аминокислотная депривация и дефицит гемина.Некоторые из них также активируются каскадами иммунных сигналов и / или атакой патогенов, включая вирусы (26, 31, 37). Ключевым последствием фосфорилирования eIF2α является образование цитоплазматических стрессовых гранул (SG) (4), очагов, в которых после остановки трансляции накапливаются остановленные комплексы мРНП (мессенджер рибонуклеопротеина). SG являются сайтами сортировки мРНК, где мРНП назначаются специфические судьбы через их взаимодействия с массивом РНК-связывающих белков и их взаимодействующих элементов.
Семейство протеинкиназ фосфорилирует общий сайт в eIF2α (серин 51), регуляторной субъединице eIF2. Это фосфорилирование ингибирует функцию eIF2, ограничивая образование преинициативного комплекса и уменьшая инициацию трансляции (48). Каждая из киназ eIF2α, включая протеинкиназу R (PKR), регулируемую гемом киназу eIF2α, общую контрольную недерепрессируемую 2 и PKR-подобную киназу эндоплазматического ретикулума (ER), активируется в ответ на различные стрессы окружающей среды, такие как окислительный и ER стресс, тепловой шок, аминокислотная депривация и дефицит гемина.Некоторые из них также активируются каскадами иммунных сигналов и / или атакой патогенов, включая вирусы (26, 31, 37). Ключевым последствием фосфорилирования eIF2α является образование цитоплазматических стрессовых гранул (SG) (4), очагов, в которых после остановки трансляции накапливаются остановленные комплексы мРНП (мессенджер рибонуклеопротеина). SG являются сайтами сортировки мРНК, где мРНП назначаются специфические судьбы через их взаимодействия с массивом РНК-связывающих белков и их взаимодействующих элементов. К ним относятся факторы, участвующие в редактировании и обработке РНК, подавлении трансляции и процессинге микроРНК.
К ним относятся факторы, участвующие в редактировании и обработке РНК, подавлении трансляции и процессинге микроРНК.
Образование SG может быть спровоцировано остановкой трансляции, вызванной фосфорилированием eIF2α, во время которого рибосомы отталкиваются от транскрипта мРНК, оставляя множество молекул мРНК, высвобождаемых из полисом (2). Эти неполисомные молекулы мРНК взаимодействуют со специфическими РНК-связывающими белками, которые направляют их сборку в SG или другие типы гранул РНК (например, процессинговые тельца). Белковый состав комплекса мРНП в значительной степени определяет тип гранулы РНК, в которую он собран, и белок-белковые взаимодействия между РНК-связывающими белками, по-видимому, управляют этим процессом.Клеточные белки TIA-1 и G3BP играют критическую роль в сборке SG, образуя агрегаты посредством меж- и внутримолекулярных взаимодействий (5, 16, 46). Эти белки взаимодействуют с различными другими факторами, включая, в случае G3BP, USP10 (деубиквитинирующий фермент) и каприн-1 (связанный с клеточным циклом РНК-связывающий белок с несколькими предполагаемыми функциями, включая транскрипцию промежуточного гена вируса осповакцины [VV]. [20, 43]). Другие факторы, обнаруженные в SG, включают факторы инициации трансляции, такие как eIF3 и малые субъединицы рибосом.Большие рибосомные субъединицы заметно отсутствуют в SG, потому что остановка трансляции происходит на стадии до того, как большая субъединица может присоединиться к трансляционному комплексу (5).
[20, 43]). Другие факторы, обнаруженные в SG, включают факторы инициации трансляции, такие как eIF3 и малые субъединицы рибосом.Большие рибосомные субъединицы заметно отсутствуют в SG, потому что остановка трансляции происходит на стадии до того, как большая субъединица может присоединиться к трансляционному комплексу (5).
На сегодняшний день как про-, так и противовирусную активность приписывают образованию или ингибированию SG, и это часто свидетельствует о вирусном подавлении клеточных стрессовых реакций (9). Некоторые вирусы изменяют образование и состав SG, чтобы стимулировать свой репликативный цикл (9, 35, 41). Например, частицы ортореовируса индуцируют и локализуются в SG на ранних этапах инфицирования, и этот этап может способствовать жизненному циклу вируса (36).Протеазы полиовируса активно расщепляют G3BP, PABP и eIF4G во время инфекции (49), но, тем не менее, образуются стабильные SG, содержащие TIA-1 и мРНК с положительным смыслом; эти измененные SG, по-видимому, не обладают противовирусным действием и могут вместо этого быть провирусными, способствуя отключению клеток-хозяев (35).
Напротив, несколько вирусов, по-видимому, ингибируют образование SG либо по всей цитоплазме, например, вирус Сендай и ротавирус (18, 33), либо в локализованной области клетки, такой как вирус леса Семлики (32). Вирус Западного Нила (WNV) привлекает TIA-1 и TIA-R к 3′-стволовой петле своей негативно-смысловой РНК, и TIA-R, по-видимому, способствует репликации вируса, так как эмбриональные фибробласты мыши с нокаутом TIA-R (KO) ( MEF) демонстрируют пониженную репликацию вируса (14).Однако MEF TIA-1 KO демонстрируют нормальную репликацию WNV, и образования SG во время инфекции не наблюдается. TIA-1 KO MEF показали повышенную вирусную продукцию с использованием вируса везикулярного стоматита, вируса Синдбис и вируса простого герпеса типа 1 (HSV-1) (28).
VV представляет собой большой ДНК-вирус с двухцепочечным ДНК-геномом и является прототипным членом семейства Orthopoxvirus , которое также включает вирус натуральной оспы (возбудитель оспы) и вирус оспы обезьян (новый зоонозный патоген, [15 ]). Поксвирусы разработали сложные способы уклонения от адаптивных и пассивных иммунных ответов и предотвращения прерывания их репликации противовирусными ответами клетки-хозяина (42). Ранее считалось, что VV не индуцирует образование канонических SG, хотя ранее было показано, что маркерный белок SG G3BP и его взаимодействующий партнер каприн-1 локализуются внутри вирусных репликационных фабрик во время инфекции VV дикого типа (WT) (19, 47) . В дополнение к отчету о локализации G3BP и каприна-1 внутри фабрик, факторы трансляции eIF4E, eIF4G и PABP, как сообщается, накапливаются на фабриках во время продуктивного заражения.Мало что известно о поведении этих белков во время непродуктивной инфекции.
Поксвирусы разработали сложные способы уклонения от адаптивных и пассивных иммунных ответов и предотвращения прерывания их репликации противовирусными ответами клетки-хозяина (42). Ранее считалось, что VV не индуцирует образование канонических SG, хотя ранее было показано, что маркерный белок SG G3BP и его взаимодействующий партнер каприн-1 локализуются внутри вирусных репликационных фабрик во время инфекции VV дикого типа (WT) (19, 47) . В дополнение к отчету о локализации G3BP и каприна-1 внутри фабрик, факторы трансляции eIF4E, eIF4G и PABP, как сообщается, накапливаются на фабриках во время продуктивного заражения.Мало что известно о поведении этих белков во время непродуктивной инфекции.
Инфекция клеток VV, лишенных гена E3L, является хорошо известной моделью непродуктивной вирусной инфекции. Белок E3L представляет собой белок, связывающий двухцепочечную РНК (дцРНК), который, как полагают, предотвращает противовирусные реакции хозяина путем секвестрации дцРНК во время инфекции. Ранее было показано, что клетки, инфицированные вирусами, лишенными гена E3L (Δ E3L мутантных вирусов), активируют дцРНК-связывающую киназу PKR (11, 27).Репликация Δ E3L мутантного вируса in vitro обычно выявляет дефект 10 с логарифмической шкалой от 1 до 2 по сравнению с вирусами дикого типа (51). Этот дефект в значительной степени объясняется снижением трансляции вирусного белка после активации PKR, которая, как полагают, блокирует репликацию VV на промежуточной стадии экспрессии гена (30, 51). Экспрессия вирусного гена может быть восстановлена путем экспрессии белков, которые секвестрируют дцРНК (8). Это установило важность распознавания дцРНК фактором хозяина как инициирующего фактора в подавлении репликации VV.
Ранее было показано, что клетки, инфицированные вирусами, лишенными гена E3L (Δ E3L мутантных вирусов), активируют дцРНК-связывающую киназу PKR (11, 27).Репликация Δ E3L мутантного вируса in vitro обычно выявляет дефект 10 с логарифмической шкалой от 1 до 2 по сравнению с вирусами дикого типа (51). Этот дефект в значительной степени объясняется снижением трансляции вирусного белка после активации PKR, которая, как полагают, блокирует репликацию VV на промежуточной стадии экспрессии гена (30, 51). Экспрессия вирусного гена может быть восстановлена путем экспрессии белков, которые секвестрируют дцРНК (8). Это установило важность распознавания дцРНК фактором хозяина как инициирующего фактора в подавлении репликации VV.
Мы были заинтересованы в исследовании событий ниже распознавания дцРНК и активации PKR, которые способствуют ингибированию репликации VV. В частности, нас интересовало, является ли фосфорилирование eIF2α последним важным этапом, необходимым для ограничения репликации VV, или есть доказательства того, что другие функциональные белки, расположенные ниже активации PKR и фосфорилирования eIF2α, вносят вклад в противовирусный ответ. В частности, мы исследовали, может ли механизм ингибирования трансляции во время инфицирования мутантным вирусом Δ E3L включать образование SG или противовирусные функции SG-ассоциированных клеточных белков.
В частности, мы исследовали, может ли механизм ингибирования трансляции во время инфицирования мутантным вирусом Δ E3L включать образование SG или противовирусные функции SG-ассоциированных клеточных белков.
МАТЕРИАЛЫ И МЕТОДЫ
Клеточные линии. Клетки U2OS были любезным подарком Дэвида Сабатини (Институт биомедицинских исследований Уайтхеда). Клетки HeLa, BHK-21 и Vero E6 были получены из АТСС. Клеточные линии MEF, лишенные PKR или экспрессирующие мутант eIF2α S51A , с соответствующими им WT-партнерами, были любезным подарком Р. Кауфмана (Мичиганский университет, Анн-Арбор) (39, 40). TIA-1 KO MEF и контрольные линии были созданы в нашей лаборатории. Все клеточные линии поддерживали в среде Игла, модифицированной Дульбекко (DMEM), с добавлением глутамина и 10% фетальной телячьей сыворотки (FCS, D10).Клеточные линии MEF были иммортализованы путем трансфекции большим Т-антигеном вируса обезьяны 40 и пассированы <20 раз в ходе описанных здесь исследований, чтобы избежать каких-либо изменений в их генетическом материале. Клетки рибосомного белка большой субъединицы 7a (YFP-RPL7a), меченные желтым флуоресцентным белком (YFP), были созданы в нашей лаборатории, как описано ранее (23). Вкратце, конструкция RPL7a, включающая кодирующую последовательность YFP на своем С-конце, была создана с использованием ПЦР и шаблона, полученного от Open Biosystems.Стабильные трансфектанты были созданы в клетках U2OS, отобранных по устойчивости к лекарственным средствам (канамицин) и субклонированным путем ограничивающего разведения. Функция белка, меченного YFP, была подтверждена его включением в полисомальные фракции (данные не показаны).
Клетки рибосомного белка большой субъединицы 7a (YFP-RPL7a), меченные желтым флуоресцентным белком (YFP), были созданы в нашей лаборатории, как описано ранее (23). Вкратце, конструкция RPL7a, включающая кодирующую последовательность YFP на своем С-конце, была создана с использованием ПЦР и шаблона, полученного от Open Biosystems.Стабильные трансфектанты были созданы в клетках U2OS, отобранных по устойчивости к лекарственным средствам (канамицин) и субклонированным путем ограничивающего разведения. Функция белка, меченного YFP, была подтверждена его включением в полисомальные фракции (данные не показаны).
Вирусы, вирусные инфекции и анализ бляшек. Штамм Western Reserve (WR) VV был получен от B. Moss (NIAID, NIH) и выращен в клетках HeLa S3. Исходные титры вируса определяли в трех повторностях на клетках Vero, и вирус хранили в аликвотах при -80 ° C.
Δ E3L мутантный вирус был получен посредством гомологичной рекомбинации для замены всей открытой рамки считывания (ORF) E3L на ORF mCherry (Clontech 632523). ПЦР с перекрытием использовали для создания продукта ПЦР с ORF mCherry, фланкированным с обеих сторон на 500 п.н. последовательностей выше и ниже кодирующей последовательности E3L . Этим продуктом ПЦР трансфицировали клетки BHK-21 после инфицирования WT VV стандартными методами. Бляшки, содержащие рекомбинантные вирусы, идентифицировали с помощью флуоресцентной микроскопии после экспрессии mCherry, и бляшки очищали три раза на клетках BHK-21.Штаммы вирусов получали инокуляцией клеток BHK-21 при множественности инфекции (MOI) 0,01 и собирали в соответствии со стандартными протоколами (13). Сайты и последовательности вставки были подтверждены прямым секвенированием продукта ПЦР, полученного из лизатов инфицированных клеток, с использованием праймеров, фланкирующих вставную кассету. Мутантный вирус Δ E3L был компетентным в отношении репликации в клетках BHK-21, но не в клетках HeLa или Vero, что согласуется с предыдущими сообщениями.
ПЦР с перекрытием использовали для создания продукта ПЦР с ORF mCherry, фланкированным с обеих сторон на 500 п.н. последовательностей выше и ниже кодирующей последовательности E3L . Этим продуктом ПЦР трансфицировали клетки BHK-21 после инфицирования WT VV стандартными методами. Бляшки, содержащие рекомбинантные вирусы, идентифицировали с помощью флуоресцентной микроскопии после экспрессии mCherry, и бляшки очищали три раза на клетках BHK-21.Штаммы вирусов получали инокуляцией клеток BHK-21 при множественности инфекции (MOI) 0,01 и собирали в соответствии со стандартными протоколами (13). Сайты и последовательности вставки были подтверждены прямым секвенированием продукта ПЦР, полученного из лизатов инфицированных клеток, с использованием праймеров, фланкирующих вставную кассету. Мутантный вирус Δ E3L был компетентным в отношении репликации в клетках BHK-21, но не в клетках HeLa или Vero, что согласуется с предыдущими сообщениями.
Вирус Δ E3L — F17R -Venus был получен путем гомологичной рекомбинации с использованием родительского мутантного вируса Δ E3L , описанного выше. Промотор F17R был выбран потому, что ранее было показано, что эта ORF демонстрирует «позднюю» кинетику экспрессии генов (34). Вкратце, ПЦР с перекрыванием использовали для получения продукта ПЦР с последовательностью промотора F17R , за которой следовала ORF Венеры (Addgene 11931), сразу за которой следовал стоп-кодон. Эта кассета фланкирована с обеих сторон на 500 п.н. последовательностей выше и ниже сайта вставки в межгенной области между J4 и J5. Ранее было показано, что этот сайт хорошо переносит вставки.Рекомбинантный вирус был создан, клонирован и секвенирован, как описано выше для мутантного вируса Δ E3L .
Промотор F17R был выбран потому, что ранее было показано, что эта ORF демонстрирует «позднюю» кинетику экспрессии генов (34). Вкратце, ПЦР с перекрыванием использовали для получения продукта ПЦР с последовательностью промотора F17R , за которой следовала ORF Венеры (Addgene 11931), сразу за которой следовал стоп-кодон. Эта кассета фланкирована с обеих сторон на 500 п.н. последовательностей выше и ниже сайта вставки в межгенной области между J4 и J5. Ранее было показано, что этот сайт хорошо переносит вставки.Рекомбинантный вирус был создан, клонирован и секвенирован, как описано выше для мутантного вируса Δ E3L .
Для экспериментов с многоступенчатой кривой роста клетки помещали в шестилуночные чашки при 90% конфлюэнтности. Вирус добавляли при MOI 0,01, и клетки инкубировали при частом качании в течение 1 ч при 37 ° C. Затем клетки промывали пять раз забуференным фосфатом физиологическим раствором (PBS) и добавляли 1 мл DMEM-2% FCS (D2). Время заражения (часы после заражения [hpi]) измеряли с этого момента времени. В разные моменты времени клетки собирали соскабливанием в культуральную среду и хранили при -80 ° C до проведения анализа бляшек. Эксперименты с одноцикловой кривой роста выполняли точно так же, как описано для многоцикловых экспериментов, за исключением того, что вирус добавляли при MOI, равном 5. Клетки промывали 10 раз PBS через 1 час для удаления введенного вируса.
В разные моменты времени клетки собирали соскабливанием в культуральную среду и хранили при -80 ° C до проведения анализа бляшек. Эксперименты с одноцикловой кривой роста выполняли точно так же, как описано для многоцикловых экспериментов, за исключением того, что вирус добавляли при MOI, равном 5. Клетки промывали 10 раз PBS через 1 час для удаления введенного вируса.
Анализы бляшек проводили с конфлюэнтными клетками Vero (вирус WT) или BHK-21 (Δ E3L мутантный вирус) в 12-луночных планшетах (для одноцикловых анализов титры обоих вирусов определяли на клетках BHK).Образцы были подвергнуты трем циклам быстрого замораживания-оттаивания с использованием жидкого азота с оттаиванием при 37 ° C. Клеточный дебрис удаляли вращением при 1000 об / мин в течение 3 минут, и образцы последовательно разбавляли 1:10 для анализа бляшек. Использовали посевной материал объемом 250 мкл с частым покачиванием в течение 1 ч при 37 ° C. Затем клетки покрывали D2 и инкубировали при 37 ° C в течение 36 часов. После инкубации клетки либо окрашивали с использованием 0,2% раствора кристаллического фиолетового (анализы бляшек вируса WT), либо фиксировали в 2% параформальдегиде (PFA) в PBS (анализы мутантного вируса Δ E3L ).Бляшки подсчитывали на глаз (клетки Vero) или с использованием экспрессии mCherry в качестве маркера репликации мутантного вируса Δ E3L . Обратите внимание, что в этих условиях фиксации (без пермеабилизации или продолжительной промывки) белок mCherry можно было обнаружить с помощью стандартной флуоресцентной микроскопии. Бляшки мутантного вируса Δ E3L визуализировали как участки экспрессирующих mCherry клеток с окрашиванием, распределенным по цитоплазме.
После инкубации клетки либо окрашивали с использованием 0,2% раствора кристаллического фиолетового (анализы бляшек вируса WT), либо фиксировали в 2% параформальдегиде (PFA) в PBS (анализы мутантного вируса Δ E3L ).Бляшки подсчитывали на глаз (клетки Vero) или с использованием экспрессии mCherry в качестве маркера репликации мутантного вируса Δ E3L . Обратите внимание, что в этих условиях фиксации (без пермеабилизации или продолжительной промывки) белок mCherry можно было обнаружить с помощью стандартной флуоресцентной микроскопии. Бляшки мутантного вируса Δ E3L визуализировали как участки экспрессирующих mCherry клеток с окрашиванием, распределенным по цитоплазме.
IF и лекарственная обработка. Для экспериментов по иммунофлуоресценции (IF) вирус использовали для заражения клеток U2OS или HeLa с MOI 5.Клетки инкубировали при 37 ° C в течение 1 ч при частом покачивании. Через 1 ч инокулят удаляли, клетки трижды промывали PBS и добавляли D2. С этого момента отсчитывали время заражения (hpi).
Для экспериментов с использованием арсенита натрия (NA; Sigma) и циклогексимида (CHX; Sigma) клетки HeLa инфицировали вирусом при MOI 5, как описано выше. При 5 hpi добавляли NA в виде разведения в PBS в концентрации 0,1 мМ. Через час среду заменяли на D2, содержащий 100 мкг / мл CHX, растворенного в диметилсульфоксиде (ДМСО).К контрольной среде добавляли равный объем ДМСО. При 7 hpi клетки фиксировали и обрабатывали для окрашивания IF, как описано ниже.
В указанные моменты времени клетки осторожно промывали PBS и фиксировали в 4% PFA (Electron Microscopy Sciences) в течение 20 минут при комнатной температуре. Затем их промывали PBS и повышали проницаемость с использованием метанола при -20 ° C в течение 2 минут при качании. Метанол удаляли, и клетки инкубировали в блокирующем буфере (PBS, содержащий 4% лошадиной сыворотки) в течение ночи при 4 ° C.На следующий день клетки окрашивали антителами, разведенными в блокирующем буфере в течение 1 ч, с последующей тщательной промывкой. Вторичные антитела разводили 1: 1000 в блокирующем буфере и наносили на 30 мин. Следует отметить, что белок mCherry, продуцируемый мутантным вирусом Δ E3L , лишь слабо обнаруживался с помощью стандартной флуоресцентной микроскопии с использованным протоколом фиксации и окрашивания (данные не показаны). Это позволило нам окрашивать клетки, инфицированные мутантным вирусом Δ E3L , с использованием антител, связанных с красными флуорофорами, которые были намного ярче, чем тусклый сигнал mCherry.Образцы были промыты и закреплены с помощью ProLong Antifade Gold (Invitrogen). Образцы просматривали с помощью микроскопа Zeiss Axioplan2 с объективом 63x, устройства Apotome и программного обеспечения Axiovision или с помощью конфокального микроскопа Perkin-Elmer Ultraview с вращающимся диском с объективом 100x. Монтажные работы были собраны с помощью Adobe Photoshop.
Вторичные антитела разводили 1: 1000 в блокирующем буфере и наносили на 30 мин. Следует отметить, что белок mCherry, продуцируемый мутантным вирусом Δ E3L , лишь слабо обнаруживался с помощью стандартной флуоресцентной микроскопии с использованным протоколом фиксации и окрашивания (данные не показаны). Это позволило нам окрашивать клетки, инфицированные мутантным вирусом Δ E3L , с использованием антител, связанных с красными флуорофорами, которые были намного ярче, чем тусклый сигнал mCherry.Образцы были промыты и закреплены с помощью ProLong Antifade Gold (Invitrogen). Образцы просматривали с помощью микроскопа Zeiss Axioplan2 с объективом 63x, устройства Apotome и программного обеспечения Axiovision или с помощью конфокального микроскопа Perkin-Elmer Ultraview с вращающимся диском с объективом 100x. Монтажные работы были собраны с помощью Adobe Photoshop.
Антитело к USP10 было получено от Bethyl Laboratories (A300-900A). Антитела к G3BP, eIF3b и TIA-1 были получены от Santa Cruz Biotechnology Inc. (каталожные номера sc70283, sc137215 и sc166246).Антитело к каприну было получено от Protein Tech Group, используемое антитело против FMRP было Santa Cruz sc-101048, используемое антитело против FXR2 было Santa Cruz sc-32266, и используемое козье антитело против FXR1 было sc-10544. DAPI (4 ‘, 6-диамидино-2-фенилиндол) и вторичные антитела, полученные у ослов и конъюгированные с Alexa 488 или 568, были получены от Invitrogen.
(каталожные номера sc70283, sc137215 и sc166246).Антитело к каприну было получено от Protein Tech Group, используемое антитело против FMRP было Santa Cruz sc-101048, используемое антитело против FXR2 было Santa Cruz sc-32266, и используемое козье антитело против FXR1 было sc-10544. DAPI (4 ‘, 6-диамидино-2-фенилиндол) и вторичные антитела, полученные у ослов и конъюгированные с Alexa 488 или 568, были получены от Invitrogen.
Fluorescence гибридизация in situ (FISH). Вкратце, клетки инфицировали или имитировали инфицирование, как описано выше, перед фиксацией в 4% PFA в течение 20 минут при комнатной температуре.Клетки подвергали проницаемости в ледяном метаноле в течение 5 минут, промывали PBS и дополнительно подвергали проницаемости при 4 ° C в 70% этаноле, не содержащем РНКазы, в течение ночи. Покровные стекла регидратировали в буфере 2 × SSC (1 × SSC — 0,15 М NaCl плюс 0,015 М цитрат натрия) (Sigma S6639) перед прегибридизацией с 2 нг зонда [5′-флуоресцеин-олиго (dT) 50; Genelink] на покровное стекло в буфере для гибридизации (25% формамид [Ambion AM9342], 0,05 M EDTA, 10% натриевая соль декстрансульфата [Sigma], 1 × раствор Денхардта [Sigma D2532], 0,5 мг / мл тРНК [Sigma R9001], 1 мМ рибонуклеозид-ванадильный комплекс [Fluka 94742]) в течение 1 ч при 60 ° C. Гибридизацию проводили в буфере для гибридизации плюс 2 нг зонда на покровное стекло в течение 5 минут при 65 ° C и 4 часов при 40 ° C в темноте. Клетки промывали 2 × SSC, контрастировали DAPI, чтобы выделить ДНК и фабрики репликации вирусов, и помещали на предметные стекла микроскопа, как описано выше. Образцы просматривали на микроскопе Zeiss Axioplan 2 с объективом 63x, устройством Apotome и программным обеспечением Axiovision.
Гибридизацию проводили в буфере для гибридизации плюс 2 нг зонда на покровное стекло в течение 5 минут при 65 ° C и 4 часов при 40 ° C в темноте. Клетки промывали 2 × SSC, контрастировали DAPI, чтобы выделить ДНК и фабрики репликации вирусов, и помещали на предметные стекла микроскопа, как описано выше. Образцы просматривали на микроскопе Zeiss Axioplan 2 с объективом 63x, устройством Apotome и программным обеспечением Axiovision.
SDS-PAGE и вестерн-блоттинг. Клетки для электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) помещали в 12-луночные планшеты при 90% конфлюэнтности и инфицировали WT или мутантным вирусом Δ E3L при MOI 5. .После 1 ч инкубации и трех промывок PBS клетки покрывали D2 и инкубировали при 37 ° C в течение 6 часов, начиная с последней промывки. Для сбора образцов среду аспирировали и клетки лизировали на льду с использованием буфера для анализа радиоиммунопреципитации (50 мМ Трис-HCl, pH 7,4, 150 мМ NaCl, 1% NP-40, 0,5% дезоксихолата натрия, 0,1% SDS), содержащего ингибиторы протеаз ( Смесь ингибиторов протеазы Roche Complete Mini) и ингибиторов фосфатазы (Sigma P2850) в соответствии с инструкциями производителя. Добавляли рабочий буфер SDS-PAGE, и образцы загружали в гели трис-HCl с градиентом от 4 до 15% (Bio-Rad) после нагревания при 95 ° C в течение 10 минут. Маркеры геля белка полного диапазона Rainbow были загружены в каждый гель (GE Healthcare). Вестерн-блоттинг выполняли с использованием системы миниэлектрофореза Bio-Rad в соответствии с инструкциями производителя. Мембраны блокировали в течение ночи в PBS-0,2% твин 20-4% обезжиренном сухом молоке перед инкубацией с первичным антителом. Антитело к eIF2αP было получено от Cell Signaling Technology (номер в каталоге.9721). Антикроличьи антитела, конъюгированные с пероксидазой хрена, были получены от Santa Cruz Biotechnology Inc., и сигнал детектировали путем инкубации с реагентами ECL (Invitrogen) и воздействия на рентгеновскую пленку (Kodak BioMax).
Добавляли рабочий буфер SDS-PAGE, и образцы загружали в гели трис-HCl с градиентом от 4 до 15% (Bio-Rad) после нагревания при 95 ° C в течение 10 минут. Маркеры геля белка полного диапазона Rainbow были загружены в каждый гель (GE Healthcare). Вестерн-блоттинг выполняли с использованием системы миниэлектрофореза Bio-Rad в соответствии с инструкциями производителя. Мембраны блокировали в течение ночи в PBS-0,2% твин 20-4% обезжиренном сухом молоке перед инкубацией с первичным антителом. Антитело к eIF2αP было получено от Cell Signaling Technology (номер в каталоге.9721). Антикроличьи антитела, конъюгированные с пероксидазой хрена, были получены от Santa Cruz Biotechnology Inc., и сигнал детектировали путем инкубации с реагентами ECL (Invitrogen) и воздействия на рентгеновскую пленку (Kodak BioMax).
РЕЗУЛЬТАТЫ
Δ E3L мутантный VV плохо реплицируется в клетках U2OS и демонстрирует измененную морфологию вирусной фабрики (VF). Мы сконструировали мутантный VV без гена E3L (Δ E3L мутантный VV), как описано в разделах Материалы и Методы. В соответствии с предыдущей работой мы обнаружили, что этот вирус плохо реплицируется в клетках U2OS и Vero, но реплицируется с высокими титрами в клетках BHK (данные не показаны). Мы также охарактеризовали репликацию этого вируса в клетках U2OS, поскольку предыдущие исследования структуры и функции SG были выполнены с этой линией клеток (рис. 1 A). На кривой многоступенчатого роста Δ E3L мутантный VV плохо реплицировался в клетках U2OS по сравнению с вирусом WT (штамм WR). Титры мутантного вируса Δ E3L не увеличивались значительно в течение 72-часового периода, тогда как титр вируса WT вырос до титра 5 × 10 6 БОЕ.Поскольку дефект в репликации VV мутанта Δ E3L ранее был связан с его неспособностью предотвращать активацию PKR (10-12), мы собрали образцы для SDS-PAGE и исследовали вестерн-блоты на фосфорилированный eIF2α (eIF2αP). По сравнению с таковыми в ложно инфицированных клетках уровни фосфорилирования eIF2α не были повышены в клетках, инфицированных вирусом WT при 6 hpi (рис.
В соответствии с предыдущей работой мы обнаружили, что этот вирус плохо реплицируется в клетках U2OS и Vero, но реплицируется с высокими титрами в клетках BHK (данные не показаны). Мы также охарактеризовали репликацию этого вируса в клетках U2OS, поскольку предыдущие исследования структуры и функции SG были выполнены с этой линией клеток (рис. 1 A). На кривой многоступенчатого роста Δ E3L мутантный VV плохо реплицировался в клетках U2OS по сравнению с вирусом WT (штамм WR). Титры мутантного вируса Δ E3L не увеличивались значительно в течение 72-часового периода, тогда как титр вируса WT вырос до титра 5 × 10 6 БОЕ.Поскольку дефект в репликации VV мутанта Δ E3L ранее был связан с его неспособностью предотвращать активацию PKR (10-12), мы собрали образцы для SDS-PAGE и исследовали вестерн-блоты на фосфорилированный eIF2α (eIF2αP). По сравнению с таковыми в ложно инфицированных клетках уровни фосфорилирования eIF2α не были повышены в клетках, инфицированных вирусом WT при 6 hpi (рис. 1B). Однако, в соответствии с предыдущими исследованиями, мутантный вирус Δ E3L вызывал значительное повышение уровней фосфорилированного eIF2α (10-12).В инфицированных образцах был обнаружен перекрестно-реактивный полипептид (*), но его легко отличить от eIF2α по размеру.
1B). Однако, в соответствии с предыдущими исследованиями, мутантный вирус Δ E3L вызывал значительное повышение уровней фосфорилированного eIF2α (10-12).В инфицированных образцах был обнаружен перекрестно-реактивный полипептид (*), но его легко отличить от eIF2α по размеру.
Репликация WT и Δ E3L мутантных VV в клетках U2OS. (A) Δ E3L мутант или вирус WT использовали для заражения клеток U2OS при MOI 0,01 в трех повторностях. В указанные моменты времени клетки собирали и титры вирусов измеряли с помощью анализа бляшек на клетках Vero E6 (WR = WT) или BHK-21 (Δ E3L мутантный вирус). Планки погрешностей показывают 1 стандартное отклонение.(B) Вестерн-блоттинг проводили с использованием равных образцов клеток U2OS, инфицированных мутантом Δ E3L или вирусом WT, при MOI 5 в течение 6 часов. Блоты зондировали антителом к фосфорилированному eIF2α. Перекрестно-реактивный полипептид меньшего размера связывал антитело в инфицированных клетках (*). (C) Формирование фабрики репликации оценивали в клетках U2OS, инфицированных мутантом Δ E3L или вирусом WT, при MOI, равном 5. Клетки фиксировали при 6 hpi и окрашивали с использованием DAPI для обнаружения ДНК. Стрелки указывают на фабрики репликации цитоплазматических вирусов.Z-серии собирали с помощью конфокального микроскопа; Для создания показанных изображений использовался алгоритм проецирования максимальной интенсивности.
(C) Формирование фабрики репликации оценивали в клетках U2OS, инфицированных мутантом Δ E3L или вирусом WT, при MOI, равном 5. Клетки фиксировали при 6 hpi и окрашивали с использованием DAPI для обнаружения ДНК. Стрелки указывают на фабрики репликации цитоплазматических вирусов.Z-серии собирали с помощью конфокального микроскопа; Для создания показанных изображений использовался алгоритм проецирования максимальной интенсивности.
Клетки U2OS, инфицированные мутантом Δ E3L или WT VV, были четко идентифицированы по присутствию цитоплазматических вирусных репликационных фабрик (фиг. 1C, стрелки). В клетках, инфицированных мутантным вирусом Δ E3L , эти фабрики репликации отличались по внешнему виду от тех, которые обычно наблюдаются во время репликации WT VV. Фабрики в клетках, инфицированных мутантным вирусом Δ E3L , были более многочисленными, со средней частотой 5.3 на клетку ( n = 25), в то время как фабрики в WT-инфицированных клетках имели среднюю частоту 1,7 на клетку ( n = 25). Кроме того, фабрики в клетках, инфицированных мутантным вирусом Δ E3L , обычно были меньше и имели более однородную круглую форму, чем те, которые наблюдались в клетках, инфицированных WT в тот же момент времени.
Кроме того, фабрики в клетках, инфицированных мутантным вирусом Δ E3L , обычно были меньше и имели более однородную круглую форму, чем те, которые наблюдались в клетках, инфицированных WT в тот же момент времени.
G3BP образует цитоплазматические гранулы во время инфицирования мутантным VV Δ E3L . Нас интересовало, как SG-ассоциированный белок G3BP локализуется во время цикла репликации мутантного вируса Δ E3L .Чтобы исследовать это, как клетки HeLa, так и клетки U2OS инфицировали мутантом Δ E3L или WT VV, или ложно инфицировали. На 7 hpi, время, когда инфекции WT и Δ E3L мутантным вирусом должны быть хорошо установлены, клетки фиксировали и окрашивали на G3BP. Кроме того, мы окрашивали другие инфицированные клетки на TIA-1 или белок большой рибосомной субъединицы RPL7a.
Мы обнаружили, что во время инфицирования клеток HeLa или U2OS WT VV, G3BP обычно обнаруживался распределенным по цитоплазме в большинстве клеток (рис. 2 A), подобное окрашиванию, наблюдаемому в ложно инфицированных клетках, за исключением того, что оно образовывало отдельные цитоплазматические гранулы в небольшом проценте клеток (фиг. 2A, части iii и ii). Когда это было определено количественно, было точечное окрашивание G3BP примерно от 10 до 12% окрашенных ДНК VF (фиг. 2B). В клетках, инфицированных WT VV, TIA-1 также иногда образовывал цитоплазматические гранулы, хотя гранулы TIA-1 встречались немного реже (от 3 до 6%). Напротив, при заражении мутантным вирусом Δ E3L от 81 до 100% фабрик, обнаруженных в клетках, содержали цитоплазматические гранулы, окрашенные G3BP (рис.2A, часть i и B). Аналогичная частота накопления TIA-1 наблюдалась при инфицировании мутантным VV Δ E3L (от 73 до 95% фабрик). Никаких фабрик, содержащих RPL7a, не наблюдали во время инфицирования WT или мутантным VV Δ E3L ни в одной из линий клеток, что позволяет предположить, что эти скопления не представляют сайты активной трансляции.
2 A), подобное окрашиванию, наблюдаемому в ложно инфицированных клетках, за исключением того, что оно образовывало отдельные цитоплазматические гранулы в небольшом проценте клеток (фиг. 2A, части iii и ii). Когда это было определено количественно, было точечное окрашивание G3BP примерно от 10 до 12% окрашенных ДНК VF (фиг. 2B). В клетках, инфицированных WT VV, TIA-1 также иногда образовывал цитоплазматические гранулы, хотя гранулы TIA-1 встречались немного реже (от 3 до 6%). Напротив, при заражении мутантным вирусом Δ E3L от 81 до 100% фабрик, обнаруженных в клетках, содержали цитоплазматические гранулы, окрашенные G3BP (рис.2A, часть i и B). Аналогичная частота накопления TIA-1 наблюдалась при инфицировании мутантным VV Δ E3L (от 73 до 95% фабрик). Никаких фабрик, содержащих RPL7a, не наблюдали во время инфицирования WT или мутантным VV Δ E3L ни в одной из линий клеток, что позволяет предположить, что эти скопления не представляют сайты активной трансляции. Из-за их более высокой частоты в клетках, инфицированных мутантным вирусом Δ E3L с дефицитом репликации, мы полагаем, что они являются частью противовирусного ответа хозяина, и для простоты мы называем эти гранулы противовирусными гранулами (AVG).
Из-за их более высокой частоты в клетках, инфицированных мутантным вирусом Δ E3L с дефицитом репликации, мы полагаем, что они являются частью противовирусного ответа хозяина, и для простоты мы называем эти гранулы противовирусными гранулами (AVG).
маркеров SG накапливаются вокруг VF с различной частотой во время Δ E3L мутантных и WT VV инфекций. (A) Клетки HeLa были инфицированы мутантом Δ E3L (i) или WT (ii) VV при MOI 5 или ложно инфицированы (iii). Клетки фиксировали при 7 hpi и окрашивали антителами к G3BP (красный) и DAPI (синий). Показаны поля зрения, собранные при увеличении × 40. Стрелками показаны скопления G3BP внутри и вокруг VF. Стрелками показаны ФЖ без явных скоплений G3BP.(B) Клетки HeLa или U2OS инфицировали мутантом Δ E3L или WT VV при MOI 5 при 7 hpi, и клетки фиксировали и окрашивали на маркерный белок SG TIA-1 или G3BP или на белок большой субъединицы рибосомы. RPL7a. DAPI использовался для окраски фабрик репликации вирусов. Фабрики репликации, окрашенные DAPI, связанные с каждым белком, подсчитывали с помощью микроскопии и выражали в процентах от общего количества фабрик. Для каждой выборки подсчитывались предприятия из 10 полей зрения ( n > 50 во всех случаях).
Фабрики репликации, окрашенные DAPI, связанные с каждым белком, подсчитывали с помощью микроскопии и выражали в процентах от общего количества фабрик. Для каждой выборки подсчитывались предприятия из 10 полей зрения ( n > 50 во всех случаях).
содержат SG-ассоциированные белки и локализуются на фабриках вирусной репликации в клетках, инфицированных мутантным вирусом Δ E3L . Поскольку повышенное фосфорилирование eIF2α было индуцировано инфекцией мутантного вируса Δ E3L , известны такие белки, как TIA-1 и G3BP чтобы формировать цитоплазматические SG в ответ на фосфорилирование eIF2α, мы предположили, что AVG, показанные на рис. 2, могут представлять небольшие SG. Поэтому мы дополнительно охарактеризовали эти AVG путем окрашивания на дополнительные белковые маркеры SG (USP10) и на другие компоненты SG, которые также являются партнерами по связыванию G3BP, caprin-1 и USP10 (44).Клетки оценивали с использованием DAPI в качестве маркера ДНК для определения местонахождения фабрик репликации цитоплазматических вирусов.
В ложно инфицированных клетках маркер SG TIA-1 был распределен как в цитоплазме, так и в ядрах ложно инфицированных клеток (рис. 3 A, часть v, красный) (22, 24). G3BP был диффузно распределен по цитоплазме (рис. 3A, часть v, зеленый). В клетках, инфицированных мутантным вирусом Δ E3L , картина окрашивания TIA-1 и G3BP резко изменилась. И TIA-1, и G3BP были сконцентрированы в разных AVG, которые были тесно связаны с периферией вирусных репликационных фабрик (рис.3A, части i и ii). Последовательные Z-секции подтвердили, что AVG окружают фабрики репликации, а в некоторых случаях встроены в них; Z-срезы также показали, что окрашивание G3BP наблюдалось в промежутках в окрашивании DAPI, которое маркирует VF, как описано ранее (19; см. Рис. S1 в дополнительном материале). Эта гранула не была клеточным типом-специфическим ответом на инфекцию VV, поскольку аналогичные гранулы, содержащие TIA-1 и G3BP, наблюдались, когда эти эксперименты проводились с клетками HeLa (данные не показаны и на рис. 2).
2).
Характеристика гранул во время инфицирования мутантом VV Δ E3L . (A) Клетки U2OS инфицировали мутантным вирусом Δ E3L с MOI 5 (от i до iv) или ложно инфицировали (v). Клетки фиксировали при 7 hpi и окрашивали антителами к компонентам SG TIA-1 (i и v, красный), G3BP (i и v, зеленый) и USP10 (i и v, красный) или антителами к большим рибосомам. субъединица белка RPL7a (iv, зеленый). Клетки визуализировали при увеличении × 63. (B) Клетки U2OS, стабильно экспрессирующие белок YFP-RPL7a (зеленый), инфицировали мутантом Δ E3L (i) или WT VV (ii) при MOI 5.Клетки фиксировали при 7 hpi и окрашивали антителами к G3BP (красный цвет). DAPI использовали для окрашивания ДНК. Стрелки идентифицируют VF в клетках, инфицированных мутантным вирусом Δ E3L . Области в рамке показывают увеличенные области
USP10, известный взаимодействующий партнер G3BP (17, 44), также, по-видимому, формирует AVG, которые окружают мутантный VF Δ E3L . В ложно инфицированных клетках USP10 демонстрировал диффузное точечное цитоплазматическое распределение (фиг. 3A, часть v, красный). Во время заражения мутантным вирусом Δ E3L он демонстрировал измененное распределение, аналогичное распределению G3BP; он накапливается в AVG, окружающих и встроенных в вирусные репликационные фабрики (рис.3А, часть iii). Каприн-1, альтернативный партнер связывания G3BP, также локализован в пунктированных структурах, окружающих VFs в клетках, инфицированных мутантным вирусом Δ E3L (данные не показаны) и РНК-связывающих белков, ломких X (FMRP) и связанных с ломкими X (FXR1 , FXR2) также локализованы в точечных структурах (см. Рис. S2 в дополнительном материале).
В ложно инфицированных клетках USP10 демонстрировал диффузное точечное цитоплазматическое распределение (фиг. 3A, часть v, красный). Во время заражения мутантным вирусом Δ E3L он демонстрировал измененное распределение, аналогичное распределению G3BP; он накапливается в AVG, окружающих и встроенных в вирусные репликационные фабрики (рис.3А, часть iii). Каприн-1, альтернативный партнер связывания G3BP, также локализован в пунктированных структурах, окружающих VFs в клетках, инфицированных мутантным вирусом Δ E3L (данные не показаны) и РНК-связывающих белков, ломких X (FMRP) и связанных с ломкими X (FXR1 , FXR2) также локализованы в точечных структурах (см. Рис. S2 в дополнительном материале).
Чтобы определить, могут ли AVG представлять области продолжающейся или остановленной трансляции, мы окрашивали клетки, инфицированные мутантным вирусом Δ E3L , антителами к RPL7a, белку большой субъединицы рибосомы.В ложно-инфицированных клетках распределение RPL7a было диффузно-цитоплазматическим (фиг. 3A, часть v, зеленый). В клетках, инфицированных мутантным вирусом Δ E3L , изменений в этой локализации не наблюдалось (фиг. 3A, часть iv, зеленый цвет). Окрашивание RPL7a оставалось цитоплазматическим и не накапливалось в VF или гранулах. Чтобы проверить эти результаты, мы инфицировали клетки U2OS, стабильно экспрессирующие YFP-меченый RPL7a, с помощью мутанта E3L Δ или WT VV с MOI 5. Не было обнаружено, что белок RPL7a-YFP локализуется в VF WT или гранулах, меченных G3BP. в Δ E3L мутантных VV-инфицированных клетках (рис.3Б). Вместо этого RPL7A-YFP был ядрышком (что соответствует синтезу новых рибосом) и распределен по цитоплазме. Эти результаты говорят о том, что AVG не являются центрами перевода.
3A, часть v, зеленый). В клетках, инфицированных мутантным вирусом Δ E3L , изменений в этой локализации не наблюдалось (фиг. 3A, часть iv, зеленый цвет). Окрашивание RPL7a оставалось цитоплазматическим и не накапливалось в VF или гранулах. Чтобы проверить эти результаты, мы инфицировали клетки U2OS, стабильно экспрессирующие YFP-меченый RPL7a, с помощью мутанта E3L Δ или WT VV с MOI 5. Не было обнаружено, что белок RPL7a-YFP локализуется в VF WT или гранулах, меченных G3BP. в Δ E3L мутантных VV-инфицированных клетках (рис.3Б). Вместо этого RPL7A-YFP был ядрышком (что соответствует синтезу новых рибосом) и распределен по цитоплазме. Эти результаты говорят о том, что AVG не являются центрами перевода.
AVG, индуцированные мутантным Δ E3L , являются мультибелковыми структурами. Чтобы определить, все ли белки, которые мы видели в гранулах, находились в отдельных гранулах, или эти белки колокализовались в одних и тех же гранулах во время инфицирования мутантным VV Δ E3L , инфицировано Клетки U2OS дважды окрашивали на G3BP и TIA-1 или на G3BP и eIF3b, белок, который можно найти в SG. Инфицированные клетки HeLa дважды окрашивали на G3BP и USP10. TIA-1 (зеленый) и G3BP (красный) показали частичную совместную локализацию в AVG, окружающих и встроенных в вирусные репликационные фабрики (рис. 4 A, часть i). Все AVG, по-видимому, содержали как TIA-1, так и G3BP, хотя относительные уровни этих двух белков варьировали, что приводило к различным проявлениям колокализации. Сходные результаты были получены при двойном окрашивании клеток на G3BP и eIF3b (фиг. 4A, часть ii). Здесь eIF3b (зеленый) лишь частично совпал с G3BP (красный).G3BP оказался преобладающим компонентом AVG, тогда как eIF3b появился только на их периферии. Более того, AVG, содержащие G3BP, часто содержат мало или совсем не обнаруживают eIF3b (данные не показаны), что позволяет предположить, что eIF3 является второстепенным компонентом AVG. В клетках HeLa G3BP и USP10 обнаруживают только частичную совместную локализацию в гранулах, предполагая, что эти белки могут физически не взаимодействовать в этих структурах (фиг.
Инфицированные клетки HeLa дважды окрашивали на G3BP и USP10. TIA-1 (зеленый) и G3BP (красный) показали частичную совместную локализацию в AVG, окружающих и встроенных в вирусные репликационные фабрики (рис. 4 A, часть i). Все AVG, по-видимому, содержали как TIA-1, так и G3BP, хотя относительные уровни этих двух белков варьировали, что приводило к различным проявлениям колокализации. Сходные результаты были получены при двойном окрашивании клеток на G3BP и eIF3b (фиг. 4A, часть ii). Здесь eIF3b (зеленый) лишь частично совпал с G3BP (красный).G3BP оказался преобладающим компонентом AVG, тогда как eIF3b появился только на их периферии. Более того, AVG, содержащие G3BP, часто содержат мало или совсем не обнаруживают eIF3b (данные не показаны), что позволяет предположить, что eIF3 является второстепенным компонентом AVG. В клетках HeLa G3BP и USP10 обнаруживают только частичную совместную локализацию в гранулах, предполагая, что эти белки могут физически не взаимодействовать в этих структурах (фиг.![]() 4A, часть iii, и данные не показаны). Подобные исследования совместной локализации были выполнены с некоторыми из редких AVG, наблюдаемых во время инфекции WT VV, чтобы определить, были ли сформированные структуры аналогичными; наблюдались аналогичные уровни и похожие модели колокализации (см. рис.S3 в дополнительном материале) (данные не показаны).
4A, часть iii, и данные не показаны). Подобные исследования совместной локализации были выполнены с некоторыми из редких AVG, наблюдаемых во время инфекции WT VV, чтобы определить, были ли сформированные структуры аналогичными; наблюдались аналогичные уровни и похожие модели колокализации (см. рис.S3 в дополнительном материале) (данные не показаны).
Множественные маркеры SG частично колокализуются в гранулах, и гранулы содержат поли (A) РНК. (A) Клетки U2OS (i и ii) или HeLa (iii) были инфицированы мутантным вирусом Δ E3L при MOI 5. Клетки фиксировали при 7 hpi и окрашивали антителами к компонентам SG / гранулы TIA-1 ( i, зеленый) и G3BP (i, красный) или eIF3b (ii, зеленый) и G3BP (ii, красный) и с DAPI для окрашивания ДНК. (B) Клетки U2OS были инфицированы мутантом Δ E3L (с i по iv и vi) или WT (vii и viii) VV с MOI 5 или ложно инфицированными (v).При 7 hpi клетки фиксировали и обрабатывали для FISH с использованием меченного флуоресцеином олиго (dT) зонда для локализации мРНК. В качестве контроля образец, инфицированный мутантным вирусом Δ E3L , инкубировали без зонда (vi). Показаны прогнозы максимальной интенсивности. Области в рамке показывают увеличенные области
В качестве контроля образец, инфицированный мутантным вирусом Δ E3L , инкубировали без зонда (vi). Показаны прогнозы максимальной интенсивности. Области в рамке показывают увеличенные области
Поскольку известно, что как G3BP, так и TIA-1 взаимодействуют с мРНК, чтобы управлять образованием SG, мы окрашивали инфицированные клетки U2OS с использованием флуоресцентно меченного олиго (dT) РНК-зонда (рис. 4B), чтобы определить, содержат ли AVG мРНК.Поли (A) -содержащая РНК накапливалась по схеме, напоминающей структуру AVG в клетках, инфицированных мутантным вирусом Δ E3L , проявляя гранулярное распределение по периферии фабрики, а иногда и в ее центре. Зонд олиго (dT) совместно локализован с G3BP-положительными AVG в клетках, инфицированных мутантным вирусом Δ E3L (данные не показаны). В клетках, инфицированных WT VV, окрашивание олиго (dT) было обнаружено в центре VF в распределении, аналогичном показанному ранее (19). Однако зонда вокруг фабрик не обнаружено (рис. 4B, часть ii). Следовательно, инфицирование клеток U2OS и HeLa мутантным VV Δ E3L индуцирует образование цитоплазматических, трансляционно-неактивных AVG. Эти AVG содержат поли (A) РНК, SG-ассоциированные клеточные белки и их известных партнеров по связыванию, и они образуются вокруг (а иногда и внутри) фабрик репликации вирусов.
4B, часть ii). Следовательно, инфицирование клеток U2OS и HeLa мутантным VV Δ E3L индуцирует образование цитоплазматических, трансляционно-неактивных AVG. Эти AVG содержат поли (A) РНК, SG-ассоциированные клеточные белки и их известных партнеров по связыванию, и они образуются вокруг (а иногда и внутри) фабрик репликации вирусов.
Δ E3L мутантные VV-индуцированные AVG не являются стрессовыми гранулами, потому что AVG регулярно окрашиваются положительно на несколько SG-ассоциированных белков (TIA-1, G3BP), но, по-видимому, содержат меньше других SG-ассоциированных белков (например.g., eIF3), мы спросили, являются ли гранулы уникально локализованным типом SG или они представляют собой отдельную структуру, однозначно запускаемую во время инфекции Δ E3L мутантной VV. Для этого клетки HeLa или U2OS инфицировали мутантным VV Δ E3L с MOI 1 и обрабатывали в течение 2 часов, начиная с 5 hpi, NA (химическое вещество, которое, как известно, останавливает трансляцию и запускает образование SG посредством окислительного стресса) для определения были ли AVG перераспределены по цитоплазме. В Δ E3L мутантных VV-инфицированных клетках G3BP был обнаружен в AVG, окружающих VF, а не где-либо еще в цитоплазме после обработки NA (рис.5 А). В неинфицированных клетках, обнаруженных в том же поле зрения, SG-подобные структуры (разбросанные по цитоплазме) были очевидны (то есть те, у которых отсутствуют фабрики). Таким образом, AVG отличались от SG по своей локализации, оставаясь тесно связанными с VF даже во время лечения NA.
В Δ E3L мутантных VV-инфицированных клетках G3BP был обнаружен в AVG, окружающих VF, а не где-либо еще в цитоплазме после обработки NA (рис.5 А). В неинфицированных клетках, обнаруженных в том же поле зрения, SG-подобные структуры (разбросанные по цитоплазме) были очевидны (то есть те, у которых отсутствуют фабрики). Таким образом, AVG отличались от SG по своей локализации, оставаясь тесно связанными с VF даже во время лечения NA.
Образование гранул, по-видимому, ингибирует дальнейшее образование SG, и гранулы стабильны после обработки CHX. Клетки U2OS инфицировали мутантным вирусом Δ E3L при MOI 1 (A, C) или ложно инфицировали (B).Некоторые образцы обрабатывали 0,1 мМ NA при 5 hpi и фиксировали при 7 hpi (A). Дополнительные образцы обрабатывали 0,1 мМ NA при 5 hpi в течение 1 часа, а затем обрабатывали 100 мкг / мл CHX в течение 1 часа и фиксировали при 7 hpi (B, C). После фиксации клетки окрашивали на G3BP (красный) и DAPI (синий) для окрашивания ДНК. Показаны прогнозы максимальной интенсивности.
Показаны прогнозы максимальной интенсивности.
Этот результат подсказал нам, что AVG могут быть очень стабильными структурами. Известно, что SG разрушаются обработкой CHX (22), который останавливает трансляцию, «замораживая» рибосомы на молекулах мРНК, предотвращая удлинение трансляции и отток рибосом.Это приводит к демонтажу ячеистых SG, поскольку SG являются динамическими структурами; без источника новых комплексов инициации трансляции SGs рассеиваются (3). Мок-инфицированные клетки, обработанные CHX, показали полное растворение индуцированных арсенитом SG (фиг. 5B). В клетках, инфицированных мутантным вирусом Δ E3L и обработанных CHX при 6 hpi в течение 1 ч, частота AVG не уменьшалась и оставалась ассоциированной с вирусными репликационными фабриками в клетках, инфицированных Δ E3L мутантным VV (фиг. 5C).Сохранение AVG после обработки, которая растворяет SG, указывает на то, что AVG составляют отдельную клеточную структуру, которая более стабильна, чем канонический SG.
Для образования гранул необходимо действие пути PKR / eIF2α. Инфекция VV мутанта E3L Δ приводит к активации PKR и фосфорилированию eIF2α (11, 27, 50-52). Поскольку AVG появлялись только в условиях, когда фосфорилирование eIF2α увеличивалось, мы предположили, что активация пути PKR / eIF2α служила спусковым механизмом для образования AVG.Если эта гипотеза верна, дефекты в пути передачи сигналов PKR должны предотвращать как фосфорилирование eIF2α, так и образование AVG, что приводит к более высоким титрам вируса. Поэтому мы спросили, спасается ли репликация мутантного вируса Δ E3L в MEF, лишенных гена PKR ( PKR KO), или в MEF, экспрессирующих мутантный белок eIF2α, где сайт регуляторного фосфорилирования серина 51 был мутирован в нефосфорилируемый аланин. (eIF2α S51A , клетки AA) и было ли это спасение коррелировано с изменением образования AVG.
MEF WT или PKR KO MEF были инфицированы мутантным VV WT или Δ E3L при MOI 0,01 в трех повторностях, а репликация вируса измерялась через 2, 24, 48 и 72 hpi. WT VV одинаково хорошо реплицировался в обеих линиях MEF (рис. 6 A, часть i). Δ E3L мутантный VV плохо реплицируется в WT MEF. В MEF PKR KO репликация мутантного вируса Δ E3L увеличивалась в 6,6 раза по сравнению с ростом MEF дикого типа при 72 hpi. Этот уровень спасения согласуется с уровнем, ранее показанным для клеток, лишенных активности PKR (50).В клетках PKR KO наблюдалось пониженное накопление фосфорилированного eIF2α (фиг. 6A, часть ii), но некоторое фосфорилирование все еще наблюдалось.
WT VV одинаково хорошо реплицировался в обеих линиях MEF (рис. 6 A, часть i). Δ E3L мутантный VV плохо реплицируется в WT MEF. В MEF PKR KO репликация мутантного вируса Δ E3L увеличивалась в 6,6 раза по сравнению с ростом MEF дикого типа при 72 hpi. Этот уровень спасения согласуется с уровнем, ранее показанным для клеток, лишенных активности PKR (50).В клетках PKR KO наблюдалось пониженное накопление фосфорилированного eIF2α (фиг. 6A, часть ii), но некоторое фосфорилирование все еще наблюдалось.
Репликация мутантных VV WT и Δ E3L в (A) PKR KO и (B) eIF2α S51A MEF и согласованных контролях WT (A и B, части i). Клетки инфицировали мутантными вирусами WT или Δ E3L при MOI 0,01 в трех повторностях. Образцы собирали через 2, 24, 48 и 72 hpi, и титры вирусов измеряли с помощью анализа бляшек на клетках BHK (Δ E3L мутантный вирус) или Vero (WR).Планки погрешностей показывают 1 стандартное отклонение. (A и B, части ii) Клетки инфицировали мутантом Δ E3L или вирусом WR при MOI 5 или ложно инфицировали. При 6 hpi клетки собирали для SDS-PAGE и вестерн-блоттинга. Блоты зондировали антителами к фосфорилированному eIF2α. Перекрестно-реактивный полипептид связывается антителом в инфицированных образцах, но его легко отличить от eIF2α (*). Значения слева — это размеры молекул в килодальтонах. (A и B, части iii) Клетки инфицировали мутантным вирусом Δ E3L при MOI 5 и фиксировали при 6 hpi для окрашивания антителами к G3BP и DAPI для окрашивания ДНК.(A и B, части iv) Клетки инфицировали и окрашивали, как описано выше. Было подсчитано количество фабрик, содержащих гранулы, и выражено в процентах от общего количества фабрик. Планки погрешностей показывают 1 стандартное отклонение.
(A и B, части ii) Клетки инфицировали мутантом Δ E3L или вирусом WR при MOI 5 или ложно инфицировали. При 6 hpi клетки собирали для SDS-PAGE и вестерн-блоттинга. Блоты зондировали антителами к фосфорилированному eIF2α. Перекрестно-реактивный полипептид связывается антителом в инфицированных образцах, но его легко отличить от eIF2α (*). Значения слева — это размеры молекул в килодальтонах. (A и B, части iii) Клетки инфицировали мутантным вирусом Δ E3L при MOI 5 и фиксировали при 6 hpi для окрашивания антителами к G3BP и DAPI для окрашивания ДНК.(A и B, части iv) Клетки инфицировали и окрашивали, как описано выше. Было подсчитано количество фабрик, содержащих гранулы, и выражено в процентах от общего количества фабрик. Планки погрешностей показывают 1 стандартное отклонение.
Мы окрашивали G3BP в MEF PKR WT и KO и рассчитывали частоту образования AVG. Для сравнения были включены данные параллельных экспериментов с использованием клеток U2OS (фиг. 6A и B, часть iv). В MEF PKR WT инфекция мутантного вируса Δ E3L вызвала устойчивое образование AVG, как было определено с использованием G3BP в качестве маркера, при этом AVG представлены примерно в 97% VF (рис.6A, части iii [внизу] и iv). Однако в PKR KO MEF образование AVG было снижено по частоте на ~ 40% и качественно выглядело меньше и менее отчетливо (рис. 6A, части iii и iv).
В MEF PKR WT инфекция мутантного вируса Δ E3L вызвала устойчивое образование AVG, как было определено с использованием G3BP в качестве маркера, при этом AVG представлены примерно в 97% VF (рис.6A, части iii [внизу] и iv). Однако в PKR KO MEF образование AVG было снижено по частоте на ~ 40% и качественно выглядело меньше и менее отчетливо (рис. 6A, части iii и iv).
Затем мы спросили, требуется ли фосфорилирование eIF2α для образования AVG. MEF WT (SS) и eIF2α S51A (AA) инфицировали мутантным вирусом WT или Δ E3L . При 72 hpi продукция мутантных вирионов Δ E3L увеличивалась более чем в 180 раз в клетках AA по сравнению с аналогичными MEF дикого типа (рис.6Б, часть i). Присутствие нефосфорилируемого eIF2α не влияло на репликацию WT VV. Как и ожидалось, вестерн-блоттинг показал, что инфицирование мутантным вирусом Δ E3L стимулировало фосфорилирование eIF2α в MEF дикого типа, но не в клетках с нокаутом AA (фиг. 6B, часть ii). В MEF, содержащих WT eIF2α, образование гранул было нормальным, но в MEF, лишенных фосфорилируемой формы eIF2α, образование AVG было полностью отменено. Таким образом, фосфорилирование eIF2α имеет решающее значение для снижения репликации VV, лишенного гена E3L , и для образования AVG.Интересно, что клетки PKR KO не спасают вирус так же, как клетки AA, что позволяет предположить, что PKR — не единственная киназа eIF2α, активируемая во время инфекции VV.
В MEF, содержащих WT eIF2α, образование гранул было нормальным, но в MEF, лишенных фосфорилируемой формы eIF2α, образование AVG было полностью отменено. Таким образом, фосфорилирование eIF2α имеет решающее значение для снижения репликации VV, лишенного гена E3L , и для образования AVG.Интересно, что клетки PKR KO не спасают вирус так же, как клетки AA, что позволяет предположить, что PKR — не единственная киназа eIF2α, активируемая во время инфекции VV.
Репликация мутантного вируса Δ E3L повышена в MEF, в которых отсутствует ген TIA — 1 , несмотря на повышенные уровни фосфорилирования eIF2α и образование AVG. Основываясь на обнаруженной нами корреляции между уровнями фосфорилирования eIF2α и частотой AVG, мы Затем проверили, ингибируют ли AVG активно репликацию вируса после фосфорилирования eIF2α.Поэтому мы спросили, может ли TIA-1 (компонент AVG) быть важным для противовирусной активности AVG во время репликации мутантного вируса Δ E3L . Сначала мы определили, проявляют ли MEF, лишенные TIA-1, измененное фосфорилирование eIF2α после инфицирования мутантным VV Δ E3L (фиг. 7 A). Вестерн-блоттинг показал, что инфекция мутантного вируса Δ E3L вызвала сопоставимое увеличение eIF2αP в обоих TIA-1 — / — и + / + MEF по сравнению с уровнем в вирусе WT (рис. 7A, Δ мутант E3L вирус на дорожках 2 и 4 и WT на дорожках 3 и 5).
Сначала мы определили, проявляют ли MEF, лишенные TIA-1, измененное фосфорилирование eIF2α после инфицирования мутантным VV Δ E3L (фиг. 7 A). Вестерн-блоттинг показал, что инфекция мутантного вируса Δ E3L вызвала сопоставимое увеличение eIF2αP в обоих TIA-1 — / — и + / + MEF по сравнению с уровнем в вирусе WT (рис. 7A, Δ мутант E3L вирус на дорожках 2 и 4 и WT на дорожках 3 и 5).
Репликация WT и Δ E3L мутантных VV в клетках TIA-1 KO и MEF WT. (A) Клетки инфицировали мутантом Δ E3L или WT VV при MOI 5 и собирали при 6 hpi для SDS-PAGE и вестерн-блоттинга. Блоты зондировали антителами к фосфорилированному eIF2α. Перекрестно-реактивный полипептид был связан с антителом в инфицированных образцах (*). Значения слева — это размеры молекул в килодальтонах. (B) Клетки инфицировали мутантным вирусом Δ E3L при MOI 5 и фиксировали при 6 hpi для окрашивания антителами к G3BP и DAPI.Стрелки указывают на фабрики вирусов. (C) Фабрики, содержащие гранулы, были подсчитаны и выражены в процентах от общего количества фабрик. (D) Клетки инфицировали мутантным вирусом Δ E3L , экспрессирующим Венеру под контролем последнего промотора F17R при MOI 5. При 7 hpi образцы собирали для SDS-PAGE и вестерн-блоттинга и зондировали антителами к GFP (для обнаружения Венеры, верхние панели) и бета-актин в качестве контроля загрузки (нижние панели). (E) Клетки инфицировали мутантным вирусом Δ E3L при MOI 0.01 в трех экземплярах. Образцы собирали через 2, 24, 48 и 72 hpi, и титры вирусов измеряли с помощью анализа бляшек на клетках BHK (Δ E3L мутантный вирус) или Vero (вирус WR). Планки погрешностей показывают 1 стандартное отклонение. (F) Клетки инфицировали мутантным вирусом Δ E3L при MOI 5 в трех повторностях. Образцы собирали через 2 и 24 часа на дюйм, и титры вирусов измеряли с помощью анализа бляшек на клетках BHK. Планки погрешностей показывают 1 стандартное отклонение.
(C) Фабрики, содержащие гранулы, были подсчитаны и выражены в процентах от общего количества фабрик. (D) Клетки инфицировали мутантным вирусом Δ E3L , экспрессирующим Венеру под контролем последнего промотора F17R при MOI 5. При 7 hpi образцы собирали для SDS-PAGE и вестерн-блоттинга и зондировали антителами к GFP (для обнаружения Венеры, верхние панели) и бета-актин в качестве контроля загрузки (нижние панели). (E) Клетки инфицировали мутантным вирусом Δ E3L при MOI 0.01 в трех экземплярах. Образцы собирали через 2, 24, 48 и 72 hpi, и титры вирусов измеряли с помощью анализа бляшек на клетках BHK (Δ E3L мутантный вирус) или Vero (вирус WR). Планки погрешностей показывают 1 стандартное отклонение. (F) Клетки инфицировали мутантным вирусом Δ E3L при MOI 5 в трех повторностях. Образцы собирали через 2 и 24 часа на дюйм, и титры вирусов измеряли с помощью анализа бляшек на клетках BHK. Планки погрешностей показывают 1 стандартное отклонение.
Затем мы количественно оценили образование AVG в TIA-1 — / — и TIA-1 + / + MEF, инфицированных мутантом Δ E3L или вирусом WT, с использованием G3BP для обнаружения AVG и DAPI для окрашивания вирусных репликационных фабрик.Не было обнаружено качественных или количественных различий в AVG между TIA-1 — / — и TIA-1 + / + MEF (рис. 7B), что согласуется с высокими уровнями фосфорилирования eIF2α, наблюдаемыми в обоих типах клеток, что приводит к AVG. формирование. Однако следует отметить, что морфология мутантного VF Δ E3L в клетках TIA-1 — / — была более похожа на фабрики, сформированные в инфицированных вирусом WT клетках, что позволяет предположить, что рост вируса восстанавливается.
Мы исследовали возможность того, что MEF TIA-1 KO были более пермиссивными для репликации мутантного вируса Δ E3L .Первоначально мы использовали мутантный вирус Δ E3L , который экспрессировал флуоресцентный белок Венеры поздно во время инфекции VV (с использованием промотора F17R ). В MEF дикого типа Вестерн-блоттинг для выявления экспрессии Венеры показал, что накопилось очень мало белка (фиг. 7D, дорожка 2), но в TIA-1 — / — MEF экспрессия была значительно увеличена (дорожка 4), что соответствует удалению этого белка. приводя к восстановлению репликации ДНК и поздней экспрессии генов. На кривой многоциклового роста (рис.7E), титр мутантного вируса Δ E3L был увеличен в 25 раз в TIA-1 — / — MEF по сравнению с титром в TIA-1 WT MEF при 72 hpi. На 24 и 48 hpi титры мутантного вируса Δ E3L увеличивались в 7 и 4 раза соответственно по сравнению с титрами, наблюдаемыми во время репликации в TIA-1 + / + MEF. Чтобы подтвердить этот фенотип, мы также провели эксперименты с одноцикловой кривой роста с этими клетками, чтобы определить, наблюдалось ли улучшение роста вируса в течение более короткого периода инфицирования (рис.7F). Эти анализы показали аналогичное увеличение репликации Δ E3L мутанта VV. Это подтвердило, что в отсутствие TIA-1 мутантный вирус Δ E3L уклоняется от нормального блока репликации вируса, связанного с фосфорилированием активации PKR и фосфорилирования eIF2α.
В MEF дикого типа Вестерн-блоттинг для выявления экспрессии Венеры показал, что накопилось очень мало белка (фиг. 7D, дорожка 2), но в TIA-1 — / — MEF экспрессия была значительно увеличена (дорожка 4), что соответствует удалению этого белка. приводя к восстановлению репликации ДНК и поздней экспрессии генов. На кривой многоциклового роста (рис.7E), титр мутантного вируса Δ E3L был увеличен в 25 раз в TIA-1 — / — MEF по сравнению с титром в TIA-1 WT MEF при 72 hpi. На 24 и 48 hpi титры мутантного вируса Δ E3L увеличивались в 7 и 4 раза соответственно по сравнению с титрами, наблюдаемыми во время репликации в TIA-1 + / + MEF. Чтобы подтвердить этот фенотип, мы также провели эксперименты с одноцикловой кривой роста с этими клетками, чтобы определить, наблюдалось ли улучшение роста вируса в течение более короткого периода инфицирования (рис.7F). Эти анализы показали аналогичное увеличение репликации Δ E3L мутанта VV. Это подтвердило, что в отсутствие TIA-1 мутантный вирус Δ E3L уклоняется от нормального блока репликации вируса, связанного с фосфорилированием активации PKR и фосфорилирования eIF2α.
ОБСУЖДЕНИЕ
Здесь мы показываем, что клетки реагируют на непродуктивную инфекцию VV путем сборки цитоплазматических гранул, которые окружают фабрики репликации вируса. Эти гранулы требуют фосфорилирования eIF2α и, по-видимому, важны для подавления репликации вируса.Эти AVG схожи с SG по содержанию белка, но устойчивы к разборке под действием CHX, в отличие от SG (1, 23). Поэтому AVG выглядят более статичными и менее динамичными, чем SG. Это говорит о том, что AVG не несут ответственности за удержание мРНК в «приостановленном» состоянии для последующего высвобождения (как SG), но их функция заключается исключительно в блокировании репликации VV.
AVG, по-видимому, отличаются от других скоплений белков-хозяев, которые образуются на фабриках репликации VV или на них. Было высказано предположение, что локальная трансляция вирусной мРНК происходит внутри VF, что было элегантно продемонстрировано на клетках, инфицированных вирусами, экспрессирующими голубой флуоресцентный белок (CFP) или вирусные белки, меченные YFP (19). Сходные отчеты описывают локализованное рекрутирование аппарата инициации трансляции хозяина (eIF4E, eIF4G, но не PABP) в специфические субрегионы внутри VFs (19, 47). Это рекрутирование факторов трансляции клетки-хозяина в VF было приписано успешному захвату вирусами трансляционного аппарата хозяина. AVG, которые мы определяем в этих исследованиях, демонстрируют явные отличия от внутренних структур VF, описанных ранее. (i) AVG формируются в основном вне VF (хотя были некоторые случаи, когда эти гранулы формировались внутри VF).(ii) AVG содержат TIA-1, который был исключен из внутренних очагов VF (47). (iii) AVG появляются раньше, чем описанные ранее очаги. (iv) Сборка AVG абсолютно требует фосфорилирования eIF2α, которое в значительной степени подавлено в WT VV-инфицированных клетках. (v) Наиболее важно то, что AVG, по-видимому, обладают противовирусной природой, в то время как внутренние гранулы, как предполагается, выполняют провирусную функцию. AVG более многочисленны во время инфицирования мутантным вирусом Δ E3L , чем во время инфицирования WT (AVG окружают фабрики в 73–100% клеток, инфицированных мутантным VV Δ E3L , тогда как только 3–12% инфицированных WT клеток обнаруживают аналогичные конструкции).
Сходные отчеты описывают локализованное рекрутирование аппарата инициации трансляции хозяина (eIF4E, eIF4G, но не PABP) в специфические субрегионы внутри VFs (19, 47). Это рекрутирование факторов трансляции клетки-хозяина в VF было приписано успешному захвату вирусами трансляционного аппарата хозяина. AVG, которые мы определяем в этих исследованиях, демонстрируют явные отличия от внутренних структур VF, описанных ранее. (i) AVG формируются в основном вне VF (хотя были некоторые случаи, когда эти гранулы формировались внутри VF).(ii) AVG содержат TIA-1, который был исключен из внутренних очагов VF (47). (iii) AVG появляются раньше, чем описанные ранее очаги. (iv) Сборка AVG абсолютно требует фосфорилирования eIF2α, которое в значительной степени подавлено в WT VV-инфицированных клетках. (v) Наиболее важно то, что AVG, по-видимому, обладают противовирусной природой, в то время как внутренние гранулы, как предполагается, выполняют провирусную функцию. AVG более многочисленны во время инфицирования мутантным вирусом Δ E3L , чем во время инфицирования WT (AVG окружают фабрики в 73–100% клеток, инфицированных мутантным VV Δ E3L , тогда как только 3–12% инфицированных WT клеток обнаруживают аналогичные конструкции). Если бы активная транскрипция или трансляция были связаны с AVG, мы могли бы ожидать увидеть больше AVG во время успешного инфицирования WT VV, чем во время ограниченного репликацией инфекции мутантного вируса Δ E3L . Более того, потребность в повышенном фосфорилировании eIF2α для образования AVG сильно свидетельствует против того, чтобы они были нормальной частью цикла репликации VV.
Если бы активная транскрипция или трансляция были связаны с AVG, мы могли бы ожидать увидеть больше AVG во время успешного инфицирования WT VV, чем во время ограниченного репликацией инфекции мутантного вируса Δ E3L . Более того, потребность в повышенном фосфорилировании eIF2α для образования AVG сильно свидетельствует против того, чтобы они были нормальной частью цикла репликации VV.
Требования к образованию AVG. Требование фосфорилирования eIF2α для запуска образования AVGs предлагает модель для их сборки.Мы предполагаем, что блокада E3L восприятия дцРНК при инфекции WT VV делает возможным образование больших VF, которые не ограничиваются AVG в большинстве клеток (рис. 8, верхняя панель). При инфекциях с VV, лишенным белка E3L (нижняя панель), дцРНК доступна для активации PKR, что увеличивает фосфорилирование eIF2α и приводит к образованию AVG. Предсказание этой модели состоит в том, что другие мутанты VV, которые индуцируют фосфорилирование eIF2α, также должны индуцировать образование AVG (6, 29). Неясно, действительно ли eIF2α является компонентом AVG, поскольку окрашивание IF не показало окончательно накопление этого белка вокруг мутантных VF Δ E3L , возможно, из-за перекрестной реактивности антител с неизвестным вирусным белком.Скорее, мы предполагаем, что фосфорилирование eIF2α может остановить вирусную трансляцию в достаточной степени, чтобы позволить белкам, обнаруживаемым в AVG (РНК-связывающие белки, такие как TIA-1, G3BP, FMRP и FXR1), образовывать зародышевую структуру на вирусной РНК, что приводит к AVG. формирование. Хотя эта гипотеза является спекулятивной, она согласуется с известными свойствами подавления трансляции TIA-1, FXR1 и FMRP, подобных клеткам сборок AVGS, которые формируются вокруг VF, и их корреляции с ингибированием репликации VV.
Неясно, действительно ли eIF2α является компонентом AVG, поскольку окрашивание IF не показало окончательно накопление этого белка вокруг мутантных VF Δ E3L , возможно, из-за перекрестной реактивности антител с неизвестным вирусным белком.Скорее, мы предполагаем, что фосфорилирование eIF2α может остановить вирусную трансляцию в достаточной степени, чтобы позволить белкам, обнаруживаемым в AVG (РНК-связывающие белки, такие как TIA-1, G3BP, FMRP и FXR1), образовывать зародышевую структуру на вирусной РНК, что приводит к AVG. формирование. Хотя эта гипотеза является спекулятивной, она согласуется с известными свойствами подавления трансляции TIA-1, FXR1 и FMRP, подобных клеткам сборок AVGS, которые формируются вокруг VF, и их корреляции с ингибированием репликации VV.
Модель роли AVG в противовирусном ответе на VV. Инфекция вирусом WT (вверху) продуцирует дцРНК, которая связывается с E3L, предотвращая активацию PKR и приводя к продуктивной инфекции, поскольку фосфорилирование eIF2α и образование AVG подавляются E3L. Заражение мутантным вирусом Δ E3L (внизу) приводит к активации PKR, что приводит к фосфорилированию eIF2α и отсроченной инициации трансляции. Связанные с фабрикой вирусные мРНК связываются трансляционным сайленсером TIA-1, который ограничивает репликацию вируса.Формируются многочисленные AVG, содержащие мРНК, G3BP, TIA-1 и связанные с ними белки.
Заражение мутантным вирусом Δ E3L (внизу) приводит к активации PKR, что приводит к фосфорилированию eIF2α и отсроченной инициации трансляции. Связанные с фабрикой вирусные мРНК связываются трансляционным сайленсером TIA-1, который ограничивает репликацию вируса.Формируются многочисленные AVG, содержащие мРНК, G3BP, TIA-1 и связанные с ними белки.
Есть два возможных механизма работы AVG. Одна из возможностей заключается в том, что AVG секвестрируют факторы хозяина, необходимые для репликации, вдали от центра репликации вируса. Наше открытие, что G3BP и каприн-1 сконцентрированы в AVG, представляет особый интерес в этом контексте, поскольку G3BP и каприн-1 были предложены для облегчения транскрипции промежуточных генов VV и необходимы для промежуточной вирусной транскрипции in vitro (20 ).G3BP и каприн-1 были обнаружены внутри VF WT на промежуточной стадии инфекции VV (19). Этот набор был расценен как часть успешного заражения. Хотя мы практически не наблюдали накопления G3BP или каприна-1 в большинстве VF во время инфицирования вирусом WT, количественное накопление G3BP и каприна-1 в AVG, окружающих фабрики, образованных во время инфицирования мутантным VV Δ E3L , согласуется с интерпретацией что эти белки секвестрируются в AVG во время инфицирования мутантным вирусом Δ E3L , чтобы блокировать развитие репликации вируса на стадии промежуточной транскрипции.
Мы считаем важным, что и каприн-1, и USP10 присутствуют в AVG и являются взаимодействующими партнерами G3BP. Каприн-1, как известно, образует ядра SG при сверхэкспрессии и может регулировать G3BP-опосредованный транспорт РНК, тогда как деубиквитинирующая активность USP10 регулируется ассоциацией с G3BP (43, 44) и регулирует мембранный транспорт между ER и аппаратом Гольджи. Тот факт, что оба эти белка связаны с AVG, предполагает, что одна из функций AVG состоит в том, чтобы служить центром набора для множества различных типов сигналов.Роль сигнального центра согласуется с очевидной стабильностью AVG, что может позволить нескольким различным типам сигналов интегрироваться в окрестности центра репликации VV. Учитывая важность передачи сигналов дцРНК в стимуляции апоптоза при инфекции VV (25), также возможно, что компоненты апоптоза также присутствуют в AVG.
Вторая потенциальная функция AVG — это привлечение белков с прямой противовирусной активностью, таких как TIA-1, в область VF. Предыдущая работа указала на противовирусную роль TIA-1 в репликации вируса HSV-1 и Sindbis (28), предполагая, что противовирусный механизм TIA-1 не ограничивается поксвирусами.Однако TIA-1 также играет провирусную роль в репликации флавивирусов (28), поэтому его противовирусный эффект не универсален для всех вирусов. В нестрессированных клетках TIA-1 является преимущественно ядерным и опосредует альтернативный сплайсинг. Однако при инфицировании мутантным VV Δ E3L TIA-1 накапливается в цитоплазме и концентрируется поблизости от центра репликации. Потеря TIA-1 приводит к усилению репликации мутантного вируса Δ E3L (фиг. 7), демонстрируя его функциональную роль в ограничении инфекции.Это предполагает, что TIA-1 может напрямую ингибировать экспрессию вирусного гена, связывая вирусную мРНК и подавляя ее трансляцию. С другой стороны, рекрутирование TIA-1 в AVG и последующее истощение из ядра может изменить сплайсинг генов-мишеней TIA-1 и тем самым обеспечить более устойчивый противовирусный ответ.
Предыдущая работа указала на противовирусную роль TIA-1 в репликации вируса HSV-1 и Sindbis (28), предполагая, что противовирусный механизм TIA-1 не ограничивается поксвирусами.Однако TIA-1 также играет провирусную роль в репликации флавивирусов (28), поэтому его противовирусный эффект не универсален для всех вирусов. В нестрессированных клетках TIA-1 является преимущественно ядерным и опосредует альтернативный сплайсинг. Однако при инфицировании мутантным VV Δ E3L TIA-1 накапливается в цитоплазме и концентрируется поблизости от центра репликации. Потеря TIA-1 приводит к усилению репликации мутантного вируса Δ E3L (фиг. 7), демонстрируя его функциональную роль в ограничении инфекции.Это предполагает, что TIA-1 может напрямую ингибировать экспрессию вирусного гена, связывая вирусную мРНК и подавляя ее трансляцию. С другой стороны, рекрутирование TIA-1 в AVG и последующее истощение из ядра может изменить сплайсинг генов-мишеней TIA-1 и тем самым обеспечить более устойчивый противовирусный ответ. Необходима дальнейшая работа, чтобы различать эти возможности. Следует отметить, что MEF, лишенные TIAR, близкого родственника TIA-1, не спасают репликацию мутантного VV Δ E3L (данные не показаны).Поскольку TIA-1 и TIAR имеют разные мишени для мРНК, это может указывать на то, что TIA-1 специфически распознает вирусную мРНК, а TIAR — нет.
Необходима дальнейшая работа, чтобы различать эти возможности. Следует отметить, что MEF, лишенные TIAR, близкого родственника TIA-1, не спасают репликацию мутантного VV Δ E3L (данные не показаны).Поскольку TIA-1 и TIAR имеют разные мишени для мРНК, это может указывать на то, что TIA-1 специфически распознает вирусную мРНК, а TIAR — нет.
Наши данные, представленные на рис. 6, подтверждают предыдущие исследования, показывающие, что dsRNA-активированная киназа PKR важна для ограничения репликации мутантного вируса Δ E3L (8, 11, 12, 50, 51). Наши исследования также предполагают, что множественные киназы eIF2α могут вносить вклад в фосфорилирование eIF2α в клетках, инфицированных мутантным вирусом Δ E3L , который незначительно увеличивает фосфорилирование eIF2α даже при отсутствии PKR.В соответствии с идеей, что фосфорилирование eIF2α является критическим этапом в ограничении репликации мутантного вируса Δ E3L , инфицирование клеток eIF2α S51Α, неспособных фосфорилировать eIF2α (но способных активировать PKR) мутантным вирусом Δ E3L , приводило к большему спасение репликации мутантного вируса Δ E3L и более полный блок образования AVG. Неожиданно наши эксперименты показали, что фосфорилирование eIF2α не единственное событие, необходимое для репликации VV.Клетки TIA-1, инфицированные мутантным вирусом Δ E3L , поддерживали репликацию вируса, несмотря на увеличение фосфорилирования eIF2α. Репликация вирусов, продуцирующих кэпированные и поли (A) мРНК в присутствии фосфорилирования eIF2α, была отмечена ранее (7).
Неожиданно наши эксперименты показали, что фосфорилирование eIF2α не единственное событие, необходимое для репликации VV.Клетки TIA-1, инфицированные мутантным вирусом Δ E3L , поддерживали репликацию вируса, несмотря на увеличение фосфорилирования eIF2α. Репликация вирусов, продуцирующих кэпированные и поли (A) мРНК в присутствии фосфорилирования eIF2α, была отмечена ранее (7).
Эта диссоциация фосфорилирования eIF2α от репликации VV убедительно доказывает, что фосфорилирование eIF2α per se не ограничивает репликацию VV, но также необходима индукция AVG посредством этого фосфорилирования.Открытие того, что клетки, лишенные TIA-1, все еще образуют цитоплазматические гранулы, но что гранулы с дефицитом TIA-1 не блокируют репликацию вируса, согласуется с исследованиями вирусного разрушения SG. Например, полиовирус специфически расщепляет G3BP и индуцирует образование TIA-1-содержащих SG, которые не ингибируют репликацию вируса. Это говорит о том, что уклонение вируса от противовирусного действия цитоплазматических гранул может принимать форму блокирования их образования или удаления критических компонентов (9, 28, 32, 35).
Выяснение молекулярного механизма, с помощью которого TIA-1 ингибирует репликацию мутантного вируса Δ E3L , и полное исследование состава и функций этих новых цитоплазматических гранул являются целями будущих исследований. Настоящее исследование показывает, что TIA-1 играет ранее не охарактеризованную роль в ограничении репликации поксвируса. Предыдущая работа описывает роль TIA-1 и родственного белка TIAR в клеточном гомеостазе, росте и метаболизме клеточной РНК, влияя на сплайсинг, трансляцию и распад мРНК (38, 53).Предыдущие результаты предполагают, что TIA-1 подавляет репликацию вирусов HSV-1 и Sindbis, и были продемонстрированы взаимодействия между TIA-1 и вирусными РНК-транскриптами при инфицировании вирусом гепатита B и WNV (14, 45). Остается важный вопрос: ограничивает ли TIA-1 репликацию мутантного вируса Δ E3L посредством его взаимодействия с молекулами вирусной РНК во время инфекции и образуются ли аналогичные гранулы во время заражения этими другими вирусами.
БЛАГОДАРНОСТИ
Мы благодарим Сару Джонстон (USAMRIID) за помощь в проведении экспериментов, Рэйчел Фирнс и сотрудников лаборатории Коннора за полезную критику рукописи, а также Саманту Стюарт, Сару Тисдейл и Джуди Йен за отличную техническую поддержку.
Работа поддержана грантами NIH R01 (AI 033600) и R01 (AR 051472), присужденными П.А. J.H.C. при частичной поддержке профессора Питера Пола по развитию карьеры.
Спонсоры не играли никакой роли в дизайне исследования, сборе и анализе данных, решении опубликовать или подготовке рукописи.
- Авторские права © 2011, Американское общество микробиологии
Гранулы подавления трансляции и стресса в противовирусном иммунном ответе
Anderson, P.& Кедерша, Н. Гранулы РНК: посттранскрипционные и эпигенетические модуляторы экспрессии генов. Нат. Преподобный Мол. Cell Biol. 10 , 430–436 (2009).
CAS PubMed Google ученый
Андерсон П. и Кедерша Н. Стресс-гранулы: Дао сортировки РНК. Trends Biochem. Sci. 33 , 141–150 (2008).
CAS PubMed Google ученый
Кедерша, Н., Иванов, П. и Андерсон, П. Стрессовые гранулы и клеточная сигнализация: больше, чем просто проходящая фаза? Trends Biochem. Sci. 38 , 494–506 (2013).
CAS PubMed Google ученый
Макинерни, Г. М., Кедерша, Н. Л., Кауфман, Р. Дж., Андерсон, П. и Лильестрем, П. Важность фосфорилирования eIF2α и сборки стрессовых гранул в регуляции трансляции альфавирусов. Мол. Биол. Ячейка 16 , 3753–3763 (2005).
Мол. Биол. Ячейка 16 , 3753–3763 (2005).
CAS PubMed PubMed Central Google ученый
Onomoto, K. et al. Критическая роль антивирусной стрессовой гранулы, содержащей RIG-I и PKR, в обнаружении вирусов и врожденном иммунитете. PLoS ONE 7 , e43031 (2012).
CAS PubMed PubMed Central Google ученый
Джексон, Р. Дж., Хеллен, К. У. Т., Пестова Т.V. Механизм инициации эукариотической трансляции и принципы ее регуляции. Нат. Преподобный Мол. Cell Biol. 11 , 113–127 (2010).
CAS PubMed PubMed Central Google ученый
Проттер, Д. С. У. и Паркер, Р. Принципы и свойства стрессовых гранул. Trends Cell Biol. 26 , 668–679 (2016).
CAS PubMed PubMed Central Google ученый
Белый, Дж.П. и Ллойд, Р. Э. Регулирование стрессовых гранул в вирусных системах. Trends Microbiol. 20 , 175–183 (2012).
CAS PubMed PubMed Central Google ученый
Поблете-Дюран, Н., Прадес-Перес, Ю., Вера-Отарола, Дж., Сото-Рифо, Р. и Валиенте-Эчеверрия, Ф. Кто кого регулирует? Обзор гранул РНК и вирусных инфекций. Вирусов 8 , E180 (2016).
PubMed Google ученый
Зонку Р., Эфеян А. и Сабатини Д. М. mTOR: от интеграции сигналов роста к раку, диабету и старению. Нат. Преподобный Мол. Cell Biol. 12 , 21–35 (2011).
CAS PubMed Google ученый
фон дер Хаар, Т., Гросс, Дж. Д., Вагнер, Г. и Маккарти, Дж. Э. Г. Белок, связывающий кэп мРНК eIF4E, в посттранскрипционной экспрессии генов. Нат. Struct. Мол. Биол. 11 , 503–511 (2004).
CAS PubMed Google ученый
McEwen, E. et al. Регулируемое гемом ингибитор-киназа фосфорилирование эукариотического фактора инициации трансляции 2 ингибирует трансляцию, индуцирует образование стрессовых гранул и опосредует выживание при воздействии арсенита. J. Biol. Chem. 280 , 16925–16933 (2005).
J. Biol. Chem. 280 , 16925–16933 (2005).
CAS PubMed Google ученый
Лю, Л., Han, A. и Chen, J. Контроль инициации трансляции с помощью гем-регулируемой киназы эукариотического фактора инициации 2α в эритроидных клетках при цитоплазматических стрессах. Мол. Клетка. Биол. 21 , 7971–7980 (2001).
CAS PubMed PubMed Central Google ученый
Wek, S. A., Zhu, S. & Wek, R. C. Связанная с гистидил-тРНК синтетазой последовательность в протеинкиназе eIF-2α GCN2 взаимодействует с тРНК и требуется для активации в ответ на голодание по различным аминокислотам. Мол. Клетка. Биол. 15 , 4497–4506 (1995).
CAS PubMed PubMed Central Google ученый
Deng, J. et al. Активация GCN2 в УФ-облученных клетках подавляет трансляцию. Curr. Биол. 12 , 1279–1286 (2002).
CAS PubMed Google ученый
Гарсия, М. А., Мерс, Э. Ф. и Эстебан, М.Протеинкиназа дцРНК PKR: вирус и клеточный контроль. Biochimie 89 , 799–811 (2007).
PubMed Google ученый
Harding, H.P., Zhang, Y., Bertolotti, A., Zeng, H. & Ron, D. Perk необходим для регуляции трансляции и выживания клеток во время развернутого белкового ответа. Мол. Ячейка 5 , 897–904 (2000).
CAS PubMed Google ученый
Panniers, R.Трансляционный контроль при тепловом шоке. Biochimie 76 , 737–747 (1994).
CAS PubMed Google ученый
Thomas, M. G., Loschi, M., Desbats, M. A. & Boccaccio, G. L. Гранулы РНК: хорошие, плохие и уродливые. Ячейка. Сигнал. 23 , 324–334 (2011).
CAS PubMed Google ученый
Ваттем, К.M. & Wek, R.C. Реинициация с участием вышестоящих ORF регулирует трансляцию мРНК ATF4 в клетках млекопитающих. Proc. Natl Acad. Sci. США 101 , 11269–11274 (2004).
CAS PubMed Google ученый
Novoa, I. et al. Экспрессия генов, индуцированная стрессом, требует запрограммированного восстановления после репрессии трансляции. EMBO J. 22 , 1180–1187 (2003).
CAS PubMed PubMed Central Google ученый
Низкая, W.-К. и другие. Ингибирование инициации эукариотической трансляции морским природным продуктом патеамином A. Mol. Ячейка 20 , 709–722 (2005).
CAS PubMed Google ученый
Mazroui, R. et al. Ингибирование рекрутирования рибосом вызывает образование стрессовых гранул независимо от фосфорилирования эукариотического фактора инициации α. Мол. Биол. Ячейка 17 , 4212–4219 (2006).
CAS PubMed PubMed Central Google ученый
Хагнер П.R. et al. Рибосомный белок S6 высоко экспрессируется в неходжкинской лимфоме и ассоциируется с мРНК, содержащей 5′-концевой олигопиримидиновый тракт. Онкоген 30 , 1531–1541 (2011).
CAS PubMed Google ученый
Fujimura, K., Sasaki, A. T. & Anderson, P. Селенит нацелен на eIF4E-связывающий белок-1, чтобы ингибировать инициацию трансляции и индуцировать сборку неканонических стрессовых гранул. Nucleic Acids Res. 40 , 8099–8110 (2012).
CAS PubMed PubMed Central Google ученый
Emara, M. M. et al. Перекись водорода вызывает образование стрессовых гранул независимо от фосфорилирования eIF2α. Biochem. Биофиз. Res. Commun. 423 , 763–769 (2012).
Биофиз. Res. Commun. 423 , 763–769 (2012).
CAS PubMed PubMed Central Google ученый
Он, Т., Кедерша, Н., Хикман, Т., Тисдейл, С. и Андерсон, П. Функциональный скрининг РНКи связывает модификацию O -GlcNAc рибосомных белков с нагрузкой на гранулы и процессинг сборки тела. Нат. Cell Biol. 10 , 1224–1231 (2008).
CAS PubMed PubMed Central Google ученый
Кедерша Н. и др. Динамическое перемещение TIA-1 сопровождает рекрутирование мРНК на стрессовые гранулы млекопитающих. J. Cell Biol. 151 , 1257–1268 (2000).
CAS PubMed PubMed Central Google ученый
Иванов П.А., Чудинова Е.М., Надеждина Е.С. Нарушение микротрубочек ингибирует образование стрессовых гранул цитоплазматических рибонуклеопротеидов. Exp. Cell Res. 290 , 227–233 (2003).
CAS PubMed Google ученый
Лоски, М., Leishman, C.C., Berardone, N. & Boccaccio, G.L. Динеин и кинезин регулируют динамику стрессовых гранул и П-тел. J. Cell Sci. 122 , 3973–3982 (2009).
CAS PubMed PubMed Central Google ученый
Андерсон П. и Кедерша Н. Заметно подчеркнута роль eIF2, TIA-1 и стрессовых гранул в трансляции белков. Шапероны клеточного стресса 7 , 213–221 (2002).
CAS PubMed PubMed Central Google ученый
Кедерша, Н.Л., Гупта, М., Ли, В., Миллер, И. и Андерсон, П. РНК-связывающие белки TIA-1 и TIAR связывают фосфорилирование eIF-2α со сборкой стресса у млекопитающих гранулы. J. Cell Biol. 147 , 1431–1441 (1999).
CAS PubMed PubMed Central Google ученый
Tourrière, H.и другие. Эндорибонуклеаза G3BP, ассоциированная с RasGAP, собирает стрессовые гранулы. J. Cell Biol. 160 , 823–831 (2003).
PubMed PubMed Central Google ученый
Кедерша, Н. и Андерсон, П. Гранулы стресса млекопитающих и обрабатывающие тела. Methods Enzymol. 431 , 61–81 (2007). В этой статье представлены превосходные протоколы для индукции и иммунофлуоресцентного обнаружения стрессовых гранул, а также информация о коммерчески доступных антителах для общих маркеров стрессовых гранул.
CAS PubMed Google ученый
Gilks, N. et al. Сборка стрессовых гранул опосредуется прионоподобной агрегацией TIA-1. Мол. Биол. Ячейка 15 , 5383–5398 (2004).
CAS PubMed PubMed Central Google ученый
Matsuki, H. et al. И G3BP1, и G3BP2 способствуют образованию стрессовых гранул. Гены Клеток 18 , 135–146 (2013).
CAS PubMed Google ученый
Кедерша Н. и др. Стресс-гранулы и обрабатывающие тела являются динамически связанными сайтами ремоделирования мРНП. J. Cell Biol. 169 , 871–884 (2005).
169 , 871–884 (2005).
CAS PubMed PubMed Central Google ученый
Уиллер Дж. Четкие этапы сборки и разборки напряженных гранул. eLife 5 , e18413 (2016).
PubMed PubMed Central Google ученый
Лин, Ю., Проттер, Д. С. У., Розен, М. К. и Паркер, Р. Формирование и созревание разделенных фазами жидких капель с помощью РНК-связывающих белков. Мол. Ячейка 60 , 208–219 (2015).
CAS PubMed PubMed Central Google ученый
Квон, С., Чжан, Ю. и Матиас, П.Деацетилаза HDAC6 является новым критическим компонентом стрессовых гранул, участвующих в стрессовой реакции. Genes Dev. 21 , 3381–3394 (2007).
Genes Dev. 21 , 3381–3394 (2007).
CAS PubMed PubMed Central Google ученый
Leung, A. K. L. et al. Поли (АДФ-рибоза) регулирует стрессовые реакции и активность микроРНК в цитоплазме. Мол. Ячейка 42 , 489–499 (2011).
CAS PubMed PubMed Central Google ученый
Цай, В.-C. и другие. Деметилирование аргинина G3BP1 способствует сборке стрессовых гранул. J. Biol. Chem. 291 , 22671–22685 (2016).
CAS PubMed PubMed Central Google ученый
Jayabalan, A. K. et al. NEDDylation способствует сборке стрессовых гранул. Нат. Commun. 7 , 12125 (2016).
K. et al. NEDDylation способствует сборке стрессовых гранул. Нат. Commun. 7 , 12125 (2016).
CAS PubMed PubMed Central Google ученый
Рохас, М., Arias, C.F. & López, S. Протеинкиназа R отвечает за фосфорилирование eIF2α при ротавирусной инфекции. J. Virol. 84 , 10457–10466 (2010).
CAS PubMed PubMed Central Google ученый
Willis, K. L., Langland, J. O. & Shisler, J. L. Двухцепочечные вирусные РНК из транскриптов ранних или промежуточных генов вируса коровьей оспы обладают функцией активации PKR, что приводит к активации NF-κB, когда белок K1 отсутствует или мутирован. J. Biol. Chem. 286 , 7765–7778 (2011).
CAS PubMed Google ученый
Heinicke, L.A. et al. Димеризация РНК способствует димеризации и активации PKR. J. Mol. Биол. 390 , 319–338 (2009).
CAS PubMed PubMed Central Google ученый
Наллагатла, С. Р. и др. 5′-трифосфат-зависимая активация PKR РНК с короткими стеблями-петлями. Наука 318 , 1455–1458 (2007).
CAS PubMed Google ученый
Наллагатла, С. Р., Торони, Р. и Бевилаква, П. С. Регулирование врожденного иммунитета через структуру РНК и протеинкиназу PKR. Curr. Мнение. Struct. Биол. 21 , 119–127 (2011).
CAS PubMed Google ученый
Даубер, Б.и другие. Рибонуклеопротеин вируса гриппа В является мощным активатором противовирусной киназы PKR. PLoS Pathog. 5 , e1000473 (2009).
PubMed PubMed Central Google ученый
Berlanga, J. J. et al. Противовирусный эффект киназы фактора инициации трансляции 2α млекопитающих GCN2 против РНК-вирусов. EMBO J. 25 , 1730–1740 (2006).
CAS PubMed PubMed Central Google ученый
Чан, С.-W. & Egan, P.A. Белки оболочки вируса гепатита C регулируют CHOP посредством индукции ответа развернутого белка. FASEB J. 19 , 1510–1512 (2005).
CAS PubMed Google ученый
Cheng, G., Feng, Z. & He, B. Инфекция, вызванная вирусом простого герпеса 1, активирует резидентную киназу PERK эндоплазматического ретикулума и опосредует дефосфорилирование eIF-2 с помощью белка 134,5. J. Virol. 79 , 1379–1388 (2005).
CAS PubMed PubMed Central Google ученый
Мор, И. и Соненберг, Н. Трансляция хоста на стыке инфекции и иммунитета. Клеточный микроб-хозяин 12 , 470–483 (2012).
CAS PubMed Google ученый
Ян, Э., Мор, И. и Уолш, Д. А. Руководство от шапки к хвосту по стратегиям трансляции мРНК в инфицированных вирусом клетках. Annu. Rev. Virol. 3 , 283–307 (2016).
CAS PubMed Google ученый
Khaperskyy, D. A., Hatchette, T. F. & McCormick, C. Вирус гриппа A ингибирует образование гранул цитоплазматического стресса. FASEB J. 26 , 1629–1639 (2012).
CAS PubMed Google ученый
Уайт, Дж. П., Карденас, А.М., Мариссен, У. Э. и Ллойд, Р. Е. Ингибирование образования стрессовых гранул цитоплазматической мРНК вирусной протеиназой. Клеточный микроб-хозяин 2 , 295–305 (2007). Это первое исследование, описывающее прямое вмешательство в образование стрессовых гранул за счет протеолитического расщепления G3BP1 и показывающее противовирусный эффект образования стрессовых гранул.
CAS PubMed Google ученый
Руджери, А. и другие. Динамические колебания трансляции и образование стрессовых гранул отмечают клеточный ответ на вирусную инфекцию. Клеточный микроб-хозяин 12 , 71–85 (2012). Это первое исследование, в котором описываются динамические колебания остановки и восстановления трансляции как особенности внутреннего иммунного ответа на вирусную инфекцию.
и другие. Динамические колебания трансляции и образование стрессовых гранул отмечают клеточный ответ на вирусную инфекцию. Клеточный микроб-хозяин 12 , 71–85 (2012). Это первое исследование, в котором описываются динамические колебания остановки и восстановления трансляции как особенности внутреннего иммунного ответа на вирусную инфекцию.
CAS PubMed Google ученый
Хаперский Д.А. и др. Выключение хозяина вируса гриппа А отключает вызванную антивирусным стрессом остановку трансляции. PLoS Pathog. 10 , e1004217 (2014).
PubMed PubMed Central Google ученый
Borghese, F. & Michiels, T. Лидерный белок кардиовирусов ингибирует сборку стрессовых гранул. J. Virol. 85 , 9614–9622 (2011).
J. Virol. 85 , 9614–9622 (2011).
CAS PubMed PubMed Central Google ученый
Финнен, Р. Л., Zhu, M., Li, J., Romo, D. & Banfield, B. W. Вирион вируса простого герпеса 2, блокирующий активность эндорибонуклеазы-хозяина, необходим для нарушения образования стрессовых гранул. J. Virol. 90 , 7943–7955 (2016).
CAS PubMed PubMed Central Google ученый
Рейкин, С., Нгуен, Дж. Б. и Модис, Ю. Распознавание образов и механизмы передачи сигналов RIG-I и MDA5. Перед. Иммунол. 5 , 342 (2014).
PubMed PubMed Central Google ученый
Zeng, W. et al. Восстановление пути RIG-I показывает сигнальную роль незакрепленных цепей полиубиквитина в врожденном иммунитете. Cell 141 , 315–330 (2010).
CAS PubMed PubMed Central Google ученый
Wu, B. & Hur, S. Как рецепторы типа RIG-I активируют MAVS. Curr. Мнение. Virol. 12 , 91–98 (2015).
CAS PubMed PubMed Central Google ученый
Васкес, К. и Хорнер, С. М. Координация MAVS противовирусного врожденного иммунитета. J. Virol. 89 , 6974–6977 (2015).
CAS PubMed PubMed Central Google ученый
Clavarino, G. et al. Индукция GADD34 необходима для дцРНК-зависимой продукции интерферона-β и участвует в контроле инфекции вирусом чикунгунья. PLoS Pathog. 8 , e1002708 (2012).
CAS PubMed PubMed Central Google ученый
Reineke, L.C. et al. Стресс-гранулы регулируют активацию двухцепочечной РНК-зависимой протеинкиназы через комплекс, содержащий G3BP1 и каприн1. мБио 6 , e02486 (2015).
PubMed PubMed Central Google ученый
Лангереис, М.A., Feng, Q. & van Kuppeveld, F. J. MDA5 локализуется в стрессовых гранулах, но эта локализация не требуется для индукции интерферона I типа. J. Virol. 87 , 6314–6325 (2013).
CAS PubMed PubMed Central Google ученый
Санчес-Апарисио, М. Т., Эйллон, Дж., Лео-Масиас, А., Вольф, Т. и Гарсия-Састре, А. Субклеточные локализации комплексов RIG-I, TRIM25 и MAVS. Дж.Virol. 91 , e01155–16 (2017).
PubMed PubMed Central Google ученый
Ким, В. Дж., Бэк, С. Х., Ким, В., Рю, И. и Джанг, С. К. Секвестрация TRAF2 в стрессовые гранулы прерывает передачу сигналов фактора некроза опухоли в стрессовых условиях. Мол. Клетка. Биол. 25 , 2450–2462 (2005).
CAS PubMed PubMed Central Google ученый
Ю, Дж.-S. и другие. DHX36 усиливает передачу сигналов RIG-I, облегчая PKR-опосредованное образование антивирусных стрессовых гранул. PLoS Pathog. 10 , e1004012 (2014).
PubMed PubMed Central Google ученый
Kim, T. et al. Аспартат-глутамат-аланин-гистидиновый бокс-мотив (DEAH) / РНК-геликаза А-геликаза воспринимает микробную ДНК в плазматических дендритных клетках человека. Proc. Natl Acad. Sci. США 107 , 15181–15186 (2010).
CAS PubMed Google ученый
Zhang, Z. et al. Геликазы DDX1, DDX21 и DHX36 образуют комплекс с адаптерной молекулой TRIF, чтобы воспринимать дцРНК в дендритных клетках. Иммунитет 34 , 866–878 (2011).
CAS PubMed PubMed Central Google ученый
Gack, M.U. et al. TRIM25 RING-finger E3 убиквитинлигаза необходима для противовирусной активности, опосредованной RIG-I. Nature 446 , 916–920 (2007).
CAS PubMed Google ученый
Reineke, L.C. & Lloyd, R.E. Белок стрессовых гранул G3BP1 рекрутирует протеинкиназу R для стимулирования множественных противовирусных реакций врожденного иммунитета. J. Virol. 89 , 2575–2589 (2015). Это исследование показывает петлю положительной обратной связи активации PKR через ее привлечение к стрессовым гранулам с помощью G3BP1.
PubMed Google ученый
Schulz, O. et al. Протеинкиназа R способствует иммунитету против определенных вирусов, регулируя целостность мРНК интерферона. Клеточный микроб-хозяин 7 , 354–361 (2010).
CAS PubMed PubMed Central Google ученый
Taghavi, N. & Samuel, C.E. Каталитическая активность PKR протеинкиназы необходима для PKR-зависимой активации митоген-активируемых протеинкиназ и усиления индукции интерферона β после вирусной инфекции. Вирусология 427 , 208–216 (2012).
CAS PubMed PubMed Central Google ученый
Киллип, М. Дж., Смит, М., Джексон, Д. и Рэндалл, Р. Е. Активация каскада индукции интерферона вирусами гриппа А требует синтеза вирусной РНК и ядерного экспорта. J. Virol. 88 , 3942–3952 (2014).
J. Virol. 88 , 3942–3952 (2014).
PubMed PubMed Central Google ученый
Като, Х.и другие. Различная роль геликаз MDA5 и RIG-I в распознавании РНК-вирусов. Nature 441 , 101–105 (2006).
CAS PubMed Google ученый
Liu, S.-Y., Sanchez, D.J., Aliyari, R., Lu, S. & Cheng, G. Систематическая идентификация индуцированных интерфероном противовирусных факторов типа I и типа II. Proc. Natl Acad. Sci. США 109 , 4239–4244 (2012).
CAS PubMed Google ученый
Лекмин, Ф. и другие. Активация киназы p70 S6 и фосфорилирование репрессора 4E-BP1 трансляции мРНК интерферонами I типа. J. Biol. Chem. 278 , 27772–27780 (2003).
и другие. Активация киназы p70 S6 и фосфорилирование репрессора 4E-BP1 трансляции мРНК интерферонами I типа. J. Biol. Chem. 278 , 27772–27780 (2003).
CAS PubMed Google ученый
Kaur, S. et al. Регуляторные эффекты млекопитающих-мишеней активированных рапамицином путей в передаче сигналов интерферона I и II типа. J. Biol. Chem. 282 , 1757–1768 (2007).
CAS PubMed Google ученый
Clavarino, G. et al. Субъединица протеинфосфатазы 1 Ppp1r15a / GADD34 регулирует продукцию цитокинов в дендритных клетках, стимулированных полиинозиновой: полицитидиловой кислотой. Proc. Natl Acad. Sci. США 109 , 3006–3011 (2012).
CAS PubMed Google ученый
Dalet, A. et al. Ингибирование синтеза белка и GADD34 контролируют гетерогенную экспрессию IFN-β в ответ на дцРНК. EMBO J. 36 , e201695000 (2017). Это исследование тщательно исследует остановку трансляции и синтез противовирусных цитокинов, которые происходят одновременно в клетках, обработанных поли (I: C). Он показывает новый механизм индукции GADD34 через активацию IRF3 и предлагает модель циклов последовательной остановки и восстановления трансляции.
Google ученый
Кодзима, Э. и др. Функция GADD34 заключается в восстановлении после отключения синтеза белка, вызванного стрессом ER: выяснение у мышей с дефицитом GADD34. FASEB J. 17 , 1573–1575 (2003).
CAS PubMed Google ученый
Даймонд, М. С. и Фарзан, М. Противовирусные функции широкого спектра действия белков IFIT и IFITM. Нат. Rev. Immunol. 13 , 46–57 (2012).
PubMed PubMed Central Google ученый
Сильверман, Р. Х. Вирус встречается с 2 ‘, 5’-олигоаденилатсинтетазой и РНКазой L во время противовирусного ответа интерферона. J. Virol. 81 , 12720–12729 (2007).
CAS PubMed PubMed Central Google ученый
Тейджаро, Дж. Р. Интерфероны типа I в вирусном контроле и иммунной регуляции. Curr. Мнение. Virol. 16 , 31–40 (2016).
CAS PubMed PubMed Central Google ученый
Джордж К. Х., Рамасвами Г., Ли, Дж. Б. и Самуэль, С. Е. Редактирование клеточных собственных РНК аденозиндезаминазой ADAR1 подавляет врожденные иммунные реакции на стресс. J. Biol. Chem. 291 , 6158–6168 (2016).
CAS PubMed PubMed Central Google ученый
Кристиансен, Х., Гад, Х. Х., Эскильдсен-Ларсен, С., Депре, П. и Хартманн, Р. Семейство олигоаденилатсинтетазы: древнее семейство белков с множественной противовирусной активностью. J. Interferon Cytokine Res. 31 , 41–47 (2011).
CAS PubMed Google ученый
Zhu, J. et al. Противовирусная активность человеческого белка OASL опосредуется усилением передачи сигналов датчика РНК RIG-I. Иммунитет 40 , 936–948 (2014).
Иммунитет 40 , 936–948 (2014).
CAS PubMed PubMed Central Google ученый
Вельсби, И.и другие. PARP12 , ген, стимулированный интерфероном, участвующий в контроле трансляции белка и воспаления. J. Biol. Chem. 289 , 26642–26657 (2014).
CAS PubMed PubMed Central Google ученый
Lee, H. et al. Противовирусный белок цинкового пальца опосредует индуцируемый ретиноевой кислотой ген I-подобный рецептор-независимый противовирусный ответ на вирус лейкемии мышей. Proc. Natl Acad.Sci. США 110 , 12379–12384 (2013).
CAS PubMed Google ученый
Karlberg, T. et al. Структурная основа отсутствия активности АДФ-рибозилтрансферазы в противовирусном белке поли (АДФ-рибоза) полимераза-13 / цинковый палец. J. Biol. Chem. 290 , 7336–7344 (2015).
CAS PubMed PubMed Central Google ученый
Гань, Дж.-П. и другие. Полнопротеомная идентификация поли (АДФ-рибоза) связывающих белков и поли (АДФ-рибоза) белковых комплексов. Nucleic Acids Res. 36 , 6959–6976 (2008).
CAS PubMed PubMed Central Google ученый
Isabelle, M., Gagné, J.-P., Gallouzi, I.-E. И Poirier, G.G. Количественная протеомика и динамическая визуализация показывают, что сборка стрессовых гранул, опосредованная G3BP, зависит от поли (АДФ-рибозы) после воздействия MNNG-индуцированного алкилирования ДНК. J. Cell Sci. 125 , 4555–4566 (2012).
J. Cell Sci. 125 , 4555–4566 (2012).
CAS PubMed Google ученый
Туласи Раман, С. Н. и др. DDX3 взаимодействует с белками NS1 и NP вируса гриппа A и выполняет противовирусную функцию, регулируя образование стрессовых гранул. J. Virol. 90 , 3661–3675 (2016).
PubMed PubMed Central Google ученый
Ли Т.и другие. NF90 представляет собой новый белок, взаимодействующий с NS1 вируса гриппа A, который противодействует ингибирующей роли NS1 в фосфорилировании PKR. FEBS Lett. 590 , 2797–2810 (2016).
CAS PubMed Google ученый
Wen, X. et al. NF90 проявляет противовирусную активность за счет регуляции фосфорилирования PKR и стрессовых гранул в инфицированных клетках. J. Immunol. 192 , 3753–3764 (2014).
CAS PubMed Google ученый
Wang, P. et al. Ядерный фактор 90 отрицательно регулирует репликацию вируса гриппа, взаимодействуя с вирусным нуклеопротеином. J. Virol. 83 , 7850–7861 (2009).
CAS PubMed PubMed Central Google ученый
Scholte, F. E. M. et al. Компоненты стрессовых гранул G3BP1 и G3BP2 играют провирусную роль на ранних этапах репликации вируса чикунгунья. J. Virol. 89 , 4457–4469 (2015).
CAS PubMed PubMed Central Google ученый
Нельсон, Э. В. и др. Вирус Эбола не вызывает образования стрессовых гранул во время инфекции и секвестрирует стрессовые гранулярные белки внутри вирусных включений. J. Virol. 90 , 7268–7284 (2016).
CAS PubMed PubMed Central Google ученый
Симпсон-Холли, М.и другие. Формирование противовирусных цитоплазматических гранул при ортопоксвирусной инфекции. J. Virol. 85 , 1581–1593 (2011). Это исследование описывает уникальные противовирусные гранулы, которые образуются в клетках, инфицированных вирусом осповакцины; эти гранулы имеют общие компоненты стресс-гранул, но различаются по своему составу и свойствам.
CAS PubMed Google ученый
Альборнос, А., Карлетти, Т., Corazza, G. & Marcello, A. Компонент стрессовых гранул TIA-1 связывает РНК вируса клещевого энцефалита и привлекается к перинуклеарным сайтам репликации вируса для ингибирования трансляции вируса. J. Virol. 88 , 6611–6622 (2014).
PubMed PubMed Central Google ученый
Garaigorta, U. & Chisari, F. V. Вирус гепатита C блокирует эффекторную функцию интерферона, индуцируя фосфорилирование протеинкиназы R. Клеточный микроб-хозяин 6 , 513–522 (2009).
CAS PubMed PubMed Central Google ученый
Линдквист, М. Э., Лифланд, А. В., Атли, Т. Дж., Сантанджело, П. Дж. И Кроу, Дж. Е. Респираторно-синцитиальный вирус индуцирует стрессовые гранулы РНК хозяина для облегчения репликации вируса. J. Virol. 84 , 12274–12284 (2010).
J. Virol. 84 , 12274–12284 (2010).
CAS PubMed PubMed Central Google ученый
Пеллетье, Дж.И Соненберг, Н. Внутренняя инициация трансляции мРНК эукариот, управляемая последовательностью, полученной из РНК полиовируса. Nature 334 , 320–325 (1988).
CAS PubMed Google ученый
Chaudhry, Y. et al. Калицивирусы различаются функциональными требованиями к компонентам eIF4F. J. Biol. Chem. 281 , 25315–25325 (2006).
CAS PubMed Google ученый
Цир, Б., Lenarcic, E. , Cecil, C. & Moorman, N.J. РНК-геликаза eIF4AIII является критическим детерминантом репликации цитомегаловируса человека. Вирусология 489 , 194–201 (2016).
, Cecil, C. & Moorman, N.J. РНК-геликаза eIF4AIII является критическим детерминантом репликации цитомегаловируса человека. Вирусология 489 , 194–201 (2016).
CAS PubMed PubMed Central Google ученый
Biedenkopf, N. et al. Природное соединение сильвестрол — мощный ингибитор репликации вируса Эбола. Antiviral Res. 137 , 76–81 (2017).
CAS PubMed Google ученый
Ле Саж, В., Cinti, A., Amorim, R. & Mouland, A.J. Адаптация стрессовой реакции: вирусная подрывная деятельность сигнального пути mTOR. Вирусы 8 , E152 (2016).
PubMed Google ученый
Montaner, S. Активация Akt / TSC / mTOR с помощью рецептора, связанного с G-белком KSHV: новые сведения о молекулярном онкогенезе и лечении саркомы Капоши. Cell Cycle 6 , 438–443 (2007).
CAS PubMed Google ученый
Крамс, С. М. и Мартинес, О. М. Вирус Эпштейна – Барра, рапамицин и иммунные ответы хозяина. Curr. Мнение. Трансплантация органа. 13 , 563–568 (2008).
PubMed PubMed Central Google ученый
Томсон, А. В., Тернквист, Г. Р. и Раймонди, Г. Иммунорегуляторные функции ингибирования mTOR. Нат. Rev. Immunol. 9 , 324–337 (2009).
CAS PubMed PubMed Central Google ученый
Китинг, Р. и др. Киназа mTOR модулирует ответ антител, обеспечивая перекрестный защитный иммунитет от летальной инфекции вирусом гриппа. Нат. Иммунол. 14 , 1266–1276 (2013).
CAS PubMed PubMed Central Google ученый
Кедерша, Н.и другие. Комплексы G3BP-caprin1-USP10 обеспечивают конденсацию стрессовых гранул и связываются с 40S субъединицами. J. Cell Biol. 212 , 845–860 (2016).
CAS PubMed PubMed Central Google ученый
Holcik, M. & Sonenberg, N. Трансляционный контроль при стрессе и апоптозе. Нат. Преподобный Мол. Cell Biol. 6 , 318–327 (2005).
CAS PubMed Google ученый
Парсян, А.и другие. мРНК геликазы: тактика трансляционного контроля. Нат. Преподобный Мол. Cell Biol. 12 , 235–245 (2011).
CAS PubMed Google ученый
Rozelle, D. K., Filone, C. M., Kedersha, N. & Connor, J.H. Активация путей стрессовой реакции способствует образованию противовирусных гранул и ограничивает репликацию вируса. Мол. Клетка. Биол. 34 , 2003–2016 (2014).
PubMed PubMed Central Google ученый
Ся, Дж.и другие. Инфекция вируса денге вызывает образование гранул G3BP1 в эпителиальных клетках легких человека. Arch. Virol. 160 , 2991–2999 (2015).
CAS PubMed Google ученый
Patton, J. T. et al. Ингибитор трансляции сильвестрол проявляет прямую противоопухолевую активность, сохраняя при этом врожденный и адаптивный иммунитет против лимфопролиферативного заболевания, вызванного ВЭБ. Oncotarget 6 , 2693–2708 (2015). В этом исследовании изучается влияние ингибитора трансляции и индуктора стрессовых гранул сильвестрола на врожденный и адаптивный иммунитет in vivo .
PubMed Google ученый
Tian, Q., Taupin, J., Elledge, S., Robertson, M. & Anderson, P. Активированная Fas серин / треонинкиназа (FAST) фосфорилирует TIA-1 во время Fas-опосредованного апоптоза. J. Exp. Med. 182 , 865–874 (1995).
CAS PubMed Google ученый
Förch, P. et al. Фактор TIA-1, способствующий апоптозу, является регулятором альтернативного сплайсинга пре-мРНК. Мол. Ячейка 6 , 1089–1098 (2000).
PubMed Google ученый
Fournier, M.-J. и другие. Инактивация пути mTORC1 – эукариотический фактор инициации трансляции 4E изменяет образование стрессовых гранул. Мол. Клетка. Биол. 33 , 2285–2301 (2013).
CAS PubMed PubMed Central Google ученый
Чернов К.Г. и др. Атомно-силовая микроскопия показывает связывание мРНК с микротрубочками, опосредованное двумя основными белками мРНП YB-1 и PABP. FEBS Lett. 582 , 2875–2881 (2008).
CAS PubMed Google ученый
Аримото, К., Fukuda, H., Imajoh-Ohmi, S., Saito, H. & Takekawa, M. Формирование стрессовых гранул ингибирует апоптоз за счет подавления стресс-зависимых путей MAPK. Нат. Cell Biol. 10 , 1324–1332 (2008).
CAS PubMed Google ученый
Gallois-Montbrun, S. et al. Противовирусный белок APOBEC3G локализуется в комплексах рибонуклеопротеидов, обнаруженных в P-тельцах и стрессовых гранулах. J. Virol. 81 , 2165–2178 (2007).
CAS PubMed Google ученый
Brai, A. et al. Белок DDX3 человека является ценной мишенью для разработки противовирусных агентов широкого спектра действия. Proc. Natl Acad. Sci. США 113 , 5388–5393 (2016).
CAS PubMed Google ученый
Nawaz, M. S. et al. Регуляция активности эндонуклеазы V человека и перемещение к цитоплазматическим стрессовым гранулам. J. Biol. Chem. 291 , 21786–21801 (2016).
CAS PubMed PubMed Central Google ученый
Parker, L. M., Fierro-Monti, I. & Mathews, M. B. Ядерный фактор 90 является субстратом и регулятором двухцепочечной РНК-активируемой протеинкиназы киназы фактора инициации 2 эукариот. J. Biol. Chem. 276 , 32522–32530 (2001).
CAS PubMed Google ученый
Критическая роль антивирусной стресс-гранулы, содержащей RIG-I и PKR, в обнаружении вирусов и врожденном иммунитете
Abstract
Ретиновая кислота, индуцируемая геном I (RIG-I) -подобные рецепторы (RLR), действуют как цитоплазматические сенсоры вирусной РНК, чтобы инициировать противовирусные реакции, включая продукцию интерферона I типа (IFN). Было неясно, как RIG-I встречает и воспринимает вирусную РНК. Чтобы решить эту проблему, мы исследовали внутриклеточную локализацию RIG-I в ответ на вирусную инфекцию с использованием недавно созданных антител против RIG-I. Иммуногистохимический анализ показал, что RLR локализованы в вирус-индуцированных гранулах, содержащих маркеры стрессовых гранул (SG) вместе с вирусной РНК и противовирусными белками. Из-за сходства морфологии и компонентов мы назвали эти агрегаты антивирусными стрессовыми гранулами (avSG). Вирус гриппа A (IAV), дефицитный по неструктурному белку 1 (NS1), эффективно генерировал avSG, а также IFN, однако IAV, кодирующий NS1, производил мало.Ингибирование образования avSG путем удаления компонента SG или двухцепочечной РНК (dsRNA) -зависимой протеинкиназы (PKR) приводило к снижению продукции IFN и сопутствующему усилению репликации вируса. Кроме того, мы наблюдали, что трансфекция дцРНК приводит к продукции IFN зависимым от avSGs образом. Эти результаты убедительно свидетельствуют о том, что avSG является локусом для восприятия несамостоятельной РНК, и что оркестровка множества белков имеет решающее значение для запуска противовирусных ответов.
Было неясно, как RIG-I встречает и воспринимает вирусную РНК. Чтобы решить эту проблему, мы исследовали внутриклеточную локализацию RIG-I в ответ на вирусную инфекцию с использованием недавно созданных антител против RIG-I. Иммуногистохимический анализ показал, что RLR локализованы в вирус-индуцированных гранулах, содержащих маркеры стрессовых гранул (SG) вместе с вирусной РНК и противовирусными белками. Из-за сходства морфологии и компонентов мы назвали эти агрегаты антивирусными стрессовыми гранулами (avSG). Вирус гриппа A (IAV), дефицитный по неструктурному белку 1 (NS1), эффективно генерировал avSG, а также IFN, однако IAV, кодирующий NS1, производил мало.Ингибирование образования avSG путем удаления компонента SG или двухцепочечной РНК (dsRNA) -зависимой протеинкиназы (PKR) приводило к снижению продукции IFN и сопутствующему усилению репликации вируса. Кроме того, мы наблюдали, что трансфекция дцРНК приводит к продукции IFN зависимым от avSGs образом. Эти результаты убедительно свидетельствуют о том, что avSG является локусом для восприятия несамостоятельной РНК, и что оркестровка множества белков имеет решающее значение для запуска противовирусных ответов.
Образец цитирования: Ономото К., Джоги М., Ю Дж-С, Нарита Р., Моримото С., Такемура А. и др. (2012) Критическая роль антивирусной стрессовой гранулы, содержащей RIG-I и PKR, в обнаружении вирусов и врожденном иммунитете. PLoS ONE 7 (8): e43031. https://doi.org/10.1371/journal.pone.0043031
Редактор: Акио Канаи, Университет Кейо, Япония
Поступила: 11.04.2012; Принята к печати: 16 июля 2012 г .; Опубликовано: 13 августа 2012 г.
Это статья в открытом доступе, свободная от всех авторских прав, и ее можно свободно воспроизводить, распространять, передавать, модифицировать, надстраивать или иным образом использовать в любых законных целях.Работа сделана доступной по лицензии Creative Commons CC0 как общественное достояние.
Финансирование: Министерство образования, культуры, спорта, науки и технологий Японии (инновационные области «Регулирование РНК» (№ 20112009), научные исследования «A» и начало исследовательской деятельности) (http: / /www. mext.go.jp/english/), Министерство здравоохранения, труда и социального обеспечения Японии (http://www.mhlw.go.jp/english/index.html), Японское агентство науки и технологий PRESTO (http://www.jst.go.jp/kisoken/presto/index_e.html), Мемориальный фонд Уэхара (http://www.ueharazaidan.com/), Мемориальный фонд Мочида для медицинских и фармацевтических исследований (http://www.mochida.co.jp/zaidan/), Научный фонд Такаэда (http://www.takeda-sci.or.jp/index.html), Фонд Наито (http://www.naito-f.or.jp/) и Nippon Boehringer Ingelheim (http: // www .boehringer-ingelheim.co.jp / com / Home / index.jsp). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
mext.go.jp/english/), Министерство здравоохранения, труда и социального обеспечения Японии (http://www.mhlw.go.jp/english/index.html), Японское агентство науки и технологий PRESTO (http://www.jst.go.jp/kisoken/presto/index_e.html), Мемориальный фонд Уэхара (http://www.ueharazaidan.com/), Мемориальный фонд Мочида для медицинских и фармацевтических исследований (http://www.mochida.co.jp/zaidan/), Научный фонд Такаэда (http://www.takeda-sci.or.jp/index.html), Фонд Наито (http://www.naito-f.or.jp/) и Nippon Boehringer Ingelheim (http: // www .boehringer-ingelheim.co.jp / com / Home / index.jsp). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: У авторов есть следующие конкурирующие интересы: Это исследование частично финансировалось Nippon Boehringer Ingelheim. Нет патентов, продуктов в разработке или продаваемых продуктов, которые можно декларировать. Это не влияет на соблюдение авторами всех политик PLoS ONE в отношении обмена данными и материалами, как подробно описано в руководстве для авторов.
Это не влияет на соблюдение авторами всех политик PLoS ONE в отношении обмена данными и материалами, как подробно описано в руководстве для авторов.
Введение
Интерфероны I и III типов (IFN) — это цитокины с сильной противовирусной активностью [1], [2].При связывании IFN с их родственными рецепторными комплексами активируется внутриклеточный сигнал, что приводит к активации факторов транскрипции, фактора 3 гена, стимулированного IFN, гетеротримерного преобразователя сигнала и активатора транскрипции (STAT) 1, STAT2 и фактора регуляции IFN ( IRF) -9 и гомодимер STAT1. Эти факторы вызывают активацию сотен генов, стимулированных интерфероном (ISG). Некоторые продукты ISG действуют как противовирусные белки и участвуют в блокаде репликации вируса.Уровень двухцепочечной (ds) РНК-зависимой протеинкиназы (PKR) повышается при обработке IFN, однако для каталитической активности PKR требуется dsRNA. Когда IFN-обработанные клетки инфицированы вирусом, дцРНК, продуцируемая как побочный продукт репликации вируса, активирует PKR, а активированная PKR инактивирует фактор инициации трансляции эукариот (eIF) 2а путем фосфорилирования [3]. Другой противовирусный белок 2’– 5 ‘олигоаденилатсинтетаза (OAS) также индуцируется экспрессией IFN. Каталитическая активность OAS требует дцРНК, и вирусная инфекция активирует OAS с образованием 2’– 5 ‘A.Затем 2’– 5 ‘A активирует клеточную РНКазу L, и вирусная РНК разрушается [1]. Хотя модель «dsRNA-активируемого ингибирования» широко принята, обработанные IFN и инфицированные вирусом клетки не обязательно подвергаются самоубийству, поскольку обычные биоанализы IFN продемонстрировали индуцированное IFN выживание инфицированных клеток [4]. Чтобы объяснить эти явления, была выдвинута гипотеза, что вирусная транскрипция / трансляция происходит в определенном субклеточном компартменте, таким образом, блокирование трансляции и деградация РНК этими противовирусными белками мало влияет на метаболизм хозяина.Однако такой купе еще никто не демонстрировал.
Другой противовирусный белок 2’– 5 ‘олигоаденилатсинтетаза (OAS) также индуцируется экспрессией IFN. Каталитическая активность OAS требует дцРНК, и вирусная инфекция активирует OAS с образованием 2’– 5 ‘A.Затем 2’– 5 ‘A активирует клеточную РНКазу L, и вирусная РНК разрушается [1]. Хотя модель «dsRNA-активируемого ингибирования» широко принята, обработанные IFN и инфицированные вирусом клетки не обязательно подвергаются самоубийству, поскольку обычные биоанализы IFN продемонстрировали индуцированное IFN выживание инфицированных клеток [4]. Чтобы объяснить эти явления, была выдвинута гипотеза, что вирусная транскрипция / трансляция происходит в определенном субклеточном компартменте, таким образом, блокирование трансляции и деградация РНК этими противовирусными белками мало влияет на метаболизм хозяина.Однако такой купе еще никто не демонстрировал.
IFN обычно не продуцируются в биологически значимых количествах. Большинство типов клеток млекопитающих способны продуцировать IFN при вирусной инфекции. Репликация вируса определяется цитоплазматическими сенсорами не собственной РНК; RIG-I, ген 5, связанный с дифференцировкой меланомы (MDA5), и лаборатория генетики и физиологии 2 (LGP2), которые в совокупности называются RLR, чтобы инициировать каскад событий, ведущих к активации факторов транскрипции, IRF-3 / — 7 и ядерный фактор-êB (NF-êB), затем активация генов IFN [5] — [9].Таким образом, основная функция системы IFN состоит в том, чтобы воспринимать чужеродную РНК и уничтожать вторгающуюся РНК, которая включает РНК, полученную в результате репликации ДНК-вирусов [10], [11]. Хотя генетические данные показывают, что RLR имеет решающее значение для обнаружения вирусной РНК в цитоплазме, его конкретное распределение неизвестно.
Репликация вируса определяется цитоплазматическими сенсорами не собственной РНК; RIG-I, ген 5, связанный с дифференцировкой меланомы (MDA5), и лаборатория генетики и физиологии 2 (LGP2), которые в совокупности называются RLR, чтобы инициировать каскад событий, ведущих к активации факторов транскрипции, IRF-3 / — 7 и ядерный фактор-êB (NF-êB), затем активация генов IFN [5] — [9].Таким образом, основная функция системы IFN состоит в том, чтобы воспринимать чужеродную РНК и уничтожать вторгающуюся РНК, которая включает РНК, полученную в результате репликации ДНК-вирусов [10], [11]. Хотя генетические данные показывают, что RLR имеет решающее значение для обнаружения вирусной РНК в цитоплазме, его конкретное распределение неизвестно.
В этом отчете мы исследовали клеточную локализацию RIG-I в клетках, инфицированных вирусом гриппа А. Мы обнаружили, что вирусная инфекция или трансфекция вирусной РНК заставляет RIG-I образовывать гранулярные агрегаты, содержащие маркеры стрессовых гранул, которые мы называем антивирусными стрессовыми гранулами (avSG). Наш анализ показал, что avSG имеют решающее значение для передачи сигналов для активации гена IFN, предполагая, что avSG служит платформой для восприятия чужеродной РНК с помощью RLR. Более того, поскольку гранула также рекрутирует PKR, OAS и РНКазу L, настоятельно рекомендуется, чтобы это был компартмент, в котором некоторые противовирусные белки ингибируют репликацию вируса.
Наш анализ показал, что avSG имеют решающее значение для передачи сигналов для активации гена IFN, предполагая, что avSG служит платформой для восприятия чужеродной РНК с помощью RLR. Более того, поскольку гранула также рекрутирует PKR, OAS и РНКазу L, настоятельно рекомендуется, чтобы это был компартмент, в котором некоторые противовирусные белки ингибируют репликацию вируса.
Результаты
Инфекция IAV с дефицитом NS1 приводит к образованию гранул, содержащих RIG-I
Мы создали антитело против RIG-I, которое специфически обнаруживает RIG-I с помощью иммуноокрашивания и иммуноблоттинга (Рисунок S1) (Материалы и методы) [12].Для наблюдения за распределением RIG-I в клетках клетки инфицировали двумя типами IAV, диким типом (WT) и ÄNS1, в котором отсутствует ген неструктурного белка 1 (NS1), мощного ингибитора продукции IFN [13]. . Репликация WT IAV была обнаружена через 3 часа после инфицирования как ядерное накопление вирусного нуклеокапсидного белка (NP) (рис. 1A). Позднее при инфицировании (9–12 ч) NP, предположительно в виде комплекса с вирусной геномной РНК [14], перемещается в цитоплазму. RIG-I был диспергирован в неинфицированных клетках, и инфекция WT IAV не вызвала каких-либо изменений в его распределении.С другой стороны, в клетках, инфицированных IAVÄNS1, NP накапливались в ядре через 6 часов после инфицирования, однако только часть NP перемещалась в цитоплазму через 9–12 часов (Рисунок 1B). В отличие от WT IAV, NP IAVÄNS1 обнаруживают спекл-подобное распределение в цитоплазме. Примечательно, что образование этого спекла, содержащего RIG-I, сильно коррелирует с активацией RIG-I-опосредованной активации сигнала, о чем судят по ядерной локализации (рис. 1C) и димеризации IRF-3 и сопутствующему усиленному производству ISG, таких как RLR и STAT1 (Данные не показаны).Действительно, соотношение клеток с IAV- и IAVÄNS1-индуцированным ядерным IRF-3 составляло 2,7% и 33,7% соответственно, а клетки, содержащие спеклы RIG-I вместе с ядерным IRF-3, составляли 0,0% (IAV) и 72,2% (IAVÄNS1).
1A). Позднее при инфицировании (9–12 ч) NP, предположительно в виде комплекса с вирусной геномной РНК [14], перемещается в цитоплазму. RIG-I был диспергирован в неинфицированных клетках, и инфекция WT IAV не вызвала каких-либо изменений в его распределении.С другой стороны, в клетках, инфицированных IAVÄNS1, NP накапливались в ядре через 6 часов после инфицирования, однако только часть NP перемещалась в цитоплазму через 9–12 часов (Рисунок 1B). В отличие от WT IAV, NP IAVÄNS1 обнаруживают спекл-подобное распределение в цитоплазме. Примечательно, что образование этого спекла, содержащего RIG-I, сильно коррелирует с активацией RIG-I-опосредованной активации сигнала, о чем судят по ядерной локализации (рис. 1C) и димеризации IRF-3 и сопутствующему усиленному производству ISG, таких как RLR и STAT1 (Данные не показаны).Действительно, соотношение клеток с IAV- и IAVÄNS1-индуцированным ядерным IRF-3 составляло 2,7% и 33,7% соответственно, а клетки, содержащие спеклы RIG-I вместе с ядерным IRF-3, составляли 0,0% (IAV) и 72,2% (IAVÄNS1). ).
).
Рис. 1. Инфекция IAV вызывает спекловое распределение маркеров RIG-I и стрессовых гранул.
( A – C ) Клетки HeLa были имитированы или инфицированы IAV ( A ) или IAVÄNS1 ( B ) в течение указанного периода, фиксированы, окрашены и проанализированы с помощью конфокальной микроскопии.Клетки окрашивали антителами против RIG-I (RIG-I), нуклеокапсидного белка против IAV (NP) и антителами против TIAR (TIAR). Ядра окрашивали DAPI. Через 9 и 12 часов после заражения процент спекл-подобного распределения RIG-I составлял 0,5% и 0,0% в клетках, инфицированных IAV, и 62,4% и 83,6% в клетках, инфицированных IAVÄNS1, соответственно. Увеличенные изображения соответствуют области в рамке на каждой панели. Клетки через 9 часов после инфицирования окрашивали антителами против RIG-I и против IRF-3 ( C ).( D и E ) Клетки HeLa инфицировали IAVÄNS1 в течение 9 часов и окрашивали анти-G3BP (G3BP) вместе с анти-RIG-I (RIG-I) ( D ) или анти-eIF3 (eIF3 ) ( E ). Увеличенные изображения соответствуют областям в рамке. ( F ) Клетки HeLa ложно обрабатывали или инфицировали IAV или IAVÄNS1 в течение 12 часов. Готовили клеточные экстракты и иммунопреципитировали антителом против RIG-I. Осадки анализировали иммуноблоттингом (IP: RIG-I) с использованием антител против G3BP, HuR, TIAR и RIG-I.Исходные данные: 1/50 экстрактов, используемых для иммунопреципитации, были проанализированы аналогичным образом с помощью иммуноблоттинга.
Увеличенные изображения соответствуют областям в рамке. ( F ) Клетки HeLa ложно обрабатывали или инфицировали IAV или IAVÄNS1 в течение 12 часов. Готовили клеточные экстракты и иммунопреципитировали антителом против RIG-I. Осадки анализировали иммуноблоттингом (IP: RIG-I) с использованием антител против G3BP, HuR, TIAR и RIG-I.Исходные данные: 1/50 экстрактов, используемых для иммунопреципитации, были проанализированы аналогичным образом с помощью иммуноблоттинга.
https://doi.org/10.1371/journal.pone.0043031.g001
Гранулы, индуцированные IAVÄNS1, содержат как маркер стрессовых гранул, так и антивирусные белки
Мы охарактеризовали природу этих пятен с помощью различных антител и обнаружили, что интересно, что RIG-I демонстрирует совместную локализацию с NP (83,5%) и маркером стрессовых гранул (SG), внутриклеточным антиген-связанным белком, ограниченным Т-клетками (TIAR ) (97.1%) через 9 ч (Рисунок 1B). Другие маркеры SG аналогичным образом рекрутируются в гранулы, продуцируемые IAVÄNS1: белок, связывающий домен Sh4 Ras-GAP (G3BP) (97,6% колокализован с RIG-I), eIF3 (99,8% колокализован с G3BP) (рис. 1D и 1E) человеческий антиген R (HuR) (98,8% колокализован с RIG-I) (данные не показаны). Кроме того, физическое взаимодействие между маркерами RIG-I и SG было продемонстрировано с помощью анализов с понижением (рис. 1F). Эти результаты убедительно свидетельствуют о том, что, хотя инфекция IAV потенциально индуцирует передачу сигналов для активации гена IFN и образование гранулярных агрегатов, содержащих маркеры SG, NS1 сильно блокирует и то, и другое.Эктопическая экспрессия полноразмерного NS1 и N-концевого РНК-связывающего домена NS1 резко ингибировала как образование гранул, так и передачу сигналов RIG-I в ответ на инфекцию IAVÄNS1, что указывает на то, что N-концевой домен NS1 отвечает за эти активности ( Рисунок S2A и S2B).
1D и 1E) человеческий антиген R (HuR) (98,8% колокализован с RIG-I) (данные не показаны). Кроме того, физическое взаимодействие между маркерами RIG-I и SG было продемонстрировано с помощью анализов с понижением (рис. 1F). Эти результаты убедительно свидетельствуют о том, что, хотя инфекция IAV потенциально индуцирует передачу сигналов для активации гена IFN и образование гранулярных агрегатов, содержащих маркеры SG, NS1 сильно блокирует и то, и другое.Эктопическая экспрессия полноразмерного NS1 и N-концевого РНК-связывающего домена NS1 резко ингибировала как образование гранул, так и передачу сигналов RIG-I в ответ на инфекцию IAVÄNS1, что указывает на то, что N-концевой домен NS1 отвечает за эти активности ( Рисунок S2A и S2B).
представляют собой внутриклеточный рибонуклеопротеиновый комплекс (РНП), генерируемый клеточным стрессом, включая окислительный, тепловой шок и стресс эндоплазматического ретикулума, и содержат мРНК с остановкой трансляции и различные РНК-связывающие белки [15]. Поскольку многие маркеры SG являются РНК-связывающими белками, мы исследовали локализацию других RLR, MDA5 и LGP2, а также PKR (см. Ниже), РНКазы L и OAS с помощью специфических антител. Интересно, что эти белки также рекрутировались в SG и вирус-индуцированные гранулы в ответ на арсенит и IAVÄNS1, соответственно (рис. 2A, 2B, 2C, 2D).
Поскольку многие маркеры SG являются РНК-связывающими белками, мы исследовали локализацию других RLR, MDA5 и LGP2, а также PKR (см. Ниже), РНКазы L и OAS с помощью специфических антител. Интересно, что эти белки также рекрутировались в SG и вирус-индуцированные гранулы в ответ на арсенит и IAVÄNS1, соответственно (рис. 2A, 2B, 2C, 2D).
Рис. 2. Противовирусные белки совместно локализованы с SG.
( A – D ) Клетки HeLa подвергали ложной обработке (ложной), инфицировали IAVÄNS1 в течение 9 часов или обрабатывали NaAsO 2 в течение 1 часа.Клетки фиксировали и окрашивали на G3BP и MDA5 (94,2% колокализация) ( A ), G3BP и LGP2 (97,6% колокализация) ( B ), RIG-I и РНКазу L (84,5% колокализация) ( C ). , RIG-I и OAS (87,4% колокализация) ( D ) в клетках, инфицированных IAVÄNS1. Увеличенные изображения соответствуют областям в рамке.
https://doi.org/10.1371/journal. pone.0043031.g002
pone.0043031.g002
Инфекция IAVÄNS1 индуцирует противовирусные SG, содержащие вирусную РНК
Эти результаты побудили нас изучить корреляцию между образованием SG и активацией гена IFN.Обработка клеток арсенитом (NaAsO 2 ), которая вызвала окислительный стресс, приводила к образованию гранул, аналогичных тем, которые генерируются IAVÄNS1 (рис. 3A). Точно так же искусственная сверхэкспрессия PKR привела к образованию SG (58,9%) (рис. 3A). Хотя инфекция IAVÄNS1 активировала ген IFN-â, ни арсенит, ни PKR не активировали ген (рис. 3B). Эти результаты предполагают, что SG и вирус-индуцированные гранулы функционально различны, возможно, из-за присутствия вирусной РНК в вирус-индуцированных гранулах.Действительно, флуоресценция in situ гибридизации (FISH) ясно продемонстрировала, что вирусная РНК совместно локализовалась с гранулами NP (рис. 3C) и RIG-I (рис. 3D) в клетках, инфицированных IAVÄNS1, тогда как инфицированные IAV клетки показали совместную локализацию вирусной РНК с NP (Рисунок S3A), но не с RIG-I (Рисунок S3B). Как только вирусная РНК задействована RIG-I-содержащим комплексом, промотор-стимулятор-1 IFN-α (IPS-1, также известный как MAVS, VISA или Cardif), экспрессируемый на внешней мембране митохондрий, задействуется для облегчения RIG-I-IPS1. передача сигналов Mitofusin 1-зависимым образом [12], [16].Хотя большая часть IPS-1 локализуется в митохондриальной сети неинфицированных и инфицированных IAV клеток, инфекция IAVÄNS1 вызывает спекл-подобное распределение. Перелокализованный IPS-1 демонстрирует очевидные контакты с TIAR- (Рисунок 3E, нижняя правая панель) и RIG-I- (Рисунок S4), содержащим SG. Это согласуется с моделью, согласно которой SG физически контактирует с митохондриями посредством взаимодействия между RIG-I и IPS-1 посредством гомотипического взаимодействия домена рекрутирования каспаз (CARD) -CARD [17] — [20]. Хотя сообщалось об ассоциации IPS-1 с меткой FLAG с пероксисомами, положительными по отношению к белку пероксисомной мембраны (PMP70) после вирусной инфекции [21], мы не наблюдали их очевидной ассоциации (рис.
Как только вирусная РНК задействована RIG-I-содержащим комплексом, промотор-стимулятор-1 IFN-α (IPS-1, также известный как MAVS, VISA или Cardif), экспрессируемый на внешней мембране митохондрий, задействуется для облегчения RIG-I-IPS1. передача сигналов Mitofusin 1-зависимым образом [12], [16].Хотя большая часть IPS-1 локализуется в митохондриальной сети неинфицированных и инфицированных IAV клеток, инфекция IAVÄNS1 вызывает спекл-подобное распределение. Перелокализованный IPS-1 демонстрирует очевидные контакты с TIAR- (Рисунок 3E, нижняя правая панель) и RIG-I- (Рисунок S4), содержащим SG. Это согласуется с моделью, согласно которой SG физически контактирует с митохондриями посредством взаимодействия между RIG-I и IPS-1 посредством гомотипического взаимодействия домена рекрутирования каспаз (CARD) -CARD [17] — [20]. Хотя сообщалось об ассоциации IPS-1 с меткой FLAG с пероксисомами, положительными по отношению к белку пероксисомной мембраны (PMP70) после вирусной инфекции [21], мы не наблюдали их очевидной ассоциации (рис. 3E).
3E).
Рисунок 3. Вирусная РНК необходима для образования функциональной SG для активации сигнального пути RIG-I / IPS-1.
( A ) Клетки 293T трансфицировали пустым вектором (пустым) или вектором экспрессии HA-PKR (HA-PKR) в течение 24 часов или обрабатывали NaAsO 2 в течение 1 часа и окрашивали анти-RIG- I, антитела против HA (PKR) и против TIAR и DAPI. Увеличенные изображения соответствуют областям в рамке. ( B ) Клетки 293T трансфицировали пустым вектором (пустым) или вектором экспрессии HA-PKR в течение 48 часов, или обрабатывали NaAsO 2 в течение 1 часа, или инфицировали IAVÄNS1 в течение 12 часов.Относительные уровни мРНК эндогенного гена IFN-â определяли с помощью количественной ПЦР (qPCR). Данные представлены в виде среднего стандартного значения ± ошибка среднего (SEM). ( C и D ) Клетки HeLa ложно обрабатывали или инфицировали IAVÄNS1 в течение 12 часов. Вирусная РНК (вРНК) была обнаружена методом FISH с использованием РНК-зонда, комплементарного сегменту 1 IAV, а NP ( C ) и RIG-I ( D ) были обнаружены с использованием анти-NP и анти-RIG. -I антитела (97,1% и 98,2% совместная локализация вРНК с NP и RIG-I, соответственно).TO-PRO-3 использовали для окрашивания ядерной ДНК (ДНК). ( E ) Клеточные линии HeLa, стабильно экспрессирующие IPS-1 с тегом FLAG, подвергали ложной обработке или инфицировали IAV или IAVÄNS1 в течение 10 часов. Клетки окрашивали антителами против PMP70, против FLAG и против TIAR. Белыми стрелками обозначены контакты между FLAG-IPS-1 и TIAR. 67,8% инфицированных IAVÄNS1 клеток имели контакты, тогда как инфицированные IAV клетки практически не имели контакта (2,7%). На нижней панели показаны увеличенные изображения PMP70 (зеленый) и FLAG (красный), PMP70 (зеленый) и TIAR (красный), а также FLAG (зеленый) и TIAR (красный) в клетках, инфицированных IAVÄNS1.
-I антитела (97,1% и 98,2% совместная локализация вРНК с NP и RIG-I, соответственно).TO-PRO-3 использовали для окрашивания ядерной ДНК (ДНК). ( E ) Клеточные линии HeLa, стабильно экспрессирующие IPS-1 с тегом FLAG, подвергали ложной обработке или инфицировали IAV или IAVÄNS1 в течение 10 часов. Клетки окрашивали антителами против PMP70, против FLAG и против TIAR. Белыми стрелками обозначены контакты между FLAG-IPS-1 и TIAR. 67,8% инфицированных IAVÄNS1 клеток имели контакты, тогда как инфицированные IAV клетки практически не имели контакта (2,7%). На нижней панели показаны увеличенные изображения PMP70 (зеленый) и FLAG (красный), PMP70 (зеленый) и TIAR (красный), а также FLAG (зеленый) и TIAR (красный) в клетках, инфицированных IAVÄNS1.
https://doi.org/10.1371/journal.pone.0043031.g003
Производство SG не является результатом передачи сигналов RIG-I или IFN, поскольку избыточная экспрессия IPS-1 активировала ядерную транслокацию IRF-3 без образования SG (Рисунок S5A), и SG, сформированные в клетках HEC-1B с дефицитом IFN-рецептора (Рисунок S5B). Кроме того, другие вирусы, включая вирусы Sindbis (SINV), энцефаломиокардита (EMCV) и Adeno (Ad) dl203, также генерировали гранулы, содержащие RIG-I и G3BP (рисунок S5C), что позволяет предположить, что эта SG-подобная гранула является общей реакцией на вирусные инфекции .Чтобы отличить индуцированные вирусом гранулы от обычных SG, мы назвали индуцированные вирусом спеклы антивирусными SG (avSG).
Кроме того, другие вирусы, включая вирусы Sindbis (SINV), энцефаломиокардита (EMCV) и Adeno (Ad) dl203, также генерировали гранулы, содержащие RIG-I и G3BP (рисунок S5C), что позволяет предположить, что эта SG-подобная гранула является общей реакцией на вирусные инфекции .Чтобы отличить индуцированные вирусом гранулы от обычных SG, мы назвали индуцированные вирусом спеклы антивирусными SG (avSG).
Нарушение образования avSG ингибирует IAVÄNS1-индуцированную активацию IFN
Чтобы выяснить, требуется ли образование avSG для экспрессии IFN, мы отключили G3BP, критический компонент для образования канонических SG. G3BP siRNA явно подавляла экспрессию G3BP (рис. 4A). В соответствии с предыдущим исследованием [22], нокдаун G3BP сильно ингибировал образование avSG в клетках, инфицированных IAVÄNS1 (рис. 4B), а количество клеток, которые демонстрировали спекловое распределение RIG-I и TIAR, было уменьшено (рис. 4C). и 4D).Более того, экспрессия гена IFN-â сильно ингибировалась в клетках с нокдауном G3BP по сравнению с контрольными клетками, обработанными siRNA (фиг. 4E). Эти результаты предполагают, что образование avSG необходимо для эффективной активации IFN типа I. Кроме того, нокдаун eIF3 или RHAU, оба из которых являются компонентами SG, также блокировал как образование avSG, так и активацию гена IFN (данные не показаны).
4E). Эти результаты предполагают, что образование avSG необходимо для эффективной активации IFN типа I. Кроме того, нокдаун eIF3 или RHAU, оба из которых являются компонентами SG, также блокировал как образование avSG, так и активацию гена IFN (данные не показаны).
Рисунок 4. Нокдаун G3BP нарушает образование avSG и активацию гена IFN-â.
( A – E ) Клетки HeLa трансфицировали контрольной миРНК (N.C) или siRNA, нацеленная на G3BP человека (G3BPi). Через 48 ч после трансфекции клетки собирали и G3BP и актин детектировали иммуноблоттингом ( A ). Клетки имитировали (имитировали) или инфицировали IAVÄNS1 в течение 12 часов, фиксировали и окрашивали антителами против RIG-I, против NP и против TIAR и DAPI ( B ). Определяли процент клеток, содержащих фокусы RIG-I ( C ) или TIAR ( D ). Относительный уровень мРНК IFN-â определяли методом кПЦР ( E ).Данные представлены в виде среднего стандартного значения ± ошибка среднего (SEM).
https://doi.org/10.1371/journal.pone.0043031.g004
Инфекция IAVÄNS1 вызывает активацию и накопление PKR в avSG
Было высказано предположение, что семейство протеинкиназ, включая PKR, общий контроль недерепрессируемого 2 (GCN2), PKR-подобную киназу эндоплазматического ретикулума (PERK) и регулируемую гемом киназу eIF2α (HRI), фосфорилирует eIF2á, что приводит к образованию SGs. Обработка арсенитом вызывает окислительный стресс, приводящий к активации HRI, и образуются SG.PKR активируется дцРНК или 5 ¢ ppp-содержащей РНК [23], поэтому мы предполагаем, что РНК IAV активирует PKR, что приводит к образованию avSG через фосфорилирование eIF2á. Чтобы решить вопрос о вовлечении PKR, мы исследовали локализацию PKR в обработанных арсенитом и инфицированных IAVÄNS1 клетках и обнаружили, что PKR накапливается в SG и avSG (рис. 5A). Интересно, что фосфорилированный eIF2a также был обнаружен в avSG, специфически генерируемых IAVÄNS1, но не в IAV-инфицированных клетках (фиг. 5B). Иммуноблоттинг подтвердил, что IAVÄNS1 специфически индуцирует фосфорилирование PKR и eIF2á, тогда как обработка арсенитом индуцирует фосфорилирование eIF2á без активации PKR, что указывает на то, что IAVÄNS1 и арсенит индуцируют SG через различные пути (рис. 5C).
5B). Иммуноблоттинг подтвердил, что IAVÄNS1 специфически индуцирует фосфорилирование PKR и eIF2á, тогда как обработка арсенитом индуцирует фосфорилирование eIF2á без активации PKR, что указывает на то, что IAVÄNS1 и арсенит индуцируют SG через различные пути (рис. 5C).
Рисунок 5. Локализация и активация PKR в индуцированных IAVÄNS1 avSG.
( A ) Клетки HeLa ложно обрабатывали или инфицировали IAVÄNS1 в течение 9 часов или обрабатывали NaAsO 2 в течение 1 часа. Клетки фиксировали и окрашивали антителами против RIG-I и против PKR (% совместной локализации: 95,1% и 97,0% в клетках, инфицированных IAVÄNS1, и обработанных NaAsO 2 соответственно). Увеличенные изображения соответствуют областям в рамке. ( B ) Клетки HeLa были имитированы или инфицированы IAV или IAVÄNS1 в течение 9 часов и окрашены антифосфо-eIF2a (Ser 51) (p-eIF2á) и G3BP (% совместной локализации: 0.0% и 46,5% в клетках, инфицированных IAV и IAVÄNS1, соответственно). Увеличенные изображения соответствуют областям в рамке. ( C ) Клетки HeLa инфицировали IAV или IAVÄNS1 в течение 12 часов или обрабатывали NaAsO 2 в течение 1 часа. Клеточные экстракты были подготовлены и подвергнуты SDS-PAGE и иммуноблоттингу с использованием антител против RIG-I, PKR, фосфорилированной PKR (Thr 446) (p-PKR), фосфорилированного eIF2á (Ser 51) (p-eIF2á), IAV NP и â-актин.
Увеличенные изображения соответствуют областям в рамке. ( C ) Клетки HeLa инфицировали IAV или IAVÄNS1 в течение 12 часов или обрабатывали NaAsO 2 в течение 1 часа. Клеточные экстракты были подготовлены и подвергнуты SDS-PAGE и иммуноблоттингу с использованием антител против RIG-I, PKR, фосфорилированной PKR (Thr 446) (p-PKR), фосфорилированного eIF2á (Ser 51) (p-eIF2á), IAV NP и â-актин.
https://doi.org/10.1371/journal.pone.0043031.g005
Критическая роль PKR в образовании avSG и продукции IFN в клетках, инфицированных IAV
Описанные выше результаты указывают на образование вирусных РНК-содержащих avSG, которые необходимы для RLR-опосредованной передачи противовирусного сигнала. Чтобы оценить потребность в PKR во время инфекции IAVÄNS1, мы проанализировали образование avSG в эмбриональных фибробластах мыши (MEF), полученных от мышей WT и с нокаутом PKR (KO) (фиг. 6). MEF PKR WT и KO инфицировали либо IAV, либо IAVÄNS1, окрашивали антителами против RIG-I, против NP и против TIAR и рассчитывали частоту avSG. В случае WT IAV, avSG не образовывались в WT и KO MEF, как определено на рисунке 1. IAVÄNS1 производил avSG в WT, но не в PKR KO MEF (рисунок 6A, 6B, 6C). Более того, делеция PKR привела к блокаде экспрессии гена IFN-â (фиг. 6D), продукции белка IFN-â (фиг. 6E) и димеризации IRF-3 (фиг. 6F). Кроме того, мы подтвердили эти результаты, используя siRNA, направленную на экспрессию PKR в клетках HeLa. SiRNA эффективно подавляла экспрессию эндогенной PKR, что приводило к сильному ингибированию индуцированной IAVÄNS1 экспрессии гена IFN-â, сопутствующему снижению количества avSG (фиг. S6).Взятые вместе, результаты показывают, что PKR важна для активации генов avSG и IFN в клетках, инфицированных IAVÄNS1. Важно отметить, что блокирование образования avSG путем нокдауна PKR или G3BP усиливает репликацию IAVÄNS1 (рис. 7). Эти результаты убедительно указывают на новую роль avSG в противовирусных реакциях врожденного иммунитета.
В случае WT IAV, avSG не образовывались в WT и KO MEF, как определено на рисунке 1. IAVÄNS1 производил avSG в WT, но не в PKR KO MEF (рисунок 6A, 6B, 6C). Более того, делеция PKR привела к блокаде экспрессии гена IFN-â (фиг. 6D), продукции белка IFN-â (фиг. 6E) и димеризации IRF-3 (фиг. 6F). Кроме того, мы подтвердили эти результаты, используя siRNA, направленную на экспрессию PKR в клетках HeLa. SiRNA эффективно подавляла экспрессию эндогенной PKR, что приводило к сильному ингибированию индуцированной IAVÄNS1 экспрессии гена IFN-â, сопутствующему снижению количества avSG (фиг. S6).Взятые вместе, результаты показывают, что PKR важна для активации генов avSG и IFN в клетках, инфицированных IAVÄNS1. Важно отметить, что блокирование образования avSG путем нокдауна PKR или G3BP усиливает репликацию IAVÄNS1 (рис. 7). Эти результаты убедительно указывают на новую роль avSG в противовирусных реакциях врожденного иммунитета.
Рисунок 6. Критическая роль PKR в формировании активации гена avSG и IFN-â.
( A – C ) MEF, полученные от мышей WT и PKR KO, имитировали лечение или инфицирование IAVÄNS1 в течение 12 часов.Клетки окрашивали анти-RIG-I, анти-IAV NP и анти-TIAR антителами и DAPI ( A ). Определяли процент клеток, содержащих фокусы RIG-I ( B ) или TIAR ( C ). ( D – F ) MEF PKR WT и PKR KO подвергали ложной обработке или инфицировали IAVÄNS1. Уровень мРНК IFN-α через 9 ч после инфицирования определяли с помощью кПЦР ( D ). Уровни белка IFN-α в культуральной среде через 15 ч после инфицирования количественно определяли с помощью ELISA ( E ) .Экстракты клеток подвергали Native-PAGE, и димер IRF-3 детектировали иммуноблоттингом с использованием антитела против IRF-3. NP и актин IAV определяли с помощью SDS-PAGE с последующим блоттингом с использованием антител против NP и актина ( F ). Данные, показанные в B-E, представлены в виде среднего стандартного значения ± ошибка среднего (SEM).
https://doi.org/10.1371/journal.pone.0043031.g006
Рисунок 7. Ингибирование образования avSG усиливает репликацию вируса IAV.
КлеткиHeLa трансфицировали контрольной миРНК (N.C) или siRNA, нацеленная на мРНК PKR человека или G3BP. Через 48 часов после трансфекции клетки обрабатывали имитатором или инфицировали IAVÄNS1 в течение 24 часов. Уровни экспрессии сегмента 3 РНК IAV и мРНК GAPDH определяли с помощью ОТ-ПЦР ( верхний ). Паттерны экспрессии РНК IAV были количественно определены с помощью LAS-1000 UV mini (Fujifilm, Япония) и нормализованы с помощью GAPDH ( нижний ). Данные представлены в виде среднего стандартного значения ± ошибка среднего (SEM).
https://doi.org/10.1371/journal.pone.0043031.g007
Следует отметить, что в отсутствие PKR цитоплазматический транспорт NP ускоряется (Рисунок 6A). Этот эффект также наблюдается в клетках HeLa, в которых PKR подавлена (рисунок S6C). Хотя механизм неизвестен, эти результаты предполагают, что PKR негативно регулируют цитоплазматический транспорт нуклеокапсида IAV.
Хотя механизм неизвестен, эти результаты предполагают, что PKR негативно регулируют цитоплазматический транспорт нуклеокапсида IAV.
Вирусная РНК генерирует avSG зависимым от PKR способом
Предыдущие сообщения показали, что геномная РНК IAV ответственна за запуск противовирусной передачи сигналов через RIG-I [6], [9], [24], [25].Поскольку геном IAV не является инфекционным, мы извлекли его из инфицированных IAV клеток и трансфицировали в MEF WT или PKR KO и исследовали, индуцирует ли геномная РНК IAV исключительно образование avSG и последующую активацию гена IFN. Как показано на фиг. 8A, геномной РНК IAV достаточно для продуцирования avSG, что указывает на то, что ни вирусный белок, ни репликация вирусной РНК не требуются. Кроме того, PKR требуется для образования вирусных РНК-индуцированных avSG (фиг. 8A и 8B).Поскольку PKR также необходима для индуцированной поли I: C активации гена IFN [26], мы протестировали короткий и длинный поли I: C, которые избирательно активируют RIG-I и MDA5 соответственно [27]. Короткий и длинный поли I: C индуцировали образование avSG зависимым от PKR образом (фиг. 8A и 8B). Мы подтвердили, что продукция IFN-α этими РНК зависит от PKR (рис. 8C). Вирусная, но не хозяйская РНК способна запускать ответ, что продемонстрировано обнаружением того факта, что общая РНК, выделенная из инфицированных клеток, но не из неинфицированных клеток, индуцирует образование avSG и активацию гена IFN-â (рис. S7A и S7B).Эти данные демонстрируют, что PKR необходима для образования avSG, которые рекрутируют вирусную РНК и RLR для запуска активации гена IFN во время IAV-инфекции. Следует отметить, что, как показано на фиг. 3B, сверхэкспрессия PKR может активировать образование SG, но не экспрессию IFN в отсутствие вирусной РНК, предполагая, что функция PKR является предварительным условием, но недостаточна для эффективной индукции RLR-опосредованной передачи противовирусных сигналов.
Короткий и длинный поли I: C индуцировали образование avSG зависимым от PKR образом (фиг. 8A и 8B). Мы подтвердили, что продукция IFN-α этими РНК зависит от PKR (рис. 8C). Вирусная, но не хозяйская РНК способна запускать ответ, что продемонстрировано обнаружением того факта, что общая РНК, выделенная из инфицированных клеток, но не из неинфицированных клеток, индуцирует образование avSG и активацию гена IFN-â (рис. S7A и S7B).Эти данные демонстрируют, что PKR необходима для образования avSG, которые рекрутируют вирусную РНК и RLR для запуска активации гена IFN во время IAV-инфекции. Следует отметить, что, как показано на фиг. 3B, сверхэкспрессия PKR может активировать образование SG, но не экспрессию IFN в отсутствие вирусной РНК, предполагая, что функция PKR является предварительным условием, но недостаточна для эффективной индукции RLR-опосредованной передачи противовирусных сигналов.
Рисунок 8. Вирусная РНК и polyI: C индуцируют образование avSG и экспрессию гена IFN-â PKR-зависимым образом.
( A – C ) MEF, полученные от мышей WT и PKR KO, были ложно обработаны или трансфицированы геномной РНК IAV, коротким поли I: C или длинным поли I: C в течение 9 часов и окрашены анти-RIG-I , антитела против G3BP и DAPI ( A ). Процент клеток, содержащих очаги G3BP, показан в ( B ). Относительные уровни мРНК IFN-α определяли с помощью кПЦР ( C ). Данные, показанные в B и C, представлены в виде среднего стандартного ± ошибка среднего (SEM).
https: // doi.org / 10.1371 / journal.pone.0043031.g008
Discussion
Недавние исследования идентифицировали доменную структуру RLRs и различных адаптерных белков, регулирующих RLR-опосредованные антивирусные сигнальные каскады [28], но как RLRs встречаются с вирусной РНК в инфицированных клетках, остается неясным. В этом исследовании мы обнаружили, что все RLR рекрутируются в цитоплазматические гранулы, называемые avSG, при вирусных инфекциях. avSG содержат множество маркеров SG, G3BP, TIAR и eIF3, но в отличие от канонических SG также содержат вирусную РНК и вирусные NP.Мы продемонстрировали, что avSG имеют решающее значение для индуцированной вирусом активации гена IFN. Поскольку RLR должны эффективно находить свои лиганды, чтобы действовать как важные сенсоры для вирусной РНК, avSG могут способствовать правильному взаимодействию между вирусной РНК и RLR. Кроме того, OAS и RNase L рекрутируются в avSG, подтверждая модель, согласно которой RNase L усиливает передачу сигналов, индуцирующих IFN, путем обнаружения криптических лигандов для RIG-I и MDA5 [29]. Более того, специфическое привлечение противовирусных белков в avSG предполагает критическую роль в блокировании вирусной репликации без влияния на нормальную трансляцию хозяина.Мы также наблюдали, что другие вирусы, включая SINV, аденовирус EMCV, вирус гепатита C и вирус болезни Ньюкасла, индуцировали avSG (рисунок S5C и данные не показаны), что позволяет предположить, что avSG могут функционировать как общая платформа для обнаружения многих вирусов, чтобы инициировать передачу антивирусных сигналов.
avSG содержат множество маркеров SG, G3BP, TIAR и eIF3, но в отличие от канонических SG также содержат вирусную РНК и вирусные NP.Мы продемонстрировали, что avSG имеют решающее значение для индуцированной вирусом активации гена IFN. Поскольку RLR должны эффективно находить свои лиганды, чтобы действовать как важные сенсоры для вирусной РНК, avSG могут способствовать правильному взаимодействию между вирусной РНК и RLR. Кроме того, OAS и RNase L рекрутируются в avSG, подтверждая модель, согласно которой RNase L усиливает передачу сигналов, индуцирующих IFN, путем обнаружения криптических лигандов для RIG-I и MDA5 [29]. Более того, специфическое привлечение противовирусных белков в avSG предполагает критическую роль в блокировании вирусной репликации без влияния на нормальную трансляцию хозяина.Мы также наблюдали, что другие вирусы, включая SINV, аденовирус EMCV, вирус гепатита C и вирус болезни Ньюкасла, индуцировали avSG (рисунок S5C и данные не показаны), что позволяет предположить, что avSG могут функционировать как общая платформа для обнаружения многих вирусов, чтобы инициировать передачу антивирусных сигналов. Поскольку PKR сама по себе не может запускать активацию гена IFN (фиг. 3B), PKR вносит вклад в вышеупомянутую IAV-индуцированную активацию RIG-I. Сообщалось, что SINV активирует GCN2 для фосфорилирования eIF2á [30], предполагая, что несколько вирусов могут активировать разные киназы eIF2á с образованием avSG.
Поскольку PKR сама по себе не может запускать активацию гена IFN (фиг. 3B), PKR вносит вклад в вышеупомянутую IAV-индуцированную активацию RIG-I. Сообщалось, что SINV активирует GCN2 для фосфорилирования eIF2á [30], предполагая, что несколько вирусов могут активировать разные киназы eIF2á с образованием avSG.
Наша модель функции avSG представлена на рисунке 9. Мы строго не исключаем возможность того, что PKR может напрямую фосфорилировать молекулы-мишени для участия в активации гена IFN, однако, поскольку активации PKR одной не достаточно для запуска продукции IFN, это эффект может быть постепенным.
Рисунок 9. avSG и врожденные противовирусные реакции.
Вирусные инфекции генерируют РНК с несамоподписанными, такими как 5′-трифосфат или двухцепочечная структура ( a ).В случае IAVÄNS1 PKR имеет решающее значение для образования avSG ( b ). IAV дикого типа ингибирует образование avSG под действием белка NS1 (c ). Некоторые другие вирусы могут активировать различные киназы eIF2a, такие как GCN2, PERK и HRI, для производства функциональных avSG ( d ). avSG состоят из маркеров SG и других РНК-связывающих белков, включая RLR, противовирусные белки (PKR, OAS и РНКаза L) и вирусную РНК. Внутри avSG вирусная РНК может восприниматься RLR для запуска передачи противовирусных сигналов ( e ).Активированные RLR рекрутируют митохондриальный IPS-1 посредством взаимодействий CARD-CARD ( f ). IPS-1 служит еще одной платформой для TRAF и протеинкиназ, TBK-1, IKKi и комплекса IKK, для активации генов-мишеней ( g ). Антивирусные белки активируются вирусной РНК, чтобы блокировать синтез и трансляцию вирусной РНК ( h ). Более того, система OAS-РНКаза L может продуцировать дцРНК для усиления передачи сигналов RLR ( i ).
Некоторые другие вирусы могут активировать различные киназы eIF2a, такие как GCN2, PERK и HRI, для производства функциональных avSG ( d ). avSG состоят из маркеров SG и других РНК-связывающих белков, включая RLR, противовирусные белки (PKR, OAS и РНКаза L) и вирусную РНК. Внутри avSG вирусная РНК может восприниматься RLR для запуска передачи противовирусных сигналов ( e ).Активированные RLR рекрутируют митохондриальный IPS-1 посредством взаимодействий CARD-CARD ( f ). IPS-1 служит еще одной платформой для TRAF и протеинкиназ, TBK-1, IKKi и комплекса IKK, для активации генов-мишеней ( g ). Антивирусные белки активируются вирусной РНК, чтобы блокировать синтез и трансляцию вирусной РНК ( h ). Более того, система OAS-РНКаза L может продуцировать дцРНК для усиления передачи сигналов RLR ( i ).
https://doi.org/10.1371/journal.pone.0043031.g009
Распознавание вирусной РНК с помощью RIG-I и MDA5 вызывает АТФ-зависимые конформационные изменения молекул и позволяет им взаимодействовать с митохондриальным IPS-1 посредством взаимодействия CARD-CARD. Несколько отчетов показали, что активированный RIG-I образует димер или олигомер, который необходим для эффективной активации сигнала [31], [32]. Кроме того, было продемонстрировано, что IPS-1 перераспределяется по митохондриям в ответ на вирусную инфекцию, а IPS-1 образует прионоподобные агрегаты [12], [16].Эти наблюдения указывают на возможность того, что для передачи сигналов необходимо локальное обогащение как RLRs, так и IPS-1. Хотя наша попытка обнаружить биохимическое взаимодействие между RLR-содержащим avSG и агрегатами IPS-1 in vitro до сих пор не увенчалась успехом из-за их нерастворимости, наш иммуногистохимический анализ убедительно показывает, что митохондрии, обогащенные IPS-1, физически связаны с avSG. в ответ на инфекцию IAVÄNS1 (рис. 3E и S4), что предполагает критическую роль avSG как платформы для взаимодействия RLR-IPS-1.
Несколько отчетов показали, что активированный RIG-I образует димер или олигомер, который необходим для эффективной активации сигнала [31], [32]. Кроме того, было продемонстрировано, что IPS-1 перераспределяется по митохондриям в ответ на вирусную инфекцию, а IPS-1 образует прионоподобные агрегаты [12], [16].Эти наблюдения указывают на возможность того, что для передачи сигналов необходимо локальное обогащение как RLRs, так и IPS-1. Хотя наша попытка обнаружить биохимическое взаимодействие между RLR-содержащим avSG и агрегатами IPS-1 in vitro до сих пор не увенчалась успехом из-за их нерастворимости, наш иммуногистохимический анализ убедительно показывает, что митохондрии, обогащенные IPS-1, физически связаны с avSG. в ответ на инфекцию IAVÄNS1 (рис. 3E и S4), что предполагает критическую роль avSG как платформы для взаимодействия RLR-IPS-1.
Фосфорилирование eIF2á по Ser51, как известно, запускает образование канонических SGs, однако точный механизм, с помощью которого фосфорилированный eIF2á рекрутирует др. Компоненты SG, не совсем понятен из-за сложности биохимического анализа [33]. Мы продемонстрировали, что PKR активируется, рекрутируется в avSG и необходима для образования avSG после заражения IAVÄNS1. Вирусная РНК в первую очередь ответственна за запуск активации PKR, поскольку трансфекция геномной РНК IAV или поли I: C индуцировала образование avSG и активацию гена IFN зависимым от PKR образом.В соответствии с нашими данными, некоторые исследования показали, что дефицит PKR снижает выработку IFN в ответ на polyI: C и вирусные инфекции [34] — [38]. Schulz et al. сообщили, что PKR не требуется для продукции белков IFN-á / â в ответ на IAV в дендритных клетках костного мозга (BM-DC) [39]. Очевидно, это не согласуется с нашими данными, полученными с помощью MEF. Хотя мы не смогли напрямую сравнить MEF и BM-DC, наше объяснение этого несоответствия заключается в различии типов клеток, поскольку экспрессия белка IFN, определенная с помощью ELISA (рисунок 6E), соответствует уровню мРНК (рисунок 6D) и нокдаун PKR с помощью HeLa.
Компоненты SG, не совсем понятен из-за сложности биохимического анализа [33]. Мы продемонстрировали, что PKR активируется, рекрутируется в avSG и необходима для образования avSG после заражения IAVÄNS1. Вирусная РНК в первую очередь ответственна за запуск активации PKR, поскольку трансфекция геномной РНК IAV или поли I: C индуцировала образование avSG и активацию гена IFN зависимым от PKR образом.В соответствии с нашими данными, некоторые исследования показали, что дефицит PKR снижает выработку IFN в ответ на polyI: C и вирусные инфекции [34] — [38]. Schulz et al. сообщили, что PKR не требуется для продукции белков IFN-á / â в ответ на IAV в дендритных клетках костного мозга (BM-DC) [39]. Очевидно, это не согласуется с нашими данными, полученными с помощью MEF. Хотя мы не смогли напрямую сравнить MEF и BM-DC, наше объяснение этого несоответствия заключается в различии типов клеток, поскольку экспрессия белка IFN, определенная с помощью ELISA (рисунок 6E), соответствует уровню мРНК (рисунок 6D) и нокдаун PKR с помощью HeLa. клетки резко уменьшили продукцию IFN (Рисунок S6B).BM-DC может использовать киназу eIF2α, отличную от PKR, для образования avSG.
клетки резко уменьшили продукцию IFN (Рисунок S6B).BM-DC может использовать киназу eIF2α, отличную от PKR, для образования avSG.
NS1 IAV представляет собой многофункциональный белок, который ингибирует различные факторы хозяина, включая PKR [40], [41], RIG-I [42], [43], и белок 25, содержащий трехчастный мотив (TRIM25), который, как известно, регулирует Активация RIG-I [44], и потенциально секвестрирует вирусную дцРНК через свой дцРНК-связывающий домен. Здесь мы продемонстрировали, что NS1 IAV заметно ингибирует avSG и активацию гена IFN. В соответствии с этим недавнее сообщение продемонстрировало, что образование IAV-индуцированного SG ингибируется NS1 дикого типа, но не мутантным NS1, в котором Arg38 и Arg41 заменены на Ala [41].Известно, что несколько классов вирусов ингибируют образование SG во время инфекции. Вирусы Западного Нила и Сендай кодируют РНК, которая взаимодействует с TIAR и ингибирует сборку SG [45], [46]. Протеаза полиовируса 3C расщепляет G3BP по Gln 326 в процессе инфицирования [22]. Более того, Simpon-Holley et al. недавно продемонстрировали, что белок E3L вируса осповакцины, предотвращающий активацию и фосфорилирование PKR eIF2á, и вирус осповакцины ÄE3L, лишенный генов E3L, создают гранулированную структуру, отличную от гранулы, называемой противовирусной гранулой (AVG) [47].Они также сообщили, что MEF, лишенные компонента AVG TIA-1, демонстрируют повышенную репликацию вируса осповакцины, что позволяет предположить, что AVG имеет решающее значение для противовирусных ответов хозяина. Эти результаты убедительно свидетельствуют о том, что вирусы приобретают средства для ингибирования образования avSG и последующей активации гена IFN.
Более того, Simpon-Holley et al. недавно продемонстрировали, что белок E3L вируса осповакцины, предотвращающий активацию и фосфорилирование PKR eIF2á, и вирус осповакцины ÄE3L, лишенный генов E3L, создают гранулированную структуру, отличную от гранулы, называемой противовирусной гранулой (AVG) [47].Они также сообщили, что MEF, лишенные компонента AVG TIA-1, демонстрируют повышенную репликацию вируса осповакцины, что позволяет предположить, что AVG имеет решающее значение для противовирусных ответов хозяина. Эти результаты убедительно свидетельствуют о том, что вирусы приобретают средства для ингибирования образования avSG и последующей активации гена IFN.
Канонический SG был предложен в качестве хранилища для остановленной трансляции мРНК хозяина в ответ на различные стрессы и возможного партнера с другим комплексом РНП, процессинговым телом, которое отвечает за деградацию мРНК [33].Следовательно, SG рассматривается как компартмент для динамической регуляции трансляции при стрессе окружающей среды. Наши результаты открывают новую роль недавно идентифицированного avSG как платформы для взаимодействия между вирусной РНК и противовирусными молекулами хозяина, чтобы запустить каскад событий, ведущих к уничтожению вируса. Хотя разница между SG и avSG до конца не изучена, будущие исследования позволят выявить механизм их сборки и биологические функции при стрессах и иммунных ответах.
Наши результаты открывают новую роль недавно идентифицированного avSG как платформы для взаимодействия между вирусной РНК и противовирусными молекулами хозяина, чтобы запустить каскад событий, ведущих к уничтожению вируса. Хотя разница между SG и avSG до конца не изучена, будущие исследования позволят выявить механизм их сборки и биологические функции при стрессах и иммунных ответах.
Материалы и методы
Культура клеток, трансфекция и вирусы
MEF от pkr + / + и — / — мышей были получены от доктора И-Ли Янга [26]. Клетки HeLa, 293T и HEC-1B [48], [49] поддерживали в среде Игла, модифицированной Дульбекко (DMEM), с FBS и пенициллин-стрептомицином (100 Ед / мл и 100 мкг / мл соответственно). Клеточная линия HeLa, стабильно экспрессирующая IPS-1 с тегом FLAG, была описана ранее [12]. Клетки 293T трансфицировали FuGENE6 (Roche) или Lipofectamine 2000 (Invitrogen).Аденовирус типа 12 (Ad12) dl203, предоставленный доктором К. Широки, и SINV размножались в клетках 293T и Vero соответственно. IAV (A / PR / 8/34 и ÄNS1), первоначально произведенные доктором А. Гарсия-Састре (Медицинская школа Маунт-Синай, США) и предоставленные доктором С. Акирой (Университет Осаки, Япония), были выращены в аллантоисные полости 9-дневных яиц с эмбрионами. Клетки обрабатывали культуральной средой («ложно обработанной») или инфицировали IAV, IAVÄNS1, SINV, EMCV или Ad12 dl203 в среде, не содержащей сыворотки и антибиотиков.После адсорбции в течение 1 ч при 37 ° C среду меняли и заражение продолжали в течение различных периодов в присутствии DMEM, содержащей сыворотку. Геномную РНК IAV экстрагировали из частично очищенного вирусного исходного материала с помощью TRIzol (Invitrogen) и 1,0 мкг вирусной РНК трансфицировали Lipofectamine RNAi MAX (Invitrogen) в чашке диаметром 35 мм. PolyI: C был приобретен в Amersham. Короткий полиI: C получали, как описано ранее [27].
IAV (A / PR / 8/34 и ÄNS1), первоначально произведенные доктором А. Гарсия-Састре (Медицинская школа Маунт-Синай, США) и предоставленные доктором С. Акирой (Университет Осаки, Япония), были выращены в аллантоисные полости 9-дневных яиц с эмбрионами. Клетки обрабатывали культуральной средой («ложно обработанной») или инфицировали IAV, IAVÄNS1, SINV, EMCV или Ad12 dl203 в среде, не содержащей сыворотки и антибиотиков.После адсорбции в течение 1 ч при 37 ° C среду меняли и заражение продолжали в течение различных периодов в присутствии DMEM, содержащей сыворотку. Геномную РНК IAV экстрагировали из частично очищенного вирусного исходного материала с помощью TRIzol (Invitrogen) и 1,0 мкг вирусной РНК трансфицировали Lipofectamine RNAi MAX (Invitrogen) в чашке диаметром 35 мм. PolyI: C был приобретен в Amersham. Короткий полиI: C получали, как описано ранее [27].
Иммуноблоттинг, антитела и реагенты
Приготовление клеточных экстрактов и иммуноблоттинг уже были описаны ранее [5], [50]. Поликлональные антитела, используемые для обнаружения IRF-3 человека в нативном PAGE, и поликлональные антитела против IRF-3 человека и мыши для иммуноокрашивания были описаны ранее [50]. Моноклональные антитела против NP гриппа (mAb61A5), которые были созданы доктором Y. Kikuchi (Университет Иваки Мейсей, Япония), были предоставлены доктором F. Momose (Университет Китасато, Япония) [51]. Моноклональные антитела против человеческого OAS (6-1) были предоставлены доктором Ю. Сокава (Киотский технологический институт, Япония). Антитела против человеческого RIG-I, против человеческого MDA5 и против человеческого LGP2 первоначально были получены путем иммунизации кроликов синтетическим пептидом, соответствующим аминокислотам 793–807 человеческого RIG-I, 145–160 человеческого MDA5 и 535–553 LGP2 человека соответственно.Как показано на рисунке S1, нокдаун эндогенного RIG-I с помощью shРНК специфически ингибирует гранулистое накопление RIG-I при иммуноокрашивании (рисунок S1A) и появление полосы, соответствующей эндогенному RIG-I при вестерн-блоттинге (рисунок S1B), что указывает на высокую специфичность антитела против RIG-I.
Поликлональные антитела, используемые для обнаружения IRF-3 человека в нативном PAGE, и поликлональные антитела против IRF-3 человека и мыши для иммуноокрашивания были описаны ранее [50]. Моноклональные антитела против NP гриппа (mAb61A5), которые были созданы доктором Y. Kikuchi (Университет Иваки Мейсей, Япония), были предоставлены доктором F. Momose (Университет Китасато, Япония) [51]. Моноклональные антитела против человеческого OAS (6-1) были предоставлены доктором Ю. Сокава (Киотский технологический институт, Япония). Антитела против человеческого RIG-I, против человеческого MDA5 и против человеческого LGP2 первоначально были получены путем иммунизации кроликов синтетическим пептидом, соответствующим аминокислотам 793–807 человеческого RIG-I, 145–160 человеческого MDA5 и 535–553 LGP2 человека соответственно.Как показано на рисунке S1, нокдаун эндогенного RIG-I с помощью shРНК специфически ингибирует гранулистое накопление RIG-I при иммуноокрашивании (рисунок S1A) и появление полосы, соответствующей эндогенному RIG-I при вестерн-блоттинге (рисунок S1B), что указывает на высокую специфичность антитела против RIG-I. Кроме того, аналогичная картина окрашивания была получена с моноклональным антителом к RIG-I человека, производимым Perseus Proteomics Inc, Япония. Другие антитела были получены из следующих источников: анти-G3BP (611126) от Transduction Laboratories ™, анти-IRF-3 (CBX00167) от COSMO BIO, анти-PKR (sc-6282), анти-РНКаза L (sc-22870) , анти-G3BP (sc-70283), анти-eIF3 (sc-16377), анти-c-myc (sc-40) и анти-TIAR (sc-1749) от Santa Cruz Biotechnology, anti-FLAG (M2) от Sigma, анти-фосфо-PKR (pT446) (1120-1) от Epitomics, анти-актин (MAB1501R) от CHEMICON International, анти-PMP70 (ab3421) от Abcam, анти-HA-Tag (6E2) и анти-фосфо- eIF2á (Ser51) (119A11) от Cell Signaling, и анти-HuR (RN004P, RIP-Certified Antibody) и анти-α-актин (PM053) от MBL.В качестве вторичных антител использовали конъюгированные с Alexa 488, 594 и 633 антитела против IgG мыши, кролика или козы, приобретенные у Invitrogen. К культуре клеток добавляли 0,5 мМ арсенита натрия (Sigma) на 1 час.
Кроме того, аналогичная картина окрашивания была получена с моноклональным антителом к RIG-I человека, производимым Perseus Proteomics Inc, Япония. Другие антитела были получены из следующих источников: анти-G3BP (611126) от Transduction Laboratories ™, анти-IRF-3 (CBX00167) от COSMO BIO, анти-PKR (sc-6282), анти-РНКаза L (sc-22870) , анти-G3BP (sc-70283), анти-eIF3 (sc-16377), анти-c-myc (sc-40) и анти-TIAR (sc-1749) от Santa Cruz Biotechnology, anti-FLAG (M2) от Sigma, анти-фосфо-PKR (pT446) (1120-1) от Epitomics, анти-актин (MAB1501R) от CHEMICON International, анти-PMP70 (ab3421) от Abcam, анти-HA-Tag (6E2) и анти-фосфо- eIF2á (Ser51) (119A11) от Cell Signaling, и анти-HuR (RN004P, RIP-Certified Antibody) и анти-α-актин (PM053) от MBL.В качестве вторичных антител использовали конъюгированные с Alexa 488, 594 и 633 антитела против IgG мыши, кролика или козы, приобретенные у Invitrogen. К культуре клеток добавляли 0,5 мМ арсенита натрия (Sigma) на 1 час.
Конструкций плазмид
p-125 Luc, pEF-BOS-FLAG-IPS-1, pCAGGS-myc, pCAGGS-myc-NS1, pCAGGS-myc-NS1 (аминокислоты 1–80), pCAGGS-myc-NS1 (аминокислоты 81– 230) плазмиды были описаны ранее [42], [48], [52]. кДНК для PKR человека была получена от Dr.A. Hovanessian (Парижский университет, Франция) и pEF-BOS-HA-PKR и pEF-BOS-HA-IPS1 были получены субклонированием кДНК в вектор pEF-BOS соответственно. pSUPER, pCMVÄR8.91, pMDG и pRDI292 были предоставлены доктором Д. Троно (Федеративная политехническая школа Лозанны, Швейцария) [53] — [56].
кДНК для PKR человека была получена от Dr.A. Hovanessian (Парижский университет, Франция) и pEF-BOS-HA-PKR и pEF-BOS-HA-IPS1 были получены субклонированием кДНК в вектор pEF-BOS соответственно. pSUPER, pCMVÄR8.91, pMDG и pRDI292 были предоставлены доктором Д. Троно (Федеративная политехническая школа Лозанны, Швейцария) [53] — [56].
Анализ репортера люциферазы
Систему анализа репортерной двойной люциферазы (Promega) использовали в соответствии с инструкциями производителя для анализов люциферазы. В качестве внутреннего контроля использовали люциферазную конструкцию Renilla pRL-TK (Promega).
Иммунофлуоресцентная микроскопия
Клетки фиксировали 4% параформальдегидом (PFA) в течение 20 мин при 4 ° C, проницаемость 0,05% Triton X-100 в PBS в течение 5 мин при комнатной температуре (RT), блокировали 5 мг / мл BSA в PBST (0,04 % Tween20 в PBS) в течение 30 мин и инкубировали с соответствующими первичными антителами, разведенными в блокирующем буфере, в течение ночи при 4 ° C. Затем клетки инкубировали со вторичными антителами в течение 1 ч при комнатной температуре. Ядра окрашивали 4,6-димайдино-2-фенилинодолом (DAPI) и анализировали с помощью конфокального лазерного микроскопа LSM 510-V4.2 (Carl Zeiss) или TCS-SP (Leica). Процент клеток, содержащих avSG, был рассчитан более чем в 5 случайно выбранных полях для каждого слайда.
Затем клетки инкубировали со вторичными антителами в течение 1 ч при комнатной температуре. Ядра окрашивали 4,6-димайдино-2-фенилинодолом (DAPI) и анализировали с помощью конфокального лазерного микроскопа LSM 510-V4.2 (Carl Zeiss) или TCS-SP (Leica). Процент клеток, содержащих avSG, был рассчитан более чем в 5 случайно выбранных полях для каждого слайда.
Количественная ПЦР с обратной транскрипцией
Тотальную РНК получали с помощью реагента TRIzol (Invitrogen), обрабатывали ДНКазой I (Roche Applied Science) и амплифицировали с помощью ПЦР с обратной транскрипцией с системой определения последовательности ABI PRISM 7700 (Applied Biosystems). Для синтеза кДНК использовали реагенты обратной транскрипции TaqMan (Applied Biosystems).Мы использовали коммерческие наборы TaqMan Universal PCR Master Mix и TaqMan праймер-зонды (Applied Biosystems) для человеческого и мышиного IFN-α. В качестве внутреннего контроля для методов сравнительного порогового цикла использовали набор праймер-зонд для 18 s рРНК эукариот (Applied Biosystems). Результаты были нормированы на обилие внутреннего контроля. Для обнаружения РНК IAV и глицеральдегид-3-фосфатдегидрогеназы (GAPDH) мы использовали специальные наборы праймеров и амплифицировали с Ex Taq HS (Takara). РНК IAV: 5 ¢ — ATTTGCAACACTACAGGGGC-3 ¢ (прямая) и 5 ¢ -GACTGACGAAAGGAATCCCA-3 (обратная).МРНК GAPDH:
5 ¢ — GAGTCAACGGATTTGGTCGT-3 ¢ (вперед) и
5 ¢ — TTGATTTTGGAGGGATCTCG-3 ¢ (реверс).
Коиммунопреципитация
Антитело RIG-I было перекрестно сшито с белком G Dynabeads (Invitrogen) в соответствии с протоколом производителя. Лизат клеток инкубировали с антителом против RIG-I -Dynabeads в течение 120 мин при комнатной температуре. Иммунопреципитированные комплексы RIG-I элюировали кипячением в загрузочном буфере и затем обрабатывали для вестерн-блоттинга.
РНК-интерференция
Использовали систему экспрессии лентивирусной shRNA.Первоначально были сконструированы RIG-I shRNA № 1 и RIG-I shRNA № 2. Олигонуклеотиды со следующими смысловыми и антисмысловыми последовательностями использовали для конструирования лентивирусного вектора, кодирующего малую шпилечную РНК (кшРНК). РИГ-И шРНК №1; 5 ¢ -GATCCCCGAGGTGCAGTATATTCAGGTT CAAGAGACCTGAATATACTGCACCTCTTTTTGGAAA-3 ¢ (смысл) и 5 ¢ -AGCTT T TCCAAAAAGAGGTGCAGTATATTCAGGTCTCTTGAACCTGAATATGACTG CACC РИГ-И шРНК №2; 5 ¢ -GATCCCCGAATTTAAAACCA GAATTATCTTCAAGAGAGATAATTCTGGTTTTAAATTCTTTTTTGGAAA-3 ¢ (смысл) и 5 ¢ -AGCTTTTCCAAAAAGAATTTAAAACCAGTAATTATCTCTC TTGAAGATAGATTCTG ¢GAGATAGATTCTG.Описанные выше олигонуклеотиды были отожжены и субклонированы в сайт Bgl II-Hind III pSUPER. Для конструирования pLV-shRNA против RIG-I фрагменты BamHI-SalI, вырезанные из pSUPER-RIG-I # 1 и pSUPER-RIG-I # 2, субклонировали в сайт BamHI-SalI pRDI292. Рекомбинантные лентивирусы получали трансфекцией пустого лентивирусного вектора или соответствующей конструкции shRNA вместе с упаковывающей конструкцией pCMVÄR8.91 и обволакивающей плазмидой pMDG. Через 48 часов супернатант культуры собирали и среду фильтровали с 0.45 мкм фильтр переносили на клетки HeLa. Через 72 часа клетки отбирали средой, содержащей 2 мкг / мл пуромицина (Sigma). Отрицательный контроль миРНК и миРНК, нацеленные на PKR и G3BP, были приобретены у Invitrogen. Каждую siRNA трансфицировали Lipofectamine RNAi MAX (Invitrogen) в соответствии с инструкциями производителя. Через 48 часов после трансфекции клетки собирали, инфицировали IAVÄNS1 и затем подвергали ПЦР в реальном времени, иммунофлуоресцентным анализам или SDS-PAGE с последующим иммуноблоттингом.
Флуоресцентная гибридизация in situ (FISH
) Анализ АнализFISH был описан ранее [57]. Вкратце, после иммунофлуоресцентных анализов клетки фиксировали в 4% PFA в течение 10 минут и пермеаблизировали на льду с 0,5% Triton X-100 в PBS в течение 5 минут. После депротеинизации протеиназой К клетки повторно фиксировали в 4% PFA в течение 10 мин, а затем подвергали ступенчатой дегидратации в этаноле. Высушенные покровные стекла инкубировали с меченной биотином РНК-зондом в течение 12 ч при 37 ° C.После гибридизации клетки промывали и инкубировали с авидин-FITC в течение 30 мин при 37 ° C. Ядра окрашивали ТО-ПРО-3 и исследовали с помощью конфокального лазерного сканирующего микроскопа.
Иммуноферментный анализ (ELISA
)Супернатанты культур собирали и подвергали ELISA с использованием набора мышиного IFN-α (источник интерферона PBL) в соответствии с инструкциями производителей.
Дополнительная информация
Рисунок S1.
Антитело против RIG-I специфически распознает эндогенный человеческий RIG-I. Клетки HeLa инфицировали контрольным лентивирусом или двумя лентивирусами, кодирующими различные кшРНК, специфичные для RIG-I (№1 и №2), в течение 72 часов. (A) Клетки обрабатывали NaAsO 2 в течение 1 часа и окрашивали на RIG-I и G3BP. NaAsO 2 вызывает спекл-подобную локализацию RIG-I и G3BP. (B) Клетки обрабатывали IFN-α человека в течение 12 часов. Клеточные экстракты получали и подвергали SDS-PAGE и иммуноблоттингу с использованием антител против RIG-I, MDA5 и α-актина.Сигналы RIG-I были ослаблены нокдауном RIG-I.
https://doi.org/10.1371/journal.pone.0043031.s001
(TIF)
Рисунок S2.
N-концевой области NS1 достаточно, чтобы блокировать агрегацию RIG-I и противовирусные сигналы. (A) Клетки 293T трансфицировали пустым вектором (пустым), меченным myc NS1 (myc-NS1 (Full)), N-концевым NS1 (1–80) или C-концевым NS1 (81–230) на 48 ч. Клетки обрабатывали имитатором (имитатором) или инфицировали IAVÄNS1 в течение 9 ч и окрашивали на RIG-I и NS1 (myc).Процент клеток с индуцированным IAVÄNS1 спеклом RIG-I составлял 0,0%, 2,3%, 43,1% для клеток, экспрессирующих NS1, NS1 (1–80) и NS1 (81–230), соответственно. (B) Клетки 293T временно трансфицировали репортерными плазмидами, содержащими природный промотор IFN-α вместе с указанными векторами, экспрессирующими NS1. Трансфицированные клетки обрабатывали имитатором или инфицировали IAVÄNS1 в течение 12 ч и подвергали двойному люциферазному анализу. Данные представлены в виде среднего стандартного значения ± ошибка среднего (SEM).
https: // doi.org / 10.1371 / journal.pone.0043031.s002
(TIF)
Рисунок S3.
Локализация вирусной РНК в IAV-инфицированных клетках. (A и B) клеток HeLa ложно обрабатывали или инфицировали IAV в течение 12 часов. Вирусная РНК (вРНК) была обнаружена методом FISH с использованием РНК-зонда, комплементарного сегменту 1 IAV, и NP (A) и RIG-I (B) были обнаружены с использованием анти-NP и анти-RIG-I. антитела. TO-PRO-3 использовали для окрашивания ядерной ДНК (ДНК). Вирусные РНК и НЧ не образовывали очагов.
https://doi.org/10.1371/journal.pone.0043031.s003
(TIF)
Рисунок S4.
IPS-1 скопился в непосредственной близости от очагов RIG-I. клеток HeLa, стабильно экспрессирующих IPS-1 с тегом FLAG, подвергали ложной обработке или инфицировали IAV или IAVÄNS1 в течение 10 часов. Клетки окрашивали антителами против FLAG и RIG-I и DAPI. Объединенные изображения FLAG и RIG-I увеличены на нижней панели. Белыми стрелками обозначены контакты RIG-I / IPS-1. Эти контакты наблюдались у 74 человек.2% и 1,8% клеток, инфицированных IAVÄNS1 и IAV, соответственно.
https://doi.org/10.1371/journal.pone.0043031.s004
(TIF)
Рисунок S5.
Образование avSG не является следствием активации гена IFN. (A) Клетки 293T трансфицировали пустым вектором или вектором экспрессии для IPS-1 (HA-IPS-1) в течение 24 часов. Клетки окрашивали на IRF-3, HA-tag и TIAR. Ядерный IRF-3 наблюдался почти во всех экспрессирующих IPS-1 клетках (95,5%), однако эти клетки демонстрировали небольшие очаги TIAR (3.0%). (B) Клетки HEC-1B, дефицитные по рецептору IFN типа I, подвергали ложной обработке, инфицировали IAVÄNS1 в течение 9 часов или обрабатывали NaAsO 2 в течение 1 часа, как указано. Клетки окрашивали на RIG-I и G3BP. SG и avSG наблюдались в клетках HEC-1B (% колокализации 98,4% и 92,9% для IAVÄNS1 и NaAsO 2 соответственно). Увеличенные изображения соответствуют областям в рамке. (C) Клетки HeLa были ложно обработаны или инфицированы SINV, EMCV или Ad12 dl203 в течение 9 часов, зафиксированы и окрашены на RIG-I и G3BP, как указано (% совместной локализации: 99.2%, 98,4% и 98,2% соответственно). Увеличенные изображения соответствуют областям в рамке.
https://doi.org/10.1371/journal.pone.0043031.s005
(TIF)
Рисунок S6.
IAV-индуцированное образование avSG ингибировалось в клетках с нокдауном PKR. (A – E) Клетки HeLa трансфицировали контрольной миРНК (N.C) или миРНК, нацеленной на три независимые части мРНК PKR человека (№13). (A) Через 48 часов после трансфекции клетки собирали и определяли PKR и актин с помощью вестерн-блоттинга. (B – E) Через 48 часов после трансфекции клетки обрабатывали имитатором (пустая полоса) или инфицировали IAVÄNS1 (закрашенная полоса) в течение 9 часов. Уровень мРНК IFN-α определяли с помощью qPCR (B) . Иммуноокрашивание клеток HeLa, трансфицированных контрольной (N.C) или PKR-целевой (PKR) siRNA, после имитационной обработки или заражения IAVÄNS1 (C) . Клетки также исследовали путем окрашивания на очаги RIG-I (D) , TIAR (E) после 12 часов инфицирования. Указано процентное содержание клеток, содержащих соответствующие очаги.Данные представлены в виде среднего стандартного значения ± ошибка среднего (SEM).
https://doi.org/10.1371/journal.pone.0043031.s006
(TIF)
Рисунок S7.
Общая РНК из IAV-инфицированных клеток, но не из неинфицированных клеток, индуцирует образование avSG и активацию гена IFN-â. (A и B) MEF дикого типа подвергали ложной обработке (без РНК) или трансфицировали тотальной РНК, экстрагированной из неинфицированных MEF (MEF RNA) или из инфицированных IAV клеток в течение 12 часов (РНК MEF, инфицированная IAV). Клетки окрашивали на RIG-I и G3BP (% образования avSG 0.0%, 4,0% и 21,4% для отсутствия РНК, РНК MEF и РНК MEF, инфицированной IAV, соответственно) (A) . Увеличенные изображения соответствуют областям в рамке. Уровни эндогенного IFN-α мРНК определяли с помощью qPCR (B) . Данные представлены в виде среднего стандартного значения ± ошибка среднего (SEM).
https://doi.org/10.1371/journal.pone.0043031.s007
(TIF)
Благодарности
Мы благодарим Р. Кагеяму за предоставление конфокального микроскопа для этого исследования, Ф.Momose и Y. Kikuchi для антитела против IAV NP и Y. Sokawa для антитела против OAS.
Вклад авторов
Задумал и разработал эксперименты: KO MY TF. Проведены эксперименты: KO MJ JY RN SM AT AK SO TM. Проанализированы данные: KO KN HN MY TF. Внесенные реагенты / материалы / инструменты анализа: SS. Написал бумагу: KO MY TF.
Ссылки
- 1. Samuel CE (2001) Противовирусное действие интерферонов. Clin Microbiol Rev 14: 778–809, содержание.
- 2. Witte K, Witte E, Sabat R, Wolk K (2010) IL-28A, IL-28B и IL-29: многообещающие цитокины с интерфероноподобными свойствами типа I. Фактор роста цитокинов Rev 21: 237–251.
- 3. Gale M Jr, Katze MG (1998) Молекулярные механизмы устойчивости к интерферону, опосредованные вирусным ингибированием PKR, индуцированной интерфероном протеинкиназы. Pharmacol Ther 78: 29–46.
- 4. Rubinstein S, Familletti PC, Pestka S (1981) Удобный анализ интерферонов.J Virol 37: 755–758.
- 5. Ёнеяма М., Кикучи М., Нацукава Т., Синобу Н., Имаидзуми Т. и др. (2004) РНК-геликаза RIG-I выполняет важную функцию в индуцированных двухцепочечной РНК врожденных противовирусных реакциях. Nat Immunol 5: 730–737.
- 6. Като Х., Такеучи О, Сато С., Йонеяма М., Ямамото М. и др. (2006) Различная роль геликаз MDA5 и RIG-I в распознавании РНК-вирусов. Природа 441: 101–105.
- 7. Йонеяма М., Кикучи М., Мацумото К., Имаидзуми Т., Миягиши М. и др.(2005) Общие и уникальные функции DExD / H-box геликаз RIG-I, MDA5 и LGP2 в противовирусном врожденном иммунитете. J Immunol 175: 2851–2858.
- 8. Хорнунг В., Эллегаст Дж, Ким С., Брзозка К., Юнг А. и др. (2006) 5′-Трифосфатная РНК является лигандом для RIG-I. Наука 314: 994–997.
- 9. Пихлмайр А., Шульц О., Тан С. П., Наслунд Т. И., Лильестром П. и др. (2006) RIG-I-опосредованные противовирусные ответы на одноцепочечную РНК, несущую 5′-фосфаты. Наука 314: 997–1001.
- 10. Расмуссен С.Б., Йенсен С.Б., Нильсен С., Куартин Э., Като Н. и др. (2009) Инфекция, вызванная вирусом простого герпеса, определяется как Toll-подобными рецепторами, так и геноподобными рецепторами, индуцируемыми ретиноевой кислотой, которые синергически индуцируют продукцию интерферона I типа. J Gen Virol 90: 74–78.
- 11. Samanta M, Iwakiri D, Kanda T., Imaizumi T, Takada K (2006) РНК, кодируемые вирусом EB, распознаются RIG-I и активируют передачу сигналов, чтобы индуцировать IFN типа I. EMBO J 25: 4207–4214.
- 12.Оногути К., Ономото К., Такамацу С., Джоги М., Такемура А. и др. (2010) Вирусная инфекция или 5’ppp-РНК активирует противовирусный сигнал за счет перераспределения IPS-1, опосредованного MFN1. PLoS Pathog 6: e1001012.
- 13. Hale BG, Randall RE, Ortin J, Jackson D (2008) Многофункциональный белок NS1 вирусов гриппа А. J Gen Virol 89: 2359–2376.
- 14. Портела А., Дигард П. (2002) Нуклеопротеин вируса гриппа: многофункциональный РНК-связывающий белок, имеющий ключевое значение для репликации вируса.J Gen Virol 83: 723–734.
- 15. Бучан Дж. Р., Паркер Р. (2009) Гранулы эукариотического стресса: тонкости перевода. Mol Cell 36: 932–941.
- 16. Хоу Ф, Сун Л., Чжэн Х, Скауг Б., Цзян QX и др. (2011) MAVS формирует функциональные прионоподобные агрегаты для активации и распространения противовирусного врожденного иммунного ответа. Ячейка 146: 448–461.
- 17. Xu LG, Wang YY, Han KJ, Li LY, Zhai Z и др. (2005) VISA представляет собой адаптерный белок, необходимый для инициируемой вирусом передачи сигналов IFN-бета.Mol Cell 19: 727–740.
- 18. Сет RB, Sun L, Ea CK, Chen ZJ (2005) Идентификация и характеристика MAVS, митохондриального антивирусного сигнального белка, который активирует NF-kappaB и IRF 3. Cell 122: 669–682.
- 19. Каваи Т., Такахаши К., Сато С., Кобан С., Кумар Х. и др. (2005) IPS-1, адаптер, запускающий индукцию интерферона I типа, опосредованную RIG-I и Mda5. Nat Immunol 6: 981–988.
- 20. Мейлан Э., Курран Дж., Хофманн К., Морадпур Д., Биндер М. и др.(2005) Cardif — это адаптерный белок в антивирусном пути RIG-I, на который нацелен вирус гепатита С. Природа 437: 1167–1172.
- 21. Dixit E, Boulant S, Zhang Y, Lee AS, Odendall C и др. (2010) Пероксисомы являются сигнальными платформами для противовирусного врожденного иммунитета. Ячейка 141: 668–681.
- 22. White JP, Cardenas AM, Marissen WE, Lloyd RE (2007) Ингибирование образования цитоплазматических стрессовых гранул мРНК вирусной протеиназой. Клеточный микроб-хозяин 2: 295–305.
- 23.Nallagatla SR, Hwang J, Toroney R, Zheng X, Cameron CE и др. (2007) 5′-трифосфат-зависимая активация PKR РНК с короткими стержневыми петлями. Наука 318: 1455–1458.
- 24. Баум А., Сачиданандам Р., Гарсия-Састре А. (2010). Предпочтение RIG-I коротким вирусным молекулам РНК в инфицированных клетках выявлено с помощью секвенирования следующего поколения. Proc Natl Acad Sci U S A 107: 16303–16308.
- 25. Rehwinkel J, Tan CP, Goubau D, Schulz O, Pichlmair A, et al.(2010) RIG-I обнаруживает вирусную геномную РНК во время инфицирования вирусом РНК с отрицательной цепью. Cell 140: 397–408.
- 26. Ян Ю.Л., Рейс Л.Ф., Павлович Дж., Агуцци А., Шафер Р. и др. (1995) Недостаточная передача сигналов у мышей, лишенных двухцепочечной РНК-зависимой протеинкиназы. EMBO J 14: 6095–6106.
- 27. Като Х, Такеучи О, Микамо-Сато Э, Хираи Р., Каваи Т. и др. (2008) Зависимое от длины распознавание двухцепочечных рибонуклеиновых кислот индуцируемым ретиноевой кислотой геном-I и геном 5, связанным с дифференцировкой меланомы.J Exp Med 205: 1601–1610.
- 28. Йонеяма М., Фудзита Т. (2010) Распознавание вирусных нуклеиновых кислот при врожденном иммунитете. Rev Med Virol 20: 4–22.
- 29. Malathi K, Dong B, Gale M Jr, Silverman RH (2007) Малая собственная РНК, генерируемая РНКазой L, усиливает противовирусный врожденный иммунитет. Природа 448: 816–819.
- 30. Берланга Дж. Дж., Вентосо И., Хардинг Х. П., Дэн Дж., Рон Д. и др. (2006) Противовирусный эффект фактора инициации трансляции 2-альфа-киназы млекопитающих GCN2 против РНК-вирусов.EMBO J 25: 1730–1740.
- 31. Оуда Р., Ономото К., Такахаси К., Эдвардс М.Р., Като Х. и др. (2011) Ген I-индуцируемый ретиноевой кислотой miR-23b подавляет инфекции, вызываемые риновирусами минорной группы, посредством подавления рецептора липопротеинов очень низкой плотности. J Biol Chem 286: 26210–26219.
- 32. Сайто Т., Хираи Р., Лоо Ю.М., Оуэн Д., Джонсон С.Л. и др. (2007) Регулирование врожденной противовирусной защиты через общий репрессорный домен в RIG-I и LGP2. Proc Natl Acad Sci U S A 104: 582–587.
- 33. Кедерша Н., Андерсон П. (2007) Гранулы стресса млекопитающих и обрабатывающие тела. Методы Enzymol 431: 61–81.
- 34. Дибольд СС, Монтойя М., Унгер Х., Алексопулу Л., Рой П. и др. (2003) Вирусная инфекция превращает дендритные клетки, не являющиеся плазмацитоидными, на продуценты интерферона с высоким содержанием. Природа 424: 324–328.
- 35. Gilfoy FD, Mason PW (2007) Продукция интерферона, индуцированная вирусом Западного Нила, опосредуется двухцепочечной РНК-зависимой протеинкиназой PKR.J Virol 81: 11148–11158.
- 36. McAllister CS, Samuel CE (2009) РНК-активированная протеинкиназа усиливает индукцию бета-интерферона и апоптоз, опосредованный цитоплазматическими РНК-сенсорами. J Biol Chem 284: 1644–1651.
- 37. Carpentier PA, Williams BR, Miller SD (2007) Различная роль протеинкиназы R и toll-подобного рецептора 3 в активации астроцитов вирусными стимулами. Glia 55: 239–252.
- 38. Барри Дж., Брейквелл Л., Фрагкудис Р., Аттарзаде-Язди Дж., Родригес-Андрес Дж. И др.(2009) PKR действует на ранней стадии заражения, подавляя продукцию вируса леса Семлики и сильно усиливая реакцию интерферона типа I. J Gen Virol 90: 1382–1391.
- 39. Schulz O, Pichlmair A, Rehwinkel J, Rogers NC, Scheuner D, et al. (2010) Протеинкиназа R способствует иммунитету против определенных вирусов, регулируя целостность мРНК интерферона. Клеточный микроб-хозяин 7: 354–361.
- 40. Min JY, Li S, Sen GC, Krug RM (2007) Сайт на белке NS1 вируса гриппа A опосредует как ингибирование активации PKR, так и временную регуляцию синтеза вирусной РНК.Вирусология 363: 236–243.
- 41. Хаперский Д.А., Хэтчетт Т.Ф., Маккормик С. (2011) Вирус гриппа А ингибирует образование гранул цитоплазматического стресса. FASEB J.
- 42. Guo Z, Chen LM, Zeng H, Gomez JA, Plowden J, et al. (2007) Белок NS1 вируса гриппа А подавляет функцию внутрицитоплазматического сенсора патогена, RIG-I. Am J Respir Cell Mol Biol 36: 263–269.
- 43. Mibayashi M, Martinez-Sobrido L, Loo YM, Cardenas WB, Gale M Jr и др.(2007) Ингибирование индуцируемой ретиноевой кислотой гена I-опосредованной индукции бета-интерферона белком NS1 вируса гриппа А. Дж. Вирол 81: 514–524.
- 44. Гак М.Ю., Альбрехт Р.А., Урано Т., Инн К.С., Хуанг И.С. и др. (2009) Вирус гриппа А NS1 нацелен на убиквитинлигазу TRIM25, чтобы избежать распознавания вирусным РНК-сенсором хозяина RIG-I. Клеточный микроб-хозяин 5: 439–449.
- 45. Ли В., Ли Й, Кедерша Н., Андерсон П., Эмара М. и др. (2002) Клеточные белки TIA-1 и TIAR взаимодействуют с 3′-стволовой петлей комплементарной минус-цепи РНК вируса Западного Нила и способствуют репликации вируса.J Virol 76: 11989–12000.
- 46. Исени Ф., Гарсин Д., Нишио М., Кедерша Н., Андерсон П. и др. (2002) Конечная РНК вируса Сендай связывает TIAR, клеточный белок, участвующий в индуцированном вирусом апоптозе. EMBO J 21: 5141–5150.
- 47. Симпсон-Холли М., Кедерша Н., Дауэр К., Рубинс К. Х., Андерсон П. и др. (2010) Образование противовирусных цитоплазматических гранул при ортопоксвирусной инфекции. J Virol 85: 1581–1593.
- 48. Йонеяма М., Сухара В., Фукухара Ю., Фукуда М., Нишида Е. и др.(1998) Прямой запуск системы интерферона типа I вирусной инфекцией: активация комплекса факторов транскрипции, содержащего IRF-3 и CBP / p300. EMBO J 17: 1087–1095.
- 49. Daly C, Reich NC (1993) Двухцепочечная РНК активирует новые факторы, которые связываются с элементом ответа, стимулированным интерфероном. Mol Cell Biol 13: 3756–3764.
- 50. Ивамура Т., Йонеяма М., Ямагути К., Сухара В., Мори В. и др. (2001) Индукция киназы IRF-3 / -7 и NF-kappaB в ответ на двухцепочечную РНК и вирусную инфекцию: общие и уникальные пути.Гены клеток 6: 375–388.
- 51. Momose F, Kikuchi Y, Komase K, Morikawa Y (2007) Визуализация опосредованного микротрубочками транспорта рибонуклеопротеина потомства вируса гриппа. Микробы заражают 9: 1422–1433.
- 52. Оногучи К., Йонеяма М., Такемура А., Акира С., Танигучи Т. и др. (2007) Вирусные инфекции активируют гены интерферона I и III типов посредством общего механизма. J Biol Chem 282: 7576–7581.
- 53. Brummelkamp TR, Bernards R, Agami R (2002) Система для стабильной экспрессии коротких интерферирующих РНК в клетках млекопитающих.Наука 296: 550–553.
- 54. Налдини Л., Бломер Ю., Галлай П., Ори Д., Маллиган Р. и др. (1996) Доставка гена in vivo и стабильная трансдукция неделящихся клеток лентивирусным вектором. Наука 272: 263–267.
- 55. Zufferey R, Nagy D, Mandel RJ, Naldini L, Trono D (1997) Множественно аттенуированный лентивирусный вектор обеспечивает эффективную доставку гена in vivo. Nat Biotechnol 15: 871–875.
- 56. Bridge AJ, Pebernard S, Ducraux A, Nicoulaz AL, Iggo R (2003) Индукция интерферонового ответа векторами РНКи в клетках млекопитающих.Нат Генет 34: 263–264.
- 57. Джо С., Кавагути А., Такидзава Н., Морикава Ю., Момосе Ф. и др. (2010) Участие системы везикулярного транспорта в мембранном нацеливании на геном потомства вируса гриппа. Микробы заражают 12: 1079–1084.
РНКаза L усиливает передачу сигналов интерферона, индуцируя PKR-опосредованные антивирусные стрессовые гранулы
РЕЗЮМЕ
Вирусная инфекция приводит к активации индуцированной интерфероном эндорибонуклеазы, РНКазы L, что приводит к деградации вирусных и клеточных РНК.Как клеточные, так и вирусные продукты расщепления РНК РНКазой L связывают рецепторы распознавания паттернов (PRR), такие как индуцируемый ретиноевой кислотой I (Rig-I) и / или белок 5, связанный с дифференцировкой меланомы (MDA5), для дальнейшего усиления продукции интерферона (IFN) и противовирусного ответа . Хотя многое известно о механике связывания лиганда и активации PRR, остается неясным, как клетки координируют восприятие РНК с сигнальным ответом и продукцией интерферона. Мы показываем, что продукты расщепления РНК активности РНКазы L вызывают образование антивирусных стрессовых гранул (avSG), регулируя активацию двухцепочечной РНК (dsRNA) -зависимой протеинкиназы R (PKR), и привлекают противовирусные белки Rig-I, PKR, OAS. и РНКаза L в avSG.Биохимический анализ очищенного avSG показал взаимодействие ключевого белка стрессовых гранул, G3BP1, только с PKR и Rig-I, но не с OAS или РНКазой L. Сборка AvSG во время активации РНКазы L необходима для IRF3-опосредованной продукции IFN, а не для передачи сигналов IFN или провоспалительных процессов. индукция цитокинов. Следовательно, клетки, лишенные образования avSG или передачи сигналов РНКазы L, продуцируют меньше IFN и проявляют более высокую чувствительность во время заражения вирусом Сендай, демонстрируя важность avSG в опосредованной РНКазой L защите хозяина.Во время вирусной инфекции мы предлагаем роль РНК, расщепленных РНКазой L, в индукции avSG, содержащих противовирусные белки, чтобы обеспечить платформу для эффективного взаимодействия лигандов РНК с рецепторами распознавания образов для усиления продукции IFN для эффективного усиления противовирусного ответа.
ВАЖНОСТЬ Двухцепочечные РНК, образующиеся во время вирусных инфекций, служат в качестве патоген-ассоциированных молекулярных паттернов (PAMP) и связывают рецепторы распознавания паттернов, чтобы стимулировать выработку IFN. РНКаза L представляет собой IFN-регулируемую эндорибонуклеазу, которая активируется в инфицированных вирусом клетках и расщепляет одноцепочечные вирусные и клеточные РНК.Расщепленные РНКазой L дцРНК передают сигнал Rig-подобным геликазам для усиления продукции IFN. Это исследование определяет новую роль антивирусных стрессовых гранул, индуцированных РНКазой L, в качестве антивирусного сигнального хаба для координации лигандов РНК с родственными рецепторами для создания эффективного ответа хозяина во время вирусных инфекций.
Вирусная регуляция гранул РНК в инфицированных клетках
Abrahamyan LG, Chatel-Chaix L, Ajamian L, Milev MP, Monette A, Clement JF, Song R, Lehmann M, DesGroseillers L, Laughrea M, Boccaccio G, Mouland AJ (2010) Новые рибонуклеопротеины Staufen1 предотвращают образование стрессовых гранул, но способствуют инкапсидации геномной РНК ВИЧ-1.J Cell Sci 123: 369–383
Статья CAS PubMed Google ученый
Андерсон П., Кедерша Н. (2008) Стресс-гранулы: Дао сортировки РНК. Trends Biochem Sci 33: 141–150
Статья CAS PubMed Google ученый
Андерсон П., Кедерша Н. (2009) Гранулы РНК: посттранскрипционные и эпигенетические модуляторы экспрессии генов. Nat Rev Mol Cell Biol 10: 430–436
Статья CAS PubMed Google ученый
Андерсон П., Кедерша Н., Иванов П. (2015) Стресс-гранулы, П-тела и рак.Biochim Biophys Acta 1849: 861–870
Статья CAS PubMed Google ученый
Андрей MA, Ingelfinger D, Heintzmann R, Achsel T, Rivera-Pomar R, Luhrmann R (2005) Роль eIF4E и eIF4E-транспортера в нацеливании мРНП на процессинговые тела млекопитающих. РНК 11: 717–727
Статья CAS PubMed PubMed Central Google ученый
Aqil M, Naqvi AR, Bano AS, Jameel S (2013) Белок Nef ВИЧ-1 связывается с аргонавтом-2 и действует как вирусный супрессор РНК-интерференции.PLoS ONE 8: e74472
Артикул CAS PubMed PubMed Central Google ученый
Ariumi Y, Kuroki M, Kushima Y, Osugi K, Hijikata M, Maki M, Ikeda M, Kato N (2011) Вирус гепатита C захватывает Р-тела и компоненты стрессовых гранул вокруг липидных капель. J Virol 85: 6882–6892
Статья CAS PubMed PubMed Central Google ученый
Башкиров В.И., Scherthan H, Solinger JA, Buerstedde JM, Heyer WD (1997) Цитоплазматическая экзорибонуклеаза мыши (mXRN1p) с предпочтением субстратов тетраплекса G4.J Cell Biol 136: 761–773
Статья CAS PubMed PubMed Central Google ученый
Beckham CJ, Light HR, Nissan TA, Ahlquist P, Parker R, Noueiry A (2007) Взаимодействие между РНК вируса мозаики брома и тельцами цитоплазматической обработки. J Virol 81: 9759–9768
Статья CAS PubMed PubMed Central Google ученый
Берланга JJ, Ventoso I, Harding HP, Deng J, Ron D, Sonenberg N, Carrasco L, de Haro C (2006) Противовирусный эффект фактора инициации трансляции 2alpha киназы GCN2 млекопитающих против РНК-вирусов.EMBO J 25: 1730–1740
Артикул CAS PubMed PubMed Central Google ученый
Bhowmick R, Mukherjee A, Patra U, Chawla-Sarkar M (2015) Ротавирус разрушает цитоплазматические Р-тельца во время инфекции. Virus Res 210: 344–354
Статья CAS PubMed Google ученый
Bordeleau ME, Cencic R, Lindqvist L, Oberer M, Northcote P, Wagner G, Pelletier J (2006) Опосредованная РНК секвестрация РНК-геликазы eIF4A патеамином A ингибирует инициацию трансляции.Chem Biol 13: 1287–1295
Статья CAS PubMed Google ученый
Borghese F, Michiels T (2011) Лидерный белок кардиовирусов ингибирует сборку стрессовых гранул. J Virol 85: 9614–9622
Артикул CAS PubMed PubMed Central Google ученый
Бьюкен Дж. Р., Паркер Р. (2009) Гранулы эукариотического стресса: тонкости трансляции.Mol Cell 36: 932–941
Статья CAS PubMed PubMed Central Google ученый
Burdick R, Smith JL, Chaipan C, Friew Y, Chen J, Venkatachari NJ, Delviks-Frankenberry KA, Hu WS, Pathak VK (2010) P-ассоциированный с телом белок Mov10 подавляет репликацию ВИЧ-1 на нескольких этапах. J Virol 84: 10241–10253
Статья CAS PubMed PubMed Central Google ученый
Burgess HM, Richardson WA, Anderson RC, Salaun C, Graham SV, Gray NK (2011) Ядерная релокализация цитоплазматических поли (A) -связывающих белков PABP1 и PABP4 в ответ на УФ-облучение выявляет мРНК-зависимый экспорт метазоана PABPs.J Cell Sci 124: 3344–3355
Статья CAS PubMed PubMed Central Google ученый
Кэссиди К.А., Гросс М. (2002) Белок U (S) 11 вируса простого герпеса типа 1 взаимодействует с протеинкиназой R в инфицированных клетках и требует 30-аминокислотной последовательности, смежной с субстратным доменом киназы. J Virol 76: 2029–2035
Статья CAS PubMed PubMed Central Google ученый
Chahar HS, Chen S, Manjunath N (2013) Компоненты P-тела LSM1, GW182, DDX3, DDX6 и XRN1 рекрутируются в сайты репликации WNV и положительно регулируют репликацию вируса.Вирусология 436: 1–7
Статья CAS PubMed Google ученый
Chan SW, Egan PA (2005) Белки оболочки вируса гепатита C регулируют CHOP посредством индукции ответа развернутого белка. FASEB J 19: 1510–1512
Статья CAS PubMed Google ученый
Checkley MA, Nagashima K, Lockett SJ, Nyswaner KM, Garfinkel DJ (2010) Компоненты P-тела необходимы для ретротранспозиции Ty1 во время сборки ретротранспозиционно-компетентных вирусоподобных частиц.Mol Cell Biol 30: 382–398
Статья CAS PubMed Google ученый
Chen D, Wilkinson CR, Watt S, Penkett CJ, Toone WM, Jones N, Bahler J (2008) Множественные пути по-разному регулируют глобальные реакции на окислительный стресс у делящихся дрожжей. Mol Biol Cell 19: 308–317
Статья CAS PubMed PubMed Central Google ученый
Chen C, Ma X, Hu Q, Li X, Huang F, Zhang J, Pan T, Xia J, Liu C (2017) Вирус лейкемии Молони 10 (MOV10) ингибирует деградацию APOBEC3G через вмешательство в Vif -опосредованный убиквитин-протеасомный путь.Ретровирология 14:56
Статья CAS PubMed PubMed Central Google ученый
Clavarino G, Claudio N, Dalet A, Terawaki S, Couderc T, Chasson L, Ceppi M, Schmidt EK, Wenger T, Lecuit M, Gatti E, Pierre P (2012), субъединица белковой фосфатазы 1, регулируемая Ppp1r15a / GADD34 производство цитокинов в полиинозиновых: дендритных клетках, стимулированных полицитидиловой кислотой. Proc Natl Acad Sci U S A 109: 3006–3011
Статья PubMed PubMed Central Google ученый
Corcoran JA, Johnston BP, McCormick C (2015) Вирусная активация сигнальной оси MK2-hsp27-p115RhoGEF-RhoA вызывает перестройки цитоскелета, разрушение p-тел и стабилизацию ARE-мРНК.PLoS Pathog 11: e1004597
Артикул CAS PubMed PubMed Central Google ученый
Cuevas RA, Ghosh A, Wallerath C (2016) MOV10 обеспечивает противовирусную активность против РНК-вирусов путем усиления индукции RIG-I-MAVS-независимого IFN. J Immunol 196: 3877–3886
Статья CAS PubMed PubMed Central Google ученый
Dang Y, Kedersha N, Low WK, Romo D, Gorospe M, Kaufman R, Anderson P, Liu JO (2006) Эукариотический фактор инициации 2альфа-независимый путь индукции стрессовых гранул природным продуктом патеамином А.J Biol Chem 281: 32870–32878
Статья CAS PubMed Google ученый
Dauber B, Poon D, Dos Santos T, Duguay BA, Mehta N, Saffran HA, Smiley JR (2016) Белок отключения хозяина вириона вируса простого герпеса усиливает трансляцию истинных поздних мРНК вируса независимо от подавления протеинкиназы R и образование стрессовых гранул. J Virol 90: 6049–6057
Артикул CAS PubMed PubMed Central Google ученый
Decker CJ, Parker R (2012) P-тельца и стрессовые гранулы: возможные роли в контроле трансляции и деградации мРНК.Cold Spring Harb Perspect Biol 4: a012286
Статья CAS PubMed PubMed Central Google ученый
Deng J, Harding HP, Raught B, Gingras AC, Berlanga JJ, Scheuner D, Kaufman RJ, Ron D, Sonenberg N (2002) Активация GCN2 в УФ-облученных клетках ингибирует трансляцию. Curr Biol 12: 1279–1286
Статья CAS PubMed Google ученый
Dhillon P, Rao CD (2018) Ротавирус вызывает образование ремоделированных стрессовых гранул и Р-телец и их секвестрацию в вироплазме, что способствует производству потомства вируса.J Virol 92: e01363–18
CAS PubMed PubMed Central Google ученый
Dinh PX, Beura LK, Das PB, Panda D, Das A, Pattnaik AK (2013) Индукция стрессовых гранулоподобных структур в клетках, инфицированных вирусом везикулярного стоматита. J Virol 87: 372–383
Статья CAS PubMed PubMed Central Google ученый
Dougherty JD, White JP, Lloyd RE (2011) Опосредованное полиовирусом нарушение процессов обработки цитоплазмы тел.J Virol 85: 64–75
Статья CAS PubMed Google ученый
Durand S, Cougot N, Mahuteau-Betzer F, Nguyen CH, Grierson DS, Bertrand E, Tazi J, Lejeune F (2007) Ингибирование нонсенс-опосредованного распада мРНК (NMD) новой химической молекулой обнаруживает динамику факторов NMD в P-телах. J Cell Biol 178: 1145–1160
Статья CAS PubMed PubMed Central Google ученый
Elkayam E, Faehnle CR, Morales M, Sun J, Li H, Joshua-Tor L (2017) Многовалентный набор аргонавтов человека с помощью GW182.Mol Cell 67: 646–658.e643
Артикул CAS PubMed PubMed Central Google ученый
Эмара М.М., Бринтон М.А. (2007) Взаимодействие TIA-1 / TIAR с продуктами вируса Западного Нила и денге в инфицированных клетках мешает формированию стрессовых гранул и процессам сборки тела. Proc Natl Acad Sci U S A 104: 9041–9046
Статья CAS PubMed PubMed Central Google ученый
Eulalio A, Behm-Ansmant I, Schweizer D, Izaurralde E (2007) Образование P-телец является следствием, а не причиной РНК-опосредованного молчания генов.Mol Cell Biol 27: 3970–3981
Статья CAS PubMed PubMed Central Google ученый
Finnen RL, Pangka KR, Banfield BW (2012) Инфекция вируса простого герпеса 2 влияет на накопление стрессовых гранул. J Virol 86: 8119–8130
Статья CAS PubMed PubMed Central Google ученый
Finnen RL, Hay TJ, Dauber B, Smiley JR, Banfield BW (2014) Вирион-ассоциированная рибонуклеаза vhs вируса простого герпеса 2 препятствует образованию стрессовых гранул.J Virol 88: 12727–12739
Статья CAS PubMed PubMed Central Google ученый
Финнен Р.Л., Чжу М., Ли Дж., Ромо Д., Банфилд Б.В. (2016) Вирион вируса простого герпеса 2 останавливает активность эндорибонуклеазы, чтобы нарушить образование стрессовых гранул. J Virol 90: 7943–7955
Артикул CAS PubMed PubMed Central Google ученый
Fournier MJ, Coudert L, Mellaoui S, Adjibade P, Gareau C, Cote MF, Sonenberg N, Gaudreault RC, Mazroui R (2013) Инактивация пути mTORC1-эукариотического фактора инициации трансляции 4E изменяет формирование стрессовых гранул.Mol Cell Biol 33: 2285–2301
Статья CAS PubMed PubMed Central Google ученый
Fricke J, Koo LY, Brown CR, Collins PL (2013) Секвестрация p38 и OGT в вирусные тельца включения в клетках, инфицированных респираторно-синцитиальным вирусом человека, подавляет активность MK2 и сборку стрессовых гранул. J Virol 87: 1333–1347
Статья CAS PubMed PubMed Central Google ученый
Фролова Е., Горчаков Р., Гармашова Н., Аташева С., Вергара Л. А., Фролов И. (2006) Формирование nsP3-специфических белковых комплексов при репликации вируса Синдбис.J Virol 80: 4122–4134
Статья CAS PubMed PubMed Central Google ученый
Fujimura K, Sasaki AT, Anderson P (2012) Селенит нацелен на eIF4E-связывающий белок-1, чтобы ингибировать инициацию трансляции и индуцировать сборку неканонических стрессовых гранул. Nucleic Acids Res 40: 8099–8110
Статья CAS PubMed PubMed Central Google ученый
Fung G, Ng CS, Zhang J, Shi J, Wong J, Piesik P, Han L, Chu F, Jagdeo J, Jan E, Fujita T, Luo H (2013) Производство доминантно-отрицательного фрагмента из-за Расщепление G3BP1 способствует разрушению митохондрий-ассоциированных гранул защитного стресса во время инфекции CVB3.PLoS ONE 8: e79546
Артикул CAS PubMed PubMed Central Google ученый
Furtak V, Mulky A, Rawlings SA, Kozhaya L, Lee K, Kewalramani VN, Unutmaz D (2010) Нарушение компонента P-тела Mov10 ингибирует инфекционность ВИЧ-1. PLoS ONE 5: e9081
Артикул CAS PubMed PubMed Central Google ученый
Gallois-Montbrun S, Kramer B, Swanson CM, Byers H, Lynham S, Ward M, Malim MH (2007) Противовирусный белок APOBEC3G локализуется в комплексах рибонуклеопротеинов, обнаруженных в P-тельцах и стрессовых гранулах.J Virol 81: 2165–2178
Статья CAS PubMed Google ученый
Garaigorta U, Heim MH, Boyd B, Wieland S, Chisari FV (2012) Вирус гепатита C (HCV) индуцирует образование стрессовых гранул, белки которых регулируют репликацию РНК HCV и сборку и выход вируса. J Virol 86: 11043–11056
Артикул CAS PubMed PubMed Central Google ученый
Garcia MA, Meurs EF, Esteban M (2007) Протеинкиназа дцРНК PKR: вирус и клеточный контроль.Biochimie 89: 799–811
Статья CAS PubMed Google ученый
Gilks N, Kedersha N, Ayodele M, Shen L, Stoecklin G, Dember LM, Anderson P (2004) Сборка стрессовых гранул опосредуется прионоподобной агрегацией TIA-1. Mol Biol Cell 15: 5383–5398
Статья CAS PubMed PubMed Central Google ученый
Горчаков Р., Гармашова Н., Фролова Е., Фролов И. (2008) Различные типы nsP3-содержащих белковых комплексов в клетках, инфицированных вирусом Синдбис.J Virol 82: 10088–10101
Артикул CAS PubMed PubMed Central Google ученый
Greer AE, Hearing P, Ketner G (2011) Белок 11 k аденовируса E4 связывает и перемещает цитоплазматический компонент P-телец Ddx6 в агресомы. Вирусология 417: 161–168
Статья CAS PubMed PubMed Central Google ученый
Habjan M, Pichlmair A, Elliott RM, Overby AK, Glatter T, Gstaiger M, Superti-Furga G, Unger H, Weber F (2009) NSs-белок вируса лихорадки долины Рифт индуцирует специфическую деградацию двойного цепочечная РНК-зависимая протеинкиназа.J Virol 83: 4365–4375
Статья CAS PubMed PubMed Central Google ученый
Harding HP, Novoa I, Zhang Y, Zeng H, Wek R, Schapira M, Ron D (2000a) Регулируемая инициация трансляции контролирует стресс-индуцированную экспрессию генов в клетках млекопитающих. Mol Cell 6: 1099–1108
Статья CAS Google ученый
Harding HP, Zhang Y, Bertolotti A, Zeng H, Ron D (2000b) Perk необходим для регуляции трансляции и выживания клеток во время развернутого белкового ответа.Mol Cell 5: 897–904
Статья CAS PubMed Google ученый
Hebner CM, Wilson R, Rader J, Bidder M, Laimins LA (2006) Вирусы папилломы человека нацелены на путь двухцепочечной РНК-протеинкиназы. J Gen Virol 87: 3183–3193
Статья CAS PubMed Google ученый
Heinicke LA, Wong CJ, Lary J, Nallagatla SR, Diegelman-Parente A, Zheng X, Cole JL, Bevilacqua PC (2009) Димеризация РНК способствует димеризации и активации PKR.J Mol Biol 390: 319–338
Статья CAS PubMed PubMed Central Google ученый
Heinrich BS, Cureton DK, Rahmeh AA, Whelan SP (2010) Экспрессия белка перенаправляет синтез РНК вируса везикулярного стоматита на цитоплазматические включения. PLoS Pathog 6: e1000958
Артикул CAS PubMed PubMed Central Google ученый
Hoenen T, Shabman RS, Groseth A, Herwig A, Weber M, Schudt G, Dolnik O, Basler CF, Becker S, Feldmann H (2012) Тельца включения являются местом репликации эболавируса.J Virol 86: 11779–11788
Статья CAS PubMed PubMed Central Google ученый
Hopkins KC, Tartell MA, Herrmann C, Hackett BA, Taschuk F, Panda D, Menghani SV, Sabin LR, Cherry S (2015) Вирус-индуцированная остановка трансляции через 4EBP1 / 2-зависимый распад 5′-TOP мРНК ограничивает вирусную инфекцию. Proc Natl Acad Sci U S A 112: E2920–2929
Статья CAS PubMed PubMed Central Google ученый
Hou S, Kumar A, Xu Z, Airo AM, Stryapunina I, Wong CP, Branton W, Tchesnokov E, Gotte M, Power C, Hobman TC (2017) Вирус Зика захватывает белки стрессовых гранул и модулирует стресс хозяина отклик.J Virol. https://doi.org/10.1128/jvi.00474-17
Артикул PubMed PubMed Central Google ученый
Hu Z, Wang Y, Tang Q, Yang X, Qin Y, Chen M (2018) Тельца включения вируса парагриппа человека типа 3 ингибируют образование антивирусных стрессовых гранул, экранируя вирусные РНК. PLoS Pathog 14: e1006948
Артикул CAS PubMed PubMed Central Google ученый
Hubstenberger A, Courel M, Benard M, Souquere S, Ernoult-Lange M, Chouaib R, Yi Z, Morlot JB, Munier A, Fradet M, Daunesse M, Bertrand E, Pierron G, Mozziconacci J, Kress M , Weil D (2017) Очистка P-Body выявляет конденсацию репрессированных регулонов мРНК.Mol Cell 68: 144–157.e145
Артикул CAS PubMed Google ученый
Humoud MN, Doyle N, Royall E, Willcocks MM, Sorgeloos F, van Kuppeveld F, Roberts LO, Goodfellow IG, Langereis MA, Locker N (2016) Инфекция калицивируса кошек нарушает сборку цитоплазматических стрессовых гранул и вызывает расщепление G3BP1 . J Virol 90: 6489–6501
Артикул CAS PubMed PubMed Central Google ученый
Икегами Т., Нараянан К., Вон С., Камитани В., Петерс С.Дж., Макино С. (2009) Белок NSs вируса лихорадки Рифт-Валли способствует посттранскрипционной подавлению протеинкиназы PKR и ингибирует фосфорилирование eIF2alpha.PLoS Pathog 5: e1000287
Артикул CAS PubMed PubMed Central Google ученый
Ingelfinger D, Arndt-Jovin DJ, Luhrmann R, Achsel T (2002) Белки LSm1-7 человека совместно локализуются с ферментами, разрушающими мРНК Dcp1 / 2 и Xrnl, в отдельных цитоплазматических очагах. РНК 8: 1489–1501
CAS PubMed PubMed Central Google ученый
Iseni F, Garcin D, Nishio M, Kedersha N, Anderson P, Kolakofsky D (2002) Концевая РНК вируса Сендай связывает TIAR, клеточный белок, участвующий в индуцированном вирусом апоптозе.EMBO J 21: 5141–5150
Артикул CAS PubMed PubMed Central Google ученый
Isler JA, Skalet AH, Alwine JC (2005) Инфекция цитомегаловируса человека активирует и регулирует ответ развернутого белка. J Virol 79: 6890–6899
Статья CAS PubMed PubMed Central Google ученый
Иванов П.А., Чудинова Е.М., Надеждина Е.С. (2003) Нарушение микротрубочек подавляет образование стрессовых гранул цитоплазматических рибонуклеопротеидов.Exp Cell Res 290: 227–233
Статья CAS PubMed Google ученый
Иванов П., Кедерша Н., Андерсон П. (2018) Гранулы напряжения и обрабатывающие тела в трансляционном управлении. Cold Spring Harb Perspect Biol. https://doi.org/10.1101/cshperspect.a032813
Артикул Google ученый
Izumi T., Burdick R, Shigemi M, Plisov S, Hu WS, Pathak VK (2013) Локализация Mov10 и APOBEC3G в процессинговых телах не требуется для включения вирионов и противовирусной активности.J Virol 87: 11047–11062
Статья CAS PubMed PubMed Central Google ученый
Джексон Р.Дж., Хеллен К.У., Пестова Т.В. (2010) Механизм инициации эукариотической трансляции и принципы ее регуляции. Nat Rev Mol Cell Biol 11: 113–127
Статья CAS PubMed PubMed Central Google ученый
Jain S, Wheeler JR, Walters RW, Agrawal A, Barsic A, Parker R (2016) Стресс-гранулы, модулируемые АТФазой, содержат разнообразный протеом и субструктуру.Cell 164: 487–498
Статья CAS PubMed PubMed Central Google ученый
Jayabalan AK, Sanchez A, Park RY, Yoon SP, Kang GY, Baek JH, Anderson P, Kee Y, Ohn T (2016) NEDDylation способствует сборке напряженных гранул. Nat Commun 7: 12125
Статья CAS PubMed PubMed Central Google ученый
Katsafanas GC, Moss B (2007) Совместная локализация транскрипции и трансляции в цитоплазматических фабриках поксвируса координирует вирусную экспрессию и подчиняет функции хозяина.Клеточный микроб-хозяин 2: 221–228
Статья CAS PubMed PubMed Central Google ученый
Кедерша Н., Андерсон П. (2002) Стресс-гранулы: сайты сортировки мРНК, которые регулируют стабильность и трансляционную способность мРНК. Biochem Soc Trans 30: 963–969
Статья CAS PubMed Google ученый
Кедерша Н.Л., Гупта М., Ли В., Миллер И., Андерсон П. (1999) РНК-связывающие белки TIA-1 и TIAR связывают фосфорилирование eIF-2 альфа со сборкой стрессовых гранул млекопитающих.J Cell Biol 147: 1431–1442
Статья CAS PubMed PubMed Central Google ученый
Kedersha N, Cho MR, Li W, Yacono PW, Chen S, Gilks N, Golan DE, Anderson P (2000) Динамическое перемещение TIA-1 сопровождает рекрутирование мРНК в стрессовые гранулы млекопитающих. J Cell Biol 151: 1257–1268
Статья CAS PubMed PubMed Central Google ученый
Kedersha N, Stoecklin G, Ayodele M, Yacono P, Lykke-Andersen J, Fritzler MJ, Scheuner D, Kaufman RJ, Golan DE, Anderson P (2005) Гранулы напряжения и обрабатывающие тела являются динамически связанными сайтами ремоделирования мРНП .J Cell Biol 169: 871–884
Статья CAS PubMed PubMed Central Google ученый
Кедерша Н., Тисдейл С., Хикман Т., Андерсон П. (2008) Количественная визуализация в реальном времени гранул стресса и обрабатывающих тел млекопитающих. Методы Enzymol 448: 521–552
Статья CAS PubMed Google ученый
Кедерша Н., Иванов П., Андерсон П. (2013) Стресс-гранулы и клеточная сигнализация: больше, чем просто проходящая фаза? Trends Biochem Sci 38: 494–506
Статья CAS PubMed Google ученый
Kedersha N, Panas MD, Achorn CA, Lyons S, Tisdale S, Hickman T, Thomas M, Lieberman J, McInerney GM, Ivanov P, Anderson P (2016) Комплексы G3BP-Caprin1-USP10 опосредуют конденсацию стрессовых гранул и ассоциировать с 40S субъединицами.J Cell Biol 212: 845–860
Статья CAS PubMed PubMed Central Google ученый
Хаперский Д.А., Хэтчетт Т.Ф., Маккормик С. (2012) Вирус гриппа А подавляет образование гранул цитоплазматического стресса. FASEB J 26: 1629–1639
Статья CAS PubMed Google ученый
Хонг А., Ян Э. (2011) Модуляция стрессовых гранул и Р-телец во время дицистровирусной инфекции.J Virol 85: 1439–1451
Артикул CAS PubMed Google ученый
Кодзима Э., Такеучи А., Ханеда М., Яги А., Хасегава Т., Ямаки К., Такеда К., Акира С., Шимоката К., Исобе К. (2003). Функция GADD34 заключается в восстановлении после отключения индуцированного синтеза белка. стрессом ER: выяснение на мышах с дефицитом GADD34. FASEB J 17: 1573–1575
Статья CAS PubMed Google ученый
Lahaye X, Vidy A, Pomier C, Obiang L, Harper F, Gaudin Y, Blondel D (2009) Функциональная характеристика тел Негри (NB) в клетках, инфицированных вирусом бешенства: доказательства того, что NB являются сайтами вирусной транскрипции и репликация.J Virol 83: 7948–7958
Статья CAS PubMed PubMed Central Google ученый
Le Sage V, Cinti A, McCarthy S, Amorim R, Rao S, Daino GL, Tramontano E, Branch DR, Mouland AJ (2017) Вирус Эбола VP35 блокирует сборку стрессовых гранул. Вирусология 502: 73–83
Статья CAS PubMed Google ученый
Leung AK, Vyas S, Rood JE, Bhutkar A, Sharp PA, Chang P (2011) Поли (АДФ-рибоза) регулирует стрессовые реакции и активность микроРНК в цитоплазме.Mol Cell 42: 489–499
Статья CAS PubMed PubMed Central Google ученый
Li W, Li Y, Kedersha N, Anderson P, Emara M, Swiderek KM, Moreno GT, Brinton MA (2002) Клеточные белки TIA-1 и TIAR взаимодействуют с 3 ‘стволовой петлей вируса Западного Нила комплементарная минус-цепь РНК и облегчает репликацию вируса. J Virol 76: 11989–12000
Артикул CAS PubMed PubMed Central Google ученый
Li S, Peters GA, Ding K, Zhang X, Qin J, Sen GC (2006) Молекулярная основа активации PKR с помощью PACT или dsRNA.Proc Natl Acad Sci U S A 103: 10005–10010
Статья CAS PubMed PubMed Central Google ученый
Lindquist ME, Lifland AW, Utley TJ, Santangelo PJ, Crowe JE Jr (2010) Респираторный синцитиальный вирус индуцирует стрессовые гранулы РНК хозяина для облегчения репликации вируса. J Virol 84: 12274–12284
Артикул CAS PubMed PubMed Central Google ученый
Lindquist ME, Mainou BA, Dermody TS, Crowe JE Jr (2011) Активация протеинкиназы R необходима для индукции стрессовых гранул респираторно-синцитиальным вирусом, но необязательна для репликации вируса.Вирусология 413: 103–110
Статья CAS PubMed PubMed Central Google ученый
Linero FN, Thomas MG, Boccaccio GL, Scolaro LA (2011) Инфекция вируса Хунина нарушает образование стрессовых гранул в клетках Vero, обработанных арсенитом, посредством ингибирования фосфорилирования eIF2alpha. J Gen Virol 92: 2889–2899
Статья CAS PubMed Google ученый
Лю Р., Мосс Б. (2016) Противоположные роли эффекторных путей двухцепочечной РНК и белков защиты вируса, выявленные с помощью линий нокаутных клеток CRISPR-Cas9 и мутантов вируса осповакцины.J Virol 90: 7864–7879
Артикул CAS PubMed PubMed Central Google ученый
Лю Дж., Валенсия-Санчес М.А., Хэннон Г.Дж., Паркер Р. (2005) Зависимая от микроРНК локализация целевых мРНК в Р-тельцах млекопитающих. Nat Cell Biol 7: 719–723
Статья CAS PubMed PubMed Central Google ученый
Liu TT, Yang Q, Li M, Zhong B, Ran Y, Liu LL, Yang Y, Wang YY, Shu HB (2016) LSm14A играет критическую роль в противовирусных иммунных ответах, регулируя уровень MITA в клетке. специфическим образом.J Immunol 196: 5101–5111
Статья CAS PubMed Google ученый
Ma S, Bhattacharjee RB, Bag J (2009) Экспрессия поли (A) -связывающего белка активируется во время восстановления после теплового шока в клетках HeLa. FEBS J 276: 552–570
Артикул CAS PubMed Google ученый
Matsuki H, Takahashi M, Higuchi M, Makokha GN, Oie M, Fujii M (2013) И G3BP1, и G3BP2 способствуют формированию стрессовых гранул.Гены клеток 18: 135–146
Статья CAS PubMed Google ученый
Mazroui R, Sukarieh R, Bordeleau ME, Kaufman RJ, Northcote P, Tanaka J, Gallouzi I, Pelletier J (2006) Ингибирование рекрутирования рибосом вызывает образование стрессовых гранул независимо от фосфорилирования эукариотического фактора инициации 2alpha. Mol Biol Cell 17: 4212–4219
Статья CAS PubMed PubMed Central Google ученый
McCormick C, Khaperskyy DA (2017) Ингибирование трансляции и стрессовые гранулы в противовирусном иммунном ответе.Nat Rev Immunol 17: 647–660
Статья CAS PubMed Google ученый
McEwen E, Kedersha N, Song B, Scheuner D, Gilks N, Han A, Chen JJ, Anderson P, Kaufman RJ (2005) Фосфорилирование эукариотического фактора инициации трансляции 2, регулируемое гемом, ингибитором киназы, ингибирует трансляцию, вызывает образование стрессовых гранул и способствует выживанию после воздействия арсенита. J Biol Chem 280: 16925–16933
Статья CAS PubMed Google ученый
McInerney GM, Kedersha NL, Kaufman RJ, Anderson P, Liljestrom P (2005) Важность фосфорилирования eIF2alpha и сборки стрессовых гранул в регуляции трансляции альфавирусов.Mol Biol Cell 16: 3753–3763
Статья CAS PubMed PubMed Central Google ученый
Meng X, Xiang Y (2019) Гранулы РНК, связанные с SAMD9-опосредованным ограничением поксвируса, по составу аналогичны антивирусным гранулам, но не требуют TIA1 для ограничения поксвируса. Вирусология 529: 16–22
Статья CAS PubMed Google ученый
Mir MA, Duran WA, Hjelle BL, Ye C, Panganiban AT (2008) Хранение клеточных 5′-колпачков мРНК в P-тельцах для захвата вирусного колпачка.Proc Natl Acad Sci U S A 105: 19294–19299
Статья PubMed PubMed Central Google ученый
Mok BW, Song W, Wang P, Tai H, Chen Y, Zheng M, Wen X, Lau SY, Wu WL, Matsumoto K, Yuen KY, Chen H (2012) Белок NS1 вируса гриппа A взаимодействует с телами клеточного процессора и стрессовыми гранулами через связанный с РНК белок 55 (RAP55) во время вирусной инфекции. J Virol 86: 12695–12707
Артикул CAS PubMed PubMed Central Google ученый
Montero H, Rojas M, Arias CF, Lopez S (2008) Ротавирусная инфекция вызывает фосфорилирование eIF2alpha, но предотвращает образование стрессовых гранул.J Virol 82: 1496–1504
Статья CAS PubMed Google ученый
Накагава К., Нараянан К., Вада М., Макино С. (2018) Ингибирование образования стрессовых гранул дополнительным белком коронавируса 4a ближневосточного респираторного синдрома облегчает трансляцию вируса, что приводит к эффективной репликации вируса. J Virol 92: e00902–18
CAS PubMed PubMed Central Google ученый
Nallagatla SR, Hwang J, Toroney R, Zheng X, Cameron CE, Bevilacqua PC (2007) 5′-трифосфат-зависимая активация PKR с помощью РНК с короткими стержневыми петлями.Наука 318: 1455–1458
Статья CAS PubMed Google ученый
Nathans R, Chu CY, Serquina AK, Lu CC, Cao H, Rana TM (2009) Клеточные микроРНК и P-тельца модулируют взаимодействия хозяина-ВИЧ-1. Mol Cell 34: 696–709
Статья CAS PubMed PubMed Central Google ученый
Nelson EV, Schmidt KM, Deflube LR, Doganay S, Banadyga L, Olejnik J, Hume AJ, Ryabchikova E, Ebihara H, Kedersha N, Ha T, Muhlberger E (2016) Вирус Эбола не вызывает образование стрессовых гранул во время инфекции и секвестров стрессируют белки гранул внутри вирусных включений.J Virol 90: 7268–7284
Статья CAS PubMed PubMed Central Google ученый
Ng CS, Jogi M, Yoo JS, Onomoto K, Koike S, Iwasaki T, Yoneyama M, Kato H, Fujita T (2013) Вирус энцефаломиокардита разрушает стрессовые гранулы, критическую платформу для запуска противовирусных врожденных иммунных ответов. J Virol 87: 9511–9522
Статья CAS PubMed PubMed Central Google ученый
Николич Дж., Сивас А., Лама З. (2016) Инфекция вируса бешенства вызывает образование стрессовых гранул, тесно связанных с вирусными фабриками.PLoS Pathog 12: e1005942
Артикул CAS PubMed PubMed Central Google ученый
Oceguera A, Peralta AV, Martinez-Delgado G, Arias CF, Lopez S (2018) РНК ротавируса губки связывают РНК-связывающие белки клетки-хозяина и препятствуют их субклеточной локализации. Вирусология 525: 96–105
Статья CAS PubMed Google ученый
Оконски К.М., Самуэль С.Е. (2013) Формирование стрессовых гранул, индуцированное вирусом кори, зависит от протеинкиназы PKR и нарушается РНК-аденозиндезаминазой ADAR1.J Virol 87: 756–766
Статья CAS PubMed PubMed Central Google ученый
Onomoto K, Jogi M, Yoo JS, Narita R, Morimoto S, Takemura A, Sambhara S, Kawaguchi A, Osari S, Nagata K, Matsumiya T, Namiki H, Yoneyama M, Fujita T (2012) Критическая роль антивирусной стрессовой гранулы, содержащей RIG-I и PKR, для обнаружения вирусов и врожденного иммунитета. PLoS ONE 7: e43031
Артикул CAS PubMed PubMed Central Google ученый
Панас М.Д., Иванов П., Андерсон П. (2016) Механистические взгляды на динамику стрессовых гранул млекопитающих.J Cell Biol 215: 313–323
Статья CAS PubMed PubMed Central Google ученый
Patel CV, Handy I, Goldsmith T, Patel RC (2000) PACT, стресс-модулированный клеточный активатор интерферон-индуцированной двухцепочечной РНК-активируемой протеинкиназы, PKR. J Biol Chem 275: 37993–37998
Статья CAS PubMed Google ученый
Pene V, Li Q, Sodroski C, Hsu CS, Liang TJ (2015) Динамическое взаимодействие стрессовых гранул, DDX3X и IKK-alpha опосредует множество функций при инфицировании вирусом гепатита C.J Virol 89: 5462–5477
Статья CAS PubMed PubMed Central Google ученый
Poblete-Duran N, Prades-Perez Y, Vera-Otarola J, Soto-Rifo R, Valiente-Echeverria F (2016) Кто кого регулирует? обзор гранул РНК и вирусных инфекций. Вирусы 8: E180
Статья CAS PubMed Google ученый
Protter DSW, Parker R (2016) Принципы и свойства стрессовых гранул.Trends Cell Biol 26: 668–679
Статья CAS PubMed PubMed Central Google ученый
Rabouw HH, Langereis MA, Knaap RC, Dalebout TJ (2016) Вспомогательный белок 4a ближневосточного респираторного коронавируса ингибирует PKR-опосредованные реакции на антивирусный стресс. PLoS Pathog 12: e1005982
Артикул CAS PubMed PubMed Central Google ученый
Reed JC, Molter B, Geary CD, McNevin J, McElrath J, Giri S, Klein KC, Lingappa JR (2012) HIV-1 Gag кооптирует клеточный комплекс, содержащий DDX6, геликазу, которая способствует сборке капсида.J Cell Biol 198: 439–456
Статья CAS PubMed PubMed Central Google ученый
Reineke LC, Kedersha N, Langereis MA, van Kuppeveld FJ, Lloyd RE (2015) Стресс-гранулы регулируют активацию двухцепочечной РНК-зависимой протеинкиназы через комплекс, содержащий G3BP1 и Caprin1. MBio 6: e02486
Статья CAS PubMed PubMed Central Google ученый
Rincheval V, Lelek M, Gault E, Bouillier C, Sitterlin D, Blouquit-Laye S, Galloux M, Zimmer C, Eleouet JF, Rameix-Welti MA (2017) Функциональная организация цитоплазматических телец включения в клетках, инфицированных респираторно-синцитиальный вирус.Nat Commun 8: 563
Статья CAS PubMed PubMed Central Google ученый
Rojas M, Arias CF, Lopez S (2010) Протеинкиназа R отвечает за фосфорилирование eIF2alpha при ротавирусной инфекции. J Virol 84: 10457–10466
Статья CAS PubMed PubMed Central Google ученый
Rozelle DK, Filone CM, Kedersha N, Connor JH (2014) Активация путей стрессового ответа способствует образованию противовирусных гранул и ограничивает репликацию вируса.Mol Cell Biol 34: 2003–2016
Статья CAS PubMed PubMed Central Google ученый
Ruggieri A, Dazert E, Metz P, Hofmann S, Bergeest JP, Mazur J, Bankhead P, Hiet MS, Kallis S, Alvisi G, Samuel CE, Lohmann V, Kaderali L, Rohr K, Frese M, Stoecklin G, Bartenschlager R (2012) Динамические колебания трансляции и образование стрессовых гранул отмечают клеточный ответ на вирусную инфекцию. Клеточный микроб-хозяин 12: 71–85
Статья CAS PubMed Google ученый
Sciortino MT, Parisi T, Siracusano G, Mastino A, Taddeo B, Roizman B (2013) РНКаза отключения вириона-хозяина играет ключевую роль в блокировании активации протеинкиназы R в клетках, инфицированных вирусом простого герпеса 1.J Virol 87: 3271–3276
Статья CAS PubMed PubMed Central Google ученый
Sen GL, Blau HM (2005) Argonaute 2 / RISC находится в сайтах распада мРНК млекопитающих, известных как цитоплазматические тельца. Nat Cell Biol 7: 633–636
Статья CAS PubMed Google ученый
Seto E, Inoue T, Nakatani Y, Yamada M, Isomura H (2014) Процессирующие тела накапливаются в клетках, инфицированных цитомегаловирусом человека, и не влияют на репликацию вируса при высокой множественности инфекции.Вирусология 458–459: 151–161
Статья CAS PubMed Google ученый
Sharma NR, Majerciak V, Kruhlak MJ, Zheng ZM (2017) KSHV ингибирует образование стрессовых гранул с помощью вирусного ORF57, блокирующего активацию PKR. PLoS Pathog 13: e1006677
Артикул CAS PubMed PubMed Central Google ученый
Sheth U, Parker R (2006) Нацеливание аберрантных мРНК на тела цитоплазматического процессора.Cell 125: 1095–1109
Статья CAS PubMed PubMed Central Google ученый
Silva PA, Pereira CF, Dalebout TJ, Spaan WJ, Bredenbeek PJ (2010) Псевдоузел РНК необходим для продукции субгеномной РНК вируса желтой лихорадки нуклеазой XRN1 хозяина. J Virol 84: 11395–11406
Артикул CAS PubMed PubMed Central Google ученый
Симпсон-Холли М., Кедерша Н., Дауэр К., Рубинс К. Х., Андерсон П., Хенсли Л. Е., Коннор Дж. Х. (2011) Формирование противовирусных цитоплазматических гранул во время ортопоксвирусной инфекции.J Virol 85: 1581–1593
Статья CAS PubMed Google ученый
Sivan G, Glushakow-Smith SG, Katsafanas GC, Americo JL, Moss B (2018) Ограничение диапазона человеческих хозяев мутанта с двойной делецией C7 / K1 вируса коровьей оспы опосредуется атипичным способом ингибирования трансляции. J Virol 92: e01329–18
Артикул CAS PubMed PubMed Central Google ученый
Smith RW, Gray NK (2010) Поли (A) -связывающий белок (PABP): обычная вирусная мишень.Biochem J 426: 1–12
Статья CAS PubMed Google ученый
Sokoloski KJ, Dickson AM, Chaskey EL, Garneau NL, Wilusz CJ, Wilusz J (2010) Вирус Синдбис узурпирует клеточный белок HuR, чтобы стабилизировать его транскрипты и способствовать продуктивным инфекциям в клетках млекопитающих и комаров. Клеточный микроб-хозяин 8: 196–207
Статья CAS PubMed PubMed Central Google ученый
Srivastava SP, Kumar KU, Kaufman RJ (1998) Фосфорилирование эукариотического фактора инициации трансляции 2 опосредует апоптоз в ответ на активацию двухцепочечной РНК-зависимой протеинкиназы.J Biol Chem 273: 2416–2423
Статья CAS PubMed Google ученый
Stoecklin G, Kedersha N (2013) Связь GW / P-тел с гранулами напряжения. Adv Exp Med Biol 768: 197–211
Статья CAS PubMed PubMed Central Google ученый
Stohr N, Lederer M, Reinke C, Meyer S, Hatzfeld M, Singer RH, Huttelmaier S (2006) ZBP1 регулирует стабильность мРНК во время клеточного стресса.J Cell Biol 175: 527–534
Статья CAS PubMed PubMed Central Google ученый
Takeuchi K, Komatsu T, Kitagawa Y, Sada K, Gotoh B (2008) Белок C вируса Сендай играет роль в ограничении активации PKR, ограничивая образование внутриклеточной двухцепочечной РНК. J Virol 82: 10102–10110
Статья CAS PubMed PubMed Central Google ученый
Thomas MG, Loschi M, Desbats MA, Boccaccio GL (2011) Гранулы РНК: хорошие, плохие и уродливые.Cell Signal 23: 324–334
Статья CAS PubMed Google ученый
Toroney R, Nallagatla SR, Boyer JA, Cameron CE, Bevilacqua PC (2010) Регулирование PKR с помощью РНК IRES HCV: важность домена II и NS5A. J Mol Biol 400: 393–412
Артикул CAS PubMed PubMed Central Google ученый
Tourriere H, Chebli K, Zekri L, Courselaud B, Blanchard JM, Bertrand E, Tazi J (2003) Связанная с RasGAP эндорибонуклеаза G3BP собирает стрессовые гранулы.J Cell Biol 160: 823–831
Статья CAS PubMed PubMed Central Google ученый
Tsai WC, Gayatri S, Reineke LC, Sbardella G, Bedford MT, Lloyd RE (2016) Деметилирование аргинина G3BP1 способствует сборке стрессовых гранул. J Biol Chem 291: 22671–22685
Статья CAS PubMed PubMed Central Google ученый
Tu YC, Yu CY, Liang JJ, Lin E, Liao CL, Lin YL (2012) Блокирование двухцепочечной РНК-активированной протеинкиназы PKR неструктурным белком 2A вируса японского энцефалита.J Virol 86: 10347–10358
Статья CAS PubMed PubMed Central Google ученый
Visser LJ, Medina GN, Rabouw HH, de Groot RJ, Langereis MA, de Los T, van Kuppeveld FJM (2019) Лидерская протеаза вируса ящура расщепляет G3BP1 и G3BP2 и ингибирует образование стрессовых гранул. J Virol 93: e00922–18
Артикул PubMed PubMed Central Google ученый
фон дер Хаар Т., Гросс Дж. Д., Вагнер Г., Маккарти Дж. Э. (2004) Белок, связывающий кепку мРНК, eIF4E в посттранскрипционной экспрессии генов.Nat Struct Mol Biol 11: 503–511
Статья CAS PubMed Google ученый
Wang T, Tian C, Zhang W, Luo K, Sarkis PT, Yu L, Liu B, Yu Y, Yu XF (2007) 7SL РНК опосредует упаковку вириона противовирусной цитидиндезаминазы APOBEC3G. J Virol 81: 13112–13124
Артикул CAS PubMed PubMed Central Google ученый
Ward AM, Bidet K, Yinglin A, Ler SG, Hogue K, Blackstock W, Gunaratne J, Garcia-Blanco MA (2011) Количественная масс-спектрометрия белков, взаимодействующих с РНК DENV-2, показывает, что РНК DEAD-бокса геликаза DDX6 связывает структуры DB1 и DB2 3 ‘UTR.РНК Biol 8: 1173–1186
Статья CAS PubMed PubMed Central Google ученый
Wek SA, Zhu S, Wek RC (1995) Связанная с гистидил-тРНК синтетазой последовательность в протеинкиназе eIF-2 альфа GCN2 взаимодействует с тРНК и требуется для активации в ответ на голодание по различным аминокислотам. Mol Cell Biol 15: 4497–4506
Статья CAS PubMed PubMed Central Google ученый
Wheeler JR, Matheny T, Jain S, Abrisch R, Parker R (2016) Четкие этапы сборки и разборки напряженных гранул.Elife 5: e18413
Статья PubMed PubMed Central Google ученый
White JP, Lloyd RE (2012) Регулирование стрессовых гранул в вирусных системах. Trends Microbiol 20: 175–183
Статья CAS PubMed PubMed Central Google ученый
White JP, Cardenas AM, Marissen WE, Lloyd RE (2007) Ингибирование образования стрессовых гранул цитоплазматической мРНК вирусной протеиназой.Клеточный микроб-хозяин 2: 295–305
Статья CAS PubMed Google ученый
Wichroski MJ, Robb GB, Rana TM (2006) Факторы рестрикции ретровирусного хозяина человека APOBEC3G и APOBEC3F локализуются в тельцах, обрабатывающих мРНК. PLoS Pathog 2: e41
Артикул CAS PubMed PubMed Central Google ученый
Wilczynska A, Aigueperse C, Kress M, Dautry F, Weil D (2005) Трансляционный регулятор CPEB1 обеспечивает связь между телами dcp1 и стрессовыми гранулами.J Cell Sci 118: 981–992
Статья CAS PubMed Google ученый
Willis KL, Langland JO, Shisler JL (2011) Двухцепочечные вирусные РНК из транскриптов ранних или промежуточных генов вируса осповакцины обладают активирующей функцией PKR, что приводит к активации NF-kappaB, когда белок K1 отсутствует или мутирован. J Biol Chem 286: 7765–7778
Статья CAS PubMed Google ученый
Xia J, Chen X, Xu F, Wang Y, Shi Y, Li Y, He J, Zhang P (2015) Инфекция вируса денге индуцирует образование гранул G3BP1 в эпителиальных клетках легких человека.Arch Virol 160: 2991–2999
Артикул CAS PubMed Google ученый
Yang X, Hu Z, Fan S, Zhang Q, Zhong Y, Guo D, Qin Y, Chen M (2018) Протеаза пикорнавируса 2A регулирует образование стрессовых гранул для облегчения вирусной трансляции. PLoS Pathog 14: e1006901
Артикул CAS PubMed PubMed Central Google ученый
Ye X, Pan T, Wang D, Fang L, Ma J, Zhu X, Shi Y, Zhang K, Zheng H, Chen H, Li K, Xiao S (2018) Вирус ящура противодействует на подавление внутреннего сайта входа в рибосомы с помощью G3BP1 и ингибирует G3BP1-опосредованную сборку стрессовых гранул посредством посттрансляционных механизмов.Фронт Иммунол 9: 1142
Артикул CAS PubMed PubMed Central Google ученый
Youn JY, Dunham WH, Hong SJ, Knight JDR, Башкуров M, Chen GI, Bagci H, Rathod B, MacLeod G, Eng SWM, Angers S, Morris Q, Fabian M, Cote JF, Gingras AC (2018 Картирование близости с высокой плотностью показывает субклеточную организацию гранул и тел, связанных с мРНК. Mol Cell 69: 517–532.e511
Артикул CAS PubMed Google ученый
Yu JH, Yang WH, Gulick T, Bloch KD, Bloch DB (2005) Ge-1 является центральным компонентом тела процессинга цитоплазматической мРНК млекопитающих.РНК 11: 1795–1802
Статья CAS PubMed PubMed Central Google ученый
Zaborowska I, Kellner K, Henry M, Meleady P, Walsh D (2012) Рекрутирование фактора инициации трансляции хозяина eIF4G с помощью ssDNA-связывающего белка I3 вируса осповакцины. Вирусология 425: 11–22
Статья CAS PubMed Google ученый
Ziehr B, Vincent HA, Moorman NJ (2016) Человеческий цитомегаловирус pTRS1 и pIRS1 антагонизируют протеинкиназу R для облегчения репликации вируса.J Virol 90: 3839–3848
Статья CAS PubMed PubMed Central Google ученый
Zoncu R, Efeyan A, Sabatini DM (2011) mTOR: от интеграции сигнала роста до рака, диабета и старения. Nat Rev Mol Cell Biol 12: 21–35
Статья CAS PubMed Google ученый
«Консервированная противовирусная роль для индуцированной вирусом цитоплазматической экзосомной композиции» Джером Майкл Моллестон
Название степени
доктор философских наук
Аннотация
Деградация РНК— это строго регулируемый и высококонсервативный процесс, который избирательно воздействует на аберрантные РНК с использованием как 5 ’, так и 3’ экзонуклеаз.РНК, деградирующие в этом процессе, включают вирусную РНК, но механизмы, с помощью которых вирусная РНК идентифицируется и задействуется в механизме деградации, не совсем понятны. Чтобы идентифицировать новые противовирусные гены, мы провели скрининг РНКи генов с известной ролью в метаболизме РНК в клетках дрозофилы. Мы идентифицировали экзосому РНК, которая нацелена на распад 3’-конца РНК, и два компонента комплекса TRAMP с кофактором экзосомы, dMtr4 и dZcchc7, в качестве противовирусного средства против группы РНК-вирусов. Поскольку эти гены являются высококонсервативными, я распространил эти исследования на клетки человека и обнаружил, что экзосома, а также компоненты TRAMP hMTR4 и hZCCHC7 являются противовирусными.Хотя hMTR4 и hZCCHC7 обычно являются ядерными, я обнаружил, что инфицирование вирусами цитоплазматической РНК вызывает их экспорт в цитоплазматические гранулы, где они образуют комплекс, который специфически распознает и индуцирует деградацию вирусных мРНК. Более того, я обнаружил, что 3’-UTR мРНК буниавируса достаточно, чтобы вызвать индуцированную вирусом экзосомную деградацию, демонстрируя цис-регуляцию.
Несколько типов гранул рибонуклеопротеина (РНП) взаимодействуют как с 5 ’, так и с 3’ механизмами распада для облегчения деградации секвестрированных РНК.Чтобы определить, содержат ли гранулы, содержащие компонент TRAMP, компоненты других определенных гранул РНП, я провел иммунофлуоресценцию для hZCCHC7, а также компонентов Р-телец, стрессовых гранул и гранул экзосом, и обнаружил, что hZCCHC7 может колокализоваться с белками, находящимися в гранулах экзосом. и стрессовые гранулы во время вирусной инфекции, предполагая, что hZCCHC7 может связывать трансляционно остановленные вирусные РНК и доставлять их к гранулам экзосом для деградации.
Чтобы дополнительно охарактеризовать регуляцию ядерного экспорта компонента TRAMP во время инфекции, я исследовал вирусные сигналы, необходимые для этого транспорта.Я обнаружил, что трансфекции дцРНК достаточно, чтобы вызвать релокализацию, в то время как инфицирование вирусами, инактивированными УФ-излучением, — нет. Более того, я проверил роль канонических адаптеров врожденного иммунитета в этом процессе и обнаружил, что PKR сенсора дцРНК способствует перемещению во время инфицирования вирусом Синдбис. В целом, мои результаты показывают, что присутствие реплицирующейся вирусной РНК заставляет компоненты TRAMP быть перепрофилированы на роль цитоплазматического надзора в нескольких классах гранул РНП, включая стрессовые гранулы и гранулы экзосом.Там они избирательно задействуют вирусные РНК для деградации, чтобы ограничить распространение широкого спектра вирусов.
Рекомендуемое цитирование
Моллестон, Джером Майкл, «Консервативная противовирусная роль для индуцированного вирусом цитоплазматического экзосомного комплекса» (2016). Общедоступные диссертации Пенсильвании . 2480.
https://repository.upenn.edu/edissertations/2480
«ГТФаза-активирующий белок-связывающий белок 1 играет противовирусную роль», автор: Кабита Пандей
Тип документа
Диссертация — Открытый доступ
Название степени
Магистр наук (MS)
Отдел
Биология и микробиология
Первый советник
Xiuqing Wang
Ключевые слова
Противовирусный, G3BP1, PEDV, Стресс гранулы
Аннотация
Вирус эпидемической диареи свиней (PEDV) — это несегментированный вирус, который использует одноцепочечную РНК с положительным смыслом в качестве генетического материала.PEDV относится к семейству Coronaviridae, и основными клиническими признаками являются обширная диарея и обезвоживание кормящих поросят. Это возникающее заболевание приводит к огромным экономическим потерям в свиноводстве. Очень мало исследований проводится в отношении роли врожденного иммунитета в инфекции PEDV. Формирование стрессовых гранул (SG) наблюдается, когда клетки попадают в различные стрессовые условия, включая вирусные инфекции. SG образуются, когда одна из четырех киназ: двухцепочечная РНК (dsRNA) -зависимая протеинкиназа (PKR), PKR-подобная киназа эндоплазматического ретикулума (PERK), недерепрессируемая киназа 2 (GCN2) общего контроля и геморегулируемая ингибиторная киназа (HRI) вызывают фосфорилирование фактора инициации трансляции эукариот (eIF2α).Альтернативный путь образования SG — ингибирование геликазы РНК eIF4A. Фосфорилирование eIF2α путем активации PKR является наиболее распространенным путем образования SG. SG считаются показателем врожденного противовирусного ответа хозяина, который ограничивает трансляцию вирусных генов. Белок, активирующий Ras-GTPase (домен Sh4), связывающий белок 1 (G3BP1), является одним из важных белков, резидентов стрессовых гранул, который зарождается в сборке стрессовых гранул. Целью исследования было изучить роль G3BP1 в репликации PEDV.Мы обнаружили, что истощение G3BP1 ингибирует образование SG, а избыточная экспрессия G3BP1 вызывает сборку SG. Мы наблюдали, что нокдаун G3BP1 путем подавления РНК значительно увеличивал репликацию PEDV. Точно так же сверхэкспрессия экзогенного G3BP1 снижала репликацию вируса примерно в 100 раз по сравнению с векторным контролем. Мы также наблюдали, что клетки, инфицированные PEDV, устойчивы к образованию SG при обработке арсенитом натрия. Повышение уровней мРНК провоспалительных цитокинов, таких как интерлейкин-1β (IL-1β) и фактор некроза опухоли — α (TNF-α), также наблюдалось в инфицированных PEDV клетках с нокдауном G3BP1 по сравнению с инфицированными PEDV контрольными клетками. .Взятые вместе, наши результаты показывают, что PEDV индуцирует временное образование SG, а G3BP1 играет противовирусную роль в репликации вируса.
Предметные рубрики Библиотеки Конгресса
Диарея свиней.
Свиньи — Вирусные болезни.
Противовирусные средства.
Белок, активирующий ГТФазу.
Описание
Включая библиографические ссылки
Издатель
Государственный университет Южной Дакоты
Рекомендуемое цитирование
Панди, Кабита, «ГТФаза-активирующий белок-связывающий белок 1 играет противовирусную роль в репликации вируса эпидемической диареи свиней (PEDV)» (2018). Электронные диссертации и диссертации . 2973.
https://openprairie.sdstate.edu/etd/2973



