Гипертрофия правого желудочка — Right ventricular hypertrophy
Гипертрофия правого желудочка ( ГПЖ ) — это состояние, определяемое аномальным увеличением сердечной мышцы, окружающей правый желудочек . Правый желудочек — одна из четырех камер сердца. Он расположен ближе к нижнему краю сердца и получает кровь из правого предсердия и перекачивает кровь в легкие.
Поскольку RVH — это увеличение мышцы, оно возникает, когда мышце требуется более интенсивная работа. Следовательно, основными причинами RVH являются патологии систем, связанных с правым желудочком, таких как легочная артерия , трикуспидальный клапан или дыхательные пути.
RVH может быть доброкачественным и иметь незначительное влияние на повседневную жизнь, или может привести к таким состояниям, как сердечная недостаточность , с плохим прогнозом.
Признаки и симптомы
Симптомы
Хотя проявления различаются, люди с гипертрофией правого желудочка могут испытывать симптомы, связанные с легочной гипертензией , сердечной недостаточностью и / или сниженным сердечным выбросом . К ним относятся:
- Затрудненное дыхание при нагрузке
- Боль в груди ( стенокардия ) при нагрузке
- Обморок ( обморок ) при физической нагрузке
- Общая утомляемость / вялость
- Головокружение
- Ощущение распирания в верхней части живота
- Дискомфорт или боль в правой верхней части живота
- Снижение аппетита
- Отеки ( отеки ) ног, лодыжек или ступней
- Учащенное сердцебиение (учащенное сердцебиение)
В редких случаях у людей могут быть симптомы синдрома Ортнера , которые включают кашель, кровохарканье и охриплость голоса.
Приметы
При физикальном обследовании наиболее заметные признаки связаны с развитием правосторонней сердечной недостаточности. Они могут включать в себя повышенное яремное венозное давлении , асцит , левые парастернальную вертикальную качку и нежный, увеличенную печень при пальпации.
При аускультации могут присутствовать усиленный второй легочный звук (S2), третий тон сердца, называемый «галопом правого желудочка», а также систолический шум в области трикуспидального клапана, усиленный вдохом. Иногда систолический шум может передаваться и выслушиваться через печень. Реже диастолический шум также может быть услышан в результате легочной недостаточности.
Причины
RVH обычно возникает из-за хронического заболевания легких или структурных дефектов сердца. Одной из наиболее частых причин RVH является легочная гипертензия (PH), определяемая как повышение артериального давления в сосудах, по которым кровь поступает в легкие. PH приводит к увеличению давления в легочной артерии. Правый желудочек пытается компенсировать это повышенное давление, изменяя его форму и размер. Гипертрофия отдельных миоцитов приводит к увеличению толщины стенки правого желудочка. Заболеваемость ЛГ во всем мире составляет 4 на миллион человек. RVH встречается примерно в 30% этих случаев.
Всемирная организация здравоохранения в целом подразделяет PH на пять категорий в зависимости от первопричины. Заболеваемость RVH варьируется между группами. Общие причины ЛГ включают хроническую обструктивную болезнь легких (ХОБЛ), тромбоэмболию легочной артерии и другие рестриктивные заболевания легких. RVH часто возникает в результате этих нарушений. RVH наблюдается у 76% пациентов с запущенной ХОБЛ и у 50% пациентов с рестриктивной болезнью легких.
RVH также возникает в ответ на структурные дефекты сердца. Одна из частых причин — трикуспидальная недостаточность . Это заболевание, при котором трикуспидальный клапан не закрывается должным образом, что приводит к обратному току крови. Другие структурные дефекты, которые приводят к РВГ, включают тетралогию Фалло , дефекты межжелудочковой перегородки , стеноз легочного клапана и дефекты межпредсердной перегородки .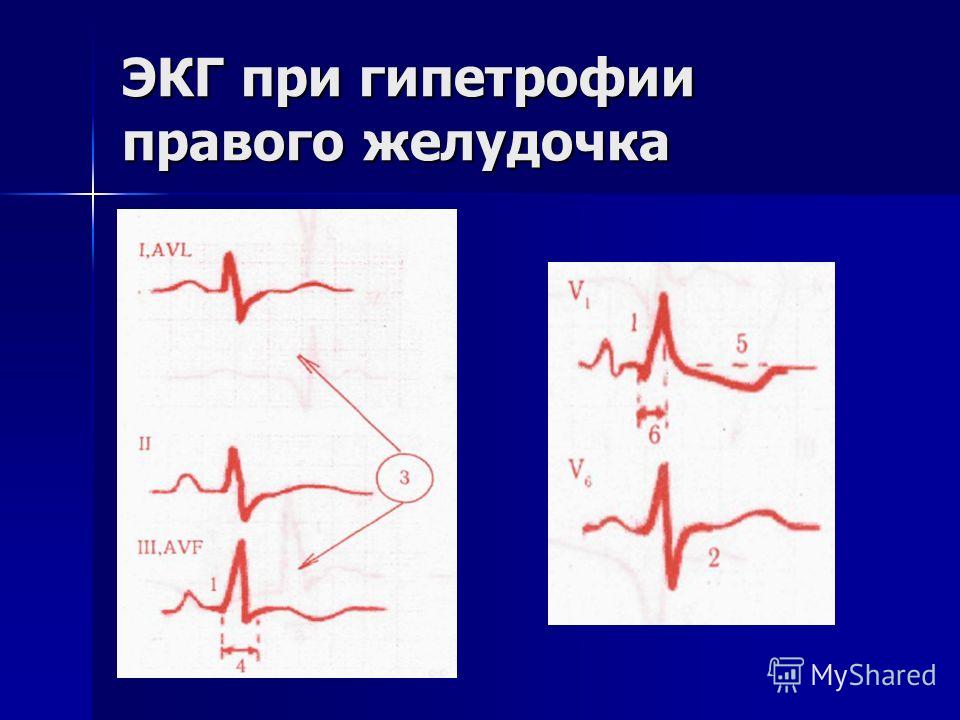
К другим факторам риска РВГ относятся курение, апноэ во сне и физическая активность. Это увеличивает риск сердечных и легочных заболеваний и, следовательно, RVH.
Патофизиология
Гипертрофия правого желудочка может быть как физиологическим, так и патофизиологическим процессом. Это становится патофизиологическим (повреждающим) при чрезмерной гипертрофии. Патофизиологический процесс в основном происходит за счет аберрантной передачи нейроэндокринных гормонов; ангиотензин II , эндотелин-1 и катехоламины (например, норадреналин ).
Ангиотензин-II и эндотелин-1
Ангиотензин-II и эндотелин-1 — это гормоны, которые связываются с рецепторами ангиотензина (AT) и эндотелина (ET). Это рецепторы, связанные с G-белком, которые действуют через внутренние сигнальные пути. Через несколько промежуточных продуктов эти пути прямо или косвенно увеличивают производство активных форм кислорода (АФК), вызывая накопление в клетках миокарда . Это может впоследствии вызвать некротическую гибель клеток, фиброз и митохондриальную дисфункцию.
Это было продемонстрировано в исследованиях на животных. Протеинкиназа C (PKC) представляет собой промежуточную молекулу в сигнальном пути, и мыши, лишенные PKC, показали устойчивость к сердечной недостаточности по сравнению с мышами, избыточно экспрессирующими PKC, у которых обнаружена сердечная дисфункция.
Нацеливание на систему ренин-ангиотензин (РААС) (с использованием ингибиторов ангиотензинпревращающего фермента и блокаторов рецепторов ангиотензина) является общепризнанным клиническим подходом к обращению вспять дезадаптивной гипертрофии сердца независимо от артериального давления.
Катехоламины
Уровень катехоламинов увеличивается из-за повышенной активности симпатической нервной системы. Катехоламины могут действовать на альфа-адренорецепторы и бета-адренорецепторы, которые являются рецепторами, связанными с G-белком. Это связывание инициирует те же внутриклеточные сигнальные пути, что и ангиотензин и эндотелин. Также происходит активация цАМФ и увеличение внутриклеточного Ca2 +, что приводит к сократительной дисфункции и фиброзу.
Катехоламины могут действовать на альфа-адренорецепторы и бета-адренорецепторы, которые являются рецепторами, связанными с G-белком. Это связывание инициирует те же внутриклеточные сигнальные пути, что и ангиотензин и эндотелин. Также происходит активация цАМФ и увеличение внутриклеточного Ca2 +, что приводит к сократительной дисфункции и фиброзу.
Другие
Гормоны — не единственная причина RVH. Гипертрофия также может быть вызвана механическими силами, путями mTOR, оксидом азота и иммунными клетками . Иммунные клетки могут вызывать гипертрофию, вызывая воспаление.
Диагностика
Гексаксиальная система отсчета ЭКГ показывает отклонение оси вправоДва основных диагностических теста, используемых для подтверждения гипертрофии правого желудочка, — это электрокардиография и эхокардиография.
Электрокардиография
Использование электрокардиограммы (ЭКГ) для измерения гипертрофии камеры сердца хорошо известно, но, поскольку активность левого желудочка является доминирующей на ЭКГ, для любых обнаруживаемых изменений часто требуется большая степень RVH. Тем не менее, ЭКГ используется для диагностики RVH. Посмертное исследование на пациентах 51 взрослых мужчин пришло к выводу , что анатомическое РВГ может быть диагностировано с помощью одного или более из следующих критериев ЭКГ:
Однако Американская кардиологическая ассоциация рекомендовала использовать дополнительные диагностические тесты для диагностики RVH, потому что ни один критерий или набор критериев не считались достаточно надежными.
Эхокардиография
Эхокардиографию можно использовать для прямой визуализации толщины стенки правого желудочка. Предпочтительным методом является трансэзофагеальный доступ, дающий обзор 4 камер. Нормальная толщина свободной стенки правого желудочка составляет от 2 до 5 миллиметров, при этом значение более 5 мм считается гипертрофическим.
Уход
Важно понимать, что гипертрофия правого желудочка сама по себе не является главной проблемой, а вопрос о том, что представляет собой гипертрофия правого желудочка. Гипертрофия правого желудочка — это промежуточная стадия между повышенным давлением в правом желудочке (на ранних стадиях) и недостаточностью правого желудочка (на более поздних стадиях). Таким образом, лечение гипертрофии правого желудочка заключается либо в предотвращении развития гипертрофии правого желудочка, либо в предотвращении прогрессирования в сторону недостаточности правого желудочка. Сама по себе гипертрофия правого желудочка не имеет (фармакологического) лечения.
Гипертрофия правого желудочка — это промежуточная стадия между повышенным давлением в правом желудочке (на ранних стадиях) и недостаточностью правого желудочка (на более поздних стадиях). Таким образом, лечение гипертрофии правого желудочка заключается либо в предотвращении развития гипертрофии правого желудочка, либо в предотвращении прогрессирования в сторону недостаточности правого желудочка. Сама по себе гипертрофия правого желудочка не имеет (фармакологического) лечения.
Лечение причины
Поскольку основными причинами гипертрофии правого желудочка являются трикуспидальная регургитация или легочная гипертензия (обсуждалось выше), лечение включает лечение этих состояний. Трикуспидальная регургитация обычно лечится консервативно, стремясь устранить первопричину и регулярно наблюдая за пациентом. Хирургия рассматривается в более серьезных ситуациях, когда у пациента есть серьезные симптомы. Хирургические варианты включают либо замену клапана, либо восстановление клапана (так называемая аннулопластика). Когда дело доходит до замены, есть выбор между биопротезным клапаном или механическим клапаном, в зависимости от конкретных характеристик пациента. Механический клапан имеет большую долговечность, но требует антикоагуляции, чтобы снизить риск тромбоза. Лечение легочной гипертензии будет зависеть от конкретной причины легочной гипертензии. Кроме того, можно также рассмотреть следующие варианты: диуретическая, кислородная и антикоагулянтная терапия.
Управление осложнениями
По прошествии длительного периода правый желудочек не может в достаточной степени адаптироваться для перекачки повышенного давления в правом желудочке, что называется правожелудочковой недостаточностью. Эта правожелудочковая недостаточность является основным осложнением гипертрофии правого желудочка. Механизмы, лежащие в основе прогрессирования от гипертрофии до отказа, не совсем понятны, и лучший подход к лечению включает уменьшение / минимизацию факторов риска прогрессирования. Изменение образа жизни часто может помочь снизить риск этого прогрессирования. Изменения в образе жизни включают: употребление меньшего количества соленой пищи, поскольку потребление соли приводит к большей задержке жидкости в организме; Отказ от курения; избегать чрезмерного употребления алкоголя, так как алкоголь снижает силу сердечных сокращений. Когда гипертрофия правого желудочка переходит в правожелудочковую недостаточность, лечение сводится к сердечной недостаточности. Вкратце, это включает использование:
Изменение образа жизни часто может помочь снизить риск этого прогрессирования. Изменения в образе жизни включают: употребление меньшего количества соленой пищи, поскольку потребление соли приводит к большей задержке жидкости в организме; Отказ от курения; избегать чрезмерного употребления алкоголя, так как алкоголь снижает силу сердечных сокращений. Когда гипертрофия правого желудочка переходит в правожелудочковую недостаточность, лечение сводится к сердечной недостаточности. Вкратце, это включает использование:
Рекомендации
внешняя ссылка
Структурные изменения правого желудочка при приобретенных пороках сердца :: ТРУДНЫЙ ПАЦИЕНТ
В.В.Варясин1, А.Г.Евдокимова2
1Городская клиническая больница №52, Москва
2МГМСУ им. А.И.Евдокимова, Москва
В статье обсуждаются структурные изменения правого желудочка на фоне хронической сердечной недостаточности, клапанных пороках, стенозе легочной артерии. Приводятся методы коррекции состояний, приводящих к поражению правого желудочка.
Ключевые слова: правый желудочек, структурные изменения, сердечные клапаны.
Structural changes in right ventricle in acquired heart defects
V.V.Varyasin1, A.G.Evdokimova2
1City Hospital №52, Moscow
2A.I.Evdokimov MSMDU, Moscow
The paper discusses structural changes of right ventricle (RV) caused by chronic heart failure, defects of valves, pulmonary artery stenosis, ect. Approaches to the treatment of disorders that lead to structural changes in RV are presented.
Keywords: right ventricle, structural changes, cardiac valves.
Сведения об авторе:
Евдокимова Анна Григорьевна – д.м.н., профессор, Кафедра терапии №1 факультета последипломного образования Московского государственного медико-стоматологического университета им. А.И.Евдокимова
Структурные изменения сердца обнаруживаются у всех больных с хронической сердечной недостаточностью и выражаются в изменениях размеров и формы сердца в ответ на повреждения миокарда или нарушение гемодинамики [1, 2]. В России, как в Европе и Америке, число людей с сердечной недостаточностью растет [3, 4]. Среди причин развития хронической сердечной недостаточности (ХСН) вторичные пороки сердца занимают третье место [5].
В России, как в Европе и Америке, число людей с сердечной недостаточностью растет [3, 4]. Среди причин развития хронической сердечной недостаточности (ХСН) вторичные пороки сердца занимают третье место [5].
В настоящее время считается, что развитие ХСН и переход в стадию декомпенсации у больных c приобретенными пороками сердца связаны с прогрессирующим ремоделированием миокарда. От степени вовлеченности правых отделов сердца в процессы ремоделирования во многом зависят темпы развития сердечной недостаточности и прогноз заболевания [6].
В течение длительного времени основное внимание кардиологов было сосредоточено на изучении левого желудочка сердца, роль которого в поддержании гемодинамики считалась основной, а роль правого желудочка (ПЖ) в развитии сердечной недостаточности должным образом недооценивалась [7]. Возможно, это можно объяснить трудностями изучения ПЖ с помощью неинвазивных методов исследования. Такие сложности возникают при исследовании ПЖ и с помощью эхокардиографии (большая часть камеры лежит за грудиной, желудочек имеет неправильную форму, вследствие выраженной трабекулярности стенок проблематично четко определить границы эндокарда), что порождает значительный разброс нормальных значений, по данным разных исследователей [8, 9].
Использование ЭХО-КГ и ЭКГ методов на базе соотношений массы миокарда и относительной толщины стенки левого желудочка, толщины стенки левого желудочка к поперечному диаметру его полости в конце диастолы позволило выделить три основных геометрических моделей ремоделирования левых отделов сердца [10]:
1. Концентрическая гипертрофия (увеличение массы миокарда и относительной толщины стенки левого желудочка).
2. Эксцентрическая гипертрофия (увеличение массы при нормальной относительной толщине).
3. Концентрическое ремоделирование (нормальная масса и увеличенная относительная толщина стенки левого желудочка).
Такие геометрические модели ремоделирования в полной мере относятся и к ПЖ [11]. Имеется тесная взаимосвязь ремоделирования обоих желудочков, начиная с самых ранних стадий хронической сердечной недостаточности, что свидетельствует о единых патогенетических механизмах развития дисфункции миокарда [12].
В начале заболеваний процесс структурных изменений может носить компенсаторный характер в течение определенного времени [13]. В дальнейшем доказана возможность перехода адаптивного ремоделирования ПЖ при объемной его перегрузке в патологическое, то есть такое, которое сохраняется после устранения причин его вызвавших [14]. Ряд авторов установили достоверные критерии обратимости или необратимости ремоделирования ПЖ в раннем послеоперационном периоде корреции пороков сердца [15].
В клинической практике наиболее распространенной причиной дисфункции ПЖ при вторичных пороках клапанов левых отделов сердца является хроническая левожелудочковая недостаточность. При развитии и нарастании функциональной несостоятельности левых отделов сердца растет и гемодинамическая нагрузка на ПЖ [16]. Левожелудочковая недостаточность увеличивает постнагрузку через увеличение венозного легочного и, особенно, артериального легочного давления, возможны и другие механизмы, к которым относят ишемические и кардиомиопатические изменения миокарда, также имеет значение и межжелудочковое воздействие [17]. В настоящее время в развитии недостаточности ПЖ большое значение придается нарушению функции левого желудочка, прежде всего, диастолической функции [18].
При аортальном пороке сердца, особенно в стадии декомпенсации, отмечается функциональная относительная недостаточность митрального клапана, которая в свою очередь сопровождается легочной гипертензией [19]. Наиболее часто легочная гипертензия отмечается при органических пороках митрального клапана [20].Если сравнивать недостаточность с митральным стенозом, то при недостаточности легочная гипертензия развивается в более поздние сроки порока. По мере прогрессирования стеноза митрального клапана развивается левопредсердная декомпенсация, растет давление в легочных венах и возникает венозный застой, а следующим этапом является рефлекторный спазм – рефлекс Китаева, являющийся на ранних этапах заболевания по существу компенсаторным, а затем по мере прогрессирования заболевания развивается органическое сужение артерий легкого с легочной гипертензии [21].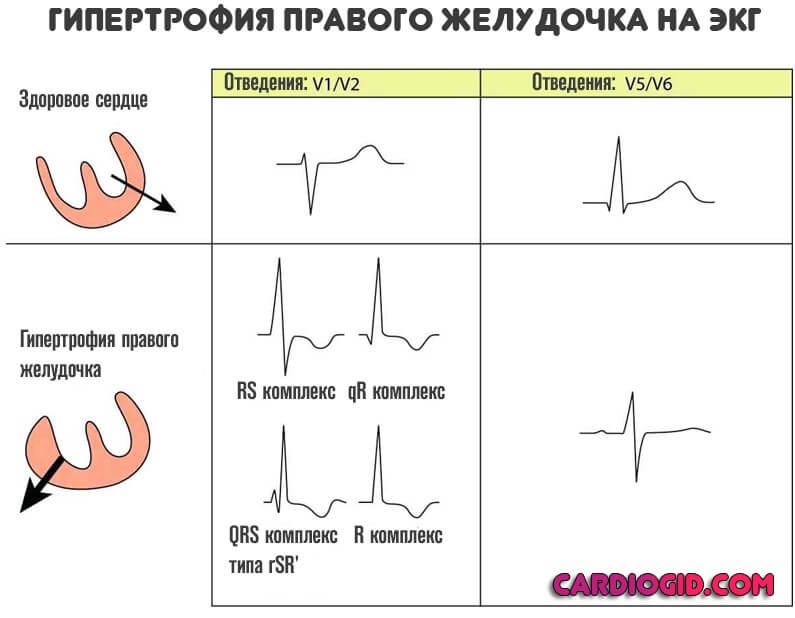
При прогрессировании сердечной недостаточности, помимо гипертрофии миокарда ПЖ, развивается и дилатация его полости [22]. В таких случаях возможно и применение таких терминов как дилатационное поражение ПЖ по аналогии с левым [23].
Наряду с изменениями в размерах, толщины стенки и соотношений в показателях давления–объема в ПЖ отмечаются изменения кардиомиоцитов и внеклеточного матрикса [24].
При пороках сердца в кардиомиоцитах происходит смена генетической программы синтеза актиномиозина на резервную аллельную форму, адекватную высокой рабочей нагрузке сердца [25].
Необходимо отметить, что ПЖ – насос системы низкого давления, который хорошо адаптируется к нагрузке объемом, но очень плохо – к нагрузке давлением, что приводит к его гипертрофии и дисфункции. При общем клиническом обследовании у больных с развитой легочной гипертензией определяют расширение границ сердца вправо, выслушивают акцент II тона на легочной артерии, пансистолический шум регургитации на трикуспидальном клапане, диастолический шум недостаточности клапана легочной артерии, а также III тон. Выявляют расширение шейных вен, гепатомегалию, симптом плеска, асцит, периферические отеки с похолоданием конечностей. Указанные симптомы характерны для больного с уже развитыми симптомами правожелудочковой недостаточности [26].
Cтеноз клапана легочной артерии
Стеноз устья легочной артерии чаще всего бывает врожденным, клиническое течение заболевания у взрослых может протекать доброкачественно с незначительной скоростью прогрессирования клапанного стеноза, имеются публикации, где больные доживали до 57 и 67 лет [27]. В литературе можно встретить описание наблюдения пациента с дефектом межжелудочковой перегородки и стеноза легочной артерии, успешно прооперированного в возрасте 76 лет [28]. В редких случаях клапанный стеноз легочной артерии может развиваться при ревматизме, чаще в сочетании с поражением других клапанов [29]. Стеноз клапана легочной артерии может встречаться при инфекционном эндокардите [30] и карциноидном синдроме [31]. Ремоделирования ПЖ в этих условиях обусловлено перегрузкой давления с развитием компенсаторной концентрической гипертрофией миокарда с уменьшением объема ПЖ.
Ремоделирования ПЖ в этих условиях обусловлено перегрузкой давления с развитием компенсаторной концентрической гипертрофией миокарда с уменьшением объема ПЖ.
В дальнейшем при не устраненном пороке нарушение компенсации проявляется развитием недостаточности гипертрофированного ПЖ. В результате снижается минутный объем сердца в покое, который практически не возрастает при нагрузке, развиваются циркуляторная гипоксия и цианоз. Однако типичная картина правожелудочковой недостаточности с выраженным венозным застоем в большом круге кровообращения наблюдается редко.
Недостаточность клапана легочной артерии
Недостаточность клапана легочной артерии – это порок сердца, при котором не происходит полного смыкания клапанов легочной артерии в период диастолы сердца, что приводит к возникновению обратного тока крови из легочной артерии в правый желудочек. Гемодинамика при недостаточности клапана легочной артерии обеспечивается тоногенной дилатацией правого желудочка с присоединением гипертрофии и увеличением сердечного выброса. В последующем происходит гипертрофия и правого предсердия.
Недостаточность клапана легочной артерии приводит к объемной перегрузке ПЖ. В отсутствие легочной гипертензии ПЖ способен справляться со значительной объемной перегрузкой пока сохраняется его нормальная сократимость, и нет тяжелой недостаточности трехстворчатого клапана. При сочетании недостаточности клапана легочной артерии с легочной гипертензией происходит перегрузка ПЖ как объемом, так и давлением.
Пульмональная недостаточность чаще всего связана с дилатацией кольца клапана легочной артерии, возникающей вследствие первичной или вторичной легочной гипертензии [32]. Недостаточность клапана легочной артерии наблюдается и при идиопатической аневризме легочной артерии [33]. В литературе большинство публикаций о пульмональной недостаточности, она описывается как осложнение операций по поводу врожденных пороков сердца (Тетрада Фалло или другие аномалии легочной артерии) [34].
Известно, что при ревматизме могут возникать повреждения клапана легочной артерии с развитием его недостаточности, наряду с поражением других клапанов сердца [35]. Инфекционный эндокардит (ИЭ) легочной артерии тоже может быть причиной недостаточности и часто сочетается с эндокардитом трехстворчатого клапана [36].
Приобретенная пульмональная регургитация редко бывает гемодинамически значимой, однако, со временем может существенно нарушать функцию ПЖ, приводя к аритмии и внезапной сердечной смерти [37]. Та или иная степень пульмональной регургитации встречается и при коронарной болезни сердца, так было установлено, что из 741 больных она была у 481 [38].
Ряд авторов, изучая сердца атлетов установили, что чем значительнее увеличение размеров сердца, тем больше вероятность клапанной пульмональной и трекуспидальной регургитации [39].
Лечение стеноза легочной артерии
Основное лечение стеноза легочной артерии хирургическое. Оно показано при появлении первых жалоб и при бессимптомном течении заболевания, когда градиент давления превышает 50 мм рт.ст., то есть при умеренном (50–80 мм рт. ст.) и выраженном (> 80 мм рт. ст.) стенозе. При меньшем градиенте больные не предъявляют жалоб и требуют наблюдения и хирургического лечения при ухудшении состояния. Риск операции значительно повышается при резком стенозе с синдромом «малого желудочка» и у больных старше 20 лет при выраженных дистрофических и склеротических изменениях в гипертрофированном миокарде. Оптимальный возраст для оперативного лечения – 5–10 лет, однако при выраженном стенозе приходится прибегать к операции раньше. Хирургическое лечение противопоказано при выраженной правожелудочковой недостаточности.
Существует два основных метода хирургического лечения:
• вальвулотомия, то есть рассечение сросшихся комиссур;
• инфундибулэктомия – иссечение гипертрофированных мышц выходного тракта правого желудочка с применением искусственного кровообращения.
Баллонная вальвулопластика при катетеризации сердца в последние годы становится методом выбора. Летальность при операциях с применением искусственного кровообращения – около 3%, при баллонной вальвулопластике – несколько меньше. После вмешательства на клапане может наблюдаться небольшая регургитация крови.
Летальность при операциях с применением искусственного кровообращения – около 3%, при баллонной вальвулопластике – несколько меньше. После вмешательства на клапане может наблюдаться небольшая регургитация крови.
Отдаленные результаты хирургического лечения
Самой частой проблемой у таких больных является развитие правожелудочковой недостаточности. Она связана с остаточным клапанным стенозом, недостаточным иссечением гипертрофированного миокарда в выносящем тракте правого желудочка, образованием на нем обратного тока крови или с глубокой дистрофией гипертрофированного миокарда при слишком поздней операции.
Лечение недостаточности клапана легочной артерии
При поражении клапана легочной артерии проводят лечение основного заболевания. При недостаточности клапана легочной артерии в результате легочной гипертензии показаны мероприятия, направленные на уменьшение легочной гипертензии. Лечение и прогноз определяется заболеванием, вызвавшим недостаточность клапана. При ИЭ лечение нацелено на ликвидацию воспалительного процесса (антибиотикотерапия), в последующем при наличии показаний, производят имплантацию искусственного клапана.
При легочной гипертензии следует стремиться уменьшить объем регургитации путем снижением давления в легочной артерии.
При первичной недостаточности клапана (то есть обусловленной его патологией) прогноз благоприятный и лечение требуется лишь при наличии тяжелой формы правожелудочковой недостаточности. В случае отказа пациента от хирургического лечения назначаются диуретики и венозные вазодилататоры. Хирургическое лечение – имплантация искусственного клапана, а при дилатации клапанного кольца аннулопластика. Функциональная недостаточность клапана легочной артерии при вторичной гипертензии, обусловленной митральным стенозом, исчезает после успешного оперативного устранения стеноза.
Лечение недостаточности клапанов легочной артерии симптоматическое. Хирургическая коррекция врожденных форм проводится в виде радикальных операций – протезирования клапанов или паллиативных вмешательств.
Пороки трехстворчатого клапана
Недостаточность трехстворчатого клапана обнаруживается чаще при пороках клапанов левых отделов сердца и носит вторичный характер, сопровождается систолической дисфункцией ПЖ с расширением фиброзного кольца [40]. Трикуспидальная недостаточность является плохим прогностическим фактором для пациентов с митральным или аортальным пороком, а также их сочетаниями [41]. Трикуспидальная недостаточность может встречаться и в позднем послеоперационном периоде после протезирования митрального клапана при развившейся дисфункции протеза [42].
При трикуспидальной недостаточности регургитация крови из ПЖ в правое предсердие относительно быстро ведет к дилатации правого предсердия без существенной его гипертрофии. Компенсация порока осуществляется подобно митральной недостаточности, однако компенсирующие возможности правого предсердия меньше, поэтому рано формируются венозная гипертензия.
Трикуспидальная недостаточность отмечается чаще при заболеваниях митрального клапана [43]. Характерно значительное расширение фиброзного кольца за счет области передней и задней створок и соответствующих комиссур. Фиброзная часть, соответствующая перегородочной области, которая является единой с межжелудочковой перегородкой, не дилатируется [44].
Относительная трикуспидальная недостаточность характеризуется отсутствием фиброзных изменений клапана, отмечается лишь утолщение краев створок, вызванное постоянным воздействием волны регургитации.
ИЭ трехстворчатого клапана среди эндокардитов других клапанов встречается гораздо реже [45]. Летальность без хирургического лечения составляет более 35%. Наиболее часто развитие ИЭ трехстворчатого клапана связывают с внутривенным введением лекарственных веществ [46].
Ревматизм – самая частая причина развития органической недостаточности трехстворчатого клапана [47]. При этом происходят утолщение и деформация створок, укорочение и утолщение сухожильных нитей. Образующаяся недостаточность клапана в большинстве случаев комбинируется с той или иной степенью сужения правого атриовентрикулярного отверстия из-за сращения створок клапана.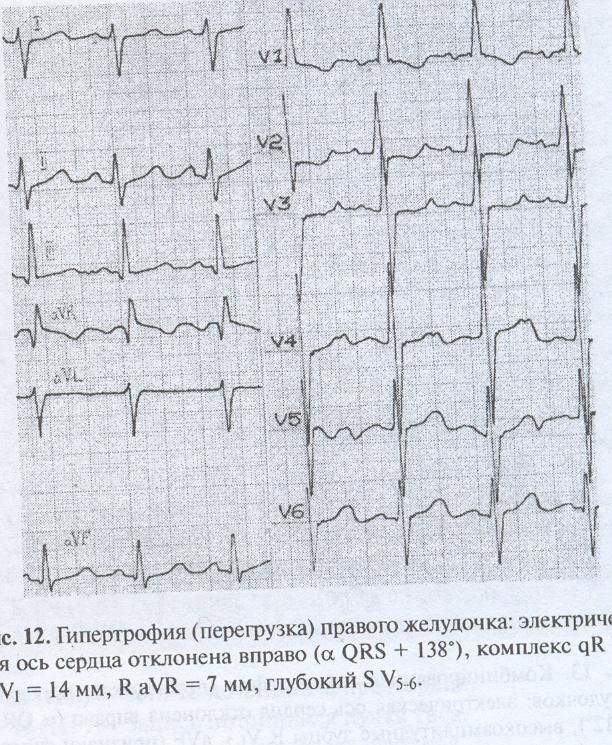
Ревматическая трикуспидальная недостаточность нередко сочетается с поражением других клапанов и встречается реже относительной трикуспидальной недостаточности. [48].
Деформация трехстворчатого клапана и развитие его недостаточности иногда происходит при злокачественном карциноиде [49], травматическом разрыве папиллярных мышц [50], миксоме клапана [51].
При развитии недостаточности ПЖ в случаях порока трехстворчатого клапана признаки застоя крови в венах большого круга наблюдаются, в отличие от функциональной недостаточности, уже в стадии его компенсации.
Трикуспидальный стеноз почти всегда имеет ревматическую этиологию и часто сочетается с ревматическими поражениями других клапанов. Очень редко описывают стеноз трикуспидального клапана после установки водителя ритма [52].
Морфологически отмечают склероз створок, фиброзного кольца, сухожильных хорд и верхушек сосочковых мышц. При ревматическом поражении трехстворчатого клапана происходит утолщение и укорочение створок, сращение комиссур.
При стенозе отверстия трехстворчатого клапана перемещение крови из правого предсердия в правый желудочек происходит при наличии градиента давления между ними, увеличивающемся на вдохе или при нагрузках и уменьшающемся на выдохе. Компенсация кровообращения в известных пределах происходит за счет расширения и гипертрофии правого предсердия. В дальнейшем относительно слабое правое предсердие быстро дилатирует, когда среднее давление в правом предсердии превышает 10 мм рт. ст., развивается застой в большом круге кровообращения с вовлечением органов брюшной полости. Раннее развитие застоя в венах большого круга кровообращения, характерное для стеноза отверстия трехстворчатого клапана, контрастирует с отсутствием ортопноэ и легочного застоя.
Лечение трикуспидального порока
При трикуспидальной недостаточности показаны ингибиторы АПФ и/или антагонисты рецепторов ангиотензина, а также разгрузка большого круга кровообращения посредством применения высоких доз диуретиков (в том числе антагонистов альдостерона). Для устранения систолической дисфункции, возникающей на фоне дилатации ПЖ, применяют сердечные гликозиды. Используют b-блокаторы, хотя и в более низких дозах [53].
Для устранения систолической дисфункции, возникающей на фоне дилатации ПЖ, применяют сердечные гликозиды. Используют b-блокаторы, хотя и в более низких дозах [53].
Основным методом лечения функциональной недостаточности трикуспидального клапана является устранение ее причины. Как указывалось выше, вторичная легочная гипертензия является осложнением приобретенных клапанных пороков левого отдела сердца, которая и является ведущей причиной развития трикуспидальной недостаточности.
После оперативных вмешательств на клапанах левых отделов сердца, легочная гипертензия обычно уменьшается [54], но в ряде наблюдений снижения легочной гипертензии не отмечается, что является риском послеоперационной летальности [55].
Трикуспидальная недостаточность может присутствовать у больных с декомпенсированным митральным пороком и без легочной гипертензии, которая также может исчезать после хирургической коррекции порока [56].
Выбор оперативного вмешательства на клапанах левых отделов сердца имеет значение. Нет четких показаний для той или иной операции, у каждого оперативного вмешательства есть недостатки и преимущества. Считается, что пластические операции, в частности, на митральном клапане в сочетании с пластикой трикуспидального клапанов сопровождаются ранними хорошими результатами, однако в последующем возникает необходимость реопераций [57], но уже с операционной летальностью до 37% [58]. Ряд авторов отмечали, что у больных после хирургического лечения митрального клапана в 20–50% определялась стойкая или рецидивирующая трикуспидальная недостаточность [59].
Протезирование клапанов сердца сопровождается хорошими результатами с обратным ремоделированием левого и правого желудочка. Выбор протеза также имеет значение, так например, сравнивая механические протезы, отмечено что двустворчатые оказывают более ранние обратные изменения правых отделов сердца [60].
Большинство кардиохирургов разницы между биологическими и механическими протезами не видят, тем не менее, считают, что механически двустворчатые протезы лучше [61].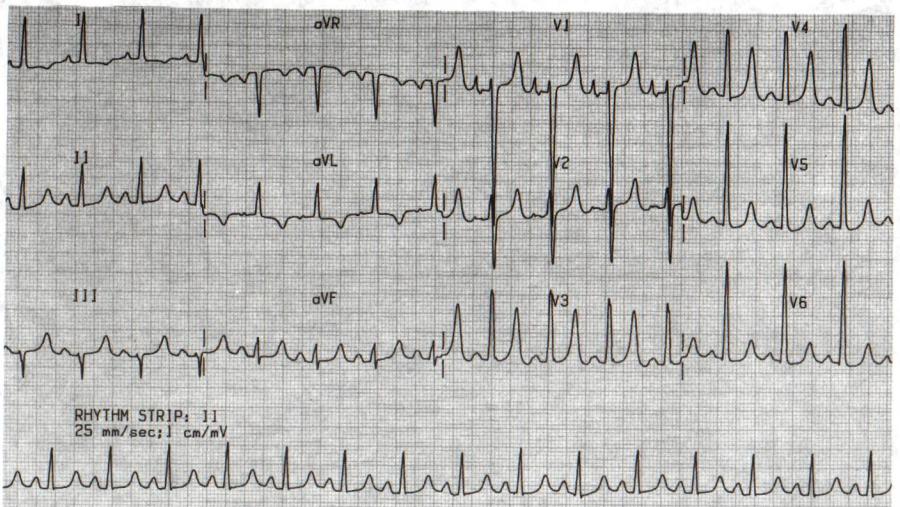
Выделяют четыре степени недостаточности трикуспидального клапана: I – едва определимая обратная струя крови, II – обратный ток определяется на расстоянии 2 см от клапана, III – струя регургитации определяется на расстоянии более 2 см от клапана, IV – регургитация определяется на большом протяжении полости правого предсердия [62].
До настоящего времени ведутся дискуссии, когда при наличии митрального порока сердца оперировать трикуспиадальный клапан [63].
Учитывая возможность сохранения трикуспидальной недостаточности, рекомендуется делать пластику или аннулопластику трикуспидального клапана во время операций на левом сердце. Известно, что дилатация фиброзного кольца может и не сопровождаться трикуспидальной недостаточностью. Однако дилатация фиброзного кольца является прогрессирующим заболеванием, поэтому и надо делать аннулопластику, хотя еще и нет трикуспидальной недостаточности [64, 65]. Отдельные авторы при операциях на клапанах левых отделов сердца рекомендуют делать аннулопластику трикуспидального клапана с профилактической целью [66].
Существует большое количество разновидностей пластических операций трикуспидального клапана, среди которых выделяют два основных – шовные и опорно-кольцевые. Следует отметить, что постоянно идет поиск более совершенных оперативных методик [67, 68].
Большое разнообразие методов пластической коррекции недостаточности трикуспидального клапана свидетельствует о том, что в настоящее время нет такого метода, который по своей эффективности устраивал бы всех кардиохирургов и был бы применим для коррекции трикуспидальной недостаточности любой степени выраженности [69].
При изолированной или органической трикуспидальной недостаточности чаще используется протезирование трикуспидального клапана [70].
Протезирование трехстворчатого клапана выполняют чаще при грубых изменениях створок, а также подклапанных структур и в случае неэффективности ранее проведенной аннулопластики.
При морфологических изменениях клапанного аппарата, а также в ряде случаев при выраженной «относительной» трикуспидальной недостаточности при наличии факторов, способствующих несостоятельности аннулопластики, показания для первичного протезирования трикуспидального клапана расширяются, возводя тем самым эту операцию из разряда вынужденной в разряд единственно верной [71].
Заключение
Особенности гемодинамики каждого клапанного поражения накладывает безусловные особенности на клиническую картину хронической сердечной недостаточности, а также на тактику ведения этих больных. Знание и учет этих особенностей позволяет дифференцированно и эффективно лечить больных. Правожелудочковую недостаточность можно представить как синдром с различными этиологией и патогенезом, сопровождающийся на начальных стадиях компенсацией, а в конечном итоге приводящий к срыву адаптации.
Литература
1. Sharpe N., Doghty R.N. Left ventricular remodelling and improved long-term outcomes in chronic heart failure. Eur Heart J. 1998; 19: Suppl B: B36–9.
2. Беленков Ю.Н ,. Мареев В.Ю , Агеев Ф.Т. Что такое сердечная недостаточность? Как лучше ее диагностировать? Сердечная недостаточность. 2002; 3 (5): 209–10.
3. Lam C.S., Donal E., Kraigher-Krainer E. et al. Epidemiology and clinical course of heart failure with preserved ejection fraction. Eur J Heart Fail. 2011 Jan; 13 (1): 18–28.
4. Соломахина Н.И., Беленков Ю.Н., Бугрова Е.М. Частота хронической сердечной недостаточности и ее причины среди госпитализированных пациентов пожилого и старческого возраста. Сердечная недостаточность. 2010; 6: 328–332.
5. Беленков Ю.Н., Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. 2000; 173.
6. Ускова О.В. Ремоделирование левого желудочка у больных с тяжелой хронической сердечной недостаточностью. Сердечная недостаточность. 2004; 3 (5): 136–139.
7. Ghio S., Tavazzi L. Right ventricular dysfunction in advanced heart failure. Ital Heart J. 2005 Oct; 6 (10): 852–5.
8. Ярославская Е.И, Морова Н А. Структурно-геометрические параметры правого желудочка сердца. Казанский медицинский журнал. 2008; 89 (1): 8–11.
9. Simon M.A. Right ventricular adaptation to pressure overload. Curr Opin Crit Care. 2010 Jun; 16 (3): 237–43.
10. Baggish A.L., Weiner R.B., Yared K. et al. Impact of family hypertension history on exercise-induced cardiac remodeling. Am J Cardiol. 2009 Jul 1; 104 (1): 101–6.
Am J Cardiol. 2009 Jul 1; 104 (1): 101–6.
11. Панев Н.И., Коротенко О.Ю., Цай Л.В. Типы ремоделирования левого и правого желудочков при сочетании хронического пылевого бронхита с ишемической болезнью сердца и артериальной гипертензией. Сибирский медицинский журнал (г. Томск). 2009; 24 (1): 113–114.
12. Панев Н.И., Сергеева Л.И. O влиянии различных факторов на ремоделирование правых отделов сердца при прогрессировании хронической сердечной недостаточности у больных ишемической болезнью сердца. Бюллетень Сибирского отделения Российской академии медицинских наук. 2006; (3): 77–82.
13. Takano H., Hasegawa H., Nagai T. et al. Implication of cardiac remodeling in heart failure: mechanisms and therapeutic strategies. Intern Med. 2003 Jun; 42 (6): 465–9.
14. Цеханович В.Н., Морова Н.А., Ярославская Е.И. Влияние хирургической коррекции митральных, митрально-аортальных пороков, дефектов межпредсердной перегородки на течение ремоделирования правого жеоудочка сердца. Патология кровообращения и кардиохирургия. 2007; (4): 69–74.
15. Ярославская Е.И., Морова Н.А., Цеханович В. Н. и др. Способ прогнозирования параметров правого желудочка после хирургической коррекции пороков сердца. Патент. Номер:2372033. 10 Ноября, 2009.
16. Демидова Н. Ю. Диастолическая функция правого желудочка при различных типах диастолической дисфункции левого желудочка у больных артериальной гипертензии. Патология кровообращения и кардиохирургия. 2007; (3): 55–58.
17. Нарциссова Г.П. Особенности ремоделирования правого желудочка в условиях гиперфункции. Журнал Патология кровообращения и кардиохирургия. 2001; 1: 94–98.
18. Schwarz E.R., Dashti R. The clinical quandary of left and right ventricular diastolic dysfunction and diastolic heart failure. Cardiovasc J Afr. 2010 Jul-Aug; 21 (4): 212–20.
19. Дземешкевич С.Л.,Стивенсон Л.У Алексии-Месхишвили В.В. Болезни аортального клапана. Функция. Диагностика. Лечение. М.: Гоэтар-Мед, 2004; 328.
20. Pedrazzini G.B., Faletra F., Vassalli G.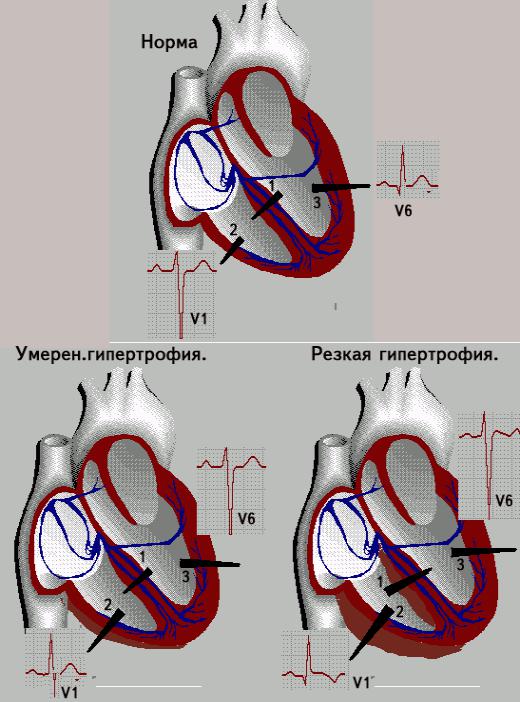 et al. Swiss Med Wkly. 2010 Jan 23;140(3-4):36-43.
et al. Swiss Med Wkly. 2010 Jan 23;140(3-4):36-43.
21. Дземешкевич С.Л., Стивенсон Л.У. Болезни митрального клапана. М.: Геотар-Мед, 2000; 287.
22. Левчук М.Н., Бондаренко Б.Б. Правый желудочек и межжелудочковое взаимодействие. Артериальная гипертензия. 2010; 16 (3): 321–324.
23. Бокерия Л.А., Скопин И.И., Мироненко В.А. и др. Дилатация левого желудочка при клапанных пороках сердца. Вопросы нозологии. Бюллетень научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева РАМН. Сердечно-сосудистые заболевания. 2005; 6 (6): 5–8.
24. Kret M., Arora R. Pathophysiological basis of right ventricular remodeling. J Cardiovasc Pharmacol Ther. 2007 Mar; 12 (1): 5–14.
25. Литасова Е.Е., Власов Ю.А., Караськов А.М. Приобретенные пороки – основные механизмы адаптации. Патология кровообращения и кардиохирургия. 1998; (2–3): 35–39.
26. Руководство по кардиологии. Под. ред В.Н.Коваленко. К: МОРИАН, 2008; 1424.
27. Duke M. Severe pulmonic stenosis in late adult life. Report of two cases. Dis Chest. 1967 Mar; 51 (3): 320–6.
28. Sidhu M., Goel P., Chopra A.K. et al. Surgical correction of congenital heart disease at 76 years of age. J Card Surg. 2010 Nov; 25 (6): 672–4.
29. Liuzzo J.P., Shin Y.T., Lucariello R. et al. Triple valve repair for rheumatic heart disease. J Card Surg. 2005 Jul-Aug; 20 (4): 358–63.
30. Boroomandpoor M., Abolghasemi S., Moshar S. et al. Isolated Pulmonary Valve Endocarditis. J Teh Univ Heart Ctr. 2009; 2: 119–120.
31. Gustafsson B.I., Hauso O., Drozdov I. et al. Carcinoid heart disease. Int J Cardiol. 2008 Oct 13; 129 (3): 318–24.
32. Hubatsch M., Pal K., Zoltan P. et al. A rare cause of pulmonary arterial hypertension diagnosed in an elderly patient. Pneumologia. 2010 Jul-Sep; 59 (3): 164–9.
33. Muthialu N., Raju V., Muthubaskaran V. et al. Idiopathic pulmonary artery aneurysm with pulmonary regurgitation. Ann Thorac Surg. 2010 Dec; 90 (6): 2049–51.
34. Oosterhof T., Hazekamp M.G., Mulder B.J. Opportunities in pulmonary valve replacement. Expert Rev Cardiovasc Ther. 2009 Sep; 7 (9): 1117–22.
Expert Rev Cardiovasc Ther. 2009 Sep; 7 (9): 1117–22.
35. Talwar S., Jayanthkumar H.V., Sharma G. et al. Quadrivalvular rheumatic heart disease. Int J Cardiol. 2006 Jan 4; 106 (1): 117–8.
36. Akram M., Khan I.A. Isolated pulmonic valve endocarditis caused by group B streprococcus (Streptococcus agalactiae) – a case report and literature review. Angiology. 2001 Mar; 52 (3): 211–5.
37. Bouzas B., Kilner P.J., Gatzoulis M.A. Pulmonary regurgitation: not a benign lesion. Eur Heart J. 2005 Mar; 26 (5): 433–9.
38. Ristow B., Ahmed S., Wang L. et al. Pulmonary regurgitation end-diastolic gradient is a Doppler marker of cardiac status: data from the Heart and Soul Study. J Am Soc Echocardiogr. 2005 Sep; 18 (9): 885–91.
39. Sandrock M., Schmidt-Trucksäss A., Schmitz D. et al. Influence of physiologic cardiac hypertrophy on the prevalence of heart valve regurgitation. J Ultrasound Med. 2008 Jan; 27 (1): 85–93.
40. Demirbağ R. Management of the tricuspid valve regurgitation Anadolu Kardiyol Derg. 2009 Jul; 9 Suppl 1: 43–9.
41. Bernal J.M., Gutierrez-Morlote J., Llorca J. et al. Tricuspid valve repair: an old disease, a modern experience. Ann Thorac Surg. 2004 Dec; 78 (6): 2069–74.
42. Shiran A., Sagie А. Tricuspid regurgitation in mitral valve disease incidence, prognostic implications, mechanism, and management. J Am Coll Cardiol. 2009 Feb 3; 53 (5): 401–8.
43. Chan K.M., Zakkar M., Amirak E. et al. Tricuspid valve disease: pathophysiology and optimal management. Prog Cardiovasc Dis. 2009 May-Jun; 51 (6): 482–6.
44. Seo H.S., Ha J.W., Moon J.Y. et al. Right ventricular remodeling and dysfunction with subsequent annular dilatation and tethering as a mechanism of isolated tricuspid regurgitation. Circ J. 2008 Oct; 72 (10): 1645–9.
45. Rostagno C., Rosso G., Puggelli F. et al. Active infective endocarditis: Clinical characteristics and factors related to hospital mortality. Cardiol J. 2010; 17 (6): 566–73.
46. Capoun R., Thomas M., Caputo M. , Asimakopoulos G. Surgical treatment of tricuspid valve endocarditis: a single-centre experience. Perfusion. 2010 May; 25 (3): 169–73.
, Asimakopoulos G. Surgical treatment of tricuspid valve endocarditis: a single-centre experience. Perfusion. 2010 May; 25 (3): 169–73.
47. Караськов А.М., Семенов И.И., Астапов Д.А. и др. Биопротезы «Кемкор» и «Перикор» при хирургическом лечении пороков трикуспидального клапана. Патология кровообращения и кардиохирургия. 2009; 1: 11–16.
48. Bernal J.M., Pontón A., Diaz B. et al. Surgery for rheumatic tricuspid valve disease: a 30-year experience. J Thorac Cardiovasc Surg. 2008 Aug; 136 (2): 476–81.
49. Shin H.W., Kim H., Yoon H.J. et al. Ovarian tumor-associated carcinoid heart disease presenting as severe tricuspid regurgitation. J Cardiovasc Ultrasound. 2011 Mar; 19 (1): 45–9.
50. Lin S.J., Chen C.W., Chou C.J. et al. Traumatic tricuspid insufficiency with chordae tendinae rupture: a case report and literature review. Kaohsiung J Med Sci. 2006 Dec; 22 (12): 626–9.
51. Rajani R., Sarangmath N., Mishra B. Massive right atrial myxoma. Int J Cardiol. 2008 Aug 1; 128 (1): 121–2.
52. Villagrán E., Silva J., Rodríguez J.E. Tricuspid valve stenosis due to a pacemaker lead. Rev Esp Cardiol. 2010 Dec; 63 (12): 1486.
53. Калягин А.Н. Особенности ведения больных с ревматическими пороками сердца и хронической сердечной недостаточностью. Современная ревматология. 2009; 3: 24–29.
54. Шматов Д.В., Железнев С.И., Астапов Д.А. и др. Непосредственные результаты протезирования аортального клапана у пациентов с аортальным стенозом и систолической дисфункцией левого желудочка. Патология кровообращения и кардиохирургия. 2010; 4: 17–22.
55. Goldstone A.B., Chikwe J., Pinney S.P. et al. Incidence, epidemiology, and prognosis of residual pulmonary hypertension after mitral valve repair for degenerative mitral regurgitation. Am J Cardiol. 2011 Mar 1; 107 (5): 755–60.
56. Kirali K., Omeroglu S.N., Uzun K. et al. Evolution of repaired and non-repaired tricuspid regurgitation in rheumatic mitral valve surgery without severe pulmonary hypertension. Asian Cardiovasc Thorac Ann. 2004 Sep; 12 (3): 239–45.
2004 Sep; 12 (3): 239–45.
57. Bernal J.M., Pontón A., Diaz B. et al. Combined mitral and tricuspid valve repair in rheumatic valve disease: fewer reoperations with prosthetic ring annuloplasty. Circulation. 2010 May 4; 121 (17): 1934–40.
58. McCarthy P.M., Bhudia S.K., Rajeswaran J. et al. Tricuspid valve repair: durability and risk factors for failure. J Thorac Cardiovasc Surg. 2004 Mar; 127 (3): 674–85.
59. Matsunaga A., Duran C.M. Progression of tricuspid regurgitation after repaired functional ischemic mitral regurgitation. Circulation. 2005 Aug 30; 112 (9) Suppl: 453–7.
60. Бокерия Л.А.,Косарева Т.И.,Макаренко В.Н. и др. Ремоделирование полостей сердца в зависимости от типа механического протеза после митрального протезирования. Сердечно-сосудистые заболевания. Бюллетень НЦССХ им. А.Н.Бакулева. 2010;11 (6): 54–61.
61. Kaplan M., Kut M.S., Demirtas M.M. et al. Prosthetic replacement of tricuspid valve: bioprosthetic or mechanical Ann Thorac Surg. 2002 F
Роль правого желудочка в патологии сердечно-сосудистой системы Текст научной статьи по специальности «Клиническая медицина»
Г.П. Нарциссова
Роль правого желудочка в патологии сердечно-сосудистой системы
ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздрава России, 630055, Новосибирск, ул. Речкуновская, 15, [email protected]
УДК 616 ВАК 14.01.05
Поступила в редколлегию 12 февраля 2014 г.
© Г.П. Нарциссова, 2014
В обзоре представлен современный подход к оценке структуры и функции правого желудочка, основанный на рекомендациях Американской ассоциации эхокардиографии, приведены нормативные значения. Показано клиническое значение нарушения функции правого желудочка и его важная роль в структуре сердечно-сосудистой патологии.
Ключевые слова: правый желудочек; структура и функция; эхокардиография.
В эхокардиографии исторически сложилось так, что наиболее изученным отделом сердца, имеющим специальные инструменты оценки и функции, является левый желудочек (ЛЖ). На этом фоне другие камеры, в том числе правый желудочек (ПЖ), изучены значительно слабее, хотя интерес к правому желудочку нарастает в течение последних двух десятилетий. Правый желудочек часто называют «забытым» или даже «бедным родственником» левого желудочка. Не так давно ПЖ считался менее важной частью нормальной циркуляции.
Функция ПЖ находилась в тени масштабных исследований функции ЛЖ. Однако в последнее время важность ПЖ стала очевидной. Наблюдается возрастание интереса к особой роли ПЖ и его влияния на глобальную функцию через бивентрикулярное взаимодействие [1, 2]. Первоначально исследователи пытались экстраполировать данные, полученные о левом желудочке, на правый желудочек [1, 3, 4].
Однако с самого начала было ясно, что левый и правый желудочки значительно отличаются по многим параметрам, хотя и имеют ряд объединяющих их признаков. Желудочки анатомически объединены системой кровоснабжения, фиброзно-мышеч-ным аппаратом, общей перегородкой, перикардом и внутригрудным давлением, подвержены тесному механическому и функциональному взаимодействию. Межжелудочковое взаимодействие выражается во взаимном влиянии сократимости, пост- и преднагрузки обоих желудочков, их взаимозависимости во время фаз систолы и диастолы как в норме, так и при поражениях миокарда [5, 6].
В то же время правый желудочек имеет свои особенности. Это отдельное эмбриологическое развитие, более тонкие стенки и большая податливость по сравнению с ЛЖ, неправильные треугольные очертания, более грубые трабекулы, модераторный пучок. Трикуспидальный и легочный клапаны не имеют общего фиброзного кольца. ПЖ имеет три анатомические области: приносящий тракт (синус), верхушку и выносящий тракт (конус), ПЖ сокращается перистальтической волной от синуса к конусу. ПЖ выполняет до 25% от работы ЛЖ, переносит нагрузку объемом лучше, чем нагрузку давлением. ПЖ имеет более низкую ФВ. Межжелудочковая перегородка имеет четко выраженные право- и левожелудочковую стороны (слои) [5, 6]. В отличие от ЛЖ кровоснабжение миокарда ПЖ осуществляется в большей части из бассейна правой коронарной артерии, он менее подвержен ишемии, чем левый.
Трикуспидальный и легочный клапаны не имеют общего фиброзного кольца. ПЖ имеет три анатомические области: приносящий тракт (синус), верхушку и выносящий тракт (конус), ПЖ сокращается перистальтической волной от синуса к конусу. ПЖ выполняет до 25% от работы ЛЖ, переносит нагрузку объемом лучше, чем нагрузку давлением. ПЖ имеет более низкую ФВ. Межжелудочковая перегородка имеет четко выраженные право- и левожелудочковую стороны (слои) [5, 6]. В отличие от ЛЖ кровоснабжение миокарда ПЖ осуществляется в большей части из бассейна правой коронарной артерии, он менее подвержен ишемии, чем левый.
В настоящее время для неинвазив-ной оценки ПЖ используют методы муль-тиспиральной компьютерной томографии, магнитно-резонансной томографии (МРТ), стресс-тесты, исследование сывороточных маркеров, эхокардиографию. Если для левого желудочка разработано много программ оценки структуры и функции, то для правого желудочка отдельных программ нет, и долгое время пытались применить к нему различные методы оценки ЛЖ. Были попытки исследовать объемы и фракцию выброса правого желудочка методом дисков из 4-камерной апикальной позиции, размеры из парастернальной позиции, разрабатывались нормативные показатели. Необходимо отметить, что долгое время не было
системного подхода и как такового протокола исследования правого желудочка. ПЖ исследовался фрагментарно, что не позволяло комплексно оценить его морфо-функцио-нальные особенности. Многие зарубежные исследователи показали сходные результаты при оценке систолической и диастолической функций ПЖ и ЛЖ методами эхокар-диографии, допплер-ЭхоКГ и тканевой допплерографии. В российских руководствах по эхокардиографии также описывались эти методы и приводились нормативные значения, однако любой врач ультразвуковой диагностики знает, насколько неточны измерения для ПЖ [3, 7, 8].
Ограничениями эхокардиографической диагностики состояния ПЖ являются неоптимальная визуализация вследствие его загрудинной локализации; невозможности обзора полости ПЖ целиком вследствие его серповидной формы и расположения приносящего и выносящего трактов в разных плоскостях; отсутствия адекватной эхо-кардиографической геометрической модели; трудности в очерчивании эндокардиальной поверхности ПЖ из-за неадекватной визуализации и выраженной трабекулярности; региональная гетерогенность сократимости и релаксации ПЖ; значительная зависимость ПЖ от пред- и постнагрузки, а также давления в левых отделах сердца.
Неинвазивная оценка ПЖ включает в себя исследование структуры (размеры, объем, форма), внутренней архитектуры (гипертрофия, масса, тканевые характеристики) и функции ПЖ (индексы контрактильности, сегментарная функция, диастолические параметры, систолическое давление в легочной артерии, постнагрузка ПЖ). В рекомендациях Американской ассоциации эхокардиографии (ASE) (2006) по оценке камер сердца наряду с показателями левого желудочка были приведены нормативные значения для правого желудочка и правого предсердия. Однако по мере накопления опыта изменились подходы к оценке ПЖ и пересмотрены нормативные значения [9]. В 2010 г. опубликованы новые рекомендации ASE по эхокардиографии ПЖ у взрослых (Guidelines for the Echocardiography Assessment of the Right Heart in Adults), которые используют по настоящее время. В этих рекомендациях, в частности, приводятся измененные нормативные показатели размеров и функции ПЖ: базальный поперечный размер >4,2 см, средний поперечный размер >3,5 см, базально-апикальный размер >8,6 см, толщина миокарда 0,3-0,5 см. Также были изменены нормы для правого предсердия: максимальная длина 5,3 см, малая дистанция 4,4 см, площадь 18 см2 [10].
Для оценки ПЖ ASE рекомендует использовать 14 позиций: апикальные, парастернальные, субкостальные по длинной и короткой осям. Важно исследовать все доступные планы, чтобы дать полную оценку общей и сегментарной структуры и функции ПЖ. Что касается оценки объема и фракции выброса ПЖ, то в настоящее время их измерение в 2D-режиме не рекомендуется из-за разнородности методов и сложной геометрической формы.
Для исследования систолической функции рекомендован показатель FAC (fractional area change), или ФИП (фракционное изменение площади), которое вычисляется
по формуле: ФИП = (КДП — КСП) / КДП х 100%, где КДП -конечная диастолическая площадь ПЖ, КСП — конечная систолическая площадь ПЖ в 4-камерной позиции. FAC хорошо коррелирует с функцией ПЖ по данным радио-нуклидной вентрикулографии или МРТ и служит хорошим прогностическим предиктором. Применение методики ограничено невозможностью измерения FAC при неадекватной визуализации. Нормальные значения для FAC составляют 60-35%.
FAC хорошо коррелирует с функцией ПЖ по данным радио-нуклидной вентрикулографии или МРТ и служит хорошим прогностическим предиктором. Применение методики ограничено невозможностью измерения FAC при неадекватной визуализации. Нормальные значения для FAC составляют 60-35%.
Вычисление объемов и ФВ ПЖ возможно с использованием метода трехмерной эхокардиографии (3D-Echo). Это перспективная методика, позволяющая реконструировать очертания структур и полостей сердца в режиме реального времени. Обнаружена корреляция ФВ и КДО ПЖ, измеренных в 3D режиме, с данными МРТ. Нижний предел для ФВ 44%. Рекомендуется зарезервировать трехмерные методы для вычисления объема и определения ФВ правого желудочка.
Простым методом оценки систолической функции ПЖ является измерение TAPSE (Tricuspid annular plane systolic excursion) — систолической экскурсии плоскости трикуспидального кольца в М-режиме. Показатель TAPSE легко доступен, в норме составляет 1,6-2,0 см. TAPSE <16 мм указывает на систолическую дисфункцию ПЖ, например у пациентов с нижнебазальным острым инфарктом миокарда и вовлечением ПЖ и у пациентов с сердечной недостаточностью (СН).
Индекс миокардиальной сократимости, или индекс Tei (MPI — myocardial performance index) — это индекс функции миокарда ПЖ, который используется для оценки глобальной систолической и диастолической функции правого желудочка. Этот показатель называют еще индексом функции миокарда ПЖ (ИФМ). Это отношение общего времени изоволюмической активности к времени, затраченному на систолическое изгнание. Индекс Tei рассчитывается по формуле: ИФМ = (IVRT + IVCT) / ET, где IVRT — время изоволюмического расслабления; IVCT — время изоволю-мического сокращения; ET — время изгнания. Индекс Tei может быть рассчитан с использованием импульсно-вол-нового (PW) допплера либо тканевого допплера (TDI). Норма индекса Tei для PW Doppler >0,40, для TDI >0,55. IVCT увеличивается при систолической дисфункции и приводит к уменьшению периода изгнания (ET). IVRT увеличивается при нарушении диастолической функции. При прогрес-сировании миокардиальной дисфункции индекс увеличивается вследствие изменения всех трех временных его компонентов. ИФМ хорошо коррелирует с ФК СН и выживаемостью пациентов, сравнительно независим от геометрии, пред- и постнагрузки ПЖ, трикуспидальной регургита-ции и ЧСС [6].
IVCT увеличивается при систолической дисфункции и приводит к уменьшению периода изгнания (ET). IVRT увеличивается при нарушении диастолической функции. При прогрес-сировании миокардиальной дисфункции индекс увеличивается вследствие изменения всех трех временных его компонентов. ИФМ хорошо коррелирует с ФК СН и выживаемостью пациентов, сравнительно независим от геометрии, пред- и постнагрузки ПЖ, трикуспидальной регургита-ции и ЧСС [6].
Важным параметром, отражающим глобальную систолическую функцию миокарда, является оценка скорости движения миокарда ПЖ методом тканевой допплерографии. Снижение пиковой систолической скорости S’ движения трикуспидального кольца S'<10 см/с — индикатор систолической дисфункции ПЖ, который хорошо коррелирует с другими индексами.
Для оценки деформации ПЖ используют также показатели Strain и Strain Rate. Деформация (Strain) выявляет количество (амплитуду) локальной мгновенной деформации, в то время как скорость деформации (Strain rate) отражает скорость укорочения волокон, обеспечивая независимые от преднагрузки маркеры сократительной функции. Согласно рекомендациям ASE (2010), их использование пока ограничено для рутинного применения из-за недостаточного накопления нормативных данных. Эти методы остаются инструментом исследования в научных лабораториях. Оценку диастолической функции ПЖ рекомендуется рассматривать у пациентов с подозрением на дисфункцию ПЖ как маркер ранней или скрытой дисфункция ПЖ или у пациентов с известными нарушениями правожелудочко-вой функции как маркер неблагоприятного прогноза [10]. Транстрикуспидальные показатели Е/А, E/E’ и размер ПП являются предпочтительными. Классификация диастолической дисфункции ПЖ в рекомендациях ASE представлена следующим образом: Е/А <0,8 — нарушение релаксации; Е/А от 0,8 до 2,1 и Е/ Е’соотношение >6 или диастолическое преобладание потока в печеночных венах — псевдонормальный тип; Е/А >2,1 с DT <120 мс — рестриктивный тип. Диа-столическая дисфункция — маркер ранней или скрытой дисфункции ПЖ или у пациентов с известными нарушениями правожелудочковой функции как предиктор неблагоприятного прогноза.
Диа-столическая дисфункция — маркер ранней или скрытой дисфункции ПЖ или у пациентов с известными нарушениями правожелудочковой функции как предиктор неблагоприятного прогноза.
В исследование ПЖ входит оценка степени тяжести ЛГ — расчет систолического (СДЛА/СДПЖ) и среднего давления в легочной артерии (ЛА). Систолическое давление в ЛА рекомендовано рассчитывать по скорости трикус-пидальной регургитации и систолическому градиенту с добавлением давления в ПП [6, 10-12]. Приводим нижние пограничные значения размеров и индексов ПЖ, отделяющие норму от патологии [10].
ПЖ базальный диаметр, см >4,2
ПЖ толщина, см >0,5
ВОПЖ дисгальный, см >2,7
ВОПЖ проксимальный, см >3,3
ПП длина, см >5,3
ПП ширина, см >4,4
ПП площадь, см2 >18
TAPSE, см <1,6
PW Doppler peak velocity at the annulus S’ см/с <1 0
PW Doppler MPI >0,40
Tissue Doppler MPI >0,55
FAC, % <35
E/A <0,8 или >2,1
E/E’ >6
Deceleration time, мс <120
Количественная оценка размера и функции ПЖ имеет важное клиническое и прогностическое значение при ряде сердечно-сосудистых заболеваний. Изучение роли и функции правых отделов сердца и особенностей их ремо-делирования при многих заболеваниях (пороки сердца, тромбоэмболия легочной артерии и ее осложнения, кар-
диомиопатии, сочетанная кардиореспираторная патология, сердечная недостаточность, гипертоническая болезнь и др.) представляет большой научный и практический интерес [13].
С точки зрения существующих известных врожденных и приобретенных, в том числе ятрогенных нозологий, можно сказать, что ПЖ «рожден быть плохим», поскольку любая его перегрузка немедленно ведет к дилатации. Дила-тация ПЖ определяется по результатам морфометрии, а также если соотношение КДР ПЖ/ЛЖ >0,6 по короткой оси, ПЖ/ЛЖ >2/3 по длинной оси в 2-камерной позиции, а верхушка сердца формируется ПЖ.
Причины дилатации ПЖ — перегрузка объемом, сопротивлением, трикуспидальная и легочная регургита-ция, кардиомиопатии и др. [6]. При ряде врожденных пороков сердца (ВПС) наблюдается гипоплазия ПЖ, характеризующаяся уменьшением полости правого желудочка, возникшим вследствие недоразвития приточного или тра-бекулярного отделов либо выраженной гипертрофии миокарда в трабекулярном отделе желудочка. Гипоплазия правого желудочка как изолированная патология встречается редко. Однако в сочетании с другими пороками синдром гипоплазии правого желудочка встречается чаще. Это выраженный стеноз или атрезия легочной артерии, тетрада Фалло, атрезия трикуспидального клапана и др.
Гипертрофия миокарда ПЖ связана с ростом карди-омиоцитов. В норме масса миокарда ПЖ в три раза меньше массы ЛЖ. При резко выраженной гипертрофии масса ПЖ превышает массу ЛЖ. Гипертрофия ПЖ — обычно результат систолической перегрузки давлением, выравнивания межжелудочковой перегородки (или даже D формирование ПЖ). Причинами гипертрофии миокарда правого желудочка являются легочная гипертензия, гипертрофическая кардиомиопатия, амилоидоз, митральный стеноз, конечная стадия аортального стеноза, стеноз или атрезия легочной артерии, тетрада Фалло и др.
При всех этих состояниях правый желудочек может быть активным или гипокинетичным со снижением его функции и развитием сердечной недостаточности. Еще недавно роль контрактильной функции ПЖ считалась гемодинамически незначительной. Сегодня признано большое клиническое и прогностическое значение право-желудочковой недостаточности.
«Чистая», или первичная, ПЖ недостаточность выявляется редко и в большинстве случаев связана с ВПС. Вторичная правожелудочковая недостаточность ассоциирована с широким кругом заболеваний как сердечной, так и несердечной природы, нередко с вовлечением в патологический процесс ЛЖ. При этом дисфункция ПЖ появляется параллельно или вторично к дисфункции ЛЖ через повышение давления в МКК и межжелудочковое взаимодействие. В связи с этим правожелудочковую недостаточность можно представить как синдром с различной этиологией, сопровождающийся снижением сократительной функции.
Острая правожелудочковая недостаточность характеризуется клинической картиной острого легочного
РисЛ.
Гипертрофия миокарда и уменьшение полости ПЖ у пациента с рестриктивной кардиомиопатией.
Рис. 2.
Дилатация правого желудочка при острой ТЭЛА.
Рис. 3.
Выраженная легочная регургитация у пациента в отдаленном периоде после радикальной коррекции тетрады Фалло.
сердца с застоем крови в большом круге кровообращения. Причинами острой ПЖ недостаточности является тромбоэмболия легочной артерии (ТЭЛА), тяжелая острая легочная патология (спонтанный клапанный пневмоторакс, ателектаз, долевая пневмония, продолжительный астматический статус), острый диффузный миокардит, инфаркт миокарда правого желудочка, инфаркт миокарда левого желудочка с распространением на правый, инфаркт миокарда с разрывом межжелудочковой перегородки и др. При быстром увеличении давления в легочной артерии, например при острой легочной эмболии, ПЖ резко увеличивается, что приводит к расширению трикуспидального кольца и трикуспидальной регургитации с клиническими признаками правожелудочковой недостаточности [14].
Хроническая правожелудочковая недостаточность встречается чаще, чем острая, и обычно развивается в результате хронической легочной гипертензии. Правожелудочковая недостаточность сопровождается снижением сократительной функции. Это может наблюдаться при поражении миокарда ПЖ (инфаркте ПЖ, кардиомиопатиях, после кардиохирургической операции, кардиомиопатиях ПЖ и др.). Левожелудочковая сердечная недостаточность наиболее распространена, при этом повышение давления в МКК и межжелудочковое взаимодействие могут привести к недостаточности ПЖ.
Одной из ведущих причин дисфункции ПЖ являются ИБС, ишемия и инфаркт миокарда ПЖ. Изолированный инфаркт миокарда ПЖ встречается редко, у 3-5% больных, умерших от инфаркта миокарда. Гораздо чаще инфаркт миокарда ПЖ выявляют в сочетании с трансму-
ральным инфарктом миокарда ЛЖ нижней локализации и заднего сегмента МЖП. Примерно у 30% пациентов с нижним инфарктом в той или иной степени поражается правый желудочек. Часто обширный инфаркт ведет к тяжелой правожелудочковой недостаточности. Правожелудочковая дисфункция — один из самых мощных независимых предикторов исхода после инфаркта миокарда, даже в отсутствии инфаркта миокарда ПЖ. Аналогичные результаты были показаны у больных с ХСН и выживших через год после инфаркта [13, 15].
При нагрузке объемом (трикуспидальная или легочная регургитация, ВПС с внутрисердечным шунтом) также может развиваться дисфункция миокарда и правожелудочковая недостаточность. Причинами трикуспидальной регургитации могут быть как заболевания трикуспидального клапана (карциноидные заболевания, ревматизм, миксоматозная дегенерация, врожденные пороки, дисп-лазия соединительной ткани и др.), так и состояние правого желудочка и малого круга кровообращения. Легочная регургитация чаще всего обусловлена легочной гипертен-зий, реже наблюдается в отдаленном периоде после хирургического лечения ряда ВПС.
В последние годы растет число взрослых пациентов после операции радикальной коррекции тетрады Фалло с послеоперационной тяжелой легочной регургитацией, которая приводит к выраженной дилатации и дисфункции ПЖ, что служит показанием к замене клапана легочной артерии [17].
При нагрузке сопротивлением (легочная гипертен-зия, тяжелый сепсис, трансплантация сердца, ВПС, мит-
ральный стеноз, аортальный декомпенсированный стеноз, длительная искусственная вентиляция легких, кардиоми-опатии ЛЖ) также развивается дисфункция и недостаточность ПЖ. У пациентов с констриктивным перикардитом конечное диастолическое давление в желудочках становится равным. Подобная физиология может наблюдаться и у пациентов с большим количеством плеврального выпота и ХОБЛ, в конечной стадии легочной болезни.
Легочная гипертензия и дисфункция ПЖ развиваются при многих критических заболеваниях, после карди-охирургической операции с искусственным кровообращением и могут быть связаны с плохим прогнозом. Снижение функции правого желудочка — частое явление после открытой сердечной хирургии. Объяснение тому — перикард-эктомия, «оглушенный» миокард, ишемическое повреждение из-за неоптимальной миокардиальной защиты ПЖ во время операции, механическое повреждение правого предсердия и др. [16, 18-20].
Таким образом, ремоделирование ПЖ, правожелудочковая дисфункция и недостаточность имеют важное клиническое и прогностическое значение. Эхокардиогра-фия — доступный метод для оценки функции ПЖ и является исследованием первой линии, обеспечивающим достоверную информацию о размерах, структуре и функции ПЖ, межжелудочковых взаимодействиях. В связи с этим представленные данные по эхокардиографическому исследованию ПЖ необходимо включить в рутинный протокол врача.
Список литературы
1. Sheehan F. // Heart. 2008. V. 94. P. 1510-1515.
2. Жаринов О.И., Салам С., Коморовский Р.Р. // Кардиология. 2000.
№ 11. С. 45-49.
3. Бакшеев В.И., Коломоец Н.М., Турсунова Г.Ф. // Клиническая медицина 2006. V. 10. P. 16-23.
4. Нарциссова Г.П. // Патология кровообращения и кардиохирургия. 2001. № 1. С. 94-98.
5. Haddad F. // Circulation. 2008. V. 117. P. 1436-1448.
6. Safford R. // Новости медицины и фармации. Кардиология. 2011. № 359.
7. Клиническое руководство по ультразвуковой диагностике. М.,
2007. Т. 5.
8. Рыбакова М.К, Алехин М.Н., Митьков В.В. Практическое руководство по ультразвуковой диагностике. Эхокардиография. М.,
2008.
9. Lang R.M., Bierig M., Devereux R.B.et al. // J. Am. Soc. Echocardiogr. 2005. V. 18. P. 1440-1465.
10. Rudski L.G., Lai W.W., Afilalo J. et al. // J. Am. Soc. Echocardiogr. 2010. V. 23. P. 685-713.
11. Поташев С.В. // Серцева недостатнкть. 2011. № 1. С. 25-33.
12. Demirkol S., Unlu M. // Arslan Anadolu Kardiyol. Derg. 2013. V. 13. P. 103-107.
13. Piazza G., Goldhaber S.Z. // Chest. 2005. V. 128. P. 1836-185.
14. Матвеева Н.В., Нарциссова Г.П., Карпенко А.А., Чернявский М.А. // Патология кровообращения и кардиохирургия. 2013. № 1. С. 11-14.
15. Fakhri A.A., Haghes-Doichev R.A. et al. // Heart Failure Clin. 2012. V. 20. P. 353-372.
16. Price L.C. // Critical Care. 2010.
17. Нарциссова Г.П., Прохорова Д.С., Матвеева Н.В. и др. // Патология кровообращения и кардиохирургия. 2012. № 2. С. 15-19.
18. Айрапетян Г.Г., Адамян К.Г, Аракелян И.А. // Международный на-учно-исследоват. журнал. Медицинские науки. 2013.
19. Parashar S.K. // Medicine Update. 2010. V. 20. Р. 288-294.
20. Price L.C., Wort S.J., Finney S.J. // Critical Care. 2010. V. 14. Р. 169.
Аномалия Эбштейна
Этот порок встречается редко, но может быть очень опасным. У него множество клинических масок. Суть его заключается в том, что трехстворчатый клапан по каким-то причинам смещен в полость правого желудочка, т.е. расположен не на своем месте (между правым предсердием и правым желудочком), а значительно ниже по току крови. При этом полость правого предсердия оказывается гораздо больше нормальной, а правого желудочка — меньше нормальной. Часть предсердия, в которое теперь входит участок желудочка, называют «атриализованной» частью желудочка, и она может достигать значительных размеров за счет уменьшенной полости самого желудочка. Створки самого клапана также ненормальны: они смещены, неправильно развиты, как и весь мышечный и хордальный аппарат, приводящий их в движение. Сопутствующим, и, в сущности, жизнеспасающим пороком является дефект в межпредсердной перегородке, через который происходит сброс «справа налево» из-за постоянного переполнения растянутой камеры огромного правого предсердия.
Дети с аномалией Эбштейна рождаются с цианозом, который через 2-3 месяца может уменьшиться, т.к. сопротивление сосудов легких, высокое в периоде новорожденности, снижается. Но, если дефект в перегородке небольшой, то состояние половины детей становится в этот период критическим, и они могут погибнуть от нарастающей сердечной недостаточности и осложнений цианоза уже в первые недели жизни. При таком течении необходимо экстренно расширить дефект баллоном, т.е. сделать процедуру Рашкинда. Это на первых порах увеличит объем сброса «справа налево» и облегчит работу правым отделам сердца. Но, если явления будут нарастать, то это может быть показанием к ранней коррекции, хотя и не очень желательной из-за небольших размеров сердца.
Однако, большинству детей этого не потребуется. Их состояние будет разным, как и степень цианоза и признаков сердечной недостаточности. Степень смещения клапанного кольца, состояние створок клапана, величина «атриализованной» части желудочка, ставшей теперь частью правого предсердия, очень индивидуальны. Нередко больные при незначительных анатомических изменениях в сердце (умеренное смещение клапана, не выраженная недостаточность, сохранная функция правого желудочка) живут 10–15 лет и, кроме синюшного цвета кожи и слизистых их может ничего не беспокоить. Однако, одними из самых частых нарушений, сопутствующих, как правило, аномалии Эбштейна, являются различные нарушения ритма сердца. Это закономерно, т.к. узлы и пути проводящей системы находятся именно в правых отделах сердца и обязательно затрагиваются как самим пороком, так и его последствиями (стенка правого предсердия, которая проводит электрический импульс при каждом сердечном сокращении, растягивается). Несмотря на вполне удовлетворительное состояние части больных, они обязательно должны постоянно наблюдаться у кардиолога, и хирургическое лечение рано или поздно — необходимо.
Выбор времени операции целиком зависит от состояния ребенка. Но при «благоприятном» течении этого порока вполне возможно отложить операцию до подросткового возраста, естественно, если нет угрожающих жизни осложнений.
Дело в том, что операция будет направлена на полное исправление порока, т.е. она является радикальной. Производят ее на открытом сердце, в условиях искусственного кровообращения. Лишний участок предсердия устраняется путем ушивания, а трехстворчатый клапан с помощью швов приподнимается и укрепляется в позиции, близкой к нормальной. Если это невозможно, то его иссекают и заменяют искусственным протезом. Попутно устраняются участки, которые могут быть источниками нарушения ритма. Иными словами, хирурги пытаются либо сделать пластику клапана, т.е. восстановить целостность створок и обойтись без искусственных материалов в полости сердца, либо вшить протез. Конечно, первое — предпочтительнее, но и протезирование, хотя и имеет недостатки, является надежным и хорошо отработанным методом. К сожалению, часто вопрос о выборе — пластика или протезирование — окончательно решить можно только на операционном столе. Перед операцией вам должны точно объяснить все возможные варианты и рассказать о том, что ожидает ребенка после нее.
Понятно, что, если речь идет о протезировании клапана, то его лучше делать позже, когда размеры сердца достаточны, чтобы можно было поставить протез, рассчитанный на максимально длительный срок. Ведь, по мере роста ребенка, растет, увеличиваясь в размерах, и его сердце, и в какой-то момент жизни отверстие, где находится протез клапана, окажется относительно узким — стенотичным.
Протезы клапанов
Скажем несколько слов о том, что из себя представляют протезы клапанов. Протез – это искусственный клапан, который выполняет функцию естественного. Представьте себе металлическое, или гибкое пластиковое, кольцо, обтянутое подушкой из синтетического материала (через нее будут накладываться швы — без этого пришить протез нельзя). Сам клапан, находящийся внутри кольца и осуществляющий механизм закрытия и открытия «шлюза», бывает разным. Он может быть сделан из биологического материала (как правило, клапана свиньи, который по размерам и форме вполне соответствует клапану человека). Его делают также из ткани сердечной сорочки человека, выкраивая из него полулуния створок и пришивая к основанию кольца. Изготовление клапанов — это отдельная отрасль медицины, их делают вручную, в лабораториях, а потом обрабатывают и хранят в особых условиях. У такого готового клапана три створки, и он очень похож на естественный полулунный клапан аорты или легочного ствола. Механический клапан целиком состоит из титанового сплава, имеет две подвижные створки и представляет удивительное совершенство современной технологии в медицине. Такие клапаны разработаны давно, но постоянно улучшаются как в конструкции, так и в составе. Они так же промышленно выпускаются и применяются в кардиохирургии уже не одно десятилетие.
Выбор клапана — биологический или механический — заключается в том, что при первом ребенку не надо в течение всей жизни регулярно принимать лекарства, «разжижающие» кровь и предотвращающие образование сгустков на клапане, а при втором это абсолютно необходимо. С другой стороны, механический клапан, может функционировать дольше — годы и десятилетия — без замены, если правильно соблюдать режим и прием лекарств. Обо всем этом вам должны подробно рассказать, но в конечном счете, ваше мнение о выборе того или иного вида протеза, не может быть определяющим.
Результаты операций в целом хорошие как непосредственные, так и отдаленные, и их нужно ожидать у 90 процентов оперированных больных.
Если у вас выявлены данные симптомы и признаки необходимо провести тщательное исследование сердца. Если состояние пациента ухудшается, отмечается увеличение сердца, а также различные осложнения, необходимо проводить хирургическое лечение. Терапия включает в себя терапевтическое и хирургическое лечение.
Аномалия Эбштейна: симптомы
Зачастую пациенты с данным пороком могут не испытывать дискомфорта и неприятных ощущений долгое время. Даже пациенты с резко измененным клапаном могут иметь лишь незначительные проявления порока. Симптомы и признаки развиваются длительно и включаются в себя:
- Одышка;
- Повышенная утомляемость, преимущественно при физической нагрузке;
- Отеки нижних конечностей;
- Различные нарушения ритма;
- Изменение окраски кожи и губ.
Обычно у новорожденных с аномалией Эбштейна признаки изменения цвета кожи появляются раньше, чем признаки сердечной недостаточности. Появление вышеуказанных симптомов в столь раннем возрасте указывает на тяжелое поражение и требует безотлагательного лечения.
У детей более старшего возраста определяются признаки сердечной недостаточности: повышенная утомляемость, одышка, возникающая преимущественно во время физической активности (игры), также ребенок может указать на чувство тяжести в области сердца. Также вы можете отметить наличие цианоза каймы губ и кончика пальцев.
Причины
Сердце человека состоит из четырех камер: две верхние камеры — предсердия (левое и правое), две нижние — желудочки, стенки желудочков толстые и мощные, так как они должны выполнять работу по выбросу крови ко всем органам и системам человека. Между предсердиями и желудочками находятся клапаны, своеобразные двери, которые плотно смыкаются и открываются только в одну сторону, обеспечивая принцип одностороннего движения крови в организме. При аномалии Эбштейна происходит смещение трикуспидального клапана в сторону правого желудочка, в результате чего объем желудочка уменьшается, а правое предсердие становится большим. К тому же сам клапан недоразвит и нарушается как функционирование левого желудочка, так и предсердия, так как кровь из желудочка снова возвращается в правое предсердие, вызывая его перегрузку, также возникает и перегрузка желудочка. Изменения, которые претерпевает клапан различны, и степень поражения может варьировать от незначительной до резкой деформации и значительного его смещения. При данной патологии, как мы уже говорили, происходит перегрузка правого предсердия и желудочка, что, в конечном счете, ведет к развитию правожелудочковой сердечной недостаточности.
Причины, которые ведут к образовании. Врожденных пороков, пока остаются неясными, но известно, что и генетический и внешние факторы играют немаловажную роль. В очень редких случаях было выявлено, что если мать во время беременности принимала препараты лития или болела рядом инфекционных заболевания, то ребенок рождался с аномалией Эбштейна.
Сопутствующие дефекты
При аномалии Эбштейна возможно наличие других врожденных пороков сердца:
Дефект межпредсердной перегородки
Более 50% с аномалией Эбштена имеют дефект в межпредсердной перегородке. В связи с наличием этого дефекта венозная, бедная кислородом кровь, смешивается с оксигенированной кровью левого предсердия. В связи с этим в системный кровоток попадает менее обогащенная кислородом кровь, что, несомненно, ухудшает состояние пациента. Также при наличии ДМПП увеличивается риск образования тромбов, которые с током венозной крови могут попасть через дефект в артериальное русло и привести к инсульту. При оперативном вмешательстве по поводу аномалии Эбштейна, если хирург обнаружит дефект межпредсердной перегородки, он обязательно устранит его.
-
Нарушения ритма
В нашем сердце в правом предсердии располагается определенная группа клеток, которая способна индуцировать импульсы, которые по определенному пути распространяются по миокарду , обеспечивая синхронную работу всех камер сердца. При аномалии Эбштейна может быть несколько дополнительных путей распространения импульса, что в свою очередь вызывает нарушения ритма, так называемые тахиаритмии, которые значительно ухудшают состояние человека, а в ряде случаев могут привести к потере сознания при высокой частоте сердечного ритма. Также в связи с перегрузкой правого предсердия возникает его расширение, что является благоприятной средой для формирования трепетания предсердий.
Когда необходимо обратиться к врачу
Если вы заметили, что ребенок быстро устает, у него одышка, когда он не только играет, но и просто спокойно сидит, окружающие отмечают цианоз губ и пальцев — вам необходимо обратиться к педиатру, который направит вашего ребенка на консультацию к специалисту по врожденным порокам сердца.
Диагностика
Если у вас нет каких-либо внешних признаков врожденного порока сердца, то заподозрить какое-либо нарушение врач может, услышав шум при аускультации сердца. Однако, наличие шума, не всегда указывает на органическое поражение сердца. Это может быть и функциональный шум. Тем не менее, если врач подозревает наличие у вас или у вашего ребенка врожденного порока сердца – вам необходимо пройти специальное инструментальное исследование для уточнения диагноза.
Рентгенография органов грудной клетки
рентгенография органов грудной клетки может выявить увеличение размеров сердца, что может указывать на наличие, в частности, аномалии Эбштейна.
Эхокардиография
Это исследование позволяет четко визуализировать структуры сердца. При помощи ультразвукового датчика врач проводит исследование предсердия, желудочков и клапанов между ними, крупных сосудов и их клапанного аппарата. Благодаря этому методу врач с высокой точность поставить диагноз аномалии Эбштейна, а также измерит все необходимые параметры (как размеры, так и функциональные характеристики сердца).
Электрокардиография
Позволяет определить наличие сопутствующих нарушений ритма, а также определить, если у вас дополнительные пути проведения, которые вызывают тахиаритмию.
Холтеровское мониторирование ЭКГ
Это исследование проводится , как правило, в течение 24–48 часов , благодаря чему, можно выявить нарушения ритма, которые возникают периодически, без какой –либо закономерности.
Зондирование сердца
Данный метод исследования редко используется при аномалии Эбштейна, так как такие неинвазивные методики как эхокардиография, дают полный объем информации по данной патологии.
Осложнения
До определенного времени пациенты с аномалией Эбштейна могут и не испытывать каких-либо неприятных симптомом и вести обычный образ жизни. Но при данном пороке возможны и нарушения ритма, развитие сердечной недостаточности, также повышается риск внезапной сердечной смерти, инсульта.
Физическая активность
В зависимости от выраженности поражения клапанного аппарата, а также функциональных особенностей в каждом индивидуальном случае врач также посоветует и разный уровень физической активности. Следует помнить, что все решается в индивидуальном порядке.
Беременность с аномалией Эбштейна
Женщина с Аномалией Эбштейна может благополучно выносить и родить здорового ребенка. Но во время беременности возрастает объем циркулирующей крови, что приводит к дополнительной нагрузке на сердечную мышцу, что может привести к декомпенсации порока и возникновению жизнеугрожающих осложнений. Поэтому беременность должна быть спланирована и ведение беременности должно проводится врачом кардиологом совместно с акушером-гинекологом. А родовспоможение — в условиях специализированного стационара.
Лечение порока — аномалия Эбштейна
Если у вас нет симптомов или нарушений ритма сердца, то ваш доктор может просто порекомендовать тщательный контроль вашего состояния с регулярным обследованием: Общий осмотр, электрокардиография, рентгенография грудной клетки, эхокардиография и,холтеровское мониторирование
Терапевтическое лечение
Если у вас есть проблемы с сердечным ритмом, то, скорее всего, вам будет назначен препарат из группы антиаритмиков. Обычно используются бета-блокаторы, блокаторы кальциевых каналов, сердечные гликозиды. А если у вас выявлены признаки сердечной недостаточности, то врач прибегнет к назначению диуретиков, сердечных гликозидов, ингибиторов АПФ
Хирургическое лечение
Возможно несколько путей хирургического лечения аномалии Эбштейна. Если ткани трикуспидального клапана позволяют провести пластику (реконструкцию) клапана, то проводится клапаносохраняющая реконструктивная операция. Но в большинстве случаев проводится имлантация нового клапана (обычно в нашей клинике используют биологические протезы). Также во время операции в миокард правого желудочка или интракоронарно водятся стволовые клетки, для развития новых клеток миокарда, которые смогут помочь правому желудочку начать работать в новых, нормальных, но не привычных для него условиях.
Если во время диагностики были выявлены сопутствующие дефекты сердца, то проводится их параллельное устранение. Также во время операции на открытом сердце осуществляется устранение дополнительных путей проведения электрического импульса, которые вызывают тахиаритмию.
Необходимо помнить, что после кардиохирургической операции необходимо соблюдать режим приема лекарственных препаратов, так как прекращение приема раньше времени (например антикоагулянтов) может привести к тяжелым последствиям вплоть до смертельного исхода.
Помните, что пациенты с врожденным пороком сердца и после операции являются полноценными членами общества и могут вести нормальный образ жизни. Единственным ограничением, которое будет отличать вас от окружающих — вы будете чуть чаще посещать вашего врача, но всегда только с хорошими новостями о том, что вы здоровы и все у вас будет хорошо.
A Pulmonary Trunk Banding Model of Pressure Overload Induced Right Ventricular Hypertrophy and Failure
Please note that all translations are automatically generated.
Мы представляем хирургический метод побудить гипертрофия правого желудочка и неудачи в крыс.
Этот метод может помочь ответить на ключевые вопросы о базовых механизмах и лечении отказа правого желудочка. Основным преимуществом этого метода является то, что он позволяет точное и воспроизводимое увеличение после нагрузки, что вызывает гипертрофию правого желудочка и отказ. Последствия этого метода распространяются на терапию правого желудочка неудачи, потому что он устраняет эффекты вторичной для легочной вазодилатации.
Перед началом процедуры изоляции ствола выберите соответствующий диаметр для полосы и отрегулируйте клип-приложение лигатинга до тех пор, пока расстояние между челюстями не будет на один миллиметр, когда клип полностью сжат, оставляя люмен в 6 миллиметров. Далее, подтвердить отсутствие реакции в крайнем случае в анестезировали 100 до 120-граммовый Wistar крысы отрумянивания и сделать двухсантиметровый разрез кожи вдоль средней линии грудины. Под рассеченным микроскопом вырезать основные грудной мышцы на его стернальной привязанности и определить второй, третий и четвертый costae.
Используйте ножницы, чтобы сократить четвертый, третий и второй costae близко к грудине и тщательно вскрыть межреберных мышц до полного левого торакотомии была выполнена. При выполнении левой боковой торакотомии вы должны быть очень осторожны, как левая внутренняя маммориальная артерия просто ниже грудной клетки, так что будьте очень осторожны. Вставьте ретрактор между грудиной и costae и откройте челюсти, пока тимус не будет виден в верхней части поля просмотра.
Используйте пиен тибры тщательно перевернуть тимуса подвергать аорты и легочного ствола и направлять кончик небольшой хирургический крючок, согнутый до 85 градусов угол, через обратный пазухи паракардии за левым придатком предсердий. Потяните крючок на полпути назад через пазуху и направлять кончик уха крюк вверх, пока он не появится между восходящей аорты, и легочный ствол. При размещении ухо крючок убедитесь, что у вас есть правильный угол.
Вы не должны использовать любую силу это может быть немного трудно на начальном этапе, но вы можете освоить его с практикой. Используйте ножницы радужной оболочки глаза, чтобы удалить любые соединительной ткани, покрывающей кончик, чтобы отделить ствол легких от восходящей аорты. Используйте угловые foreceps для руководства 10 сантиметров кусок 4/0 мультифилимантной лигатуры вокруг легочного ствола через проход, сделанный крючком.
Захватите конец лигатуры с помощью другого типса. Ствол легких теперь должен быть отделен от восходящей аорты и может контролироваться лигатурой вокруг него. Когда легочный ствол был обеспечен, используйте зажим для того чтобы нагрузить регулировать applier зажима лигатинга.
Тщательно руководство одной челюсти и одной ноги клипа через проход вокруг легочного ствола с помощью лигатуры мягко тянуть легочный ствол вверх и в вилку клипа. Когда легочный ствол находится в вилке, и два кончика клипа свободны от каких-либо соединительной ткани, сжать клип применять полосы удаления лигатуры, как только правый желудочек расширяется в ответ на полосу. Когда ствол был полосатой удалить peen типсы из тимуса и вернуть ткани в его естественное положение.
Удалите выдвижной, и использовать абсорбируемые 4/0 многофилиментных швов, чтобы закрыть грудную клетку в три слоя. Затем подкожно вводят 2 миллилитров солевого раствора, чтобы заменить любую жидкость, потерянную во время операции, и следить за животным до полной лежачести. При выборе различных диаметров клипа можно вызвать различные стадии тяжести заболевания, о чем свидетельствует растущая степень гипертрофии правого желудочка.
Только тяжелые полосы вызывает дополнительные сердечные проявления, включая печеночную недостаточность. Различия в умеренной и тяжелой пульминной полосы ствола очевидны за счет увеличения давления правого желудочка и вызвать умеренный по сравнению с тяжелой правой желудочковой недостаточности, как показали пошаговое снижение сердечного выброса и трикуспидной кольцевой плоскости систолической экскурсии, как тяжесть полосы увеличивается. Процедура полосирования легочного ствола, вызванная расширением правого желудочка, проявляется увеличением как в правом желудочковом конце диастолического объема, так и в систолическом объеме у умеренных легочных стволов, полосатых крыс по сравнению с фиктивными животными, а также в тяжелом легочном стволе, полосатом крысами по сравнению с умеренными и фиктивными животными.
Также наблюдается резкое уменьшение фракции выброса правого желудочка. Гипертрофия правого желудочка также указывается на увеличение кардиомиоцитов поперечной секционной области в легочном стволе полосатой крыс, по сравнению с фиктивных животных, а также другие морфологические изменения в правом желудочков, связанные с правом желудочка отказа, в том числе фиброз правого желудочка. После освоения этот метод может быть выполнен в течение 30 минут, если он выполняется должным образом.
При попытке этой процедуры важно получить согласованные результаты с моделью, прежде чем инициировать экспериментальные исследования. После своего развития этот метод проложил путь для исследователей в области правой сердечной недостаточности для изучения фармакологических вмешательств и основных механизмов. После просмотра этого видео вы должны иметь хорошее понимание того, как выполнять легочные полосы ствола.
Изменения электрокардиограммы при инфекции COVID-19 | Рябыкина
1. Министерство здравоохранения РФ. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 3. (03.03.2020). Москва. Доступно на: https://www.garant.ru/products/ipo/prime/doc/73647088/
2. Gautret P, Lagier J-C, Parola P, Hoang VT, Meddeb L, Mailhe M et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. International Journal of Antimicrobial Agents. 2020;105949. [Epub ahead of print]. DOI: 10.1016/j.ijantimicag.2020.105949
3. Cheung CC, Davies B, Gibbs K, Laksman ZW, Krahn AD. Multi-lead QT Screening is Necessary for QT Measurement: Implications for Management of Patients in the COVID-19 Era. JACC: Clinical Electrophysiology. 2020;S2405500X20302504. [Epub ahead of print]. DOI: 10.1016/j.jacep.2020.04.001
4. Рябыкина Г.В., Блинова Е.В., Сахнова Т.А. Электровекторкардиографическая диагностика. Глава в книге «Легочная гипертензия», под ред. И.Е. Чазовой, Т.В. Мартынюк. – М.: Издательство Практика, 2015. – С.155-188. ISBN 978-5-89816-138-5
5. Берестень Н.Ф., Сандриков В.А., Федорова С.И. Функциональная диагностика. Национальное руководство. Гл. 2. — М.: Гэотар-Медиа, 2019. – 784с. ISBN 978-5-9704-4242-5
6. Томов Л., Томов И. Нарушения ритма сердца. – М.: Медицина и физкультура, 1976. –390с
7. Yan G-X, Antzelevitch C. Cellular Basis for the Brugada Syndrome and Other Mechanisms of Arrhythmogenesis Associated With ST-Segment Elevation. Circulation. 1999;100(15):1660–6. DOI: 10.1161/01.CIR.100.15.1660
8. Alings M, Wilde A. “Brugada” Syndrome: Clinical Data and Suggested Pathophysiological Mechanism. Circulation. 1999;99(5):666–73. DOI: 10.1161/01.CIR.99.5.666
9. Gussak I, Antzelevitch C, Bjerregaard P, Towbin J, Chaitman B. The Brugada syndrome: clinical, electrophysiologic and genetic aspects. Journal of the American College of Cardiology. 1999;33(1):5– 15. DOI: 10.1016/S0735-1097(98)00528-2
10. Zhang J, Sacher F, Hoffmayer K, O’Hara T, Strom M, Cuculich P et al. Cardiac Electrophysiological Substrate Underlying the ECG Phenotype and Electrogram Abnormalities in Brugada Syndrome Patients. Circulation. 2015;131(22):1950–9. DOI: 10.1161/CIRCULATIONAHA.114.013698
11. Frustaci A, Priori SG, Pieroni M, Chimenti C, Napolitano C, Rivolta I et al. Cardiac Histological Substrate in Patients With Clinical Phenotype of Brugada Syndrome. Circulation. 2005;112(24):3680–7. DOI: 10.1161/CIRCULATIONAHA.105.520999
12. Coronel R, Casini S, Koopmann TT, Wilms-Schopman FJG, Verkerk AO, de Groot JR et al. Right Ventricular Fibrosis and Conduction Delay in a Patient With Clinical Signs of Brugada Syndrome: A Combined Electrophysiological, Genetic, Histopathologic, and Computational Study. Circulation. 2005;112(18):2769–77. DOI: 10.1161/CIRCULATIONAHA.105.532614
13. Takagi M. Localized right ventricular morphological abnormalities detected by electron-beam computed tomography represent arrhythmogenic substrates in patients with the Brugada syndrome. European Heart Journal. 2001;22(12):1032–41. DOI: 10.1053/euhj.2000.2424
14. Chang D, Saleh M, Garcia-Bengo Y, Choi E, Epstein L, Willner J. COVID-19 Infection Unmasking Brugada Syndrome. HeartRhythm Case Reports. 2020;6(5):237–40. DOI: 10.1016/j.hrcr.2020.03.012
15. Bikdeli B, Madhavan MV, Jimenez D, Chuich T, Dreyfus I, Driggin E et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-Up. Journal of the American College of Cardiology. 2020;75(23):2950–73. DOI: 10.1016/j.jacc.2020.04.031
Публикации в СМИ
Недостаточность клапана лёгочной артерии — неспособность клапана лёгочной артерии препятствовать обратному движению крови из лёгочного ствола в правый желудочек во время его диастолы.
Этиология • Относительная недостаточность при лёгочной гипертензии • Врождённые пороки • Инфекционный эндокардит у наркоманов • Синдром Марфана • Ревматизм • Карциноидный синдром • Сифилис • Идиопатическая дилатация лёгочной артерии.
Патофизиология • Недостаточность клапана лёгочной артерии приводит к объёмной перегрузке правого желудочка • В отсутствие лёгочной гипертензии правый желудочек способен справляться со значительной объёмной перегрузкой, пока сохраняется его нормальная сократимость, и нет тяжёлой недостаточности трёхстворчатого клапана • При сочетании недостаточности клапана лёгочной артерии с лёгочной гипертензией происходит перегрузка правого желудочка как объёмом, так и давлением • При острой тяжёлой недостаточности клапана лёгочной артерии — правожелудочковая недостаточность.
Клиническая картина и диагностика
• Жалобы возникают в связи с присоединяющимися недостаточностью правого желудочка и трикуспидальной недостаточностью.
• Объективные данные •• Набухание шейных вен •• Пальпаторно определяемая пульсация правого желудочка •• Пальпаторно определяемый II тон и диастолическое дрожание •• Усиление лёгочного компонента II тона •• При дефектах створок лёгочный компонент II тона ослаблен или отсутствует •• убывающий диастолический шум Грэма Стилла. Длительность шума зависит от скорости выравнивания диастолического давления в лёгочной артерии и правом желудочке.
Специальные исследования
• ЭКГ: признаки гипертрофии и перегрузки правых отделов сердца.
• Яремная флебограмма: волна V указывает на трикуспидальную регургитацию вследствие правожелудочковой недостаточности.
• Рентгенография органов грудной клетки •• Выбухание дуги лёгочной артерии •• Усиление лёгочного сосудистого рисунка и дилатация правых отделов сердца зависят от наличия или отсутствия лёгочной гипертензии.
• ЭхоКГ •• Вегетации, дилатация фиброзного кольца лёгочной артерии, выбухание межжелудочковой перегородки в полость левого желудочка •• Выраженность регургитации (см. Недостаточность клапана аорты) •• Повышение систолического давления в правом желудочке и лёгочной артерии.
• Катетеризация полостей сердца •• Повышение конечного диастолического давления в правом желудочке и ЦВД •• Проведение проб с аминофиллином и кислородом для определения обратимости лёгочной гипертензии.
• Ангиопульмонография: поступление контрастного вещества из лёгочной артерии в правый желудочек во время его диастолы.
ЛЕЧЕНИЕ
• Лекарственная терапия •• Лечение правожелудочковой недостаточности (диуретики и венозные вазодилататоры) •• При любом органическом поражении клапана — профилактика инфекционного эндокардита, при относительной недостаточности профилактика не показана.
• Хирургическое лечение •• Показания: клинически выраженная правожелудочковая недостаточность при тяжёлом инфекционном эндокардите, не поддающемся антибиотикотерапии •• Методы хирургического лечения: протезирование клапана биологическим или, реже, механическим протезом. См. также Недостаточность трёхстворчатого клапана.
Специфические осложнения • ТЭЛА • Вторичный инфекционный эндокардит • Тромбоз протеза • Дегенеративные изменения биологического протеза и необходимость в репротезировании.
Прогноз зависит от осложнений и сопутствующей патологии; сама по себе недостаточность клапана лёгочной артерии на прогноз обычно не влияет.
МКБ-10 • I37 Поражения клапана лёгочной артерии
Дисфункция правого желудочка и отказ при хронической перегрузке давлением
Дисфункция правого желудочка (ПЖ) является основной причиной смерти при легочной артериальной гипертензии (ЛАГ). Наше понимание патофизиологии дисфункции правого желудочка ограничено, но улучшается. Методы более ранней диагностики дисфункции правого желудочка и лечение, специально разработанное для минимизации или обращения вспять процесса ремоделирования, вероятно, улучшат результаты. Мы рассматриваем текущее понимание дисфункции правого желудочка при хронической перегрузке давлением и представляем некоторые новые идеи, основанные на недавних исследованиях в области патофизиологии, диагностики и лечения.
1. Введение
Дисфункция правого желудочка (ПЖ) может возникать по ряду клинических сценариев, включая перегрузку давлением, кардиомиопатии, ишемическую, врожденную или клапанную болезнь сердца, аритмию и сепсис. Перегрузка давлением может возникнуть в острой или хронической форме. Диагноз ставится на основании данных анамнеза и физического обследования, электрокардиограммы, рентгенографии грудной клетки, эхокардиограммы и инвазивной гемодинамики. Нарушение правого желудочка почти всегда связано с плохим прогнозом.Раннее распознавание важно для улучшения результатов. Хотя перегрузка давлением может возникнуть при стенозе клапана легочного клапана, наиболее частой причиной перегрузки давлением является легочная артериальная гипертензия (ЛАГ). Последние достижения, особенно в лечении ЛАГ, подчеркнули важность функции правого желудочка и стимулировали возобновление интереса к лучшему пониманию его адаптации к перегрузке давлением. Это особенно очевидно за последний год, когда функция правого желудочка пересматривалась несколько раз [1, 2], как и эхокардиографические методы визуализации правого желудочка [3], функции правого желудочка в кардиохирургии и торакальной хирургии [4–6], механизмы, лежащие в основе недостаточности ПЖ при ЛГ [7], и лечение острой правожелудочковой недостаточности [8].
2. Хроническая перегрузка правого желудочка давлением
ЛАГ определяется как среднее давление в легочной артерии> 25 мм рт. Исторически долгосрочные результаты были довольно плохими из-за прогрессирующего увеличения артериальной гипертензии, приводящего к тяжелой недостаточности ПЖ. Но клинические результаты значительно улучшились с недавним появлением нескольких легочно-специфических вазодилататоров [10–13], таких как простаноиды, антагонисты рецепторов эндотелина и ингибиторы фосфодиэстеразы 5A (PDE5A).Средняя выживаемость для пациентов с ЛАГ без лечения составляет 2,8 года с 1-, 3- и 5-летней выживаемостью 68%, 48% и 34% соответственно [10]. При непрерывном лечении простаноидами выживаемость улучшилась на 87–88%, 63–71% и 56% соответственно [12, 14]. Аналогичные результаты были получены с пероральным антагонистом рецепторов эндотелина бозентаном (выживаемость 82–96% через 1 год; выживаемость через 2 года 67–89%) [15]. Функция правого желудочка является критическим фактором, определяющим исходы пациентов с ЛАГ, и недавно была признана важным направлением для дальнейших исследований [16].Нарушение правого желудочка является конечным результатом ЛАГ и причиной не менее 70% всех смертей от ЛАГ [10]. К сожалению, трудно определить, у каких пациентов разовьется недостаточность ПЖ и в какой период болезни.
3. Патофизиология адаптации правого желудочка к хронической перегрузке давлением
Одной из ключевых особенностей адаптации правого желудочка к хронической перегрузке давлением является гипертрофия. В общем, это происходит из-за повышенного напряжения стенки из-за повышенного давления (закон Лапласа).Размер миоцитов увеличивается за счет синтеза дополнительных саркомеров [7]. Внеклеточный матрикс также увеличивается, что приводит к усилению фиброза. В какой-то момент адаптация оказывается недостаточной перед лицом перегрузки давлением, что приводит к дилатации, снижению систолической и диастолической функции и явной недостаточности ПЖ. К сожалению, эта последовательность событий не совсем понятна в RV. Наблюдается уменьшение тяжелой цепи миозина α -подтипа по сравнению с β -подтипом, что связано с пониженной систолической функцией [17, 18].Экспрессия актина также изменяется при ПАУ, как и комплекс тропонина [7]. Перегрузка давлением вызывает изменения в плотностях β -адренорецепторов и рецепторов ангиотензина 1 типа. Как и при недостаточности ЛЖ, недостаточность ПЖ связана с активацией ренин-ангиотензиновой системы. Ишемия правого желудочка также была задокументирована при ЛАГ, что указывает на то, что несоответствие между предложением кислорода и потребностью в кислороде, вероятно, связано с развитием гипертрофии и недостаточности ПЖ [19], что может быть связано со снижением рекрутирования микрососудов или снижением сосудорасширяющей способности [7].Повышение регуляции апоптоза миоцитов в ПЖ, перегруженном давлением, также, вероятно, способствует прогрессирующей дисфункции ПЖ [7]. Митохондриальная синтаза оксида азота (mtNOS) активируется в гипертрофированном миокарде правого желудочка и частично восстанавливается при лечении ингибитором PDE5A, силденафилом [20]. Эти результаты согласуются с предыдущими исследованиями, показывающими увеличение экспрессии PDE5 [21], митохондриального мембранного потенциала [22] и захвата глюкозы [23] тканью правого желудочка у пациентов с ЛАГ, и могут представлять собой новую мишень для терапевтического вмешательства, специфичного для правого желудочка. [24].
У пациентов с ЛАГ наблюдалась региональная гетерогенность ремоделирования и дисфункции ПЖ [25]. Гипертрофия наиболее высока в тракте оттока ПЖ и хуже у пациентов с декомпенсированной функцией ПЖ (рис. 1). Утолщение регионарной стенки, как показатель региональной функции, значительно уменьшается в выводном тракте (воронка) у пациентов независимо от функционального статуса ПЖ, с соответствующим повышенным напряжением стенки в этой области. Первоначальные отчеты нашей группы предполагали, что изменения в региональной структуре и функции ПЖ, особенно в тракте оттока, предшествуют явной гемодинамической декомпенсации ПЖ, поскольку пациенты с менее тяжелой недостаточностью ПЖ имеют избирательную гипертрофию тракта оттока, тогда как пациенты с тяжелой недостаточностью ПЖ генерализованная гипертрофия ПЖ.Эти результаты должны быть проспективно подтверждены в когортах пациентов, у которых можно проследить прогрессирование заболевания с течением времени и лечения, но этот асимметричный гипертрофический ответ согласуется с более ранним исследованием, которое обнаружило большее укорочение волокон в тракте оттока по сравнению с областью синуса ПЖ и последовательные сроки сокращения в двух регионах [26]. Гипертрофия и дисфункция в тракте оттока могут быть ранним признаком надвигающейся недостаточности ПЖ и предполагают, что лучшее понимание ремоделирования ПЖ на региональном уровне может значительно продвинуть наши знания о реакции ПЖ на заболевание.
4. Выявление дисфункции правого желудочка
Выявление дисфункции правого желудочка на менее тяжелых стадиях, что позволило бы провести более раннее вмешательство и потенциально лучшие долгосрочные результаты, было ограничено в основном из-за сложной трехмерной геометрии правого желудочка, которая не поддается предположению о простом предположении. эллипсоид, сложные взаимодействия ЛЖ / перегородки и отсутствие общепринятых подходов к оценке функции ПЖ на региональном и органном уровне. Текущие маркеры недостаточности ПЖ, которые были связаны с плохими результатами, распознают только терминальную стадию заболевания.В последнее время появилось несколько подходов к более точному выявлению дисфункции правого желудочка.
Клинически признанным золотым стандартом для выявления дисфункции правого желудочка и понимания физиологии в состоянии перегрузки давлением остается инвазивная гемодинамика [1]. Давление в правом предсердии, сердечный выброс и среднее давление в легочной артерии — все они являются прогностическими факторами при ЛАГ [10]. Измерение гемодинамики с помощью упражнений может дополнительно выявить ЛАГ, не проявляющуюся в покое, отличить диастолическую дисфункцию ЛЖ и помочь в прогнозе (неспособность увеличить сердечный выброс с помощью упражнений) [1].Петли давление-объем функции ПЖ при хронической ЛАГ могут предоставить дополнительную информацию, выходящую за рамки стандартной гемодинамики. Например, было показано, что простациклин улучшает связь желудочков и сосудов (отношение сократимости, определяемое соотношением конечного систолического давления и объема, Ees, к постнагрузке, определяемой эластичностью легочной артерии, которая сама по себе является отношением конечного систолического давления. к ударному объему, рисунок 2) [27]. Эта методология использовалась для демонстрации повышенной сократимости (отношение конечного систолического давления к объему, Ees), несмотря на более низкий сердечный выброс и разделение желудочков и сосудов (более низкое отношение Ees к эластичности легочной артерии, Ea) при ЛАГ [28].Измерения гемодинамики, которые принимают во внимание пульсацию легочного кровотока, также дают возможность лучше понять гидравлическую нагрузку, с которой сталкивается ПЖ. Повышенная жесткость сосудистой сети приводит к увеличению отражения волн жидкости и увеличению нагрузки на насос RV. В то время как сопротивление легочных сосудов (транспульмональный градиент, деленный на сердечный выброс) является клиническим стандартом измерения нагрузки на легочные сосуды, это дает информацию только о статической нагрузке.Однако 1/3 — 1/2 легочной нагрузки (гидравлическая мощность) обусловлена пульсирующим характером кровотока [1]. Нагрузка в системе с пульсирующим потоком лучше характеризуется входным сопротивлением. Одно недавнее исследование входного импеданса легочных сосудов у 49 педиатрических пациентов с ЛАГ предсказало клинические исходы через год лучше, чем сопротивление легочных сосудов [29]. Такие измерения пульсирующей нагрузки и желудочко-сосудистого взаимодействия могут помочь объяснить, когда и как ПЖ отказывает [30], что приводит к улучшению диагностики и более индивидуализированному лечению [31].
Эхокардиография — стандартный клинический метод оценки правого желудочка при ЛАГ. Его главным преимуществом является неинвазивный характер, позволяющий проводить последовательные исследования во времени и хорошую визуализацию основных структур и функций правого желудочка в динамическом режиме. Хотя эхокардиографическая оценка давления в легочной артерии может быть сделана с помощью трикуспидальной регургитирующей струи, решения о лечении, основанные на гемодинамике ЛАГ, должны подтверждаться инвазивно. Кроме того, возможность оценить давление в легочной артерии по трикуспидальной регургитирующей струе весьма полезна, хотя для принятия решения о лечении при ЛАГ гемодинамика должна быть подтверждена инвазивно.Фракционное изменение площади (FAC), как суррогат фракции выброса, рассчитывается путем анализа разницы в площади поперечного сечения правого желудочка в систолу и диастолу и имеет прогностическое значение в небольших исследованиях, как и увеличение правого желудочка, трикуспидальная регургитация, перикардиальная регургитация. выпот и индекс Tei (производительность миокарда) [9]. Новые методы включают в себя тканевую доплеровскую визуализацию (TDI) и отслеживание спеклов. Пиковая систолическая деформация свободной стенки ПЖ за счет TDI снижается у пациентов с ЛГ, и этот показатель коррелирует с транспульмональным градиентом, легочным сосудистым сопротивлением и сердечным индексом [32].Было обнаружено, что пиковая систолическая деформация свободной стенки ПЖ снижается с увеличением ЛГ и далее снижается при декомпенсации ПЖ [33]. TDI правого желудочка также продемонстрировал хорошую корреляцию с фракцией выброса правого желудочка, полученной с помощью магнитного резонанса сердца (CMR) [34]. Отслеживание спеклов также использовалось для количественной оценки деформации миокарда правого желудочка и может быть ценным методом для выявления доклинических заболеваний, поскольку оно обнаруживает незначительные изменения, которые трудно определить количественно с помощью TDI. Например, спекл-трекинг паттернов деформации миокарда правого желудочка выявил аномальное сокращение правого желудочка у пациентов с системным склерозом с нормальным легочным давлением, даже когда другие маркеры, такие как систолическая экскурсия в плоскости трикуспидального кольца, не изменились по сравнению с нормальными [35–37].Надежный метод выявления доклинической дисфункции правого желудочка был бы важным достижением в визуализации правого желудочка. Трехмерная эхокардиография была утверждена как метод оценки объемов правого желудочка и использовалась для оценки функции правого желудочка [38–40]. Ограничения эхокардиографии включают ограниченные акустические окна для визуализации сложной трехмерной структуры правого желудочка.
CMR был полезен для анатомической оценки правого желудочка, а в последнее время также для функциональной оценки. Недавно были опубликованы два недавних обзора CMR при ЛАГ [41, 42].Измерения объема, массы и инсультного индекса ПЖ с помощью CMR предсказали 1-летнюю выживаемость у 64 пациентов с ЛАГ [43]. Измерения жесткости ПА с помощью CMR (пульсации, податливости, емкости, растяжимости, модуля упругости и индекса жесткости, не зависящего от давления), как сообщается, являются чувствительной мерой ранней ПАУ [44]. Визуализация кровотока с помощью CMR использовалась для обнаружения вихрей кровотока в основной легочной артерии у пациентов с ЛАГ [45]. Однако многие, если не большинство, показатели функции RV по CMR еще не стандартизированы.
Компьютерная томография (КТ) также может быть полезна для оценки структуры и функции правого желудочка благодаря высокому пространственному разрешению, доступности и быстрому времени сканирования, хотя она ограничена радиацией и контрастным воздействием [46–48]. КТ использовалась для выявления регионально гетерогенного ремоделирования и дисфункции правого желудочка при легочной гипертензии [25]. Это согласуется с результатами исследования CMR и эхокардиографии, которое обнаружило большее укорочение волокон в тракте оттока по сравнению с областью синуса правого желудочка [26].
5. Лечение дисфункции правого желудочка, вызванной перегрузкой давлением
Данные клинических испытаний все еще весьма ограничены в отношении влияния ЛАГ-специфического лечения на функцию правого желудочка, как и данные о любом специфическом лечении дисфункции правого желудочка. Регресс гипертрофии правого желудочка наблюдался через 1 год лечения блокаторами кальциевых каналов в высоких дозах [49]. Лечение простациклином было связано с умеренным обратным ремоделированием ПЖ, в частности, обращением вспять некоторой дилатации и сферичности, а также с увеличением ударного объема ПЖ [50, 51].В небольшом ретроспективном исследовании антагонист рецепторов эндотелина бозентан привел к улучшению инвазивной гемодинамики, функционального статуса и тенденции к улучшению ударного объема правого желудочка, но без значительного изменения объема правого желудочка или фракции выброса [52]. Ингибитор PDE5A силденафил увеличивает сократительную способность правого желудочка в изолированных препаратах сердца крысы и отдельных кардиомиоцитах [21]. По крайней мере, в одном продолжающемся многоцентровом исследовании лечения ЛАГ (с бозентаном) в настоящее время оценивается ответ правого желудочка на лечение с помощью серийной МРТ сердца, результаты которого, как мы надеемся, будут опубликованы в течение следующего года [53].
На ранней стадии исследования есть несколько уникальных методов лечения, которые, как сообщается, специально предназначены для улучшения функции правого желудочка в состоянии перегрузки давлением. Растительный экстракт улучшал функцию правого желудочка у крыс, моделирующих ПАУ с тяжелой недостаточностью правого желудочка [54]. Созданный тканевой инженерией лист скелетных миобластов улучшил диастолическую функцию правого желудочка, минимизировал фиброз и увеличил плотность капилляров в модели ЛАГ на крысах [55]. Было высказано предположение о роли стимуляции правого желудочка в качестве сердечной ресинхронизирующей терапии при ЛАГ, поскольку наблюдали, что диссинхронное сокращение правого желудочка коррелирует с тяжестью заболевания [56–58].
6. Заключение
Несмотря на то, что наши знания о дисфункции правого желудочка при хронической перегрузке давлением продолжают расти, многое еще предстоит понять. Особое внимание следует уделять влиянию ЛАГ на желудочково-сосудистые взаимодействия и тому, как патофизиологические нарушения приводят к дисфункции на уровне органов. Региональные оценки правого желудочка могут предоставить возможность для лучшего понимания механизмов дисфункции правого желудочка и более ранней диагностики, поскольку неоднородная адаптация правого желудочка, по-видимому, является ранним маркером надвигающейся недостаточности правого желудочка при ЛАГ.Важно отметить, что крайне необходимы новые методы лечения для улучшения ремоделирования и дисфункции правого желудочка при хронической перегрузке давлением.
Раскрытие информации
Д-р М.А. Саймон сообщает о получении гонорара за консультации или работе в платных консультативных советах Gilead, а также о получении гонорара за лекции от United Therapeutics и Gilead. Доктор М. Р. Пинский не имеет конфликта интересов.
Благодарности
NHLBI предоставляет KL2 RR024154, HL073198 и HL67181. Его содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения NCRR или NIH.Информация о NCRR доступна на http://www.ncrr.nih.gov/. Информацию о реорганизации Клинического исследовательского предприятия можно получить по адресу http://nihroadmap.nih.gov/clinicalresearch/overview-translational.asp.
Анатомия, функции и дисфункции RV
Введение
Новый импульс в понимании правого желудочка (ПЖ) в отношении здоровья и болезней возник благодаря накоплению данных о его симптоматической и прогностической значимости во многих клинических сценариях. 1 Когда врач сталкивается с патологическим правым желудочком, основные основные процессы включают перегрузку давлением, перегрузку объемом или первичный миокардиальный процесс (таблица 1 и рисунок 1). Клинический курс и терапевтический подход в этих трех ситуациях значительно различаются, хотя часто они сосуществуют. 2
Таблица 1: Этиология перегрузки правого желудочка давлением, перегрузки объемом и кардиомиопатии правого желудочка
| RV Перегрузка по давлению | Перегрузка объема RV | RV Кардиомиопатия |
| Легочная гипертензия (ЛГ) * | Клапанная регургитация | Инфаркт миокарда (ИМ) |
| Легочная артериальная гипертензия | Трикуспидальный | Аритмогенная кардиомиопатия правого желудочка |
| Болезнь левых отделов сердца | Легочный | Дилатационная кардиомиопатия |
| Из-за болезни легких и / или гипоксии | Системно-легочный шунт | Гипертрофическая кардиомиопатия |
| Хроническая тромбоэмболическая ЛГ и обструкция других легочных артерий | Дефект межпредсердной перегородки | Амилоидоз |
| Неясные и / или многофакторные механизмы | Частичный аномальный дренаж легочной вены | Миокардит |
| Стеноз клапана легочной артерии | Высокие выходные состояния ** (т. Е.э., тиреотоксикоз) | Саркоид |
| Стеноз ПА | Пересадка | |
| Тромбоэмболия легочной артерии | Послеоперационный | |
| Вспомогательное устройство после левого желудочка (LV) | ||
| Кардиотоксичность (например, химиотерапия) | ||
| Сепсис |
Рисунок 1
Обзор результатов патологии, гистологии и магнитного резонанса правого желудочка при здоровье и болезни. Перегруженный давлением ПЖ демонстрирует гипертрофию и дилатацию, уплощение систолической перегородки и обширный фиброз. Перегруженный объемом ПЖ демонстрирует дилатацию, уплощение диастолической перегородки и легкий фиброз. Кардиомиопатический ПЖ (аритмогенная кардиомиопатия на рисунке) демонстрирует дилатацию ПЖ, аневризмы и замещение фибро-жировой ткани. Изменено с разрешения Sanz J et al. 2 Обзор результатов патологии, гистологии и магнитного резонанса правого желудочка при здоровье и болезни. Перегруженный давлением ПЖ демонстрирует гипертрофию и дилатацию, уплощение систолической перегородки и обширный фиброз. Перегруженный объемом ПЖ демонстрирует дилатацию, уплощение диастолической перегородки и легкий фиброз. Кардиомиопатический ПЖ (аритмогенная кардиомиопатия на рисунке) демонстрирует дилатацию ПЖ, аневризмы и замещение фибро-жировой ткани. Изменено с разрешения Sanz J et al. 2Нормальный жилой дом
RV на 10-15% больше по объему, чем LV, с более тонкой свободной стенкой и меньшей массой. 3 По мере старения происходит уменьшение массы и объема ПЖ, а также увеличение фракции выброса (ФВ). Объемы и масса ПЖ у мужчин, как правило, выше, тогда как ФВ ПЖ ниже. 4 Часто описываются три анатомических компонента: 1) входное отверстие, содержащее аппарат с трехстворчатым клапаном; 2) трабекулярная вершина и 3) выходное отверстие или воронка.Хотя в ЛЖ имеется 3 отдельных миокардиальных слоя агрегированных кардиомиоцитов, в ПЖ их всего 2: поверхностный, преимущественно периферический слой и субэндокардиальный, преимущественно продольный слой (Рисунок 2). ПЖ и ЛЖ тесно взаимосвязаны не только через перегородку, но также через общие эпикардиальные периферические миоциты и перикардиальное пространство, которые составляют анатомическую основу бивентрикулярной взаимозависимости. 5
Рисунок 2
( A ) Нормальное сердце, если смотреть спереди, показывает расположение по окружности поверхностного правого и среднего левого слоев агрегированных кардиомиоцитов.( B ) Открытый нормальный правый желудочек показывает продольно расположенные агрегаты субэндокардиальных миоцитов ( черные пунктирные линии, ). Ao: аорта; PV: легочный клапан; RVOT: отводящий тракт RV; ТВ: трехстворчатый клапан. Изменено с разрешения Sanz J et al. 2 ( A ) Нормальное сердце, если смотреть спереди, показывает расположение по окружности поверхностного правого и среднего левого слоев агрегированных кардиомиоцитов. ( B ) Открытый нормальный правый желудочек показывает продольно расположенные агрегаты субэндокардиальных миоцитов ( черные пунктирные линии, ). Ao: аорта; PV: легочный клапан; RVOT: отводящий тракт RV; ТВ: трехстворчатый клапан. Изменено с разрешения Sanz J et al. 2Нет убедительных данных, позволяющих предположить, что процессы возбуждения и сокращения или источник энергии (преимущественно жирные кислоты) в ПЖ отличаются от ЛЖ. 6 Коронарный кровоток в состоянии покоя ниже в ПЖ и возникает как в систолу, так и в диастолу. Потребление кислорода и экстракция в состоянии покоя также ниже, что приводит к более высокому запасу экстракции кислорода, если это необходимо.Вместе с выступающими коллатералями левой коронарной системы эти особенности делают ПЖ относительно устойчивым к ишемии. 7,8 Однако из-за более тонкой стенки и большей зависимости от коронарного перфузионного давления перфузия правого желудочка более уязвима к увеличению полостного (и, следовательно, внутримурального) давления правого желудочка и к системной гипотензии. 9
ПЖ сокращается перистальтическим движением, которое происходит раньше в пазухе и верхушке, чем в конусе, 3 и продольное укорочение составляет примерно 75% сокращения правого желудочка. 10 LV является важным участником выброса правого желудочка, генерируя 20-40% ударного объема правого желудочка (SV) преимущественно, но не только за счет сокращения перегородки. 1,6 Более тонкая стенка и меньшее соотношение объема и площади поверхности делают RV более податливым и способным выдерживать повышенную предварительную нагрузку, но неспособным справиться с резкими скачками давления PA. 1 Резкое увеличение преднагрузки или постнагрузки немедленно связано с дилатацией правого желудочка для сохранения SV. Через несколько минут эта гетерометрическая адаптация заменяется гомеометрической адаптацией с нормализацией объема и повышенной сократимостью.Из инвазивных петель давления можно получить эластичность легочной артерии (индекс постнагрузки правого желудочка) и конечную систолическую эластичность правого желудочка (индекс сократимости правого желудочка). 5 Сравнение эластичности артерий и конечной систолической эластичности позволяет определить адекватность адаптации сократимости ПЖ к постнагрузке или «сцеплению» с малым кровообращением. Оптимальная вентрикулоартериальная связь имеет место, когда обе эластичности равны (конечная систолическая эластичность / артериальная эластичность = 1). Однако оптимальная конечная систолическая эластичность / артериальная эластичность для изгнания при минимальных затратах энергии, как видно из нормального правого желудочка, составляет 1.5-2. 6 Строго говоря, конечная систолическая эластичность / артериальная эластичность измеряется инвазивно, хотя были разработаны упрощенные инвазивные и неинвазивные подходы на основе визуализации. 2
RV с перегрузкой по давлению
Перегрузка правого желудочка давлением, чаще всего вторичная по отношению к ЛГ, приводит к гипертрофии правого желудочка, преимущественно концевому систолическому и раннему диастолическому уплощению межжелудочковой перегородки и, в конечном итоге, к прогрессирующей дилатации и дисфункции правого желудочка (рис. 1).Дисбаланс предложения и потребности в кислороде был продемонстрирован при сердечной недостаточности, связанной с ЛГ, с потенциальными механизмами, включая разрежение капилляров, системную гипотензию, нарушение систолического коронарного кровотока из-за повышенного напряжения стенки, механической неэффективности и сжатия правой коронарной артерии расширенной PA. 2 Потенциальным следствием нарушения снабжения кислородом является метаболическое ремоделирование с «метаболическим переключением» с окисления жирных кислот на менее эффективный, но сберегающий кислород анаэробный гликолиз в качестве предпочтительного источника энергии. 11 Острая перегрузка давлением (т. Е. Тромбоэмболия легочной артерии) приводит к острой дилатации с повышенным напряжением стенки, снижением перфузии, а также метаболическим переключением. Однако, в отличие от хронической ЛГ, она дополнительно связана с притоком воспалительных лейкоцитов в миокард и лизисом миоцитов, особенно в тракте оттока. 12
При хронической перегрузке давлением правый желудочек первоначально отвечает адаптивным ремоделированием : относительно сохраненные объемы и функция компенсирующей концентрической гипертрофией.Когда сократимость больше не может увеличиваться, чтобы соответствовать постнагрузке, происходит дезадаптивное ремоделирование с эксцентрической гипертрофией , прогрессирующей дилатацией и диссинхронией правого желудочка и поддержанием SV с помощью механизмов Франка-Старлинга (гетерометрическая адаптация). Это происходит за счет повышенного давления наполнения и, в конечном итоге, клинической декомпенсации. 6 Расширение правого желудочка вызывает дополнительные вредные межжелудочковые взаимодействия в диастолу (см. Ниже).
RV с перегрузкой по объему
Отличительными признаками являются дилатация и гипертрофия ПЖ (увеличенная масса свободной стенки, хотя и сохраненная толщина) и преимущественно диастолический сдвиг перегородки влево (рис. 1).Из-за анатомических и физиологических особенностей, рассмотренных выше, перегрузка объемом переносится намного лучше, чем перегрузка давлением. 1 Расширение правого желудочка приводит к увеличению натяжения стенки и, следовательно, к одновременному увеличению постнагрузки.
Сократимость правого желудочка сохраняется в течение длительного времени, хотя сократительный резерв может быть нарушен. Перегрузка объемом приводит к одновременной дисфункции ЛЖ, 5 , в первую очередь из-за недостаточного заполнения вторичного к смещению перегородки и изменений геометрии ЛЖ, а не к уменьшению SV правого желудочка вперед. 1 Хроническая перегрузка объемом правого желудочка может в конечном итоге привести к систолической дисфункции правого желудочка и повышенной смертности, особенно при наличии наложенной перегрузки давлением и / или заметного увеличения правого желудочка, что требует корректирующих вмешательств до того, как наступит значительная дилатация правого желудочка. 1
Кардиомиопатический РВ
Поражения миокарда различной этиологии могут поражать ПЖ. Его адаптивный ответ в этом контексте различается не только в зависимости от основного патологического процесса, но также, что важно, от любой связанной с ним перегрузки объемом и / или давлением.Дисфункция правого желудочка, связанная с ишемией, рассматривается ниже в качестве примера.
Ишемическая болезнь сердца
Острый ИМ ПЖ обычно возникает при окклюзии правой коронарной артерии проксимальнее краевых ветвей. 7 Острая ишемия правого желудочка и / или ИМ приводят как к систолической, так и к диастолической дисфункции. Снижение EF правого желудочка может вызвать снижение выработки и гипотонию, что, в свою очередь, усугубит ишемию. Снижение податливости ПЖ усугубляется ограничением перикарда на расширенном ПЖ, что приводит к заметному увеличению давления в правом предсердии и нарушению межжелудочковых взаимодействий.В этой ситуации адекватное наполнение ПЖ (и поддержание ВП) может сильно зависеть как от адекватной предварительной нагрузки, инотропной поддержки, так и / или сохраненного сокращения предсердий. 7,8 Поражение ПЖ при остром инфаркте миокарда выявляется при аутопсии или магнитно-резонансных исследованиях чаще, чем клинически (до 30% и 50% соответственно), особенно при нижних, но также часто и при передних инфарктах. 13,14
Из-за вышеупомянутой относительной устойчивости к ишемии правого желудочка хронические инфаркты правого желудочка несколько редки и могут быть идентифицированы in vivo у 5-13% пациентов с магнитным резонансом (рис. 3). 14,15 По тем же причинам функция правого желудочка имеет тенденцию восстанавливаться после острой фазы. Таким образом, стойкая постинфарктная дисфункция правого желудочка, вероятно, имеет многофакторную этиологию, включая не только хронический ИМ, но также взаимодействия ЛЖ и ПЖ, повышенную постнагрузку, ишемию и митральную регургитацию. 15
Рисунок 3
Магнитно-резонансные изображения нижнего ИМ (, стрелка, ) с вовлечением нижней стенки ПЖ, что продемонстрировано поздним усилением гадолиния ( стрелки, ). Изменено с разрешения Sanz J et al. 2 Магнитно-резонансные изображения нижнего ИМ (, стрелка, ) с вовлечением нижней стенки ПЖ, что продемонстрировано поздним усилением гадолиния ( стрелки, ). Изменено с разрешения Sanz J et al. 2Ссылки
- Констам М.А., Кирнан М.С., Бернштейн Д. и др. Оценка и лечение правосторонней сердечной недостаточности: научное заявление Американской кардиологической ассоциации. Обращение 2018; 137: e578-e622.
- Sanz J, Sánchez-Quintana D, Bossone E, Bogaard HJ, Naeije R. Анатомия, функция и дисфункция правого желудочка: обзор современного состояния JACC. J Am Coll Cardiol 2019; 73: 1463-82.
- Dell’Italia LJ. Правый желудочек: анатомия, физиология и клиническое значение. Curr Probl Cardiol 1991; 16: 653-720.
- Кавут С.М., Лима Дж. А., Барр Р. Г. и др. Половые и расовые различия в структуре и функции правого желудочка: мультиэтническое исследование атеросклероза-правого желудочка. Тираж 2011; 123: 2542-51.
- Naeije R, Badagliacca R. Перегруженное правое сердце и взаимозависимость желудочков. Cardiovasc Res 2017; 113: 1474-85.
- Лам Т., Дуглас И.С., Арчер С.Л. и др. Оценка функции правого желудочка в условиях исследования: пробелы в знаниях и дальнейшие пути. Официальное заявление об исследованиях Американского торакального общества. Am J Respir Crit Care Med 2018; 198: e15-e43.
- O’Rourke RA, Dell’Italia LJ.Диагностика и лечение инфаркта миокарда правого желудочка. Curr Probl Cardiol 2004; 29: 6-47.
- Harjola VP, Mebazaa A, Čelutkienė J, et al. Современное лечение острой правожелудочковой недостаточности: заявление Ассоциации сердечной недостаточности и Рабочей группы по легочному кровообращению и функции правого желудочка Европейского общества кардиологов. Eur J Heart Fail 2016; 18: 226-41.
- Zong P, Tune JD, Downey HF. Механизмы баланса спроса / предложения кислорода в правом желудочке. Exp Biol Med (Maywood) 2005; 230: 507-19.
- Brown SB, Raina A, Katz D, Szerlip M, Wiegers SE, Forfia PR. Продольное укорочение составляет большую часть сокращения правого желудочка и улучшается после терапии легочными вазодилататорами у здоровых субъектов и пациентов с легочной артериальной гипертензией. Сундук 2011; 140: 27-33.
- Rich S, Pogoriler J, Husain AN, Toth PT, Gomberg-Maitland M, Archer SL. Долгосрочные эффекты эпопростенола на легочную сосудистую сеть при идиопатической легочной артериальной гипертензии. Сундук 2010; 138: 1234-9.
- Watts JA, Marchick MR, Kline JA. Правожелудочковая сердечная недостаточность от тромбоэмболии легочной артерии: ключевые отличия от хронической легочной гипертензии. J Card Fail 2010; 16: 250-9.
- Andersen HR, Falk E, Nielsen D. Инфаркт правого желудочка: частота, размер и топография при ишемической болезни сердца: проспективное исследование, включающее 107 последовательных аутопсий из отделения коронарной терапии. J Am Coll Cardiol 1987; 10: 1223-32.
- Masci PG, Francone M, Desmet W, et al. Ишемическое повреждение правого желудочка у пациентов с острым инфарктом миокарда с подъемом сегмента ST: характеристика с помощью сердечно-сосудистого магнитного резонанса. Тираж 2010; 122: 1405-12.
- Сабе М.А., Сабе С.А., Кусуносе К., Фламм С.Д., Гриффин Б.П., Квон Д.Х. Предикторы и прогностическое значение фракции выброса правого желудочка у пациентов с ишемической кардиомиопатией. Обращение 2016; 134: 656-65.
Клинические темы: Острые коронарные синдромы, аритмии и клиническая EP, дислипидемия, сердечная недостаточность и кардиомиопатии, легочная гипертензия и венозная тромбоэмболия, клапанная болезнь сердца, фибрилляция предсердий / наджелудочная недостаточность ритма, нарушение ритма сердца, нарушение ритма сердца
Ключевые слова: Острый коронарный синдром, Ударный объем, Систола, Диастола, Миоциты, сердце, Расширение, Желудочки сердца, Трикуспидальный клапан Циркуляция в легких Недостаточность митрального клапана, Коронарные сосуды, Гликолиз, Перистальтика, Жирные кислоты, Прогноз, Анаэробиоз, Фибрилляция предсердий, Давление в предсердиях, Миокард Перикард, Кардиомиопатии, Кардиомиопатии, Магнитно-резонансная спектроскопия, Ишемия миокарда, Аневризма, Гипертрофия, Гипофиз, Инфаркт легких Эмболия, 9 0015 Потребление кислорода, Гипертония, легочная
<Вернуться к списку
Правосторонняя сердечная недостаточность | Michigan Medicine
Обзор темы
Правосторонняя сердечная недостаточность означает, что правая сторона сердца не перекачивает кровь в легкие так же хорошо, как в норме.
Его также называют легочным сердцем.
Что происходит с сердцем?
У большинства людей сердечная недостаточность развивается из-за проблем с левым желудочком. Но снижение функции правого желудочка также может произойти при сердечной недостаточности. По мере того, как кровь начинает возвращаться за отказавший левый желудочек в легкие, правому желудочку становится все труднее перекачивать возвращающуюся кровь через легкие. Как и левый желудочек, правый желудочек со временем ослабнет и начнет давать сбои.
Причина этого?
Наиболее частой причиной правосторонней сердечной недостаточности фактически является левосторонняя сердечная недостаточность. Но другие состояния, такие как определенные заболевания легких, могут привести к отказу правого желудочка, даже если с левым желудочком проблем нет.
Причина | Что это? | Как это вызывает правостороннюю сердечную недостаточность? |
|---|---|---|
Левосторонняя сердечная недостаточность | Левый желудочек не перекачивает кровь эффективно.Это приводит к повышению давления позади левой части сердца, что со временем приводит к отказу правой части сердца. | Кровь возвращается за левым желудочком в левое предсердие, в легкие, а затем, в конечном итоге, в правый желудочек, что также в конечном итоге дает сбой. Это позволяет крови поступать дальше в конечности, печень и другие органы. |
Хроническая болезнь легких | Он включает эмфизему, тромбоэмболию легочной артерии и другие причины легочной гипертензии. | Высокое кровяное давление в легочных артериях увеличивает нагрузку на правый желудочек. Со временем это приводит к отказу правого желудочка. |
Ишемическая болезнь сердца | Это закупорка артерий, кровоснабжающих сердце. | ИБС может вызвать левостороннюю сердечную недостаточность, ведущую к правосторонней сердечной недостаточности.Или он может напрямую вызвать правостороннюю сердечную недостаточность, блокируя кровоснабжение правого желудочка. |
Стеноз легочной артерии | Это сужение клапана легочной артерии, ограничивающее кровоток из правого желудочка. | Увеличивает работу правого желудочка, подобно хроническому заболеванию легких. |
Стеноз трехстворчатого клапана | Это сужение трехстворчатого клапана. | Ограничивает кровоток из правого предсердия, вызывая расширение правого предсердия и поддержание притока крови к нему. |
Трикуспидальная регургитация | Трехстворчатый клапан закрывается неправильно.Это заставляет кровь из правого желудочка течь обратно в правое предсердие. | Вызывает перегрузку правого желудочка объемом. Со временем это вызывает дилатацию правого желудочка и его отказ. |
Сужение перикарда | Перикард представляет собой мембранный мешок вокруг сердца.Повторяющееся или продолжающееся воспаление вызывает его жесткость и утолщение и препятствует нормальному расширению сердца для перекачивания крови. | Утолщенный перикард ограничивает способность сердца эффективно перекачивать кровь. |
Шунт слева направо | Это ненормальное соединение между левым и правым полушариями сердца.Обычно присутствует с рождения. | Это вызывает перегрузку правого желудочка объемом, похожую на трикуспидальную регургитацию. |
Кредиты
Текущий по состоянию на: 31 августа 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
Ракеш К. Пай MD, FACC — Кардиология, электрофизиология
E.Грегори Томпсон, врач внутренних болезней,
Мартин Дж. Габика, врач, семейная медицина
Адам Хусни, доктор медицины, семейная медицина,
Стивен Форт, доктор медицины, MRCP, FRCPC, интервенционная кардиология
По состоянию на 31 августа 2020 г.
Автор: Здоровый персонал
Медицинский обзор: Ракеш К. Пай, доктор медицины, FACC — кардиология, электрофизиология, и Э. Грегори Томпсон, доктор медицины — врач внутренних болезней, и Мартин Дж. Габика, доктор медицины — семейная медицина, и Адам Хусни, доктор медицины — семейная медицина, Стивен Форт, доктор медицины, MRCP, FRCPC Интервенционная кардиология
Давление в правом желудочке сердца — обзор
Этиология и морфология трехстворчатого клапана
ТР, вторичная по отношению к давлению правого желудочка (ПЖ) и / или перегрузке объемом, встречается чаще, чем та, которая связана с первичным анатомическим поражением ТВ.Вторичный TR, обычно обозначаемый как , функциональный TR, характеризуется внутренне нормальными TV-створками, но аномальной коаптацией, часто в результате комбинации ремоделирования правого желудочка и дилатации трикуспидального кольца ( Fig. 20.1 ). Измерения сферичности правого желудочка (апикальная четырехкамерная систолическая площадь правого желудочка / размер по длинной оси правого желудочка) 2 и эксцентрическая дилатация 3 были связаны с желудочковым смещением границ TV-коаптации, вызывая фиксацию створок (или тентование) с неполным систолическим давлением. коаптация.При измерении с апикальной четырехкамерной проекции ( рис. 20.2 ) расстояние привязки 2 от кольцевой плоскости телевизора и область привязки 3 , окруженная смещенными створками и кольцевой плоскостью, независимо коррелируют с серьезностью функциональный TR. По мере развития функционального TR кольцевое пространство TV расширяется, становится более круглым и теряет свою обычную седловидную конфигурацию. 4 При прогрессирующем кольцевом увеличении TV, легко оцениваемом по 2-мерному расстоянию между введением передней и перегородочной створок в апикальной четырехкамерной проекции, также отмечается ухудшение функциональной TR. 3 Однако при значительной привязке ТВ-листовок функциональный TR можно наблюдать без значительного расширения кольца ТВ. 2
В одном исследовании пациентов с ТР от умеренной до тяжелой, выявленных с помощью эхокардиографии, у 86% была обнаружена функциональная ТР по сравнению с 14% с первичной аномалией ТВ-вкладышей. 5 Легочная гипертензия, первичная или вторичная, является наиболее частой причиной функциональной ТР. От умеренной до тяжелой TR наблюдается у 60% пациентов с тяжелой симптоматической первичной легочной гипертензией. 6 Вторичная легочная гипертензия в результате хронического заболевания легких, левожелудочковой недостаточности или левого клапана сердца (чаще всего митрального клапана), когда она сопровождается значительной функциональной TR, имеет более зловещий прогноз. 5,7,8-10 Систолическое давление в легочной артерии> 55 мм рт. Аппарат ТВ 11 ; однако ТР, связанная с инфарктом правого желудочка и дефектами межпредсердной перегородки (ДМПП), являются исключением.
Функциональная ТР может также возникать в состояниях с чистой объемной перегрузкой ПЖ без легочной гипертензии, например, при ДМПП с большим шунтом слева направо. Внутреннее заболевание миокарда с инфарктом правого желудочка с постинфарктным ремоделированием и дисплазией правого желудочка также связаны с функциональной ТР, обычно при наличии значительной диастолической перегрузки ПЖ давлением.
TR в результате первичного отклонения от нормы телевизора, также называемого органическим TR ( рис. 20.3 ), встречается гораздо реже, чем функциональный TR. 5 , 12 Состояния, поражающие левые клапаны, такие как дегенеративная миксоматозная болезнь, инфекционный эндокардит и, в редких случаях, ревматические заболевания, также могут включать ТВ. 11 , 12
Аномалия Эбштейна, наиболее частая врожденная причина ТР, связана с морфологическим спектром различных диспластических и привязанных створок ТВ, смещенных к вершине ПЖ. 13 TR может возникнуть через много лет после лучевой терапии средостения, хотя это наблюдается реже, чем левосторонняя клапанная регургитация, вызванная радиацией. 14 Травматический TR вызвана нарушением вспомогательного ТВ аппарата было связано со многими формами груди травмы и может ускользнуть от диагноза в течение многих лет после острого события. 15
кардиостимуляторы и кардиовертер-дефибриллятор приводит могут привести к серьезным TR несколько механизмов, в том числе телевизионного листовка перфорации, ведущая запутанности внутри опорного устройства ТВ, свинец адгезии к телевизору листовке или свинцовому соударения предотвращая нормальное замыкание ТВА листовки. 16
Необычные системные заболевания, такие как гиперэозинофильный синдром и карциноид, могут влиять на телевизор, 11 приводя к тяжелой TR.При карциноидном синдроме створки ТВ обычно утолщены, втянуты и неподвижны в полуоткрытом положении с очевидной неполной центральной коаптацией. 17 Аналогичные, но несколько менее драматические изменения были зарегистрированы у пациентов с лекарственным заболеванием ТВ, связанным с аноректическими агентами 18 и алкалоидами спорыньи, такими как эрготамин 19 и перголид. 20
Перегрузка желудочков сердца — обзор
8.4 Легочная артериальная гипертензия
ЛАГ — это патология, при которой прогрессирующее повышение легочного артериального давления вызывает перегрузку правого желудочка, дисфункцию, гипертрофию и затем недостаточность.ЛАГ — это клинический термин, обозначающий очень редкое идиопатическое заболевание (распространенность 1-2 на 1 000 000 человек) с плохим прогнозом (выживаемость менее 3 лет с момента постановки диагноза при отсутствии лечения). Первые симптомы появляются, когда среднее систолическое давление в легочной артерии в состоянии покоя превышает 20 мм рт. ЛАГ морфологически и гистологически характеризуется неомускуляризацией мелких легочных артерий с толстой интимой, гипертрофией сред, адвентициальной пролиферацией и аномальным отложением внеклеточного матрикса.Прогрессирование ремоделирования сосудов приводит к сужению просвета, повышению легочного артериального давления и необратимой ЛАГ [153]. Помимо этой идиопатической формы, легочная гипертензия может быть вызвана гемолитической анемией, ВИЧ-инфекцией или генетическими мутациями в гене BMPR2. Продолжительное пребывание на высоте может также из-за хронической гипоксии вызвать легочную гипертензию у предрасположенных людей. В 1980-х и 1990-х годах длительное употребление аноректических агентов, таких как бенфлуорекс, дексфенфлурамин и фенфлурамин, которые в настоящее время сняты с продажи, увеличивало риск развития легочной гипертензии в 23 раза [154].Совсем недавно у пациентов с болезнью Паркинсона, получавших лечение производными спорыньи, применяемыми из-за их агонистических свойств в отношении дофаминергических рецепторов, наблюдалось увеличение количества ЛАГ и ВБС, перголида или каберголина, которые также являются агонистами рецепторов 5-HT 2B , но не с лизуридом или тергуридом, которых нет [82].
Многочисленные аргументы подтверждают нынешний интерес к серотонину при экспериментальной и человеческой ЛАГ. Экспериментальные данные выявили определяющее действие серотонина в патофизиологии ЛАГ.Серотонин оказывает сосудосуживающее и митотическое действие на гладкомышечные клетки сосудов. Экспрессия рецепторов SERT и серотонина 5-HT 1B, 2A, 2B и 5-HT 7 обнаруживается в эндотелиальных и гладкомышечных клетках легочных артерий. Анализ митотического ответа гладкомышечных клеток, выделенных из нормальных легочных артерий или от пациентов с ЛАГ, подтверждает заметное повышение митотической активности серотонина на гладкомышечных клетках ПАУ. Рис. 12.1.
Генетически длинный аллельный вариант промотора SERT связан с увеличением пролиферации гладких мышц; Было высказано предположение, что гомозиготная форма этого варианта связана с идиопатической ЛАГ у пациентов, но более широкое исследование полиморфизма SERT не подтвердило эту связь [155].У крыс хроническая гипоксия и серотонин вызывают обширное ремоделирование сосудов. Точно так же сверхэкспрессия гена SERT у мышей вызывала спонтанное развитие ЛАГ в отсутствие гипоксии и усиление легочной гипертензии после гипоксического стимула. Напротив, ремоделирование сосудов и гипоксическая легочная гипертензия снижены у мутантных мышей по рецептору 5-HT 1B или по SERT [153]. Следовательно, путь передачи сигналов серотонина модулирует функцию гладких мышц легочных сосудов как в нормальных условиях, так и на стадии заболевания, и, вероятно, способствует прогрессированию ЛАГ.Однако точный механизм еще предстоит уточнить. СИОЗС, которые временно повышают уровень серотонина за счет ингибирования захвата серотонина, не влияют на развитие гипоксической ЛАГ. Напротив, наблюдалась связь между поздним использованием СИОЗС матерью и стойкой неонатальной легочной гипертензией [20]. Таким образом, в настоящее время неясно, приводит ли серотонин сам по себе или комбинация его первичных эффекторов к развитию ЛАГ.
Высокие концентрации серотонина в плазме обнаруживаются у пациентов с ЛАГ.Положительная корреляция между этими концентрациями и давлением в правом желудочке наблюдалась более чем у 80% пациентов с ЛАГ [33]. Лекарства, которые могут вызывать легочную гипертензию, такие как аминорекс, перголид, фенфлурамин и дексфенфлурамин (или, по крайней мере, их активные метаболиты), потенциально способны высвобождать серотонин, хотя они являются агонистами рецепторов 5-HT 2 , а точнее 5- HT 2B подтип. Стимуляция высвобождения серотонина может способствовать увеличению концентрации серотонина в плазме и активации серотонинергических рецепторов.Хроническое воздействие гипоксии (имитирующее большую высоту) приводит к сверхэкспрессии рецепторов 5-HT 2B (и 5-HT 1B ). Легочная гипертензия связана со значительным увеличением экспрессии рецепторов 5-HT 2B (и 5-HT 1B ) в легочных артериях грызунов и людей [156, 157]. ЛАГ, индуцированная гипоксией, у мышей значительно усиливается при введении терапевтических доз дексфенфлурамина. Напротив, возникновение индуцированной гипоксией ПАУ у мышей полностью предотвращается в присутствии селективного антагониста рецепторов 5-HT 2B , RS-127445.Точно так же у мышей Htr2b — / — ЛАГ не развивается после хронического воздействия гипоксии и введения дексфенфлурамина [157]. Эксперименты с использованием гладкомышечных клеток легочных сосудов показали, что активация рецепторов 5-HT 2B также может инициировать прогрессию клеточного цикла и митогенез. При анализе гена рецептора 5-HT 2B у пациентов, у которых развилась ЛАГ после приема фенфлурамина, была обнаружена гетерозиготная мутация. Этот мутировавший рецептор проявляет большую эффективность клеточной пролиферации, в частности, в ответ на нордексфенфлурамин (активный метаболит дексфенфлурамина) и серотонин за счет исключительного связывания с белком Gα13 [158].Недавно взрослых, привыкших к высотным упражнениям, лечили соединением-антагонистом рецептора 5-HT 2B , разработанным Epix, PRX-08066. У этих здоровых людей наблюдалось снижение систолического давления в легких во время упражнений в условиях гипоксии без влияния на системное давление. В августе 2007 г. было опубликовано клиническое исследование фазы II, посвященное изучению эффектов этого соединения при гипертонии, вторичной по отношению к хронической обструктивной болезни легких. Более 58 пациентов, получавших 400 мг PRX-08066, у 44% показали небольшое снижение легочного систолического давления, PRX- 08066 не влияет на системное артериальное давление [159].Недавние исследования с использованием модели индуцированной монокроталином легочной гипертензии подтвердили, что другие антагонисты рецепторов 5-HT 2B (тергурид, PRX-08066 или C-122) значительно снижали легочное давление, утолщение артериальной стенки и закупорку просвета, но сохраняли сердечную функцию [ 156, 160, 161].
Серотонин может также влиять на другие регуляторные пути, участвующие в прогрессировании ЛАГ; в частности, серотонин может ингибировать сигнальный путь BMP путем модуляции нижестоящих белков Smad.Взаимодействие с этим сигнальным путем сильно подозревается, потому что хроническое введение серотонина увеличивает легочное артериальное давление и ремоделирование сосудов у гетерозиготных мышей по гену Bmpr2 , Bmpr2 +/- и усиливает эффекты гипоксии. Нарушение этих сигнальных путей может быть важным кофактором гипоксии в патогенезе ЛАГ [162]. Было показано, что как мутация BMPR2 , так и агонисты рецепторов 5-HT 2B вызывают активацию тирозинкиназы SRC; наоборот, антагонисты рецепторов 5-HT 2B ингибируют транспортировку SRC и функцию нижестоящего канала.У мышей с нокаутом Bmpr2R899X , у которых спонтанно развивается легочная гипертензия, антагонист рецептора 5-HT 2B , SB-204741, блокировал активацию SRC, вызванную мутацией Bmpr2R899X . SB-204741 предотвращал развитие легочной гипертензии, уменьшал рекрутирование воспалительных клеток в легкие, уменьшал мускуляризацию кровеносных сосудов, а также снижал фосфорилирование SRC и нижестоящую активность у мышей Bmpr2R899X . Наследственная легочная гипертензия возникает в результате повышенной активации SRC, сокращения клеток и сосудистого сопротивления, но антагонизм рецепторов 5-HT 2B предотвращает фосфорилирование SRC, последующую активность и легочную гипертензию у мышей Bmpr2R899X [163].
При трансплантации BM было показано, что ограниченная экспрессия рецепторов 5-HT 2B к клеткам BM необходима и достаточна для развития индуцированной гипоксией или монокроталином легочной гипертензии, подтверждая действие серотонина на дифференцировку гемопоэтических стволовых клеток [164]. Интересно, что клетки ВМ Bmpr2R899X также вызывают спонтанную легочную гипертензию с ремоделированием и воспалением при трансплантации контрольным мышам, тогда как контрольные клетки ВМ обладают защитным эффектом против развития заболевания при трансплантации мышам с мутантом Bmpr2R899X .Донорские клетки, полученные из ВМ, были обнаружены в легких мышей-реципиентов. Функциональный и молекулярный анализ выявил дисфункцию мутантных ВМ-клеток, указывающую на фенотип легочной гипертензии, вскоре после трансплантации и задолго до развития патологии легких. Таким образом, клетки ВМ играют ключевую роль в патогенезе генетической легочной гипертензии, учитывая, что трансплантированные клетки ВМ Bmpr2R899X были способны управлять фенотипом легких [165].
Вместе эти данные раскрывают роль серотонина в развитии ЛАГ и изменяют вклад серотонина в ЛАГ во внелегочное кроветворное событие.
Острая перегрузка правого желудочка давлением. Сравнение двух моделей правого-левого шунта. Легочная артерия к левому предсердию и правое предсердие к левому предсердию: экспериментальное исследование | Journal of Cardiothoracic Surgery
Функция правого желудочка определена как независимый фактор риска смертности при различных заболеваниях, таких как хроническая обструктивная болезнь легких (ХОБЛ), легочная артериальная гипертензия (ЛАГ) (недостаточность ПЖ является конечным результатом ЛАГ и причиной не менее 70% всех смертей от ЛАГ), респираторный дистресс-синдром у взрослых (ARDS) и т. д. [8].Также легочная гипертензия, вторичная по отношению к дилатационной кардиомиопатии, представляет собой фактор риска для процедуры трансплантации сердца из-за дисфункции правого желудочка трансплантата [9]. Дисфункция правого желудочка (ПЖ) может возникать по ряду клинических сценариев, включая перегрузку давлением, кардиомиопатии, ишемические, врожденные или клапанные пороки сердца, аритмии и сепсис. Перегрузка давлением может возникнуть в острой или хронической форме [10].
Часто развитие ЛРВ свидетельствует о заключительной фазе заболевания.В кардиоторакальной хирургии RVF, по-видимому, является частой причиной послеоперационного кардиогенного шока, связанного с высокой летальностью [11–13]. Были предложены различные хирургические методы лечения ЛПН, такие как септостомия предсердий [3], экстракорпоральное обходное кровообращение справа налево с центрифужным насосом крови и мембранным оксигенатором [14], экспериментальная септостомия предсердий с вено-венозной экстракорпоральной мембранной оксигенацией (VV-ECMO). ) [15], либо создание периферического шунта [16]. Тем не менее, имплантация правостороннего вспомогательного устройства связана с высокой летальностью [17].
Первая идея шунтирования легочной артерии в левое предсердие была предложена 50 лет назад и принадлежит Билгутаю и Лиллехею [18]. В 1972 году Гупта оценил шунт ЛП в левое предсердие при легочной гипертензии на экспериментальной модели [19]. Наиболее важным побочным эффектом модели Гупты, который также используется в последнее время в практике септостомии предсердий, является тяжелая гипоксемия из-за чрезмерного шунтирования справа налево. Наши записи подтвердили снижение артериального кислорода в обеих группах, но это не было статистически значимым (Рисунок 4).
Рисунок 4Корреляция процентного изменения pO от исходного уровня 2 Артериальная артерия между двумя шунтами .
Помимо нескольких других механизмов, которые приводят к низкому сердечному выбросу при ЛДН, основной особенностью является снижение транслегочного кровотока с уменьшенным результатом наполнения левого предсердия и желудочков, что называется последовательной взаимозависимостью желудочков. Наша цель состояла в том, чтобы оценить гемодинамический статус легочной артерии в шунт левого предсердия, который может иметь много преимуществ, и сравнить этот шунт с межпредсердным шунтом.
Перевязка легочной артерии у свиней воспроизводимо приводит к правосторонней недостаточности кровообращения, определяемой по увеличению давления в правом желудочке и средней легочной артерии, а также снижению конечного диастолического давления в левом желудочке. В нашем исследовании в обеих группах после шунтирования было обнаружено увеличение частоты сердечных сокращений на 10 и 20 минуте и снижение среднего артериального давления, но была статистически значимая разница среднего артериального давления между двумя группами через 20 минут (p = 0 .054) более заметен в шунте группы 1 (PA-LA). Этот результат можно объяснить сопутствующим снижением в этой группе УВО через 20 минут. Существует статистически значимая разница между группами относительно процентного изменения переменной SVR от исходного уровня до 10 минут и статистически значимая разница между двумя группами через 20 минут (p = 0,075). Наши записи низкого САД и низкого УВО в обеих группах согласуются с результатами, описанными другими исследователями [20–22].
Давление в правом желудочке было статистически значимо выше в группе RA-LA. Перегрузка правого желудочка — давление часто приводит к опасной для жизни желудочковой тахикардии. С этой точки зрения шунт PA-LA имеет значительное преимущество. Мы заметили, что давление в правом предсердии в обеих группах не увеличилось, как ожидалось, потому что эксперимент был острым, и трикуспидальный клапан по данным эпикардиальной эхокардиографии имел достаточную компетентность. Однако межпредсердный шунт, вероятно, полезен только в том случае, если происходит достаточное шунтирование справа налево для увеличения сердечного выброса.
Результаты более низкого среднего артериального давления и УВО в пользу шунта PA-LA указывают на более легкую манипуляцию сердечной функцией для оптимизации работы сердца с помощью простых маневров, таких как инфузия объема или медицинское вмешательство в случаях реальных условий перегрузки правого желудочка.
Септостомия предсердий была связана с риском внутрипроцедурной и постпроцедурной смертности до 30% в нескольких сериях [3, 5, 23–25], чаще всего вторичными по отношению к прогрессирующей гипоксии, правожелудочковой недостаточности и желудочковым аритмиям.По этой причине Зирер и др. [26] попытались определить качественное и количественное влияние шунтирования с низким и высоким расходом. В этом исследовании шунтирование с низким потоком (15% сердечного выброса) улучшило диастолическую податливость правого желудочка на 42% и вызвало смещение соотношения резервуара и канала RA в сторону физиологических условий. В нашем исследовании сердечный выброс существенно не отличался между двумя группами. Это можно отнести к механизму Франка-Старлинга. Согласно механизму Франка-Старлинга, когда сердце растягивается в ответ на повышенную преднагрузку, оно увеличивает силу сокращения за счет увеличения потребления кислорода миокардом.Но в нашем исследовании мы наблюдали, что кровоток в ПМЖВ имел статистически значимую разницу между группами относительно процентного изменения от исходного уровня до 10 минут и статистически значимую разницу между двумя группами через 20 минут (p <0,0005) в пользу шунта PA-LA. (Рисунок 5,6).
Рисунок 5График, показывающий поток в LAD и изменения во время эксперимента .
Рисунок 6Корреляция процентного изменения от базовой линии ПМЖВ между двумя шунтами .
Согласно закону Хагена-Пуазейля
шунт PA — LA имеет в 10 раз больший объемный расход, где Q : объемный расход, π : математическая константа, η : динамическая вязкость жидкости [паскаль — секунда (Па · с)], P и : входное давление, P или : выходное давление, L: общая длина трубки в направлении x (в метрах), R: — радиус.
Из-за анатомической близости между легочной артерией и левым предсердием длина трансплантата PA-LA всегда короче, чем трансплантата RA-LA. Градиент давления PA-LA всегда выше, чем RA-LA. Эти две проблемы составляют неотъемлемое преимущество шунта PA-LA и делают шунт PA-LA более эффективным, поскольку он может обеспечить более широкий диапазон достижимых потоков через шунт. Учитывая тот факт, что текущая технология позволяет регулировать перевязку легочной артерии, мы можем предположить, что в будущем мы сможем рассчитывать идеальный кровоток индивидуально.
К нашему удивлению, системная артериальная ненасыщенность после шунта PA-LA не увеличилась резко с разрушительными последствиями, такими как системная доставка кислорода. Преимущества шунта из легочной артерии в левое предсердие следующие:
- 1.
Можно проводить без экстракорпорального кровообращения
- 2.
Может использоваться с регулируемым устройством окклюзии с телеметрическим управлением, как устройство для бандажирования легочной артерии Flo-Watch (EndoArt, Лозанна, Швейцария), которое успешно внедрено в клиническую практику бандажирования [20].
- 3.
Может быть легко закупорено с помощью существующих устройств, например, устройство для окклюзии сосудов Gianturco-Grifka, которое является подходящей системой закрытия для закрытия шунта из-за большого размера (9 мм) [21]
- 4.
Может быть легко выполнено в сочетании с устройством помощи легких без помпы, как Novalung, параллельно с шунтом PA или в последовательной настройке [22].
Дефект межжелудочковой перегородки | Учебная ветеринарная больница ЛГУ
Что такое дефект межжелудочковой перегородки?
Дефект межжелудочковой перегородки (VSD) является результатом порока внутрижелудочковой перегородка, обеспечивающая ненормальное сообщение между правым и левым желудочками.Обычно во время внутриутробного развития несколько структур (трабекулярная мышечная перегородка, входная мышечная перегородка, инфундибулярная мышечная перегородка и перепончатая перегородка от эндокардиальных подушек) сливаются определенным образом, образуя внутрижелудочковую перегородку. Отказ любого из этих плавкие конструкции могут привести к VSD. Наиболее частым ДМЖП является перимембранозный дефект. в результате нарушения слияния мембранных и мышечных компонентов.
Преобразователи частотыклассифицируются в зависимости от того, резистивные они или не резистивные. Как Название подразумевает, что резистивный VSD — это VSD меньшего диаметра, который обеспечивает сопротивление кровоток. Из-за обычно более высокого систолического давления в левом желудочке по сравнению с давление в правом желудочке, у большинства резистивных межжелудочковых промежутков кровоток слева направо. В количество шунтируемой крови зависит от размера ДМЖП и градиента давления на VSD.Шунтированная кровь быстро перемещается в легочные артерии по мере того, как кровь течет. во время систолы от сокращающегося левого желудочка к уже сокращающемуся правому желудочек. Это шунтирование крови приводит к объемной перегрузке левой стороны сердце из-за чрезмерного кровообращения в легочных сосудах. Эксцентрическая гипертрофия левого желудочка возникает из-за перегрузки по объему. Может развиться левосторонняя застойная сердечная недостаточность.
Аортальная недостаточность также может возникать из-за отсутствия поддержки аортального клапана из положения VSD.Слышен систолический шум от ДМЖП при диастолической аортальной недостаточности. временами шепот (шепот взад и вперед). У нерезистивных преобразователей частоты дефект большего диаметра позволяет крови свободно течь между левым и правым желудочками. Направление потока определяется сопротивлением оттоку в легочную артерию и аорту от правый желудочек и левый желудочек соответственно. Обычно системное сопротивление примерно в пять раз больше, чем сопротивление легких, поэтому кровь будет шунтироваться слева направо через большой дефект.Увеличение легочной гипертензии происходит из-за массивного легочная избыточная циркуляция крови. Эксцентрическая гипертрофия обоих желудочков вторична по отношению к объемная перегрузка и правый желудочек концентрически гипертрофируется из-за давления перегрузка со временем. В редких случаях легочная гипертензия может стать тяжелой из-за легочной гипертензии. артериальная вазоконстрикция, позволяющая давлению в правом желудочке превышать давление в левом, вызывая реверсирование шунта.Шумы в межжелудочковой перегородке различаются по интенсивности в зависимости от размера. Маленький до умеренного резистивного систолического шума может быть громче, чем большой резистивный систолический шум. бормочет.
Клинические признаки
Клинические признаки ДМЖП могут включать признаки левосторонней сердечной недостаточности. Клинические признаки левосторонней сердечной недостаточности может быть незначительной, например, учащение дыхания в состоянии покоя до умеренное снижение активности или непереносимость упражнений.Другие клинические признаки могут включать: кашель, отсутствие сна по ночам, усиление кашля по ночам или снижение аппетита. Приметы может прогрессировать до кашля с розовой пеной, что может вызвать респираторный дистресс. Редко, когда большие нерезистивные ДМЖП имеют обратный поток, цианоз и слабость могут быть клиническими признаки замечены.
Лечение
Хотя небольшие резистивные преобразователи частоты часто издают громкий шум, последствия этого дефекта маленькие и этот дефект не требует лечения.Напротив, резистивный средний размер ДМЖП могут иметь легкие и тяжелые последствия, и исход этого дефекта трудно подобрать. предсказывать. У некоторых животных в раннем возрасте появляются признаки застойной левожелудочковой недостаточности. и потребуется лечение стандартными препаратами, такими как диуретики, ангиотензинпревращающие ингибитор ферментов. Иногда назначают сильнодействующие артериодилататоры для снижения общего шунтирующий поток, позволяя снизить системное кровяное давление и увеличить кровоток из левого желудочка в аорту.Другое немедикаментозное лечение создается хирургическим путем. стеноз легочной артерии или бандажирование легочной артерии с целью уменьшения шунтирующего кровотока за счет увеличения легочное сосудистое сопротивление. Операция по исправлению фактического дефекта выполняется редко. и в настоящее время изучаются интервенционные методы для закрытия дефекта. Пациенты с большими нерезистивными ДМЖП получают медицинское лечение, как указано выше. резистивные ДМЖП умеренного размера с ранним установлением артериодилататора.
Последующая деятельность
Животных с легкими ДМЖП следует ежегодно повторно обследовать.

