Низкое расположение плаценты низкое прикрепление плаценты низкое предлежание плаценты
Многих будущих матерей волнует, насколько может быть опасным низкое расположение плаценты.
В норме плацента – орган, через который происходит обмен между кровью матери и плода – прикрепляется ближе к дну матки или по задней ее стенке. Это участки, которые в силу анатомических причин кровоснабжаются лучше всего, значит, и обмен веществ будет протекать наилучшим образом. Однако существуют причины, по которым место прикрепления плаценты может оказаться ниже. Если оно расположено ниже 6 см от внутреннего зева матки, это будет низкое расположение плаценты.
При этом принципиально важно, перекрывает ли плацента внутренний маточный зев или нет – от этого зависит и течение беременности, и ее разрешение. В случае, если низко расположенная плацента совсем не перекрывает внутренний зев, говорят просто о низкой плацентации, если частично перекрывает – о неполном предлежании, и если полностью – о полном предлежании плаценты.
Если просто имеет место низкое расположение плаценты, женщина обычно допускается до самостоятельных родов, но всегда нужно помнить о возможности отслойки плаценты, что может привести к острой гипоксии плода.
Отчего возникает патология прикрепления плаценты?
В норме при оплодотворении зародыш внедряется в стенку матки, создает в ней углубление – лакуну, через которую поступают нужные вещества, позже все это трансформируется в плаценту.
 Лучшим местом является дно и задняя стенка – там обычно и прикрепляется яйцо. Но если на матке есть какие-либо дефекты – рубцы после абортов или оперативных родов, миоматозные или аденомиозные узлы или врожденные анатомические дефекты, прикрепиться в нужном месте плодное яйцо не может и делает это ниже, там, где возможно. Там же формируется позже и плацента.
Лучшим местом является дно и задняя стенка – там обычно и прикрепляется яйцо. Но если на матке есть какие-либо дефекты – рубцы после абортов или оперативных родов, миоматозные или аденомиозные узлы или врожденные анатомические дефекты, прикрепиться в нужном месте плодное яйцо не может и делает это ниже, там, где возможно. Там же формируется позже и плацента. Низкое расположение плаценты всегда чревато нарушениями питания зародыша, потому у женщин с низкой плацентацией существует изначальная угроза гипоксии и гипотрофии плода, кроме того, всегда надо быть настороже на предмет отслойки плаценты. Не всегда эта отслойка происходит полностью, вызывая сильное кровотечение и гибель плода – иногда появляются отслойки небольших участков, под которыми скапливается кровь в виде гематомы –наружного кровотечения нет и беременность сохраняется, но чем больше площадь отслоившейся плаценты, тем хуже чувствует себя ребенок.
 Таким образом, по статистике, только у 5% женщин низкая плацентация сохраняется до 32 недели ( те, у кого был поставлен диагноз), и только треть из оставшихся сохраняет эту особенность до 37 недель.
Таким образом, по статистике, только у 5% женщин низкая плацентация сохраняется до 32 недели ( те, у кого был поставлен диагноз), и только треть из оставшихся сохраняет эту особенность до 37 недель. Никаких приемов или методов лечения низкого расположения плаценты не существует, надо только постоянно наблюдаться у врача и надеяться войти в тот самый удачный процент!
чем грозит ребенку, как диагностируется
При расположении детского места в нижнем сегменте матки в области внутреннего зева определяют полное предлежание плаценты. Ее край перекрывает родовые пути и делает раскрытие шейки в родах невозможным. Если родовой процесс запустится, сокращения миометрия приведут к отслойке плаценты и массивному кровотечению. Поэтому место прикрепления плаценты определяют с первого триместра и наблюдают за ним на протяжении всей беременности.
Почему плацента прикрепляется низко
Низкое прикрепление плаценты определяется на последних сроках гестации всего у 3% женщин. Но во время УЗИ во 2 триместре оно выявляется значительно чаще. Это связано с процессом миграции плаценты, когда рост матки приводит к ее постепенному смещению вверх. Поэтому вместо предлежания сохраняется низкое прикрепление, которое более безопасно.
Но во время УЗИ во 2 триместре оно выявляется значительно чаще. Это связано с процессом миграции плаценты, когда рост матки приводит к ее постепенному смещению вверх. Поэтому вместо предлежания сохраняется низкое прикрепление, которое более безопасно.
Полное предлежание плаценты опасно кровотечением
Причинами предлежания плаценты чаще всего выступают патологические состояния матки, которые ведут к изменению эндометрия и характера кровотока в нем.
Чаще всего данное состояние провоцируют:
- хронический эндометрит;
- частые аборты и выскабливания;
- высокий паритет родов;
- в анамнезе роды с инфекционными осложнениями;
- рубцы на матке после кесарева сечения или пластических операций;
- курение.
Эмболизация маточных артерий, которая используется при лечении миомы небольших размеров, не рассматривается в качестве фактора риска нарушения кровотока в маточных артериях, если после манипуляции до наступления беременности выдержан срок не менее года.
Причиной могут быть особенности эмбриона. Нарушения развития, которые сопровождаются недостатком или низкой активностью протеолитических ферментов, не позволяют прикрепиться зародышу в верхних отделах матки. Поэтому имплантация происходит низко, у внутреннего зева.
Имплантация является одним из критических периодов развития, под действием неблагоприятных факторов возникают отклонения в развитии хориона. Часть ворсин децидуальной оболочки атрофируются, а остальные становятся ветвистыми.
Такой тип хориона в большей степени способен мигрировать по эндометрию.
Полное предлежание плаценты может сопровождаться плотным прикреплением или истинным приращением. Это связано с недостаточно развитой слизистой оболочкой матки в области внутреннего зева.
Полное предлежание диагностируется на УЗИ
Когда можно заметить патологию
При первом УЗИ в 11-12 недель отмечают место прикрепления плаценты. Если она расположена по передней стенке или сзади, а край находится в области внутреннего зева, это не считают предлежанием. Обычно к следующему скрининговому УЗИ плодное место успевает мигрировать на несколько сантиметров выше внутреннего зева. Центральное прикрепление в 1 триместре может перейти в краевое, когда только часть плаценты останется на пути плода, а остальная сместиться по задней стенке или в другую сторону. Но это не уменьшает рисков для вынашивания плода.
Если она расположена по передней стенке или сзади, а край находится в области внутреннего зева, это не считают предлежанием. Обычно к следующему скрининговому УЗИ плодное место успевает мигрировать на несколько сантиметров выше внутреннего зева. Центральное прикрепление в 1 триместре может перейти в краевое, когда только часть плаценты останется на пути плода, а остальная сместиться по задней стенке или в другую сторону. Но это не уменьшает рисков для вынашивания плода.
Если на УЗИ в 22 недели определили, что внутренний зев перекрыт плацентой, необходимо тщательное наблюдение за беременной, а когда появляется кровь из половых путей – экстренная госпитализация. В позднем сроке плацента уже не сможет сместиться на безопасное расстояние.
Предлежание плаценты можно определить при вагинальном осмотре. Вместо предлежащей части плода пальпируется губчатое мягкое образование, а плод в позднем сроке предлежит ягодицами.
Но при диагностированной патологической плацентации влагалищные осмотры увеличивают риск спонтанного кровотечения.
При беременности с таким осложнением есть риск преждевременного прерывания
Опасные симптомы
Главный признак предлежания плаценты – кровотечение, которое возникает на фоне полного благополучия. Риск увеличивается по мере прогрессирования беременности, чаще симптом встречается во 2-3 триместре. Иногда появлению кровянистых выделений предшествует тонус матки или появление схваток.
При центральном предлежании кровянистые выделения могут иметь рецидивирующий характер. Они появляются в различном объеме от мажущих красных пятен на белье до свободно вытекающей крови. Это приводит к развитию анемии у беременной. Кровь всегда ярко-алая, ее появление не сопровождается болью.
Повышение тонуса матки, вызванное нервным напряжением, физической нагрузкой, в позднем сроке может привести к разворачиванию нижнего маточного сегмента.
При этом происходит сокращение миометрия.
Плацента не содержит мышц, поэтому не способна сокращаться и начинает отслаиваться.
Вероятность отслойки зависит от количества беременностей:
- у первородящих шейка матки начинает открываться снаружи, внутренний зев открывается позже;
- у повторнородящих роды начинаются с разворачивания нижнего сегмента матки, поэтому риск отслойки выше.
Выраженное кровотечение или то, которое возникло в родах, самостоятельно остановиться не может. Оно ведет к формированию геморрагического шока. Его степень зависит от объема кровопотери и утяжеляется у женщин с анемией. Признаки геморрагического шока следующие:
- головокружение, помутнение сознания;
- общая слабость;
- снижение артериального давления;
- учащенное сердцебиение;
- бледность кожных покровов.
В начальной стадии шока появляется холодный пот, но при значительной кровопотере возникает сухость слизистых оболочек, липкая слюна. Язык обложен белым налетом, бледность дополняется синюшностью. Дыхание поверхностное, частое. Плохой признак – тошнота и появление рвоты. При отсутствии медицинской помощи кровотечение приводит к смерти.
Язык обложен белым налетом, бледность дополняется синюшностью. Дыхание поверхностное, частое. Плохой признак – тошнота и появление рвоты. При отсутствии медицинской помощи кровотечение приводит к смерти.
Осложнения беременности
В нижнем сегменте матки кровоснабжение значительно хуже, чем в остальных участках органа.
Чем грозит ребенку недостаточный кровоток:
- фето-плацентарная недостаточность;
- хроническая гипоксия;
- задержка внутриутробного развития.
До конца 2 — начала 3 триместра размеры плода будут соответствовать норме. Позже из-за хронической гипоксии становится заметным отставание в размерах плода, которое диагностируется по длине бедренной кости, объему живота и другим фетометрическим показателям во время УЗИ. Задержка развития плода, которая развивается во 2 триместре, происходит по асимметричному типу. Если выраженный недостаток питания и анемия присоединяются в 3 триместре, то ЗРП развивается по симметричному типу с сохранением пропорций плода.
На протяжении всей беременности сохраняется угроза прерывания. Она проявляется периодическими мажущими выделениями. От анемии, развивающейся у матери, страдает и плод. Это усиливает проявления задержки внутриутробного развития, ведет к нарушению функции внешнего дыхания после родов.
Дети, рожденные от матерей с анемией, хуже переносят период адаптации. Физиологическая желтуха новорожденных, которая является следствием распада фетального гемоглобина, может протекать в тяжелой форме.
Полное предлежание плаценты в сочетании с анемией увеличивает риск развития гипоксической травмы мозга, которая наблюдается у 40% недоношенных новорожденных с низким гемоглобином. Она проявляется следующими изменениями:
- кровоизлияние в боковые желудочки мозга;
- обструктивная гидроцефалия;
- перивентрикулярная лейкомаляция.
Но наиболее тяжелым последствием при беременности становится острая гипоксия, которая возникает при отслойке плаценты. Если женщина находится вне стационара, в большинстве случаев наступает антенатальная гибель плода. У беременной с массивной кровопотерей высокий риск развития ДВС-синдрома.
Если женщина находится вне стационара, в большинстве случаев наступает антенатальная гибель плода. У беременной с массивной кровопотерей высокий риск развития ДВС-синдрома.
Кровотечение приводит к острой гипоксии плода
Как рожать с предлежанием плаценты
Роды через естественные родовые пути с полным предлежанием плаценты невозможны. Но есть шанс доносить ребенка до 36-37 недель. Тактика зависит от срока гестации, состояния беременной и наличия кровянистых выделений.
Во 2 триместре, если выделений крови нет, требуется регулярное наблюдение в женской консультации, контроль коагулограммы. В 3 триместре нужна плановая госпитализация в 32-34 недели для наблюдения и пролонгирования вынашивания.
При наличии угрозы прерывания проводится токолитическая терапия, коррекция гемостаза.
Применяются следующие препараты:
- магния сульфат, бэта-адреномиметики – для снятия тонуса матки;
- спазмолитики;
- пентоксифиллин, дипиридамол – в качестве дезагрегантов;
- свежезамороженная плазма – для улучшения свертывания крови;
- препараты железа – для коррекции анемии.

36-37 недель — это максимальный срок для планового родоразрешения. Если возникает массивная потеря крови, необходима экстренная госпитализация в роддом. В этом случае вне зависимости от срока проводят кесарево сечение.
Операция имеет свои особенности. При смещении части плаценты на переднюю стенку разрез на матке производят корпорпально, чтобы избежать усиления кровопотери. Иногда во время кесарева обнаруживают, что плацента плотно прикреплена. Реже наблюдается истинное приращение. В первом случае возможно отделение плаценты рукой, а приращение разъединить невозможно. Поэтому женщине проводят экстирпацию матки с сохранением придатков.
В послеоперационном периоде необходима коррекция анемии, нарушений свертывания крови и инфекционных осложнений.
В некоторых больницах высокого уровня, где есть сосудистые хирурги, после извлечения плода при кесаревом сечении можно выполнить эмболизацию маточных артерий. Это позволит снизить риск кровопотери и легче отделить плаценту.
Это позволит снизить риск кровопотери и легче отделить плаценту.
Полное предлежание – это патология женщин, часто прибегающих к абортам. Поэтому снизить риск можно, если реже прибегать к такой манипуляции, планировать свои беременности и использовать презерватив для защиты от инфекции.
Читайте в следующей статье: беременность после медикаментозного прерывания беременности
Плацента низко расположена — чем грозит и что делать?
Беременной женщине нужно быть готовой к тому, что в её состоянии могут происходить отклонения от нормального вынашивания ребёнка. Услышав от врача о таких неприятностях, следует не паниковать, а строго и неукоснительно соблюдать все его предназначения.
Одним из примеров осложнения здорового течения беременности может быть низкое расположение плаценты. Что это такое, по какой причине возникает и чем грозит вашему малышу? Попробуем выяснить вместе.
Роль плаценты в развитии плода
Плацента представляет собой мостик между мамой и плодом. Медики называют её временным органом, который снабжает организм ребенка кислородом, всеми веществами, необходимыми для его развития, выводит ненужные компоненты. Плацента также вырабатывает гормоны для прогресса беременности, защищает малыша от инфекций. Словом, этот орган служит инструментом развития и питания ребёнка от организма его мамы.
Когда беременность протекает нормально, плацента развивается на расстоянии 6 см от внутренней части шейки матки. Если плацента расположена низко, то доктора ставят диагноз «низкая плацентация».
Что такое низкая плацентация?
Что же такое предлежание плаценты? Это одно из отклонений от нормального хода беременности. Предлежание или низкая плацентация бывает тогда, когда плацента находится в нижней части матки. В таком положении она может целиком или частично перекрывать канал шейки матки.
Симптомом предлежания плаценты может быть кровотечение. Оно происходит в результате растяжения нижней части матки во второй половине беременности. Иногда плацента даже начинает отслаиваться — и тогда происходит очень сильное кровотечение. Такое состояние представляет угрозу и для мамы, и для ребенка, но встречается не очень часто. Если же кровотечение остановить невозможно, то могут начаться преждевременные роды. В отдельных ситуациях, даже если до предполагаемой даты родов остается пару недель, прибегают к кесареву сечению для спасения обеих жизней.
Оно происходит в результате растяжения нижней части матки во второй половине беременности. Иногда плацента даже начинает отслаиваться — и тогда происходит очень сильное кровотечение. Такое состояние представляет угрозу и для мамы, и для ребенка, но встречается не очень часто. Если же кровотечение остановить невозможно, то могут начаться преждевременные роды. В отдельных ситуациях, даже если до предполагаемой даты родов остается пару недель, прибегают к кесареву сечению для спасения обеих жизней.
Типы предлежания
Предлежание плаценты в медицине делят на 4 типа:
- Плацента находится в нижней части матки. При этом сохраняется возможность родов естественным путём.
- Нижним краем плацента касается канала шейки матки, не закрывая его. В этом случае тоже сохраняется возможность вагинальных родов.
- Частичное перекрытие плацентой канала шейки матки. При таком предлежании роды проходят с помощью кесарева сечения.
- Полное перекрытие плацентой канала шейки матки.
 Родоразрешение проходит кесаревым сечением.
Родоразрешение проходит кесаревым сечением.
В случаях, когда ультразвуковая диагностика в начале беременности показывает, что плацента расположена близко от шейки матки либо касается ее, не волнуйтесь. Возможно, говорить о предлежании плаценты ещё рано. Ведь с развитием плода матка расширяется, и плацента может отойти от её шейки самостоятельно, естественным путём. Даже если на 20-й неделе беременности УЗИ показывает предлежание, это не значит, что до родов всё не станет на свои места без дополнительных мер.
Каждой беременной женщине с диагнозом предлежание доктора рекомендуют пройти дополнительное УЗИ на 36-й неделе беременности. Результатом исследования может оказаться отсутствие предлежания плаценты, то есть нормализация её состояния.
Иногда предлежание плаценты может быть абсолютно бессимптомным для женщины. Диагностировать его можно только на УЗИ.
Факторы риска
Следует знать, что возникновение низкого предлежания более характерно второй, третьей беременности. Повышает вероятность возникновения этой патологии также кесарево сечение в прошлых родах, предлежание плаценты в прошлых беременностях.
Повышает вероятность возникновения этой патологии также кесарево сечение в прошлых родах, предлежание плаценты в прошлых беременностях.
Особым фактором риска является курение женщины. Токсические вещества в этом случае не только пагубно влияют на расположение плаценты, а и могут привести к задержке умственного развития малыша.
Дальнейшая тактика поведения беременной зависит от наличия кровотечения и срока беременности. Если диагноз «предлежание плаценты» поставлен во втором триместре беременности и кровотечения нет, то, вероятней всего, доктор порекомендует воздержаться от физических нагрузок.
При наличии кровотечений вам, скорее всего, будет необходимо лечь в стационар для удобства постоянного контроля врача. Возможно, после прекращения кровотечения доктор предложит остаться в стационаре до родов. Не отказывайтесь, ссылаясь на хорошее самочувствие! Поберегите себя и ребёнка, ведь ждать осталось немного!
Специально для beremennost.net Елена ТОЛОЧИК
что это такое, чем опасна, роды, что делать если плацента низко расположена / Mama66. ru
ru
Женский организм разительно отличается от мужского. Это утверждение общеизвестно, однако далеко не каждый человек представляет себе, насколько сильно они различаются. А ведь в женском организме при необходимости появляются новые органы, а когда необходимость в них отпадает, они исчезают бесследно. Невероятно, правда?
Ситуация, требующая от женщины таких удивительных способностей проста и очевидна – беременность. Этот период характеризуется развитием даже 2 временных органов: желтого тела и плаценты. Правда, появляются они не одновременно, а последовательно.
Оба этих органа имеют огромное значение для развития малыша и сохранения беременности. И, к сожалению, оба они могут иметь различные патологии. Это и отслоение плаценты, и различное количество сосудов на пуповине, и низко расположенная плацента. Последнее, кстати, встречается наиболее часто. Что значит низко расположена плацента? Вопрос сложный, для начала надо понять, что такое плацента.
Что такое плацента
Еще до начала беременности, в середине менструального цикла, начинает развиваться желтое тело – орган, отвечающий за выработку прогестерона, необходимый для подготовки эндометрия к имплантации оплодотворенной яйцеклетки, а также для самой имплантации и поддержания беременности. Желтое тело образуется на месте фолликулы, выпустившей в маточную трубу созревшую яйцеклетку.
Дальнейшая судьба желтого тела зависит от того, произошло зачатие или нет. Если яйцеклетка не была оплодотворена, то она выходит вместе с кровью во время менструации, а желтое тело постепенно деградирует, то есть, рассасывается. Если же происходит оплодотворение, то желтое тело остается активно еще 4 месяца — до завершения развития плаценты.
А откуда берется плацента и зачем она нужна? Плацента развивается после имплантации плодного яйца. К этому времени оно имеет уже приличный запас клеток, которые после имплантации делятся на 2 части: из одной впоследствии будет развиваться плод, из другой – плодные оболочки и, собственно, плацента. Любопытная деталь: за развитие плаценты и оболочек отвечает мужская часть ДНК плодного яйца.
Любопытная деталь: за развитие плаценты и оболочек отвечает мужская часть ДНК плодного яйца.
Плацента полностью формируется к 16 неделе беременности, однако, вплоть до 36 недели она продолжает расти, так как малышу необходимо все больше кислорода и питательных веществ. Как и любой процесс в организме, развитие плаценты может протекать с нарушениями. Одна из возможных патологий носит название низкая плацентация при беременности.
Кстати, и сам обмен между двумя организмами происходит именно посредством плаценты. Как видите, важность плаценты для сохранения беременности переоценить трудно.
Виды расположения плаценты
Обычно плацента крепится на задней стенке матки ближе к ее дну. Стоит заметить, что матка – сосуд перевернутый, и дно у нее расположено сверху. Это самый оптимальный вариант расположения плаценты. Однако так получается не всегда. В некоторых случаях плацента крепится к передней стенке. Что так же не является патологией.
Низкое расположение плаценты при беременности гораздо опаснее. Если плацента расположена низко, она подвергается более сильному давлению со стороны плода, да и при любом внешнем воздействии риск повреждения плаценты или ее отслоения возрастает. Кроме того, на поздних сроках активно двигающийся ребенок тоже может повредить плаценту, или же пережать пуповину.
Еще один минус низкого расположения плаценты в том, что нижняя часть матки не так хорошо снабжается кровью, как ее дно. Все это чревато гипоксией плода – острой нехваткой кислорода. Низким называется такое расположение плаценты, когда между ее нижним краем и зевом матки менее 6 см.
Если плацента расположена низко, но по задней стенке матки, то скорее всего, ситуация выправится самостоятельно, и плацента мигрирует в более высокое положение. Передняя стенка имеет большую склонность к растяжению, и миграция для нее также характерна, однако направление миграции противоположно: обычно плацента движется наоборот, вниз, к шейке матки.
Еще более сложной и опасной патологией расположения плаценты является ее частичное или полное предлежание. Предлежанием называется такое состояние, когда плацента частично или полностью заслоняет зев матки. Подробнее о предлежании плаценты →
Причины низкого расположения
Низкая плацента при беременности может быть следствием целого ряда причин. Чаще всего – различного рода повреждений слизистого слоя матки. Это могут быть и воспаления, и инфекционные заболевания, и последствия предыдущих абортов и выкидышей, особенно, если имело место выскабливание. Рубцы на матке после кесарева и других гинекологических операции также могут помешать плодному яйцу закрепиться в верхней части матки.
Плацента низко расположена
Причиной низкого расположения плаценты при беременности могут стать и патологии развития матки, в том числе недоразвитости матки или неправильной ее формы. Кроме того, низкая плацента встречается при многоплодной беременности.
Симптомы низкого расположения плаценты
Как правило, низко расположенная плацента не сообщает о себе никакими симптомами. В некоторых случаях могут появляться тянущие боли в нижней части живота или кровотечение. Однако это уже является симптомами отслоения плаценты, а не просто низкой плацентации.
Если плацента располагается не предельно низко к зеву матки, то внешних симптомов может и не быть. В этом случае на 12 неделе низкая плацентация определяется на плановом УЗИ.
Чем опасна низкая плацентация при беременности?
Как и любая патология, низкая плацентация имеет целый ряд возможных, но вовсе не обязательных последствий. Чем опасна низкая плацентация у беременных? Чтобы ответить на этот вопрос, нужно снова углубиться в физиологию.
Во-первых, плод со временем растет и все сильнее давит на нижнюю часть матки. Если плацента расположена низко, и также подвергается избыточному давлению со стороны ребенка. Это может привести к отслоению плаценты или вагинальному кровотечению, и, как следствие, возникает риск выкидыша. Кроме того, кровоснабжение нижней части матки значительно хуже, чем в ее верхней части. В связи с этим плод может недополучать кислорода и питательных веществ.
Это может привести к отслоению плаценты или вагинальному кровотечению, и, как следствие, возникает риск выкидыша. Кроме того, кровоснабжение нижней части матки значительно хуже, чем в ее верхней части. В связи с этим плод может недополучать кислорода и питательных веществ.
Чем грозит низкая плацентация теперь понятно. Как же дело обстоит с предлежанием плаценты? Все перечисленное выше характерно и для него. Однако стоит учитывать, что в этом случае плацента находится в самом нижнем положении и испытывает гораздо более сильное давление, в связи с этим все риски низкой плацентации усиливаются.
Лечение и профилактика низкой плацентации
Что делать, если у вас плацента низко расположена? Рекомендации довольно просты. Прежде всего, не надо лишний раз волноваться. В большинстве своем, женщины с этой патологией без проблем вынашивают ребенка и рожают его самостоятельно. Для этого обычно достаточно выслушать врача и выполнять все, что он скажет. Ну а лишнее волнение вряд ли положительно скажется на беременности.
К сожалению, медикаментозное лечение низкой плацентации при беременности невозможно. В большинстве случаев можно лишь ждать, что плацента сама займет более подходящее место. Это не только возможно, но и наиболее вероятно. Матка постоянно растет, что и способствует изменению положения. Так что, если женщине ставят диагноз «низкая плацентация» на 20-22 или даже на 32 неделе, это еще не приговор. Считается, что до 36 недели положение плаценты вполне может измениться.
Заведите привычку подкладывать под ноги подушку, когда ложитесь. И, конечно же, не пропускайте плановые посещения врача, а если гинеколог посоветует лечь на сохранение, не пренебрегайте этим советом.
А что можно сделать для предотвращения низкого расположения плаценты? Прежде всего, нужно избегать абортов и выкидышей. Кроме того, очень важно своевременно и еще до беременности пролечить все инфекционные и воспалительные процессы. Конструктивные особенности матки, к сожалению, исправить не в наших силах.
Секс
Секс при низкой плацентации противопоказан, а также придется избегать чрезмерных физических нагрузок. Нельзя будет бегать, прыгать, тяжести поднимать. Причины отказа от половой жизни понятны не всем, а ведь все довольно просто. Плацента при этой патологии находится очень близко к шейке матки, иногда в 2-3 см, а ритмичные толчки, напряжение, сокращение матки во время оргазма могут стать причиной отслоения плаценты. То же самое касается и физических нагрузок.
Роды при низкой плацентации
Чем опасна низкая плацентация во время беременности понятно, а чем это грозит во время родов? Все зависит от конкретного местоположения плаценты. В большинстве случаев, роды при низкой плацентации проходят естественным путем.
Если же плацента расположена слишком близко к зеву, возможно, околоплодный пузырь будет проколот искусственно. В этом случае головка плода прижмет плаценту к матке. Если имеет место предлежание плаценты или же плод в матке расположен неправильно, женщине будет сделано плановое кесарево сечение./Fotosearch_COG12028-56a76a273df78cf77295bef4.jpg)
Впрочем, низкая плацента – это не повод для паники. Во-первых, и при такой патологии легко выносить ребенка без вредных последствий, во-вторых, до 34 недели расположение плаценты не стабильно. Оно легко может измениться на более благоприятное. Так что, если вам поставили диагноз «низкая плацента», нужно настроиться на лучшее и выполнять рекомендации врача, тогда все будет в порядке: ребенок родится своевременно, естественным путем и без осложнений.
Полезное видео о низкой плаценте при беременности
АвторНизкая плацентация при беременности – есть ли опасность
Автор Анна Свиридова На чтение 5 мин. Просмотров 1.3k. Опубликовано
Просмотров 1.3k. Опубликовано
Низкая плацентация при беременности возникает при локализации плаценты в нижней части матки. Опасность патологии – в развитии осложнений как в течение всего периода вынашивания, так и при родах.
Что это такое
Плацента – специальный орган в организме женщины, формирование которого происходит при беременности. Ее назначение – защита плода от внешних вредных воздействий, снабжение его питательными веществами и кислородом, выведение токсинов.
Формирование органа в норме происходит на 10–12 неделе гестации. Ее окончательное созревание приходится примерно на 16-ую неделю. Но на этом ее рост не прекращается, а продолжается вплоть до 36 недели.
Около 15% женщин в положении сталкивается с такой патологией, как низкая плацентация при беременности, то есть расположение органа ниже, чем нужно. К дате родов детское место может переместиться выше, что будет вариантом нормы. Если же смещение пойдет к внутреннему маточному зеву – примерно в 5 см от него или частично закроет просвет, то это уже предлежание плаценты.
Если же смещение пойдет к внутреннему маточному зеву – примерно в 5 см от него или частично закроет просвет, то это уже предлежание плаценты.
Возможные причины патологии:
- физиологические особенности матки – загиб, врожденные пороки;
- повреждение стенок матки механически ранее – выскабливание, искусственное прерывание беременности;
- воспалительные заболевания – сальпингит, эндометрит;
- гормональные сбои, вызывающие нарушение менструального цикла;
- возраст женщины более 35 лет;
- тяжелая физическая нагрузка в первые месяцы гестации.
Чем опасна низкая плацентация при беременности
Место прикрепления органа определяют еще на ранних сроках с помощью УЗИ. Если диагностировано его низкое крепление и к сроку 24–26 оно не сместилась выше, есть риск развития осложнений у женщины и плода.
Наибольшая опасность возникает во 2 триместре, когда эмбрион увеличивается в размерах и давит на плаценту. Вследствие этого она может опустить ниже и перекрыть цервикальный канал.
Что это значит и к чему приводит:
- сильные кровотечения у женщины – вызывают железодефицитную анемию;
- ухудшение кровоснабжения – опасно гипоксией и вызывает задержку развития плода;
- отслойка – нарушает кровоснабжение ребенка;
- недостаточно места для плода – вызывает неправильное предлежание;
- затруднение естественных родов – низкая плацента не дает пройти головке ребенка в малый таз или перекрывает родовые пути при схватках;
- при показании кесарева сечения низкая плацента по передней стенке осложняет операцию и вызывает сильное кровотечение.
Какие симптомы
Если детское место расположено не около маточного зева, то патология не имеет никакой симптоматики. Патологию диагностируют на 12–13 неделе гестации путем проведения ультразвуковой диагностики.
Чем ниже находится плацента, тем сильнее проявляются симптомы:
- кровянистые выделения из влагалища после физической активности, нагрузки;
- тянущие боли внизу живота;
- болевые ощущения в области поясницы.

У некоторых женщин при низком расположении органа проявляются такие признаки:
- снижение давления;
- головокружение, головные боли;
- отеки;
- тошнота, рвота.
Чем раньше определена патология, тем меньше грозят опасные последствия. Поэтому так важно регулярно ходить на прием к гинекологу.
Диагноз на ранних сроках ставят примерно 80% беременных, но к 30 неделе у большинства из тех, у кого была низкая плацентация, орган перемещается выше.
Как влияет на беременность
Норма – это крепление плаценты ко дну матки (наверху). Часто орган прикреплен по задней стенке матке, у некоторых – по передней.
При низком расположении детского места (меньше 6 см от края маточного зева), есть риск осложнений. После 24–27 недель начинают движения плода, а после 31 недели гестации – они более активные. Ребенок способен повредить плаценту или пуповину.
Другое осложнение – нарушение кровоснабжения, в результате чего плоду недостаточно кислорода.
Какие есть запреты
Наличие патологии накладывает определенные обязанности на женщину. Чтобы не навредить себе и будущему ребенку, важно строго соблюдать все назначения доктора.
При диагностированной патологии нельзя:
- перегружать себя физически, поднимать тяжести;
- делать резкие движения;
- подвергать себя стрессам и переутомлениям.
Рекомендации: Секс при низкой плацентации противопоказан при наличии таких симптомов, как кровотечение, боли, а также при угрозе прерывания беременности.
Нужно ли лечить
Заболевание не лечится с помощью лекарств, поднять детское место медикаментами не получится. В большинстве случаев плацента постепенно при росте матки занимает правильную позицию и диагноз снимают.
Что делать женщине? В течение всего срока вынашивания ребенка важно соблюдать рекомендации врача, периодически проходить ультразвуковое исследование.
При сильном развитии патологии, начиная с 28 недели гестации, женщине прописывают препараты:
- Актиферрин, Гемофер – для повышения уровня гемоглобина.
- Гинипрал, Папаверин – для снижения тонуса матки, снятия спазмов, улучшения эластичности маточных стенок.
- Фолиевая кислота, Магне В6, Курантил – для улучшения питания плаценты, кровообращения.
- Утрожестан – для повышения уровня прогестерона при необходимости.
Если в третьем триместре у беременной возникают обильные кровотечения или есть вероятность развития гипоксии плода, женщину госпитализируют и оставляют в стационаре под врачебным контролем до родов.
На видео о низком прикреплении
Как рожать
Если в период вынашивания ребенка женщина регулярно обследовалась, то можно рассчитывать на благополучное естественное разрешение.
Течение родов зависит от таких факторов:
- место расположения детского места;
- наличие или отсутствие осложнений во время вынашивания;
- сопутствующие патологии.
Если плацента не закрывает маточный зев, при родах прокалывают околоплодный пузырь. При прохождении по родовым путям плод прижимает головкой орган к стеке матке, что предупреждает его отслойку.
При ягодичном предлежании ребенка показано кесарево сечение.
Рекомендуем прочитать статью о миоме матки при беременности. Из нее вы узнаете об особенностях вынашивания ребенка при диагностированной опухоли, возможных осложнениях, тактике ведения беременности, как проходят роды.
Зачем назначают Утрожестан при беременности? Читайте здесь.
Рекомендации
Если диагностирована низкая плацентация при беременности, необходимы такие меры профилактики:
- Правильное питание будущей мамы. В рационе должны присутствовать все необходимые витамины и минералы.
 Полезны продукты с высоким содержанием железа, кальция, магния.
Полезны продукты с высоким содержанием железа, кальция, магния. - Регулярные прогулки на свежем воздухе. Это улучшает кровоснабжение и поступление кислорода к ребенку.
- При отдыхе необходимо под ноги подкладывать подушку. Это улучшит кровоток и питание органа, что способствует его постепенному смещению выше.
Важно стараться избегать стрессов и волнения. Полезна специальная гимнастика для беременных. Но необходимы легкие упражнения, резкие движения запрещены. Предварительно необходимо проконсультироваться с доктором.
В чем особенности родов при низкой плацентации
Низкое расположение питательной оболочки под названием плацента иногда встречается в акушерской практике. Как правило, низкую плацентацию отмечают у женщин на ранних сроках развития беременности. Со временем она поднимается и занимает нормальное положение. Однако иногда этого не происходит, и плацента находится в низком расположении до родов.
Что это за явление низкая плацентация и какие опасности оно в себе таит? Эти вопросы беспокоят будущих мамочек с подобной записью в обменной карте.
Роды при низкой плацентации. Кто в группе риска
Низкая плацентация подразумевает прикрепление оплодотворенной яйцеклетки в нижней области матки.
Причинами такого прикрепления являются:
- Патологические особенности строения матки и других половых органов женщины;
- Воспалительные процессы;
- Операции;
- Возраст больше 35 лет;
- Аборты;
- Повышенные физические нагрузки в начале развития беременности.
Таким образом, в группе риска неправильного расположения находятся те женщины, у которых в прошлом было вмешательство в полость матки.
При этом значительно травмируется питательный слой – эндометрий.
При наступлении беременности эмбриону просто невозможно прикрепится в более правильных участках матки.
Также сюда можно отнести женщин с такими заболеваниями:
- Эрозия шейки матки;
- Кольпит или молочница;
- Дисфункция яичников;
- Застойные состояния в малом тазу.

При постановке на учет в женской консультации необходимо сразу сообщить врачу о данных явлениях в состоянии здоровья.
Это даст возможность своевременно диагностировать возможные осложнения и более внимательно контролировать течение беременности.
Диагностика низкой плацентации
Симптоматика данного осложнения включает в себя следующие проявления:
- Болезненные ощущения;
- Кровяные выделения.
На ранних сроках развития беременности определить самостоятельно по ощущениям низкое прикрепление плода практически невозможно.
Выделения и боль возникают при низкой плацентации значительно позже.
Обычно данное состояние определяется на контрольном ультразвуковом исследовании в 12 недель. На этом сроке врач не станет акцентировать внимание женщины на этом состоянии.
Если к 20 неделям плацента не поднимается тогда стоит говорить о диагнозе « низкое расположение плаценты».
Окончательный диагноз устанавливает врач после того, как будет осуществлена процедура пальпация плаценты. Другие способы обследования опасны для матери и ребенка.
Другие способы обследования опасны для матери и ребенка.
Однако до наступления родов возможность нормализации положения плаценты существует. Поэтому важно проводить регулярный контроль данного состояния.
Насколько опасны естественные роды при низкой плацентации
Постановка диагноза «низкое прикрепление плаценты» вызывает справедливый вопрос у женщин «Чем оно опасно?».
Данное состояние может стать причиной следующих осложнений:
- Самопроизвольное прерывание беременности;
- Недостаток кислорода у ребенка;
- Недостаток питания для ребенка;
- Риск возникновения внутренних кровотечений;
- Обвитие пуповиной.
Родить самостоятельно при этом осложнении возможно, если в ходе обследований не выявлены сопутствующие патологические состояния.
Процесс родоразрешения проходит под постоянным контролем врачей и в случае неправильного течения процесса проводят операцию экстренного кесарева сечения.
Низкая плацентация при беременности: причины, симптомы, диагностика, лечение
Активное лечение такой патологии может применяться в случае, если симптомы выражены или есть данные о кровотечении. Затем используйте медикаментозные препараты, которые направлены на остановку кровотечения, улучшение маточно-плацентарного кровообращения и сохранение беременности. Женщинам с таким диагнозом обязательно нужен щадящий режим, необходимо избегать нагрузок и длительных прогулок.
Затем используйте медикаментозные препараты, которые направлены на остановку кровотечения, улучшение маточно-плацентарного кровообращения и сохранение беременности. Женщинам с таким диагнозом обязательно нужен щадящий режим, необходимо избегать нагрузок и длительных прогулок.
Иногда низкая плацентация в более поздние сроки может вызвать отслойку плаценты, затем может повыситься тонус матки, что требует приема токолитических препаратов в остром периоде.Далее при нормальном состоянии женщинам назначают препараты, улучшающие реологические свойства крови и нормализующие маточное кровообращение. Но следует учитывать, что подобная активная тактика может применяться только при тяжелых симптомах, если клинически низкая плацента не очевидна, то никакого внешнего вмешательства не требуется.
Ипрадол — препарат из группы селективных симпатомиметиков, который действует путем связывания с рецепторами матки и приводит к расслаблению мышечных волокон.Поэтому препарат применяют при низкой плацентации, которая осложняется угрозой выкидыша и сопровождается повышением тонуса матки и ритмичными сокращениями. Способ применения препарата — внутривенный, что позволяет быстро добиться эффекта. Дозировка — 10 мкг препарата нужно вводить медленно, а затем перейти на инфузию. Побочные эффекты — учащенное сердцебиение, нарушение сердечного ритма, головная боль, повышение температуры тела, повышение давления, тремор, диарея. Меры предосторожности — лекарство нельзя применять при беременности до 22 недель.
Способ применения препарата — внутривенный, что позволяет быстро добиться эффекта. Дозировка — 10 мкг препарата нужно вводить медленно, а затем перейти на инфузию. Побочные эффекты — учащенное сердцебиение, нарушение сердечного ритма, головная боль, повышение температуры тела, повышение давления, тремор, диарея. Меры предосторожности — лекарство нельзя применять при беременности до 22 недель.
На фоне активной токолитической терапии возможно проведение параллельной гемостатической терапии при выраженном кровотечении.
Транексамовая кислота — это средство для системного гемостаза, которое действует путем ингибирования фибринолиза и широко используется в гинекологии. Препарат можно применять для лечения осложнений при низкой плацентации, в том числе при образовании ретроколокатной гематомы. Способ применения препарата внутривенно капельно. Дозировка 100 миллилитров раствора в течение первого часа, а затем под контролем состояния и анализа крови.Побочные действия транексамовой кислоты — нарушение сердечного ритма, головная боль, шум в ушах, тромбоз, заложенность носа, головокружение, судороги.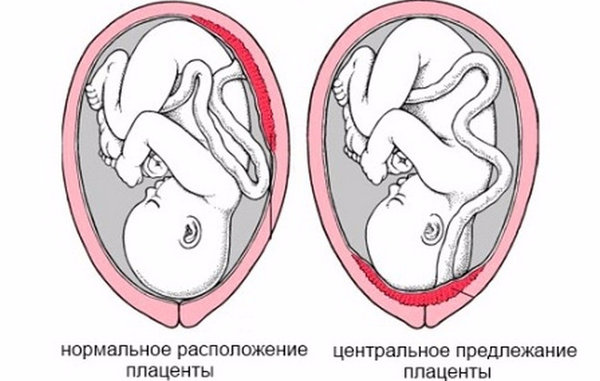 Меры предосторожности — при наличии крови в моче применять препарат с осторожностью, так как это может вызвать дальнейшую анурию.
Меры предосторожности — при наличии крови в моче применять препарат с осторожностью, так как это может вызвать дальнейшую анурию.
Если у женщины с низкой плацентацией было небольшое кровотечение, но не нарушился тонус матки и состояние ребенка, то может образоваться небольшая гематома, которая со временем рассосется. Но он может быть источником заражения, поскольку кровь — хорошая питательная среда для патогенных микроорганизмов.Поэтому после такого большинства склонен к обязательному приему антибактериального средства, не опасного для плода. Это не только предотвращает заражение, но и влияет на микроорганизмы, которые могут размножаться в этот период болезни. Группа антибиотиков цефалоспоринового ряда считается наиболее приемлемой для применения беременными.
Цефтибутен — бета-лактамный антибиотик третьего поколения, особенно эффективен при действии на грамположительную и грамотрицательную флору.Препарат оказывает бактерицидное действие на возможных анаэробных возбудителей инфекции, поэтому его можно использовать в профилактических целях в гинекологии. Дозировка препарата — 200 миллиграммов два раза в сутки, с учетом профилактического приема не менее пяти дней. Возможны побочные эффекты при воздействии на желудок — развивается колит или дисбактериоз, проявляющийся вздутием живота, нарушением стула. Меры предосторожности — нельзя применять препарат при аллергии на антибиотики-пенициллины, а также при врожденных ферментопатиях.
Дозировка препарата — 200 миллиграммов два раза в сутки, с учетом профилактического приема не менее пяти дней. Возможны побочные эффекты при воздействии на желудок — развивается колит или дисбактериоз, проявляющийся вздутием живота, нарушением стула. Меры предосторожности — нельзя применять препарат при аллергии на антибиотики-пенициллины, а также при врожденных ферментопатиях.
Применение витаминов в терапии низкой плацентации очень важно, так как часто наблюдается нарушение кровотока в пуповине и плаценте. Поэтому употребление витаминов, содержащих в своем составе магний и аскорбиновую кислоту, способствует улучшению кровообращения в матке и плаценте, что снижает влияние недостатка кислорода на мозг ребенка.
Актовегин — препарат, который чаще всего применяется для профилактики и лечения маточно-плацентарной недостаточности.Этот препарат является производным различных аминокислот, которые в тканях человека нормализуют клеточное дыхание и улучшают поглощение кислорода. Препарат применяют в ампулах. Для приема и комплексного лечения аномалий плаценты рекомендуется дозировка 10 миллилитров в сутки. Способ применения внутримышечно. Побочные действия могут проявляться в виде выраженных аллергических реакций на чужеродный белок. Меры предосторожности — препарат для инъекций можно растворять только в физиологическом растворе или глюкозе, с другими растворителями препарат не применяется.Перед применением лекарства необходимо провести пробу на чувствительность, так как он аллергенен.
Препарат применяют в ампулах. Для приема и комплексного лечения аномалий плаценты рекомендуется дозировка 10 миллилитров в сутки. Способ применения внутримышечно. Побочные действия могут проявляться в виде выраженных аллергических реакций на чужеродный белок. Меры предосторожности — препарат для инъекций можно растворять только в физиологическом растворе или глюкозе, с другими растворителями препарат не применяется.Перед применением лекарства необходимо провести пробу на чувствительность, так как он аллергенен.
Применение других препаратов может быть только симптоматическим. Этиологической терапии низкой плаценты нет, так как средства не могут влиять на само расположение плаценты.
Физиотерапевтическое лечение при беременности тоже не рекомендуется, так как сложно предсказать реакцию ребенка и плаценты на такое вмешательство. Поэтому в остром периоде тепловые и лучевые процедуры не используются.
Альтернативное лечение низкой плацентации
Альтернативные методы лечения низкой плаценты могут использоваться очень широко. Такие методы можно использовать даже при отсутствии проявлений диагноза для профилактики осложнений. Для этого можно использовать травы и настои, улучшающие маточно-плацентарное кровообращение, ведь часто ребенку может не хватать питательных веществ. Во избежание отслойки и угрозы преждевременных родов используйте средства, снижающие тонус и симпатическую активность.Поэтому пить настои лечебных трав и лечиться народными средствами можно на протяжении всей беременности вплоть до родов.
Такие методы можно использовать даже при отсутствии проявлений диагноза для профилактики осложнений. Для этого можно использовать травы и настои, улучшающие маточно-плацентарное кровообращение, ведь часто ребенку может не хватать питательных веществ. Во избежание отслойки и угрозы преждевременных родов используйте средства, снижающие тонус и симпатическую активность.Поэтому пить настои лечебных трав и лечиться народными средствами можно на протяжении всей беременности вплоть до родов.
- Сок из моркови, яблок и свеклы очень полезен при низкой плацентации для нормализации структуры сосудистых стенок и улучшения кровообращения, если конечно нет аллергии. Для приготовления сока нужно отжать пол-литра яблочного сока, добавить один стакан сока тертой моркови и стакан свекольного сока, все тщательно перемешать и перед употреблением добавить мед.Дозировка — по половине стакана сока принимают утром и вечером. №
- Чай из имбиря, лимонного сока и веточек малины очень полезен для улучшения трофикы матки и предотвращения инфекционных осложнений.
 Он хорошо тонизирует организм беременной, оказывает успокаивающее действие и бодрит по утрам. Его можно принимать около двух литров в день, если, конечно, нет отеков и гипертонии. Для этого нужно сварить чай из веточек малины, кипятя их несколько минут, а затем налить чай в чашку и добавить десять граммов имбиря и четверть лимонного сока.Пить этот чай вместо простой воды нужно несколько раз в день, затем можно немного полежать, закинув ноги на холм, чтобы улучшить приток крови к матке.
Он хорошо тонизирует организм беременной, оказывает успокаивающее действие и бодрит по утрам. Его можно принимать около двух литров в день, если, конечно, нет отеков и гипертонии. Для этого нужно сварить чай из веточек малины, кипятя их несколько минут, а затем налить чай в чашку и добавить десять граммов имбиря и четверть лимонного сока.Пить этот чай вместо простой воды нужно несколько раз в день, затем можно немного полежать, закинув ноги на холм, чтобы улучшить приток крови к матке. - Для профилактики восходящей инфекции очень хорошо использовать для умывания травяной раствор. Для этого нужно взять кору дуба и траву, чередовать, отпаривать, а теплую траву мыть каждый день. №
Лечение травами используется очень часто, так как многие травы хорошо влияют на тонус матки, местное кровообращение и плод, а также обладают системным действием, успокаивая организм.
- Зверобой — растение, нормализующее тонус сосудов плаценты и улучшающее кровообращение в матке, регулирующее нервную проводимость.
 Для приготовления лечебного чая нужно взять 50 грамм зверобоя, его нужно варить на медленном огне пять-десять минут, а затем профильтровать. Пить этот чай нужно трижды в день по чайной ложке, можно до тридцать седьмой недели.
Для приготовления лечебного чая нужно взять 50 грамм зверобоя, его нужно варить на медленном огне пять-десять минут, а затем профильтровать. Пить этот чай нужно трижды в день по чайной ложке, можно до тридцать седьмой недели. - Особенно эффективен при профилактике осложнений низкой плацентации и появления отслоений настоя из крапивы двудомной.Для приготовления лечебного чая нужно взять десять граммов травы, залить водой в количестве полулитра, а затем, после того, как она потеет двадцать минут, процедить и выпить. Дозировка — около литра чая нужно выпивать в день, контролируя другую жидкость при наличии отеков.
- Настойка календулы — отличное токолитическое средство, а также обладает свойствами уменьшать активность кровотечения при наличии ретроколарической гематомы. Для приготовления лечебного чая нужно взять цветки и плоды календулы, залить водой в объеме полулитра, а затем, после того, как она приобретет оттенок в течение двадцати минут, процедить и выпить.В остром периоде можно выпивать до полулитра настойки в день, а затем можно пить профилактическую дозу столовой ложки дважды в день.

- Нужно взять по 100 грамм сухой травы одуванчика и подорожника, заварить чай из литра воды и пить по столовой ложке трижды в день. Курс лечения — четыре недели. Это отличное средство для нормализации трофики плода, так как расширяет кровеносные сосуды и активирует поступление кислорода и питательных веществ к плоду.
Гомеопатия используется для лечения низкой плацентации так же широко, как и альтернативные методы лечения.И главное достоинство таких методов — возможность их длительного приема.
- Арника — гомеопатическое средство, в состав которого входят растительные препараты, которые более эффективны у пациентов с низкой плацентацией, которая проявляется кровотечением после механического удара. Способ применения препарата — по одной капле каждые два часа в первые и вторые сутки после появления симптомов, а затем по одной капле трижды в сутки, под контролем сердцебиения — при возникновении тахикардии дозу можно уменьшено.Побочных эффектов не было.
 Меры предосторожности — не принимать, если у вас аллергия на пыльцу липы.
Меры предосторожности — не принимать, если у вас аллергия на пыльцу липы. - Цинкум валерианикум — неорганический гомеопатический препарат. Используется для лечения низкой плацентации, которая сопровождается тянущими болями внизу живота. Прием этого лекарства может предотвратить отслоение, если лечение начинается до появления каких-либо симптомов при первоначальном диагнозе. Способ применения препарата зависит от формы. Дозировка при приеме капель — одна капля на десять килограммов массы тела, а при приеме капсул — две капсулы трижды в день.Возможны побочные эффекты в виде гиперемии кожи рук и ног, а также ощущения жара. Меры предосторожности — не применять одновременно со спазмолитиками.
- Gamamellis — агент номер один с низким уровнем плаценты или предлежанием плаценты. Это гомеопатический препарат, улучшающий кровообращение в плаценте и укрепляющий связь в этом месте, что предотвращает отшелушивание. Выпускается в форме капель и применяется в дозировке восемь капель за раз. Способ применения — раствор закапать в 100 миллилитров кипяченой воды и выпить за полчаса до еды.Курс лечения можно начинать с приема трех капель дважды в день, а затем, через месяц, можно увеличить дозу до пяти капель по мере увеличения срока беременности. Побочные действия возникают редко, возможны кожные аллергические реакции.
- Hydra-stice — гомеопатическое средство на основе растения желтого корня, которое очень эффективно сохраняет беременность благодаря своему действию, подобному природному гормону прогестерону. Препарат нормализует кровообращение, что даже при низкой плаценте улучшает трофику плаценты.Препарат особенно эффективен на поздних сроках беременности двойней или анемии у матери. Препарат выпускается в гранулах и дозируется по шесть гранул каждые шесть часов. Не рекомендуется принимать препарат до беременности. №
Оперативное лечение низкой плаценты не применяется, так как изменить естественное место прикрепления плаценты невозможно даже любыми физическими упражнениями. Что касается оперативного вмешательства при низкой плацентации, следует сказать о периоде родов.Часто низкая плацента при активных родах может дать небольшую отслойку. Затем врач при пальпации определяет весь плодовый пузырь, требующий вмешательства. При проведении амниотомии плод опускается ниже по родовым путям и даже при небольшой отслойке возникает сдавливание — это может остановить кровотечение и образование гематомы. Таким образом, проводится вмешательство — амниотомия, которую можно рассматривать как инвазивное вмешательство с низкой плацентацией. В последующий период низкая плацента может дать осложнения по задержке плодных оболочек, затем также требуется хирургическое вмешательство в виде ручного отделения плаценты.
Остальные случаи низкой плацентации активного хирургического лечения не требуют.
[49], [50], [51], [52], [53]
Взаимосвязь между материнским иммунологическим ответом во время беременности и началом преэклампсии
Материнская иммунная толерантность необходима для поддержания беременности. Иммунологическая толерантность матери к полуаллогенному плоду становится выше при донорской беременности от неродственных доноров, поскольку полный геном плода является аллогенным для матери.Вместо отторжения, аллогенный плод переносится беременной женщиной при беременности с донорской яйцеклеткой. Сообщалось, что материнская заболеваемость во время беременности с донорством яйцеклеток выше по сравнению со спонтанной беременностью или оплодотворением in vitro. В частности, беременность с донорством яйцеклеток связана с более высокой частотой индуцированной беременностью гипертонии и патологии плаценты. Преэклампсия, специфическое для беременности заболевание, характеризующееся развитием как гипертонии, так и протеинурии, остается ведущей причиной материнской и перинатальной смертности и заболеваемости.Цель этого обзора — охарактеризовать и связать феномен материнско-фетальной иммунологической толерантности во время беременности с полуаллогенным плодом, то есть спонтанно зачатых беременностей и беременностей с оплодотворением in vitro, беременностей с оплодотворением, а также беременностей с аллогенным плодом или беременностью с донорством яйцеклеток. Также оценивалась материнская иммунная толерантность при неосложненных беременностях и патологических беременностях, например, при преэклампсии. Кроме того, был рассмотрен вопрос о том, может ли неадекватный иммунологический ответ матери на аллогенный плод привести к более высокой распространенности преэклампсии при беременности с донорством яйцеклеток.
1. Введение
Иммунологический ответ матери во время беременности важен для поддержания этого состояния. Это подразумевает толерантность к полуаллогенному плоду, который обладает наполовину материнскими генами и наполовину отцовскими генами. Чем более генетически отличным является плод, тем выше иммунологическая толерантность во время беременности. Это происходит во время беременности путем донорства яйцеклеток (ED), когда плод аллогенный. Такая толерантность также влияет на модуляцию патологий, связанных с беременностью, включая преэклампсию [1].Поскольку преэклампсия осложняет до 8% беременностей, она является основной причиной материнской и перинатальной смертности и заболеваемости. Неблагоприятные перинатальные исходы, такие как недоношенность и ограничение внутриутробного развития, связаны с этим состоянием. Преэклампсия — это специфическое для беременности заболевание, характеризующееся развитием как гипертонии, так и протеинурии. Иногда болезнь прогрессирует в мультиорганный кластер с различными клиническими признаками. К предрасполагающим расстройствам относятся хроническая гипертензия, диабет и ожирение.Более того, афроамериканские и филиппинские женщины и низкий социально-экономический статус связаны с повышенным риском. Хотя точная этиология заболевания все еще неизвестна, недостаточная ранняя плацентация особенно связана с преэклампсией с ранним началом [2]. Фактически, аномальная плацентация считается иммунологически опосредованной [2, 3]. Поскольку профилактика и прогноз преэклампсии по-прежнему невозможны, симптоматическое клиническое ведение должно быть сосредоточено на предупреждении материнской заболеваемости (например,, генерализованные припадки эклампсии) и смертность [2].
С эпидемиологической точки зрения существует более высокая частота гипертонии, вызванной беременностью, у беременных из-за ЭД, которая колеблется от 16% до 40% всех случаев [4]. По сравнению с беременностью путем аутологичного оплодотворения in vitro (ЭКО) распространенность гипертензивных осложнений составляет 26–37% по сравнению с 8%, с отношением шансов (OR) 7,1 для группы ED [4]. Более того, частота гипертонии, вызванной беременностью, выше у беременных с ЭД, которые не связаны с донором и ранее не контактировали со спермой донора [3–5].
Целью этого обзора является анализ феномена материнско-плодовой иммунологической толерантности и его возможной связи с началом преэклампсии, поскольку это могло бы оправдать более высокую распространенность этой патологии у беременных с ЭД в результате неадекватной иммунологической реакции матери на аллогенный плод.
2. Иммунология матери и плода
Множество механизмов плода, матери и плаценты защищают плод от иммунной системы матери. Ткань плода, проникающая в материнскую территорию, характеризуется низкой иммуногенностью.Трофобласт практически не экспрессирует молекулы основного комплекса гистосовместимости (MHC) или антигена лейкоцитов человека (HLA), которые вносят вклад в изменчивость в пределах одного вида. Этот и другие иммунорегуляторные механизмы направлены на предотвращение отторжения фетальных клеток по их прибытии [6, 7].
Еще до имплантации материнская рецептивность хозяина отражается в матке. Слабая цитотоксическая активность по отношению к чужеродным агентам и выдающаяся способность сегрегировать цитокины естественных киллеров матки (uNK) в материнско-фетальной интерфазе вмешиваются в обширное гемодинамическое ремоделирование, которому подвергается беременная матка [6, 7].Системный материнский ответ готовится еще до того, как зигота достигает матки, который основан на экспрессии цитокинового профиля, характерного для Т-хелперных лимфоцитов (Th) типа 2 (Th3) [6, 7].
2.1. Имплантация и иммунологический ответ матери на материнско-плодовой поверхности
Во время плацентации человека в матке беременной происходят три основных изменения. Во-первых, эндометрий дифференцируется в плотный клеточный матрикс, известный как децидуальная оболочка. Во-вторых, децидуальная оболочка и нижележащий миометрий поражены трофобластическими клетками плода.В-третьих, подтип этих клеток, вневорсинчатый цитотрофобласт плода (EVT), проникает в материнские сосуды, изменяя и замещая эндотелий и часть мышечного слоя. Таким образом, материнские маточные артерии трансформируются в широкие сосуды с низким сопротивлением за счет разрушения их мышечного слоя, что приводит к усилению материнского кровотока к плаценте [8, 9].
Инвазивный характер гемохориальной плацентации предполагает прямой контакт между клетками матери и плода. Плацентарные ворсинки, состоящие из цитотрофобласта и покрытые синцитиотрофобластом, погружены в циркулирующую материнскую кровь, которая вступает в контакт с составляющими ее иммунными клетками.Точные механизмы, участвующие в материнской иммунологической толерантности, которые делают возможной полуаллогенную или аллогенную беременность при ЭД [10–12], все еще неизвестны. Изменение из-за чрезмерной или недостаточной плацентации может привести к патологической беременности. Например, некоторые авторы предполагают, что хорошо известное материнское воспаление, связанное с преэклампсией, может возникать из-за высокой концентрации микрочастиц синцитиотрофобласта, циркулирующих в крови матери. Они должны чрезмерно активировать ответ материнских моноцитов через их toll-подобные рецепторы (TLR-) 1 [13–16].
Для успешного завершения имплантации децидуальная оболочка матери претерпевает иммунологические изменения. Они начинаются уже в секреторной фазе женского менструального цикла и адаптируются к иммунному ответу на стадии до зачатия. Среди клеточных компонентов выделяются иммунорегуляторные и проангиогенные функции uNK-клеток и антиген-презентаторных клеток (макрофагов и дендритных клеток (DC)) [17].
2.1.1. Естественные клетки-киллеры матки
Четыре основных популяции децидуальных лейкоцитов, присутствующих на ранних сроках беременности, — это клетки uNK, макрофаги, DC и T-клетки.Из них наиболее распространены uNK, макрофаги и Т-лимфоциты CD3 + (CD8 + и редко CD4 +). В-клетки практически не обнаруживаются [18].
NK-клетки характеризуются экспрессией поверхностных маркеров CD56 и CD16 и подразделяются на две популяции в зависимости от плотности маркера CD56 (яркий-сильный или тусклый-средний). Из NK-клеток, циркулирующих в периферической крови, 90–95% из них высоко цитотоксичны и принадлежат к фенотипу CD56 dim CD16 +. Остальные из них обладают ярким CD56 CD16- и очень эффективно секретируют цитокины.В децидуальной оболочке большинство NK-клеток обладают ярким CD16-фенотипом CD56. Таким образом, uNK-клетки фенотипически отличаются от NK-клеток периферической крови и характеризуются низкой токсичностью и хорошей способностью секретировать цитокины и ангиогенные медиаторы [19]. Их жизненный цикл ограничен. Они быстро размножаются во время поздней секреторной фазы менструального цикла и падают в количестве после половины срока беременности. Тот факт, что uNK-клетки присутствуют до имплантации и даже в децидуальной оболочке внематочной беременности, предполагает, что они индуцируются сигналами, регулируемыми стромальными эндокринными факторами, а не эмбриональной тканью [19].
uNK-клетки регулируют инвазию трофобластов за счет секреции ангиогенных факторов роста, цитокинов и хемокинов [20, 21]. Более того, способность uNK-клеток убивать полуаллогенные клетки плода или аллогенные клетки при беременностях с ЭД ограничена [21]. Тесный контакт между EVT и децидуальными лейкоцитами предполагает существование паракринных взаимодействий между материнскими лейкоцитами и клетками плода [18]. Цитокины, продуцируемые uNK-клетками на границе плод-мать человека, включают интерлейкин (IL) 8, интерферон-индуцибельный белок-10 (IP-10) и наиболее синтезируемый цитокин с помощью uNK, регулируемый при активации, нормальные Т-клетки экспрессируются и секретируются (RANTES), запускает миграцию инвазивного трофобласта.Ангиогенные факторы uNK включают фактор роста эндотелия сосудов (VEGF) и фактор роста плаценты (PlGF), а также наиболее распространенный NKG5 [21]. Подлинный интерес к роли, которую играет иммунитет в ремоделировании сосудов, выявлен в исследовании Hanna et al. [21], которые продемонстрировали in vitro и in vivo , что uNK-клетки участвуют в ремоделировании спиральной артерии матки, способствуя ангиогенезу в местах эмбриональной имплантации посредством градиента цитокинов и вазоактивных медиаторов [21, 22].Последующие данные показали, что во время ангиогенной активации гормональные факторы и гипоксическая обстановка также способны регулировать продукцию ангиогенных факторов, таких как VEGF, и их взаимодействие с эндотелиальными клетками [23].
Регулирование вторжения трофобластов. Специфическое распознавание трофобластов осуществляется клетками uNK. Эти клетки обладают рецепторами активатора или ингибитора, которые принадлежат к трем основным семействам: семейство лектинов типа C (CD94 / NKG), киллерный иммуноглобулин-подобный рецептор (KIR) и иммуноглобулин-подобные транскрипты (ILT или лейкоцитарный иммуноглобулин-подобный рецептор. ) [24].Эффекторные функции NK-клеток зависят от тонкой настройки между этими рецепторами ингибитора и активатора, и они считаются активированными, когда рецепторы KIR конститутивно экспрессируются [19].
Было продемонстрировано, что вневорсинчатые клетки трофобласта экспрессируют материнский и отцовский HLA-C. Лиганды HLA-C для материнских рецепторов KIR делятся на две группы, C1 и C2, которые определяются диморфизмом в положении 80 домена α 1. Взаимодействие между молекулами HLA трофобласта и рецепторами KIR uNK-клеток материнского эндометрия подавляет цитотоксическую активность и модулирует продукцию цитокинов и факторы роста uNK-клетками, способствуя росту трофобластов, инвазии эндометрия и ремоделированию сосудов [25].
Семейство рецепторов KIR распознает молекулы HLA трофобласта. Таким образом, рецепторы KIR2D (содержащие два иммуноглобулиноподобных домена) uNK-клеток лучше способны распознавать трофобластный HLA-C, чем KIR NK в периферической крови. В зависимости от комбинации гаплотипов KIR2D может действовать больше как активатор или больше как ингибитор [25, 26].
Геномная область KIR содержит семейство высокополиморфных и гомологичных генов, локализованных в хромосоме 19q13.4 внутри комплекса рецепторов лейкоцитов. Согласно популяционным исследованиям, порядок генов KIR вдоль хромосомы в основном определяет два разных гаплотипа: A (не имеет рецепторов активатора) и B (обладает рецепторами активатора и ингибитора) [25, 27].
Материнский генотип KIR может быть AA (ингибитор), AB или BB. Комбинация материнского генотипа KIR AA с генотипом HLAC2 () плода увеличивает риск преэклампсии [25]. Поскольку это взаимодействие дает сильный сигнал ингибитора, считается, что ингибирование, а не активация uNK-клеток, предрасполагает к преэклампсии.uNK-клетки не могут участвовать в ремоделировании маточных артерий, потому что они ингибируются. Поэтому было предложено присутствие активаторных рецепторов в клетках uNK для защиты от преэклампсии (Рисунок 1) [25].
Рисунок 1: Матернофетальный иммунный ответ при преэклампсии. При преэклампсии на границе раздела матери и плода происходит ряд событий, которые приводят к изменению экспрессии различных факторов (PIGF, sENG, sFLT1, GM-CSF и TLR-4) по сравнению с нормальными беременностями.Точно так же соотношение между различными популяциями иммунных клеток (Th27 / Treg, Th2 / Th3) отличается от нормального у пациентов с преэклампсией. Что касается системы комплемента, преэклампсия усиливает синтез MBL и C5a. Эти изменения проявляются в периферической крови, в которой провоспалительная системная среда также видна с высокими уровнями IL-6α, TNF-alpha, IL-8, IP-10, MCP-1, ICAM-1 и VCAM-1. Treg: CD4 + CD25 + Foxp3 + регуляторные Т-клетки; TLR: толл-подобный рецептор; HLA: лейкоцитарный антиген человека; клетка uNk: естественная клетка-киллер матки; KIR: киллерный иммуноглобулиноподобный рецептор; sFLT1: растворимый fms-подобный фактор тирозинкиназы-1 ; sENG: растворимый эндоглин; PIGF: фактор роста плаценты; GM-CSF: колониестимулирующий фактор гранулоцитов-макрофагов; MBL: лектин, связывающий маннозу; Th-клетка: Т-хелперная клетка; ИЛ: интерлейкин; IFNg: гамма-интерферон; TNF-альфа: фактор некроза опухоли альфа; IP-10: интерферон-индуцибельный белок-10; МСР-1: хемотаксический белок моноцитов-1; ICAM-1: молекула межклеточной адгезии 1; VCAM-1: белок адгезии сосудистых клеток 1; Th27: субпопуляция эффекторных клеток TCD4 +, клетки Thelper 17.
Следовательно, функциональность uNK-клеток во время беременности зависит от комбинации двух полиморфных генов. Это материнский генотип для KIR (AA, AB или BB) и гаплотипы HLA-C плода [C1 () или C2] [24]. Во время беременности частота материнского генотипа KIR AA увеличивается с патологиями, связанными с дефектной плацентацией (преэклампсия, задержка внутриутробного развития и повторяющиеся самопроизвольные аборты), но только тогда, когда плод имеет больше генов C2, чем мать (например, материнский C1 / C1 с C1 / C2 у плода и C1 / C2 у матери с C2 / C2 плода) или когда единственный C2, который есть у плода, имеет отцовское происхождение.Следовательно, постулируется вредный эффект отцовского аллогенного C2 и роль этих пар рецептор / лиганд на ранних стадиях беременности в патогенезе репродуктивной недостаточности [28]. Известно, что теломерная B-область гаплотипа KIRB защищает от этих изменений во время беременности, особенно когда плод обладает геном C2 [27]. В общих чертах, разные человеческие популяции представляют собой обратную связь между частотой AA и частотой HLA-C2, что предполагает отбор против этой комбинации [25].
При нормальной беременности распознавание HLA-C плода рецептором KIR-BB uNK запускает высвобождение цитокинов клетками uNK. К ним относятся трансформирующий фактор роста-бета (TGF- β ), участие которого в иммунорегуляции и ангиогенезе хорошо известно, а также ангиогенные факторы, фактор роста плаценты (PIGF) и фактор роста эндотелия сосудов (VEGF). Напротив, при преэклампсии, когда KIR-AA материнских uNK-клеток распознает HLA-C вневорсинчатого трофобласта, uNK-клетки демонстрируют более низкую экспрессию этих медиаторов [3], а также сверхэкспрессию антиангиогенных факторов, таких как растворимый эндоглин (sENG) и растворимый fms-подобный тирозиновый (sFLT1) фактор киназы-1.sENG ингибирует связывание TGF- β 1 с поверхностью его рецепторов и снижает эндотелиальную передачу сигналов, опосредованную оксидом азота. sFLT1 связывается с ангиогенными белками VEGF и PIGF и блокирует их действие [29]. Интересно, что значительно более низкие уровни PIGF, но с более высокими концентрациями sFLT1 и sENG были продемонстрированы до 30 недели гестации в сыворотке или плазме беременных женщин, у которых развилась преэклампсия, по сравнению с беременными женщинами, у которых это заболевание не развилось.Следовательно, их можно использовать в качестве маркеров-предикторов преэклампсии [30].
Сывороточные уровни гранулизина, цитотоксического гранулярного белка NK-клеток и цитотоксических Т-лимфоцитов, значительно выше у пациентов с преэклампсией по сравнению с женщинами с нормальной беременностью [31, 32]. Действительно, доля цитотоксических Т-клеток, продуцирующих гранулизин, заметно увеличивается в периферической крови пациентов с преэклампсией по сравнению со здоровыми беременными женщинами [33]. У женщин с преэклампсией не наблюдается значительных различий в сывороточных уровнях RANTES, цитокина, продуцируемого uNK-клетками на границе плод-мать человека, по сравнению со здоровыми беременными женщинами [34].Тем не менее, было обнаружено, что экспрессия плацентарного гена RANTES повышается при тяжелой преэклампсии с ранним началом с 25 по 27 недели гестации по сравнению с образцами плаценты при неосложненных беременностях на аналогичных неделях [3]. Необходимы дальнейшие исследования для выяснения точного вклада RANTES в индукцию толерогенного материнского иммунного ответа, обеспечивающего выживание, миграцию и инвазию трофобластов. Эти исследования позволят лучше понять его роль в осложнениях беременности, таких как повторяющиеся самопроизвольные аборты или преэклампсия.
2.1.2. Клетки-антиген-презентаторы: дендритные клетки и макрофаги
Дендритные клетки. Несколько направлений исследований продемонстрировали ключевую роль, которую играют антиген-презентаторные клетки (APC) в материнско-фетальной интерфазе во время беременности [20].
DC, которые являются наиболее мощными APC, необходимы для инициации и модуляции иммунных ответов и индукции иммунологической толерантности [35–37]. У людей плотность незрелых ДК эндометрия (CD1a +) значительно выше, чем у зрелых ДК (CD83 +) на протяжении всего менструального цикла.Действительно, общее количество CD1a + DC в базальном слое эндометрия намного больше, чем в функциональном слое во время секреторной фазы. CD1a, высокоспецифичный и чувствительный маркер незрелых DC, опосредует HLA-независимый путь презентации антигена [37]. В течение первого триместра беременности большинство ДК экспрессируют DC-специфический рецептор адгезии DC-SIGN (специфичный для дендритных клеток неинтегрин, захватывающий ICAM, классифицируемый как CD209). DC-SIGN экспрессируется незрелыми DC в периферической ткани [38].Фактически, экспрессия DC-SIGN на границе раздела мать-плод у макака-резус описывается как ранний ответ материнской иммунной системы приматов на имплантируемый эмбрион [39]. ДК матки направляют материнскую восприимчивость, регулируя ремоделирование децидуальной ткани и ангиогенез у мышей. В самом деле, маточные DCs играют ключевую роль в имплантации эмбриона, когда они обнаруживают незрелый фенотип [40].
Во время внутриутробной и внематочной беременности преобладает незрелый статус DC, что связано с взаимодействием с uNK.Статус зрелого DC был связан с неудачей имплантации [17, 38, 41], тогда как большинство децидуальных незрелых DC-SIGN + DCs находятся в тесном контакте с uNK; Зрелые ДК CD83 + относятся к CD3 + Т-клеткам [38]. Что касается адаптивного ответа, то DC участвуют в индукции толерантности, поскольку они имеют решающее значение для дифференцировки индуцированных агонистами Т-регуляторных клеток (Treg) [42].
Гемоксигеназа-1 (HO-1) — это микросомальный фермент с противовоспалительными, антиапоптотическими и антипролиферативными свойствами.Это позволяет принимать аллотрансплантаты у мышей, а его подавление влечет за собой острое отторжение. Его высокая экспрессия клетками трофобласта на ранних стадиях беременности хорошо известна. Снижение HO-1 связано с осложнениями беременности у мышей, такими как аборт [43]. При беременностях мышей HO-1 играет ключевую роль в поддержании материнских DC в незрелом состоянии. Толерогенные незрелые ДК способствуют размножению периферических Treg-клеток. Блокирование HO-1 приводит к тому, что DC становятся зрелыми, что способствует действию эффекторных Т-клеток [43].Действительно, и HO-1, и его метаболит монооксид углерода способствуют имплантации и плацентации [44, 45]. Блокировка HO-1 приводит к повышению артериального давления у беременных крыс [46]. Расстройства беременности, такие как преэклампсия и задержка внутриутробного развития, связаны с уменьшением HO-1 и нарушением ремоделирования спиральных артерий матери [44]. Интересно, что окись углерода индуцирует пролиферацию клеток uNK и ремоделирование спиральных артерий у беременных мышей с гипертензией, мутантной HO-1 [44].Соответственно, в клинической модели ограничения внутриутробного развития на мышах окись углерода предотвращала гибель плода за счет снижения уровней свободного гема в кровотоке [45].
Макрофаги. ДК и макрофаги, присутствующие в эндометрии человека, играют роль в децидуализации и имплантации [47]. Макрофаги также способствуют местной иммунной толерантности [47–49]. После uNK макрофаги являются второй по численности популяцией в материнско-фетальной интерфазе как при имплантации, так и при раннем развитии беременности [48, 49].Макрофаги собираются вокруг спиральных артерий, в то время как плацента развивается и поддерживает ремоделирование сосудов, высвобождая проангиогенные факторы, такие как VEGF и MMP, и удаляя апоптотические клетки [50]. Они также генерируют широкий спектр цитокинов, главным образом для их функции как APC, и они, в частности, продуцируют высокие уровни IL-10, хорошо известного противовоспалительного медиатора [48]. Децидуальные макрофаги являются потенциальными регуляторами активации и активности Т-клеток. Следовательно, они ингибируют Т-клеточные ответы за счет продукции простагландина E2, а также продуцируют метаболиты триптофана, которые могут отменять пролиферацию Т-клеток [48].
Функциональное созревание макрофагов приводит к эффекторному фенотипу макрофагов, M1 или M2 [18, 50]. Макрофаги M1 активируются под действием провоспалительных цитокинов и липополисахаридов. Напротив, макрофаги M2 поляризованы, подвергаясь воздействию среды, содержащей цитокины Th3 (IL-4, IL-10) и глюкокортикоиды [18]. Макрофаги M1-типа, или классически активированные моноциты, участвуют в прогрессировании воспаления, разделяя фактор некроза опухоли α (TNF α ) и IL-12, и они играют роль в разрушении тканей [50, 51].Макрофаги M2 или, альтернативно, активированные моноциты, генерируют повышенную продукцию противовоспалительных цитокинов, антагониста рецептора IL-1, IL-10 и трансформирующего фактора роста (TGF-) бета. Таким образом, макрофаги М2 восстанавливают ткани и подавляют воспаление [50, 51]. Кроме того, макрофаги M2 экспрессируют рецептор маннозы макрофагов, который обеспечивает защиту организма-хозяина и устранение веществ, образующихся при воспалительных процессах [48, 49]. Фактически поляризация M2 характеризуется повышенной экспрессией рецепторов врожденного иммунитета [18].
Поляризация децидуальных макрофагов в сторону M2, обнаруживаемая при нормальной беременности, указывает на то, что их иммуносупрессивная активность имеет решающее значение для поддержания иммунологического гомеостаза во время беременности [18, 50]. Врожденный иммунный ответ макрофагов регулируется посредством передачи сигналов, опосредованной рецепторами распознавания образов, то есть толл-подобными рецепторами (TLR). Распознавание микробов TLR на макрофагах является основным механизмом защиты хозяина в децидуальной оболочке [18, 48, 50]. В конце беременности макрофаги с воспалительным фенотипом участвуют в созревании шейки матки и в начале родов [50].
Как это ни парадоксально у пациентов, перенесших ЭКО, воспалительная среда, созданная при выполнении биопсии эндометрия перед имплантацией, влечет за собой более высокую частоту имплантации. Это связано с высокой концентрацией макрофагов / ДК и повышенными провоспалительными цитокинами [47].
Изучение образцов тканей от самопроизвольных абортов и планового прерывания беременности показало увеличение популяции децидуальных макрофагов при спонтанных абортах. Также была продемонстрирована сверхэкспрессия Fas-лиганда (Fas-L) этих децидуальных макрофагов во время спонтанных абортов.Fas-L представляет собой трансмембранный белок, который связывается с рецептором Fas и запускает апоптоз клеток, экспрессирующих Fas. Следовательно, было выдвинуто предположение, что экспрессия Fas-L децидуальными макрофагами является частью M2-подобной поляризации. Экспрессия Fas-L децидуальными макрофагами может индуцировать апоптоз Fas-несущих активированных Т-клеток, чтобы потенциально уменьшить вредные материнские иммунные ответы против полуаллогенного или аллогенного эмбриона при беременностях с ЭД [48].
Децидуальная дифференцировка макрофагов и ДК регулируется колониестимулирующим фактором гранулоцитов-макрофагов (GM-CSF).В эндометрии небеременного человека клетки люминального и железистого эпителия являются основным источником GM-CSF. Пик уровней мРНК GM-CSF наблюдался во время «окна имплантации». МРНК рецептора GM-CSF локализована в эндотелиальных клетках спиральной артерии. GM-CSF является фактором роста трофобласта [52]. GM-CSF может играть роль в патогенезе преэклампсии. Уровни GM-CSF в децидуальных клетках выше у пациентов с преэклампсией по сравнению с контрольной группой, соответствующей гестационному возрасту.Кроме того, цитокины, участвующие в преэклампсии TNF α и IL-1 β , активируют мРНК GM-CSF в культивируемых децидуальных клетках человека в первом триместре [52]. В соответствии с этим, уровни GM-CSF в крови и уровни GM-CSF / общего белка в плаценте значительно выше у беременных с преэклампсией, чем у нормальных беременностей [53]. Следовательно, можно предположить, что повышенный уровень GM-CSF у пациентов с преэклампсией может способствовать зрелости DC и поляризации децидуальных макрофагов к M1.
2.1.3. Система комплемента
Система комплемента является важным компонентом врожденного гуморального иммунитета, состоящего из белков. Они опосредуют очищение от патогенов, апоптотических клеток и иммунных комплексов, формируя комплекс мембранной атаки (MAC), который приводит к лизису клеток [54, 55]. Система комплемента может активироваться тремя путями: классический путь запускается комплексами антиген-антитело; альтернативный путь активируется спонтанно и непрерывно; лектиновый путь запускается связыванием маннан-связывающего лектина с остатками маннозы на поверхности микроорганизмов [54, 55].Независимо от механизма активации, все пути сходятся с образованием C3 конвертаз, которые превращают C3 в его активные компоненты, C3a и C3b. C3b является основным эффектором комплемента, который маркирует чужие клетки для разрушения фагоцитами. C3b также связывается с C3-кавертазами с образованием C5-конвертазы, которая превращает C5 в C5b и мощный провоспалительный медиатор C5a. C5b связывается не только с C6, C7, C8, но и со многими единицами C9, образуя литическую пору, которая вставляется в клеточные мембраны, известную как MAC (C5b-9).C3a и C5a, широко известные как анафилатоксины, учитывая их роль в анафилактическом шоке, способствуют удалению патогенов за счет увеличения проницаемости сосудов, индукции хемотаксиса воспалительных клеток и высвобождения цитокинов. C3a и C5a проявляют эти провоспалительные эффекты, связываясь со своими соответствующими рецепторами, рецептором C3a (C3aR) и двумя рецепторами для C5, рецептора C5a (C5aR; CD88) и рецептора C5a, подобного рецептору 2 (C5L2) [55].
Синцитиотрофобласты, ворсинчатые цитотрофобласты и EVT экспрессируют три регуляторных белка комплемента: фактор ускорения распада (DAF), мембранный кофакторный белок (MCP) и CD59, который предотвращает образование MAC и последующий лизис клеток [55 ].Таким образом, чрезмерная активация комплемента предотвращается при успешной беременности человека благодаря присутствию этих трех регуляторных белков в мембранах трофобластов [55].
Компонент комплемента C1q играет очень важную роль в миграции трофобластов, ремоделировании спиральных артерий и нормальной плацентации [56]. Децидуальные эндотелиальные клетки (ДЭК), покрывающие спиральные артерии, приобретают способность синтезировать C1q. Этот белок связан с поверхностью клетки и действует как физическая связь между эндоваскулярными трофобластами и ДЭК, способствуя процессу ремоделирования сосудов [54].В соответствии с этим, у беременных крыс с дефицитом C1q [C1q (- / -)] наблюдаются основные признаки преэклампсии человека: гипертензия, альбуминурия, эндотелиоз, снижение плацентарного VEGF и повышенные уровни растворимого рецептора VEGF 1 (sFlt-1), с высокой внутриутробной смертностью. Их плаценты также демонстрируют повышенный окислительный стресс и пониженный кровоток [56].
Маннозосвязывающий лектин (MBL) активирует лектиновый путь комплемента. Уровень MBL в полости влагалища изменяется во время менструального цикла, который локально продуцируется вагинальными клетками [54].MBL, по-видимому, играет ключевую роль в эмбриональной имплантации, поскольку анализ аспиратов матки, полученных при захвате ооцитов для ЭКО, выявил высокий уровень MBL у пациентов с бесплодием неизвестной этиологии по сравнению с пациентами, которым проводилось ЭКО / ИКСИ по мужскому фактору или трубке. бесплодие [54]. Хотя сывороточные уровни MBL повышаются во время беременности, его функция все еще требует уточнения [54]. Пациенты с преэклампсией показывают более высокие медианные концентрации MBL в плазме по сравнению с женщинами с неосложненной беременностью [57].Точно так же ассоциация генетически связанного полиморфизма MBL с MBL снижает функциональную активность, которая защищает от преэклампсии [54]. Интересно, что сыворотка, полученная от женщин с преэклампсией, предотвращает взаимодействие между EVT и DEC, что позволяет избежать эндоваскулярной инвазии трофобластических клеток. Повышенный уровень MBL в сыворотке крови у женщин с преэклампсией подавляет взаимодействие EVT с C1q, что препятствует процессу адгезии EVT и миграции через DECs [54].
Лектиновый путь комплемента также активируется фиколинами, которые опосредуют примитивный опсонофагоцитоз. Это растворимые молекулы врожденной иммунной системы, которые распознают молекулы углеводов на микробных патогенах, апоптозных и некротических клетках. Уровни фиколина-2 в плазме ниже у пациентов с преэклампсией по сравнению со здоровыми беременными женщинами. Эти пониженные концентрации фиколина-2 в плазме при преэклампсии могут способствовать развитию материнского синдрома заболевания из-за нарушения удаления материала трофобласта, высвобождаемого в кровоток матери преэклампсической плацентой с гипоксическим и окислительным стрессом [58].
Хотя компоненты комплемента обычно высоки во время беременности, чрезмерная активация комплемента, особенно усиленный синтез C5a, связана с такими осложнениями беременности, как повторный аборт, преждевременные роды и преэклампсия. C5 может быть вредным, потому что он индуцирует антиангиогенный sFlt-1. sFlt-1 секвестрирует VEGF и PIGF, которые являются решающими факторами роста для нормального развития плаценты и успешной беременности. Таким образом, было высказано предположение, что C5a может повредить ангиогенез, способствуя аномальной плацентации, что делает возможной потерю плода на ранних стадиях беременности или преэклампсию на более поздних стадиях.С другой стороны, C5a может вызвать преждевременные роды, вызывая созревание шейки матки и высвобождая большое количество медиаторов, стимулирующих роды [55].
Пациенты с преэклампсией имеют значительно более высокие уровни C4d, C3a и C5b9 и значительно более низкие концентрации C3, чем у здоровых беременных [59]. Действительно, более высокие плазматические уровни C5b9 или чрезмерная активация терминального комплемента были обнаружены у пациентов с преэклампсией с ограничением внутриутробного развития по сравнению с пациентами с нормальным внутриутробным ростом [59].При беременности у человека в период между 10 и 15 неделями гестации уровни продукта активации Bb в плазме (полученные из факторов B, которые инициируют активацию C3b посредством комплекса инициации альтернативного пути), активированных C3 (C3a), C5-9 и сывороточных уровней были количественно определены ангиогенные факторы PiGF, sFLT-1 и sENG. Высокие уровни Bb и низкие концентрации PiGF были связаны с более поздним развитием преэклампсии [60]. Удивительно, но у повторнородящих женщин, которые сменили партнера, уровень Bb был выше, и вероятность развития преэклампсии у них была в 5 раз выше, чем у женщин, которые все еще жили со своим партнером с момента последней беременности [61].
У женщин с преэклампсией уровень C5a в плазме значительно выше, чем у женщин с неосложненной беременностью [62]. До 20 недели гестации женщины, у которых позже развилось какое-либо гипертоническое заболевание, связанное с беременностью или гестационной гипертензией, показали более высокие уровни C3a в плазме по сравнению с женщинами, у которых эти заболевания не развивались [63]. В плаценте людей с тяжелой преэклампсией с ранним началом была обнаружена низкая экспрессия C3aR по сравнению с женщинами с преждевременной беременностью без преэклампсии [64].
Было обнаружено, что активация комплемента C3aR через аутоантитела вносит вклад в патогенез преэклампсии. Аутоантитело, агонистическое к рецепторам ангиотензина II типа 1 человека, стимулирует отложение комплемента С3 в плаценте и почках беременных мышей посредством активации рецептора ангиотензина II типа 1. Вмешательство в передачу сигналов C3a через C3aR-специфический антагонист комплемента значительно снижает артериальную гипертензию и протеинурию у беременных мышей, которым инъецировали аутоантитела, являющиеся агонистами рецептора ангиотензина II типа 1.Антагонист комплемента C3aR значительно не только ингибирует индуцированный аутоантителами циркулирующий sFlt-1, хорошо известный антиангиогенный белок, связанный с преэклампсией, но также уменьшает небольшой размер плаценты с нарушенным ангиогенезом и ограничением внутриутробного развития. У людей было продемонстрировано, что в плаценте пациентов с преэклампсией отложение C3 значительно выше, чем в контрольной группе с нормальным давлением. В культивируемых эксплантатах ворсинок человека активация его комплемента C3aR рассматривается как важный механизм, лежащий в основе индуцированной аутоантителами секреции sFlt-1 и снижения ангиогенеза [65].Антагонист C3aR может способствовать лечению преэклампсии. Тем не менее, низкая экспрессия C3aR в плаценте женщин с преэклампсией [64] указывает на то, что необходимы дальнейшие исследования для оценки полезности постулируемой терапии.
2.1.4. Толл-подобные рецепторы (TRL)
Клетки врожденной иммунной системы отвечают на инфекционные микроорганизмы рецепторами распознавания образов, такими как TLR. Они распознают последовательности, экспрессируемые микробами, называемые патоген-ассоциированными молекулярными структурами (PAMP), такими как бактериальный липополисахарид (LPS) или вирусная дцРНК.Поскольку как в первом триместре, так и в доношенной плаценте присутствуют TLR, плацента может распознавать патогены через эти рецепторы и вызывать последующий иммунный ответ [66].
Известно, что трофобласты человека в первом триместре постоянно секретируют хемокины, такие как онкоген, связанный с ростом, онкоген, связанный с ростом α , IL-8 и хемотаксический белок-1 моноцитов (MCP-1). Эти хемокины привлекают моноциты, NK-клетки и нейтрофилы. Лигирование TLR-3 вирусным поли (I: C) или TLR-4 бактериальным LPS значительно увеличивает секрецию хемокинов трофобластом.Это приводит к усилению хемотаксиса моноцитов и нейтрофилов. Более того, стимуляция TLR-3 вызывает секрецию RANTES клетками трофобласта, что является хемотаксическим для моноцитов [66].
Значительное увеличение экспрессии белка TLR-4 наблюдается в трофобластах плаценты у пациентов с преэклампсией по сравнению с беременными с нормальным давлением [66, 67]. Неожиданно было обнаружено, что экспрессия TLR-2 и TLR-4 в материнских нейтрофилах снижается при преэклампсии по сравнению с нормальной беременной контрольной группой аналогичного гестационного возраста [68].Необходимы дальнейшие исследования для объяснения дискордантной экспрессии TLR-4 между плацентарными трофобластами и материнскими нейтрофилами у пациентов с преэклампсией.
2.1.5. Децидуализированная секреция эндометрия
В ответ на паракринные сигналы от трофобласта в значительной степени индуцируются провоспалительные цитокины, хемокины и ангиогенные факторы в децидуальных стромальных клетках. В соответствии с этим, было проведено исследование с децидуализированными с помощью прогестерона стромальными клетками эндометрия человека, которые обрабатывали либо условной средой из трофобластов человека (TCM), либо контролируемой кондиционированной средой (CCM) из недецидуализированных стромальных клеток.Было обнаружено, что наиболее сверхэкспрессируемыми генами через 12 часов лечения были хемокины CXCL1 (GRO α ), IL8, хемокиновый рецептор CXC типа 4 (CXCR-4) и другие гены, участвующие в иммунном ответе, такие как пентраксин 3 (PTX3 ), IL6 и TNF α -индуцированный белок 6 (TNFAIP6) или металлопротеиназы (MMP1, MMP10 и MMP14). Гены с пониженной регуляцией были факторами роста, такими как IGF1, FGF1 и генами, участвующими в передаче сигналов Wnt. Паракринные взаимодействия между EVT и материнской децидуальной оболочкой, следовательно, важны для успешной эмбриональной имплантации, которая происходит в среде, обогащенной цитокинами / хемокинами, где митотическая активность стромальных клеток ограничена в фазе инвазивной имплантации [69].Предыдущее исследование in vitro также показало, что наиболее сверхэкспрессируемые стромальными клетками эндометрия гены во время имплантации из-за эффекта трофобласта были те, которые участвовали в воспалительной реакции, иммунном ответе и хемотаксисе (PTX3, IL8, рецепторы IL1, рецепторы IL18 и TNFAIP6), регуляторы роста клеток (IGF-связывающие белки 1 и 2) и передачу сигнала. Подавляемые гены — это гены, участвующие в протеолизе (MMP11) и гибели клеток, факторы транскрипции и гены, участвующие в гуморальном иммунном ответе (антиген CD24) [70].
Основным секреторным продуктом децидуализированного эндометрия беременной женщины является белок-1, связывающий инсулиноподобный фактор роста (IGFBP1). Его взаимодействие с интегрином α 5 β 1 поверхности клетки EVT запускает его миграцию независимым от IGF образом. В то время как продукция децидуального IGFBP1 прогрессивно увеличивается в течение первого и второго триместров неосложненной беременности, у женщин, у которых должна развиться преэклампсия, наблюдается низкий уровень IGFBP1 в сыворотке, что может указывать на децидуальную дисфункцию [71].
2.2. Антигены и активность трофобластов
2.2.1. Паттерн экспрессии HLA трофобласта
Подавляющее большинство трофобластов, которые вступают в контакт с материнской тканью, не обладают антигенными детерминантами, необходимыми для активации материнских Т-клеток; действительно, это предотвращает потенциальное отторжение материнского плода. Синцитиотрофобласт, который является основным трофобластом, вступающим в контакт с материнской иммунной системой, лишен классических антигенов HLA I и II классов.EVT имеет инвазивный фенотип и образует столбики клеток, которые проникают в децидуальную оболочку матери и замещают эндотелий спиральных артерий. Этот EVT выражает единый паттерн экспрессии HLA класса I с неполиморфными молекулами, которые включают HLA-E, -F, -G и -C [29].
HLA-G имеет решающее значение для толерантности матери к полуаллогенному или аллогенному плоду при беременностях с ЭД. Экспрессия HLA-G в EVT была обнаружена на протяжении всей беременности [26]. С Fas-L растворимый HLA-G индуцирует апоптоз CD8 + Т-клеток [24, 29].HLA-G, экспрессируемый в EVT, подавляет не только ответы цитотоксических Т-лимфоцитов, но также функции NK-клеток. Лидерный пептид HLA-G образует комплекс с HLA-E на поверхности клеток трофобласта и связывается с рецептором CD94 / NKG2 в NK-клетках. Впоследствии активность NK-клеток подавляется [24].
HLA-F также встречается в EVT. Хотя он слабо экспрессируется в первом триместре, его экспрессия увеличивается во время беременности [27]. HLA-E, который обнаруживается во всех клетках, экспрессирующих HLA-C или HLA-F, локализуется в основном на поверхности EVT, которая проникает в децидуальную оболочку матери.Подобно HLA-F, он может способствовать росту плода, поскольку его экспрессия совпадает с периодом быстрого роста плода [27]. Хотя полиморфный HLA-C также присутствует в EVT, он не так сильно полиморфен, как HLA-A и HLA-B. Из всех молекул HLA класса I, экспрессируемых EVT, только HLA-C демонстрирует изменчивость, необходимую для образования аллоантигена плода, и он распознается материнскими uNK-клетками через их рецепторы KIR [29].
2.2.2. Fas-лиганд
Fas-L — трансмембранный белок [72].Fas-L из EVT плода или материнских децидуальных клеток в сочетании с растворимым HLA-G из EVT индуцирует апоптоз CD8 + Т-клеток [23, 28], тем самым повышая материнскую иммунную толерантность. Было описано, что изолированные клетки трофобласта первого триместра не показывают FasL на своей мембране, но также экспрессируют цитоплазматическую форму. Этот внутриклеточный FasL конститутивно секретируется клетками трофобласта посредством высвобождения микровезикул. После разрушения этих микровезикул секретируемый FasL индуцирует апоптоз Т-клеток за счет активации пути Fas [72].Это знание было подтверждено последующим исследованием in vivo , которое обнаружило продукцию и хранение FasL только в синцитиотрофобласте человека в первом триместре беременности, но не в цитотрофобласте [73]. С другой стороны, недавно сообщалось, что полиморфизм Fas-L A-670G связан с повышенным риском преэклампсии [74]. Таким образом, желание лучше понять экспрессию FasL у плода и ее вклад в толерантность матери и ребенка может вдохновить на дальнейшие исследования.
2.2.3. Индолеамин-2,3-диоксигеназа
Индолеамин-2,3-диоксигеназа (IDO) — это фермент, разлагающий аминокислоту триптофан. У человека он экспрессируется как в EVT, так и в ворсинчатых трофобластах, где он может ингибировать активацию материнских Т-клеток за счет лишения триптофановых Т-клеток [24]. Уровни триптофана в сыворотке снижаются с первого триместра беременности человека [24]. Было продемонстрировано, что фармакологическое ингибирование активности IDO при беременности мышей вызывает опосредованное материнскими Т-клетками отторжение аллогенной, но не сингенной концепции.Тем не менее, генетическая делеция IDO у мышей приводит к нормальному размеру помета по сравнению с контрольными мышами, достаточными для IDO. Стоит отметить, что недостаток IDO у млекопитающих может быть компенсирован ферментом триптофандиоксигеназой, который индуцирует катаболизм триптофана [24].
2.2.4. Семейство B7
Молекулы семейства B7 представляют собой трансмембранные белки, принадлежащие к суперсемейству иммуноглобулинов [75]. Для оптимальной активации материнских Т-клеток требуется связь между Т-клеточным рецептором (TCR) и антигенным пептидом HLA антигенпрезентирующей клетки (APC).Чтобы спровоцировать эффективную активацию Т-клеток, необходим положительный костимулирующий сигнал, который опосредуется взаимодействием между CD28, который конститутивно экспрессируется в большинстве зрелых Т-клеток, и молекулами B7-1 и B7-2, экспонируемыми APC [ 74]. Интересно, что блокада B7-1 и B7-2 во время имплантации мышам, как сообщалось, вызывает ингибирование отторжения материнского плода у склонных к аборту вязок CBA / JxDBA / 2 [76]. Более того, частота B7-1 и B7-2, экспрессирующих активированные моноциты, в периферической крови пациентов с преэклампсией ниже, чем у здоровых беременных [77].
B7-1 и B7-2 также связываются с другим рецептором Т-клеток, цитотоксическим лимфоцитарным антигеном-4 (CTLA-4). Их объединение обеспечивает тормозной сигнал, который играет ключевую роль в негативной регуляции иммунной системы [75]. Во время беременности ткани плода экспрессируют CTLA-4 на границе раздела матери и ребенка. Предполагается предрасположенность к повторному самопроизвольному аборту, опосредованному полиморфизмом гена CTLA4 [24].
Другой костимуляторный путь, который играет роль в периферической толерантности, определяется рецептором запрограммированной смерти-1 и его лигандами, PDL1 и PDL2.Во время беременности, в то время как PDL1 или B7-h2 экспрессируется всеми популяциями трофобластов, PDL2 или B7-DC присутствует в синцитиотрофобласте на ранних сроках беременности [75]. Известно, что PDL1 необходим для поддержания материнско-фетальной толерантности, а его блокада или недостаточность приводит к плохой выживаемости плода и сдвигу в сторону плацентарных цитокинов Th2 [24].
2.3. Системный иммунологический ответ матери во время беременности
2.3.1. Характеристический цитокиновый профиль Т-хелперных клеток 2
Th-лимфоциты можно разделить на Th2 или Th3.Первоначально предполагалось, что плод человека не отторгается материнской иммунной системой из-за преобладающего производства цитокинов клетками Th3. Цитокины Th3, продуцируемые на границе раздела матери и плода, будут ингибировать ответы Th2, что приведет к выживанию плода [78]. Тем не менее, в то время как клетки Th3 преобладают на ранних сроках децидуальной беременности, клетки Th2 преобладают в небеременном эндометрии, особенно в пролиферативной фазе. Таким образом, отношение Th2 / Th3 достигает пика в пролиферативном эндометрии и значительно снижается в секреторной фазе и достигает самого низкого уровня в децидуальной оболочке ранней беременности [79].Точно так же экспрессия цитокинов Th3, особенно IL-6 и IL-10, в 10 раз выше в децидуальной оболочке ранней беременности по сравнению с небеременным эндометрием [80]. Кроме того, прогестерон стимулирует ответ Th3-типа, снижает воспалительные цитокины и сдерживает аллогенные ответы, чтобы обеспечить выживание плода [18].
Характерными цитокинами Th3-клеток являются IL-4, IL-5, IL-6, IL-9, IL-10 и IL-13. Хотя эти клетки участвуют в развитии гуморального иммунитета против внеклеточных патогенов, они также подавляют функции фагоцитарных клеток.Клетки Th2 не только синтезируют интерферон-g (IFN-g), IL-2 и фактор некроза опухоли-a (TNF-), но также запускают клеточный иммунитет и фагоцит-зависимое воспаление [81].
Тенденция к иммунным ответам Th2 была обнаружена при осложнениях, связанных с беременностью у человека, таких как повторяющиеся самопроизвольные аборты. Сообщалось о значительно более высоких уровнях сывороточных цитокинов Th3, IL-6 и IL-10 и о значительно более низких уровнях цитокина Th2, IFN-g, при нормальной беременности по сравнению с необъяснимыми повторяющимися потерями при беременности [82].Соответственно, у пациенток, сообщающих о повторных потерях беременности, и у бесплодных женщин с множественными неудачными имплантациями после ЭКО наблюдаются повышенные цитокиновые ответы Т-хелпера 1 за счет циркулирующих Т-клеток [81]. Инъекция каждого цитокина Th2, такого как IFN-g, TNF- и IL-2, или их совместное введение беременным мышам значительно увеличивает резорбцию плода [81].
Однако функция RANTES, главного хемокина в ответе Th2, может оказаться важной для модуляции ответов специфических Т-клеток на аллоантигены во время нормальной беременности.Действительно, успешная беременность сопровождается повышенными уровнями RANTES в сыворотке крови, которые ниже у пациенток, перенесших повторные аборты. Было продемонстрировано in vitro , что RANTES специфически подавляет аллоактивированные материнские Т-клетки. Таким образом, высокие уровни прогестерона, присутствующие во время нормальной беременности, особенно на материнско-фетальной поверхности, могут быть предикторами продукции RANTES на уровнях, необходимых для локального индуцирования толерогенного иммунного ответа [18].
RANTES (также известный как CCL5) — провоспалительный хемокин, который может действовать как модулятор аллоантиген-специфических Т-клеточных ответов при здоровой беременности [18].В то время как при успешной беременности уровни RANTES в сыворотке высоки, при повторных самопроизвольных абортах они низкие [83]. Действительно, RANTES точно подавляет аллоактивированные материнские Т-клетки [84]. Таким образом, RANTES может сотрудничать в материнском толерогенном иммунном ответе, обеспечивая выживание и миграцию трофобластных клеток [18].
Преобладание Th3 при нормальной беременности сменяется преобладанием Th2 при преэклампсии. Известно, что в периферической крови при преэклампсии процент Th2-клеток и соотношение Th2 / Th3 значительно выше, а процент Th3-клеток значительно ниже, чем в третьем триместре здоровой беременности [85].Изменение иммунитета Th2-типа выражается в сыворотке пациентов с преэклампсией повышением соотношений IL2 / IL4 и IFNg / IL4. Кроме того, преэклампсия связана с провоспалительной системной средой из-за повышенных циркулирующих уровней провоспалительных цитокинов IL-6 и TNF-альфа, хемокинов IL-8, IP-10 и MCP-1, а также молекул адгезии, молекулы межклеточной адгезии 1 ( ICAM-1) и белок адгезии сосудистых клеток 1 (VCAM-1) по сравнению с нормальной беременностью. Удивительно, но повышение концентрации IP-10, MCP-1, ICAM-1 и VCAM-1 у пациентов с преэклампсией достоверно коррелирует со значениями артериального давления, параметрами функции печени и почек [85].В соответствии с этим, продукция IL-12 мононуклеарными клетками периферической крови, который вызывает ответ Th2, снижается у здоровых беременных женщин, но увеличивается у пациентов с преэклампсией [86].
2.3.2. Иммуносупрессорная активность регуляторных Т-клеток
В материнском иммунном ответе против плода, который можно рассматривать как полуаллотрансплантат или аллотрансплантат при беременности с ЭД, роль CD4 + CD25 + Foxp3 + Treg-клеток особенно важна. Транскрипционный регуляторный белок forkhead box P3 (FOXP3) является репрессором транскрипции, необходимым для развития и функционирования Treg-клеток [87].Он был идентифицирован в децидуальных CD4 + Т-клетках, экспрессирующих FOXP3, с высоким уровнем CD25 (CD4 + FOXP3 +) или низким уровнем CD25 (CD4 +) [88]. В то время как децидуальные CD4 + Treg-клетки участвуют в регуляции иммунных ответов у людей, децидуальные CD4 + T-клетки демонстрируют активированный фенотип, экспрессируя повышенные уровни CD69 и низкие уровни FOXP3 и цитотоксического Т-лимфоцитарного антигена (CTLA) -4 [88]. Децидуальные CD4 + Treg-клетки вносят вклад в материнскую иммунную толерантность к антигенам плода, поскольку децидуальные клетки на ранних сроках беременности содержат большое количество CD4 + Treg-клеток, которые экспрессируют CTLA-4 на высоком уровне.Эти клетки предотвращают пролиферацию аутологичных CD4 + CD25– Т-клеток. Более того, доля децидуальных CD4 + Т-клеток значительно ниже при самопроизвольном аборте по сравнению с искусственным абортом [89].
Treg-клетки необходимы для индукции и поддержания антиген-специфической толерантности MHC класса II. Хотя HLA II не экспрессируется в ворсинках или EVT, остатки трофобластных клеток, содержащие внутриклеточный антиген HLA-DR плода, циркулируют в материнской крови. Было высказано предположение, что незрелые DCs, действуя как APC, улавливают этот дебрис и вызывают периферическую толерантность посредством индукции Treg-клеток.Иммунная регуляция CD4 + Т-клеток осуществляется главным образом Treg-клетками. Апоптоз CD8 + Т-клеток индуцируется растворимым лигандом HLA-G и Fas, экспрессируемым в EVT. Регулирование как CD4 +, так и CD8 + Т-клеток приводит к материнской толерантности [29].
Treg-клетки также повышают материнскую толерантность плода за счет экспрессии CTLA-4 на их поверхности. Лигирование CTLA-4 трансмембранным белком B7 APC приводит к повышенной экспрессии IDO на децидуальных и периферических DCs крови и моноцитах / макрофагах [90].IDO ограничивает доступность триптофана для Т-клеток [18].
Циркулирующие Treg-клетки увеличиваются на ранних сроках беременности, достигают более высокого уровня во втором триместре и уменьшаются в послеродовом периоде [91]. Было высказано предположение, что эстроген способствует толерантности матери и ребенка за счет увеличения количества Treg-клеток, поскольку лечение наивных мышей E2 увеличивает как количество клеток CD25 +, так и уровень экспрессии FoxP3. Кроме того, лечение эстрогенами и беременность вызывают сходную экспрессию белка FoxP3 [87].В соответствии с этим, модели in vivo, и in vitro, изящных мышей предоставили доказательства того, что прогестерон увеличивает долю CD4 + CD25 + Treg-клеток и экспрессию IL-10 и усиливает их подавляющую функцию. Кроме того, в физиологических дозах, эквивалентных средним срокам беременности, прогестерон, но не эстрадиол, превращает TCD4 + CD25- Т-клетки в CD4 + CD25 + Treg-клетки. Поэтому было высказано предположение, что прогестерон расширяет популяции Treg-клеток посредством ядерных рецепторов прогестерона.Кроме того, RU 486 значительно снижает количество и функцию Treg-клеток на границе раздела матерно-плодовых тканей до начала индуцированного аборта. Сообщалось, что значительно сниженная экспрессия Foxp3 сопровождается значительным увеличением провоспалительных факторов [92].
Субпопуляция эффекторных клеток TCD4 +, Th27, отличается от клеток Th2, Th3 и Treg. Клетки Th27 секретируют ИЛ-17 и экспрессируют хемокиновый рецептор СС типа 6 (CCR6) [93]. В то время как распространенность Treg снизилась, количество клеток Th27 увеличилось как в периферической крови, так и в децидуальной оболочке пациентов с необъяснимым повторным выкидышем по сравнению со здоровыми ранними беременными женщинами [94].Интересно, что экспрессия IL-17 может подавляться Treg. Пациенты с необъяснимым повторным невынашиванием беременности демонстрируют пониженную супрессивную активность Treg в клетках Th27 по сравнению со здоровыми женщинами, перенесшими ранний плановый аборт [93].
В настоящее время считается, что необъяснимые рецидивирующие самопроизвольные аборты могут быть аллоиммунным заболеванием, связанным с нарушенной материнско-фетальной толерантностью, в которой ключевую роль играют Treg-клетки. Поскольку Foxp3 является решающим регуляторным фактором для развития и функции Treg-клеток; Дефицит гена Foxp3 подавляет регуляторную функцию Treg-клеток.Соответственно, была обнаружена значимая ассоциация между полиморфизмами гена Foxp3 rs3761548A / C и rs2232365A / G и необъяснимыми рецидивирующими абортами в китайской популяции женщин [95].
Tregs необходимы для поддержания беременности, и низкие уровни были обнаружены при осложнениях беременности. Таким образом, не только женщины с необъяснимыми рецидивирующими самопроизвольными абортами, но и пациенты с преэклампсией демонстрируют низкие уровни Treg как в материнской крови, так и в плаценте. Фактически, у пациентов с преэклампсией процент клеток в популяции CD4 + Т-клеток в мононуклеарных клетках периферической крови значительно ниже, чем у женщин с нормальной беременностью и здоровых небеременных женщин.Более того, образцы плаценты от пациентов с преэклампсией показывают низкий процент FoxP3 + клеток в CD3 + Т-клетках по сравнению с таковыми у здоровых беременных. Было высказано предположение, что цитотоксические Т-клетки увеличиваются в базальной децидуальной оболочке при преэклампсии, поскольку соотношение CD8 + T / CD3 + T-клеток в образцах плацентарной преэклампсии было намного выше, чем в образцах, взятых от здоровых беременных [96]. Частота обычных CD4 + CD25high FoxP3 + Treg и частота нетрадиционных CD4 + CD25– FoxP3 + Treg снижается в периферической крови у пациентов с преэклампсией по сравнению со здоровыми беременными женщинами [97].Кроме того, преобладание клеток Th27 и соотношение Th27 / Treg увеличивается в периферической крови при преэклампсии по сравнению с нормальной беременностью [98].
Поскольку полный геном плода является аллогенным по отношению к матери при беременности с ЭД, материнская иммунная толерантность особенно важна для успеха беременности. Существенно большое количество T CD4 + и NK-клеток в базальной бляшке плаценты от беременностей с ЭД, по сравнению с таковыми от беременностей без ЭКО или без ЭКО, может указывать на усиление материнской иммунной толерантности по отношению к аллотрансплантату плода [99].
Как ни странно, недавно было высказано предположение, что при материнской толерантности к полу- или аллогенному плоду при беременностях с ЭД периферические или экстратимические Treg-клетки жизненно важны, поскольку они блокируют иммунный ответ на чужеродные антигены. Напротив, Treg-клетки тимуса подавляют аутоиммунитет [100, 101].
Выдержка спермы для индукции Т-регуляторных клеток. Помимо воздействия остатков трофобластических клеток, воздействие сперматозоидов также может вызывать толерантность, специфичную для HLA класса II.Антигены HLA-DR, экспрессируемые в сперматозоидах, могут индуцировать антиген-специфическую толерантность к HLA II. Treg-клетки играют центральную роль в индукции и поддержании этого процесса [29]. Мышиные модели показали, что Treg-клетки активируются мужскими антигенами [102]. Фактически, семенная жидкость расширяет пул Treg-клеток в парааортальных лимфатических узлах, дренирующих матку [103], и вызывает накопление Treg-клеток в матке до имплантации эмбриона [104]. Действительно, Treg-клетки необходимы при имплантации эмбриона.Клетки Treg накапливаются в матке мышей в рецептивной фазе цикла течки, а семенная жидкость дополнительно способствует экспансии Treg [105]. С другой стороны, растворимый HLA класса I в семенной жидкости может вызывать специфическую толерантность к HLA I. NK-клетки играют ключевую роль в индукции толерантности. Такое воздействие может повысить материнскую иммунную толерантность к отцовским антигенам HLA класса I и II до беременности [29].
При беременности, наступившей с использованием донорских сперматозоидов, женщины ранее не подвергались воздействию спермы, а плод представляет собой полусиаллотрансплантат матери.Поскольку риск преэклампсии у донорских сперматозоидов очень высок (18,2%), воздействие спермы может снизить риск преэклампсии [29]. Наряду с этим был изучен риск преэклампсии при интрацитоплазматической инъекции сперматозоидов (ИКСИ) с использованием либо эякулированной, либо хирургической спермы, и оба случая связаны с воздействием семенной жидкости. В то время как в ИКСИ с эякулированной спермой существует экспозиция спермы, экспозиция отсутствует в ИКСИ со спермой, полученной хирургическим путем. Риск преэклампсии при ИКСИ с эякулированной спермой такой же, как и при ЭКО — 4%.Как ни странно, риск преэклампсии при ИКСИ с использованием спермы, полученной хирургическим путем, составляет 11%, что значительно выше, чем при ИКСИ с эякулированной спермой [106]. Кроме того, поскольку риск преэклампсии при беременностях с эректильной дисфункцией при предыдущем контакте со спермой партнера высок (16,00%), аллогенный плод может представлять собой фактор риска преэклампсии. В случаях переноса донорских эмбрионов плод является аллогенным по отношению к матери, и это не связано с предыдущим воздействием спермы. В таких случаях риск преэклампсии чрезвычайно высок (33.00%) [29]. Эти данные подчеркивают важность воздействия сперматозоидов в индукции материнско-фетальной иммунной толерантности.
Начало преэклампсии может быть связано с постепенным уменьшением количества Treg-клеток, которые индуцируют отцовскую антиген-специфическую толерантность в третьем триместре беременности [29, 91]. Кроме того, описан защитный эффект множественности при преэклампсии. Несмотря на возможность уменьшения Т-клеток памяти после родов, зачатие семени может поддерживать их количество на определенном уровне.Таким образом, при второй беременности с тем же партнером количество Т-клеток памяти может быстро увеличиваться. Этот защитный эффект множественности при преэклампсии будет утрачен при смене партнера [29]. Также примечательно, что чем больше интервал между вторыми и третьими родами с одним и тем же партнером, тем выше риск преэклампсии. Это открытие можно объяснить прогрессирующим уменьшением Т-клеток памяти после родов во время второй или третьей беременности. Уровни Т-клеток памяти достигают самого низкого уровня более чем через 10 лет после последней доставки, а приматывание семенной жидкости поддерживает эти индуцирующие толерантность Т-клетки на низком уровне.Таким образом, при последующей беременности некоторые из этих женщин могут не достичь адекватной переносимости, что, в свою очередь, повышает риск преэклампсии [29].
2.3.3. B Лимфоциты и материнские антитела против HLA плода
Что касается адаптивного материнского гуморального иммунного ответа во время беременности, то отцовские анти-HLA-антитела наблюдались в моделях на повторнородящих мышах. Точно так же HLA-специфические B-клетки плода были обнаружены при беременности мышей [107]. В-клетки способны продуцировать антитела [108].
Во время беременности человека антигены плода вызывают адаптивный ответ материнской гуморальной иммунной системы. Соответственно, могут образовываться материнские антитела против HLA плода, которые особенно склонны к увеличению, когда несоответствия HLA между матерью и плодом высоки. Поскольку беременность с ЭД может быть связана с большим количеством несовпадений по HLA, чем спонтанно зачатие беременности, женщины с беременностью с ЭД могут вырабатывать более высокие уровни антител. Остается неизвестным, возникают ли неблагоприятные клинические последствия в результате гуморального иммунного ответа матери на антигены плода.Фактически, антипатернальные антитела к HLA и антифетальные Т-клетки присутствуют во многих нормальных беременностях [107].
У пациентов с преэклампсией было обнаружено аутоантитело против рецептора ангиотензина II типа I (AT1-AA). Он связывается с рецептором AT1, который высоко экспрессируется в плаценте, и запускает активацию внутриклеточного каскада, что приводит к продукции антиангиогенных факторов sFlt1 и эндоглина [108]. B-клетки являются частью адаптивного материнского клеточного иммунного ответа.Две субпопуляции B-клеток — это клетки B1 и B2. В то время как клетки B1 развиваются во время эмбриональной и перинатальной жизни, клетки B2 производятся в послеродовой период. Клетки B1 могут быть подразделены на клетки B1a и B1b на основании экспрессии клеточного маркера CD5 клетками B1a, но не клетками B1b. Клетки B2 и B1b продуцируют адаптивные антитела при стимуляции антигеном, тогда как клетки B1a синтезируют естественные антитела в отсутствие антигенных стимулов [108]. Известно, что аутоантитела к AAT1-AA продуцируются клетками CD19 + CD5 + B1a, но не клетками CD19 + CD5 – B2, полученными из периферической крови небеременных женщин и стимулированными in vitro сывороткой от преэкламптических женщин [109] .Во время беременности у человека доля клеток CD5 + B1a значительно снижается. Таким образом, было высказано предположение, что уменьшение циркулирующих клеток B1a во время беременности может способствовать материнской иммунной толерантности, поскольку эти клетки являются основными продуцентами поли-реактивных антител [110]. У беременных с неосложненной беременностью уровни CD19 + CD5 + значительно ниже к третьему триместру, в то время как уровни CD19 + CD5 + остаются высокими у пациентов с преэклампсией [109].
3.Материнская толерантность при беременности по донорству яйцеклеток
При беременностях с эректильной дисфункцией плод аллогенен по отношению к матери. HLA плода возникает из донорской яйцеклетки и от биологического отца будущего новорожденного ребенка. При спонтанной беременности плод полуаллоген по отношению к матери. Было показано, что гиперактивация Th2 и Th3 аллогенным плодом специфична для беременности с ЭД в первом триместре беременности по сравнению с беременностями ЭКО и беременностями естественным зачатием.Другой регуляторный противодействующий механизм при беременностях с ЭД отражается в предпочтительной активации Th3 и относительном подавлении экспрессии хемокинов Th2 [111].
Большое количество несовпадений в пяти наиболее иммуногенных антигенах HLA (HLA-A, -B, -C, -DR и -DQ) при беременностях с ЭД может иметь клинические последствия. Действительно, здоровые неосложненные доношенные беременности, содержащие ребенка с несоответствием HLA-C, вызывают более высокий процент CD4 + активированных Т-клеток в децидуальной оболочке и содержат функциональные регуляторные Т-клетки CD4 + в децидуальной ткани по сравнению с беременностями с HLA-C-совместимыми беременностями [111] .Более того, существует значимая корреляция между общим количеством несовпадений HLA-A, HLA-B, HLA-C, HLA-DR и HLA-DQ и процентом активированных CD4 + Т-клеток в дециду
Радиация во время беременности — FamilyEducation
Радиация
Облучение во время беременности
Беременные женщины опасаются двух видов радиационного облучения. Первое, так называемое неионизирующее излучение, исходит от бытовых приборов, таких как микроволновые печи и телевизоры.Второй — ионизирующее излучение, и оно исходит от рентгеновских лучей.Факты о беременности
В закрытых соляриях кожа затемняется с помощью курса ультрафиолета. Это излучение может вызвать рак кожи, преждевременное появление морщин, солнечные бляшки, нарушения пигментации и повреждение глаз, и все это плохо. Если вы не против получить что-либо из вышеперечисленного, хорошая новость заключается в следующем: загар в помещении не повредит вашему ребенку!
Суть в следующем: не беспокойтесь о радиационном воздействии бытовой техники и оборудования связи.Уровни настолько низкие, что ваш ребенок не пострадает.
Неионизирующее излучение
В наши дни невозможно избежать излучения, исходящего от обычных бытовых приборов и оборудования связи, такого как микроволновые печи, радиоприемники, телевизоры, радары, высоковольтные линии электропередач, некоторые системы охранной сигнализации, междугородные телефоны и т. Д. телеграфные передачи, электрические одеяла, водяные кровати с подогревом, диспетчерские линии такси, вышки спутниковой связи, видеотерминалы (ВДТ), автоматические открыватели гаражных ворот и электрические игрушки.Большей части этого просто невозможно избежать.
Некоторые исследования воздействия этого вида неионизирующего излучения выявили красный флаг в отношении чрезмерного облучения. Высокий уровень неионизирующего излучения у людей был связан (но не доказан научно) с генетическим повреждением, самопроизвольным абортом и врожденными дефектами. Но протестированные уровни были чрезвычайно высокими, намного превышающими те, которым мы обычно подвергаемся. Вы можете сидеть на два дюйма перед телевизором каждый день в течение всего дня во время беременности и не беспокоиться о радиационном повреждении вашего плода (вам следует больше беспокоиться о своем здравомыслии).Но если проявить осторожность, вы можете уберечь свой плод от вреда, если…
- Сядьте на расстоянии не менее пяти футов от телевизора, когда он включен.
- Стойте на расстоянии не менее трех футов и в стороне, когда работает микроволновая печь.
- Проверьте микроволновую печь на герметичность, вставив бумажное полотенце в дверцу и закрыв ее. Вы не должны вытаскивать полотенце из двери. Если можете, уплотнения изношены и их следует заменить.
- Не сидите слишком близко к задней части экрана компьютера.Большая часть излучения исходит сзади; поэтому, если ваша рабочая станция помещает вас за экран вашего коллеги, вы можете переехать. Но имейте в виду, что обширные исследования не могут найти однозначной связи между работой за компьютером весь день и врожденными дефектами.
- Хотя нет никаких доказательств того, что копировальные машины вредны для плода, будьте осторожны и ограничьте количество времени, которое вы проводите с этими машинами.
Внематочная беременность: диагностика, профилактика и ведение
1.Введение
Внематочная беременность (ВП) является результатом имплантации и созревания концептуса вне полости эндометрия, что в конечном итоге заканчивается смертью плода. Без своевременной диагностики и лечения ВП может стать опасной для жизни ситуацией [1]. Это принято от греческого слова «ektopos», что означает неуместное [2], имея в виду имплантацию бластоцисты вне полости эндометрия с более чем 95,5% имплантации в фаллопиеву трубу [3–7], где плод или эмбрион отсутствуют. или перестает расти.ВП представляет собой серьезную проблему для здоровья женщин детородного возраста, составляя 1,2–1,4% от всех зарегистрированных беременностей. Наиболее определенные факторы риска имеют материнское происхождение: воспалительные заболевания органов малого таза, инфекция Chlamydia trachomatis , курение, хирургия маточных труб, индуцированный цикл зачатия, а также эндометриоз [8]. В течение последних 40 лет заболеваемость неуклонно росла одновременно с увеличением заболеваемости венерическими заболеваниями (ЗППП) и сопутствующим сальпингитом (воспалением фаллопиевых труб).Наиболее частым местом эктопической имплантации является маточная труба. Другие участки, такие как живот, яичник или шейка матки, встречаются гораздо реже, но связаны с более высокой смертностью. Эта более высокая смертность связана с большей трудностью обнаружения и массивным кровотечением, которое может возникнуть в случае разрыва на этих участках [9].
Ежегодная заболеваемость ВП явно увеличилась за последние 34 года [10]. В западном мире было замечено 4–10% смертей, связанных с беременностью [11, 12], в то время как в развивающихся странах этот показатель растет экспоненциально [13].Несмотря на прогресс в диагностических методах, позволяющих ставить более раннюю диагностику, эта проблема все еще остается опасной для жизни. Ат-Турки [14] сообщил, что в арабских странах, таких как Королевство Саудовская Аравия, наблюдается рост заболеваемости. Одновременно Calderon et al. [15] отметили, что показатель EP составил 11,2 на 1000 беременностей в Калифорнии в 1999–2000 гг. По последним данным, частота ВП в Ирландии составляет 14,8 на 1000 беременностей [16]. В Ирландии, как и в большинстве развитых стран, произошло снижение смертности от ВП, что отражает историю успеха современного менеджмента.Опасное для жизни хирургическое вмешательство у женщины с положительным результатом теста на беременность и гемодинамическим шоком во многих случаях превратилось в несрочное медицинское состояние. Основное снижение смертности произошло в результате более ранней и более точной диагностики, что стало возможным благодаря развитию ультразвукового исследования с высоким разрешением и радиоиммуноанализа на хорионический гонадотропин человека (ХГЧ), а также широкой доступности лапароскопии [17].
2. Типы внематочной беременности
Фаллопиевы трубы — частое место в большинстве случаев трубного ВП [18].Около 75–80% ВП встречаются в ампулярной части, 10–15% — в истмической части и около 5% — в фимбриальном конце фаллопиевой трубы [19]. ВП маточных труб может быть диагностировано с помощью трансвагинального ультразвукового исследования (TVS) и подразумевает наличие интактной фаллопиевой трубы с беременностью, которая, вероятно, будет расти и визуализироваться как неоднородная масса, которая вполне может быть сплющенным мешком, содержащим трофобластическую ткань [20] .
ВП шейки матки встречается редко и составляет всего 0,15% от всех ВП [21]. Это можно определить как имплантацию бластоцисты в эндоцервикс с выдуванием внутреннего отверстия.Это связано с высоким потенциалом заболеваемости и смертности. Своевременное вмешательство необходимо для сохранения фертильности и исключения необходимости гистерэктомии [22]. Его можно диагностировать с помощью ультразвукового исследования в соответствии с критериями, описанными Хофманном и Тимором-Тритчем. В истинном EP, доплеровские исследования наблюдали характерные паттерны трофобласта с высокой скоростью потока и низким импедансом [23].
ВП яичников — один из самых редких вариантов, частота встречаемости оценивается в 0,15–3% от всех диагностированных ВП [24, 25].Одним из важных факторов риска овариальной беременности является использование внутриматочных спиралей (ВМС). ВМС — один из методов контрацепции, предотвращающий внутриматочную имплантацию на 99,5%; если имплантация происходит с ВМС, в 95% случаев это трубная имплантация и очень редко в других местах, например, в яичниках [26]. Каждая девятая внематочная беременность среди пользователей внутриматочных спиралей (ВМС) связана с беременностью из яичников [27, 28]. Диагноз сложен и основан на хирургических и гистопатологических наблюдениях [29].Ранняя диагностика необходима, чтобы избежать более серьезных осложнений и неотложных инвазивных процедур [30]. Однако Panda et al. [31] отметили, что предоперационная диагностика остается сложной задачей, и ее нельзя диагностировать на ранней стадии. На рисунке 1 показаны различные сайты EP.
Рис. 1.
Различные участки внематочной беременности [8].
3. Симптомы острой и хронической внематочной беременности
Симптомы ВП могут быть острыми, например, короткий период аменореи (5–8 недель), периодическое скудное вагинальное кровотечение темной кровью (мажущие кровянистые выделения) и боль в животе и в области плеч. .Хронические симптомы, включая те, которые прошли после предыдущего приступа острой боли, аменореи, тупой ноющей боли в нижней части живота, вагинального кровотечения, дизурии, частого мочеиспускания или задержки мочи и тенезмов прямой кишки.
Острая ВП — распространенная клиническая проблема, диагностируемая на основе сочетания клинических, сонографических и лабораторных данных. Хроническая ВП — более обычная ситуация и считается результатом незначительных повторных разрывов трубной беременности, которые развиваются в гематоцеле, содержащее кровь, сгустки и трофобластическую ткань, которые могут быть активными или неактивными [32].Гематоцеле окружено адгезией и вызывает воспалительную реакцию. Согласно другим данным [33], женщины с острыми или хроническими заболеваниями имели похожие медицинские и хирургические истории болезни. В частности, две группы не различались по предполагаемым факторам риска ВП; у них была аналогичная история операций на органах малого таза, перевязки маточных труб, заболеваний, передающихся половым путем, или инфекций органов малого таза.
4. Факторы риска, влияющие на частоту внематочной беременности
Основные факторы риска внематочной беременности различны в разных странах из-за различных культурных и социальных особенностей.Определение основных факторов риска внематочной беременности приводит к быстрой диагностике и совершенствованию стратегий ее предотвращения. Выявлены различные факторы риска внематочной беременности, включая предшествующую внематочную беременность, предыдущие операции на органах малого таза, индукцию овуляции, использование внутриматочной спирали (ВМС), воспалительные заболевания органов малого таза (ВЗОМТ) в анамнезе и курение во время зачатия [34–37] .
У женщин с ВП может быть затронута их будущая фертильность, и это увеличивает их риск повторного ВП.Когда EP растет в маточной трубе, он может повредить окружающую ткань труб. Это может повысить вероятность того, что яйцо застрянет там в будущем. Но раннее выявление и лечение могут минимизировать повреждающие эффекты ВП. На вероятность повторной ЭП влияет сочетание других факторов риска. Они могут включать курение, использование вспомогательных репродуктивных технологий (ВРТ) для зачатия и степень повреждения маточных труб.
Предыдущая операция на органах малого таза может увеличить риск ЭП [38].Предыдущая операция в области малого таза или на трубах может вызвать спайки. Спайки образуются у большинства женщин после гинекологических операций на органах малого таза. Исследования показали, что спайки образовывались у 55–100% пациентов, перенесших репродуктивную операцию на тазу, открытую или лапароскопическую. Например, миомэктомия (операция по удалению миомы), трубная хирургия (удаление EP), операция на яичнике (удаление кисты) и операция по поводу эндометриоза могут вызвать спаечные процессы.
EP необходимо всегда учитывать, особенно после индукции овуляции цитратом кломифена (100 мг / день, начиная с 5-го дня цикла) или вспомогательными репродуктивными технологиями (ART).Частота ВП значительно возрастает после АРТ и колеблется от 2 до 11 [39]. Каждый врач, лечащий женщин репродуктивного возраста, должен помнить об этом диагнозе. Индукция овуляции с использованием восьми инъекций ФСГ и гормонального протокола ХГЧ вызвала ВП левой трубы и начала расти раньше, чем правая, вызывая боль и кровотечение [40]. Гинекологи, врачи первичной медико-санитарной помощи, сонологи и врачи отделения неотложной помощи должны иметь высокое подозрение на гетеротопную беременность у женщин, зачатых после использования препаратов, вызывающих овуляцию [41].
Внутриматочная контрацепция является наиболее часто используемым методом обратимой контрацепции длительного действия из-за его высокой эффективности и безопасности, простоты использования и низкой стоимости. ВМС является наиболее часто используемым методом обратимой контрацепции во всем мире и используется в среднем 23% женщин, пользующихся противозачаточными средствами, с диапазоном от <2 до> 40% в зависимости от страны [42]. Беременность с использованием ВМС in situ чаще бывает внематочной, чем беременность без ВМС. Использование ВМС в прошлом может незначительно повысить риск внематочной беременности (объединенное ИЛИ: 1.40, 95% ДИ: 1,23–1,59) [43]. Считалось, что увеличение числа ВП среди пользователей ВМС связано с несколькими факторами. Во-первых, раздражение маточных труб, вызванное присутствием ВМС в полости матки, может помешать яйцеклетке попасть в матку. Во-вторых, ВМС может предотвратить только внутриутробную беременность, но не ВП. В-третьих, бактерии, занесенные через введение ВМС, могут вызвать инфекцию фаллопиевых труб, что увеличивает риск ВП. Этот риск среди пользователей ВМС в 2,94–4,5 раза выше, чем у лиц, не использующих ВМС [44].
Воспалительное заболевание органов малого таза (ВЗОМТ) определяется как инфекция эндометрия, фаллопиевых труб и / или смежных структур, вызванная проникновением микроорганизмов из нижних отделов половых путей [45]. У большинства девочек с ВЗОМТ развивается после заражения венерическими заболеваниями (ЗППП), такими как хламидиоз или гонорея. В мире наблюдается рост заболеваемости ВП, что в основном связано с увеличением заболеваемости ВЗОМТ [46]. В Великобритании ежегодно диагностируется около 11000 случаев (заболеваемость 11.5 на 1000 родильных домов) [47], в то время как в США ежегодно регистрируется 108 800 случаев (заболеваемость 19,7 на 1000 родильных домов).
Курение матери сигарет во время зачатия было связано с повышенным риском внематочной беременности с зависимостью от дозы (скорректированное отношение шансов: 1,30–2,49) [48]. Исследования показали, что котинин (активный метаболит никотина) увеличивает экспрессию прокинетицина PROKR1 в фаллопиевых трубах, регулятора сократимости гладких мышц и гена, который считается важным для внутриматочной имплантации [49].Курение было связано со снижением уровня транскрипта проапоптотического гена (BAD) (P <0,01) и повышенным уровнем транскрипта BCL2 (P <0,05) в биоптатах фаллопиевых труб. BAD- и BCL2-специфическая иммунная метка была локализована на эпителии фаллопиевых труб. Таким образом, курение может изменить оборот эпителиальных клеток маточных труб и связано со структурными, а также функциональными изменениями, которые могут способствовать развитию ВП [50]. Более того, курение сигарет увеличивает транскрипцию рецептора прокинетицина 1 (PROKR1), рецептора, связанного с G-белком [49].PROKR являются рецепторами для PROK1, молекулы, известной своими ангиогенными свойствами, контроля сократимости гладких мышц и регуляции генов, важных для внутриматочной имплантации [51].
Возраст — это наибольший риск ВП, который увеличивается с увеличением возраста матери, при этом возраст старше 35 лет является значительным фактором риска [1]. Заболеваемость EP показала устойчивый рост с увеличением возраста матери на момент зачатия с 1,4% всех беременностей у женщин в возрасте 21 года до 6,9% беременностей у женщин в возрасте 44 лет и старше из-за хромосомных аномалий в трофобластической ткани [52] .
5. Диагностика внематочной беременности
В прошлом ВП диагностировали на основании таких клинических симптомов, как вагинальное кровотечение и боль внизу живота, но это накладывало ограничения на раннее выявление [53]. Стоит отметить, что первоначальная диагностика кровотечения в первом триместре представляет собой серьезную проблему. В последнее время обнаружение EP стало возможным с помощью сывороточного бета-хорионического гонадотропина человека (β-ХГЧ) и уровней прогестерона, а также с помощью методов вагинального ультразвукового исследования [54, 55]. Один только анализ крови не может сказать, где развивается беременность, но он может помочь врачам наблюдать за пациентами, у которых может быть растущая ВП.
5.1. Концентрация β-ХГЧ в сыворотке
На ранних сроках беременности уровень β-ХГЧ должен удваиваться примерно каждые 48 часов. После выкидыша довольно быстро спадает. Если он растет медленно или остается примерно на том же уровне в течение этого времени, это может означать, что беременность не удалась или наступила беременность. Однократное измерение концентрации β-ХГЧ в сыворотке может не показать расположение гестационного мешка [56, 57]. Демонстрация нормального удвоения уровней в сыворотке крови в течение 48 часов подтверждает диагноз жизнеспособности плода, но не исключает ВП.Отсутствие уровней при повышении уровня концентрации β-ХГЧ до 50% подтверждает нежизнеспособность, предполагающую наличие EP [58]. Более того, было замечено, что пороговые значения β-ХГЧ на 12-й день после переноса эмбриона полезны для прогнозирования окончательного типа клинической беременности. Пороговые значения для EP составили 91 МЕ / л (чувствительность 82,7%, специфичность 71,1%) [59]. В исследовании 287 пациентов с болью или кровотечением минимальное повышение уровня β-ХГЧ для жизнеспособной IUP составило 24% через 24 часа и 53% через 48 часов [60]. Seeber et al.[61] предоставили данные с доверительным интервалом 99%, которые предполагают более консервативный минимальный рост на 35% за 2 дня. В современной практике в большинстве отделений используется минимальное значение от 50 до 66% для приемлемого 48-часового повышения уровня β-ХГЧ при нормальной беременности [62].
5.2. Концентрация прогестерона в сыворотке
Пациенты с нормальной внутриутробной беременностью имели уровни прогестерона в сыворотке более 20 нг / мл (среднее значение = 30,9 нг / мл), в то время как у всех пациенток с внематочной беременностью уровень прогестерона был ниже 15 нг / мл (среднее значение = 5.7 нг / мл) [63]. В отличие от концентраций β-ХГЧ, сывороточные уровни прогестерона стабильны в течение первых 8–10 недель беременности [6]. Elsone et al. [64] показали, что пациенты с концентрацией прогестерона в сыворотке ниже 10 нг / мл (31,8 нмоль / л) и уровнем β-ХГЧ ниже 1500 мМЕ / л с большей вероятностью имеют спонтанный ВП. Аналогичным образом Williams et al. [65] сообщили, что средний прогестерон для нормальных беременностей составил 32,8 ± 4,25 нг / мл (n = 49), для внематочных беременностей 7,8 ± 0,79 нг / мл (n = 51) и самопроизвольных абортов 8.1 ± 0,91 нг / мл (n = 74). Этот тест может быть полезен некоторым пациентам, когда диагноз неясен после выполнения β-ХГЧ и трансвагинального ультразвукового исследования.
5.3. Концентрация фактора роста эндотелия сосудов (VEGF) в сыворотке крови
Фактор роста эндотелия сосудов (VEGF) является мощным ангиогенным фактором, который действует как модулятор роста сосудов, ремоделирования и проницаемости в эндометрии, децидуальной оболочке и трофобласте, а также во время развития сосудов в эмбрион, все из которых являются ключевыми процессами, связанными с нормальной имплантацией и плацентацией [66].Уровни VEGF в сыворотке были увеличены в EP. Daponte et al. [54] описали более высокие сывороточные концентрации VEGF у женщин с ВП (227,2 пг / мл), чем с аномальной внутриутробной беременностью (107,2 пг / мл). Впоследствии они пришли к выводу, что концентрации VEGF в сыворотке могут быть хорошим маркером для EP, и предложили 174 пг / мл в качестве порогового значения для диагностики EP.
5.4. Концентрация креатинкиназы (CK) в сыворотке крови
Очевидные данные свидетельствуют о том, что повышенная креатинкиназа (CK) является инструментом для диагностики EP.Трофобласт обычно проникает в мышечный слой, и материнские кровеносные сосуды разрушаются, позволяя продуктам мышечных клеток, таким как CK, попадать в кровоток [67]. Следовательно, повышенная активность CK в сыворотке является нормальным явлением во время EP [67]. Saha et al. [68] провели исследование с участием 40 женщин, и было обнаружено, что общая сывороточная активность CK была выше в группе EP по сравнению с контролем, предполагая, что этот тест может быть индикатором EP. Аналогичным образом Katsikis et al. [69] изучали 40 женщин со случаями ВП и пришли к выводу, что у женщин с ВП активность КК была значительно выше, чем у женщин с внутриутробной абортивной беременностью и контрольной группы, предполагая, что КК могут быть решающим инструментом для прогнозирования ВП.
5.5. Трансвагинальная сонография
Трансвагинальная сонография (TVS) — это метод выбора изображения для диагностики ВП с чувствительностью менее 90%. Диагноз основывается на визуализации внематочной массы, а не на невозможности визуализировать внутриутробную беременность. Диагноз ВП следует ставить на основании положительной визуализации внематочной беременности. Если ни внематочная, ни внутриутробная беременность не визуализируются на TVS, женщину следует классифицировать как имеющую «беременность неизвестного происхождения», а затем проводить наблюдение до тех пор, пока не станет известен окончательный исход беременности [70].
Ряд находок могут указывать на наличие ВП, но не являются диагностическими. Внутри сумки Дугласа может быть безэховая или неэхогенная жидкость. Эхогенная жидкость в сумке Дугласа может указывать на гемоперитонеум, вторичный по отношению к разрыву ВП или трубному выкидышу, но это также может быть замечено при разрыве геморрагической кисты яичника (рис. 2).
Рис. 2.
TVS-изображение эхогенной жидкости в сумке Дугласа, указывающее на гемоперитонеум после разрыва ВП [70].
Точная взаимосвязь между появлением трубного EP на TVS, размером массы и уровнем ХГЧ в сыворотке не определена. В своем исследовании 120 женщин с ВП, Cacciatore [71] обнаружил, что уровни ХГЧ коррелируют с размером внематочных гестационных мешков, но не с диаметром неоднородной массы придатков. Они также обнаружили, что у женщин с внематочными гестационными мешками большинство уровней ХГЧ в сыворотке были высокими и увеличивались, в то время как у женщин с неоднородной массой уровни ХГЧ в сыворотке были значительно ниже, и большинство из них снижалось.
6. Профилактика внематочной беременности
В целом женщины не могут предотвратить ВП, но они могут предотвратить серьезные осложнения с помощью ранней диагностики и лечения. Если у них есть один или несколько факторов риска ВП, женщины и их врач могут внимательно следить за первыми неделями беременности. Снижение риска инфекций, передаваемых половым путем (ИППП), таких как гонорея или хламидиоз, может увеличить шансы женщины на внематочную беременность. Если женщина снижает риск заражения одним из этих заболеваний, она также может снизить риск внематочной беременности [7].Более того, если женщины действительно заразились ИППП, важно сразу же начать лечение. Чем раньше эти женщины получат лечение, тем меньше у них разовьется воспаление, которое может повредить репродуктивную систему и увеличить риск развития ВП. Общие симптомы ИППП включают боль в животе, болезненное мочеиспускание, выделения из влагалища, аномальное вагинальное кровотечение, запах из влагалища и боль во время секса. С другой стороны, курение может увеличить риск возникновения ВП. Женщинам следует бросить курить, прежде чем пытаться зачать ребенка, чтобы снизить риск [7].Интересно, что внутрибрюшинная трансмиграция сперматозоидов происходит примерно в половине случаев при спонтанной беременности человека. Чтобы свести к минимуму риск внематочной трубной беременности у женщин с односторонним повреждением фаллопиевых труб, сальпингэктомия должна быть предпочтительным хирургическим лечением, а не попыткой спасения и восстановления маточных труб [72].
7. Медикаментозное ведение внематочной беременности
Вариант лечения ВП включает хирургическое лечение путем лапаротомии или лапароскопии, а медикаментозное лечение обычно является системным или местным путем, или выжидательной терапией [73, 74].
7.1. Хирургическое лечение лапаротомией или лапароскопией
Несмотря на различные недавние достижения в ведении внематочной беременности, традиционное хирургическое лечение путем лапаротомии по-прежнему является наиболее широко используемым методом лечения в нашем учреждении. При надлежащем и своевременном лечении можно предотвратить материнскую смертность из-за внематочной беременности. В исследовании с участием 56 пациенток у 3 (5,4%) была неразрывная трубная беременность, у 27 (48%) — разрыв внематочной беременности и у 26 (46.3%) имели хроническую внематочную беременность. При лапаротомии сальпингэктомия была выполнена 21 (37,4%) пациенту, сальпингоофорэктомия — 26 (46,3%), иссечение рудиментарного рога матки — 4 (7,1%), резекция и анастомоз конец в конец — 1 (1,8%). и тотальная абдоминальная гистерэктомия — у 4 (7,1%). Материнской смертности не было [75]. Фактически, впервые описанное лапароскопическое лечение внематочной беременности было консервативным [76]. Позднее Dubuisson et al. [77] предложили сальпингэктомию с помощью лапароскопии.
Лапароскопический доступ предпочтительнее открытого доступа у гемодинамически стабильного пациента. Лапароскопические процедуры связаны с более коротким временем операции, меньшей интраоперационной кровопотерей, более коротким пребыванием в больнице и более низкими требованиями к обезболиванию [78–80]. Лапаротомию следует выполнять только пациентам с разрывом, которые находятся в состоянии гиповолемического шока и компромисса. Если контралатеральная труба здорова, предпочтительным вариантом является сальпингэктомия, при которой удаляется вся маточная труба или пораженный сегмент, содержащий внематочную беременность (рис. 3).Сальпингостомия — это удаление внематочной беременности путем ее рассечения из трубы и оставления фаллопиевой трубы на месте в попытке сохранить фертильность на этой стороне [7].
Рисунок 3.
(A) Внематочная беременность в левой трубке при лапароскопии и (B) трубная внематочная беременность была удалена с помощью сальпингэктомии [7].
Успешность сальпингостомии составляет 92%, а случаи неудачи можно лечить с помощью метотрексата (МТ) [81]. Серийные измерения β-ХГЧ следует проводить до тех пор, пока их нельзя будет обнаружить, чтобы убедиться в отсутствии стойкости трофобластической ткани.Иногда профилактическая доза метотрексата назначается при сальпингостомии [82]. Стойкий ВП возникает в результате неполного удаления трофобластической ткани [83], наиболее частого осложнения лапароскопической сальпингостомии, и встречается с частотой 5–20% [84, 85]. Он диагностируется во время последующего наблюдения, когда концентрация β-ХГЧ, измеряемая один раз в неделю, достигает плато или повышается [8]. NICE [86] рекомендовал женщинам, перенесшим сальпингостомию, определять уровень β-ХГЧ в сыворотке через 7 дней после операции, а затем еженедельно до получения отрицательного результата.В одном рандомизированном контролируемом исследовании лапароскопической хирургии профилактический прием метотрексата снизил частоту стойкой внематочной беременности с 14,5 до 1,9%. Основное преимущество заключалось в более короткой продолжительности послеоперационного наблюдения [85].
Имеющиеся данные убедительно свидетельствуют об отсутствии разницы в пользе для здоровья между лапароскопией и лапаротомией, включая ключевой исход последующей успешной беременности [87]. Таким образом, с годами тенденция все больше менялась, и в настоящее время лапаротомия при внематочной беременности применяется в сложных случаях, когда пациентка нестабильна гемодинамически, и в сложных случаях, когда сосуществуют тазовые и абдоминальные образования, когда практикующий считает, что достижение пневмоперитонеума скорее всего, будет неудачной и пустой тратой времени.Таким образом, если вы в настоящее время являетесь стажером старшего специалиста, вам придется объяснять своему консультанту, почему пациенту была сделана лапаротомия вместо лапароскопии [88].
7.2. Медицинское обслуживание
Медикаментозное лечение полезно пациентам с неразрывной трубной внематочной беременностью, которые гемодинамически стабильны, имеют минимальные симптомы и низкий объем свободной внутрибрюшинной жидкости при УЗИ [89]. Медикаментозное лечение ВП значительно дешевле хирургического [90]. Для лечения внематочной беременности использовалось множество различных агентов, включая системный и местный метотрексат, местный хлорид калия, гиперосмолярную глюкозу, простагландины, даназол, этопозид и мифепристон (RU486) [91, 92].Метотрексат для внутримышечного введения является наиболее широко используемым и успешным лекарственным средством для лечения внематочной беременности и обычно назначается по протоколу однократной дозы. Метотрексат — антагонист фолиевой кислоты, который нацелен на быстро делящиеся клетки и останавливает митоз. Метотрексат был впервые использован при диагностированном ВП в 1960 г. для безопасного хирургического удаления плаценты из мест ее абдоминальной имплантации во втором и третьем триместре беременности [93]. При внематочной беременности препарат предотвращает пролиферацию клеток цитотрофобластов, снижая жизнеспособность клеток и секрецию β-ХГЧ и тем самым поддерживая беременность прогестероном.Это способствует разрешению внематочной беременности и ремоделированию тканей [7].
Для метотрексата доступны две распространенные схемы: многодозовый (метотрексат 1,0 мг / кг внутримышечно ежедневно; дни 0, 2, 4 и 6 чередуются с фолиевой кислотой 0,1 мг / кг перорально в дни 1, 3, 5 и 7) и разовая доза (Метотрексат 0,4–1,0 мг / кг или 50 мг / м 2 в / м без фолиновой кислоты) [93]. В многодозовой схеме чередуются внутримышечные дозы метотрексата 1,0 мг / кг через день с внутримышечной дозой лейковорина кальция 0 через день.1 мг / кг, антидот-антагонист фолиевой кислоты, до четырех доз каждого из них до тех пор, пока уровень β-ХГЧ не снизится на 15% в течение двух дней подряд [8]. Приблизительно 14–20% пациентов, получающих лечение однократной дозой, потребуют повторной дозы, что обычно решается после падения концентрации β-ХГЧ менее чем на 15% с 4 по 7 день после лечения. Этот временной масштаб используется, поскольку метотрексат может вызвать временное повышение уровня β-ХГЧ в сыворотке после первоначального лечения [7]. Лечение метотрексатом очень эффективно при небольших стабильных внематочных беременностях.Метаанализ нерандомизированных исследований показал эффективность 93% (95% доверительный интервал 89–96%) для многодозовых протоколов и 88% (95% доверительный интервал 86–90%) для однократной терапии [94]. Чем меньше повышение уровня β-ХГЧ до введения метотрексата, тем выше шанс на успешное лечение. Повышение уровня β-ХГЧ в сыворотке крови на 11–20% за 48 часов до введения метотрексата было связано с более высокими показателями успеха [95, 96]. Barnhart et al. [97] исследовали в своем метаанализе обе схемы (многодозовый и однократный) и пришли к выводу, что многодозовый режим был более эффективным, чем однократный, с показателем успешности 93% для многодозового режима и 88% для однократного. — режим дозирования.
Многие побочные эффекты, связанные с лечением метотрексатом, включают тошноту и рвоту, стоматит, диарею, дискомфорт в животе, пневмонит, кожную реакцию светочувствительности, нарушение функции печени, обратимая, тяжелая нейтропения (редко) и обратимая алопеция (редко) [98]. Более того, побочные эффекты высоких доз метотрексата (MTX-HD) могут быть опасными для жизни; однако дозы различных доз перорального метотрексата варьируют из-за индивидуальной вариабельности желудочно-кишечной абсорбции этого лекарственного средства. Костный мозг, слизистая оболочка желудочно-кишечного тракта и волосы особенно уязвимы к действию метотрексата из-за их высокой скорости клеточного обмена, а поскольку концентрация метотрексата обратно пропорциональна почечному клиренсу [99], почечная токсичность часто встречается у метотрексата-HD.
7.3. Ожидаемое управление
Ожидаемое управление означает, что мы ожидаем, что EP разрешится естественным образом без какого-либо вмешательства. Больница будет внимательно следить за этим, вместо того, чтобы немедленно лечить. Ожидаемое лечение может применяться у отдельных пациентов с самоограничивающейся внематочной беременностью; пропорция чрезмерно леченых должна приниматься до тех пор, пока не будет найден маркер, идентифицирующий эту подгруппу пациентов [100, 101]. Исследования, оценивающие выжидательную тактику внематочной беременности, в первую очередь основаны на этой концепции регрессии трофобласта и, следовательно, подвержены неопределенности в отношении определенных первичных ВП, которые являются диагнозом [98].
Подходящий кандидат для выжидательной тактики должен иметь внематочную беременность без признаков разрыва, быть клинически стабильным, бессимптомным и иметь постоянно снижающуюся концентрацию β-ХГЧ [7]. Низкий уровень прогестерона в сыворотке также является возможным маркером пригодности для выжидательной тактики. Последующее наблюдение должно проводиться от одного до трех раз в неделю с измерением β-ХГЧ и ультразвуковым исследованием по мере необходимости. Сообщается, что выжидательная тактика наиболее эффективна, когда исходный уровень β-ХГЧ <1000 МЕ / л [102].Другое последнее руководство, опубликованное Американским колледжем акушеров и гинекологов, заключается в том, что выжидательная тактика может сыграть свою роль, когда уровень β-ХГЧ составляет 200 мМЕ / мл и находится в стадии снижения [8]. Другой анализ показал, что благоприятными прогностическими признаками для успешного выжидательного лечения ВП являются следующие минимальные клинические симптомы без признаков гемодинамического компромисса: доказательства эктопического разрешения за счет снижения уровней β-ХГЧ, предшествующего выжидательной терапии, могут использоваться для такого расширения; низкий исходный уровень β-ХГЧ в сыворотке: успешное выжидание происходит в 98% случаев для ХГЧ 200 МЕ / л, в 73% для β-ХГЧ 500 МЕ / л и в 25% для β-ХГЧ 2000 МЕ / л.В целом, если исходный уровень β-ХГЧ в сыворотке составляет 1000 МЕ / л, то успешное выжидательное ведение может произойти у большинства пациенток (88%) с размером внематочной беременности 4 см, без сердцебиения плода на трансвагинальной сонографии с последующим гемоперитонеумом 50 мл. Доказательства эктопического разрешения при сканировании - еще один способ диагностики [8, 98]. Сообщается о степени успеха от 47 до 82%, в зависимости от исходного состояния пациента [7].
Что делать, если у вас грыжа во время беременности
Согласно статье, опубликованной в январе 2018 года в журнале Frontiers in Surgery , единого мнения относительно лучшего времени для восстановления грыжи у беременных женщин нет.(2)
Если ваша грыжа небольшая и не вызывает каких-либо неприятных симптомов, вы и ваш врач можете решить подождать, пока вы родите, чтобы исправить ее.
Но если грыжа причиняет вам дискомфорт, большинство врачей порекомендуют исправить ее, пока вы еще беременны.
И если у вашей грыжи разовьется осложнение, например, защемление или ущемление, потребуется экстренная операция. (2)
При отсутствии неотложной помощи для лечения грыжи во время беременности могут быть доступны следующие варианты:
Плановое восстановление во время беременности
Ваш врач может предложить хирургическое лечение грыжи, пока вы все еще беременны, если оно вызывает у вас симптомы или достаточно велико, чтобы рисковать развитием осложнений.
Маловероятно, что точное время проведения операции будет соответствовать каким-либо конкретным правилам. Некоторые врачи рекомендуют его в течение первого или второго триместра, в то время как другие считают, что второй триместр — оптимальное время для операции.
Если грыжа восстанавливается только с помощью швов — без использования стальной сетки для поддержки области ослабленной мышцы — тогда риск рецидива грыжи во время беременности высок.
Но использование сетки в операции может ограничить гибкость брюшной стенки и вызвать боль как во время текущей беременности, так и во время любой будущей.
Операция по пластике грыжи во время беременности считается безопасной процедурой. Как указано в отчете Frontiers in Surgery , в одном исследовании пластики пупочной грыжи у 126 беременных женщин в течение 30 дней после операции было зарегистрировано небольшое количество побочных эффектов и отсутствие выкидышей. (2)
Ремонт грыжи во время кесарева сечения
Если у вас нет особо серьезной грыжи и вы планируете рожать с помощью кесарева сечения (кесарево сечение), вы можете пройти лечение грыжи во время кесарева сечения. время.
The Frontiers in Surgery В статье отмечается, что сочетание пластики грыжи с кесаревым сечением, по-видимому, приводит к более длительной общей процедуре восстановления паховых грыж, но не при пупочных грыжах — это означает, что она занимает не больше времени, чем обычная операция C -раздел.
Так же, как и при плановой пластике во время беременности, использование только швов для проведения пластики во время кесарева сечения, по-видимому, несет больший риск рецидива грыжи, чем использование стальной сетки. (2)
Лечение грыжи после родов
В случае грыжи легкой степени вы и ваш врач можете принять решение не лечить грыжу во время кесарева сечения по ряду причин, в том числе если вы планируете еще одну беременность.
Пластика грыжи может быть проведена как отдельная процедура уже через пять-восемь недель после родов, или ее можно отложить на год или дольше, чтобы позволить вашему организму более полно восстановиться после беременности.
В этой ситуации, согласно статье Frontiers in Surgery , отсрочка пластики грыжи на срок до пяти лет кажется безопасной, если вы продолжаете следить за увеличением грыжи и ее осложнениями. (2)
Сводка — Питание во время беременности
За 20 лет, прошедших с момента публикации исторического отчета Совета по пищевым продуктам и питанию Материнское питание и течение беременности (NRC, 1970), области питания и акушерства сильно изменились.Эти изменения, многие из которых были вызваны самим отчетом и работой последующих комитетов правления и Института медицины, включают расширение частных и государственных исследований, усиление преподавания перинатального питания студентам медицинских специальностей и возрождение интереса к прикладному питанию со стороны врачей акушерства и педиатрии. Также в этот период в США была учреждена Программа дополнительного питания для женщин, младенцев и детей (WIC).S. Министерство сельского хозяйства; отчеты о предотвращении низкой массы тела при рождении (IOM, 1985) и Prenatal Care (IOM, 1988) были опубликованы Институтом медицины; создана Национальная комиссия по предупреждению младенческой смертности; и отчет « Забота о нашем будущем»; Содержание «Пренатальный уход» № было выпущено Службой общественного здравоохранения (DHHS, 1989). Все эти события подчеркнули важность питания во время беременности и перинатального периода.
Повышение наглядности услуг по охране материнства в Соединенных Штатах также привлекло внимание ко многим пробелам и недостаткам в знаниях о питании матерей и о том, как последние результаты следует применять в дородовой помощи. Для устранения этих недостатков Совет по пищевым продуктам и питанию (FNB) в конце 1987 г. учредил Комитет по статусу питания во время беременности, питания и кормления грудью для проведения подробной оценки опубликованных данных. Комитет выполнил свою задачу, сформировав три подкомитета:
Статус питания и увеличение веса во время беременности. Потребление пищевых добавок во время беременности и статус питания во время кормления грудью.Родительский комитет, помимо координации работы своих подкомитетов, поддерживал тесную связь с Подкомитетом FNB по Десятому изданию Рекомендуемых диетических пособий, чтобы поддерживать последовательность в работе двух групп.
В целом комитет нашел несколько хорошо спланированных исследований и мало научных данных по многим важным вопросам. По этой причине в данной публикации подчеркнуты области, требующие дальнейших исследований. Пристальное внимание к информации в этих отчетах должно способствовать стимулированию как исследований, так и практики, направленных на достижение общей цели улучшения здоровья и благополучия матерей и детей в Соединенных Штатах.
Публикация включает два отчета. Часть I представляет собой критическую оценку данных, касающихся статуса питания и набора веса во время беременности. Часть II содержит анализ доказательств необходимости приема пищевых добавок во время беременности. Вторая публикация, посвященная питанию в период лактации, будет выпущена в конце 1990 года. Каждый из этих отчетов является ответом на конкретные запросы Бюро по охране здоровья матери и ребенка и развитию ресурсов Министерства здравоохранения и социальных служб США, которое финансировало исследование.Комитет ожидает, что материалы, представленные в трех отчетах, послужат основой для дополнительных публикаций, представляющих комплексный практический подход к оказанию диетической помощи при беременности и кормлении грудью.
Часть I: Статус питания и прибавка в весе
Общие цели подкомитета по статусу питания и весу во время беременности заключались в анализе научных данных, касающихся увеличения веса во время беременности, и в формулировании рекомендаций по увеличению веса во время беременности.Подкомитету было предложено ответить на следующие вопросы:
Как статус питания до беременности и потребление пищи во время беременности влияют на характер и общую прибавку в весе?
Какие антропометрические измерения могут быть полезны при оценке статуса питания во время беременности?
Как следует изменить рекомендации по увеличению массы тела для беременных чернокожих, латиноамериканцев и женщин из стран Юго-Восточной Азии, а также для тех, кто моложе 20 лет и старше 35 лет?
Часть I касается лишь ограниченного объема питания во время беременности.Он не включает многие другие элементы услуг по пренатальному питанию, такие как оценка и улучшение питательного качества рациона (кратко рассматривается в Части II этого тома), а также важность доступа к регулярному и достаточному количеству питательной пищи. разработка рациональных методов питания в семье, корректировка рациона питания матерей с острыми и хроническими заболеваниями, а также пропаганда грудного вскармливания и просвещение. Хотя подкомитет ограничил свой обзор своей обязанностью, он признал, что такой широкий спектр услуг по питанию является важной частью комплексной охраны материнского здоровья.
Подкомитет начал свою работу по отслеживанию тенденций в отдельных аспектах дородового ухода, статуса питания матери, а также течения и исходов беременности (например, рост плода при рождении, сохранение веса в послеродовом периоде). Затем он предпринял свои основные усилия — обширный критический обзор научной литературы. Были изучены эпидемиологические и клинические данные, касающиеся детерминант влияния увеличения веса на здоровье матери и ребенка. Это включало рассмотрение общего прироста, характера прироста и состава ткани.Были оценены практичность и полезность антропометрических измерений в клинических условиях. Подкомитет обратил пристальное внимание на новый анализ Национального обследования естественной естественности за 1980 год, который предоставляет единственные недавно представленные на национальном уровне данные США по прибавке в весе во время беременности, весу новорожденного и ряду характеристик матери.
Большая часть изученной литературы относится к женщинам, живущим в промышленно развитых странах. Данные были более полными для белых, чем для небелых.Выводы и рекомендации, представленные в этом отчете, относятся к здоровым женщинам в Соединенных Штатах; они не оценивались по отношению к женщинам в менее развитых странах или женщинам, недавно эмигрировавшим из этих стран в Соединенные Штаты.
Подкомитет уделил особое внимание разъяснению своих определений и изучению сильных и слабых сторон методов исследования.


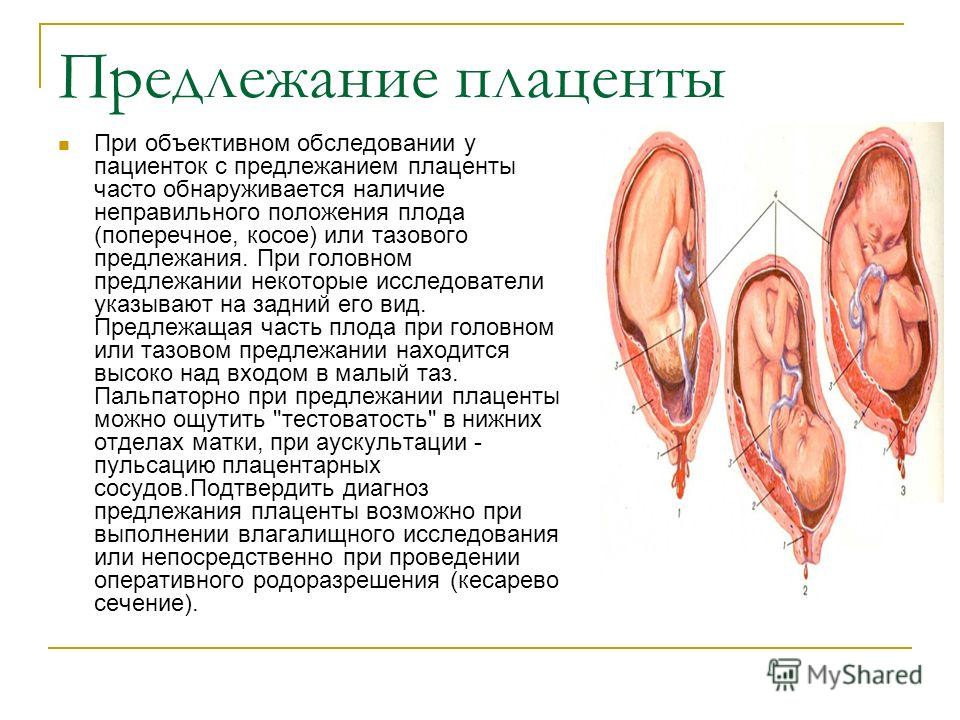 Родоразрешение проходит кесаревым сечением.
Родоразрешение проходит кесаревым сечением. ru
ru
 Полезны продукты с высоким содержанием железа, кальция, магния.
Полезны продукты с высоким содержанием железа, кальция, магния.
 Он хорошо тонизирует организм беременной, оказывает успокаивающее действие и бодрит по утрам. Его можно принимать около двух литров в день, если, конечно, нет отеков и гипертонии. Для этого нужно сварить чай из веточек малины, кипятя их несколько минут, а затем налить чай в чашку и добавить десять граммов имбиря и четверть лимонного сока.Пить этот чай вместо простой воды нужно несколько раз в день, затем можно немного полежать, закинув ноги на холм, чтобы улучшить приток крови к матке.
Он хорошо тонизирует организм беременной, оказывает успокаивающее действие и бодрит по утрам. Его можно принимать около двух литров в день, если, конечно, нет отеков и гипертонии. Для этого нужно сварить чай из веточек малины, кипятя их несколько минут, а затем налить чай в чашку и добавить десять граммов имбиря и четверть лимонного сока.Пить этот чай вместо простой воды нужно несколько раз в день, затем можно немного полежать, закинув ноги на холм, чтобы улучшить приток крови к матке. Для приготовления лечебного чая нужно взять 50 грамм зверобоя, его нужно варить на медленном огне пять-десять минут, а затем профильтровать. Пить этот чай нужно трижды в день по чайной ложке, можно до тридцать седьмой недели.
Для приготовления лечебного чая нужно взять 50 грамм зверобоя, его нужно варить на медленном огне пять-десять минут, а затем профильтровать. Пить этот чай нужно трижды в день по чайной ложке, можно до тридцать седьмой недели.
 Меры предосторожности — не принимать, если у вас аллергия на пыльцу липы.
Меры предосторожности — не принимать, если у вас аллергия на пыльцу липы.