Лимфосаркома средостения лечение в Москве, лимфосаркома средостения диагностика в клинике «Евроонко»
Под термином лимфома средостения понимают злокачественное новообразование, при котором происходит поражение медиастинальных лимфатических узлов. Различают первичные и вторичные лимфомы средостения. Первичные манифестируют именно с поражения медиастинальных лимфатических узлов. При вторичных, эти группы лимфоузлов поражаются в процессе распространения заболевания и развития метастазов.
Причины и группы риска
Чаще всего причины развития лимфомы средостения у конкретного пациента остаются неизвестными. Однако есть некоторые факторы, при наличии которых вероятность возникновения заболевания увеличивается. К ним относят:
- Наличие в анамнезе перенесенного мононуклеоза (вызывается вирусом Эпштейна-Барр).
- Вирусный гепатит С.
- Инфицирование ВИЧ.
- Аутоиммунные патологии: системная красная волчанка, ревматоидный артрит.
- Иммунодефицитные состояния как врожденные, так и приобретенные — синдром Вискота-Олдрича, Луи-Бара, иммуносупрессивная терапия при трансплантации оранов и др.

- Противоопухолевое лечение с помощью химиотерапии и лучевой терапии.
- Воздействие канцерогенов и неблагоприятных производственных и экологических факторов.
- Наследственная предрасположенность. Вероятность развития лимфомы средостения выше у людей, чьи близкие родственники страдали от каких-либо видов гемобластозов (лейкозы или лимфомы).
- Избыточное воздействие солнечного излучения.
Симптомы лимфомы средостения
На начальных стадиях, лимфомы средостения часто протекают бессимптомно, или же симптомы неспецифичны и могут быть приняты за признаки другого заболевания. Нередки случаи, когда единственным проявлением становится случайно обнаруженное на рентгенограмме или флюорограмме увеличение лимфатических узлов средостения.
Из других симптомов могут быть:
- Общее недомогание.
- Слабость и повышенная утомляемость.
- Снижение аппетита и похудение.
- Необъяснимое повышение температуры тела (не связанное с инфекционными заболеваниями).

- Ночная потливость.
- Зуд кожи.
- Сухой саднящий кашель.
Когда лимфоузлы достигнут определенной величины, может развиться компрессия органов грудной клетки, которая проявляется следующими признаками:
- Одышка.
- Учащенное сердцебиение.
- Затруднение глотания.
- Изменение голоса, его осиплость.
- Отечность лица и шеи.
- Расширение подкожных вен груди.
- Цианоз.
- У некоторых пациентов может развиваться экссудативный плеврит или хилоторакс (скопление лимфатической жидкости в плевральной полости).
Некоторые особенно агрессивные лимфомы средостения на последних стадиях могут прорастать в грудную стенку, перикард или диафрагму.
Стадии лимфомы
Лимфома является системным заболеванием. При прогрессировании она может поражать всю лимфатическую систему и даже выходить за ее пределы, распространяясь на внелимфатические органы и ткани.
Если на начальных стадиях при лимфоме средостения имеется поражение только медиастинальных лимфатических узлов, то по мере распространения, в процесс вовлекаются другие группы.
- 1 стадия — поражена одна лимфатическая зона, т. е. увеличены только медиастинальные лимфоузлы.
- 2 стадия — имеется поражение лимфоузлов двух зон по одну сторону диафрагмы, например, увеличены медиастинальные лимфоузлы и надключичные.
- 3 стадия — имеются единичные очаги поражения по обе стороны диафрагмы.
- 4 стадия — имеются множественные очаги поражения по обе стороны диафрагмы.
Виды
Лимфомы средостения — это разнородная и довольно обширная группа заболеваний. Ее можно разделить на две большие части — ходжкинскинские лимфомы (лимфогранулематоз) и неходжкинские.
Ходжкинская лимфома получила свое название в честь врача, который первым предложил выделить данное заболевание в отдельную нозологическую группу. Основным ее отличием от других видов опухолей лимфатической системы является наличие клеток Березовского-Штернберга.
Неходжкинские лимфомы представляют собой очень большую и разнородную группу опухолей.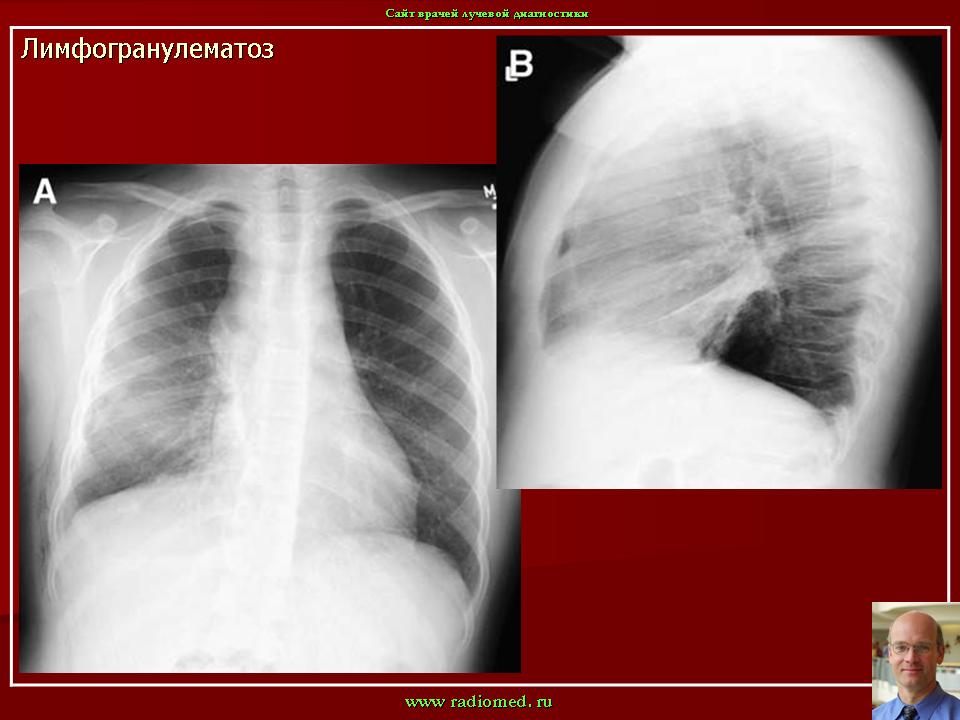 В зависимости от того, из какого пула клеток произрастает новообразование, выделяют Т-клеточные и В-клеточные лимфомы. Каждая из этих разновидностей, в свою очередь, делится на подгруппы.
В зависимости от того, из какого пула клеток произрастает новообразование, выделяют Т-клеточные и В-клеточные лимфомы. Каждая из этих разновидностей, в свою очередь, делится на подгруппы.
Диагностика
Для обнаружения увеличенных узлов в средостении применяются различные методы медицинской визуализации — рентгенография органов грудной клетки в разных проекциях, компьютерная томография, УЗИ средостения, МРТ. Как правило, требуется применение сразу нескольких методов обследования, поскольку каждый из них имеет свои ограничения. В ряде случаев может назначаться лимфосцинтиграфия — исследование лимфатической системы с помощью лимфотропных радионуклидных препаратов, которые отслеживаются с помощью специального сканера. Это исследование позволяет более детально визуализировать лимфатические протоки и узлы.
Для определения тактики лечения необходимо знать гистологический тип опухоли, поэтому необходимо проведение биопсии. Если имеются увеличенные лимфоузлы, доступные для пальпации, проводят их пункционную или эксцизионую биопсию.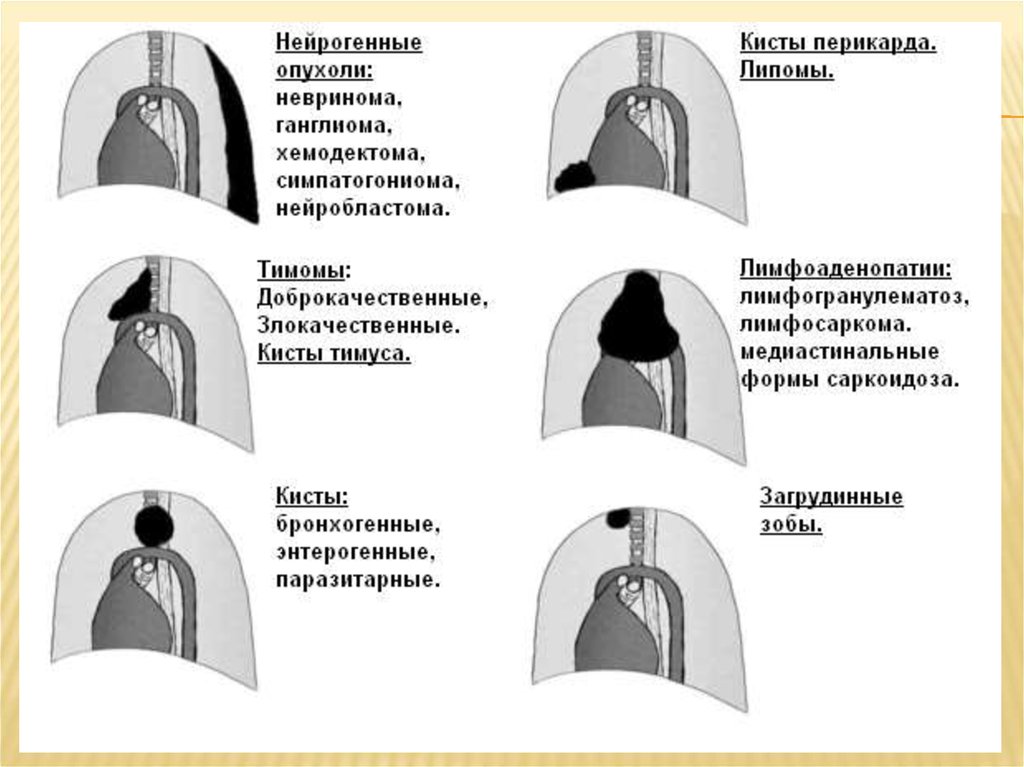 Для биопсии внутренних лимфоузлов проводят медиастиноскопию или медиастинотомию — хирургическое вмешательство на полости средостения.
Для биопсии внутренних лимфоузлов проводят медиастиноскопию или медиастинотомию — хирургическое вмешательство на полости средостения.
Лечение
Методы лечения лимфомы средостения определяются гистологическим вариантом опухоли и стадией заболевания. Может применяться химиотерапия, лучевая терапия и иногда хирургическое лечение.
Химиотерапия
Химиотерапия является основным методом лечения подавляющего большинства лимфом средостения. Выбор схемы будет зависеть от гистологического вида опухоли и ее индивидуальных молекулярных особенностей. В целом лечение состоит из нескольких блоков. Сначала назначаются препараты в высоких дозах, чтобы уничтожить максимальное количество злокачественных клеток. Потом, после достижения ремиссии, еще какое-то время проводят поддерживающее лечение, направленное на уцелевшие опухолевые клетки.
Лучевая терапия
Лучевая химиотерапия дает хороший эффект при локальном лимфогранулематозе средостения. Также на нее хорошо реагируют и лимфосаркомы. Кроме этого, лучевая терапия может применяться в рамках комбинированного лечения других морфологических типов лимфом (химиолучевая терапия), или в качестве паллиативного лечения для уменьшения объема увеличенных лимфоузлов и облегчения тягостных симптомов.
Кроме этого, лучевая терапия может применяться в рамках комбинированного лечения других морфологических типов лимфом (химиолучевая терапия), или в качестве паллиативного лечения для уменьшения объема увеличенных лимфоузлов и облегчения тягостных симптомов.
Хирургическое лечение
Хирургия может использоваться при локализованных формах лимфомы средостения. При этом удаляются пораженные лимфоузлы (тотальная биопсия). В ряде случаев такие вмешательства целесообразно проводить после химиотерапии или химиолучевой терапии.
Трансплантация костного мозга
При рецидиве или прогрессировании лимфомы на фоне химиотерапии необходимо более серьезное воздействие на опухоль — высокодозная полихимиотерапия. Это лечение очень агрессивное и приводит не только к гибели злокачественных клеток, но и опустошению костного мозга и, как следствие, к угнетению кроветворения. В результате развивается тяжелая анемия, глубокий иммунодефицит и множественные кровотечения. Чтобы компенсировать это состояние, пациенту делают трансплантацию гемопоэтических стволовых клеток (ГСК).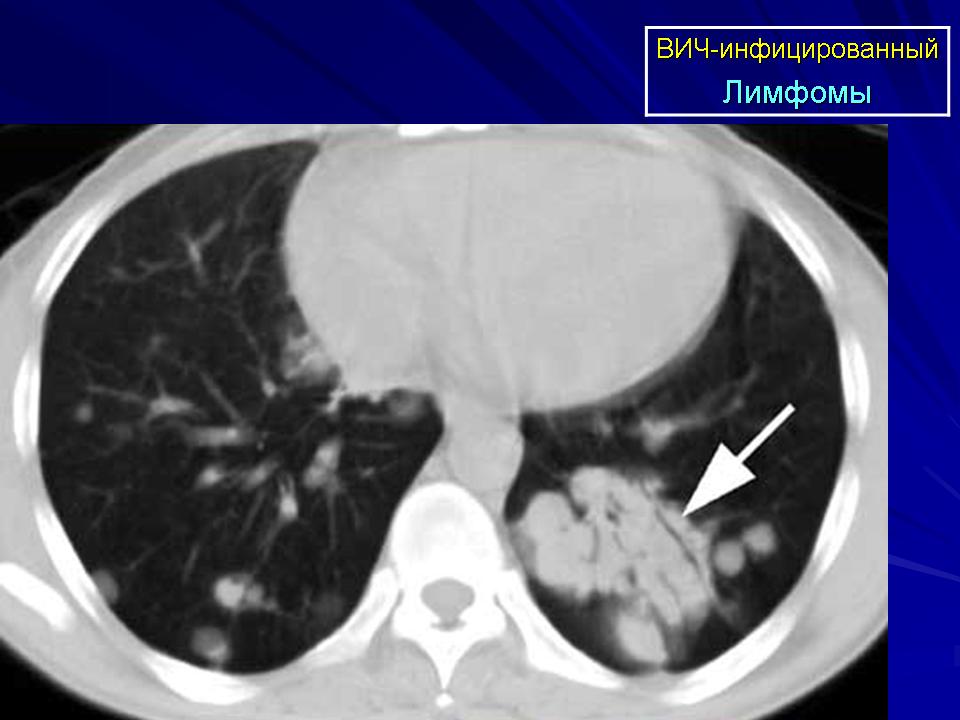 Они заселяют костный мозг и восстанавливают кроветворение.
Они заселяют костный мозг и восстанавливают кроветворение.
ГСК могут брать у самого пациента на этапе консолидации ремиссии. Такая трансплантация называется аутологичной. Также клетки могут быть взяты от донора. В этом случае трансплантация называется аллогенной. У каждого из этих методов есть свои преимущества и недостатки, поэтому выбор трансплантата осуществляется индивидуально, с учетом клинической ситуации и возможностей поиска донора.
Течение заболевания у пожилых
В большинстве случаев у пожилых пациентов лимфомы характеризуются более неблагоприятным прогнозом, чем у молодых. Это связывают со следующими факторами:
- В пожилом возрасте чаще возникают более агрессивные и сложно поддающиеся лечению лимфомы.
- Возможности лечения пожилых пациентов могут быть ограничены ввиду наличия сопутствующей патологии. В частности, они могут не перенести агрессивную химиотерапию, или ее риски могут превышать возможную пользу.
- У многих пожилых людей имеются хронические заболевания сердца и дыхательной системы, течение которых осложняется при увеличении медиастинальных лимфатических узлов.

Лимфома и беременность
При лимфомах рекомендуется применять надежные методы контрацепции как во время лечения, так и в течение 2 лет после его окончания. Если заболевание диагностируется во время беременности, тактика определяется индивидуально с учетом состояния пациентки и ее диагноза.
Если речь идет об индолентных (медленно текущих формах) лимфомах, рекомендуют регулярное наблюдение и к лечению приступают только после прогрессирования патологии. В других случаях лечение начинают немедленно, поскольку затягивание сроков может привести к распространению болезни и усугублению состояния больной.
Если беременность диагностирована в 1 триместре, рекомендуют прерывание. На остальных сроках проводят химиотерапию, которую подбирают с учетом возможности проникновения препаратов через плацентарный барьер. За 2-3 недели до предполагаемых родов терапию отменяют, чтобы восстановился костный мозг и показатели крови. Это необходимо для уменьшения осложнений при родах (кровотечения).
При постановке диагноза лимфома в 3 триместре беременности, может быть два варианта развития событий:
- Тактика аналогичная 2 триместру беременности.
- Если срок гестации уже большой (32-33 недели), а пациентка категорически отказывается от химиотерапии на фоне беременности, можно рекомендовать досрочное родоразрешение с началом химиотерапии через 2-3 недели после родов.
Риски развития врожденных пороков развития и осложнений родов аналогичны общепопуляционным.
Осложнения лимфомы средостения
При прогрессировании лимфома средостения может приводить к компрессии органов грудной клетки с развитием характерных осложнений: сердечно-легочная недостаточность, нарушение глотания, плевриты и др. Неблагоприятным признаком является переход лимфомы на внелимфатические органы, например, на костный мозг или нервную систему.
Прогноз и профилактика
Прогноз лимфомы средостения зависит от гистологического варианта опухоли и стадии заболевания. Например, при локальных формах лимфогранулематоза 5-летняя выживаемость достигает 90%. А вот при 4 стадии заболевания, когда имеются множественные метастазы или внелимфатические очаги поражения, 5-летняя выживаемость составляет около 45%.
Например, при локальных формах лимфогранулематоза 5-летняя выживаемость достигает 90%. А вот при 4 стадии заболевания, когда имеются множественные метастазы или внелимфатические очаги поражения, 5-летняя выживаемость составляет около 45%.
При неходжкинских лимфомах более благоприятный прогноз отмечается у агрессивных форм заболевания, поскольку у таких больных есть высокие шансы добиться полной ремиссии при высокодозной химиотерапии. А вот при индолентных, медленно текущих лимфомах, лечение часто оказывается недостаточно эффективным, лимфома приобретает резистентность к химиопрепаратам и начинает прогрессировать. В этой связи рекомендуют тактику активного наблюдения и химиотерапию назначают только при ухудшении состояния больного, чтобы избежать устойчивости к такому воздействию.
Запись на консультацию круглосуточно
+7 (495) 668-82-28
Дифференциальная диагностика лимфом средостения
Опухоли средостения (тимомы, карциномы тимуса, нейроэндокринные, герминогенные опухоли и др.
Лимфомы средостения возникают, как правило, у людей молодого возраста и являются высококурабельным заболеванием при своевременной и точной постановке морфологического диагноза, только на основании которого возможен подбор оптимального лечения.
Манифестация болезни происходит в виде появления медиастинальной массы, локализованной в переднем, верхнем или среднем средостении.
У большинства пациентов наблюдаются симптомы, вызванные наличием медиастинального образования:
- одышка
- общая слабость
- кашель
- синдром компрессии верхней полой вены
- cимптомы интоксикации– B-симптомы (лихорадка выше 38 °С, профузные ночные поты и потеря массы тела более 10% в течение 6 месяцев) наблюдаются менее чем у половины пациентов
Существуют объективные трудности клинической и морфологической диагностики опухолей средостения,
особенно лимфоидной природы. Получить диагностический материал сложно, для этого используют
различные виды биопсий, но полученный материал зачастую небольшого объема и деформирован. Помимо
малого количества и деформации материала, что само по себе затрудняет морфологическую
диагностику, лимфомы средостения демонстрируют значительную вариабельность гистологических и
цитологических изменений, что влечет за собой необходимость выполнения иммуногистохимического
исследования во всех случаях (рис.8,9).
Получить диагностический материал сложно, для этого используют
различные виды биопсий, но полученный материал зачастую небольшого объема и деформирован. Помимо
малого количества и деформации материала, что само по себе затрудняет морфологическую
диагностику, лимфомы средостения демонстрируют значительную вариабельность гистологических и
цитологических изменений, что влечет за собой необходимость выполнения иммуногистохимического
исследования во всех случаях (рис.8,9).
При поражении органов средостения рентгенологическая и клиническая картина неспецифичны (рис.1), только развернутый гистологический диагноз позволяет определиться с тактикой и подобрать эффективную терапию.
Спектр лимфом, возникающих в средостении, широк (рис.2,3,4,5,6,7), чаще всего это:
- лимфома Ходжкина
- первичная медиастинальная крупноклеточная В-клеточная лимфома,
- диффузная крупноклеточная В-клеточная лимфома
- медиастинальная лимфома серой зоны
- индолентные неходжкинские лимфомы
- Т-клеточные лимфомы
Рисунок 1а.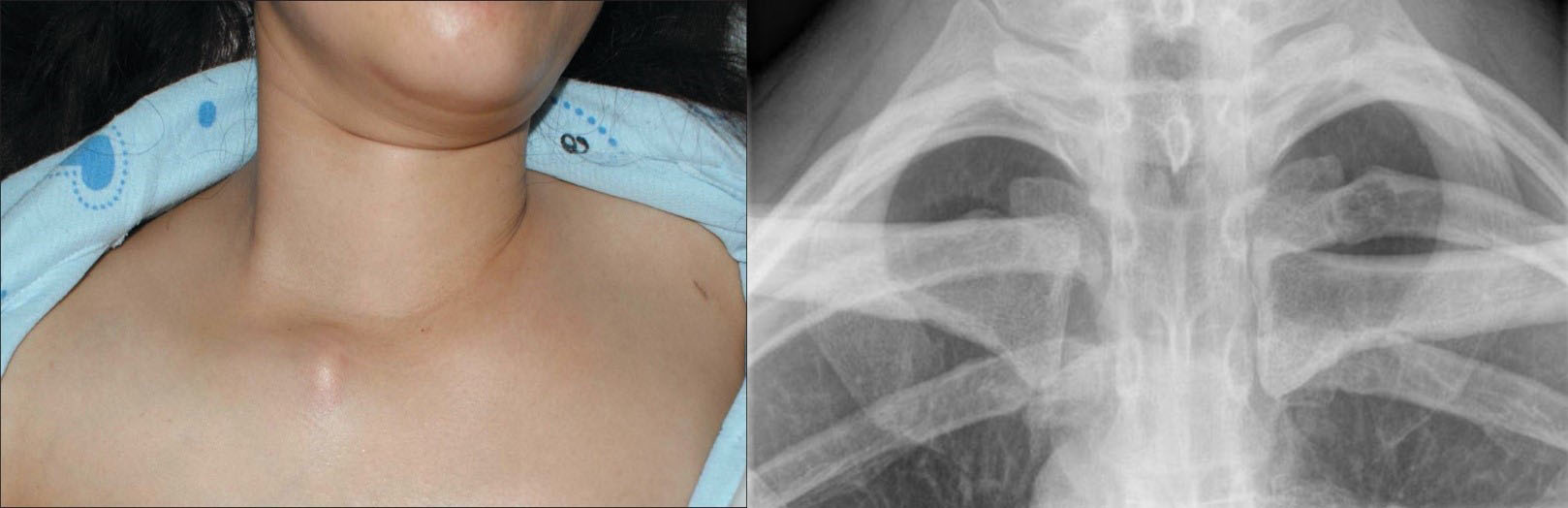 Компьютерная томография пациента К, 31 лет с
медиастинальным образованием (НМИЦ онкологии им. Н.Н. Петрова), аксиальная
плоскость.
Компьютерная томография пациента К, 31 лет с
медиастинальным образованием (НМИЦ онкологии им. Н.Н. Петрова), аксиальная
плоскость.
Рисунок 1б. Компьютерная томография пациента К, 31 лет с медиастинальным образованием (НМИЦ онкологии им. Н.Н. Петрова), сагитальная плоскость.
Рисунок 1в. Компьютерная томография пациента К, 31 лет с медиастинальным образованием (НМИЦ онкологии им. Н.Н. Петрова), фронтальная плоскость.
Рисунок 2. Лимфобластный лимфомалейкоз (Гематоксилин-эозин, х200, НМИЦ онкологии им. Н.Н. Петрова).
Рисунок 3. Анапластическая крупноклетоная лимфома. (Гематоксилин-эозин, х200, НМИЦ онкологии им. Н.Н. Петрова).
Рисунок 4. Диффузная крупноклеточная В-клеточная лимфома. (Гематоксилин-эозин, х200, НМИЦ онкологии им. Н.Н. Петрова).
(Гематоксилин-эозин, х200, НМИЦ онкологии им. Н.Н. Петрова).
Рисунок 5. Первичная медиастинальная крупноклеточная В-клеточная лимфома. (Гематоксилин-эозин, х200, НМИЦ онкологии им. Н.Н. Петрова).
Рисунок 6. В-клеточная лимфома маргинальной зоны, ассоциированная с лимфоидной тканью слизистых оболочек (MALT-лимфома, Гематоксилин-эозин, х200, НМИЦ онкологии им. Н.Н. Петрова).
Рисунок 7. Классическая лимфома Ходжкина. (Гематоксилин-эозин, х200, НМИЦ онкологии им. Н.Н. Петрова).
Рисунок 8. Алгоритм дифференциальной диагностики ПМКВЛ и ДВКЛ. ПМВЛ – первичная медиастинальная крупноклеточная В-клеточная лимфома; ДВКЛ – диффузная крупноклеточная В-клеточная лимфома; МЛСЗ – медиастинальная лимфома серой зоны.
Рисунок 9. Алгоритм дифференциальной диагностики ПМКВЛ и ЛХ. ПМВЛ –
первичная медиастинальная крупноклеточная В-клеточная лимфома; ХЛ – лимфома
Ходжкина; МЛСЗ – медиастинальная лимфома серой зоны.
Алгоритм дифференциальной диагностики ПМКВЛ и ЛХ. ПМВЛ –
первичная медиастинальная крупноклеточная В-клеточная лимфома; ХЛ – лимфома
Ходжкина; МЛСЗ – медиастинальная лимфома серой зоны.
Источник: http://www.med-sovet.pro/jour/article/view/1897/1836
Материал подготовлен: Харченко Евгения Владимировна
Показатели выживаемости и факторы, влияющие на прогноз (прогноз) неходжкинской лимфомы
Показатели выживаемости могут дать вам представление о том, какой процент людей с таким же типом и стадией рака все еще жив в течение определенного периода времени (обычно 5 лет). ) после постановки диагноза. Они не могут сказать вам, как долго вы будете жить, но они могут помочь вам лучше понять, насколько вероятно, что ваше лечение будет успешным.
Имейте в виду, что показатели выживаемости являются оценочными и часто основаны на предыдущих исходах большого количества людей, у которых был определенный рак, но они не могут предсказать, что произойдет в каждом конкретном случае. Эти статистические данные могут сбить с толку и вызвать у вас дополнительные вопросы. Спроси у наш врач , который знаком с вашей ситуацией , как эти номера могут относиться к вам .
Эти статистические данные могут сбить с толку и вызвать у вас дополнительные вопросы. Спроси у наш врач , который знаком с вашей ситуацией , как эти номера могут относиться к вам .
Что такое 5-летняя относительная выживаемость?
Относительная выживаемость сравнивает людей с таким же типом и стадией неходжкинской лимфомы (НХЛ) с людьми в общей популяции. Например, если 5-летняя относительная выживаемость для конкретной стадии НХЛ составляет 70 %, это означает, что у людей с этим раком вероятность заболевания в среднем примерно на 70 % выше, чем у людей, у которых нет этого рака. прожить не менее 5 лет после постановки диагноза.
Откуда берутся эти цифры?
Американское онкологическое общество опирается на информацию из базы данных наблюдения, эпидемиологии и конечных результатов (SEER), поддерживаемой Национальным институтом рака (NCI), для получения статистических данных о выживаемости при различных типах рака.
База данных SEER отслеживает 5-летнюю относительную выживаемость при НХЛ в США в зависимости от того, насколько далеко распространился рак. Однако база данных SEER не группирует рак по классификации Лугано (стадия 1, стадия 2, стадия 3 и т. д.). Вместо этого он группирует рак по локализованным, регионарным и отдаленным стадиям:
- Локализованный: Рак ограничен областью одного лимфатического узла, одним лимфоидным органом или одним органом вне лимфатической системы.
- Региональный: Рак распространяется от одной области лимфатических узлов до близлежащего органа, обнаруживается в двух или более областях лимфатических узлов на одной стороне (выше или ниже) диафрагмы или считается объемным заболеванием.
- Отдаленные: Рак распространился на отдаленные части тела, такие как легкие, печень или костный мозг, или на области лимфатических узлов выше и ниже диафрагмы.
5-летняя относительная выживаемость при НХЛ
Общая 5-летняя относительная выживаемость людей с НХЛ составляет 74%.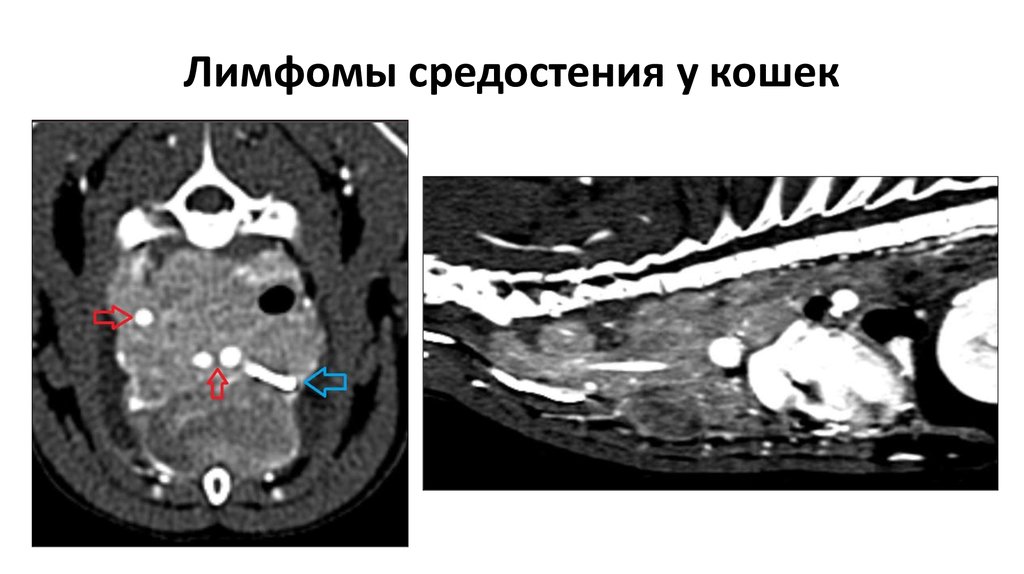 Но важно иметь в виду, что показатели выживаемости могут сильно различаться для разных типов и стадий лимфомы.
Но важно иметь в виду, что показатели выживаемости могут сильно различаться для разных типов и стадий лимфомы.
Ниже приведены 5-летние показатели относительной выживаемости для двух наиболее распространенных типов НХЛ — диффузной крупноклеточной В-клеточной лимфомы (ДВККЛ) и фолликулярной лимфомы (ФЛ) — на основе данных о людях, которым был поставлен диагноз в период с 2012 по 2018 год.
В-клеточная лимфома
Стадия ВИДЯЩЕЙ | Пятилетняя относительная выживаемость |
Локализованный | 73% |
Региональный | 74% |
Дальний | 58% |
Все этапы SEER вместе взятые | 65% |
Фолликулярная лимфома
Стадия SEER | Пятилетняя относительная выживаемость |
Локализованный | 97% |
Региональный | 91% |
Дальний | 87% |
Все этапы SEER вместе взятые | 90% |
Расшифровка номеров
- Эти номера относятся только к стадии лимфомы, когда она впервые диагностирована.
 Они не применяются в дальнейшем, если рак растет, распространяется или возвращается после лечения.
Они не применяются в дальнейшем, если рак растет, распространяется или возвращается после лечения. - У людей, у которых в настоящее время диагностирована НХЛ, прогноз может быть лучше, чем показывают эти цифры. Со временем методы лечения улучшились, и эти цифры основаны на данных о людях, которые были диагностированы и пролечены не менее 5 лет назад.
- Эти цифры не учитывают всего. Показатели выживаемости сгруппированы в зависимости от того, насколько далеко распространился рак, но ваш возраст и общее состояние здоровья, тип вашей НХЛ, насколько хорошо она реагирует на лечение, а также другие факторы (см. ниже) также могут повлиять на ваш прогноз.
Прогностические факторы неходжкинской лимфомы
Для некоторых типов лимфомы стадия не слишком полезна для определения прогноза (перспективы). В этих случаях другие факторы могут дать врачам лучшее представление о прогнозе человека.
Международный прогностический индекс (IPI)
Международный прогностический индекс (IPI) был впервые разработан, чтобы помочь врачам определить перспективы для людей с быстрорастущими (агрессивными) лимфомами. Тем не менее, он оказался полезным и для большинства других лимфом (кроме медленно растущих [индолентных] фолликулярных лимфом, которые обсуждаются ниже). IPI позволяет врачам планировать лечение лучше, чем они могли бы просто на основе типа и стадии лимфомы. Это стало более важным, поскольку были разработаны новые, более эффективные методы лечения, которые иногда имеют больше побочных эффектов. Индекс помогает врачам выяснить, нужны ли эти методы лечения.
Тем не менее, он оказался полезным и для большинства других лимфом (кроме медленно растущих [индолентных] фолликулярных лимфом, которые обсуждаются ниже). IPI позволяет врачам планировать лечение лучше, чем они могли бы просто на основе типа и стадии лимфомы. Это стало более важным, поскольку были разработаны новые, более эффективные методы лечения, которые иногда имеют больше побочных эффектов. Индекс помогает врачам выяснить, нужны ли эти методы лечения.
Показатель зависит от 5 факторов:
- Возраст пациента
- Стадия лимфомы
- Независимо от того, находится ли лимфома в органах вне лимфатической системы
- Состояние работоспособности (PS) — насколько хорошо человек может выполнять обычные повседневные действия
- Уровень лактатдегидрогеназы (ЛДГ) в крови, который увеличивается с количеством лимфомы в организме
Хорошие прогностические факторы | Факторы неблагоприятного прогноза |
Возраст 60 лет и младше | Возраст старше 60 лет |
Этап I или II | Стадия III или IV |
Отсутствие лимфомы вне лимфатических узлов или лимфома только в 1 области вне лимфатических узлов | Лимфома более чем в 1 органе тела за пределами лимфатических узлов |
PS: Может нормально функционировать | PS: Нуждается в помощи в повседневной деятельности |
ЛДГ в сыворотке в норме | Высокий уровень ЛДГ в сыворотке |
Каждому фактору неблагоприятного прогноза присваивается 1 балл. Люди без каких-либо неблагоприятных прогностических факторов будут иметь 0 баллов, а люди со всеми неблагоприятными прогностическими факторами будут иметь 5 баллов. Индекс делит людей с лимфомами на 4 группы риска:
Люди без каких-либо неблагоприятных прогностических факторов будут иметь 0 баллов, а люди со всеми неблагоприятными прогностическими факторами будут иметь 5 баллов. Индекс делит людей с лимфомами на 4 группы риска:
- Низкий риск (0 или 1 неблагоприятный прогностический фактор)
- Низко-средний риск (2 неблагоприятных прогностических фактора)
- Высокий промежуточный риск (3 неблагоприятных прогностических фактора)
- Высокий риск (4 или 5 неблагоприятных прогностических факторов)
Международный прогностический индекс фолликулярной лимфомы (FLIPI)
IPI полезен для большинства лимфом, но не так полезен для фолликулярных лимфом, которые имеют тенденцию к более медленному росту. Врачи разработали Международный прогностический индекс фолликулярной лимфомы (FLIPI) специально для этого типа лимфомы. Он использует несколько иные прогностические факторы, чем IPI.
Хорошие прогностические факторы | Факторы неблагоприятного прогноза |
Возраст 60 лет и младше | Возраст старше 60 лет |
Этап I или II | Стадия III или IV |
Гемоглобин крови 12 г/дл или выше | Уровень гемоглобина в крови ниже 12 г/дл |
Поражено 4 или меньше лимфатических узлов | Поражение более 4 лимфатических узлов |
ЛДГ в сыворотке в норме | Высокий уровень ЛДГ в сыворотке |
Пациентам присваивается балл за каждый неблагоприятный прогностический фактор. Люди без каких-либо неблагоприятных прогностических факторов будут иметь 0 баллов, а люди со всеми неблагоприятными прогностическими факторами будут иметь 5 баллов. Затем индекс делит людей с фолликулярной лимфомой на 3 группы:
Люди без каких-либо неблагоприятных прогностических факторов будут иметь 0 баллов, а люди со всеми неблагоприятными прогностическими факторами будут иметь 5 баллов. Затем индекс делит людей с фолликулярной лимфомой на 3 группы:
- Низкий риск (отсутствие или 1 неблагоприятный прогностический фактор)
- Промежуточный риск (2 неблагоприятных прогностических фактора)
- Высокий риск (3 или более неблагоприятных прогностических фактора)
Как для IPI, так и для FLIPI у людей из группы низкого риска, как правило, прогноз лучше, чем у людей из группы высокого риска.
Текущие и перспективные варианты лечения первичных В-клеток средостения лимфома
1. Swerdlow SH, Campo E, Pileri SA, et al. Редакция 2016 г. Классификация лимфоидной ткани Всемирной организации здравоохранения новообразования. Кровь 2016; 127: 2375–2390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2.
Нгуен Л.Н., Ха К.С., Хесс М. и соавт. Результат
комбинированное лечение первичных крупных В-клеток I и II стадий
лимфома средостения. Int J Радиат Онкол Биол
Физ.
2000 г.; 47:
1281–1285 гг. [PubMed] [Google Scholar]
Int J Радиат Онкол Биол
Физ.
2000 г.; 47:
1281–1285 гг. [PubMed] [Google Scholar]
3. van Besien K, Kelta M, Bahaguna P. Первичная медиастинальная B-клеточная лимфома: обзор патологии и управления. Джей Клин Онкол 2001 г.; 19: 1855–1864 гг. [PubMed] [Google Scholar]
4. Бледсо Дж. Р., Редд Р. А., Хассерджян Р. П. и соавт. Иммунофенотипический спектр первичной медиастинальной крупноклеточной В-клеточной лимфомы выявляет прогностический биомаркеры, связанные с исходом. Ам Дж гематол 2016; 91: Е436–Е441. [PubMed] [Google Scholar]
5. Ким Х.Дж., Ким Х.К., Пак Джи и др. Сравнительная патология анализ В-клеточных лимфом средостения: селективная экспрессия р63, но нет GATA3 оптимально дифференцирует первичную средостенную крупноклеточную В-клеточную лимфому классической лимфомы Ходжкина. Диагност Патол 2019; 14: 133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6.
Лаззарино М., Орланди Э., Паулли М. и др. Первичные медиастинальные В-клетки
лимфома со склерозом: агрессивная опухоль с характерными клиническими и
патологические особенности. Джей Клин Онкол
1993; 11:
2306–2313. [PubMed] [Google Scholar]
Джей Клин Онкол
1993; 11:
2306–2313. [PubMed] [Google Scholar]
7. Родиг С.Дж., Сэвидж К.Дж., Нгуен В. и др. Экспрессия TRAF1 и c-Rel Активация является полезным дополнением в различении классической лимфомы Ходжкина. из подмножества морфологически или иммунофенотипически сходных лимфомы. Ам Дж. Сург Патол 2005 г.; 29: 196–203. [PubMed] [Google Scholar]
8. Копи-Бергман С., Плонке А., Алонсо М.А. и соавт. Экспрессия MAL в лимфоидных клеток: еще одно доказательство MAL как отдельного молекулярного маркера первичного Медиастинальные крупноклеточные В-клеточные лимфомы. мод Патол 2002 г.; 15: 1172–1180 гг. [PubMed] [Академия Google]
9. Дорфман Д.М., Шахсафаи А., Алонсо М.А. Полезность иммуноокрашивания CD200 в диагностике первичных медиастинальная крупноклеточная В-клеточная лимфома: сравнение с MAL, CD23 и другими маркеры. Мод Патол 2012 г.; 25: 1637–1643 гг. [PubMed] [Google Scholar]
10.
Guiter C, Dusanter-Fourt I, Copie-Bergman C, et al. Учредительный STAT6
активация при первичной медиастинальной крупноклеточной В-клеточной лимфоме.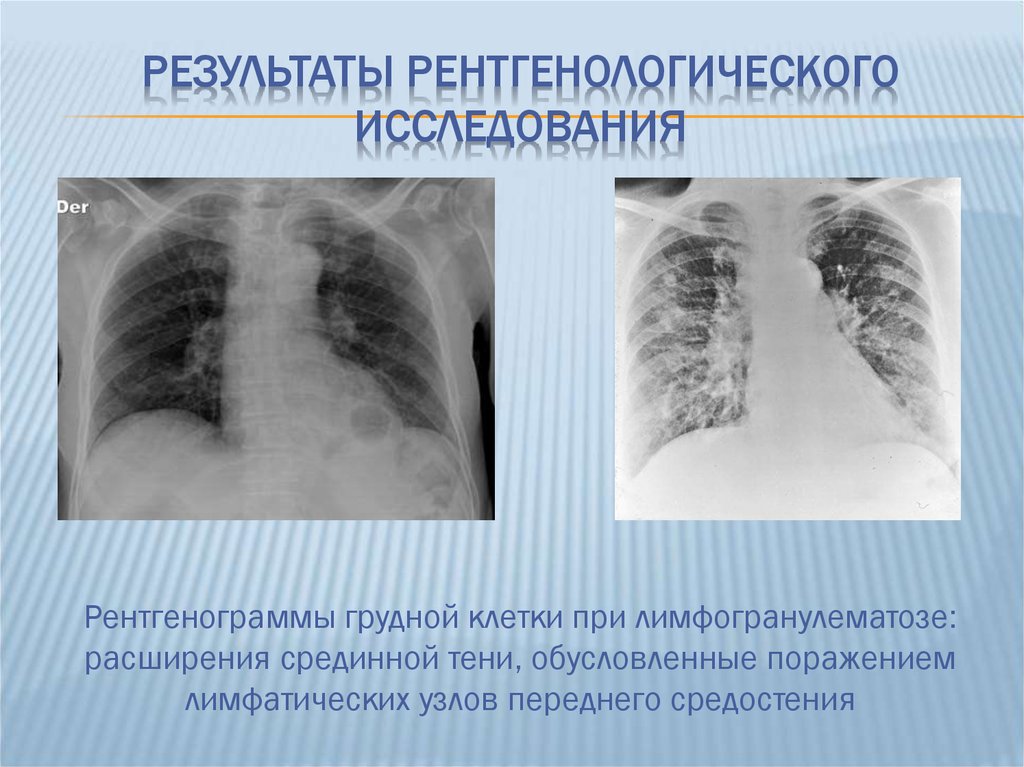 Кровь
2004 г.; 104:
543–549. [PubMed] [Google Scholar]
Кровь
2004 г.; 104:
543–549. [PubMed] [Google Scholar]
11. Розенвальд А., Райт Г., Лерой К. и др. Молекулярная диагностика первичная медиастинальная В-клеточная лимфома выявляет клинически благоприятный подгруппа диффузной крупноклеточной В-клеточной лимфомы, связанной с Ходжкином лимфома. J Эксперт Мед 2003 г.; 198: 851–862. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Savage KJ, Monti S, Kutok JL, et al. Молекулярная подпись Медиастинальная крупноклеточная В-клеточная лимфома отличается от других диффузных крупноклеточных лимфом. В-клеточные лимфомы имеют общие черты с классической лимфомой Ходжкина. лимфома. Кровь 2003 г.; 102: 3871–3879. [PubMed] [Google Scholar]
13. Тва Д.Д., Чан Ф.К., Бен-Нерия С. и др. Геномные перестройки с участием лигандов запрограммированной смерти, рецидивируют в первичных медиастинальных крупная В-клеточная лимфома. Кровь 2014; 123: 2062–2065 гг. [PubMed] [Академия Google]
14.
Джулино-Рот Л., О’Донохью Т., Чен З.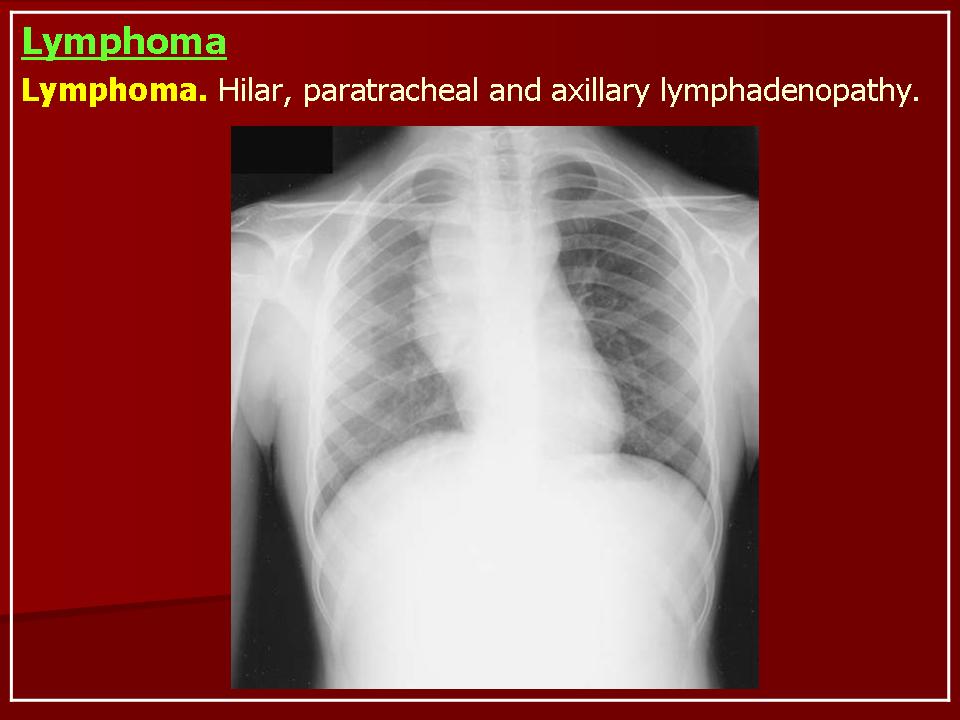 и др. Исходы взрослых и
дети с первичной медиастинальной В-клеточной лимфомой, получающие лечение с поправкой на дозу
ЭПОХА-Р. Бр Дж Гематол
2017; 179:
739–747. [Бесплатная статья PMC] [PubMed] [Google Scholar]
и др. Исходы взрослых и
дети с первичной медиастинальной В-клеточной лимфомой, получающие лечение с поправкой на дозу
ЭПОХА-Р. Бр Дж Гематол
2017; 179:
739–747. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Хейден А., Тонсет П., Ли Д.Г. и др. Результат первичной медиастинальная крупноклеточная В-клеточная лимфома с использованием R-CHOP: влияние адаптированного ПЭТ подход. Кровь 2020; 136: 2803–2811. [PubMed] [Google Scholar]
16. Мартелли М., Чериани Л., Зукка Э. и др. [18F] фтордезоксиглюкоза позитронно-эмиссионная томография предсказывает выживаемость после химиоиммунотерапии для первичная медиастинальная крупноклеточная В-клеточная лимфома: результаты Международного Исследовательская группа экстранодальной лимфомы IELSG-26 Исследование. Дж Клин Онкол 2014; 32: 1769 г.–1775. [PubMed] [Google Scholar]
17.
Мелани С., Адвани Р., Рощевски М. и др. Конец лечения и серийный
ПЭТ-визуализация при первичной медиастинальной В-клеточной лимфоме после коррекции дозы
EPOCH-R: изменение парадигмы в принятии клинических решений. гематологический
2018; 103:
1337–1344 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
гематологический
2018; 103:
1337–1344 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Вассилакопулос Т.П., Михаил М., Папагеоргиу С. и соавт. Выявление очень подгруппы низкого риска пациентов с первичными медиастинальными большими B-клетками лимфому лечили с помощью R-CHOP. Онколог 2021; 26: 597–609. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Хендерсон Т.О., Амстердам А., Бхатия С. и др. Регулярный обзор: наблюдение за раком молочной железы у женщин, получавших лучевую терапию для детский, подростковый или юношеский рак. Анна Интерн Мед 2010 г.; 152: 444–455; w144–w154. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Юсуф С.В., Венкатесулу Б.П., Махадеван Л.С. и соавт. Радиационно-индуцированный сердечно-сосудистые заболевания: клиническая перспектива. Фронт Кардиовас Мед 2017; 4: 66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21.
Pinnix CC, Smith GL, Milgrom S, et al. Предикторы радиации
пневмонит у пациентов, получающих лучевую терапию с модулированной интенсивностью для
Ходжкинская и неходжкинская лимфома.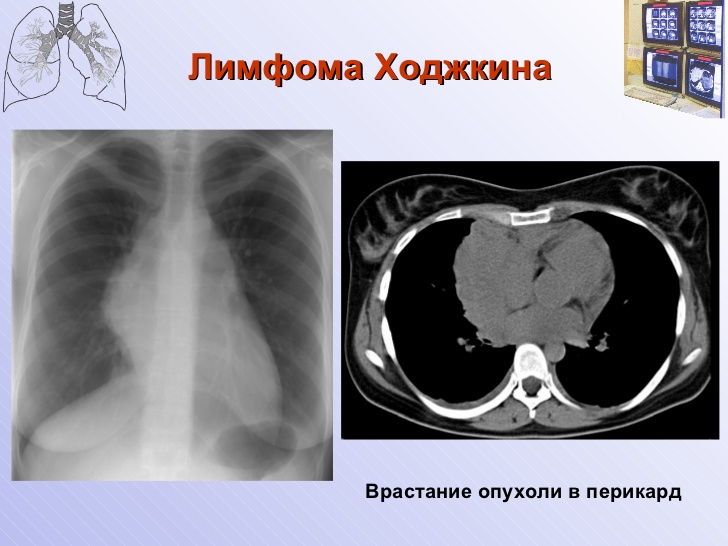 Int J Radiat Oncol
Биол Физ
2015 г.; 92:
175–182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Int J Radiat Oncol
Биол Физ
2015 г.; 92:
175–182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Шах Н.Н., Сабо А., Хантингтон С.Ф. и др. R-CHOP по сравнению с скорректированной дозой R-EPOCH на переднем крае лечения первичной медиастинальной В-клеточной лимфомы: многоцентровый анализ. Бр Дж Гематол 2018; 180: 534–544. [PubMed] [Академия Google]
23. Вассилакопулос Т.П., Пангалис Г.А., Кацигианнис А. и соавт. ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизолон с лучевой терапией или без нее в первичная медиастинальная крупноклеточная В-клеточная лимфома: развивающийся стандарт Забота. Онколог 2012 г.; 17: 239–249. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Данливи К., Питталуга С., Маэда Л.С. и др. с поправкой на дозу Терапия EPOCH-ритуксимабом при первичных В-клетках средостения лимфома. N Engl J Med 2013; 368: 1408–1416 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25.
Камю В., Берриоло-Ридингер А., Лекен Ж. и др. R-CHOP14 как стандарт
лечение первичной медиастинальной В-клеточной лимфомы: 10-летний опыт LYSA
центры. В: Ежегодное собрание ASH,
Сан-Диего, Калифорния, 5
Декабрь
2020. [Google Scholar]
R-CHOP14 как стандарт
лечение первичной медиастинальной В-клеточной лимфомы: 10-летний опыт LYSA
центры. В: Ежегодное собрание ASH,
Сан-Диего, Калифорния, 5
Декабрь
2020. [Google Scholar]
26. Тодескини Г., Секки С., Морра Э. и др. Первичный медиастинальный большой В-клеточная лимфома (PMLBCL): долгосрочные результаты ретроспективного многоцентрового исследования Итальянский опыт у 138 пациентов, получавших CHOP или МАКОП-Б/ВАКОП-Б. Бр Дж Рак 2004 г.; 90: 372–376. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Зинзани П.Л., Мартелли М., Бертини М. и др. Индукционная химиотерапия стратегии лечения первичной медиастинальной крупноклеточной В-клеточной лимфомы со склерозом: ретроспективное многонациональное исследование с участием 426 человек, ранее не получавших лечения пациенты. гематологический 2002 г.; 87: 1258–1264 гг. [PubMed] [Google Scholar]
28.
Вассилакопулос Т.П., Папагеоргиу С.Г., Ангелопулу М.К. и соавт. Позитронно-эмиссионная томография
после ответа на ритуксимаб-СНОР в первичных крупных В-клетках средостения
лимфома: влияние на результаты и стратегии лучевой терапии. Энн Хематол
2021; 100:
2279–2292. [PubMed] [Google Scholar]
Энн Хематол
2021; 100:
2279–2292. [PubMed] [Google Scholar]
29. Шмитц Н., Зейналова С., Никельсен М. и соавт. CNS International Prognostic Индекс: модель риска рецидива ЦНС у пациентов с диффузной крупноклеточной В-клеткой лимфому лечили с помощью R-CHOP. Джей Клин Онкол 2016; 34: 3150–3156. [PubMed] [Google Scholar]
30. Беме В., Шмитц Н., Зейналова С. и др. События со стороны ЦНС у пожилых людей пациенты с агрессивной лимфомой, получающие современную химиотерапию (CHOP-14) с ритуксимабом или без него: анализ пациентов, получавших лечение в RICOVER-60 исследование Немецкой исследовательской группы неходжкинской лимфомы высокой степени злокачественности (ДШНХЛ). Кровь 2009 г.; 113: 3896–3902. [PubMed] [Google Scholar]
31.
Папагеоргиу С.Г., Диамантопулос П., Левиду Г. и соавт. Изолированная центральная нервная
системные рецидивы при первичной крупноклеточной В-клеточной лимфоме средостения после CHOP-подобного
химиотерапия с ритуксимабом или без него. гематол
Онкол
2013; 31:
10–17. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
32. Soumerai JD, Hellmann MD, Feng Y, et al. Лечение первичной медиастинальная В-клеточная лимфома с ритуксимабом, циклофосфамидом, доксорубицином, винкристин и преднизолон связаны с высокой частотой первичных рефрактерное заболевание. Лейк-лимфома 2014; 55: 538–543. [PubMed] [Академия Google]
33. Hamlin PA, Portlock CS, Straus DJ и др. Первичный медиастинальный большой В-клеточная лимфома: оптимальная терапия и анализ прогностических факторов у 141 последовательных пациентов, лечившихся в Мемориальном центре Слоана Кеттеринга с 1980 по 1999. Бр Дж. Гематол 2005 г.; 130: 691–699. [PubMed] [Google Scholar]
34. Лаззарино М., Орланди Э., Паулли М. и др. Результат лечения и прогностические факторы первичной медиастинальной (тимусной) В-клеточной лимфомы: многоцентровое исследование 106 пациентов. Джей Клин Онкол 1997 год; 15: 1646–1653 гг. [PubMed] [Академия Google]
35.
Сен Л.Х., Антин Дж.Х., Шульман Л.Н. и др. Первичные диффузные крупные В-клетки
лимфома средостения: исход после высокодозной химиотерапии и
трансплантация аутологичных гемопоэтических клеток.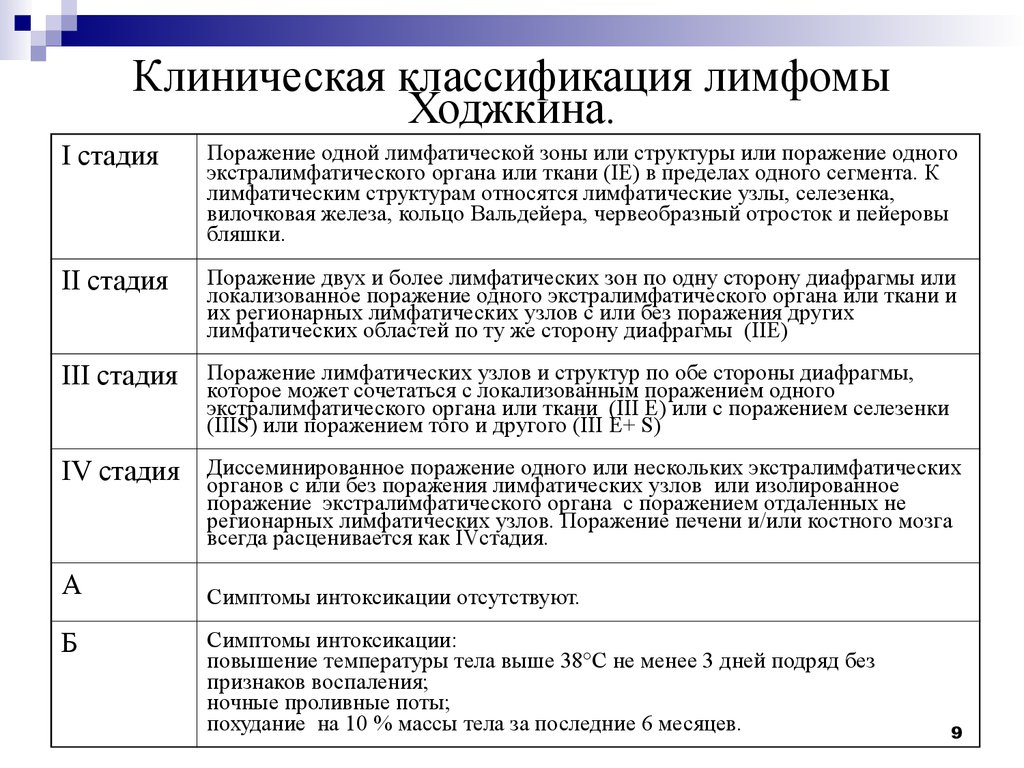 Кровь
1998 год; 91:
717–723. [PubMed] [Google Scholar]
Кровь
1998 год; 91:
717–723. [PubMed] [Google Scholar]
36. Moskowitz CH, Nademanee A, Masszi T, et al. Брентуксимаб ведотин как консолидирующая терапия после аутологичной трансплантации стволовых клеток у пациентов с лимфомой Ходжкина с риском рецидива или прогрессирования (AETHERA): рандомизированное, двойное слепое, плацебо-контролируемое исследование 3 фазы. Ланцет 2015 г.; 385: 1853–1862 гг. [PubMed] [Академия Google]
37. Про Б., Адвани Р., Брайс П. и др. Итоги пятилетки брентуксимаб ведотин у пациентов с рецидивирующим или рефрактерным системным анапластическая крупноклеточная лимфома. Кровь 2017; 130: 2709–2717. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Стейдл С., Гаскойн Р.Д. Молекулярный патогенез первичной медиастинальной крупноклеточной В-клетки лимфома. Кровь 2011 г.; 118: 2659–2669. [PubMed] [Google Scholar]
39.
Zinzani PL, Pellegrini C, Chiappella A, et al. Брентуксимаб ведотин в
рецидив первичной крупноклеточной В-клеточной лимфомы средостения: результат фазы 2
клиническое испытание. Кровь
2017; 129:
2328–2330. [PubMed] [Google Scholar]
Кровь
2017; 129:
2328–2330. [PubMed] [Google Scholar]
40. Якобсен Э.Д., Шарман Дж.П., Оки Ю. и др. Брентуксимаб ведотин демонстрирует объективные ответы в фазе 2 исследования рецидивирующего/рефрактерного DLBCL с вариабельной экспрессией CD30. Кровь 2015 г.; 125: 1394–1402 гг. [PubMed] [Google Scholar]
41. Грин М.Р., Монти С., Родиг С.Дж. и др. Интегративный анализ показывает селективная амплификация 9p24.1, повышенная экспрессия лиганда PD-1 и дальнейшая индукция через JAK2 при узловой склерозирующей лимфоме Ходжкина и первичная медиастинальная крупноклеточная В-клеточная лимфома. Кровь 2010 г.; 116: 3268–3277. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Ремер М.Г., Адвани Р.Х., Лигон А.Х. и соавт. Генетический PD-L1 и PD-L2 изменения определяют классическую лимфому Ходжкина и предсказывают исход. Джей Клин Онкол 2016; 34: 2690–2697. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43.
Чапуи Б., Ремер М.Г., Стюарт С. и соавт. Целевые генетические особенности
первичного яичка и первичной центральной нервной системы
лимфомы.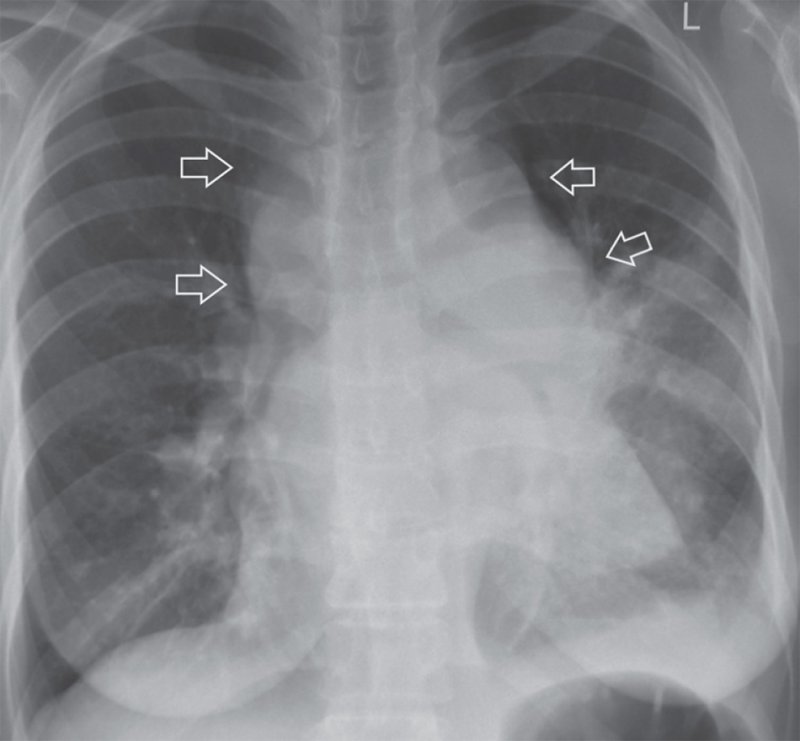 Кровь
2016; 127:
869–881. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кровь
2016; 127:
869–881. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Ши М., Ремер М.Г., Чапуй Б. и соавт. Выражение запрограммировано Лиганд 2 клеточной смерти 1 (PD-L2) является отличительной чертой первичной медиастинальная (тимусная) крупноклеточная В-клеточная лимфома, ассоциированная с копией PDCD1LG2 прирост. Ам Дж. Сург Патол 2014; 38: 1715–1723 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Ван Русбрук К., Феррейро Дж. Ф., Туссейн Т. и др. Геномные изменения Локусы JAK2 и PDL встречаются в широком спектре лимфоидных злокачественные новообразования. Гены Хромосомы Рак 2016; 55: 428–441. [PubMed] [Google Scholar]
46. Wang Y, Wenzl K, Manske MK, et al. Амплификация 9p24.1 в диффузная крупноклеточная В-клеточная лимфома определяет уникальное подмножество случаев, напоминают первичную медиастинальную крупноклеточную В-клеточную лимфому. Рак крови J 2019; 9: 73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47.
Анселл С.М. , Лесохин А.М., Боррелло И. и др. Блокада PD-1 ниволумабом
при рецидивирующей или рефрактерной лимфоме Ходжкина. Н англ
Джей Мед
2015 г.; 372:
311–319. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Лесохин А.М., Боррелло И. и др. Блокада PD-1 ниволумабом
при рецидивирующей или рефрактерной лимфоме Ходжкина. Н англ
Джей Мед
2015 г.; 372:
311–319. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Арманд П., Шипп М.А., Рибраг В. и др. Запрограммированная смерть-1 блокада с пембролизумабом у пациентов с классической лимфомой Ходжкина после неэффективность брентуксимаба ведотина. Джей Клин Онкол 2016; 34: 3733–3739. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Чен Р., Зинзани П.Л., Фанале М.А. и соавт. Фаза II исследования Эффективность и безопасность пембролизумаба при рецидивирующей/рефрактерной классической болезни Ходжкина лимфома. Джей Клин Онкол 2017; 35: 2125–2132 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50.
Юнес А., Санторо А., Шипп М. и др. Ниволумаб для классического
Лимфома Ходжкина после неудачи обеих аутологичных стволовых клеток
трансплантация и брентуксимаб ведотин: многоцентровая, многогрупповая,
одногрупповое испытание фазы 2. Ланцет Онкол
2016; 17:
1283–1294 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ланцет Онкол
2016; 17:
1283–1294 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Zinzani PL, Ribrag V, Moskowitz CH, et al. Фаза 1b исследования пембролизумаб у пациентов с рецидивирующим/рефрактерным поражением первичного средостения В-клеточная лимфома: результаты продолжающегося исследования Keynote-013. Кровь 2016; 128: 619–619. [Google Scholar]
52. Арманд П., Родиг С., Мельниченко В. и др. Пембролизумаб при рецидиве или рефрактерная первичная медиастинальная крупноклеточная В-клеточная лимфома. Джей Клин Онкол 2019; 37: 3291–3299. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Зинзани П.Л., Санторо А., Гритти Г. и др. Ниволумаб в сочетании с брентуксимаб ведотин при рецидиве/резистентности первичных медиастинальных крупных В-клеток лимфома: эффективность и безопасность фазы II CheckMate 436 изучать. Джей Клин Онкол 2019; 37: 3081–3089. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54.
Абрамсон Дж.С., Паломба М.Л., Гордон Л.И.




 Они не применяются в дальнейшем, если рак растет, распространяется или возвращается после лечения.
Они не применяются в дальнейшем, если рак растет, распространяется или возвращается после лечения.