111. Сердце. Источники развития. Строение оболочек сердца. Васкуляризация. Иннервация. Регенерация. Возрастные изменения. Трансплантация.
Развитие. Сердце начинает развиваться на 17-е сутки из двух зачатков: 1)мезенхимы и 2) миоэпикардиальных пластинок висцерального листка спланхнотома в краниальном конце эмбриона.
Из мезенхимы справа
и слева образуются трубочки, которые
впячиваются в висцеральные листки
спланхнотомов. Та часть висцеральных
листков, которая прилежит к мезенхимным
трубочкам, превращается в миоэпикардиальную
пластинку. В дальнейшем с участием
туловищной складки происходит сближение
правого и левого зачатков сердца и
затем соединение этих зачатков
впереди передней кишки. Из слившихся
мезенхимных трубочек формируется
эндокард сердца. Клетки миоэпикардиальных
пластинок дифференцируются в 2
направлениях: из наружной части образуется
мезотелий, выстилающий эпикард, а клетки
внутренней части дифференцируются в
трех направлениях. Из них образуются:
1) сократительные кардиомиоциты; 2)
проводящие кардиомиоциты; 3) эндокринные
кардиомиоциты.
Из них образуются:
1) сократительные кардиомиоциты; 2)
проводящие кардиомиоциты; 3) эндокринные
кардиомиоциты.
В процессе дифференцировки сократительных кардиомиоцитов клетки приобретают цилиндрическую форму, соединяются своими концами при помощи десмосом, где в дальнейшем формируются вставочные диски (discus intercalates). В формирующихся кардиомиоцитах появляются миофибриллы, расположенные продольно, канальцы гладкой ЭПС, за счет впячивания сарколеммы образуются Т-каналы, формируются митохондрии.
Проводящая система сердца начинает развиваться на 2-м месяце эмбриогенеза и заканчивается на 4-м месяце.
Клапаны сердца развиваются из эндокарда. Левый
атриовентрикулярный клапан закладывается
на 2-м месяце эмбриогенеза в виде
складки, которая называется эндокардиалъным валиком. В валик врастает соединительная ткань
из эпикарда, из которой образуется
соединительнотканная основа створок
клапана, прикрепляющаяся к фиброзному
кольцу.
Правый клапан закладывается в виде миоэндокардиального валика, в состав которого входит гладкая мышечная ткань. В створки клапана врастает соединительная ткань миокарда и эпикарда, при этом количество гладких миоцитов уменьшается, они сохраняются лишь у основания створок клапана.
На 7-й неделе эмбриогенеза формируются интрамуральные ганглии, включающие мультиполярные нейроны, между которыми устанавливаются синапсы.
Строение оболочек сердца.
ЭНДОКАРД (полость сердца) 1. эндотелий (на толстой базальной мембране) 2. подэнтотелиальный слой (РСТ с малодифференцированными клетками) 3. мышечно-эластический слой 4. наружный соединительно-тканный слой (РСТ с толстыми эластическими волокнами, имеются коллагеновые и ретикулярные волокна) (миокард) | ЭПИКАРД (полость перикарда) 1. 2. поверхностный слой коллагеновых волокон 3. слой эластических волокон 4. глубокий слой коллегеновых волокон 5. глубокий коллагеново-эластический слой (миокард) |
ПЕРИКАРД | |
МИОКАРД | |
Стенка сердца состоит из 3 оболочек: 1) эндокарда (endocardium), 2) миокарда (myocardium) и 3) эпикарда (epicardium).
Эндокард выстилает предсердия и желудочки, в разных местах имеет различную толщину, состоит из 4 слоев: 1) эндотелия; 2) субэндотелия; 3) мышечно-эластического слоя; 4) наружного соединительнотканного слоя. (соответствует строению вены мышечного типа)
Левый атриовентрикулярный
клапан включает
2 створки. Основой створки клапана
является соединительнотканная
пластинка, состоящая из коллагеновых
и эластических волокон, незначительного
количества клеток и основного межклеточного
вещества. Пластинка прикрепляется к
фиброзному кольцу, окружающему
клапан, и покрыта эндотелиоцитами, под
которыми находится субэндотелий.
Основой створки клапана
является соединительнотканная
пластинка, состоящая из коллагеновых
и эластических волокон, незначительного
количества клеток и основного межклеточного
вещества. Пластинка прикрепляется к
фиброзному кольцу, окружающему
клапан, и покрыта эндотелиоцитами, под
которыми находится субэндотелий.
Правый атриовентрикулярный клапан состоит из 3 створок. Поверхность клапанов, обращенных к предсердию, гладкая, к желудочку — неровная, так как к этой поверхности прикрепляются сухожилия сосочковых мышц.
Клапаны аорты и легочной артерии называются полулунными. Они состоят из 3 слоев: 1) внутреннего; 2) среднего и 3) наружного.
Внутренний слой сформирован за счет эндокарда, включает эндотелий, субэндотелий, содержащий фибробласты с консолями, поддерживающими эндотелиальные клетки. Глубже располагаются слои коллагеновых и эластических волокон.
Средний слой представлен рыхлой соединительной
тканью.
Наружный слой состоит из эндотелия, сформированного за счет эндотелия сосуда, и коллагеновых волокон, проникающих в субэндотелий клапана из фиброзного кольца.
Миокард состоит из функциональных волокон, которые образуются при соединении концов кардиомиоцитов. Кардиомиоциты имеют цилиндрическую форму, их длина — до 120 мкм, диаметр 15-20 мкм. Места соединения концов кардиомиоцитов называются вставочными дисками (discus intercalates). В состав дисков входят десмосомы, места прикрепления актиновых филаментов, интердигитации и нексусы. В центре кардиомиоцита располагается 1-2 овальных, обычно полиплоидных, ядра.
В кардиомиоцитах хорошо развиты митохондрии, гладкая ЭПС, миофибриллы, слабо развиты гранулярная ЭПС, комплекс Гольджи, лизосомы. В оксифильной цитоплазме имеются включения гликогена, липидов и миоглобина.
Миофибриллы состоят
из актиновых и миозиновых филаментов.
За счет актиновых филаментов образуются
светлые (изотропные) диски, разделенные
телофрагмами. За счет миозиновых
филаментов и заходящих между ними концов
актиновых филаментов образуются
анизотропные диски (диски А), разделенные
мезофрагмой. Между двумя телофрагмами
располагается саркомер, являющийся
структурной и функциональной единицей
миофибриллы.
За счет миозиновых
филаментов и заходящих между ними концов
актиновых филаментов образуются
анизотропные диски (диски А), разделенные
мезофрагмой. Между двумя телофрагмами
располагается саркомер, являющийся
структурной и функциональной единицей
миофибриллы.
Напротив каждого диска имеется система L-канальцев, включающих 2 латеральные цистерны (канальца), соединенные продольными канальцами. Система L-канальцев окружает миофибриллы. На границе между дисками со стороны сарколеммы отходит впячивание — Т-канал, который располагается между латеральными цистернами двух соседних L-систем. Структура, состоящая из Т-канала и двух латеральных цистерн, между которыми проходит этот канал, называется триадой.
От боковой поверхности
кардиомиоцитов отходят отростки —
мышечные анастомозы, которые соединяются
с боковыми поверхностями кардиомиоцитов
соседнего функционального волокна.
Благодаря мышечным анастомозам сердечная
мышца представляет собой единое целое.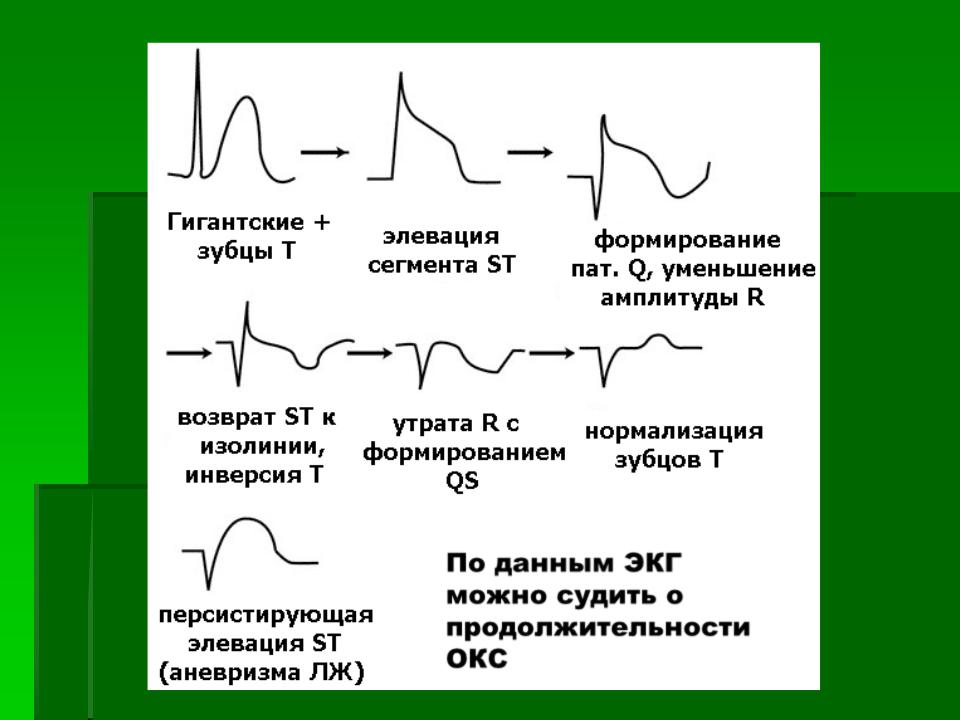
Секреторные кардиомиоциты (эндокриноциты) находятся в предсердии, содержат много отростков. В этих клетках слабо развиты миофибриллы, гладкая ЭПС, Т-каналы, вставочные диски; хорошо развиты комплекс Гольджи, гранулярная ЭПС и митохондрии, в цитоплазме содержатся секреторные гранулы. Функция: вырабатывают гормон — ПНФ. ПНФ воздействует на те клетки, которые имеют специальные рецепторы к нему. Такие рецепторы имеются на поверхности сократительных кардиомиоцитов, миоцитов кровеносных сосудов, эндокриноцитах клубочковой зоны коры надпочечников, клетках эндокринной системы почек. Таким образом, ПНФ стимулирует сокращение сердечной мышцы, регулирует артериальное давление, водно-солевой обмен, мочевыделение.
Проводящая система
сердца (systema
conducens
cardiacum)
– мышечные клетки, формирующие и
проводящие импульсы к сократительным
клеткам сердца.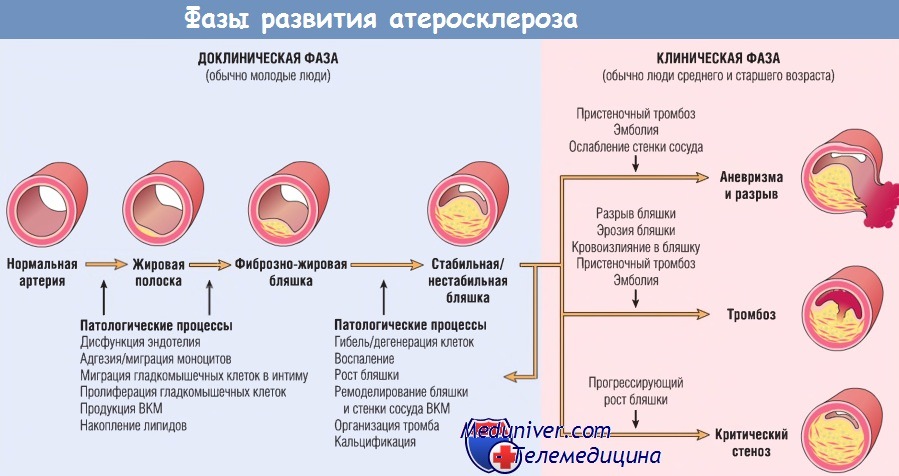
Проводящая система сердца представлена синусно-предсердным узлом, атриовентрикулярным узлом, предсердно-желудочковым пучком (пучком Гиса) и ножками пучка Гиса.
Синусно-предсердный узел представлен пейсмекерными клетками (Р-клетками), расположенными в центре узла, диаметр которых 8-10 мкм. Форма Р-клеток овальная, их миофибриллы развиты слабо, имеют различное направление. Гладкая ЭПС Р-клеток развита слабо, в цитоплазме имеется включение гликогена, митохондрии, отсутствуют вставочные диски и Т-каналы. В цитоплазме Р-клеток много свободного кальция, благодаря чему они способны ритмично вырабатывать сократительные импульсы.
Снаружи от пейсмекерных клеток располагаются проводящие кардиомиоциты II типа. Это узкие, удлиненные клетки, малочисленные миофибриллы которых расположены чаще всего параллельно. В клетках слабо развиты вставочные диски и Т-каналы. Функция — проведение импульса к проводящим кардиомиоцитам III типа или к сократительным кардиомиоцитам. Проводящие кардиомиоциты
II типа иначе называются переходными.
Проводящие кардиомиоциты
II типа иначе называются переходными.Атриовентрикулярный узел состоит из небольшого количества пейсмекерных клеток, расположенных в центре узла, и многочисленных проводящих кардиомиоцитов II типа. Функции атриовентрикулярного узла: 1) вырабатывает импульс с частотой 30-40 в минуту; 2) кратковременно задерживает прохождение импульса, идущего от синусно-предсердного узла на желудочки, благодаря чему сначала сокращаются предсердия, потом — желудочки.
В том случае, если прекращается поступление импульсов от синусно-предсердного узла к атриовентрикулярному (поперечная блокада сердца), то предсердия сокращаются в обычном ритме (60-80 сокращений в минуту), а желудочки — в 2 раза реже. Это опасное для жизни состояние.
Проводящие
кардиомиоциты III типа расположены в пучке Гиса и его ножках.
Их длина 50-120 мкм, ширина — около 50 мкм.
Цитоплазма этих кардиомиоцитов светлая,
разнонаправленные миофибриллы,
вставочные диски и Т-каналы развиты
слабо. Их функция — передача импульса
от кардиомиоцитов II типа на
сократительные кардиомиоциты.
Кардиомиоциты III типа образуют пучки
(волокна Пуркинье), которые чаще всего
располагаются между эндокардом и
миокардом, встречаются в миокарде.
Волокна Пуркинье подходят и к
сосочковым мышцам, благодаря чему к
моменту сокращения желудочков
напрягаются сосочковые мышцы, что
препятствует выворачиванию клапанов
в предсердия.
Их функция — передача импульса
от кардиомиоцитов II типа на
сократительные кардиомиоциты.
Кардиомиоциты III типа образуют пучки
(волокна Пуркинье), которые чаще всего
располагаются между эндокардом и
миокардом, встречаются в миокарде.
Волокна Пуркинье подходят и к
сосочковым мышцам, благодаря чему к
моменту сокращения желудочков
напрягаются сосочковые мышцы, что
препятствует выворачиванию клапанов
в предсердия.
Иннервация сердца. Сердце иннервируется и чувствительными, и эфферентными нервными волокнами. Чувствительные (сенсорные) нервные волокна поступают из 3 источников: 1) дендриты нейронов спинномозговых (спинальных) ганглиев верхнегрудного отдела спинного мозга; 2) дендриты чувствительных нейронов узла блуждающего нерва; 3) дендриты чувствительных нейронов интрамуральных ганглиев. Эти волокна заканчиваются рецепторами.
Эфферентными
волокнами являются симпатические и
парасимпатические нервные волокна,
относящиеся к вегетативной (автономной)
нервной системе.
Симпатическая рефлекторная дуга сердца включает цепь, состоящую из 3 нейронов. 1 -й нейрон заложен в спинальном ганглии, 2-й — в латерально-промежуточном ядре спинного мозга, 3-й — в периферическом симпатическом ганглии (верхнем шейном или зйездчатом).
Ход импульса по симпатической рефлекторной дуге: рецептор, дендрит 1-го нейрона, аксон 1-го нейрона, дендрит 2-го нейрона, аксон 2-го нейрона образует преганглионарное, миелиновое, холинергическое волокно, контактирующее с дендритом 3-го нейрона, аксон 3-го нейрона в виде постганглионарного, безмиелинового адренергического нервного волокна направляется в сердце и заканчивается эффектором, который непосредственно на сократительные кардиомиоциты не воздействует. При возбуждении симпатических волокон частота сокращений увеличивается.
Парасимпатическая
рефлекторная дуга состоит из цепи 3 нейронов. 1-й нейрон
заложен в чувствительном ганглии
блуждающего нерва, 2-й — в ядре блуждающего
нерва, 3-й — в интрамуральном ганглии.
Ход импульса по парасимпатической рефлекторной дуге: рецептор 1-го нейрона, дендрит 1-го нейрона, аксон 1-го нейрона, дендрит 2-го нейрона, аксон 2-го нейрона образует преганглионарное, миелиновое, холинергическое нервное волокно, которое передает импульс на дендрит 3-го нейрона, аксон 3-го нейрона в виде постганглионарного безмиелинового, холинергического нервного волокна направляется к проводящей системе сердца. При возбуждении парасимпатических нервных волокон частота и сила сердечных сокращений уменьшаются (брадикардия).
Эпикард представлен соединительнотканной
основой, покрытой мезотелием (однослойный
плоский эпителий целомического типа)
— это висцеральный листок, который
переходит в париетальный листок —
перикард. Перикард тоже выстлан
мезотелием. Между эпикардом и перикардом
имеется щелевидная полость, заполненная
небольшим количеством жидкости,
выполняющей смазывающую функцию.
Перикард развивается из париетального
листка спланхнотома. В соединительной
ткани эпикарда и перикарда имеются
жировые клетки (адипоциты).
В соединительной
ткани эпикарда и перикарда имеются
жировые клетки (адипоциты).
Возрастные изменения сердца. В процессе развития сердца имеют место 3 этапа: 1) дифференцировка; 2) стадия стабилизации; 3) стадия инволюции (обратного развития).
Дифференцировка начинается уже в эмбриогенезе и
продолжается сразу после рождения,
так как изменяется характер
кровообращения. Сразу после рождения
закрывается овальное окно между левым
и правым предсердием, закрывается
проток между аортой и легочной артерией.
Это приводит к снижению нагрузки на
правый желудочек, который подвергается
физиологической атрофии, и к повышению
нагрузки на левый желудочек, что
сопровождается его физиологической
гипертрофией. В это время происходит
дифференцировка сократительных
кардиомиоцитов, сопровождаемая
гипертрофией их саркоплазмы за счет
увеличения количества и толщины
миофибрилл. Вокруг функциональных
волокон сердечной мышцы есть тонкие
прослойки рыхлой соединительной
ткани.
Период стабилизации начинается примерно в 20-летнем возрасте и заканчивается в 40 лет. После этого начинается стадия инволюции, сопровождаемая уменьшением толщины кардиомиоцитов вследствие уменьшения толщины миофибрилл. Прослойки соединительной ткани утолщаются. Уменьшается количество симпатических нервных волокон, в то время как число парасимпатических практически не изменяется. Это приводит к снижению частоты и силы сокращений сердечной мышцы. К старости (70 лет) уменьшается и количество парасимпатических нервных волокон. Кровеносные сосуды сердца подвергаются склеротическим изменениям, что затрудняет кровоснабжение миокарда (мускулатуры сердца). Это называется ишемической болезнью. Ишемическая болезнь может привести к омертвению (некрозу) сердечной мышцы, что называется инфарктом миокарда.
Кровоснабжение
сердца обеспечивается венечными артериями,
которые отходят от аорты. Венечные
артерии — это типичные артерии мышечного
типа. Особенность этих артерий
заключается в том, что в субэндотелии
и в наружной оболочке имеются пучки
гладких миоцитов, расположенных
продольно. Артерии разветвляются на
более мелкие сосуды и капилляры, которые
затем собираются в венулы и коронарные
вены. Коронарные вены впадают в правое
предсердие или венозный синус. Следует
отметить, что в эндокарде капилляры
отсутствуют, так как его трофика
осуществляется за счет крови камер
сердца.
Особенность этих артерий
заключается в том, что в субэндотелии
и в наружной оболочке имеются пучки
гладких миоцитов, расположенных
продольно. Артерии разветвляются на
более мелкие сосуды и капилляры, которые
затем собираются в венулы и коронарные
вены. Коронарные вены впадают в правое
предсердие или венозный синус. Следует
отметить, что в эндокарде капилляры
отсутствуют, так как его трофика
осуществляется за счет крови камер
сердца.
Репаративаня регенерация возможна только в грудном или в раннем детском возрасте, когда кардиомиоциты способны к митотическому делению. При гибели мышечных волокон они не восстанавливаются, а замещаются соединительной тканью.
Острый инфаркт миокарда
Инфаркт миокарда – это заболевание, сопровождающееся некрозом одного или нескольких участков сердечной мышцы в результате острого нарушения кровотока в коронарных артериях, питающих миокард. Острый инфаркт миокарда без подъема сегмента ST и инфаркт миокарда с подъемом сегмента ST являются разновидностями острого коронарного синдрома, который включает также нестабильную стенокардию.
Инфаркт миокарда – ведущая причина смертности в большинстве стран, в том числе в России. Своевременная госпитализация во многих случаях позволяет предотвратить необратимые повреждения сердечной мышцы, однако часто пациенты неправильно оценивают возникающие симптомы и пытаются справиться с ними самостоятельно, что приводит к позднему обращению к врачу. Поэтому при острой боли в груди или других тревожных симптомах необходимо как можно раньше проконсультироваться со специалистом.
Риск инфаркта миокарда повышается с возрастом – чаще заболевают люди старше 60 лет. Однако в последнее время увеличилось количество ранних инфарктов миокарда – у людей моложе 40 лет. Среди пациентов младше 70 лет преобладают мужчины, однако после 70 количество мужчин и женщин с инфарктом миокарда становится одинаковым. Это может быть связано с защищающим действием эстрогенов (женских половых гормонов), которые снижают вероятность атеросклероза – главного фактора риска развития сердечного приступа.
Прогноз инфаркта миокарда зависит от обширности поражения сердечной мышцы, наличия сопутствующих заболеваний, времени обращения за медицинской помощью и возраста пациента. Смертность при остром инфаркте миокарда достигает 30 %.
Синонимы русские
Сердечный приступ, ИМ.
Синонимы английские
Heart attack, acute myocardial infarction, MI, myocardial infarction.
Симптомы
Основным симптомом острого инфаркта миокарда является резкая боль в груди, которая чаще всего ощущается как резкое сдавливание. Она продолжается обычно дольше 15 минут и не купируется приемом нитроглицерина. Боль может распространяться на левое плечо, лопатку, шею, нижнюю челюсть, может сопровождаться холодным потом, тошнотой и рвотой, потерей сознания. В некоторых случаях боль имеет нетипичную локализацию – в животе, в позвоночнике, левой или даже правой руке.
Иногда инфаркту предшествуют неспецифические симптомы: в течение нескольких дней до сердечного приступа человек может ощущать слабость, недомогание, дискомфорт в области груди.
Инфаркт может не сопровождаться характерным болевым синдромом и проявляться лишь такими признаками, как одышка, учащенное сердцебиение, слабость, тошнота. Неявная симптоматика инфаркта миокарда особенно характерна для женщин.
Таким образом, основными симптомами острого инфаркта миокарда являются:
- боль в груди,
- одышка,
- холодный пот,
- чувство страха,
- потеря сознания,
- тошнота, рвота.
Общая информация о заболевании
Инфаркт миокарда развивается в результате нарушения кровоснабжения сердечной мышцы, что приводит к недостатку кислорода и питательных веществ и некрозу (омертвению) участка миокарда. Основной причиной нарушения кровотока в сосудах, питающих миокард, является атеросклероз коронарных артерий – отложение атеросклеротических бляшек, состоящих в основном из холестерина, на внутренней поверхности сосудов. Затем происходит разрастание соединительной ткани (склероз) стенки сосуда и формирование отложений кальция (кальциноз) с дальнейшей деформацией и сужением просвета сосуда вплоть до полной закупорки. Впоследствии в атеросклеротической бляшке может развиваться так называемое асептическое воспаление, которое при воздействии провоцирующих факторов (физической нагрузке, повышении артериального давления и др.) способно приводить к надрыву бляшки. В области повреждения скапливаются тромбоциты, выделяются биологически активные вещества, которые еще больше усиливают адгезию (слипание) форменных элементов крови, и в итоге образуется тромб, закупоривающий просвет коронарной артерии. Возникновению тромба также способствует повышенная свертываемость крови. В случае, если кровоток в сосудах не восстанавливается в ближайшие шесть часов, происходят необратимые изменения в тканях миокарда.
Впоследствии в атеросклеротической бляшке может развиваться так называемое асептическое воспаление, которое при воздействии провоцирующих факторов (физической нагрузке, повышении артериального давления и др.) способно приводить к надрыву бляшки. В области повреждения скапливаются тромбоциты, выделяются биологически активные вещества, которые еще больше усиливают адгезию (слипание) форменных элементов крови, и в итоге образуется тромб, закупоривающий просвет коронарной артерии. Возникновению тромба также способствует повышенная свертываемость крови. В случае, если кровоток в сосудах не восстанавливается в ближайшие шесть часов, происходят необратимые изменения в тканях миокарда.
Редко инфаркт миокарда случается при резком спазме или тромбоэмболии патологически неизмененных коронарных артерий, однако это наблюдается лишь в 5 % случаев.
Чаще всего инфаркт миокарда локализуется в передней стенке левого желудочка, реже – в задней стенке левого желудочка и межжелудочковой перегородки.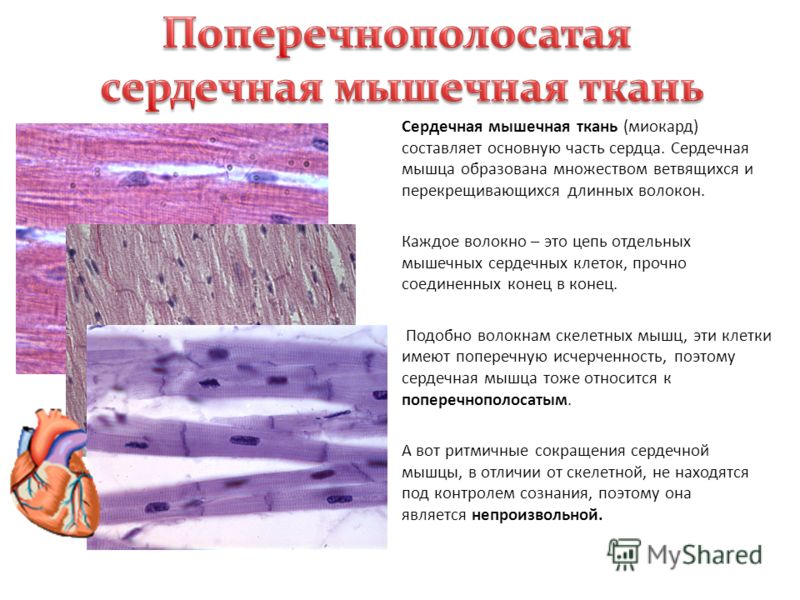 Инфаркт в области правого желудочка возникает редко. Выделяют трансмуральный и субэндокардиальный инфаркт миокарда. При трансмуральном патологические изменения затрагивают всю стенку сердца, при субэндокардиальном – от ? до ½ толщины стенки. Существует также деление на инфаркт миокарда без подъема сегмента ST и инфаркт миокарда с подъемом сегмента ST. Наличие изменений сегмента S-T на электрокардиограмме позволяет заподозрить полную закупорку коронарной артерии и обширное повреждение миокарда с более высоким риском развития необратимого некроза тканей. Подъем сегмента S-T не наблюдается при частичной закупорке артерии – это может говорить об инфаркте миокарда без подъема сегмента S-T или нестабильной стенокардии. Однако лишь при инфаркте миокарда изменяется активность кардиальных энзимов.
Инфаркт в области правого желудочка возникает редко. Выделяют трансмуральный и субэндокардиальный инфаркт миокарда. При трансмуральном патологические изменения затрагивают всю стенку сердца, при субэндокардиальном – от ? до ½ толщины стенки. Существует также деление на инфаркт миокарда без подъема сегмента ST и инфаркт миокарда с подъемом сегмента ST. Наличие изменений сегмента S-T на электрокардиограмме позволяет заподозрить полную закупорку коронарной артерии и обширное повреждение миокарда с более высоким риском развития необратимого некроза тканей. Подъем сегмента S-T не наблюдается при частичной закупорке артерии – это может говорить об инфаркте миокарда без подъема сегмента S-T или нестабильной стенокардии. Однако лишь при инфаркте миокарда изменяется активность кардиальных энзимов.
При нарушении кровоснабжения миокарда гибель клеток начинается, прежде всего, в области эндокарда, а затем зона повреждения распространяется по направлению к перикарду. Обширность поражения зависит от степени закупорки артерии, ее длительности, системы коллатерального кровообращения.
Некроз в тканях сердечной мышцы вызывает острую боль. Обширное повреждение миокарда может приводить к нарушению сократительной функции сердца, что проявляется острой левожелудочковой недостаточностью с развитием отека легких и кардиогенного шока. Кардиогенный шок, в свою очередь, усугубляет течение инфаркта миокарда за счет ухудшения коронарного кровообращения. В результате возникают тяжелые нарушения ритма сердца, в том числе фибрилляция предсердий.
Трансмуральный инфаркт в некоторых случаях может приводить к разрыву стенки сердца или к аневризме – локальному истончению и выпячиванию участка миокарда.
Кто в группе риска?
Основной причиной развития инфаркта миокарда (до 90 % всех случаев) является атеросклероз. Поэтому факторы риска развития атеросклероза увеличивают и вероятность развития сердечного приступа. В группу риска входят:
- мужчины старше 45 лет и женщины старше 65 лет,
- страдающие ожирением, дислипидемией, артериальной гипертензией, сахарным диабетом,
- люди, родственники которых страдают сердечно-сосудистыми заболеваниями и/или перенесли инфаркт миокарда,
- курильщики,
- ведущие малоподвижный образ жизни,
- употребляющие наркотики (кокаин, амфетамины могут спровоцировать спазм коронарных артерий),
- испытывающие сильный стресс.

Диагностика
Острый инфаркт миокарда во многих случаях протекает малосимптомно или атипично, что затрудняет его диагностику. Существует ряд заболеваний, проявления которых зачастую могут быть схожи с проявлениями сердечного приступа: аневризма аорты, стенокардия, заболевания печени и желчевыводящих путей, депрессия, эзофагит и другие. Поэтому при подозрении на инфаркт миокарда необходимо провести ряд лабораторных и инструментальных исследований, позволяющих отличить инфаркт миокарда от другой патологии и выявить обширность и локализацию повреждения, продолжительность ишемии, постинфарктные осложнения. Кроме того, важно распознать признаки сопутствующих заболеваний: патологии почек и дыхательной системы, сахарного диабета, анемии. Все это определяет дальнейшую схему лечения и прогноз заболевания.
Лабораторная диагностика
- Общий анализ крови. При остром инфаркте миокарда может наблюдаться лейкоцитоз. Количество лейкоцитов увеличивается со второго часа после возникновения нарушений кровообращения и достигает пика на 2-4-е сутки.
 Важно обратить внимание и на количество эритроцитов, так как анемия усугубляет кислородное голодание сердечной мышцы.
Важно обратить внимание и на количество эритроцитов, так как анемия усугубляет кислородное голодание сердечной мышцы. - Лейкоцитарная формула. Возможен лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилией.
- Скорость оседания эритроцитов (СОЭ). Повышение СОЭ свидетельствует об остром воспалительном процессе.
- Тропонин I (количественно) – белок, который участвует в мышечном сокращении. При сердечном приступе его уровень обычно повышается начиная с 4-6-го часа, максимум на 2-е сутки и нормализуется в течение 6-8 дней от начала заболевания.
- Миоглобин. Это белок, который содержится в мышечной ткани, в том числе в миокарде. При инфаркте миокарда уровень миоглобина увеличивается в течение 4-6 часов.
- Аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ). При инфаркте миокарда уровень этих ферментов является показателем обширности повреждения сердечной мышцы.
- Креатинкиназа MB. Увеличение ее концентрации специфично для повреждения сердечной мышцы.
 Ее уровень возрастает с первых часов и сохраняется повышенным в течение 2-3 суток.
Ее уровень возрастает с первых часов и сохраняется повышенным в течение 2-3 суток. - Лактатдегидрогеназа (ЛДГ) общая – фермент, который содержится практически во всех клетках организма и участвует в утилизации глюкозы. Уровень ЛДГ повышается при инфаркте миокарда, патологии печени, крови, почек. При инфаркте миокарда остается повышенным в течение 10-14 дней.
- Лактатдегидрогеназа 1, 2 (ЛДГ, 1, 2 фракции). Формы фермента лактатдегидрогеназы, которые содержатся в основном в клетках сердца, коркового вещества почек, печени. Эти показатели могут быть использованы для оценки обширности поражения при инфаркте миокарда.
- Антитромбин III. Синтезируется в клетках эндотелия сосудов и клетках печени, участвует в инактивации ряда факторов свертывания крови. Уменьшение количества антитромбина III говорит о повышенном риске тромбоза. Понижен его уровень при тромбоэмболии, атеросклерозе.
- Волчаночный антикоагулянт, скрининговый тест (LA1). Волчаночный антикоагулянт представляет собой комплекс антител против фосфолипидов.
 Их наличие может свидетельствовать об аутоиммунных заболеваниях, а также является признаком повышенного риска тромбообразования.
Их наличие может свидетельствовать об аутоиммунных заболеваниях, а также является признаком повышенного риска тромбообразования. - Протромбиновый индекс (ПИ), международное нормализованное отношение – МНО). Анализ используется для оценки внешнего пути свертывания крови и активности I, II, V, VII, X факторов свертывания. Гиперкоагуляция увеличивает риск образования тромбов. При инфаркте миокарда протромбиновый индекс может быть повышен.
- Гликированный гемоглобин (HbA 1c, гликозилированный гемоглобин, гликогемоглобин). Образуется при присоединении глюкозы к гемоглобину. Данный показатель позволяет оценить количество глюкозы в крови на протяжении последних 120 дней – это средняя продолжительность жизни эритроцита. Высокий уровень гликированного гемоглобина говорит о высокой концентрации глюкозы за последние три месяца и свидетельствует о большой вероятности осложнений сахарного диабета, который, в свою очередь, увеличивает риск инфаркта миокарда. Тест на гликированный гемоглобин используется для оценки эффективности лечения и прогноза инфаркта миокарда у пациентов с сахарным диабетом.

- Глюкоза в плазме. Также используется для диагностики сахарного диабета.
- Железо в сыворотке. Железо входит в состав цитохромов и участвует в клеточном дыхании. При инфаркте миокарда уровень железа может быть повышен.
- Электролиты сыворотки. При остром инфаркте миокарда может меняться уровень натрия, калия, магния, кальция, хлора. Однако это происходит не всегда, при неосложненном течении инфаркта миокарда уровень электролитов может быть не изменен.
- Мочевая кислота в сыворотке. При нарушении кровоснабжения миокарда происходит некроз клеток сердечной мышцы с распадом органических веществ и выделением продуктов распада, в том числе мочевой кислоты. Это, в свою очередь, провоцирует развитие воспаления в зоне повреждения миокарда. Таким образом, уровень мочевой кислоты при обширном инфаркте миокарда может быть повышен.
- С-реактивный белок, количественно. При инфаркте миокарда бывает повышен за счет воспалительной реакции.
- Триглицериды.
 Образуются в кишечнике из жиров пищи. Депонируются в жировой ткани и расходуются клетками по мере необходимости для получения энергии. Повышенный уровень триглицеридов может свидетельствовать о высоком риске атеросклероза.
Образуются в кишечнике из жиров пищи. Депонируются в жировой ткани и расходуются клетками по мере необходимости для получения энергии. Повышенный уровень триглицеридов может свидетельствовать о высоком риске атеросклероза. - Холестерол общий. Это соединения, которые участвуют в формировании атеросклеротических бляшек. Его концентрация может быть увеличена при инфаркте миокарда, возникшем в результате атеросклероза коронарных артерий.
- Холестерол – липопротеины высокой плотности (ЛПВП) – фракция общего холестерина, которая препятствует формированию атеросклеротических бляшек.
- Холестерол – липопротеины низкой плотности (ЛПНП) – фракция холестерола, участвующая в формировании атеросклеротических бляшек.
- Холестерол – липопротеины очень низкой плотности (ЛПОНП). Это липопротеины, которые образуются в печени. Являются переносчиками фосфолипидов, триглицеридов, холестерола. При попадании из печени в кровь подвергаются химическим превращениям с образованием липопротеинов низкой плотности
- Коэффициент атерогенности.
 Это соотношение «вредных» (ЛПНП, ЛПОНП, триглицеридов) и «полезных» липопротеинов (ЛПВП). Повышение коэффициента атерогенности говорит о высоком риске развития атеросклероза.
Это соотношение «вредных» (ЛПНП, ЛПОНП, триглицеридов) и «полезных» липопротеинов (ЛПВП). Повышение коэффициента атерогенности говорит о высоком риске развития атеросклероза.
Другие методы исследования
- Электрокадиография (ЭКГ). Позволяет подтвердить диагноз «инфаркт миокарда», определить локализацию и степень повреждения сердечной мышцы, выявить признаки нарушения сердечного ритма.
- Рентгенография органов грудной клетки. Используется для выявления аневризмы сердца.
- Ультразвуковое исследование сердца. Позволяет выявить участок поражения миокарда, оценить сократительную способность сердца.
Лечение
Терапия назначается индивидуально в зависимости от возраста пациента, тяжести состояния и обширности поражения сердечной мышцы. Огромное значение имеет восстановление кровоснабжения миокарда в течение первых 12 часов после появления первых признаков инфаркта миокарда. Это может предотвратить или уменьшить степень некроза тканей. Основными направлениями терапии при остром инфаркте миокарда являются купирование болевого синдрома, тромболитическая и антикоагулянтная терапия, снижение нагрузки на миокард, предупреждение и лечение возникших осложнений.
Основными направлениями терапии при остром инфаркте миокарда являются купирование болевого синдрома, тромболитическая и антикоагулянтная терапия, снижение нагрузки на миокард, предупреждение и лечение возникших осложнений.
Профилактика
Здоровое питание с низким содержанием насыщенных жиров и большим количеством овощей и фруктов.
Достаточная физическая активность.
Отказ от алкоголя и курения.
Своевременное прохождение профилактических медицинских осмотров для выявления заболеваний, повышающих риск развития инфаркта миокарда.
Рекомендуемые анализы
- Общий анализ крови
- Лейкоцитарная формула
- Скорость оседания эритроцитов (СОЭ)
- Тропонин I (количественно)
- Миоглобин
- Аланинаминотрансфераза (АЛТ)
- Аспартатаминотрансфераза (АСТ)
- Антитромбин III
- Волчаночный антикоагулянт, скрининговый тест (LA1)
- Коагулограмма № 1 (протромбин (по Квику), МНО)
- Гликированный гемоглобин (HbA 1c)
- Глюкоза в плазме
- Железо в сыворотке
- Калий, натрий, хлор в сыворотке
- Креатинкиназа MB
- Лактатдегидрогеназа (ЛДГ) общая
- Мочевая кислота в сыворотке
- С-реактивный белок, количественно
- Триглицериды
- Холестерол общий
- Холестерол – липопротеины высокой плотности (ЛПВП)
- Холестерол – липопротеины низкой плотности (ЛПНП)
- Холестерол – липопротеины очень низкой плотности (ЛПОНП)
- Коэффициент атерогенности
- Лабораторная диагностика острого коронарного синдрома и инфаркта миокарда (оптимальный)
- Лабораторная диагностика острого коронарного синдрома и инфаркта миокарда (минимальный)
- Лабораторное обследование сердца и сосудов
Развитие и регенерация сердца: метаболизм создает и исправляет сердце
- Меган Л Мартик,
- Калифорнийский технологический институт, США;
Человеческое сердце — замечательный орган, но сердце рыбки данио еще более замечательно, потому что оно может восстанавливаться, если оно повреждено. Этот процесс восстановления, известный как регенерация, имеет много общего со сложными процессами развития, посредством которых сердце создается у эмбрионов рыбок данио. В человеческом сердце повреждение, такое как сердечный приступ, приводит к рубцеванию и, в конечном итоге, к сердечной недостаточности, поэтому лучшее понимание связи между развитием сердца и регенерацией у рыбок данио может помочь в усилиях по повышению эффективности регенерации у людей. Две статьи в eLife могут помочь в этих усилиях, показав, что метаболизм играет роль в обоих процессах.
Этот процесс восстановления, известный как регенерация, имеет много общего со сложными процессами развития, посредством которых сердце создается у эмбрионов рыбок данио. В человеческом сердце повреждение, такое как сердечный приступ, приводит к рубцеванию и, в конечном итоге, к сердечной недостаточности, поэтому лучшее понимание связи между развитием сердца и регенерацией у рыбок данио может помочь в усилиях по повышению эффективности регенерации у людей. Две статьи в eLife могут помочь в этих усилиях, показав, что метаболизм играет роль в обоих процессах.
Во время развития кардиомиоциты — клетки, из которых состоит сердечная мышца, называемая миокардом, — подвергаются сложным движениям, которые позволяют формировать внутренние стенки сердца (рис. 1А; Moorman and Christoffels, 2003; Staudt and Stainier, 2012). Эти внутренние стенки, также известные как трабекулы, представляют собой мышечные гребни, которые помогают сердцу сокращаться, а также помогают насыщать кислородом развивающуюся сердечную стенку (Sedmera et al. , 2000). В одной из статей eLife Рюичи Фукуда, Дидье Штайнье (оба из Института исследований сердца и легких им. Макса Планка) и их коллеги сообщают о результатах экспериментов, в которых использовались трехмерная визуализация отдельных клеток, трансплантация клеток и генетические методы для изучения развитие трабекул (Fukuda et al., 2019). Они показывают, что кардиомиоциты претерпевают обширные изменения формы по мере того, как они отделяются или отслаиваются от миокарда с образованием трабекул.
, 2000). В одной из статей eLife Рюичи Фукуда, Дидье Штайнье (оба из Института исследований сердца и легких им. Макса Планка) и их коллеги сообщают о результатах экспериментов, в которых использовались трехмерная визуализация отдельных клеток, трансплантация клеток и генетические методы для изучения развитие трабекул (Fukuda et al., 2019). Они показывают, что кардиомиоциты претерпевают обширные изменения формы по мере того, как они отделяются или отслаиваются от миокарда с образованием трабекул.
Метаболический контроль развития сердца и восстановления сердца у взрослых рыбок данио.
( A ) Трабекулы образуются в сердце, когда компактные кардиомиоциты отслаиваются от миокарда. Фукуда и др. обнаружили, что передача сигналов Nrg1/ErbB2 активирует гликолиз, чтобы инициировать сложные клеточные движения, участвующие в деламинации. ( B ) В регенерирующем сердце взрослой рыбки данио кардиомиоциты в «пограничной зоне» на краю поврежденной области дедифференцируются и пролиферируют.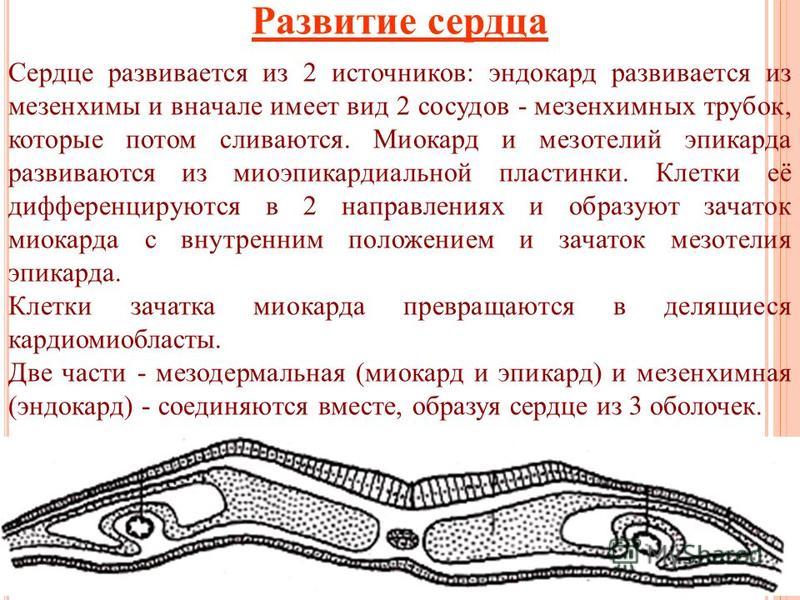 Хонкоп и др. раскрыли роль передачи сигналов Nrg1/ErbB2 в контроле метаболического перепрограммирования кардиомиоцитов пограничной зоны с окислительного фосфорилирования (OXPHOS) на гликолиз. Кроме того, они обнаружили, что гликолиз необходим для пролиферации после повреждения.
Хонкоп и др. раскрыли роль передачи сигналов Nrg1/ErbB2 в контроле метаболического перепрограммирования кардиомиоцитов пограничной зоны с окислительного фосфорилирования (OXPHOS) на гликолиз. Кроме того, они обнаружили, что гликолиз необходим для пролиферации после повреждения.
Предыдущая работа показала, что сигнальный путь Nrg1/ErbB2 участвует в формировании трабекул (Lee et al., 19).95; Liu et al., 2010) и Fukuda et al. теперь покажите, что этот путь также активирует гликолиз, чтобы инициировать процесс деламинирования (рис. 1А). В частности, они показывают, что клетки с подавленной гликолитической активностью не в состоянии совершать сложные клеточные движения, необходимые для правильного формирования трабекул. Хотя многое известно о метаболических процессах в сердце взрослого человека, Fukuda et al. выявить ранее недостаточно изученную роль гликолиза в развитии сердца.
Во взрослом сердце кардиомиоциты зависят от метаболизма жирных кислот и митохондриального окислительного фосфорилирования в качестве основных источников метаболической активности. У мышей кардиомиоциты претерпевают метаболический сдвиг от гликолиза к окислительному фосфорилированию в первую неделю после рождения, и это коррелирует с потерей этими клетками способности к пролиферации (Lopaschuk et al., 19).92; Менендес-Монтес и др., 2016). Поскольку известно, что сердце мыши теряет способность к регенерации в течение недели после рождения, интересно предположить, что метаболический сдвиг играет роль в подавлении способности к восстановлению (Porrello et al., 2011).
У мышей кардиомиоциты претерпевают метаболический сдвиг от гликолиза к окислительному фосфорилированию в первую неделю после рождения, и это коррелирует с потерей этими клетками способности к пролиферации (Lopaschuk et al., 19).92; Менендес-Монтес и др., 2016). Поскольку известно, что сердце мыши теряет способность к регенерации в течение недели после рождения, интересно предположить, что метаболический сдвиг играет роль в подавлении способности к восстановлению (Porrello et al., 2011).
Рыбки данио, с другой стороны, сохраняют замечательную способность регенерировать во взрослую жизнь. В поврежденном сердце рыбки данио кардиомиоциты вблизи поврежденного участка или «пограничной зоны» дедифференцируются, а затем пролиферируют, способствуя регенерации (рис. 1B; Poss et al., 2002; Kikuchi et al., 2010; Jopling et al., 2010). ). Однако гетерогенность типов клеток, обнаруженных в сердце во время восстановления, усложнила попытки полностью понять регенеративные способности рыбок данио.
Во второй статье Йерун Баккерс (Институт Хабрехта и Университетский медицинский центр Утрехта) и его коллеги, в том числе Хессель Хонкоп и Деннис де Баккер в качестве первых авторов, сообщают, как они использовали недавно созданную трансгенную репортерную линию, которая маркирует кардиомиоциты пограничной зоны и метод, называемый сортировкой клеток с активированной флуоресценцией, для получения чистых популяций как пролиферирующих клеток пограничной зоны, так и непролиферирующих «удаленных клеток» (Honkoop et al., 2019). Отдельные клетки из обеих популяций затем подверглись секвенированию одноклеточной РНК, как и эмбриональные кардиомиоциты. Интересно, что это показало, что пролиферирующие клетки пограничной зоны больше напоминали эмбриональные клетки, чем непролиферирующие удаленные клетки.
Honkoop et al. далее показали, что кардиомиоциты пограничной зоны отличаются от отдаленных кардиомиоцитов тем, что окислительное фосфорилирование снижено, а гликолиз и ферментация лактата увеличены. Это говорит о том, что клетки пограничной зоны подвергаются метаболическому перепрограммированию, чтобы иметь метаболическое состояние, более похожее на эмбриональное. Хонкоп и др. также исследовали сигнальный путь Nrg1/ErbB2, поскольку предыдущие исследования показали, что этот путь необходим для пролиферации кардиомиоцитов после повреждения (D’Uva et al., 2015; Gemberling et al., 2015). Они обнаружили, что этот путь индуцируется в клетках пограничной зоны, чтобы регулировать переход к гликолитическому механизму во взрослых кардиомиоцитах. Более того, когда гликолиз был заблокирован, регенерация не удалась из-за подавления пролиферации. Хонкоп и др. также показали, что гены гликолиза обогащены в сердечной ткани мыши, в которой ErbB2 был сверхэкспрессирован, и повышенная гликолитическая активность улучшала восстановление у этих мышей после травмы.
Это говорит о том, что клетки пограничной зоны подвергаются метаболическому перепрограммированию, чтобы иметь метаболическое состояние, более похожее на эмбриональное. Хонкоп и др. также исследовали сигнальный путь Nrg1/ErbB2, поскольку предыдущие исследования показали, что этот путь необходим для пролиферации кардиомиоцитов после повреждения (D’Uva et al., 2015; Gemberling et al., 2015). Они обнаружили, что этот путь индуцируется в клетках пограничной зоны, чтобы регулировать переход к гликолитическому механизму во взрослых кардиомиоцитах. Более того, когда гликолиз был заблокирован, регенерация не удалась из-за подавления пролиферации. Хонкоп и др. также показали, что гены гликолиза обогащены в сердечной ткани мыши, в которой ErbB2 был сверхэкспрессирован, и повышенная гликолитическая активность улучшала восстановление у этих мышей после травмы.
В целом, результаты этих двух работ способствуют нашему пониманию того, как регенерация реактивирует программы развития, активируя профиль транскрипции, аналогичный тому, который обнаруживается в эмбриональных популяциях, и используя метаболическое перепрограммирование для возвращения клеток в эмбрионоподобное состояние. Учитывая, что эти механизмы сохраняются от рыб до млекопитающих, данные представляют собой многообещающий терапевтический путь для индукции регенерации сердца человека. Однако мы не до конца понимаем, почему поврежденное сердце переключается на гликолиз, чтобы пролиферировать. Не потому ли, что пролиферация — это высокоэнергетический процесс? Или гликолиз необходим для других критических процессов, необходимых для регенерации сердца, таких как сложные изменения формы клеток? Понимание нюансов каждого процесса будет важно, поскольку исследователи ищут способы помочь человеческому сердцу восстановиться после травмы.
Учитывая, что эти механизмы сохраняются от рыб до млекопитающих, данные представляют собой многообещающий терапевтический путь для индукции регенерации сердца человека. Однако мы не до конца понимаем, почему поврежденное сердце переключается на гликолиз, чтобы пролиферировать. Не потому ли, что пролиферация — это высокоэнергетический процесс? Или гликолиз необходим для других критических процессов, необходимых для регенерации сердца, таких как сложные изменения формы клеток? Понимание нюансов каждого процесса будет важно, поскольку исследователи ищут способы помочь человеческому сердцу восстановиться после травмы.
Каталожные номера
Статья и информация об авторе
Сведения об авторе
Megan L Martik
Megan L Martik работает в Отделении биологии и биологической инженерии Калифорнийского технологического института, Пасадена, США
Для корреспонденции
[email protected]Конкурирующие интересы
Конкурирующие интересы не заявлены «Этот ORCID iD идентифицирует автора этой статьи:» 0000-0003-1186-4085
История публикаций
- Версия записи опубликована: 4 февраля 2020 г.
 (версия 1)
(версия 1)
Авторское право
© 2020, Martik
Эта статья распространяется в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование и распространение при условии указания оригинального автора и источника.
Метрики
Число цитирований статей, полученное путем опроса самых высоких значений из следующих источников: Crossref, PubMed Central, Scopus.
Ссылки для скачивания
Список ссылок, состоящий из двух частей, для загрузки статьи или частей статьи в различных форматах.
Загрузки (ссылка для скачивания статьи в формате PDF)
- Статья PDF
Открытые цитаты (ссылки для открытия цитат из этой статьи в различных онлайн-сервисах управления ссылками)
- Менделей
- ЧитатьКуб»>
Процитируйте эту статью (ссылки для загрузки цитат из этой статьи в форматах, совместимых с различными инструментами управления ссылками)
- Меган Л Мартик
(2020)
Развитие и регенерация сердца: метаболизм создает и исправляет сердце
eLife 9 :e54665.
https://doi.org/10.7554/eLife.54665
- Скачать БибТекс
- Скачать .RIS
Категории и теги
- Прозрение
- Биология развития
- метаболизм
- развитие сердца
- регенерация
- кардиомиоциты
Исследовательские организмы
- мышь
- Рыбка данио
Неуплотнение левого желудочка: MedlinePlus Genetics
Описание
Неуплотнение левого желудочка — это заболевание сердечной мышцы, которое возникает, когда нижняя левая камера сердца (левый желудочек), которая помогает сердцу перекачивать кровь, развивается неправильно. Вместо гладкой и твердой мышцы сердечная мышца левого желудочка толстая и выглядит губчатой. Аномальная сердечная мышца слаба и имеет нарушенную способность перекачивать кровь, поскольку она либо не может полностью сокращаться, либо не может полностью расслабиться. Чтобы сердце нормально перекачивало кровь, сердечная мышца должна полностью сокращаться и расслабляться.
Вместо гладкой и твердой мышцы сердечная мышца левого желудочка толстая и выглядит губчатой. Аномальная сердечная мышца слаба и имеет нарушенную способность перекачивать кровь, поскольку она либо не может полностью сокращаться, либо не может полностью расслабиться. Чтобы сердце нормально перекачивало кровь, сердечная мышца должна полностью сокращаться и расслабляться.
У некоторых людей с некомпактным поражением левого желудочка симптомы вообще отсутствуют; у других проблемы с сердцем, которые могут включать внезапную сердечную смерть. Дополнительные признаки и симптомы включают аномальные сгустки крови, нерегулярный сердечный ритм (аритмия), ощущение трепетания или сердцебиения в груди (сердцебиение), сильную усталость во время физических упражнений (непереносимость физических упражнений), одышку (одышку), обмороки (обмороки), отек ног (лимфедема) и проблемы с лежанием на горизонтальной поверхности. Некоторые пострадавшие имеют признаки других пороков сердца. Неуплотнение левого желудочка может быть диагностировано в любом возрасте, от рождения до позднего взросления. Приблизительно у двух третей людей с некомпрессией левого желудочка развивается сердечная недостаточность.
Приблизительно у двух третей людей с некомпрессией левого желудочка развивается сердечная недостаточность.
Частота
Неуплотнение левого желудочка, по оценкам, поражает от 8 до 12 случаев на 1 миллион человек в год. Тем не менее, это состояние, вероятно, более распространено, чем эта оценка, потому что люди, у которых нет каких-либо связанных признаков или симптомов, могут не обращаться за медицинской помощью.
Причины
Было обнаружено, что варианты (также известные как мутации) в нескольких генах вызывают неуплотнение левого желудочка. По оценкам, варианты в генах MYH7 и MYBPC3 вызывают до 30 процентов случаев; варианты в других генах ответственны за небольшой процент случаев. Однако причина состояния часто неизвестна.
Большинство генов, связанных с неуплотнением левого желудочка, включая MYH7 и MYBPC3 , предоставляют инструкции для создания белков, которые играют роль в функционировании структур внутри мышечных волокон, называемых саркомерами. Эти структуры необходимы для того, чтобы мышцы напрягались (сокращались). Регулярные сокращения сердечной мышцы перекачивают кровь к остальным частям тела. Другие гены, связанные с неуплотнением левого желудочка, участвуют в определенных сигнальных путях, формировании и поддержании структурного каркаса (цитоскелета) клеток сердечной мышцы или регуляции электрических сигналов, контролирующих сердцебиение.
Эти структуры необходимы для того, чтобы мышцы напрягались (сокращались). Регулярные сокращения сердечной мышцы перекачивают кровь к остальным частям тела. Другие гены, связанные с неуплотнением левого желудочка, участвуют в определенных сигнальных путях, формировании и поддержании структурного каркаса (цитоскелета) клеток сердечной мышцы или регуляции электрических сигналов, контролирующих сердцебиение.
Неясно, как генетические варианты вызывают неуплотнение левого желудочка. В норме в процессе развития до рождения сердечная мышца уплотняется (уплотняется), становится гладкой и твердой. Варианты в определенных генах, вероятно, приводят к изменениям в этом процессе. В результате сердечная мышца левого желудочка не уплотнена, а утолщена и губчата, что приводит к неуплотнению левого желудочка.
Неуплотнение левого желудочка также может быть частью синдромов, поражающих несколько частей тела. Когда неуплотнение левого желудочка является частью синдрома, оно вызывается вариантами гена, участвующего в этом синдроме. Кроме того, было обнаружено, что неуплотнение левого желудочка развивается у небольшого процента женщин во время их первой беременности. У этих женщин причина состояния неизвестна, но на нее может влиять повышенная нагрузка, которую беременность оказывает на сердечную мышцу. В некоторых случаях сердечная мышца возвращается к нормальному состоянию после беременности, а в других случаях у пострадавших женщин наблюдаются различные признаки и симптомы неуплотнения левого желудочка на протяжении всей жизни.
Кроме того, было обнаружено, что неуплотнение левого желудочка развивается у небольшого процента женщин во время их первой беременности. У этих женщин причина состояния неизвестна, но на нее может влиять повышенная нагрузка, которую беременность оказывает на сердечную мышцу. В некоторых случаях сердечная мышца возвращается к нормальному состоянию после беременности, а в других случаях у пострадавших женщин наблюдаются различные признаки и симптомы неуплотнения левого желудочка на протяжении всей жизни.
Наследование
Некомпактность левого желудочка может иметь разные типы наследования.
В большинстве случаев, в том числе когда состояние вызвано вариантами гена MYH7 или MYBPC3 , неуплотнение левого желудочка наследуется по аутосомно-доминантному типу, что означает, что одной копии измененного гена в каждой клетке достаточно для вызвать расстройство. В большинстве случаев больной наследует вариант от одного больного родителя. Другие случаи возникают в результате появления новых вариантов гена и возникают у людей, у которых в семье не было этого заболевания.
Другие случаи неуплотнения левого желудочка наследуются по аутосомно-рецессивному типу, что означает, что обе копии гена в каждой клетке имеют варианты. Каждый из родителей человека с аутосомно-рецессивным заболеванием несет по одной копии измененного гена, но обычно у них нет признаков и симптомов заболевания.
Неуплотнение левого желудочка также может наследоваться по рецессивному типу, сцепленному с Х-хромосомой. Некоторые гены, связанные с этим заболеванием (например, ген TAFAZZIN ) расположены на Х-хромосоме, которая является одной из двух половых хромосом. У мужчин (у которых есть только одна Х-хромосома) одной измененной копии гена в каждой клетке достаточно, чтобы вызвать заболевание. У женщин (имеющих две Х-хромосомы) вариант должен иметь место в обеих копиях гена, чтобы вызвать заболевание. Поскольку маловероятно, что женщины будут иметь две измененные копии этого гена, мужчины гораздо чаще страдают Х-сцепленными рецессивными заболеваниями, чем женщины. Характерной чертой Х-сцепленного наследования является то, что отцы не могут передать Х-сцепленные признаки своим сыновьям.
Характерной чертой Х-сцепленного наследования является то, что отцы не могут передать Х-сцепленные признаки своим сыновьям.
Другие названия этого состояния
- Миокард плода
- Сотовидный миокард
- Синдром гипертрабекуляции
- Изолированное неуплотнение миокарда желудочка
- Гипертрабекуляция левого желудочка
- Некомпактная кардиомиопатия миокарда левого желудочка
- Некомпактная кардиомиопатия левого желудочка
- ГЛЖ
- LVNC
- Неуплотнение миокарда левого желудочка
- Некомпактная кардиомиопатия
- Губчатый миокард
Дополнительная информация и ресурсы
Информация о генетическом тестировании
- Реестр генетического тестирования: некомпактность левого желудочка
- Реестр генетических тестов: некомпактность левого желудочка 1
- Реестр генетического тестирования: некомпактность левого желудочка 10
- Реестр генетических тестов: Неуплотнение левого желудочка 6
- Реестр генетического тестирования: некомпактность левого желудочка 7
- Реестр генетических тестов: некомпактность левого желудочка 8
Информационный центр генетических и редких заболеваний
- Некомпрессия левого желудочка
Ресурсы поддержки и защиты интересов пациентов
- Поиск информации о заболеваниях
- Национальная организация редких заболеваний (NORD)
Научные исследования от ClinicalTrials.
 gov
gov- ClinicalTrials.gov
Каталог генов и болезней от OMIM
- КАРДИОМИОПАТИЯ, ДИЛЯТАЦИОННАЯ, 1C, С ИЛИ БЕЗ КОМПАКТАЦИИ ЛЕВОГО ЖЕЛУДОЧКА
- КАРДИОМИОПАТИЯ, РАСШИРЕННАЯ, 1D
- КАРДИОМИОПАТИЯ РАСШИРЕННАЯ, 1R
- КАРДИОМИОПАТИЯ, РАСШИРЕННАЯ, 1S
- КАРДИОМИОПАТИЯ РАСШИРЕННАЯ, 1Y
- ЛЕВЫЙ ЖЕЛУДОЧОК НЕКОМПАКЦИОННЫЙ 1
- ЛЕВЫЙ ЖЕЛУДОЧОК НЕКОМПАКЦИОННЫЙ 10
- ЛЕВЫЙ ЖЕЛУДОЧОК НЕКОМПАКТНЫЙ 2
- ЛЕВЫЙ ЖЕЛУДОЧОК НЕКОМПАКЦИОННЫЙ 7
- ЛЕВЫЙ ЖЕЛУДОЧОК НЕКОМПАКЦИОННЫЙ 8
Научные статьи в PubMed
- PubMed
Ссылки
- Bennett CE, Freudenberger R. Современный подход к диагностике и лечению
некомпактной кардиомиопатии левого желудочка: обзор литературы.
Кардиол Рес Практ. 2016;2016:5172308. дои: 10.1155/2016/5172308.
 Epub, январь 2016 г.
11. Цитирование в PubMed или бесплатная статья в PubMed Central
Epub, январь 2016 г.
11. Цитирование в PubMed или бесплатная статья в PubMed Central - Dong X, Fan P, Tian T, Yang Y, Xiao Y, Yang K, Liu Y, Zhou X. Последние достижения в области молекулярной генетики некомпактного левого желудочка кардиомиопатия. Клин Чим Акта. 2017 Февраль; 465: 40-44. дои: 10.1016/j.cca.2016.12.013. Epub 2016, 15 декабря. Цитирование на PubMed
- Финстерер Дж., Столлбергер С., Таубин Дж.А. Неуплотнение левого желудочка кардиомиопатия: кардиальные, нервно-мышечные и генетические факторы. Нат Рев Кардиол. 2017 апр; 14 (4): 224-237. doi: 10.1038/nrcardio.2016.207. Epub 2017, 12 января. Цитирование на PubMed
- Таубин Дж. А., Лортс А., Джеффрис Дж. Л. Левый желудочек без уплотнения кардиомиопатия. Ланцет. 2015 22 августа; 386 (9995): 813-25. дои: 10.1016/S0140-6736(14)61282-4. Epub 2015, 9 апреля. Цитирование на PubMed
- Ван К., Такасаки А., Ватанабэ Одзава С., Накаока Х.


 мезотелий на базальной мембране
мезотелий на базальной мембране
 Важно обратить внимание и на количество эритроцитов, так как анемия усугубляет кислородное голодание сердечной мышцы.
Важно обратить внимание и на количество эритроцитов, так как анемия усугубляет кислородное голодание сердечной мышцы. Ее уровень возрастает с первых часов и сохраняется повышенным в течение 2-3 суток.
Ее уровень возрастает с первых часов и сохраняется повышенным в течение 2-3 суток. Их наличие может свидетельствовать об аутоиммунных заболеваниях, а также является признаком повышенного риска тромбообразования.
Их наличие может свидетельствовать об аутоиммунных заболеваниях, а также является признаком повышенного риска тромбообразования.
 Образуются в кишечнике из жиров пищи. Депонируются в жировой ткани и расходуются клетками по мере необходимости для получения энергии. Повышенный уровень триглицеридов может свидетельствовать о высоком риске атеросклероза.
Образуются в кишечнике из жиров пищи. Депонируются в жировой ткани и расходуются клетками по мере необходимости для получения энергии. Повышенный уровень триглицеридов может свидетельствовать о высоком риске атеросклероза. Это соотношение «вредных» (ЛПНП, ЛПОНП, триглицеридов) и «полезных» липопротеинов (ЛПВП). Повышение коэффициента атерогенности говорит о высоком риске развития атеросклероза.
Это соотношение «вредных» (ЛПНП, ЛПОНП, триглицеридов) и «полезных» липопротеинов (ЛПВП). Повышение коэффициента атерогенности говорит о высоком риске развития атеросклероза.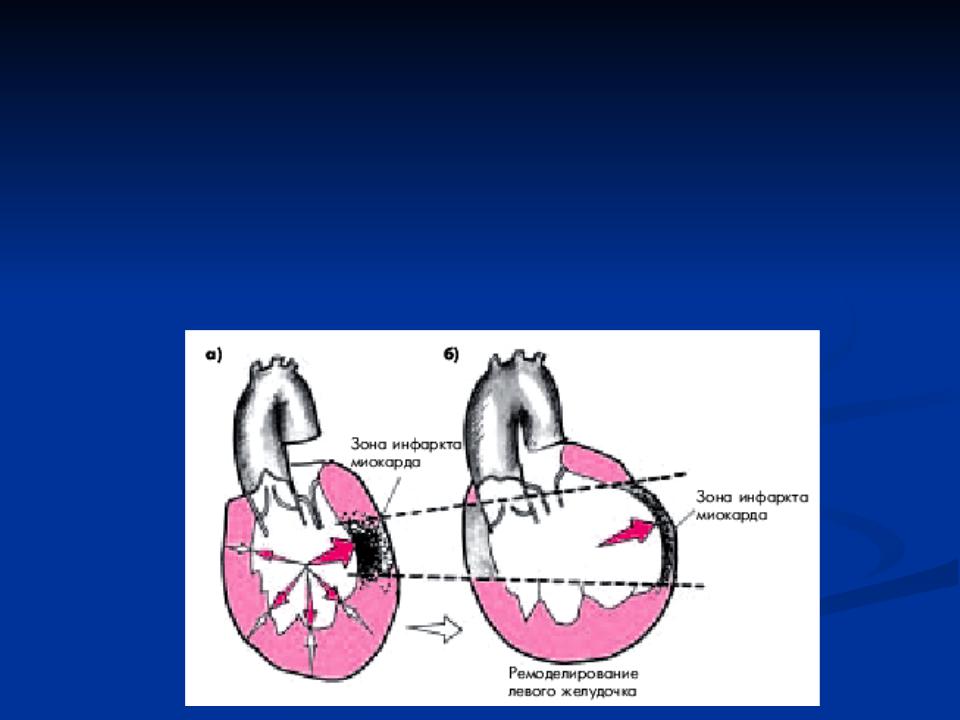 (версия 1)
(версия 1) Epub, январь 2016 г.
11. Цитирование в PubMed или бесплатная статья в PubMed Central
Epub, январь 2016 г.
11. Цитирование в PubMed или бесплатная статья в PubMed Central
