Анемия при беременности
Под анемией понимают снижение уровня гемоглобина в крови.
Во время беременности в организме женщины увеличивается количество жидкости, а значит, и объем циркулирующей крови. За счет этого кровь «разжижается» и доля гемоглобина в ее общем объеме падает. Это считается нормальным явлением, в связи с чем нижняя граница количества гемоглобина при беременности установлена на уровне 110 г/л (при норме для небеременной женщины в 120–140 г/л). Но дальнейшее падение уровня гемоглобина является опасным для здоровья и даже жизни будущей матери.
В зависимости от значений этого показателя анемия при беременности может быть:
- легкой степени тяжести — 110–90 г/л;
- умеренно выраженной — 89–70 г/л;
- тяжелой — 69–40 г/л.
Наиболее частыми осложнениями при анемии во время беременности считаются:
- угроза прерывания беременности;
- гестоз;
- пониженное артериальное давление;
- преждевременная отслойка плаценты;
- задержка развития плода;
- преждевременные роды;
- анемия в первый год жизни ребенка.
Так что анемия при беременности — отнюдь не безобидное состояние. Оно имеет серьезные последствия и для матери, и для плода.
Во время беременности железо расходуется не только на кроветворение матери, но и на нужды плода. Особенно активно этот расход возрастает на 16–20-й неделях, когда запускается процесс кроветворения у плода. К концу беременности запасы железа истощаются у любой женщины и для их полного восстановления необходимо 2–3 года.
Другими причинами анемии при беременности являются:
- дефицит железа в пище главным образом из-за недостаточного количества мяса в рационе;
- дефицит витаминов группы B и C, необходимых для нормального усвоения железа;
- болезни, при которых возникает недостаток белков, участвующих в обмене железа, включая тяжелый гестоз;
- ранний гестоз (токсикоз), мешающий полноценно питаться;
- частые роды с небольшим интервалом.

Если же говорить о группах риска развитии анемии во время беременности, то к ним можно причислить женщин: с многоплодной беременностью и многорожавших; имевших до наступления беременности менструации длительностью более 5 дней; у которых были симптомы анемии во время предыдущей беременности; с гестозом; с хроническими заболеваниями желудочно-кишечного тракта, печени, хроническими инфекциями; вегетарианок. Все, попавшие в группу риска, должны особенно тщательно следить за своим состоянием и по возможности позаботиться о профилактике анемии во время беременности.
Учитывая, что во время беременности потребность организма женщины в микроэлементе возрастает на 15–33%, на передний план обычно выходят симптомы, указывающие на гипоксию: слабость, быстрая утомляемость; нарушение сна: днем — сонливость, ночью — бессонница; головные боли; головокружения, шум в ушах; одышка; сердцебиение; обмороки.
Переносимость симптомов анемии индивидуальна: кто-то падает в обморок при относительно высоких значениях гемоглобина, кто-то отказывается от госпитализации с гемоглобином на уровне около 70 г/л, искренне не понимая всей тяжести анемии и ее опасности при беременности. Именно поэтому клинический анализ крови во время беременности проводится обязательно и несколько раз. Имеет значение и падение значений железа в сыворотке крови и сывороточного ферритина. Снижение количества последнего до 12 мкг/л говорит о дефиците железа, даже если гемоглобин еще в норме.
Лечение анемии в период ожидания малыша включат в себя диетотерапию. Одна из основ как профилактики, так и лечения анемии при беременности — правильное питание. Питание для профилактики анемии при беременности должно содержать в достаточном количестве вещества, необходимые для нормального кроветворения, — это мясо, рыба. В этих продуктах железо изначально двухвалентное, поэтому легко всасывается. Но одной диеты может быть недостаточно даже для профилактики.
Для лечения анемии назначаются препараты железа. Обычно ограничиваются средствами для перорального приема (т.е. внутрь) — препараты железа в инъекциях рекомендуют только в тяжелых случаях и только в условиях стационара.
Обычно ограничиваются средствами для перорального приема (т.е. внутрь) — препараты железа в инъекциях рекомендуют только в тяжелых случаях и только в условиях стационара.
Как российские, так и зарубежные эксперты отмечают, что профилактика анемии у беременных эффективней, чем ее лечение, и чем выше уровень гемоглобина, тем проще привести его к норме. Впрочем, о том же говорит и здравый смысл. Поэтому, планируя беременность и тем более уже ожидая ребенка, лучше заняться профилактикой анемии не дожидаясь, пока недостаток железа станет заметен.
Врач-гематолог (заведующий),
консультационным отделением Рачкова Т.А.
Анемия при беременности – железные аргументы и развеивание мифов
Анемия – одно из самых частых осложнений, возникающих во время беременности. В России этот диагноз ставится каждой третьей беременной женщине. Однако не все, столкнувшись с этим диагнозом понимают, о чём идёт речь и что надо делать, чтобы лечение было максимально эффективным.
Анемия – заболевание, при котором снижается уровень гемоглобина крови, часто при одновременном снижении числа эритроцитов. Основной причиной развития анемии является несоответствие между поступлением железа в организм и его затратами.
Во время беременности затраты на нужды растущего плода обуславливают значительное возрастание потребности в железе. Кроме того, более редкой, но возможной причиной анемии может быть недостаточное поступление фолиевой кислоты или витамина В12.
К факторам риска по развитию железодефицитной анемии во время беременности относятся:
- обильные менструации в анамнезе;
- заболевания желудочно-кишечного тракта;
- инфекционно-воспалительные заболевания;
- анемия в прошлом;
- короткий промежуток между беременностями, в том числе зачатие во время лактации;
- многоплодная беременность.

Поскольку главной задачей гемоглобина является доставка кислорода – жизненно важного элемента – ко всем тканям и клеткам женщины и плода, несложно представить какой вред наносит его снижение во время беременности. Однако и после родов вопрос нельзя считать закрытым. Доказано, что низкий уровень гемоглобина ассоциируется со снижением лактации, а так же с развитием анемии у ребенка.
Железодефицитная анемия проявляется слабостью, головокружением, патологической утомляемостью, извращенным восприятием вкусов и запахов, учащенным сердцебиением, отдышкой, головной болью, обмороками. Кожа становится сухой и бледной, а волосы и ногти ломкими.
Ставится диагноз анемии на основании оценки уровня гемоглобина в общем анализе крови. Нижняя граница нормы гемоглобина при беременности – 110 г/л. Однако, прежде чем снижается гемоглобин, происходит истощение запасов железа, что проявляется снижением уровня ферритина сыворотки крови. Это состояние носит название латентный дефицит железа и так же требует коррекции.
Лечение анемии и латентного дефицита железа проводят с помощью препаратов железа, которые чаще всего назначаются в виде таблеток или раствора для приёма внутрь, но иногда применяют растворы для внутривенного введения. Такая необходимость возникает, когда уровень гемоглобина очень низкий или в случае нарушения всасывания железа из желудочно-кишечного тракта.
Так же важно помнить о потенциале белковой диеты в коррекции железодефицита. Так как гемоглобин – это связь двух субъединиц – металлосодержащего гемма и белка глобина, — то при недостаточном поступлении белка даже адекватному количеству железа в организме связаться не с чем.
При диагнозе анемия пациенту важно помнить, что потребление продуктов с высоким содержанием железа поможет лишь поддержать имеющийся уровень гемоглобина, но не сможет повысить его уровень и насытить запасы железа в достаточной степени.
Отдельно хочется остановиться на том, в каких же продуктах содержание железа, действительно, высокое. Распространённым заблуждением является мнение, что при анемии нужно есть яблоки, свёклу и гранаты, а так же пить гранатовый сок. 100 грамм яблок содержат 0,5 — 2,2 мг железа; 100 грамм свёклы – 1,0 – 1,4 мг железа; 100 грамм гранатов — 0,78 мг железа. Примерно такое же количество железа содержат огурцы, клубника, тыква и другие фрукты и овощи. Для сравнения, гречка содержит 8 мг железа на 100 г продукта, сухофрукты (курага, чернослив, сушеные яблоки) — от 12 до 15 мг железа. Лидером по содержанию железа является свиная печень. Кроме того, высоко содержание этого микроэлемента в говяжьей печени, какао, чечевице, яичный желток, сердце.
Распространённым заблуждением является мнение, что при анемии нужно есть яблоки, свёклу и гранаты, а так же пить гранатовый сок. 100 грамм яблок содержат 0,5 — 2,2 мг железа; 100 грамм свёклы – 1,0 – 1,4 мг железа; 100 грамм гранатов — 0,78 мг железа. Примерно такое же количество железа содержат огурцы, клубника, тыква и другие фрукты и овощи. Для сравнения, гречка содержит 8 мг железа на 100 г продукта, сухофрукты (курага, чернослив, сушеные яблоки) — от 12 до 15 мг железа. Лидером по содержанию железа является свиная печень. Кроме того, высоко содержание этого микроэлемента в говяжьей печени, какао, чечевице, яичный желток, сердце.
Профилактикой железодефицитной анемии беременных является исследованием запасов железа и уровня гемоглобина на этапе планирования беременности, и при выявлении отклонений от нормы своевременная их коррекция, потребление продуктов с высоким содержанием железа, приём витаминно-минеральных комплексов, содержащих профилактические дозировки железа.
Врач акушер-гинеколог
женской консультации №14
Хиврич Е.Б.
Норма общего анализа крови во время беременности. Гемоглобин, тромбоциты, гематокрит, эритроциты и лейкоциты при беременности. Клинический анализ крови во время беременности. Гематологические изменения при беременности.
Перевод материалов сайта UpTodate.com
Нормально протекающая беременность характеризуется значительными изменениями почти во всех органах и системах для приспособления к требованиям фетоплацентарного комплекса, в том числе, во время беременности меняются показатели анализов крови.
Нормы анализа крови при беременности: краткое содержание статьи
- Значимыми гематологические изменениями в течение беременности являются физиологическая анемия, нейтрофилия, умеренная тромбоцитопения, повышение факторов свертывания крови и снижение фибринолиза.
- К 6-12 неделям беременности объем плазмы крови повышается примерно на 10-15 %.
 Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно.
Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно. - Количество эритроцитов начинает увеличиваться на 8-10 неделях беременности и к концу беременности увеличивается на 20-30% (250-450 мл) относительно нормального уровня для небеременных женщин к концу беременности Значительное увеличение объема плазмы относительно увеличения количества гемоглобина и объема эритроцитов приводит к умеренному снижению уровня гемоглобина (физиологическая анемия беременных), что наблюдается у здоровых беременных.
- У беременных женщин возможно незначительное снижение количества тромбоцитов по сравнению со здоровыми небеременными женщинами.
- Количество нейтрофилов начинает расти на втором месяце беременности и стабилизируется во втором или третьем триместрах, в это время количество лейкоцитов. Абсолютное количество лимфоцитов не изменяется.
- Уровень некоторых факторов свертывания крови меняется в течение беременности.
В данной статье описаны гематологические изменения, происходящие во время беременности, наиболее важными из которых являются:
- Повышение объема плазмы крови и уменьшение гематокрита
- Физиологическая анемия, низкий гемоглобин
- Повышенные лейкоциты при беременности
- Нейтрофилия
- Умеренная тромбоцитопения
- Повышение прокоагулянтных факторов
- Уменьшение фибринолиза
Анализы, упоминаемые в статье
Как сдать анализы крови и получить скидку 5%? Зайдите в интернет-магазин лабораторий ЦИР!Объем плазмы крови
К 6-12 неделям беременности объем плазмы крови повышается примерно на 10-15 %. Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно. В среднем объем плазмы крови увеличивается на 1100-1600 мл в триместр, и в результате объем плазмы за беременность увеличивается до 4700-5200 мл, что на 30 до 50% выше объема плазмы у небеременных женщин.
В среднем объем плазмы крови увеличивается на 1100-1600 мл в триместр, и в результате объем плазмы за беременность увеличивается до 4700-5200 мл, что на 30 до 50% выше объема плазмы у небеременных женщин.
В течение беременности активность ренина плазмы крови имеет тенденцию повышаться, при этом уровень предсердного натрийуретического пептида несколько снижается. Это говорит о том, что увеличение объема плазмы вызвано недостаточностью сосудистой системы, к которой приводит системная вазодилатация (расширение сосудов во всем организме) и увеличение сосудистой емкости. Так как изначально увеличивается именно объем плазмы крови, то его воздействие на почечные и предсердные рецепторы приводит к противоположным воздействиям на гормональный фон (снижение активности ренина плазмы и увеличение натрийуретического пептида). Эта гипотеза также подтверждается наблюдением, что повышение потребления натрия не влияет на дальнейшее увеличение объема плазмы крови.
После родов объем плазмы сразу снижается, но вновь повышается через 2-5 дней, возможно из-за увеличения секреции альдостерона, происходящей в это время. Затем объем плазмы вновь постепенно снижается: через 3 недели после родов он все ещё повышен на 10-15% относительно нормального уровня для небеременных женщин, но обычно полностью приходит норме через 6 недель после родов.
Эритроциты при беременности, СОЭ при беременности
Количество эритроцитов начинает увеличиваться на 8-10 неделе беременности и к концу беременности увеличивается на 20-30% (250-450 мл) относительно нормального уровня для небеременных, в особенности у женщин, принимавших препараты железа во время беременности. Среди беременных, не принимавших препараты железа, количество эритроцитов может увеличиваться только на 15-20%. Продолжительность жизни эритроцитов немного снижается в течение нормальной беременности.
Уровень эритропоэтина при нормальной беременности повышается на 50% и его изменение зависит от наличия осложнений беременности. Повышение эритропоэтина в плазме приводит к увеличению количества эритроцитов, которые частично обеспечивают высокие метаболические требования в кислороде в течение беременности.
Повышение эритропоэтина в плазме приводит к увеличению количества эритроцитов, которые частично обеспечивают высокие метаболические требования в кислороде в течение беременности.
У женщин, не принимающих препараты железа, средний объем эритроцитов снижается во время беременности и в третьем триместре в среднем составляет 80-84 фл. Однако, у здоровых беременных и у беременных с умеренным дефицитом железа средний объем эритроцитов увеличивается примерно на 4 фл.
СОЭ при беременности увеличивается, что не имеет диагностического значения.
Анемия при беременности, гемоглобин при беременности, гематокрит при беременности, низкий гемоглобин при беременности
Снижение гемоглобина при беременности
Значительное увеличение объема плазмы относительно увеличения количества гемоглобина и объема эритроцитов приводит к умеренному снижению уровня гемоглобина (физиологическая анемия или низкий гемоглобин у беременных), что наблюдается у здоровых беременных. Самая большая разница между темпами роста объема плазмы крови и количества эритроцитов в материнском кровотоке, формируется в течение конца второго, начале третьего триместра (снижение гемоглобина обычно происходит в 28-36 недель беременности). Концентрация гемоглобина повышается благодаря прекращению увеличения объема плазмы и продолжения повышения количества гемоглобина. Наоборот, отсутствие появления физиологической анемии является фактором риска мертворождения.
Анемия при беременности
Установление четкого определения анемии у беременных женщин достаточно сложно, т.к. оно складывается из связанных с беременностью изменений в объеме плазмы крови и количества эритроцитов, физиологическими различиями в концентрации гемоглобина между женщинами и мужчинами и частотой использования препаратов железа при беременности.
- Центр профилактики и контроля заболеваний определил анемию, как уровень гемоглобина меньше, чем 110 г/л (гематокрит меньше 33%) в первом и третьем триместрах и менее, чем 105 г/л (гематокрит менее 32%) во втором триместре.

- ВОЗ определила анемию у беременных, как снижение гемоглобина меньше 110 г/л (11 г/дл) или гематокрит меньше 6,83 ммоль/л или 33%. Тяжелая анемия беременных определяется уровнем гемоглобина меньше 70 г/л и нуждается в медицинском лечении. Очень тяжелая анемия определяется уровнем гемоглобина меньше 40 г/л и нуждается в неотложной медицинской помощи в связи с риском застойной сердечной недостаточности.
Женщины со значением гемоглобина ниже этих уровней считаются анемичными и должны подвергаться стандартным анализам (общий анализ крови с оценкой мазка периферической крови, подсчет ретикулоцитов, сывороточное железо, ферритин, трансферрин). Если при обследовании отклонений не выявлено, то гемоглобин, сниженный до уровня 100 г/л можно считать физиологической анемией с большим разнообразием факторов, влияющих на нормальный уровень гемоглобина у конкретного человека.
Хроническая тяжелая анемия наиболее распространена у женщин в развивающихся странах. Снижение материнского гемоглобина ниже 60 г/л приводит к уменьшению объема амниотической жидкости, вазодилатации мозговых сосудов плода и изменение частоты сердечного ритма плода. Также повышается риск преждевременных родов, самопроизвольных выкидышей, рождения детей с низким весом и мертворождения. Кроме того, тяжелая анемия (гемоглобин меньше 70 г/л) повышает риск материнской смертности. Нет данных, что анемия повышает риск врожденных аномалий плода.
Тяжелая хроническая анемия обычно связана с недостаточным запасом железа (из-за недостаточного потребления с пищей или кишечных глистных инвазий), дефицитом фолатов (из-за недостаточного потребления и хронических гемолитических состояний, таких как малярия). Таким образом, предупреждение хронической анемии и улучшение исход беременности возможно при применении пищевых добавок и использовании мер контроля за инфекциями.
Проведение переливания крови и эритроцитарной массы (в тех местах, где доступно безопасное переливание крови) является разумным агрессивным лечением тяжелой формы анемии, особенно если есть признаки гипоксии плода.
Признаки физиологической анемии беременных исчезают через 6 недель после родов, когда объем плазмы возвращается к норме.
Потребность в железе
При одноплодной беременности потребность в железе составляет 1000 мг за беременность: примерно 300 мг для плода и плаценты и, примерно, 500 мг, если таковые имеются, для увеличения количества гемоглобина. 200 мг теряется через кишечник, мочу и кожу. Так как у большинства женщин нет адекватного запаса железа для обеспечения потребностей во время беременности, то железо обычно назначают в составе мультивитаминов, или как отдельный элемент. В целом, у женщин, принимающих препараты железа, концентрация гемоглобина выше на 1 г/дл, чем у женщин, не принимающих железо.
Потребность в фолатах
Ежедневная потребность в фолатах для небеременных женщин составляет 50-100 мкг. Повышение количества эритроцитов во время беременности приводит к увеличению потребностей в фолиевой кислоте, что обеспечивается увеличением дозы фолиевой кислоты до 400-800 мкг в сутки, для предотвращения дефектов нервной трубки у плода.
Тромбоциты при беременности
В большинстве случаев, количество тромбоцитов во время неосложненной беременности остается в пределах нормы для небеременных женщин, но так же у беременных женщин возможно и снижение количества тромбоцитов по сравнению со здоровыми небеременными женщинами. Количество тромбоцитов начинает расти сразу после родов и продолжает увеличиваться в течение 3-4 недель, пока не вернется к нормальным значениям.
Тромбоцитопения при беременности
Наиболее важное в акушерстве изменение в физиологии тромбоцитов при беременности — это тромбоцитопения, которая может быть связана с осложнениями беременности (тяжелая преэклампсия, HELLP-синдром), медикаментозными расстройствами (иммунная тромбоцитопения) либо может являться гестационной тромбоцитопенией.
Гестационная или случайная тромбоцитопения протекает бессимптомно в третьем триместре беременности у пациенток без предшествующей тромбоцитопении. 9/л. Количество лейкоцитов снижается до референсного интервала для небеременных женщин к шестому дню после родов.
9/л. Количество лейкоцитов снижается до референсного интервала для небеременных женщин к шестому дню после родов.
В периферической крови у беременных женщин может быть небольшое количество миелоцитов и метамиелоцитов. По данным некоторых исследований наблюдается увеличение количества юных форм нейтрофилов во время беременности. Тельца Доли (голубое окрашивание цитоплазматических включений в гранулоцитах) считаются нормой у беременных женщин.
У здоровых женщин при неосложненной беременности не происходит изменений абсолютного количества лимфоцитов и нет значительных изменений в относительном количестве Т- и В-лимфоцитов. Число моноцитов обычно не изменяется, число базофилов может немного снижаться, а число эозинофилов может несколько повышаться.
Факторы свертывания крови и ингибиторы
При нормальной беременности происходят следующие изменения уровней факторов свертывания крови, приводящие к физиологической гиперкоагуляции:
- Из-за гормональных изменений при беременности снижается активность общего протеин S антигена, свободного протеин S антигена и протеина S.
- Устойчивость к активированному протеину С повышается во втором и третьем триместрах. Данные изменения были выявлены при проведении тестов первого поколения с использованием чистой плазмы крови (т.е. не лишенной фактора V), однако этот тест редко применяется клинически и имеет лишь исторический интерес.
- Фибриноген и факторы II, VII, VIII, X, XII и XIII повышаются на 20-200%.
- Повышается фактор фон Виллебранда.
- Повышается активность ингибиторов фибринолиза, TAF1, PAI-1 и PAI-2. Так же заметно повышается уровень PAI-1.
- Уровни антитромбина III, протеина С, фактора V и фактора IX чаще всего остаются без изменений или повышаются незначительно.
Конечный результат данных изменений — повышение тенденции к тромбообразованию, увеличение вероятности венозных тромбозов в течение беременности и, особенно, в послеродовый период. Наряду с сокращением миометрия и повышением уровня децидуального тканевого фактора, гиперкоагуляция защищает беременную от чрезмерного кровотечения во время родов и отделения плаценты.
Наряду с сокращением миометрия и повышением уровня децидуального тканевого фактора, гиперкоагуляция защищает беременную от чрезмерного кровотечения во время родов и отделения плаценты.
АЧТВ остается в норме в течение беременности, но может немного снижаться. Протромбиновое время может укорачиваться. Время кровотечения не изменяется.
Сроки нормализации активности свертывания крови в послеродовый период могут варьировать в зависимости от факторов, но все должно вернуться в нормальные рамки через 6-8 недель после родов. Гемостазиограмму не нужно оценивать ранее, чем через 3 месяца после родов и после завершения лактации для исключения влияния факторов беременности.
Влияние факторов приобретенной либо наследственной тромбофилии на беременность является сферой для исследований.
Послеродовый период
Гематологические изменения, связанные с беременностью, возвращаются в нормальные рамки через 6-8 недель после родов. Скорость и характер нормализации изменений, связанных с беременностью, конкретных гематологических показателей описаны выше в разделе, посвященном каждому параметру.
Гематологические осложнения при беременности
- Железодефицитная анемия.
- Тромбоцитопения.
- Неонатальная аллоиммунная тромбоцитопения.
- Приобретенная гемофилия А.
- Венозные тромбозы.
- Резус- и не резус-аллоиммунизация. Для диагностики проводится анализ на резус-антитела и антигрупповые антитела.
- Проявление ранее нераспознанного нарушения свертывающей системы, такое как болезнь фон Виллебранда, наиболее часто манифестирует у женщин в период беременности и родов. Для скрининга болезни фон Виллебранда сдается анализ для оценки агрегации тромбоцитов с ристоцетином.
- Апластическая анемия.
Гемоглобин при беременности: нормы и отклонения
Многие ошибочно считают, что гемоглобин у беременных и уровень железа в крови это одно и то же. На самом деле железо всего лишь отвечает за синтез белка в костном мозге, именно он и называется гемоглобином. Его важность для жизнедеятельности организма трудно переоценить. Гормон переносит кислород и углекислый газ от наших легких к тканям и обратно. Особенно часто плохая выработка гормона происходит на 3 триместре, когда клеткам нужен дополнительный кислород из-за активного развития плода. Низкий уровень гормона в крови приводит к возникновению малокровия, также называемого анемией.
На самом деле железо всего лишь отвечает за синтез белка в костном мозге, именно он и называется гемоглобином. Его важность для жизнедеятельности организма трудно переоценить. Гормон переносит кислород и углекислый газ от наших легких к тканям и обратно. Особенно часто плохая выработка гормона происходит на 3 триместре, когда клеткам нужен дополнительный кислород из-за активного развития плода. Низкий уровень гормона в крови приводит к возникновению малокровия, также называемого анемией.
Чем повысить гемоглобин при беременности
Нормальное содержание гемоглобина у взрослой женщины в пределах 110-150 г/л, при беременности эти цифры слегка меняются. Причем в первом триместре он может даже повысится, за счет отсутствия месячных, а затем, когда матка и плод требуют большее количество крови, резко упасть. Важно следить за своим состоянием постоянно и не допускать чтобы анализы показали уровень гемоглобина 100 и ниже. В качестве профилактики отлично помогут продукты, повышающие гемоглобин и содержащие большое количество железа.
Что есть беременной с анемией:
- зеленые листовые овощи;
- сухофрукты;
- морепродукты;
- постное мясо;
- хлеб из муки цельного помола.
Важно понимать, что повысить гемоглобин без таблеток можно, но если ситуация слишком серьезная, то лучше обратиться за помощью к врачу. Среди методик экстренной борьбы с первыми призраками анемии: употребление специальных железосодержащих препаратов и витаминов, а также полноценное правильное питание. У беременных женщин уровень гормона влияет на правильное развитие плода и его нарушение может привести к патологиям в развитии и даже выкидышу.
Как контролировать гемоглобин беременной
Мы редко следим за своим питанием в полной мере, считая, что употребление здоровых продуктов уже итак залог крепкого здоровья. На деле же выходит, что если мы не любим какой-то конкретный продукт, вроде печени или бобовых, то исключая его из потребления, мы получает серьезный дефицит микроэлементов. Железодефицитная анемия, ранее называющаяся малокровием, возникает у всех групп населения, не зависимо от уровня жизни. Особенно опасна она для беременных, ведь низкий гемоглобин при родах, может провоцировать серьезные проблемы.
На деле же выходит, что если мы не любим какой-то конкретный продукт, вроде печени или бобовых, то исключая его из потребления, мы получает серьезный дефицит микроэлементов. Железодефицитная анемия, ранее называющаяся малокровием, возникает у всех групп населения, не зависимо от уровня жизни. Особенно опасна она для беременных, ведь низкий гемоглобин при родах, может провоцировать серьезные проблемы.
Нормы гемоглобина по неделям сможет подсказать лечащий врач, изучивший ваш полный анамнез. Средние показатели существенно отличаются для различного возраста и телосложения рожениц. Норма гемоглобина в крови по триместрам:
- в 1-м триместре — 112–165 (среднее — 131) г/л;
- во 2-м триместре — 108–144 (среднее — 120) г/л;
- в 3-м триместре 110–140 (среднее — 112) г/л.
Гемоглобин 130 г/л считается средним уровнем и ничем не грозит матери или ребенку. Конечно хорошо, когда норма ближе к верхней границе, но это далеко не обязательное условие. Женщины с недостатком железа в крови чаще ощущают усталость, вялость и ломоту в теле. Им тяжело даются даже простые физические упражнения. Что уже говорить про работу по дому на 38 неделе беременности.
Существует также ряд факторов, которые могут усугубить риск развития ЖДС:
- малый промежуток между беременностями, что не дает организму восстановится;
- токсикозы, так как рвота снижает уровень всех микроэлементов в крови;
- многоплодная беременность, в которой расход железа втрое больше обычного;
- дисбактериоз, который ухудшает всасываемость микроэлемента.
Низкий гемоглобин симптомы
Во время беременности количество крови в организме должно регулярно увеличиваться, чтобы питать плод. Дефицит железа вызывает недостаток формирования клеток, переносящих кислород и уничтожающих избыток углекислого газа. Это в свою очередь ведет к недостаточному питанию сердца и сосудов, ухудшается кровоток, могут наблюдаться нарушения ритма, головокружения, слабость. Если у вас резко упал гемоглобин, вы легко опознаете это по общей вялости, ломкости ногтей и волос, быстрой утомляемости и возникновению отдышки.
Это в свою очередь ведет к недостаточному питанию сердца и сосудов, ухудшается кровоток, могут наблюдаться нарушения ритма, головокружения, слабость. Если у вас резко упал гемоглобин, вы легко опознаете это по общей вялости, ломкости ногтей и волос, быстрой утомляемости и возникновению отдышки.
Основное, что нужно помнить – именно организм матери гарантирует ребенку нормальный уровень гемоглобина при рождении. Перед родами ваши показатели гемоглобина должны быть не ниже 110 г/л, иначе это уже грозит серьезной анемией новорожденному. Рекомендуется начинать лечение и принимать препараты для повышения гемоглобина уже при первых симптомах развития дефицита железа.
Можно ли беременным принимать БАДы с железом
Рынок богат препаратами, направленными на поддержку организма матери и ребенка. Большинство комплексов для будущих мам содержат в своем составе не только железо, но и фолиевую кислоту и группу витаминов B. Почему важно выбрать витамины с железом именно для беременных? В них содержится все нормы веществ, рассчитанные сразу на двоих. Многие не задумываются, что потребление простых витаминов уже не удовлетворяет потребностей будущей матери. Растущий плод забирает на себя все доступные элементы и, если какие-то из них окажутся на грани дефицита, это может спровоцировать серьезные проблемы со здоровьем матери.
Так, анемия во время беременности не только негативно сказывается на состоянии женщины, но и представляет опасность для ребенка. Ослабленный организм матери может спровоцировать выкидыш, тем самым избавив себя от лишнего груза, чтобы выжить. Вовремя начатое лечение при резком падении показателей гемоглобина увеличит уровень железа в крови, насытит клетки кислородом и поможет дышать спокойно.
Какие элементы помогают усваиваться железу
Несмотря на то, что большинство комплексов и биоактивных добавок содержат оптимальное количество железа, употреблять его нужно разумно. Так существуют продукты, которые стимулируют его быструю усвояемость, а существуют и те, которые мешают. Чтобы нечаянно не сделать своему организму хуже, нужно знать простые правила сочетания.
Так существуют продукты, которые стимулируют его быструю усвояемость, а существуют и те, которые мешают. Чтобы нечаянно не сделать своему организму хуже, нужно знать простые правила сочетания.
Если вы любитель молочных продуктов, то лучше на время отказаться от чрезмерного употребление кальция и фосфора, они блокируют усвояемость железа. Также негативно влияет на процесс избыточное количество марганца и цинка. Чтобы наоборот стимулировать лучшую усвояемость метала, включите в свой рацион:
- Цитрусовые и витамин С – рекомендуется запивать таблетки цитрусовым или гранатовым соком. Регулярное употребление аскорбиновой кислоты способно улучшить усвояемость железа в более чем 5 раз.
- Витамин В6, В9 и В12 – облегчают состояние организма при анемии, укрепляют стенки сосудов и нервную систему. Помогают улучшить структуру кровяных телец и стимулируют их дополнительную выработку.
- Молибден и медь – помогают поддерживать оптимальный уровень ферментов, которые отвечают за усвояемость железосодержащих веществ, а также активно участвуют в образовании эритроцитов.
Автор:
Штатный копирайтер
Эта статья была написана опытным копирайтером в сфере здоровья и красоты.
Гемостаз при беременности — норма, причины нарушений
Нормальная беременность сопровождается множеством изменений, направленных на обеспечение роста плода. Перемены происходят и в системе гемостаза, при этом любые отклонения от нормы могут быть чреваты серьезными осложнениями как для матери, так и для ребенка.
Изменения гемостаза при беременности
Перемены в системе гемостаза у беременных женщин в первую очередь связаны с появлением нового круга кровообращения — маточно-плацентарного, необходимого для полноценного обеспечения плода кислородом и питательными веществами.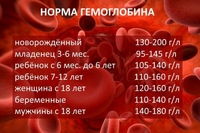
Изменения уровня тромбоцитов
В большинстве случаев содержание в крови тромбоцитов остается неизменным, однако примерно у 10% женщин1 концентрация этих клеток снижается — развивается тромбоцитопения. Обычно она связана с тремя состояниями2:
- Гипертонические расстройства, например, преэклампсия
- Гестационная тромбоцитопения, вызванная увеличением общего объема крови
- Идиопатическая (то есть развившаяся по невыясненным причинам) тромбоцитопеническая пурпура.
Изменения свертывающей системы крови
В период беременности происходят существенные изменения в системе гемостаза, направленные на усиление суммарной активности факторов свертывания крови3. Это обусловлено тем, что в стенках сосудов, обеспечивающих плацентарный кровоток и, следовательно, жизнедеятельность плода, нет слоя, который позволяет предотвратить свертывание крови внутри сосудов. На тканях плаценты регулярно скапливаются нити фибрина. Чтобы они не нарушали кровоток, необходимо постоянно их растворять, а для этого фибринолитическая система крови должна быть гораздо более активна, чем до зачатия. Именно поэтому показатели, отражающие уровень коагуляции и фибринолиза у здоровых женщин, которые ждут ребенка, повышены.
С увеличением коагуляционного потенциала и связано значительное повышение уровня почти всех факторов свертывания крови, кроме факторов XI и XIII. Кроме того, увеличивается и концентрация в плазме фибриногена.
Изменения в показателях гемостаза у беременных женщин, общая картина1:
- Уровень плазменного фибриногена в конце беременности может быть выше нормы
- Содержание фактора VII может увеличиваться в несколько раз
- Уровень фактора фон Виллибранда и фактора VIII повышается в поздние сроки, когда активность коагуляционной системы увеличивается более чем вдвое по сравнению с небеременным состоянием
- Уровень фактора IX увеличивается незначительно
- Уровень фактора XI незначительно снижается
- Содержание фактора XIII после первоначального увеличения постепенно снижается, достигая половины нормального значения для небеременных женщин
- Уровень факторов II и V существенно не изменяется
- Антитромбин часто остается на прежнем уровне
- Активность протеина С, предположительно, не изменяется
- Антигены протеина С имеют тенденцию к увеличению во втором триместре, тем не менее они остаются в пределах нормы
- Общий и свободный протеин S снижается с увеличением срока гестации.

- Фибринолитическая активность при беременности снижается, оставаясь низкой в родах ив послеродовый период.
Из важных изменений, происходящих в системе гемостаза у здоровых женщин, необходимо отметить рост концентрации D-димера по мере увеличения сроков беременности.
Таким образом, при беременности наблюдаются физиологические изменения системы гемостаза в сторону гиперкоагуляци.
Какие лабораторные параметры позволяют оценить систему гемостаза при беременности?
Большинство специалистов сходится во мнении, что оценку гемостаза обязательно проводить на разных сроках беременности, начиная с момента первичного обследования.
Для оценки гемостаза исследуется уровень нескольких показателей, каждый из которых играет важное значение в функционировании системы свертывания крови.
Минимальное обследование гемостаза включает в себя определение следующих параметров:
АЧТВ — активированное частичное тромбопластиновое время. В некоторых лабораториях этот показатель называют АПТВ (активированное парциальное тромбопластиновое время). АЧТВ — это время, необходимое для сворачивания плазмы крови после добавления к ней кальция, фосфолипидов и каолина.
Укорочение АЧТВ говорит об ускорении свертывания и увеличении вероятности развития ДВС-синдрома, а также о возможном наличии антифосфолипидного синдрома или недостаточности факторов свертывания.
Удлинение АЧТВ характерно для недостаточной коагуляционной способности крови и риске кровотечений во время родов или в послеродовой период.
Протромбиновое время — показатель гемостаза, показывающий, сколько времени нужно для свертывания плазмы крови при добавлении к ней кальция и тканевого фактора. Отражает внешний путь свертывания.
Укорочение протромбинового времени характерно для ДВС-синдрома.
Удлинение может говорить об увеличении вероятности послеродового кровотечения вследствие дефицита ряда факторов свертывания, заболеваний печени, недостаточности витамина К и некоторых других состояний и заболеваний.

В различных лабораториях протромбиновое время может быть представлено тремя способами:
- Протромбиновый индекс, представляющий собой отношение данного результата протромбинового времени к результату нормальной плазмы крови.
- Протромбин по Квику, который отражает уровень различных факторов свертывания в процентах.
- МНО, или INR — международное нормализованное отношение, показатель, отражающий сравнение свертывания крови исследуемого образца со свертыванием стандартизированной крови в норме.
Фибриноген — белок, из которого образуется фибрин, участвующий в формировании красного тромба.
Снижение содержания этого белка наблюдается при ДВС-синдроме, патологии печени.
Повышение уровня фибриногена во время беременности — вариант нормы. Также следует определять количество тромбоцитов в крови для исключения тромбоцитопатий.
D-димер — это продукт распада фибрина, небольшой фрагмент белка, присутствующий в крови после разрушения тромба. То есть его повышение говорит об активном процессе тромбообразования. В то же время этот показатель физиологически повышается при беременности.
Однако для того, чтобы подтвердить, что у пациента развился тромбоз, только измерения уровня D-димера недостаточно. Для подтверждения диагноза следует провести дополнительные инструментальные методы исследования (ультразвуковое дуплексное ангиосканирование, КТангиография) и оценить наличие клинических признаков заболевания.
При подозрении на наличие антифосфолипидного синдрома (АФС) врачи могут определять наличие волчаночного антикоагулянта, антикардиолипиновых антител и антител к β2-гликопротеину 1.
Также в некоторых случаях врачи могут предполагать наличие наследственной тромбофилии (генетически обусловленной способности организма к формированию тромбов). С более подробной информацией о наследственных тромбофилиях вы можете ознакомиться в соответствующем разделе.

Список литературы
- Prisco D., Ciuti G., Falciani M. Hemostatic changes in normal pregnancy // Hematol. Meet.Reports (formerly Haematol. Reports). 2009;1(10):1-5.
- Katz D., Beilin Y. Disorders of coagulation in pregnancy // Br. J. Anaesth. / ed. Hemmings H.C.Oxford University Press. 2015;115(suppl 2):ii75-ii88.
- Иванов А.В. Нарушение системы гемостаза при беременности: клинико-диагностическиеаспекты // Лабораторная медицина — 2014. — Т. 4. — № 11. — С. 60–63.
SARU.ENO.19.03.0436
Как определить анемию при беременности?
Во время беременности необходимо проверять ряд показателей, которые предоставят информацию о состоянии женского организма. Одни из важных показателей —это уровень гемоглобина и уровень железа в крови.
Анемия — это состояние, характеризующееся уменьшением количества эритроцитов и снижением уровня гемоглобина в единице объема крови.
Всемирная организация здравоохранения и Американская коллегия акушеров и гинекологов подтверждают наличие анемии при беременности для следующих показаний гемоглобина:
- Для первого триместра: Hb <11 г/дл.
- Для второго триместра: Hb <10,5 г/дл.
- Для третьего триместра: Hb <11 г/дл.
Осложнения возникающие при железо-дефицитной анемии.
- хроническая гипоксия плода
- задержка развития плода.
- невынашивание беременности
- слабость родовой деятельности
- ранние послеродовые кровотечения
- гипогалактия
- гнойно-септические осложнения в послеродовом периоде.
Самые частые причины развития анемии.
1. Дефицит железа в организме.Факторы, влияющие на развитие железодефицитной анемии:
- Низкое поступление железа с пищей (вегетарианство, нарушение питания)
- Обильные менструации в анамнезе.
- Хронические заболевания желудочно-кишечного тракта, при которых нарушается всасывания питательных веществ в том числе микроэлементов.

- Инфекционные заболевания.
- Короткий промежуток между беременностями.
При недостаточном потреблении из продуктов — во время длительной кулинарной обработки уничтожается значимая часть фолатов.
- Употребление алкоголя — алкоголь препятствует абсорбации фолата.
- Нарушение всасывания в кишечнике — при болезнях желудочно-кишечного тракта.
Как проявляется анемия во время беременности?
Ранние симптомы развития анемии неярко выражены — это легкая утомляемость, слабость, небольшие головокружения, легкая отдышка во время нагрузки, учащенное сердцебиение. При выраженной анемии проявляется бледность.
Железодефицитная анемия может спровоцировать развитие преждевременных родов, влияет и на внутриутробное развитие плода.
Диагностика анемии при беременности.
Специалисты медицинского центра «САНАС» производят забор и анализ крови, измеряют сывороточное железо, ферритин и трансферрин у пациентки. Железодефицитная анемия подтверждается при обнаружении сниженного уровня железа и ферритина, на фоне повышенного транссферина в сыворотке крови.
Лечение железодефицитной анемии.
Для лечения железодефицитной анемии назначают препараты сульфата железа в виде таблеток. Так как некоторые беременные не могут полностью абсорбировать достаточное количества железа из таблеток, может быть назначено парентеральное введение препаратов (например, внутримышечные инъекции).
Во время лечения обязателен еженедельный забор крови на исследование гематокрита и гемоглобина, в случае отсутствия изменений в анализах, стоит подозревать и наличие дефицита фолатов.
Дефицит фолатов определяется по его уровню в сыворотке крови. Лечат фолатдефицитную анемию при беременности приемом препаратов фолиевой кислоты.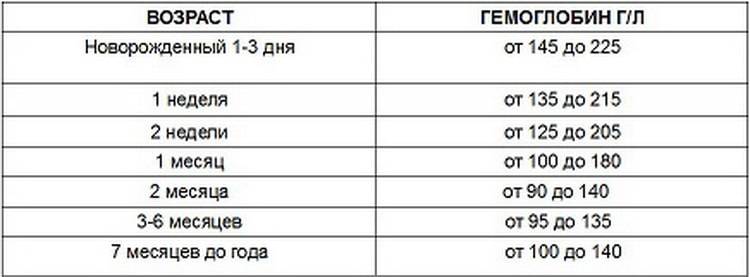 Такие препараты могут быть назначены беременным женщинам в целях профилактики и тем, кто только планирует беременность.
Такие препараты могут быть назначены беременным женщинам в целях профилактики и тем, кто только планирует беременность.
Профилактика железодефицитной анемии.
Лучшая профилактика анемии — это проверка запасов железа, определение уровня гемоглобина ещё на этапе планирования беременности. При выявлении каких-либо отклонений производится коррекция уровня железа в крови, в рацион добавляются продукты с высоким содержанием железа, могут быть назначены витаминно-минеральные комплексы.
В медицинском центре «САНАС» работают квалифицированные гематологи, которым вы сможете доверить своё здоровье.
Гемоглобин при беременности: Норма, мифы и реальность | Дневник будущей мамы
Какой гемоглобин у беременной считается нормой? Этот вопрос вызывает огромное количество споров в медицинском сообществе. В норме ли у тебя гемоглобин? Выше? Ниже? В этой статье ты найдешь ответы на свои вопросы.
Гемоглобин – это сложная химическая молекула, состоящая из 514 аминокислот, причем 7 из них являются незаменимыми. Считается, что они не синтезируются организмом и должны поступать извне.
Снижение гемоглобина во второй половине беременности является нормальным. Это происходит из-за увеличения объема циркулируемой крови в 1,5 раза по сравнению с небеременным состоянием. При этом, количество эритроцитов (красных кровяных телец, которые переносят кислород) увеличивается не сильно. Что приводит к расжижению крови.
Согласно ВОЗ во третьем триместре беременности нормой считается показатель гемоглобина в пределах 110 -140 г/л. Перед родами допускается снижение до 100 г/л.
Немаловажную роль играет самочувствие беременной. Если анализы показывают низкий, по мнению врачей, гемоглобин, а женщина чувствует себя прекрасно: активна, бодра, полна сил, ребенок шевелится регулярно, то скорее всего не стоит сильно беспокоиться. Достаточно скорректировать диету. Подробнее читай в моей статье Упал-отжался…5 способов как поднять гемоглобин у беременной.
Если женщина себя плохо чувствует, ребенок мало или слишком много и сильно шевелится, стоит прислушаться к рекомендациям врача. Зачем нужно поднимать гемоглобин читай в следующей моей статье.
Чтобы грамотно назначить препарат, провести коррекцию диеты для беременной необходимо знать причину патологического снижения уровня гемоглобина. Причин всего 3.
1) Недостаток железа. Неправильный рацион питания или проблемы с всасыванием железа у беременной. В этом случае необходимо увеличить долю железосодержащих продуктов в рационе и решать проблемы пищеварения.
2) Недостаточно сбалансированное питание по белку, а вернее аминокислотам. В этом случае предпочтение следует отдать зеленым листовым овощам. О роли хлорофилла в поднятии гемоглобина читай в моей статье «Упал-отжался…5 способов как поднять гемоглобин у беременной».
3) Недостаток витамина В12. Отсутствие синтеза этого витамина в кишечнике из-за преобладания гнилостной микрофлоры. В12 – это кобольтосодержащее соединение, которое выступает в роли катализатора биохимических реакций синтеза гемоглобина. В этом случае лучше предпочесть витамин В12 в форме метилкобаломина. В отличие от широко распространенного цианокобаломина, он всасывается уже в ротовой полости. И посему, проблемы с пищеварением у беременной, которые и явились причиной его недостатка, не помешают его всасыванию.
4) Еще одной причиной снижения гемоглобина является наличие паразитов, поскольку одни из них питаются кровью, а другие вызывают внутренние кровотечения. Вот почему антипаразитарная программа — одно из обязательных условий подготовки к зачатию. Тем не менее, во время беременности, антипаразитарные программы запрещены, по причине высокой токсичности трав и препаратов, используемых для этих целей. Для беременной, в этом случае, выход один — увеличить дозу железосодержащих продуктов.
Высокий гемоглобин во второй половине беременности не менее опасен. Это может говорить о чрезмерной густоте крови, что, в свою очередь, может привести к риску тромбообразования.
Для разжижения крови нужны ОМЕГА-3 жирные кислоты или соответствующая коррекция рациона. Подробнее об ОМЕГА-3 для беременной читай в моей статье «Как родить умного ребенка? – миссия выполнима» и «ТОП-5 продуктов для подготовки к родам».
Помимо этого врач может назначить препараты для снижения риска тромбообразования.
В любом случае, тебе следует следить за своим самочувствием, самочувствием твоего малыша. Чаще гулять в парках, особенно хвойных, заниматься легкой физической активностью. Береги себя и своего малыша! Подписывайся на мой канал! До скорой встречи.
Связь между уровнем гемоглобина в первые 20 недель беременности и исходами беременности
Аннотация
Фон
Низкий уровень гемоглобина связан с неблагоприятными исходами беременности. Наше исследование было направлено на оценку связи гемоглобина (Hb) в первые 20 недель беременности и восстановления низкого уровня Hb с исходами беременности в Австралии.
Методы
Клинические данные по одноплодной беременности из двух государственных больниц третьего уровня в Новом Южном Уэльсе были получены за 2011–2015 годы.Связь между самым низким результатом Hb в первые 20 недель беременности и неблагоприятными исходами определялась с помощью скорректированной регрессии Пуассона. Пациенты с гемоглобином <110 г / л были классифицированы как «восстановленные» и «не восстановленные» на основании результатов гемоглобина, начиная с 21 недели, и риск неблагоприятных исходов исследован с помощью скорректированной регрессии Пуассона.
Результаты
Из 31 906 одноплодных беременностей 4,0% имели Hb <110 и 10,2% - ≥140 г / л на сроке ≤20 недель. Женщины с низким уровнем гемоглобина имели значительно более высокий риск послеродового кровотечения, переливания крови, преждевременных родов, очень низкой массы тела при рождении и передачи ребенка в учреждение более высокого уровня или мертворождения.Высокий гемоглобин также был связан с более высоким риском преждевременных родов, очень низкой массой тела при рождении и переходом к более высокому уходу / мертворождению. Переливание крови было единственным исходом, при котором риск снижался с увеличением Hb. Риск переливания был значительно ниже в «восстановленной» группе по сравнению с «невосстановленной» (OR 0,39, 95% ДИ 0,22–0,70), но восстановление Hb не оказало значительного влияния на другие измеренные исходы.
Переливание крови было единственным исходом, при котором риск снижался с увеличением Hb. Риск переливания был значительно ниже в «восстановленной» группе по сравнению с «невосстановленной» (OR 0,39, 95% ДИ 0,22–0,70), но восстановление Hb не оказало значительного влияния на другие измеренные исходы.
Выводы
Женщины с низким и высоким уровнем гемоглобина в первые 20 недель беременности имели более высокий риск неблагоприятных исходов, чем женщины с нормальным уровнем гемоглобина.Восстановление гемоглобина через 20 недель не улучшило показатели большинства неблагоприятных исходов, но снизило риск переливания крови.
Образец цитирования: Randall DA, Patterson JA, Gallimore F, Morris JM, McGee TM, Ford JB, et al. (2019) Связь между уровнем гемоглобина в первые 20 недель беременности и исходами беременности. PLoS ONE 14 (11): e0225123. https://doi.org/10.1371/journal.pone.0225123
Редактор: Массимо Чиккоцци, университет биомедицинского кампуса, ИТАЛИЯ
Поступила: 11 июля 2019 г .; Принята к печати: 29 октября 2019 г .; Опубликован: 13 ноября 2019 г.
Авторские права: © 2019 Randall et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Набор данных, используемый в этой статье, был создан путем извлечения клинических данных матерей из базы данных ObstetriX и электронных медицинских записей в больнице Royal North Shore и больнице Westmead за период с 2011 по 2015 годы.Разрешение на использование наборов данных было получено от местного округа здравоохранения Северного Сиднея Комитетом по этике исследований в области здравоохранения, а также посредством дополнительных приложений оценки для каждой больницы. Извлечение данных для базы данных ObstetriX осуществлялось хранителями данных в каждой больнице, а извлечение данных eMR было предпринято третьей стороной по контракту. Деидентифицированные данные были безопасно переданы и затем собраны авторами. Как авторы, мы не можем делиться предоставленными нам наборами данных.Процедуры получения доступа к данным можно получить в Исследовательском бюро местного медицинского округа Северного Сиднея (тел. +61 2 9926 4590, https://www.nslhd.health.nsw.gov.au/AboutUs/Research/Office), и Женский институт исследований и сбора данных Вестмид (W 2 IRED; связаться с доцентом / профессором Сенг Чай Чуа +61 2 8850 8100, https://www.wslhd.health.nsw.gov.au/WNH/Health- Профессионалы / Исследования).
Извлечение данных для базы данных ObstetriX осуществлялось хранителями данных в каждой больнице, а извлечение данных eMR было предпринято третьей стороной по контракту. Деидентифицированные данные были безопасно переданы и затем собраны авторами. Как авторы, мы не можем делиться предоставленными нам наборами данных.Процедуры получения доступа к данным можно получить в Исследовательском бюро местного медицинского округа Северного Сиднея (тел. +61 2 9926 4590, https://www.nslhd.health.nsw.gov.au/AboutUs/Research/Office), и Женский институт исследований и сбора данных Вестмид (W 2 IRED; связаться с доцентом / профессором Сенг Чай Чуа +61 2 8850 8100, https://www.wslhd.health.nsw.gov.au/WNH/Health- Профессионалы / Исследования).
Финансирование: Исследование финансировалось за счет средств пилотного проекта Австралийского национального управления крови.Спонсор не принимал участия в планировании исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Каждая десятая женщина страдает обильным кровотечением после родов, и 15% этих женщин будут переливать эритроциты. [1] Отмечено увеличение количества переливаний крови среди беременных женщин, что вызывает озабоченность.[2, 3] Дородовое и дородовое выявление и коррекция анемии может быть эффективной стратегией для уменьшения последствий кровопотери после родов и улучшения исходов родов. [4]
Потребность в железе увеличивается во время беременности, в основном для увеличения массы красных кровяных телец, удовлетворения потребностей плода в железе и для компенсации кровопотери при родах. [5] Хотя во время беременности наблюдается увеличение объема красных кровяных телец, наблюдается большее увеличение объема плазмы, и это дифференциальное увеличение приводит к разбавлению гемоглобина (Hb) в крови во время беременности. [6] В Австралии не существует согласованного нормального диапазона для концентрации гемоглобина у беременных [7] и нет данных о здоровье населения, в которых можно было бы проспективно собирать уровни гемоглобина для изучения диапазонов и их влияния на исходы. Всемирная организация здравоохранения (ВОЗ) считает беременных женщин с гемоглобином <110 г / л анемией [8], однако пороговые значения получены в основном из развивающихся стран и не обязательно могут быть обобщены. [7] Пороговые значения, рекомендованные Центрами по контролю и профилактике заболеваний США, были разработаны на основе четырех европейских исследований здоровых беременных женщин, получающих добавки железа.[9] Они определили следующие максимальные уровни гемоглобина для диагностики анемии: 110 г / л в первом триместре, 105 г / л во втором триместре и 110 г / л в третьем триместре. [9] На сегодняшний день никаких исследований среди австралийских беременных не проводилось.
[6] В Австралии не существует согласованного нормального диапазона для концентрации гемоглобина у беременных [7] и нет данных о здоровье населения, в которых можно было бы проспективно собирать уровни гемоглобина для изучения диапазонов и их влияния на исходы. Всемирная организация здравоохранения (ВОЗ) считает беременных женщин с гемоглобином <110 г / л анемией [8], однако пороговые значения получены в основном из развивающихся стран и не обязательно могут быть обобщены. [7] Пороговые значения, рекомендованные Центрами по контролю и профилактике заболеваний США, были разработаны на основе четырех европейских исследований здоровых беременных женщин, получающих добавки железа.[9] Они определили следующие максимальные уровни гемоглобина для диагностики анемии: 110 г / л в первом триместре, 105 г / л во втором триместре и 110 г / л в третьем триместре. [9] На сегодняшний день никаких исследований среди австралийских беременных не проводилось.
Анемия при поступлении при рождении была связана с более высокой частотой кесарева сечения и неблагоприятными исходами, такими как более высокая частота послеродовых кровотечений (ПРК), переливание крови и перевод младенца в отделение интенсивной терапии новорожденных [10]. Анемия в первом и втором триместре беременности связана с низкой массой тела при рождении и преждевременными родами [11, 12], а также с высоким уровнем гемоглобина.[13]
Национальные рекомендации по уходу за беременными рекомендуют всем женщинам проверять уровень гемоглобина при первом дородовом посещении и еще раз примерно на 28 неделе беременности [14]. Хотя рекомендуется обследовать и лечить любую анемию, регулярный прием добавок железа не рекомендуется при каждой беременности. [15] Рекомендации по контролю за кровью пациентов направлены на сокращение акушерских переливаний крови за счет индивидуального подхода, который пытается снизить потребность в переливании и, следовательно, избежать ненужного контакта с кровью и продуктами крови.[16] Учитывая потенциальную важность уровня железа до родов в помощи женщинам в преодолении кровопотери, связанной с родами, важно понимать влияние низкого уровня гемоглобина на ранних сроках беременности на неблагоприятные исходы. На этом этапе, возможно, удастся восстановить уровень гемоглобина. Таким образом, наше исследование было направлено на оценку уровней гемоглобина на сроке ≤20 недель и связи с ПРК и переливанием крови при рождении или послеродовом периоде, а также на снижение уровня гемоглобина на вероятность ПРК или переливания крови и / или улучшение исходов беременности.
На этом этапе, возможно, удастся восстановить уровень гемоглобина. Таким образом, наше исследование было направлено на оценку уровней гемоглобина на сроке ≤20 недель и связи с ПРК и переливанием крови при рождении или послеродовом периоде, а также на снижение уровня гемоглобина на вероятность ПРК или переливания крови и / или улучшение исходов беременности.
Материалы и методы
Устройство и установка
Исследование представляло собой ретроспективное когортное исследование с использованием данных больниц и проводилось в двух крупных государственных больницах в Новом Южном Уэльсе, Австралия, Королевской больнице Северного побережья и больнице Вестмид. Были включены одноплодные беременности за пятилетний период с 1 января 2011 г. по 31 декабря 2015 г.
Источники данных
Подробные данные о характеристиках матери, истории беременности и факторах рождения были получены из базы данных ObstetriX («данные о рождении»), клинической базы данных, которая заполняется акушерками при бронировании, во время дородовых посещений и при поступлении при родах, записывая информацию о рождении. срок беременности не менее 20 недель или вес при рождении 400 г.Данные о возрасте матери, стране рождения (COB), стационарных и амбулаторных обращениях в перинатальный период (от начала беременности до шести недель послеродового периода) для матери были получены из электронной медицинской карты («eMR»). Большинство диагнозов и процедур были закодированы в соответствии с Международной статистической классификацией болезней и проблем, связанных со здоровьем, Австралийской модификацией (ICD10-AM) и Австралийской классификацией медицинских вмешательств [17], с небольшим меньшинством, закодированными с использованием классификации SNOMED.[18] Результаты Hb и дата теста были получены либо из базы данных ObstetriX, где они были введены вручную, либо из данных патологии eMR (где результаты были получены из местной лаборатории патологии больницы или из внешней лаборатории, связанной только для Вестмида).
Переменные
Чтобы выявить женщин с низким уровнем гемоглобина, были проанализированы все результаты, полученные в первые 20 недель беременности, и самый низкий результат был классифицирован по категориям 10 г / л (<90, 90–99, 100–109 и т. Д. 150–159 г / л), а также три широкие категории <110 (диапазон 45–109), 110–139 и 140+ (диапазон 140–159) г / л.Результаты Hb между 8 и 14 (n = 24) были перекодированы на 80–140 из-за вероятных ошибок транскрипции. Все другие результаты за пределами вероятных значений (от 45 до 159 г / л), определенных клиническими авторами и сравнений с уровнями гематокрита, были пропущены. Мы выбрали самый низкий уровень гемоглобина в первые 20 недель, так как нас интересовал уровень гемоглобина перед любым лечением. Те, у кого не было результата Hb в течение первых 20 недель, были исключены из исследования, и распределение их характеристик сравнили с распределением тех, кто участвовал в исследовании, с использованием стандартизованных процентных различий.[19] Женщины с результатом Hb <110 г / л на сроке ≤20 недель были дополнительно обследованы, чтобы определить их последующее среднее значение Hb в оставшейся части гестационного периода до рождения (> 20 недель). Эти женщины были классифицированы как «выздоровевшие», если их средний гемоглобин после 20 недель беременности составлял 110 г / л или более, «не восстановленные», если средние результаты Hb были <110 г / л, и «без дальнейших результатов», если больше не было гемоглобина. результаты были записаны через 20 недель и до родов.
Основными исходами были послеродовое кровотечение (ПРК; комбинированный показатель, использующий данные о рождении и eMR) и переливание крови при рождении или через 6 недель после рождения (данные о рождении и eMR).Дальнейшие исходы включали преждевременные роды (срок беременности <37 недель; данные о родах), разделенные на запланированные (индукционное или предродовое кесарево сечение) и самопроизвольные, мертворождение (данные о рождении), перевод новорожденных в специализированный детский сад (SCN) или отделение интенсивной терапии новорожденных (NICU). ; данные о рождении), малый для гестационного возраста <10% (SGA; данные о рождении) [20] и очень низкий вес при рождении (<1500 г; данные о рождении). См. Более подробную информацию в таблице S1.
; данные о рождении), малый для гестационного возраста <10% (SGA; данные о рождении) [20] и очень низкий вес при рождении (<1500 г; данные о рождении). См. Более подробную информацию в таблице S1.
Возраст матери, COB и почтовый индекс проживания были получены из eMR.Равенство, курение, индекс массы тела (ИМТ), гестационный диабет, гипертензия при беременности, аномальное расположение плаценты, анемия, диабет, гипертония и обширные операции на матке в анамнезе были получены на основе данных о рождении. Социально-экономический статус был сопоставлен с Индексом относительных социально-экономических преимуществ и недостатков (IRSAD) [21] с использованием почтового индекса и разделен на квинтили населения. Дополнительные факторы рождения, которые могли быть опосредующими причинами ПРК или переливания крови, т.е. начало родов, способ родов и разрыв промежности, были получены из данных о рождении.
Статистические методы
Характеристики женщин в трех широких группах гемоглобина (<110, 110–139, 140+ г / л) сравнивались с использованием тестов χ 2 . Данные по исходам также сравнивались между этими широкими группами гемоглобина с использованием процентов. Относительная частота ПРК, переливания крови, преждевременных родов, малых для гестационного возраста, очень низкой массы тела при рождении и перевода в отделение интенсивной терапии / SCN или мертворождений исследовалась более детально в группах гемоглобина (<90, 90–99, 100–109, 110–119 , 120–129, 130–139, 140–149, 150–159 г / л) с использованием модифицированных моделей регрессии Пуассона с поправкой на материнские характеристики (возраст, ИМТ, страна рождения, родство, квинтиль SES), факторы риска беременности (курение , гестационный диабет и гипертония, ранее существовавший диабет и гипертензия, предыдущие операции на матке, аномальное расположение плаценты, дородовое кровотечение) и потенциально опосредующие факторы (начало родов, способ родов, разрывы промежности).Использовался составной показатель мертворождения или перевода на более высокий уровень помощи, поскольку не было достаточного количества мертворожденных, чтобы рассматривать их отдельно..gif) Риск тех же исходов для женщин с «восстановленным» и «не восстановленным» гемоглобином также оценивался с использованием модифицированного Пуассона и корректировался с помощью меньшего набора ковариат, которые различались в группах гемоглобина и также влияли на исходы (страна рождения, Квинтиль SES, паритет, курение, ИМТ, начало родов, способ родов, слезы промежности). Не было достаточного количества мертворожденных или младенцев с очень низкой массой тела при рождении для отдельного обследования, поэтому они были объединены в комбинированный показатель неблагоприятного исхода новорожденных с переводом на более высокий уровень оказания медицинской помощи.
Риск тех же исходов для женщин с «восстановленным» и «не восстановленным» гемоглобином также оценивался с использованием модифицированного Пуассона и корректировался с помощью меньшего набора ковариат, которые различались в группах гемоглобина и также влияли на исходы (страна рождения, Квинтиль SES, паритет, курение, ИМТ, начало родов, способ родов, слезы промежности). Не было достаточного количества мертворожденных или младенцев с очень низкой массой тела при рождении для отдельного обследования, поэтому они были объединены в комбинированный показатель неблагоприятного исхода новорожденных с переводом на более высокий уровень оказания медицинской помощи.
Этика
Этическое одобрение для этого исследования было получено от этического комитета местного медицинского округа Северного Сиднея (LNR / 17 / HAWKE / 32).
Результаты
В период с 1 января 2011 г. по 31 декабря 2015 г. в больницах Royal North Shore и Westmead было зарегистрировано 40 352 родов. После исключения (см. Рис. 1) осталось 31 906 родов одиночек. Ряд женщин были исключены из анализа из-за отсутствия гемоглобина в первые 20 недель (n = 4621). Сравнение характеристик тех женщин, у которых отсутствует гемоглобин, и популяции окончательного анализа приведено в таблице S2.Женщины, у которых в течение первых 20 недель беременности отсутствовал результат Hb, были аналогичны женщинам в исследуемой популяции, но с меньшей вероятностью родились в Южной Азии и с большей вероятностью родились в Океании, имели 2 или более предыдущих беременностей, имели в анамнезе дефицит B12 / фолиевой кислоты и курили во время беременности (стандартизованная разница> 0,1).
Среднее значение самого низкого уровня гемоглобина на сроке ≤20 недель, зарегистрированное для каждой женщины, составило 127,4 г / л (стандартное отклонение 10,0), а медиана составила 128 (межквартильный размах 13).В целом, 4,0% женщин имели Hb <110 г / л, 85,7% имели Hb 110–139 г / л и 10,2% имели Hb 140+ г / л на сроке ≤20 недель. Женщины с Hb <110 г / л на сроке ≤20 недель с меньшей вероятностью, чем женщины с Hb 110–139 и 140+ родились в Австралии, Европе, Южной и Северо-Восточной Азии и Америке, и с большей вероятностью родились. родиться в Африке, на Ближнем Востоке, в Южной и Центральной Азии (Таблица 1). Также имел место социально-экономический градиент, при котором вероятность проживания в наиболее благополучных районах возрастала с повышением уровня гемоглобина.Женщины с более низким уровнем гемоглобина имели более высокий показатель паритета, с большей вероятностью имели ИМТ <18,5 и имели в анамнезе железодефицитную анемию, чем женщины со средним уровнем гемоглобина, у которых, в свою очередь, были более высокие показатели, чем у женщин с гемоглобином 140+. В группе с низким уровнем гемоглобина чаще было запланировано кесарево сечение, реже рождались естественные роды без посторонней помощи, а среди вагинальных родов частота травм промежности была аналогичной.
Женщины с Hb <110 г / л на сроке ≤20 недель с меньшей вероятностью, чем женщины с Hb 110–139 и 140+ родились в Австралии, Европе, Южной и Северо-Восточной Азии и Америке, и с большей вероятностью родились. родиться в Африке, на Ближнем Востоке, в Южной и Центральной Азии (Таблица 1). Также имел место социально-экономический градиент, при котором вероятность проживания в наиболее благополучных районах возрастала с повышением уровня гемоглобина.Женщины с более низким уровнем гемоглобина имели более высокий показатель паритета, с большей вероятностью имели ИМТ <18,5 и имели в анамнезе железодефицитную анемию, чем женщины со средним уровнем гемоглобина, у которых, в свою очередь, были более высокие показатели, чем у женщин с гемоглобином 140+. В группе с низким уровнем гемоглобина чаще было запланировано кесарево сечение, реже рождались естественные роды без посторонней помощи, а среди вагинальных родов частота травм промежности была аналогичной.
Наиболее частыми неблагоприятными исходами беременности были младенцы, переведенные в специализированные учреждения (16,0%), послеродовые кровотечения (13.6%), малолетних для гестационного возраста (9,5%) и преждевременных родов (7,1%) (таблица 2). Пациенты с Hb <110 г / л имели более высокий процент всех неблагоприятных исходов по сравнению с группой с Hb 110–139 г / л. У пациентов с Hb 140+ г / л вероятность многих неблагоприятных исходов была несколько выше, чем у пациентов с нормальным гемоглобином, но вероятность переливания была ниже, чем у пациентов с более низким Hb.
На рис. 2 показаны скорректированные отношения частоты неблагоприятных исходов по детальным группам гемоглобина. После поправки на коварианты в многомерных моделях наблюдалась U-образная связь между гемоглобином и всеми неблагоприятными исходами, за исключением переливания крови.Для большинства исходов риск был сравнительно выше при более низких уровнях Hb, чем при более высоких, причем риск начинал увеличиваться при уровнях Hb менее 120 (по сравнению с 120–129 г / л). U-образная зависимость была очень незначительной для ПРК, при этом скорректированные показатели среди лиц с самым высоким Hb (150–159) составляли всего 1,1 и не были значительными. Наблюдалась линейная зависимость между гемоглобином и скоростью переливания, причем скорость переливания была значительно выше в группах гемоглобина <120 г / л и ниже в группах гемоглобина ≥130 г / л (хотя и не достигала значимости) по сравнению с 120–129 г / L группа.
U-образная зависимость была очень незначительной для ПРК, при этом скорректированные показатели среди лиц с самым высоким Hb (150–159) составляли всего 1,1 и не были значительными. Наблюдалась линейная зависимость между гемоглобином и скоростью переливания, причем скорость переливания была значительно выше в группах гемоглобина <120 г / л и ниже в группах гемоглобина ≥130 г / л (хотя и не достигала значимости) по сравнению с 120–129 г / L группа.
Из 1282 женщин с Hb <110 г / л на сроке ≤20 недель 38% (n = 492) имели средний уровень Hb с 21 недели до рождения ≥110 г / л («восстановлен»), 38% (n = 488) нет («не восстановлен»), и еще 24% (n = 302) не имели результатов по гемоглобину после 21 недели (таблица 3). Мы сравнили риск неблагоприятных исходов для «восстановленных» и «невосстановленных» групп гемоглобина с поправкой на коварианты. Скорректированный риск переливания был значительно ниже в «восстановленной» группе по сравнению с «невосстановленной» группой, но не было значительного увеличения или уменьшения риска для других исходов.
Обсуждение
Среди 31 906 одноплодных беременностей 4% женщин имели Hb <110 г / л и 10% имели Hb 140+ г / л на сроке ≤20 недель беременности. Наши результаты показывают, что как низкий, так и высокий уровень гемоглобина на сроке ≤20 недель связаны с неблагоприятными исходами во время родов в U-образной форме, которая возрастает по обе стороны от точки наименьшего риска и составляет 120–129 г / л. Связь между низким уровнем гемоглобина и неблагоприятными исходами была относительно сильнее, чем связь между высоким уровнем гемоглобина и неблагоприятными исходами. Только переливание имело линейную зависимость: риск увеличивался при более низком Hb и снижался при более высоком Hb.U-образная связь между гемоглобином и неблагоприятными исходами, которую мы обнаружили, также была показана в исследовании, проведенном в Перу, при беременности как на большой, так и на небольшой высоте. [22]
Из женщин с низким уровнем гемоглобина на сроке ≤20 недель почти у 40% уровень гемоглобина восстановился во второй половине беременности. Восстановление гемоглобина, по-видимому, не изменило риск ПРК, преждевременных родов, SGA или составного показателя, включая перевод на более высокий уровень помощи, мертворождение и очень низкий вес при рождении, но снизило риск послеродового переливания крови.Эти данные согласуются с обзором данных испытаний, согласно которому добавление железа улучшило уровень гемоглобина у беременных, но не улучшило окончательно исходы беременности [23]. Причины, по которым улучшение гемоглобина не приводит к улучшению перинатальных исходов, требуют дальнейшего изучения. Может существовать критическое окно для воздействия низкого гемоглобина на исходы, или низкий уровень гемоглобина может быть симптомом основного состояния, которое само по себе является причиной плохого исхода. Другая возможность заключается в том, что восстановление гемоглобина действительно улучшает некоторые результаты, но не те, которые конкретно измеряются в нашем исследовании.
Восстановление гемоглобина, по-видимому, не изменило риск ПРК, преждевременных родов, SGA или составного показателя, включая перевод на более высокий уровень помощи, мертворождение и очень низкий вес при рождении, но снизило риск послеродового переливания крови.Эти данные согласуются с обзором данных испытаний, согласно которому добавление железа улучшило уровень гемоглобина у беременных, но не улучшило окончательно исходы беременности [23]. Причины, по которым улучшение гемоглобина не приводит к улучшению перинатальных исходов, требуют дальнейшего изучения. Может существовать критическое окно для воздействия низкого гемоглобина на исходы, или низкий уровень гемоглобина может быть симптомом основного состояния, которое само по себе является причиной плохого исхода. Другая возможность заключается в том, что восстановление гемоглобина действительно улучшает некоторые результаты, но не те, которые конкретно измеряются в нашем исследовании.
Более высокая частота ПРК, продемонстрированная в группах с низким уровнем гемоглобина по сравнению с группами с нормальным гемоглобином, согласуется с предыдущими данными, свидетельствующими о том, что анемия связана с более высоким риском ПРК. [24, 25] У женщин с высоким уровнем гемоглобина в антенатальном периоде частота ПРК несколько выше, чем у женщин. пациенты с нормальным уровнем гемоглобина (хотя и незначительно), но с меньшей вероятностью подвергались переливанию, чем пациенты с низким уровнем гемоглобина, что могло быть связано с лучшими запасами железа или тем, что лечащие врачи были более склонны переносить кровопотерю перед тем, как принять решение о переливании.Мы также обнаружили значительно более высокий риск неблагоприятных исходов, таких как преждевременные роды, очень низкий вес при рождении и перевод на более высокий уровень лечения или мертворождение для людей с высоким результатом Hb, как было обнаружено в других исследованиях [26, 27], возможно, из-за неадекватного содержания плазмы. увеличение объема или нарушение реакции на воспаление и инфекцию [5, 26] или, возможно, из-за высокого уровня гемоглобина до беременности.
Дородовое кровотечение и аномальное расположение плаценты могут вызывать анемию, а также связаны с неблагоприятными исходами беременности.[28, 29] Эти факторы были скорректированы в нашем анализе, но также маловероятно, что они повлияли на анемию в первые 20 недель беременности, поскольку кровотечение из-за этих факторов обычно происходит на более поздних сроках беременности.
Австралийские данные о распространенности анемии у беременных ограничены. Наша оценка низкого уровня гемоглобина (4%) была аналогична оценке женщин с анемией во время беременности в Южной Австралии в 2015 году (6,6%) [30]. Международные исследования выявили гораздо более высокие показатели материнской анемии: глобальная оценка в 2011 г. составила 38%.[31] Высокая доля женщин с железодефицитной анемией в анамнезе в нашей популяции (15%), особенно в группе с низким уровнем гемоглобина, предполагает, что, возможно, существовали возможности скорректировать низкий уровень гемоглобина из-за дефицита железа до беременности.
Нам удалось получить результаты Hb для большой группы беременных женщин и изучить результаты по уровням Hb на сроке беременности ≤20 недель. Однако ограничения этих данных заключались в том, что были доступны только результаты Hb, которые были вручную введены в данные о рождении акушерками или были получены из патологических лабораторий в больницах (в Royal North Shore) или в больничных или связанных лабораториях патологии (в Westmead).Это означало, что 13% беременных женщин (n = 4621) не имели достоверных результатов Hb в течение первых 20 недель беременности. Тем не менее, эти женщины были в целом похожи на женщин из последней популяции исследования. Кроме того, мы не знали причину низкого уровня гемоглобина или какие меры были приняты для восстановления гемоглобина, и могли сделать вывод о лечении только на основании изменений в результатах гемоглобина. Исходя из предыдущего опроса и клинического опыта, мы предполагаем, что большинство женщин принимали дополнительное железо либо в составе поливитаминов, либо в составе добавки, содержащей только железо [32], но без информации о том, какие добавки и сколько железа они содержащиеся в базе данных, мы не смогли изучить, как это повлияло на гемоглобин или результаты.Результаты по стране рождения предполагают, что некоторые случаи талассемии / серповидно-клеточной анемии могли быть пропущены, поскольку эти состояния более распространены в Африке и на Ближнем Востоке, где вероятность рождения женщин с низким гемоглобином была выше.
Выводы
Мы обнаружили, что у женщин с низким уровнем гемоглобина в первые 20 недель беременности вероятность ПРК и переливания крови после родов выше, чем у женщин с гемоглобином 120–129 г / л. Пациенты с высоким и низким уровнем гемоглобина имели повышенный риск преждевременных родов, очень низкий вес при рождении и комбинированные исходы в виде перевода на более высокий уровень помощи или мертворождения по сравнению с теми, у кого было 120–129 г / л.Восстановление гемоглобина во время беременности снизило риск послеродового переливания крови, но, по-видимому, не повлияло на риск других измеренных неблагоприятных исходов. Необходимы дальнейшие исследования, чтобы определить, почему низкий и высокий уровень гемоглобина в первые 20 недель связан с более неблагоприятными исходами и можно ли предотвратить эти неблагоприятные исходы до или во время беременности.
Благодарности
В состав Руководящей группы по акушерскому переливанию входят: Дженнифер Р. Боуэн (Королевская больница Северного побережья), Сандра Кокрейн (Национальное управление крови), Дэвид О Ирвинг (Служба крови Красного Креста Австралии), Джеймс П. Исбистер (Сиднейский университет), Элени Мейсон (Госпиталь Сент-Винсент), Майкл К. Николл (Здравоохранение Нового Южного Уэльса), Майкл Дж. Пик (Австралийский национальный университет), Аманда Томсон (Служба крови Австралийского Красного Креста) и Пенни О’Бейд (Комиссия по совершенствованию клинической практики).
Ссылки
- 1. Паттерсон Дж., Робертс С., Боуэн Дж., Ирвинг Д., Исбистер Дж., Моррис Дж. И др. Акушерское переливание крови во время беременности, родов и в послеродовой период: популяционное исследование. Obstet Gynecol. 2014. 123 (1): 126–33. pmid: 24463672
- 2. Knight M, Callaghan WM, Berg C, Alexander S, Bouvier-Colle MH, Ford JB и др. Тенденции послеродового кровотечения в странах с высокими ресурсами: обзор и рекомендации Международной совместной группы по послеродовым кровотечениям.BMC Беременность и роды. 2009; 9: 55. pmid: 19943928
- 3. Ford JB, Робертс CL, Симпсон JM, Vaughan J, Cameron CA. Повышенная частота послеродовых кровотечений в Австралии. Int J Gynaecol Obstet. 2007. 98 (3): 237–43. pmid: 17482190
- 4. Муньос М., Пенья-Росас Дж. П., Робинсон С., Мильман Н., Хольцгрев В., Брейманн С. и др. Управление кровью пациентов в акушерстве: ведение анемии и нарушений кроветворения во время беременности и в послеродовой период: консенсусное заявление NATA.Transfus Med. 2018; 28 (1): 22–39. pmid: 28722245
- 5. Мильман Н. Железо и беременность — хрупкое равновесие. Анналы гематологии. 2006. 85 (9): 559–65. pmid: 16691399
- 6. Мильман Н. Предродовая анемия: профилактика и лечение. Анналы гематологии. 2008. 87 (12): 949–59. pmid: 18641987
- 7. Национальное управление крови. Руководство по управлению кровью пациентов: Модуль 5 — Акушерство и материнство. Канберра: Национальное управление крови, 2015.
- 8.Всемирная организация здоровья. Концентрация гемоглобина для диагностики анемии и оценки степени тяжести. Женева: ВОЗ, 2011 г. Номер документа: WHO / NMH / NHD / MNM / 11.1.
- 9. Центры по контролю и профилактике заболеваний. Рекомендации по профилактике и контролю дефицита железа в США. Атланта, Джорджия: CDC; 1998 [цитируется 15 января 2019 года]. Доступно по адресу: https://www.cdc.gov/Mmwr/preview/mmwrhtml/00051880.htm.
- 10. Друккер Л., Хантс Ю., Фаркаш Р., Рухлемер Р., Самуэлофф А., Грисару-Грановский С.Железодефицитная анемия при поступлении в роды и родоразрешение связана с повышенным риском кесарева сечения и неблагоприятными исходами для матери и новорожденного. Переливание. 2015; 55 (12): 2799–806. pmid: 26246160
- 11. Аллен Л.Х. Анемия и дефицит железа: влияние на исход беременности. Am J Clin Nutr. 2000. 71 (5): 1280–4.
- 12. Haider BA, Olofin I, Wang M, Spiegelman D, Ezzati M, Fawzi WW. Анемия, пренатальное употребление железа и риск неблагоприятных исходов беременности: систематический обзор и метаанализ.BMJ. 2013; 346: f3443. pmid: 23794316
- 13. Мерфи Дж. Ф., Ньюкомб Р. Г., О’Риордан Дж., Коулз И. Ф., Пирсон Дж. Ф. Связь уровня гемоглобина в первом и втором триместрах с исходом беременности. Ланцет. 1986. 327 (8488): 992–5.
- 14. Департамент здравоохранения. Руководство по клинической практике: Ведение беременности. Канберра, Австралия: Департамент здравоохранения правительства Австралии, 2018.
- 15. Королевский колледж акушеров и гинекологов Австралии и Новой Зеландии.Заявление C-Obs 25: Добавки витаминов и минералов и беременность. Мельбурн: RANZCOG, 2014 Номер документа: C-Obs 25.
- 16. Isbister JP. Трехкомпонентная матрица управления кровью пациентов — обзор. Лучшая практика Res Clin Anaesthesiol. 2013. 27 (1): 69–84. pmid: 235
- 17. Национальный центр классификации здоровья. Международная статистическая классификация болезней и проблем, связанных со здоровьем, десятая редакция, австралийская модификация (ICD-10-AM), Австралийская классификация медицинских вмешательств (ACHI) и Австралийские стандарты кодирования (ACS), седьмое издание.Сидней: Национальный центр классификации здравоохранения, 2010.
- 18. SNOMED International. Что такое SNOMED CT? 2018 [цитируется 21 августа 2018 г.]. Доступно по адресу: https://www.snomed.org/snomed-ct/what-is-snomed-ct.
- 19. Остин ПК. Диагностика баланса для сравнения распределения исходных ковариат между группами лечения в выборках, сопоставленных с оценкой склонности. Статистика в медицине. 2009. 28 (25): 3083–107. pmid: 19757444
- 20. Доббинс Т.А., Салливан Э.А., Робертс К.Л., Симпсон Дж. М..Национальные процентили массы тела при рождении в Австралии с разбивкой по полу и гестационному возрасту, 1998–2007 гг. Med J Aust. 2012; 197 (5): 291–4. pmid: 22938128
- 21. Австралийское статистическое бюро. 2033.0.55.001 — Перепись населения и жилищного фонда: социально-экономические индексы территорий (SEIFA), Австралия, 2011 2011 [цитируется 15 июня 2018 года]. Доступно по адресу: http://www.abs.gov.au/AUSSTATS/[email protected]/allprimarymainfeatures/8C5F5BB699A0921CCA258259000BA619?opendocument.
- 22. Гонсалес Г.Ф., Стинланд К., Тапиа В.Уровень материнского гемоглобина и исходы для плода на малых и больших высотах. Американский журнал физиологии — регуляторной, интегративной и сравнительной физиологии. 2009; 297 (5): R1477 – R85. pmid: 19741055
- 23. Peña ‐ Rosas JP, De ‐ Regil LM, Garcia ‐ Casal MN, Dowswell T. Ежедневный пероральный прием добавок железа во время беременности. Кокрановская база данных Syst Rev.2015; (7).
- 24. Owiredu WKBA, Osakunor DNM, Turpin CA, Owusu-Afriyie O. Лабораторное прогнозирование первичного послеродового кровотечения: сравнительное когортное исследование.BMC Беременность и роды. 2016; 16 (1).
- 25. Кавле Дж. А., Штольцфус Р. Дж., Виттер Ф., Тильш Дж. М., Халфан СС, Колфилд Л. Е.. Связь между анемией во время беременности и кровопотерей во время и после родов у женщин с естественными родами на острове Пемба, Занзибар, Танзания. J Health Popul Nutr. 2008. 26 (2): 232–40. pmid: 18686556
- 26. Dewey KG, Oaks BM. U-образная кривая риска, связанного с материнским гемоглобином, статусом железа или добавками железа. Am J Clin Nutr.2017; 106: 1694С – 702С. pmid: 265
- 27. Gonzales GF, Tapia V, Fort AL. Материнские и перинатальные исходы при втором измерении гемоглобина у неанемичных женщин при первом бронировании: влияние высоты проживания в Перу. ISRN Акушерство и гинекология. 2012; 2012: 7.
- 28. Синха П., Куруба Н. Дородовое кровотечение: обновление. J Obstet Gynaecol. 2008. 28 (4): 377–81. pmid: 18604667
- 29. Ваганян С.А., Лавери Дж.А., Анант К.В., Винцилеос А.Аномалии имплантации плаценты и риск преждевременных родов: систематический обзор и метаанализ. Am J Obstet Gynecol. 2015; 213 (4): S78 – S90.
- 30. Scheil W, Jolly K, Scott J, Catcheside B, Sage L, Kennare R. Результат беременности в Южной Австралии, 2015 г. Аделаида: Отдел оценки результатов беременности, SA Health, Правительство Южной Австралии, 2017.
- 31. Стивенс Г.А., Финукейн М.М., Де-Регил Л.М., Пасиорек С.Дж., Флаксман С.Р., Бранка Ф. и др. Глобальные, региональные и национальные тенденции в концентрации гемоглобина и распространенности общей и тяжелой анемии у детей, беременных и небеременных женщин за 1995–2011 годы: систематический анализ репрезентативных данных для населения.Lancet Global Health. 2013; 1 (1): E16 – E25. pmid: 25103581
- 32. Чаттерджи Р., Шанд А., Нассар Н., Уоллс М., Хамбалия Аризона. Использование добавок железа во время беременности. Правильные ли женщины принимают правильное количество? Clin Nutr. 2016; 35 (3): 741–7. pmid: 26070630
Уровни гемоглобина в первом триместре беременности связаны с риском гестационного сахарного диабета, преэклампсии и преждевременных родов у китайских женщин: ретроспективное исследование | BMC Беременность и роды
В этом большом исследовании беременных мы обнаружили, что женщины, у которых до беременности ИМТ был ≥24 кг / м 2 , имели значительно более высокие уровни Hb в первом триместре, чем женщины, у которых до беременности ИМТ был ниже. <24 кг / м 2 .Кроме того, у женщин, у которых впоследствии развился ГСД и ПЭ, уровень гемоглобина в первом триместре был значительно выше, чем в контрольной группе, тогда как у женщин с преждевременными родами уровень гемоглобина в первом триместре был значительно ниже. После поправки на возможные факторы, влияющие на факторы, уровни Hb в течение первого триместра были значимо и положительно связаны с риском GDM и PE и были значимо и отрицательно связаны с риском преждевременных родов. Более того, среди женщин, у которых ИМТ до беременности был <24 кг / м ( 2 ), уровни гемоглобина более 130 г / л в течение первого триместра были связаны со значительно более высоким риском ГСД и более низкими показателями преждевременных родов.Более того, когда уровень гемоглобина превышал 150 г / л, риск ПЭ был значительно повышен. Однако среди женщин, у которых до беременности ИМТ был ≥24 кг / м 2 , только уровни гемоглобина выше 150 г / л повышали риск ГСД.
Подобно нашим результатам, более раннее обсервационное исследование 730 китайских беременных женщин показало, что высокие уровни гемоглобина у матери (> 130 г / л) в первом триместре были связаны со значительно более высокой частотой ГСД [16]. Еще в 1986 году Мерфи и др.[17] провели исследование с участием 44 316 беременных женщин и обнаружили, что у женщин с высоким уровнем гемоглобина до 24 недель беременности частота ПЭ была значительно выше. Недавнее ретроспективное когортное исследование 920 одноплодных беременностей показало, что у беременных женщин со значениями Hb ≥125 г / л до 14 недель гестации риск развития ПЭ и ГСД возрастал соответственно в 3,8 и 3,3 раза по сравнению с женщинами со значениями гемоглобина более 110–124 г / л [10]. Аналогичным образом, в отчете Мехрабиана и Хоссейни [18] о 973 беременностях в течение 2011–2012 гг. Значительно более высокая частота ГСД и ПЭ была обнаружена среди женщин, у которых на ранних сроках беременности уровень гемоглобина ≥125 г / л, чем у женщин со значениями гемоглобина <125 г. / L.Значения OR относительных рисков составили 3,7 (95% ДИ; от 2,2 до 6,4) и 5,4 (95% ДИ; от 2,8 до 10,5) соответственно [18]. Наши результаты в целом соответствуют результатам этих исследований. Беременные женщины в нашем исследовании с уровнем гемоглобина ≥130 г / л имели повышенный риск ГСД и ПЭ, и связь становилась более значительной, когда уровень гемоглобина превышал 150 г / л.
Связь, наблюдаемая в этом и других исследованиях между уровнями Hb и риском GDM и PE, кажется биологически правдоподобной. Примечательно, что результаты, представленные как в нашем, так и в других исследованиях [12, 16], показали, что женщины с высоким уровнем гемоглобина имели более высокий ИМТ до беременности, что позволяет предположить, что высокий уровень гемоглобина может быть следствием их лучшего статуса питания.Кроме того, высокий статус питания может быть связан с повышенным риском ГСД и ПЭ. Кроме того, мы предположили, что высокий уровень гемоглобина может отражать перегрузку железом, поскольку было подтверждено, что добавление железа в высоких дозах играет роль в возникновении ГСД [19]. Накапливающиеся данные показали, что железо является сильным прооксидантом, а перегрузка железом может усиливать окислительный стресс β-клеток, вызывая, таким образом, резистентность к инсулину и нарушая метаболизм глюкозы [20].
Механизм, лежащий в основе вклада Hb в PE, может в первую очередь включать высокую вязкость крови.Гипервязкость может напрямую снижать кровоток в микрососудах с низкой кинетической силой, таких как плацента [21]. Это может привести к снижению перфузии и оксигенации ткани плаценты, что усугубляет гипоксию ткани плаценты как прямой результат низкой скорости плацентарного кровообращения и снижения поступления кислорода. Более того, Hb играет непосредственную роль в регуляции оксида азота (NO) и функции эндотелия. NO является сильнодействующим вазодилататором и может расслаблять гладкомышечные клетки сосудов. Свободный гемоглобин может связывать и неактивный NO, что приводит к сужению сосудов с последующей гипертензией [22] и ишемией плаценты.Кроме того, окисленный гемоглобин может создавать гемовые отложения, полученные из метгемоглобина, на эндотелии сосудов, что, в свою очередь, непосредственно повреждает эндотелий или способствует образованию атеромы за счет эффекта окисленных липопротеинов низкой плотности [23].
В дополнение к GDM и PE, наше исследование выявило значительную связь между анемией и высоким риском преждевременных родов. Кроме того, риск преждевременных родов снижался с увеличением уровня гемоглобина в первом триместре, особенно среди женщин, у которых до беременности ИМТ был <24 кг / м 2 .Другие исследования также подтвердили, что анемия является независимым фактором риска преждевременных родов, хотя исследования уровней гемоглобина и риска преждевременных родов немногочисленны. Ретроспективное исследование, сравнивающее одноплодную беременность с анемией и без нее в течение первого триместра у женщин, родивших в период с 1988 по 2002 год, показало, что по сравнению с неанемическими женщинами более высокие показатели преждевременных родов (<37 недель беременности) были обнаружены среди женщин с анемией (10,7 % против 9,0% соответственно p <0.001). Более того, материнская анемия была независимым фактором риска преждевременных родов даже после поправки на вмешивающиеся факторы (OR = 1,2; 95% CI 1,1–1,2, p <0,001) [24]. В другой период измерения гемоглобина анализ 295 651 беременной женщины показал, что высокая частота преждевременных родов наблюдалась при уровне гемоглобина <110 г / л, а относительный риск увеличивался при уменьшении диапазона значений гемоглобина. Кроме того, женщины с уровнем гемоглобина выше 145 г / л также были связаны со значительно повышенным риском преждевременных родов (OR: 1.14; 95% ДИ 1,05, 1,25) [25]. В отличие от приведенных выше результатов, у женщин с уровнем гемоглобина> 130 г / л в нашем исследовании был значительно снижен риск преждевременных родов, а относительный риск снижался при увеличении диапазона значений гемоглобина. Однако международное многоцентровое перекрестное исследование 5690 одноплодных и первородящих беременностей показало, что не было статистически значимого влияния анемии на риск преждевременных родов [26]. По нашему мнению, различия в популяционных характеристиках исследуемых участников различных исследований могут быть основной причиной, объясняющей эти противоречивые результаты.
Кроме того, несколько исследований подтвердили, что железодефицитная анемия, а не анемия, вызванная другими причинами, влияет на преждевременные роды [27, 28]. Таким образом, они предположили, что дефицит железа может быть причиной преждевременных родов. Однако на сегодняшний день точные механизмы, лежащие в основе железодефицитной или железодефицитной анемии и преждевременных родов, еще не установлены. Возможный механизм может включать недостаточный перенос кислорода к матке, плаценте и плоду из-за нарушения транспортной способности гемоглобина, вызванного дефицитом железа.
После того, как мы провели анализ подгрупп, стратифицированных по ИМТ до беременности, мы обнаружили, что связь повышенного гемоглобина с риском развития ГСД сохраняется в каждой подгруппе. Хотя тенденция к увеличению частоты ТЭЛА с повышенным уровнем гемоглобина была отмечена только у женщин, у которых до беременности ИМТ был ≥24 кг / м 2 , защитные эффекты высоких уровней гемоглобина на преждевременные роды наблюдались только у женщин, у которых до беременности был ИМТ ≥24 кг / м 2 . ИМТ беременности был <24 кг / м 2 . Эти результаты, по-видимому, предполагают, что уровни гемоглобина в первом триместре по-разному влияют на возникновение ПЭ и преждевременных родов в разных категориях ИМТ до беременности.Кроме того, уровни гемоглобина в первом триместре были значительно выше у женщин, у которых до беременности ИМТ был ≥24 кг / м 2 по сравнению с женщинами, у которых до беременности ИМТ был <24 кг / м 2 , и их Расчетные значения уровня гемоглобина риска в первом триместре были 150 г / л и 130 г / л соответственно. Таким образом, эти данные предполагают, что ИМТ до беременности следует учитывать при оценке уровня гемоглобина в первом триместре. Однако на сегодняшний день не существует единых стандартов, определяющих высокий уровень гемоглобина.
Наше многоцентровое исследование было первым, в котором был проведен совместный анализ ИМТ и гемоглобина у матери до беременности на наличие ГСД, ПЭ и преждевременных родов. Размер выборки в нашем исследовании очень большой. Кроме того, наше исследование было проведено обученным персоналом, и большая часть данных была собрана из медицинских записей, что обеспечило стандартизацию сбора данных. Кроме того, анализ подгрупп, стратифицированный по ИМТ до беременности, позволил нам показать, что ИМТ до беременности играет роль во влиянии на взаимосвязь между уровнями гемоглобина и исходами беременности.Однако наше исследование является ретроспективным, и набранные беременные женщины были из трех городов Китая. Кроме того, есть некоторые различия между исходной когортой и последней когортой исследования. Таким образом, эти ограничения могут внести систематическую ошибку и ограничить распространение результатов исследования на всех беременных женщин в Китае. Кроме того, следует отметить, что размер выборки нашего исследования все еще может быть недостаточным в некоторых подгруппах, например, в группе женщин с уровнем гемоглобина <110 г / л и ИМТ до беременности ≥24 кг / м 2 , что может частично объяснить несущественные результаты.Кроме того, количество участников с ПЭ и преждевременными родами также может быть недостаточным в нашем исследовании для оценки статистически значимой разницы из-за наших критериев исключения. Недавние исследования показали, что повышенные запасы железа могут играть роль в развитии GDM во время беременности [19, 29]. Однако в этом исследовании у нас нет данных относительно материнского уровня железа или ферритина, а также нет данных о приеме добавок, таких как фолиевая кислота или таблетки железа в первом триместре.Таким образом, мы не смогли ни определить, связана ли наблюдаемая анемия с дефицитом железа, ни подробно обсудить влияние добавок на анемию, ни даже провести совместный анализ уровней гемоглобина и статуса железа в настоящем исследовании. Кроме того, в зависимости от результатов нашего и других исследований, установление баланса между статусом железа и уровнями гемоглобина может стать проблемой в будущем и должно быть выявлено с помощью более тщательно разработанных исследований.
(PDF) Уровни материнского гемоглобина во время беременности и их связь с массой новорожденных при рождении
Уровни материнского гемоглобина во время беременности
216 Иранский журнал детской гематологии, онкологии, том 5.No4
14. Хайдер Б.А., Олофин И., Ван М,
Шпигельман Д., Эззати М., Фавзи У.
Анемия, пренатальное употребление железа и риск
неблагоприятных исходов беременности: систематический обзор
и метаанализ. Bmj. 2013; 346.
15.Себастьян Т., Ядав Б., Джеясилан Л.,
Виджаяселви Р., Хосе Р. Смолл на
родов в гестационном возрасте среди южноиндийских
женщин: временные тенденции и факторы риска
с 1996 по 2010 год.
родов 2015; 15 (1): 7.
16. van den Broek NR, Jean-Baptiste R,
Neilson JP. Факторы, связанные с
преждевременными, ранними и поздними недоношенными
родами в Малави. PloS one
2014; 9 (3): e
- .
- ↵
Evers IM, de Valk HW, Mol BWJ, ter Braak EWMT , Visser GHA: Макросомия, несмотря на хороший гликемический контроль при диабетической беременности I типа: результаты общенационального исследования в Нидерландах.Diabetologia 45: 1484–1489, 2002
- ↵
Lauenborg J, Mathiesen ER, Ovesen P, Westergaard JG, Ekbom P, Molsted-Pedersen L, Damm P: Аудит мертворожденных женщин с преждевременным диабетом 1 типа. Уход за диабетом 26: 1385–1389, 2003
- ↵
Экбом П., Дамм П., Ногаард К., Клаузен П., Фельдт-Расмуссен У., Фельдт-Расмуссен Б., Нильсен Л.Х., Молстед-Педерсен Л., Матизен. экскреция альбумина и суточное артериальное давление как предикторы преэклампсии при диабете I типа.Diabetologia 43: 927–931, 2000
- ↵
Kyne-Grzebalski D, Wood L, Marshall SM, Taylor R: Эпизодическая гипергликемия у беременных с хорошо контролируемым сахарным диабетом 1 типа: основной потенциальный фактор, лежащий в основе макросомии ( От редакции). Diabet Med 16: 621–622, 1999
- ↵
Hartland AJ, Smith JM, Clark PMS, Webber J, Chowdhury T, Dunne F. -диабетические беременные.Ann Clin Biochem 36: 235–237, 1999
- ↵
O’Kane MJ, Lynch PLM, Moles KW, Magee SE: Определение контрольного диапазона HbA1c во время беременности для контроля диабета и осложнений, согласованных с испытаниями. Clin Chim Acta 311: 157–159, 2001
Килпатрик ES: Гликированный гемоглобин в 2000 году. J Clin Pathol 53: 335–339, 2000
- ↵
Маршалл С.М., Барт Дж. Маршалл С.М., Барт Дж. : Стандартизация измерений HbA1c: согласованное заявление (обзор).Diabet Med 17: 5–6, 2000
- ↵
Американская диабетическая ассоциация: Помощь женщинам с диабетом до зачатия (Заявление о позиции). Уход за диабетом 23: S65 – S68, 2000
- ↵
Worth R, Potter JM, Drury J, Fraser RB, Cullen DR: Гликозилированный гемоглобин при нормальной беременности: продольное исследование с использованием двух независимых методов. Diabetologia 28: 76–79, 1985
- ↵
Parentoni LS, de Faria EC, Bartelega MJLF, Moda VMS, Facin ACC, Castilho LN: контрольные пределы гликированного гемоглобина, полученные с помощью высокоэффективной жидкостной хроматографии у взрослых и беременных женщин.Clin Chim Acta 274: 105–109, 1998
- ↵
Линд Т., Чейн Г.А.: Влияние нормальной беременности на гликозилированные гемоглобины. Br J Obstet Gynaecol 86: 210–213, 1979
- ↵
Hiilesmaa V, Suhonen L, Teramo K: Гликемический контроль связан с преэклампсией, но не с гипертонией, вызванной беременностью, у женщин с сахарным диабетом I типа. Diabetologia 43: 1534–1539, 2000
- ↵
Jensen DM, Mølsted-Pedersen L, Beck-Nielsen H, Westergaard JG, Ovesen P, Damm P: Скрининг на гестационный сахарный диабет с помощью модели, основанной на индикаторах риска: проспективное исследование.Am J Obstet Gynecol 189: 1383–1388, 2003
- ↵
Glumer C, Jørgensen T, Borch-Johnsen K: Распространенность диабета и нарушение регуляции глюкозы в датском населении. Уход за диабетом 26: 2335–2340, 2003
- ↵
Всемирная организация здравоохранения: Определение, диагностика и классификация сахарного диабета и его осложнений: Отчет консультации ВОЗ. Часть 1: Диагностика и классификация сахарного диабета. Женева, Всемирная организация здравоохранения., 1999
- ↵
Карр С.Р., Слокум Дж., Теффт Л., Хейдон Б., Карпентер М.: Точность офисных глюкометров при скрининге гестационного диабета. Am J Obstet Gynecol 173: 1267–1272, 1995
- ↵
Åberg A: Гестационный диабет: скрининг, диагностика и прогноз. Lund, Sweden, Studenterlitteratur, 2001
- ↵
Mills JL, Jovanovic L, Knopp R, Aarons J, Conley M, Park E, Lee YJ, Holmes L, Simpson JL, Metzger B: Физиологическое снижение уровня глюкозы в плазме натощак концентрация в первом триместре нормальной беременности: исследование диабета на ранних сроках беременности.Метаболизм 47: 1140–1144, 1998
- ↵
Lurie S: Возрастное распределение популяции эритроцитов на поздних сроках беременности. Gynecol Obstet Invest 30: 147–149, 1990
Лурье С., Данон Д: Продолжительность жизни эритроцитов на поздних сроках беременности. Obstet Gynecol 80: 123–126, 1992
- ↵
Lurie S: Распределение плотности эритроцитов при гестационном диабете класса A2 (требующий инсулина). Arch Gynecol Obstet 258: 65–68, 1996
17. Брейманн К. Железодефицитная анемия при беременности
. 2013.
18.Yi S, Han Y, Ohrr H. Анемия до
беременности и риск преждевременных родов, низкий вес при рождении
и малый для гестационного возраста
роды у корейских женщин.Европейский журнал
клинического питания 2013; 67 (4): 337-342.
19. Кодзуки Н., Ли А.С., Кац Дж. От умеренной до
тяжелая, но не легкая материнская анемия — это
, связанная с повышенным риском малых для-
результатов гестационного возраста. Журнал
Nutritio 2012; 142 (2): 358-362.
20.Haggaz AD, Radi EA, Adam I.
Анемия и низкая масса тела при рождении на западе
Судан. Труды Королевского общества
тропической медицины и гигиены
2010; 104 (3): 234-236.
21.Xu X, Yang H, Chen A, Zhou Y, Wu
K, Liu J и др. Исходы рождаемости, связанные с
неформальной переработкой электронных отходов в Гуйюй,
Китай. Репродуктивная токсикология
2012; 33 (1): 94-98.
22.Кумар К.Дж., Аша Н., Мурти Д.С.,
Суджата М., Манджунатх В. Материнская анемия
в различных триместрах и ее влияние на массу и зрелость новорожденного
: обсервационное исследование
. Международный журнал профилактической медицины
2013; 4 (2): 193.
23. Chang S, Zeng L, Brouwer ID, Kok FJ,
Yan H. Влияние железодефицитной анемии при беременности
на умственное развитие ребенка в
сельских районах Китая. Педиатрия 2013; 131 (3): e755-
e763.
24.Сешадри С. Распространенность микронутриентов
дефицит особенно железа, цинка и
фолиевой кислоты у беременных женщин на Юго-Востоке
Азия. Британский журнал питания
2001; 85 (2): S87.
25.Йылдыз Y, Озгу Э, Унлу С.Б., Салман Б,
Эйи ЭГИ. Связь между материнским гемоглобином в третьем
триместре и
при рождении вес / длина тела; результаты из третичного центра
в Турции. Журнал материнской медицины —
Фетальная и неонатальная медицина
2013; 27 (7): 729-732.
26. Ford JB, Algert FH, Patterson JA.
Изменения гемоглобина во время беременности: ретроспективное когортное исследование
последовательных
беременностей 2014 г.
27.Rasmussen KM. Существует ли причинно-следственная связь
между железодефицитной анемией или железодефицитной анемией
и массой тела при рождении,
продолжительностью беременности и перинатальной смертностью?
Журнал питания
2001; 131 (2): 590S-603S.
28. Джеймс TR. Концентрация гемоглобина
и показатели статуса железа в трех триместрах беременности
и их связь
с исходом для плода 2012.
29. Шобейри Ф, Бегум К., Назари М. Проспективное исследование материнского гемоглобина
Статус индийских женщин во время беременности
и исход беременности. Питание
Research 2006; 26 (5): 209-213.
30. Госвами Т.М., Патель В.Н., Пандья Н.Х.,
Мевада АК, Десаи К.С., Соланки КБ.
Материнская анемия во время беременности и
ее влияние на перинатальный исход.
International Journal of Biomedical и
Advance Research 2014; 5 (2): 99-102.
31. Ахмад МО, Калсум У, Сугра У,
Хади У, Имран М. Влияние материнской
анемии на массу тела при рождении. Дж. Аюб Мед Колл
Абботтабад 2011; 23 (1): 77-79.
32.Scholl TO. Статус материнского железа:
в зависимости от роста плода, продолжительность беременности
и наличие железа у новорожденного
. Обзоры питания 2011; 69 (дополнение
1): S23-S29.
33.Ribot B, Aranda N, Viteri F,
Hernández-Martínez C, Canals J, Arija V.
Истощенные запасы железа без ранней анемии
во время беременности сопряжены с повышенным риском
более низкой массы тела при рождении, даже если
ежедневно получать умеренное количество железа.
(PDF) Высокий и низкий уровни гемоглобина во время беременности
женщина, мы не знаем, отличался ли статус женщины по анемии
при входе в программу от ее статуса на
на более ранней или более поздней стадии беременности. Тем не менее, наш анализ
сравнил уровень гемоглобина у женщин на определенной стадии беременности
с таковыми у других женщин
, у которых гемоглобин был измерен на той же стадии беременности.Случайная ошибка в измерении гемоглобина
и гематокрита могла иметь больше места в нашем исследовании
, чем в контролируемом исследовании, потому что мы использовали данные гемоглобина
, собранные в клиниках несколькими специалистами
с использованием методов капиллярного анализа. Ran-
Ошибкаdom могла снизить силу наблюдаемых OR
. Кроме того, одним из преимуществ Специальной дополнительной программы
для женщин, младенцев и
детей является то, что женщины получают обогащенные железом злаки
и соки, содержащие витамин С, как часть их пищевых продуктов
.Кроме того, женщин с положительным результатом скрининга на анемию
направляют на лечение к своему терапевту.
Таким образом, программные вмешательства могли уменьшить силу связи
, наблюдаемую между анемией
и преждевременными родами. Данные об осложнениях беременности
(например, кровотечение в первом и втором триместре) и причинах
преждевременных родов (индуцированных или спонтанных) отсутствовали.
Данные об осложнениях могли пролить некоторый свет на механизмы, предложенные в нашем исследовании
.
Окончательным ограничением нашего исследования является то, что данные о материнском состоянии железа
отсутствуют в наборе данных по надзору за питанием при беременности
. Следовательно, мы не могли проверить, связана ли наблюдаемая анемия с дефицитом железа
или какой-либо другой причиной. Хотя
анемия возникает по многим причинам, дефицит железа на сегодняшний день является наиболее важной причиной
, отчасти потому, что очень трудно удовлетворить очень высокие требования к железу
во время беременности.Следовательно,
разумно предположить, что большинство из
случаев умеренной анемии в нашем исследовании были вызваны дефицитом железа
. Кроме того, наше открытие более сильного увеличения риска преждевременных родов с более тяжелой анемией
предполагает связь с анемией с дефицитом железа
, поскольку снижение значений гемоглобина
увеличивает прогностическую ценность анемии для дефицита железа.
лв.
20
Прием добавок железа во время беременности — это обычная практика
, направленная на профилактику железодефицитной анемии.
Наше исследование предполагает, что добавление железа может
предотвратить преждевременные роды, если наблюдаемая связь
может быть установлена как причинная. Результаты одного испытания, в котором изучали
, снижает ли добавление железа частоту преждевременных родов
, оказались неубедительными.
23
Поскольку стандарт
в клинической практике предусматривает предоставление добавок железа-
всем беременным женщинам, было бы неэтично отказываться от
приема добавок железа из контрольного исследования
группа беременных женщин без доказательств что группа
была насыщена железом.Тем не менее, в отсутствие клинических испытаний
доказательств пользы добавок железа —
в отношении исхода родов, высокого риска дефицита железа
среди беременных женщин и демонстрации того, что добавка железа
снижает распространенность железосодержащих препаратов.
дефицитная анемия при отсутствии побочных эффектов —
достаточно, чтобы оправдать практику рутинного приема добавок во время беременности.
24
Доказательства причинной связи в наблюдаемой ассоциации
между высоким уровнем материнского гемоглобина и
SGA отсутствуют.Добавки железа не могут повысить уровень гемоглобина на
выше оптимального для данного человека
; поэтому его нельзя рассматривать как одну из
причин высокого уровня гемоглобина. Наиболее вероятно, что
как повышенный уровень гемоглобина, так и SGA являются результатом
общих нарушений беременности. Мы согласны с
другими исследователями
11,17
, что высокий уровень гемоглобина во время беременности
заслуживает большего внимания, чем в настоящее время
получает в клинической практике.
Список литературы
1. Центры по контролю и профилактике заболеваний. Питание беременных
Наблюдение, 1996 полный отчет. Атланта: Министерство здравоохранения США
и социальных служб, 1998.
2. Целевая группа профилактических служб США. Регулярные добавки железа —
, менструация во время беременности. JAMA 1993; 270: 2846–54.
3. Целевая группа превентивных служб США. Скрининг железодефицитной анемии
, включая профилактику железа.В: Справочник по клиническим
профилактическим службам. 2-е изд. Александрия, Вирджиния: International
Medical Publishing; 1996: 231–46.
4. Гарн С.М., Риделла С.А., Петцольд А.С., Фолкнер Ф. Гематолог по материнской линии —
Уровни и исходы беременности, Семин Перинатол 1981; 5: 155–
62.
5. Ким И., Хангерфорд Д.В., Ип R, Kuester SA, Zyrkowski C, Trow-
мост FL. Система наблюдения за питанием беременных — США
, 1979–1990 гг. MMWR CDC Surveill Summ 1992; 41: 26–41.
6. Мерфи Дж. Ф., О’Риордан Дж., Ньюкомб Р. Дж., Коулз Е. К., Пирсон Дж. Ф.
Отношение уровня гемоглобина в первом и втором триместрах к
исходу беременности. Ланцет 1986; 1: 992–5.
7. Либерман Э., Райан К.Дж., Монсон Р.Р., Шенбаум СК. Факторы риска
, учитывающие расовые различия в частоте преждевременных родов.
N Engl J Med 1987; 317: 743–8.
8. Либерман Э., Райан К.Дж., Монсен Р.Р., Шенбаум СК. Связь
материнского гематокрита с преждевременными родами.Am J Obstet Gynecol
1988; 159: 107–14.
9. Клебанофф М.А., Шионо PH, Берендес Х.В., Роадс Г.Г. Факты и
артефактов об анемии и преждевременных родах. JAMA 1989; 262:
511–5.
10. Клебанофф М.А., Шионо PH, Селби СП, Трахтенберг А.И., Граубард Б.И.
Анемия и самопроизвольные преждевременные роды. Am J Obstet Gynecol
1991; 164: 59–63.
11. Лу З.М., Гольденберг Р.Л., Кливер С.П., Каттер Г, Бланксон М.Л. Соотношение
между гематокритом матери и наступлением беременности —
.Obstet Gynecol 1991; 71: 190–4.
12. Шолль Т.О., Хедигер М.Л., Фишер Р.Л., Ширер Дж.В. Анемия по сравнению с дефицитом железа
: повышенный риск преждевременных родов в проспективном исследовании
. Am J Clin Nutr 1992; 55: 985–8.
13. Стир П., Алам М.А., Уодсворт Дж., Велч А. Связь между
концентрацией материнского гемоглобина и массой тела при рождении в различных
этнических группах. BMJ 1995; 310: 489–91.
14. Критерии CDC для анемии у детей и женщин детородного возраста.
MMWR Morb Mortal Wkly Rep 1989; 38: 400–4.
ТОМ. 96, NO. 5, ЧАСТЬ 1, НОЯБРЬ 2000
Scanlon et al. Анемия и высокий гемоглобин 747
Питательные вещества | Бесплатный полнотекстовый | Железодефицитная и железодефицитная анемия: последствия и влияние на беременность, развитие плода и параметры в раннем детстве
1. Введение
Анемия с концентрацией гемоглобина (Hb) не ниже 10 г / дл в срок встречается почти во всех беременностях. и в большинстве случаев отражает физиологический процесс (обсуждается ниже), а не состояние дефицита или лежащее в основе гематологическое нарушение [1].Значительная анемия во время беременности (определяется как концентрация гемоглобина 2,3,4). Анемия является основным фактором заболеваемости и смертности матери и плода, особенно в менее развитых странах [2,3,4,5,6]. Среди причин анемии во время беременности анемия из-за дефицита железа (ЖДА) является наиболее распространенной, особенно в более развитых странах, где вклад других вызывающих анемию заболеваний, таких как малярия или гемоглобинопатии, менее значим [7,8,9].Анемия во время беременности, и особенно ЖДА, является как давним научным интересом, так и элементом моей практики гематолога.При подготовке этого обзора был проведен поиск в PubMed с использованием терминов «беременность» и «дефицит железа». Диапазон дат не был указан, но основное внимание было уделено бумагам 2015 года и более поздних версий. Конкретные поисковые запросы по подтемам включали «гепсидин» и «рекомендации». В ходе этого процесса было выявлено около 71 отчета, обзора или исследования, ранее неизвестных автору.
2. Физиологическая анемия беременных
Влияние ID на выработку эритроцитов происходит в контексте того, что обычно называют физиологической анемией беременности.Это явление сохраняется у всех видов млекопитающих [10,11], и предполагается, что физиологическая анемия беременных служит цели улучшения плацентарной перфузии за счет снижения вязкости материнской крови и облегчения доставки кислорода и питательных веществ к плоду за счет увеличения эритроцитарная масса [12]. Начиная примерно с шестой недели беременности объем плазмы увеличивается непропорционально массе эритроцитов, достигая максимального значения примерно на 24 неделе беременности.Максимальный объем плазмы на 40% и 50% выше, чем в начале беременности [13]. Поскольку параметры, используемые для выявления анемии в клинической практике (гематокрит (Hct), концентрация гемоглобина в крови и количество циркулирующих эритроцитов) выражаются как концентрации, основанные на объеме цельной крови, увеличенный объем плазмы вызывает их уменьшение и, следовательно, вызывает «анемию». Хотя концентрация Hb, Hct и, в меньшей степени, количество эритроцитов являются показателями анемии, используемыми на практике, эти параметры являются лишь суррогатами фактического определения анемии: снижение массы эритроцитов на единицу массы тела [14].По этому критерию физиологическая анемия беременных на самом деле не является анемией: увеличение массы эритроцитов на 15% и 25% происходит во время беременности, но скрывается за счет разжижающего эффекта увеличения объема плазмы [15]. Это вызвано увеличением концентрации эритропоэтина в сыворотке крови в конце второго и начале третьего триместров [16] и облегчается или потенциально ограничивается доступностью железа. У беременных женщин, принимающих добавки железа, наблюдается большее увеличение массы эритроцитов, чем у женщин, не принимающих добавки железа [1], а у женщин с нарушенными запасами железа в начале беременности будет наблюдаться ограниченное увеличение массы эритроцитов.Однако верхний предел увеличения массы эритроцитов при наличии достаточного количества железа регулируется посредством контроля эритропоэтина и не повышается за счет увеличения доступности железа: беременные женщины из племени банту, которые придерживаются как традиционной диеты, богатой железом, так и генетической предрасположенности. Чтобы увеличить абсорбцию железа с пищей, не увеличивайте концентрацию Hb или Hct с помощью добавок [17,18]. В результате восстановления баланса между объемом плазмы и массой эритроцитов обычно считается, что концентрация Hb 19].На рисунке 1 показаны концентрации гемоглобина по триместрам на основе отчетов из Норвегии [19], Ямайки [20] и Китая [21]. Объем материнской плазмы обычно уменьшается в течение последних недель беременности, и, следовательно, Hct, Hb и количество циркулирующих эритроцитов. увеличение [13]. Объем материнской крови обычно возвращается к уровню до беременности в течение одной-шести недель после родов, а материнский эритропоэз увеличивается на поздних сроках беременности и возвращается к норме примерно через месяц после родов [22].3. Баланс железа: обзор
Подробное обсуждение регулирования баланса железа выходит за рамки этого обзора, и читатель отсылается к недавним обзорам [23,24,25]. Содержание железа в организме человека тщательно регулируется и обычно поддерживается на уровне около 40 мг / кг у женщин и около 50 мг / кг у мужчин. Поскольку люди не могут выделять избыточное железо регулируемым образом, баланс железа регулируется на уровнях абсорбции железа энтероцитами двенадцатиперстной кишки и мобилизации железа из паренхимы печени и макрофагов.Эти процессы регулируются гепсидином, небольшим пептидом, вырабатываемым в печени. Гепсидин связывается с ферропортином, экспортирующим клеточное железо, вызывая его интернализацию. Когда уровни гепсидина повышаются, железо остается в энтероцитах или макрофагах и становится недоступным для производства эритроцитов. Когда гепсидин снижается, либо из-за ID, либо из-за повышенного эритропоэза, поглощенное железо в энтероцитах или железо, накопленное в макрофагах, мобилизуется в кровоток [23,24]. На абсорбцию пищевого железа также влияют источник железа и состояния двенадцатиперстной кишки, например pH.Доля железа, абсорбированного из гемового железа и непищевых источников, таких как соли железа или сахараты, составляет приблизительно 10-15% элементарного железа, в то время как абсорбируется менее 2% элементарного железа из растительных источников. ID может удвоить процент абсорбции железа из любого данного источника [26]. Железо транспортируется из энтероцита в плазменный транспортный белок железа трансферрин. Количество железа, связанного с трансферрином и циркулирующего в крови, при нормальных обстоятельствах составляет примерно 0,2 мг / кг [27]. Запасное железо находится в макрофагах селезенки, костного мозга или печени, а также в паренхиматозных клетках печени (5–6 мг / кг у женщин, 10–12 мг / кг у мужчин).Железо макрофагов в значительной степени происходит за счет рециркуляции стареющих эритроцитов, в то время как паренхимные клетки печени получают или выделяют железо из трансферрина или в него [27]. Самый большой запас железа в организме находится в циркулирующих эритроцитах и предшественниках эритроидов в костном мозге (примерно 28 мг / кг у женщин и 32 мг / кг у мужчин). Почти все это железо эритроцитов находится в форме Hb [27].5. ID для женщин в пременопаузе
ID отражает истощение запасов железа. Хотя «золотым стандартом» для ID является отсутствие окрашиваемого ретикулоэндотелиального железа в образце костного мозга, в клинической практике это обычно определяется с помощью суррогатных лабораторных маркеров, таких как низкий уровень сывороточного ферритина или пониженный процент насыщения трансферрина железом [31]. .Значения этих параметров обсуждаются ниже. Частота ID во время беременности отражает не только потребность беременных в железе, но и высокую частоту ID среди женщин в пременопаузе. Конкретные оценки варьируются в зависимости от изучаемой популяции и конкретного параметра, используемого для определения ID. Ниже обсуждаются различные диагностические критерии ID при беременности. В недавнем исследовании, проведенном в США, определение ID по низкому уровню ферритина в сыворотке [32]. Частота ID также может различаться в зависимости от популяции пациентов.Используя пороговое значение сывороточного ферритина 20–30 мкг / л для определения ID или минимальных запасов железа [32,33,34,35], по крайней мере 25% женщин в возрасте 15–39 лет, участвовавших в Третьем национальном обследовании питания и здоровья США. (NHANES) [36], были железодефицитными (Таблица 1). Подгруппы афроамериканских и нелатинских белых женщин напоминали все обследуемое население, но 50% латиноамериканских женщин в этом возрастном диапазоне имели дефицит железа. В обзоре исследований, проведенных в Европе, 40% 55% женщин в пременопаузе имели дефицит железа [35].По большей части, ИН у женщин в пременопаузе является результатом дисбаланса между потреблением пищевого железа и физиологической кровопотерей во время менструации или предыдущей беременности. Снижение потребления железа с пищей может способствовать этому дисбалансу, например, у женщин, придерживающихся вегетарианской или веганской диеты, которые не принимают добавки железа, или у которых наблюдается мальабсорбция железа [37,38]. Менструальная кровопотеря может составлять 25–50 мг железа за цикл [33] в зависимости от концентрации Hct / Hb у пациентки и индивидуального характера менструации, и может быть значительно больше у пациенток с меноррагией [39].Это отличается от ситуации для мужчин и женщин в постменопаузе, у которых ИН является следствием кровопотери из-за патологического поражения, чаще всего в желудочно-кишечном тракте, и где требуется эндоскопическое исследование источника кровопотери [ 40]. Однако беременным женщинам может потребоваться обследование на предмет патологической кровопотери, если это предполагает клиническая ситуация.6. Оценка ID и ЖДА при беременности
ID может существовать без анемии, когда запасы железа отсутствуют, но продолжающийся дефицит железа недостаточно серьезен для снижения концентрации Hb.Это состояние гораздо чаще встречается у здоровых женщин, чем у здоровых мужчин. В исследовании, определяющем нормальный диапазон концентраций растворимых рецепторов трансферрина в сыворотке, ID с нормальными показателями крови наблюдали у 9,5% здоровых взрослых женщин-добровольцев (в пременопаузе и постменопаузе), но только у 1,5% мужчин [41]. Как отмечалось ранее, в исследовании не страдающих анемией женщин в первом триместре беременности 42% имели дефицит железа [32]. ID без анемии часто бывает преходящей стадией; Клиническое значение ID без анемии является предметом активных исследований [42].ЖДА развивается, когда поступление железа недостаточно для удовлетворения постоянной потребности в продукции красных кровяных телец, и следует стадиям, которые были четко определены в течение многих лет [43]. Начальная стадия называется железодефицитным эритропоэзом или иногда железо-ограниченным эритропоэзом. Этот термин также используется для описания эритропоэза в таких обстоятельствах, как анемия при хроническом заболевании / воспалении, когда продуцируемая цитокинами продукция гепсидина ухудшает мобилизацию железа, несмотря на достаточное количество запасенного железа [44].На начальных стадиях железодефицитного эритропоэза концентрация Hb / Hct начинает постепенно снижаться, но эритроциты остаются морфологически нормальными. Биохимические тесты, указанные в таблице 2 (концентрация сывороточного железа, общая железосвязывающая способность (TIBC), концентрация трансферрина и концентрация ферритина), снижаются в этот момент. Как отмечалось выше, если потребление железа достаточно для поддержания Hb / Hct и суточных потерь, пациент может оставаться в устойчивом состоянии железодефицитного эритропоэза. В противном случае по мере продолжения неудовлетворенной потребности в железе происходит снижение гемоглобина на 1-2 мг / дл (который все еще может находиться в пределах нормального диапазона гемоглобина), среднего размера эритроцитов (регистрируемого электронными счетчиками клеток как средний корпускулярный объем, MCV). ) начинает снижаться.Вскоре после этого концентрация Hb в эритроците (средняя корпускулярная концентрация Hb, MCHC) также начинает снижаться. Эта закономерность представлена в таблице 2. Скорость, с которой происходят эти изменения и прогрессирует до ЖДА, зависит от продолжающегося дефицита железа. Этот процесс снижения MCV (микроцитоза) и уменьшения MCHC (гипохромия) приводит к характерному морфологическому виду ЖДА [43]. (Рисунок 2). Хотя ряд биохимических тестов для оценки статуса железа широко доступен (Таблица 2), на их интерпретацию и использование влияет множество обстоятельств.Концентрация ферритина в сыворотке крови является маркером ретикулоэндотелиальных запасов железа, а концентрация ферритина в сыворотке ниже нормального диапазона является наиболее специфическим биохимическим индикатором ID. Ряд исследований показывает, что это наиболее эффективный единичный тест для скрининга на беременность [45,46]. Однако существуют разногласия относительно того, что составляет концентрацию ферритина в сыворотке, позволяющую диагностировать ЖД у женщин [47, 48]. Это отражает высокую частоту бессимптомных ИД среди здоровых женщин, у которых получены популяционные лабораторные показатели.Например, нижний предел нормы концентрации ферритина в сыворотке крови, установленный международной справочной лабораторией, составляет 11 мкг / л для женщин и 24 мкг / л для мужчин (www.mayocliniclabs.com). Напротив, исследования корреляции концентраций ферритина в сыворотке с окрашиванием железа в костном мозге показывают, что величина ферритина, указывающая на отсутствие или значительно сниженные запасы железа в костном мозге, составляет приблизительно 30 мкг / л запасов железа, независимо от пола пациента [34,49]. В недавнем систематическом обзоре пороговых значений сывороточного ферритина для ID во время беременности сообщается, что в большинстве исследований использовались значения 12–15 мкг / л, но эти пороговые значения находились в диапазоне 30 мкг / л.Обоснования выбора порога приводились редко, и авторы пришли к выводу, что требуется стандартизация [47,50]. В таблице 3 перечислены пороговые значения, используемые в различных исследованиях и руководствах. Более низкие пороги ферритина связаны со значительным снижением чувствительности для ID при минимальном увеличении чувствительности. Было подсчитано, что порог ферритина 30 мкг / л является 98% специфичным и 92% чувствительным для ID, в то время как порог сывороточного ферритина 10 мкг / л чувствителен только 25% [32].Хотя низкий уровень ферритина в сыворотке всегда указывает на ID, ферритин в сыворотке является реагентом острой фазы, уровень которого может быть увеличен пропорционально запасам железа в результате инфекции, воспаления, заболевания печени, злокачественных новообразований или других состояний. В таких обстоятельствах ИН может присутствовать при нормальной или умеренно повышенной концентрации ферритина в сыворотке [51]. Обычно это не проблема у здоровых в остальном молодых женщин, но может быть смешивающим фактором у более сложных пациентов. Были предложены методы корректировки уровня ферритина в сыворотке на основе маркеров воспаления, таких как C-реактивный белок [52], хотя в большинстве случаев использование дополнительных тестов (обсуждаемых ниже) позволяет выявить ID, если это подозревается у пациента с нормальным уровнем ферритина в сыворотке. концентрация.Как отмечалось ранее, железо для эритропоэза циркулирует связанным с трансферрином. Трансферрин может быть непосредственно измерен и выражен как концентрация белка или функционально выражен как TIBC (количество связанного железа на объем сыворотки или плазмы). Подробное обсуждение взаимосвязи между этими параметрами выходит за рамки данного обзора [58,59]. С клинической точки зрения они служат одной и той же диагностической цели, и клинические лаборатории часто сообщают об одном или другом. Трансферрин и TIBC повышены при неосложненной ЖД [60], но могут быть уменьшены при воспалении или недоедании [61].Точно так же снижение концентрации железа в сыворотке или плазме может отражать снижение запасов железа или может отражать нарушение мобилизации железа из-за воспаления и в большинстве случаев опосредованное гепсидином [62,63]. Доступность железа для эритропоэза (в отличие от запасов железа, оцениваемых по ферритину сыворотки) оценивается по проценту насыщения трансферрина / TIBC железом. Снижение насыщения трансферрина (особенно, когда концентрация трансферрина / TIBC нормальная или повышенная) коррелирует с другими показателями ID во время беременности [64] и может указывать на ID у пациентов с нормальной концентрацией ферритина, у которых ID подозревается на основании клинических или статистических данных. основание.Повышенная концентрация растворимого рецептора трансферрина в сыворотке крови (sTfR) связана с ID, но также с повышенным эритропоэзом из-за врожденных гемоглобинопатий, других причин гемолиза или неэффективного эритропоэза. Воспаление не увеличивает и не уменьшает его [31,41]. У беременных демонстрация повышенной концентрации sTfR в сыворотке крови, особенно у пациенток с нормальной или повышенной концентрацией ферритина в сыворотке, предположительно повышенная непропорционально запасам железа, подтверждает ID [65].Специфичность sTfR в отношении ID может быть увеличена путем выражения его как отношения sTfR к логарифмическому значению сывороточного ферритина [66]. Однако соотношение sTfR, по-видимому, не более эффективно, чем концентрация ферритина в сыворотке при более общих обстоятельствах [67]. Роль гепсидина как первичного медиатора гомеостаза железа отмечалась ранее. Уровни гепсидина повышаются при анемии, вызванной воспалением / хроническим заболеванием, и снижаются при ЖД, и их можно использовать для различения этих двух синдромов, оба из которых связаны с гипоферриемией [68].Измерение гепсидина в клинических целях в настоящее время не является широко доступным, но может стать таковым в ближайшие несколько лет. Гепсидин, по-видимому, является эффективным индикатором ID во время беременности [69,70], но его конкретная роль в лечении еще предстоит определить [71].7. Влияние ID во время беременности
Оценка влияния ID матери на течение беременности и развитие детей в раннем возрасте более сложна, чем может показаться на первый взгляд. ID более распространен среди экономически и социально неблагополучных групп населения [72], и эти проблемы могут независимо вносить вклад в осложнения во время беременности и в раннем детском развитии.В случае ЖДА могут возникнуть вопросы относительно того, является ли какой-либо отрицательный эффект общим следствием анемии или специфическим для ИД [73]. В одном недавнем сообщении о женщинах, инфицированных шистосомозом во время беременности, материнская ЖДА, по-видимому, предсказывает идентификацию ребенка в возрасте шести месяцев [74]. ID также может быть маркером других проблем с питанием. В исследовании, проведенном в Пакистане, у женщин с недостаточным весом на ранних сроках беременности концентрация ферритина в сыворотке крови была ниже, чем у матерей с нормальным весом или с избыточным весом [75].ИН может способствовать нарушению когнитивного развития в раннем детстве [76], и возможность вмешаться во время беременности и избежать этого осложнения является привлекательной с точки зрения общественного здравоохранения. Однако не совсем ясно, могут ли добавки железа матери во время беременности обратить вспять эффекты материнского ID во время беременности на развитие нервной системы [77,78]. Два недавних систематических обзора не обнаружили доказательств того, что добавление железа во время беременности улучшало развитие нервной системы у потомства [76,79].Конкретная частота ID в изученных популяциях могла способствовать отсутствию статистически значимого эффекта: преимущества могли быть ограничены пациентами с дефицитом железа или предельными запасами железа на момент лечения [79,80]. С точки зрения анемии / статуса железа у новорожденных доказательства кажутся более ясными: исследования, охватывающие 60 лет, последовательно подтверждают концепцию, согласно которой материнский ID обычно не снижает снабжение плода железом. Похоже, что биология вынашивания отдает приоритет плоду как реципиенту железа и питательных веществ, необходимых для синтеза гемоглобина.В результате концентрация гемоглобина у младенцев, рожденных от матерей с ЖДА, обычно является нормальной для младенческого возраста, а значения биохимических маркеров статуса железа (таких как сывороточное железо, насыщение трансферрина и сывороточный ферритин), наблюдаемые у новорожденных, по-видимому, не связаны с наблюдаемые у матери [81,82,83,84,85,86,87,88]. Однако концентрация сывороточного ферритина в пуповинной крови во время родов, по-видимому, предсказывает концентрацию сывороточного ферритина в первые два года жизни [89]. Доступность новых подходов к оценке гомеостаза железа может привести к изменению этой парадигмы.В отчете Ли и его коллег указывается на более высокую распространенность анемии новорожденных и маркеры снижения доступности железа (снижение ферритина пуповинной крови по сравнению с зарегистрированными значениями, повышение sTfR в сыворотке) у детей, рожденных от железодефицитных матерей-подростков [90]. Безусловно, необходимы дальнейшие исследования в этой популяции, особенно для определения распространенности материнских факторов, независимо связанных с анемией новорожденных, таких как материнское ожирение или употребление табака [91]. Хотя sTfR увеличивается при ID, он также является маркером эритропоэтической активности, что повышает вероятность того, что ферритин пуповинной крови был относительно низким из-за повышенной мобилизации запасов железа для эритропоэза.Наблюдаемые повышенные уровни эритропоэтина также могут соответствовать этой интерпретации [90]. Доказательства влияния материнского удостоверения личности на течение беременности более ясны. ID приводит к гипертрофии плаценты [92], а тяжелый ID у матери, по-видимому, увеличивает риск преждевременных родов, низкой массы тела при рождении и детской смерти [93]. По крайней мере, в одном исследовании ЖДА в первом триместре была связана с низкой массой тела при рождении, но развитие ИД на более поздних сроках беременности — нет [94]. Однако важно учитывать, что идентификация матери может быть маркером отсутствия продовольственной безопасности или отсутствия дородового ухода, что может иметь аналогичные последствия.Также сложно отличить эффекты анемии в целом от эффектов, специфичных для ID [73]. В случае матери гематологические преимущества добавок железа менее спорны [95,96]. Согласно обзору опубликованных отчетов, регулярный прием препаратов железа снизил частоту доношенной анемии на 73% и частоту ЖДА на 67% [97,98]. В таблице 4 обобщены результаты систематического обзора Кокрановской базы данных, в котором сравниваются результаты ежедневного приема добавок железа с плацебо или отсутствием добавок железа [71,96].8. Подход к применению железа во время беременности
В настоящее время ни Целевая группа профилактических служб США, ни Американский колледж акушеров и гинекологов (ACOG) не занимают позицию по регулярному добавлению железа во время беременности [53,99], а также руководящие принципы общества в Великобритания не рекомендует это делать. И ACOG, и британские руководящие принципы рекомендуют скрининг на анемию в качестве суррогата для выявления ID. Рекомендуемые стандарты, по которым следует исследовать анемию в обоих обществах, в целом соответствуют ранее обсуждавшимся в этом обзоре ожидаемой степени анемии от физиологической анемии беременности: 11.0 г / дл в первом и третьем триместрах и 10,5 г / дл во втором триместре (ACOG), или 11,0 г / дл в первом триместре и 10,5 г / дл в последующих триместрах (Великобритания) [53,54,55 ]. Оба руководства предлагают в качестве начального шага испытание железа с последующим исследованием других причин, если ответа недостаточно. Этот подход создает риск пропуска лиц с дефицитом железа, но не страдающих анемией, а также на ранних стадиях ID. На основании перекрестных исследований небеременных женщин репродуктивного возраста было высказано предположение, что порог гемоглобина равен 12.8 г / дл (выше стандарта Всемирной организации здравоохранения 12,0 г / дл) является более подходящим порогом для выявления женщин из группы риска ID [100]. Ни ACOG, ни британские руководящие принципы не рекомендуют рутинный скрининг с исследованиями железа, но британские руководящие принципы рекомендуют измерять сывороточный ферритин у женщин с высоким риском ID, даже если они не страдают анемией [54,55]. Наиболее эффективный подход к прогнозированию и контролю риска ИН во время беременности является важной темой для будущих исследований. (См. Раздел 9 ниже). Существует два общих подхода к добавлению железа беременным женщинам, не страдающим анемией.Это выборочные добавки, обычно основанные на лабораторных показателях или демографических характеристиках пациентов в зонах повышенного риска; и обычные или универсальные добавки. Один хорошо описанный подход к селективному добавлению основан на оценке запасов железа по ферритину сыворотки. Когда уровень ферритина в сыворотке превышает 70 мкг / л, запасы железа считаются достаточными для поддержания беременности, и никаких добавок не назначают. Когда сывороточный ферритин составляет менее 30 мкг / л, запасы железа считаются отсутствующими или почти отсутствующими, и пациента лечат 80–100 мг элементарного железа в день перорально.Женщины, у которых уровень ферритина находится между этими точками, получают добавки в малых дозах 30–40 мг / день [101]. Недавний систематический обзор поддерживает концепцию, согласно которой периодический прием добавок железа во время беременности (2–3 раза в неделю, в отличие от ежедневного) так же эффективен, как и ежедневный прием, и связан с меньшим количеством побочных эффектов и, предположительно, с более высоким соблюдением режима [102]. более 75% женщин, участвовавших в третьем исследовании NHANES в целом (таблица 1), потребовали бы добавок на определенном уровне, и более 90% женщин-латиноамериканок потребовали бы добавки.По этой причине многие врачи применяют рутинные или универсальные добавки железа для всех беременных. Был предложен альтернативный подход к селективным добавкам с использованием гепсидина в качестве индикатора ранней ID и необходимости терапии. В недавнем отчете, в котором сравнивалась методика приема добавок, управляемая гепсидином, с универсальной профилактикой, были выявлены схожие исходы для пациентов в обеих группах [71]. Это исследование проводилось в группе высокого риска в Гамбии, и этот подход может иметь другие результаты в других местах.Одной из причин избегать регулярного приема добавок в менее развитых странах является опасение, что добавление железа увеличит риск заражения железозависимыми микроорганизмами и паразитами, включая малярию. Исследование, проведенное в Папуа-Новой Гвинее, показало, что преимущества добавок железа при материнской анемии и массе тела при рождении превышают потенциальный риск, хотя преимущества были наиболее выражены у пациентов с некоторой степенью ID [80]. В общем, добавление железа считается низким риском [53], а добавка железа в дозе 65 мг элементарного железа в мг / день, начиная с 20 недели гестации или ранее, обычно является достаточной для предотвращения ЖД во время беременности [30].Однако одним из аргументов против рутинного приема добавок железа, особенно в менее развитых странах, является то, что положительный эффект на нейрокогнитивное развитие младенцев (в отличие от положительного воздействия на материнскую анемию и запасы железа) не был четко продемонстрирован, как обсуждалось ранее [79 ]. В соответствии с рекомендациями Великобритании и ACOG, исследование этиологии анемии будет проводиться, если уровень гемоглобина ниже описанного. На этом этапе основное внимание уделяется лечению ЖДА (которое можно рассматривать как обеспечение человека с адекватными запасами железа дополнительным железом, необходимым для беременности).Целью лечения ЖДА является коррекция анемии, а также восполнение недостающих запасов железа. Если лечение начато на ранних сроках беременности, необходимо будет обеспечить прием 500–800 мг железа, которое будет передано новорожденному, а также поддержание материнского гемоглобина / гемоглобина и восполнение запасов железа. Разумным подходом к терапии является введение 60–100 мг элементарного железа в день. Доступны различные пероральные препараты железа, и предпочтения пациентов, а в некоторых случаях и финансовые затраты пациента, могут определять выбор.Традиционно, ID лечили пероральным железом три раза в день. Последующие исследования, посвященные взаимодействию пероральной терапии железом с гепсидиновой осью, привели к признанию того, что прирост гепсидина, вызванный терапевтическими дозами солей железа или сахаратов, снижает абсорбцию примерно на 24 часа, подразумевая, что пероральная терапия один раз в день столь же эффективна или более эффективна. чем при традиционном дозировании два или три раза в день [103]. Отсутствие реакции на пероральное введение железа должно привести к переоценке статуса железа (как описано в Разделе 6.Это было бы направлено на решение проблем с абсорбцией железа, приводящих к плохому ответу или (что чаще) несоблюдению режима терапии железом, но также для рассмотрения других возможных этиологий анемии во время беременности. Пероральная терапия железом при ЖДА во время беременности должна продолжаться до тех пор, пока Hb / Hct и MCV не вернутся в нормальный диапазон и пока уровень ферритина в сыворотке также не вернется к твердо нормальному значению (определенно выше 30 мкг / л и, вероятно, выше 50 мкг / л). L), что указывает на адекватные запасы железа. Большинство беременных пациенток могут переносить пероральное введение железа, особенно если его вводят один раз в день или периодически.Однако, если пациент не реагирует на пероральное введение железа или не может / не хочет принимать пероральное железо, внутривенная терапия препаратом железа безопасна и эффективна [104]. Преимущество внутривенной терапии железом состоит в том, что она одновременно и быстро корректирует Hb / Hct и запасы железа. Недавние систематические обзоры показывают, что внутривенная терапия железом во время беременности позволяет более полно достичь желаемых концентраций гемоглобина [105,106]. Доступен ряд препаратов железа для внутривенного введения с различными режимами дозирования, и их подробное обсуждение выходит за рамки настоящего обзора.В большинстве случаев общая доза для внутривенного введения составляет 1000–1500 мг элементарного железа. При отсутствии желудочно-кишечных признаков или симптомов эндоскопическая оценка желудочно-кишечного тракта вряд ли позволит выявить поражение, являющееся причиной кровопотери у женщин с ИН в пременопаузе, и ее можно безопасно отложить в пользу испытания заместительной терапии железом [107]. Как отмечалось ранее, отсутствие ответа на терапию препаратом железа должно требовать оценки либо продолжающихся источников кровопотери, если имеются устойчивые доказательства ИН, либо рассмотрения анемии другой этиологии.Уровни HbA1c значительно ниже на ранних и поздних сроках беременности
Строгий гликемический контроль необходим для минимизации заболеваемости матери и плода и смертности от беременностей, осложненных диабетом (1–3). Помимо измерения уровня глюкозы в крови в домашних условиях, которое не всегда может отражать истинный средний уровень глюкозы в крови (4), полезным параметром регуляции метаболизма является HbA 1c (5–8). Таким образом, прием добавок HbA 1c , как это часто бывает вне беременности, кажется целесообразным.
До беременности целью метаболического контроля у женщин с диабетом является уровень HbA 1c , близкий к нормальному (9). Однако верхний нормальный диапазон HbA 1c во время нормальной беременности редко исследуется различными методами (10), в основном на поздних сроках беременности (5,6,11,12), и референсные диапазоны обычно устанавливаются на основании небеременного состояния ( 4). Повышенные уровни HbA 1c в третьем триместре связаны с повышенным риском преэклампсии (3,13), макросомии (1) и мертворождения (2), что приводит к предположениям о том, что целевой уровень HbA 1c во время беременности должен быть одинаковым. ниже, чем вне беременности, чтобы предотвратить побочные эффекты.
Существует необходимость установить референсный диапазон HbA 1c во время нормальной беременности с помощью международно признанного метода исследования контроля и осложнений диабета (DCCT). В этом исследовании мы оценили нормальный верхний диапазон HbA 1c на ранних и поздних сроках беременности.
ДИЗАЙН И МЕТОДЫ ИССЛЕДОВАНИЯ
В нашей дородовой клинике мы случайным образом отобрали 100 здоровых беременных женщин без гестационного диабета в анамнезе (группа ранних беременностей).У всех испытуемых был случайный уровень глюкозы в капиллярной крови <7,0 ммоль / л при первом дородовом посещении примерно на 14 неделе (диапазон 8-17), и ни у одного из них не развился гестационный диабет. Использовался выборочный скрининг, основанный на факторах риска гестационного диабета (14).
Группа поздних беременностей была создана из 98 здоровых беременных женщин на 33 неделе (диапазон 28–37), которые в рамках другого исследования (14) прошли нормальный пероральный тест на толерантность к глюкозе (ПГТТ) с дозировкой 75 г. HbA 1c был измерен в тот же день, что и OGTT.
Небеременную контрольную группу составили 145 здоровых женщин в возрасте 30 лет, обследованных в рамках популяционного опроса Inter 99 (15). У всех был нормальный OGTT. 8 ) (нормальный диапазон 4,1–6,4%, коэффициент вариации межисследовательской точности 3.5%). Нормальный ПГТВ определялся как значение ПГТВ через 2 часа <7,8 ммоль / л (16). Случайные измерения уровня глюкозы в крови выполняли с помощью прибора HemoCue (Hemocue, Ängelholm, Швеция), коэффициент вариации которого у беременных составляет 2,8–3,7% (17,18).
Для расчета ИМТ у беременных использовались рост и вес до беременности. Протокол был одобрен местным этическим комитетом.
Статистический анализ
Данные представлены как средние значения ± стандартное отклонение. Для сравнения трех групп использовался тест тенденции.Когда тест тенденции был значимым, для сравнения между группами использовались непарные тесты Стьюдента t с использованием поправки Бонферрони, позволяющей проводить множественные сравнения. P <0,05 считается значимым. HbA 1c считался нормально распределенным. Нормальный диапазон рассчитывали как среднее ± 2 SD.
РЕЗУЛЬТАТЫ
Уровень HbA 1c значительно снизился на ранних сроках беременности и еще больше снизился на поздних сроках беременности по сравнению с небеременными женщинами того же возраста (Таблица 1).Нормальный диапазон HbA 1c составлял 4,7–6,3% у небеременных женщин, 4,5–5,7% на ранних сроках беременности и 4,4–5,6% на поздних сроках беременности. Чтобы исключить, что различия в HbA 1c были обусловлены различиями в ИМТ между группами, женщины с ИМТ> 25 кг / м 2 были исключены из всех групп, в результате осталось 106 небеременных субъектов, 87 пациенток с ранней беременностью и 85 Субъекты с поздней беременностью. Среднее значение HbA 1c существенно не изменилось (контроль 5,5 ± 0,4, ранняя беременность 5.1 ± 0,3, а на поздних сроках беременности 5,0 ± 0,3%; P для тренда <0,001), тогда как ИМТ был сопоставимым (21,7 ± 2,0, 21,6 ± 1,7 и 21,5 ± 1,9 кг / м 2 ; P = NS).
ВЫВОДЫ
У тщательно отобранных женщин без диабета и с использованием поперечного дизайна мы обнаружили, что HbA 1c был ниже на ранних сроках беременности и еще больше снижался на поздних сроках беременности по сравнению с небеременными женщинами того же возраста, которые использовали метод, согласованный с DCCT. . Снижение верхней границы нормы HbA 1c с 6.От 3% до беременности до 5,6% в третьем триместре беременности имеет важное клиническое значение при определении референсного диапазона для HbA 1c во время беременности у женщин с диабетом.
Наши результаты согласуются с данными O’Kane et al. (6), которые изучили 493 здоровых женщины с помощью метода DCCT, в основном в третьем триместре, и с помощью Hartland et al. (5), которые исследовали 267 беременных европеоидных и 249 азиатских женщин с помощью турбидиметрического иммуноанализа с латексным усилением. Однако небеременные женщины не были включены для сравнения в эти два исследования.В наше исследование было включено достаточное количество женщин, чтобы выявить существенные различия, и важность использования DCCT-согласованного метода HbA 1c была рассмотрена в заявлении о консенсусе (8).
На поздних сроках беременности все женщины в нашем исследовании прошли тест на нормальную толерантность к глюкозе. Это может объяснить, почему мы обнаружили дальнейшее снижение HbA 1c на поздних сроках беременности по сравнению с другими (5).
Во время нормальной беременности снижение уровня глюкозы в крови натощак происходит на ранних сроках беременности, в основном между 6 и 10 неделями, и сохраняется в течение оставшейся части беременности (19).Таким образом, образующиеся новые эритроциты будут подвергаться воздействию более низкой средней по времени концентрации глюкозы, чем у небеременных женщин, и поэтому степень гликозилирования может быть меньше (12). Кроме того, продолжительность жизни эритроцитов во время беременности, вероятно, уменьшится, что также приведет к снижению значения HbA 1c (20–22). Уровень гемоглобина в этом исследовании не измерялся, и возможная роль анемии не могла быть объяснена.
Наше исследование, в котором участвовали небеременные, беременные на ранних и поздних сроках беременности, продемонстрировало снижение верхнего нормального уровня HbA 1c с 6.От 3 до 5,7% на ранних сроках беременности и до 5,6% в третьем триместре беременности, что указывает на снижение HbA 1c во время нормальной беременности, что имеет клиническое значение при определении цели для HbA 1c во время беременности, осложненной диабетом.
Таблица 1 —HbA 1c при нормальной, ранней и поздней беременности по сравнению с небеременными женщинами того же возраста без диабета
Ссылки
Дефицит витамина B6 и анемия во время беременности
Мы показали, что некоторые беременные женщины с анемией, которые не реагировали на добавки железа, имели дефицит витамина B6, и что анемия у этих женщин улучшилась. при приеме витамина B6.Хотя женщины были успешно вылечены, для клинической оценки важно уточнить, отражает ли низкая концентрация витамина B6 в сыворотке дефицит витамина B6 или это нормальная физиологическая реакция на беременность. Чтобы изучить нутриционный статус здоровых беременных женщин, мы проспективно изучили изменчивость сывороточных концентраций питательных микроэлементов, влияющих на выработку эритропоэтических клеток, включая железо, витамин B6, витамин B12, фолиевую кислоту и общий белок / альбумин, с приближающейся стадией беременности.Хотя уровни всех микронутриентов в крови имели тенденцию к снижению с приближением срока беременности, в третьем триместре уровни железа и, в частности, витамина B6 упали до нижних пределов референтного диапазона для небеременных. Эти результаты показывают, что у беременных женщин может развиваться дефицит витамина B6 одновременно с дефицитом железа. PLP, надежный индикатор статуса питания витамина B6, как известно, гидролизуется до пиридоксаля щелочной фосфатазой (ALP). На статус витамина B6 во время беременности может влиять ЩФ, которая вырабатывается плацентой.Barnard et al. (1987) указывают, что для точной оценки нутритивного статуса витамина B6 и правильного понимания физиологии витамина B6 у беременных женщин требуется измерение как PLP, так и пиридоксаля в плазме. Таким образом, в этом исследовании мы использовали сумму PLP и пиридоксаля в крови в качестве маркеров статуса витамина B6. Было признано, что у наших пациентов был очевидный дефицит витамина B6 по сравнению с нормальным диапазоном для небеременных.
Средние концентрации общего белка и альбумина у здоровых беременных женщин поддерживались приблизительно на начальном уровне на протяжении всей беременности с учетом увеличения объема плазмы во время беременности.Напротив, 82% женщин с дефицитом витамина B6 имели низкий уровень сывороточного протеина / альбумина. Хотя это может отражать недостаточное питание, вызванное недостаточным потреблением белка, мы считаем, что снижение концентрации общего белка в крови является характерной чертой дефицита витамина B6 у беременных женщин. Кроме того, большая часть женщин с дефицитом витамина B6 имела многоплодную беременность, что может выступать в качестве фактора риска из-за накопления витамина B6 плодом и плацентой.
Дефицит витамина B6 может препятствовать начальной ферментативной стадии синтеза гема и использованию железа в эритропоэтических клетках (Институт медицины, 1998; Awad, 2006). Дефицит как железа, так и витамина B6 вызывает микроцитарную гипохромную анемию и неразличимую картину крови, что указывает на необходимость измерения концентраций обоих веществ для постановки правильного диагноза. В медицинской практике беременным женщинам рекомендуется принимать добавки железа перед любыми измерениями.Здесь мы сообщаем, что дефицит витамина B6 часто встречается у беременных женщин и, предположительно, способствует высокой распространенности анемии у беременных.

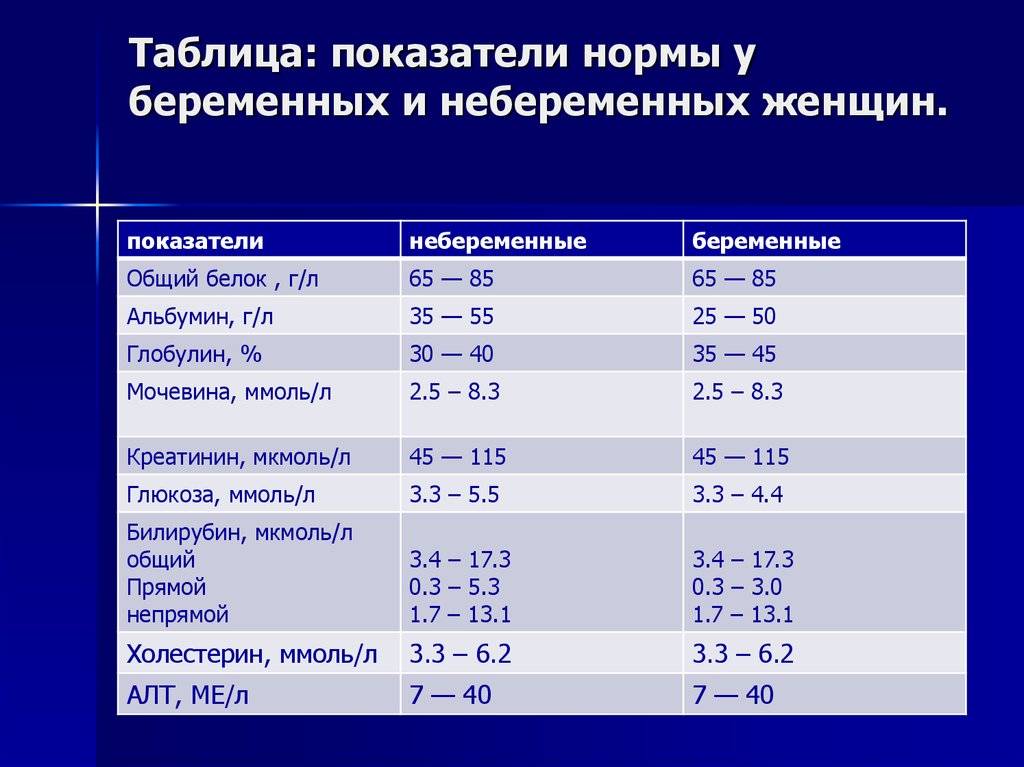

 Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно.
Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно.