Гаптоглобин
Белок, связывающий свободный гемоглобин, предотвращая выведение его из организма.
Открыт в 1938 г. М. Polonovski и М. Jajle. Это белок острой фазы воспаления, обладающий способностью связывать свободный гемоглобин, освобождающийся из эритроцитов, предотвращая выведение гемоглобина из организма и поражение почек. Он, как и трансферрин, церуроплазмин, относится к белкам, представляющим собой наиболее древнюю систему иммунной защиты организма.
Связывание токсичного свободного гемоглобина происходит с a-глобиновыми цепями гемоглобинов А, F, S и С. Метгемоглобин, гем и аномальные формы гемоглобина, в которых альфа-цепи отсутствуют, гаптоглобин не связывает. Гаптоглобин-гемоглобиновый комплекс быстро захватывается из циркулирующей крови ретикулоэндотелиальными клетками, благодаря чему предотвращается или минимизируется потеря гемоглобина и железа.
При гемолизе эритроцитов наблюдается быстрое снижение уровня гаптоглобина плазмы. В норме в день разрушается и удаляется из циркуляции около 1% эритроцитов. Увеличение этого количества до 2% ведёт к полному исчезновению гаптоглобина (в отсутствие таких стимулов для его продукции, как острое воспаление или кортикостероидная терапия). При патологиях, связанных с неэффективным гемопоэзом и разрушением эритроцитов при некоторых гемоглобинопатиях, наблюдается хроническое снижение уровня гаптоглобина (и гемопексина). Свободные димеры гемоглобина могут проходить через почечный фильтр, подвергаясь реабсорбции и катаболизму с включением железа в клеточный ферритин и гемосидерин. При насыщении способности к проксимальной реабсорбции свободный гемоглобин экскретируется в мочу. Железо в клетках почечных канальцев может достигать токсических концентраций, вызывающих нарушение функции почек.
Увеличение этого количества до 2% ведёт к полному исчезновению гаптоглобина (в отсутствие таких стимулов для его продукции, как острое воспаление или кортикостероидная терапия). При патологиях, связанных с неэффективным гемопоэзом и разрушением эритроцитов при некоторых гемоглобинопатиях, наблюдается хроническое снижение уровня гаптоглобина (и гемопексина). Свободные димеры гемоглобина могут проходить через почечный фильтр, подвергаясь реабсорбции и катаболизму с включением железа в клеточный ферритин и гемосидерин. При насыщении способности к проксимальной реабсорбции свободный гемоглобин экскретируется в мочу. Железо в клетках почечных канальцев может достигать токсических концентраций, вызывающих нарушение функции почек.
Снижение гаптоглобина (в отсутствие других факторов, влияющих на его продукцию) является чувствительным маркёром внутрисосудистого гемолиза. Синтез гаптоглобина происходит преимущественно в печени, но также и в жировой ткани и лёгких. Стимулируется (посредством цитокинов) воспалением, но не гемолизом или снижением уровня гаптоглобина. Пик повышения наблюдается на 4 — 6 днях после стимуляции; снижение до нормального уровня – в течение 2 недель после удаления стимулирующих факторов.
Пик повышения наблюдается на 4 — 6 днях после стимуляции; снижение до нормального уровня – в течение 2 недель после удаления стимулирующих факторов.
В настоящее время продемонстрировано, что свободный гаптоглобин и его комплексы с гемоглобином играют важную роль не только в поддержании резерва железа, но и в контроле местных воспалительных процессов. Они являются мощными пероксидазами, которые гидролизуют пероксиды, освобождающиеся в процессе действия фагоцитов, гаптоглобин кроме того, ингибирует катепсин В и модулирует активность и пролиферацию лейкоцитов в участке воспаления. Комплексирование гемоглобина гаптоглобином предотвращает стимуляцию им перекисного окисления липидов и образование гидроксильного радикала в участках воспаления. Гаптоглобин относят к природным бактериостатическим агентам при инфекциях Fe-зависимыми бактериями (например, Escherichia coli), что связано, возможно, с предотвращением использования ими железа гемоглобина.
Длительно сохраняющиеся высокие значения гаптоглобина являются признаком неблагоприятного течения болезни. Уменьшение концентрации гаптоглобина чаще всего отмечается при заболеваниях, сопровождающихся внутрисосудистым гемолизом или повышенным высвобождением гемоглобина, например, при гемолитической анемии, пострансфузионном гемолизе и малярии. Внесосудистый гемолиз обычно не приводит к изменению концентрации гаптоглобина. Кроме того, снижение концентрации гаптоглобина может отмечаться при врождённой агаптоглобулинемии и тяжёлых заболеваниях печени с нарушением синтеза белков. Искусственные клапаны сердца и интенсивные занятия спортом, сопровождающиеся постоянным механическим повреждением эритроцитов, также могут приводить к снижению уровня гаптоглобина.
Уменьшение концентрации гаптоглобина чаще всего отмечается при заболеваниях, сопровождающихся внутрисосудистым гемолизом или повышенным высвобождением гемоглобина, например, при гемолитической анемии, пострансфузионном гемолизе и малярии. Внесосудистый гемолиз обычно не приводит к изменению концентрации гаптоглобина. Кроме того, снижение концентрации гаптоглобина может отмечаться при врождённой агаптоглобулинемии и тяжёлых заболеваниях печени с нарушением синтеза белков. Искусственные клапаны сердца и интенсивные занятия спортом, сопровождающиеся постоянным механическим повреждением эритроцитов, также могут приводить к снижению уровня гаптоглобина.
Уровень гаптоглобина низок в период новорожденности, а также у женщин во время беременности или терапии экзогенными эстрогенами, включая оральные контрацептивы.
Взятие крови предпочтительно проводить утром натощак, после 8-14 часов ночного периода голодания (воду пить можно), допустимо днем через 4 часа после легкого приема пищи. Накануне исследования необходимо исключить повышенные психоэмоциональные и физические нагрузки (спортивные тренировки), приём алкоголя.На исследование может повлиять приём лекарственных препаратов, обуславливающих гемолитическую анемию (дапсон, метилдопа, сульфосалазин), эстрогенов, оральных контрацептивов, тамоксифена, андрогенов.
Накануне исследования необходимо исключить повышенные психоэмоциональные и физические нагрузки (спортивные тренировки), приём алкоголя.На исследование может повлиять приём лекарственных препаратов, обуславливающих гемолитическую анемию (дапсон, метилдопа, сульфосалазин), эстрогенов, оральных контрацептивов, тамоксифена, андрогенов.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения в медицинском центре СТУДИЯ ДОКТОР: мг/дл.
Альтернативные единицы: г/л.
Пересчёт единиц: г/л х 100 мг/дл.
Референсные значения
Возраст (в годах) | пол | мг/дл |
| 0 — 1 год | Муж. Жен Жен | 0 – 300 0 – 235 |
| 1 — 12 лет | Муж. Жен. | 3 – 270 11 – 220 |
| 13 — 60 лет | Муж. Жен. | 14 – 258 35 – 250 |
| > 60 лет | Муж. Жен. | 40 – 268 63 – 273 |
Повышение значений:
реакции острой фазы при инфекциях, травмах, некрозах, хирургических вмешательствах, сепсисе;
кортикостероидная терапия.
обструкция желчевыводящих путей;
нефротический синдром;
применение андрогенов;
злокачественные опухоли, плазмоцитома;
сахарный диабет;
коллагенозы;
болезнь Ходжкина;
голодание.
Понижение значений:
генетический дефицит гаптоглобина;
наследственный сфероцитоз;
гемолитическая болезнь;
аутоиммунная гемолитическая анемия;
неэффективный эритропоэз;
применение эстрогенов;
беременность;
период новорожденности;
патология печени (цирроз).

11 первых показателей здоровья в крови
Для врача любой специализации БИОХИМИЧЕСКИЙ АНАЛИЗ КРОВИ – это сложное лабораторное исследование, которое проводится для определения состояния системы и органов человека.
Для любого взрослого человека и ребенка- это пожалуй самый первый и простой способ проверить свой организм и состояние его здоровья.
Биохимический анализ крови очень важен для правильной диагностики подавляющего большинства болезней, поэтому его предписывают в первую очередь.
Правильная расшифровка данных биохимического анализа и знание необходимых правильных показателей дает возможность точно определить имеющиеся нарушения в работе органов, водно-солевом обмене, а также дисбаланс микроэлементов, воспалительные инфекции и процессы.
Что входит в 11 критериев оценки здоровья по биохимии?
- Общий белок— анализы крови определяют суммарную концентрацию различных белков, которые состоят из аминокислот.

Норма: 64-84 г/л.
Биохимический анализ крови указывает на то, что при превышении уровня нормальных показателей белка можно говорить о ревматизме, артрите, инфекционных или онкологическом заболеваниях.
При заниженном белке возможны: болезни кишечника, почек, печени или онкологическое заболевание.
- Гемоглобин— это специфический белок, входящий в систему эритроцитов, который отвечает за перемещения кислорода в организме. Анализы крови при биохимии определяют уровень гемоглобина.
Норма: жен — 120-150 г/л, муж — 130-160 г/л.
Пониженное содержание гемоглобина при биохимическом анализе крови может указывать на имеющиеся признаки анемии.
- Гаптоглобин— белок (известен трех типов Hp2-2, Hp2-1, Hp1-1) связывает гемоглобин и отвечает за сохранение железа в организме.
 Количество белка выявляется при анализе крови.
Количество белка выявляется при анализе крови.
Норма (гаптоглобина в сыворотке): пожилые — 350-1750 мг/л, взрослые — 150-2000 мг/л, дети — 250-1380 мг/л.
Результаты анализа крови пониженного уровня гаптоглобина указывает на увеличение селезенки, заболевание печени, аутоиммунное заболевание или дефекты мембраны эритроцитов.
Биохимические анализы указывает на то, что высокий уровень может наблюдаться при злокачественных новообразованиях (рак молочной железы, легких, гениталий или кишечника).
- Глюкоза— один из важных компонентов, который отвечает за углеводный обмен. Биохимический анализ крови позволяет определить уровень глюкозы. Содержание глюкозы в артериальной крови всегда выше, чем в обычной венозной.
Норма: 3,30-5,50 ммоль/л.
Повышенный уровень глюкозы может указывать на угрозу диабета 1 или диабета 2 типа, либо о нарушениях терпимости к глюкозе. Определяется при биохимическом анализе.
Определяется при биохимическом анализе.
- Мочевина— является основным продуктом распада белков. Уровень мочевины определяется анализом крови.
Норма: 2,5-8,3 ммоль/л.
Увеличение уровня мочевины в биохимическом анализе взятой крови говорит о проблеме работы почек, кровотечениях, возможной сердечной недостаточности, различных опухолях, непроходимости мочевыводящих путей или кишечной непроходимости. Биохимический анализ крови определяет краткое повышение уровня мочевины, которое может также возникать после сильных физических нагрузок или интенсивных тренировок.
- Креатинин— как и сама мочевина, креатинин является показателем работы почек и участвует в общем энергетическом обмене тканей.
Норма (в зависимости от мышечной массы): жен — 53-97 мкмоль/л. муж — 62-115 мкмоль/л. Повышение уровня обычно указывает на имеющуюся почечную недостаточность или развивающийся гипертиреоз.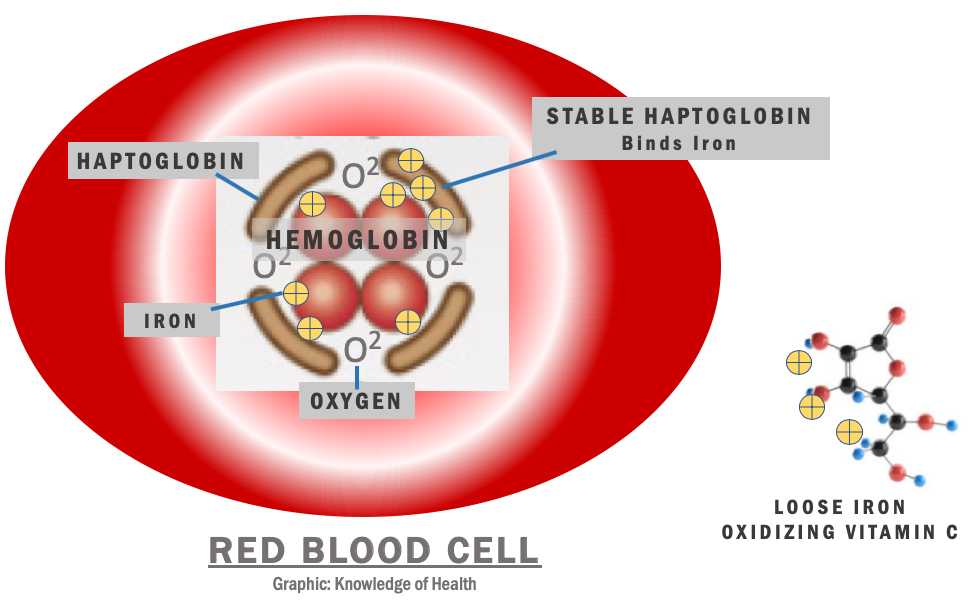
- Холестерин(холестерол) — является компонентом жирового обмена, также участвует при построении мембраны клетки и синтезе витамина D и половых гормонов. Различают — общий холестерин, холестерин липопротеинов с низкой плотностью (ЛПНП) и высокой плотностью (ЛПВП).
Норма (холестерин общий): 3,5-6,5 ммоль/л.
Если биохимический анализ крови показывает высокий уровень, то это ориентирует на риск атеросклероза, болезни печени и сердечно-сосудистой системы.
- Билирубин— желто-красный пигмент, который образуется во время распада гемоглобина. Бывает непрямой и прямой билирубин, которые составляют вместе билирубин общий.
Нормы (общего билирубина): 5-20 мкмоль/л.
При увеличении нормы выше, чем 27 мкмоль/л у человека начинается желтуха. Повышенное содержание может быть вызвано заболеваниями печени, раком, гепатитом, отравлениями или симптомами цирроза печени.
- АлАТ (АЛТ) Аланинаминотрансфераза— фермент печени может быть использован для оценки ее работы. Находится в клетках почек печени и сердца. Обнаруживается при разрушении клеток в этих органах.
Нормы: жен — до 31 ед/л, муж — до 41 ед/л.
Повышенное содержание АлАТ указывает на поражение печени или сердца и связанными с этим опасными заболеваниями.
- АсАТ (АСТ) Аспартатаминотрансфераза— клеточные ферменты, такие как АлАТ, содержатся в клетках печени сердца и почек. Участвует при обмене аминокислот.
Норма: жен — до 31 ед./л, муж — до 41 ед./л.
Биохимический анализ крови после расшифровки может показать, что повышение уровня может привести к инфаркту, раку печени, гепатиту, панкреатиту.
- Амилаза— необходим для расщепления углеводов из пищи, обеспечивает их переваривание.

Норма для альфа-амилазы: 28-100 ед/л.
Нормы панкреатической амилазы: 0-50 ед./л.
Повышенное содержание амилазы при биохимическом анализе крови указывает на: холецистит, перитонит, сахарный диабет, панкреатит, кисту поджелудочной железы, камни или почечную недостаточность.
«В здоровом теле — здоровый дух» — эту фразу мы слышим с самого детства. Но достаточно ли внимания мы уделяем своему здоровью? А ведь нужно вовремя проходить профилактические осмотры и прислушиваться к «сигналам» своего организма!
11 показателей здоровья — биохимический анализ, который позволит оценить общее состояние здоровья.
Что нужно, чтобы сдать анализ?
Отбор материала для биохимического анализа всегда рекомендуется проводить натощак (нельзя принимать какую-либо пищу за 6-12 часов), из жидкости разрешается только пить воду. Исследуемый материал для биохимии берется из вен.
Исследуемый материал для биохимии берется из вен.
- Прийти в любую клинику Талап с 7:30 до 16.00.
- Обратиться в регистратуру для оформления анализа.
- Сдать анализ в процедурном кабинете.
Анализы в медицинском центре ЛабСтори, запись на прием к врачу онлайн
Описание анализа
Гаптоглобин является одним из основных элементов, который связывает гемоглобин в крови. Его основная функция – предотвращение любых видов повреждений почечных канальцев и сохранение необходимого уровня железа в крови благодаря исключению экскреции гемоглобина.
Лабораторный анализ на концентрацию гаптоглобина позволяет обнаружить в организме острые воспалительные процессы, нефротические изменения, генетические отклонения, появление злокачественных опухолей или начинающийся некроз тканей – уровень белка может как снижаться, так и увеличиваться.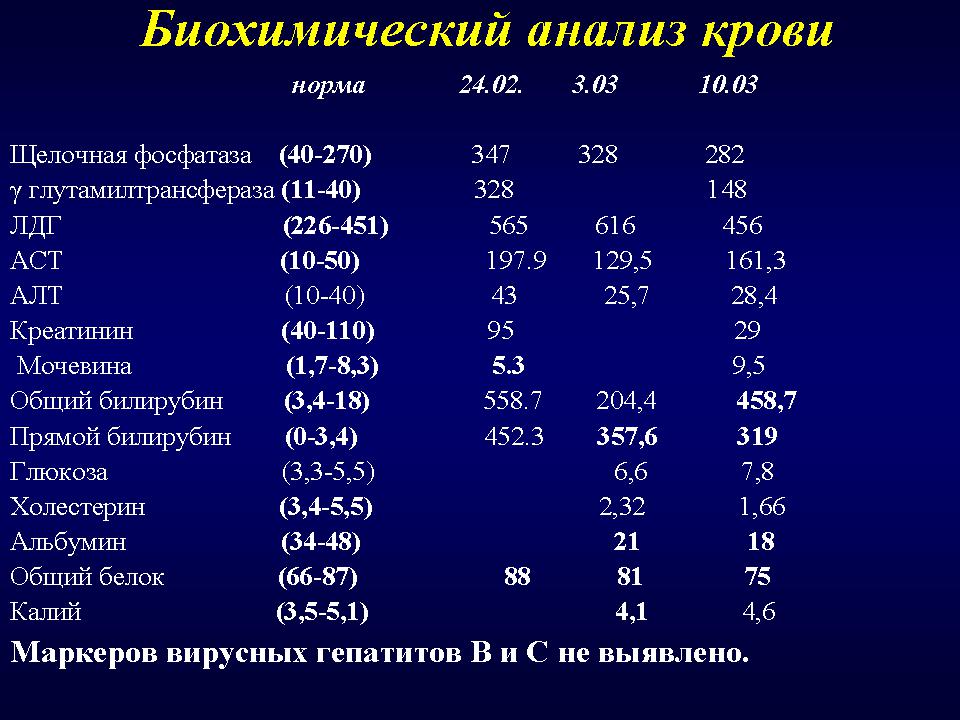 Этот белок относится к острофазным элементам, но изменения его показателей не настолько закономерны, как у других белков. Исследование проводится с использованием сыворотки крови методом иммунотурбидиметрии.
Этот белок относится к острофазным элементам, но изменения его показателей не настолько закономерны, как у других белков. Исследование проводится с использованием сыворотки крови методом иммунотурбидиметрии.
Показания к проведению
Анализ применяется в случае:
-
контроля за процедурой переливания крови пациенту;
-
необходимости диагностики гемолитического состояния больного.
Факторы, влияющие на результаты анализа
Точность лабораторного анализа может быть нарушена из-за проведенного гемолиза, хилеза пробы, употребления андрогенов или кортикостероидов во время медикаментозной терапии.
Врач, назначающий исследование
Направление на анализ можно получить у неонатолога, педиатра, терапевта, онколога, гематолога, ревматолога.
Подготовка к анализу
Забор материала у пациента производится исключительно натощак, прием еды перед исследованием следует ограничить – ничего жареного, жирного, никакого алкоголя за 8 часов до процедуры. С утра при необходимости можно выпить воды. Прием лекарственных препаратов нежелателен на время забора крови, но в особых ситуациях следует в точности указать дозировку и количество употребляемых лекарств.
С утра при необходимости можно выпить воды. Прием лекарственных препаратов нежелателен на время забора крови, но в особых ситуациях следует в точности указать дозировку и количество употребляемых лекарств.
Нежелательно совмещать проведение анализа и другие диагностические процедуры – флюорографию, ректальный осмотр, физиотерапию, УЗИ-диагностику.
Интерпретация результатов
После получения на руки окончательных результатов лабораторных анализов обязательно проконсультируйтесь с профильным врачом. Не занимайтесь самодиагностикой, показатели могут немного отличаться в зависимости от использованного оборудования в лаборатории. Референсные значения нормального уровня гаптоглобина в крови:
-
для детей до 1 месяца 0,1-3,0 г/л;
-
2 месяца-14 лет 0,2-3,0 г/л;
-
для взрослых 0,3-3,0 г/л.
ИДЦ — Иркутский диагностический центр
Гаптоглобин (сыворотка крови) (количественный)
Описание услуги
Код услуги:
2Ж1023
Готовность результатов:
по графику, ближайшие даты: 21. 06.21, 23.06.21, 24.06.21, 26.06.21, результат через 4 рабочих дня, после 17:00
06.21, 23.06.21, 24.06.21, 26.06.21, результат через 4 рабочих дня, после 17:00
Гаптоглобин (гемоглобин-связывающий белок) Физиологическая роль гаптоглобина заключается в связывании гемоглобина из разрушенных эритроцитов с последующим транспортом гаптоглобин-гемоглобиновых комплексов в купферовские клетки печени для утилизации.
Норма: 16 – 200 мг/дл в сыворотке крови.
Клинико-диагностическое значение
Белок острой фазы воспаления, претерпевает при воспалении двунаправленные изменения: повышение концентрации, что является результатом стимуляции его синтеза интерлейкинами; с другой стороны – снижение концентрации, что отражает умеренную или среднюю степень гемолиза. Суммарным результатом может быть повышение, снижение или сохранения нормального уровня белка. Поскольку эти процессы развиваются одновременно, истинную характеристику состояния можно получить, исследуя в той же пробе другой белок острой фазы, не подверженный влиянию гемолиза. Повышение концентрации гаптоглобина в сыворотке крови происходит при острых и хронических воспалительных процессах и инфекциях различной этиологии, злокачественных новообразованиях, некрозе тканей, закупорке желчных путей, приёме кортикостеройдов.
Уменьшение концентрации гаптоглобина наблюдается при гемолизе различного генеза (аутоиммунный, изоиммунный, механический), неэффективном эритропоэзе, панкреатите, саркоидозе, гепатоцеллюлярных болезнях, лечении эстрогенами, беременность.
Повышение концентрации гаптоглобина в сыворотке крови происходит при острых и хронических воспалительных процессах и инфекциях различной этиологии, злокачественных новообразованиях, некрозе тканей, закупорке желчных путей, приёме кортикостеройдов.
Уменьшение концентрации гаптоглобина наблюдается при гемолизе различного генеза (аутоиммунный, изоиммунный, механический), неэффективном эритропоэзе, панкреатите, саркоидозе, гепатоцеллюлярных болезнях, лечении эстрогенами, беременность.
Для сдачи биоматериала (кровь из вены) обратиться в регистратуру клинико-диагностической лаборатории на 2 этаже. Перед сдачей анализов рекомендуется воздержаться от приема пищи в течение не менее 3 часов. Можно пить воду без газа.
Сдать анализ крови на гаптоглобин в медицинской лаборатории Оптимум г. Сочи (Адлер)
Анализ крови на гаптоглобин – это тест лабораторной диагностики, направленный на определение уровня специфического белкового соединения – гаптоглобина в плазме крови исследуемого человека.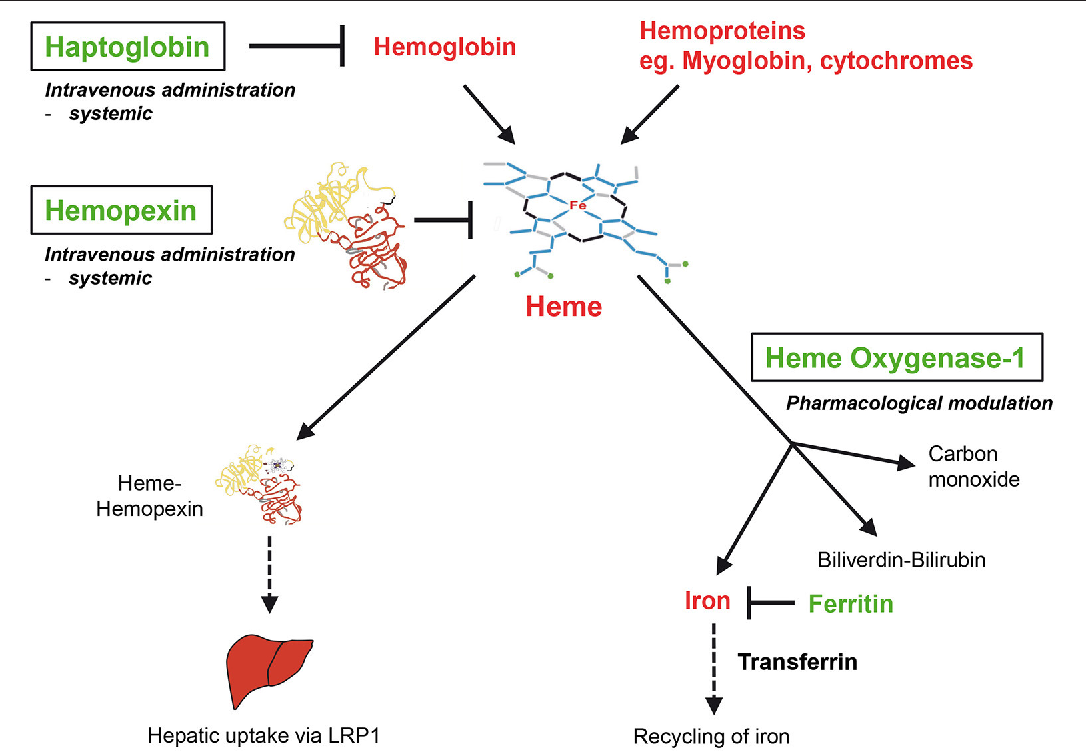 Подготовка и непосредственный забор образцов биологического материала производится по общим правилам, предъявляемым к биохимическим исследованиям. Для этого в утренние часы натощак путем пункции вены необходимо набрать около 10 мл крови. Результат готовится на протяжении рабочего дня.
Подготовка и непосредственный забор образцов биологического материала производится по общим правилам, предъявляемым к биохимическим исследованиям. Для этого в утренние часы натощак путем пункции вены необходимо набрать около 10 мл крови. Результат готовится на протяжении рабочего дня.Что такое гаптоглобин?
Сложное белковое соединение углеводов с протеинами (глобулинами) плазмы крови, обладающее способностью связывать гемоглобин, называют гаптоглобином. Это значит, что его главное физиологическое предназначение – участие в обмене гемоглобина и железа в организме. В чистом виде гаптоглобин синтезируется в печени в трех фенотипических вариантах. Свободно циркулируя в плазме он захватывает гемоглобин, освободившийся после разрушения в селезенке эритроцитов. Таким образом, это важное для организма соединение преждевременно не разрушается и не выводится из организма.
Важно помнить! Гаптоглобин – это транспортный белок, связывающий свободный гемоглобин плазмы и доставляющий в клетки, которые выполняют его расщепление. Освобождающееся при этом железо сразу же расходуется на синтез нового гемоглобина!
Освобождающееся при этом железо сразу же расходуется на синтез нового гемоглобина!
Норма уровня гаптоглобина
Для гаптоглобина предусмотрены норма, зависящая от возрастного критерия. Общепринятые референтные значения в единицах измерения – мг/л, такие:
- Дети новорожденные (до месяца) – 50-480;
- Дети от 3-4 месяцев до подросткового возраста – 250-1380;
- Подростки после 16 лет и взрослые до 60 лет – 150-2000;
- Люди старше 60 лет – 350-1750.
Что значит превышение нормы гаптоглобина?
Существует два основных механизма, вызывающих повышение уровня гаптоглобина выше нормы. Это может быть гемолиз – избыточное разрушение эритроцитов в организме, и стимуляция печени медиаторами воспаления, результатом которой становится ее чрезмерная активность в отношении синтеза гаптоглобина. Подобное явление бывает при:
- Выраженных воспалительных реакциях в организме;
- Опухолевом поражении любой локализации, особенно сопровождающемся распространением метастазов;
- Болезнях почек, проявляющихся нефротическим синдромом;
- Ревматических и других миокардитах, а также инфаркте миокарда;
- Аутоиммунных заболеваниях соединительной ткани;
- Лимфогранулематозе.
 Гаптоглобин входит в группу важных критериев оценки течения этой болезни;
Гаптоглобин входит в группу важных критериев оценки течения этой болезни; - Застое желчи (холестаз).
Почему показатель гаптоглобина может быть ниже нормы?
Основные механизмы понижения гаптоглобина ниже нормы такие:
- Активный гемолиз (разрушение эритроцитов), что бывает при неправильном переливании крови, резус-конфликте, наличии искусственных клапанов сердце и сосудистых протезов, аутоиммунных болезнях. В таком случае резервы печени попросту исчерпываются на фоне постоянной стимуляции;
- Патология печени, приводящая к печеночно-клеточной недостаточности, что вызывает утрату этим органом способности к синтезу любых белков.
Гаптоглобин в плазме крови арктических ластоногих [ Haptoglobin in the blood plasma of arctic pinnipeds ]
ФИЗИОЛОГИЯ
Ветеринарная Практика № 3(42), 2008 167
Как отмечалось выше, из данной группы
животных до настоящего времени дожили
тюлени №1 и №2, тогда как №3 и №4 по-
гибли через определенное время содержа-
ния в неволе. Не исключено, что отмечен-
Не исключено, что отмечен-
ные особенности динамики содержания гап-
тоглобина у них в крови в начальный пери-
од адаптации к новым условиям жизни свя-
заны с особенностями их физиологического
состояния в этот период, определившего их
дальнейшую жизнеспособность. В пользу
этого предположения свидетельствуют и
другие показатели, по которым резко разли-
чались выделенные нами мини-группы — №1
+ №2 и №3 + №4. В частности, к таким по-
казателям относится лейкоцитарная форму-
ла, которая, как известно, широко использу-
ется в медицинской и ветеринарной практи-
ке с диагностическими целями. Выделенные
нами две группы резко различались по соот-
ношению уровня лимфоцитов и нейтрофи-
лов [4]. Так, у погибших в разное время тю-
леней №3 и №4 не наблюдался физиологи-
ческий перекрест, являющийся характерной
возрастной особенностью клеточного соста-
ва крови млекопитающих. Этот факт позво-
Этот факт позво-
лил предположить, что утрата характерных
возрастных особенностей может рассматри-
ваться как снижение уровня жизнеспособ-
ности, приводящее к гибели животных.
Заключение
Таким образом, результаты исследований
показывают, что гаптоглобин является ла-
бильным показателем, содержание которого
в крови тюленей зависит от физиологиче-
ского состояния животных. На этом основа-
нии показатель уровня гаптоглобина в плаз-
ме крови ластоногих может использоваться
для оценки состояния популяции в биомо-
ниторинге, а также для характеристики фи-
зиологического состояния животных в усло-
виях океанариума.
Summary
The results of investigation of the haptoglobin in
a blood plasma of two species of pinnipeds — harp
(Pagophilus groenlandicus Erxleben, 1777) and
grey (Halichoerus grypus Fabricius, 1791) seals
are submitted. Fixed, that haptoglobin is a labile
parameter, which contents in a blood of seals de-
pends on the physiological state of animals. Is con-
Is con-
cluded that the parameter of a haptoglobin level in
a blood plasma of pinnipeds can be used for an
evaluation of the population state in biomonitoring,
and also for the characteristic of the animal physio-
logical state in captivity.
Список литературы
1. Алешкин В.А., Новикова Л.И., Лютов А.Г.,
Алешкина Т.Н. Белки острой фазы и их клиниче-
ское значение // Клин. мед. — 1988. — Т.66, №8. —
С.39-48.
2. Бейсембаева Р.У. Гаптоглобин: структура, свой-
ства и роль в организме позвоночных // Успехи
соврем. биол. — 1984. — Т.98, вып. 3(6). — С.409-
425.
3. Кавцевич Н.Н., Ерохина И.А. Биохимические и
цитологические исследования морских млекопи-
тающих в Арктике. — Апатиты: Изд-во КНЦ РАН,
1996. — 169с.
4. Кавцевич Н.Н., Ерохина И.А., Войнов В.Б. Оцен-
ка и контроль физиологических и функциональ-
ных параметров ластоногих // Эксперименталь-
ные исследования морских млекопитающих в
условиях Кольского залива.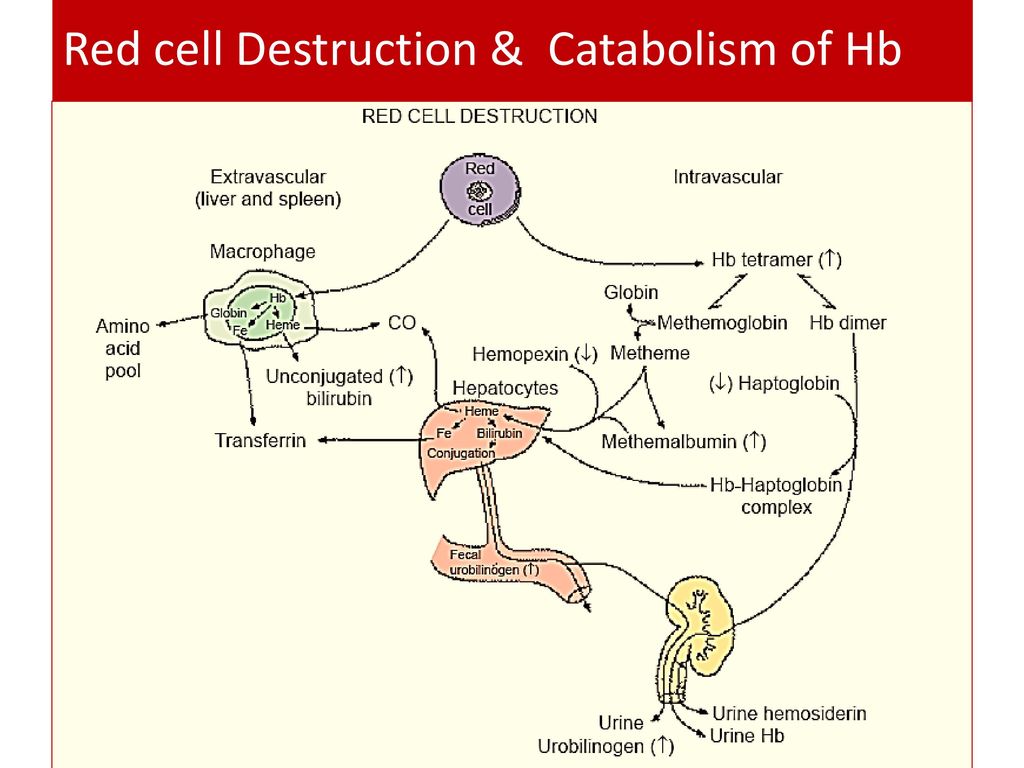 – Апатиты: Изд.
– Апатиты: Изд.
Кольского научного центра РАН, 2007. – С.125-
161.
5. Кокунин В.А. Статистическая обработка данных
при малом числе опытов // Укр. биохим. журн. —
1975. – Т.47, №6. — С.776-790.
6. Потелов В.А. Перспективные для промысла виды
морских млекопитающих в прибрежной зоне
Баренцева моря // Развитие прибрежного про-
мысла и аквакультуры в Баренцевом море. —
Мурманск, 1994. — С.65-67.
7. Справочник по лабораторным методам исследо-
вания / Под ред. Л.А.Даниловой. — СПб: Питер,
2003. — 736с.
8. Geraci J.R., Smith T.G. Functional hematology of
ringed seals (Phoca hispida) in the Canadian Arc-
tic // J. Fish. Res. Board. Can. — 1975. — V.32, N 12. —
P.2559-2564.
9. Gruys E., Obwolo M.J., Toussaint J.M. Diagnostic
significance of the major acute-phase proteins in
veterinary clinical chemistry: A review // Vet. Bull.
1994. — V.64. — P.1009-1018.
10. Handbook of marine mammal medicine / Ed. by
L.A.Dierauf and F.M.D.Gulland. — CRC Press, Boca
Raton, Florida, 2001. — 1063p.
11. Krafft B.A., Lydersen C., Kovacs K.M. Serum hap-
toglobin concentrations in ringed seals (Pusa his-
pida) from Svalbard, Norway // J. Wildlife Diseases.
— 2006. — V.42, N 2. — P.442-446.
12. Murata H., Shimada N., Yoshioka M. Current re-
search on acute-phase proteins in veterinary diagno-
sis: An overview // Vet. J. — 2004. — V.168. — P.28-40.
13. Solter P.F., Hoffman W.E., Hungerford L.L., Siegel
J.P., Stdenis S.H., Dornier J.L. Haptoglobin and
ceruloplasmin as determinants оf inflammation in
dogs // Am. J. Vet. Res. — 1991. — V.52. — P.1738-
1742.
14. Thomton J.D., Mellish J.-A.E. Haptoglobin concen-
trations in free-range and temporarily captive juve-
nile Steller sea lions // J. Wildlife Diseases. — 2007. —
V.43, N 2. — P.258-261.
15. Timoshenko Yu.K. Harp seals as indicators of the
Barents Sea ecosystem//Whales, seals, fish and man:
Proc.Int.Symp.Biol.of Mar.Mamm.in the North East
Atlantic, 29 nov.-1 dec.1994, Tromso, Norway /
Ed.A.S.Blix, L.Walloe, O.Ultang.-Amsterdam: El-
sevier Sci.B.V., 1995. — P.509-522.
16. Zenteno-Savin T., Castellini M.A., Rea L.D., Fadely
B.S. Plasma haptoglobin
17. levels in threatened Alaskan pinniped populations //
J. Wildlife Diseases. — 1997. — V.33. — P.64-71.
| Вещество | Женщины | Мужчины | Дети | Описание | Отклонение от нормы | |
| Общий белок, г/л | 64-84 | 48-82 | Участвует в поддержке Ph, доставляет вещества по организму |
При высоких показателях можно диагностировать ревматизм, артрит, инфекции или онкологию. При значении ниже нормы имеются нарушения в функционировании кишечного тракта, почек, печени, онкологические новообразования. При значении ниже нормы имеются нарушения в функционировании кишечного тракта, почек, печени, онкологические новообразования.
|
||
| Гемоглобин г/л | 120-150 | 130-160 | 110-145 | Осуществляет транспортировку кислорода по тканям | Значение ниже нормы в биохимии крови указывает на симптомы анемии | |
| Гаптоглобин, мг/л | 150-2000 | 250-1380 | Отвечает за связывание гемоглобина, удерживает железо в тканях |
Низкие значения указывают на увеличенную селезенку, патологии печени, снижение иммунитета. Превышение нормы наблюдается при злокачественных опухолях в органах. Превышение нормы наблюдается при злокачественных опухолях в органах.
|
||
| Глюкоза, ммоль/л | 3,80-5,82 | 1,7-6,4 | Обеспечивает углеводный обмен | Высокий уровень показывает склонность к диабету. | ||
| Мочевина, ммоль/л | 2,8-7,2 | 2,5-7,3 | Основной продукт распада белков | При повышении значения в общей биохимии крови наблюдаются нарушения функционирования почек, сердца, новообразования. | ||
| Креатинин, мкмоль/л | 53-97 | 62-115 | 50-100 | Показатель функционирования почек |
Превышение нормы подразумевает патологии почек, гипертиреоз.
|
|
| Холестерин, ммоль/л | 3,5-6,5 | 3,5-7,5 | Компонент жирового обмена | Если среди показателей биохимии крови выявлен высокий холестерин, есть риск атеросклероза, болезней печени и сердца. | ||
| Билирубин, мкмоль/л | 8,5-20,5 |
до 250 (новорождённые) |
Желто-красный пигмент, образующийся в процессе распада гемоглобина | При критичном превышении нормы развивается желтуха. Высокое содержание обычно спровоцировано патологиями печени, онкологией, признаками цирроза. | ||
| АлАТ, ед/л | До 35 | До 45 | До 35 | Печеночный фермент | Высокий уровень указывает на сердечные и печеночные патологии | |
АсАТ, ед. /л /л
|
До 31 | До 41 | До 31 | Ферменты в печени, сердце, почках | При высоком значении есть риск инфаркта, онкологии, гепатита, панкреатита. | |
| Амилаза, ед/л | 25-125 | Нужна для переваривания углеводов из продуктов питания | Высокое содержание в биохимии крови у взрослых говорит о холецистите и воспалениях печени, диабете, камнях в почках. | |||
Роль гаптоглобина в здоровье и болезнях: в центре внимания диабет
Clin Diabetes. 2016 июл; 34 (3): 148–157.
1 и 1, 2Марк МакКеллар
1 MyGenetx Clinical Laboratories, Франклин, TN
Дэвид Дж.
 Вигеруст
Вигеруст1 MyGenetx Clinical, TN MyGenetx Clinical 2 Медицинский факультет Университета Вандербильта, Отделение неврологической хирургии, Нашвилл, Теннесси
1 Клинические лаборатории MyGenetx, Франклин, Теннесси
2 Медицинский факультет Университета Вандербильта, Отделение неврологической хирургии, Нашвилл, Теннесси Корреспондент.© Американская диабетическая ассоциация, 2016 г. Эта статья цитируется в других статьях в PMC. In Brief Перспективная идентификация людей с диабетом, которые подвергаются наибольшему риску развития осложнений, будет иметь большое значение для общественного здравоохранения, если соответствующие ресурсы будут сосредоточены на тех, кто получит наибольшую пользу от агрессивного вмешательства. Гаптоглобин (Hp) — это белок острой фазы, который имеет решающее значение для удаления свободного гемоглобина и нейтрализации окислительного повреждения. Недавние эпидемиологические исследования показали, что эпидемия диабета поражает 415 миллионов человек во всем мире, и ожидается, что к 2040 году эта цифра увеличится до почти 642 миллионов человек (1).Пациенты, страдающие диабетом, часто более восприимчивы к множеству полиорганных осложнений, которые возникают в результате дисфункции микрососудов и макрососудов. Эти осложнения являются основной причиной заболеваемости и смертности в форме ускоренного атеросклеротического заболевания. Известно, что нарушение гликемического контроля и последующие изменения сосудистого эндотелия связаны со всеми степенями атеросклеротического заболевания (2,3). У этой группы пациентов распространен ускоренный атеросклероз, на который приходится> 75% смертности среди людей с диабетом (4). В последнее десятилетие попытки более строгого контроля гликемии предпринимались с сомнительным успехом. В дополнение к более строгим мерам контроля гликемии, были предприняты попытки снизить сердечно-сосудистый риск путем изменения образа жизни и режимов приема лекарств для уменьшения гиперлипидемии и гипертонии. Одна из областей, представляющих значительный интерес для клинического и исследовательского сообщества, — это разработка усовершенствованных инструментов скрининга для выявления и снижения сердечно-сосудистого риска.Одна из таких областей, которая вызвала значительный интерес, — это прогностическая ценность скрининга генотипа гаптоглобина (Hp) в отношении сердечно-сосудистого риска. Полоновски и Джейл впервые описали биохимические свойства Hp более 75 лет назад (5–7). После этого первоначального описания были описаны многочисленные важные биологические функции Hp. Hp представляет собой острофазовый α 2 -гликопротеин с основной биологической функцией связывания свободного гемоглобина (Hb) с очень высоким сродством для предотвращения потери железа после внутрисосудистого гемолиза (8,9) и предотвращения Hb-опосредованного повреждения почек. Hp присутствует в сыворотке крови всех млекопитающих, но полиморфизм обнаружен только у человека (15). Аллельные различия, наблюдаемые у людей, возникают в результате перекрестной дупликации экзонов 3 и 4, что приводит к аллелю Hp1 с 5 экзонами и аллелю Hp2 с 7 экзонами () (16).Производятся три основных генотипа, которые были идентифицированы с помощью гель-электрофореза: Hp1-1, Hp1-2 и Hp2-2 (17,18). Hp Del также был описан в популяциях Японии, Китая и Кореи, но не был обнаружен в популяциях Африки или Европы (19–21). Также были описаны несколько минорных генотипов (Hp1-Johnson, Hp1-M и Hp0) (22). Три преобладающих генотипа демонстрируют разные структуры и биологические эффекты, как описано ниже. Структурное представление аллелей Hp Del, 1 и 2.Экзонные последовательности Hp обозначены пронумерованными и заштрихованными прямоугольниками. Интронные последовательности обозначены сплошной линией. Экзоны 3 и 4 аллеля Hp1 были дублированы в аллеле Hp2, давая начало экзонам 3-6. Человеческий ген Hp расположен на хромосоме 16q22 и состоит из трех структурных аллелей, продуктами которых являются Hp1F, Hp1S и Hp2 (23). Продукты аллелей Hp1F и Hp1S отличаются только одной аминокислотой, тогда как аллель Hp2 является результатом слияния аллелей Hp1F и Hp1S.Транскрипция и трансляция происходят как единый полипептид, который посттрансляционно процессируется в меньшую α-цепь и большую β-цепь, которые связаны дисульфидным мостиком (24). Однако наличие аллелей Hp1 и Hp2 у человека приводит к образованию димеров Hp1-1, гетеродимеров Hp1-2 и димеров Hp2-2. Расчетная частота Hp1-1 составляет 15–18%, Hp2-1 — 46%, а Hp2-2 — 38% (25). Hp в основном осуществляется в печени, но экспрессия также наблюдается в легких, коже, селезенке, почках и жировой ткани (26–28). Отличительной особенностью Hp является облегчение очистки от гемоглобина. Hb — это важный белок крови, участвующий в транспортировке кислорода в системе кровообращения и обеспечивающий детоксикацию активных форм кислорода и азота (34,35). Высвобождение свободного гемоглобина в кровь — это естественное явление, связанное с внутрисосудистым гемолизом, который происходит во время разрушения стареющих эритроцитов (эритроцитов), которое происходит со скоростью 2 × 10 6 эритроцитов в секунду (36,37). В кровотоке достаточно Hp (38–208 мг / дл), чтобы связывать и выводить 3 г гемоглобина, что препятствует свободной циркуляции гемоглобина в организме (44).Экспрессия CD163 этими клетками индуцируется воспалением и высвобождением цитокинов, таких как IL-1 и IL-6. IL-6 играет особенно важную функцию, поскольку он важен для стимуляции выработки Hp и модуляции экспрессии CD163 на поверхности клетки (45–47). CD163 подавляется TNF-α, IL-4 и интерфероном γ (48). Регуляция этого процесса строго контролируется высвобождением иммуномодулирующих молекул. Hb, который связан с Hp для клиренса, интернализуется, обрабатывается и разлагается с высвобождением гема для дальнейшей обработки гемоксигеназой-1 для высвобождения железа, где его можно рециркулировать для создания новых белков Hb.Когда он не связан с Hb, Hp выводится из плазмы через 3-5 дней. При связывании с Hb среднее время удаления комплекса составляет ~ 20 минут (49,50). Hp не рециркулируется во время этого процесса очистки, а, скорее, деградирует, и происходит выработка белка de novo для пополнения запасов крови и тканей (51). В отсутствие механизма клиренса свободный гемоглобин может катализировать образование свободных радикалов и опосредовать разрушение клеточных компонентов и внеклеточных макромолекул, а также способствовать окислению холестерина ЛПНП (37). Hp связывается со свободным Hb, возможно, с самым высоким сродством в природе (9,52,53). Когда свободное железо присутствует в кровообращении и в тканях, может возникнуть множество неблагоприятных последствий. Этап инициации может быть вызван двумя разными железозависимыми механизмами. Механизм, зависящий от гидроксильных радикалов, который был принят большинством в качестве преобладающего механизма перекисного окисления липидов (59), и альтернативный независимый от гидроксильных радикалов механизм, который также был предложен и ставит комплексы железа с кислородом, а не гидроксильный радикал, в качестве инициатор перекисного окисления липидов (60). Способность Hp снижать повреждающее действие свободных радикалов зависит от генотипа. Исследования Меламед-Франк и др. демонстрируют, что Hp1-1 обладает большей способностью защищать от окислительного повреждения, несмотря на то, что все три генотипа имеют одинаковую аффинность связывания (61). Решающее отличие — доступность молекулы Hp во внесосудистое пространство. Различия в размерах молекул служат механизмом исключения; следовательно, у людей с Hp2-1 или Hp2-2 свободный гемоглобин остается в кровотоке в течение длительного периода времени и вызывает более сильный окислительный стресс (61).Антиоксидантная способность Hp у людей с диабетом вызывает особую озабоченность. В частности, генотип Hp2-2 считается основным геном восприимчивости для людей с диабетом 2 типа, поскольку он приводит к снижению антиоксидантной способности (62). Роль Hp как белка острой фазы выявляет его возможную иммунорегуляторную активность. Hp обладает мощной регулирующей активностью в отношении лимфоцитов. Например, Arredouani et al. (66) и Guetta et al. (67) продемонстрировали, что Hp играет роль в балансе между Т-хелпером-1 (Th2) и Т-хелпером-2 (Th3), сильно способствуя сильному ответу клеток Th2.Эти исследования продемонстрировали, что аллель Hp1 в комплексе с Hb стимулирует секрецию значительно большего количества IL-6 и IL-10, чем аллель Hp2. Ответ Th2 более эффективен для защиты от внутриклеточных паразитов и ингибирует высвобождение цитокинов Th3, которые отвечают за защиту от внеклеточных патогенов. В контексте иммуноопосредованных заболеваний болезнь Крона, язвенный колит, ревматоидный артрит и системная красная волчанка связаны с полиморфизмом в Hp.Например, прогаптоглобин-2 (proHp), который протеолитически расщепляется до Hp2 посредством сайт-специфического расщепления, был связан с глютеновой болезнью и диабетом 1 типа (68,69). Недавно исследования Zhang et al. (70) и Moreno-Navarette et al. (71) предположили, что сывороточные уровни proHp повышены у людей с диабетом 2 типа и что циркулирующие уровни proHp способствуют инсулинорезистентности при ожирении. Повышение proHp связано с кишечной проницаемостью, дислипидемией, воспалением и инсулинорезистентностью. Нарушение заживления ран является известным серьезным осложнением диабета и вызывается апоптозом, клеточной инфильтрацией и сниженным ангиогенезом. Недавние исследования продемонстрировали снижение лимфангиогенеза и ангиогенеза во время заживления диабетических ран (72–74). Cid et al. (77) наблюдали, что сыворотка пациентов с системным васкулитом стимулировала ангиогенез в модели in vitro. Было показано, что уровень Hp в сыворотке у пациентов с васкулитом коррелирует как с заболеванием, так и с ангиогенной активностью. Повышенный уровень Hp, обнаруживаемый при хронических воспалительных состояниях, может играть важную роль в восстановлении тканей. Например, при системном васкулите Hp может компенсировать ишемию, способствуя развитию коллатеральных сосудов (77). Неоваскуляризация в результате ангиогенеза может иметь патологическое значение в контексте диабета. Патологический ангиогенез усиливает прогрессирование заболевания и увеличивает инфильтрацию макрофагов и толщину стенок сосудов, что приводит к гипоксии и разрыву межпластных бляшек (78,79). Оксид азота (NO) — это газ, вырабатываемый различными типами клеток, который участвует в нескольких важных физиологических процессах. NO участвует в тонусе сосудов, модулирует функцию нейротрансмиттеров в центральной и периферической нервной системе и участвует в клеточной защите и агрегации тромбоцитов (80,81). И свободный Hb, и комплекс Hp-Hb инактивируют NO, тогда как Hp не влияет на NO. В результате повышение уровня циркулирующего Hb или комплекса Hp-Hb может привести к истощению NO и отсутствию релаксации эндотелия, что способствует сердечно-сосудистым заболеваниям (ССЗ). Пациенты с генотипом Hp1-1 могут иметь преимущество перед носителями Hp2-1 или Hp2-2, поскольку комплекс Hp1-1 Hp-Hb выводится из кровотока более эффективно, чем другие комплексы Hp. Диабет является предрасполагающим фактором для инфекций. У людей с диабетом риск системной инфекции в два-четыре раза выше, чем у людей без диабета (83,84). Вариация генотипа Hp также влияет на смертность как от внеклеточных, так и от внутриклеточных патогенов.Например, несколько исследований продемонстрировали, что пациенты могут иметь большую предрасположенность к малярии и развитию тяжелых осложнений в зависимости от их генотипа Hp (85–88). Патогены, такие как Corynebacterium diptheriae и Staphylococcus aureus , которым для роста требуется железо, как известно, используют комплекс Hp-Hb для своей метаболической активности (89, 90). Люди с диабетом особенно восприимчивы к бактериальным инфекциям, особенно инфекциям мочевыводящих путей, дыхательных путей и мягких тканей.Например, известно, что S. aureus вызывает как респираторные инфекции, так и инфекции мочевыводящих путей, которые могут привести к бактериальному нефриту. Кроме того, S. aureus является наиболее распространенной инфекцией мягких тканей у людей с диабетом (83,92,93). Наконец, было обнаружено, что пациенты с Hp2-2 имеют более высокую смертность и худшие исходы от туберкулеза и болезни Хансона (проказа), чем пациенты других генотипов (88,95–97). Учитывая его роль в качестве белка острой фазы, участие Hp в различных патогенных инфекциях хорошо задокументировано, а конкретный генотип, который несет пациент, имеет прямое отношение к конечному исходу инфекции. Hp также был связан с внутриклеточными патогенами. Диабет признан важным фактором риска для нескольких внутриклеточных патогенов (98).Например, пациенты с Hp2-2 имеют более высокую степень смертности от ВИЧ, при этом среднее время выживания составляет 11 лет для людей с Hp1-1 или Hp2-1 по сравнению с 7,3 годами для людей с Hp2-2. Диабет связан с деменцией и нейродегенеративными расстройствами, такими как болезнь Альцгеймера (БА) и болезнь Паркинсона (БП) (106,107). Хотя механизмы остаются неясными, диабет 2 типа может обострить и привести к прогрессированию нейродегенеративного процесса. Один из возможных распространенных механизмов — окислительный стресс (108). В дополнение к этой общности в патогенезе есть также доказательства того, что сама AD может способствовать инсулинорезистентности в головном мозге (108). Учитывая общую тенденцию окислительного стресса и роль Hp в управлении окислительными реакциями, несколько недавних исследований продемонстрировали связь Hp с нейродегенеративными патологиями. Наконец, в нескольких исследованиях изучалось влияние генотипа Hp на исход и разрешение внутримозгового кровоизлияния. Murthy et al. (115) недавно сообщили, что пациенты с генотипом Hp2-2 испытывают худшие результаты после внутримозгового кровоизлияния. Эти результаты были подтверждены другим исследованием Kantor et al. (116) в контексте субарахноидального кровоизлияния, когда исходы у пациентов с генотипом Hp2-2 были хуже. Генотип Hp постоянно ассоциируется как маркер и фактор риска сердечно-сосудистых заболеваний.В исследовании Chapelle et al. (117), пациенты с генотипом Hp2-2 имели более тяжелый инфаркт миокарда. Позднее Hp был исследован в проспективном исследовании с участием> 342 000 пациентов старше 11,8 лет. Было показано, что Hp является значительным фактором риска острого инфаркта миокарда (ОИМ), инсульта и сердечной недостаточности (СН) (118). Данные этого исследования установили, что связь Hp с этими сердечно-сосудистыми событиями была сильнее у мужчин, чем у женщин. Hp был почти таким же предсказуемым, как общий холестерин для ОИМ, и примерно таким же предсказательным, как общий холестерин инсульта, с более сильной связью с ишемической болезнью, чем с геморрагическим инсультом, где 4.Риск ишемической болезни увеличился в 2 раза. Haas et al. (119) аналогичным образом установили связь с Hp как потенциальным прогностическим биомаркером ОИМ. Таким образом, генотип Hp имеет такую же прогностическую ценность, как и общий холестерин, в отношении риска ОИМ и инсульта. HF и инсульт также были связаны с генотипом Hp (118 120). Costacou et al. (120) описали пограничный повышенный риск инсульта у людей с диабетом 1 типа и генотипом Hp1-1. В более раннем исследовании (121) эта же группа описала повышенный риск сердечно-сосудистых заболеваний у людей с генотипом Hp2-2 по сравнению с людьми с генотипом Hp1-1.Staals et al. (122) также предположили повышенный риск лакунарного инсульта в зависимости от генотипа Hp пациента. Вышеупомянутое исследование Holme et al. (118) установили двукратное увеличение риска инсульта и 1.5-кратное увеличение риска сердечной недостаточности. Hp2-2 был связан с более высокими концентрациями общего сывороточного и свободного холестерина, уменьшением выживаемости трансплантата у пациентов, перенесших коронарное шунтирование, и более высоким риском рестеноза после имплантации стента (Hp2-2 36% против Hp2-1 31%) (123 –125). Hp2-2 является явным генетическим фактором риска развития аневризмы, коронарного атеросклероза и нестабильного стеноза сонной артерии независимо от многих классических факторов риска, включая дислипидемию, гипертензию, диабет, курение и гипергомоцистенемию, или в связи с ними. Кроме того, Hp является фактором риска развития рефрактерной гипертензии у пациентов с существующей гипертензией (129 130).Данные демонстрируют, что пациентам с генотипом Hp2-2 требуется больше антигипертензивной терапии для контроля артериального давления, чем пациентам с другими генотипами. Пациенты с генотипом Hp2-2 также требуют большей поддержки и наблюдения, чем пациенты с альтернативными генотипами Hp (129 130). Напротив, пациенты с генотипом Hp1-1 имеют более низкий уровень осложнений, чем пациенты с гипертонией с генотипом Hp2-1 или Hp2-2 (130). Литература решительно поддерживает гипотезу о том, что генотип Hp2-2 обеспечивает гораздо меньшую защиту от окислительного повреждения артерий у пациентов с атеросклеротическими бляшками.Генотип Hp2-2 также создает дополнительный риск сердечно-сосудистых заболеваний, а также других осложнений, включая аневризму, разрыв каротидной бляшки, инфаркт миокарда и снижение выживаемости после аортокоронарного шунтирования. За последние 20 лет стало ясно, что Hp можно рассматривать как предиктор предрасположенности к сердечно-сосудистым нарушениям и меру прогноза и исходов пациентов. Генерация АФК играет важную роль в возникновении сосудистых осложнений у людей с диабетом (61).Осложнения у людей с диабетом, вызванные генотипом HP, включают сердечно-сосудистые заболевания, ретинопатию и нефропатию. В исследованиях пациентов, находящихся на гемодиализе, Леви и другие (131 132) описали защитный эффект у пациентов с генотипом Hp1-1. Два независимых исследования Levy et al. (133,134) показали, что генотип Hp коррелирует с сосудистыми осложнениями. Например, генотип Hp1-1 защищает от повреждения сосудов как следствие повышенной антиоксидантной активности по сравнению с Hp2-1 или Hp2-2.Подобные результаты были описаны Szafranek et al. (135), которые обнаружили, что Hp является основным геном предрасположенности к диабетическим сосудистым осложнениям. Сообщалось, что генотип Hp2 связан с повышенным риском сердечно-сосудистых событий, таких как инфаркт миокарда, у людей с диабетом 2 типа (134, 136). Эти и другие исследования показывают, что пациенты с Hp2 могут иметь в пять раз больший риск ишемической болезни сердца и подверженность сердечно-сосудистым заболеваниям по сравнению с пациентами с генотипом Hp1-1. Помимо сердечно-сосудистого риска и осложнений, генотип Hp также коррелирует с повышенным риском диабетической ретинопатии у людей с диабетом 2 типа. У пациентов с нормальным артериальным давлением Mogarekar и Hampe (137) показали повышенный риск развития тяжелой ретинопатии у пациентов с генотипом Hp2-2. По сравнению с другими генотипами это исследование показало градуированную взаимосвязь риска с числом аллелей Hp2. Определение генотипа Hp, таким образом, может быть полезным при оценке и лечении диабетической ретинопатии.Исследования четко продемонстрировали, что слепоту в результате диабета можно предотвратить с помощью ранней диагностики, выяснения факторов риска и своевременной фотокоагуляции, где это необходимо. Генотипирование Hp может позволить более раннюю идентификацию и своевременное вмешательство для пациентов, которые могут страдать диабетической ретинопатией. Концентрации Hp в плазме были исследованы на предмет различных патогенных заболеваний. И высокие, и низкие уровни Hp указывают на клинические состояния.Повышенные концентрации в плазме были описаны в случаях травм, ожогов, воспалений и рака из-за острофазовой природы белка и его роли в удалении окислительных форм из кровообращения (33,61,138). Уровни в плазме высоки через несколько дней после воспалительного или травматического инсульта и возвращаются к норме в течение нескольких недель (139). Состояния, при которых снижается Hp, включают недоедание, гемолиз, заболевания печени, аллергические реакции и судорожные расстройства (139–142). Учитывая участие Hp в патогенезе сердечно-сосудистых, неврологических, инфекционных и воспалительных состояний, для пациентов было бы полезно иметь диагностический инструмент, который может быстро идентифицировать генотип Hp, чтобы можно было проводить надлежащую терапию. Например, Hp2-2 обнаружен у ~ 36% населения. Для людей с этим генотипом было проведено не менее 10 исследований, в которых в совокупности изучались около 175 000 пациентов, с целью определить влияние этого генотипа на негомозиготных носителей. Для начала терапии витамином Е или витамином С можно использовать экспресс-тест, чтобы свести к минимуму прогрессирование сердечно-сосудистых заболеваний на 30–40% (143). Было показано, что введение 400 МЕ витамина Е эффективно снижает сердечно-сосудистые события (12,144). Антиоксидантная активность витамина E нейтрализует окислительную способность свободного гема и служит заменителем активности Hp (145). Свободный гем может привести к окислению частиц ЛПНП и привести к росту и нестабильности атеросклеротической бляшки.Умеренные дозы витаминов C и E могут быть эффективными для стабилизации окислительного стресса и снижения уровня циркулирующих свободных радикалов (12,145). Текущая методология определения генотипа — гель-электрофорез, который требует много времени и не оптимален для большого количества пациентов или коммерческих диагностических целей. Метод, разработанный Леви и др. (146) использует иммуноферментный анализ (ELISA) для характеристики генотипа Hp. Этот метод ELISA представляет собой удобный и точный диагностический инструмент для определения генотипа Hp в исследовательской среде, но он не использовался в коммерческих диагностических целях. Новые методы массового генотипирования пациентов позволяют проводить быстрый скрининг и раннее применение альтернативной антиоксидантной терапии и приносят огромную пользу людям с диабетом. Наиболее подробно охарактеризованным свойством Hp является его способность связывать свободный Hb и способствовать эндоцитозу через рецептор скавенджера CD163 и внутриклеточную деградацию комплекса Hp-Hb (9,37,147). В этом процессе Hp может уменьшить потерю свободного гемоглобина за счет клубочковой фильтрации и способствовать рециркуляции железа.Помимо своей роли в клиренсе, Hp выполняет защитную функцию, заключающуюся в том, что гем и железо, высвобождаемые из свободного Hb, удаляются из кровотока, тем самым предотвращая производство ROS. В контексте диабета роль Hp может быть как защитной, так и патогенной. Пациенты с аллелем Hp2 имеют значительно более высокий риск сердечно-сосудистых, неврологических и инфекционных осложнений. Особую озабоченность у людей с диабетом вызывает значительно повышенный риск инфаркта миокарда, инсульта, инфекций и заболеваний почек у людей с генотипом Hp2-2. Хотя риск выше для пациентов с Hp2-2, есть несколько способов снизить этот риск до исходного уровня сердечно-сосудистого риска для пациентов с диабетом. Введение экзогенных антиоксидантов, таких как витамин C и витамин E, может смягчить вредные эффекты генотипа Hp2-2 (12, 134, 143, 148, 149). Таким образом, для исследовательского и диагностического сообщества крайне важно разработать новые методы определения генотипа пациента и усовершенствовать терапию для лечения людей с диабетом с полиморфизмом Hp2. Авторы работают в MyGenetx, компании, которая проводит лабораторные исследования диабета. О других потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось. Аневризматическое субарахноидальное кровоизлияние (aSAH) поражает более 30 000 человек в год в Соединенных Штатах, при этом, по оценкам, смертность составляет 30–50% (Hop et al., 1997; Stegmayr et al., 2004; Захария и др., 2010). Это самая смертоносная форма инсульта. Хотя первичное кровоизлияние и раннее повреждение головного мозга (EBI) является основной причиной плохих результатов, отсроченные механизмы травмы головного мозга также играют значительную роль. Церебральный вазоспазм (CV) и отсроченный церебральный инфаркт (DCI) являются наиболее изученными отсроченными событиями и, как известно, вносят свой вклад в неблагоприятные исходы после аСАГ (Rosengart et al., 2007). Тем не менее обширные фундаментальные исследования и клинические испытания, направленные на сердечно-сосудистые заболевания, не привели к значительному прогрессу, вероятно, из-за того, что церебральная ишемия также встречается в регионах без явного ангиографического вазоспазма (Gomis et al., 2010; Macdonald et al., 2011). Более того, сердечно-сосудистые заболевания — это только один механизм, способствующий плохим исходам в дополнение к воспалению, церебральному микротромбозу, дисфункции гематоэнцефалического барьера (ГЭБ) и кортикальной деполяризации (Neil-Dwyer et al., 1994; Stein et al., 2006; Vergouwen et al. ., 2008; Dreier et al., 2009; Dhar et al., 2012; Woitzik et al., 2012). Поскольку церебральное повреждение в значительной степени является многофакторным, нацеливание на один аспект может иметь ограниченную эффективность в снижении отсроченного повреждения мозга. После разрыва аневризмы временное повышение внутричерепного давления и снижение церебрального кровотока приводит к инициированию каскада EBI, который включает глобальную церебральную ишемию и отек мозга (Bederson et al., 1995; Клаассен и др., 2002; Schubert et al., 2011). Большая часть доказательств этого исходит из исследований на животных, а не из клинических исследований из-за невозможности контролировать икту, и они рассмотрены в других источниках (Sehba et al., 2012; Sabri et al., 2013b). В моделях на животных этот каскад приводит к воспалению, некрозу / апоптозу эндотелиальных клеток, апоптозу нейронов и ауторегуляторной дисфункции и остается важной областью активных исследований. С помощью этого EBI кровь выбрасывается в субарахноидальное пространство, смешиваясь с спинномозговой жидкостью (CSF) и образуя сгусток.В течение 24 часов после аСАГ наблюдается интенсивная инфильтрация мозговых оболочек полиморфно-ядерными лейкоцитами (Macdonald and Weir, 1991). Фагоцитоз (направленный на клиренс гематомы) и лизис эритроцитов (эритроцитов) происходит через 16–32 часа, но продолжается в течение нескольких дней, при этом скопления интактных эритроцитов все еще остаются в паутинной оболочке до 35 дней после аСАГ (Macdonald and Weir, 1991 ; Форман, 2016). По оценкам,> 250 миллионов молекул гемоглобина (Hb) высвобождаются на один RBC (Wintrobe and Greer, 2004).Инертный свободный гемоглобин, если он не связан своим высокоаффинным связывающим белком гаптоглобином (Hp), быстро подвергнется окислению и станет мощной провоспалительной и цитотоксической молекулой (Foley et al., 1994; Ascenzi et al., 2005). Связываясь с Hb, Hp предотвращает окисление и, таким образом, выполняет нейропротекторную роль (Zhao et al., 2009; Andersen et al., 2012). У человека есть два аллеля Hp и ряд известных редких вариантов (Langlois and Delanghe, 1996). Роль генотипа Hp и его значимость для тяжести заболевания изучалась в различных областях, включая эпилепсию, сердечно-сосудистые заболевания, диабет, серповидно-клеточные и почечные заболевания (Panter et al., 1985; Ланглуа и Деланге, 1996; Asleh et al., 2003; Садрзаде и др., 2004; Amiri et al., 2013; МакКеллар и Вигеруст, 2016). Общий вывод этих исследований состоит в том, что генотип Hp2-2 связан с более тяжелым фенотипом заболевания и повышенной иммунной реактивностью (Langlois and Delanghe, 1996; Roguin et al., 2003; Levy et al., 2007, 2010; Goldenstein et al., 2012; Purushothaman et al., 2012). Три предыдущих исследования продемонстрировали связь между генотипом Hp и частотой сердечно-сосудистых заболеваний после аСАГ (Borsody et al., 2006; Ohnishi et al., 2013; Leclerc et al., 2015). В четвертом исследовании (крупнейшем исследовании с участием 193 пациентов) Kantor et al. идентифицировали Hp2-2 как предиктор неблагоприятных исходов, но не оценивали DCI или церебральный вазоспазм (Kantor et al., 2014). Связь между плохим исходом и Hp 2-2 была воспроизведена в одном исследовании, хотя оспаривалась в другом (Ohnishi et al., 2013; Leclerc et al., 2015). В целом эти данные указывают на то, что генотип Hp может быть важным медиатором в долгосрочных результатах лечения пациентов после аСАГ.В этом обзоре мы обсуждаем роль, которую играет полиморфизм Hp и Hp, и то, как это влияет на механизмы отсроченного повреждения после aSAH, а также подтверждающие доказательства. Понимание роли Hp в клиренсе гемоглобина из спинномозговой жидкости и головного мозга и его смягчение патологических медиаторов после aSAH может привести к новым терапевтическим методам. В нормальных условиях гемоглобин ограничен эритроцитами, а внутриклеточный гемоглобин подвергается автоокислению с медленной скоростью, образуя метгемоглобин (metHb) и активные формы кислорода (АФК), в первую очередь супероксид-анион (Shikama, 1998; Boutaud et al., 2010). Однако обширная антиоксидантная система внутри эритроцитов отвечает за снижение окисленного гемоглобина и нейтрализацию АФК (Gonzales et al., 1984; Lee et al., 2003; Nagababu et al., 2003) (Рисунок 1). Рисунок 1 . Общее представление о роли гаптоглобина. Внеклеточный гемоглобин (то есть после лизиса эритроцитов) подвергнется серии окислительных реакций с образованием метглобина, который подвергается дальнейшему окислению с образованием свободного гема и свободного железа (Rifkind et al., 2014). Принимая во внимание, что 250–270 миллионов молекул Hb высвобождаются в эритроцитах, и что каждый Hb содержит четыре гема (также называемых железо-протопорфирин IX), лизис эритроцитов быстро создает уровни Hb, которые клетки мозга не могут эффективно метаболизировать. Эти молекулы гемоглобина являются источником патологических реакций, включая выработку свободных радикалов, индукцию провоспалительных каскадов, дисфункцию и повреждение эндотелиальных и гладкомышечных клеток, а также снижение доступности NO (Sadrzadeh et al., 1984; Touyz and Schiffrin, 2004; Figueiredo et al. ., 2007; Азаров и др., 2008; Сильва и др., 2009; Кабралес и Фридман, 2013; Лиск и др., 2013). Железо вызывает значительное повреждение клеток и гибель нейронов после aSAH, хотя некоторые утверждают, что ферритина, связывающего железо, может быть достаточно для уменьшения токсичности железа. Было высказано предположение, что в моделях САК крыс, получавших хелатор железа, дефероксамин, вредные эффекты железа были уменьшены (Lee et al., 2010). Однако токсичность, связанная с клиническим применением дефероксамина, ограничивает его использование. Гаптоглобин — это реагент острой фазы, который в основном продуцируется печенью и является основным связывающим гемоглобином белком плазмы.Формирование комплекса Hp-Hb опосредует клиренс Hb путем интернализации этого комплекса через рецептор мембраны мусорщика CD163 на моноцитах и макрофагах в печени и селезенке и, возможно, микроглии в головном мозге в случае церебрального кровотечения (Schaer CA et al., 2013; Schaer DJ et al., 2013; Rifkind et al., 2014; Schaer et al., 2014). После интернализации гем расщепляется гемоксигеназой 1 (HO1) на биливердин и железо (Thomsen et al., 2013). HO1 индуцируется гемом, а также воспалительными цитокинами (Terry et al., 1998; Thomsen et al., 2013). В отсутствие достаточного резерва Hp (например, гипогаптоглобинемия) структура Hb часто модифицируется окислением, которое снижает способность CD163 связывать комплекс (Vallelian et al., 2008). Связывание Hp-Hb стабилизирует структуру Hb, предотвращает окисление белка Hb и сохраняет связывание CD163, так что Hb может эффективно эндоцитозироваться фагоцитом, а затем метаболизироваться гемоксигеназой (Buehler et al., 2009). Защитные механизмы Hp особенно важны во внутрисосудистом пространстве, где часто происходит гемолиз.Однако, хотя Hp присутствует в спинномозговой жидкости, его не так много, как в крови, и он легко подавляется молярным соотношением Hb после САК (Galea et al., 2012). Предположительно, это способствует окислительному стрессу, вызванному гемовым железом, и обильному провоспалительному каскаду с последствиями, включая повреждение сосудов, церебральный вазоспазм, микротромбоз и нейрональную токсичность. В моделях внутримозгового кровоизлияния (ICH) экспериментально индуцированная гипогаптоглобимемия привела к усилению окислительного стресса в ткани перигематомы, в то время как животные со сверхэкспрессией Hp человека продемонстрировали меньшее неврологическое повреждение и меньшее повреждение нейронов и олигодендроглии в мозге, пораженном ICH (Zhao et al. al., 2009). Два основных аллеля, Hp1 и Hp2, существуют для гена Hp, обнаруженного на хромосоме 16. Эти два аллеля отвечают за три различных возможных генотипа со структурным полиморфизмом: гомозиготный (1-1 или 2-2) и гетерозиготный 2-1. В западных популяциях, по оценкам, распределение Hp 1-1 составляет ~ 16%, Hp 2-1 составляет ~ 48%, а Hp 2-2 составляет ~ 36%. Hp расщепляется на две субъединицы α и β цепи, соединенные дисульфидной связью. Оба аллеля имеют одну и ту же β-цепь (Goldenstein et al., 2012).Β-цепь отвечает за связывание Hb, таким образом, оба генотипа имеют схожую аффинность связывания Hb (Asleh et al., 2005). Однако комплекс Hp-Hb, образованный с Hp 1-1, является лучшим антиоксидантом по сравнению с Hp 2-2, и пациенты с Hp 1-1 имеют более высокие уровни циркулирующего Hp (Langlois and Delanghe, 1996; Melamed-Frank et al., 2001 ; Далан и др., 2016, 2017). Кроме того, циркулирующий гемоглобин, связанный с Hp1-1, выводится быстрее, чем его аналог Hp 2 (Asleh et al., 2003; Azarov et al., 2008). Нейровоспаление возникает после aSAH с повышением хемокинов и цитокинов в спинномозговой жидкости и сыворотке.Некоторые цитокины, в частности IL-1β, TNFα и IL-6, неоднократно связывались с ухудшением клинического исхода, повышением ССЗ и ухудшением неврологического спада у пациентов с аСАГ (Mathiesen et al., 1997; Gruber et al., 2000; Kwon и Jeon, 2001; Hendryk et al., 2004; Chou et al., 2012). Исследование ЦСЖ пациентов с аСАГ показало увеличение количества активированных нейтрофилов и моноцитов, и что устойчивость этого ответа коррелирует с замедленным неврологическим ухудшением (Provencio et al., 2010; Moraes et al., 2015). Исследования на мышах, истощающие периферические нейтрофилы до травмы, улучшили когнитивные результаты после аСАГ (Provencio et al., 2016). Лихорадка, повышенный уровень лейкоцитов, частота сердечных сокращений или тахипноэ наблюдаются почти у 87% пациентов, и эта воспалительная реакция увеличивает риск развития замедленной ишемии головного мозга (Dhar and Diringer, 2008). Критическая роль, которую играют Toll-подобные рецепторы (TLR) в воспалении SAH, были областью активных исследований в последние годы.TLR принадлежат к семейству рецепторов распознавания образов и играют хорошо описанную роль в врожденном иммунитете и воспалительных реакциях (Lee and Lee, 2002). TLR4 является наиболее изученным при нейровоспалении и САК. Он экспрессируется в различных типах клеток, включая микроглию, нейроны, астроциты и эндотелиальные клетки. TLR4 (и другие члены семейства, такие как TLR2) могут активироваться рядом лигандов, включая гем и другие компоненты, высвобождаемые SAH (Lee and Lee, 2002; Jack et al., 2005). Недавно, помимо гема, metHb был установлен в качестве лиганда для TLR4 (Figueiredo et al., 2007; Квон и др., 2015). В aSAH связывание TLR4 metHb / heme должно приводить к активации провоспалительного каскада, опосредованного ядерным фактором каппа-бета (NFκB) в микроглии (или макрофагах), транскрипции ДНК, а также продукции и высвобождению TNFα и IL-1β (Lehnardt , 2010; Kwon et al., 2015; Lucke-Wold et al., 2016). Гаптоглобин имеет отношение к этому воспалительному пути TLR4, поскольку связывание Hp-Hb предотвращает превращение oxyHb в metHb, а также внеклеточное высвобождение гема из гемоглобина (Schaer et al., 2014). Другие формы гемоглобина, такие как oxyHb, не связывают TLR4 (Gram et al., 2013; Schaer et al., 2014; Kwon et al., 2015). Путь TLR4 в микроглии приводит к высвобождению хемокинов / цитокинов и привлечению активированных периферических макрофагов и нейтрофилов в ЦНС (Olson and Miller, 2004). Исследования на животных показали, что такая активация микроглии приводит к повреждению нейрональных клеток, и, наоборот, истощение микроглии оказывает нейрозащитное действие (Hanafy, 2013; Schneider et al., 2015). Макрофаги также играют центральную роль в регулировании стареющих эритроцитов и клиренса гемоглобина (Soares and Hamza, 2016).Хотя в поддерживающих условиях эритрофагоциты обладают противовоспалительной способностью, избыток свободного гема и железа может модулировать фенотип макрофагов в провоспалительный фенотип M1, продуцирующий воспалительные цитокины и ROS (Soares and Hamza, 2016; Vinchi et al., 2016). Этот механизм индуцированной свободным гемом / железом дифференцировки зависит от сигнального пути TLR4 и ROS (Vinchi et al., 2016). Интересно, что поглотители гема и хелаторы железа могут ослаблять поляризацию макрофагов в провоспалительный фенотип (Lin et al., 2010; Винчи и др., 2016). При болезненных состояниях, включая диабет и ожирение, Hp 2-2 был связан с более высоким воспалительным состоянием с повышением уровней лейкоцитов, TNFα и IL-6 (Lazalde et al., 2014; Costacou et al., 2015). Hp 2-2 также чрезмерно представлен при аутоиммунных заболеваниях, включая волчанку и ревматоидный артрит (MacKellar and Vigerust, 2016). При воспалительных состояниях без продуктов ЦСЖ крови TNFα, по-видимому, играет прямую роль в хронических когнитивных изменениях и может быть независимым фактором когнитивного исхода после САК (Rosi et al., 2004; Тобиник, 2009; Беларби и др., 2012). В популяции aSAH корреляция генотипа Hp с иммунным и воспалительным ответом не проводилась. В будущих исследованиях следует изучить цитокиновый ответ и уровни TNFα с генотипом Hp 2-2. Кроме того, это следует проводить как системно, так и интратекально, чтобы попытаться отделить врожденную иммунную реактивность Hp 2-2 от улучшенного клиренса Hp 1-1. Гематоэнцефалический барьер (ГЭБ) образован эндотелиальными клетками микрососудов головного мозга (ЭК) с плотными контактами и концевыми ножками астроцитов, окружающими ЭК, и при участии перицитов.ГЭБ играет фундаментальную роль в гомеостазе мозга, регулируя проникновение внутрисосудистых молекул из крови в мозг (Ueno, 2007). Исследования дисфункции ГЭБ, связанной с САК, относительно немногочисленны по сравнению с литературой по сердечно-сосудистым заболеваниям (Shigeno et al., 1982; Trojanowski, 1982; Peterson and Cardoso, 1983a, b; Dóczi et al., 1986). У животных значительное изменение проницаемости ГЭБ наблюдалось вначале уже через 3 часа после САК, достигая пика через 48 часов и нормализовалось на 3-й день (Dóczi, 1985; Dóczi et al., 1986; Germanò et al., 2007). Множественные процессы могут способствовать разрушению ГЭБ после САК, включая некроз / апоптоз ЭК, сокращение ЭК и / или перицитов, а также разрушение плотных контактов, что приводит к увеличению проницаемости сосудов и образованию отека мозга (Shigeno et al., 1982; Kago et al. , 2006; Haorah et al., 2007; Kahles et al., 2007; Butt et al., 2011). EC играет активную роль после SAH и имеет решающее значение для BBB. Кровь в субарахноидальном пространстве быстро стимулирует экспрессию молекул клеточной адгезии (CAM) на просветной поверхности ЭК (Gallia, Tamargo, 2006; Silva et al., 2009). Это сочетается с общим снижением синтеза белка (Foley et al., 1994), снижением экспрессии zona occludens 1 [ZO-1, ключевой дополнительный белок плотных контактов цитоплазмы (TJ)], изменением экспрессии Claudin 5 и изменениями в Цитоскелет ЭК, которые все вносят вклад в снижение целостности эндотелия и ГЭБ (Dóczi et al., 1986; Silva et al., 2009; Butt et al., 2011). Экспрессия CAM и селектинов позволяет макрофагам и нейтрофилам связываться с ЭК и перемещаться в субарахноидальное пространство, где они фагоцитируют экстравазированные эритроциты (эритрофагоцитоз) и очищают свободный Hb посредством CD163-опосредованного эндоцитоза комплексов Hb: Hp (Gallia and Tamargo, 2006).Эти захваченные макрофаги и нейтрофилы затем умирают и дегранулируют в субарахноидальном пространстве, что приводит к высвобождению внутриклеточных эндотелинов и свободных кислородных радикалов, которые вносят вклад в вызванное воспалением повреждение ЭК и дисфункцию ГЭБ (Hijdra et al., 1988; Dietrich and Dacey, 2000; Claassen et al., 2001). На животных моделях было продемонстрировано, что повреждение ЭК и ГЭБ возникает после системной или интратекальной инфузии Hb (Trojanowski, 1982; Peterson and Cardoso, 1983a, b; Dóczi et al., 1986; Butt et al., 2011). Исследования на моделях внутримозгового кровоизлияния также подтверждают вывод о том, что воздействие внеклеточного гемоглобина приводит к нарушению ГЭБ (Xi et al., 1998; Bhasin et al., 2002; Keep et al., 2008). In vivo эксперименты показывают, что связывание Hp с Hb снижает цитотоксичность EC и модификацию клеточной мембраны (Schaer C.A. et al., 2013; Schaer et al., 2014). Имеются также ограниченные клинические доказательства того, что повышенная концентрация Hp при болезненных состояниях также защищает от повреждения ЭК (Dalan et al., 2017). Поскольку пациенты с Hp 2-2 имеют более низкие уровни Hp в сыворотке и более низкие антиоксидантные свойства Hp, эти пациенты могут быть предрасположены к усилению повреждения ЭК и дисфункции ГЭБ после САК (Langlois and Delanghe, 1996; Melamed-Frank et al., 2001; Dalan et al. ., 2017). Накапливающиеся данные подтверждают роль MMP-9 в раннем разрушении ГЭБ после САК (Sehba et al., 2004; Guo et al., 2010). ММР-9 разрушает внеклеточный матрикс базальной пластинки микрососудов головного мозга, который включает коллаген IV, ламинин, фибронектин и белки межэндотелиальных плотных контактов, такие как ZO-1 (Sehba et al., 2004; Судзуки и др., 2010). Известно, что при церебральной ишемии и САК TNFα повышается и может коррелировать с худшим клиническим исходом (Dong et al., 2009; Vecchione et al., 2009; Chou et al., 2012). Как уже упоминалось, путь расщепления свободного гемоглобина запускает высвобождение TNFα через путь TLR4 / NFκB, а TNFα является одним из цитокинов, который, как известно, увеличивает активность MMP (Sun et al., 2010). Влияние генотипа Hp на TNFα не изучалось при САК (Lazalde et al., 2014). Не было проведено исследований, четко разъясняющих нейропротекторную роль Hp при дисфункции ГЭБ.Но, учитывая тот факт, что продукты распада крови, такие как гемоглобин / гем, и связанный с ним окислительный стресс могут способствовать разрушению ГЭБ, опосредованный Hp клиренс свободного гемоглобина, возможно, может быть одним из основных механизмов, участвующих в предотвращении дисфункции ГЭБ после САК. В контексте внутримозгового кровоизлияния экспериментально индуцированная гипогаптоглобинемия приводит к усилению отека мозга, что действительно указывает на защитную роль Hp в сохранении ГЭБ (Zhao et al., 2009). В одной недавней публикации, посвященной пациентам с диабетом, было высказано предположение, что пациенты с Hp 2-2, которые имеют более низкую плазменную концентрацию Hp, имеют повышенную скорость апоптоза ЭК (Dalan et al., 2017). Также необходимы дальнейшие исследования для определения влияния фенотипов Hp на ЭК и / или повреждение / функцию перицитов и распад ГЭБ. Интересно, что свойства Hp1-1 (86 кДа) указывают на значительное преимущество в размере молекулы по сравнению с Hp 2-2 (170–900 кДа), что может помочь ему проникать через клеточные мембраны и нарушенный ГЭБ, добавляя еще одно потенциальное защитное преимущество (Langlois and Delanghe , 1996; Меламед-Франк и др., 2001). Церебральный вазоспазм возникает у большинства пациентов после аСАГ, но только примерно у 20-30% развивается симптоматический церебральный вазоспазм (Kassell et al., 1985). Спазм сосудов головного мозга связан с нарушением баланса сосудорасширяющих и сосудосуживающих средств (Pradilla et al., 2010). Оксид азота (NO) является вазодилататором, который вырабатывается ЭК, нейронами и микроглией и регулирует тонус сосудов головного мозга (Faraci and Brian, 1994). После САК гемоглобин, высвобождаемый из эритроцитов, может поглощать и уменьшать доступный NO, а также вызывать отсроченную дисфункцию eNOS (Sehba et al., 2000; Pluta, 2005, 2006; Azarov et al., 2008). Снижение уровней NO связано с сердечно-сосудистыми заболеваниями, а эксперименты по увеличению NO уменьшают церебральный вазоспазм (Gabikian et al., 2002; Sun et al., 2003; Прадилла и др., 2004; Pluta et al., 2005; Pluta, 2006; Sabri et al., 2013a). В моделях на животных индукция экспрессии Hp или терапевтическая инфузия Hp защищает вазоактивные эффекты от внутрисосудистого гемолиза (Boretti et al., 2009). Хотя было бы интуитивно предположить, что связывание Hp снижает реактивность NO с Hb, это, по-видимому, не так (Azarov et al., 2008; Boretti et al., 2009). Связывание Hp-Hb, скорее, стабилизирует восстановленную форму Hb и снижает поглощение NO за счет уменьшения дальнейшего образования свободных радикалов за счет улучшения секвестрации Hb и увеличения клиренса Hb, связанного с макрофагами (Miller et al., 1997; Boretti et al., 2009; Леви и др., 2010; Купер и др., 2013; Schaer et al., 2016). Вазоспазм также тесно связан с воспалением, и было показано, что провоспалительные вещества могут запускать сердечно-сосудистые заболевания без крови в спинномозговой жидкости (Mori et al., 1994; Nagata et al., 1996; Recinos et al., 2006). Считается, что CV опосредуется активацией TLR4 / TNFα, и было показано, что ингибирование TNFα предотвращает и устраняет вазоспазм на мышиной модели (Vecchione et al., 2009; Okada and Suzuki, 2017).В модели САК у мышей введение антагонистов TLR4 внутрижелудочковым путем предотвращало пост-САК неврологические нарушения и вазоспазм (Kawakita et al., 2016). Нокаут TLR4 также подавлял вазоспазм в модели инъекции крови мышей, при этом TLR4 микроглии необходим для индукции вазоспазма, скорее всего, посредством индукции TNFα (Hanafy, 2013). Как указано выше, своевременное образование комплекса Hp-Hb играет важную роль в предотвращении активации TLR4. В проспективном исследовании тридцати пациентов у пациентов с более высокими уровнями TLR4 в клетках периферической крови наблюдалось учащение вазоспазма и замедленной церебральной ишемии (Ma et al., 2015). Несколько клинических исследований показали корреляцию с генотипом Hp 2-2 и увеличением CV после aSAH (Borsody et al., 2006; Ohnishi et al., 2013; Leclerc et al., 2015). Механизм получения этого преимущества не совсем ясен. Нет исследований, посвященных генотипу Hp и уровням NO после выполнения aSAH. Однако системные заболевания, включая диабет и преэклампсию во время беременности, показали корреляцию с генотипом Hp 2-2, более низкими уровнями NO и повышенным тонусом сосудов (Sertório et al., 2013; Dahan et al., 2015). Имеет ли Hp 2-2 более низкую доступность NO по сравнению с Hp 1-1 в aSAH — это правдоподобный, хотя и спекулятивный механизм. Сходным образом, может ли полиморфизм TLR4 усугублять вазоспазм SAH у некоторых или всех генотипов Hp, нуждается в дальнейшем исследовании (Ferwerda et al., 2008). Известно, что САК связана с состоянием гиперкоагуляции, хотя это было предметом ограниченных клинических исследований (Ikeda et al., 1997; Boluijt et al., 2015). Нарушения свертывания крови можно разделить на факторы, влияющие (1) на активацию, агрегацию и взаимодействие тромбоцитов с ЭК, (2) на свертывание крови и (3) на фибринолиз (Cardenas et al., 2016). В нескольких публикациях предпринимались попытки всестороннего рассмотрения этих факторов с противоречивыми результатами (Fujii et al., 1997; Ikeda et al., 1997; Boluijt et al., 2015). Тем не менее, исследования связывают отклонения коагуляции и фибринолитического каскада у пациентов с плохим исходом после аСАГ (Peltonen et al., 1997; Ji et al., 2014; Boluijt et al., 2015; Ramchand et al., 2016). Как и следовало ожидать в условиях повреждения ЭК и состояния гиперкоагуляции, артериальный микротромбоз был продемонстрирован у пациентов с aSAH как на человеческой модели, так и на модели in vivo на животных (Suzuki et al., 1990; Sehba et al., 2005; Stein et al., 2006; Friedrich et al., 2012; Sabri et al., 2012). Кроме того, развитие микротромбов является одним из механизмов, способствующих плохому исходу, и остается целью терапевтического вмешательства (Suzuki et al., 1990; Stein et al., 2006; Vergouwen et al., 2008). Некоторые авторы установили, что эти тромбы являются эмболическими, и при транскраниальном допплеровском исследовании сигналы микроэмболии наблюдались почти у 70% пациентов с САК, и это было связано с отсроченной ишемией (Romano et al., 2002; Azarpazhooh et al. , 2009). Однако другие авторы измерили частоту сигналов микроэмболии и обнаружили, что их частота намного ниже (Paschoal et al., 2015). Доказательства, по-видимому, свидетельствуют в пользу развития местных микротромбов в спастических, поврежденных ЭК артериол, а не системных микроэмболов как основного виновника микротромбоза (Friedrich et al., 2012; Sabri et al., 2012). Коагуляция неразрывно связана с воспалительными цитокинами, которые, как известно, повышаются после aSAH, включая TNFα (через TLR4), который активирует коагуляцию за счет снижения продукции протеинкиназы C (антитромботик), увеличения выработки эндотелием тканевого фактора (прокоагулянта) и увеличения активации тромбоцитов ( Valone, Epstein, 1988; Kirchhofer et al., 1994; Yamamoto et al., 1999; Wagner, Burger, 2003; Pircher et al., 2012). Эта активация тромбоцитов также сильно ингибируется NO, и aSAH представляет собой состояние истощения NO, вызванное поглощением свободного гемоглобина и повреждением ЭК, которые продуцируют NO (Sehba et al., 2000; Лоскальцо, 2001; Вагнер и Бургер, 2003; Voetsch et al., 2004; Азаров и др., 2008; Boretti et al., 2009). Связывание гаптоглобина с гемоглобином уменьшает воспаление и сохраняет NO, что может уменьшить осложнения гиперкоагуляции (Figueiredo et al., 2007; Azarov et al., 2008; Boretti et al., 2009; Vecchione et al., 2009; Lazalde et al., 2014; Schaer et al., 2014, 2016; Costacou et al., 2015). К сожалению, клинические испытания не показали явного преимущества антитромбоцитарных препаратов или системной антикоагуляции, хотя клинические испытания по оценке системного гепарина в низких дозах продолжаются (NCT02501434) (Siironen et al., 2003; ван ден Берг и др., 2006; Дорхаут Мис и др., 2007; Simard et al., 2013). Одной из причин этого может быть наша нынешняя неспособность идентифицировать пациентов с высоким риском церебрального микротромбоза. Существует также корреляция между Hp 2-2 и клиническими протромботическими последствиями, возможно, вторичными по отношению к усилению окислительного стресса, связанному с Hp 2-2, и снижению NO (Delanghe et al., 1997; Melamed-Frank et al., 2001; Touyz и Schiffrin, 2004; Voetsch et al., 2004; MacKellar, Vigerust, 2016).В исследовании пациентов со спонтанной венозной тромбоэмболией было обнаружено, что генотип Hp 2-2 был связан со значительно повышенным риском, однако это никогда не изучалось в популяции aSAH (Vormittag et al., 2005). Дополнительные доказательства гиперкоагуляции с Hp 2-2 отмечены в кардиологической литературе, указывающей, что этот генотип связан с худшими исходами после сердечного шунтирования и более высокой частотой кардиоэмболических событий после коронарной ангиопластики (Delanghe et al., 1997; Roguin et al., 2003). Клинические исследования по изучению спонтанного тромбоза глубоких вен у пациентов с аСАГ показывают высокую частоту (24%), однако корреляция с генотипом Hp не исследовалась (Ray et al., 2009). Связан ли генотип Hp2-2 с клинически значимым профилем гиперкоагуляции при aSAH, требует дальнейшего изучения, хотя этот генотип может создавать синергетический эффект с индуцированной aSAH гиперкоагуляцией. Неизбирательное использование антитромбоцитов и антикоагулянтов не оказалось полезным, а определение генетической предрасположенности к гиперкоагуляции принесло бы существенную пользу для дизайна клинических испытаний и терапевтического вмешательства. По сравнению с плазмой, Hp присутствует в спинномозговой жидкости в низких концентрациях и может быстро подавляться количеством деградированных эритроцитов в спинномозговой жидкости (Galea et al., 2012). В сообществе до сих пор существуют споры о том, будут ли Hp и CD163 в значительной степени присутствовать в ЦНС, чтобы иметь возможность иметь дело с надфизиологическими уровнями гемоглобина и метгемоглобина. Системная экспрессия Hp активируется как реагент острой фазы после aSAH, хотя это увеличение явно не транслируется в CSF (Galea et al., 2012). Тем не менее, известно, что олигодендроциты способны продуцировать некоторое количество Hp, и повышенная экспрессия может служить терапевтическим механизмом для снижения активации TLR4 и последующего воспаления (Zhao et al., 2009). Также представляется, что активатор фактора 2 (Nrf2), связанный с ядерным фактором, в контексте ICH может значительно увеличивать продукцию Hb не только в крови, но и в головном мозге, обеспечивая интригующее решение для регулирования уровней Hp в головном мозге (Zhao et al. ., 2007, 2009). Также был интерес к роли CD163 как медиатора для различных эффектов клиренса Hp-Hb. По-видимому, существует более высокое сродство Hp2-2, связанного с Hb, к CD163; однако интернализация связанного комплекса (Hp-Hb-CD163) может быть выше для Hp1-1, хотя это неясно и требует дальнейшего исследования (Kristiansen et al., 2001; Asleh et al., 2003; Na et al. , 2005; Липиски и др., 2013). Большая часть работ по генотипу Hp сосредоточена на периферических маркерах, а не на спинномозговой жидкости.Это остается особой проблемой для aSAH, поскольку считается, что ictus и экстравазация крови в CSF быстро подавляют способность связывания Hp, независимо от фенотипа (Galea et al., 2012). Так почему же фенотип Hp 1-1 может быть защитным, если Hp в основном существует в кровотоке за пределами ГЭБ? Одно из объяснений состоит в том, что размер Hp 1-1 значительно меньше, чем Hp 2-2, и он может легче проходить через BBB в CSF, таким образом улучшая состояние гипо-Hp (Langlois and Delanghe, 1996).Однако это противоречит данным, которые показывают более низкую концентрацию Hp в спинномозговой жидкости у пациентов с Hp 1-1, и предполагается, что это связано с улучшенным захватом макрофагами (Galea et al., 2012). Исследование временной концентрации Hp в CSF после aSAH остается необходимым для понимания использования Hp с течением времени, клиренса Hp-Hb и потенциального перемещения периферического Hp в CSF (и, наоборот, Hb на периферию). Более надежные исследования, изучающие связанный CSF Hp (т.е.е., Hb-Hp) по сравнению со свободным Hp в спинномозговой жидкости поможет выяснить механизм клиренса крови и защиты Hp после САК. Глимфатический путь (или менингеальная лимфатическая система) для выведения растворенных веществ спинномозговой жидкости стал интересной темой исследования. Существуют доказательства того, что увеличение размера растворенного вещества ограничивает клиренс глимфатической / лимфатической системы, и, кроме того, aSAH снижает ее функцию (Iliff et al., 2012; Gaberel et al., 2014; Bacyinski et al., 2017). Поскольку Hp1-1 меньше, чем Hp2-2, возможно, что гемоглобин, связанный с Hp1-1, выводится быстрее или не препятствует выведению других метаболитов мозга, хотя это требует дальнейшего исследования. Наконец, существует несколько ограничений для экспериментальных исследований Hp на мышах. Во-первых, мыши имеют только один генотип Hp, который соответствует Hp1 человека, и поэтому мыши экспрессируют только фенотип Hp1-1 (Levy et al., 2006). Во-вторых, в доклинических исследованиях введения Hp используются смешанные растворы гаптоглобина, состоящие из нескольких фенотипов Hp (Graw et al., 2016, 2017; Shi et al., 2016). Эти ограничения затрудняют интерпретацию роли Hp в патофизиологии кровоизлияния в мозг.В будущих исследованиях, посвященных изучению Hp при aSAH и других церебральных кровоизлияниях, следует использовать мышей с мутантами Hp2 в дополнение к мышам дикого типа, экспрессирующим Hp1. Лизис эритроцитов и высвобождение свободного гемоглобина / гема управляет большей частью патологического процесса, связанного с замедленным повреждением головного мозга после САК. Гаптоглобин и его полиморфизм были широко изучены при других болезненных состояниях, настолько, что был разработан Hp, полученный из плазмы человека, который используется для лечения гемолиза (Schaer D.J. et al., 2013). Доказательства как доклинических, так и клинических исследований подтверждают мнение о том, что полиморфизм гаптоглобина является виновником фазы отсроченного повреждения мозга при САК. Дальнейшие усилия должны быть сосредоточены на более крупномасштабных исследованиях, касающихся полиморфизма Hp, на расшифровке молекулярных механизмов, с помощью которых функционирует Hp, и, возможно, тестировании инфузии Hp в качестве терапии для пациентов с САК, страдающих от отложенного повреждения мозга. Идея этой статьи принадлежит SB и JG.И написание, и редактирование выполняли все авторы. Авторы SB, PP, DM, HZ внесли свой вклад в первоначальную рукопись, написав отдельные части рукописи. Они были объединены и отредактированы SB, а затем представлены HC, JG, PD, JC и SD для экспертного редактирования и окончательной подготовки. И JL, и JA рассмотрели и критически отредактировали содержание рукописи. Эта работа частично финансировалась грантом NIH 1R21NS095166, F31NS086441 и премией Фонда аневризмы мозга. Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов. Амири А. А., Хашеми-Сотех М. Б., Хагшенас М. Р., Данешвар Ф., Растегар А. и Фаразманд Т. (2013). Полиморфизм гаптоглобина у лиц с диабетической микроангиопатией 2 типа. N. Am. J. Med. Sci. 5, 529–535.DOI: 10.4103 / 1947-2714.118929 PubMed Аннотация | CrossRef Полный текст | Google Scholar Андерсен, К. Б., Торвунд-Йенсен, М., Нильсен, М. Дж., Де Оливейра, К. Л., Херслет, Х. П., Андерсен, Н. Х. и др. (2012). Структура гаптоглобин-гемоглобинового комплекса. Nature 489, 456–459. DOI: 10.1038 / природа11369 PubMed Аннотация | CrossRef Полный текст | Google Scholar Асчензи, П., Бочеди, А., Виска, П., Альтруда, Ф., Толозано, Э., Берингелли, Т., и другие. (2005). Удаление гемоглобина и гема. IUBMB Life 57, 749–759. DOI: 10.1080 / 15216540500380871 PubMed Аннотация | CrossRef Полный текст | Google Scholar Асле, Р., Гетта, Дж., Калет-Литман, С., Миллер-Лотан, Р., и Леви, А. П. (2005). Различия в железо-опосредованном окислительном стрессе, обусловленные генотипом гаптоглобина и диабетом in vitro и in vivo . Circ. Res. 96, 435–441. DOI: 10.1161 / 01.RES.0000156653.05853.b9 PubMed Аннотация | CrossRef Полный текст | Google Scholar Asleh, R., Marsh, S., Shilkrut, M., Binah, O., Guetta, J., Lejbkowicz, F., et al. (2003). Генетически обусловленная неоднородность поглощения гемоглобина и предрасположенность к диабетическим сердечно-сосудистым заболеваниям. Circ. Res. 92, 1193–1200. DOI: 10.1161 / 01.RES.0000076889.23082.F1 PubMed Аннотация | CrossRef Полный текст | Google Scholar Азаров И., Хе Х., Джефферс А., Басу С., Усер Б., Hantgan, R.R. и др. (2008). Скорость поглощения оксида азота гемоглобином, связанным с гаптоглобином. Оксид азота 18, 296–302. DOI: 10.1016 / j.niox.2008.02.006 PubMed Аннотация | CrossRef Полный текст | Google Scholar Азарпажу, М. Р., Велаяти, А., Чемберс, Б. Р., Неджад, Х. М., и Неджад, П. С. (2009). Микроэмболические сигналы при субарахноидальном кровоизлиянии. J. Clin. Neurosci. 16, 390–393. DOI: 10.1016 / j.jocn.2008.05.013 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бацынский, А., Сюй, М., Ван, В., и Ху, Дж. (2017). Параваскулярный путь удаления отходов мозга: современное понимание, значение и противоречия. Фронт. Нейроанат. 11: 101. DOI: 10.3389 / fnana.2017.00101 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бедерсон, Дж. Б., Джермано, И. М., и Гуарино, Л. (1995). Кортикальный кровоток и церебральное перфузионное давление в новой модели субарахноидального кровоизлияния у крысы без краниотомии. Инсульт 26 , 1086–1091; обсуждение: 91–92.DOI: 10.1161 / 01.STR.26.6.1086 PubMed Аннотация | CrossRef Полный текст | Google Scholar Беларби К., Джопсон Т., Твиди Д., Ареллано К., Луо В., Грейг Н. Х. и др. (2012). Ингибитор синтеза белка TNF-альфа восстанавливает функцию нейронов и устраняет когнитивный дефицит, вызванный хроническим нейровоспалением. J. Нейровоспаление 9:23. DOI: 10.1186 / 1742-2094-9-23 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бхасин, Р.Р., Си, Г., Хуа, Ю., Кип, Р. Ф., и Хофф, Дж. Т. (2002). Экспериментальное внутримозговое кровоизлияние: влияние лизированных эритроцитов на отек мозга и проницаемость гематоэнцефалического барьера. Acta Neurochir. Дополнение 81, 249–251. DOI: 10.1007 / 978-3-7091-6738-0_65 PubMed Аннотация | CrossRef Полный текст | Google Scholar Болуйт, Дж., Мейерс, Дж. К., Ринкель, Дж. Дж., И Вергувен, М. Д. (2015). Гемостаз и фибринолиз при отсроченной ишемии головного мозга после аневризматического субарахноидального кровоизлияния: систематический обзор. J. Cereb. Blood Flow Metab. 35, 724–733. DOI: 10.1038 / jcbfm.2015.13 PubMed Аннотация | CrossRef Полный текст | Google Scholar Boretti, F. S., Buehler, P. W., D’Agnillo, F., Kluge, K., Glaus, T., Butt, O. I., et al. (2009). Секвестрация внеклеточного гемоглобина в гаптоглобиновый комплекс снижает его гипертензивный и окислительный эффекты у собак и морских свинок. J. Clin. Вкладывать деньги. 119, 2271–2280. DOI: 10.1172 / JCI39115 PubMed Аннотация | CrossRef Полный текст | Google Scholar Борсоди, М., Берк, А., Коплин, В., Миллер-Лотан, Р., и Леви, А. (2006). Гаптоглобин и развитие спазма сосудов головного мозга после субарахноидального кровоизлияния. Неврология 66, 634–640. DOI: 10.1212 / 01.wnl.0000200781.62172.1d PubMed Аннотация | CrossRef Полный текст | Google Scholar Буто, О., Мур, К. П., Ридер, Б. Дж., Гарри, Д., Хауи, А. Дж., Ван, С. и др. (2010). Ацетаминофен подавляет перекисное окисление липидов, катализируемое гемопротеинами, и ослабляет почечную недостаточность, вызванную рабдомиолизом. Proc. Natl. Акад. Sci. США 107, 2699–2704. DOI: 10.1073 / pnas.04107 PubMed Аннотация | CrossRef Полный текст | Google Scholar Бюлер, П. В., Абрахам, Б., Валлелиан, Ф., Линнемайр, К., Перейра, К. П., Чиполло, Дж. Ф. и др. (2009). Гаптоглобин сохраняет путь поглотителя гемоглобина CD163, защищая гемоглобин от перекисной модификации. Кровь 113, 2578–2586. DOI: 10.1182 / кровь-2008-08-174466 PubMed Аннотация | CrossRef Полный текст | Google Scholar Батт, О.И., Бюлер П. В. и Д’Агнилло Ф. (2011). Нарушение гематоэнцефалического барьера и окислительный стресс у морских свинок после системного воздействия модифицированного бесклеточного гемоглобина. Am. J. Pathol. 178, 1316–1328. DOI: 10.1016 / j.ajpath.2010.12.006 PubMed Аннотация | CrossRef Полный текст | Google Scholar Кабралес, П., и Фридман, Дж. М. (2013). Вазоактивность HBOC: взаимодействие между поглощением оксида азота и способностью генерировать биоактивные формы оксида азота. Антиоксид.Редокс-сигнал. 18, 2284–2297. DOI: 10.1089 / ars.2012.5099.test PubMed Аннотация | CrossRef Полный текст | Google Scholar Карденас, Дж. К., Рейн-Смит, К. М., и Черч, Ф. К. (2016). «Обзор свертывания крови и патофизиология нарушений свертывания крови», в энциклопедии клеточной биологии , , ред. Р. А. Брэдшоу и П. Шталь (Уолтем, Массачусетс: Elsevier / AP), 714–722. Чоу, С. Х., Феске, С. К., Атертон, Дж., Кенигсберг, Р. Г., Де Ягер, П.Л., Ду, Р. и др. (2012). Раннее повышение сывороточного фактора некроза опухоли альфа связано с плохим исходом субарахноидального кровоизлияния. J. Investig. Med. 60, 1054–1058. DOI: 10.2310 / JIM.0b013e3182686932 PubMed Аннотация | CrossRef Полный текст | Google Scholar Клаассен, Дж., Бернардини, Дж. Л., Крейтер, К., Бейтс, Дж., Ду, Ю. Э., Коупленд, Д. и др. (2001). Влияние цистернальной и желудочковой крови на риск замедленной церебральной ишемии после субарахноидального кровоизлияния: пересмотр шкалы Фишера. Инсульт 32, 2012–2020 гг. DOI: 10.1161 / HS0901.095677 PubMed Аннотация | CrossRef Полный текст | Google Scholar Клаассен, Дж., Каруапома, Дж. Р., Крейтер, К. Т., Ду, Э. Ю., Коннолли, Е. С., и Майер, С. А. (2002). Глобальный отек мозга после субарахноидального кровоизлияния: частота, предикторы и влияние на исход. Инсульт 33, 1225–1232. DOI: 10.1161 / 01.STR.0000015624.29071.1F PubMed Аннотация | CrossRef Полный текст | Google Scholar Купер, К.E., Schaer, D. J., Buehler, P. W., Wilson, M. T., Reeder, B.J., Silkstone, G., et al. (2013). Связывание гаптоглобина стабилизирует гемоглобин, феррил-железо и глобиновый радикал на тирозине бета145. Антиоксид. Редокс-сигнал. 18, 2264–2273. DOI: 10.1089 / ars.2012.4547.test PubMed Аннотация | CrossRef Полный текст | Google Scholar Костаку, Т., Эванс, Р. В., и Орчард, Т. Дж. (2015). Отличается ли концентрация окислительных и воспалительных биомаркеров в зависимости от генотипа гаптоглобина при диабете 1 типа? Антиоксид.Редокс-сигнал. 23, 1439–1444. DOI: 10.1089 / ars.2015.6355 PubMed Аннотация | CrossRef Полный текст | Google Scholar Dahan, I., Farber, E., Thauho, N., Nakhoul, N., Francis, A., Awawde, M., et al. (2015). Взаимодействие между фенотипом гаптоглобина 2 и сахарным диабетом на систолическое давление в легочной артерии и биодоступность оксида азота у пациентов, находящихся на гемодиализе. J. Diabetes Res. 2015: 613860. DOI: 10.1155 / 2015/613860 PubMed Аннотация | CrossRef Полный текст | Google Scholar Далан, Р., Liew, H., Goh, L.L., Gao, X., Chew, D.E., Boehm, B.O., et al. (2016). Генотип гаптоглобина 2-2 связан с воспалением и толщиной интима-медиа сонной артерии. Diab. Васк. Дис. Res. 13, 373–376. DOI: 10.1177 / 147 Abstract
 В последние два десятилетия была сделана ассоциация между полиморфизмом Hp и осложнениями, возникающими при диабете. Было показано, что люди с полиморфизмом Hp имеют значительно более высокий риск развития сердечно-сосудистых заболеваний. Этот обзор обобщает текущую литературу о роли Hp в здоровье и болезнях, с акцентом на диабет.
В последние два десятилетия была сделана ассоциация между полиморфизмом Hp и осложнениями, возникающими при диабете. Было показано, что люди с полиморфизмом Hp имеют значительно более высокий риск развития сердечно-сосудистых заболеваний. Этот обзор обобщает текущую литературу о роли Hp в здоровье и болезнях, с акцентом на диабет.
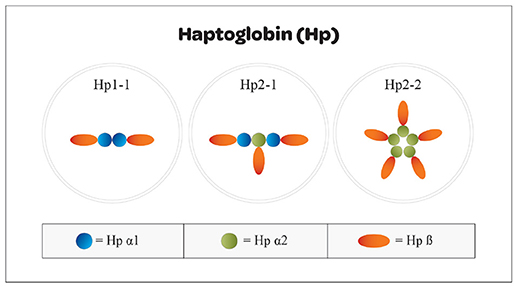 (10–12).Связывание Hp со свободным Hb образует стабильный комплекс с очень высоким сродством, который выводится из циркуляции системой ретикулоцитов и CD163-положительными макрофагами, клетками Купфера и гепатоцитами (13,14). Выполняя роль очищающего белка, Hp устраняет окислительный потенциал железа, содержащегося в молекуле Hb.
(10–12).Связывание Hp со свободным Hb образует стабильный комплекс с очень высоким сродством, который выводится из циркуляции системой ретикулоцитов и CD163-положительными макрофагами, клетками Купфера и гепатоцитами (13,14). Выполняя роль очищающего белка, Hp устраняет окислительный потенциал железа, содержащегося в молекуле Hb.
Молекулярная структура и регуляция
 Экспрессия Hp может увеличиваться в присутствии гормона роста, инсулина и бактериального эндотоксина, а также при экспрессии провоспалительных цитокинов, продуцируемых макрофагами, таких как интерлейкин (IL) -1, IL-6 и фактор некроза опухоли-α (TNF). -α) (14,29,30). Помимо индукции цитокинами, глюкокортикоиды, катехоламины и гипоксия также могут активировать экспрессию Hp (31,32). Несмотря на то, что Hp в основном является сывороточным белком, он также обнаруживается в моче, синовиальной жидкости, асцитной жидкости, спинномозговой жидкости и плевральной жидкости (33).
Экспрессия Hp может увеличиваться в присутствии гормона роста, инсулина и бактериального эндотоксина, а также при экспрессии провоспалительных цитокинов, продуцируемых макрофагами, таких как интерлейкин (IL) -1, IL-6 и фактор некроза опухоли-α (TNF). -α) (14,29,30). Помимо индукции цитокинами, глюкокортикоиды, катехоламины и гипоксия также могут активировать экспрессию Hp (31,32). Несмотря на то, что Hp в основном является сывороточным белком, он также обнаруживается в моче, синовиальной жидкости, асцитной жидкости, спинномозговой жидкости и плевральной жидкости (33). Функции Hp
 В результате внутрисосудистого гемолиза могут возникать различные серьезные осложнения, если они сопровождаются другими сопутствующими заболеваниями, такими как диабет, инфекционные заболевания, травмы и рак (38,39). Hp образует прочный нековалентный комплекс с Hb (комплекс Hp-Hb), который приводит к его удалению через ретикулоэндотелиальную систему и рецептор-опосредованный эндоцитоз через CD163 на гепатоцитах, клетках Купфера и тканевых макрофагах (40–43).
В результате внутрисосудистого гемолиза могут возникать различные серьезные осложнения, если они сопровождаются другими сопутствующими заболеваниями, такими как диабет, инфекционные заболевания, травмы и рак (38,39). Hp образует прочный нековалентный комплекс с Hb (комплекс Hp-Hb), который приводит к его удалению через ретикулоэндотелиальную систему и рецептор-опосредованный эндоцитоз через CD163 на гепатоцитах, клетках Купфера и тканевых макрофагах (40–43).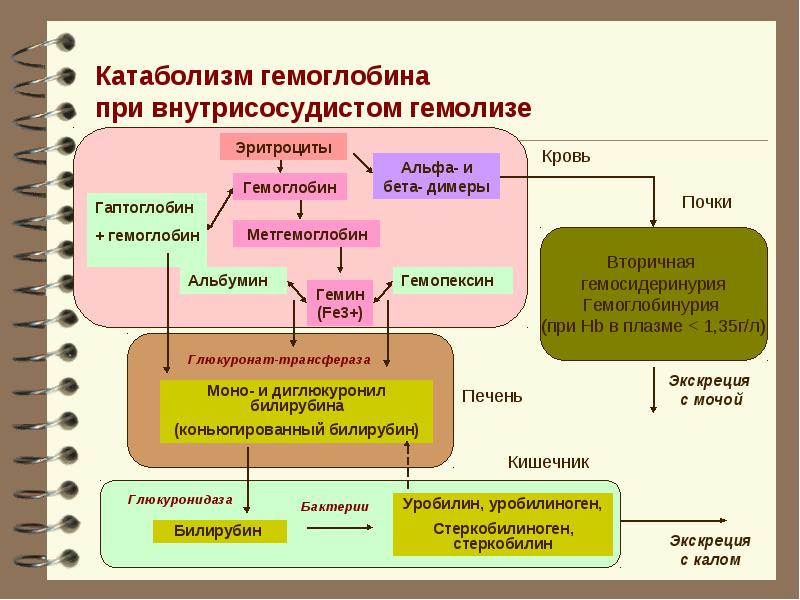
Антиоксидантная активность
 В течение некоторого времени было известно, что перегрузка железом может способствовать развитию диабета и атеросклероза (54–57). Патофизиология железа связана со способностью железа участвовать в образовании сильных окислителей, таких как гидроксильный радикал (58).Железо участвует в реакции Габера-Вейсса для преобразования активных форм кислорода (АФК), таких как супероксид и перекись водорода, в более мощные формы, такие как гидроксильный радикал (56). Свободное железо может быть вредным катализатором перекисного окисления липидов, поскольку оно может как инициировать, так и усиливать процесс перекисного окисления липидов.
В течение некоторого времени было известно, что перегрузка железом может способствовать развитию диабета и атеросклероза (54–57). Патофизиология железа связана со способностью железа участвовать в образовании сильных окислителей, таких как гидроксильный радикал (58).Железо участвует в реакции Габера-Вейсса для преобразования активных форм кислорода (АФК), таких как супероксид и перекись водорода, в более мощные формы, такие как гидроксильный радикал (56). Свободное железо может быть вредным катализатором перекисного окисления липидов, поскольку оно может как инициировать, так и усиливать процесс перекисного окисления липидов. Эти преобразования могут повредить ткани.
Эти преобразования могут повредить ткани. Иммунорегуляторная активность
 Еще в 1968 году с работ Нево и Статтона (63), а позднее, с работы Ланглуа и Деланге (64), люди с генотипом Hp2-2 продемонстрировали усиленную иммунную функцию.Например, люди с Hp2-2 проявляют больший ответ на вакцинацию, производя более высокие уровни защитных антител (65). Hp также был описан Langlois и Delanghe как обладающий ингибирующей активностью в синтезе простагландинов и, как следствие, обладающий противовоспалительными свойствами (64).
Еще в 1968 году с работ Нево и Статтона (63), а позднее, с работы Ланглуа и Деланге (64), люди с генотипом Hp2-2 продемонстрировали усиленную иммунную функцию.Например, люди с Hp2-2 проявляют больший ответ на вакцинацию, производя более высокие уровни защитных антител (65). Hp также был описан Langlois и Delanghe как обладающий ингибирующей активностью в синтезе простагландинов и, как следствие, обладающий противовоспалительными свойствами (64).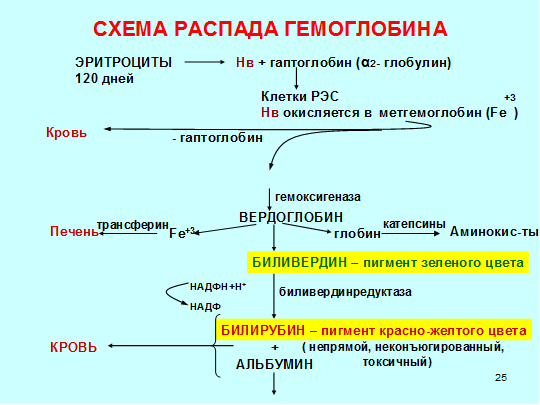 Эти данные свидетельствуют о том, что пациенты с аллелями Hp1 более эффективны в защите от инфекции.
Эти данные свидетельствуют о том, что пациенты с аллелями Hp1 более эффективны в защите от инфекции. Ангиогенез и лимфангиогенез
 Известно, что Hp играет роль в ангиогенезе согласно Cockerill et al. (75). Исследование Oh et al. (76) продемонстрировали, что proHp может повышать экспрессию фактора роста эндотелия сосудов (VEGF) и рецептора 2 VEGF и увеличивать разрастание и ветвление эндотелия.Эти данные предполагают, что proHp может способствовать ангиогенезу через сигнальный путь VEGF.
Известно, что Hp играет роль в ангиогенезе согласно Cockerill et al. (75). Исследование Oh et al. (76) продемонстрировали, что proHp может повышать экспрессию фактора роста эндотелия сосудов (VEGF) и рецептора 2 VEGF и увеличивать разрастание и ветвление эндотелия.Эти данные предполагают, что proHp может способствовать ангиогенезу через сигнальный путь VEGF. Богатые липидами мембраны эритроцитов и свободный Hb физиологически вредны в контексте диабета и атеросклероза. Неоваскуляризация атеросклеротической бляшки может быть вызвана Hp или proHp, что приводит к большему риску у людей с диабетом.
Богатые липидами мембраны эритроцитов и свободный Hb физиологически вредны в контексте диабета и атеросклероза. Неоваскуляризация атеросклеротической бляшки может быть вызвана Hp или proHp, что приводит к большему риску у людей с диабетом. Блокада оксида азота
 Более быстрый клиренс увеличивает доступность NO для выполнения своих физиологических функций. Одна иллюстрация преимущества одного генотипа Hp над другим была замечена в недавнем отчете Sertorio et al. (82) показали, что у пациентов с преэклампсией Hp1-1 играет защитную роль, уменьшая поглощение NO.У пациентов с Hp2-1 и Hp2-2 наблюдалось обострение преэклампсии, отчасти из-за снижения биодоступности NO.
Более быстрый клиренс увеличивает доступность NO для выполнения своих физиологических функций. Одна иллюстрация преимущества одного генотипа Hp над другим была замечена в недавнем отчете Sertorio et al. (82) показали, что у пациентов с преэклампсией Hp1-1 играет защитную роль, уменьшая поглощение NO.У пациентов с Hp2-1 и Hp2-2 наблюдалось обострение преэклампсии, отчасти из-за снижения биодоступности NO. Болезнь Последствия полиморфизма Hp
Инфекционная болезнь
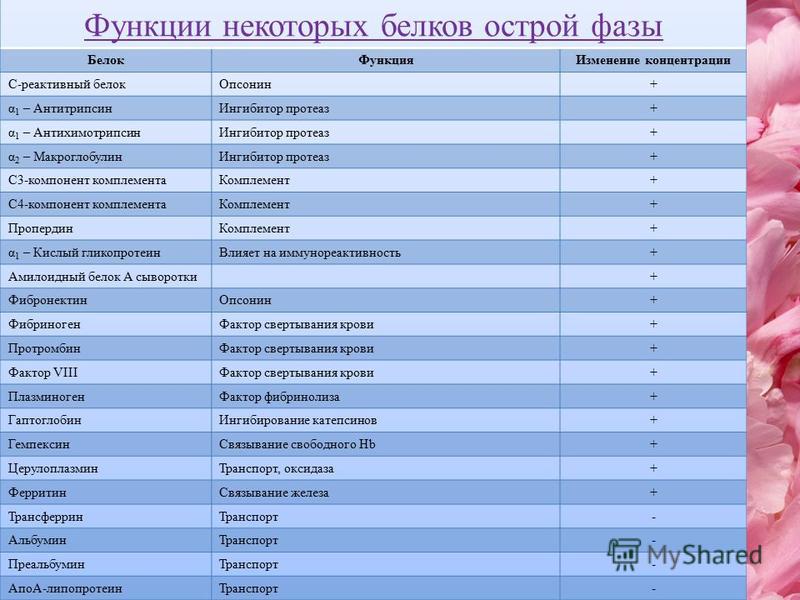 Сниженная активность Hp2 по очистке свободного гемоглобина может позволить этим бактериям использовать этот источник железа, способствуя усилению колонизации и роста.Пищаны и др. (91) продемонстрировали, что S. aureus может расти способом, который полностью зависит от способности связывать Hb, извлекать гем, пропускать гем через оболочку бактериальных клеток и разрушать гем в цитоплазме. Способность различных бактерий использовать железо из гемоглобина может способствовать возникновению инфекции мягких тканей, если свободный гем не удаляется после гемолиза эритроцитов.
Сниженная активность Hp2 по очистке свободного гемоглобина может позволить этим бактериям использовать этот источник железа, способствуя усилению колонизации и роста.Пищаны и др. (91) продемонстрировали, что S. aureus может расти способом, который полностью зависит от способности связывать Hb, извлекать гем, пропускать гем через оболочку бактериальных клеток и разрушать гем в цитоплазме. Способность различных бактерий использовать железо из гемоглобина может способствовать возникновению инфекции мягких тканей, если свободный гем не удаляется после гемолиза эритроцитов.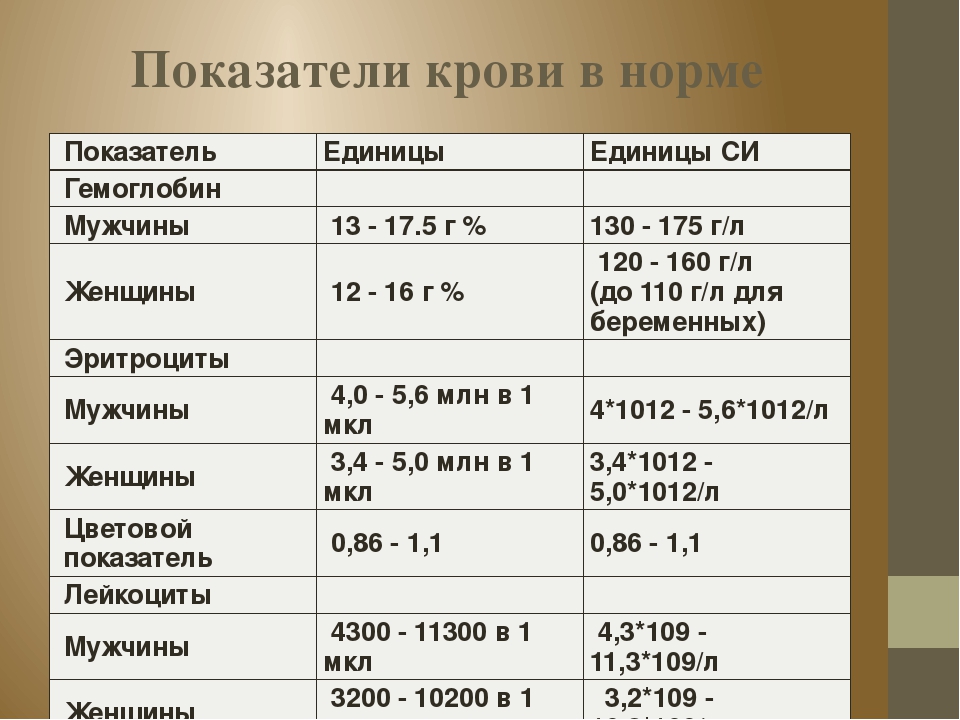 Эти результаты могут быть особенно важны в контексте осложнений диабета, сердечно-сосудистых заболеваний, хирургических вмешательств и травм. В целом механизмы врожденного иммунитета хозяина, включая Hp, ограничивают доступность железа для патогенов, тем самым устраняя одно важное требование для роста бактерий (94,95).
Эти результаты могут быть особенно важны в контексте осложнений диабета, сердечно-сосудистых заболеваний, хирургических вмешательств и травм. В целом механизмы врожденного иммунитета хозяина, включая Hp, ограничивают доступность железа для патогенов, тем самым устраняя одно важное требование для роста бактерий (94,95). Пациенты с Hp2-2 также имели значительно более высокие титры вируса ВИЧ, чем пациенты с другими генотипами (99). Генотип Hp также был исследован у пациентов с ВИЧ при развитии саркомы Капоши (СК). СК вызывается вирусом герпеса 8, оппортунистической инфекцией, редко встречающейся за пределами пациентов с ослабленным иммунитетом. Speeckaert et al.(100) исследовали влияние генотипа Hp и продемонстрировали, что генотип Hp1-1 представляет наибольший риск для развития KS, за ним следуют Hp2-2 и Hp2-1. Напротив, Speeckaert et al. (101) в более раннем исследовании продемонстрировали, что Hp1-1 обеспечивает наибольшую защиту от вируса Эпштейна-Барра, а Hp2-2 имеет наибольшую связь, определяемую титром сыворотки. В моделях гриппа на животных имеются существенные доказательства того, что Hp активируется при клиническом заболевании. Это было обнаружено у свиней и хорьков, у которых физиология легких аналогична физиологии человека (102, 103).Значительные наблюдения, касающиеся респираторных заболеваний крупного рогатого скота, были связаны с увеличением продукции Hp (104).
Пациенты с Hp2-2 также имели значительно более высокие титры вируса ВИЧ, чем пациенты с другими генотипами (99). Генотип Hp также был исследован у пациентов с ВИЧ при развитии саркомы Капоши (СК). СК вызывается вирусом герпеса 8, оппортунистической инфекцией, редко встречающейся за пределами пациентов с ослабленным иммунитетом. Speeckaert et al.(100) исследовали влияние генотипа Hp и продемонстрировали, что генотип Hp1-1 представляет наибольший риск для развития KS, за ним следуют Hp2-2 и Hp2-1. Напротив, Speeckaert et al. (101) в более раннем исследовании продемонстрировали, что Hp1-1 обеспечивает наибольшую защиту от вируса Эпштейна-Барра, а Hp2-2 имеет наибольшую связь, определяемую титром сыворотки. В моделях гриппа на животных имеются существенные доказательства того, что Hp активируется при клиническом заболевании. Это было обнаружено у свиней и хорьков, у которых физиология легких аналогична физиологии человека (102, 103).Значительные наблюдения, касающиеся респираторных заболеваний крупного рогатого скота, были связаны с увеличением продукции Hp (104). Эти наблюдения при респираторной инфекции особенно актуальны, учитывая недавнее сообщение о Hp как о части сурфактантной системы легких человека, в которой он локализуется совместно с сурфактантным белком B (105). Как видно из этих нескольких примеров, восприимчивость к инфекционным заболеваниям частично зависит от генотипа Hp, и это особенно важно для людей с диабетом и полиморфизмом Hp.
Эти наблюдения при респираторной инфекции особенно актуальны, учитывая недавнее сообщение о Hp как о части сурфактантной системы легких человека, в которой он локализуется совместно с сурфактантным белком B (105). Как видно из этих нескольких примеров, восприимчивость к инфекционным заболеваниям частично зависит от генотипа Hp, и это особенно важно для людей с диабетом и полиморфизмом Hp. Неврология
 Фактически, генотип Hp был вовлечен в большую восприимчивость к идиопатической БП (109, 110). Есть также несколько сообщений об участии Hp в патогенезе AD. Накопление β-амилоида в головном мозге является движущей силой патогенеза БА. Spagnuolo et al. ранее сообщалось, что Hp может связываться с аполипопротеином E (ApoE) и нарушать его функцию в гомеостазе холестерина (111).Иммунопреципитация и иммуноблоттинг показали, что Hp и β-амилоид образуют комплексы в ткани мозга пациентов с БА. Было показано, что взаимодействие между ApoE и β-амилоидом имеет решающее значение для ограничения нейротоксичности β-амилоида и для ускорения его клиренса. Spagnuolo et al. далее продемонстрировали, что Hp вместо нарушения связывания ApoE с β-амилоидом способствует образованию комплекса между β-амилоидом и ApoE2, ApoE3 или ApoE4 (111). Следовательно, это исследование предполагает, что риск развития AD не только может быть связан с различными изоформами ApoE, но также может зависеть от уровня и типа Hp.Song et al.
Фактически, генотип Hp был вовлечен в большую восприимчивость к идиопатической БП (109, 110). Есть также несколько сообщений об участии Hp в патогенезе AD. Накопление β-амилоида в головном мозге является движущей силой патогенеза БА. Spagnuolo et al. ранее сообщалось, что Hp может связываться с аполипопротеином E (ApoE) и нарушать его функцию в гомеостазе холестерина (111).Иммунопреципитация и иммуноблоттинг показали, что Hp и β-амилоид образуют комплексы в ткани мозга пациентов с БА. Было показано, что взаимодействие между ApoE и β-амилоидом имеет решающее значение для ограничения нейротоксичности β-амилоида и для ускорения его клиренса. Spagnuolo et al. далее продемонстрировали, что Hp вместо нарушения связывания ApoE с β-амилоидом способствует образованию комплекса между β-амилоидом и ApoE2, ApoE3 или ApoE4 (111). Следовательно, это исследование предполагает, что риск развития AD не только может быть связан с различными изоформами ApoE, но также может зависеть от уровня и типа Hp.Song et al.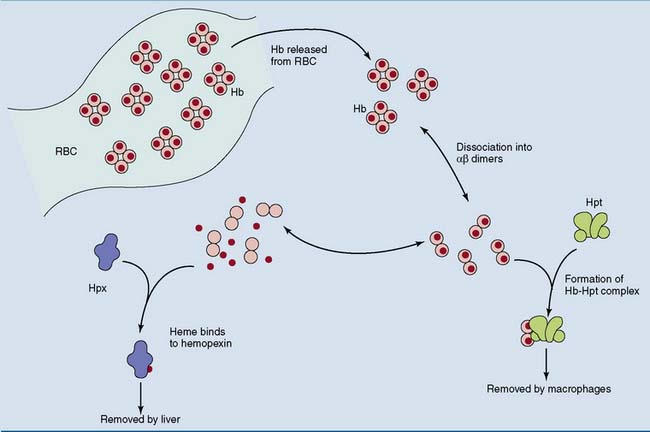 (112) сообщили о значительно более высоком уровне сывороточного Hp у пациентов с БА, чем у здоровых контрольных субъектов. Их результаты подтверждают гипотезу о том, что окислительный стресс является ключевым событием в патогенезе БА. Конкретные генотипы не изучались в этом исследовании, поэтому в будущем потребуется исследование, чтобы определить влияние Hp1 по сравнению с Hp2 на патогенез БА. Атрофия головного мозга, снижение метаболизма глюкозы в мозге и инсулинорезистентность центральной нервной системы — все это признаки БА, БП и диабета 2 типа (113, 114).
(112) сообщили о значительно более высоком уровне сывороточного Hp у пациентов с БА, чем у здоровых контрольных субъектов. Их результаты подтверждают гипотезу о том, что окислительный стресс является ключевым событием в патогенезе БА. Конкретные генотипы не изучались в этом исследовании, поэтому в будущем потребуется исследование, чтобы определить влияние Hp1 по сравнению с Hp2 на патогенез БА. Атрофия головного мозга, снижение метаболизма глюкозы в мозге и инсулинорезистентность центральной нервной системы — все это признаки БА, БП и диабета 2 типа (113, 114).
Кардиология

 (12,126,127).В одном исследовании с участием пациентов мужского пола с диабетом Lioupis et al. (128) продемонстрировали, что пациенты имели более высокий уровень гомоцистеина в сыворотке и что пациенты с генотипом Hp2-2 имели более высокую концентрацию железа в атеросклеротической бляшке. Эти данные свидетельствуют о том, что повышенное отложение железа в бляшках может быть причиной повышенного окислительного стресса и нестабильности сонной бляшки.
(12,126,127).В одном исследовании с участием пациентов мужского пола с диабетом Lioupis et al. (128) продемонстрировали, что пациенты имели более высокий уровень гомоцистеина в сыворотке и что пациенты с генотипом Hp2-2 имели более высокую концентрацию железа в атеросклеротической бляшке. Эти данные свидетельствуют о том, что повышенное отложение железа в бляшках может быть причиной повышенного окислительного стресса и нестабильности сонной бляшки. Диабет
Диагностическое значение Hp
Заключение
Двойственность интересов
Ссылки
1. Guariguata L, Whiting DR, Hambleton I, Beagley J, Linnenkamp U, Shaw JE.
Глобальные оценки распространенности диабета на 2013 год и прогнозы на 2035 год. Diabetes Res Clin Pract.
2014; 103: 137–149 [PubMed] [Google Scholar] 2. Mostaza JM, Lahoz C, Salinero-Fort MA, et al..
Степень тяжести атеросклероза сонных артерий в зависимости от гликемического статуса: поперечное популяционное исследование. Атеросклероз
2015; 242: 377–382 [PubMed] [Google Scholar] 3. Ифрим С., Василеску Р.
Раннее выявление атеросклероза у пациентов с диабетом 2 типа по эндотелиальной дисфункции и толщине интима-медиа. Rom J Intern Med
2004; 42: 343–354 [PubMed] [Google Scholar] 4. Морено П.Р., Фустер В.
Новые аспекты патогенеза диабетического атеротромбоза. J Am Coll Cardiol
2004; 44: 2293–2300 [PubMed] [Google Scholar] 5.Полоновский М.
Биохимия гаптоглобина и ее клиническая интерпретация. Ренд Ист Суп Санит
1950; 13: 842–875.
[на итальянском] [PubMed] [Google Scholar] 6. Полоновский М.
Влияние глобина плазмы на индекс гаптоглобина. Пел
1945; 16: 496–498.
[на французском] [PubMed] [Google Scholar] 7. Джейл М.Ф., Саид Я, Гиллард П.
Действие гаптоглобина на пероксидазный катализ гемоглобина: новая теория образования ферментов. Bull Soc Chim Biol (Париж)
1946; 28: 63–80.
[на французском] [PubMed] [Google Scholar] 8. Lim SK.
Последствия гемолиза без гаптоглобина.Редокс Rep
2001; 6: 375–378 [PubMed] [Google Scholar] 9. Ратанасопа К., Чакан С., Ильяс М., Нантасенамат С., Бюлов Л.
Захват гемоглобина человека гаптоглобином: молекулярные механизмы и клиническое применение. Антиоксидный окислительно-восстановительный сигнал
2013; 18: 2364–2374 [PubMed] [Google Scholar] 10. Lipiski M, Deuel JW, Baek JH, Engelsberger WR, Buehler PW, Schaer DJ.
Гаптоглобиновые терапевтические средства, специфичные для фенотипа Hp1-1 и Hp2-2 человека, эффективны как in vitro, так и у морских свинок для ослабления токсичности гемоглобина. Антиоксидный окислительно-восстановительный сигнал
2013; 19: 1619–1633 [Бесплатная статья PMC] [PubMed] [Google Scholar] 11.Бэк Дж. Х., Д’Агнилло Ф., Валлелиан Ф. и др. .
Патофизиология, управляемая гемоглобином, является следствием in vivo повреждения накопления эритроцитов, которое может быть ослаблено у морских свинок с помощью терапии гаптоглобином. J Clin Invest
2012; 122: 1444–1458 [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Гольденштейн Х., Леви Н.С., Леви А.П.
Генотип гаптоглобина и его роль в определении сосудистых заболеваний, опосредованных гемом-железом. Pharmacol Res
2012; 66: 1–6 [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Нильсен MJ, Андерсен CB, Moestrup SK.Связывание CD163 с комплексами гаптоглобин-гемоглобин включает двойное связывание электростатического рецептора-лиганда. J Biol Chem
2013; 288: 18834–18841 [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Ван И, Кинзи Э, Бергер Ф.Г., Лим С.К., Бауманн Х.
Гаптоглобин, белок плазмы, индуцируемый воспалением. Редокс Rep
2001; 6: 379–385 [PubMed] [Google Scholar] 15. Bowman BH, Barnett DR, Lum JB, Yang F.
Гаптоглобин. Методы Энзимол
1988; 163: 452–474 [PubMed] [Google Scholar] 16. Bowman BH, Куровский А.
Гаптоглобин: эволюционный продукт дупликации, неравного кроссинговера и точечной мутации.Adv Hum Genet
1982; 12: 189–261, 453–184 [PubMed] [Google Scholar] 18. Smithies O, Connell GE, Dixon GH.
Хромосомные перестройки и эволюция генов гаптоглобина. Природа
1962; 196: 232–236 [PubMed] [Google Scholar] 19. Су YC, Чен YC, Ли SC, Ли CC, Tung YT.
Обнаружение Hpdel у здоровых людей и больных раком на Тайване. Clin Chem Lab Med
2009; 47: 745–749 [PubMed] [Google Scholar] 20. Шимада Э., Одагири М., Чайвонг К. и др. .
Обнаружение Hpdel у тайцев, удаленного аллеля гена гаптоглобина, который вызывает врожденный дефицит гаптоглобина.Переливание
2007; 47: 2315–2321 [PubMed] [Google Scholar] 21. Пак К.Ю., Сон Дж., Ким Дж. К..
Генотипическое распределение гаптоглобина (включая аллель Hp0) и связанные концентрации гаптоглобина в сыворотке крови у корейцев. Дж. Клин Патол
2004; 57: 1094–1095 [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Нагаи Т., Окадзаки Т., Янагисава Ю.
Анализ ДНК субъектов, гетерозиготных по гену гаптоглобина-Джонсона альфа. Exp Clin Immunogenet
1997; 14: 113–117 [PubMed] [Google Scholar] 24. Polticelli F, Bocedi A, Minervini G, Ascenzi P.Структура и функция гаптоглобина человека: исследование на молекулярном моделировании. FEBS J
2008; 275: 5648–5656 [PubMed] [Google Scholar] 25. Вассел Дж.
Гаптоглобин: функция и полиморфизм. Clin Lab
2000; 46: 547–552 [PubMed] [Google Scholar] 26. Ян Ф., Фридрихс В.Е., Наварихо-Эшбо А.Л., де Граффенрид Л.А., Боуман Б.Х., Коулсон Дж. Дж.
Экспрессия гена гаптоглобина в легких, специфичная к типу клеток и вызванная воспалением. Лаборатория Инвест
1995; 73: 433–440 [PubMed] [Google Scholar] 27. Friedrichs WE, Navarijo-Ashbaugh AL, Bowman BH, Yang F.Экспрессия и воспалительная регуляция гена гаптоглобина в адипоцитах. Biochem Biophys Res Commun
1995; 209: 250–256 [PubMed] [Google Scholar] 28. Калмоварин Н., Фридрихс В.Е., О’Брайен Х.В., Лайнехан Л.А., Боуман Б.Х., Ян Ф.
Внепеченочная экспрессия генов белков плазмы при воспалении. Воспаление
1991; 15: 369–379 [PubMed] [Google Scholar] 29. Смитс М.Б., Пастеркамп Г., Лим С.К., Велема Е., ван Мидделаар Б., де Клейн Д.П.
Синтез оксида азота участвует в экспрессии артериального гаптоглобина после устойчивых изменений кровотока.FEBS Lett
2002; 529: 221–224 [PubMed] [Google Scholar] 30. Ян Ф., Гио А.Дж., Герберт Д.К., Слабее Ф.Дж., Уолтер Калифорния, Коулсон Дж. Дж.
Легочная экспрессия гена гаптоглобина человека. Am J Respir Cell Mol Biol
2000; 23: 277–282 [PubMed] [Google Scholar] 31. О, МК, Пак Х.Дж., Ким Н.Х., Пак С.Дж., Пак И.Ю., Ким И.С.
Индуцируемый гипоксией фактор-1альфа усиливает экспрессию гена гаптоглобина за счет улучшения связывания STAT3 с промотором. J Biol Chem
2011; 286: 8857–8865 [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. do Nascimento CO, Hunter L, Trayhurn P.Регулирование экспрессии гена гаптоглобина в адипоцитах 3T3-L1 цитокинами, катехоламинами и PPARgamma. Biochem Biophys Res Commun
2004; 313: 702–708 [PubMed] [Google Scholar] 34. Шаер DJ, Алаяш А.И.
Механизмы очистки и контроля гемоглобина от колыбели до могилы. Антиоксидный окислительно-восстановительный сигнал
2010; 12: 181–184 [PubMed] [Google Scholar] 36. Асчензи П., Бочеди А., Виска П. и др. .
Удаление гемоглобина и гема. IUBMB Life
2005; 57: 749–759 [PubMed] [Google Scholar] 37. Шаер DJ, Винчи Ф., Ингоглиа Дж., Толозано Э., Бюлер П.В.Гаптоглобин, гемопексин и родственные пути защиты — фундаментальная наука, клинические перспективы и разработка лекарств. Front Physiol
2014; 5: 1–13 [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Ирвин Д.К., Хиен Бэк Дж., Хасселл К. и др. .
Вызванное гемоглобином окисление сосудов легких, воспаление и ремоделирование способствуют прогрессированию гипоксической легочной гипертензии и ослабляются у крыс при введении гаптоглобина многократными дозами. Свободный Радик Биол Мед
2015; 82: 50–62 [Бесплатная статья PMC] [PubMed] [Google Scholar] 40.Алаяш А.И., Андерсен С.Б., Моэструп С.К., Бюлов Л.
Гаптоглобин: детоксификатор гемоглобина в плазме. Тенденции биотехнологии
2013; 31: 2–3 [PubMed] [Google Scholar] 41. Кемпфер Т., Дюрст Э., Гериг П. и др. .
Внеклеточный гемоглобин поляризует протеом макрофагов в направлении клиренса Hb, повышения антиоксидантной способности и подавления экспрессии HLA класса 2. J Proteome Res
2011; 10: 2397–2408 [PubMed] [Google Scholar] 42. Дурнфорд А., Данбар Дж., Галеа Дж. И др. .
Удаление гемоглобина после субарахноидального кровоизлияния.Acta Neurochir Suppl
2015; 120: 51–54 [PubMed] [Google Scholar] 43. Кристиансен М., Граверсен Дж. Х., Якобсен С. и др. .
Идентификация рецептора поглотителя гемоглобина. Природа
2001; 409: 198–201 [PubMed] [Google Scholar] 44. Садрзаде С.М., Бозоргмехр Дж., Фенотипы гаптоглобина в состоянии здоровья и расстройствах. Am J Clin Pathol
2004; 121 (Дополнение): S97 – S104 [PubMed] [Google Scholar] 45. Graversen JH, Madsen M, Moestrup SK.
CD163: сигнальный рецептор, улавливающий комплексы гаптоглобин-гемоглобин из плазмы. Int J Biochem Cell Biol
2002; 34: 309–314 [PubMed] [Google Scholar] 46.Мэдсен М, Граверсен Дж. Х., Моэструп СК.
Гаптоглобин и CD163: захват и рецептор, передающий гемоглобин в лизосомы макрофагов. Редокс Rep
2001; 6: 386–388 [PubMed] [Google Scholar] 47. Бюхлер К., Эйзингер К., Краутбауэр С.
Диагностический и прогностический потенциал макрофагоспецифического рецептора CD163 при воспалительных заболеваниях. Цели лекарств от воспаления и аллергии
2013; 12: 391–402 [PubMed] [Google Scholar] 48. Гордон С.
Гомеостаз: рецептор-поглотитель гемоглобина. Curr Biol
2001; 11: R399 – R401 [PubMed] [Google Scholar] 49.Нойес В.Д., Гарби Л.
Скорость синтеза гаптоглобина у нормального человека: определение по возвращению к нормальным уровням после инфузии гемоглобина. Сканд Дж Клин Лаб Инвест
1967; 20: 33–38 [PubMed] [Google Scholar] 50. Faulstick DA, Lowenstein J, Yiengst MJ.
Кинетика клиренса гаптоглобин-гемоглобинового комплекса у человека. Кровь
1962; 20: 65–71 [PubMed] [Google Scholar] 51. Ван Влирберге Х, Деланге Дж.
Полиморфизм гаптоглобина и гемостаз железа. Clin Chem
2003; 49: 708–709 [PubMed] [Google Scholar] 52.McCormick DJ, Атасси MZ.
Связывание гемоглобина с гаптоглобином: определение участка связывания гаптоглобина на альфа-цепи человеческого гемоглобина. J Protein Chem
1990; 9: 735–742 [PubMed] [Google Scholar] 53. Nantasenamat C, Prachayasittikul V, Bulow L.
Молекулярное моделирование человеческого комплекса гемоглобин-гаптоглобин проливает свет на защитные механизмы гаптоглобина. PLoS One
2013; 8: e62996. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Раджапуркар М.М., Хегде У, Бхаттачарья А., Алам М.Г., Шах С.В.Эффект деферипрона, перорального хелатора железа, при диабетической и недиабетической гломерулярной болезни. Методы Toxicol Mech
2013; 23: 5–10 [PubMed] [Google Scholar] 55. Алам С.Р., Шах А.С., Ричардс Дж. И др. .
Сверхмалые суперпарамагнитные частицы оксида железа у пациентов с острым инфарктом миокарда: ранний клинический опыт. Circ Cardiovasc Imaging
2012; 5: 559–565 [PubMed] [Google Scholar] 56. Сваминатан С., Фонсека В.А., Алам М.Г., Шах С.В.
Роль железа при диабете и его осложнениях. Уход за диабетом
2007; 30: 1926–1933 [PubMed] [Google Scholar] 57.Шах С.В., Алам МГ.
Роль железа при атеросклерозе. Am J Kidney Dis
2003; 41 (3 Suppl. 1): S80 – S83 [PubMed] [Google Scholar] 58. Холливелл Б.
Свободные радикалы и антиоксиданты: обновление личного мнения. Nutr Rev
2012; 70: 257–265 [PubMed] [Google Scholar] 59. Аяла А., Муньос М.Ф., Аргуэльес С.
Перекисное окисление липидов: производство, метаболизм и сигнальные механизмы малонового диальдегида и 4-гидрокси-2-ноненала. Oxid Med Cell Longev
2014; 2014: 360438. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Цянь С.Ю., Бюттнер Г.Р.Химия железа и дикислорода — важный путь к инициированию биологического свободнорадикального окисления: исследование электронного парамагнитного резонанса спинового захвата. Свободный Радик Биол Мед
1999; 26: 1447–1456 [PubMed] [Google Scholar] 61. Меламед-Франк М., Лаше О., Энав Б.И. и др. .
Структурно-функциональный анализ антиоксидантных свойств гаптоглобина. Кровь
2001; 98: 3693–3698 [PubMed] [Google Scholar] 62. Амири А.А., Хашеми-Сотех М.Б., Ахшенас М.Р., Данешвар Ф., Растегар А., Фаразманд Т.
Полиморфизм гаптоглобина у лиц с диабетической микроангиопатией 2 типа.N Am J Med Sci
2013; 5: 529–535 [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Нево СС, Саттон Х.
Связь между ответом на вакцинацию против брюшного тифа и известными генетическими маркерами. Am J Hum Genet
1968; 20: 461–469 [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Ланглуа MR, Delanghe JR.
Биологическое и клиническое значение полиморфизма гаптоглобина у человека. Clin Chem
1996; 42: 1589–1600 [PubMed] [Google Scholar] 65. Деланге-младший, Ланглуа М.Р., Де Бузер М.Л.
Полиморфизм гаптоглобина: ключевой фактор проатерогенной роли В-клеток?
Атеросклероз
2011; 217: 80–82 [PubMed] [Google Scholar] 66.Арредуани М., Маттейс П., Ван Хойвельд Э. и др. .
Гаптоглобин напрямую влияет на Т-клетки и подавляет высвобождение цитокинов 2-го типа из Т-хелперных клеток. Иммунология
2003; 108: 144–151 [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Гетта Дж., Штраус М., Леви Н.С., Фахум Л., Леви А.П.
Генотип гаптоглобина модулирует баланс цитокинов Th2 / Th3, продуцируемых макрофагами, подвергающимися воздействию свободного гемоглобина. Атеросклероз
2007; 191: 48–53 [PubMed] [Google Scholar] 68. Вануйцель Т., Вермейр С., Клейнен И.
Роль гаптоглобина и родственного ему белка зонулина в воспалительном заболевании кишечника.Тканевые барьеры
2013; 1: e27321. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Фазано А.
Зонулин и его регуляция функции кишечного барьера: биологическая дверь к воспалению, аутоиммунитету и раку. Physiol Rev
2011; 91: 151–175 [PubMed] [Google Scholar] 70. Zhang D, Zhang L, Zheng Y, Yue F, Russell RD, Zeng Y.
Уровни циркулирующего зонулина у недавно диагностированных пациентов с диабетом 2 типа в Китае. Диабет Res Clin Pract
2014; 106: 312–318 [PubMed] [Google Scholar] 71. Морено-Наваррете Дж. М., Сабатер М., Ортега Ф., Рикарт В., Фернандес-Реаль Дж. М..Циркулирующий зонулин, маркер кишечной проницаемости, увеличивается в связи с инсулинорезистентностью, связанной с ожирением. PLoS One
2012; 7: e37160. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Сааристо А., Таммела Т., Фарккила А. и др. .
Фактор роста эндотелия сосудов С ускоряет заживление диабетических ран. Am J Pathol
2006; 169: 1080–1087 [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Маруяма К., Асаи Дж., Ии М., Торн Т., Лосордо Д.В., Д’Амор, Пенсильвания.
Уменьшение количества и активации макрофагов приводит к уменьшению образования лимфатических сосудов и способствует нарушению заживления диабетических ран.Am J Pathol
2007; 170: 1178–1191 [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Оливер Дж., Детмар М.
Повторное открытие лимфатической системы: старые и новые взгляды на развитие и биологическую функцию лимфатической сосудистой сети. Genes Dev
2002; 16: 773–783 [PubMed] [Google Scholar] 75. Кокерилл Г.В., Гэмбл-младший, Вадас М.А.
Ангиогенез: модели и модуляторы. Int Rev Cytol
1995; 159: 113–160 [PubMed] [Google Scholar] 76. О, МК, Пак Х. Дж., Ли Дж. Х., Бэ Х. М., Ким ИС.
Одноцепочечный предшественник прогаптоглобин способствует ангиогенезу, регулируя экспрессию фактора роста эндотелия сосудов (VEGF) и рецептора VEGF2.FEBS Lett
2015; 589: 1009–1017 [PubMed] [Google Scholar] 77. Сид М.С., Грант Д.С., Хоффман Г.С., Ауэрбах Р., Фаучи А.С., Кляйнман Г.К.
Идентификация гаптоглобина как ангиогенного фактора в сыворотках крови пациентов с системным васкулитом. J Clin Invest
1993; 91: 977–985 [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Морено П.Р., Пурушотаман М., Пурушотаман К.Р.
Неоваскуляризация налета: защитные механизмы, предательство или война. Ann N Y Acad Sci
2012; 1254: 7–17 [PubMed] [Google Scholar] 79. Морено П.Р., Санс Дж., Фустер В.Механизмы содействия здоровью сосудов: циркулирующие клетки-предшественники, ангиогенез и обратный транспорт холестерина. J Am Coll Cardiol
2009; 53: 2315–2323 [PubMed] [Google Scholar] 80. Газомедиаторы OlasB.
(NO, CO и HS) и их роль в гемостазе и тромбозе. Clin Chim Acta
2015; 445: 115–121 [PubMed] [Google Scholar] 81. Суслова Т.Е., Ситожевский А.В., Огуркова О.Н. и др. .
Гемостаз тромбоцитов у пациентов с метаболическим синдромом и сахарным диабетом 2 типа: cGMP- и NO-зависимые механизмы инсулино-опосредованной агрегации тромбоцитов.Front Physiol
2014; 5: 1–8 [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Серторио Дж. Т., Лаккини Р., Амарал Л. М. и др. .
Полиморфизм гаптоглобина влияет на биодоступность оксида азота при преэклампсии. J Hum Hypertens
2013; 27: 349–354 [PubMed] [Google Scholar] 83. Бурекович А., Диздаревич-Бостанджич А., Годиньяк А.
Плохо регулируемый уровень глюкозы в крови у пациентов с диабетом: предиктор острых инфекций. Мед Арх
2014; 68: 163–166 [PubMed] [Google Scholar] 84. Шах BR, Hux JE.
Количественная оценка риска инфекционных заболеваний для людей с диабетом.Уход за диабетом
2003; 26: 510–513 [PubMed] [Google Scholar] 85. Елагиб А.А., Кидер А.О., Акерстрем Б, Эльбашир М.И.
Связь фенотипа гаптоглобина (1-1) с малярией falciparum в Судане. Транс Р Соц Троп Мед Хиг
1998; 92: 309–311 [PubMed] [Google Scholar] 86. Му AK, Bee PC, Lau YL, Chen Y.
Идентификация белковых маркеров у пациентов, инфицированных Plasmodium knowlesi, Plasmodium falciparum и Plasmodium vivax. Int J Mol Sci
2014; 15: 19952–19961 [Бесплатная статья PMC] [PubMed] [Google Scholar] 87. Някерига А.М., Трой-Бломберг М.Фенотипы гаптоглобина и статус железа у детей, живущих в эндемичных по малярии районах на побережье Кении. Acta Trop
2013; 126: 127–131 [PubMed] [Google Scholar] 88. Quaye IK.
Гаптоглобин, воспаление и болезнь. Транс Р Соц Троп Мед Хиг
2008; 102: 735–742 [PubMed] [Google Scholar] 89. Аллен CE, Шмитт MP.
Использование источников железа хозяина Corynebacterium diphtheriae: множественные связывающие гемоглобин белки необходимы для использования железа из комплекса гемоглобин-гаптоглобин. J Бактериол
2015; 197: 553–562 [Бесплатная статья PMC] [PubMed] [Google Scholar] 90.Тидеманн М.Т., Пинтер ТБ, Стиллман М.Дж.
Понимание блокирования переноса гема путем использования молекулярных взаимодействий в основных переносчиках гема IsdA-NEAT, IsdC-NEAT и IsdE из Staphylococcus aureus. Металломика
2012; 4: 751–760 [PubMed] [Google Scholar] 92. Адамс Н., Джонсон, доктор медицины, Storm DW, Maves RC.
Острый очаговый бактериальный нефрит, вызванный устойчивым к метициллину Staphylococcus aureus у иммунокомпетентного взрослого человека. Инфекционное заболевание
2014; 42: 433–436 [PubMed] [Google Scholar] 93. Мессад Н., Прайснар Т.К., Лина Г. и др..
Наличие колонизирующего штамма Staphylococcus aureus, выделенного при язвах диабетической стопы. Сахарный диабет
2015; 64: 2991–2995 [Бесплатная статья PMC] [PubMed] [Google Scholar] 95. Шеной М., Сомаяджулу Г.Л., Бхаскаран С.С.
Фенотипы гаптоглобулина при лепре. Лепр Индия
1983; 55: 566–569 [PubMed] [Google Scholar] 96. Dobler CC, Flack JR, Marks GB.
Риск туберкулеза среди людей с сахарным диабетом: общенациональное австралийское когортное исследование. BMJ Open
2012; 2: e000666 [Бесплатная статья PMC] [PubMed] [Google Scholar] 97.Янг Ф., Уоттон С.Дж., Кричли Дж. А., Анвин, Северная Каролина, Голдакр М.Дж.
Повышенный риск заболевания туберкулезом у людей с сахарным диабетом: исследование рекордной связи среди населения Великобритании. J Epidemiol Общественное здравоохранение
2012; 66: 519–523 [PubMed] [Google Scholar] 98. Ходжсон К., Моррис Дж., Бридсон Т., Гован Б., Раш К., Кетисан Н.
Иммунологические механизмы, усугубляющие двойное бремя диабета и внутриклеточных бактериальных инфекций. Иммунология
2015; 144: 171–185 [Бесплатная статья PMC] [PubMed] [Google Scholar] 99. Деланге JR, Langlois MR, Boelaert JR, et al..
Полиморфизм гаптоглобина, метаболизм железа и смертность при ВИЧ-инфекции. СПИД
1998; 12: 1027–1032 [PubMed] [Google Scholar] 100. Speeckaert R, Colebunders B, Boelaert JR и др. .
Связь фенотипов гаптоглобина с развитием саркомы Капоши у ВИЧ-инфицированных. Arch Dermatol Res
2011; 303: 763–769 [PubMed] [Google Scholar] 101. Speeckaert R, Speeckaert MM, Padalko E, Claeys LR, Delanghe JR.
Фенотип гаптоглобина связан с титром антител к вирусу Эпштейна-Барра. Clin Chem Lab Med
2009; 47: 826–828 [PubMed] [Google Scholar] 102.Pomorska-Mol M, Markowska-Daniel I, Kwit K, Czyzewska E, Dors A, Rachubik J, Pejsak Z.
Иммунный и воспалительный ответ свиней во время острого гриппа, вызванного вирусом свиного гриппа h2N1. Арка Вирол
2014; 159: 2605–2614 [Бесплатная статья PMC] [PubMed] [Google Scholar] 103. Мартинес-Орельяна П., Марторелл Дж., Видана Б. и др. .
Клинический ответ на пандемический вирус гриппа h2n1 в летальном и легком случае у хорьков. Вирол Дж
2015; 12: 1–10 [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Грибель П., Хилл К., Стоки Дж.Как стресс влияет на иммунные реакции при респираторной инфекции. Аним Здоровье Res Rev
2014; 15: 161–165 [PubMed] [Google Scholar] 106. Verdile G, Fuller SJ, Martins RN.
Роль диабета 2 типа в нейродегенерации. Нейробиол Дис
2015; 84: 22–38 [PubMed] [Google Scholar] 107. Сена С.М., Перейра А.М., Карвалью С. и др. .
Диабет 2 типа усугубляет связанные с болезнью Альцгеймера сосудистые изменения аорты у мышей. Дж. Альцгеймерс Дис
2015; 45: 127–138 [PubMed] [Google Scholar] 108. Розалес-Корраль S, Tan DX, Manchester L, Reiter RJ.Диабет и болезнь Альцгеймера: две совпадающие патологии на одном фоне: оксидативный стресс. Oxid Med Cell Longev
2015; 2015: 985845. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Коста-Маллен П., Чековей Н., Забети А. и др. .
Функциональный полиморфизм гаптоглобина, связывающего гемоглобин, влияет на предрасположенность к идиопатической болезни Паркинсона. Am J Med Genet B Neuropsychiatr Genet
2008; 147B: 216–222 [PubMed] [Google Scholar] 110. Аргуэльес С., Венеро Дж. Л., Гарсия-Родригес С. и др..
Использование гаптоглобина и транстиретина в качестве потенциальных биомаркеров для доклинической диагностики болезни Паркинсона. Neurochem Int
2010; 57: 227–234 [PubMed] [Google Scholar] 111. Spagnuolo MS, Maresca B, La Marca V, Carrizzo A, Veronesi C, Cupidi C, Piccoli T, Maletta RG, Bruni AC, Abrescia P, Cigliano L.
Гаптоглобин взаимодействует с аполипопротеином Е и бета-амилоидом и влияет на их перекрестные помехи. ACS Chem Neurosci
2014; 5: 837–847 [PubMed] [Google Scholar] 112. Сон АйЮ, Ким Ю.Д., Чанг С.В., Чо Х.Дж.
Связь между гаптоглобином сыворотки и патогенезом болезни Альцгеймера.Intern Med
2015; 54: 453–457 [PubMed] [Google Scholar] 113. Приядаршини М., Камаль М.А., Грейг Н.Х. и др. .
Болезнь Альцгеймера и диабет 2 типа: изучение связи с ожирением и тирозингидроксилазой. Мишени для лекарств от неврологического расстройства ЦНС
2012; 11: 482–489 [Бесплатная статья PMC] [PubMed] [Google Scholar] 114. Авилес-Олмос I, Лимузен П., Лис А., Фолтиние Т.
Болезнь Паркинсона, инсулинорезистентность и новые средства нейропротекции. Мозг
2013; 136: 374–384 [PubMed] [Google Scholar] 115. Мурти С.Б., Леви А.П., Дакворт Дж. И др..
Наличие аллеля гаптоглобина-2 связано с худшими функциональными исходами после спонтанного внутримозгового кровоизлияния. Всемирный нейрохирург
2015; 83: 583–587 [PubMed] [Google Scholar] 116. Кантор Э., Байир Х., Рен Д. и др. .
Генотип гаптоглобина и функциональный исход после аневризматического субарахноидального кровоизлияния. J Neurosurg
2014; 120: 386–390 [Бесплатная статья PMC] [PubMed] [Google Scholar] 117. Шапель Дж. П., Альберт А., Смитс Дж. П., Хойсгем С., Кульбертус Х.
Влияние фенотипа гаптоглобина на размер инфаркта миокарда.N Engl J Med
1982; 307: 457–463 [PubMed] [Google Scholar] 118. Holme I, Aastveit AH, Hammar N, Jungner I, Walldius G.
Гаптоглобин и риск инфаркта миокарда, инсульта и застойной сердечной недостаточности у 342 125 мужчин и женщин в исследовании Apolipoprotein MOrtality RISk (AMORIS). Энн Мед
2009; 41: 522–532 [PubMed] [Google Scholar] 119. Хаас Б., Серки Т., Вагнер Д. Р. и др. .
Протеомный анализ образцов плазмы от пациентов с острым инфарктом миокарда определяет гаптоглобин как потенциальный прогностический биомаркер.J Proteomics
2011; 75: 229–236 [PubMed] [Google Scholar] 120. Costacou T, Secrest AM, Ferrell RE, Orchard TJ.
Генотип гаптоглобина и частота цереброваскулярных заболеваний при диабете 1 типа. Diab Vasc Dis Res
2014; 11: 335–342 [Бесплатная статья PMC] [PubMed] [Google Scholar] 121. Костаку Т., Феррелл Р.Э., Орчард Т.Дж.
Генотип гаптоглобина: определяющий фактор риска сердечно-сосудистых осложнений при диабете 1 типа. Сахарный диабет
2008; 57: 1702–1706 [PubMed] [Google Scholar] 122. Стаалс Дж., Бонс Дж. А., ван Остенбрюгге Р. Дж. И др..
Исследование SELDI-TOF-MS при лакунарном инсульте с последующим фенотипированием гаптоглобина. Curr Neurovasc Res
2008; 5: 93–98 [PubMed] [Google Scholar] 123. Бракман Л., Де Бакер Д., Деланге Дж., Клэйс Л., Де Бакер Г.
Связь между полиморфизмом гаптоглобина, липидами, липопротеинами и воспалительными факторами. Атеросклероз
1999; 143: 383–388 [PubMed] [Google Scholar] 124. Рогин А., Рибичини Ф., Ферреро В. и др. .
Фенотип гаптоглобина и риск рестеноза после имплантации стента коронарной артерии.Am J Cardiol
2002; 89: 806–810 [PubMed] [Google Scholar] 125. Деланге Дж., Камбье Б., Ланглуа М. и др. .
Полиморфизм гаптоглобина, генетический фактор риска в хирургии коронарного шунтирования. Атеросклероз
1997; 132: 215–219 [PubMed] [Google Scholar] 126. Иджас П., Сакси Дж., Соинне Л. и др. .
Аллель гаптоглобина 2 ассоциирован с нестабильной каротидной бляшкой и серьезными сердечно-сосудистыми событиями. Атеросклероз
2013; 230: 228–234 [PubMed] [Google Scholar] 127. Рузевик Дж., Джексон К., Прадилла Дж., Гарсон-Мувди Т., Тамарго Р. Дж..Формирование аневризмы у мышей с провоспалительным трансгенным гаптоглобином 2-2. Нейрохирургия
2013; 72: 70–76 [PubMed] [Google Scholar] 128. Лиупис С., Барбатис С., Другу А. и др. .
Связь генотипа гаптоглобина и общих факторов риска сердечно-сосудистых заболеваний с количеством железа в атеросклеротических каротидных бляшках. Атеросклероз
2011; 216: 131–138 [PubMed] [Google Scholar] 129. Деланге Дж. Р., Дюпре Д. А., Де Буйзере М. Л. и др. .
Рефрактерная гипертензия связана с фенотипом гаптоглобина 2-2. J Кардиоваск Риск
1995; 2: 131–136 [PubMed] [Google Scholar] 130.Деланге Дж. Р., Дюпре Д. А., Де Буйзере М. Л. и др. .
Полиморфизм гаптоглобина и осложнения при установленной эссенциальной артериальной гипертензии. J Hypertens
1993; 11: 861–867 [PubMed] [Google Scholar] 131. Burbea Z, Nakhoul F, Rosenberg S и др. .
Роль фенотипа гаптоглобина в терминальной стадии болезни почек. Нефрон Опыт Нефрол
2004; 97: e71 – e76 [PubMed] [Google Scholar] 132. Аслех Р., Леви А.П.
Исследования in vivo и in vitro устанавливают, что гаптоглобин является основным геном предрасположенности к диабетическим сосудистым заболеваниям.Vasc Health Risk Manag
2005; 1: 19–28 [Бесплатная статья PMC] [PubMed] [Google Scholar] 133. Леви А.П., Рогин А., Хохберг И. и др. .
Фенотип гаптоглобина и сосудистые осложнения у больных сахарным диабетом. N Engl J Med
2000; 343: 969–970 [PubMed] [Google Scholar] 134. Леви А.П., Хохберг И., Яблонски К. и др. .
Фенотип гаптоглобина является независимым фактором риска сердечно-сосудистых заболеваний у людей с диабетом: исследование Strong Heart. J Am Coll Cardiol
2002; 40: 1984–1990 [PubMed] [Google Scholar] 135.Шафранек Т., Марш С., Леви А.П.
Гаптоглобин: главный ген предрасположенности к диабетическим сосудистым осложнениям. Exp Clin Cardiol
2002; 7: 113–119 [Бесплатная статья PMC] [PubMed] [Google Scholar] 136. Леви А.П., Ларсон М.Г., Кори Д., Лотан Р., Вита Дж. А., Бенджамин Э. Дж.
Фенотип гаптоглобина и распространенная ишемическая болезнь сердца в когорте потомков Фрамингема. Атеросклероз
2004; 172: 361–365 [PubMed] [Google Scholar] 137. Mogarekar MR, Hampe MH.
Фенотип гаптоглобина2-2 является дополнительным фактором риска ретинопатии при сахарном диабете 2 типа.Индийский J Hum Genet
2013; 19: 154–158 [Бесплатная статья PMC] [PubMed] [Google Scholar] 138. Ван Ф, Хуанг В, Ли А.
Гаптоглобин сыворотки подавляет функции Т-лимфоцитов после ожогов. Подбородок Med Sci J
1996; 11: 180–183 [PubMed] [Google Scholar] 139. Burtis CA, Ashwood ER, Bruns DE, Tietz NW (ред.). Учебник Тиц по клинической химии и молекулярной диагностике. 5-е изд.
Сент-Луис, Мо, Сондерс, 2013 [Google Scholar] 140. Писсенс М.Ф., Мариен Г., Стивенс Э.
Снижение уровня гаптоглобина при респираторной аллергии. Клиническая аллергия
1984; 14: 287–293 [PubMed] [Google Scholar] 141.Пантер СС, Садрзаде С.М., Халлавей П.Е., Хейнс Дж. Л., Андерсон В. Е., Итон Дж. У.
Гипогаптоглобинемия, связанная с семейной эпилепсией. J Exp Med
1985; 161: 748–754 [Бесплатная статья PMC] [PubMed] [Google Scholar] 142. Глория-Боттини Ф., Лукарелли П., Сакуччи П. и др. .
Генетический полиморфизм и идиопатическая генерализованная эпилепсия: свидетельство взаимодействия между системами гаптоглобина и ACP1. Нейропедиатрия
2008; 39: 357–358 [PubMed] [Google Scholar] 143. Вейнер Х.Л., Горбатов Р., Варди М. и др. .
Фармакогеномное взаимодействие между генотипом гаптоглобина и витамином Е на прогрессирование и стабильность атеросклеротических бляшек.Атеросклероз
2015; 239: 232–239 [Бесплатная статья PMC] [PubMed] [Google Scholar] 144. Блюм С., Варди М., Браун Дж. Б. и др. .
Витамин E уменьшает сердечно-сосудистые заболевания у людей с сахарным диабетом и генотипом гаптоглобина 2-2. Фармакогеномика
2010; 11: 675–684 [Бесплатная статья PMC] [PubMed] [Google Scholar] 145. Фарид Н., Инбал Д., Нахоул Н. и др. .
Витамин Е и диабетическая нефропатия у мышей и людей. Мир Джей Нефрол
2013; 2: 111–124 [Бесплатная статья PMC] [PubMed] [Google Scholar] 146. Леви Н.С., Варди М., Блюм С. и др..
Иммуноферментный анализ (ELISA) для определения фенотипа гаптоглобина человека. Clin Chem Lab Med
2013; 51: 1615–1622 [Бесплатная статья PMC] [PubMed] [Google Scholar] 147. Томсен Дж. Х., Этцеродт А., Свендсен П., Моэструп СК.
Путь гаптоглобин-CD163-гемоксигеназа-1 для удаления гемоглобина. Oxid Med Cell Longev
2013; 2013: 523652. [Бесплатная статья PMC] [PubMed] [Google Scholar] 148. Гатри П.А., Абдоллахи М.Р., Гонт Т. и др. .
Дубликон гаптоглобина, гемоглобин и витамин С: анализ в исследованиях сердца и здоровья британских женщин и проспективном исследовании Caerphilly.Маркеры Dis
2014; 2014: 529456. [Бесплатная статья PMC] [PubMed] [Google Scholar] 149. Варди М, Леви Н.С., Леви А.П.
Витамин Е в профилактике сердечно-сосудистых заболеваний: важность правильного отбора пациентов. J Lipid Res
2013; 54: 2307–2314 [Бесплатная статья PMC] [PubMed] [Google Scholar] Frontiers | Уникальный вклад гаптоглобина и генотипа гаптоглобина в аневризматическое субарахноидальное кровоизлияние
Введение
Процессинг внеклеточного гемоглобина и роль гаптоглобина
Нейровоспаление
BBB Нарушение
Церебральный вазоспазм
Артериальный микротромбоз
Научные неточности
Выводы и направления на будущее
Авторские взносы
Финансирование
Заявление о конфликте интересов
Список литературы
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Далан Р., Лю X., Го Л. Л., Бинг С. и Луо К. К. (2017). Апоптоз эндотелиальных клеток коррелирует с низкой концентрацией гаптоглобина при диабете. Diab.Васк. Дис. Res. 14, 534–539. DOI: 10.1177 / 147
17719827PubMed Аннотация | CrossRef Полный текст | Google Scholar
Деланге, Дж., Камбье, Б., Ланглуа, М., Де Буйзере, М., Нилс, Х., Де Бакер, Д., и др. (1997). Полиморфизм гаптоглобина, генетический фактор риска в хирургии коронарного шунтирования. Атеросклероз 132, 215–219. DOI: 10.1016 / S0021-9150 (97) 00089-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дхар, Р., и Диринджер, М. Н. (2008). Бремя системной воспалительной реакции позволяет прогнозировать спазм сосудов и исход после субарахноидального кровоизлияния. Neurocrit. Care 8, 404–412. DOI: 10.1007 / s12028-008-9054-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дхар Р., Скалфани М. Т., Блэкберн С., Зазулия А. Р., Видин Т. и Дирингер М. (2012). Связь между ангиографическим вазоспазмом и регионарной гипоперфузией при аневризматическом субарахноидальном кровоизлиянии. Инсульт 43, 1788–1794. DOI: 10.1161 / STROKEAHA.111.646836
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dóczi, T. (1985). Патогенетическое и прогностическое значение повреждения гематоэнцефалического барьера в острой стадии аневризматического субарахноидального кровоизлияния. Clin. Exp. Stud. Acta Neurochir 77, 110–132. DOI: 10.1007 / BF01476215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Доци, Т., Джу, Ф., Адам, Г., Bozóky, B., and Szerdahelyi, P. (1986). Повреждение гематоэнцефалического барьера во время острой стадии субарахноидального кровоизлияния на примере новой модели на животных. Нейрохирургия 18, 733–739. DOI: 10.1227 / 00006123-198606000-00010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дун, X., Сун, Ю. Н., Лю, В. Г., и Го, X. Л. (2009). Mmp-9, потенциальная мишень для лечения церебральной ишемии. Curr. Neuropharmacol. 7, 269–275. DOI: 10.2174 / 1570159097
157PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дорхаут Мис, С.М., ван ден Берг, В. М., Алгра, А., и Ринкель, Г. Дж. (2007). Антитромбоцитарная терапия при аневризматическом субарахноидальном кровоизлиянии. Кокрановская база данных Syst. Ред. 17: CD006184. DOI: 10.1002 / 14651858.CD006184.pub2
CrossRef Полный текст | Google Scholar
Драйер, Дж. П., Майор, С., Мэннинг, А., Войцик, Дж., Дренкхан, К., Стейнбринк, Дж. И др. (2009). Распространяющаяся кортикальная ишемия — это новый процесс, связанный с ишемическим повреждением у пациентов с аневризматическим субарахноидальным кровоизлиянием. Мозг 132 (Pt 7), 1866–1881. DOI: 10.1093 / мозг / awp102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ферверда Б., МакКолл М. Б., Верхейен К., Кульберг Б. Дж., Ван дер Вен А. Дж., Ван дер Меер Дж. У. и др. (2008). Функциональные последствия полиморфизма толл-подобного рецептора 4. Mol. Med. 14, 346–352. DOI: 10.2119 / 2007-00135.Ferwerda
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фигейредо, Р.Т., Фернандес, П. Л., Моурао-Са, Д. С., Порто, Б. Н., Дутра, Ф. Ф., Алвес, Л. С. и др. (2007). Характеристика гема как активатора Toll-подобного рецептора 4. J. Biol. Chem. 282, 20221–20229. DOI: 10.1074 / jbc.M610737200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фоли П. Л., Такенака К., Касселл Н. Ф. и Ли К. С. (1994). Цитотоксическое действие кровянистой спинномозговой жидкости на церебральные эндотелиальные клетки в культуре. J. Neurosurg. 81, 87–92.DOI: 10.3171 / jns.1994.81.1.0087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фридрих Б., Мюллер Ф., Фейлер С., Шоллер К. и Плеснила Н. (2012). Экспериментальное субарахноидальное кровоизлияние вызывает раннее и длительное сужение микрокартериальных артерий и микротромбоз: микроскопическое исследование in-vivo, . J. Cereb. Blood Flow Metab. 32, 447–455. DOI: 10.1038 / jcbfm.2011.154
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fujii, Y., Такеучи, С., Сасаки, О., Минакава, Т., Койке, Т., и Танака, Р. (1997). Серийные изменения гемостаза при аневризматическом субарахноидальном кровоизлиянии с особым упором на отсроченный ишемический неврологический дефицит. J. Neurosurg. 86, 594–602. DOI: 10.3171 / jns.1997.86.4.0594
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Габерель, Т., Гакуба, К., Гулай, Р., Мартинес де Лисаррондо, С., Хануз, Дж. Л., Эмери, Э. и др. (2014). Нарушение перфузии лимфатической системы после инсульта, выявленное с помощью МРТ с контрастным усилением: новая мишень для фибринолиза? Инсульт 45, 3092–3096.DOI: 10.1161 / STROKEAHA.114.006617
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Габикян П., Клаттербак Р. Э., Эберхарт К. Г., Тайлер Б. М., Тирни Т. С. и Тамарго Р. Дж. (2002). Профилактика экспериментального церебрального вазоспазма путем внутричерепной доставки донора оксида азота из полимера с контролируемым высвобождением: исследования токсичности и эффективности на кроликах и крысах. Инсульт 33, 2681–2686. DOI: 10.1161 / 01.STR.0000033931.62992.B1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Галеа, Дж., Cruickshank, G., Teeling, J. L., Boche, D., Garland, P., Perry, V.H., et al. (2012). Интратекальная система поглощения CD163-гаптоглобина-гемоглобина при субарахноидальном кровоизлиянии. J. Neurochem. 121, 785–792. DOI: 10.1111 / j.1471-4159.2012.07716.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Галлия, Г. Л., и Тамарго, Р. Дж. (2006). Взаимодействие лейкоцитов и эндотелиальных клеток при хроническом вазоспазме после субарахноидального кровоизлияния. Neurol. Res. 28, 750–758.DOI: 10.1179 / 016164106X152025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Germanò, A., Caffo, M., Angileri, F. F., Arcadi, F., Newcomb-Fernandez, J., Caruso, G., et al. (2007). Антагонист рецепторов NMDA фелбамат снижает поведенческие расстройства и изменения проницаемости гематоэнцефалического барьера после экспериментального субарахноидального кровоизлияния у крысы. J. Neurotrauma 24, 732–744. DOI: 10.1089 / neu.2006.0181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гольденштейн, Х., Леви, Н.С., Леви, А.П. (2012). Генотип гаптоглобина и его роль в определении сосудистых заболеваний, опосредованных гемом-железом. Pharmacol. Res. 66, 1–6. DOI: 10.1016 / j.phrs.2012.02.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gomis, P., Graftieaux, J. P., Sercombe, R., Hettler, D., Scherpereel, B., and Rousseaux, P. (2010). Рандомизированное двойное слепое плацебо-контролируемое пилотное исследование высоких доз метилпреднизолона при аневризматическом субарахноидальном кровоизлиянии. J. Neurosurg. 112, 681–688. DOI: 10.3171 / 2009.4.JNS081377
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонзалес Р., Оклер К., Вуазен Э., Гаутеро Х., Дерми Д. и Бойвин П. (1984). Супероксиддисмутаза, каталаза и глутатионпероксидаза в эритроцитах пациентов со злокачественными заболеваниями. Cancer Res. 44, 4137–4139.
PubMed Аннотация | Google Scholar
Грамм, М., Свейнсдоттир, С., Рушер, К., Ханссон, С. Р., Синтио, М., Акерстрём, Б. и др. (2013). Гемоглобин вызывает воспаление после преждевременного внутрижелудочкового кровотечения за счет образования метгемоглобина. J. Нейровоспаление 10: 100. DOI: 10.1186 / 1742-2094-10-100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Graw, J. A., Mayeur, C., Rosales, I., Liu, Y., Sabbisetti, V. S., Riley, F. E., et al. (2016). Терапия гаптоглобином или гемопексином предотвращает острые побочные эффекты реанимации после длительного хранения эритроцитов. Тираж 134, 945–960. DOI: 10.1161 / CIRCULATIONAHA.115.019955
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Graw, J. A., Yu, B., Rezoagli, E., Warren, H. S., Buys, E. S., Bloch, D. B., et al. (2017). Эндотелиальная дисфункция подавляет способность гаптоглобина предотвращать гипертензию, вызванную гемоглобином. Am. J. Physiol. Heart Circ. Physiol. 312, h2120 – h2127. DOI: 10.1152 / ajpheart.00851.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грубер, А., Рёсслер, К., Граннингер, В., Доннер, А., Ильевич, М. У. и Чех, Т. (2000). Желудочковая спинномозговая жидкость и сывороточные концентрации sTNFR-I, IL-1ra и IL-6 после аневризматического субарахноидального кровоизлияния. J. Neurosurg. Анестезиол. 12, 297–306. DOI: 10.1097 / 00008506-200010000-00001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Го, З., Сунь, X., Хэ, З., Цзян, Ю., Чжан, X., и Чжан, Дж. Х. (2010). Матричная металлопротеиназа-9 потенцирует раннее повреждение головного мозга после субарахноидального кровоизлияния. Neurol. Res. 32, 715–720. DOI: 10.1179 / 016164109X12478302362491
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ханафи, К. А. (2013). Роль микроглии и пути TLR4 в апоптозе нейронов и вазоспазме после субарахноидального кровоизлияния. J. Нейровоспаление 10:83. DOI: 10.1186 / 1742-2094-10-83
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаора, Дж., Рамирес, С. Х., Шалл, К., Смит, Д., Пандья, Р., и Персидский Ю. (2007). Окислительный стресс активирует протеинтирозинкиназу и матриксные металлопротеиназы, что приводит к дисфункции гематоэнцефалического барьера. J. Neurochem. 101, 566–576. DOI: 10.1111 / j.1471-4159.2006.04393.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хендрик, С., Джарзаб, Б., и Йоско, Дж. (2004). Повышение уровней ИЛ-1 бета и ИЛ-6 в спинномозговой жидкости у пациентов с вазоспазмом после аневризматической САК. Neuro Endocrinol. Lett. 25, 141–147.
PubMed Аннотация | Google Scholar
Hijdra, A., van Gijn, J., Nagelkerke, N.J., Vermeulen, M., and van Crevel, H. (1988). Прогнозирование отсроченной ишемии головного мозга, повторного кровотечения и исходов после аневризматического субарахноидального кровоизлияния. Инсульт 19, 1250–1256. DOI: 10.1161 / 01.STR.19.10.1250
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хоп, Дж. У., Ринкель, Дж. Дж., Алгра, А., и ван Гийн, Дж. (1997). Летальность и функциональный исход после субарахноидального кровоизлияния: систематический обзор. Инсульт 28, 660–664. DOI: 10.1161 / 01.STR.28.3.660
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Икеда К., Асакура Х., Футами К. и Ямасита Дж. (1997). Коагуляционная и фибринолитическая активация спинномозговой жидкости и плазмы после субарахноидального кровоизлияния. Нейрохирургия 41, 344–349; обсуждение: 9–50. DOI: 10.1097 / 00006123-199708000-00002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Илифф, Дж.J., Wang, M., Liao, Y., Plogg, B.A., Peng, W., Gundersen, G.A., et al. (2012). Параваскулярный путь способствует прохождению спинномозговой жидкости через паренхиму головного мозга и очищению интерстициальных растворенных веществ, включая бета-амилоид. Sci. Пер. Med. 4: 147ra11. DOI: 10.1126 / scitranslmed.3003748
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джек, С.С., Арбор, Н., Манусов, Дж., Монгрейн, В., Блейн, М., МакКри, Э. и др. (2005). Передача сигналов TLR регулирует врожденные иммунные ответы в микроглии и астроцитах человека. J. Immunol. 175, 4320–4330. DOI: 10.4049 / jimmunol.175.7.4320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цзи Ю., Мэн К. Х. и Ван З. Г. (2014). Изменения свертывающей и фибринолитической системы у больных с субарахноидальным кровоизлиянием. Neurol. Med. Чир. 54, 457–464. DOI: 10.2176 / nmc.oa2013-0006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каго Т., Такаги Н., Датэ И., Такенага Ю., Такаги, К., и Такео, С. (2006). Церебральная ишемия усиливает фосфорилирование тирозина окклюдина в капиллярах мозга. Biochem. Биофиз. Res. Commun. 339, 1197–1203. DOI: 10.1016 / j.bbrc.2005.11.133
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Калес, Т., Лудике, П., Эндрес, М., Галла, Х. Дж., Стейнмец, Х., Буссе, Р. и др. (2007). НАДФН-оксидаза играет центральную роль в повреждении гематоэнцефалического барьера при экспериментальном инсульте. Инсульт 38, 3000–3006.DOI: 10.1161 / STROKEAHA.107.489765
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кантор, Э., Байир, Х., Рен, Д., Провенсио, Дж. Дж., Уоткинс, Л., Краго, Э. и др. (2014). Генотип гаптоглобина и функциональный исход после аневризматического субарахноидального кровоизлияния. J. Neurosurg. 120, 386–390. DOI: 10.3171 / 2013.10.JNS13219
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Касселл, Н. Ф., Сасаки, Т., Колохан, А. Р., и Назар, Г.(1985). Спазм сосудов головного мозга после аневризматического субарахноидального кровоизлияния. Инсульт 16, 562–572. DOI: 10.1161 / 01.STR.16.4.562
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кавакита Ф., Фудзимото М., Лю Л., Накано Ф., Накацука Ю. и Судзуки Х. (2016). Эффекты антагонистов Toll-Like рецептора 4 против церебрального вазоспазма после экспериментального субарахноидального кровоизлияния у мышей. Mol Neurobiol. 54, 6624–6633. DOI: 10.1007 / s12035-016-0178-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кипр, Р.F., Xiang, J., Ennis, S. R., Andjelkovic, A., Hua, Y., Xi, G., et al. (2008). Функция гематоэнцефалического барьера при внутримозговом кровоизлиянии. Acta Neurochir. Дополнение 105, 73–77. DOI: 10.1007 / 978-3-211-09469-3_15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кирххофер Д., Чопп Т. Б., Хадвари П. и Баумгартнер Х. Р. (1994). Эндотелиальные клетки, стимулированные фактором некроза опухоли-альфа, экспрессируют различные количества тканевого фактора, что приводит к негомогенному отложению фибрина в системе нативного кровотока.Эффекты ингибиторов тромбина. J. Clin. Вкладывать деньги. 93, 2073–2083. DOI: 10.1172 / JCI117202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристиансен, М., Граверсен, Дж. Х., Якобсен, К., Сонне, О., Хоффман, Х. Дж., Лоу, С. К., и др. (2001). Идентификация рецептора поглотителя гемоглобина. Природа 409, 198–201. DOI: 10.1038 / 35051594
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квон, К. Ю., Чон, Б.С. (2001). Уровни цитокинов в спинномозговой жидкости и отсроченный ишемический дефицит у пациентов с аневризматическим субарахноидальным кровоизлиянием. J. Korean Med. Sci. 16, 774–780. DOI: 10.3346 / jkms.2001.16.6.774
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Квон, М. С., Ву, С. К., Курланд, Д. Б., Юн, С. Х., Палмер, А. Ф., Банерджи, У. и др. (2015). Метгемоглобин является эндогенным лигандом толл-подобного рецептора 4, имеющим отношение к субарахноидальному кровоизлиянию. Внутр.J. Mol. Sci. 16, 5028–5046. DOI: 10.3390 / ijms16035028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ланглуа М. Р. и Деланге Дж. Р. (1996). Биологическое и клиническое значение полиморфизма гаптоглобина у человека. Clin. Chem. 42, 1589–1600.
PubMed Аннотация | Google Scholar
Лазальде, Б., Уэрта-Герреро, Х. М., Сименталь-Мендиа, Л. Э., Родригес-Моран, М., и Герреро-Ромеро, Ф. (2014). Генотип гаптоглобина 2-2 связан с уровнями TNF-альфа и IL-6 у субъектов с ожирением. Dis. Маркеры 2014: 6. DOI: 10.1155 / 2014/6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леклерк, Дж. Л., Блэкберн, С., Нил, Д., Мендес, Н. В., Уортон, Дж. А., Уотерс, М. Ф. и др. (2015). Фенотип гаптоглобина предсказывает развитие очагового и глобального церебрального вазоспазма и может влиять на исходы после аневризматического субарахноидального кровоизлияния. Proc. Natl. Акад. Sci. США 112, 1155–1160. DOI: 10.1073 / pnas.1412833112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Дж.Ю., Кип, Р. Ф., Хе, Ю., Сагер, О., Хуа, Ю., и Си, Г. (2010). Обработка гемоглобина и железа в головном мозге после субарахноидального кровоизлияния и влияние дефероксамина на раннее повреждение головного мозга. J. Cereb. Blood Flow Metab. 30, 1793–1803. DOI: 10.1038 / jcbfm.2010.137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Т. Х., Ким, С. У., Ю, С. Л., Ким, С. Х., Парк, Д. С., Мун, Х. Б. и др. (2003). Пероксиредоксин II необходим для поддержания продолжительности жизни эритроцитов у мышей. Кровь 101, 5033–5038. DOI: 10.1182 / кровь-2002-08-2548
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lehnardt, S. (2010). Врожденный иммунитет и нейровоспаление в ЦНС: роль микроглии в повреждении нейронов, опосредованном Toll-подобным рецептором. Glia 58, 253–263. DOI: 10.1002 / glia.20928
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леви, А., Леви, Дж. Э., Калет-Литман, С., Миллер-Лотан, Р., Леви, Н.С., Асаф Р. и др. (2006). Генотип гаптоглобина является детерминантой железа, перекисного окисления липидов и накопления макрофагов в атеросклеротической бляшке. Артериосклер. Тромб. Васк. Биол. 27, 134–140. DOI: 10.1161 / 01.ATV.0000251020.24399.a2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леви А. П., Аслех Р., Блюм С., Леви Н. С., Миллер-Лотан Р., Калет-Литман С. и др. (2010). Гаптоглобин: основные и клинические аспекты. Антиоксид. Редокс-сигнал. 12, 293–304. DOI: 10.1089 / ars.2009.2793
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леви А. П., Пурушотаман К. Р., Леви Н. С., Пурушотаман М., Штраус М., Аслех Р. и др. (2007). Подавление рецептора поглотителя гемоглобина у лиц с диабетом и генотипом Hp 2-2: последствия для реакции на кровоизлияние в бляшки и уязвимость бляшек. Circ. Res. 101, 106–110. DOI: 10.1161 / CIRCRESAHA.107.149435
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линь Т., Kwak, Y.H., Sammy, F., He, P., Thundivalappil, S., Sun, G., et al. (2010). Синергетическое воспаление индуцируется продуктами разложения крови с агонистами микробных Toll-подобных рецепторов и блокируется гемопексином. J. Infect. Дис. 202, 624–632. DOI: 10.1086 / 654929
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Липиски, М., Деуэл, Дж. У., Бэк, Дж. Х., Энгельсбергер, В. Р., Бюлер, П. В., и Шаер, Д. Дж. (2013). Гаптоглобиновые терапевтические средства, специфичные для фенотипа Hp1-1 и Hp2-2 человека, эффективны как in vitro , так и на морских свинках для ослабления токсичности гемоглобина. Антиоксид. Редокс-сигнал. 19, 1619–1633. DOI: 10.1089 / ars.2012.5089
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лиск К., Комински Д., Эрентраут С., Бонавентура Дж., Нусс Р., Хасселл К. и др. (2013). Индуцированная гемоглобином проницаемость эндотелиальных клеток частично регулируется с помощью механизма передачи сигналов, зависимого от гена 88 первичного ответа миелоидной дифференцировки. Am. J. Respir. Cell Mol. Биол. 49, 619–626. DOI: 10.1165 / rcmb.2012-0440OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лакке-Волд, Б.П., Логсдон, А.Ф., Маноранджан, Б., Тернер, Р.С., МакКоннелл, Э., Вейтс, Г.Э. и др. (2016). Аневризматическое субарахноидальное кровоизлияние и нейровоспаление: всесторонний обзор. Внутр. J. Mol. Sci. 17: 497. DOI: 10.3390 / ijms17040497
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, К., Чжоу, В., Янь, З., Цюй, М., и Бу, X. (2015). Толл-подобный рецептор 4 (TLR4) связан с церебральным вазоспазмом и отсроченной церебральной ишемией при аневризматическом субарахноидальном кровоизлиянии. Neurol. Med. Чир. 55, 878–884. DOI: 10.2176 / nmc.oa.2015-0077
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Macdonald, R. L., Higashida, R. T., Keller, E., Mayer, S. A., Molyneux, A., Raabe, A., et al. (2011). Клазосентан, антагонист рецепторов эндотелина, у пациентов с аневризматическим субарахноидальным кровотечением, подвергающимся хирургическому клипированию: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3 (СОЗНАНИЕ-2). Lancet Neurol. 10, 618–625.DOI: 10.1016 / S1474-4422 (11) 70108-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Матизен Т., Эднер Г., Ульфарссон Э. и Андерссон Б. (1997). Антагонист рецепторов интерлейкина-1 в спинномозговой жидкости и фактор некроза опухоли альфа после субарахноидального кровоизлияния. J. Neurosurg. 87, 215–220. DOI: 10.3171 / jns.1997.87.2.0215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Меламед-Франк, М., Лаше, О., Энав, Б.И., Шафранек Т., Леви Н.С., Риклис Р.М. и др. (2001). Структурно-функциональный анализ антиоксидантных свойств гаптоглобина. Кровь 98, 3693–3698. DOI: 10.1182 / blood.V98.13.3693
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер Ю. И., Алтаментова С. М., Шаклай Н. (1997). Окисление липопротеинов низкой плотности гемоглобином происходит из-за инициируемого гемом радикала глобина: антиоксидантная роль гаптоглобина. Биохимия 36, 12189–12198.DOI: 10.1021 / bi970258a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Moraes, L., Grille, S., Morelli, P., Mila, R., Trias, N., Brugnini, A., et al. (2015). Субпопуляции иммунных клеток спинномозговой жидкости и периферической крови пациентов с аневризматическим субарахноидальным кровоизлиянием. Springerplus 4: 195. DOI: 10.1186 / s40064-015-0970-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мори, Т., Нагата, К., Исида, Т., Никайдо, Х., Кобаяси, Э., Сасаки, Т. и др. (1994). Последовательные морфологические изменения сужающейся базилярной артерии на собачьей модели экспериментального церебрального вазоспазма путем инъекции талька. J. Vet. Med. Sci. 56, 535–540. DOI: 10.1292 / jvms.56.535
PubMed Аннотация | CrossRef Полный текст | Google Scholar
На, Н., Оуян, Дж., Таес, Ю. Э. и Деланге, Дж. Р. (2005). Концентрации свободного гемоглобина в сыворотке крови у здоровых людей связаны с типом гаптоглобина. Clin. Chem. 51, 1754–1755. DOI: 10.1373 / Clinchem.2005.055657
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нагабабу Э., Крест Ф. Дж. И Рифкинд Дж. М. (2003). Вызванная перекисью водорода деградация гема в красных кровяных тельцах: защитная роль каталазы и глутатионпероксидазы. Biochim. Биофиз. Acta 1620, 211–217. DOI: 10.1016 / S0304-4165 (02) 00537-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нагата, К., Сасаки, Т., Мори, Т., Никайдо, Х., Кобаяси, Э., Ким, П. и др. (1996). Цистернальная инъекция талька собаке может вызвать замедленное и продолжительное сужение артерии, морфологически и фармакологически напоминающее церебральный вазоспазм. Surg. Neurol. 45, 442–447. DOI: 10.1016 / 0090-3019 (95) 00455-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нил-Дуайер, Г., Ланг, Д. А., Доши, Б., Гербер, К. Дж., И Смит, П. В. (1994). Отсроченная церебральная ишемия: патологический субстрат. Acta Neurochir. 131, 137–145. DOI: 10.1007 / BF01401464
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ohnishi, H., Iihara, K., Kaku, Y., Yamauchi, K., Fukuda, K., Nishimura, K., et al. (2013). Фенотип гаптоглобина предсказывает церебральный вазоспазм и клиническое ухудшение после аневризматического субарахноидального кровоизлияния. J. Stroke Cerebrovasc. Дис. 22, 520–526. DOI: 10.1016 / j.jstrokecerebrovasdis.2013.02.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Окада, Т., и Сузуки, Х. (2017). Толл-подобный рецептор 4 как возможная терапевтическая мишень для замедленных повреждений головного мозга после аневризматического субарахноидального кровоизлияния. Neural Regen. Res. 12, 193–196. DOI: 10.4103 / 1673-5374.200795
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Олсон, Дж. К., и Миллер, С. Д. (2004). Микроглия инициирует врожденные и адаптивные иммунные ответы центральной нервной системы через несколько TLR. J. Immunol. 173, 3916–3924. DOI: 10.4049 / jimmunol.173.6.3916
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пантер С. С., Садрзаде С. М., Халлавей П. Э., Хейнс Дж. Л., Андерсон В. Э. и Итон Дж. У. (1985). Гипогаптоглобинемия, связанная с семейной эпилепсией. J. Exp. Med. 161, 748–754. DOI: 10.1084 / jem.161.4.748
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Paschoal, F. M. Jr., de Almeida Lins, Ronconi, K., de Lima Oliveira, M., Nogueira Rde, C., Paschoal, E.Х., Тейшейра, М. Дж. И др. (2015). Эмболические сигналы во время рутинной транскраниальной допплерографии при аневризматическом субарахноидальном кровоизлиянии. Biomed Res. Int. 2015: 153714. DOI: 10.1155 / 2015/153714
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пелтонен, С., Ювела, С., Касте, М., и Лассила, Р. (1997). Активация гемостаза и фибринолиза после субарахноидального кровоизлияния. J. Neurosurg. 87, 207–214. DOI: 10.3171 / jns.1997.87.2.0207
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петерсон, Э.У. и Кардосо Э. Р. (1983a). Гематоэнцефалический барьер после экспериментального субарахноидального кровоизлияния. Часть 1: реакция на инсульт, вызванный артериальной гипертензией. J. Neurosurg. 58, 338–344. DOI: 10.3171 / jns.1983.58.3.0338
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Петерсон, Э. У., и Кардосо, Э. Р. (1983b). Гематоэнцефалический барьер после экспериментального субарахноидального кровоизлияния. Часть 2: ответ на вливание хлорида ртути. J. Neurosurg. 58, 345–351. DOI: 10.3171 / jns.1983.58.3.0345
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Pircher, J., Merkle, M., Wornle, M., Ribeiro, A., Czermak, T., Stampnik, Y., et al. (2012). Протромботические эффекты фактора некроза опухоли альфа in vivo усиливаются отсутствием рецептора TNF-альфа подтипа 1 и требуют рецептора TNF-альфа подтипа 2. Arthritis Res. Ther. 14: R225. DOI: 10.1186 / ar4064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Плута, р.М. (2005). Отсроченный церебральный вазоспазм и оксид азота: обзор, новая гипотеза и предлагаемое лечение. Pharmacol. Ther. 105, 23–56. DOI: 10.1016 / j.pharmthera.2004.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Плута, Р. М. (2006). Дисфункция синтаз оксида азота как причина и терапевтическая цель замедленного церебрального вазоспазма после САК. Neurol. Res. 28, 730–737. DOI: 10.1179 / 016164106X152052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Плута, р.М., Деджам, А., Граймс, Г., Гладвин, М. Т., и Олдфилд, Э. Х. (2005). Инфузии нитритов для предотвращения замедленного церебрального вазоспазма на модели субарахноидального кровоизлияния приматов. JAMA 293, 1477–1484. DOI: 10.1001 / jama.293.12.1477
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Прадилла, Г., Чайчана, К. Л., Хоанг, С., Хуанг, Дж., И Тамарго, Р. Дж. (2010). Воспаление и церебральный вазоспазм после субарахноидального кровоизлияния. Neurosurg. Clin. N. Am. 21, 365–379. DOI: 10.1016 / j.nec.2009.10.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Прадилла, Г., Тай, К. А., Леньяни, Ф. Г., Хсу, В., Кретцер, Р. М., Ван, П. П. и др. (2004). Задержка внутричерепной доставки донора оксида азота из полимера с контролируемым высвобождением предотвращает экспериментальный церебральный вазоспазм у кроликов. Нейрохирургия 55, 1393–1399; обсуждение: 9–400. DOI: 10.1227 / 01.NEU.0000143615.26102.1A
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Provencio, J.Дж., Фу, X., Сиу, А., Расмуссен, П. А., Хазен, С. Л., и Рансохофф, Р. М. (2010). Нейтрофилы спинномозговой жидкости участвуют в развитии вазоспазма при субарахноидальном кровоизлиянии. Neurocrit. Care 12, 244–251. DOI: 10.1007 / s12028-009-9308-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Провенсио, Дж. Дж., Суонк, В., Лу, Х., Брюне, С., Балтан, С., Хапре, Р. В. и др. (2016). Истощение нейтрофилов после субарахноидального кровоизлияния улучшает память через рецепторы NMDA. Brain Behav. Иммун. 54, 233–242. DOI: 10.1016 / j.bbi.2016.02.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пурушотаман, К. Р., Пурушотаман, М., Леви, А. П., Ленто, П. А., Эврард, С., Ковачич, Дж. К. и др. (2012). Повышенная экспрессия специфичных для окисления эпитопов и апоптоз связаны с генотипом гаптоглобина: возможные последствия для прогрессирования бляшек при атеросклерозе человека. J. Am. Coll. Кардиол. 60, 112–119.DOI: 10.1016 / j.jacc.2012.04.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ramchand, P., Nyirjesy, S., Frangos, S., Doerfler, S., Nawalinski, K., Quattrone, F., et al. (2016). Параметр тромбоэластографии позволяет прогнозировать исход после субарахноидального кровоизлияния: исследовательский анализ. World Neurosurg. 96, 215–221. DOI: 10.1016 / j.wneu.2016.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рэй, В. З., Стром, Р.Г., Блэкберн, С. Л., Эшли, В. У., Сикард, Г. А., и Рич, К. М. (2009). Заболеваемость тромбозом глубоких вен после субарахноидального кровоизлияния. J. Neurosurg. 110, 1010–1014. DOI: 10.3171 / 2008.9.JNS08107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ресинос, П. Ф., Прадилла, Г., Тай, К. А., Перес, М., Хдейб, А. М., и Тамарго, Р. Дж. (2006). Контролируемое высвобождение липополисахарида в субарахноидальное пространство кроликов вызывает хронический вазоспазм в отсутствие крови. Surg. Neurol. 66, 463–469; обсуждение: 469. doi: 10.1016 / j.surneu.2006.04.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рифкинд, Дж. М., Моханти, Дж. Г., и Нагабабу, Э. (2014). Патофизиология внеклеточного гемоглобина связана с усилением окислительных реакций. Фронт. Physiol. 5: 500. DOI: 10.3389 / fphys.2014.00500
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рогин, А., Кох, В., Кастрати, А., Аронсон Д., Шомиг А. и Леви А. П. (2003). Генотип гаптоглобина позволяет прогнозировать серьезные побочные эффекты со стороны сердца в течение 1-летнего периода после чрескожной транслюминальной коронарной ангиопластики у лиц с диабетом. Уход за диабетом 26, 2628–2631. DOI: 10.2337 / diacare.26.9.2628
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Романо, Дж. Г., Фортеза, А. М., Конча, М., Кох, С., Херос, Р. К., Моркос, Дж. Дж. И др. (2002). Обнаружение микроэмболов с помощью транскраниальной допплерографии при аневризматическом субарахноидальном кровоизлиянии. Нейрохирургия 50, 1026–1030; обсуждение: 30–31. DOI: 10.1097 / 00006123-200205000-00016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Розенгарт, А. Дж., Шультайс, К. Э., Толентино, Дж., И Макдональд, Р. Л. (2007). Факторы прогноза исхода у пациентов с аневризматическим субарахноидальным кровоизлиянием. Инсульт 38, 2315–2321. DOI: 10.1161 / STROKEAHA.107.484360
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рози, С., Рамирес-Амайя, В., Хаусс-Вегжиняк, Б., и Венк, Г. Л. (2004). Хроническое воспаление головного мозга приводит к снижению рецепторов NMDA-R1 в гиппокампе. J. Нейровоспаление 1:12. DOI: 10.1186 / 1742-2094-1-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сабри, М., Ай, Дж., Лакович, К., Д’Аббонда, Дж., Илодигве, Д., и Макдональд, Р. Л. (2012). Механизмы образования микротромбов после экспериментального субарахноидального кровоизлияния. Неврология 224: 26–37.DOI: 10.1016 / j.neuroscience.2012.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сабри, М., Ай, Дж., Ласс, Э., Д’Аббонданса, Дж., И Макдональд, Р. Л. (2013a). Генетическое устранение eNOS снижает вторичные осложнения экспериментального субарахноидального кровоизлияния. J. Cereb. Blood Flow Metab. 33, 1008–1014. DOI: 10.1038 / jcbfm.2013.49
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сабри М., Ласс Э. и Макдональд Р.Л. (2013б). Раннее повреждение головного мозга: общий механизм субарахноидального кровоизлияния и глобальной ишемии головного мозга. Stroke Res. Удовольствие. 2013: 394036. DOI: 10.1155 / 2013/394036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Садрзаде, С. М., Граф, Э., Пантер, С. С., Халлавей, П. Э. и Итон, Дж. У. (1984). Гемоглобин. Биологический реактив фентона. J. Biol. Chem. 259, 14354–14356.
PubMed Аннотация | Google Scholar
Шаер, К.A., Deuel, J. W., Bittermann, A. G., Rubio, I. G., Schoedon, G., Spahn, D. R., et al. (2013). Механизмы защиты гаптоглобина от перекисного окисления гемоглобина запускают повреждение эндотелия. Cell Death Differ. 20, 1569–1579. DOI: 10.1038 / cdd.2013.113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schaer, C.A., Deuel, J. W., Schildknecht, D., Mahmoudi, L., Garcia-Rubio, I., Owczarek, C., et al. (2016). Гаптоглобин сохраняет передачу сигналов оксида азота в сосудах во время гемолиза. Am. J. Respir. Крит. Care Med. 193, 1111–1122. DOI: 10.1164 / rccm.201510-2058OC
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаер, Д. Дж., Бюлер, П. В., Алаяш, А. И., Белчер, Дж. Д., Верчеллотти, Г. М. (2013). Еще раз о гемолизе и свободном гемоглобине: изучение гемоглобина и поглотителей гемина как нового класса терапевтических белков. Кровь 121, 1276–1284. DOI: 10.1182 / кровь-2012-11-451229
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаер, Д.Дж., Винчи, Ф., Инголия, Г., Толозано, Э. и Бюлер, П. В. (2014). Гаптоглобин, гемопексин и родственные пути защиты — фундаментальная наука, клинические перспективы и разработка лекарств. Фронт. Physiol. 5: 415. DOI: 10.3389 / fphys.2014.00415
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шнайдер, У. С., Давидс, А. М., Бранденбург, С., Мюллер, А., Эльке, А., Магрини, С., и др. (2015). Микроглия вызывает отложенное повреждение головного мозга после субарахноидального кровоизлияния. Acta Neuropathol. 130, 215–231. DOI: 10.1007 / s00401-015-1440-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шуберт, Г. А., Зеиз, М., Хегевальд, А. А., Манвилл, Дж., И Том, К. (2011). Гипоперфузия в острой фазе субарахноидального кровоизлияния. Acta Neurochir. Дополнение 110 (Pt 1), 35–38. DOI: 10.1007 / 978-3-7091-0353-1_6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сехба, Ф. А., Хоу, Дж., Плута, Р.М., Чжан Дж. Х. (2012). Важность ранней черепно-мозговой травмы после субарахноидального кровоизлияния. Прог. Neurobiol. 97, 14–37. DOI: 10.1016 / j.pneurobio.2012.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сехба, Ф. А., Мостафа, Г., Фридрих, В. мл., И Бедерсон, Дж. Б. (2005). Острая микрососудистая агрегация тромбоцитов после субарахноидального кровоизлияния. J. Neurosurg. 102, 1094–1100. DOI: 10.3171 / jns.2005.102.6.1094
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сехба, Ф.А., Мостафа, Г., Кнопман, Дж., Фридрих, В. мл., И Бедерсон, Дж. Б. (2004). Острые изменения в базальной пластинке микрососудов после субарахноидального кровоизлияния. J. Neurosurg. 101, 633–640. DOI: 10.3171 / jns.2004.101.4.0633
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сехба, Ф. А., Шварц, А. Ю., Черешнев, И., Бедерсон, Дж. Б. (2000). Резкое снижение уровня оксида азота в мозге после субарахноидального кровоизлияния. J. Cereb. Blood Flow Metab. 20, 604–611. DOI: 10.1097 / 00004647-200003000-00018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sertório, J. T., Lacchini, R., Amaral, L. M., Palei, A. C., Cavalli, R. C., Sandrim, V. C., et al. (2013). Полиморфизм гаптоглобина влияет на биодоступность оксида азота при преэклампсии. J. Hum. Гипертоническая болезнь. 27, 349–354. DOI: 10.1038 / jhh.2012.57
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ши П.А., Цой Э., Chintagari, N. R., Nguyen, J., Guo, X., Yazdanbakhsh, K., et al. (2016). Продолжительное лечение серповидно-клеточных мышей гаптоглобином увеличивает экспрессию HO-1 и H-ферритина и снижает отложение железа в почках без улучшения функции почек. Br. J. Haematol. 175, 714–723. DOI: 10.1111 / bjh.14280
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шигено Т., Фричка Э., Брок М., Шрамм Дж., Шигено С. и Червос-Наварро Дж. (1982).Отек мозга после экспериментального субарахноидального кровоизлияния. Инсульт 13, 368–379. DOI: 10.1161 / 01.STR.13.3.368
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Siironen, J., Juvela, S., Varis, J., Porras, M., Poussa, K., Ilveskero, S., et al. (2003). Отсутствие влияния эноксапарина на исход аневризматического субарахноидального кровоизлияния: рандомизированное двойное слепое плацебо-контролируемое клиническое исследование. J. Neurosurg. 99, 953–959. DOI: 10.3171 / jns.2003.99.6.0953
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сильва, Г., Джени, В., Хора, А., Ларсен, Р., Балла, Дж., И Соарес, М. П. (2009). Окисленный гемоглобин является эндогенным провоспалительным агонистом, нацеленным на эндотелиальные клетки сосудов. J. Biol. Chem. 284, 29582–29595. DOI: 10.1074 / jbc.M109.045344
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Симард, Дж. М., Олдрич, Э. Ф., Шрейбман, Д., Джеймс, Р. Ф., Полифка, А., и Бити, Н. (2013). Внутривенное вливание низких доз гепарина пациентам с аневризматическим субарахноидальным кровоизлиянием: предварительная оценка. J. Neurosurg. 119, 1611–1619. DOI: 10.3171 / 2013.8.JNS1337
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стегмайр Б., Эрикссон М. и Асплунд К. (2004). Снижение смертности от субарахноидального кровоизлияния: изменения в заболеваемости и летальности с 1985 по 2000 год. Инсульт 35, 2059–2063. DOI: 10.1161 / 01.STR.0000138451.07853.b6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стейн, С. К., Браун, К. Д., Чен, X. Х., Смит, Д. Х., и Грэм, Д. И. (2006). Тромбоэмболия и отсроченная ишемия головного мозга после субарахноидального кровоизлияния: исследование аутопсии. Нейрохирургия 59, 781–787; обсуждение: 7–8. DOI: 10.1227 / 01.NEU.0000227519.27569.45
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сунь, Б. Л., Чжан, С. М., Ся, З.Л., Ян, М. Ф., Юань, Х., Чжан, Дж. И др. (2003). L-аргинин улучшает перфузию церебральной крови и вазодвигание микрососудов после субарахноидального кровоизлияния у крыс. Clin. Гемореол. Microcirc. 29, 391–400.
PubMed Аннотация | Google Scholar
Sun, J., Feng, A., Zhang, Y., Sun, S., Hu, W., Yang, M., et al. (2010). Фукоидан увеличивает TNF-альфа-индуцированную секрецию ММР-9 в моноцитарной клеточной линии U937. Inflamm. Res. 59, 271–276. DOI: 10.1007 / s00011-009-0095-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Suzuki, H., Хасегава, Ю., Чен, В., Канамару, К., и Чжан, Дж. Х. (2010). Рекомбинантный остеопонтин при церебральном вазоспазме после субарахноидального кровоизлияния. Ann. Neurol. 68, 650–660. DOI: 10.1002 / ana.22102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сузуки, С., Кимура, М., Сума, М., Окима, Х., Симидзу, Т., и Ивабучи, Т. (1990). Церебральный микротромбоз при симптоматическом церебральном вазоспазме — количественное гистологическое исследование при аутопсии. Neurol. Med.Чир. 30, 309–316. DOI: 10.2176 / nmc.30.309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Терри К. М., Кликеман Дж. А., Хойдал Дж. Р. и Каллахан К. С. (1998). Влияние фактора некроза опухоли-альфа и интерлейкина-1 альфа на экспрессию гемоксигеназы-1 в эндотелиальных клетках человека. Am. J. Physiol. 274 (3 Pt 2), H883 – H891.
PubMed Аннотация
Томсен, Дж. Х., Этцеродт, А., Свендсен, П., и Моэструп, С. К. (2013).Путь гаптоглобин-CD163-гемоксигеназа-1 для удаления гемоглобина. Оксид. Med. Клетка. Longev. 2013: 523652. DOI: 10.1155 / 2013/523652
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тобиник, Э. (2009). Модуляция фактора некроза опухоли для лечения болезни Альцгеймера: обоснование и текущие данные. Препараты для ЦНС 23, 713–725. DOI: 10.2165 / 11310810-000000000-00000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Туиз, Р.М., и Шиффрин, Э. Л. (2004). Реактивные формы кислорода в биологии сосудов: значение при гипертонии. Histochem. Cell Biol. 122, 339–352. DOI: 10.1007 / s00418-004-0696-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валлелиан Ф., Пименова Т., Перейра К. П., Абрахам Б., Миколайчик М. Г., Шодон Г. и др. (2008). Реакция перекиси водорода с гемоглобином вызывает обширное сшивание альфа-глобина и ухудшает взаимодействие гемоглобина с эндогенными путями скавенджера. Free Radic. Биол. Med. 45, 1150–1158. DOI: 10.1016 / j.freeradbiomed.2008.07.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валоне Ф. Х. и Эпштейн Л. Б. (1988). Синтез двухфазного фактора активации тромбоцитов моноцитами человека, стимулированного ИЛ-1-бета, фактором некроза опухоли или ИФН-гамма. J. Immunol. 141, 3945–3950.
Google Scholar
van den Bergh, W. M., Group, M. S., Algra, A., Dorhout Mees, S. M., van Kooten, F., Dirven, C.M., et al. (2006). Рандомизированное контролируемое исследование ацетилсалициловой кислоты при аневризматическом субарахноидальном кровоизлиянии: исследование MASH. Инсульт 37, 2326–2330. DOI: 10.1161 / 01.STR.0000236841.16055.0f
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vecchione, C., Frati, A., Di Pardo, A., Cifelli, G., Carnevale, D., Gentile, M. T., et al. (2009). Фактор некроза опухоли альфа опосредует вызванное гемолизом сужение сосудов и церебральный вазоспазм, вызванный субарахноидальным кровоизлиянием. Гипертония 54, 150–156. DOI: 10.1161 / HYPERTENSIONAHA.108.128124
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vergouwen, M. D., Vermeulen, M., Coert, B.A., Stroes, E. S., and Roos, Y. B. (2008). Микротромбоз после аневризматического субарахноидального кровоизлияния: дополнительное объяснение отсроченной ишемии головного мозга. J. Cereb. Blood Flow Metab. 28, 1761–1770. DOI: 10.1038 / jcbfm.2008.74
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Винчи, Ф., Коста да Силва, М., Инголья, Г., Петрилло, С., Бринкман, Н., Цуэрчер, А. и др. (2016). Терапия гемопексином восстанавливает индуцированное гемом провоспалительное фенотипическое переключение макрофагов на мышиной модели серповидно-клеточной анемии. Кровь 127, 473–486. DOI: 10.1182 / кровь-2015-08-663245
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vormittag, R., Vukovich, T., Mannhalter, C., Minar, E., Schönauer, V., Bialonczyk, C., et al. (2005). Фенотип гаптоглобина 2-2 как потенциально новый фактор риска спонтанной венозной тромбоэмболии. Haematologica 90, 1557–1561.
PubMed Аннотация | Google Scholar
Винтроб М. М. и Грир Дж. П. (2004). Клиническая гематология Винтроба, 11-е изд. . Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс.
Woitzik, J., Dreier, J. P., Hecht, N., Fiss, I., Sandow, N., Major, S., et al. группа Cs. (2012). Отсроченная ишемия головного мозга и распространяющаяся деполяризация при отсутствии ангиографического спазма сосудов после субарахноидального кровоизлияния. Дж.Цереб. Blood Flow Metab. 32, 203–212. DOI: 10.1038 / jcbfm.2011.169
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Си, Г., Кип, Р. Ф., и Хофф, Дж. Т. (1998). Эритроциты и замедленное формирование отека мозга после внутримозгового кровоизлияния у крыс. J. Neurosurg. 89, 991–996. DOI: 10.3171 / jns.1998.89.6.0991
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямамото, К., Симокава, Т., Кодзима, Т., Лоскутофф, Д.Дж. И Сайто Х. (1999). Регулирование экспрессии гена протеина С мыши in vivo : эффекты фактора некроза опухоли-альфа, интерлейкина-1 и трансформирующего фактора роста-бета. Тромб. Гемост. 82, 1297–1301. DOI: 10.1055 / с-0037-1614379
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Захария, Б.Е., Хикман, З.Л., Гробельный, Б.Т., ДеРоса, П., Котчетков, И., Дюкру, А.Ф. и др. (2010). Эпидемиология аневризматического субарахноидального кровоизлияния. Neurosurg. Clin. N. Am. 21, 221–233. DOI: 10.1016 / j.nec.2009.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhao, X., Song, S., Sun, G., Strong, R., Zhang, J., Grotta, J.C., et al. (2009). Нейропротекторная роль гаптоглобина после внутримозгового кровоизлияния. J. Neurosci. 29, 15819–15827. DOI: 10.1523 / JNEUROSCI.3776-09.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, X., Сунь, Г., Чжан, Дж., Стронг, Р., Дэш, П. К., Кан, Ю. В. и др. (2007). Фактор транскрипции Nrf2 защищает мозг от повреждений, вызванных внутримозговым кровоизлиянием. Инсульт 38, 3280–3286. DOI: 10.1161 / STROKEAHA.107.486506
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаптоглобин
Изображения: Ссылки по теме на внешние сайты (из Bing)
Онтология: Гаптоглобины (C0018595)
| Определение (CSP) | гликопротеин крови, обнаруженный во фракции альфа-глобулина, который связывает свободный гемоглобин. |
| Определение (MSH) | Гликопротеины плазмы, которые образуют стабильный комплекс с гемоглобином, способствуют переработке гемового железа. У человека они кодируются геном на коротком плече хромосомы 16. |
| Концепции | Биологически активное вещество ( T123 ) , Аминокислота, пептид или белок ( T116 ) |
| МСХ | D006242 |
| SnomedCT | 85294008 |
| LNC | LP16411-8, MTHU013894 |
| Английский | Гаптоглобин, гаптоглобины, гаптоглобины [химические вещества / ингредиенты], гаптоглобин, гаптоглобины, Hp — гаптоглобин, гаптоглобин (вещество), гаптоглобин, NOS |
| шведский | Гаптоглобинер |
| Чешский | гаптоглобины |
| финский | Гаптоглобинит |
| Итальянский | Аптоглобина, Аптоглобина |
| Русский | ГАПТОГЛОБИНЫ, ГАПТОГЛОБИНЫ |
| Японский | ハ プ ト グ ロ ビ ン |
| Французский | Гаптоглобины |
| Хорватский | HAPTOGLOBINI |
| Польский | Гаптоглобины |
| Испанский | гаптоглобина (сустансия), гаптоглобина, гаптоглобинас |
| немецкий | Гаптоглобин |
| Португальский | Гаптоглобина |
Анализ крови на гаптоглобин | Vancouver Sun
Содержание статьи
Анализ крови на гаптоглобин измеряет уровень гаптоглобина в крови.
Гаптоглобин — это белок, вырабатываемый печенью. Он прикрепляется к определенному типу гемоглобина в крови. Гемоглобин — это белок клеток крови, переносящий кислород.
Как проводится тест
Требуется образец крови.
Как подготовиться к тесту
Некоторые лекарства могут повлиять на результаты этого теста. Ваш лечащий врач сообщит вам, нужно ли вам прекратить прием каких-либо лекарств.НЕ прекращайте прием лекарств, пока не поговорите со своим врачом.
Лекарства, которые могут повысить уровень гаптоглобина, включают:
Лекарства, которые могут снизить уровень гаптоглобина, включают:
- Противозачаточные таблетки
- Хлорпромазин
- Дифенгидрамин
- Иммунной гемолитической анемией
- Долгосрочным (хроническим) заболеванием печени
- Скоплением крови под кожей (гематомой)
- Заболеванием печени
- Реакцией на переливание крови
- Обильное кровотечение
- Обморок или головокружение
- Множественные проколы для поиска вен
- Гематома (скопление крови под кожей)
- Инфекция (небольшой риск каждый раз, когда кожа порвана)
- 1.
Мюррей С.Дж., Вос Т., Лозано Р., Нагави М., Флаксман А.Д., Мишо К., Эззати М., Шибуя К., Саломон Дж. А., Абдалла С. и др. Годы жизни с поправкой на инвалидность (DALY) для 291 болезни и травмы в 21 регионе, 1990–2010 годы: систематический анализ для исследования глобального бремени болезней 2010. Lancet. 2012. 380 (9859): 2197–223.
PubMed Статья Google Scholar
- 2.
Gu K, Cowie CC, Harris MI. Смертность среди взрослых с диабетом и без него в национальной когорте США.С. Население, 1971–1993 гг. Уход за диабетом. 1998. 21 (7): 1138–45.
CAS PubMed Статья Google Scholar
- 3.
Ньюман Дж. Д., Шварцбард Аризона, Вайнтрауб Х. С., Гольдберг И. Дж., Бергер Дж. С.. Первичная профилактика сердечно-сосудистых заболеваний при сахарном диабете. J Am Coll Cardiol. 2017; 70 (7): 883–93.
PubMed PubMed Central Статья Google Scholar
- 4.
Меллбин Л.Г., Ансельмино М., Райден Л.Диабет, преддиабет и сердечно-сосудистый риск. Eur J Cardiovasc Назад Rehabil. 2010; 17 (Приложение 1): S9–14.
PubMed Статья Google Scholar
- 5.
Bao X, Borne Y, Johnson L, Muhammad IF, Persson M, Niu K, Engstrom G. Сравнение воспалительных профилей заболеваемости сахарным диабетом и сердечно-сосудистыми заболеваниями: проспективное исследование, изучающее гипотезу «общей почвы» . Кардиоваск Диабетол. 2018; 17 (1): 87.
PubMed PubMed Central Статья Google Scholar
- 6.
Иджас П., Сакси Дж., Соинне Л., Туймала Дж., Яухиайнен М., Юла А., Кахонен М., Кесаниеми Ю. А., Кованен П. Т., Касте М. и др. Аллель гаптоглобина 2 ассоциирован с нестабильной каротидной бляшкой и серьезными сердечно-сосудистыми событиями. Атеросклероз. 2013. 230 (2): 228–34.
CAS PubMed Статья Google Scholar
- 7.
Далан Р., Лью Х., Го Л.Л., Гао Х, Чу Д.Э., Бем Б.О., Леов М.К. Генотип гаптоглобина 2-2 связан с воспалением и толщиной интима-медиа сонной артерии.Diabetes Vasc Dis Res. 2016; 13 (5): 373–6.
CAS Статья Google Scholar
- 8.
Орчард Т.Дж., Баклунд Дж.С., Костаку Т., Клири П., Лопес-Вирелла М., Леви А.П., Лачин Дж. М., Группа DER. Генотип гаптоглобина 2-2 и риск ишемической болезни сердца в исследовании «Контроль диабета и осложнения» / «Эпидемиология вмешательств и осложнений диабета» (DCCT / EDIC). J Осложнения диабета. 2016; 30 (8): 1577–84.
PubMed PubMed Central Статья Google Scholar
- 9.
Янсен Х., Самани Н.Дж., Шункерт Х. Менделирующие рандомизационные исследования ишемической болезни сердца. Eur Heart J. 2014; 35 (29): 1917–24.
CAS PubMed Статья Google Scholar
- 10.
Хименес-Росалес А., Амая-Чавес А., Домингес Гарсиа М.В., Камарилло-Ромеро Е., Уитрон Браво Г.Г., Крус А.М. Ассоциация биомаркеров воспалительного и окислительного стресса у субъектов с сердечно-сосудистым риском. Am J Ther. 2013. 20 (4): 422–31.
PubMed Статья Google Scholar
- 11.
Xuan Y, Gao X, Holleczek B, Brenner H, Schottker B. Прогнозирование инфаркта миокарда, инсульта и сердечно-сосудистой смертности с помощью биомаркеров окислительного стресса в моче: результаты большого когортного исследования. Int J Cardiol. 2018; 273: 223–9. https://doi.org/10.1016/j.ijcard.2018.08.002
PubMed Статья Google Scholar
- 12.
Ван С., Ван Дж., Чжан Р., Ван Т., Янь Д., Хэ З., Цзян Ф., Ху Ц., Цзя В.Менделирующий рандомизационный анализ для оценки причинного влияния гаптоглобина на макроангиопатию у пациентов с сахарным диабетом 2 типа в Китае. Кардиоваск Диабетол. 2018; 17 (1): 14.
PubMed PubMed Central Статья Google Scholar
- 13.
Andersen CBF, Stodkilde K, Saederup KL, Kuhlee A, Raunser S, Graversen JH, Moestrup SK. Гаптоглобин. Антиоксидный окислительно-восстановительный сигнал. 2017; 26 (14): 814–31.
CAS PubMed Статья Google Scholar
- 14.
Alayash AI, Andersen CB, Moestrup SK, Bulow L. Гаптоглобин: детоксификатор гемоглобина в плазме. Trends Biotechnol. 2013; 31 (1): 2–3.
CAS PubMed Статья Google Scholar
- 15.
Джан У, Бююкинан М., Гузелант А., Угур А., Караибрахимоглу А., Ябанджун С. Исследование воспалительных биомаркеров метаболического синдрома у подростков. J Pediatr Endocrinol Metab. 2016; 29 (11): 1277–83.
CAS PubMed Google Scholar
- 16.
Awadallah S, Madkour M, Hamidi RA, Alwafa EA, Hattab M, Zakkour B, Al-Matroushi A, Ahmed E, Al-Kitbi M. Уровни аполипопротеина A1 и лецитина в плазме: холестерин-ацилтрансфераза при сахарном диабете 2 типа: корреляция с фенотипы гаптоглобина. Синдр диабета. 2017; 11 (Приложение 2): S543–6.
PubMed Статья Google Scholar
- 17.
Меландер О., Модрего Дж., Заморано-Леон Дж. Дж., Сантос-Санчо Дж. М., Лахера В., Лопес-Фарре А. Дж..Новые циркулирующие биомаркеры для прогнозирования смерти от сердечно-сосудистых заболеваний у здорового населения. J Cell Mol Med. 2015; 19 (10): 2489–99.
CAS PubMed PubMed Central Статья Google Scholar
- 18.
Cigliano L, Pugliese CR, Spagnuolo MS, Palumbo R, Abrescia P. Гаптоглобин связывает антиатерогенный белок аполипопротеин E — нарушение аполипопротеина E — стимуляция как лецитин: холестерин-ацилтрансферазы, так и активности холестерин-ацилтрансферазы, а также холестерин-ацилтрансферазы.FEBS J. 2009; 276 (21): 6158–71.
CAS PubMed Статья Google Scholar
- 19.
Сас К.М., Карновский А., Михайлидис Г., Пеннатур С. Метаболомика и диабет: аналитические и вычислительные подходы. Сахарный диабет. 2015; 64 (3): 718–32.
CAS PubMed PubMed Central Статья Google Scholar
- 20.
Ньюгард CB. Метаболомика и метаболические заболевания: где мы находимся? Cell Metab.2017; 25 (1): 43–56.
CAS PubMed Статья Google Scholar
- 21.
Джонсон Ч., Иванишевич Дж., Сюздак Г. Метаболомика: за пределами биомаркеров и к механизмам. Nat Rev Mol Cell Biol. 2016; 17 (7): 451–9.
CAS PubMed PubMed Central Статья Google Scholar
- 22.
Лу Дж., Се Дж., Цзя В., Цзя В. Метаболомика в исследовании диабета 2 типа у людей.Front Med. 2013; 7 (1): 4–13.
PubMed Статья Google Scholar
- 23.
Klupczynska A, Derezinski P, Kokot ZJ. Метаболомика в медицинских науках — тенденции, проблемы и перспективы. Acta Pol Pharm. 2015. 72 (4): 629–41.
CAS PubMed Google Scholar
- 24.
Чен П., Хоу Х, Ху Г, Вэй Л., Цзяо Л., Ван Х, Чен С., Ву Дж, Бао И, Цзя В. Подкожная жировая ткань брюшной полости: благоприятное жировое депо для диабета? Кардиоваск Диабетол.2018; 17 (1): 93.
PubMed PubMed Central Статья Google Scholar
- 25.
Qiu Y, Zhou B, Su M, Baxter S, Zheng X, Zhao X, Yen Y, Jia W. Количественная метаболомика на основе масс-спектрометрии выявила отчетливый липидный профиль у пациентов с раком груди. Int J Mol Sci. 2013. 14 (4): 8047–61.
PubMed PubMed Central Статья Google Scholar
- 26.
Сухре К., Раффлер Дж., Кастенмюллер Г. Биохимические выводы из популяционных исследований с помощью генетики и метаболомики. Arch Biochem Biophys. 2016; 589: 168–76.
CAS PubMed Статья Google Scholar
- 27.
Молнос С., Валь С., Хайд М., Икхофф ЭМВ, Пул R, Флогель А., Дилен Дж., Муч Д., Прен С., Брейер М. и др. Соотношения метаболитов как потенциальные биомаркеры диабета 2 типа: ПРЯМОЕ исследование. Диабетология. 2018; 61 (1): 117–29.
CAS PubMed Статья Google Scholar
- 28.
Stegemann C, Pechlaner R, Willeit P, Langley SR, Mangino M, Mayr U, Menni C, Moayyeri A, Santer P, Rungger G, et al. Липидомический профиль и риск сердечно-сосудистых заболеваний в проспективном популяционном исследовании Bruneck. Тираж. 2014. 129 (18): 1821–31.
CAS PubMed Статья Google Scholar
- 29.
Wang Z, Klipfell E, Bennett BJ, Koeth R, Levison BS, Dugar B, Feldstein AE, Britt EB, Fu X, Chung YM, et al. Метаболизм фосфатидилхолина в кишечной флоре способствует развитию сердечно-сосудистых заболеваний. Природа. 2011. 472 (7341): 57–63.
CAS PubMed PubMed Central Статья Google Scholar
- 30.
Glomset JA. Механизм реакции этерификации холестерина в плазме: трансфераза жирных кислот плазмы. Biochim Biophys Acta.1962; 65: 128–35.
CAS PubMed Статья Google Scholar
- 31.
Chen L, Liang B, Froese DE, Liu S, Wong JT, Tran K, Hatch GM, Mymin D, Kroeger EA, Man RY, et al. Окислительная модификация липопротеинов низкой плотности у нормальных и гиперлипидемических пациентов: влияние композиции лизофосфатидилхолина на расслабление сосудов. J Lipid Res. 1997. 38 (3): 546–53.
CAS PubMed Google Scholar
- 32.
Oka H, Kugiyama K, Doi H, Matsumura T, Shibata H, Miles LA, Sugiyama S, Yasue H. Лизофосфатидилхолин индуцирует активатор плазминогена урокиназного типа и его рецептор в макрофагах человека частично через окислительно-восстановительный путь. Артериосклер Thromb Vasc Biol. 2000. 20 (1): 244–50.
CAS PubMed Статья Google Scholar
- 33.
Ким М., Юнг С., Ким С.И., Ли С.Х., Ли Дж.Х. Связанное с прегипертензией повышение уровня циркулирующих лизофосфатидлихолинов, активность Lp-PLA2 и окислительный стресс.PLoS ONE. 2014; 9 (5): e96735.
PubMed PubMed Central Статья Google Scholar
- 34.
Ли Х, Фанг П., Ли И, Куо Ю.М., Эндрюс А.Дж., Нанаяккара Дж., Джонсон С., Фу Х., Шан Х., Ду Ф и др. Активные формы кислорода в митохондриях опосредуют активацию эндотелиальных клеток, индуцированную лизофосфатидилхолином. Артериосклер Thromb Vasc Biol. 2016; 36 (6): 1090–100.
CAS PubMed PubMed Central Статья Google Scholar
- 35.
Takahashi M, Okazaki H, Ogata Y, Takeuchi K, Ikeda U, Shimada K. Лизофосфатидилхолин индуцирует апоптоз в эндотелиальных клетках человека посредством механизма, зависимого от протеинкиназы, активируемой p38-митогеном. Атеросклероз. 2002. 161 (2): 387–94.
CAS PubMed Статья Google Scholar
- 36.
Paapstel K, Kals J, Eha J, Tootsi K, Ottas A, Piir A, Jakobson M, Lieberg J, Zilmer M. Обратные отношения сывороточных фосфатидилхолинов и лизофосфатидилхолинов с повреждением сосудов и частотой сердечных сокращений у пациентов с атеросклерозом .Нутр Метаб Кардиоваск Дис. 2018; 28 (1): 44–52.
CAS PubMed Статья Google Scholar
- 37.
Mannheim D, Herrmann J, Versari D, Gossl M, Meyer FB, McConnell JP, Lerman LO, Lerman A. Повышенная экспрессия Lp-PLA2 и лизофосфатидилхолина в симптоматических каротидных атеросклеротических бляшках. Инсульт. 2008. 39 (5): 1448–55.
CAS PubMed PubMed Central Статья Google Scholar
- 38.
Нахджавани М., Асгарани Ф., Халилзаде О, Эстегамати А., Ганией А., Мортеза А., Анвари М. Окисленный липопротеин низкой плотности отрицательно коррелирует с активностью лецитин-холестерина ацилтрансферазы при сахарном диабете 2 типа. Am J Med Sci. 2011; 341 (2): 92–5.
PubMed Статья Google Scholar
- 39.
Eigenbrodt ML, Bursac Z, Rose KM, Couper DJ, Tracy RE, Evans GW, Brancati FL, Mehta JL. Общее межпадвентициальное расстояние (диаметр) сонной артерии как индикатор повреждающего воздействия возраста и атеросклероза, перекрестное исследование риска атеросклероза в когортных данных ограниченного доступа сообщества (ARICLAD), 1987-89.Кардиоваск Ультразвук. 2006; 4: 1.
PubMed PubMed Central Статья Google Scholar
- 40.
Накви Т.З., Ли М.С. Толщина интима-медиа сонных артерий и бляшки в оценке сердечно-сосудистого риска. JACC Cardiovasc Imaging. 2014. 7 (10): 1025–38.
Артикул Google Scholar
- 41.
Саба Л., Араки Т., Кумар П.К., Раджан Дж., Лавра Ф., Икеда Н., Шарма А.М., Шафик С., Николаидес А., Лэрд Дж. Р. и др.Межадвентициальный диаметр сонной артерии в большей степени связан с количеством бляшек, чем диаметр просвета: автоматизированный инструмент для анализа инсульта. J Clin Ультразвук. 2016; 44 (4): 210–20.
PubMed Статья Google Scholar
- 42.
Козакова М., Мориццо С., Ла Каррубба С., Фабиани И., Делла Латта Д., Джамагидзе Дж., Чиаппино Д., Ди Белло В., Паломбо С. Связь между диаметром общей сонной артерии, оценкой риска Фрамингема и сердечно-сосудистыми событиями.Нутр Метаб Кардиоваск Дис. 2017; 27 (4): 329–34.
CAS PubMed Статья Google Scholar
- 43.
Polak JF, Sacco RL, Post WS, Vaidya D, Arnan MK, O’Leary DH. Случайный инсульт связан с диаметром общей сонной артерии, а не с толщиной интима-медиа общей сонной артерии. Инсульт. 2014. 45 (5): 1442–6.
PubMed PubMed Central Статья Google Scholar
- 44.
Eigenbrodt ML, Sukhija R, Rose KM, Tracy RE, Couper DJ, Evans GW, Bursac Z, Mehta JL. Толщина стенки общей сонной артерии и внешний диаметр как предикторы распространенных и возникающих сердечных событий в крупном популяционном исследовании. Кардиоваск Ультразвук. 2007; 5: 11.
PubMed PubMed Central Статья Google Scholar
- 45.
Глагов С., Вайзенберг Э., Зариньш С.К., Станкунавичюс Р., Колеттис Г.Дж. Компенсаторное увеличение атеросклеротических коронарных артерий человека.N Engl J Med. 1987. 316 (22): 1371–5.
CAS PubMed Статья Google Scholar
- 46.
Полак Дж. Ф., Вонг К., Джонсон В. К., Блумке Д. А., Харрингтон А., О’Лири Д.Х., Янез Н.Д. Связь факторов риска сердечно-сосудистых заболеваний, толщины интима-медиа сонной артерии и массы левого желудочка с межадвентициальным диаметром общей сонной артерии: мультиэтническое исследование атеросклероза (MESA). Атеросклероз. 2011. 218 (2): 344–9.
CAS PubMed PubMed Central Статья Google Scholar
- 47.
Petersen AK, Krumsiek J, Wagele B, Theis FJ, Wichmann HE, Gieger C, Suhre K. О проверке соотношений метаболитов без гипотез в исследованиях ассоциаций по всему геному и метаболому. BMC Bioinform. 2012; 13: 120.
Артикул Google Scholar
- 48.
Чжай Дж., Ван-Саттлер Р., Харт Ди-джей, Арден Н.К., Хаким А.Дж., Иллиг Т., Спектор Т.Д. Соотношение аминокислот с разветвленной цепью и гистидина в сыворотке: новый метаболомный биомаркер остеоартрита коленного сустава.Ann Rheum Dis. 2010. 69 (6): 1227–31.
CAS PubMed Статья Google Scholar
- 49.
Illig T, Gieger C, Zhai G, Romisch-Margl W., Wang-Sattler R, Prehn C., Altmaier E, Kastenmuller G, Kato BS, Mewes HW, et al. Полногеномный взгляд на генетические вариации метаболизма человека. Нат Жене. 2010. 42 (2): 137–41.
CAS PubMed Статья Google Scholar
- 50.
Shi Y, Liu L, Yu Y, Long Y, Zheng H. Кислые аминокислоты: новый тип имитатора ферментов с применением для биочувствительности и оценки антиоксидантного поведения. Spectrochim Acta A Mol Biomol Spectrosc. 2018; 201: 367–75.
CAS PubMed Статья Google Scholar
- 51.
Aftring RP, Manos PN, Buse MG. Катаболизм аминокислот с разветвленной цепью мышцами диафрагмы голодных и диабетических крыс. Обмен веществ. 1985. 34 (8): 702–11.
CAS PubMed Статья Google Scholar
- 52.
Адева-Андани М.М., Лопес-Масид Л., Донапетри-Гарсиа С., Фернандес-Фернандес С., Сиксто-Лил С. Ферменты, участвующие в метаболизме аминокислот с разветвленной цепью у людей. Аминокислоты. 2017; 49 (6): 1005–28.
CAS PubMed Статья Google Scholar
- 53.
Катаками Н., Мита Т., Ирие Y, Такахара М., Мацуока Т.А., Гошо М., Ватада Х., Шимомура И., Ситаглиптин Профилактическое исследование оценки толщины интима-медиа C.Влияние ситаглиптина на тканевые характеристики стенки сонной артерии у пациентов с диабетом 2 типа: апостериорный субанализ превентивного исследования ситаглиптина по оценке толщины интима-медиа (SPIKE). Кардиоваск Диабетол. 2018; 17 (1): 24.
PubMed PubMed Central Статья Google Scholar
- 54.
Бханпури Н.Х., Холлберг С.Дж., Уильямс П.Т., Маккензи А.Л., Баллард К.Д., Кэмпбелл В.В., Маккартер Дж. П., Финни С.Д., Волек Дж. С.. Ответы факторов риска сердечно-сосудистых заболеваний на модель лечения диабета 2 типа, включая пищевой кетоз, вызванный устойчивым ограничением углеводов в течение 1 года: открытое, нерандомизированное, контролируемое исследование.Кардиоваск Диабетол. 2018; 17 (1): 56.
PubMed PubMed Central Статья Google Scholar
- 55.
Риццо М., Ризви А.А., Патти А.М., Николич Д., Джильо Р.В., Кастеллино Дж., Ли Вольти Г., Каприо М., Монтальто Г., Провенцано В. и др. Лираглутид улучшает метаболические параметры и толщину интима-медиа сонных артерий у пациентов с диабетом с метаболическим синдромом: 18-месячное проспективное исследование.
Как будет выглядеть тест
Когда игла вводится для забора крови, некоторые люди чувствуют умеренную боль.Другие чувствуют только укол или покалывание. После этого может появиться небольшая пульсация или небольшой синяк. Это скоро уйдет.
Почему проводится тест
Этот тест проводится для того, чтобы увидеть, насколько быстро разрушаются ваши эритроциты. Это может быть сделано, если ваш врач подозревает, что у вас какой-то тип анемии, вызванный вашей иммунной системой.
Нормальные результаты
Нормальный диапазон составляет от 41 до 165 миллиграммов на децилитр (мг / дл) или от 410 до 1650 миллиграммов на литр (мг / л).
Содержание статьи
Нормальные диапазоны значений могут незначительно отличаться в разных лабораториях. Некоторые лаборатории используют разные измерения или тестируют разные образцы. Поговорите со своим врачом о значении ваших конкретных результатов теста.
Что означают аномальные результаты
Когда красные кровяные тельца активно разрушаются, гаптоглобин исчезает быстрее, чем создается. В результате уровень гаптоглобина в крови падает.
Уровни ниже нормы могут быть вызваны:
Высшее- уровни, превышающие нормальные, могут быть связаны с:
Рисками
Сдача крови сопряжена с небольшим риском.Вены и артерии различаются по размеру от одного человека к другому и от одной стороны тела к другой. Взятие крови у одних людей может быть труднее, чем у других.
Другие риски, связанные с забором крови, незначительны, но могут включать:
Ссылки
Chernecky CC, Berger BJ.Гаптоглобин (Hp) — сыворотка. В: Chernecky CC, Berger BJ, ред. Лабораторные исследования и диагностические процедуры . 6-е изд. Сент-Луис, Миссури: Эльзевьер Сондерс; 2013: 604-605.
Мишель М. Аутоиммунные и внутрисосудистые гемолитические анемии В: Goldman L, Schafer AI, eds. Гольдман-Сесил Медицина . 25-е изд. Филадельфия, Пенсильвания: Эльзевьер Сондерс; 2016: глава 160.
Уровни гаптоглобина зависят от полиморфизма Hp1 – Hp2, ожирения, воспаления и гипертонии при сахарном диабете 2 типа
ВведениеСахарный диабет 2 типа (СД2) — хроническое заболевание и наиболее распространенная форма диабета.1 Патогенез СД2 связан с субклиническим хроническим воспалением и активацией иммунной системы. 2–4
Гаптоглобин (Hp) — это острофазовый реагент α2-гликопротеина (54 кДа), который в первую очередь поглощает высвобождаемый гемоглобин (Hb). поступает в кровоток либо путем гемолиза, либо путем нормального обмена эритроцитов, предотвращая окислительное повреждение, связанное с гемоглобином.5-7 Растворимый комплекс Hp-Hb не фильтруется через клубочки, а транспортируется в печень для разложения поглотителем Hp-Hb. рецепторы, такие как рецептор CD163, обнаруженный на поверхности моноцитов, макрофагов и клеток Купфера.8,9 Комплекс Hp – Hb – CD163 индуцирует выработку нескольких противовоспалительных и антиоксидантных медиаторов.10
УровеньHp увеличивается в несколько раз (в 3–8 раз) в ответ на местные или системные воспалительные стимулы.11 Основные индукторы являются провоспалительными цитокинами, такими как IL-1, IL-6 и TNF-α, 12, поскольку существуют сайты связывания цитокинов в регуляторных областях промотора гена Hp, с контролем скорости транскрипции и последующим синтезом белка.13 Одно исследование продемонстрировало на модели диабета, индуцированного стрептозотоцином в течение 8 недель, изменения в экспрессии Hp сильно связаны с уровнями TNF-α и IL-6 в сыворотке и соотношением TNF-α / IL-6.14
Ген Hp расположен на длинном плече хромосомы 16 (16q22.2) и представляет собой полиморфизм, характеризующийся двумя аллелями: Hp1 и Hp2. Аллель Hp1 имеет пять экзонов и является консервативным среди видов. Аллель Hp2 специфичен для человека и имеет семь экзонов, которые, вероятно, возникли в результате дупликации (негомологичного кроссинговера) с участием экзонов 3 и 4 аллеля Hp1.9
Hp синтезируется в виде единой цепи, которая расщепляется в амино-концевая α-цепь и карбоксиконцевая β-цепь, связанные дисульфидными связями.Α-цепь, кодируемая аллелем Hp1 (α1 — 9 кДа), меньше, чем цепь, продуцируемая аллелем Hp2 (α2 — 16–20 кДа). Β-цепь (40 кДа) идентична для обоих аллелей Hp и содержит основные домены, участвующие в связывании Hp-Hb. Следовательно, стехиометрия зрелого белка Hp зависит от генотипа: индивидуумы Hp1-Hp1 продуцируют один линейный гомодимер, Hp2-Hp2 продуцируют циклические полимеры, а у гетерозиготных субъектов белок Hp может быть обнаружен в виде линейного гомодимера и / или мультимеров. 15-17 Помимо структурных различий, белковые продукты Hp1 и Hp2 имеют и другие функциональные различия: способность связывать Hb, способность связывать комплекс Hp – Hb с рецептором CD163, скорость выведения комплекса Hp – Hb из кровообращения. и ингибирующее действие на синтез простагландинов (противовоспалительное действие Hp), которые заметно выше у Hp1-Hp1, чем у носителя Hp2.18
Частоты аллелей и генотипов Hp различаются по всему миру. Предыдущие исследования показали, что аллель Hp1 наиболее часто встречается в Африке и Южной Америке и реже — в Юго-Восточной Азии. В западных странах среднее распределение генотипов Hp составляет 16% Hp1 – Hp1, 48% Hp2 – Hp1 и 36% Hp2 – Hp2, что соответствует частотам аллелей около 40% Hp1 и 60% Hp2.9,19
Т.к. СД2 и его осложнения были связаны с повышенным окислительным стрессом, вызванным, в первую очередь, гипергликемией, 20 Hp могут играть важную роль в этом контексте из-за его антиоксидантной активности за счет поглощения экстракорпускулярного гемоглобина, который может инициировать свободнорадикальную реакцию, высвобождая гемовое железо.17,20
Несмотря на существование некоторых отчетов, изучающих связь между T2DM и Hp20–30 в разных популяциях, результаты все еще противоречивы. Поэтому в этом исследовании мы намеревались оценить связь между уровнями Hp и полиморфизмом генов Hp1 – Hp2, а также клиническими и лабораторными параметрами в группе пациентов с СД2 в Бразилии.
Материал и методы Этические аспектыЭто исследование было одобрено комитетом по этике Федерального университета Минас-Жерайс (Минас-Жерайс, Бразилия) — ETIC 0062.0.203.000-11 — и больницы Санта-Каса (Минас-Жерайс, Бразилия) — 059/2011 — в соответствии с этическими принципами Хельсинкской декларации. Все участники предоставили письменное информированное согласие до включения в исследование.
План экспериментаЭто перекрестное исследование случай – контроль было проведено с участием 164 субъектов в возрасте 32–70 лет. В группу случаев вошли 102 пациента с клиническим и лабораторным диагнозом СД2 в соответствии с критериями, установленными Американской диабетической ассоциацией (ADA) 31, в то время как 62 человека, не страдающих диабетом, соответствовали полу, возрасту и индексу массы тела (ИМТ). классифицируется как контрольная группа.Соотношение случай / контроль 2: 1 было принято в соответствии с расчетом выборки, основанным на средних значениях уровней Hp из выборки групп (мощность = 0,95; уровень значимости = 0,05). Пациенты с СД2 набирались в эндокринологической клинике (больница Санта-Каса, Минас-Жерайс, Бразилия) с июня 2012 года по сентябрь 2013 года. В течение того же периода участники контрольной группы набирались из местного сообщества. Критерии исключения включали следующие параметры: возраст старше 70 лет, беременность, рак, аутоиммунные заболевания, недавние сердечно-сосудистые заболевания (например,грамм. сердечный приступ, инсульт, тромбоз за последние пять лет), а также текущие или недавние инфекции и / или воспалительные процессы. Интервью и медицинские записи использовались для получения клинических и лабораторных данных для всех пациентов с СД2. Наличие или отсутствие гипертонии определялось клиническим персоналом Эндокринологической клиники (больница Санта-Каса, Минас-Жерайс, Бразилия) в соответствии с критериями, принятыми ADA31: систолическое артериальное давление ≥140 мм рт. Ст. Или диастолическое артериальное давление ≥80 мм рт. гипотензивные препараты.Контрольная группа имела нормальный уровень глюкозы в крови натощак (60–99 мг / дл) и не принимала гипогликемические препараты.
Отбор образцов кровиОбразцы венозной крови были собраны у каждого участника в пробирки с ЭДТА и без антикоагулянта, позволили свернуться в течение 30 минут и центрифугировали при 1100 × g в течение 20 минут при 25 ° C. Полученные фракции супернатанта (плазма и сыворотка) помещали в аликвоты в микропробирки и хранили при -80 ° C до биохимического анализа. Аликвоту цельной крови, собранной в EDTA, также хранили для последующего выделения геномной ДНК и анализа генотипа Hp.
Биохимические измеренияУ субъектов контрольной группы измеряли уровень глюкозы в крови натощак сразу после центрифугирования образцов сыворотки, полученных после 8 часов голодания. Испытания проводили ферментно-колориметрическим методом с использованием набора Glicose-PP (Gold Analisa, Minas Gerais, Бразилия) в соответствии с инструкциями производителя и спектрофотометра BTR 811 (Biotron, Бразилия).
Уровни высокочувствительного С-реактивного белка (hs-CRP) были измерены в образцах сыворотки с использованием иммунотурбидиметрического метода, hsCRP VITROS Chemistry Products (Ortho Clinical Diagnostics, New York, USA) в соответствии с инструкциями производителя и System Vitros Chemistry 5.1 FS (Орто Клиническая Диагностика, Нью-Йорк, США). Уровни HbA1c определяли в образцах плазмы с помощью метода высокоэффективной жидкостной хроматографии (ВЭЖХ) в тестовой системе D10 — Hemoglobin A1C (Bio Rad®, Франция). Этот метод сертифицирован Национальной программой стандартизации гликогемоглобина (NGSP).
Уровни цитокинов TNF-α, IL-10 и IL-6 в плазме определяли методом цитометрических шариков (CBA) с использованием систем гибких наборов повышенной чувствительности человека (BD Biosciences Pharmingen, Калифорния, США), следуя инструкциям производителей ‘ инструкции.Сбор и анализ данных выполняли в проточном цитометре LSRFortessa ™ (BD Biosciences Pharmingen, Калифорния, США) с использованием программного обеспечения FCAP Array Software версии 1.0.1.
УровниHp в плазме были количественно определены с использованием иммуноферментного анализа (ELISA) — Quantikine® ELISA Human Haptoglobin Immunoassay (R&D Systems, Миннеаполис, США), который в равной степени определяет обе человеческие формы Hp1 – Hp1 и Hp2 – Hp2 в соответствии с протоколом производителя. . Уровни hs-CRP, цитокинов и Hp измеряли одновременно для всех образцов.Генотипирование
гаптоглобинаГеномную ДНК получали с использованием набора Biopur Mini Spin Kit (Biometrix Biotecnologia®, Куритиба, Бразилия). Генотипирование Hp выполняли с помощью специальной двухэтапной аллельной полимеразной цепной реакции (ПЦР), как описано Koch et al. 32. В первой реакции специфичный для аллеля 1 фрагмент 1757 п.н. и специфический для аллеля 2 фрагмент 3481 п.н. амплифицировали с праймером A (5′-GAGGGGAGCTTGCCTTTCCATTG-3 ‘) и праймером B (5′-GAGATTTTTGAGCCCTGGCTGGT-3′). Во второй реакции амплифицировали только последовательность, специфичную для аллеля 2 349 пар оснований, с использованием праймера C (5’-CCTGCCTCGTATTAACTGCACCAT-3 ‘) и праймера D (5′-CCGAGTGCTCCACATAGCCATGT-3’).Условия ПЦР были следующими: начальная денатурация при 95 ° C в течение 2 минут, затем 35 циклов при 95 ° C в течение 1 минуты, 69 ° C в течение 2 минут (1 минута для реакции 2), 69 ° C в течение 2 минут (1 минута для реакции 2) и окончательное удлинение 7 мин при 72 ° C. Продукты ПЦР визуализировали с помощью электрофореза в 1% агарозном геле, затем окрашивали раствором бромистого этидия (10 мг / мл — Sigma – Aldrich, Миссури, США).
Статистический анализДанные были проверены на нормальность с помощью теста Шапиро – Уилка. Параметрические переменные были представлены как среднее значение ± стандартное отклонение (SD), непараметрические переменные — как медиана (межквартильный размах — IQR) и процент от общего количества для категориальных переменных.
Сравнения параметрических переменных проводили с помощью t-критерия Стьюдента или дисперсионного анализа (ANOVA) с последующим апостериорным LSD-тестом; а для непараметрических переменных использовался критерий Манна – Уитни или поправка Краскела – Уоллиса и Бонферрони при необходимости.
Равновесие Харди – Вайнберга (HWE) было оценено с использованием точных тестов с помощью онлайн-программ GENEPOP и OEGE (доступно на: http://genepop.curtin.edu.au/genepop_op1.html и http: //www.oege. org / software / hardy-weinberg.html соответственно).Различия в генотипических и аллельных частотах между группами проверяли с помощью критерия хи-квадрат (χ2) с остаточным анализом.
Корреляционный анализ между уровнями Hp, клиническими и биохимическими параметрами в группе СД2 был проведен с помощью корреляционного теста Спирмена.
Все статистические анализы были выполнены с использованием пакета статистических данных социальных наук (SPSS) версии 17.0, и значение p ≤0,05 считалось статистически значимым.
РезультатыВ таблице 1 представлены клинические и лабораторные характеристики случая (СД2) и контрольной группы.Группы были сопоставлены по полу, возрасту и ИМТ (p> 0,05 для всех). Пациенты с СД2 имели более высокие окружность талии (p
0,0001), соотношение талии и бедер (p0,0001), уровни глюкозы натощак (p0,0001) и уровни IL-6 (p = 0,001) по сравнению с контрольной группой, не страдающей диабетом. УровниHp в плазме были выше в группе СД2 [1,15 (0,52) г / л], чем в контрольной группе [0,88 (0,58) г / л] (p = 0,005 — рис. 1). Интересно, что у пациентов с СД2 с артериальной гипертензией (n = 94) уровень Hp [1,19 ± 0,46 г / л] был выше по сравнению с пациентами без гипертензии (n = 8) [0.80 ± 0,26 г / л] (p = 0,021 — рис. 1).
Анализ уровней Hp проводился с учетом статуса ожирения: ИМТ 30 кг / м2 (без ожирения) и ИМТ ≥ 30 кг / м2 (ожирение). Пациенты с СД 2 типа с ожирением имели более высокие уровни Hp по сравнению с контрольной группой с ожирением (p = 0,009) и пациентами с СД 2 типа без ожирения (p = 0,003 — Таблица 2). Уровни Hp не показали различий при сравнении групп пациентов и контрольных групп с учетом ИМТ 30 кг / м2 (p = 0,634). Контрольная группа также не показала различий между уровнями Hp и категориями BMI (p = 0,959).
Мы провели анализ ассоциации полиморфизма гена Hp с СД2 по сравнению с контрольной группой (таблица 3).Полиморфизм находится в равновесии Харди – Вайнберга (p> 0,025) для любой группы. Частоты генотипов различались между пациентами и контрольными субъектами (p = 0,036), а остаточный анализ показал, что генотип Hp1 – Hp1 чаще встречается у пациентов с СД2 по сравнению с контрольной группой, не страдающей диабетом. Частоты аллеля Hp1 (СД2: 0,49; контроль: 0,38) и аллеля Hp2 (СД2: 0,51; контроль: 0,62) различались между группами (OR = 1,606; 95% ДИ 0,994–2,599; p = 0,041). Доминантная модель наследования (Hp2 – Hp2 + Hp2 – Hp1 vs.Hp1 – Hp1) показали значительную ассоциацию (OR = 0,320; 95% ДИ 0,118–0,839; p = 0,010) с СД2, которая не наблюдалась в рецессивной модели (p = 0,418).
Чтобы оценить, может ли полиморфизм гена Hp модулировать уровни циркулирующего белка, уровни Hp сравнивали в соответствии с их генотипами для обеих групп и отдельно (T2DM или контроль) (Таблица 4). Анализ показал, что в аддитивной и доминантной моделях уровни Hp ниже у носителей аллеля Hp2, учитывая всех участников (p = 0.001; p = 0,020, соответственно) и только контрольные субъекты (p = 0,008; p = 0,035, соответственно). У пациентов с СД2 не выявлено различий в уровне Hp между генотипами (все p> 0,05).
Наконец, была исследована корреляция между уровнями Hp в плазме и клиническими / лабораторными параметрами в группе пациентов с СД2 (рис. 2). Уровни Hp показали значительную положительную корреляцию с окружностью талии (r = 0,298, p = 0,002), ИМТ (r = 0,317, p = 0,001), IL-6 (r = 0,255, p = 0,012) и hs-CRP (r = 0,382, p = 0,001).
ОбсуждениеВ этом исследовании оценивалась связь между уровнями Hp, полиморфизмом Hp1 – Hp2 и клиническими / лабораторными параметрами у пациентов с СД2.Данные продемонстрировали, что T2DM связан с более высокими уровнями Hp у людей с ожирением, на которые влияют воспаление и гипертония. Кроме того, мы наблюдали, что уровни Hp модулируются полиморфизмом Hp1 – Hp2 при рассмотрении СД2 и контрольных групп.
Клинические и лабораторные характеристики пациентов с СД2 и контрольной группы показали, что у пациентов с СД2 выше окружность талии и соотношение талии и бедер. Эти результаты подтверждают понимание того, что не только ожирение, но, в основном, ожирение верхней части тела отрицательно влияет на метаболизм глюкозы и является независимым фактором риска развития СД2.33 Кроме того, у пациентов с СД2 также наблюдался более высокий уровень ИЛ-6 по сравнению с контрольной группой. Более высокие уровни провоспалительных цитокинов (например, IL-6, IL-1β, TNF-α) также были обнаружены у пациентов с T2DM в других исследованиях34–36, показывающих, что этиопатогенез этого заболевания тесно связан с активацией воспалительных механизмов.
В диабетической группе уровень Hp был выше, чем в контрольной. Анализ уровней Hp с учетом статуса ожирения показал, что пациенты с СД2 с ожирением имеют более высокие уровни Hp, чем пациенты с СД2, не страдающие ожирением, и пациенты с ожирением в контрольной группе.Кроме того, уровни Hp в группе T2DM положительно коррелировали с окружностью талии, BMI, IL-6 и hs-CRP. Взятые вместе, эти результаты подчеркивают, что повышенный уровень Hp связан с ожирением и воспалением в группе СД2. В согласии с этим, Van Campenhout и др. 20 в исследовании случай-контроль с пациентами с СД2 из Бельгии обнаружили более высокие уровни Hp у пациентов, чем контрольные, и положительную корреляцию между этими уровнями и CRP. Это исследование показало, что более высокие уровни Hp при сахарном диабете — это состояние, связанное с нарушениями метаболизма железа и воспалительным статусом, способствующим увеличению параметров окислительного стресса.Совсем недавно Mohieldein et al.21 также обнаружили более высокие уровни Hp у пациентов с СД2 из Саудовской Аравии по сравнению с контрольной группой. Более того, повышение уровня Hp зависело от ИМТ: у пациентов с ожирением (ИМТ ≥30 кг / м2) и избыточной массой тела (ИМТ 25–29,9 кг / м2) у пациентов с СД2 уровень Hp был выше, чем у худых пациентов (ИМТ
25 кг / м2).IL-6 широко продуцируется подкожной и внутрибрюшной жировой тканью.13 В свою очередь, он стимулирует синтез в печени Hp, 37 и, кроме того, Hp продуцируется адипоцитами.10 Chiellini et al.38 продемонстрировали, что ген Hp активируется в белой жировой ткани мышей db / db с ожирением по сравнению с их худыми однопометниками и что провоспалительные цитокины являются важным сигналом для этой регуляции. Более того, сывороточные уровни Hp считались маркером ожирения у людей, а ИМТ и СРБ — независимыми детерминантами этих сывороточных уровней у женщин.39
Диабетическое состояние связано со снижением антиоксидантной защиты и нарушениями метаболизма железа. нарушается гликозилированной фракцией Hb (GlyHb), потому что даже после образования комплекса GlyHb-Hp GlyHb может продолжать окислительно модифицировать белки в стенке сосуда, увеличивая повреждение эндотелия.40 Кроме того, GlyHb, по-видимому, высвобождает свободное железо (окислительно-восстановительная форма — Fe2 +) легче, чем негликозилированный Hb.41 Железо в степени окисления 2+ является одним из наиболее реактивных прооксидантов, поскольку оно катализирует образование высокореактивных гидроксильных радикалов. которые способны инициировать и распространять перекисное окисление липидов, гликоксидирование и повреждение ДНК.42
Пациенты с СД2 и артериальной гипертензией показали более высокие уровни Hp по сравнению с пациентами без этой сопутствующей патологии. Известно, что сахарный диабет связан с высвобождением внеклеточного гемоглобина из-за повреждения эндотелия.Внеклеточный гемоглобин действует как мощный поглотитель NO (оксида азота) посредством высокоскоростной реакции дезоксигенации, вызывая сужение сосудов и окислительные повреждения тканей.43 NO вырабатывается эндотелием и является центральным модулятором сосудистого тонуса, подавляет тромбоциты. агрегация и адгезия лейкоцитов, а также оказывает антиоксидантное и противовоспалительное действие.18 Повышение уровня Hp, наблюдаемое при гипертонии, может быть связано с компенсаторным механизмом связывания внеклеточного Hb, уменьшением поглощения NO и поддержанием нормального кровяного давления. .Boretti et al.44 показали на животных моделях (собаки и морские животные), как компартментализация Hb и его взаимодействие с Hp (комплекс Hp – Hb) может помочь регулировать кровяное давление. Некоторые исследования показали, что полиморфизм Hp1 – Hp2 может модулировать биодоступность NO, поскольку люди с генотипом Hp2 – Hp2 и преэклампсией45 или T2DM46 демонстрируют более низкие концентрации нитритов в плазме по сравнению с людьми с другими генотипами.
Мы обнаружили, что генотип Hp1 – Hp1 чаще встречается при СД2, чем в контрольной группе, и следовал модели доминантного наследования, хотя аллель Hp2 чаще встречался в обеих группах.Стерн и др. 22 обнаружили, что генотип Hp1 – Hp1 связан с T2DM (мексиканцы-американцы). Однако некоторые исследования обнаружили связь между генотипом Hp2 – Hp2 и СД2. 23–28 Белок Hp1 – Hp1 обладает способностью связывать больше Hb, чем другие фенотипы, с большей эффективностью в обеспечении захвата комплекса Hp – Hb рецептором CD163. который выводится из кровотока быстрее, чем белок Hp2 – Hp2.47 Более того, фенотип Hp2 – Hp2 связан с повышенным риском сердечно-сосудистых заболеваний у пациентов с СД2.39,48 Следовательно, этот результат не ожидался, но показывает генетические характеристики бразильской популяции, что является результатом смешанного брака между европейцами, африканцами и индейцами.
Более высокие уровни Hp в контроле наблюдались в Hp1 – Hp1 по сравнению с носителями Hp2, в соответствии с Kasvosve et al.49 Однако при T2DM кажется, что генотип Hp2 – Hp2 способствует повышенным уровням белка Hp, аналогично носителям Hp1 – Hp1. Поскольку Hp, экспрессируемый аллелем Hp2, обладает меньшей способностью связывать Hb и комплекс Hp-Hb с рецептором CD163, это состояние может нарушать функции Hp при T2DM. Таким образом, эти результаты предполагают, что, хотя T2DM имеет более высокие уровни Hp (возможно, из-за воспалительного статуса), большая часть их функции неэффективна.
Некоторые ограничения этой работы и противоречивые результаты по сравнению с другими исследованиями известны как небольшой размер выборки, что оправдано строгими критериями отбора пациентов и контрольной группы, различными методами, используемыми для людей с фенотипом / генотипом Hp, или различным генетическим фоном пациентов. изученные популяции. Однако его данные представляют новую и клинически важную информацию о профиле Hp при T2DM, и необходимо провести другие исследования, чтобы расширить понимание роли Hp ’и T2DM в других популяциях.
ЗаключениеУчитывая эпидемическое количество пациентов с СД2 в мире, включая Бразилию, улучшенные знания о воспалительных маркерах, связанных с сахарным диабетом, могут способствовать улучшению клинического наблюдения.
Наши результаты показывают, что более высокие уровни Hp связаны с СД2 и зависят от ИМТ, воспалительного статуса и артериальной гипертензии. Более высокая частота гомозиготного Hp1 наблюдалась у пациентов с T2DM, однако аллель Hp2 способствует более высокому уровню белка, что может поставить под угрозу функцию Hp в этой группе.
Конфликт интересовАвторы заявляют об отсутствии конфликта интересов.
(PDF) Клиническая полезность уровней гаптоглобина для оценки гемолиза у недавно перенесенных пациентов
2 Advances in Hematology
Это пациенты в возрасте восемнадцати лет и старше
были приглашены для включения в исследование. Пациенты с
в анамнезе переливания крови за последние четыре месяца,
в анамнезе с заменой сердечного клапана, признаками гепатомегалии,
спленомегалией и / или желтухой при физикальном обследовании, пациенты
с аномальными функциональными пробами печени или любые другие доказательства гемолиза
на момент включения в исследование были исключены.Было получено письменное информированное согласие на участие в исследовании
и на переливание крови.
пациентов могли выйти из исследования в любое время. Любой пациент, у которого
развились признаки гемолиза в течение периода исследования, был удален
, а уровни гаптоглобина в сыворотке не использовались в статистическом анализе
.
3.2. Процедура. После получения информированного согласия и регистрации
соответствующих показаний для переливания крови было зарегистрировано
, образцы крови были взяты у пациентов с помощью
периферической венепункции, которая была выполнена с соблюдением асептики.Уровни гаптоглобина в сыворотке составляли
, измеренные четыре раза для каждого пациента: один раз перед первым переливанием
и трижды после последнего переливания
(сразу после переливания и двадцать четыре и сорок
через восемь часов после переливания). Эти времена были определены на основе периода полураспада гаптоглобина и комплекса гемоглобин-
гаптоглобин. Для измерения
сывороточного гаптоглобина перед трансфузией образец для определения типа и перекрестного совпадения
использовали как можно чаще, чтобы избежать дополнительных
венепункций.Также регистрировался возраст каждой единицы упакованных эритроцитов
иперелитых.
3.3. Переливание PRBC. Переливание PRBC было выполнено медсестрой, ухаживающей за пациентом, в соответствии с рекомендованными инструкциями
. PRBC были получены из больничного банка крови
. Консервант, использованный в PRBC
, представлял собой CPD (цитрат фосфат декстроза). Перелитые единицы
были идентифицированы после соответствующего типа и перекрестного сопоставления в
банке крови.Исследователи не участвовали в отборе
или переливании PRBC.
3.4. Измерение сывороточного гаптоглобина. Уровни тоглобина hap-
в сыворотке измеряли в больничной лаборатории
с использованием Beckmen Coulter Unicel DXC путем комбинирования антитела против гаптоглобина
с молекулой гаптоглобина
, образующей нерастворимый комплекс. Это комплексное соединение антиген-антитело
было измерено по оптическому поглощению при 340 нанометрах
с использованием принципа турбидиметрии [7].Гаптоглобин
сыворотки был зарегистрирован в миллиграммах на децилитр. Нормальный диапазон сывороточного гаптоглобина
в нашей больничной лаборатории составляет 36–
195 мг / дл.
3.5. Статистика. Мы использовали дисперсионный анализ с повторным измерением
для изучения групповых различий в уровнях сывороточного гаптоглобина
в различные временные интервалы. Одномерный парный тест t-
был использован для изучения различий между уровнями гаптоглобина до
ипосле переливания крови.Fisher Exact использовался для
категориальных данных. Статистическая значимость была установлена на уровне менее
или, равном 0,05. Данные были проанализированы с использованием статистической системы Number Cruncher
(2004). Размер выборки из двадцати одного пациента
, измеренный четыре раза с повторными измерениями
Anova был рассчитан на основе умеренного эффекта
0,2.
4. Наблюдения и результаты
Всего двадцать один пациент получил сорок семь единиц
PRBC.Наиболее частым показанием для переливания было
острая кровопотеря из-за желудочно-кишечного кровотечения, наблюдаемая у пятнадцати
пациентов, из которых у одиннадцати пациентов было геморроидальное кровотечение
и у четырех пациентов был неидентифицированный желудочно-кишечный источник кровотечения
. У трех пациенток было обильное менструальное кровотечение
из маточных фиброидов, одна пациентка попала в автомобильную аварию
, повлекшую за собой массивную кровопотерю, и две
пациентки были госпитализированы в отделение интенсивной терапии с острой
дыхательной недостаточностью из-за аспирационной пневмонии .Хотя
уровни гаптоглобина в сыворотке могут быть увеличены при воспалительных
условиях, из двух пациентов в нашем исследовании, которые были госпитализированы с острой дыхательной недостаточностью
, ни один из них не был отмечен, до
не имели аномально повышенных исходных уровней гаптоглобина в сыворотке.
У 21 пациента сывороточный уровень гаптоглобина
els, взятый перед трансфузией, сразу после, 24 часа
и 48 часов после переливания был исследован
на предмет значительных различий с использованием дисперсионного анализа с
повторными измерениями.Не было обнаружено значительных различий
после корректировки с использованием оценки Гринхаус-Гейссера, DF =
3,60, F = 1,26, P = 0,28.
На рис. 1 и в таблице 1 показаны уровни гаптоглобина
для всех 21 пациента в различные временные интервалы.
Таблица 2 показывает среднее значение, стандартное отклонение и среднее значение
различий в уровнях гаптоглобина в каждом временном интервале. Различия
были изучены с использованием одномерного парного t-теста
, при этом было обнаружено только существенное различие между уровнями гаптоглобина
до трансфузии и уровнями гаптоглобина сразу
после переливания (P =.041, двусторонний).
У 21 пациента уровни гаптоглобина до
переливания крови были в пределах нормы. Сразу
после переливания у трех пациентов уровень гаптоглобина был ниже нормы, а у
у двух из этих пациентов наблюдалось стойкое снижение уровня гаптоглобина
через 24 и 48 часов. Кроме того, у одного пациента уровень гаптоглобина в сыворотке снизился на
через 24 часа, а у одного — на
через 48 часов. У обоих этих пациентов были нормальные уровни в другие периоды времени
.
Мы также отметили, что в общей сложности четыре пациента получили кровь
старше 30 дней. У двоих из них уровень гаптоглобина
был ниже 36 мг / дл через 48 часов после переливания. Это было
, что не является статистически значимым при P = 0,07, точное значение Фишера.
Мы также наблюдали, что три пациента с низким нормальным гаптоглобином
на исходном уровне (менее 60 мг / дл) имели уровень менее
, чем 36 мг / дл через 48 часов. Ни у одного пациента с уровнем выше
60 мг / дл перед переливанием не было аномального уровня ниже
, чем 36 мг / дл через 48 часов.Это было значительным при P = 0,02,
Fisher Exact.
Наше исследование не было рассчитано на эффект
огромных объемов переливания PRBC на уровни сывороточного гаптоглобина
. Однако мы отметили, что из трех пациентов, которые
получили более двух единиц PRBC, только у одного был посттрансфузионный уровень
, который был ниже нормы, и это падение
наблюдалось через 48 часов после переливания. У этого пациента было

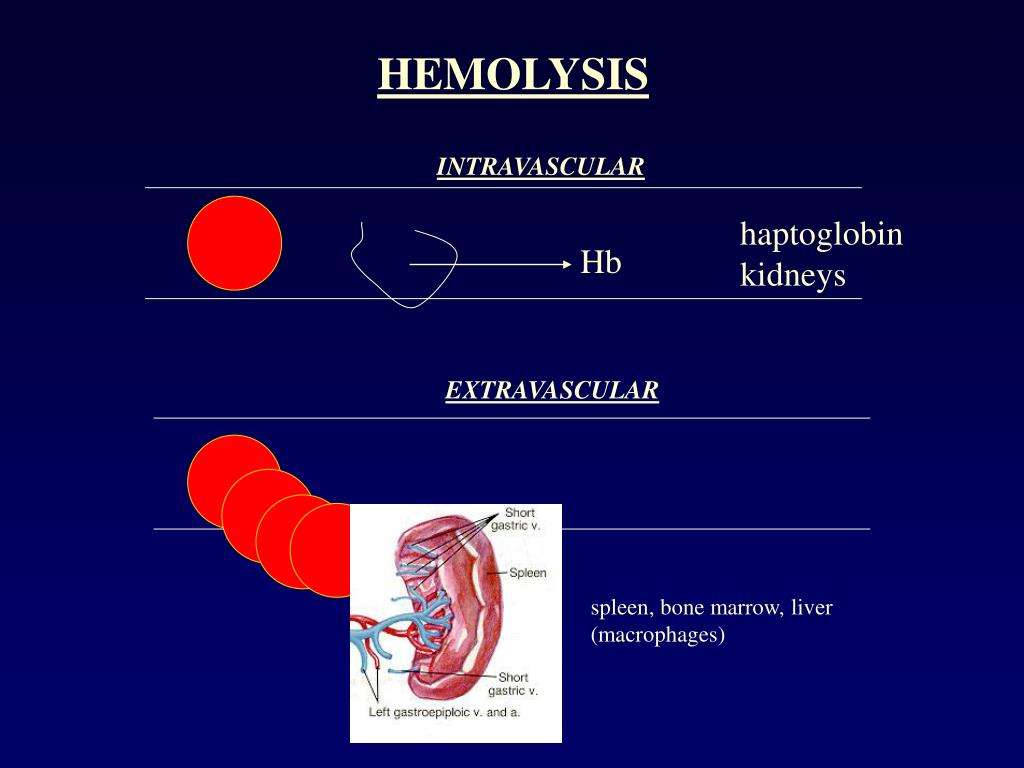
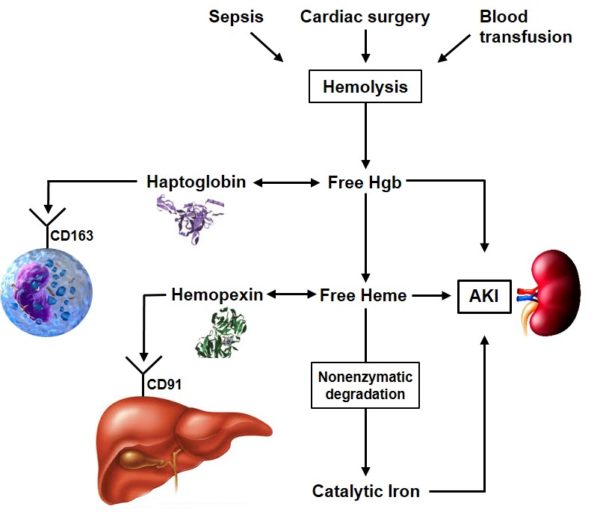
 Количество белка выявляется при анализе крови.
Количество белка выявляется при анализе крови.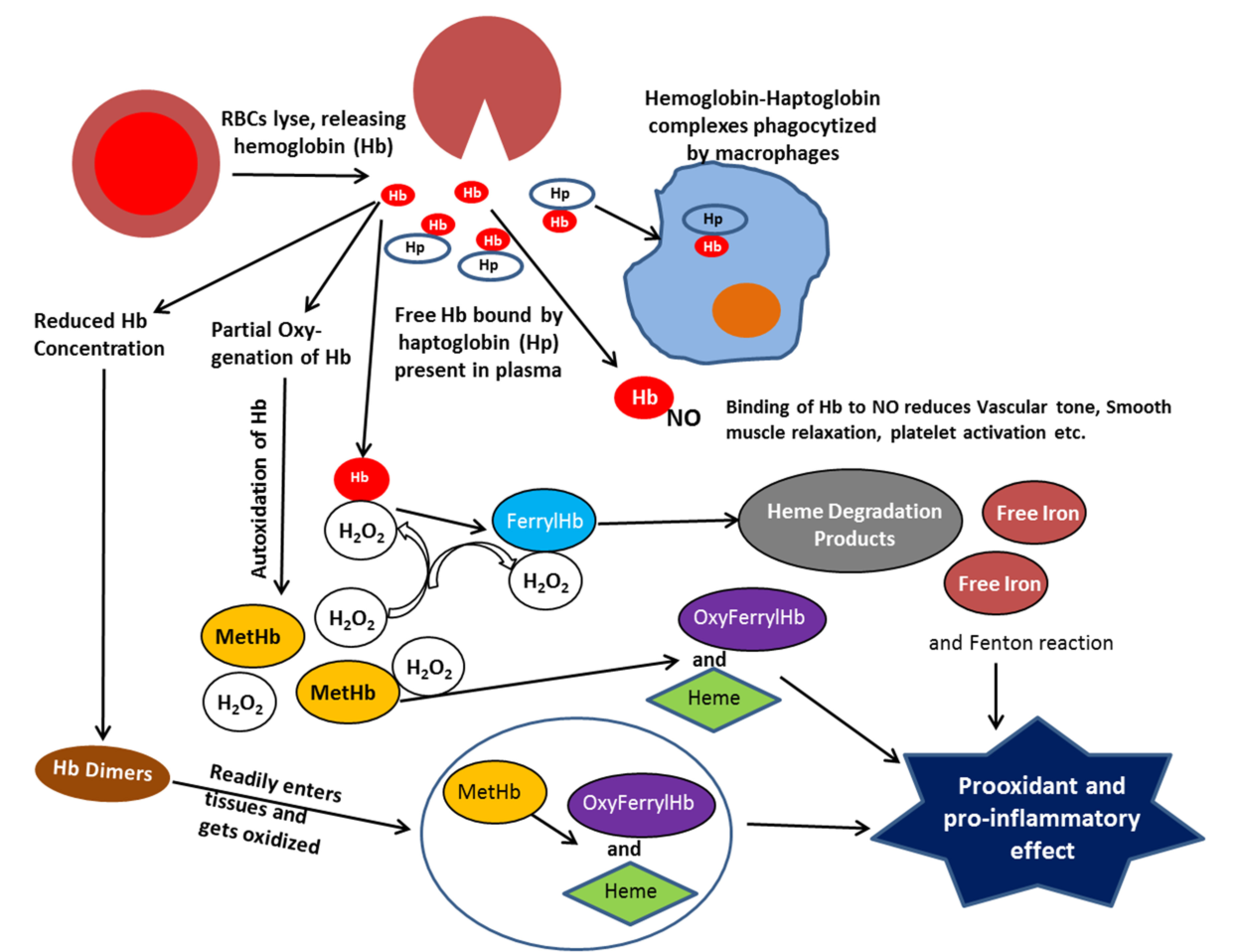
 Гаптоглобин входит в группу важных критериев оценки течения этой болезни;
Гаптоглобин входит в группу важных критериев оценки течения этой болезни;