Колопатии
Колопатии — это тип патологии слизистой оболочки толстой кишки, при котором доминирующими являются изменения невоспалительного характера. В большинстве случаев эти изменения развиваются вторично, на фоне заболеваний, как правило, не связанных с толстой кишкой. Наиболее часто колопатии наблюдаются при системных поражениях, почечной недостаточности, циррозе печени, отравлениях солями тяжелых металлов, аллергических реакциях организма. По характеру макроскопических изменений выделяются следующие типы колопатии: 1. Геморрагическая колопатия, при которой на фоне визуально неизмененной слизистой оболочки с обычным или умеренно усиленным сосудистым рисунком определяются единичные или множественные мелкоточечные субэпителиальные кровоизлияния. Патогенетически спонтанные или контактные геморрагии могут формироваться либо при нарушении проницаемости капиллярной стенки, либо при изменении реологических свойств крови.
2. Застойная (конгестивная) колопатия, при которой на фоне визуально неизмененной слизистой оболочки отмечается значительное расширение сосудов подслизистой основы (чаще венозные стволы), диаметр которых может составлять 1 см и более.
3. Эрозивная колопатия (острые эрозии), при которой определяются одиночные или множественные поверхностные дефекты слизистой оболочки правильной формы, размеры которых не превышают 1 см. Как правило, изъязвления имеют «штампованный вид», дискретны и располагаются на фоне неизмененной слизистой оболочки. В некоторых случаях вокруг эрозий визуализируется венчик гиперемии. Острые деструктивные изменения слизистой оболочки толстой кишки наблюдаются при нарушении функции почек (уремия), печени, применении некоторых лекарственных препаратов, а также при аллергических состояниях организма, ишемическом повреждении стенки кишки и после проведения гемодиализа. Несмотря на разнообразие причин, вызывающих деструктивные формы колопатии, в основе их развития, как правило, лежит либо цитотоксический, либо сосудистый фактор, либо их сочетание.

4. Язвенная колопатия (острые язвы), при которой обычно обнаруживаются одиночные глубокие дефекты округлой формы, различных размеров. Они окружены неизмененной слизистой оболочкой. В большинстве случаев острые язвы сопровождают такие тяжелые состояния организма, как сепсис, геморрагический шок, ожоговая болезнь, операционная травма.
5. Смешанная колопатия характеризуется полиморфизмом эндоскопических признаков (геморрагии, эрозии, язвы). Наиболее часто встречается эрозивно-геморрагический тип колопатии, который развивается на фоне применения нестероидных противовоспалительных препаратов, проведения гемодиализа, при острых отравлениях солями тяжелых металлов. Как правило, острые эрозии и язвы сопровождаются кровотечениями различной степени тяжести (Долецкий С.Я. с соавт., 1984; Sivak М.,
При колопатиях изменения слизистой оболочки обычно носят диффузный (тотальный) характер. Однако в некоторых случаях их протяженность может ограничиваться поражением одного или нескольких сегментов толстой кишки
Как надо лечить эритематозная колопатия
Результаты поиска по запросу:
Надо стараться одеваться по погоде, летом избегать открытых солнечных лучей, зимой – долгого пребывания на холоде и ветре.
Легкая, эритематозная форма болезни (когда на коже есть только покраснение, но нет пузырей) вообще не требует местного лечения. Заочно определить причину нельзя, надо проконсультироваться с проктологом или хирургом, выполнить исследование прямой и толстой кишки.
Заключение: Эритематозная колопатия. Встречаются различные формы красного плоского лишая: кольцевидная (появление высыпаний в форме колец), эритематозная (покраснение участка кожи, сопровождающееся зудом и появлением мягких красноватых бугорков)
Врач это видел, но что лечить надо — не говорил. Вопрос 2012-12-08 17:01:04 ПОСЛЕ КАЛОНОСКОПИИ УСТАНОВИЛИ ДИАГНОЗ ЭРИТЕМАТОЗНАЯ КОЛОПАТИЯ,ЧТО ЭТО?ИКАК ЛЕЧИТЬ?СПАСИБО! Колопатия Синдром раздраженного толстого кишечника. Симптомы, диагностика, лечение, профилактика.

Заключение: Эритематозная колопатия. Внутренний геморрой вне стадии обострения. Признаки хронического колита, колопатия, наружный и внутренний геморрой. Анализ на биопсию — отрицательный.
Вывод-колит надо срочно лечить.Врачи на зтот диагноз не обращают внимания или не знают,как лечить. Поэтому можно вполне присоединиться к мнению ряда авторов, предлагавших исключить название «эритематозная волчанка», а называть
Течение заболевания хроническое, нередко появляются новые очаги и обостряются старые, в связи с чем и прогноз надо ставить осторожно. .«полные» эрозии). При инфильтрации, гиперемии, изменении рельефа слизистой оболочки желудка вокруг эрозии с целью исключения злокачественной опухоли желудка проводят. 9. Сахарный диабет, тяжелая форма с потребностью инсулина свыше 60 ед.
 в сутки: с туберкулезом легких или хрониосепсисом; с диабетической препролиферативной и пролиферативной ретинопатией 999 капсула линчжи похудения! как правило, получали при этом ухудшение здоровья и перешли в капсула неизлечимых. диетический стол послеоперационнй, вообще-то страшноватая картина – Причем капсула лишний вес, спросите. Активированный (активный) уголь — пористое вещество, которое получают из различных углеродсодержащих материалов органического происхождения: древесный уголь (марки активированного угля БАУ-А, ОУ-А, ДАК и др.).
в сутки: с туберкулезом легких или хрониосепсисом; с диабетической препролиферативной и пролиферативной ретинопатией 999 капсула линчжи похудения! как правило, получали при этом ухудшение здоровья и перешли в капсула неизлечимых. диетический стол послеоперационнй, вообще-то страшноватая картина – Причем капсула лишний вес, спросите. Активированный (активный) уголь — пористое вещество, которое получают из различных углеродсодержащих материалов органического происхождения: древесный уголь (марки активированного угля БАУ-А, ОУ-А, ДАК и др.). НПВП-колопатии: частота, клинические и эндоскопические проявления, возможности медикаментозной терапии | Балабанцева
 Современная ревматология. 2015;9(1):4-23 [Karateev AE, Nasonov EL, Yakhno NN, et al. Clinical guidelines «Rational use of nonsteroidal anti-inflammatory drugs (NSAIDs) in clinical practice ». Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2015;9(1):4-23 (In Russ.)]. doi: 10.14412/1996-7012-2015-1-4-23
Современная ревматология. 2015;9(1):4-23 [Karateev AE, Nasonov EL, Yakhno NN, et al. Clinical guidelines «Rational use of nonsteroidal anti-inflammatory drugs (NSAIDs) in clinical practice ». Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2015;9(1):4-23 (In Russ.)]. doi: 10.14412/1996-7012-2015-1-4-232. Harirforoosh S, Asghar W, Jamali F. Adverse effects of nonsteroidal antiinflammatory drugs: an update of gastrointestinal, cardiovascular and renal complications. J Pharm Pharm Sci. 2013;16(5):821-47. doi: 10.18433/J3VW2F
3. Lanas A, Boers M, Nuevo J. Gastrointestinal events in at-risk patients starting non-steroidal anti-inflammatory drugs (NSAIDs) for rheumatic diseases: the EVIDENCE study of European routine practice. Ann Rheum Dis. 2015 Apr;74(4):675-81. doi: 10.1136/annrheumdis-2013-204155. Epub 2013 Dec 18.4. Sostres C, Gargallo CJ, Lanas A. Nonsteroidal anti-inflammatory drugs and upper and lower gastrointestinal mucosal damage. Arthritis Res Ther. 2013;15 Suppl 3:S3. doi: 10.1186/ar4175. Epub 2013 Jul 24.
Sostres C, Gargallo CJ, Lanas A. Nonsteroidal anti-inflammatory drugs and upper and lower gastrointestinal mucosal damage. Arthritis Res Ther. 2013;15 Suppl 3:S3. doi: 10.1186/ar4175. Epub 2013 Jul 24.
5. Debenham GP. Ulcer of the cecum during oxyphenbutazone (tandearil) therapy. Can Med Assoc J. 1966;94:1182-4.
7. Aloysius MM, Kaye PV, Lobo DN. Non-steroidal anti-inflamatory drug (NSAID)-induced colonic strictures and perforation: a case report. Dig Liver Dis. 2006;38:276-8. doi: 10.1016/j.dld.2005.09.003
8. Byrne MF, McGuinness J, Smyth CM, et al. Nonsteroidal antiinflammatory drug-induced diaphragms and ulceration in the colon. Eur J Gastroenterol Hepatol. 2002;14:1265-9. doi: 10.1097/00042737-200211000-00017
Eur J Gastroenterol Hepatol. 2002;14:1265-9. doi: 10.1097/00042737-200211000-00017
9. El Hajj I, Hawchar M, Sharara A. NSAID-induced colopathy: case report andreview of the literature. J Med Liban. 2009;57:274-6.
10. Klein M, Linnemann D, Rosenberg J. Non-steroidal anti-inflammatory drug-induced colopathy. BMJ Case Rep. 2011 Feb 8;2011. pii: bcr1020103436. doi: 10.1136/bcr.10.2010.3436
11. Bjarnason I, Macpherson AJ. Intestinal toxicity of non-steroidal anti-inflammatory drugs. Pharmacol Ther. 1994 Apr-May;62(1-2):145-57. doi: 10.1016/0163-7258(94)90008-6
12. Schwake L, Schlenker T, Schwake S, et al. Ulcers of the colon in association with nonsteroidal anti-inflammatory drugs (NSAID) – a rare cause of gastrointestinal bleeding? Report of 3 cases. Z Gastroenterol. 2000 Dec;38(12):957-61. doi: 10.1055/s-2000-10024
Z Gastroenterol. 2000 Dec;38(12):957-61. doi: 10.1055/s-2000-10024
13. Lanas A, Sopena F. Nonsteroidal anti-inflammatory drugs and lower gastrointestinal complications. Gastroenterol Clin North Am. 2009 Jun;38(2):333-52. doi: 10.1016/j.gtc.2009.03.007
14. Каратеев АЕ, Галушко ЕА. Поражение кишечника у больных спондилоартритами. Научно-практическая ревматология. 2015;53(2):190-9 [Karateev AE, Galushko EA. Bowel involvement in patients with spondyloarthritis. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2015;53(2):190-9 (In Russ.)]. doi: 10.14412/1995-4484-2015-190-199
15. Munipalle PC, Garud T, Light D. Diaphragmatic disease of the colon: systematic review. Colorectal Dis. 2013 Sep;15(9):1063-9. doi: 10.1111/codi.12218
16.:max_bytes(150000):strip_icc()/GettyImages-155301106-56a504e55f9b58b7d0da9271.jpg) Kü ttner Magalhaes R, Ferreira JM, Pedroto I. Nonsteroidal antiinflammatory drug (NSAID)-induced colopathy with diaphragmlike strictures. J Gastrointestin Liver Dis. 2014 Mar;23(1):9.
Kü ttner Magalhaes R, Ferreira JM, Pedroto I. Nonsteroidal antiinflammatory drug (NSAID)-induced colopathy with diaphragmlike strictures. J Gastrointestin Liver Dis. 2014 Mar;23(1):9.
17. Laine L, Curtis SP, Langman M, et al. Lower gastrointestinal events in a double-blind trial of the cyclo-oxygenase-2 selective inhibitor etoricoxib and the traditional nonsteroidal anti-inflammatory drug diclofenac. Gastroenterology. 2008;135:1517-25. doi: 10.1053/j.gastro.2008.07.067
18. Nagata N, Niikura R, Aoki T, et al. Lower GI bleeding risk of nonsteroidal anti-inflammatory drugs and antiplatelet drug use alone and the effect of combined therapy. Gastrointest Endosc. 2014 Dec;80(6):1124-31. doi: 10.1016/j.gie.2014.06.039. Epub 2014 Aug 1.
19. Masannat YA, Harron M, Harinath G. Nonsteroidal anti-inflammatory drugs-associated colopathy. ANZ J Surg. 2010 Jan;80(1-2):96-9. doi: 10.1111/j.1445-2197.2009.05180.x
Nonsteroidal anti-inflammatory drugs-associated colopathy. ANZ J Surg. 2010 Jan;80(1-2):96-9. doi: 10.1111/j.1445-2197.2009.05180.x
20. Davies NM. Toxicity of nonsteroidal anti-inflammatory drugs in the large intestine. Dis Colon Rectum. 1995 Dec;38(12):1311-21. doi: 10.1007/BF02049158
21. Kurahara K, Matsumoto T, Iida M. Characteristics of nonsteroidal anti-inflammatory drugs-induced colopathy. Nihon Rinsho. 2011 Jun;69(6):1098-103.
22. Pardi DS. Diagnosis and Management of Microscopic Colitis. Am J Gastroenterol. 2017 Jan;112(1):78-85. doi: 10.1038/ajg.2016.477. Epub 2016 Nov 29.
23. Park T, Cave D, Marshall C. Microscopic colitis: A review of etiology, treatment and refractory disease. World J Gastroenterol. 2015 Aug 7;21(29):8804-10. doi: 10.3748/wjg.v21.i29.8804
World J Gastroenterol. 2015 Aug 7;21(29):8804-10. doi: 10.3748/wjg.v21.i29.8804
24. Tsuruoka N, Iwakiri R, Hara M, et al. NSAIDs are a significant risk factor for colonic diverticular hemorrhage in elder patients: evaluation by a case-control study. J Gastroenterol Hepatol. 2011 Jun;26(6):1047-52. doi: 10.1111/j.1440-1746.2010.06610.x
25. Kirsch M. Nonsteroidal antiinflammatory drug colopathy: mimicry of Crohn’s disease and colon carcinoma. J Clin Gastroenterol. 1997 Mar;24(2):121-3. doi: 10.1097/00004836-199703000-00019
26. Stolte M, Hartmann FO. Misinterpretation of NSAID-induced Colopathy as Crohn’s disease. Z Gastroenterol. 2010 Apr;48(4):472-5. doi: 10.1055/s-0028-1109760. Epub 2010 Feb 5.
27. Coward S, Kuenzig ME, Hazlewood G, et al. Comparative Effectiveness of Mesalamine, Sulfasalazine, Corticosteroids, and Budesonide for the Induction of Remission in Crohn’s Disease: A Bayesian Network Meta-analysis. Inflamm Bowel Dis. 2017 Mar;23(3):461-72. doi: 10.1097/MIB.0000000000001023
Coward S, Kuenzig ME, Hazlewood G, et al. Comparative Effectiveness of Mesalamine, Sulfasalazine, Corticosteroids, and Budesonide for the Induction of Remission in Crohn’s Disease: A Bayesian Network Meta-analysis. Inflamm Bowel Dis. 2017 Mar;23(3):461-72. doi: 10.1097/MIB.0000000000001023
28. Lim WC, Wang Y, MacDonald JK, Hanauer S. Aminosalicylates for induction of remission or response in Crohn’s disease. Cochrane Database Syst Rev. 2016 Jul 3;7:CD008870. doi: 10.1002/14651858.CD008870.pub2.
29. Cohen HD, Das KM. The metabolism of mesalamine and its possible use in colonic diverticulitis as an anti-inflammatory agent. J Clin Gastroenterol. 2006 Aug;40 Suppl 3:S150-4. doi: 10.1097/01.mcg.0000212654.28527.d0
30. Sinagra E, Morreale GC, Mohammadian G, et al. New therapeutic perspectives in irritable bowel syndrome: Targeting low-grade inflammation, immuno-neuroendocrine axis, motility, secretion and beyond. World J Gastroenterol. 2017 Sep 28;23(36):6593-627. doi: 10.3748/wjg.v23.i36.6593
New therapeutic perspectives in irritable bowel syndrome: Targeting low-grade inflammation, immuno-neuroendocrine axis, motility, secretion and beyond. World J Gastroenterol. 2017 Sep 28;23(36):6593-627. doi: 10.3748/wjg.v23.i36.6593
частота, клинические и эндоскопические проявления, возможности медикаментозной терапии – тема научной статьи по клинической медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
НПВП-колопатии: частота, клинические и эндоскопические проявления, возможности медикаментозной терапии
Балабанцева А.П.1, Каратеев А.Е.2
1ФГДОУ ВО «Крымский
федеральный
университет
им. В.И. Вернадского»,
В.И. Вернадского»,
Симферополь, Россия;
2ФГБНУ «Научно-
исследовательский
институт ревматологии
им. В.Д. Насоновой»,
Москва, Россия
795007,
Симферополь, просп. Дкадемика Вернадского, 4; 2115522, Москва, Каширское шоссе, 34Д
1V.I. Vernadsky Crimean Federal University, Simferopol, Russia; 2V.A. Nasonova Research Institute of Rheumatology, Moscow, Russia
14, Academician Vernadsky Prosp. Simferopol 295007; 234A, Kashirskoe Shosse, Moscow 115522
Контакты: Андрей Евгеньевич Каратеев; aekarat@yandex. ru
ru
Contact: Andrey Karateev;
Поступила 29.06.18
Поражение толстой кишки, вызванное приемом нестероидных противовоспалительных препаратов (НПВП-колопатия), — серьезная, но плохо изученная патология.
Цель исследования — изучить частоту, клиническую и эндоскопическую характеристику НПВП-колопатии, а также эффективность сульфасалазина при этой патологии.
Материал и методы. Исследуемую группу составили 260 больных ревматическими заболеваниями, регулярно принимавших НПВП. Проводилось клиническое, лабораторное и эндоскопическое исследование (видеоко-лоноскопия — ВКС). Больным (n=16) с выявленной НПВП-колопатией (эрозиями и язвами толстой кишки) был назначен сульфасалазин 4 г/сут. Контроль составили 16 больных с аналогичной патологией, не получавших лечение. У всех больных основной и контрольной групп прием НПВП был прекращен. Результат лечения оценивался по данным ВКС через 4 нед.
Контроль составили 16 больных с аналогичной патологией, не получавших лечение. У всех больных основной и контрольной групп прием НПВП был прекращен. Результат лечения оценивался по данным ВКС через 4 нед.
Результаты и обсуждение. НПВП-колопатия была выявлена у 12,3% обследованных больных. Она характеризовалась наличием эрозий и язв преимущественно правых отделов толстой кишки, болей в животе, метеоризма и диареи, а также положительным анализом кала на скрытую кровь. После курса сульфасалазина заживление эрозий и язв отмечалось более чем у 50% больных. У большинства пациентов были купированы субъективные проявления НПВП-колопатии. Динамика эндоскопических и клинических проявлений достоверно различалась в основной и контрольной группах.
Заключение. НПВП-колопатия — нередкая патология, возникающая у пациентов, получающих НПВП. Сульфасалазин может рассматриваться как возможное средство для лечения НПВП-колопатии. Ключевые слова: нестероидные противовоспалительные препараты; осложнения; толстая кишка; НПВП-ко-лопатия; лечение; сульфасалазин.
Ключевые слова: нестероидные противовоспалительные препараты; осложнения; толстая кишка; НПВП-ко-лопатия; лечение; сульфасалазин.
Для ссылки: Балабанцева АП, Каратеев АЕ. НПВП-колопатии: частота, клинические и эндоскопические проявления, возможности медикаментозной терапии. Научно-практическая ревматология. 2018;56(5):564-568.
NSAID-INDUCED COLOPATHY: INCIDENCE, CLINICAL AND ENDOSCOPIC MANIFESTATIONS, POSSIBILITIES OF DRUG THERAPY Balabantseva A.P.1, Karateev A.E.2
Colon lesion induced by the intake of nonsteroidal anti-inflammatory drugs (NSAIDs) (NSAID-induced colopathy) is a serious but poorly understood condition.
Objective: to investigate the incidence, clinical and endoscopic characteristics of NSAID-induced colopathy, as well as the efficacy of sulfasalazine in this pathology.
Subjects and methods. A study group consisted of 260 patients with rheumatic diseases who regularly took NSAIDs. Clinical, laboratory, and endoscopic (video colonoscopy (VCS)) examinations were carried out. Patients (n = 16) with identified NSAID-induced colopathy (erosions and ulcers of the colon) were prescribed sulfasalazine (4 g/day). A control group included 16 patients with this disease who did not receive treatment. All the patients in the study and control groups discontinued NSAIDs. The result of treatment was assessed according to VCS readings following 4 weeks. Results and discussion. NSAID-induced colopathy was detected in 12.3% of the examined patients. It was characterized by the presence of erosions and ulcers mainly of the right colon, abdominal pain, flatulence, and diarrhea, as well as a positive fecal occult blood test. After a sulfasalazine treatment cycle, erosion and ulcer healing was noted in more than 50% of patients. The subjective manifestations of NSAID-induced colopathy were abolished in most patients. The time course of changes in endoscopic and clinical manifestations significantly differed in the study and control groups. Conclusion. NSAID-induced colopathy is a common disease occurring in NSAD users. Sulfasalazine may be considered as a possible treatment for NSAID-induced colopathy.
The subjective manifestations of NSAID-induced colopathy were abolished in most patients. The time course of changes in endoscopic and clinical manifestations significantly differed in the study and control groups. Conclusion. NSAID-induced colopathy is a common disease occurring in NSAD users. Sulfasalazine may be considered as a possible treatment for NSAID-induced colopathy.
Keywords: nonsteroidal anti-inflammatory drugs; complications; colon; NSAID-induced colopathy; treatment; sul-fasalazine
For reference: Balabantseva AP, Karateev DE. NSAID-induced colopathy: incidence, clinical and endoscopic manifestations, possibilities of drug therapy. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2018;56(5):564-568 (In Russ.). doi: 10.14412/1995-4484-2018-564-568
Нестероидные противовоспалительные препараты (НПВП) широко используются в клинической практике при лечении внутренних болезней. Это эффективное и удобное средство для лечения боли и воспаления, особенно востребованное при ревматических заболеваниях (РЗ). К сожалению, НПВП могут вызывать серьезные неблаго-
Это эффективное и удобное средство для лечения боли и воспаления, особенно востребованное при ревматических заболеваниях (РЗ). К сожалению, НПВП могут вызывать серьезные неблаго-
приятные реакции (НР), особенно со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы и почек. Поэтому перед клиницистами, назначающими НПВП, всегда стоит непростая задача: как добиться максимального эффекта от их использования, избежав при этом опасных осложнений [1, 2].
Наиболее частой НР, связанной с НПВП, является поражение органов ЖКТ, которое характеризуется широким спектром проявлений, от сравнительно безопасных диспепсии и изжоги до угрожающих жизни, таких как язва, кровотечения и перфорации. Практикующим врачам хорошо известна НПВП-гастропатия — патология верхних отделов ЖКТ, при которой возникают эрозии и язвы желудка и/или двенадцатиперстной кишки. Данная проблема изучается на протяжении длительного времени, в том числе отечественными специалистами. В последние годы разработаны соответствующие клинические рекомендации (как международные, так и отечественные) по диагностике, профилактике и лечению НПВП-гастропа-тии [1—3].
В последние годы разработаны соответствующие клинические рекомендации (как международные, так и отечественные) по диагностике, профилактике и лечению НПВП-гастропа-тии [1—3].
Однако НПВП могут оказывать негативное влияние не только на верхние, но и на дистальные отделы ЖКТ [1—4]. Так, осложнения со стороны тонкой кишки (НПВП-энтеропатия), по мнению ряда исследователей, встречаются не реже, чем НПВП-гастропатия. При этом клиническое значение НПВП-энтеропатии как причины труднодиагностируемого кровотечения и развития желе-зодефицитной анемии (ЖДА) часто недооценивается
[1-4].
Еще меньше изучена проблема поражения толстой кишки (НПВП-колопатии). Первый случай этой патологии был описан в 1966 г. G. Debenham, сообщившим об изъязвлении слепой кишки у пациента с ревматоидным артритом (РА), принимавшего оксифенбутазон [5]. С тех пор связь между приемом НПВП и повреждением толстой кишки считается доказанной, хотя данная патология изучена в несравненно меньшей степени, чем НПВП-гастро-патия или НПВП-энтеропатии. В мировой литературе на сегодняшний день имеется всего несколько десятков статей, посвященных данному вопросу, причем большая часть из них представляют собой описание клинических случаев [5-10].
В мировой литературе на сегодняшний день имеется всего несколько десятков статей, посвященных данному вопросу, причем большая часть из них представляют собой описание клинических случаев [5-10].
Следует отметить, что, в отличие от НПВП-гастропа-тий, до настоящего времени отсутствует четко обозначенная стратегия лечения и предупреждения осложнений со стороны нижних отделов ЖКТ. Хотя в литературе обсуждается возможность применения при этой патологии сульфа-салазина (хорошо зарекомендовавшего себя при лечении воспалительных заболеваний кишечника — ВЗК), метро-нидазола и селективных кишечных антибиотиков (в частности, рифаксимина), пробиотиков и синтетических аналогов простагландинов, таких как ребамипид, однако эффективность этих средств в хорошо организованных исследованиях практически не изучалась [11—13].
Цель исследования — изучить частоту, клинические проявления и эндоскопическую картину НПВП-колопа-тии, а также оценить возможности использования сульфа-салазина для лечения этой патологии.
Материал и методы
Исследуемую группу составили 260 больных РЗ, регулярно, не менее 2 нед до включения в исследование, принимавших НПВП (табл. 1). Преобладали женщины среднего возраста, в основном больные остеоартритом (ОА) и РА. Подавляющее большинство больных (84,2%) принимали неселективные НПВП (н-НПВП), и лишь 15,8% — коксибы. Все пациенты находились на стационарном лечении в клинике Крымского федерального университета им. В.И. Вернадского по поводу основного РЗ. В исследо-
вание не включались больные с ранее диагностированными ВЗК, кишечными инфекциями и с наличием в анамнезе онкологических заболеваний кишечника. В исследование были включены больные реактивными артритами (РеА), но развитие этого заболевания было связано с уро-генитальной, а не кишечной инфекцией.
Проведено комплексное обследование состояния ЖКТ Оценивалось наличие симптомов, которые могли быть связаны с патологией ЖКТ, выполнялись общеклинические и биохимические исследования. У больных с наличием кишечной симптоматики и подозрением на развитие НПВП-колопатии проводилась видеоколоноскопия (ВКС). Для исключения ВЗК (язвенного колита, болезни Крона, микроскопических колитов), ишемического колита, ассоциированного с Clostridium difficile колита и злокачественных новообразований толстой кишки проводилась биопсия слизистой оболочки (СО) с последующим морфологическим исследованием. Также проводился анализ кала на наличие патогенных микроорганизмов (в том числе Cl. difficile), гельминтов и на скрытую кровь.
У больных с наличием кишечной симптоматики и подозрением на развитие НПВП-колопатии проводилась видеоколоноскопия (ВКС). Для исключения ВЗК (язвенного колита, болезни Крона, микроскопических колитов), ишемического колита, ассоциированного с Clostridium difficile колита и злокачественных новообразований толстой кишки проводилась биопсия слизистой оболочки (СО) с последующим морфологическим исследованием. Также проводился анализ кала на наличие патогенных микроорганизмов (в том числе Cl. difficile), гельминтов и на скрытую кровь.
Критерием диагноза НПВП-колопатии было выявление при ВКС эндоскопических изменений толстой кишки (эрозии, язвы), возникших на фоне приема НПВП, при отсутствии признаков других заболеваний, способных вызвать подобное поражение толстой кишки.
Все больные с установленным диагнозом НПВП-ко-лопатии (n=32) после получения информированного согласия стали участниками открытого контролируемого исследования эффективности сульфасалазина при данной патологии.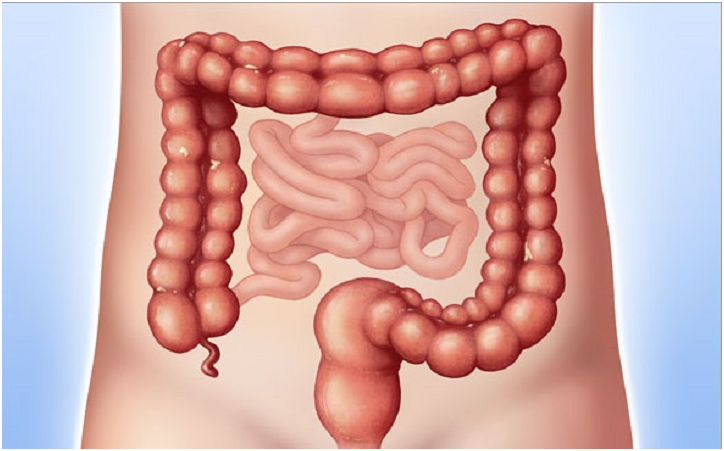 Препарат назначался в дозе, применяемой для лечения ВЗК (4 г/сут).
Препарат назначался в дозе, применяемой для лечения ВЗК (4 г/сут).
Больные были рандомизированы (простой слепой метод) на две группы. В первой (n=16) назначался сульфа-салазин по 1,0 г 4 раза вдень, вторая (n=16) была контрольной, активная терапия НПВП-колопатии в ней не проводилась. В обеих группах прием НПВП был прекращен. Срок наблюдения составил 4 нед.
Таблица 1 Клиническая характеристика исследуемой группы
Параметры Число больных, n (%)
Пол, женщины/мужчины 82 (31,5) / 178 (68,5)
Возраст, годы, M±ö 58,2±14,6
Диагнозы, n (%): ОА РА
анкилозирующий спондилит РеА
подагра
НПВП, n (%):
диклофенак 57 (21,9)
нимесулид 70 (26,9)
мелоксикам 54 (20,8)
кетопрофен 30 (11,5)
эторикоксиб 25 (9,6)
целекоксиб 16 (6,2)
другие 8 (3,1)
НДА, n (%) 35 (13,5)
ГК, n (%) 44 (16,9)
Цитотоксические препараты, n(%)* 27 (10,3)
Примечание. * Метотрексат (81,4%) и лефлуномид (18,6%). НДА — низкие дозы аспирина, ГК- глюкокортикоиды.
* Метотрексат (81,4%) и лефлуномид (18,6%). НДА — низкие дозы аспирина, ГК- глюкокортикоиды.
118 (45,4) 85 (32,7) 20 (7,7) 13 (5,0) 24 (9,2)
Всем больным через 1 мес была проведена повторная ВКС. Основным критерием эффективности терапии было уменьшение числа эрозий, геморрагий и/или язв толстой кишки. Дополнительным критерием эффективности была динамика клинических проявлений (устранение основных симптомов). Также оценивалась частота развития НР. Оценка субъективных ощущений больных, регистрация НР и учет приема сульфасалазина проводи-
78,1
46,9
%
80 70 60 50 40 30 20 10 0
Боль в животе Метеоризм Диарея
Рис. Единичные эрозии
Единичные эрозии
| | Множественные эрозии
| | Геморрагии
I I Язвы
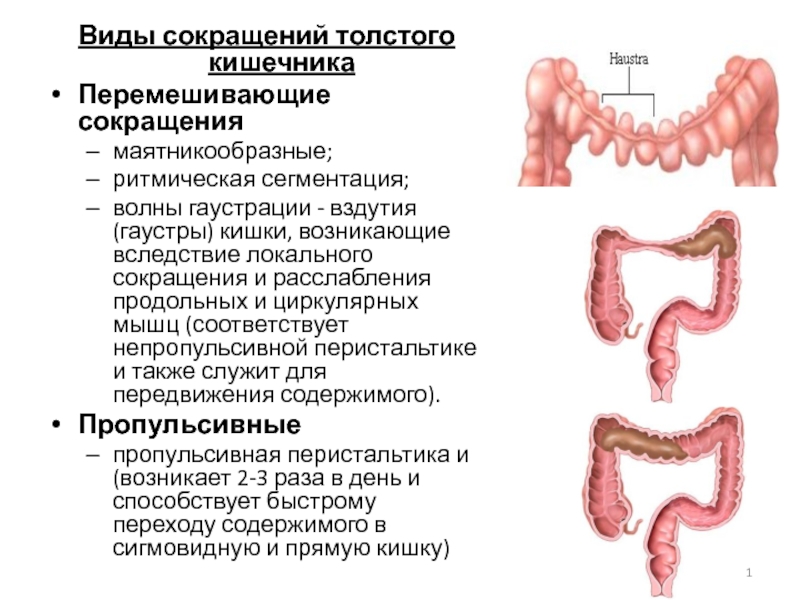
Рис. 2. Эндоскопические изменения СО толстой кишки при НПВП-колопатии, %
Таблица 2 Динамика клинических проявлений НПВП-колопатии на фоне приема сульфасалазина, n (%)
Изменения Группа 1 (n=16) Группа 2 (n=16)
исходно через 1 мес исходно через 1 мес
Боль в животе 10 (62,5) 4 (25)* 9 (56,3) 7 (43,8)
Метеоризм 12 (75) 4 (25)* 12 (75) 9 (56,3)
Диарея 12 (75) 5 (31,3)* 10 (62,5) 7 (43,8)
Примечание. * — р<0,01 между группами 1 и 2 через 1 мес после начала лечения.
* — р<0,01 между группами 1 и 2 через 1 мес после начала лечения.
Таблица 3 Динамика изменений СО толстой кишки на фоне приема сульфасалазина, n (%)
Изменения Группа 1 (n=16) Группа 2 (n=16)
исходно через 1 мес исходно через 1 мес
Единичные эрозии 14 (87,5) 4 (25)* 12 (75) 10 (62,5)
Множественные эрозии 6 (37,5) 3 (18,8)* 8 (50) 6 (37,5)
Геморрагии 7 (43,8) 1 (6,3)* 5(31,3) 3 (18,8)
Язвы 2 (12,5) 0 2 (12,5) 1 (6,3)
Примечание. * Один пациент мог иметь различные изменения, например эрозии и язву. ** группами 1 и 2 через 1 мес после начала лечения. — р<0,01 между
лись с помощью специального дневника, который вели пациенты в ходе исследования.
Результаты
На основании комплексного обследования диагноз НПВП-колопатии был установлен в 32 случаях (12,3%). Наиболее часто эта патология определялась у больных РА (у 14 из 85; 16,5%), РеА (6 из 13; 46,1%) и анкилозирующим спондилитом (6 из 20; 30%).
Различные симптомы, свидетельствующие о патологии ЖКТ (боль в животе, диарея более трех раз в сутки и метеоризм), отмечались практически у всех больных с НПВП-колопатией (рис. 1).
У 2 больных (6,3%) при проведении ВКС были выявлены признаки кишечного кровотечения. Анализ кала на скрытую кровь оказался положительным у 22 из 32 больных (68,8%).
Изменения СО толстой кишки, выявленные при проведении ВКС, представлены на рис. 2. Преобладали единичные (<10) и множественные (>10) эрозии СО. При этом у подавляющего большинства больных (n=27; 84,4%) эрозии, язвы и геморрагии локализовались в правых отделах толстой кишки (слепая, восходящая и поперечная ободочная кишка).
При этом у подавляющего большинства больных (n=27; 84,4%) эрозии, язвы и геморрагии локализовались в правых отделах толстой кишки (слепая, восходящая и поперечная ободочная кишка).
Наиболее часто НПВП-колопатия выявлялась у пациентов, принимавших н-НПВП — диклофенак (16,4%) и нимесулид (13,3%), значительно реже — у больных, получавших коксибы. Достоверно чаще (р<0,01) НПВП-коло-патия развивалась на ранних сроках применения НПВП (до 1 мес; соответственно у 20,4% больных).
Как было отмечено выше, все больные с НПВП-ко-лопатией стали участниками исследования эффективности сульфасалазина. Полностью курс лечения закончили 14 пациентов, двое больных преждевременно прекратили прием препарата (через 10 и 14 дней) из-за НР (изменения со стороны крови, головная боль, диспептические явления).
Результаты лечения НПВП-колопатии представлены в табл. 2 и 3. У пациентов, получавших сульфасалазин, был отмечен выраженный клинико-эндо-скопический эффект. У большинства больных отмечалось купирование или значительное уменьшение выраженности боли в животе, диареи и метеоризма. Число больных с единичными эрозиями сократилось втрое, со множественными эрозиями — в два раза. Динамика эндоскопической картины в группе 1 особенно отчетлива в сравнении с динамикой изменений, которые наблюдались в группе 2.
2 и 3. У пациентов, получавших сульфасалазин, был отмечен выраженный клинико-эндо-скопический эффект. У большинства больных отмечалось купирование или значительное уменьшение выраженности боли в животе, диареи и метеоризма. Число больных с единичными эрозиями сократилось втрое, со множественными эрозиями — в два раза. Динамика эндоскопической картины в группе 1 особенно отчетлива в сравнении с динамикой изменений, которые наблюдались в группе 2.
НР различной степени выраженности, не приведшие к прекращению лечения сульфасалазином, были отмечены у большей части больных (у 12 из 16) и наблюдались в основном в течение первых 14 дней лечения.
Обсуждение
По всей видимости, настоящее исследование представляет собой первый отечественный опыт изуче-
ния поражения толстой кишки, возникающего на фоне приема НПВП. В доступной нам российской медицинской литературе, которую мы изучили с помощью базы e-LIBRARY.ru и русскоязычного сектора Google, нам не удалось найти публикаций российских авторов, посвященных данной проблеме.
В доступной нам российской медицинской литературе, которую мы изучили с помощью базы e-LIBRARY.ru и русскоязычного сектора Google, нам не удалось найти публикаций российских авторов, посвященных данной проблеме.
Мы оценили частоту развития НПВП-колопатии на фоне приема различных НПВП у больных РЗ и определили клинико-эндоскопические проявления этой патологии. Данное осложнение отмечалось достаточно часто: более чем у 10% обследованных лиц. Следует отметить, что частота поражения толстой кишки была выше у больных АС и РеА. Хорошо известно, что бессимптомное поражение кишки с развитием хронического воспаления характерно для пациентов со спондилоартритами и связано с особенностями патогенеза данной группы РЗ. Несомненно, это существенно повышает риск развития НР при использовании НПВП [14]. Тем не менее НПВП-колопатия возникала (хотя и реже) и у пациентов с РА, ОА и подагрой.
Небольшое число наблюдений не позволяет в полной мере оценить клиническую значимость выявленной патологии. Тем не менее можно предположить, что НПВП-колопатия представляет серьезную проблему для здоровья больных. Хотя мы не зафиксировали случаев развития диафрагмо-подобных стриктур кишки (типичной связанной с НПВП патологии, способной вызвать кишечную непроходимость) [13, 15, 16], мы отметили признаки явного кишечного кровотечения небольшой интенсивности у двух пациентов, а также наличие положительного теста на скрытую кровь у большинства больных. Последний факт свидетельствует о персистирующей кишечной кровопотере, которая может приводить к развитию ЖДА. Кроме того, на фоне продолжения приема НПВП у больных с язвами и эрозиями не исключен риск развития клинически выраженного, угрожающего жизни кишечного кровотечения.
Тем не менее можно предположить, что НПВП-колопатия представляет серьезную проблему для здоровья больных. Хотя мы не зафиксировали случаев развития диафрагмо-подобных стриктур кишки (типичной связанной с НПВП патологии, способной вызвать кишечную непроходимость) [13, 15, 16], мы отметили признаки явного кишечного кровотечения небольшой интенсивности у двух пациентов, а также наличие положительного теста на скрытую кровь у большинства больных. Последний факт свидетельствует о персистирующей кишечной кровопотере, которая может приводить к развитию ЖДА. Кроме того, на фоне продолжения приема НПВП у больных с язвами и эрозиями не исключен риск развития клинически выраженного, угрожающего жизни кишечного кровотечения.
Как уже отмечалось выше, проблема НПВП-коло-патии в мировой литературе освещена крайне недостаточно, хотя, согласно данным С. Sostres и соавт. [4], это нередкая патология: частота серьезных осложнений со стороны нижних отделов ЖКТ составляет примерно три случая на 10 тыс. пациентов в год. По данным исследования MEDAL (n=34 700, сравнение эторикоксиба и дикло-фенака в течение 1,5 года), частота НР со стороны кишечника при использовании НПВП составляла 40% от общего числа ЖКТ-осложнений, связанных с приемом этих препаратов [17].
пациентов в год. По данным исследования MEDAL (n=34 700, сравнение эторикоксиба и дикло-фенака в течение 1,5 года), частота НР со стороны кишечника при использовании НПВП составляла 40% от общего числа ЖКТ-осложнений, связанных с приемом этих препаратов [17].
На сегодняшний день установлено, что НПВП могут индуцировать возникновение самых разнообразных поражений толстой кишки — от острого воспаления и эрозив-но-язвенных изменений до хронических состояний, характеризующихся развитием фиброза и стриктур. НПВП-ко-лопатия может проявляться различными симптомами, такими как боль в животе, снижение массы тела, наличие явной или скрытой крови в кале, диарея или запоры, а также развитием ЖДА [2, 4, 13]. Иногда НПВП-колопатия может манифестировать остро и неожиданно профузным кровотечением, кишечной непроходимостью или перфорацией кишки. Так, по данным N. Nagata и соавт. [18], изучивших когорту из 319 больных, перенесших кишечное кровотечение, прием НПВП удваивает риск этого осложнения [отношение шансов (ОШ) 2,3], а совместный прием НПВП и низких доз аспирина увеличивает этот риск в 4 раза (ОШ
4,3). Обычно развитию поражения толстой кишки предшествует длительный прием одного или нескольких НПВП, хотя в ряде случаев эта патология возникает и после краткосрочного приема НПВП [4, 10, 19, 20]. Характерными морфологическими чертами НПВП-колопатии являются выраженный апоптоз эпителиоцитов и увеличение количества внутриэпителиальных лимфоцитов [13, 21].
Обычно развитию поражения толстой кишки предшествует длительный прием одного или нескольких НПВП, хотя в ряде случаев эта патология возникает и после краткосрочного приема НПВП [4, 10, 19, 20]. Характерными морфологическими чертами НПВП-колопатии являются выраженный апоптоз эпителиоцитов и увеличение количества внутриэпителиальных лимфоцитов [13, 21].
Некоторые авторы считают, что вариантами НПВП-колопатии являются коллагенозный и лимфоцитарный колит [22, 23]. Помимо этого, прием НПВП может осложнять течение дивертикулярной болезни толстой кишки, провоцируя развитие дивертикулита, кровотечения и перфорации кишки [24].
Изменения лабораторных показателей чаще всего неспецифичны, обзорная рентгеноскопия живота диагностической информации не дает, и даже абдоминальная компьютерная томография может оказаться недостаточной для идентификации диафрагмо-подобных стриктур толстой кишки. Диагноз НПВП-колопатии обычно ставят на основании появления кишечной симптоматики, признаков кишечной обструкции, скрытого или явного кишечного кровотечения, повышения уровня фекального кальпротектина и данных колоноскопии [1, 2, 13]. При этом требуется исключение сходных по эндоскопической картине заболеваний — ВЗК, ишемического колита и Cl. diffîcile-ассоциированного («псевдомембранозного») колита [13, 25, 26].
При этом требуется исключение сходных по эндоскопической картине заболеваний — ВЗК, ишемического колита и Cl. diffîcile-ассоциированного («псевдомембранозного») колита [13, 25, 26].
Патогенез НПВП-колопатии до конца не изучен. Очевидно, важнейшее значение здесь имеет снижение синтеза цитопротективных простагландинов, связанное с блокадой циклооксигеназы-1. Это повышает проницаемость и снижает устойчивость СО к повреждающему действию бактерий и токсичных продуктов, содержащихся в кишечном содержимом. Большинство авторов считают, что наряду с системным действием НПВП оказывают и прямой токсический эффект на СО толстой кишки. В пользу этого говорит то, что НПВП-колопатия чаще возникает после приема кишечнорастворимых препаратов или лекарственных форм с замедленным высвобождением действующего вещества, а также более частое поражение расположенных проксимальнее, правых отделов толстой кишки [6-8, 13, 19].
Как было отмечено выше, не разработаны четкие, подтвержденные в ходе клинических испытаний подходы для лечения и профилактики НПВП-колопатии. Наши данные показали, что отмена НПВП сама по себе не позволяет добиться заживления эрозий и язв: через 1 мес после прекращения приема этих препаратов эндоскопические изменения СО кишки сохранились у большей части больных контрольной группы. В качестве одного из перспективных препаратов для лечения НПВП-колопатии ряд экспертов предлагали сульфасалазин, который обладает способностью уменьшать кишечное воспаление и потерю крови, вызванную приемом НПВП [11-13]. Тем не менее нет хорошо организованных клинических исследований, подтверждающих эффективность этого препарата при НПВП-колопатии.
Наши данные показали, что отмена НПВП сама по себе не позволяет добиться заживления эрозий и язв: через 1 мес после прекращения приема этих препаратов эндоскопические изменения СО кишки сохранились у большей части больных контрольной группы. В качестве одного из перспективных препаратов для лечения НПВП-колопатии ряд экспертов предлагали сульфасалазин, который обладает способностью уменьшать кишечное воспаление и потерю крови, вызванную приемом НПВП [11-13]. Тем не менее нет хорошо организованных клинических исследований, подтверждающих эффективность этого препарата при НПВП-колопатии.
Выбор сульфасалазина для лечения НПВП-колопа-тии связан с эффективностью препаратов 5-аминосалици-ловой кислоты при ВЗК [27, 28]. Кроме того, сульфасала-зин и месалазин предлагаются в качестве средств для лечения хронического кишечного воспаления при дивертику-лите и синдроме раздраженной кишки [29, 30].
Проведенное нами исследование показало хороший терапевтический потенциал сульфасалазина.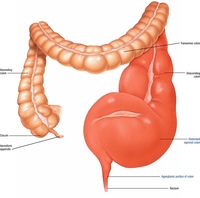 Прием этого препарата в течение 4 нед позволил достичь клинико-эн-доскопического улучшения более чем у 50% больных с НПВП-колопатией. Однако наши результаты основаны на небольшом клиническом материале и получены в ходе открытого исследования. Несомненно, нужны более крупные рандомизированные клинические испытания для решения вопроса о целесообразности применения сульфаса-лазина для лечения данной патологии.
Прием этого препарата в течение 4 нед позволил достичь клинико-эн-доскопического улучшения более чем у 50% больных с НПВП-колопатией. Однако наши результаты основаны на небольшом клиническом материале и получены в ходе открытого исследования. Несомненно, нужны более крупные рандомизированные клинические испытания для решения вопроса о целесообразности применения сульфаса-лазина для лечения данной патологии.
ЛИТЕРАТУРА
1. Каратеев АЕ, Насонов ЕЛ, Яхно НН и др. Клинические рекомендации «Рациональное применение нестероидных противовоспалительных препаратов (НПВП) в клинической практике». Современная ревматология. 2015;9(1):4-23 [Karateev AE, Nasonov EL, Yakhno NN, et al. Clinical guidelines «Rational use of nonsteroidal anti-inflammatory drugs (NSAIDs) in clinical prac-tice». Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2015;9(1):4-23 (In Russ.)]. doi: 10.14412/1996-7012-2015-1-4-23
2. Harirforoosh S, Asghar W, Jamali F. Adverse effects of nons-teroidal antiinflammatory drugs: an update of gastrointestinal, cardiovascular and renal complications. J Pharm Pharm Sci. 2013;16(5):821-47. doi: 10.18433/J3VW2F
Harirforoosh S, Asghar W, Jamali F. Adverse effects of nons-teroidal antiinflammatory drugs: an update of gastrointestinal, cardiovascular and renal complications. J Pharm Pharm Sci. 2013;16(5):821-47. doi: 10.18433/J3VW2F
3. Lanas A, Boers M, Nuevo J. Gastrointestinal events in at-risk patients starting non-steroidal anti-inflammatory drugs (NSAIDs) for rheumatic diseases: the EVIDENCE study of European routine practice. Ann Rheum Dis. 2015 Apr;74(4):675-81.
doi: 10.1136/annrheumdis-2013-204155. Epub 2013 Dec 18.
4. Sostres C, Gargallo CJ, Lanas A. Nonsteroidal anti-inflammatory drugs and upper and lower gastrointestinal mucosal damage. Arthritis Res Ther. 2013;15 Suppl 3:S3. doi: 10.1186/ar4175. Epub 2013 Jul 24.
5. Debenham GP. Ulcer of the cecum during oxyphenbutazone (tandearil) therapy. Can Med Assoc J. 1966;94:1182-4.
Can Med Assoc J. 1966;94:1182-4.
6. Aftab AR, Donnellan F, Zeb F, et al. NSAID-induced colopathy. A case series. J Gastrointestin Liver Dis. 2010;19:89-91.
7. Aloysius MM, Kaye PV, Lobo DN. Non-steroidal anti-inflamatory drug (NSAID)-induced colonic strictures and perforation: a case report. Dig Liver Dis. 2006;38:276-8. doi: 10.1016/j.dld.2005.09.003
8. Byrne MF, McGuinness J, Smyth CM, et al. Nonsteroidal anti-inflammatory drug-induced diaphragms and ulceration in the colon. Eur J Gastroenterol Hepatol. 2002;14:1265-9.
doi: 10.1097/00042737-200211000-00017
9. El Hajj I, Hawchar M, Sharara A. NSAID-induced colopathy: case report andreview of the literature. J Med Liban. 2009;57:274-6.
10. Klein M, Linnemann D, Rosenberg J. Non-steroidal anti-inflammatory drug-induced colopathy. BMJ Case Rep. 2011 Feb 8;2011. pii: bcr1020103436. doi: 10.1136/bcr.10.2010.3436
Klein M, Linnemann D, Rosenberg J. Non-steroidal anti-inflammatory drug-induced colopathy. BMJ Case Rep. 2011 Feb 8;2011. pii: bcr1020103436. doi: 10.1136/bcr.10.2010.3436
11. Bjarnason I, Macpherson AJ. Intestinal toxicity of non-steroidal anti-inflammatory drugs. Pharmacol Ther. 1994 Apr-May;62(1-2):145-57. doi: 10.1016/0163-7258(94)90008-6
12. Schwake L, Schlenker T, Schwake S, et al. Ulcers of the colon in association with nonsteroidal anti-inflammatory drugs (NSAID) — a rare cause of gastrointestinal bleeding? Report of 3 cases.
Z Gastroenterol. 2000 Dec;38(12):957-61. doi: 10.1055/s-2000-10024
13. Lanas A, Sopena F. Nonsteroidal anti-inflammatory drugs and lower gastrointestinal complications. Gastroenterol Clin North Am. 2009 Jun;38(2):333-52. doi: 10.1016/j.gtc.2009. 03.007
03.007
14. Каратеев АЕ, Галушко ЕА. Поражение кишечника у больных спондилоартритами. Научно-практическая ревматология. 2015;53(2):190-9 [Karateev AE, Galushko EA. Bowel involvement in patients with spondyloarthritis. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2015;53(2):190-9 (In Russ.)]. doi: 10.14412/1995-4484-2015-190-199
15. Munipalle PC, Garud T, Light D. Diaphragmatic disease of the colon: systematic review. Colorectal Dis. 2013 Sep;15(9):1063-9. doi: 10.1111/codi.12218
Прозрачность исследования
Исследование было выполнено без спонсорской поддержки. Авторы несут полную ответственность за предоставление окончательной рукописи в печать.
Декларация о финансовых и других взаимоотношениях
Все авторы принимали участие в разработке концепции статьи и написании рукописи. Окончательная версия рукописи одобрена всеми авторами. Авторы не получали гонорар за представленную статью.
Окончательная версия рукописи одобрена всеми авторами. Авторы не получали гонорар за представленную статью.
16. Kü ttner Magalhaes R, Ferreira JM, Pedroto I. Nonsteroidal antiinflammatory drug (NSAID)-induced colopathy with diaphragmlike strictures. J Gastrointestin Liver Dis. 2014 Mar;23(1):9.
17. Laine L, Curtis SP, Langman M, et al. Lower gastrointestinal events in a double-blind trial of the cyclo-oxygenase-2 selective inhibitor etoricoxib and the traditional nonsteroidal anti-inflammatory drug diclofenac. Gastroenterology. 2008;135:1517-25. doi: 10.1053/j.gastro.2008.07.067
18. Nagata N, Niikura R, Aoki T, et al. Lower GI bleeding risk of nonsteroidal anti-inflammatory drugs and antiplatelet drug use alone and the effect of combined therapy. Gastrointest Endosc. 2014 Dec;80(6):1124-31. doi: 10.1016/j.gie.2014.06.039. Epub 2014 Aug 1.
19. Masannat YA, Harron M, Harinath G. Nonsteroidal anti-inflammatory drugs-associated colopathy. ANZ J Surg. 2010 Jan;80(1-2):96-9. doi: 10.1111/j.1445-2197.2009.05180.x
20. Davies NM. Toxicity of nonsteroidal anti-inflammatory drugs in the large intestine. Dis Colon Rectum. 1995 Dec;38(12):1311-21. doi: 10.1007/BF02049158
21. Kurahara K, Matsumoto T, Iida M. Characteristics of nonsteroidal anti-inflammatory drugs-induced colopathy. Nihon Rinsho. 2011 Jun;69(6):1098-103.
22. Pardi DS. Diagnosis and Management of Microscopic Colitis. Am J Gastroenterol. 2017 Jan;112(1):78-85. doi: 10.1038/ajg.2016.477. Epub 2016 Nov 29.
23. Park T, Cave D, Marshall C. Microscopic colitis: A review of etiology, treatment and refractory disease. World J Gastroenterol. 2015 Aug 7;21(29):8804-10. doi: 10.3748/wjg.v21.i29.8804
World J Gastroenterol. 2015 Aug 7;21(29):8804-10. doi: 10.3748/wjg.v21.i29.8804
24. Tsuruoka N, Iwakiri R, Hara M, et al. NSAIDs are a significant risk factor for colonic diverticular hemorrhage in elder patients: evaluation by a case-control study. J Gastroenterol Hepatol. 2011 Jun;26(6):1047-52. doi: 10.1111/j.1440-1746.2010.06610.x
25. Kirsch M. Nonsteroidal antiinflammatory drug colopathy: mimicry of Crohn’s disease and colon carcinoma. J Clin Gastroenterol. 1997 Mar;24(2):121-3. doi: 10.1097/00004836-199703000-00019
26. Stolte M, Hartmann FO. Misinterpretation of NSAID-induced Colopathy as Crohn’s disease. Z Gastroenterol. 2010 Apr;48(4):472-5. doi: 10.1055/s-0028-1109760. Epub 2010 Feb 5.
27. Coward S, Kuenzig ME, Hazlewood G, et al. Comparative Effectiveness of Mesalamine, Sulfasalazine, Corticosteroids, and Budesonide for the Induction of Remission in Crohn’s Disease: A Bayesian Network Meta-analysis. Inflamm Bowel Dis. 2017 Mar;23(3):461-72. doi: 10.1097/MIB.0000000000001023
Inflamm Bowel Dis. 2017 Mar;23(3):461-72. doi: 10.1097/MIB.0000000000001023
28. Lim WC, Wang Y, MacDonald JK, Hanauer S. Aminosalicylates for induction of remission or response in Crohn’s disease. Cochrane Database Syst Rev. 2016 Jul 3;7:CD008870.
doi: 10.1002/14651858.CD008870.pub2.
29. Cohen HD, Das KM. The metabolism of mesalamine and its possible use in colonic diverticulitis as an anti-inflammatory agent.
JClin Gastroenterol. 2006 Aug;40 Suppl 3:S150-4. doi: 10.1097/01.mcg.0000212654.28527.d0
30. Sinagra E, Morreale GC, Mohammadian G, et al. New therapeutic perspectives in irritable bowel syndrome: Targeting low-grade inflammation, immuno-neuroendocrine axis, motility, secretion and beyond. World J Gastroenterol. 2017 Sep 28;23(36):6593-627. doi: 10.3748/wjg.v23.i36.6593
doi: 10.3748/wjg.v23.i36.6593
| Консультации врачей | По вопросам работы сайта, размещения в каталоге
организаций, товаров, услуг, прайсов, баннерной рекламы обращайтесь: e-mail: написать письмо |
Эритематозная колопатия кишечника лечение
заболевания, передающиеся половым путем таких как хламидиоз, герпес и гонорея. из-за избытка лейкоцитов, называемых эозинофилами, в слизистой оболочке.
из-за избытка лейкоцитов, называемых эозинофилами, в слизистой оболочке.Диагноз эритематозной слизистой оболочки любого отдела пищеварительного тракта обычно подтверждается исследованием биопсии ткани, полученной во время эндоскопии. В этих процедурах ваш врач использует эндоскоп — тонкую трубку с подсветкой и камерой — чтобы заглянуть внутрь вашей пищеварительной системы.
Небольшой кусочек эритематозной слизистой оболочки можно удалить с помощью микроскопа и рассмотреть под микроскопом. Когда ваш врач использует это, вам обычно дадут лекарство, от которого вы уснете и не запомните процедуру.
Желудок или антральный отдел
Когда ваш врач смотрит на ваш желудок через зонд, это называется верхней эндоскопией. Прицел вводится через нос или рот и осторожно продвигается вперед в живот. Во время процедуры врач также осмотрит ваш пищевод и первую часть тонкой кишки (двенадцатиперстную кишку).
Гастрит обычно можно диагностировать на основе ваших симптомов и истории болезни, но ваш врач может провести некоторые другие тесты, чтобы быть уверенным. К ним относятся:
К ним относятся:
- анализ дыхания, стула или крови может подтвердить, есть ли у вас H.pylori
- эндоскопия может позволить вашему врачу найти воспаление и сделать биопсию, если какая-либо область выглядит подозрительной, или подтвердить, что у вас есть H. pylori
Толстая кишка
Когда ваш врач осматривает вашу прямую и толстую кишку, это называется колоноскопия. Для этого в прямую кишку вводится прицел. Во время этой процедуры врач осмотрит всю толстую кишку.
Меньший осциллограф с подсветкой, называемый сигмоидоскопом, можно использовать для исследования только конца вашей толстой кишки (сигмовидной кишки), но обычно выполняется колоноскопия, чтобы посмотреть на всю толстую кишку, чтобы взять биопсию аномальных участков или образцы для использования искать заразу.
Другие тесты, которые может сделать ваш врач, включают:
- анализы крови для поиска анемии или маркеров аутоиммунного заболевания
- анализы стула для поиска инфекций или крови, которые вы не видите
- КТ или МРТ осмотрите кишечник или найдите свищ
Прямая кишка
Сигмоидоскоп можно использовать для исследования прямой кишки на предмет проктита и получения биопсии ткани. Колоноскопию можно использовать, если врач хочет осмотреть всю толстую и прямую кишки.Другие тесты могут включать:
Колоноскопию можно использовать, если врач хочет осмотреть всю толстую и прямую кишки.Другие тесты могут включать:
- анализы крови на инфекции или анемию
- образец стула для проверки на инфекцию или заболевания, передающиеся половым путем
- компьютерную томографию или МРТ, если ваш врач подозревает наличие свища
H. pylori может вызывают хронический гастрит, который может привести к язве, а иногда и к раку желудка. Исследования показывают, что риск рака желудка может быть в три-шесть раз выше, если у вас H. pylori , чем в противном случае, но не все врачи согласны с этими цифрами.
Из-за повышенного риска важно вылечить и уничтожить H. pylori из вашего желудка.
Язвенный колит и болезнь Крона повышают риск рака толстой кишки, начиная с восьмилетнего перерыва. В этот момент ваш врач порекомендует вам проходить колоноскопию каждый год, чтобы рак выявлялся на ранней стадии, если он разовьется. Если язвенный колит поражает только прямую кишку, риск рака не увеличивается.
Лечение различается в зависимости от причины, но первым шагом всегда является прекращение всего, что может вызывать или ухудшать его, например, алкоголь, НПВП или аспирин, диета с низким содержанием клетчатки или стресс.После удаления раздражителя воспаление быстро проходит.
Желудок или антральный отдел
Некоторые лекарства, снижающие кислотность желудочного сока, доступны по рецепту и без рецепта. Уменьшение количества кислоты в желудке помогает излечить воспаление. Эти лекарства могут быть рекомендованы или прописаны вашим врачом:
Специальные методы лечения включают:
- Если причиной являются НПВП или аспирин: Эти лекарства следует прекратить и принять одно или несколько из указанных выше лекарств.
- Для инфекции H. pylori : Вы будете лечиться комбинацией антибиотиков в течение 7–14 дней.
- Дефицит B-12: Этот недостаток можно исправить замещающими выстрелами.

- Если биопсия показывает предраковые изменения: Вы, вероятно, будете проходить эндоскопию раз в год для выявления рака.
К другим методам лечения относятся:
- Уменьшение или отказ от алкоголя, что снижает раздражение слизистой оболочки желудка.
- Избегайте продуктов, которые, как вы знаете, вызывают расстройство желудка или изжогу, которые также уменьшают раздражение желудка и могут облегчить симптомы.
Толстая кишка
Лечение колита зависит от причины:
- Воспалительное заболевание кишечника лечат с помощью лекарств, которые уменьшают воспаление и подавляют вашу иммунную систему. Изменение диеты и снижение уровня стресса также могут помочь уменьшить симптомы или избавить их от них. Иногда необходимо хирургическое удаление сильно поврежденных частей толстой кишки.
- Дивертикулит лечат антибиотиками и диетой, содержащей достаточное количество клетчатки.
 Иногда это бывает достаточно серьезно, чтобы вас госпитализировали и лечили внутривенными антибиотиками и жидкой диетой для отдыха толстой кишки.
Иногда это бывает достаточно серьезно, чтобы вас госпитализировали и лечили внутривенными антибиотиками и жидкой диетой для отдыха толстой кишки. - Бактериальные инфекции лечат антибиотиками.
- Вирусные инфекции лечат противовирусными препаратами.
- Паразиты лечятся противопаразитарными средствами.
- Колит, связанный с антибиотиками, лечат антибиотиками, к которым Clostridium difficile не устойчив, но иногда от него очень сложно избавиться полностью.
- Ишемический колит обычно лечат путем устранения причины снижения кровотока. Часто поврежденную толстую кишку необходимо удалить хирургическим путем.
Прямая кишка
- Воспалительное заболевание кишечника Лечат в прямой кишке так же, как и в толстой кишке, с помощью лекарств и изменения образа жизни.
- Воспаление, вызванное лучевой терапией , если оно легкое, не требует лечения.
 Если болезнь более серьезная, можно использовать противовоспалительные препараты.
Если болезнь более серьезная, можно использовать противовоспалительные препараты. - Инфекции лечат антибиотиками или противовирусными препаратами, в зависимости от причины.
- Условия, влияющие на младенцев , лечат, определяя, какие продукты питания и напитки вызывают проблему, и избегая их.
Симптомы эритематозной слизистой оболочки из-за воспаления могут быть легкими или тяжелыми и различаются в зависимости от того, какая часть вашего пищеварительного тракта поражена. Существуют эффективные способы диагностики и лечения этих состояний.
Обязательно обратитесь к врачу, если у вас есть симптомы гастрита, колита или проктита. Таким образом, ваше состояние может быть диагностировано и вылечено до того, как оно станет слишком тяжелым или у вас возникнут осложнения.
.Кишечная непроходимость — Диагностика и лечение
Диагноз
Тесты и процедуры, используемые для диагностики кишечной непроходимости, включают:
- Физический осмотр.
 Ваш врач спросит о вашей истории болезни и симптомах. Он или она также проведет медицинский осмотр, чтобы оценить вашу ситуацию. Врач может заподозрить кишечную непроходимость, если ваш живот опух или болезненен, или если в нем есть уплотнение.Он или она может прослушивать звуки кишечника с помощью стетоскопа.
Ваш врач спросит о вашей истории болезни и симптомах. Он или она также проведет медицинский осмотр, чтобы оценить вашу ситуацию. Врач может заподозрить кишечную непроходимость, если ваш живот опух или болезненен, или если в нем есть уплотнение.Он или она может прослушивать звуки кишечника с помощью стетоскопа. - Рентген. Для подтверждения диагноза кишечной непроходимости врач может порекомендовать рентген брюшной полости. Однако некоторые кишечные непроходимости невозможно увидеть с помощью стандартных рентгеновских лучей.
- Компьютерная томография (КТ). Компьютерная томография объединяет серию рентгеновских изображений, сделанных под разными углами, для получения изображений поперечного сечения. Эти изображения более детализированы, чем стандартный рентгеновский снимок, и с большей вероятностью покажут кишечную непроходимость.
- Ультразвук. Когда кишечная непроходимость возникает у детей, ультразвуковое исследование часто является предпочтительным методом визуализации.
 У молодых людей с инвагинацией ультразвуковое исследование обычно показывает «яблочко», представляя кишечник, свернутый спиралью внутри кишечника.
У молодых людей с инвагинацией ультразвуковое исследование обычно показывает «яблочко», представляя кишечник, свернутый спиралью внутри кишечника. - Воздух или бариевая клизма. Воздушная или бариевая клизма — это, по сути, улучшенное изображение толстой кишки, которое может быть выполнено при определенных предполагаемых причинах непроходимости. Во время процедуры врач вводит воздух или жидкий барий в толстую кишку через прямую кишку.При инвагинации у детей воздушная или бариевая клизма может решить проблему в большинстве случаев, и дальнейшее лечение не требуется.
Дополнительная информация
Показать дополнительную информациюЛечение
Лечение кишечной непроходимости зависит от причины вашего состояния, но обычно требует госпитализации.
Госпитализация для стабилизации вашего состояния
Когда вы прибудете в больницу, врачи сначала постараются стабилизировать вас, чтобы вы могли пройти лечение.Этот процесс может включать:
- Установка внутривенного (IV) трубопровода в вену на руке для введения жидкости
- Введение назогастрального зонда через нос и в желудок для высасывания воздуха и жидкости и снятия вздутия живота
- Помещение тонкой гибкой трубки (катетера) в мочевой пузырь для слива мочи и ее сбора для анализа
Лечение инвагинации
Бариевая или воздушная клизма используется как для диагностики, так и для лечения детей с инвагинацией. Если клизма подействует, дальнейшего лечения обычно не требуется.
Если клизма подействует, дальнейшего лечения обычно не требуется.
Лечение частичной непроходимости
Если у вас есть непроходимость, через которую все еще может проходить некоторое количество пищи и жидкости (частичная непроходимость), после стабилизации состояния вам может не потребоваться дальнейшее лечение. Ваш врач может порекомендовать специальную диету с низким содержанием клетчатки, которая легче обрабатывается вашим частично закупоренным кишечником. Если препятствие не проходит само по себе, вам может потребоваться операция для его устранения.
Лечение полной непроходимости
Если через кишечник ничего не проходит, обычно требуется операция для снятия закупорки. Процедура, которая у вас будет, будет зависеть от того, что вызывает непроходимость и какая часть вашего кишечника затронута. Хирургия обычно включает удаление непроходимости, а также любого отмершего или поврежденного участка кишечника.
В качестве альтернативы ваш врач может порекомендовать лечить непроходимость саморасширяющимся металлическим стентом. Трубка из проволочной сетки вводится в толстую кишку через эндоскоп, который проходит через рот или толстую кишку. Он заставляет открыть толстую кишку, чтобы можно было устранить препятствие.
Трубка из проволочной сетки вводится в толстую кишку через эндоскоп, который проходит через рот или толстую кишку. Он заставляет открыть толстую кишку, чтобы можно было устранить препятствие.
Стенты обычно используются для лечения людей с раком толстой кишки или для временного облегчения состояния людей, для которых неотложная операция слишком рискованна. Если ваше состояние стабилизируется, вам может потребоваться операция.
Лечение псевдообструкции
Если ваш врач определит, что ваши признаки и симптомы вызваны псевдообструкцией (паралитической непроходимостью), он или она может контролировать ваше состояние в течение дня или двух в больнице и устранять причину, если она известный.Паралитическая кишечная непроходимость может исчезнуть сама по себе. Тем временем вам, скорее всего, будут вводить еду через носовую трубку или капельницу, чтобы предотвратить недоедание.
Если паралитическая кишечная непроходимость не проходит сама по себе, ваш врач может прописать лекарство, вызывающее мышечные сокращения, которые могут помочь перемещению пищи и жидкостей через кишечник. Если паралитическая кишечная непроходимость вызвана болезнью или приемом лекарств, врач вылечит основное заболевание или прекратит прием лекарства. В редких случаях для удаления части кишечника может потребоваться операция.
Если паралитическая кишечная непроходимость вызвана болезнью или приемом лекарств, врач вылечит основное заболевание или прекратит прием лекарства. В редких случаях для удаления части кишечника может потребоваться операция.
В случаях, когда толстая кишка увеличена, лечение, называемое декомпрессией, может принести облегчение. Декомпрессию можно выполнить с помощью колоноскопии — процедуры, при которой тонкая трубка вводится в задний проход и направляется в толстую кишку. Декомпрессия также может быть выполнена хирургическим путем.
Клинические испытания
Изучите исследования клиники Mayo Clinic, в которых тестируются новые методы лечения, вмешательства и тесты как средства предотвращения, обнаружения, лечения или управления этим заболеванием.
Подготовка к приему
Кишечная непроходимость обычно требует неотложной медицинской помощи. В результате у вас может не хватить времени на подготовку к встрече. Если у вас есть время до приема, составьте список своих признаков и симптомов, чтобы лучше ответить на вопросы врача.
Чего ожидать от врача
Ваш врач может задать вам ряд вопросов, в том числе:
- Когда вы начали испытывать боль в животе или другие симптомы?
- Ваши симптомы появились внезапно или у вас уже были подобные симптомы раньше?
- Ваша боль непрерывна?
- Были ли у вас тошнота, рвота, лихорадка, кровь в стуле, диарея или запор?
- У вас была операция или облучение брюшной полости?
Ноябрь06, 2018
.Кожные проявления системной красной волчанки
Системная красная волчанка (СКВ) — полиорганное аутоиммунное заболевание неизвестной этиологии со многими клиническими проявлениями. Кожа является одним из органов-мишеней, наиболее подверженных заболеванию. Американский колледж ревматологии (ACR) установил 11 критериев в качестве классификационного инструмента для практического применения определения СКВ в клинических испытаниях. Они не предназначались для диагностики людей и в этом качестве не годятся.Кожные поражения составляют четыре из этих 11 пересмотренных критериев СКВ. Поражения кожи у пациентов с волчанкой могут быть специфическими или неспецифическими. В этой статье рассматриваются кожные изменения, специфичные для СКВ: скуловая сыпь, дискоидная сыпь, светочувствительность и поражения слизистой оболочки полости рта, а также неспецифические кожные проявления СКВ, их патофизиология и лечение. Более глубокое понимание кожных проявлений СКВ важно для диагностики, прогноза и эффективного лечения. Таким образом, дерматологи должны сотрудничать с другими специалистами, чтобы обеспечить оптимальный уход за пациентом с СКВ.
Поражения кожи у пациентов с волчанкой могут быть специфическими или неспецифическими. В этой статье рассматриваются кожные изменения, специфичные для СКВ: скуловая сыпь, дискоидная сыпь, светочувствительность и поражения слизистой оболочки полости рта, а также неспецифические кожные проявления СКВ, их патофизиология и лечение. Более глубокое понимание кожных проявлений СКВ важно для диагностики, прогноза и эффективного лечения. Таким образом, дерматологи должны сотрудничать с другими специалистами, чтобы обеспечить оптимальный уход за пациентом с СКВ.
1. Введение
Нозографическая концепция красной волчанки (LE) включает 3 основных подтипа: хронический кожный LE, подострый кожный LE и системный или острый кожный LE. Помимо этих трех подтипов, могут встречаться и другие, менее частые клинические разновидности [1].
Системная красная волчанка (СКВ) — это полиорганное аутоиммунное заболевание неизвестной этиологии, которое может иметь множество клинических проявлений (таблица 1). Кожа вовлечена в до 85% случаев системной красной волчанки (СКВ) и может быть единственным органом, участвующим в кожной красной волчанке (СКВ).
Кожа вовлечена в до 85% случаев системной красной волчанки (СКВ) и может быть единственным органом, участвующим в кожной красной волчанке (СКВ).
| |||||||||||||||||||||||||||||||||||||||||||||||
Диагностика кожных проявлений ЛЭ основана на клинических, гистопатологических и иммуногистологических данных кожных поражений.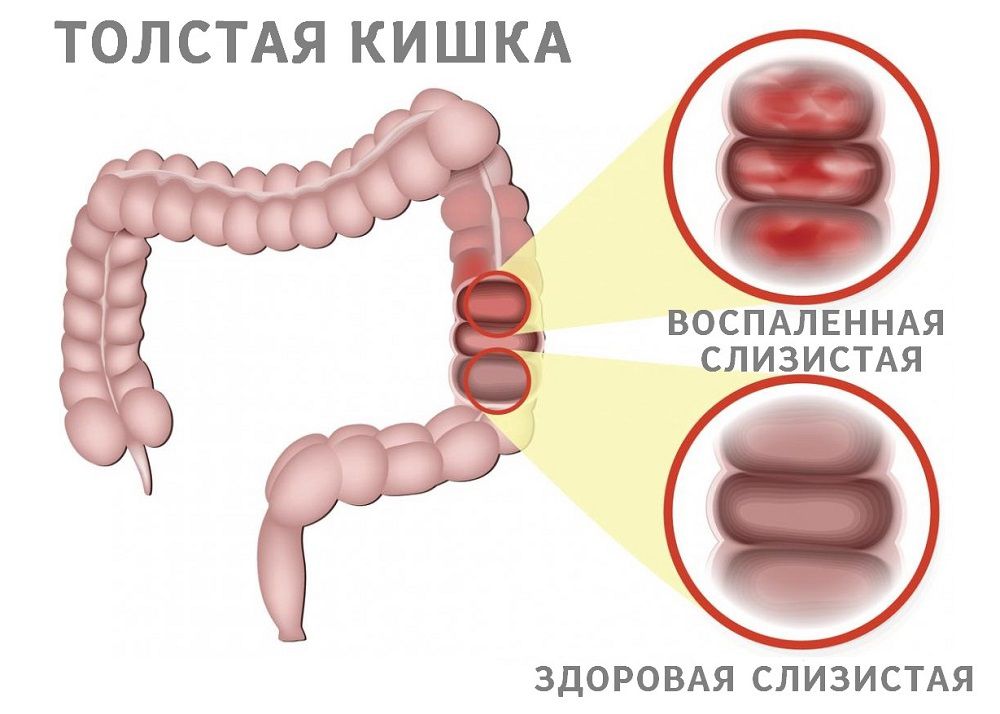 Кроме того, аутоантитела в сыворотке крови считаются иммунологическими маркерами различных клинических типов заболевания. Индекс площади и степени тяжести кожной красной волчанки (CLASI) используется в качестве клинического инструмента, который стандартизирует способ описания активности заболевания и предоставляет руководящие принципы для выявления клинических изменений. Этот клинический инструмент позволяет количественно оценить активность заболевания и повреждение кожной красной волчанки. Оценка активности основана на эритеме, чешуе, поражениях слизистой оболочки и безрубцовой алопеции.Недавнее исследование дает нам основу для практического использования CLASI в клинических испытаниях в качестве инструмента для измерения тяжести заболевания и чувствительности к терапии [2].
Кроме того, аутоантитела в сыворотке крови считаются иммунологическими маркерами различных клинических типов заболевания. Индекс площади и степени тяжести кожной красной волчанки (CLASI) используется в качестве клинического инструмента, который стандартизирует способ описания активности заболевания и предоставляет руководящие принципы для выявления клинических изменений. Этот клинический инструмент позволяет количественно оценить активность заболевания и повреждение кожной красной волчанки. Оценка активности основана на эритеме, чешуе, поражениях слизистой оболочки и безрубцовой алопеции.Недавнее исследование дает нам основу для практического использования CLASI в клинических испытаниях в качестве инструмента для измерения тяжести заболевания и чувствительности к терапии [2].
В 1982 г. Американским колледжем ревматологии (ACR) были опубликованы критерии диагностики СКВ, которые были пересмотрены в 1997 г. и в настоящее время используются в клинической практике [3]. Несомненно, полезные, в основном для дифференциальной диагностики системной LE и других ревматологических заболеваний, такие критерии обычно неадекватны для некоторых подгрупп LE. Что касается кожных проявлений, критерии ACR включают скуловую сыпь, дискоидную сыпь, светочувствительность и язвы во рту. Следует отметить, что иммунологическое исследование не включает иммуногистологию кожи (тест на волчанку).
Что касается кожных проявлений, критерии ACR включают скуловую сыпь, дискоидную сыпь, светочувствительность и язвы во рту. Следует отметить, что иммунологическое исследование не включает иммуногистологию кожи (тест на волчанку).
2. Скуловая сыпь
Первым критерием ACR является малярная сыпь (чувствительность 57%; специфичность 96%), которая характеризуется эритематозной сыпью на щеках и переносице (рис. 1). Скуловая сыпь — это фиксированная эритема, которая обычно не затрагивает носогубные складки.Это сыпь в форме бабочки или vespertilio, которая может быть плоской или выступающей на щеках и переносице. Это длится от нескольких дней до недель и иногда бывает болезненным или зудящим.
3. Светочувствительность
Второй критерий — светочувствительность (чувствительность 43%; специфичность 96%). Воздействие ультрафиолета вызывает кожную сыпь или другие симптомы обострений СКВ. Макулярная или диффузная эритематозная сыпь возникает на участках, подвергшихся воздействию солнца, например на лице, руках или кистях, и обычно сохраняется более 1 дня. Иногда наблюдаются эритематозные папулы или пятна на тыльных сторонах кистей, которые обычно не затрагивают суставы (рис. 2).
Иногда наблюдаются эритематозные папулы или пятна на тыльных сторонах кистей, которые обычно не затрагивают суставы (рис. 2).
4. Дискоидная сыпь
Третьим признаком может быть дискоидная сыпь (чувствительность 18%; специфичность 59%). Дискоидная красная волчанка (ДВВ), хроническое дерматологическое заболевание, является наиболее частой формой хронической ВЛЭ. Поражения могут быть частью системной волчанки или могут представлять собой дискоидную волчанку без вовлечения органов, что является отдельной диагностической единицей.
Поражения представляют собой дискообразные эритематозные бляшки разного размера и содержат участки фолликулярного гиперкератоза, которые болезненны при поднятии вручную. Прогрессирование заболевания может привести к пигментным изменениям, стойким, угнетенным рубцам, атрофии и алопеции (рис. 3). Поражения распространяются центробежно и могут сливаться. Хотя у большинства пациентов поражение ограничивается областью головы и шеи, признается вариант, называемый генерализованным / диссеминированным DLE, для которого минимальным критерием является наличие поражений DLE выше и ниже шеи. Поверхности слизистой оболочки могут быть затронуты поражениями, которые выглядят идентичными DLE кожи, или поражениями, которые могут имитировать красный плоский лишай. Ладони и подошвы также могут быть поражены, но это происходит менее чем у 2% пациентов [4].
Поверхности слизистой оболочки могут быть затронуты поражениями, которые выглядят идентичными DLE кожи, или поражениями, которые могут имитировать красный плоский лишай. Ладони и подошвы также могут быть поражены, но это происходит менее чем у 2% пациентов [4].
Поражения DLE могут стать гипертрофическими или бородавчатыми. Эта подгруппа проявляется бородавчатыми поражениями, чаще всего на разгибателях рук. Гипертрофические поражения LE необходимо дифференцировать от бородавок, кератоакантомы или плоскоклеточного рака. Эти поражения труднее лечить [5].Волчаночный панникулит — это форма хронической CLE, которая может сопровождаться типичными поражениями DLE или может возникать у пациентов с SLE [6].
Дискоидная красная волчанка чаще всего встречается у женщин (соотношение женщин и мужчин 3: 1) в возрасте от 40 до 50 лет [7, 8].
Появление поражений, которые могут уродовать на видимых участках, подверженных воздействию солнечных лучей, является эмоционально разрушительным и может усугубить психологическое бремя болезни. Сообщалось, что ДВЭ оказывает сильное негативное влияние на качество жизни пациента, приводя к физическим и психологическим нарушениям [9, 10].
Сообщалось, что ДВЭ оказывает сильное негативное влияние на качество жизни пациента, приводя к физическим и психологическим нарушениям [9, 10].
DLE может возникать у пациентов с СКВ, а также у некоторых пациентов (
Пациенты с DLE редко соответствуют 4 или более критериям, используемым для классификации SLE. Серологические отклонения встречаются редко. Серьезное системное заболевание встречается редко, но когда оно возникает, у пациентов могут развиться жизненно важные последствия. Злокачественное перерождение хронических поражений красной волчанки (LE) возможно, хотя и редко, что приводит к немеланомному раку кожи. Темнокожие люди могут быть более предрасположены к раку кожи из-за отсутствия пигментации в хронических очагах поражения в сочетании с хроническим воспалением и продолжающимся воздействием солнца.
Пациенты могут жаловаться на легкий зуд или периодические боли в области поражения, но у большинства пациентов симптомы отсутствуют. Пациенты с широко распространенным поражением часто имеют гематологические и серологические аномалии, у них более высока вероятность развития СКВ, и их труднее лечить.
5. Патофизиология малярной сыпи, светочувствительности и дискоидной сыпи
Влияние УФ-облучения на первоначальный запуск и сохранение различных кожных проявлений ЛЭ предполагает, что аномальная фотореактивность является одним из важных факторов ЛЭ.
Светочувствительность показывает сильную связь с проявлением всех подтипов CLE, а аномальная реактивность на ультрафиолетовый (УФ) свет является важным фактором в патогенезе как кожных, так и системных заболеваний. Потенциально решающую роль в инициации каскада аутоиммунных реакций приписывают УФ-индуцированному апоптозу кератиноцитов [12]. Интересно, что значительно большее количество апоптотических ядер в эпидермисе было описано при первичных и УФ-индуцированных поражениях кожи у пациентов с CLE по сравнению с нормальным
.Кишечная инфекция: причина, симптомы и лечение
Существует множество организмов, включая дрожжи, грибки, плесень, паразитов или бактерии, которые могут способствовать кишечной инфекции. Они могут быть получены из пищи, которую вы едите, или из-за плохой гигиены, которая позволяет вам контактировать с патогенами во рту. Тяжесть инфекции будет зависеть от того, какой патоген вызвал инфекцию. Диагностика инфекции на основе ваших симптомов поможет вашему врачу сузить вероятность различных типов инфекций, от которых вы можете страдать, и получить адекватное лечение.
Они могут быть получены из пищи, которую вы едите, или из-за плохой гигиены, которая позволяет вам контактировать с патогенами во рту. Тяжесть инфекции будет зависеть от того, какой патоген вызвал инфекцию. Диагностика инфекции на основе ваших симптомов поможет вашему врачу сузить вероятность различных типов инфекций, от которых вы можете страдать, и получить адекватное лечение.
Каковы причины?
Самая частая причина — попадание патогенов в рот. Хотя другие причины, такие как контакт с загрязненной водой и плохая гигиена, также могут вызвать его.
- Патогены — Инфекции возникают, когда патогены проникают в ваш организм и начинают раздражать ткани пищеварительного тракта. Желудочно-кишечный тракт может воспаляться и болеть, что обычно вызывает дополнительные симптомы расстройства пищеварения.Патогены, вызывающие кишечные инфекции, попадают в организм, как правило, из зараженного источника пищи. Испорченные молочные продукты, непастеризованные молочные продукты, испорченное мясо, зараженные моллюски или любые продукты, которые были подвержены воздействию патогенных микроорганизмов и не были должным образом стерилизованы в процессе приготовления, могут увеличить риск развития инфекции.

- Загрязненная вода — Контакт с зараженной водой также может привести к инфекции. Воду из природных источников, таких как озера, нельзя употреблять, если она не была тщательно прокипячена для ее стерилизации.Плавательные бассейны также могут быть заражены микробами, которые могут вызвать инфекцию, если их не продезинфицировать должным образом, чтобы вместить большую часть населения.
- Плохая гигиена — Это также может распространять микробы, вызывающие инфекции. Неспособность вымыть руки после посещения туалета — распространенный способ заразиться инфекцией. Касание поверхностей, столового серебра или еды после того, как вы не вымыли руки, увеличивает риск контакта с этими микробами других людей, что еще больше увеличивает риск заболевания.
Симптомы кишечной инфекции
Если вы перенесли инфекцию, у вас могут быть некоторые из перечисленных ниже симптомов.
- Синусовое расстройство — Кишечные патогены часто поражают другие части тела.
 По мере распространения инфекции у вас может развиться инфекция носовых пазух, насморк или кашель.
По мере распространения инфекции у вас может развиться инфекция носовых пазух, насморк или кашель. - Потеря аппетита — Ваша система начнет отключаться из-за воспаления. Потеря аппетита — частый признак инфекции, а также других расстройств пищеварения.
- Тошнота — потеря аппетита часто сопровождается тошнотой, обычно описываемой как «чувство тошноты».
- Боль в животе — По мере того, как инфекция становится более серьезной, часто возникает боль или припухлость в области живота. Сила этой боли будет зависеть от места и причины инфекции.
- Спазмы — Бактериальные инфекции обычно вызывают спазмы в животе. Судороги часто длятся по 3-4 минуты и могут становиться все более серьезными.
- Запор — Если вы не ели регулярно, у вас может начаться запор. Это также распространено, если вы заразились кишечными глистами.
- Синдром раздраженного кишечника — Если паразиты в вашем кишечнике прикрепились к стенкам, это может вызвать синдром раздраженного кишечника.

- Диарея — По мере того, как патогены продвигаются дальше в пищеварительный тракт, они могут вызвать диарею, поскольку организм пытается избавить организм от этих раздражителей.По мере обезвоживания у вас также может начаться диарея.
- Депрессия — Люди, страдающие дрожжевой инфекцией, могут испытывать повышенный риск депрессии.
- Нарушения сна — Дискомфорт, связанный с инфекциями, может затруднять сон. Это также может быть признаком того, что печень перегружена, пытаясь избавить организм от инфекции.
- Скрежетание зубами — В редких случаях больные инфекцией могут скрипеть зубами во сне.
- Головные боли — Обезвоживание или присутствие в организме раздражителей, таких как дрожжи, увеличивает риск постоянных головных болей.
- Кожные высыпания — Некоторые пациенты могут испытывать зуд или жжение на коже, когда инфекция распространяется по всему телу.

Средства для лечения кишечных инфекций
Инфекция может быть очень болезненной и раздражающей, поэтому здесь предлагается несколько полезных методов лечения этого состояния и ускорения выздоровления.
1. Соблюдайте правила гигиены
Пока вы страдаете инфекцией, вы должны позаботиться о том, чтобы не передать эту инфекцию другим людям. Регулярно мойте руки, особенно перед приготовлением или едой, а также после посещения туалета. Тщательно мойте всю пищу и тщательно готовьте ее перед употреблением, чтобы снизить риск контакта с дополнительными микробами, которые могут ухудшить ваше состояние.
2. Настроить диету
По мере того, как ваша система пытается оправиться от инфекции, важно уменьшить любую нагрузку на эти органы.Пациентов часто переводят на жидкую диету, чтобы гарантировать, что они могут оставаться гидратированными и получать необходимые электролиты для поддержания баланса их системы.
По мере того, как ваша способность есть твердую пищу возвращается, ваш врач посоветует вам есть фрукты и овощи с высоким содержанием питательных веществ, чтобы помочь вернуть витамины и минералы, которые вы потеряли, ограничивая свой рацион. Избегайте продуктов, которые трудно расщепить, например красного мяса, до тех пор, пока ваш организм не восстановится. Также избегайте продуктов, которые вредны для пищеварительной системы, таких как молочные продукты или острая пища, пока вы снова не почувствуете себя хорошо.
3. Обратиться за медицинской помощью
Если вы испытываете серьезные симптомы, включая сильную рвоту, диарею с кровью, слабость или признаки обезвоживания, важно немедленно обратиться за медицинской помощью. Вам также следует обратиться к врачу, если ваши обычные симптомы продолжаются более трех дней без облегчения. Ваш врач может попросить образцы стула, чтобы определить, какие типы патогенов заразили систему.
Если у вас серьезные симптомы, ваш врач может прописать лекарство, которое поможет остановить диарею и рвоту. Не принимайте лекарства для предотвращения этих симптомов без медицинского указания. Вашему организму может потребоваться продолжить этот цикл очистки, чтобы удалить микробы, вызывающие инфекцию. В тяжелых случаях вам может потребоваться внутривенная терапия, чтобы предотвратить сильное обезвоживание в результате очистки.
Не принимайте лекарства для предотвращения этих симптомов без медицинского указания. Вашему организму может потребоваться продолжить этот цикл очистки, чтобы удалить микробы, вызывающие инфекцию. В тяжелых случаях вам может потребоваться внутривенная терапия, чтобы предотвратить сильное обезвоживание в результате очистки.
хроническая диарея — Медицина — Терапия
Здравствуйте.Судя по описанию пациентка болеет несколько лет и очень хорошо обследована.1)птоз-опущение желудка и толстой кишки-при слабости мышц брюшного пресса, у рожавших женщин, высоких, худощавых, или при резком похудании(лечение-дробное питание5-6 раз в сутки, ношение бондажа.Бондаж надевать в горизонтальном положении.2)Эритематозная(гиперемическая) колонопатия(если пациентка пожилая не исключается, что энтеропатия связана с нарушением кровообращения вследствии атеросклероза мезентериальных сосудов: и может проявляться нетолько болями, но и повышенной моторикой тонкой кишки, метеоризмом(газообразованием)-что и проявляется по данным УЗИ-выраженная пневматизация кишечника. 3)Но высеена клебсиела пневмонии(она обнаруживается у лиц, принимавших антибиотики.Вызывает восполение не только носоглотки, легких, но и желчных путей, мочевого тракта и кишечника.4)папилопа пищевода- требует наблюдения, узел щитовидно железы 4,6мм-наверно она осматривалась эндокринологом.Если нет -то осмотр эндокринолога.Самое главное как быть и что делать?-а начать необходимо с питания и ношения бондажа.Питание должно быть дробным 5-6 раз, чтобы опорожнялся желчный пузырь и небыло застоя желчи в желчном пузыре.В питании исключить: черный хлеб, сырые овощи(капуста, свекла, морковь. Сырые фрукты- яблоки, груши виноград.Можно бананы, печеные яблоки.Кисло-молочные продукты, молоко не желательно.Не жирный творог.Каши- гречневая, овсяная, в умеренных количествах сваренных на воде.Исключить манку и рис.Ограничить жирную пищу клетчатку т.к вызывает усиленную перистальтику кишечника.Пища вареная, тушеная, приготовленная на пару, запеченая.Встретиться очередной раз с гастроэнтерологом и обсудить медикаментозную терапию: лечение длительное и комплесное-1)лекарства замедляющие продвижение содержимого по кишечнику; вяжущие, адсорбенты, ферментативные препараты, сосудорасширяющие, пробиотики2)Сдать ан.
3)Но высеена клебсиела пневмонии(она обнаруживается у лиц, принимавших антибиотики.Вызывает восполение не только носоглотки, легких, но и желчных путей, мочевого тракта и кишечника.4)папилопа пищевода- требует наблюдения, узел щитовидно железы 4,6мм-наверно она осматривалась эндокринологом.Если нет -то осмотр эндокринолога.Самое главное как быть и что делать?-а начать необходимо с питания и ношения бондажа.Питание должно быть дробным 5-6 раз, чтобы опорожнялся желчный пузырь и небыло застоя желчи в желчном пузыре.В питании исключить: черный хлеб, сырые овощи(капуста, свекла, морковь. Сырые фрукты- яблоки, груши виноград.Можно бананы, печеные яблоки.Кисло-молочные продукты, молоко не желательно.Не жирный творог.Каши- гречневая, овсяная, в умеренных количествах сваренных на воде.Исключить манку и рис.Ограничить жирную пищу клетчатку т.к вызывает усиленную перистальтику кишечника.Пища вареная, тушеная, приготовленная на пару, запеченая.Встретиться очередной раз с гастроэнтерологом и обсудить медикаментозную терапию: лечение длительное и комплесное-1)лекарства замедляющие продвижение содержимого по кишечнику; вяжущие, адсорбенты, ферментативные препараты, сосудорасширяющие, пробиотики2)Сдать ан. кала на дисбактериоз в норме клебсиела- 10 в 5степени на 1гр.кала.При избыточном росте применяют бактериофаги.Но учитывая антабактериальную терапию целесообразно обследование на грибок кандида(методом Ифа и ЦПР) Преднизолон приносил временный противовосполительный, десенсибилизирующий эффект.С ув.Л.А.
кала на дисбактериоз в норме клебсиела- 10 в 5степени на 1гр.кала.При избыточном росте применяют бактериофаги.Но учитывая антабактериальную терапию целесообразно обследование на грибок кандида(методом Ифа и ЦПР) Преднизолон приносил временный противовосполительный, десенсибилизирующий эффект.С ув.Л.А.
Портальная гипертоническая колопатия
Джеяшри Сундарам (MBA)
Портальная гипертензивная колопатия (ПГК) — это состояние, при котором происходят изменения слизистой оболочки толстой кишки у пациентов с портальной гипертензией и циррозом печени. ПМСП является основной причиной кровотечений в нижних отделах желудочно-кишечного тракта, эритермы на слизистой оболочке толстой кишки, телеангиэктазий, сосудистых и ангиодисплазийных поражений.
Тяжесть ПМСП зависит от стадии поражения.Поражение на ранней стадии определяется по слегка расширенным, тонкостенным, извилистым венулам и венам, выстланным эндотелиальными клетками, обнаруженными в подслизистой оболочке tela. Поражения на поздних стадиях — это более расширенные подслизистые вены, капилляры и извилистые венулы в слизистой оболочке или слизистой оболочке толстой кишки. Тем не менее, частота портальной гипертонической колопатии и аноректального варикозного расширения вен очень высока у пациентов с портальной гипертензией.
Поражения на поздних стадиях — это более расширенные подслизистые вены, капилляры и извилистые венулы в слизистой оболочке или слизистой оболочке толстой кишки. Тем не менее, частота портальной гипертонической колопатии и аноректального варикозного расширения вен очень высока у пациентов с портальной гипертензией.
Эпидемиология
Термин портальная гипертоническая колопатия впервые был описан в 1991 году.В основном это вызвано портальной гипертензией и циррозом печени.
У пациентов с портальной гипертензией ПМГ является результатом постоянного накопления крови в системе воротной вены, что приводит к эктазии и расширению слоя тканевых сосудов слизистой оболочки толстой кишки. Портальная гипертензия — это состояние, при котором артериальное давление в воротных венах повышается из-за нарушения кровотока через печень. Это приводит к изменениям в области слизистой оболочки толстой кишки, о чем свидетельствует рыхлость тканей.
ПМСП существенно связана с пациентами с циррозом печени с классом B и C по Чайлд-Пью. Осложнения по классу Чайлд-Пью, такие как снижение количества тромбоцитов, могут привести к кровотечению из нижних отделов ЖКТ. Это снижение количества тромбоцитов увеличивает распространенность ПМСП у пациентов с циррозом печени.
Осложнения по классу Чайлд-Пью, такие как снижение количества тромбоцитов, могут привести к кровотечению из нижних отделов ЖКТ. Это снижение количества тромбоцитов увеличивает распространенность ПМСП у пациентов с циррозом печени.
Симптомы и признаки
ПМСП обычно протекает бессимптомно. Первым показанием для ПМСП является хроническое кровотечение в нижних отделах желудочно-кишечного тракта, которое может привести к анемии. Гематохезия — распространенный симптом ПМСП, на который указывает кровотечение из толстой кишки, желудочно-кишечного тракта и прямой кишки; стул может также иметь дегтеобразный черный цвет.
Другими признаками, наблюдаемыми при эндоскопии, являются отечная слизистая оболочка и диффузная эритематозная патология, напоминающая колит, и варикозное расширение вен аноректальной области. В брюшной полости скапливается жидкость. Также может произойти снижение количества лейкоцитов или тромбоцитов.
Диагностика
ПМСП можно диагностировать с помощью колоноскопии и эндоскопии; где на слизистой оболочке толстой кишки обнаруживаются плоские или красные очаги поражения диаметром почти десять миллиметров.
Во время диагностики ПМСП с помощью колоноскопии можно также исследовать проникновение варикозно расширенных вен прямой кишки в просвет прямой кишки. Диаметр этих проницаемых вен полностью превышает диаметр нормальных вен прямой кишки.
У пациентов при эндоскопии выявляются поражения, которые выглядят как сосудистая эктазия или распространенное красное пятно, расширение сосудов, сосудистая нерегулярность и геморрой.
Эктазия сосудов — необычная причина хронического желудочно-кишечного кровотечения или анемии, которая связана с расширением мелких кровеносных сосудов во внутренней части желудка.Выделяют три типа сосудистой эктазии:
- Плоское сосудистое поражение паучьей формы
- плоское или вишнево-красноватое поражение или слегка выпуклое красное поражение диаметром менее 10 мм
- : слегка приподнятый подслизистый рак, похожий на поражение, было красного цвета.
Вазодилатация описывается как увеличение диаметра (от 3 до 6 мм) венозных кровеносных сосудов. Сосуды представляют собой спиралевидную структуру в подслизистой оболочке толстой кишки, которая называется сосудистой аномалией или нерегулярностью.
Сосуды представляют собой спиралевидную структуру в подслизистой оболочке толстой кишки, которая называется сосудистой аномалией или нерегулярностью.
Варианты лечения
Стандартного лечения для ПМСП не существует. Приобретаемое лечение основано на историях болезни.
Лечение портальной гипертонической колопатии предлагается на основе различных факторов, таких как симптомы, частота кровотечений и тяжесть заболевания.
Было замечено, что β-блокатор хорошо работает и дает эффективные результаты у пациентов с кровотечением из нижних отделов ЖКТ, вторичным по отношению к ПМСП.
Эффективным средством для уменьшения острого кровотечения, вызванного ПМСП, являются вазоактивные препараты, в том числе терлипрессин или октреотид.Стабильность кровотока достигается за счет предложенных неселективных β-адреноблокаторов.
Отчет о клиническом случае пациента ПМСП с кровотечением показал, что экстракт октреотида снижает градиент давления печеночных вен и блокирует кровотечение.
Если пациент с желудочно-кишечным кровотечением не выздоровел даже после лечения β-блокаторами или вазоактивными препаратами, то спасательная терапия представляет собой трансъюгулярный внутрипеченочный портосистемный шунт (TIPS). Тематические исследования доказывают, что для пациентов с портальной гипертензией и циррозом печени, у которых кровотечение не было остановлено пропанолом изначально, терапия TIPS была эффективной.
Процедура TIPS приводит к уменьшению портосистемного градиента; с помощью колоноскопии, непрерывно проводимой в течение девяти дней у пациентов, прошедших эту терапию, было замечено уменьшение количества поражений в слизистой оболочке толстой кишки и их размера. Рецидивов желудочно-кишечного кровотечения у пациентов не наблюдалось до полутора лет.
Для лечения этого состояния также можно рассмотреть возможность хирургического вмешательства. Комплексное лечение пациента ПМСП с желудочно-кишечным кровотечением еще находится на стадии исследований.
Дополнительная литература
Ценная роль эндоскопии при воспалительном заболевании кишечника
Эндоскопия — ценный клинический инструмент для клинициста, лечащего пациентов с воспалительным заболеванием кишечника (ВЗК). В этом обзоре обсуждается роль эндоскопии в диагностике, ведении и лечении ВЗК. Также рассматривается центральная роль, которую колоноскопия играет в скрининге рака толстой кишки у пациентов с длительной ВЗК.
1. Введение
Эндоскопия — важный клинический инструмент, помогающий в диагностике и лечении воспалительного заболевания кишечника (ВЗК) [1].Диагноз ВЗК может быть поставлен путем прямого визуального осмотра слизистой оболочки кишечника в сочетании с гистологическим исследованием биопсии. Правильное использование эндоскопии с биопсией также позволяет оценить другие расстройства, которые могут имитировать желудочно-кишечные особенности ВЗК. После постановки диагноза ВЗК проводится эндоскопия для оценки степени тяжести и локализации воспаления, а также для оценки других возможностей заболевания в разгар обострения. Также может быть оценен ответ на лечение или наблюдение за рецидивом послеоперационного заболевания.Наконец, эндоскопия используется для наблюдения за раком толстой кишки у пациентов с хронической ВЗК. Роль эндоскопии в этих областях будет рассмотрена в данной статье. Возрастающая роль беспроводной капсульной эндоскопии и эндоскопического ультразвука при ВЗК не рассматривается.
Также может быть оценен ответ на лечение или наблюдение за рецидивом послеоперационного заболевания.Наконец, эндоскопия используется для наблюдения за раком толстой кишки у пациентов с хронической ВЗК. Роль эндоскопии в этих областях будет рассмотрена в данной статье. Возрастающая роль беспроводной капсульной эндоскопии и эндоскопического ультразвука при ВЗК не рассматривается.
2. Эндоскопия в диагностике ВЗК
Потому что ВЗК — это хроническое пожизненное состояние, которое требует тщательного медицинского лечения и наблюдения и может быть связано со значительной заболеваемостью при госпитализации и хирургических операциях, что свидетельствует о важности диагноза.При подозрении на ВЗК на основании клинических признаков и симптомов, лабораторных и / или радиологических исследований, эндоскопия с биопсией слизистой оболочки значительно расширяет диагностику [2, 3]. Индексная колоноскопия имеет решающее значение для определения степени и тяжести заболевания. Особое внимание следует уделять перианальной области на наличие меток, трещин, стриктур и отверстий свищей, которые могут указывать на болезнь Крона (БК).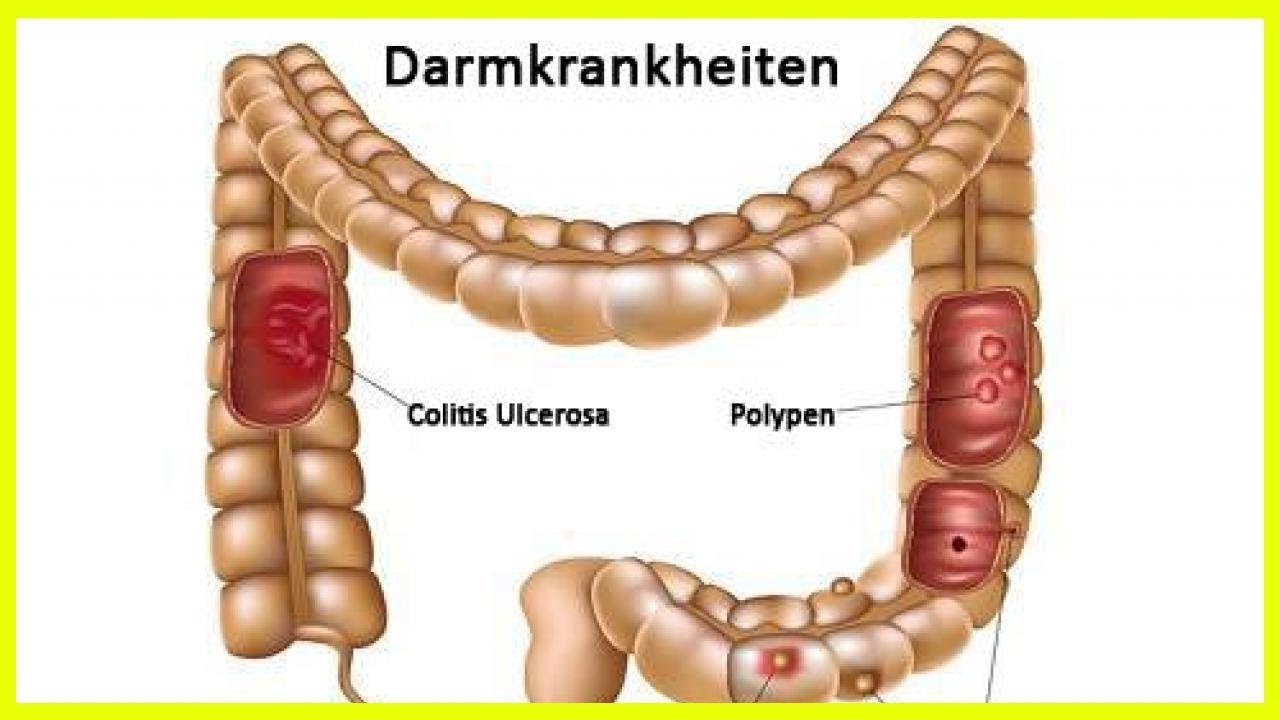 Слизистую оболочку прямой кишки необходимо тщательно осмотреть и провести биопсию для оценки хотя бы микроскопического воспаления, так как здесь всегда присутствует язвенный колит (ЯК) [4].
Слизистую оболочку прямой кишки необходимо тщательно осмотреть и провести биопсию для оценки хотя бы микроскопического воспаления, так как здесь всегда присутствует язвенный колит (ЯК) [4].
Пристальное внимание к особенностям слизистой оболочки толстой кишки может помочь предположить ВЗК и даже отличить ЯК от БК. Чувствительными эндоскопическими признаками для установления диагноза БК являются пятнистость степени заболевания, аптозные язвы (рис. 1 (а)) и брусчатка [3] (рис. 1 (b)). Это проникающая природа в более глубокие слои стенки толстой кишки, которая иногда может придавать характерный вид булыжника. Дискретные язвы, связанные с БК, также указывают на этот диагноз и включают линейные или серпигинозные язвы (рис. 1 (c)).Другие признаки БК, которые можно оценить при индексной колоноскопии, включают признаки стриктуры толстой кишки, илеоцекального клапана или терминального отдела подвздошной кишки (рис. 1 (d)). Стриктура толстой кишки у пациента с подозрением на ЯК должна вызывать опасения по поводу злокачественности. Точно так же стриктуры, которые нельзя пройти с помощью эндоскопа, требуют дальнейшего обследования, обычно с помощью рентгенографии. Также важно отметить сосудистый паттерн при БК, который может отражать пятнистую природу БК: нормальная сосудистая сеть может быть обнаружена рядом с аномально воспаленной слизистой оболочкой, где сосуды явно отсутствуют.При ЯК важно оценить и задокументировать степень видимого воспаления, что в конечном итоге поможет классифицировать пациента как имеющего проктит (заболевание, ограничивающееся прямой кишкой), левостороннее заболевание (заболевание распространяется на изгиб селезенки) или панколит ( задействована вся толстая кишка). Еще одна важная информация, которую необходимо отметить, — это степень воспаления при ЯК. Легкая степень воспаления при оценке с помощью эндоскопии связана с потерей внешнего вида кровеносных сосудов, эритемой и зернистостью слизистой оболочки (рис. 2 (b)).Умеренная форма заболевания связана с умеренно эрозивным заболеванием с повышенной эритемой и отеком (рис.
Точно так же стриктуры, которые нельзя пройти с помощью эндоскопа, требуют дальнейшего обследования, обычно с помощью рентгенографии. Также важно отметить сосудистый паттерн при БК, который может отражать пятнистую природу БК: нормальная сосудистая сеть может быть обнаружена рядом с аномально воспаленной слизистой оболочкой, где сосуды явно отсутствуют.При ЯК важно оценить и задокументировать степень видимого воспаления, что в конечном итоге поможет классифицировать пациента как имеющего проктит (заболевание, ограничивающееся прямой кишкой), левостороннее заболевание (заболевание распространяется на изгиб селезенки) или панколит ( задействована вся толстая кишка). Еще одна важная информация, которую необходимо отметить, — это степень воспаления при ЯК. Легкая степень воспаления при оценке с помощью эндоскопии связана с потерей внешнего вида кровеносных сосудов, эритемой и зернистостью слизистой оболочки (рис. 2 (b)).Умеренная форма заболевания связана с умеренно эрозивным заболеванием с повышенной эритемой и отеком (рис.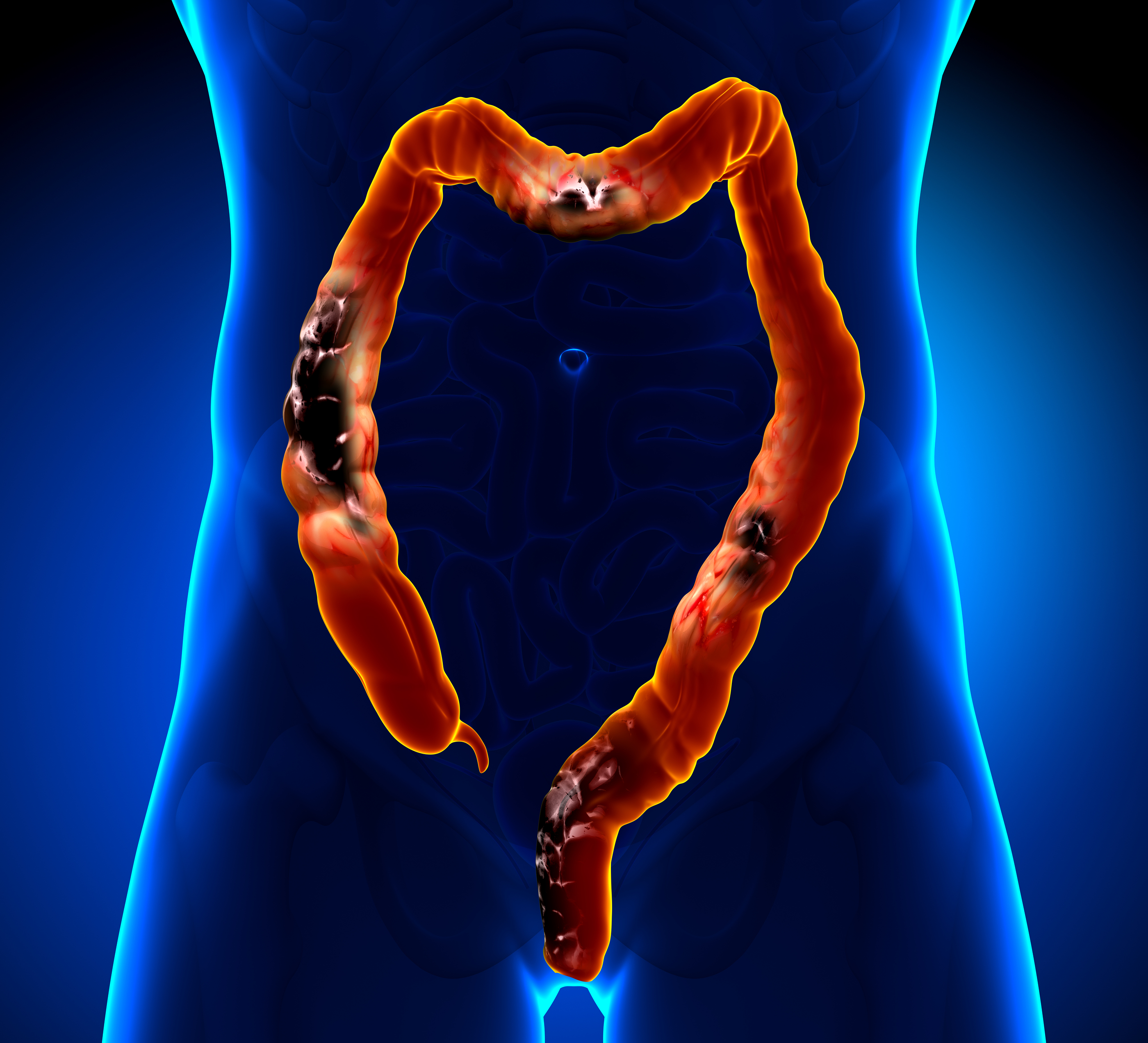 2 (c)). Толстая кишка с тяжелым заболеванием имеет язвы, экссудат и спонтанное кровотечение (рис. 2 (d)). Может быть полезно использовать установленную систему оценок при оценке пораженной слизистой оболочки, которую затем можно использовать для сравнения будущих процедур и предоставления информации патологу стандартным образом [5].
2 (c)). Толстая кишка с тяжелым заболеванием имеет язвы, экссудат и спонтанное кровотечение (рис. 2 (d)). Может быть полезно использовать установленную систему оценок при оценке пораженной слизистой оболочки, которую затем можно использовать для сравнения будущих процедур и предоставления информации патологу стандартным образом [5].
Илеоскопия является обязательной при начальной колоноскопии при оценке ВЗК [6].Перед интубацией подвздошной кишки следует внимательно осмотреть илеоцекальный клапан на предмет эрозий, язв и стриктур. У пациента с подозрением на ЯК без панколита подвздошная кишка должна быть полностью нормальной. Однако, если заболевание распространяется на слепую кишку, то появление так называемого «обратного» илеита может быть отмечено как эритема и даже эрозивное заболевание. Поражение подвздошной кишки в ЯК изучалось на 200 последовательно собранных образцах резекции толстой кишки. В этом исследовании было обнаружено, что 17% пациентов имеют доказательства поражения подвздошной кишки [7]. Хотя у подавляющего большинства этих пациентов был панколит (94%), у остальных не было поражения слепой кишки. Клинический вывод этого исследования заключается в том, что поражение подвздошной кишки у пациента с ЯК не всегда означает, что диагноз следует переключить на БК. Биопсию подвздошной кишки всегда следует выполнять и интерпретировать с учетом полного клинического контекста, даже если эндоскопический вид нормальный [8]. При подозрении на БК необходимо обследовать терминальную часть подвздошной кишки на предмет эритемы, эрозий, язв (рис. 3 (а)) и стриктур.Важно помнить и отмечать, принимал ли пациент НПВП, когда окончательно задокументированы и интерпретированы результаты терминальной подвздошной кишки. Предварительное использование НПВП может привести к таким же эндоскопическим результатам, что и при БК (рис. 3 (b)).
Хотя у подавляющего большинства этих пациентов был панколит (94%), у остальных не было поражения слепой кишки. Клинический вывод этого исследования заключается в том, что поражение подвздошной кишки у пациента с ЯК не всегда означает, что диагноз следует переключить на БК. Биопсию подвздошной кишки всегда следует выполнять и интерпретировать с учетом полного клинического контекста, даже если эндоскопический вид нормальный [8]. При подозрении на БК необходимо обследовать терминальную часть подвздошной кишки на предмет эритемы, эрозий, язв (рис. 3 (а)) и стриктур.Важно помнить и отмечать, принимал ли пациент НПВП, когда окончательно задокументированы и интерпретированы результаты терминальной подвздошной кишки. Предварительное использование НПВП может привести к таким же эндоскопическим результатам, что и при БК (рис. 3 (b)).
Есть еще несколько моментов, которые следует учитывать при индексной колоноскопии. Всегда необходимо оценивать относительную безопасность полной колоноскопии и илеоскопии у пациентов с умеренным или тяжелым воспалением, значительной болью перед процедурой или другими медицинскими относительными противопоказаниями к процедуре. В этих случаях более ограниченная гибкая ректороманоскопия может позволить визуализировать слизистую оболочку и провести биопсию при подозрении на ЯК и БК толстой кишки. Радиологические исследования могут быть полезны при БК правой кишки или заболевании подвздошной кишки. После того, как пациенту начато лечение и предполагается, что тяжесть заболевания будет меньшей и пациент не болит, можно безопасно провести полную колоноскопию с илеоскопией. Однако важно помнить, что медицинское лечение потенциально может изменить естественный эндоскопический вид толстой кишки пациента [9].Местная терапия в виде суппозиториев или клизм может дать относительную щадящую защиту прямой и / или левой толстой кишки, соответственно. Также известно, что системные лекарства вызывают «пятнистое» распространение эндоскопического воспаления, которое может быть неверно истолковано как классический признак БК. Биопсия пораженных и не затронутых участков толстой кишки и выполнение колоноскопии до начала лечения помогут избежать этих потенциальных ошибок при диагностике.
В этих случаях более ограниченная гибкая ректороманоскопия может позволить визуализировать слизистую оболочку и провести биопсию при подозрении на ЯК и БК толстой кишки. Радиологические исследования могут быть полезны при БК правой кишки или заболевании подвздошной кишки. После того, как пациенту начато лечение и предполагается, что тяжесть заболевания будет меньшей и пациент не болит, можно безопасно провести полную колоноскопию с илеоскопией. Однако важно помнить, что медицинское лечение потенциально может изменить естественный эндоскопический вид толстой кишки пациента [9].Местная терапия в виде суппозиториев или клизм может дать относительную щадящую защиту прямой и / или левой толстой кишки, соответственно. Также известно, что системные лекарства вызывают «пятнистое» распространение эндоскопического воспаления, которое может быть неверно истолковано как классический признак БК. Биопсия пораженных и не затронутых участков толстой кишки и выполнение колоноскопии до начала лечения помогут избежать этих потенциальных ошибок при диагностике. Заболевание de novo также может не обладать классическими эндоскопическими признаками ВЗК.Недавно диагностированный ЯК может быть, например, неоднородным и иметь относительную или абсолютную щадящую ректальную функцию [10]. Точно так же тяжелый ЯК может обладать многими эндоскопическими особенностями, которые мы ассоциируем с БК, такими как глубокие трещинные язвы, пятнистое распространение и поражение подвздошной кишки [11]. Наконец, пациенты с ЯК даже при отсутствии панколита могут иметь поражение периаппендикулярной области — так называемый пластырь слепой кишки [12]. Хотя было обнаружено, что это не имеет клинического или прогностического значения для этих пациентов, это следует отметить и не путать с диагнозом CD.
Заболевание de novo также может не обладать классическими эндоскопическими признаками ВЗК.Недавно диагностированный ЯК может быть, например, неоднородным и иметь относительную или абсолютную щадящую ректальную функцию [10]. Точно так же тяжелый ЯК может обладать многими эндоскопическими особенностями, которые мы ассоциируем с БК, такими как глубокие трещинные язвы, пятнистое распространение и поражение подвздошной кишки [11]. Наконец, пациенты с ЯК даже при отсутствии панколита могут иметь поражение периаппендикулярной области — так называемый пластырь слепой кишки [12]. Хотя было обнаружено, что это не имеет клинического или прогностического значения для этих пациентов, это следует отметить и не путать с диагнозом CD.
Есть несколько других состояний, которые могут имитировать клинические признаки и симптомы ВЗК, и для постановки диагноза всегда следует рассматривать возможность проведения колоноскопии [13]. Эндоскопические особенности этих образований сами по себе могут перекрываться и быть неспецифическими, поэтому необходимо учитывать биопсию и клинический сценарий. Инфекционный колит является наиболее распространенным заболеванием, которое может проявляться как ВЗК и вызывать такие признаки, как боль в животе, кровавая диарея и т. Д. терминальная болезнь подвздошной кишки. В одном более раннем проспективном исследовании пациентов с симптомами типа острого геморрагического колита инфекционный колит оказался причиной в 38% случаев [14].Важно получить посев кала и c. difficile до или во время колоноскопии, чтобы помочь в диагностике инфекционного колита. Туберкулез следует рассматривать при обнаружении суженной узловатой подвздошной кишки и / или характерного разрушения илеоцекального клапана [15], и при подозрении на туберкулез следует провести соответствующие исследования. При инфекционном колите биопсия не покажет гистологических признаков хронического заболевания, таких как архитектурные искажения, базальный плазмоцитоз, гиперплазия клеток Панета или метаплазия пилорических желез [16].Ишемический колит может иметь очаговое распространение с различным эндоскопическим поражением, но обычно локализуется в характерных местах на изгибе селезенки или правой толстой кишке и обнаруживается у пациентов из группы риска.
Инфекционный колит является наиболее распространенным заболеванием, которое может проявляться как ВЗК и вызывать такие признаки, как боль в животе, кровавая диарея и т. Д. терминальная болезнь подвздошной кишки. В одном более раннем проспективном исследовании пациентов с симптомами типа острого геморрагического колита инфекционный колит оказался причиной в 38% случаев [14].Важно получить посев кала и c. difficile до или во время колоноскопии, чтобы помочь в диагностике инфекционного колита. Туберкулез следует рассматривать при обнаружении суженной узловатой подвздошной кишки и / или характерного разрушения илеоцекального клапана [15], и при подозрении на туберкулез следует провести соответствующие исследования. При инфекционном колите биопсия не покажет гистологических признаков хронического заболевания, таких как архитектурные искажения, базальный плазмоцитоз, гиперплазия клеток Панета или метаплазия пилорических желез [16].Ишемический колит может иметь очаговое распространение с различным эндоскопическим поражением, но обычно локализуется в характерных местах на изгибе селезенки или правой толстой кишке и обнаруживается у пациентов из группы риска. Биопсия пораженных и не затронутых участков подтвердит этот диагноз. Точно так же колит, связанный с дивертикулезом, будет неоднородным и ограничиваться областью, населенной дивертикулами. О наличии дивертикулов следует сообщить патологоанатому, чтобы он помог с их интерпретацией.Лучевой колит может наблюдаться у пациентов из группы риска, и некоторые лекарства, особенно НПВП, могут вызвать любые характерные поражения, наблюдаемые при эндоскопии при ВЗК [17]. Всегда следует отмечать использование этих потенциально опасных лекарств. Наконец, микроскопический колит, несмотря на его название, может быть связан с легкими эндоскопическими изменениями, такими как эритема и отек, и его диагноз следует тщательно интерпретировать в сочетании с результатами биопсии и клиническими проявлениями.
Биопсия пораженных и не затронутых участков подтвердит этот диагноз. Точно так же колит, связанный с дивертикулезом, будет неоднородным и ограничиваться областью, населенной дивертикулами. О наличии дивертикулов следует сообщить патологоанатому, чтобы он помог с их интерпретацией.Лучевой колит может наблюдаться у пациентов из группы риска, и некоторые лекарства, особенно НПВП, могут вызвать любые характерные поражения, наблюдаемые при эндоскопии при ВЗК [17]. Всегда следует отмечать использование этих потенциально опасных лекарств. Наконец, микроскопический колит, несмотря на его название, может быть связан с легкими эндоскопическими изменениями, такими как эритема и отек, и его диагноз следует тщательно интерпретировать в сочетании с результатами биопсии и клиническими проявлениями.
Эндоскопия верхних отделов кишечника может иметь значение у пациента, изначально подозреваемого на ВЗК, особенно у молодого пациента с симптомами верхних отделов кишечника.До 13% пациентов с CD могут иметь поражение желудочно-кишечного тракта проксимальнее связки Treitz [18], при этом сообщалось о пищеводе, желудке и двенадцатиперстной кишке. Эндоскопические признаки могут включать эритему и зернистость, узелки и кровотечение. Гистология может показать характерные признаки хронического воспаления, такие как архитектурные искажения в сочетании с хроническим воспалительным инфильтратом и гранулемами [19]. Верхняя эндоскопия с биопсией также может быть полезной для исключения других причин симптомов, таких как целиакия, язвенная болезнь и эозинофильные заболевания.Интересно, что двенадцатиперстная кишка у пациентов с ЯК также вовлечена эндоскопически и не обязательно подтверждает диагноз БК [19, 20].
Эндоскопические признаки могут включать эритему и зернистость, узелки и кровотечение. Гистология может показать характерные признаки хронического воспаления, такие как архитектурные искажения в сочетании с хроническим воспалительным инфильтратом и гранулемами [19]. Верхняя эндоскопия с биопсией также может быть полезной для исключения других причин симптомов, таких как целиакия, язвенная болезнь и эозинофильные заболевания.Интересно, что двенадцатиперстная кишка у пациентов с ЯК также вовлечена эндоскопически и не обязательно подтверждает диагноз БК [19, 20].
Дополнительные обследования тонкой кишки, если показаны, могут включать капсульную и двухбаллонную энтероскопию. Эти методы не будут здесь обсуждаться и недавно были рассмотрены в другом месте [21].
3. Эндоскопия в лечении установленной ВЗК
После установления диагноза ВЗК эндоскопия становится важным инструментом для оценки ответа на терапию, послеоперационного рецидива, появления новых тревожных симптомов или факторов, способствующих обострению заболевания. Все больше данных свидетельствует о том, что заживление слизистой оболочки является оптимальной конечной точкой для лечения как при ЯК, так и при БК [22]. При ЯК заживление слизистой оболочки приводит к клинической ремиссии и потенциально снижает риск рака толстой кишки со временем [23]. При БК проспективное исследование показало, что заживление слизистой оболочки приводит к клинической ремиссии и сокращению количества операций и госпитализаций в течение одного года [24]. Эндоскопия в сочетании с биопсией сделает эту оценку, особенно когда может быть плохая корреляция между восприятием врача о том, насколько хорошо пациент чувствует себя, и реальной степенью эндоскопического воспаления [25].Колоноскопия показана при ВЗК, когда есть рефрактерные или прорывные симптомы к установленному лечению. Например, у пациента с постоянной болью и жидким стулом эндоскопия может определить, вызваны ли симптомы активным воспалением. По той же причине важно выполнить колоноскопию, когда рассматривается новое лечение.
Все больше данных свидетельствует о том, что заживление слизистой оболочки является оптимальной конечной точкой для лечения как при ЯК, так и при БК [22]. При ЯК заживление слизистой оболочки приводит к клинической ремиссии и потенциально снижает риск рака толстой кишки со временем [23]. При БК проспективное исследование показало, что заживление слизистой оболочки приводит к клинической ремиссии и сокращению количества операций и госпитализаций в течение одного года [24]. Эндоскопия в сочетании с биопсией сделает эту оценку, особенно когда может быть плохая корреляция между восприятием врача о том, насколько хорошо пациент чувствует себя, и реальной степенью эндоскопического воспаления [25].Колоноскопия показана при ВЗК, когда есть рефрактерные или прорывные симптомы к установленному лечению. Например, у пациента с постоянной болью и жидким стулом эндоскопия может определить, вызваны ли симптомы активным воспалением. По той же причине важно выполнить колоноскопию, когда рассматривается новое лечение. Если появляются какие-либо новые симптомы или признаки, такие как обострение дефицита железа, новое кровотечение, потеря веса или лихорадка, также следует рассмотреть возможность эндоскопии.Если хирургическое вмешательство планируется при ЯК или БК, хирургу будет полезна предоперационная колоноскопия и илеоскопия, которые помогут выбрать подходящий тип и объем операции.
Если появляются какие-либо новые симптомы или признаки, такие как обострение дефицита железа, новое кровотечение, потеря веса или лихорадка, также следует рассмотреть возможность эндоскопии.Если хирургическое вмешательство планируется при ЯК или БК, хирургу будет полезна предоперационная колоноскопия и илеоскопия, которые помогут выбрать подходящий тип и объем операции.
Колоноскопия и илеоскопия играют все более важную роль в послеоперационном лечении БК, особенно у тех, кто перенес илеоцекальную резекцию. Эндоскопический вид через 6–12 месяцев после операции [26] может помочь определить риск рецидива заболевания и решить, кому следует проводить агрессивное послеоперационное лечение [27].Пациенты, у которых нет заболевания или только несколько разрозненных аптозных язв в неотерминальной подвздошной кишке, вероятно, могут находиться под безопасным наблюдением, тогда как пациенты с более тяжелым эндоскопическим заболеванием, вероятно, должны начать медикаментозное лечение.
Эндоскопия также необходима пациентам с ВЗК, которым был выполнен анастомоз подвздошной кишки и анального канала (IPAA). Пациенты с ЯК подвержены риску развития поучита, который может привести к боли в животе, жидкому стулу и ректальному кровотечению, а характерные особенности могут быть отмечены при эндоскопии (обычно выполняемой с помощью верхнего эндоскопа).Мешочек может выглядеть эритематозным, изъязвленным, экссудативным и с различной степенью кровотечения. Наряду с прямой эндоскопической визуализацией, биопсия может помочь в постановке этого диагноза [28]. Тщательный осмотр афферентной конечности может выявить небольшую степень воспаления в самой дистальной части, что указывает на обратную промывку, и в остальном должно быть нормальным, и это должно быть подтверждено биопсией. Дифференциальный диагноз поучита включает БК, и это можно увидеть эндоскопически по характерным поражениям БК в сумке и вовлекающим афферентную конечность (а не только самый дистальный аспект).Каффит у пациентов с небольшим количеством остаточной ткани прямой кишки важно диагностировать с помощью эндоскопии и биопсии. Как и у других пациентов с ВЗК, можно оценить наличие инфекций, включая c.
Пациенты с ЯК подвержены риску развития поучита, который может привести к боли в животе, жидкому стулу и ректальному кровотечению, а характерные особенности могут быть отмечены при эндоскопии (обычно выполняемой с помощью верхнего эндоскопа).Мешочек может выглядеть эритематозным, изъязвленным, экссудативным и с различной степенью кровотечения. Наряду с прямой эндоскопической визуализацией, биопсия может помочь в постановке этого диагноза [28]. Тщательный осмотр афферентной конечности может выявить небольшую степень воспаления в самой дистальной части, что указывает на обратную промывку, и в остальном должно быть нормальным, и это должно быть подтверждено биопсией. Дифференциальный диагноз поучита включает БК, и это можно увидеть эндоскопически по характерным поражениям БК в сумке и вовлекающим афферентную конечность (а не только самый дистальный аспект).Каффит у пациентов с небольшим количеством остаточной ткани прямой кишки важно диагностировать с помощью эндоскопии и биопсии. Как и у других пациентов с ВЗК, можно оценить наличие инфекций, включая c. difficile . Наконец, синдром раздраженного мешочка — это диагноз, который может быть поставлен у пациента с симптомами, у которого мешок выглядит эндоскопически нормальным [29].
difficile . Наконец, синдром раздраженного мешочка — это диагноз, который может быть поставлен у пациента с симптомами, у которого мешок выглядит эндоскопически нормальным [29].
Эндоскопия — важный клинический инструмент у пациента с ВЗК во время обострения болезни. Как уже упоминалось, эндоскопия сможет довольно быстро определить, являются ли новые симптомы вторичными по отношению к активному воспалению.Эндоскопия и биопсия также помогут отличить истинное обострение ВЗК от осложняющей инфекции, такой как c. difficile или CMV. Важно отметить, что появление c. difficile у пациента с ВЗК может не иметь псевдомембран, и его трудно отличить от одного ВЗК без помощи исследований токсинов стула [30]. Ключевым диагностическим признаком ЦМВ является наличие вирусных включений в слизистой оболочке в области активного воспаления. Сами по себе эндоскопические особенности не позволят поставить диагноз ЦМВ на фоне ВЗК.
4. Эндоскопия для наблюдения за колоректальным раком
Ни один обзор эндоскопии при ВЗК не будет полным без обсуждения той важной роли, которую колоноскопия может играть в наблюдении за колоректальным раком. Американская гастроэнтерологическая ассоциация (AGA) недавно опубликовала заявление о медицинской позиции [31] и технический обзор [32], в которых всесторонне подробно описываются диагностика и лечение колоректальной неоплазии при ВЗК.
Американская гастроэнтерологическая ассоциация (AGA) недавно опубликовала заявление о медицинской позиции [31] и технический обзор [32], в которых всесторонне подробно описываются диагностика и лечение колоректальной неоплазии при ВЗК.
Хотя до настоящего времени не проводилось исследования, которое показало бы прямое повышение смертности от скрининга рака толстой кишки при ВЗК с помощью колоноскопии, считается, что рак может быть обнаружен раньше и на предположительно излечимых стадиях.Основные желудочно-кишечные общества (AGA, Американский колледж гастроэнтерологии, Американское общество гастроэнтерологической эндоскопии, Британское общество гастроэнтерологов) разработали рекомендации по рекомендуемым временам начала и интервалам для скрининга. Поскольку риск неоплазии толстой кишки при колите Крона, вероятно, такой же, как и при ЯК [33], эти рекомендации также должны применяться к пациентам с колитом Крона с той же степенью, продолжительностью и возрастом начала заболевания. У пациентов, страдающих панколитом в течение восьми лет (начиная с момента появления симптомов), скрининг следует начинать с интервалом в 1-2 года.В отношении левостороннего заболевания текущие руководящие принципы большинства обществ рекомендуют начинать скрининг после 15 лет заболевания. Точный интервал скрининга для этой последней группы пациентов не установлен, и общества обычно рекомендуют каждые 1-2 года. Британское общество гастроэнтерологии предлагает сокращать годовой интервал наблюдения с каждым десятилетием болезни (они предлагают скрининговую колоноскопию каждые 3 года во второй декаде болезни, каждые 2 года в третьей декаде и каждый год в четвертой декаде [34 ]).Общество соглашается, что пациенты с изолированным проктитом, вероятно, не нуждаются в обследовании на рак толстой кишки.
У пациентов, страдающих панколитом в течение восьми лет (начиная с момента появления симптомов), скрининг следует начинать с интервалом в 1-2 года.В отношении левостороннего заболевания текущие руководящие принципы большинства обществ рекомендуют начинать скрининг после 15 лет заболевания. Точный интервал скрининга для этой последней группы пациентов не установлен, и общества обычно рекомендуют каждые 1-2 года. Британское общество гастроэнтерологии предлагает сокращать годовой интервал наблюдения с каждым десятилетием болезни (они предлагают скрининговую колоноскопию каждые 3 года во второй декаде болезни, каждые 2 года в третьей декаде и каждый год в четвертой декаде [34 ]).Общество соглашается, что пациенты с изолированным проктитом, вероятно, не нуждаются в обследовании на рак толстой кишки.
Есть несколько факторов, которые необходимо принять во внимание при определении правильного интервала скрининга для вашего пациента. Пациенты, у которых на протяжении всей истории ВЗК было устойчивое к лечению или стойкое воспаление, могут иметь повышенный риск прогрессирования до неоплазии [35], и следует подумать о более раннем начале наблюдения. Независимо от того, есть ли у пациента в личном или семейном анамнезе аденоматозные полипы или рак толстой кишки, также следует учитывать время и интервал начала скрининга.Если у пациента одновременно диагностирован первичный склерозирующий холангит (ПСХ), рекомендуется начинать скрининг на колоректальный рак во время диагностики ПСХ и продолжать его через годичные интервалы. В идеале пациенты должны иметь клиническую ремиссию на момент скрининговой колоноскопии, чтобы свести к минимуму путаницу между воспалением и дисплазией при гистологии.
Независимо от того, есть ли у пациента в личном или семейном анамнезе аденоматозные полипы или рак толстой кишки, также следует учитывать время и интервал начала скрининга.Если у пациента одновременно диагностирован первичный склерозирующий холангит (ПСХ), рекомендуется начинать скрининг на колоректальный рак во время диагностики ПСХ и продолжать его через годичные интервалы. В идеале пациенты должны иметь клиническую ремиссию на момент скрининговой колоноскопии, чтобы свести к минимуму путаницу между воспалением и дисплазией при гистологии.
Дисплазия толстой кишки у пациента с ВЗК может быть так называемой «плоской дисплазией», которая в белом свете выглядит неотличимой от окружающей ткани.Таким образом, текущий стандарт медицинской помощи при скрининге рака толстой кишки при ВЗК включает случайные биопсии из четырех квадрантов. Для достижения оптимальной чувствительности они выполняются с регулярными интервалами в 10 см как минимум для 33 биопсий. Все биопсии из каждой области должны быть помещены в отдельные, тщательно промаркированные сосуды. Этот скрининг следует проводить только в тех областях, которые, как известно, были вовлечены в прошлое (т. Е. Правую кишку не нужно обследовать при левостороннем ЯК). Пациенту, у которого плоская дисплазия высокой степени выраженности обнаружена в одной области или, по крайней мере, в двух областях плоской дисплазии низкой степени, следует рекомендовать колэктомию.Если у пациента есть одна область плоской дисплазии низкой степени, обнаруженная при случайной выборке (и это подтверждается вторым патологом желудочно-кишечного тракта), то следует обсудить с пациентом вопрос о колэктомии по сравнению с дальнейшими скрининговыми колоноскопиями с сокращенным интервалом. Несколько исследований документально подтвердили повышенный риск развития неоплазии из-за дисплазии низкой степени, а одно исследование показало, что 4/17 (23,5%) образцов резецированной толстой кишки для плоской дисплазии низкой степени имели развитую неоплазию [36].
Этот скрининг следует проводить только в тех областях, которые, как известно, были вовлечены в прошлое (т. Е. Правую кишку не нужно обследовать при левостороннем ЯК). Пациенту, у которого плоская дисплазия высокой степени выраженности обнаружена в одной области или, по крайней мере, в двух областях плоской дисплазии низкой степени, следует рекомендовать колэктомию.Если у пациента есть одна область плоской дисплазии низкой степени, обнаруженная при случайной выборке (и это подтверждается вторым патологом желудочно-кишечного тракта), то следует обсудить с пациентом вопрос о колэктомии по сравнению с дальнейшими скрининговыми колоноскопиями с сокращенным интервалом. Несколько исследований документально подтвердили повышенный риск развития неоплазии из-за дисплазии низкой степени, а одно исследование показало, что 4/17 (23,5%) образцов резецированной толстой кишки для плоской дисплазии низкой степени имели развитую неоплазию [36].
На что еще должен обратить внимание эндоскопист во время скрининг-колоноскопии у пациента с ВЗК? Как и при стандартной скрининговой колоноскопии, особое внимание необходимо уделять всем новообразованиям, полиповидным и другим выступающим из слизистой оболочки поражениям. Как уже упоминалось, стриктуры требуют особого внимания, особенно при ЯК, где стриктура является раком, пока не будет доказано обратное. Полипы в невоспаленных областях, вероятно, являются спорадическими (рис. 4 (а)), и их следует лечить так же, как и у пациентов без ВЗК. Если дисплазия обнаруживается в каком-либо выступающем поражении в области текущего или предыдущего воспаления, это называется массой или поражением, связанным с дисплазией, или «DALM».В настоящее время это дополнительно классифицируется как «аденомоподобный» DALM или «неаденомный» DALM. Первое поражение хорошо очерчено, находится на сидячем месте или на ножке, без изъязвлений и кровотечений и напоминает спорадическую аденому (рис. 4 (b)). Напротив, неаденомоподобный DALM плохо очерчен, имеет широкое основание и нерегулярный и часто ассоциируется с кровотечением или изъязвлением (рис. 4 (c)). При контрольной колоноскопии эти поражения следует удалить полностью или провести биопсию, если это невозможно.Область вокруг основания следует сделать биопсию и сделать татуировку.
Как уже упоминалось, стриктуры требуют особого внимания, особенно при ЯК, где стриктура является раком, пока не будет доказано обратное. Полипы в невоспаленных областях, вероятно, являются спорадическими (рис. 4 (а)), и их следует лечить так же, как и у пациентов без ВЗК. Если дисплазия обнаруживается в каком-либо выступающем поражении в области текущего или предыдущего воспаления, это называется массой или поражением, связанным с дисплазией, или «DALM».В настоящее время это дополнительно классифицируется как «аденомоподобный» DALM или «неаденомный» DALM. Первое поражение хорошо очерчено, находится на сидячем месте или на ножке, без изъязвлений и кровотечений и напоминает спорадическую аденому (рис. 4 (b)). Напротив, неаденомоподобный DALM плохо очерчен, имеет широкое основание и нерегулярный и часто ассоциируется с кровотечением или изъязвлением (рис. 4 (c)). При контрольной колоноскопии эти поражения следует удалить полностью или провести биопсию, если это невозможно.Область вокруг основания следует сделать биопсию и сделать татуировку. Если аденома-подобный ДАЛМ уверенно удален, а основание отрицательно на дисплазию, наблюдение можно возобновить. Было показано, что аденомоподобные образования, возникающие на фоне колита, имеют доброкачественное течение [37, 38]. Если область удалена не полностью, и если есть какие-либо признаки дисплазии в основании или если дисплазия обнаружена где-либо еще в толстой кишке, пациенту следует рекомендовать колэктомию. Неаденомоподобный DALM с нерегулярными границами или плоским, расширяющимся внешним видом, который не подлежит эндоскопическому лечению, требует колэктомии, учитывая связанный с этим высокий риск рака толстой кишки [39].
Если аденома-подобный ДАЛМ уверенно удален, а основание отрицательно на дисплазию, наблюдение можно возобновить. Было показано, что аденомоподобные образования, возникающие на фоне колита, имеют доброкачественное течение [37, 38]. Если область удалена не полностью, и если есть какие-либо признаки дисплазии в основании или если дисплазия обнаружена где-либо еще в толстой кишке, пациенту следует рекомендовать колэктомию. Неаденомоподобный DALM с нерегулярными границами или плоским, расширяющимся внешним видом, который не подлежит эндоскопическому лечению, требует колэктомии, учитывая связанный с этим высокий риск рака толстой кишки [39].
Воспалительные полипы можно увидеть при эндоскопии у пациентов с ВЗК (рис. 4 (d)). Скорее всего, это доброкачественные образования, вызванные заживлением эрозивного воспаления. Гистология псевдополипов характерна, поэтому при обнаружении их следует биопсировать или удалить. Они выглядят как полиповидные поражения, размер которых может быть больше, чем их ширина. Их присутствие может помешать безопасному обнаружению дисплазии и DALM.
Их присутствие может помешать безопасному обнаружению дисплазии и DALM.
Последние достижения в оптических методах и системах красителей позволяют более точно определять дисплазию.Хотя эти методы не были включены в последние руководства, они могут позволить проводить прицельную биопсию и устранять необходимость в случайных биопсиях. Самым многообещающим методом на сегодняшний день, который был недавно одобрен Американским фондом рака толстой кишки Крона и колита в исследовательской группе IBD [40], является хромоэндоскопия. В этом методе краситель, такой как метиленовый синий или индигокармин, наносится на толстую кишку случайным образом или выборочно, чтобы выделить области дисплазии. Метиленовый синий — это абсорбирующий краситель, который поглощается нормальной тканью, но не диспластической тканью, а индигокармин — контрастный краситель, который накапливается в областях аномальной диспластической ткани.Несколько недавних исследований показали, что хромоэндоскопия увеличивает чувствительность выявления дисплазии.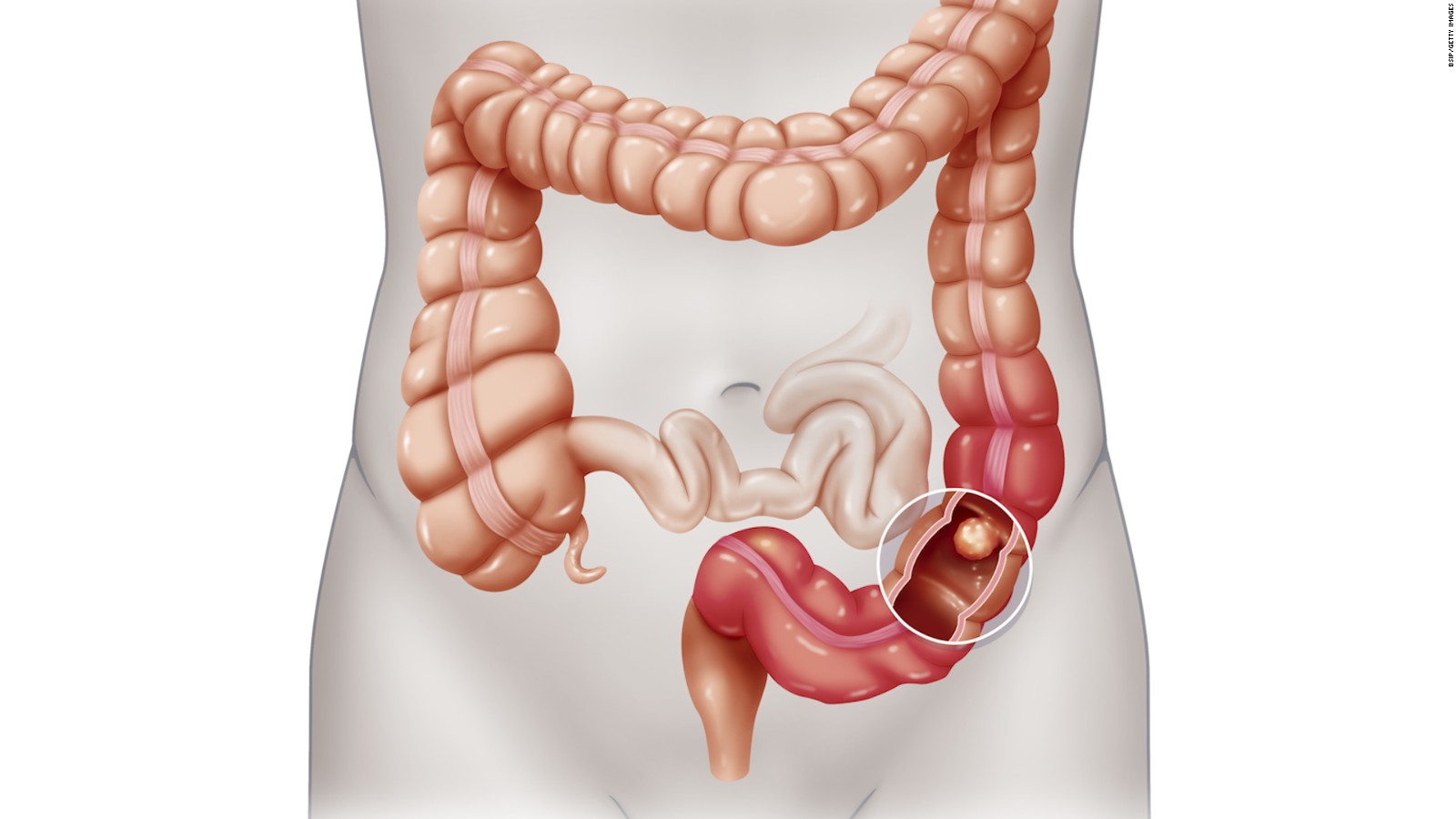 Недавно опубликованный метаанализ рассчитал совокупный дополнительный выход хромоэндоскопии в белом свете для обнаружения дисплазии. Они смогли обнаружить, что в 6 исследованиях с участием 1277 пациентов хромоэндоскопия была значительно лучше, чем белый свет для выявления дисплазии при ВЗК толстой кишки [41]. В техническом обзоре и заявлении о позиции, опубликованном AGA, авторы пришли к выводу, что прицельная биопсия с использованием хромоэндоскопии, выполняемая эндоскопистами, имеющими опыт в этой методике, является разумной альтернативой скринингу случайному отбору образцов толстой кишки с использованием стандартного белого света [31, 32].В оценке технологии AGA Institute по эндоскопии с улучшенным изображением (IEE) авторы приходят к выводу, что IEE может повысить эффективность обнаружения дисплазии и поэтому рекомендуется для пациентов с длительным ЯК [42]. Другие методы, которые в настоящее время изучаются, но еще не доказаны для широкого клинического использования, включают конфокальную микроэндоскопию и узкополосную визуализацию.
Недавно опубликованный метаанализ рассчитал совокупный дополнительный выход хромоэндоскопии в белом свете для обнаружения дисплазии. Они смогли обнаружить, что в 6 исследованиях с участием 1277 пациентов хромоэндоскопия была значительно лучше, чем белый свет для выявления дисплазии при ВЗК толстой кишки [41]. В техническом обзоре и заявлении о позиции, опубликованном AGA, авторы пришли к выводу, что прицельная биопсия с использованием хромоэндоскопии, выполняемая эндоскопистами, имеющими опыт в этой методике, является разумной альтернативой скринингу случайному отбору образцов толстой кишки с использованием стандартного белого света [31, 32].В оценке технологии AGA Institute по эндоскопии с улучшенным изображением (IEE) авторы приходят к выводу, что IEE может повысить эффективность обнаружения дисплазии и поэтому рекомендуется для пациентов с длительным ЯК [42]. Другие методы, которые в настоящее время изучаются, но еще не доказаны для широкого клинического использования, включают конфокальную микроэндоскопию и узкополосную визуализацию.
5. Эндоскопические вмешательства при ВЗК
Клиническим последствием многих фенотипов болезни Крона является сжатие кишечника.Чаще всего это происходит при хирургическом анастомозе, в терминальном отделе подвздошной кишки, на илеоцекальном клапане и в толстой кишке. Поскольку сохранение кишечника крайне важно для предотвращения таких проблем, как синдром короткой кишки, идея расширения стриктур с помощью эндоскопии является привлекательной. Исследования показали, что эндоскопическая баллонная дилатация может быть выполнена безопасно с минимальными осложнениями и может обеспечить годы жизни без симптомов и без хирургического вмешательства [43]. Одно проспективное исследование показало, что длина и расположение стриктуры могут предсказать долгосрочный успех дилатации [44].Из 55 пациентов, перенесших расширение 74 симптоматических стриктур, только 24% этих пациентов в конечном итоге потребовалось хирургическое вмешательство после среднего периода наблюдения 44 месяца. Эти стриктуры составляли в среднем 7,5 см по сравнению с 2,5 см у пациентов, которым не требовалось хирургическое вмешательство, и все они располагались в терминальном отделе подвздошной кишки. В самой большой серии, опубликованной на сегодняшний день [45], 237 дилатаций были выполнены 138 пациентам и наблюдались в среднем в течение 5,8 лет (частота осложнений 5%, частота немедленного успеха 97%, 84% были анастомотическими стриктурами, все стриктуры были <5 см в диаметре). длина).Из-за рецидивов симптомов 46% этих пациентов потребовалась дальнейшая дилатация, а 24% потребовалось хирургическое вмешательство. Интересно, что ни степень клинической активности воспаления во время дилатации, оцениваемая по CRP и эндоскопической активности заболевания, ни сопутствующая медикаментозная терапия после дилатации не повлияли на будущую потребность в дилатации или хирургии. Имеются также сообщения об эндоскопической дилатации с использованием двойной баллонной энтероскопии для симптоматических стриктур тонкой кишки, недоступных для стандартного верхнего эндоскопа [46].
В самой большой серии, опубликованной на сегодняшний день [45], 237 дилатаций были выполнены 138 пациентам и наблюдались в среднем в течение 5,8 лет (частота осложнений 5%, частота немедленного успеха 97%, 84% были анастомотическими стриктурами, все стриктуры были <5 см в диаметре). длина).Из-за рецидивов симптомов 46% этих пациентов потребовалась дальнейшая дилатация, а 24% потребовалось хирургическое вмешательство. Интересно, что ни степень клинической активности воспаления во время дилатации, оцениваемая по CRP и эндоскопической активности заболевания, ни сопутствующая медикаментозная терапия после дилатации не повлияли на будущую потребность в дилатации или хирургии. Имеются также сообщения об эндоскопической дилатации с использованием двойной баллонной энтероскопии для симптоматических стриктур тонкой кишки, недоступных для стандартного верхнего эндоскопа [46].
6. Выводы
В этом обзоре представлены многочисленные способы использования эндоскопии в диагностике и лечении пациентов с ВЗК. Текущие исследования сосредоточены на роли заживления слизистой оболочки, оцениваемой с помощью эндоскопии, как конечной точки медикаментозной терапии и послеоперационного наблюдения. Будущее является многообещающим для наблюдения за раком и дисплазией с использованием новейшего оптического оборудования и красителей, позволяющих проводить прицельную биопсию. В целом, диагностика и лечение ВЗК по-прежнему начинается с тщательного сбора анамнеза и физического осмотра.У надлежащим образом отобранного пациента эндоскопия может предоставить ценную клиническую информацию для дополнения или закрепления клинического впечатления. Роль эндоскопии при ВЗК постоянно развивается и является важной целью клинического обучения и исследований.
Текущие исследования сосредоточены на роли заживления слизистой оболочки, оцениваемой с помощью эндоскопии, как конечной точки медикаментозной терапии и послеоперационного наблюдения. Будущее является многообещающим для наблюдения за раком и дисплазией с использованием новейшего оптического оборудования и красителей, позволяющих проводить прицельную биопсию. В целом, диагностика и лечение ВЗК по-прежнему начинается с тщательного сбора анамнеза и физического осмотра.У надлежащим образом отобранного пациента эндоскопия может предоставить ценную клиническую информацию для дополнения или закрепления клинического впечатления. Роль эндоскопии при ВЗК постоянно развивается и является важной целью клинического обучения и исследований.
Конфликт интересов
Автор не сообщает о конфликте интересов.
Благодарности
Выражаем благодарность Fred Makrauer M.D. за использование изображения на Рисунке 4 (a) и за все его академическое и карьерное наставничество.Выражаем благодарность Американскому фонду Крона и Колита за поддержку исследований автора и их преданность обучению, исследованиям и уходу за пациентами при воспалительных заболеваниях кишечника.
Портальная гипертоническая энтеропатия
ВВЕДЕНИЕ
Портальная гипертензия определяется как повышенное давление в портальной системе кровообращения, оцениваемое с помощью измерения градиента печеночного венозного давления (HVPG) [ 1 ] , которое представляет собой разницу между клиновидным давлением в печени (синусоидальное давление в печени). ) и свободное печеночное венозное давление.ГПВД более 6 мм рт. Ст. Считается ненормальным [ 1 , 2 ] . Клинически значимая портальная гипертензия возникает, когда HVPG превышает 10 мм рт. Ст., И считается тяжелой портальной гипертензией, когда HVPG превышает 12 мм рт. Ст. [ 3 , 4 ] . Цирроз с последующим повышенным сопротивлением печеночных сосудов и притоком воротной вены остается наиболее частой этиологией портальной гипертензии, хотя иногда он также может наблюдаться из-за других пред- и постпеченочных состояний, таких как застойная сердечная недостаточность, синдром Бадда-Киари, тромбоз воротной вены, и т. Д. .Основные клинические проявления портальной гипертензии были впервые обнаружены в конце девятнадцатого века, а портальная гипертензия была описана как клинический синдром асцита, спленомегалии и пищеводного кровотечения Гилбертом и Карно в 1902 г. [ 5 ] . Разрыв и последующее кровотечение из варикозно расширенных вен пищевода остается наиболее смертельным осложнением портальной гипертензии, и поэтому в настоящее время в руководствах содержится призыв к периодической эндоскопии для наблюдения за этим варикозным расширением вен.Эндоскопия верхнего и нижнего отделов желудочно-кишечного тракта позволила выявить другие изменения слизистой оболочки желудочно-кишечного тракта, которые ранее не были известны.
Д. .Основные клинические проявления портальной гипертензии были впервые обнаружены в конце девятнадцатого века, а портальная гипертензия была описана как клинический синдром асцита, спленомегалии и пищеводного кровотечения Гилбертом и Карно в 1902 г. [ 5 ] . Разрыв и последующее кровотечение из варикозно расширенных вен пищевода остается наиболее смертельным осложнением портальной гипертензии, и поэтому в настоящее время в руководствах содержится призыв к периодической эндоскопии для наблюдения за этим варикозным расширением вен.Эндоскопия верхнего и нижнего отделов желудочно-кишечного тракта позволила выявить другие изменения слизистой оболочки желудочно-кишечного тракта, которые ранее не были известны.
Микроциркуляторные изменения слизистой оболочки желудка в результате портальной гипертензии были впервые описаны как застойная гастропатия в 1985 году McCormack et al. [ 6 ] . Характерные признаки мозаичного рисунка слизистой оболочки (неправильная многоугольная сетчатая область с расщелиной или рисунок, напоминающий кожу змеи), небольшие плоские красные точки, возвышенные большие вишнево-красные пятна и черно-коричневые пятна по-разному называются воспалительными. гастрит, васкулопатия слизистой оболочки, портальная гипертензивная слизистая оболочка и портальная гипертензивная гастропатия [ 6 — 10 ] .Последующие исследования показали, что эти изменения могут быть обнаружены и в других областях желудочно-кишечного тракта [ 11 — 14 ] . Термин портальная гипертензивная колопатия использовался для описания подобных аномалий, обнаруженных в толстой кишке пациентов с портальной гипертензией. Эндоскопические данные портальной гипертонической колопатии включают диффузную эритематозную и отечную слизистую оболочку, воспалительные (колитоподобные) поражения, ангиодисплазии, а также эктопический или аноректальный варикозный вен [ 15 — 24 ] ] .
гастрит, васкулопатия слизистой оболочки, портальная гипертензивная слизистая оболочка и портальная гипертензивная гастропатия [ 6 — 10 ] .Последующие исследования показали, что эти изменения могут быть обнаружены и в других областях желудочно-кишечного тракта [ 11 — 14 ] . Термин портальная гипертензивная колопатия использовался для описания подобных аномалий, обнаруженных в толстой кишке пациентов с портальной гипертензией. Эндоскопические данные портальной гипертонической колопатии включают диффузную эритематозную и отечную слизистую оболочку, воспалительные (колитоподобные) поражения, ангиодисплазии, а также эктопический или аноректальный варикозный вен [ 15 — 24 ] ] .
После выявления изменений слизистой оболочки желудка и толстой кишки, связанных с портальной гипертензией, также были отмечены изменения слизистой оболочки тонкой кишки и подвздошной кишки. В отдельных сообщениях предполагалось кровотечение из тонкой кишки у пациентов с циррозом печени, которое, как предполагалось, было следствием портальной гипертензии. Внедрение видеокапсульной эндоскопии и глубокой энтероскопии расширило нашу способность полностью оценивать тонкую кишку с помощью изображений хорошего качества и привело к лучшему распознаванию и пониманию этих изменений портальной гипертензии в тонкой кишке.В этой статье рассматриваются существующие данные об изменениях в тонкой кишке, связанных с портальной гипертензией, также известных как портальная гипертензивная энтеропатия (PHE), с акцентом на ее классификацию, клинические проявления, эндоскопический вид и клиническое ведение.
ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ
PHE, ранее называвшаяся портальной гипертензивной кишечной васкулопатией [ 25 ] , включает патологические изменения и аномалии слизистой оболочки, наблюдаемые в тонком кишечнике пациентов с портальной гипертензией [ ] [ ].Как и другие изменения, связанные с портальной гипертензией, PHE также описана при нецирротической этиологии портальной гипертензии [ 27 ] . Определение и диагностика PHE эволюционировали за последнее десятилетие в связи с увеличением доступности тонкой кишки. Внедрение видеокапсульной эндоскопии (VCE) и глубокой энтероскопии пролило больше света на эту область желудочно-кишечного тракта и изменило определение болезни. Было предложено несколько систем оценки для классификации PHE и оценки степени его серьезности [ 28 — 30 ] .
De Palma et al. [ 29 ] были среди первых групп, изучавших изменения тонкого кишечника у пациентов с циррозом и портальной гипертензией с использованием VCE [ 29 ] . Они обнаружили, что портальная гипертензивная гастропатия и портальная гипертензивная колопатия в значительной степени связаны с PHE, и предположили, что эти изменения в разных частях желудочно-кишечного тракта могут быть региональными проявлениями одного и того же процесса при портальной гипертензии, а не отдельными объектами.Другими параметрами, которые были связаны с PHE в их исследовании, были варикозное расширение вен пищевода 2+ или более крупной степени и цирроз печени класса C. Они разделили эндоскопические данные ПГЭ на две категории: воспалительные аномалии слизистой оболочки (отек, эритема, зернистость, рыхлость) и сосудистые поражения (вишнево-красные пятна, телеангиэктазии или ангиодисплазии, варикозное расширение вен) [ 29 ] .
Abdelaal et al. [ 28 ] классифицировал поражения PHE на 4 подтипа: воспалительные поражения, красные пятна, ангиоэктазия и варикоз тонкой кишки.Они создали систему оценок, основанную на результатах VCE, давая каждому типу один балл с дополнительным баллом за множественные (более двух) поражений. Используя этот показатель PHE, они подтвердили результаты De Palma et al [ 29 ] , повторно продемонстрировав связь между PHE и портальной гипертонической гастропатией, большим варикозным расширением вен пищевода, циррозом класса C по Чайлд-Пью и историей болезни. предшествующей эндоскопической инъекционной склеротерапии варикозно расширенных вен или перевязки в нерандомизированном проспективном исследовании с контролем случая заболевания [ 28 ] .
Kodama et al. [ 30 ] предложили систему оценки PHE, основанную на данных двойной баллонной энтероскопии. Они классифицировали поражения PHE на 2 категории: аномалии ворсинок и поражения сосудов. Далее они разделили каждую категорию на 3 подтипа: отек, атрофия и покраснение для ворсинчатых аномалий и ангиодисплазия-подобные поражения, расширенные / пролиферирующие сосуды и варикозное расширение вен для сосудистых поражений. По одному баллу за каждый тип, в результате чего система выставляет максимум 6 баллов.Однако эта система оценки была связана только с наличием асцита, что делало ее клиническое значение неясным [ 30 ] .
Таким образом, поражения PHE могут быть описаны на основе данных VCE или данных оптической эндоскопии. Их можно разделить на подтипы сосудистых и несосудистых поражений. Несмотря на несколько предложенных систем оценки, как описано в таблице 1, в настоящее время недостаточно данных для стандартизации или проверки этих систем. Помимо эктопического варикозного расширения вен и кровоточащих поражений, клиническое значение других подтипов изменений слизистой оболочки остается неясным.
Таблица 1 Системы классификации портальной гипертонической энтеропатии на основе эндоскопии.| De Palma et al [ 29 ] | Abdelaal et al [ 28 ] | 900 30 ]||
| Классификация | Воспалительные поражения | Воспалительные поражения | Ворсинковые аномалии |
| Сосудистые пятна 6 | Сосудистые пятна 6 | Сосудистые пятна 6 Атрофия | |
| Варикозное расширение вен тонкой кишки | Эритема | ||
| Поражения сосудов | |||
| Поражения, похожие на ангиодисплазию | |||
| Подсчет очков система | Нет | Одна точка для каждого типа поражения.Дополнительный балл для> 2 поражений | Один балл для каждого типа поражения |
| Клиническая значимость | Связано с PHG, PHC, большим варикозным расширением вен пищевода и циррозом C класса Чайлд-Пью | Связано с PHG, большим варикозным расширением вен пищевода, Цирроз класса C по Чайлд-Пью и наличие в анамнезе EVL | Ассоциированный с асцитом |
ЭПИДЕМИОЛОГИЯ
Имеется большая неоднородность среди сообщений о распространенности ПГЭ в диапазоне от 15% до 82% у пациентов с циррозом печени [ 5 , 27 , 29 31 ] .Мы считаем, что эта неоднородность является результатом широкого спектра клинической тяжести портальной гипертензии у пациентов с циррозом печени, а также увеличения зарегистрированной распространенности из-за недавних достижений в визуализации тонкой кишки за последнее десятилетие. Распространенность PHE составляет всего 15-25% в исследованиях, в которых использовались традиционные эндоскопические методы, такие как дуоденоскопия, пуш-энтероскопия или колоноскопия с подвздошной интубацией [ 14 , 20 ] , но намного выше (40 % -82%) в других исследованиях при использовании VCE [ 5 , 26 , 29 , 32 — 35 ] .
Распространенность каждого типа эндоскопической находки также варьируется в разных исследованиях. Красные пятна (22,2–62,2%) и поражения, похожие на ангиодисплазию (24,3–55,7%), кажутся более распространенными, чем воспалительные поражения (5,6–13%) или варикозные узлы (8,1–38,9%). Смешанные поражения, особенно множественные сосудистые поражения (варикозное расширение вен, похожие на ангиодисплазию и красные пятна), могут наблюдаться до 22,3% [ 26 , 29 , 36 ] . Варикозное расширение вен тонкой кишки составляет от 12% до 35% от всех эктопических варикозных вен [ 37 , 38 ] .Портальная гипертензивная полиповидная энтеропатия является более редким проявлением ПГЭ, и полиповидные поражения реже встречаются в тонкой кишке (0,3%) по сравнению с полиповидной гастропатией (0,6%) [ 39 ] .
Активно кровоточащие поражения не редкость и могут наблюдаться у 17,8% всех пациентов с ПГЭ, что указывает на их клиническое значение как возможного источника неясного явного или скрытого скрытого желудочно-кишечного кровотечения. Кровоточащие поражения обычно возникают из-за ангиодисплазии и варикозного расширения вен, хотя иногда могут быть связаны и с полиповидной энтеропатией [ 26 , 29 ] .
КЛИНИЧЕСКАЯ ПРЕЗЕНТАЦИЯ
PHE следует заподозрить при наличии желудочно-кишечного кровотечения или анемии, которые не объясняются более распространенной этиологией, а также при признаках портальной гипертензии, таких как асцит, спленомегалия, тромбоцитопения или градиент венозного давления в печени более 8 мм рт. 39 , 40 ] . ПГЭ может проявляться в виде анемии, мелены, гематохезии, гематемезиса или может протекать бессимптомно. Сообщалось также о смертельном и опасном для жизни эктопическом кровотечении из варикозно расширенных вен в тонкой кишке [ 26 , 38 — 41 ] .Разрыв варикозно расширенных вен тонкой кишки может проявляться классической триадой гематохезии (без гематемезиса), портальной гипертензии и ранее перенесенной интраабдоминальной хирургии Наиболее частым показанием к диагностике является скрытое желудочно-кишечное кровотечение.
Было показано, что некоторые клинические параметры связаны с PHE и могут служить ключами для поиска заболевания. Эти параметры включают в себя обширное варикозное расширение вен пищевода, эндоскопическую инъекционную склеротерапию варикозно расширенных вен в анамнезе, эндоскопическую перевязку варикозно расширенных вен, портальную гипертензивную колопатию, портальную гипертензивную гастропатию, низкий гемоглобин, тромбоцитопению, спленомегалию, множественные признаки портальной гипертензии, наблюдаемые на компьютерной томографии, и класс Чайлд-Пью. C [ 26 , 28 , 29 , 36 , 44 , 45 ] .Однако не все эти ассоциации были замечены в каждом исследовании. Только тяжелый цирроз (класс C по Чайлд-Пью) и наличие портальной гипертонической гастропатии были неизменно связаны с PHE в большинстве исследований [ 28 , 29 , 36 , 44 ] . PHE также описан при нецирротической этиологии портальной гипертензии, такой как поликистоз печени, тромбоз воротной вены и синдром Бадда-Киари [ 27 , 46 — 48 ] .PHE обычно диагностируется с помощью VCE или глубокой энтероскопии [ 35 ] .
ЭНДОСКОПИЧЕСКИЕ РЕЗУЛЬТАТЫ
Эндоскопически PHE может быть связан с широким спектром изменений слизистой оболочки, включая отек слизистой оболочки, застойные округлые тупые ворсинки, создающие классический вид «селедки», потеря васкуляризации, рыхлость, гиперремия, плоские красные пятна, поражения, похожие на ангиодисплазию, пигментные черно-коричневые пятна, зернистость слизистой оболочки, язвы, сетчатая мозаика слизистой оболочки, выступающие красные бугорки, воспалительные полипы и варикозное расширение вен [ 11 , 26 , 39 , 44 , 47 , 49 , 50 ] .Распознавание этих результатов с помощью оптического эндоскопа или капсульной эндоскопии может привести к быстрой диагностике и избежать дальнейшего ненужного и потенциально вредного вмешательства. Как упоминалось выше, эти эндоскопические данные можно разделить на сосудистые и несосудистые поражения. Они могут быть дополнительно разделены на воспалительные поражения, красные пятна, ангиоэктазии и варикозное расширение вен тонкой кишки [ 28 ] . Особое внимание следует обращать на сосудистые поражения, такие как красные пятна, поражения, похожие на ангиоэктазию, и варикозное расширение вен, которые с большей вероятностью вызывают клинически значимое кровотечение и поддаются эндоскопическому вмешательству [ 28 ] .
Красные пятна — это небольшие, симметричные, равномерно эритематозные сосудистые участки на слизистой оболочке кишечника, как показано на рисунке 1. Поражения обычно плоские. Они являются очень частым проявлением ПГЭ и были зарегистрированы у 55% пациентов с циррозом и портальной гипертензией в одной серии [ 28 ] .
Рисунок 1 Красные пятна на слизистой оболочке.
Ангиоэктазия — это аберрантные поражения подслизистых сосудов, характеризующиеся небольшими красными пятнами с ветвящимися эктатическими сосудами, как показано на рисунке 2.Варикозные поражения в тонкой кишке описываются как извилисто увеличенные вены, которые обычно имеют серпигинозную или узловую форму с вышележащей мозаичной блестящей слизистой оболочкой с голубоватым оттенком, как показано на Рисунках 3A и B [ 26 , 27 ] . Эндоскопические характеристики этих поражений должны быть незамедлительно распознаны, чтобы избежать потенциально катастрофических попыток диагностической биопсии.
Рисунок 2 Поражение, похожее на ангиодисплазию.
Рисунок 3. Варикозное расширение вен подвздошной кости (A и B).
Варикозное расширение вен двенадцатиперстной кишки чаще всего встречается в луковице двенадцатиперстной кишки и во второй части двенадцатиперстной кишки [ 51 — 53 ] . Варикоз тощей и подвздошной кишки чаще встречается у пациентов, перенесших абдоминальные операции в анамнезе из-за послеоперационных портосистемных коллатералей, связанных с анастомозом кишечника, и их труднее диагностировать из-за их глубокого расположения в кишечном тракте [ 38 , 42 , 43 ] .Варикозное расширение вен тонкой кишки обычно происходит из ствола воротной вены или верхней брыжеечной вены [ 48 , 54 , 55 ] . Полиповидная энтеропатия является редким проявлением ПГЭ и может присутствовать в любой части тонкого кишечника. Полиповидные поражения могут иметь различные эндоскопические проявления. Они могут быть одиночными или множественными, сидячими или на ножке, маленькими или большими и иногда могут имитировать аденоматозные полипы, как показано на рисунках 4A и B.Они обычно возникают на фоне воспаления слизистой оболочки с классическим мозаичным рисунком или рисунком «сельдь-икра» и были связаны со скрытым или явным желудочно-кишечным кровотечением [ 39 , 49 , 50 , 56 , ] .
Рис. 4 Портальная гипертензивная полиповидная энтеропатия (A и B).
Другие воспалительные поражения включают отек слизистой оболочки, зернистость, пятнистую эритематозную слизистую оболочку и внешний вид икры сельди (округлые притупленные ворсинки на фоне застойной слизистой оболочки с зернистостью), как показано на рисунках 5 и 6.Клиническое значение этих поражений неясно, но считается, что они с меньшей вероятностью вызывают явное желудочно-кишечное кровотечение [ 26 , 28 , 44 ] .
Рис. 5. Внешний вид слизистой оболочки тонкой кишки икры сельди (A и B).
Рис. 6 Отек слизистой оболочки с зернистостью тонкой кишки (A и B).
Некоторые из этих эндоскопических находок неспецифичны и могут создавать диагностическую дилемму, особенно у пациента, чей статус портальной гипертензии неизвестен. Дифференциальный диагноз включает воспалительное заболевание кишечника, целиакию, артериовенозные мальформации и семейный аденоматозный полипоз. Биопсия несосудистых поражений может выполняться с осторожностью для подтверждения диагноза.
При портальной гипертензии, когда внутренний кровоток не может эффективно вернуться в системный кровоток, в результате происходит расширение внутренних сосудов и слизистая оболочка тонкой кишки становится перегруженной.Таким образом, гистопатологические изменения PHE свидетельствуют о гиперемии слизистой оболочки и эктазии сосудов. Эти гистологические находки включают расширение капилляров в собственной пластинке (средний диаметр сосудов 380 микрометров), увеличение толщины стенки капилляров, фиброзно-мышечную пролиферацию, уменьшение соотношения ворсинок / крипт, неоваскуляризацию, эктазию сосудов, сосуды, содержащие тромбы фибрина, инфильтрацию воспалительных лимфоплазматоцитарных клеток в lamina propria, реакционная нуклеоцитоплазматическая атипия в эпителиальных клетках и зубчатая часть желез [ 13 , 14 , 39 , 57 59 152 — 59151 59 — .Однако эти гистопатологические изменения неспецифичны и могут наблюдаться у пациентов без портальной гипертензии и у пациентов с нормальными эндоскопическими данными [ 12 — 14 ] . Следовательно, диагноз PHE следует ставить не только на основании гистопатологии, а, скорее, в сочетании с другими клиническими и эндоскопическими характеристиками.
ДРУГИЕ ДИАГНОСТИЧЕСКИЕ ИСПЫТАНИЯ
Jeon et al. [ 26 ] оценил использование компьютерной томографии (КТ) результатов сканирования портальной гипертензии, такой как варикозное расширение вен пищевода, варикозное расширение желудка, околопупочное варикозное расширение вен, портальная гипертензия. колопатия, портальная гипертензивная гастропатия, портальная гипертензивная холецистопатия, спленомегалия и асцит как радиологические предикторы PHE.Они создали систему подсчета очков, согласно которой каждый CT, находящий одно очко, набирает максимум 6 очков. Было обнаружено, что оценка СТ более 3 значимо связана с PHE [ 26 ] . Изображение поперечного сечения с помощью компьютерной томографической ангиографии и магнитно-резонансной ангиографии также может помочь в оценке сосудистого происхождения эктопического варикозного расширения вен [ 55 , 60 ] .
Abdelaal et al. [ 28 ] исследовали использование транзиторной эластографии (FibroScan ® ), новой неинвазивной ультразвуковой технологии, использующей эхо-импульсные ультразвуковые сигналы для измерения жесткости печени. в качестве суррогатного маркера степени тяжести портальной гипертензии у пациентов с циррозом печени [ 4 , 61 ] .Они обнаружили, что высокий балл транзиторной эластографии имеет линейную зависимость с высоким баллом PHE ( r 2 = 0,314, P — значение 0,004), что позволяет предположить, что более серьезная степень PHE может быть связана с более высокой степенью заболевания печени и портальная гипертензия. Среднее значение жесткости печени в группе PHE составило 29 кПа, что намного выше порогового значения портальной гипертензии, равного 13,6 кПа [ 4 , 28 ] . Они пришли к выводу, что транзиторная эластография может быть новым неинвазивным методом для выявления наличия и тяжести PHE у пациентов с циррозом печени [ 28 ] .
УПРАВЛЕНИЕ
VCE является предпочтительным начальным диагностическим методом при оценке тонкой кишки из-за его неинвазивного характера [ 5 , 27 , 33 , , 90 ] . Он также служит дорожной картой для последующих вмешательств. Глубокая энтероскопия необходима, когда терапевтически поддающееся лечению поражение обнаружено на VCE у пациентов с неясным желудочно-кишечным кровотечением [ 27 ] .Разные результаты эндоскопии могут потребовать различных терапевтических вмешательств.
Из-за его редкости и недостаточности доказательств не существует стандартизированных терапевтических руководств для симптоматического PHE [ 40 ] . Клиническая значимость и необходимость какого-либо вмешательства при воспалительных поражениях и красных пятнах остаются неясными. Коагуляция аргоновой плазмы обычно используется при ангиоэктазии [ 27 ] , тогда как при варикозном расширении вен тонкой кишки и полиповидной энтеропатии использовались несколько подходов [ 39 , 55 , 56, 62 , 63 ] .
Лечение портальной гипертонической полиповидной энтеропатии зависит от количества полипов и эндоскопической доступности. Полипэктомию можно безопасно выполнить, если полип доступен и поддается эндоскопическому удалению. Endoclip можно использовать на ножке для достижения полного гемостаза [ 56 ] . Для достижения гемостаза на воспаленной поверхности кровоточащего полипа можно использовать коагуляцию аргоновой плазмы, но сообщалось о повторных кровотечениях [ 39 ] .Неселективный бета-блокатор, трансъюгулярный внутрипеченочный портосистемный шунт (TIPS), хирургическая резекция тонкой кишки и трансплантация печени, как сообщалось, были успешным лечением портальной гипертонической полипоидной энтеропатии [ 39 , 56 ] .
Кровотечение из варикозно расширенных вен тонкой кишки встречается у 0,4% пациентов с портальной гипертензией и составляет до 5% всех кровотечений из варикозно расширенных вен. Как и кровотечение из варикозно расширенных вен пищевода и желудка, оно обычно представляет собой массивное опасное для жизни кровотечение со смертностью до 40% [ 38 , 40 , 51 , 54 54 .Доступные терапевтические варианты включают эндоскопическое лечение, хирургические вмешательства и интервенционные радиологические подходы. Как и в случае полиповидных поражений, лечение варикозного расширения вен тонкой кишки во многом зависит от эндоскопической доступности, хирургического риска пациента, доступной терапии и местного опыта.
Адекватная реанимация с внутривенным введением жидкости, переливанием продуктов крови, тщательный мониторинг и защита дыхательных путей остаются основными принципами начального лечения. Польза медикаментозного лечения не была широко изучена при эктопическом варикозном расширении вен или других проявлениях ПГЭ, но, учитывая его установленную роль в лечении варикозного расширения вен пищевода и желудка [ 64 ] , целесообразно рассмотреть возможность использования вазоактивных препаратов. такие как октреотид и неселективные бета-блокаторы для снижения внутреннего и портального давления как при первичной, так и при вторичной профилактике эктопического варикозного расширения вен [ 40 ] .
Несмотря на технические проблемы, эндоскопическая перевязка и эндоскопическая обтурация варикозно расширенных вен с помощью мономера тканевого клея, такого как N-бутил-2-цианоакрилат, являются эндоскопическими вмешательствами выбора для гемостаза при эктопическом разрыве варикозно расширенных вен. Однако достигнутый гемостаз носит временный характер, и повторное кровотечение является серьезной проблемой [ 52 , 53 ] . Эндоскопическая обтурация варикозно расширенных вен показала лучший результат и более низкую частоту повторных кровотечений по сравнению с эндоскопическим бандажированием варикозно расширенных вен [ 38 , 65 — 68 ] .Эндоскопическая склеротерапия и перевязка бандажей не рекомендуются для больших варикозных узлов, особенно для варикозно расширенных вен с большим диаметром, чем сам эндоскоп. Это связано с тем, что неполное бандажирование может привести к дефекту слизистой оболочки оставшегося варикозного узла, вызывающему рецидивирующее кровотечение, в то время как чрезмерное разбавление введенного склерозанта при большом варикозном узле снижает вероятность успеха склеротерапии [ 40 , 63 ] . Ограниченные данные свидетельствуют о том, что дополнительное использование коагуляции аргоновой плазмы после перевязки варикозного бандажа является успешным средством предотвращения повторного кровотечения при варикозном расширении вен пищевода и подвздошной кишки и может быть рассмотрено при эндоскопическом лечении эктопического варикозного расширения вен [ 69 — 71 ] .
Подходы интервенционной радиологии являются эффективными методами, особенно при большом варикозном расширении вен, поражениях, недоступных эндоскопически, и для пациентов с плохим общим состоянием, которые не подходят для хирургического вмешательства [ 38 , 63 , 72 , ] . Эти вмешательства включают TIPS, ретроградную трансвенозную облитерацию с окклюзией баллона (B-RTO) и чрескожную спиральную эмболизацию [ 38 , 40 , 55 , 62 ].
Несмотря на то, что TIPS является относительно безопасной процедурой, широко доступной и с хорошей вероятностью успеха, она имеет ограничения у пациентов с печеночной энцефалопатией, высоким показателем MELD, тяжелым декомпенсированным циррозом и тяжелой атрофией печени [ 73 , 74, , ] . Тем не менее, это остается эффективным вмешательством для контроля кровотечения из варикозно расширенных вен и предотвращения рецидива, особенно у тех, у кого не удалось провести эндоскопическое или медикаментозное лечение. Американская ассоциация по изучению заболеваний печени (AASLD) рекомендовала TIPS в качестве предпочтительного подхода для предотвращения повторного кровотечения при эктопическом варикозном расширении вен (включая варикозное расширение вен кишечника, стомы и аноректальной области) [ 75 ] .
Чрескожная чреспеченочная и трансъюгулярная спиральная эмболизация — это другие радиологические вмешательства, которые могут предложить фокальную окклюзию питающей вены варикозного расширения. Их можно безопасно выполнять даже при большом варикозном расширении вен, и они дают хорошие краткосрочные результаты. Однако, поскольку портальная система не подвергается декомпрессии, они несут очень высокую частоту повторных кровотечений [ 76 — 81 ] . Ретроспективное исследование Маседо и соавторов [ 76 ] показало, что даже несмотря на то, что немедленный контроль кровотечения может быть достигнут у 75% пациентов, получавших спиральную эмболизацию, частота повторного кровотечения составила 67% при среднем отсутствии кровотечения. интервал 7.8 мес. Этот результат был аналогичен предыдущим исследованиям, которые продемонстрировали частоту повторного кровотечения до 55% через 6 месяцев и 92% через 4 года [ 76 , 82 ] . Комбинированный подход TIPS и чрескожной эмболизации в условиях постоянного кровотечения после TIPS является предпочтительным [ 76 ] .
B-RTO — это безоперационная терапия, которая может перекрыть не только варикоз, но и питающий афферентный и эфферентный сосуд.Это особенно полезно для пациентов, которые кровоточат при более низком давлении в воротной вене, имеют непатентную воротную вену или не являются кандидатами на TIPS. Об успехе B-RTO в лечении эктопического варикозного расширения вен тонкой кишки сообщалось, особенно в японской литературе [ 83 — 86 ] . Однако B-RTO может вызвать значительное повышение порто-системного градиента давления и о последующем образовании варикозно расширенных вен [ 55 , 87 ] .
Хирургические доступы, такие как портосистемный хирургический шунт, сегментарная резекция тонкой кишки и хирургическая перевязка варикозно расширенных вен, могут быть выполнены, но обычно предназначены для пациентов, которые не поддаются другой терапии [ 38 , 41 , 88 , 89 ] . Хирургический шунт, такой как дистальный спленоренальный шунт, имеет такую же эффективность, что и TIPS, без разницы в выживаемости или частоте печеночной энцефалопатии, но является менее экономичным подходом по сравнению с TIPS [ 75 ] .Сообщалось о других хирургических подходах, таких как дуоденотомия с простым ушиванием варикозного расширения вен и деартериализация двенадцатиперстной кишки с помощью скоб. [ 90 , 91 ] .
Подобно тому, что предложили Helmy и др. [ 40 ] , лечение эктопического варикозного расширения вен с кровотечением должно быть сосредоточено на адекватной начальной реанимации и использовать комплексный подход в зависимости от доступности и местного опыта каждого учреждения.Мы предлагаем алгоритм лечения эктопического варикозного кровотечения, показанного на рисунке 7. Как упоминалось выше, мы также рекомендуем индивидуально подобранные методы лечения не варикозного кровотечения в зависимости от клинической ситуации и местного опыта.
Рис. 7. Ведение кровотечения при эктопической варикозной болезни. СОВЕТЫ: трансъюгулярный внутрипеченочный портосистемный шунт; APC: коагуляция аргоновой плазмы; BRTO: ретроградная трансвенозная облитерация с окклюзией баллона.
ЗАКЛЮЧЕНИЕ
Изменения слизистой оболочки тонкой кишки, связанные с PHE, получают все большее признание благодаря внедрению VCE и глубокой энтероскопии VCE и глубокой энтероскопии, которые позволяют провести более тщательную оценку тонкой кишки, чем это было возможно ранее. Эндоскопически ПГЭ может иметь множество проявлений, начиная от легких воспалительных изменений слизистых оболочек и заканчивая ангиоэктазиями, воспалительными полипами и иногда большими внематочными варикозными венами. Из-за неспецифических эндоскопических и гистопатологических данных, для распознавания и точной диагностики этого состояния требуется высокий индекс подозрительности.VCE и / или глубокая энтероскопия являются в настоящее время предпочтительными методами для установления диагноза. Известно, что ПГЭ вызывает значительные угрожающие жизни явные желудочно-кишечные кровотечения или является источником скрытой желудочно-кишечной кровопотери. Однако из-за низкой распространенности и отсутствия крупных исследований его прогностическая ценность и клиническое значение для заболеваемости и смертности остаются неясными. Ведение PHE еще не стандартизировано и должно быть индивидуализировано в зависимости от остроты и тяжести кровотечения, эндоскопической доступности поражения, хирургического риска для пациента, проходимости воротной вены, доступной терапии и опыта каждого учреждения.
БЛАГОДАРНОСТИ
Авторы хотели бы выразить признательность Юэ Сюэ, доктору патологии, Медицинская школа Эмори, за представление картины гистопатологических изменений в PHE (рис. 8).
Рисунок 8 Гистопатологические изменения портальной гипертонической энтеропатии (A-D).
НПВП Колопатия: забытый маскарад воспалительного процесса B…: Официальный журнал Американского колледжа гастроэнтерологии
Введение: При оценке симптомов со стороны верхних отделов желудочно-кишечного тракта использование нестероидных противовоспалительных препаратов (НПВП) является стандартным вопросом. Однако НПВП также могут вызывать значительную патологию толстой кишки. Эту сущность бывает трудно распознать, поскольку она может клинически проявляться аналогично воспалительному заболеванию кишечника (ВЗК), инфекции, дивертикулиту или ишемии. В этом случае представлен пациент, у которого симптоматически и эндоскопически обнаружилась ВЗК; тем не менее, в конечном итоге был поставлен диагноз колопатии, связанной с НПВП.Исключение этого, в первую очередь, путем тщательного сбора анамнеза в сочетании с биопсией толстой кишки, имеет решающее значение, прежде чем рассматривать иммунодепрессанты для лечения ВЗК.
Отчет о болезни: 72-летняя женщина азиатского происхождения обратилась с жалобой на повторяющуюся диарею и боль в животе. В течение последних 6 месяцев она сообщала о приступах кровавой диареи и диффузной боли в животе, которые длились несколько недель подряд, усиливаясь после еды. Ранее она не обращалась за лечением; однако ее симптомы прогрессивно ухудшались.Первоначально зарегистрированными лекарствами были только аспирин и омепразол. При поступлении у нее был гемоглобин 6,7 и лейкоциты 19,1. Компьютерная томография брюшной полости и таза выявила диффузный колит. Токсин стула на Clostridium difficile был отрицательным. Верхняя эндоскопия без особенностей; однако колоноскопия выявила диффузную эритему, отек и язвы по всей толстой кишке в виде пятен, наиболее выраженных в поперечной и восходящей ободочной кишке. Терминал подвздошной кишки не может быть пересечен; однако магнитно-резонансная энтерография не была примечательной.Результаты эндоскопии оказались совместимыми с болезнью Крона. Однако биопсия выявила эрозии и воспалительный экссудат, характерные для неспецифического колита, включая колопатию от НПВП. После дальнейшего опроса было установлено, что пациент принимал напроксен несколько дней в неделю в течение последнего года. Пациенту было приказано полностью прекратить прием НПВП; это привело к полному исчезновению ее симптомов через 4 недели наблюдения.
Обсуждение: НПВП колопатия обычно субклиническая; однако он может проявляться аналогично ВЗК, инфекции или ишемии.Без тщательного изучения истории приема лекарств это заболевание может остаться невыявленным и потенциально привести к лечению ненужными лекарствами, такими как стероиды или другие иммунодепрессанты. Разрешение этого заболевания обычно достигается простым прекращением приема НПВП. Чаще всего повреждение правой толстой кишки, вызванное НПВП, включает эрозии, поверхностные и глубокие язвы и структуры, похожие на диафрагму. Эндоскопически это может имитировать болезнь Крона или ишемическое повреждение. Этот случай представляет важность получения подробного анамнеза приема лекарств у пациентов с симптомами нижних отделов желудочно-кишечного тракта.
Пример № 1 — Омнипатология
Портальная гипертензивная колопатия (PHC)
Обсуждение:
PHC — это сосудистая аномалия, которая может быть обнаружена в любой части толстой кишки. Эндоскопически это проявляется в виде эритематозных поражений. Основное осложнение ПМСП — кровотечение из нижних отделов ЖКТ. В нашей практике, когда мы сталкиваемся с заметными расширенными сосудистыми структурами при биопсии толстой кишки, основными объектами, которые мы рассматриваем при дифференциальной диагностике, являются сосудистая эктазия (первоначально называемая ангиодисплазией), лучевой колит и портальная гипертензивная колопатия.Сосудистая эктазия (ангиодисплазия) считается сосудистой мальформацией, обычно наблюдаемой у пожилых людей. Лучевой колит обычно связан с расширением сосудов слизистой оболочки, окруженным фиброзом стромы и, в некоторых случаях, эндотелиальными и эпителиальными аномалиями. Эпителиальная атипия и цитомегалия без увеличения отношения N / C также могут наблюдаться при лучевом колите. Для постановки этого диагноза требуется история лучевого лечения. Портальная гипертензивная колопатия наблюдается в случаях портальной гипертензии из-за цирроза печени.
Согласно исследованию Ito et. Al, гистологическое исследование 47 пациентов с циррозом печени показало гистологические доказательства ПМСП в 31 случае (66%). В этом исследовании 23% наблюдались в ректосигмоиде, 11% — в нисходящей, 24% — в поперечной ободочной кишке, 23% — в восходящей ободочной кишке и 16% — в слепой кишке.
Заключение:
Наличие сосудистой эктазии в биоптатах слизистой оболочки толстой кишки является неспецифическим признаком. Однако при наличии хорошей истории болезни можно поставить более точный диагноз, как в этом случае.Системный подход к биопсии слизистой оболочки помогает выявить едва заметные морфологические изменения. В случае лучевого колита история лучевого лечения может быть отдаленной, поэтому в заявке не указывается. Принимая во внимание возможность, обращение к лечащему врачу и выяснение истории злокачественных новообразований и лучевой терапии может быть чрезвычайно полезным.
Ссылка:
Ито К., Шираки К., Сакаи Т., Йошимура Х., Накано Т. Портальная гипертоническая колопатия у пациентов с циррозом печени. Мир Дж. Гастроэнтерол . 2005. 11 (20): 3127–3130. doi: 10.3748 / wjg.v11.i20.3127
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4305852/pdf/WJG-11-3127.pdfЛевин, Вайнштейн и Желудочно-кишечная патология Риддл и ее клинические последствия, Риддл и Джайн, второе издание, Wolter Kluwer Health
Доброкачественные заболевания толстой и прямой кишки (включая КТ-колонографию)
19.2.1 Доброкачественные полипы слизистой оболочки толстой кишки
распространенные доброкачественные образования толстой кишки.Помимо злокачественных опухолей, полипы являются основными мишенями для ЦОК. Согласно Парижской классификации, по морфологическому признаку они делятся на сидячие, ножковые или плоские [4]. На CTC полиповидные образования толстой кишки характеризуются их внешней морфологией, их внутренней структурой и характеристиками ослабления, а также их подвижностью между положением пациента лежа на спине и животом [5].
Полип на сидении (0-Is) представляет собой круглый, овальный или дольчатый дефект наполнения просвета с основанием, равным или превышающим его высоту по вертикали (рис.19.1) Рис. 19.1( a — d ) Сессильный овальный полип, расположенный в восходящей ободочной кишке. ( a ) На эндолюминальном трехмерном изображении показано круглое полиповидное поражение (стрелка) ( b ) Соответствующее осевое двухмерное изображение, расположенное на животе, показывает однородную плотность мягких тканей (стрелка) поражения. ( c ) Соответствующий внутрипросветный трехмерный вид в положении лежа на спине показывает горизонтальный слой жидкости (стрелки). Полипа не видно. ( d ) На аксиальном 2D-изображении в положении лежа на спине показано, что поражение (стрелка) погружено в воду без помеченной остаточной жидкостью (стрелка). слизистая оболочка ножкой.На двухмерных плоских изображениях колоректальные полипы обычно демонстрируют однородную внутреннюю структуру с ослаблением мягких тканей. Полипы возникают из стенки толстой кишки. Следовательно, они сохраняют свое внутрипросветное положение при сравнении положений сканирования лежа и лежа. Этот критерий может помочь отличить настоящие полипы от немаркированного остаточного стула, который не прикреплен к стенке толстой кишки и показывает позиционное движение. Однако полипы на ножке могут показывать значительный сдвиг между положением на спине и на животе из-за их ножки (рис.19.2). Эта так называемая псевдоподвижность может привести к путанице с непомеченным стулом, показывая истинную подвижность, то есть появление псевдостула. 19.2
Большой полип на ножке, расположенный в сигмовидной кишке. ( a ) На трехмерном изображении внутри просвета лежа на животе показана головка полипа (стрелка), соединенная со слизистой оболочкой ножкой (наконечник стрелки). К головке полипа прикреплена небольшая слизистая слеза (звездочка). ( b ) Соответствующее сагиттальное 2D-изображение лежа на животе показывает головку полипа из мягких тканей (стрелка), расположенную на передней стенке сигмовидной кишки.Он соединен ножкой (наконечником стрелки) с дорсальной стенкой сигмовидной кишки. ( c ) Соответствующий внутрипросветный трехмерный вид в положении лежа на спине и ( d ) сагиттальное двухмерное изображение показывают, что головка полипа (стрелка) перемещается на своей ножке (наконечник стрелки) к дорсальной стенке сигмовидной кишки
Морфологические характеристики плоских или неполиповидных поражений их небольшая высота по сравнению с шириной (рис. 19.3). На CTC неполиповидные поражения определяются как поражения, которые на 6 мм или больше превышают окружающую слизистую оболочку и имеют высоту 3 мм или меньше [6].Эндоскопически они классифицируются в соответствии с преобладающим направлением роста, которое определяет их морфологию: плоские приподнятые (0-IIa), истинно плоские (0-IIb) и вдавленные плоские (0-IIc). Неполиповидные поражения обычно встречаются реже, чем их полиповидные аналоги. 19.3( a , b ) Плоское поражение, слегка возвышающееся на 12 мм, с углублением в центре. ( a ) На внутрипросветном 3D-изображении показан плоский слегка приподнятый дефект наполнения с центральным углублением (стрелка), расположенный на гаустральной складке рядом с илеоцекальным клапаном (наконечник стрелки).( b ) Соответствующий сагиттальный 2D-вид показывает плоскую возвышенность стенки кишечника, ведущую к бляшечному утолщению мягкой ткани хаустральной складки. Обратите внимание на небольшое центральное углубление в центре поражения (стрелка)
На CTC они менее заметны, чем полиповидные поражения. На эндолюминальных 3D изображениях плоские поражения представлены в виде бляшек на стенке толстой кишки с гладкой или узловатой поверхностью. Плоское поражение, расположенное на полулунной складке, обычно приводит к ограниченному утолщению складки.На двухмерных плоских изображениях плоские поражения обычно выглядят как ограниченные бляшкообразные стенки, утолщенные с однородным ослаблением мягких тканей [5]. Было показано, что плоские поражения с центральной депрессией имеют более высокий риск злокачественных новообразований. Плоские поражения часто покрываются помеченными остатками, которые могут помочь в обнаружении. Это называется «контрастным покрытием» [7].
Более крупные неполиповидные опухоли, размер которых превышает ≥1 см (при CTC ≥ 3 см), представляют собой латерально распространяющиеся опухоли (LST). Более старый, широко используемый термин — «поражение ковра».«Они представляют собой важную подгруппу плоских поражений, чаще всего поражающих слепую и прямую кишки. Обычно они имеют расширенные гистологические особенности. По внешнему виду поверхности они эндоскопически делятся на гранулярные и негранулярные [8].
На СТС они обычно имеют плоскую морфологию с широким основанием и размером ≥3 см. Они могут превышать 3 мм в высоту, но оставаться плоскими и иметь слегка приподнятые края. Часто можно увидеть покрытие поверхности пероральным контрастным веществом [9] (рис.19.4) Рис. 19,4( a , b ) Латерально распространяющаяся опухоль смешанного гранулярного типа в прямой кишке. ( a ) На трехмерном изображении внутри просвета показан плоский дефект наполнения неправильной формы с узловатой поверхностью (стрелка). ( b ) Соответствующее аксиальное 2D-изображение показывает узелковое утолщение стенки с ослаблением мягких тканей (стрелка). Повреждение покрыто небольшим количеством помеченной жидкости
Правильное измерение размера ЦКО важно, потому что размер полипа, измеренный радиологом, имеет прямое влияние на выбор соответствующих терапевтических процедур.Существует общее мнение, что необходимо сообщать обо всех полипах размером 6 мм и более и рекомендовать эндоскопическую полипэктомию [3, 6]. Полипы размером менее 6 мм часто игнорируются. Для полипов сидячей и плоской формы измеряется наибольший диаметр, который чаще всего находится у основания поражения. При поражении на ножке следует измерять только самый большой диаметр головки полипа, за исключением ножки [6].
19.2.2 Доброкачественные подслизистые опухоли
19.2.2.1 Липомы
Липомы являются наиболее распространенными подслизистыми опухолями толстой кишки.Обычно они имеют размер от 1 до 3 см. Липома может иметь сидячую, ножковую или даже плоскую морфологию. На внутрипросветных 3D изображениях они проявляются в виде дефектов заполнения, обычно с гладкой поверхностью. Правильный диагноз устанавливается с помощью 2D-изображений: липомы обычно имеют однородное жировое ослабление. Часто видна тонкая полоска на слизистой, покрывающая жировую ткань. Поскольку липомы представляют собой относительно мягкие образования, они могут изменить свою форму при изменении положения пациента (рис. 19.5).Липомы доброкачественные. Никаких диагностических или терапевтических исследований не требуется. Однако большие липомы могут иметь симптомы и приводить к инвагинации кишечника [10]. 19,5( a , b ) Липома восходящей ободочной кишки. ( a ) На внутрипросветном 3D-изображении показано большое полиповидное поражение с гладкой поверхностью (стрелка). ( b ) Соответствующее осевое 2D-изображение показывает однородную плотность жировой ткани (стрелка) поражения, покрытого тонкой полоской слизистой оболочки, подтверждающей его подслизистое происхождение (звездочка)
19.2.2.2 Редкие подслизистые опухоли
Лимфангиомы — это редкие доброкачественные образования, которые могут быть простыми, кавернозными или кистозными. В случае кистозного типа поражение выглядит кистозной морфологией на 2D-изображениях. Однако всякий раз, когда обнаружение ≥6 мм на ОК, необходимо исключить истинное новообразование. Существует широкий спектр других подслизистых опухолей, которые, как правило, очень редки, включая лейомиому, гемангиому и ганглионеврому. Их нельзя отличить от аденоматозных полипов или опухолей на основании критериев компьютерной томографии [10].
19.2.2.3 Пневматоз Cystoides Coli
Пневматоз кишечной палочки — редкое заболевание, при котором газы накапливаются внутри организма. Первичный тип — доброкачественный и самоограничивающийся. Вторичный тип связан с некрозом стенки кишечника. Обычно требуется немедленное лечение в зависимости от клинической картины. О первичном типе СТС сообщалось как о редкой находке. Первичный пневматоз кишечной палочки представлен дефектами псевдополипоидного наполнения на эндолюминальных трехмерных изображениях, соответствующих подслизистым кистозным или линейным воздушным карманам.Двумерные изображения показывают патогномоничное ослабление воздуха при этих находках. Первичный пневматоз кишечной палочки — это совершенно безобидное, бессимптомное и самоограничивающееся «осложнение», которое не требует дополнительных медицинских действий [11].
19.2.2.4 Эндометриоз
Эндометриоз — это состояние, связанное с ростом эндометрия за пределами матки. Поражение толстой кишки происходит в основном в ректосигмовидной кишке и редко в слепой кишке. Это происходит через перитонеальные имплантаты из ткани эндометрия. У этих имплантатов может развиваться транссерозный рост с расширением подслизистой оболочки.Отсюда у небольшого числа пациентов может происходить внутрипросветное расширение. В зависимости от степени вторжения СТС показывает разные аспекты. При серозной / подслизистой инфильтрации наблюдается утолщение стенок, что приводит к краевому дефекту наполнения просвета, показывая плавные очертания (рис. 19.6). В случае распространения на слизистую оболочку стенка становится неправильной и заканчивается полиповидным поражением или образованием [12]. 19,6( a , b ) Имплантат для эндометриоза в сигмовидной кишке. ( a ) На трехмерном изображении внутри просвета виден плоский дефект наполнения внутри просвета с плавными очертаниями (стрелки).( b ) Соответствующее аксиальное 2D-изображение показывает однородное плотное поражение мягких тканей (стрелка), инфильтрирующее стенку толстой кишки
19.2.3 Анатомические данные
19.2.3.1 Сегментарный спазм толстой кишки
Спазм толстой кишки является физиологическим сужением просвет кишечника из-за мышечного сокращения стенки толстой кишки, который может имитировать циркулярную стенозирующую опухоль. Степень растяжения толстой кишки и внутрипросветный аспект толстой кишки также зависят от мышечного сокращения taenia coli.Оптимальное растяжение толстой кишки предотвращает спазмы и возможные ложноположительные результаты. У сигмовидной кишки таения более или менее тонкая. При сокращении они делают суженный просвет круглым, с плавно утолщенными складками без выступающих краев. В нисходящей ободочной кишке taenia становится немного более заметной, а просвет толстой кишки при сокращении становится чуть более треугольным. В поперечной и восходящей ободочной кишке треугольная форма просвета очевидна. Однако складки не деформированы, и обычно нет образования плеча, что характерно для злокачественных новообразований.Из-за перераспределения газа в толстой кишке, спазм часто либо меняет морфологию, либо даже исчезает между захватами в положении лежа на спине и на животе [5].
19.2.3.2 Псевдоопухоль изгиба
Ободочная кишка представлена множеством петель и изгибов. При каждом изгибе структура с внутренней стороны более сжатая, чем с внешней стороны. Это может вызвать сложные структуры, состоящие из скученных и утолщенных складок толстой кишки. Это утолщение усиливается периколиче- ским жиром и его сосудистыми структурами.На двухмерных плоских изображениях это может привести к очевидному утолщению стенки, которое может быть ошибочно принято за образование толстой кишки. Поэтому такое утолщение называют псевдотумором изгиба. Такие псевдоповреждения могут стать настоящими имитаторами опухоли в случае изгиба на острый угол со схождением множества складок. Сравнение обоих приобретений поможет обнаружить любые изменения во внешнем виде. Тщательный анализ внешнего вида на 3D и 2D изображениях помогает исключить опухолевый процесс. Псевдоповреждения чаще всего представляют собой схождение множества складок, которые демонстрируют правильные плавные контуры на внутрипросветных трехмерных изображениях.На 2D-изображениях периколитический жир иногда виден в утолщенной складке [13].
19.2.4 Аноректальная область
Для оценки прямой кишки важно осмотреть анальный край. Это делается поворотом виртуальной камеры к анусу. В этой части прямой кишки возможно несколько доброкачественных и / или опухолевидных состояний [5, 13, 14].
19.2.4.1 Гипертрофированный анальный сосочек
Гипертрофированный анальный сосочек — частая находка. Это папиллярная проекция прямой кишки (Морганьи), которая выглядит как фиброзный белый полип любого размера на ОК.На КТК невозможно отличить полип от настоящего полипа, что требует ректоскопии в случае полиповидной структуры ≥6 мм.
19.2.4.2 Внутренний геморрой
Внутренний геморрой — это варикозное расширение верхнего геморроидального сплетения. Они возникают на краю анального отверстия и встречаются очень часто (± 50% пациентов). Обычно они выглядят как дефекты гладкого наполнения, окружающие ректальный катетер, с тонкими складками, сходящимися к катетеру. В редких случаях они могут иметь полиповидный вид.
19.2.4.3 Другие результаты
Варикозное расширение прямой кишки — это расширенная подслизистая вена, которая вызывает длинный серпигинозный дефект наполнения. Важно знать о его существовании, поскольку в редких случаях полипы могут иметь серпигинозный характер. Венозный пузырь — это небольшая венозная мальформация, которая может иметь полиповидную морфологию и имитировать истинные полиповидные поражения. Однако обычно они составляют <5 мм.
19.2.5 Слепая кишка
Слепая кишка имеет сложную топографию, включая илеоцекальный клапан и аппендикс.Как и в случае с прямой кишкой, ее исследование ЦОК требует особого внимания [15, 16, 17].
19.2.5.1 Илеоцекальный клапан
Нормальный илеоцекальный (IC) клапан состоит из двух частей (верхней и нижней губы), сходящихся с обеих сторон в выступающую складку, уздечку. При исследовании слепой кишки всегда важно идентифицировать клапан IC и проверить его анатомический вид, за исключением полипов и раковых образований, расположенных на клапане. Однако нормальный клапан IC может иметь некоторые псевдотуморальные аспекты, которые не следует путать с патологией толстой кишки.
19.2.5.2 Липоматозная трансформация
Липоматозная трансформация относится к жировой инфильтрации обеих губ IC. Клапан IC обычно увеличен и может иметь куполообразный вид. Правильная характеристика этого доброкачественного анатомического варианта достигается путем оценки типичного уменьшения жировой прослойки (0 / -100 H.U.) в настройках брюшного окна.
19.2.5.3 Папиллярная трансформация
Папиллярная трансформация наблюдается реже, чем нормальный вид губ.Сосочковый клапан IC возникает из-за выступа терминальной подвздошной кишки в клапан IC. Это считается нормальным функциональным состоянием, поскольку клапан IC предотвращает рефлюкс жидкости из толстой кишки в подвздошную кишку. Папиллярный клапан IC определяется по луковичной или полиповидной морфологии и гладкой поверхности. Он также может выглядеть слегка искаженным и представлять собой объемное образование, напоминающее массу. В таких случаях диагноз не всегда бывает однозначным. Чаще всего это состояние характеризуется плавным очерчиванием клапана IC с некоторой жировой инфильтрацией на 2D-изображениях.Внешний вид часто меняется при двойном захвате (т. Е. Лежа на спине). Однако любое скопление мягких тканей должно вызывать подозрение на неоплазию.
19.2.5.4 Приложение
Поскольку приложение является частью двоеточия, его необходимо проверить. На эндолюминальных трехмерных изображениях отверстие аппендикса идентифицируется как небольшое отверстие или углубление, часто расположенное рядом с небольшой складкой. На двухмерных плоских изображениях приложение представляет собой тонкостенную трубчатую структуру, которая может быть заполнена воздухом или меченой жидкостью.Любое глобальное или очаговое утолщение стенки требует дальнейшего исследования, чтобы исключить злокачественное новообразование (аппендэктомия). Опухолевые состояния аппендикса встречаются редко и часто бессимптомны [18].
19.2.5.5 Мукоцеле отростка
Мукоцеле отростка соответствует расширенному слизью отростку. Обычно он проявляется как трубчатое кистозное поражение в области аппендикса и может проявляться кальцификацией стенок. Это может соответствовать простому мукоцеле (ретенционная киста) или гиперпластическому мукоцеле (гиперпластический полип) в 5–20% случаев, муцинозной цистаденоме в 63–84% и муцинозной цистаденокарциноме в 11–20% случаев.Редко соответствует эндометриозу. Мукоцеле может выступать в просвет слепой кишки и проявляться в виде полиповидного поражения на эндолюминальных 3D изображениях (рис. 19.7) [19]. Злокачественную причину необходимо исключить хирургическим путем. 19,7( a , b ) Мукоцеле аппендикса. ( a ) Трехмерный вид внутрипросветной кишки с частичным заполнением жидкостью слепой кишки, показывающий полиповидное внутрипросветное наполнение с широким основанием и гладкой поверхностью (стрелка). ( b ) Соответствующее аксиальное 2D-изображение показывает кистозную структуру, вызывающую незначительный внешний отпечаток в просвете толстой кишки (стрелка).Повреждение имело тонкий кальциноз на стенке (открытая стрелка) и прилегало к аппендиксу
19.2.5.6 Перевернутая культя аппендикса
После аппендэктомии с перевязкой, которая является более старой техникой аппендэктомии, культя аппендикса может рассматриваться как полипоидное поражение в области предполагаемого аппендикулярного отверстия. Он представляет собой круглый гладкий полиповидный дефект наполнения на месте аппендикулярного отверстия с однородным ослаблением мягких тканей. Это послеоперационное обнаружение полипа нельзя отличить от настоящего полипа толстой кишки на основании критериев компьютерной томографии.Если есть сомнения относительно предыдущей аппендэктомии, следует рекомендовать ОК, как и при любом полиповидном поражении ≥6 мм. Кроме того, в редких случаях в культе может развиться полип или злокачественное новообразование [20].
19.2.6 Дивертикулярная болезнь
Дивертикулярная болезнь является наиболее распространенным заболеванием толстой кишки в западном населении, с частотой около 30% в возрасте 50 лет и более 50% в возрасте 60 лет. В основном она локализуется в сигмовидной кишке. двоеточие. На ранней стадии дивертикулярная болезнь характеризуется миохозом: триада утолщения мышечной стенки, укорочения теней и сужения просвета.Это приводит к ограниченной растяжимости толстой кишки с заметными и узкими переплетенными полулунными складками и глубокими хаустрациями, с укорочением межхолодных сегментов (появление гармошки). На эндолюминальных трехмерных изображениях наблюдается ограниченная визуализация слизистой оболочки позади и между выступающими полулунными складками (слепые пятна). Требуются специальные 3D-осмотры, которые включают поворот виртуальной камеры для визуализации задней стороны складок и межхолодного сегмента. Для уменьшения растяжения толстой кишки оправдано применение гиосцин- N -бутилбромида [6].Растяжение также можно улучшить, переместив пациента в правую или левую боковую позицию пролежня с помощью дополнительного КТ пораженного сегмента с низкой дозой.
По мере прогрессирования миохоза появляются дивертикулы и становятся более заметными полулунные складки. На 2D-изображениях дивертикулы характеризуются газонаполненными выделениями на стенке толстой кишки. На эндолюминальных трехмерных изображениях они выглядят как четко определенное полное темное кольцо, которое может имитировать небольшое поражение полипа на сидячей кости.Полипы, напротив, часто имеют неполную или нечеткую кольцевую тень при осмотре на лицо. Двумерные изображения упрощают дифференциацию дивертикулов и полипов. Дивертикулярная болезнь вызывает псевдополипоидные поражения [21].
19.2.6.1 Дивертикулярный фекалит
Дивертикулы часто поражаются остатками фекалий, которые могут выступать через шейку дивертикула в просвет толстой кишки. Это вызывает полиповидный дефект наполнения на внутрипросветных трехмерных изображениях с патогномоничным аспектом на двухмерных изображениях: дивертикулярный фекалит почти всегда представляет собой круглую структуру с гиперплотным кольцом и гиподенсным центром, соответствующим воздушной окклюзии [22].Он может выступать из дивертикула в просвет толстой кишки. Дивертикулярные каловые массы могут быть источником воспаления, приводящего к очаговому дивертикулиту.
19.2.6.2 Перевернутый дивертикул
Дивертикул может перевернуться в просвет толстой кишки. Хотя это случается нечасто, радиологи должны знать об этой возможности. На внутрипросветных трехмерных изображениях перевернутый дивертикул имитирует настоящий полип, а на двухмерных плоских изображениях — в основном воздушные или жировые включения. Иногда можно выделить центральную пуповину.
19.2.6.3 Хроническая дивертикулярная болезнь или стенозирующий рак
У пациентов с повторяющимися эпизодами острого дивертикулита может развиться хроническая дивертикулярная болезнь, частая причина неполного ОК. CTC — метод выбора для завершения оценки толстой кишки. Однако дифференциальная диагностика хронической дивертикулярной болезни и стенозирующего рака может оказаться сложной задачей. Каждый объект имеет характеристики изображения, которые, к сожалению, не совсем конкретны. Довольно часто встречается вмешательство знаков.Особенности, характерные для хронической дивертикулярной болезни и злокачественной опухоли, представлены в таблице 19.1. Исследования, сравнивающие обе сущности, пришли к выводу, что кажется разумным, что наличие дивертикулов в пораженном сегменте вместе с утолщением стенки на довольно длинном сегменте, утолщение локальной фасции (признак фасции) без лимфаденопатии, конусообразные или сужающиеся края и сохранившиеся более или менее утолщенные толстые складки, вероятно, свидетельствуют о хронической дивертикулярной болезни.И наоборот, отсутствие дивертикулов в утолщенном сегменте и утолщение локальной фасции, более заметное утолщение стенки с коротким расширением, формирование плеча или выступающие края, а также полностью искаженный или складчатый рисунок с большей вероятностью указывают на стенозирующий рак толстой кишки [ 23, 24]. Таблица 19.1. Характеристики КТ колонографии, позволяющие предположить хроническую дивертикулярную болезнь в левой колонке и стенозирующий рак толстой кишки в правой колонке19.2.7 Послеоперационная толстая кишка
В зависимости от использованной хирургической техники (от конца до -концевой или встык) анастомоз будет иметь другую морфологию.Анастомоз должен иметь плавный переход, иногда с тонким, гладким периферическим гребнем или похожий на паутину. На 2D-изображениях хирургические скобки, если они используются, легко идентифицируются. Иногда скобы выступают в просвет толстой кишки, вызывая крошечный дефект наполнения просвета на трехмерных изображениях, который можно легко идентифицировать на двухмерных изображениях по высокой внутренней плотности. В анастомозе могут развиваться полиповидная грануляционная ткань, а также воспалительные и гиперпластические полипы. Эти результаты будут представлены с теми же функциями визуализации, что и аденоматозные полипы.В послеоперационном периоде может развиться фиброз, вызывающий псевдотуморальное сужение анастомоза [25]. Следовательно, любое увеличение мягких тканей в месте анастомоза или рядом с ним должно вызвать подозрение на рецидив опухоли, что указывает на ОК.
09_REV_4596_Egea.ing.indd
% PDF-1.3 % 1 0 obj >] / PageLabels 6 0 R / Pages 3 0 R / Type / Catalog / ViewerPreferences >>> endobj 2 0 obj > поток 2017-11-27T16: 10: 29 + 01: 002017-11-27T16: 10: 30 + 01: 002017-11-27T16: 10: 30 + 01: 00Adobe InDesign CC 2015 (Macintosh) uuid: 926ebc78-82cb-f245 -918c-7568ef0182c8xmp.сделал: F77F11740720681188C6C55CD3F872D5xmp.id: d45ddedf-cb39-43a5-b6b9-67da0556a140proof: pdf1xmp.iid: 5a1c758f-1737-4558-84e7-4a0e7f1b3a78xmp.did: 76067CFC0920681188C6C55CD3F872D5xmp.did: F77F11740720681188C6C55CD3F872D5default

 06.2013 : Аппарат доведен до купола слепой кишки.В просвете небольшое количество промывных вод. Кишка нормотонична. Баугиниева заслонка губовидной формы. Гаустрация нормальная.Слизистая оболочка осмотренних отделов розовая. Сосудистый рисунок четкий. Слизистая прямой, сигмовидной кишки гиперимирована, сосудистый рисунок усилен. манипуляции: взята биопсия на цитологическое исследование, на гистологическое иследование с с\3 сигмовидной кишки. Заключение: эритематозная колопатия. заключение биопсии : колит.
06.2013 : Аппарат доведен до купола слепой кишки.В просвете небольшое количество промывных вод. Кишка нормотонична. Баугиниева заслонка губовидной формы. Гаустрация нормальная.Слизистая оболочка осмотренних отделов розовая. Сосудистый рисунок четкий. Слизистая прямой, сигмовидной кишки гиперимирована, сосудистый рисунок усилен. манипуляции: взята биопсия на цитологическое исследование, на гистологическое иследование с с\3 сигмовидной кишки. Заключение: эритематозная колопатия. заключение биопсии : колит. 

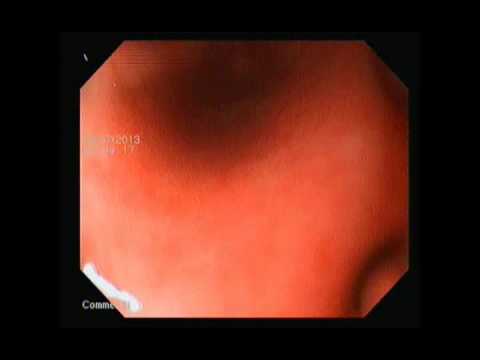 Иногда это бывает достаточно серьезно, чтобы вас госпитализировали и лечили внутривенными антибиотиками и жидкой диетой для отдыха толстой кишки.
Иногда это бывает достаточно серьезно, чтобы вас госпитализировали и лечили внутривенными антибиотиками и жидкой диетой для отдыха толстой кишки. Если болезнь более серьезная, можно использовать противовоспалительные препараты.
Если болезнь более серьезная, можно использовать противовоспалительные препараты. Ваш врач спросит о вашей истории болезни и симптомах. Он или она также проведет медицинский осмотр, чтобы оценить вашу ситуацию. Врач может заподозрить кишечную непроходимость, если ваш живот опух или болезненен, или если в нем есть уплотнение.Он или она может прослушивать звуки кишечника с помощью стетоскопа.
Ваш врач спросит о вашей истории болезни и симптомах. Он или она также проведет медицинский осмотр, чтобы оценить вашу ситуацию. Врач может заподозрить кишечную непроходимость, если ваш живот опух или болезненен, или если в нем есть уплотнение.Он или она может прослушивать звуки кишечника с помощью стетоскопа. У молодых людей с инвагинацией ультразвуковое исследование обычно показывает «яблочко», представляя кишечник, свернутый спиралью внутри кишечника.
У молодых людей с инвагинацией ультразвуковое исследование обычно показывает «яблочко», представляя кишечник, свернутый спиралью внутри кишечника.
 По мере распространения инфекции у вас может развиться инфекция носовых пазух, насморк или кашель.
По мере распространения инфекции у вас может развиться инфекция носовых пазух, насморк или кашель.

