Дисбиоз кишечника у грудничка | ru-babyhealth
Малыш грудного возраста – это не только долгожданное пополнение и радость для семьи. Он еще и является тестом на прочность, выявляющим умение родителей и врачей распознавать проблемы ребенка и оперативно устранять их. Одним из часто встречающихся казусов у малыша является дисбиоз в кишечнике.
Дисбиоз – нарушение баланса микрофлоры (биоценоза). В норме в кишечнике преобладающее большинство составляют полезные микроорганизмы – лактобактерии и бифидобактериии, способствующие адекватному пищеварению, поступлению и усвоению нужных организму питательных веществ, поддержанию в тонусе иммунной системы. Небольшая часть – примерно 10% – это условнопатогенная флора: кокки, кишечная палочка, кампиллобактерии, некоторые грибы и др. Они нужны для «стимуляции» полезной флоры.
Происходит симбиоз – сосуществование полезных и не очень бактерий. За счет выделения кислых продуктов обмена и жизнедеятельности лакто- и бифидобактериями количество «неполезных» микроорганизмов поддерживается на нужном уровне.
Условно патогенная флора потому так и названа, что здоровому человеку она вреда не причинит, а вот если организм чуть-чуть ослаб или стал восприимчив к какому-либо воздействию, тут-то она начинает активно размножаться и нарушать привычный биоценоз кишечника.
Термин «дисбиоз кишечника» обязательно подразумевает дисбактериоз – снижение содержания в толстой кишке нужных молочнокислых бактерий и параллельно – стремительное размножение и агрессивность условнопатогенных и патогенных бактерий.
Симптомы, первые признаки и течение дисбиоза (дисбактериоза) кишечника у детей грудного возраста
Все проявления дисбиоза (дисбактериоза) можно условно подразделить на общие и местные.
I Местная симптоматика
- Метеоризм, газообразование, пучение и вздутие живота.
 Эти неприятные явления происходят вследствие активного размножения и, как следствие, выделения продуктов обмена (распада) болезнетворными бактериями (золотистый стафилококк, кишечная палочка, кампиллобактер) – аммиака и аммиачных производных, сероводородных веществ, азотистых соединений.
Эти неприятные явления происходят вследствие активного размножения и, как следствие, выделения продуктов обмена (распада) болезнетворными бактериями (золотистый стафилококк, кишечная палочка, кампиллобактер) – аммиака и аммиачных производных, сероводородных веществ, азотистых соединений. - Вздутие живота и распирающие боли. Вредные бактерии в процессе жизнедеятельности образуют токсины – это составляющие мембраны или клеточной стенки микроорганизма, которые выделаются в просвет кишки, оказывая спазмирующее и нарушающее перистальтику (нормальное сокращение) действие, а также всасывательную способность.
- Нарушение пищеварения. Патогенные и ставшие патогенными микробы «забирают себе» полезные и нужные биологически активные вещества. Вследствие жизнедеятельности болезнетворных микробов и дисбаланса pH нарушается работа пищеварительных ферментов. Отсюда – не до конца переваренная пища, нехватка жизненно важных организму веществ и снижение их синтеза (часто – ферментов и «местных» гормонов, регулирующих деятельность пищеварительной системы).

- Нарушение стула – запоры или поносы (постоянные или сменяющие друг друга) как следствие вышеописанных причин.
II Общая симптоматика
- Вялость, слабость, апатия или капризность. Это первые знаки интоксикации организма из-за выделения в просвет кишки, а затем – в общий кровоток бактериальных токсинов и продуктов распада от жизнедеятельности патогенной флоры.
- Тошнота (иногда переходящая в рвоту). Причина – токсины бактерии + нарушение в системе пищеварения.
- Быстрая утомляемость и усталость. В кишечнике из-за активного размножения вредной флоры нарушается расщепление пищи – сложных веществ на простые и легкоусвояемые: белков – на аминокислоты, жиров – на жирные кислоты, углеводов – до глюкозы. Вследствие снижения количества поступивших в кровоток нужных субстанций нарушается синтез белка и, соответственно, белковых структур – ферментов, гормонов, медиаторов (передатчиков сигнала). Отсюда – нехватка питания головному мозгу и всем тканям организма, замедление биохимических реакций.

- Худоба, истощение, замедленное развитие и рост. Причины – плохое усвоение пищевых веществ, нарушение белкового синтеза (в том числе коллагена и эластина – белков роста и регенерации), интоксикация продуктами выделения бактерий.
Причины дисбиоза (дисбактериоза) у грудничков
- Невоспалительные заболевания или функциональные нарушения желудочно-кишечного тракта: дискинезия желчевыводящих путей, панкреатиты и гепатиты, врожденные пороки развития пищеварительной системы.
- Инфекционно-воспалительные заболевания – бактериальные или вирусные гастроэнтериты и колиты. Путь передачи – через грязные руки (фекально-оральный).
- Ферментная недостаточность: первичная – лактазная (непереносимость и несварение молочных продуктов), целиакия (нет фермента, расщепляющего растительный белок, в частности – белок пшеницы глютен), вторичная – при других патологиях ЖКТ.
- Бесконтрольное применение антибактериальных средств (например, при простуде).
- Погрешности в диете ребенка: ранний перевод на искусственное вскармливание, неправильно подобранное детское питание и т.
 д.
д. - Нейрогенная диспепсия – состояние, когда на фоне эмоционального стресса происходят сбои в системе пищеварения, в том числе дисбаланс биоценоза кишечника.
Лечение
Эффективное лечение дисбиоза заключается в устранении его причины. Если причиной является ферментная недостаточность, то нужно давать ребенку ферментные препараты (рекомендованный и проверенный – Креон) или строго соблюдать соответствующую диету (например, при целиакии – безглютеновая диета, при недостатке лактазы – ограничение употребления молочных продуктов).
Инфекционные гастриты, энтериты и колиты предполагают назначение антибиотиков широкого спектра действия (цефалоспоринов и макролидов) с обязательной коррекцией микрофлоры кишечника с помощью препаратов по типу Эубикора и Бифидумбактерина. Врожденные пороки развития требуют часто оперативного лечения. Прогноз обычно благоприятный.
Основная профилактика дисбиоза – правильное питание, ранняя диагностика гастроэнтерологических заболеваний, соблюдение правил гигиены и режима питания.
Похожие материалы
Дисбактериоз у грудничка: причины, симптомы, лечение
Нарушения кишечной микрофлоры проявляются у большого количества младенцев. Если провести комплексное лечение, негативное состояние грудничка можно привести в норму, поэтому рекомендуется незамедлительно воспользоваться лекарственными средствами.
Здоровые малыши нуждаются в профилактике нарушений микрофлоры на слизистой кишечника, так как выполнение необходимых мер поможет сохранить естественные процессы пищеварения в здоровом состоянии.
Что это за заболевание?
Дисбактериоз — подавление патогенными микроорганизмами в кишечнике полезной микрофлоры. Данное состояние проявляется множественными нарушениями пищеварительной системы, сопровождается общей дестабилизацией всего организма. Заболевание является очень опасным в детском возрасте, так как может привести к патологиям слизистой кишечника и стойким аллергическим реакциям.
Заболевание является очень опасным в детском возрасте, так как может привести к патологиям слизистой кишечника и стойким аллергическим реакциям.
Причины развития у малышей
Факторы, влияющие на нарушения кишечной микрофлоры у грудничка:
- Применение экстренного лечения методом проведения антибактериальной терапии.
- Невозможность осуществления грудного вскармливания в первые дни жизни ребенка.
- Наличие родовых травм.
- Недостаточно длительное проведение грудного вскармливания.
- Заболевания ЖКТ, проявляющиеся в острой или хронической форме, наличие врожденных патологий всасывания определенных веществ.
- Проведение лечения медикаментами на протяжении долгого времени без применения восстановительных и очищающих организм средств.
- Негативная экологическая обстановка в месте проживания семьи или на работе у родителей.
- Попадание малыша в стрессовые ситуации, наличие простудных заболеваний, частое пребывание в роли пассивного курильщика.

- Неправильное питание, применение продуктов не по возрасту.
- Наличие паразитов или вирусов в организме.
Какими симптомами проявляется?
Дисбактериоз у грудных младенцев проявляется рядом признаков:
- Срыгивание после приема пищи, проявляющееся в качестве регулярного патологического явления.
- Постоянное срабатывание рвотного рефлекс без видимых поводов.
- Появление неприятного запаха изо рта.
- Снижение интенсивности прибавки в весе, нехарактерное для конкретного возраста малыша.
- Беспокойное состояние.
- Проблемы со сном, резкая смена привычных биоритмов в организме младенца.
- Нарушения консистенции стула. Он может быть слишком жидким, чрезмерно обильным или кашеобразным. При ухудшении состояния ребенка в кале может обнаруживаться пена, белые выделения. Также выделения могут менять цвет на зеленый. Обычно в этом случае кал приобретает гнилостный или кислотный запах.
- Наличие болевых ощущений можно заметить по общему состоянию ребенка.
 Наиболее часто они проявляются через 2-4 часа после приема пищи. Малыш будет веси себя беспокойно, а негативное состояние сопровождается урчанием в животе, его вздутием, ложными позывами на дефекацию.
Наиболее часто они проявляются через 2-4 часа после приема пищи. Малыш будет веси себя беспокойно, а негативное состояние сопровождается урчанием в животе, его вздутием, ложными позывами на дефекацию.
Как диагностируется?
Для выявления или подтверждения диагноза дисбактериоза применяют стандартные методы диагностики:
- Копрограмма.
- Посев кала.
Следует брать у грудничка кал до приема антибактериальных средств или по прошествии более 12 часов после их отмены. При прохождении терапии каких-либо патологий пробиотиками анализ можно брать только через 30 дней после их отмены.
Симптомы лактозной недостаточности и способы лечения заболевания.
Чем лечить расстройство кишечника (диарею и запор)? Читайте в этой статье.
Как лечить?
Медикаменты
После подтверждения диагноза дисбактериоза необходимо начать комплексное лечение патологии. Сначала назначается употребление бактериофагов, которые необходимы для ликвидации патогенных бактерий в организме.
Лекарство не оказывает негативного воздействия на полезную флору. Вместе с данными препаратами следует использовать различные сорбенты, необходимые для вывода из организма ферментов и токсинов. Эти средства применяются для скорейшей нормализации ЖКТ.
Когда патогенная флора и накопившиеся токсины будут удалены из организма, необходимо заселить слизистую полезными бактериями. Для этого следует активно употреблять специальные препараты, содержащие в составе живые лакто- и бифидобактерии.
Данные лекарственные средства относятся к категории пробиотиков. Грудничкам обычно назначают Линекс, Лактобактерин, Энтерол, Бификол. Срок применения этих препаратов составляет 2-3 недели.
Важно при лечении дисбактериоза применение пребиотиков. Данные вещества активизируют работу организма, нацеленную на самостоятельную выработку полезных бактерий, ускорение их роста, развития и размножения. Следует употреблять такие элементы:
- Лактоза. Находится в молоке, вырабатываемом организмом матери.
 Предназначена для активизации роста и развития бифидобактерий.
Предназначена для активизации роста и развития бифидобактерий. - Лактулоза. Содержится в молочных продуктах, необходима для поддержания оптимального баланса численности кишечных бактерий.
- Фруктосахариды. Для получения этих веществ следует употреблять большое количество фруктов и овощей в чистом виде.
- Инсулин. Предназначен для активизации процессов распределения питательных веществ на сахара в простой форме. Находится в составе практически всех овощей. С его участием происходит рост и размножение полезных бактерий.
- Пищевые волокна. Наибольшее внимание следует обратить на целлюлозу. Она помещается в зерновых культурах, а также во фруктах и овощах. Это пища для полезных бактерий, благодаря которой они могут поддерживать свою жизненную функцию.
Дисбактериоз редко лечится с помощью антибиотиков, однако при выявлении сильного возбудителя в лабораторных условиях гастроэнтеролог может прописать такие лекарственные средства: Дифлюкан, Макропен. Они являются наименее вредными для состояния микрофлоры кишечника.
Они являются наименее вредными для состояния микрофлоры кишечника.
[warning]Чтобы осуществить профилактику негативных изменений в состоянии кишечной флоры под действием антибиотиков, параллельно с ними применяют биопрепараты, такие как Лактобактерин, Диалакт.[/warning]
Народные средства
Вылечить дисбактериоз помогает физиотерапия. Родители должны приносить малышей для прохождения процедуры в барокамерах, чтобы те могли осуществить терапию путем вдыхания чистого кислорода. В некоторых случаях назначается лазерная физиотерапия.
Показаны сеансы массажа, осуществляемого с помощью лечебных приемов. Если проявляются сильные боли в кишечнике, рекомендуется применять теплые ванночки.
Питание
Ребенок в первые месяцы жизни должен получать все необходимые питательные вещества. Если в это время по каким-либо причинам нет возможности осуществлять кормление исключительно грудным молоком, после согласования с врачом назначают адаптированные кисломолочные продукты и молочные смеси.
Когда проявляется непереносимость коровьего молока, его заменяют на соевые продукты или козье молоко.
Возможные осложнения и их предупреждение
Если болезнь долго оставалась без внимая, возможно проявление нарушений всасывания в кишечнике. В этом случае симптомы имеют ярко выраженный характер:
- Диарея со звуками и признаками брожения пищи в желудке, причем проявляется она гнилостным запахом.
- Стеаторея.
- Вздутие живота с газоизвержением.
- Постепенно родители начинают отмечать, что вместо активного роста ребенок начинает худеть.
- Проявляются типичные признаки полигиповитаминоза (при отсутствии этой патологии).
В результате невозможности кишечником правильно перерабатывать пищу может развиться непереносимость многих ее компонентов, причем в очень маленьком возрасте. Не исключено появление дистрофического состояния, сопровождающегося токсическим истощением организма.
Если для ребенка не будут применены срочные лечебные мероприятия, это грозит сильными и часто необратимыми нарушениями обменных процессов и появлением аллергических реакций практически на все пищевые продукты.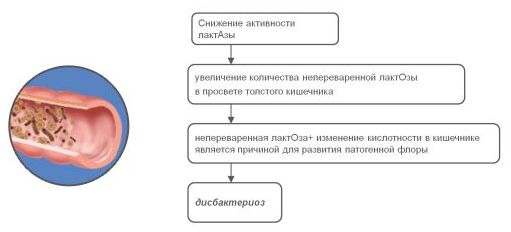
При своевременном выявлении заболевания и проведении должного лечения подобных признаков не возникает, болезнь ограничивается типичными проявлениями расстройства желудка. Чтобы не допустить сильного усугубления заболевания на ранних стадиях, предпринимается промывание желудка и перевод младенца только на щадящую пищу, то есть многие вилы прикорма приходится на время отменить.
Основные принципы диеты при дисбактериозе кишечника у взрослых и детей.
Как давать Боботик новорожденному ребенку? Инструкция по применению в этой статье.
Как заставить работать ленивый кишечник? http://vashjeludok.com/kishechnik/k-bolezni/kak-zastavit-rabotat-lenivyj.html
Профилактика заболевания
Профилактические методы дисбактериоза у грудничка основываются на выполнении некоторых правил его матерью. Позаботиться о недопущении дисбактериоза у младенца нужно еще на этапе планирования беременности.
Женщина должна пройти диагностику возможных заболеваний половой сферы. Если родовые пути не будут содержать грибков и патогенной микрофлоры, повышается вероятность сбережения малыша от данного заболевания.
Если родовые пути не будут содержать грибков и патогенной микрофлоры, повышается вероятность сбережения малыша от данного заболевания.
Чтобы не допустить нарушения естественной среды в кишечнике ребенка, необходимо осуществлять ранее прикладывание малышка к груди, то есть кормить его грудным молоком сразу после родов. Молозиво содержит все необходимые бактерии для формирования естественной среды в кишечнике малыша.
[warning]Для гарантии отсутствия дисбактериоза необходимо прикладывать ребенка к груди сразу после рождения, а не осуществлять первое кормление с помощью смеси.[/warning]
Для формирования оптимальной микрофлоры кишечника ребенка следует постоянно придерживаться оптимального режима кормлений. Не следует давать ребенку больше еды, чем ему необходимо, также не следует торопиться с добавлением прикормов или полным переводом малыша на искусственное вскармливание.
На количество и качество полезных бактерий, содержащихся в кишечнике ребенка, влияет состав грудного молока. Для обеспечения правильного питания малыша мать должна следить за собственным рационом, употребляя белки и углеводы в достаточном количестве, а также следя за тем, чтобы в блюдах содержались витамины и другие важные микроэлементы.
Для обеспечения правильного питания малыша мать должна следить за собственным рационом, употребляя белки и углеводы в достаточном количестве, а также следя за тем, чтобы в блюдах содержались витамины и другие важные микроэлементы.
Важно поддерживать чистоту всех предметов, к которым прикасается малыш.
Это касается различных игрушек, места для сна, принадлежностей для прогулки, самой одежды ребенка, так как младенец постоянно тянет руки в рот после того как прикасается к разнообразным вещам.
От дисбактериоза ребенка спасет его собственный иммунитет. Для укрепления иммунной системы организма необходимо регулярно выводить ребенка на свежий воздух, производить вечерние теплые ванночки.
Дисбактериоз у грудничков является опасным заболеванием, так как может негативно повлиять на состояние пищеварительной системы в раннем возрасте. Чтобы не допустить образования серьезных нарушений, необходимо вовремя проводить лечение недостатка полезной микрофлоры, а для здоровых детей осуществлять регулярную профилактику.
что это такое, какие присутствуют симптомы и как ставят диагноз, а также какое лечение назначают?
Дисбактериоз-очень частое явление, он встречается у 95% детей до года. Больше всего встречается у недоношенных. В чем же выражается этот недуг и опасен ли он?
Далее в статье вы узнаете все подробности об этой болезни — какие признаки и причины заболевания бывают, каковы методы диагностики и как устранить проблему. Там же мы расскажем о профилактике дисбактериоза у грудничков.
Что это такое и опасно ли?
Дисбактериоз — неуравновешенность здоровой микрофлоры кишечника. При внутритрубном развитии ЖКТ плода стерилен.
Первые бактерии, микробы кожи и слизистой у ребёнка появляются при продвижении по родовым путям мамы.
Затем происходит контакт с матерью, врачами, оборудованием палаты, водой и т.д. Этот процесс неизбежен. Со временем у грудничка определяется индивидуальный состав микрофлоры.
Соотношение бактерий закладывается на генетическом уровне. В его кишечнике должны ужиться около 400 видов бактерий и «не поссориться».
На заметку. Неполадки в желудочно-кишечном тракте могут привести не только к дискомфорту в животе, а также к ряду других заболеваний.
к оглавлению ↑Степени болезни
Выделяют 4 степени болезни:
- Первая степень характеризуется повышенным содержанием бифидо- и лактобактерий. По сути, это здоровое состояние организма. Ребёнка ничего не беспокоит, симптомы никак не проявляются. Еще эту стадию называют дисбактериальной реакцией — краткосрочное нарушение микрофлоры. Первая стадия может возникнуть при замене смеси, а также при введении прикорма. Её лечить никак не следует, организм сам справляется и восстанавливает состав микрофлоры.
- Вторая степень характеризуется равным количеством полезных и вредных бактерий. В фекалиях выявляются гемолизирующие и лактозонегативные кишечные палочки.
 Эта степень приводит к вздутию, поносу, коликам. Возможна маленькая прибавка в весе. Педиатр назначает лечение, и пересматривает питание новорожденного.
Эта степень приводит к вздутию, поносу, коликам. Возможна маленькая прибавка в весе. Педиатр назначает лечение, и пересматривает питание новорожденного. - На этой стадии выявляются в большом количестве бактерии: клебсиеллы, стафилококки, серрации, протеи и др. Это может привести к воспалительному процессу в животе, болям в кишечнике, длительной диареи с крупицами непереваренной еды. Требует незамедлительного лечения.
- Огромный рост патогенной микрофлоры. При длительном поносе происходит потеря веса грудничка, а это опасно для новорожденного. На этой стадии дисбактериоз может перейти в хроническую форму. Справиться с проблемой становится намного сложнее.
Признаки
Основными симптомами и признаками дисбактериоза у грудничков на ИВ являются:
- частые боли в животе;
- противный запах изо рта;
- высокое слюноотделение;
- сухая кожа;
- вспучивание животика;
- сложная дефекация;
- диарея более 2-3 дней;
- рвота;
- отсутствие аппетита;
- высокое количество зеленой слизи и пены, прожилки с примесью крови в кале;
- плохой набор веса.

Методы диагностики
- Копрограмма — один из методов диагностики, позволяющий выявить стадию заболевания (скорость и качество переваривания еды), а так же отсутствие или наличие воспаления. Основными параметрами выступают количество, запах, цвет, реакция кала, консистенция, наличие примесей и химический состав.
Справка. Копрограмма достаточно информативный анализ, который назначают при любых заболеваниях ЖКТ.
- Посев кала, показывает соотношение полезной и патогенной микрофлоры, устанавливает чувствительность к антибиотикам. Для того, что бы узнать результат, нужно много времени (не менее недели), связано это с тем, что бактерии должны «вырасти» для изучения.
- Биохимический анализ кала. Показывает соотношение всех полезных и вредоносных бактерий. Может показать отдел кишечника, где сосредоточена проблема. Считается самым быстрым и информативным методом.

Обычно назначают бактериальный анализ (посев кала), но он не является самым информативным. Самым высокоинформативным методом является биохимический анализ, который и следует проводить.
Вернее всего отвезти фекалии в тот же день, когда они были собраны. Если же нет такой возможности, то кал должен храниться 3-4 часа в холодильнике. Обязательно используйте стерильную баночку для сбора фекалий. Приобрести баночку можно в аптеке.
к оглавлению ↑Расшифровка анализа
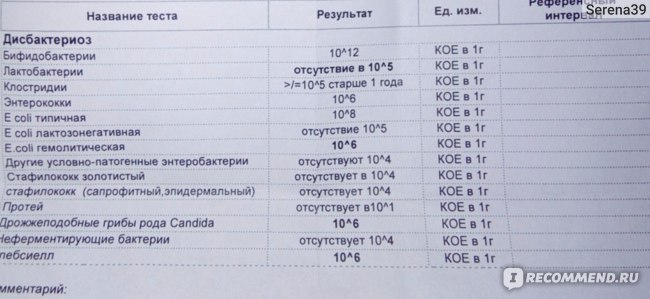
Показатель | Определение показателя | Норма у ребёнка до года | Норма у ребёнка после года |
Энтеробактерии | Бактерии, вызывающую острую кишечную инфекцию. К ним относятся: шигеллы и сальмонеллы — возбудители дизентерии. | 0 | 0 |
Кишечная палочка (общее количество) | Разделяется на три вида: кишечная палочка с нормальной ферментативной активностью, со сниженной активностью и гемолизирующая кишечная палочка. |
Причины
Основной причиной дисбактериоза является неправильное питание малыша:
- Перекорм. Если мама выбирает вариант кормления не по режиму, а по требованию, она должна понимать что если ребёнок скушал достаточное количество смеси, то он проголодается через 2,5-3 часа. Слишком частое кормление, приводит к проблемам с пищеварением. Еда не расщепляется до конца, что приводит к вздутию, коликам, и беспокойству грудничка находящегося на искусственном вскармливании.
- Недокорм. Если ребенок не получает достаточного количества смеси, это может привести к вздутию животика, а так же к зелёному жидкому калу.
- Переход на другую смесь. Также проблемы с животиком у младенца могут появиться при переходе с одной смеси на другую. Наиболее частой причиной является недостаток лактозы. Её малое количество приводит к тому, что организм малыша не справляется с перевариванием и расщеплением еды.
 В данном случае необходимо перейти на низколактозные смеси. Не стоит переходить резко, это должно происходить в течении недели, чтобы ни навредить организму малыша.
В данном случае необходимо перейти на низколактозные смеси. Не стоит переходить резко, это должно происходить в течении недели, чтобы ни навредить организму малыша. - Раннее введение прикорма при ИВ. Как раз это и является наиболее частой причиной дисбактериоза у новорожденных.
Важно! Не стоит вводить прикорм в рацион малыша ранее 6 месяцев, это прямой путь к болезням пищеварительной системы грудничка. Прикорм вводится постепенно, при учете возраста и индивидуальных особенностей новорожденного.
Варианты лечения у малышей на ИВ
Лекарства
Чаще всего, врач назначает лечение в виде приёма препаратов: пробиотики и пребиотики.
Пробиотики
Разряд живых микроорганизмов, которые являются полезными для человека. Самые важные:
- дрожжевые грибы;
- бифидо- и лактобактерии;
- кишечные палочки.
Главная задача пробиотиков — нормализовать работу пищеварения. Они бывают сухими и жидкими. На сегодняшний день, существует 4 поколения пробиотиков:
Они бывают сухими и жидкими. На сегодняшний день, существует 4 поколения пробиотиков:
- Однокомпонентные (только один штамм бактерий).
К ним относится «Биобактон». Принимается при дисбактериозе у новорожденного с первых дней жизни.
Противопоказанием является чувствительность к Биобактону, кандидоз.
Принимается 1 доза внутрь за 30-40 мин до еды 2-3 раза в сутки.
Побочным действием может быть аллергическая реакция на компоненты препарата.
- Многокомпонентные (несколько штаммов бактерий).
К ним относятся:
- «Линекс». Нормализует микрофлору кишечника. Принимают для лечения и профилактики дисбактериоза.
Противопоказанием является непереносимость компонентов препарата, а также молочных продуктов.
В возрасте до 2 лет принимается 1 капсула 3 раза в сутки. Если грудничок не может проглотить капсулу, то следует вскрыть её, высыпать содержимое в ложку и смешать с небольшим количеством воды.

Побочных действий не обнаружено.
- «Аципол». Принимается при дисбактериозе. Показан новорожденным с 3 месяцев по 1 капсуле 2-3 раза в день. Также можно смешивать в ложке с водой.
Побочных действий не обнаружено.
Противопоказанием является непереносимость компонентов препарата.
- «Линекс». Нормализует микрофлору кишечника. Принимают для лечения и профилактики дисбактериоза.
- Комбинированные (несколько видов разных бактерий, несколько штаммов одной бактерии).
К ним относится Бифиформ в разных формах выпуска.
- «Бифиформ Малыш» назначают в возрасте от 1 до 3 лет. Разводят в воде или смеси по 1 пакетику порошка 2-3 раза в день.
- «Бифиформ Бэби». Используют с помощью пипетки, рассчитывая дозу по весу малыша. Принимают 1 раз в сутки.
Продолжительность лечения не менее 10 дней. Побочных действий не обнаружено.
Противопоказанием является гиперчувствительность к компонентам препарата.
- Сорбционные (с добавлением энтерособрентов) — «Бифидумбактерин форте».
 Выпускают в форме порошка, принимают при дисбактериозе у новорожденного с первых дней жизни. Порошок перед употреблением смешивают со смесью. В возрасте до 6 месяцев принимают по 1 пакетику 2 раза в сутки, старше 6 месяцев по 1 пакетику 3-4 раза в день.
Выпускают в форме порошка, принимают при дисбактериозе у новорожденного с первых дней жизни. Порошок перед употреблением смешивают со смесью. В возрасте до 6 месяцев принимают по 1 пакетику 2 раза в сутки, старше 6 месяцев по 1 пакетику 3-4 раза в день.Курс приёма 2-3 дня. Побочных действий препарата не обнаружено. Противопоказанием является индивидуальная непереносимость.
Пребиотики
Это органические вещества, которые стимулируют рост полезных бактерий. Это могут быть углеводы, белки, витамины. Наиболее известный препарат — Сироп лактулозы и его разновидности.
К примеру «Нормазе» оказывает слабительное действие, улучшает всасывание фосфатов и солей кальция. Его применяют при запорах, дисбактериозе.
Противопоказания:
- непереносимость галактозы и фруктозы;
- гиперчувствительность;
- непроходимость кишечника;
- ректальные кровотечения;
- галактоземия.
Детям в возрасте до 1 года рекомендуют принимать по 5 мл. /сутки, до 6 лет 5-10 мл./сутки.
/сутки, до 6 лет 5-10 мл./сутки.
Побочные действия:
- тошнота;
- диарея;
- метеоризм.
Массаж
Так же при дисбактериозе новорожденному делают массаж, в целях лечения и профилактики. Массаж выполняется за 30 мин-1 час до еды, а так же через 1-2 часа после. Продолжительность не должна превышать 30 мин. Схема проведения процедуры:
- делаем по часовой стрелке круговые поглаживающие движения;
- от края к центру поглаживаем косые мышцы живота;
- по часовой стрелке необходимо провести точечный массаж пупочной области живота подушечкой указательного пальца;
- в конце сделайте расслабляющие поглаживания живота.
Массаж не стоит делать, если:
- кроха начинает сильно плакать при касаниях к животику;
- малыш очень вялый с бледной кожей на лице;
- на коже живота есть повреждения или высыпания;
- если у малыша наблюдается рвота и понос.
Причиной дисбактериоза также может быть неправильно выбранная смесь. Поэтому если у ребёнка появились признаки болезни, может быть стоит сменить питание.
Поэтому если у ребёнка появились признаки болезни, может быть стоит сменить питание.
Для профилактики дисбактериоза, очень часто, педиатры назначают препараты восстанавливающие микрофлору кишечника. Помимо этого, специалисты советуют придерживаться сбалансированного питания, выбирать качественную смесь.
Наблюдайте за поведением малыша. За его общим состоянием, характером стула, набором веса и аппетитом, чтобы определить и предупредить дисбактериоз на ранних стадиях.
Предлагаем посмотреть видео, в котором врач-педиатр расскажет о дисбактериозе у малышей:
Дисбактериоз у грудничков: симптомы, признаки, лечение
Содержание статьи:
- Что такое дисбактериоз?
- Микрофлора младенцев
- Ведущая роль бифидо- и лактобактерий
- Дисбактериоз у новорожденных
- Дисбактериоз у грудничков
- Дисбактериоз: симптомы у грудничка (новорожденного)
- Как лечить дисбактериоз у новорожденного?
- Как лечить дисбактериоз у грудничка?
Что такое дисбактериоз?
Всем известно, что кишечник богат на «жильцов», т. е. он заселен микроорганизмами. У здорового малыша в норме существует определенный баланс — относительное постоянство качественного и количественного состава бактерий или, иначе, микрофлоры. Условно говоря, в животе у человека есть «полезные» и «вредные» бактерии, и их соотношение примерно равно. Иногда этот баланс нарушается: «хороших» микроорганизмов становится настолько мало, что кишечник, «захваченный» патогенной микрофлорой, перестает нормально функционировать. И именно тогда считается, что у грудничка дисбактериоз. Диагностировать его можно только при микробиологическом исследовании содержимого кишечника. Но важно знать, что диагноза дисбактериоз как такового не существует, а за рубежом о нем не слышали вообще. В медицине принято говорить о дисбиозе кишечника.
е. он заселен микроорганизмами. У здорового малыша в норме существует определенный баланс — относительное постоянство качественного и количественного состава бактерий или, иначе, микрофлоры. Условно говоря, в животе у человека есть «полезные» и «вредные» бактерии, и их соотношение примерно равно. Иногда этот баланс нарушается: «хороших» микроорганизмов становится настолько мало, что кишечник, «захваченный» патогенной микрофлорой, перестает нормально функционировать. И именно тогда считается, что у грудничка дисбактериоз. Диагностировать его можно только при микробиологическом исследовании содержимого кишечника. Но важно знать, что диагноза дисбактериоз как такового не существует, а за рубежом о нем не слышали вообще. В медицине принято говорить о дисбиозе кишечника.
Микрофлора младенцев
Уже было упомянуто, что в кишечнике грудничка присутствуют два вида бактерий: те, что полезны для организма и «вредные». Что же они из себя представляют?
- 1. Облигатная флора.
 Бактерии этой группы считаются обязательными компонентами микрофлоры. Они нужны для нормальной работы желудочно-кишечного тракта, для поддержания иммунной системы человека, для нормального функционирования всех органов и систем организма. Представителями облигатной флоры считаются всем известные лактобактерии, бифидобактерии и кишечная палочка. Еще к ним относят бактероиды и энтерококки. Наполняя внутреннее содержание кишечника, они никак на него не влияют. Их количество может достигать 97% от общего числа микроорганизмов ЖКТ ребенка.
Бактерии этой группы считаются обязательными компонентами микрофлоры. Они нужны для нормальной работы желудочно-кишечного тракта, для поддержания иммунной системы человека, для нормального функционирования всех органов и систем организма. Представителями облигатной флоры считаются всем известные лактобактерии, бифидобактерии и кишечная палочка. Еще к ним относят бактероиды и энтерококки. Наполняя внутреннее содержание кишечника, они никак на него не влияют. Их количество может достигать 97% от общего числа микроорганизмов ЖКТ ребенка. - 2. Факультативная группа. Она не всегда присутствует в организме ребенка, но если все-таки есть, то при заболевании малыша или снижении у него иммунитета легко может стать патогенной. Стремительно развиваясь, факультативная группа может вызвать у грудничка кишечную инфекцию. Обычно к ним относят грибки рода Кандида. Организм взрослого без труда может подавить их вредное воздействие, но у еще неокрепшего грудничка могут возникнуть серьезные проблемы при стремительном размножении патогенной микрофлоры.

Ведущая роль бифидо- и лактобактерий
Важность данных представителей облигатной флоры заключается в их непосредственном участии в формировании иммунной защиты организма ребенка, ежедневно отбивая атаку болезнетворных бактерий. Благодаря наличию в естественной микрофлоре лакто- и бифидобактерий, в кишечнике нормализуется синтезирование некоторых витаминов группы В, таких как В6 (пиридоксин), В9 (фолиевая кислота), В12 (кобаламин). Данные витамины помогают лучше усваиваться некоторым жизненно важным микроэлементам: кальцию, железу, витамину D. Они, в свою очередь, необходимы для нормальной моторики желудочно-кишечного тракта (ЖКТ).
При дисбактериозе у грудничков число «полезной» микрофлоры снижается, уступая место патогенной, а значит сокращается количество витаминов. Наступает гиповитаминоз, который может стать следствием развития таких серьезных заболеваний как рахит (гиповитаминоз кальция и витамина D) и анемия (гиповитаминоз железа). Из-за гиповитаминоза нарушается процесс пищеварения.
Дисбактериоз у новорожденных
Малыш, находясь внутри утробы матери, через пуповину получает необходимые для роста и развития питательные вещества. Ему не приходится перерабатывать и переваривать поступающую пищу, она приходит к нему уже в готовом виде, поэтому необходимость в микрофлоре кишечника отпадает. Т.е. кишечник ребенка на данном этапе не заселен какими-то ни было бактериями, это происходит при прохождении новорожденного через родовые пути.
В последующую первую неделю жизни малыша количество бифидобактерий кишечника стремительно увеличивается, а к месяцу микрофлора пополняется лактобактериями.
Причинами, способствующими появлению такого недуга, как дисбактериоз у новорожденных служат ряд факторов:
- • Болезнь матери.
- • Нарушения, возникшие в ходе родовой деятельности.
- • Нахождение в роддоме больше семи дней.
- • Естественная незрелость ЖКТ новорожденного.
- • Лечение антибиотиками.

Дисбактериоз у грудничков
Причинами угнетения микрофлоры кишечника у ребенка могут стать:
- • Осложнения периода новорожденности (гипоксия, асфиксия и т.п.).
Дисбактериоз: симптомы у грудничка (новорожденного)
Дисбактериоз может протекать бессимптомно, если малыш здоров. Но как только он начинает заболевать, и происходит снижение сил иммунной системы, тут же появляются первые признаки дисбактериоза у грудничка (новорожденного):
- • Появление на коже воспалений и различного рода дерматитов.
- • Признаки молочницы во рту у новорожденного и как следствие – нарушение аппетита (боль при сосании из-за язвочек).
- • Учащение стула и изменение его консистенции.
Наличие данных признаков может служить основанием для постановки диагноза «дисбактериоз у грудничка (новорожденного)».
Как лечить дисбактериоз у новорожденного?
Не стоит тут же бежать сломя голову за лекарствами в аптеку, а потом еще пичкать своего новорожденного малыша бифидо- и лактокультурами. Как было уже указано, ребенок при рождении еще не имеет собственной микрофлоры, ее окончательное формирование наблюдается к концу периода новорожденности – по истечении месяца после родов. Поэтому не стоит предпринимать поспешных выводов и заниматься самолечением – необходима консультация педиатра, только он сможет выяснить, после осмотра и проведения некоторых лабораторных исследований, есть ли у новорожденного дисбактериоз. И лечение дисбактериоза у новорожденного сможет подобрать соответствующее.
Как было уже указано, ребенок при рождении еще не имеет собственной микрофлоры, ее окончательное формирование наблюдается к концу периода новорожденности – по истечении месяца после родов. Поэтому не стоит предпринимать поспешных выводов и заниматься самолечением – необходима консультация педиатра, только он сможет выяснить, после осмотра и проведения некоторых лабораторных исследований, есть ли у новорожденного дисбактериоз. И лечение дисбактериоза у новорожденного сможет подобрать соответствующее.
Обычно при лечении дисбактериоза у новорожденных производят коррекцию рациона питания мамы и восстановления нормальной микрофлоры детского кишечника. Если конечно причиной дисбактериоза стали не антибиотики – в этом случае требуется специальное интенсивное лечение.
Как лечить дисбактериоз у грудничка?
Если родители заметили признаки дисбактериоза у своего грудничка, то также не следует спешить с лечением. Ведь дисбактериоз у грудничков, стоит повториться, — не самостоятельное заболевание, а лишь следствие какого-то недуга. Следовательно, первым шагом к избавлению от дисбактериоза станет установление истинных причин подавления естественной микрофлоры кишечника ребенка, а уж потом ее восстановление. Помочь в этом деле также должен только специалист – лечащий педиатр ребенка, а не родители.
Следовательно, первым шагом к избавлению от дисбактериоза станет установление истинных причин подавления естественной микрофлоры кишечника ребенка, а уж потом ее восстановление. Помочь в этом деле также должен только специалист – лечащий педиатр ребенка, а не родители.
Наилучшим источником лакто- и бифидобактерий в организм грудничка является молоко его мамы, поэтому не стоит рано сворачивать грудное вскармливание, которое будет поддерживать нормальную микрофлору ее ребенка на весь период ГВ.
Если же единственным вариантом вскармливания может быть только искусственное, то следует выбирать смеси, имеющие в своем составе пробиотики. Посоветовать соответствующее питание может специалист.
Лечение дисбактериоза у грудничков проводится по следующей схеме: подавление пагубной микрофлоры + восстановление облигатной флоры.
Избавиться от «вредных» бактерий в кишечнике грудничка позволят иммунопрепараты, включающие в себя бактериофаги, которые будут поглощать ненужные микроорганизмы. Далее, для заселения животика малыша полезными бактериями врач может назначить пребиотики и пробиотики. Эти препараты содержат живые лакто-, бифидобактерии и кишечную палочку или продукты их жизнедеятельности. В аптеке можно приобрести Линекс, Дюфалак, Нормозе и т.д. Также следует принимать препараты: Эспумизан, Боботик, Бейбикалм, Сабсимплекс. Они позволят избавиться от коликов.
Маме следует прекратить принимать в пищу все острое и аллергенное (при ГВ).
Следует всегда следить за состоянием своего малыша, отмечать любые отклонения и обращаться к врачу в случае даже незначительных отклонений здоровья грудничка.
Дисбактериоз у детей причины симптомы что делать как лечить
Последнее изменение:Дата написания:
Проявление нарушения баланса нормальной микрофлоры кишечника бывает у детей разного возраста – начиная с момента рождения и до подросткового возраста. Дисбактериоз у детей имеет свою симптоматику. Лечение зависит от особенностей течения заболевания и назначается врачом. Огромную роль играют меры профилактики дисбиоза.
Дисбаланс кишечной микрофлоры проявляется, как во взрослом возрасте, так и у детей любого возраста, включая подростков и даже грудничков.
Причины нарушения микрофлоры у детей грудного возраста
Основными благоприятными факторами для развития дисбактериоза кишечника у грудных малышей являются:
- Бесконтрольное применение препаратов антибиотической направленности при лечении инфекционных заболеваний.
- Несоблюдение правил прикладывания ребенка к материнской груди матери.
- Искусственное питание.
- Различные заболевания у матери ребенка.
- Патологии, связанные с родами.
- Осложнения после хирургических операций.
- Инфекционное заражение в условиях стационара (роддом).
- Недостаточная функциональность кишечника.
- Анемия, рахит, гипотрофия и т. д.
Примечание. ЖКТ малыша, который еще находится в лоне матери, отличается тем, что в нем отсутствуют микроорганизмы. Это абсолютно чистая и стерильная среда.
Контакт с микрофлорой у грудничка
Этот важный момент для малыша наступает при его рождении. Продвижение по родовым путям связано с неизбежным «ознакомлением» с микрофлорой родной матери.
В нормальных условиях речь идет о сбалансированном содержании:
- лактобактерий;
- бифидобактерий;
- кишечных палочек.
С этого момента ребенку придется адаптироваться к миллиону других бактерий и микроорганизмов во время кормления, пеленании, объятий, целовании. В основном, это бактерии, обитающие на теле и в ротовой полости матери. При таких контактах происходит очень важный процесс колонизации кишечника грудничка безопасной и сбалансированной микрофлорой.
При процессе естественного вскармливания, кишечная микрофлора грудничка – это около 95 процентов пробиотиков (лактобактерии и бифидобактерии). Остальная часть бактерий являются облигантной (нейтральной). Они не оказывают на организм малыша полезного или негативного воздействия. Это некоторая часть стрептококков, энтерококков, микрококков, клостридий, бактероидов и кишечных палочек.
Правильный баланс всех существующих в ЖКТ грудничка микроорганизмов может быть нарушенным определенными неблагоприятными условиями или действиями. Особое внимание следует обратить на применение различных антибиотиков и факторы, связанные со временем и процедурой грудного кормления или его отсутствием.
Различие кишечной микрофлоры у малышей в зависимости от вскармливания
Нарушенная микрофлора ЖКТ у ребенка – благоприятная среда для создания целого ряда неблагоприятных последствий в его неокрепшем организме.
Причинами развития этой кишечной патологии у детей считаются:
- Длительный курс антибиотических препаратов.
- Позднее употребление ребенком материнского молока.
- Преждевременное вскармливание продуктами искусственного происхождения.
- Большой перечень заболеваний ЖКТ в острой или хронической форме.
- Использование в лечебном курсе иммунодепрессантов.
- Применение лучевой терапии.
- Целый ряд экологически неблагоприятных факторов, включая наличие в атмосфере или почве радиации, промышленных ядов, тяжелых металлов, пестицидов.
- Социальные, психологические и моральные факторы, способные провоцировать у детей стрессы.
- Склонность к простудным заболеваниям.
- Большой перечень условий маргинального образа жизни родителей ребенка – злоупотребление психотропными веществами (табак, наркотики, алкоголь и т д.) и недостаточное (неправильное) питание.
Реагирование на внешние факторы пищеварительной системы детей
Дисбактериоз в детском возрасте. Симптоматика
Признаки нарушения микрофлоры у детей разного возраста могут отличаться.
Дети до одного года
При проявлении дисбакериоза у детей раннего возраста можно наблюдать такие характерные признаки:
- Срыгивание молочной массы.
- Частое слюноотделение.
- Чрезмерная сухость кожного покрова.
- Аллергия в виде дерматита.
- Стоматит.
- Рвотные позывы или рвота.
- Неприятный запах из ротовой полости.
- Длительный понос.
- Недостаточный вес тела.
- Беспокойное поведение.
- Нарушенный и тревожный сон.
Характеристика стула при запущенном дисбактериозе кишечника у грудничков:
- обильная, жидкая или кашицеобразная форма;
- пенистые выделения;
- наличие в каловых массах белых комочков;
- зеленоватый кал;
- кисловатый запах гнили.
Кал у грудничка при поносе и дисбиозе
Дисбактериоз кишечника и болевой синдром
Для этой патологии нехарактерно ощущение постоянной боли. Она проявляется волнами, в виде чередующихся приступов, обычно через несколько часов после приема пищи.
Болевому синдрому сопутствует:
- неприятный процесс – вздутие живота;
- урчание;
- стабильные позывы на опорожнение кишечника.
Нарушение кишечного всасывания
Клиническое проявление при неправильном кишечном всасывании:
- доминирование диареи;
- брожение с процессом гниения;
- симптоматика, характерная для стеатореи и метеоризма;
- недостаточная для своего возраста и физиологических параметров масса тела;
- симптомы, указывающие на полигиповитаминоз.
Справка. Стеаторея – это нахождение жировых включений в каловых массах, связанное с плохим усвоением жиров из пищи.
Обратите внимание. В результате развития дисбактериоза кишечника организм ребенок может проявить интолерантность (снижение переносимости) к целому ряду продуктов питания. При этом важно не допустить негативный патологический процесс, в конечном итоге приводящий к токсико-дистрофическому состоянию. В нем берет участие гепатобилиарная система (печень, желчный пузырь и его протоки) и поджелудочная железа. Организму срочно ребенка требуются ферменты и желчные кислоты. Речь идет о серьезном нарушении обменных процессов. В ЖКТ происходит нежелательное накопление частиц не переваренной пищи, фактически – аллергенов, которые в свою очередь становятся причиной развития аллергодерматоза.
Дети от одного года
Анализ кала на дисбиоз
В этом возрасте проявления дисбактериоза имеют такие характерные признаки:
- череда упорных и длительных запоров;
- симптоматика, присущая при наличии неустойчивого стула;
- кишечные колики;
- гипомоторная дискинезия.
Основные жалобы:
- ощущение «надутого» желудка;
- частая отрыжка;
- отсутствие аппетита.
Примечание. Длительный по времени и стабильно рецидивирующий (прогрессирующий) дисбактериоз кишечника у детей может осложняться интоксикационным и, впоследствии, астено-невротическим синдромом.
Обратите внимание. Дисбаланс микрофлоры в кишечнике ребенка не всегда сопровождается ярко выраженной клинической симптоматикой. Дисбактериоз может часто протекать почти незаметно (латентное – скрытое течение болезненного процесса). Его косвенные признаки – частые, в том числе простудные, заболевания, плохой аппетит, сниженный вес тела.
Наиболее опасная форма дисбактериоза у детей
Речь идет о так называемом распространенном дисбактериозе, процессе распространения вредоносных микробов из ЖКТ в другие органы и системы ребенка.
Кандидоз
Классический пример такой формы бактериоза – кандидомикоз. Это одно из грибковых заболеваний, которое опасно тем, что на его фоне развиваются одновременно несколько других опасных патологий.
Среди них:
- молочница;
- ангина;
- поражение слизистой ЖКТ;
- воспаление легких.
Действенные профилактические меры по ликвидации дисбактериоза кишечника у детей
Медики настоятельно рекомендуют такие меры.
Правильное прикладывание ребенка к материнской груди
Правильные позы для кормления – профилактика от болезней у матери и ребенка
Ребенок должен быть приложен к груди уже в первые тридцать минут после родов. Вскармливание не следует прекращать даже после достижения ребенком одного года. В идеале материнское молоко служит одним из основных продуктов питания до полутора года и даже больше.
Стерильная среда кишечника через двое суток после первого кормления подвергается воздействию новых для организма ребенка микроорганизмов. Начинается колонизация ЖКТ естественной микрофлорой. Если этот процесс нарушается за счет заселения кишечника вредными бактериями, создаются все условия для развития дисбактериоза.
У малыша врачи фиксирую большую потерю веса. Родители тревожатся по поводу пугающей частоты стула (опорожнение происходит буквально после каждого приема пищи).
Обратите внимание. На дисбактериоз может указывать такая характерная картина – грудничок активно прикладывается к соску матери, но после этого неожиданно проявляет нервозность, громко кричит, делает импульсивные выгибы, поворачивает головку в сторону от груди. Это тем более странно, что он явно голодный, но отказывается от молока.
На патологию также указывают частые и болезненные запоры. Иногда малыш не может вообще опорожниться без помощи клизмы. Такие запоры возникают ввиду плохого переваривания грудного молока.
Важно! Шансы на развитие дисбактериоза у ребенка значительно увеличиваются при позднем приложении его к груди. Естественная профилактика дисбиоза предполагает обязательное прикладывание новорожденного к материнской груди буквально сразу после рождения. Это еще и стимулирование притока молока, и устранение такой распространенной проблемы, как его недостаток у рожениц.
Прием беременной женщиной препарата Лактусан
Так как устранение дисбактериоза – длительный и сложный лечебный процесс, профилактические меры по его недопущению следует принимать заранее, желательно еще в период вынашивания ребенка.
Что это значит?
Организм матери преднамеренно перед рождением малыша увеличивает в ЖКТ количественный уровень благотворных для организма ребенка бифидумбактерий.
Профилактика должна быть направлена на недопущение стерилизации микроорганизмов, которые полезны для кишечника.
Это означает, что женщине в период беременности запрещено принимать целый ряд лекарственных средств, включая большинство препаратов антибактериального действия. Кроме этого, ей следует обратить особое внимание на режим и качество своего питания, а также витаминную насыщенность употребляемых ежедневно продуктов.
Беременным женщинам следует употреблять в рекомендованном диетологами количестве:
- различные соки и настои;
- овощи;
- привычные для ее местности фрукты;
- лесные и домашние ягоды, которые не были выращены на азотосодержащих удобрениях.
В период вынашивания ребенка женщинам не рекомендуется пища, которая плохо усваивается, и на переваривание которой уходит слишком много энергии.
Лучше всего полностью отказаться от таких пищевых продуктов, как:
- жирное мясо;
- калорийные пирожные и торты;
- все виды копченостей;
- пищевые блюда с содержанием нитратов, включая колбасу и сосиски;
- продукты, содержащие в себе некоторые аллергены, например морепродукты, шоколадные изделия, какао.
Важно. Многие хронические очаги проникновения инфекции в организм беременной женщины следует, чем раньше, полностью устранить или значительно снизить их вредоносное воздействие.
Это значит:
- вылечить все зубы;
- ликвидировать воспалительные процессы в носоглотке;
- диагностировать мочеполовую и пищеварительную системы и в случае обнаружения патологий в них назначить действенный курс лечения.
Беременная женщина не должна перенапрягаться:
- физически;
- умственно;
- психологически.
Ей полезны многочасовые прогулки на чистом воздухе. Помните, что риску родовых травм подвержены, прежде всего, матери с подорванной нервной системой, не развитые физически и часто болеющие.
Позитивное мироощущение и правильный образ жизни – профилактика всех болезней, включая дисбиоз
Позитивные эмоции и духовная связь мамы и малыша – лучшая профилактика от любой болезни
Каждый человек строит свою внешнюю среду обитания и внутренний мир, исходя из накопленного опыта и нравственных предпосылок. Психологи, врачи, социологи давно говорят о том, что добродушные и позитивно мыслящие люди гораздо меньше подвержены заболеваниям, а жизненные проблемы решают без издержек для здоровья и психики.
Правильное мировоззрение и способ существования необходимо формировать в самом раннем детском возрасте. Игры, физические упражнения, прогулки, экскурсии, купание, обтирание, холодный душ, финская баня – это самая действенная профилактика против большинства заболеваний, включая и любые проблемы с ЖКТ.
Они закаляют организм ребенка и способствуют естественной защите при возможном дисбалансе микрофлоры кишечника.
Правильно налаженный процесс питания – важная мера при дисбиозе
Овощи и фрукты в ежедневном рационе
Чтобы кишечник ребенка нормально функционировал, ему необходимо ежедневно переваривать продукты с высоким содержанием волокон. Поэтому в рацион детского питания необходимо обязательно включить злаковые культуры, много овощей и фруктов.
Приучайте ребенка к ежедневному употреблению самых различных каш:
- гречневых;
- овсяных;
- ячневых;
- ржаных;
- из пшена.
Давайте хлеб малышу только чуть высушенный, состоящий из нескольких злаковых элементов и отрубей.
Преобладающими продуктами питания на вашем столе должны являться разнообразные овощи и фрукты. Готовьте детям рагу из овощей.
Добавляйте в него немного растительного масла, фасоль или горошек. Детям от одного года желательно варить кисели из ягод, компоты из привычных фруктов и отвары из полезных трав и шиповника.
Для нормализации работы ЖКТ введите в рацион ребенка кисломолочные продукты. Кефир и йогурты, предназначенные для взрослого потребителя, детям до одного года давать не следует ввиду того, что они могут нарушить правильный баланс микрофлоры ЖКТ.
Кисломолочные продукты в ежедневном меню
Самой оптимальной пищей для грудничков является молоко его матери. При искусственном вскармливании применяются различные виды смесей на коровьем молоке. Малышей следует также приучать к употреблению творожных масс, в которых находится много белка и кальция. При определении количества и качества творога вы должны ориентироваться на конкретный возраст.
При подтверждении наличия дисбактериоза у ребенка, ему не рекомендуется давать такие любимые у взрослых людей продукты, как квашеная капуста, огурцы и жареная картошка.
Дисбактериоз у детей. Методика щадящего лечения
Курс лечения, его формы и лекарственные компоненты определяются только медицинским специалистом после тщательного и всестороннего диагностирования. Первостепенное значение при этом имеет определение грамотной диеты. Для грудничков, например, очень важно предпринять все меры по сохранению возможности полноценного или частичного грудного вскармливания.
Корректирование процесса питания для детей, старше одного года, следует соотносить с написанным выше разделом.
Лечение дисбиоза у детей. Цель лечебного курса
Все медицинские усилия должны быть в первую очередь направлены на предоставление защитной микрофлоре кишечника (бифидобактерии и лактобактерии) всех преимуществ перед микроорганизмами патогенного характера. Другими словами, полезным бактериям необходимо обеспечить приток энергии для успешной восстановительной колонизации.
Пример курса лечения дисбиоза у детей (для ознакомительных целей)
Использование в лечении дисбактериза препарата под названием Лактусан
Механизм воздействия:
Активное вещество препарата – лактулоза (дисахарид) имеет возможность, не расщепляясь в верхней части кишечника, достигать отделов, находящихся в толстом кишечнике. В нем оно выполняет функции полезного субстрата в стабилизации нормальной микрофлоры – за счет избирательной стимуляции роста важных для организма бактерий.
Лактусан и его рекомендуемая дозировка
Лактусан
Препарат выпускается в виде сиропа, что очень удобно при лечении дисбактериоза у детей.
Взрослым людям рекомендуется для применения увеличенная доза (два приема в сутки по две чайные ложки). Детям, начиная с трехлетнего возраста, разрешается только одна чайная ложка в сутки. Для грудничков доза уменьшена еще в два раза (половина чайной ложки в сутки).
Безопасность применения Лактулоза доказана
На протяжении более сорока лет применения препарата для лечения дисбактериоза кишечника у детей факты проявления негативных последствий мутагенного, генотоксического или тератогенного характера медициной не зафиксированы.
Компоненты препарата не проникают в кровь. Системное негативное действие на организм ребенка отсутствует.
Препарат безопасен для женщин, вынашивающих ребенка, и новорожденных младенцев. Его применение оправдано также для диабетиков, так как препарат не содействует увеличению уровня глюкозы в крови.
Выводы
Дисбактериоз у ребенка указывает на наличие одного или нескольких первичных заболеваний. Ранее выявление дисбаланса микрофлоры в кишечнике ребенка, определение его причины и действенная врачебная помощь – надежная гарантия того, что проблема будет ликвидирована быстро, эффективно и без проблем.
Родителям следует внимательно относиться к любым жалобам детей, не предпринимать никаких самостоятельных медицинских мер и вовремя обращаться за врачебной помощью.
У грудничка дисбактериоз — в чем причина?
Практически у всех детей в возрасте до одного года встречается дисбактериоз. Особенно часто подвергаются недугу малыши, которые родились раньше срока, а также детки с пониженной иммунной системой и те, кто часто заболевает. Родителей часто волнует вопрос, чем может быть опасен дисбактериоз у грудничков? Дисбактериозом в медицинской терминологии называют нарушение микрофлоры кишечника. Не определяется как самостоятельное заболевание. В ряде европейский стран патологический процесс вообще не лечат, считая, что организм должен самостоятельно побороть недуг. Многие российские специалисты поддерживают другую точку зрения, определяющую особую терапию восстановления.
Причины
Следует понять природу происхождения дисбаланса микрофлоры. Во время нахождения в утробе матери ребенок находится в стерильном состоянии. В его кишечнике нет бактерий и микроорганизмов. В процессе рождения и прохождения по родовым путям матери, младенец впервые сталкивается со средой, в которой находятся лакто и бифидобактерии, а также кишечная палочка. После рождения новорожденный «знакомится» с целым миром микроорганизмов, попадающих в кишечник дитя. Таким образом, происходит «заселение» бактерий в кишечную флору младенца. Это абсолютно нормальный процесс. При идеальном развитии, малыш, кормящийся полностью на грудном молоке содержит 95 – 99 % пробиотиков. Остальные 1 – 5 % — это нейтральные бактерии, которые составляют маленькую часть (они не оказывают ни вреда, ни пользы). В их числе находятся:
- Стрептококки;
- Энтерококки;
- Микрококки;
- Клостридии;
- Бактероиды;
- Кишечная палочка.
Под воздействием негативных факторов данный баланс нарушается. К отрицательно влияющим аспектам относятся позднее кормление грудным молоком, необходимость приема антибиотиков кормящей матери или младенца, изначальное вскармливание искусственными смесями. На данные факторы слабый организм проявляется в виде дисбактериоза у грудничков.
Симптомы
Выделяется целый ряд признаков нарушения микрофлоры у новорожденных малышей. Основные симптомы дисбактериоза у грудничков проявляются следующими аспектами:
Следует четко понимать, какой стул новорожденного является нормой. При нормальном развитие консистенция должна быть как сметана желтоватого цвета. При этом небольшое количество слизи или пенной массы не является отклонением. Во время прикорма в стуле могут наблюдаться не переваренные кусочки пищи. Это тоже норма, так как в организме новорожденного еще недостаточно ферментов для расщепления определенных продуктов. Со временем все наладиться.
Симптомы дисбактериоза у грудничков после антибиотиков могут проявиться в виде сильной диареи, боли в животе, плохого самочувствия, сниженного иммунитета. Понос вызывает обезвоживание, поэтому требуется помощь маленькому организму.
Лечение
Если доктор диагностировал кишечный дисбактериоз, то следует приготовиться к длительному комплексному лечению своего чада. На начальной стадии терапии назначаются бактериофаги. Это вирус, который подавляет патогенную и условно – патогенную микрофлору, при этом не оказывает влияние на положительные бактерии. Данное лекарство можно назвать кишечный антисептик. Одновременно показан прием сорбентов, позволяющих вывести токсины из организма. Также, в качестве дополнения, выписываются ферменты, позволяющие ребенку лучше усваивать и переваривать пищу. Далее второй этап, который подразумевает искусственное внесение полезной микрофлоры (лакто и бифидобактрии). Для этого выписываются специальные препараты. Для скорого восстановления младенца требуется точное соблюдение рекомендаций лечащего врача. Если ребенок вскармливается искусственно, но для облегчения ситуации рекомендуются лакто – смеси. Самостоятельно давать новорожденному такую смесь нельзя. Ее должен назначить врач (если того требует схема лечения). Комплексный подход к терапии позволит малышу быстрее наладить здоровую микрофлору.
В качестве профилактики неприятного и болезненного состояния, новорожденного рекомендуется кормить грудным молоком и соблюдать правила гигиены. Кормящей маме следует внимательно относиться к своему рациону питания, правильно и сбалансировано подбирать продукты. Все что кушает женщина, передается малышу с молоком. Поэтому забота о своем здоровье играет важную роль в жизни малыша.
Дисбактериоз: тесты, лечение и многое другое
Что такое дисбактериоз?
Ваше тело полно колоний безвредных бактерий, известных как микробиота. Большинство этих бактерий положительно влияют на ваше здоровье и способствуют естественным процессам в вашем организме.
Но когда одна из этих бактериальных колоний выходит из равновесия, это может привести к дисбактериозу. Дисбиоз обычно возникает, когда бактерии в желудочно-кишечном тракте, в том числе в желудке и кишечнике, становятся неуравновешенными.
Некоторые эффекты дисбактериоза, такие как расстройство желудка, временны и легки. Во многих случаях ваше тело может исправить дисбаланс без лечения. Но если ваши симптомы станут более серьезными, вам нужно будет обратиться к врачу для диагностики.
Прочтите, чтобы узнать больше о том, что может вызвать дисбактериоз, как распознать его симптомы и что вы можете сделать для лечения и предотвращения этого состояния.
Любое нарушение баланса микробиоты может вызвать дисбактериоз.
Когда дисбактериоз возникает в желудочно-кишечном тракте, это обычно является результатом:
- изменения диеты, в результате которого увеличивается потребление белка, сахара или пищевых добавок
- случайного употребления химических веществ, таких как оставшиеся пестициды на немытых фруктах
- питье два или более алкогольных напитка в день
- новые лекарства, такие как антибиотики, которые влияют на кишечную флору
- плохая гигиена полости рта, из-за которой бактерии не сбалансированы во рту
- высокий уровень стресса или беспокойства, которые могут ослабить ваша иммунная система
- незащищенный секс, который может подвергнуть вас воздействию вредных бактерий
Дисбиоз также часто встречается на вашей коже.Это может быть вызвано воздействием вредных бактерий или чрезмерным ростом одного типа бактерий.
Например, бактерии Staphylococcus aureus могут выйти из-под контроля и привести к инфекции стафилококка. Gardnerella vaginalis бактерии могут вытеснять здоровые бактерии во влагалище и вызывать жжение, зуд и выделения из влагалища.
Ваши симптомы будут зависеть от того, где развивается дисбаланс бактерий. Они также могут отличаться в зависимости от типа бактерий, которые не сбалансированы.
Общие симптомы включают:
- неприятный запах изо рта (неприятный запах изо рта)
- расстройство желудка
- тошнота
- запор
- диарея
- затрудненное мочеиспускание
- вагинальный или ректальный зуд
- вздутие живота
- боль в груди сыпь или покраснение
- усталость
- проблемы с мышлением или концентрацией
- тревога
- депрессия
Изучив вашу историю болезни и оценив ваши симптомы, ваш врач может назначить один или несколько из следующих диагностических тестов:
Тест на органические кислоты
Ваш врач возьмет образец мочи и отправит его в лабораторию.Лаборант проверит наличие определенных кислот, которые могут вырабатывать бактерии. Если эти уровни кислоты ненормальны, это может означать, что некоторые бактерии вышли из равновесия.
Комплексный анализ пищеварительного стула (CDSA)
Ваш врач попросит вас взять домой специальное оборудование, чтобы взять образец ваших фекалий. Вы вернете этот образец своему врачу для лабораторного анализа. Лаборант проверит фекалии на наличие бактерий, дрожжей или грибков. Результаты могут сказать вашему врачу, есть ли дисбаланс или чрезмерный рост.
Водородный дыхательный тест
Ваш врач попросит вас выпить раствор сахара и подышать в специальный воздушный шар. Затем воздух в баллоне можно проверить на наличие газов, выделяемых бактериями. Слишком много или слишком мало определенных газов может указывать на бактериальный дисбаланс. Этот тест часто используется для проверки избыточного бактериального роста в тонком кишечнике (SIBO).
Ваш врач может также взять образец бактерий или ткани (биопсия) из области активной инфекции, чтобы определить, какие бактерии вызывают инфекцию.
Если бактериальный дисбаланс вызван приемом лекарств, врач, скорее всего, посоветует вам прекратить прием, пока не будет восстановлен бактериальный баланс.
Ваш врач может также назначить лекарства для борьбы с бактериями, в том числе:
- ципрофлоксацин (Cipro), антибиотик, который лечит кишечные инфекции, вызванные дисбактериозом
- рифаксимин (ксифаксан), антибиотик, который лечит симптомы синдрома раздраженного кишечника ( СРК), распространенное состояние, связанное с дисбактериозом
- Ко-тримоксазол (септрин), антибиотик, который лечит инфекции кишечника и мочевыводящих путей, вызванные дисбактериозом
Если ваша диета лежит в основе вашего бактериального дисбаланса, ваш врач поможет вы составляете план питания.
Это может помочь убедиться, что вы получаете достаточно питательных веществ для поддержания баланса бактерий, в том числе:
Врач также может посоветовать вам прекратить есть определенные продукты, содержащие вредные химические вещества или слишком много определенных питательных веществ.
Продукты, которые вы можете добавить в свой рацион, включают:
- темную листовую зелень, включая шпинат и капусту
- рыбу, включая лосось и скумбрию
- свежее мясо (избегайте мясных продуктов)
Продукты, которые могут вам понадобиться чтобы бросить есть:
- обработанное мясо, такое как мясные деликатесы, соленое или консервированное мясо
- углеводы в кукурузе, овсе или хлебе
- некоторые фрукты, такие как бананы, яблоки и виноград
- молочные продукты, включая йогурт, молоко и сыр
- продукты с высоким содержанием сахара, такие как кукурузный сироп, кленовый сироп и тростниковый сахар-сырец
Прием пре- и пробиотиков также может помочь поддерживать баланс кишечных бактерий.Эти добавки содержат культуры определенных бактерий, которые вы можете есть, пить или принимать в качестве лекарств. Поговорите со своим врачом о том, какие типы пре- или пробиотиков вам понадобятся для поддержания баланса микробиоты.
Некоторые исследования показывают, что йога и медитация помогают организму усваивать питательные вещества. Они также могут увеличить приток крови к мозгу и обратно к кишечнику. Это может уменьшить некоторые симптомы дисбактериоза.
Доказано, что дисбактериоз тесно связан с определенными заболеваниями и состояниями, в том числе:
Дисбиоз обычно протекает в легкой форме, и его можно лечить с помощью лекарств и изменения образа жизни.Но если его не лечить, дисбактериоз может привести к хроническим заболеваниям, включая СРК.
Немедленно обратитесь к врачу, если вы испытываете необычную или постоянную боль в животе или раздражение кожи. Чем раньше врач диагностирует ваше состояние, тем меньше вероятность развития каких-либо дополнительных осложнений.
Определенные изменения образа жизни могут помочь сохранить баланс бактерий и предотвратить их чрезмерный рост.
Рекомендации
- Принимайте антибиотики только под наблюдением врача.
- Поговорите со своим врачом о добавлении пре- или пробиотических добавок в свой распорядок дня, чтобы помочь регулировать количество желудочно-кишечных бактерий.
- Пейте меньше алкоголя или вовсе избегайте его, так как он может нарушить баланс бактерий в кишечнике.
- Чистите щеткой и пользуйтесь нитью каждый день, чтобы предотвратить неконтролируемый рост бактерий во рту.
- Используйте презервативы при каждом половом акте, чтобы предотвратить распространение бактерий и инфекций, передающихся половым путем.
Желудочно-кишечная инфекция: симптомы и лечение
Существует ряд бактерий, вирусов и паразитов, вызывающих инфекции желудочно-кишечного тракта (ЖКТ).По данным Центров США по контролю и профилактике заболеваний, на диарейные заболевания приходится 1 из 9 случаев детской смерти во всем мире. Ежедневно он поражает 2195 детей — больше, чем СПИД, малярия и корь вместе взятые.
Хотя они могут продолжаться до 14 дней, инфекции ЖКТ обычно длятся несколько дней. Для них характерны спазмы в животе и дискомфорт, за которыми следует диарея. Другие симптомы могут включать:
Вот несколько распространенных типов инфекций ЖКТ.
Бактериальный
- E.coli. Бактерии E. coli обнаружены в кишечнике людей и животных. Большинство разновидностей безвредны, но некоторые штаммы, такие как E. coli O157: H7, выделяют токсин, который может вызывать спазмы в животе, рвоту и кровавую диарею. E. coli распространяется через зараженную воду или пищу, контактировавшую с навозом. E. coli также может передаваться при прямом контакте между людьми.
- Сальмонелла .Инфекция сальмонеллы обычно вызывается употреблением в пищу сырой или недоваренной птицы, мяса и яиц. Большинство инфекций сальмонеллы можно классифицировать как гастроэнтерит.
Вирусный
- Норовирус. Норовирусы — самая частая причина болезней пищевого происхождения во всем мире. Особенно вероятно распространение среди людей в ограниченном пространстве. Хотя в большинстве случаев вирус распространяется через зараженную пищу или воду, передача от человека к человеку также возможна.
- Ротавирус. По данным клиники Майо, ротавирус является ведущей причиной вирусного гастроэнтерита у детей во всем мире. Дети обычно заражаются, когда они прикасаются к предметам, зараженным вирусом, а затем кладут пальцы в рот. В некоторых странах есть ротавирусная вакцина.
Паразиты
- Лямблиоз. Лямблии — это паразит, который легко распространяется через контакт с человеком и зараженную воду.Он устойчив к хлору и может распространяться в общественных бассейнах. Заражение может происходить через питьевую воду из загрязненных озер и ручьев и купаться в них.
- Криптоспоридиоз. Основная причина заболеваний, передающихся через воду в США, Cryptosporidium — микроскопический паразит, вызывающий криптоспоридиоз. У него есть внешняя оболочка, которая помогает ему выжить вне хозяина и переносить дезинфекцию хлором.
Взрослые
Немедленно обратитесь к врачу, если:
- у вас температура выше 104 ° F (40 ° C)
- не может удерживать жидкость в течение 24 часов
- рвота более 48 часов
- рвота кровью
- обезвоживание: чрезмерная жажда, сухость во рту, малое количество мочи или ее отсутствие (или темно-желтая моча), крайняя слабость, головокружение или головокружение
- кровь в кишечнике
Дети
немедленно обратитесь к педиатру, если у вашего ребенка:
- лихорадка выше 102 ° F (39 ° C)
- испытывает сильный дискомфорт или боль
- кажется вялым
- очень раздражительным
- появляется кровавая диарея
- появляется обезвоженный
Чтобы определить, обезвожен ли ваш ребенок, вы можете отслеживать, сколько он пьет и мочится, и сравнивать с их обычным количеством.
Младенцы
Немедленно покажите ребенка педиатру, если у него:
- рвота (а не обычная рвота) более нескольких часов
- сухость во рту
- не было мокрого подгузника шесть часов
- плачет без слез
- имеет тяжелую диарею
- имеет кровавый стул
- не отвечает
- необычно сонный или сонный
- имеет запавшее мягкое пятно на макушке
В большинстве случаев самообслуживание меры по уходу являются рекомендуемым лечением.Антибиотики не помогут при инфекциях ЖКТ, вызванных вирусами или паразитами.
Хотя антибиотики могут помочь в сложных случаях бактериальной инфекции, в неосложненных случаях они могут фактически продлить состояние и увеличить риск рецидива.
Кроме того, при некоторых инфекциях антибиотики могут привести к опасным осложнениям. Ваш врач может помочь определить, нужны ли вам или вашему ребенку антибиотики.
Ваш врач может порекомендовать вам избегать продуктов с высоким содержанием клетчатки, которые могут усугубить диарею.Они также могут порекомендовать безрецептурные лекарства, нейтрализующие кислоту желудочного сока или лечящие тошноту, боль в животе и диарею.
Самым важным средством ухода за собой для взрослых и детей с инфекцией желудочно-кишечного тракта является поддержание водного баланса.
Желудочно-кишечные инфекции вызываются рядом бактерий, вирусов и паразитов. Во многих случаях инфекция проходит через несколько дней.
Если у вас или вашего ребенка наблюдаются такие симптомы, как высокая температура, кровавый стул или рвота, обратитесь к врачу для получения полного диагноза и плана лечения.
Границы | Инфекционные угрозы, кишечный барьер и его троянский конь: дисбактериоз
Введение
Кишечный барьер определяет морфофункциональную единицу, отвечающую за защиту слизистой оболочки кишечника, и состоит из микробиоты кишечника, кишечных эпителиальных клеток (IEC) и слизистого иммунитета, тесно связанных сложной сетью цитокинов, антимикробных пептидов (AMP), метаболических продукты и многочисленные регуляторные молекулы (Meng et al., 2017). Учитывая, что слизистая оболочка кишечника является самой большой поверхностью тела, подверженной риску инфекционных угроз, анатомический и функциональный гомеостаз кишечного барьера является ключевым шагом в противоинфекционной защите человеческого организма.
Кишечная микробиота представляет собой первую линию защиты кишечного барьера. Микробиота включает в себя миллионы микроорганизмов, колонизирующих желудочно-кишечный тракт, большинство из которых являются бактериями. Это большое количество микроорганизмов противостоит неблагоприятной кишечной среде обитания благодаря их симбиотическим отношениям с человеческим организмом.Эти симбиотические отношения между хозяином и комменсалом развиваются после рождения и активируют метаболические, иммунные и противоинфекционные процессы, посредством которых микробиота способствует гомеостазу кишечника (O’Hara and Shanahan, 2006). Структурная и функциональная стабильность комменсальных популяций регулируется многочисленными сигнальными молекулами (кворум) и клеточными регуляторами (миРНК), а также другими физиологическими и патологическими факторами. Качественные или количественные изменения этого микробного сообщества, в широком смысле определяемого как дисбиоз, нарушают взаимоотношения между хозяином и комменсальными видами, изменяют баланс между комменсалами и патогенами, снижают защиту кишечного барьера и способствуют развитию инфекционных патогенов (McDonald et al., 2016). Следовательно, микробиота теряет свою противоинфекционную роль и становится слабым звеном, ответственным за стойкие инфекции.
В статье обсуждаются механизмы защиты кишечного барьера, ключевая противоинфекционная роль микробиоты внутри кишечного барьера и влияние дисбактериоза на опасные для жизни инфекции.
Кишечный барьер и механизмы антибактериальной защиты
Комменсальная Флора — Первая линия обороны
Кишечная микробиота включает все виды микробов, населяющих желудочно-кишечный тракт.Молекулярные методы у здоровых людей выявили разнообразную экосистему, содержащую девять бактериальных типов, четыре из которых являются доминирующими: Firmicutes, Bacteroidetes, Actinobacteria и Proteobacteria (Rajilić-Stojanović et al., 2007). Структура микробиоты постепенно определяется после достижения трехлетнего возраста посредством симбиотических отношений с организмом и обеспечивает доминирование в кишечнике определенных комменсалов («симбионтов»), принадлежащих к типу Firmicutes и Bacteroidetes или порядку Bifidobacteriales .Симбионты будут конкурировать с патогенами или потенциальными патогенными микробами («патобионтами») за существующие кишечные ниши («конкуренция ниш»), а также за питательные вещества кишечника («конкуренция питательных веществ»). Эта конкуренция обеспечивает структурную стабильность микробиоты и называется «сопротивлением колонизации». Устойчивость к колонизации использует сеть определенных молекул, играющих критическую противоинфекционную роль (Sassone-Corsi and Raffatellu, 2015; Sorbara and Pamer, 2019). Среди них есть молекулы, играющие важную метаболическую и антимикробную роль, такие как короткоцепочечные жирные кислоты (SCFA) и бактериоцины.
Короткоцепочечные жирные кислоты являются конечными продуктами анаэробной ферментации кишечной микробиоты и основным источником энергии для колоноцитов (Roediger, 1980). Эффекты SCFA опосредуются рецепторами, связанными с G-белком (GPR) (GPR41, GPR43 и GPR109A), экспрессируемыми на иммунных клетках и различных тканях, включая эпителиальные клетки кишечника. Преобладающие SCFAs присутствуют на высоких уровнях мМ в толстой кишке (бутират), энтеро-печеночной циркуляции (пропионат) и системном кровотоке (ацетат) и отвечают за эпителиальную защиту и регуляцию воспалительного кишечного ответа, обзор в Donohoe et al.(2011) и Fukuda et al. (2011). SCFAs обеспечивают низкий антибактериальный pH вокруг клеток толстой кишки, способствуют синтезу слизи и способствуют целостности IEC за счет активации белков плотных контактов, стабилизации фактора транскрипции HIF, высвобождения IL-18 и модуляции инфламмасомы NLR пиринового домена 3 (NLRP3) (Wang et al., 2012; Kelly et al., 2015; Macia et al., 2015; Feng Y. et al., 2018). В то же время SCFAs вносят вклад в антибактериальную защиту от патогенных видов за счет рекрутирования нейтрофилов, высвобождения цитокинов и AMP, а также индуцируют иммунотолерантный ответ кишечника против комменсальных видов, как обсуждается далее.
Кишечные бактерии, в частности Firmicutes, Proteobacteria и Bacteroidetes , также синтезируют множество микробицидных молекул (бактериоцинов) с широким спектром активности (Todorov et al., 2014; Drissi et al., 2015). Штаммы, продуцирующие бактериоцины, такие как молочнокислые бактерии, обычно используются в качестве пробиотиков в пищевой промышленности (Parada et al., 2007). Некоторые бактериоцины (ниссин, педиоцин) были одобрены для перорального или местного применения, а другие изучаются в качестве пероральных альтернатив антибиотикам (см. Обзор в Cavera et al., 2015). Тем не менее, оральное применение бактериоцинов все еще остается неопределенным из-за отсутствия данных об их механизмах действия, а также об их эффективности, цитотоксичности, стабильности и иммуногенности.
Дисбиоз изменяет не только баланс между комменсалами и патогенами, но и высвобождение антимикробных молекул. Это, в свою очередь, нарушает процесс устойчивости к колонизации и делает возможным проникновение в эпителий кишечника различных патогенов.
Кишечный эпителий — вторая линия противоинфекционной защиты
Кишечный эпителий имеет свои собственные защитные механизмы, как структурные, так и функциональные.Монослой кишечного эпителия включает несколько подгрупп IEC, объединенных через плотные апикальные соединения, снаружи покрытые слоем слизи. IECs вступают в прямой контакт с собственной пластинкой оболочки и иммунными клетками (Goto, Ivanov, 2013). Все клоны кишечного эпителия возникают из HOPX-покоящихся стволовых клеток, обладающих иммунорегуляторными и подавляющими опухоль свойствами (Takeda et al., 2011). IEC включают энтероабсорбирующие энтероциты, бокаловидные клетки, секретирующие слизь, клетки для отбора проб антигена (M-клетки) и клетки Панета, каждая из которых демонстрирует специфические поверхностные рецепторы.
IEC экспрессируют специфические рецепторы, а именно «рецепторы распознавания образов» (PRR), такие как Nod-подобные рецепторы (NLR), toll-подобные рецепторы (TLR) и другие семейства PRR, расположенные на клеточной мембране или в цитоплазме, которые распознают специфические микробные ассоциированные молекулярные паттерны (МАМП). Как только активация этих рецепторов вызывает каскады передачи цитоплазматического сигнала и дополнительно способствует пути NF-kappaB (NF-kB) вместе с другими клеточными факторами транскрипции, активация инфламмасом и провоспалительные цитокины (IL-17, IL-18, IL-22) ) (Hirota et al., 2011; Джонс и Нейш, 2011; Леви и др., 2015). IEC и особенно клетки Панета, находящиеся на дне кишечных крипт, выделяют AMP (человеческий кателицидин, дефенсины) с микробицидными, иммуномодулирующими и ранозаживляющими свойствами. Таким образом, IEC дополнительно вносят вклад в стабилизацию кишечного барьера, наряду с устойчивостью к колонизации микробов. Следовательно, экспрессия MyD88 в клетках Панета является важным механизмом ограничения кишечной транслокации и проникновения кишечных комменсалов или патогенов (Vaishnava et al., 2008).
Короткоцепочечные жирные кислоты и стимуляция GPR43 / 109A также защищает целостность эпителия за счет активации инфламмасом и эпигенетической иммуномодуляции пролиферации FoxP3 + регуляторных Т-клеток (Treg), как показано ниже (Macia et al., 2015).
Дисбактериоз, вызванный инфекционными или неинфекционными причинами (ишемия, воспаление, опухоли или различные методы лечения), способствует разрушению эпителия кишечника (Kitajima et al., 1999; Nagpal and Yadav, 2017; Stewart A. S. et al., 2017). Поврежденный эпителий позволяет переносить различные кишечные бактерии и их токсины, включая эндотоксины (липополисахарид, ЛПС). В свою очередь, эти транслокации приводят к бактериемии, эндотоксемии и опасным для жизни инфекциям (сепсис, примитивный перитонит, портальная энцефалопатия у пациентов с циррозом печени или активация иммунной системы при инфицировании вирусом иммунодефицита человека (ВИЧ).
Кишечный иммунитет — третья линия противоинфекционной защиты
Кишечный эпителий представляет собой самую большую эпителиальную поверхность в организме человека.Он соединяется с экосистемой кишечника, содержащей комменсальные и патогенные виды. Комменсальные микробы должны быть приняты иммунологически, тогда как кишечные патогены должны быть устранены. Эта дифференциация требует активации чрезвычайно хорошо скоординированной и эффективной иммунной системы. Учитывая, что кишечные комменсалы присутствуют в организме человека с момента рождения, они фактически представляют собой первый контакт между иммунной системой и внешней средой. Таким образом, эта большая и разнообразная микробиота будет служить одним из механизмов защиты организма от вторжения патогенных микробов.В то же время микробиота развивает взаимовыгодные отношения с организмом, и вместе с кишечным эпителием и лимфоидной тканью, ассоциированной с кишечником (GALT), микробиота образует сложный кишечный барьер против инфекционных угроз.
Этим симбиотическим отношениям способствует присутствие PRR и иммуномодулирующая способность кишечной микробиоты против антигенных структур, экспонируемых кишечной микробиотой.
Роль клеточных рецепторов
Кишечный эпителий экспрессирует множество типов рецепторов, способных распознавать различные MAMP, экспрессируемые видами микробов, и преобразовывать их в сигналы кишечника для воспалительных каскадов (Kim et al., 2004). Таким образом, TLR 1,2,4,5,6 (внеклеточные сенсоры) и NLR1,2 и TLR9 (цитоплазматические сенсоры) экспрессируются на эпителиальных клетках и действуют комплементарно, способствуя как врожденному, так и адаптивному иммунитету (Kim et al., 2004; Abreu et al. др., 2005). MAMPs экспрессируются комменсальными видами с рождения, и примеры MAMP включают LPS, обнаруженный во внешней мембране грамотрицательных бактерий, липотейхоевую кислоту, присутствующую на стенке грамположительных бактерий, пептидогликан, компонент бактериальной стенки, флагеллин, компонент кишечные жгутиковые бактерии или высвобождают везикулы наружной мембраны, которые функционируют как лиганды PRR (Cañas et al., 2018). Активация PRR в присутствии MAMP стимулирует путь передачи сигнала NF-kB, индуцирует провоспалительные интерлейкины и обеспечивает врожденный иммунный ответ, наконец, поддерживая состояние контролируемого воспаления (Hayashi et al., 2001; Bambou et al., 2004; Vora et al., 2004; Rhayat et al., 2019). В отсутствие MAMP или специфических рецепторов (свободные от микробов животные или генетические мутации рецепторов) организм не может обнаружить микробные антигены и не имеет адекватных защитных механизмов (Abreu et al., 2005). Следовательно, считается, что богатая и разнообразная комменсальная флора играет активную роль в правильном развитии иммунной системы с самого рождения.
Антигенпрезентирующие клетки (APC), принадлежащие GALT, такие как макрофаги и дендритные клетки (DC), также обладают клеточными рецепторами, которые регулируют множество генов и модулируют высвобождение фактора транскрипции NF-κB, иммуномодулирующих цитокинов и AMP. В зависимости от типа активированного рецептора DC могут вызывать провоспалительный ответ Th2 / Th27.Таким образом, например, NLR2, индуцированный комменсальными бактериями, по-видимому, играет центральную роль в подавлении воспалительной активности GALT и способности DC вызывать поляризованный ответ CD4 + Th2 в экспериментах на мышах и людях (Butler et al. , 2007; Barreau et al., 2010).
Активируя рецепторы IEC или APC, комменсальная флора вызывает толерогенный ответ в DC, характеризующийся высвобождением иммуносупрессивных цитокинов (IL10, IL4, TGF-β), промотированием Treg-клеток и фенотипа CD4 + Th3 в периферия (Iwasaki, Kelsall, 1999; Stagg et al., 2003; Atarashi et al., 2013; Махаршак и др., 2013; Martin-Gallausiaux et al., 2018). Индукция иммунной толерантности слизистых оболочек защищает эпителий от вредного воспалительного иммунного ответа и способствует созреванию иммунной системы (Jung et al., 2019). Следовательно, любое нарушение, связанное с этим процессом, играет важную роль в воспалительных процессах кишечника.
Активация клеточных рецепторов неразрывно связана с провоспалительным ответом мезентериальных ДК и, в частности, участвует в поддержании ответа Th27 / Th2, направленного против патогенов (обзор в Sorini et al., 2018). Интересно то, что DC могут активировать Treg-клетки в отношении определенных антигенов, таких как LPS комменсальной флоры, но не LPS патогенной флоры (Shirai et al., 2004). Таким образом, стимуляция мышей ЛПС, полученным из E. coli , активирует воспалительные механизмы (продукция IL-12, ответ Th2), тогда как стимуляция ЛПС, полученным из Poprhyromonas gingivalis , индуцирует продукцию IL-4 и ответ Th3 (Pulendran et al. ., 2001). Точно так же TLR распознают антигены флагеллина патогенных видов Salmonella и вызывают воспалительную реакцию против них, в то время как виды-комменсалы, лишенные этого антигена, не вызывают воспалительной реакции (Gewirtz et al., 2001).
Все эти аспекты показывают, что клеточные рецепторы представляют собой фильтр для кишечных сигналов и играют решающую роль в индукции специфических защитных механизмов, адаптированных к комменсальной флоре. Эта роль клеточных рецепторов действительно значительна, учитывая плотность и разнообразие кишечных бактерий. Дисбсиоз устраняет комменсальные виды, которые запускают поляризацию Treg-клеток и, следовательно, приводит к чрезмерному ответу Th2 или Th3, дополнительно способствуя воспалительному или аутоиммунному ответу.
Иммуномодулирующая роль GALT
Связанная с кишечником лимфоидная ткань является наиболее важной лимфатической сетью у людей и включает изолированные или агрегированные лимфоидные фолликулы (пятна Пейера), внутриэпителиальные лимфоциты, макрофаги, DC, мезентериальные ганглии, секреторные клетки IgA (sIgA) и лимфатические сосуды.
Пятна Пейера, локализованные на слизистой и подслизистой оболочке тонкой кишки, покрыты «фолликул-ассоциированным эпителием», содержащим специализированные «М-клетки».Эти клетки поглощают и транспортируют антигены из просвета кишечника в кишечные DC, где примированы Т-клеточные лимфоциты (LT) (Alpan et al., 2001). LT впоследствии возвращаются в лимфатический компартмент кишечника для выполнения своей эффекторной функции. В то же время М-клетки инициируют продукцию sIgA слизистой оболочки и гуморальные ответы (Rios et al., 2016). Таким образом, пятна Пейера напрямую опосредуют взаимодействие между кишечной флорой и гуморальным или клеточным иммунным ответом. Кишечные патогены адаптированы для вторжения и разрушения фолликул-ассоциированного эпителия, особенно М-клеток, дополнительно препятствуя дифференцировке Т-клеток и иммунному ответу; эти микробы прикрепляются к кишечному эпителию с помощью различных механизмов (Phillips et al., 2000), вторгаются в энтероциты (Kühbacher et al., 2018) или вторгаются и разрушают М-клетки (Clark et al., 1994; Autenrieth and Firsching, 1996; Penheiter et al., 1997; Corr et al., 2006) .
Кишечно-ассоциированная лимфоидная ткань также содержит популяцию толерогенных DC, а именно CD103 + DC, участвующих в экспрессии Foxp3 и кишечной конверсии наивных CD4 + Т-клеток в Treg-клетки. Комменсальная флора стимулирует CD103 + DC посредством активации специфических рецепторов или посредством собственных продуктов метаболизма, таких как SCFA (Furusawa et al., 2013; Настаси и др., 2015; Kaisar et al., 2017). Таким образом, бутират стимулирует кишечные ДК, обеспечивает кишечную иммунную толерантность за счет высвобождения ИЛ-10 (Liu et al., 2012) и поляризации Т-клеток по отношению к Т-рег-клеткам, сохраняя при этом баланс между иммуносупрессивными Т-клетками CD4 + , секретирующими ИЛ-10, IL-17-секретирующие клетки Th27 и эффекторные клетки CD4 + Th2 (Arpaia et al., 2013; Furusawa et al., 2013). Кроме того, SCFAs ослабляют чрезмерную воспалительную реакцию, вызванную LPS-продуцирующими грамотрицательными бактериями (Cox et al., 2009).
Нарушение регуляции иммунного ответа Th2 / Th27 против комменсальных видов связано с воспалительными заболеваниями кишечника. С другой стороны, чрезмерная поляризация в сторону ответа Treg ослабляет иммунный ответ на инфекции (Brenchley et al., 2004). Другой пример нарушения регуляции GALT происходит при ВИЧ из-за разрушения кишечного барьера и последующего хронического воспалительного ответа. GALT зависит от микробиоты, и стоит отметить, что развитие GALT и активация T-клеточных лимфоцитов и B-клеточных лимфоцитов не может происходить в отсутствие сигналов, выделяемых кишечной флорой.
Эксперименты с комменсалами, принадлежащими к видам Clostridium и Bacteroides , дополнительно подчеркнули способность кишечной микробиоты поддерживать гомеостаз кишечника и управлять адекватным Т-клеточным ответом через специфические MAMP во время бактериальной инвазии (Иванов и др., 2008; Lécuyer et al., 2014). Таким образом, штаммы Bacteroides fragilis , экспрессирующие полисахарид A, связывающий TLR2 на CD4 + Т-лимфоцитов, и коренные в кишечнике Clostridium , принадлежащие кластерам XIVa и IV, поддерживают Tregs, подавляют клетки Th-17 и способствуют толерантности слизистой оболочки к микробиоте толстой кишки (мазманийская и другие., 2008; Round et al., 2011; Atarashi et al., 2013). С другой стороны, сегментированные нитчатые бактерии, генетический родственник рода Clostridium , стимулируют как эффекторные Th27 CD4 + Т-клетки (Иванов и др., 2009; Farkas et al., 2015; Schnupf et al., 2017), так и антитела sIgA. во время кишечной инвазии (Lécuyer et al., 2014). Другие виды микробов также модулируют ось Treg / Th27, потенциально контролируя воспаление кишечника и толерантность (Pandiyan et al., 2019). Этот аспект также объясняет неравновесие между этими видами во время дисбактериоза, а также распространение патогенов и поражение слизистых оболочек.
Последствия эпигенетической регуляции
Модуляция экспрессии генов с помощью эпигенетических механизмов в кишечной среде была изучена специально для новообразований и воспалительных процессов (Вдовикова и др., 2018). Эпигенетические механизмы модулируют транскрипцию генов различными процессами: метилированием ДНК, модификациями гистонов и модуляцией экспрессии длинной некодирующей РНК и микроРНК. Однако механизмы, посредством которых бактерии либо поражаются, либо вызывают эпигенетические изменения кишечника, не совсем понятны.
Модификации гистонов коррелируют с активацией или репрессией генетической транскрипции посредством модуляции двух антагонистических ферментов, а именно гистонацетилтрансфераз (HAT), индуцирующих ацетилирование гистонов, и гистоновых деацетилаз (HDAC), индуцирующих деацетилирование гистонов. Во время ацетилирования структура хроматина разрыхляется и становится доступной для факторов транскрипции. Ингибиторы HDAC увеличивают ацетилирование гистонов и впоследствии регулируют экспрессию генов в многочисленных иммунных клетках, таких как эпителиальные клетки, нейтрофилы, APC и Т-клетки.Напротив, деацетилирование гистонов HDAC предотвращает транскрипцию генов. Таким образом, исследования, проведенные in vitro , показали, что ингибиторы HDAC способствуют высвобождению нескольких факторов транскрипции, таких как NFκB, MyoD, p53 или HSP90 (Vinolo et al., 2011; Kumar SA et al., 2018; Banik et al., 2019 ). Дисбаланс NF-kB коррелирует с многочисленными воспалительными и антиапоптотическими механизмами, которые мешают уклонению от вирусов (Le Negrate, 2012; Carrasco Pro et al., 2018), септическим шоком (Liu et al., 1999; Han et al., 2002) или воспалительные заболевания (Макаров, 2001; Lawrence, 2009). Точно так же p53 регулирует клеточный цикл и апоптоз, действуя как супрессор опухолей (Aubrey et al., 2018). Р53-опосредованный апоптоз был связан с распространением вирусных инфекций (Lazo and Santos, 2011; Aloni-Grinstein et al., 2018), тогда как активность, опосредованная обратной транскриптазой HSP90, скорее всего, была связана с обширной инфекцией вируса гепатита B (HBV). (Ху и Сигер, 1996). Некоторые вирусы, среди которых ВИЧ, HBV, вирус гепатита С, вирус Эпштейна-Барра, цитомегаловирус, вирус простого герпеса и Т-лимфотропный вирус человека, имеют стратегии активации NF-kB и блокировку апоптоза клеток (Santoro et al., 2003), в то время как другие, особенно онкогенные, имеют механизмы подавления р53 (Sato, Tsurumi, 2013). Было продемонстрировано, что ингибиторы HDAC могут блокировать активацию звездчатых клеток, препятствуя фиброзу печени на экспериментальных моделях животных (Park et al., 2014; Ding et al., 2018).
Таким образом, ингибируя HDAC, SCFAs могут контролировать многочисленные инфекционные и иммунные процессы (Vinolo et al., 2011; Zhou et al., 2017b; Sun et al., 2018). Хотя роль ингибиторов HDAC еще полностью не выяснена, большинство экспериментальных исследований продемонстрировали противовоспалительный дозозависимый эффект (Yin et al., 2001; Ле Пол и др., 2003; Вебер и Керр, 2006; Asarat et al., 2016; Kaisar et al., 2017; Li et al., 2018) и иммуносупрессивная роль SCFAs в опухолях (Villagra et al., 2010; Tang et al., 2011). Тем не менее, хотя другие ингибиторы HDAC уже используются в онкологической терапии, точная роль SCFAs в иммунных и опухолевых процессах остается чисто теоретической (Meijer et al., 2010; Matthews et al., 2012; Ulven, 2012).
МикроРНК (миРНК) представляют собой небольшие эволюционно консервативные некодирующие РНК, состоящие примерно из 19–23 нуклеотидов, участвующие в посттранскрипционной регуляции клеточных мРНК.Биогенез зрелой miRNA включает двухэтапный процесс отщепления от первичных miRNA (pri-miRNA). Зрелую миРНК затем загружают в комплекс, индуцированный РНК эффекторного комплекса (RISC). RISC взаимодействует с мРНК-мишенью и индуцирует расщепление мРНК или репрессию трансляции, тем самым контролируя различные метаболические или клеточные пути, включая развитие клеточного цикла, дифференцировку, апоптоз, иммунную регуляцию или онкогенез (Dalmasso et al., 2011; Singh et al., 2012; Nakata et al. ., 2017). miRNA выделяются внеклеточно большинством эукариотических клеток, и во внеклеточных везикулах, высвобождаемых грамотрицательными бактериями («везикулы внешней мембраны»), наблюдались различные типы малых некодирующих РНК (мРНК) длиной около 50-200 нт (Gong et al., 2011). Общая концепция заключается в том, что мРНК, а также малые РНК размером с микроРНК (мсРНК) длиной 15-25 нуклеотидов, такие как мсРНК, наблюдаемые в модельной бактерии E. coli (Kang et al., 2013), действуют как пост- регуляторы транскрипции и функционируют как сигнальные молекулы для роста и вирулентности бактерий в экспериментальных условиях (Ortega et al., 2012; Zhao et al., 2017) и механизмов вирулентности, по крайней мере, в экспериментальных условиях (Padalon-Brauch et al., 2008; Choi и др., 2017).Роль этих структур в гомеостазе кишечника на данный момент почти не освещена, большая часть информации получена из исследований на обычных или стерильных мышах.
миРНК кишечника выделяются IEC (Liu et al., 2016) и регулируются кишечной микробиотой посредством TLR / MyD88-зависимого пути (Dalmasso et al., 2011; Singh et al., 2012; обзор Eulalio et al., 2012; Williams et al., 2017). Лю и Вайнер (2016) провели обширное исследование, выявив многочисленные типы внеклеточных миРНК, циркулирующих в экзосомах в просвете кишечника и кале мышей и людей.Исследование доказало, что IECs и Hopx-экспрессирующие клетки являются основными источниками экзосомных кишечных miRNAs, а также подчеркнули их поглощение кишечными бактериями и потенциальную роль в посттранскрипционной регуляции бактериальных генов.
Исследования на мышах указывают на определенный паттерн комплементализации микроРНК кишечника после бактериальной колонизации (Dalmasso et al., 2011) и сообщили о преобладании miR-143, -145 в тощей и слепой кишке и miR-200b в толстой и слепой кишке. (Сингх и др., 2012). С другой стороны, человеческие клетки или экспериментальные модели животных с патогенными видами ( Helicobacter pylori, Citrobacter rodentium, Listeria monocytogenes, Francisella tularensis и Salmonella enterica ) индуцируют другую панель miRNA, в основном представленную miR-155 и miR-146. (Eulalio et al., 2012; Archambaud et al., 2013; Staedel, Darfeuille, 2013).
На молекулярном уровне растет интерес к кишечной роли miRNAs и их регуляторному влиянию на функционирование кишечного барьера, но данные по этой теме расходятся, скудны и фрагментированы.Клеточные и внеклеточные миРНК из просвета кишечника модулируют целостность эпителия, воспалительный ответ и, возможно, мРНК бактериальных генов с помощью недостаточно известных механизмов (обзор в Belcheva, 2017).
Исследования кишечных клеток человека подтвердили важность miRNA в защите эпителиальных плотных контактов (например, miRNA-122) (Ye et al., 2011), регенерации эпителия (например, miR-143, miR-145) (Chivukula et al. al., 2014) и пролиферации (члены семейства miR-30) (Peck et al., 2016), модуляции целостности эпителия (например, miR-122) (Ye et al., 2011), экспрессии гена муцина (Mo et al., 2016) и проницаемости эпителия (например, miR-21-5p) ( Наката и др., 2017).
МикроРНК кишечника также являются ключевыми регуляторами иммунного ответа против инфекций. MiRNA хозяина организуют иммунный ответ через семейства PRR и пути передачи сигналов TLR (miR-146a) (Xue et al., 2011, 2014), в то время как микробиота подавляет экспрессию miR-10a и miR-107 в DC хозяина, снижает высвобождение провоспалительных цитокинов у мышей и контролирует чрезмерную воспалительную реакцию у человека и мышей (например,g., miRNA-146a и miR-193a-3p) (Taganov et al., 2006; Nahid et al., 2011; Singh et al., 2012; Dai et al., 2015). MiRNA могут также потенциально влиять на микробиоту и облегчать воспаление толстой кишки, как было предположено из отрицательной корреляции при язвенном колите между высвобождением miR-193a-3p и воспалением толстой кишки (Dai et al., 2015). Эта концепция была дополнительно изучена в исследовании, в котором пероральный прием эндотоксина у мышей приводил к усилению эпителиальной miR-146 и способствовал толерантности врожденного иммунитета и эпителиальной защите в постнатальный период (Chassin et al., 2010). Сходным образом мыши с дефектом mi-RNA-155 не смогли развить защитный иммунитет против H. pylori или Salmonella Typhimurium (Rodriguez et al., 2007).
Патогенные бактерии также выделяют мембранные или внешние мембранные везикулы, содержащие мРНК, которые модулируют профиль миРНК хозяина и экспрессию генов (Gu et al., 2017). Некоторые исследования кишечного воспаления, вызванного энтеропатогенами, выявили повышающую регуляцию miR-16, -21, -223, -594 и miRNA-31 или понижающую регуляцию miR-124 в просвете кишечника человека (Wu et al., 2010; Koukos et al., 2013; Lin et al., 2014). Их биологическая значимость изучается.
Согласно исследованиям на людях, различные миРНК коррелировали с кишечным онкогенезом. В этом отношении кластеры miR-182, -503 и miR-17∼92 модулируют продукцию гликанов и коррелируют с ростом определенных бактерий, которые потенциально могут инициировать изменения микроокружения при колоректальном раке (Yuan et al., 2018). Таким образом, миРНК кишечника могут вызывать и поддерживать дисбактериоз, способствуя развитию различных инфекций или рака кишечника (Liu et al., 2016; Williams et al., 2017). Более того, однонуклеотидные полиморфизмы генов miRNA-146a, -27a способствуют развитию различных инфекций, связанных с воспалительными и новообразованиями кишечника (Song et al., 2013; Shao et al., 2014). Было также показано, что бутират влияет на экспрессию miRNA-106b в IEC и модулирует канцерогенез (Hu et al., 2011). Следовательно, вероятно, что эпигенетические регуляторы, такие как miRNAs, могут играть ключевую роль во взаимодействии между хозяином и микробиотой и нарушении регуляции miRNA.
Дисбиоз, троянский конь внутри кишечного барьера
Дисбактериоз и энтеральные инфекции
Кишечные патогены изменяют кишечный барьер, противодействуют кишечной микробиоте и вызывают энтеральные инфекции посредством различных механизмов, включая усиление кишечного воспаления, высвобождение бактериоцинов и активацию AMP и секреторных систем доставки токсинов (T6SS, T3SS), а также использование питательных веществ или кишечные ниши (обзор в Rolhion and Chassaing, 2016; Sorbara and Pamer, 2018).
Дисбактериоз возникает как следствие различных энтероинвазивных или энторотоксиногенных видов, которые нарушают устойчивость к колонизации, уменьшают защитные виды, принадлежащие к типу Bacteroidetes и Firmicutes (особенно Clostridiales incertae sedis XI или кластеру IV / XIVa). чрезмерный рост видов, принадлежащих к типу Proteobacteria (особенно семейств Enterococcaceae и Enterobacteriaceae ) (Vincent et al., 2013; Ливанос и др., 2018). Лечение кишечных инфекций антибиотиками дополнительно изменяет структуру микробиоты и резко нарушает процесс «устойчивости к колонизации» (Panda et al., 2014).
В результате первые изменения, вызванные дисбиозом, включают потерю комменсалов, синтезирующих бактериоцины и SCFAs, таких как Bacteroides thuringiensis и семейства Lachnospiraceae и Ruminococcaceae (Rea et al., 2010) вместе с потерей вместе с потерей ). Комменсалы Clostridia , конкурирующие с патобионтами за одну и ту же кишечную нишу (Sailhamer et al., 2009; Buffie et al., 2015; Geerlings et al., 2018) и Bacteroides thetaiotaomicron и Akkermansia muciniphila , которые защищают кишечный барьер (Hooper et al., 2001; Donato et al., 2010; Martín et al., 2019). В этих случаях обычно редкие патобионты в конечном итоге становятся доминирующими видами и проявляют различные механизмы вирулентности. Следовательно, патобионты или их эндотоксины вызывают кишечные инфекции, кишечный сепсис или постантибиотический колит (Brown et al., 2013; Pérez-Cobas et al., 2013). Более того, лечение антибиотиками способствует развитию видов с множественной лекарственной устойчивостью (МЛУ), которые, в свою очередь, становятся инвазивными и патогенными после внепросветной транслокации (Hirakata et al., 2002; Ayres et al., 2012). Следовательно, у видов Pseudomonas с MDR с системами оттока, такими как MexAB-OprM, развивается механизм распознавания кворума для определения стресса хозяина и экспрессии множественных детерминант вирулентности (Hirakata et al., 2002). Широкое распространение систем эффлюксной помпы у видов с МЛУ кишечника после лечения антибиотиками увеличивает вирулентность этих видов и связанный с ними риск внепросветной транслокации (Nishino et al., 2006; также рассмотрен в Nikaido, 1996). Поэтому дисбактериоз может быть как причиной, так и следствием энтеральной инфекции.
Восстановление микробиоты особенно сложно и лучше всего обеспечивается трансплантацией фекальной микробиоты (FMT) от здорового донора. Эффективность FMT в лечении энтероколита или сепсис-дисбиоза C. difficile еще раз подчеркивает критическую роль микробиоты для здоровья кишечника (Gough et al., 2011; Rao and Young, 2015; Wei et al., 2016).
Дисбактериоз и сепсис
Сепсис — это опасное для жизни нарушение функции органа, вызванное дисрегулируемой воспалительной реакцией на инфекционные агенты или их провоспалительные продукты. Сепсис имеет прогрессирующее и смертельное течение до генерализованного микрососудистого поражения, клеточной гипоксии и шока (Singer et al., 2016). При определенных условиях кишечные бактерии могут вызывать дисрегулируемую системную воспалительную реакцию, вызывающую сепсис (Deitch et al., 1994; Mainous et al., 1995). Микробы, наиболее часто встречающиеся при кишечном сепсисе, — это грамотрицательные бациллы, продуцирующие либо эндотоксины, либо порообразующие экзотоксины (Wallace et al., 2000), и, вероятно, одним из наиболее распространенных видов, вовлеченных в эти случаи, является E. coli , обычный обитатель кишечника (MacFie et al., 1999). Присутствие порообразующих экзотоксинов сопровождается оттоком клеточного калия и активацией инфламмасомы NLRP3. В свою очередь, они способствуют клеточному апоптозу и потере целостности эпителия, а также позволяют токсинам и патогенам проникать в портал и системный кровоток. Это дополнительно стимулирует высвобождение различных провоспалительных медиаторов и медиаторов свертывания крови и цитокиновый шторм, за которым следует вазоконстрикция, ишемия и периферический некроз и, наконец, дисфункция органов и шок (обзор в Los et al., 2013; Соннен и Хеннеке, 2013). Избыточная активация комплекса CD14 / TLR4 / MD2 бактериальными эндотоксинами также индуцирует сигнальный путь инфламмасом, наряду с активацией каспазы (Hotchkiss et al., 1999), лизисом клеток и непропорциональным высвобождением провоспалительных цитокинов, вызывая дальнейшее развитие и обострение сепсиса. , обзор в Lamkanfi (2011), Gao et al. (2018) и Скирецкий и Кавайон (2019).
Сепсис изменяет кишечный барьер с помощью множества факторов, которые в конечном итоге способствуют дисбактериозу, включая ишемию кишечника и воспалительные поражения, агрессивный уход, лечение антибиотиками, в том числе
Желчная рвота у новорожденных: быстрая диагностика кишечной непроходимости
KEN KIMURA, M.D., и ВЕРА ЛОНИНГ-БАКК, доктор медицины, Медицинский колледж Университета Айовы, Айова-Сити, Айова
Am Fam Physician. 2000 1 мая; 61 (9): 2791-2798.
Рвота желчью у новорожденных является неотложным состоянием, требующим немедленного участия бригады детских хирургов и неонатологов для периоперационного ведения. Однако первоначальное выявление, оценка и лечение часто выполняются медсестрами, семейными врачами и педиатрами общего профиля. Рвота желчью с вздутием живота или без него является первым признаком кишечной непроходимости у новорожденных.Следует немедленно ввести назо- или орогастральный зонд для декомпрессии желудка. После физикального обследования следует сделать снимки брюшной полости. Расширенные петли кишечника и уровень жидкости в воздухе предполагают хирургическую непроходимость. Может потребоваться контрастная рентгенография. Атрезия двенадцатиперстной кишки, мальротация и заворот средней кишки, атрезия тощей кишки, кишечная непроходимость мекония и некротический энтероколит являются наиболее частыми причинами непроходимости кишечника у новорожденных.
Когда у новорожденного развивается рвота желчью, следует подозревать хирургическое вмешательство.После целенаправленного физического обследования следует установить назогастральный или орогастральный катетер для декомпрессии желудка, чтобы предотвратить дальнейшую рвоту и аспирацию. Это должно быть сделано до того, как будут выполнены какие-либо диагностические или терапевтические манипуляции. Для введения жидкости, электролитов и питания необходимо установить внутривенную линию. Когда гемодинамическая стабилизация пациента стабилизируется, необходимо выполнить соответствующие визуализирующие исследования брюшной полости. Сюда входят простые снимки брюшной полости и / или контрастные исследования.Когда демонстрируются расширенные петли кишечника и уровни жидкости и воздуха, предлагается диагноз хирургической брюшной полости и показана срочная консультация детского хирурга, предпочтительно в детском хирургическом центре. Декомпрессия желудка, гидратация и обеспечение проходимости дыхательных путей должны быть выполнены до начала транспортировки пациента. Кишечная непроходимость с рвотой желчью у новорожденных может быть вызвана атрезией двенадцатиперстной кишки, мальротацией и заворотом, атрезией тощей кишки, кишечной непроходимостью мекония и некротическим энтероколитом (таблица 1).
Просмотр / печать таблицы
ТАБЛИЦА 1Причины кишечной непроходимости с желчной рвотой у новорожденных
| Тип непроходимости | Причина и частота возникновения | Возраст начала и проявления | Предоперационная процедура и результаты диагностики интервал ведения до операции | Лечение | Послеоперационное ведение | Прогноз | ||
|---|---|---|---|---|---|---|---|---|
Атрезия двенадцатиперстной кишки | Эмбриогенный; встречается у 1 случая на 5000 живорождений; 25% имеют синдром Дауна | Через несколько часов после рождения; рвота желчью, без вздутия живота | Брюшная пленка, знак «двойного пузыря» | Назогастральное отсасывание, внутривенное введение жидкости; От 24 до 48 часов | Дуоденодуоденостомия ромбовидной формы | Нет перорального приема, назогастральное отсасывание; кормление через 2–3 дня после операции | Хорошо, если не связано с серьезными аномалиями | |
Мальротация с заворотом | Неполное вращение кишечника, происходящее в течение 7–12 недель беременности | 9 дни; желчная рвота, быстрое ухудшение с заворотом | Признак спирали верхнего отдела желудочно-кишечного тракта на УЗИ; аномальное расположение верхних брыжеечных сосудов | Назогастральное отсасывание, внутривенное введение жидкости; STAT-операция для пациентов с симптомами, в течение нескольких дней для остальных | Процедура Лэдда; может потребоваться вторая лапаротомия | Не принимать внутрь; назогастральная аспирация | Хорошая без резекции кишечника, сложная при синдроме короткой кишки после резекции кишечника | |
Атрезия тощей кишки | Мезентериальная сосудистая патология во время внутриутробной жизни у 1 на 3000 9000 | часы рождения; рвота, вздутие животаУровни воздуха и жидкости на пленке брюшной полости | Назогастральное отсасывание, внутривенное введение жидкости; От 12 до 24 часов | Резекция (и) и анастомоз (и) | Нет перорального приема, назогастральное отсасывание; кормление через 2–4 дня после операции | Хорошо, если не наблюдается чрезмерной потери кишечника | ||
Мекония илеус | Генетическая, встречается у 15% новорожденных с муковисцидозом и у 1 на 5000–10 000 живущих роды | Сразу после рождения; вздутие живота, рвота желчью | Брюшная пленка; вздутие живота, уровни воздух-жидкость, потовая проба, знак «матового стекла» | Декомпрессия | Энтеростомия при осложнениях; Гастрографиновая клизма плюс внутривенное введение жидкостей | Ацетилцистеин (мукомист), ферменты поджелудочной железы | Зависит от системных проблем | |
Невозможный невроз | 9054 на 1000 живорожденийОт 10 до 12 дней после рождения; вздутие живота, рвота, стул с кровью | Брюшная пленка; вздутие живота, пневматоз, воздух в аортальной вене | Назогастральное отсасывание, внутривенное введение жидкости, питание, антибиотики в течение 10 дней. При перфорации, немедленное хирургическое вмешательство | Резекция некротизированного кишечника и энтеростомия | То же, что и предоперационное ведение | 25% нуждаются в хирургическом вмешательстве (65% выживаемость) 75% можно лечить медикаментозно (95% выживаемость) |
Причины кишечной непроходимости с желчной рвотой у новорожденных
| Тип непроходимости | Причина и частота возникновения | Возраст начала и проявления | Диагностическая процедура и результаты до операции | До операции | До операции Лечение | Послеоперационное ведение | Прогноз | |
|---|---|---|---|---|---|---|---|---|
Атрезия двенадцатиперстной кишки | Эмбриогенный; встречается у 1 случая на 5000 живорождений; 25% имеют синдром Дауна | Через несколько часов после рождения; рвота желчью, без вздутия живота | Брюшная пленка, знак «двойного пузыря» | Назогастральное отсасывание, внутривенное введение жидкости; От 24 до 48 часов | Дуоденодуоденостомия ромбовидной формы | Нет перорального приема, назогастральное отсасывание; кормление через 2–3 дня после операции | Хорошо, если не связано с серьезными аномалиями | |
Мальротация с заворотом | Неполное вращение кишечника, происходящее в течение 7–12 недель беременности | 9 дни; желчная рвота, быстрое ухудшение с заворотом | Признак спирали верхнего отдела желудочно-кишечного тракта на УЗИ; аномальное расположение верхних брыжеечных сосудов | Назогастральное отсасывание, внутривенное введение жидкости; STAT-операция для пациентов с симптомами, в течение нескольких дней для остальных | Процедура Лэдда; может потребоваться вторая лапаротомия | Не принимать внутрь; назогастральная аспирация | Хорошая без резекции кишечника, сложная при синдроме короткой кишки после резекции кишечника | |
Атрезия тощей кишки | Мезентериальная сосудистая патология во время внутриутробной жизни у 1 на 3000 9000 | часы рождения; рвота, вздутие животаУровни воздуха и жидкости на пленке брюшной полости | Назогастральное отсасывание, внутривенное введение жидкости; От 12 до 24 часов | Резекция (и) и анастомоз (и) | Нет перорального приема, назогастральное отсасывание; кормление через 2–4 дня после операции | Хорошо, если не наблюдается чрезмерной потери кишечника | ||
Мекония илеус | Генетическая, встречается у 15% новорожденных с муковисцидозом и у 1 на 5000–10 000 живущих роды | Сразу после рождения; вздутие живота, рвота желчью | Брюшная пленка; вздутие живота, уровни воздух-жидкость, потовая проба, знак «матового стекла» | Декомпрессия | Энтеростомия при осложнениях; Гастрографиновая клизма плюс внутривенное введение жидкостей | Ацетилцистеин (мукомист), ферменты поджелудочной железы | Зависит от системных проблем | |
Невозможный невроз | 9054 на 1000 живорожденийОт 10 до 12 дней после рождения; вздутие живота, рвота, стул с кровью | Брюшная пленка; вздутие живота, пневматоз, воздух в аортальной вене | Назогастральное отсасывание, внутривенное введение жидкости, питание, антибиотики в течение 10 дней. При перфорации, немедленное хирургическое вмешательство | Резекция некротизированного кишечника и энтеростомия | То же, что и предоперационное ведение | 25% нуждаются в хирургическом вмешательстве (65% выживаемость) 75% можно лечить медикаментозно (95% выживаемость) |
Атрезия двенадцатиперстной кишки
Атрезия двенадцатиперстной кишки — это врожденная непроходимость второй части двенадцатиперстной кишки.Считается, что его этиология связана с невозможностью реканализации этого сегмента кишечника на ранней стадии гестации. Беременность связана с многоводием, поскольку во многих случаях впоследствии обнаруживается кишечная непроходимость. Атрезия двенадцатиперстной кишки встречается у 1 на 5000–10 000 живорождений, причем у новорожденных мужского пола чаще, чем у девочек. Синдром Дауна встречается примерно у четверти этих пациентов; врожденные пороки сердца встречаются примерно у 20 процентов из них.
Атрезия двенадцатиперстной кишки может привести к перепончатому или прерывистому поражению, локализованному на уровне сосочка Фатера. У 80 процентов этих пациентов сосочек Фатера открывается в проксимальный отдел двенадцатиперстной кишки, что объясняет желчный характер рвоты. На снимке брюшной полости виден характерный признак «двойных пузырей», демонстрирующий пузырьки в желудке и расширенную проксимальную часть двенадцатиперстной кишки; это подтверждает диагноз (рисунок 1). Необходимо установить назогастральный зонд для непрерывного отсасывания желудочного содержимого и начать внутривенное введение жидкости.Операция требуется, но не срочно. Перед операцией может быть разрешена задержка от 24 до 48 часов для транспортировки, дальнейшего обследования и реанимации жидкости.
Просмотр / печать Рисунок
РИСУНОК 1.
Снимок брюшной полости в вертикальном положении с характерным признаком «двойного пузыря», который подтверждает диагноз атрезии двенадцатиперстной кишки. Обратите внимание на расширенный желудок (тонкая стрелка) и расширенный проксимальный отдел двенадцатиперстной кишки (толстая стрелка).
РИСУНОК 1.
Снимок брюшной полости в вертикальном положении с характерным признаком «двойного пузыря», который подтверждает диагноз атрезии двенадцатиперстной кишки. Обратите внимание на расширенный желудок (тонкая стрелка) и расширенный проксимальный отдел двенадцатиперстной кишки (толстая стрелка).
Ромбовидная дуоденодуоденостомия является стандартной процедурой при поражении прерывистого типа.1–5 Поражение мембранного типа лечится простым иссечением закупоривающей мембраны. Установка гастростомии или трансанастомотического зонда не требуется. Прогноз отличный, если у пациента нет серьезных врожденных аномалий.2–6
Мальротация и заворот средней кишки
Мальротация средней кишки — это анатомическая аномалия, которая позволяет средней кишке изгибаться по часовой стрелке вокруг верхних брыжеечных сосудов, закупоривая и, возможно, инфарктно поражая большую часть тонкой и толстой кишки. В норме третья часть двенадцатиперстной кишки проходит позади верхних брыжеечных сосудов по нижнему краю поджелудочной железы. Во время эмбриональной жизни толстая и тонкая кишки быстро растут и выходят из брюшной полости.На седьмой неделе беременности средняя кишка начинает сокращаться обратно в брюшную полость. Затем кишечник опускается в брюшную полость и вращается против часовой стрелки (если смотреть спереди), при этом слепая кишка останавливается в правом нижнем квадранте живота. Этот процесс завершается к 12 неделе беременности.
Однако по неизвестным причинам у пациентов с мальротацией средней кишки вращение прекращается после первых 90 градусов, и двенадцатиперстная кишка и восходящая ободочная кишка накладываются друг на друга вокруг верхних брыжеечных сосудов, при этом вся средняя кишка подвешена к этой узкой оси.Сам по себе мальротация кишечника не вызывает серьезных проблем. Однако из-за узкой оси средняя кишка может в любой момент повернуться вокруг оси, возможно, из-за перистальтического действия. Чем сильнее скручивание, тем больше средняя кишка страдает от закупорки просвета, препятствия венозному и лимфатическому возврату из средней кишки и препятствия артериальному притоку, что угрожает жизнеспособности средней кишки. Если не лечить своевременно, удушение кишечника приводит к ишемической потере обширного кишечника, вызывая синдром короткого кишечника.
У большинства пациентов с мальротацией средней кишки заворот кишечника развивается в течение первой недели жизни. Начальным симптомом является рвота желчью, но вздутие живота незначительно. Кишечник может быть вовлечен в удушение в любое время и в любом возрасте. Как только возникает ишемия средней кишки, развиваются нестабильная гемодинамика, трудноизлечимый метаболический ацидоз и некроз с перфорацией, что подвергает пациента критическому риску.
Неправильное положение верхних брыжеечных сосудов, выявленное при ультразвуковом исследовании, является диагностическим.7,8 Контрастное исследование верхних отделов желудочно-кишечного тракта (ЖКТ) может показать обструкцию во второй части двенадцатиперстной кишки. Тощая кишка может иметь спиралевидную конфигурацию (рис. 2). Обструкция меньшей степени может проявляться в виде двенадцатиперстной кишки, занимающей правое полушарие живота. После установления диагноза следует рассмотреть вопрос о неотложном хирургическом лечении. Заворот средней кишки связан с уровнем смертности 28 процентов.9 Плановая операция разрешена пациентам, которым случайно был поставлен диагноз контрастного исследования, проведенного по какой-либо другой причине.10
Просмотр / печать Рисунок
РИСУНОК 2.
Контрастное исследование верхних отделов желудочно-кишечного тракта, демонстрирующее типичную спиральную конфигурацию тощей кишки у пациента с заворотом кишечника.
РИСУНОК 2.
Контрастное исследование верхних отделов желудочно-кишечного тракта, демонстрирующее типичную спиральную конфигурацию тощей кишки у пациента с заворотом кишечника.
Во время операции обнаруживается, что фиброзная полоса, называемая «лентой Лэдда», проходит от забрюшинного пространства до неправильно расположенной слепой кишки через переднюю часть второй части двенадцатиперстной кишки.Эта полоса разделяется для снятия дуоденальной непроходимости. Сросшуюся брыжейку кишечника необходимо рассечь, чтобы расширить ее ось и предотвратить рецидив заворота. Во время этого рассечения верхние брыжеечные сосуды четко обнажаются и не должны травмироваться.
При своевременном проведении операции прогноз отличный.9 Если обширный кишечник ишемизирован из-за заворота, кишечник раскручивается и просто сокращается до брюшной полости, а рана брюшной полости закрывается.Двадцать четыре часа спустя живот снова вводят для «второго осмотра». В это время видна демаркация между некротизированным и жизнеспособным кишечником, что позволяет хирургу удалить некротизированный кишечник и создать энтеростому на дистальном конце нормального кишечника. Реконструкция кишечника выполняется позже.
Этот подход может спасти максимальную длину кишечника и избежать развития синдрома короткой кишки.11 В очень редких случаях мальротация кишечника может быть обнаружена у пожилых пациентов, у которых было несколько эпизодов боли в животе неустановленного происхождения.Контрастное исследование верхних отделов ЖКТ помогает в постановке этого диагноза. В этой ситуации следует рекомендовать профилактическое хирургическое лечение, чтобы избежать возможного катастрофического удушения кишечника позже.9
Атрезия тощей кишки
Атрезия тощей кишки вызвана повреждением мезентериального сосуда во время жизни плода. Заворот кишечника, инвагинация или внутренняя грыжа могут вызвать инфаркт сегмента кишечника плода, как показано экспериментально на животных.12 Атрезия тощей кишки анатомически подразделяется на четыре типа: (1) перепончатая, (2) прерывистая (Рисунок 3), (3) яблочная -корпус и (4) кратный.13 Симптомы и признаки идентичны независимо от типа поражения. Вздутие живота с рвотой желчью наблюдается в течение первых 24 часов после рождения. Чем проксимальнее поражение, тем раньше и серьезнее возникает рвота с окрашиванием желчью14. Снимки брюшной полости показывают уровни жидкости и воздуха проксимальнее поражения, что подтверждает диагноз кишечной непроходимости (рис. 4). В прошлом бариевая клизма была классическим диагностическим исследованием атрезии тощей кишки, но сегодня она не обязательно требуется для постановки диагноза, потому что результаты бариевой клизмы могут показаться нормальными у пациентов, у которых нарушение мезентериального сосуда произошло незадолго до рождения, что затрудняет постановку диагноза. .По нашему опыту, только 10% пациентов нуждались в этом исследовании для постановки диагноза15.
Просмотр / печать Рисунок
РИСУНОК 3.
Атрезия кишечника прерванного типа. Непрерывность кишечника прерывается между увеличенным проксимальным отделом кишечника (правая часть фото) и атрофическим дистальным отделом кишечника (левая часть фото).
РИСУНОК 3.
Атрезия кишечника прерывистого типа. Непрерывность кишечника прерывается между увеличенным проксимальным отделом кишечника (правая часть фото) и атрофическим дистальным отделом кишечника (левая часть фото).
Просмотр / печать Рисунок
РИСУНОК 4.
Пленка живота в вертикальном положении, показывающая вздутие кишечника с несколькими уровнями воздуха и жидкости, что указывает на атрезию нижней части кишечника.
РИСУНОК 4.
Пленка брюшной полости в вертикальном положении, показывающая вздутие кишечника с множественными уровнями воздуха и жидкости, указывающими на атрезию нижней части кишечника.
Перед операцией необходимо добиться декомпрессии желудка, внутривенной гидратации и коррекции электролитных нарушений.Для предоперационной подготовки допускается интервал от 12 до 24 часов. Во время операции для каждого типа поражения указывается своя хирургическая тактика. Как правило, реконструкция кишечника достигается с помощью анастомоза «конец в конец» (или «конец в бок») (или анастомозов при множественных атрезиях) 15,16. Прогноз обычно благоприятный, если не требуется чрезмерная резекция кишечника.
Меконий перитонит — это асептический перитонит, вызванный попаданием мекония в брюшную полость во время развития атрезии тощей кишки.Экстравазация мекония вызывает интенсивную химическую реакцию и реакцию на инородное тело с характерными кальцификациями, разрастанием сосудистых волокон и образованием кист. После установления диагноза требуется подготовка к возможной чрезмерной кровопотере во время операции. Мекониевый перитонит часто возникает в связи с мекониевой кишечной непроходимостью.17
Мекониум илеус
Мекониум илеус характеризуется задержкой толстого вязкого мекония в кишечнике (подвздошной, тощей или толстой кишке), что приводит к непроходимости кишечника.У одной половины пациентов с мекониевой непроходимостью кишечник не поврежден, и его непрерывность сохраняется.18 У других пациентов имеется ассоциированный заворот, атрезия тощей кишки, перфорация кишечника и / или мекониевый перитонит. Мекониальная кишечная непроходимость встречается у 15 процентов новорожденных с муковисцидозом, и только от 5 до 10 процентов пациентов с мекониевой непроходимостью муковисцидоза не наблюдается.19,20
Пораженный кишечник расширен из-за задержки мекония в течение жизни плода. После нескольких часов послеродовой жизни вздутие кишечника становится заметным из-за проглоченного воздуха и вызывает рвоту желчью.В некоторых случаях задержка мекония может вызвать дисторсию, вызывающую вздутие живота. При физикальном обследовании утолщенные петли кишечника часто видны и пальпируются через брюшную стенку. Значительное вздутие живота, болезненность и / или эритема кожи живота указывают на перфорацию, которая требует немедленного хирургического вмешательства.
Ректальное исследование часто затруднено, маленький диаметр прямой кишки не позволяет пальцу исследователя войти. Пробки слизи могут быть удалены после удаления пальца для исследования.На простых снимках брюшной полости видны расширенные петли кишечника с утолщенными стенками кишечника. Большое количество мекония, смешанного с проглоченным воздухом, вызывает так называемый признак «матового стекла», который типичен для мекониевой непроходимости. Кальцификация, свободный воздух или очень высокий уровень жидкости в воздухе предполагают перфорацию кишечника, которая требует срочного хирургического вмешательства. Контрастная клизма демонстрирует микроколонку (рис. 5). Рефлюкс контраста в подвздошную кишку демонстрирует пробки, расположенные в дистальном отделе тонкой кишки. Тонкая кишка узкого калибра дистальнее мекониевой пробки и расширена проксимальнее мекониевой пробки.
РИСУНОК 5.
Мекония кишечная непроходимость. Контрастная клизма демонстрирует микроколонку.
Пациенты с неосложненной мекониальной непроходимостью кишечника могут быть успешно вылечены с помощью клизмы с диатризоатом маглумина (гастрографина), выполняемой при адекватном внутривенном введении жидкости. Гипертонус рентгеноконтрастного агента (1900 мОсм на литр) втягивает жидкость в кишечник, облегчая прохождение и изгнание вязкого мекония.21 Это лечение успешно у 16-50 процентов пациентов.
Если клизма с гастрографином оказалась безуспешной, показана лапаротомия для удаления закупоривающего мекония путем энтеротомической ирригации. Немедленная операция показана пациентам с осложненной мекониевой кишечной непроходимостью. Показана резекция кишечника по поводу перфорации и / или непроходимости, связанной с перегибом кишечника, обычно требующей временной энтеростомии.
Некротический энтероколит
Некротический энтероколит — быстро прогрессирующее катастрофическое заболевание, вызывающее обширный некроз, инфекцию и перфорацию кишечника у новорожденных.Этиология неизвестна, хотя сообщалось о нескольких вероятных причинах22. Недоношенность и легочные заболевания являются частыми предрасполагающими факторами.23,24 Обычно начинаются в возрасте от 10 до 12 дней с симптомами задержки желудка, рвоты желчью, кишечной непроходимости, брюшной полости. вздутие живота и кровавый стул. Брадикардия, переохлаждение, приступы апноэ и гипотония — более поздние признаки прогрессирующего ухудшения. Патологическое кровоизлияние, гипербилирубинемия и олигурия являются поздними находками.
Физические признаки включают эритему и отек брюшной стенки, отсутствие звуков кишечника, вздутие живота, видимые и / или пальпируемые петли кишечника, охрану и летаргию.Следует иметь в виду, что физические данные не всегда или точно отражают кишечную катастрофу, особенно у слабого недоношенного ребенка.
Снимки брюшной полости, снятые с интервалом от шести до восьми часов вначале и ежедневно в последующие семь-десять дней, помогают в диагностике и оценке клинического прогресса. Растянутые петли с утолщенной стенкой кишечника, цистоидный пневматоз кишечника, воздух в воротной вене и / или свободный воздух — это рентгенологические данные (рис. 6).Ежедневное изменение газового состава кишечника является хорошим прогностическим признаком, поскольку исключает непроходимость кишечника и некроз кишечника. После постановки диагноза следует начать декомпрессию желудка и внутривенное введение жидкости и антибиотиков. Полный анализ крови, определение pH артериальной крови и газов крови, а также анализ электролитов являются обязательными. Хирургическое вмешательство показано при появлении свободного газа в брюшной полости или клинического ухудшения. 24–28 Неизлечимый метаболический ацидоз и тромбоцитопения также являются критическими признаками ишемии кишечника, указывающими на хирургическое лечение.29
Просмотр / печать Рисунок
РИСУНОК 6.
Снимок брюшной полости, показывающий пневматоз cystoides Кишечник в правом нижнем квадранте у новорожденного с некротическим энтероколитом.
РИСУНОК 6.
Снимок брюшной полости, показывающий пневматоз cystoides Кишечник в правом нижнем квадранте у новорожденного с некротическим энтероколитом.
В нашем учреждении 422 пациента с некротическим энтероколитом (обследованы в период с 1978 по 1993 год) лечились по единому протоколу декомпрессии желудка и внутривенного введения жидкости, питания и антибиотиков в течение 10 дней.Семьдесят пять процентов пациентов получили медицинское лечение, и 95 процентов выжили. Остальным 25 процентам пациентов была проведена операция по отведению фекального потока путем создания энтеростомии с выживаемостью 65 процентов (неопубликованные данные авторов).
Последствия дисбактериоза кишечника для человеческого мозга
1. Введение в ось мозг-кишечник-микробиом
Микробиом человека возник как сущность, оказывающая огромное влияние на здоровье и болезни.[1] — Бактерии в желудочно-кишечном тракте выполняют широкий спектр симбиотических функций для своего хозяина, который варьируется от переваривания и производства биоактивных метаболитов до влияния на здоровое развитие и функцию иммунной системы [1, 2]. Все эти локальные воздействия на желудочно-кишечный тракт обладают способностью воздействовать на мозг через нейронные связи, такие как блуждающий нерв, и эндокринными средствами [3, 4]. Осознание этого двустороннего взаимодействия между кишечником и мозгом теперь дало больше объяснений некоторым состояниям, иначе называемым « функциональными расстройствами », а также заложило благодатную почву для открытия новых методов лечения, модулирующих микробиом при лечении заболеваний ЦНС. [5–7].
Значительное развитие микробиома начинается во время доставки. Вагинально рожденные младенцы колонизируются материнскими фекальными и вагинальными микроорганизмами, тогда как младенцы, рожденные путем кесарева сечения, колонизируются флорой кожи [8, 9]. Хотя существует догма о том, что внутриутробная среда внутриутробного развития стерильна, это мнение было поставлено под сомнение в результате ряда открытий, в первую очередь о том, что меконий содержит колонии бактерий. Следовательно, это означает, что влияние микробиома может распространяться и на пренатальный период [10, 11].После рождения микробиом адаптируется к таким факторам, как диетическое питание, использование антибиотиков и условия жизни. Поскольку ЦНС и микробиом развиваются параллельно, значительные изменения в микробиоте происходят в критические периоды времени развития нервной системы [12, 13]. Таким образом, нарушения эволюционного развития микробиома могут иметь длительное влияние на здоровое развитие мозга, а — наоборот, из-за тесного взаимодействия между двумя системами.
Термин «дисбактериоз» относится к дисбалансу микроорганизмов в микрофлоре слизистой оболочки.Печеночная энцефалопатия является типичным примером того, как дисбактериоз желудочно-кишечного тракта может привести к повреждению ЦНС. Цирроз печени приводит к отчетливой микробиоте, которая значительно отличается от здоровых контрольных субъектов [14]. Накопление токсичных медиаторов, таких как аммоний, продуцируемых бактериями, продуцирующими уреазу, попадает в портальную циркуляцию. Концентрации аммония в крови повышаются, преодолевают гематоэнцефалический барьер и накапливаются в головном мозге, что приводит к повреждению астроцитов и отеку головного мозга [15-17]. Однако любопытно, что лечение пероральным антибиотиком рифаксимином не вызывает клинического улучшения за счет изменения пропорций бактерий в микробиоме, а скорее, улучшение эндотоксемии и когнитивных функций, по-видимому, происходит за счет модуляции метаболизма бактерий [18–21].Следовательно, нарушения микробиома, которые приводят к дисфункции ЦНС, не ограничиваются конституционными изменениями, но также могут зависеть от его метаболической активности.
2. Влияние микробиома на рассеянный склероз
2.1. Эпидемиология и патогенез
Рассеянный склероз (РС) является наиболее распространенным демиелинизирующим заболеванием ЦНС и классически описывается приобретением дискретных демиелинизирующих бляшек в сером и белом веществе ЦНС [22–24].Острая бляшка MS характеризуется инфильтрацией воспалительных клеток с сопутствующей демиелинизацией и отеком [25]. Наблюдаются периваскулярные лимфоцитарные манжеты, состоящие преимущественно из Т-клеток. Существует реактивный астроглиоз с различным уровнем апоптоза олигодендроцитов внутри бляшки [26]. Со временем бляшки становятся склеротическими, представляя собой последнее патологическое событие в этом месте после периода выраженного воспаления, астроглиоза, демиелинизации, ремиелинизации и потери аксонов.
Несмотря на эту общую патологическую отличительную черту болезни, РС весьма неоднороден с точки зрения клинической картины и прогноза [27]. Более того, точный патогенез все еще остается плохо изученным, хотя ясно, что и генетика, и окружающая среда имеют существенное влияние на начало рассеянного склероза, и между этими элементами существует сложное взаимодействие [28, 29]. Безусловно, воспаление играет ключевую роль в патофизиологии заболевания. Большинство исследователей отдают предпочтение аутоиммунной гипотезе, согласно которой активируются аутореактивные иммунные клетки, нацеленные на миелиновые антигены, вероятно, под воздействием окружающей среды [30].
Исследования миграции позволили понять, как изменения окружающей среды могут влиять на риск развития РС. Как правило, население, находящееся дальше от экватора, имеет повышенный риск развития рассеянного склероза, чем население, расположенное ближе к экватору [31, 32]. Многие исследования показали, что люди, мигрирующие из районов высокого риска в районы низкого риска, могут подвергаться устойчивому риску, если миграция произошла после определенного критического возраста [33]. И наоборот, если миграционный возраст меньше критического возраста, человеку присваивается риск перехода в новый регион.Известно, что микробиом человека демонстрирует большие географические различия между популяциями, а местная среда оказывает заметное влияние на развитие микробиоты [34, 35]. Учитывая, что микробиота влияет на развитие нервной системы и иммунитет на ранних этапах жизни, можно предположить, что это может объяснить, почему предполагаемый миграционный риск РС зависит от возраста.
Первое предположение о том, что рассеянный склероз может быть связан с гигиеническими условиями жизни, было сделано Liebowitz et al. в 1966 г. [36].Изучив степень переполненности жилищных условий, они обнаружили, что заболеваемость РС была выше в тех, которые были более гигиеничными. Гипотеза гигиены, сформулированная позже Страчаном в 1989 г., предполагала, что аллергия и аутоиммунные заболевания являются, по крайней мере частично, следствием неадекватной иммунной стимуляции против патогенов в первые годы жизни, что вызывает аберрантные реакции на себя в более поздние годы [37, 38].
Одна эпидемия РС произошла во время британской оккупации Фарерских островов во время Второй мировой войны.До прибытия британских войск в 1940 году не было зарегистрировано ни одного зарегистрированного случая РС у фарерцев, уроженцев островов. После 1943 г. было четыре эпидемии рассеянного склероза, и пациенты находились в непосредственной близости от британских лагерей [39, 40]. Был сделан вывод, что каким-то образом британские войска занесли на острова неизвестный патогенный организм. Интересно, что заболеваемость несколькими инфекциями увеличилась во время работы, что совпало с эпидемиями рассеянного склероза, особенно гастроэнтеритом и эпидемическим паротитом, что позволяет предположить связь между рассеянным склерозом и дисбактериозом [41].
Помимо географической предрасположенности к РС, другие факторы риска, такие как ожирение, курение сигарет, женский пол и низкий уровень витамина D, все связаны с различиями в составе и / или метаболической активности микробиоты [42–49]. Эти эпидемиологические данные указывают на потенциальную роль микробиома человека в предрасположенности к РС.
2.2. Бактериальный дисбиоз и MS
Некоторые из первоначальных указаний на то, что микробиота желудочно-кишечного тракта может играть роль в патогенезе рассеянного склероза, возникли в результате работы над экспериментальным аллергическим энцефаломиелитом (EAE) у мышей, свободных от микробов (GF).На протяжении десятилетий ЕАЕ широко использовался в качестве модели демиелинизирующего заболевания на животных, при котором воздействие миелиновых компонентов ЦНС, таких как гомогенат спинного мозга или специфические белки миелина, запускает опосредованный Т-клетками аутоиммунный ответ, который приводит к демиелинизации ЦНС [50, 51]. Хотя есть сходство с рецидивирующим ремиттирующим РС, есть заметные различия, которые были рассмотрены в другом месте (см. Подробный обзор у Шрирама и Штайнера [50]).
Доказательства того, что микробиота кишечника может влиять на аутоиммунитет, были собраны в экспериментах, которые сравнивали животных, содержащихся в обычном помещении, с нормальным составом микробиоты [также известной как свободная от специфических патогенов (SPF) или традиционно колонизированная (CC)] и животных, содержащихся в стерильных окружающая среда [животные без микробов (GF)], что исключает возможность постнатальной колонизации их желудочно-кишечного тракта.Отсутствие кишечной микробиоты при рождении влияет на лимфоидную ткань, ассоциированную с кишечником (GALT), так что у мышей GF появляются гипопластические бляшки Пейера и мезентериальные лимфатические узлы. Кроме того, лимфатические узлы имеют меньше зародышевых центров и плазматических клеток, продуцирующих IgA, чем обычно присутствует в контроле [49, 52]. Помимо желудочно-кишечного тракта, селезенка и лимфатические узлы также развиты слабо [53]. Это недоразвитие лимфоретикулярной системы объясняет, почему мыши GF более склонны к инфекции и почему снижается риск развития аутоиммунного заболевания [54].Было показано, что микробиом кишечника влияет на вероятность развития EAE у мышей GF и SPF. Berer et al. показали, что у мышей SJL / J, которые имеют аутореактивные CD4 Т-клетки по отношению к белку миелиновых олигодендроцитов, присутствие микробиоты GI способствует развитию EAE [55]. Кроме того, отсутствие микроорганизмов GI у мышей GF и связанная с этим ограниченная продукция клеток T H 17 в желудочно-кишечном тракте и селезенке, по-видимому, защищает от EAE в отличие от контроля [56, 57].Когда сегментированные нитчатые бактерии, которые, как известно, индуцируют продукцию клеток T H 17, инокулируют мышам GF, у этих животных развивается EAE с антигенной стимуляцией, демонстрируя, что определенные виды бактерий в микрофлоре кишечника могут предрасполагать к аутоиммунному демиелинизирующему заболеванию [ 56].
Несколько исследований продемонстрировали изменения в численности различных бактериальных таксонов при РС по сравнению с контролем. Miyake et al. исследовали образцы кала, собранные во время фазы ремиссии у пациентов с рецидивирующим ремиттирующим РС, и выявили 21 вид, которые значительно различались по относительной численности [58].Четырнадцать из этих видов принадлежали к кластерам Clostridia XIVa и IV, которые были редуцированы у пациентов с рассеянным склерозом и признаны имеющими противовоспалительную роль [59]. Кроме того, виды Bacteriodes и Prevotella были менее распространены при РС, хотя их точное патогенное значение еще не определено. Следует отметить, однако, что они не обсуждали возможное вмешивающееся влияние медикаментозной терапии, которая могла быть назначена этим пациентам.
Rumah et al.идентифицировал Clostridium perfringens типа B в стуле пациента через 3 месяца после появления симптомов РС [60]. C. perfringens B обладает способностью продуцировать эпсилон-токсин (ETX), который может преодолевать гематоэнцефалический барьер и проявлять токсичность для олигодендроцитов, обеспечивая тем самым возможный механизм демиелинизации при РС [61, 62]. Их анализ также выявил снижение частоты встречаемости C. perfringens A в желудочно-кишечном тракте пациентов с РС и что реактивность ЕТХ была в десять раз чаще, чем в контроле.Другая группа идентифицировала значительно увеличенное количество архей ( Methanobrevibacteriaceae, ) при РС по сравнению с контролем [63]. Methanobrevibacter smithii считается сильно иммуногенным и может вызывать воспаление у хозяина. Те же исследователи также идентифицировали несколько организмов, обладающих противовоспалительным действием и в меньшей степени встречающихся при РС. Значительные различия в микробиоте у Proteobacteria , такие как обогащение Shigella и Escherichia , также наблюдались при педиатрическом РС по сравнению с контролем [64].
2.3. Вирусная этиология
Многие вирусы считаются факторами риска развития РС [65]. Возможно, наиболее обсуждаемым был вирус Эпштейна-Барра (EBV), который может присутствовать в микробиоме полости рта и передаваться через слюну [66]. Люди являются обязательными хозяевами для ВЭБ, и, хотя многие здоровые люди из контрольной группы инфицированы, почти все пациенты с РС имеют серопозитивность по ВЭБ [67]. Кроме того, инфекционный мононуклеоз (ИМ) в результате ВЭБ-инфекции удваивает риск развития РС.Аналогичным образом, недавний метаанализ выявил значительную связь между положительностью IgG к EBNA (ядерному антигену EBV), инфекционным мононуклеозом и курением в повышении риска развития РС [68–70].
Несколько результатов исследований выявили присутствие EBV в B-клетках пациентов с РС. Одно исследование выявило присутствие латентных белков EBV, экспрессируемых в фолликулах B-клеток в мозговых оболочках, и что инфильтрирующие B-клетки были инфицированы EBV [71].Интересно, что спинномозговая жидкость (CSF) при MS обычно связана с олигоклональными полосами, которые являются продуктом секреции IgG клонально размноженными B-клетками [72]. Скрининг этих олигоклональных антител выявил BRRF2 и EBNA-1, которые являются белками, связанными с EBV, в качестве возможных мишеней иммунного ответа CSF IgG [73]. Как именно ВЭБ вписывается в патогенез РС, еще предстоит определить; однако его связь с микробиомом полости рта при РС очевидна.
2.4. Нарушение защиты микробиома от РС при заражении гельминтами
Некоторые глистные инфекции, по-видимому, снижают риск развития РС [74].Инфекция Trypanosoma cruzi и Paracoccidiodes brasiliensis у пациентов с РС вызывает выработку лимфоцитами большего количества интерлейкина-10 (IL-10) и нейротрофических факторов, таких как нейротрофический фактор головного мозга (BDNF) и фактор роста нервов (NGF). , по сравнению с контролем [75]. При РС обычно наблюдается небольшое количество секреции ИЛ-10, благоприятствующее ответу T H 1, а не ответу T H 2, как при глистных инфекциях [76]. Trichuris suis — гельминт, который эффективен при пероральном введении при воспалительном заболевании кишечника (ВЗК). Лечение этим гельминтом при рассеянном склерозе связано с повышением уровня IL-4 и IL-10, а также радиологическим улучшением результатов МРТ [77]. Другая группа продемонстрировала снижение IFN-γ и IL-2, а также увеличение IL-10 и IL-4 при вторичном прогрессирующем РС после введения Trichuris suis , что свидетельствует о сдвиге в сторону ответа T H 2 [78 ]. Таким образом, терапевтические манипуляции с микробиомом кишечника, которые способствуют общему противовоспалительному фенотипу, по-видимому, имеют большие перспективы в лечении РС.В этой области необходимы дополнительные данные испытаний, чтобы оценить его эффективность и безопасность.
3. Болезнь Паркинсона (БП)
БП обычно проявляется брадикинезией, постуральной нестабильностью и тремором в состоянии покоя, который возникает в результате прогрессирующей нейродегенерации в базальных ганглиях, которая связана с аномальным накоплением альфа-синуклеина и образованием телец Леви [79, 80] . До недавнего времени считалось, что БП возникает в ЦНС, при которой патологический белок α-синуклеин распространяется от дорсального моторного ядра блуждающего нерва, вовлекая базальные ганглии, а затем и полушария головного мозга [81].Однако с тех пор характерная патология была обнаружена в тканях за пределами ЦНС. В настоящее время общепризнано, что запор с замедленным транзитом является частой находкой, которая предшествует моторным симптомам при БП и может присутствовать за много лет до постановки диагноза [82–84].
Результаты аутопсии и исследований хирургической патологии продемонстрировали присутствие фосфорилированного α-синуклеина в подъязычных железах и в сплетениях Ауэрбаха и Мейснера кишечной нервной системы [85–87]. В соответствии с этими данными, патология ЖКТ и сопутствующие симптомы предшествуют двигательным особенностям как минимум на 2 года [88, 89].Передача α-синуклеина от нейрона к нейрону была элегантно показана на модели PD на животных с ротеноном, где прием ротенона вызывает высвобождение α-синуклеина и ретроградное распространение к стволу мозга; Однако гемитрансекция блуждающего нерва защищает от патологии ипсилатерального синуклеина [90]. Точно так же нейрональная передача α-синуклеина происходит в мезэнцефальных трансплантатах плода человека от пациентов с БП, у которых α-синуклеин обнаруживается в пересаженных клетках при посмертном исследовании [91, 92].Таким образом, блуждающий нерв может действовать как канал для протеопатического распространения α-синуклеина от периферии к стволу мозга. В новом ретроспективном исследовании Svensson et al. показали снижение риска БП у пациентов, перенесших туловищную ваготомию, по сравнению с суперселективной ваготомией, а также между туловищной ваготомией и общей популяцией [93]. Хотя исследование не достигло статистической значимости, полное прекращение нейронной двунаправленной коммуникации между желудочно-кишечным трактом и мозгом может быть полезным для предотвращения протеопатического распространения α-синуклеина и, следовательно, предотвращения нейродегенерации БП, которая в противном случае могла бы быть неизбежной.
Некоторые данные позволяют предположить, что микробиом участвует в БП. Scheperjans и его коллеги продемонстрировали в исследовании случай-контроль БП, что видов Prevotellaceae были значительно сокращены, в то время как видов Enterobacteriaceae и видов были увеличены у пациентов с преобладанием моторной, а не преобладающей тремором болезни [94]. Кроме того, количество Enterobacteriaceae коррелировало со степенью постуральной нестабильности. Однако остается вопрос, является ли дисбиоз следствием или причиной нарушения моторики желудочно-кишечного тракта, а также как это может влиять на продукцию, агрегацию или высвобождение α-синуклеина в желудочно-кишечном тракте.Независимо от значения микробиома в патогенезе БП, избыточный бактериальный рост, который происходит у части пациентов с нарушением моторики ЖКТ, может влиять на симптоматический ответ на медикаментозное лечение. Нарушение всасывания лекарств, в частности леводопы, является вероятной причиной повышенных двигательных колебаний, наблюдаемых при этом дисбактериозе. Введение рифаксимина показало улучшение в этих случаях [95, 96].
Микробиота полости рта и носа также может иметь отношение к болезни Паркинсона и требует исследования.Ядро языкоглоточного нерва содержит отложения α-синуклеина, и, как и блуждающий нерв, языкоглоточный нерв может выступать в качестве пути периферического проникновения патологии БП в мозг. Кроме того, обонятельная луковица часто поражается патологией БП до появления двигательных симптомов, и это является объяснением часто продромальной аносмии [97]. Имеется ли дисбактериоз полости рта или носа, еще предстоит установить, но это может дать ключ к разгадке того, почему патология БП возникает в этих других периферических анатомических участках.
4. Роль микробиома в психических заболеваниях
Воздействие микробиома желудочно-кишечного тракта на поведение человека и психические заболевания является сложным, но есть несколько наблюдений, которые демонстрируют сильную связь между этими двумя сущностями. Во-первых, тревога и депрессия часто сосуществуют с хроническими заболеваниями кишечника [98–102]. Во-вторых, мышиные модели инфекции ЖКТ демонстрируют повышенный уровень тревожного поведения и изменения биохимии ЦНС [103]. В-третьих, десятилетия назад было осознано, что стресс, возникающий в раннем или более позднем возрасте, может изменить микробный состав кишечника [104].Более поздние исследования, проведенные на животных моделях и пациентах-людях, углубились в эти ассоциации и попытались выяснить, как комменсальный микробиом влияет на поведение.
Гипоталамо-гипофизарно-надпочечниковая ось (HPA) является фундаментальной для реакции на стресс, и эндокринные нарушения этой оси связывают с депрессией и тревогой. У пациентов с тяжелой депрессией гиперактивация оси HPA вызывает гиперсекрецию катехоламинов, кортикотропин-рилизинг-фактора (CRF) и вазопрессина [105].У пациентов с депрессией часто наблюдается повышенный уровень кортизола в плазме, повышенная концентрация CRF в спинномозговой жидкости и повышенная лимбическая концентрация CRF [106, 107]. Судо и др. провели первое исследование, чтобы продемонстрировать участие микробиома кишечника в нормальном развитии оси HPA [108]. Было показано, что у мышей GF в ответ на стресс наблюдается повышенный уровень адренокортикотропного гормона (АКТГ) и кортикостерона (доминирующего глюкокортикоида у грызунов) в плазме по сравнению с мышами SPF [108, 109].Однако, когда этим мышам был привит Bifidobacterium infantis , вид бактерий, обнаруживаемый в кишечнике младенца, преувеличенная реакция на стресс нормализовалась. Важно отметить, что эта реверсия произошла только тогда, когда бактериальная инокуляция произошла к 6 неделям postnatum , что указывает на окно восприимчивости нервного развития к эффектам этого взаимодействия бактерия-хозяин [108].
Другие исследования были посвящены влиянию микробиома на поведение и биохимию мозга.Одна из проблем при интерпретации результатов этих отчетов заключается в том, что они различаются по линии, полу и происхождению животных, а также по общему дизайну эксперимента. Несмотря на эти различия, очевидно, что микробиом влияет как на поведение, так и на нейробиологию мозга. Что касается поведения, большинство исследований, сравнивающих GF и SPF мышей, сообщают о снижении тревожного поведения у GF мышей, несмотря на преувеличенную реакцию оси HPA на острый стресс [109–111]. Однако единственным заметным исключением на мышах было исследование Nishino et al.[112]. Эта группа сравнила мышей GF с мышами-гнотобиотиками, которые являются мышами, рожденными в стерильных условиях от родителей, которых кормили стулом мышей SPF, и обнаружила, что мыши ex-GF менее тревожны. В этой модели перенос бактерий вида Brautia coccoides снижает тревожное поведение [112].
Еще одно свидетельство микробного влияния на поведение связано с переносом микробиоты между линиями мышей с разными по своей природе поведенческими фенотипами. В исследовании Bercik et al.колонизация мышей GF кишечными бактериями от мышей-доноров с различными фенотипами тревожности передала поведенческий фенотип донора реципиенту [113]. Опять же, оказывается, что существует критический момент времени нервного развития, до которого поведенческие профили могут быть изменены, поскольку взрослые мыши GF, колонизированные фекалиями SPF, сохраняют анксиолитический поведенческий фенотип мышей GF [110].
Исследования на животных, в которых изучалась нейрохимия мозга и изучались концентрации моноаминов и скорость обмена, дали некоторое представление об объяснении этих поведенческих явлений.Известно, что изменения центральной нейротрансмиссии моноаминов, особенно серотонина (5-HT), норадреналина (NE) и дофамина (DA), играют роль в возникновении тревоги и депрессии [114–119]. Как можно было бы предсказать на основании их поведенческих паттернов, мыши ex-GF обнаруживают более высокие скорости обмена NE и DA и имеют более высокие концентрации 5-HT в полосатом теле, чем их аналоги GF [112]. Более того, у чувствительных к стрессу крыс, которые проявляют тревожное поведение, когда GF имеет пониженный обмен DA в лобной коре, полосатом теле и гиппокампе, чем крысы SPF [120].Многие исследования, изучающие передачу моноаминов, также исследуют уровни триптофана, поскольку триптофан необходим для синтеза 5-HT и может быть низким при депрессии [121]. Кинуренин, метаболит триптофана, увеличивается при депрессии, а соотношение кинуренин: триптофан в крови коррелирует с тревогой [103, 122, 123]. Соответственно, у менее тревожных мышей GF наблюдается пониженное соотношение кинуренин: триптофан и повышенные концентрации триптофана в плазме по сравнению с более тревожными мышами SPF [109].У самцов мышей GF наблюдается значительное увеличение концентраций 5-HT и 5-гидроксииндолуксусной кислоты (5-HIAA) в зависимости от пола. Примечательно, что снижение тревожности, наблюдаемое у животных GF, нормализуется после микробной колонизации, а также нормализации как концентраций триптофана, так и соотношения кинуренин: триптофан. Интересно, однако, что повышенная концентрация 5-HT и 5-HIAA у GF-животных остается устойчивой к колонизации [109]. Используя масс-спектрометрию, Matsumoto et al. проанализировали церебральный метаболом мышей GF и мышей ex-GF и идентифицировали 38 метаболитов, которые значительно различались [124].Примечательно, что концентрации DA в GF были в два раза выше, чем у мышей ex-GF; согласуется с выводами о том, что мыши GF демонстрируют повышенную двигательную активность и пониженное тревожное поведение по сравнению с их аналогами из ex-GF. В головном мозге мышей GF концентрация триптофана была снижена, но исследование не выявило различий в уровнях 5-HT.
Различные рецепторы, известные роли в депрессии и тревоге, находятся под влиянием микробиома. Например, рецептор 5HT1A, связанный с тревогой, снижает экспрессию в слое зубчатых гранул гиппокампа у самок мышей GF [111].Рецепторы N-метил-D-аспартата (NMDA) важны для обучения и памяти. Судо и др. сообщили о снижении регуляции мРНК субъединицы 2A рецептора NMDA (NR2A) в коре и гиппокампе мышей GF по сравнению с мышами SPF [108]. Neufeld et al., Однако, не обнаружили различий в субрегионах гиппокампа при in situ гибридизации, а скорее продемонстрировали снижение экспрессии мРНК субъединицы 2B рецептора NMDA (NR2B) в центральной миндалине мышей GF [111]. Кроме того, мРНК рецептора DA D1 была значительно выше в гиппокампе мышей GF, чем у мышей SPF [110].
У пациентов с депрессией нейрогенез гиппокампа снижается вместе с уровнями BDNF, и недавние данные показывают, что повышенный уровень BDNF в гиппокампе связан с анксиолитическим и антидепрессивным поведением [125]. В исследованиях мышей GF точное влияние микробиома на BDNF не определено; некоторые исследования показывают повышенную экспрессию BDNF в гиппокампе, в то время как другие показывают обратное как на уровне мРНК, так и на уровне белка. Различия в BDNF, по-видимому, связаны с полом, при этом снижение BDNF наблюдается в основном у самцов GF животных, а не у самок [108, 109, 111].Heijtz et al. показали, что у мышей GF экспрессия мРНК клона А, индуцируемого фактором роста нервов (NGFI-A), вовлеченного в развитие тревожного поведения, была значительно ниже в орбитальной лобной коре, полосатом теле, гиппокампе, зубчатой извилине и миндалевидном теле. по сравнению с мышами SPF [110]. Эти исследования подчеркивают роль нейротрофических факторов в оси микробиом-кишечник-мозг и их влияние на тревогу и депрессию, а также указывают на то, что регуляция этой оси может зависеть от пола.Микробиом также, по-видимому, оказывает более широкое влияние на нейробиологию, о чем свидетельствует исследование миндалевидного тела, которое показало измененный транскриптом в GF по сравнению с мышами SPF. В частности, у мышей GF наблюдается повышенная регуляция генов немедленного раннего ответа с дифференциальной экспрессией генов, участвующих в нейротрансмиссии, пластичности и метаболизме [126].
4.1. Лечение, изменяющее микробную флору
4.1.1. Пробиотики
Связи между микробиомом и поведением подкрепляются исследованиями с использованием пробиотической терапии, которая изменяет микробную среду кишечника за счет приема живых бактериальных культур.Появляется все больше свидетельств того, что определенные штаммы способны ослаблять различные поведенческие и биохимические эффекты стресса. Взрослые крысы, получавшие Lactobacillus helveticus NS8, демонстрируют снижение вызванной стрессом тревоги и депрессии, что сопоставимо с терапией циталопрамом [127]. Биохимически эти крысы имели более низкие концентрации кортикостерона и АКТГ в плазме, повышенные концентрации моноаминов в гиппокампе и транскрипцию BDNF, а также более высокие уровни плазменного IL-10, противовоспалительного цитокина, который снижается у пациентов с депрессией [127].Точно так же пробиотический состав L. helveticus R0052 и B. longum R0175 ослаблял ответ на хронический стресс, снижая уровни кортикостерона, адреналина и NE в плазме [128]. Кроме того, пробиотики B. longum 1714 и B. breve 1205 обладают анксиолитическим действием у мышей [129]. Пробиотики с B. infantis , ранее обсуждавшиеся как способные обратить вспять чрезмерную стрессовую реакцию у мышей GF, показали различные результаты на крысах; один показал ослабление поведенческих и биохимических аномалий, связанных с разлучением с матерью, а другой показал минимальные поведенческие эффекты, несмотря на изменения в уровнях различных цитокинов и метаболитов [130, 131].
Хроническое лечение L. rhamnosus (JB-1) у мышей снизило уровень кортикостерона, вызванного стрессом, а также поведение, связанное с тревогой и депрессией, и вызвало изменения в гамма-аминомасляной кислоте [ГАМК (B1b) и ГАМК (Aα2) ] мРНК рецептора в определенных областях мозга [132]. Интересно, что эти данные не были обнаружены у мышей, подвергнутых ваготомии [132]. Известно, что блуждающий нерв опосредует связь между микробиотой кишечника и осью HPA с повышением концентрации мРНК CRF, АКТГ в плазме и кортикостерона у грызунов после стимуляции блуждающего нерва [133].Кроме того, у людей стимуляция блуждающего нерва оказывает антидепрессивное действие, включая нормализацию оси HPA [134, 135]. У мышей JB-1 увеличивал частоту возбуждения пучка брыжеечных нервов, что предотвращалось поддиафрагмальной ваготомией [133]. Точно так же в модели мышей, в которой хронический легкий DSS-колит вызывает тревожное поведение, B. longum NCC3001 нормализовал тревожное поведение и изменения ЦНС, вызванные хроническим воспалением кишечника, но не у мышей, перенесших ваготомию [136].Сходные результаты были получены на модели T. muris паразита хронической толстой кишки, что дополнительно подтверждает нервно-опосредованный механизм пробиотического эффекта [103].
С иммунологической точки зрения Smith et al. продемонстрировали, что Рекомбинация активирует ген-1 ( Rag1 ) с нокаутом мышей, которые являются дефицитными по В- и Т-клеткам, имели дисбиоз, измененное поведение и повышенную активность оси HPA [137]. При предварительной обработке L. rhamnosus (R0011) и L. helveticus (R0052), микробиота и поведенческие изменения были нормализованы [137]. У крыс инфаркт миокарда (ИМ) сопровождается усилением клеточного апоптоза лимбической системы и депрессивным поведением [138]. В этой модели введение пробиотиков, которые объединили L. helveticus и B. longum , улучшило депрессию после инфаркта миокарда за счет снижения провоспалительных цитокинов и восстановления целостности барьера в желудочно-кишечном тракте [139].Интересно, что используя мышь с нокаутом IL-10, которая является моделью воспаления толстой кишки, аналогичной IBD, Ohland et al. показали, что принятый рацион и наличие или отсутствие воспаления в желудочно-кишечном тракте могут влиять на эффективность пробиотиков [140]. Это предполагает роль иммунных клеток в здоровье кишечника и поведении грызунов. В совокупности эти исследования полностью подтверждают роль пробиотических штаммов в модуляции различных аспектов функции и поведения мозга, некоторые из которых, по-видимому, по крайней мере частично зависят от блуждающего нерва.
4.1.2. Пребиотики
Пребиотики — это пищевые компоненты, которые модулируют микробиоту, увеличивая рост пробиотических микробов, и использовались в нескольких исследованиях для дальнейшего определения роли микробиома в поведении. Олигосахариды грудного молока (HMO) способствуют росту определенных бактерий, включая пробиотические представители рода Bifidobacterium и Lactobacillus . Мыши, получавшие пребиотик, содержащий олигосахариды грудного молока 3’сиалиллактозу (3’SL) или 6’сиалиллактозу (6’SL), демонстрировали менее тревожное поведение и меньшее изменение микробиоты в ответ на стресс [141].Пребиотики, фруктоолигосахарид (FOS) и галактоолигосахариды (GOS) способствовали росту Lactobacilli и Bifidobacteria в кишечнике и повышали экспрессию субъединиц BDNF и NR1 в гиппокампе по сравнению с контролем. GOS также увеличивает субъединицы NR2A гиппокампа и экспрессию NR1 во фронтальной коре и увеличивает плазменный D-аланин, который действует как агонист рецептора NMDA [142]. Эти исследования показывают, что опосредованное пребиотиками разрастание кишечной микробиоты, как и пробиотики, может влиять на нейрохимию мозга и поведение животных.
4.1.3. Противомикробные препараты
Введение пероральных, но не внутрибрюшинных, противомикробных препаратов (неомицин, бацитрацин и пимарицин) мышам SPF увеличивало долю популяций Lactobacilli и Actinobacteria , уменьшая при этом долю γ-протеобактерий и ? популяции [113]. Эти изменения микробиоты были связаны с улучшением стандартизированных тестов на менее тревожное поведение, эффекты, которые были обратимы после прекращения противомикробной терапии и возврата к профилям микробиоты до лечения.Эти изменения не зависели от воспаления, уровней нейромедиаторов желудочно-кишечного тракта и целостности нервной системы.
4.2. Данные исследований на людях
4.2.1. Разнообразие микробов среди различных популяций
Поперечные исследования на людях начали изучать микробный состав кишечника и его связь с настроением. Naseribafrouei et al. проанализировали образцы фекалий пациентов с депрессией и контрольной группы и не обнаружили общей значимой разницы в видовом разнообразии между депрессивными и недепрессивными образцами, а скорее общее преобладание порядка Bacteroidales в депрессии и уменьшение в семействе Lachnospiraceae [143].На уровне рода Alistipes и Oscillibacter были связаны с депрессией. Jiang et al. проанализировали образцы фекалий пациентов с активным большим депрессивным расстройством (активное-MDD), ответивших на большое депрессивное расстройство (ответили-MDD) и здоровых людей из контрольной группы. В отличие от первого исследования, Jiang et al. обнаружили повышенное фекальное бактериальное α-разнообразие в группе с активным БДР по сравнению с контролем; однако этого не было обнаружено между ответившими БДР по сравнению с контролем [144].Три доминирующих типа Bacteroidetes, Proteobacteria и Actinobacteria были увеличены, в то время как Firmicutes были значительно ниже в группах как с активным БДР, так и в группах с ответом на БДР, чем в контрольной группе. Faecalibacterium был связан с отрицательной корреляцией с тяжестью депрессивных симптомов. В соответствии с Naseribafrouei et al., При депрессии было обнаружено увеличение Oscillibacter и Alistipes по сравнению с контрольной группой [144].Следует отметить, что возможные смешивающие элементы для объяснения различий между этими двумя исследованиями могут быть связаны с набором контролей из амбулаторной неврологической клиники Naseribafrouei et al., В отличие от Цзяна, который набирал здоровых субъектов в качестве контроля [143, 144]. Кроме того, различия в возрасте субъектов, а также географическое положение между исследованиями могут способствовать различиям в бактериальном разнообразии, поскольку известно, что на разнообразие кишечных бактерий влияют несколько факторов, включая состояние здоровья, возраст, диету и использование антибиотиков [47]. .В поперечном наблюдательном исследовании, изучающем связи между микробиомом кишечника и материнским темпераментом у детей ясельного возраста, было обнаружено, что определенные параметры темперамента могут быть связаны с различиями в филогенетическом разнообразии [145]. Кроме того, они обнаружили определенные половые связи между темпераментом и микробиомом кишечника.
Эти исследования начинают определять группы бактерий, потенциально вредные для патогенеза расстройств настроения, хотя потребуются дальнейшие исследования для выяснения временных и причинно-следственных связей между микробиотой кишечника и депрессией, а также для оценки их полезности в качестве биомаркеров заболевания.Опять же, как и в исследованиях на грызунах, эти результаты указывают на связанные с полом различия в том, как можно регулировать микробиом и как он влияет на ЦНС и поведение.
4.2.2. Исследования пробиотиков на людях
На сегодняшний день было проведено несколько исследований пробиотиков на людях для оценки их влияния на настроение. Употребление 3-недельного курса йогурта, содержащего Lactobacillus casei Shirota (LcS), улучшило настроение у пациентов с плохим настроением (по оценке с помощью анкетирования) [146].У здоровых добровольцев, получивших 30-дневный курс лечения L. helveticus R0052 и B. longum R0175 по сравнению с плацебо, испытуемые, получавшие пробиотики, демонстрировали меньшую соматизацию, депрессию и враждебность гнева [147]. Исследование Steenbergen et al. стремились дополнить эти результаты и показали, что участники, получавшие многовидовые пробиотики, снизили когнитивную реактивность до грустного настроения [148]. В рандомизированном двойном слепом плацебо-исследовании с пациентами с синдромом хронической усталости (СХУ) два месяца ежедневного приема LcS вызывали значительное повышение как Lactobacillus , так и Bifidobacterium и сопутствующее значительное снижение симптомов тревоги по сравнению с контролем [149].Эти результаты свидетельствуют о том, что прием пробиотиков может помочь уменьшить негативные мысли, связанные с грустным настроением. Прием пробиотиков требует дальнейших исследований в качестве потенциальной стратегии лечения или профилактики депрессии.
5. Перспективы
Темы, обсуждаемые в этом обзоре, подчеркивают широкое влияние микробиома на широкий спектр психических и неврологических заболеваний. Изменения в микробиоме имеют отношение ко многим заболеваниям мозга, и понимание аномальных изменений микрофлоры желудочно-кишечного тракта в этих условиях необходимо для определения новых мишеней для лечения.Распознавание патологических изменений в строении микробиома предлагает возможные средства предвидения или прогнозирования будущего заболевания. Это также дает возможность вмешаться и исправить дисбактериоз с благотворным влиянием на болезнь.
Нельзя недооценивать роль микробиома в развитии нервной системы. Как обсуждалось ранее, воздействие определенных микроорганизмов в определенные моменты времени на животных моделях может иметь длительное влияние на риск неврологических заболеваний и поведение.Лечение, изменяющее микробную флору, может повлиять на здоровое развитие мозга, и необходима дальнейшая работа в этой области, чтобы понять, насколько это может быть значительным для людей.
Будущая работа, которая расширяет наше текущее понимание дисбиозов, возникающих при заболеваниях ЦНС, должна, как мы надеемся, обеспечить более глубокое понимание механизмов заболеваний, связанных с микробиотой, и предоставить дополнительные терапевтические возможности для пациентов. Благодарности под номерами наград Uh4CA140233, U01CA182370, R01CA159036, R01AI110372 и R21DE025352.З.П. — штатный врач Департамента по делам ветеранов системы здравоохранения Нью-Йоркской гавани. Авторы несут исключительную ответственность за содержание, которое не обязательно отражает официальную точку зрения Национальных институтов здравоохранения, Департамента по делам ветеранов США или правительства США.
Доктор Хикман и доктор Хусейн внесли равный вклад в эту работу.
Дисбактериоз кишечника — Eurofins Megalab Canarias
Исследование кишечной флоры (дисбактериоз кишечника)
Дисбактериоз
Для хорошего здоровья необходимо правильное пищеварение и усвоение питательных веществ.Заболевания, влияющие на кишечный транзит, широко распространены среди населения и могут указывать на расстройства пищеварения или, альтернативно, на сопутствующие проявления патологических симптомов других систем или органов.
Исчерпывающее исследование стула — полезный и неинвазивный инструмент для оценки здоровья кишечного тракта с учетом микробиологических, вирусных (аденовирус, рота-вирус) и паразитарных (амеба, геллаты, инфузории, кокцидии и кишечных гельминты) исследование.
Специфический микробиологический анализ и определение концентрации каждого из видов, составляющих кишечную флору, резидентную флору (E. coli, Enterococcus sp., Lactobacillus sp., Bacteroides sp., Prevotella sp., Bifidobacterium sp., Clostridium) sp.), проходящей флоры (E. coli lactosa negativa, Klebsiella pneumoniae / oxytoca, Enterobacter cloacae, Citrobacter freundii, Pseudomonas sp., Bacillus sp., Staphilococcus sp., Streptococcus sp.) и иногда энтеропатогенной флорой (Salmonella sp., Vibrio sp., Yersinia sp., Campylobacter sp. И т. Д.), А также наличие дрожжей (Candida sp.) И плесени (Geotrichum sp., Aspergillus sp., Mucor sp.) Может помочь в диагностике и, следовательно, выяснение кишечных проблем, связанных с процессами ДИСБИОЗА
Важность сохранения и поддержания физиологической кишечной флоры заключается в том, что она способствует целостности слизистой оболочки кишечника и способствует устойчивости к колонизации патогенными микробами.
Исследование также может быть распространено на паразитов (Entamoeba hystolitica, Entamoeba Coli, Entamoeba hartmani; Giardia Кишечник; Dientamoeba fragilis; Chilomastix mesnili; Iodamoeba butchslii; Endolimax nana; Cryptococcus spominis; ; Trematodes; Cestodes) аденовирус, ротавирус и антигены Heliobacter Pylori и Clostridium difficile, запрашивая профиль РАСШИРЕННОГО ДИСБИОЗА.

 Эти неприятные явления происходят вследствие активного размножения и, как следствие, выделения продуктов обмена (распада) болезнетворными бактериями (золотистый стафилококк, кишечная палочка, кампиллобактер) – аммиака и аммиачных производных, сероводородных веществ, азотистых соединений.
Эти неприятные явления происходят вследствие активного размножения и, как следствие, выделения продуктов обмена (распада) болезнетворными бактериями (золотистый стафилококк, кишечная палочка, кампиллобактер) – аммиака и аммиачных производных, сероводородных веществ, азотистых соединений.

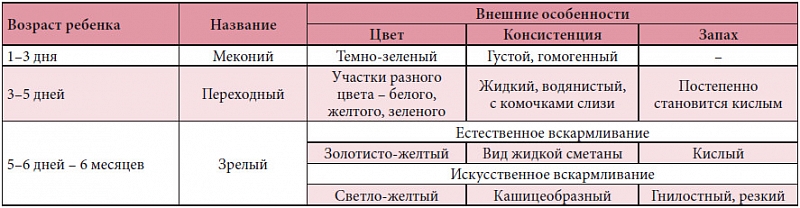 д.
д.
 Наиболее часто они проявляются через 2-4 часа после приема пищи. Малыш будет веси себя беспокойно, а негативное состояние сопровождается урчанием в животе, его вздутием, ложными позывами на дефекацию.
Наиболее часто они проявляются через 2-4 часа после приема пищи. Малыш будет веси себя беспокойно, а негативное состояние сопровождается урчанием в животе, его вздутием, ложными позывами на дефекацию./187/187.jpg) Предназначена для активизации роста и развития бифидобактерий.
Предназначена для активизации роста и развития бифидобактерий.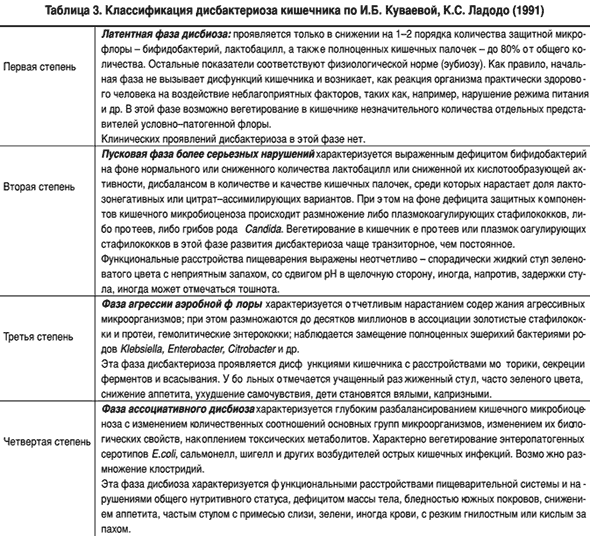 Эта степень приводит к вздутию, поносу, коликам. Возможна маленькая прибавка в весе. Педиатр назначает лечение, и пересматривает питание новорожденного.
Эта степень приводит к вздутию, поносу, коликам. Возможна маленькая прибавка в весе. Педиатр назначает лечение, и пересматривает питание новорожденного.

 4
4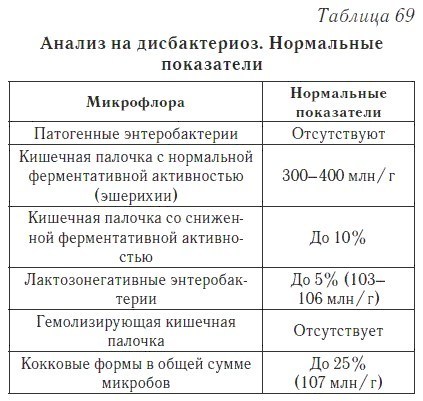 В данном случае необходимо перейти на низколактозные смеси. Не стоит переходить резко, это должно происходить в течении недели, чтобы ни навредить организму малыша.
В данном случае необходимо перейти на низколактозные смеси. Не стоит переходить резко, это должно происходить в течении недели, чтобы ни навредить организму малыша.
 Выпускают в форме порошка, принимают при дисбактериозе у новорожденного с первых дней жизни. Порошок перед употреблением смешивают со смесью. В возрасте до 6 месяцев принимают по 1 пакетику 2 раза в сутки, старше 6 месяцев по 1 пакетику 3-4 раза в день.
Выпускают в форме порошка, принимают при дисбактериозе у новорожденного с первых дней жизни. Порошок перед употреблением смешивают со смесью. В возрасте до 6 месяцев принимают по 1 пакетику 2 раза в сутки, старше 6 месяцев по 1 пакетику 3-4 раза в день.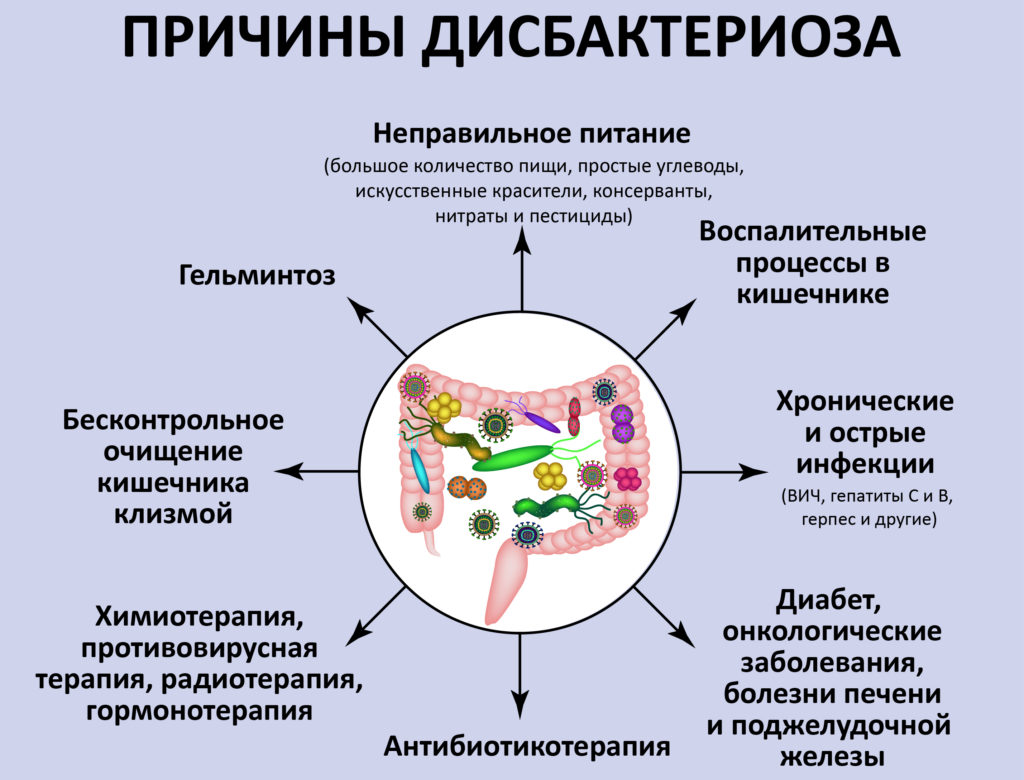 Бактерии этой группы считаются обязательными компонентами микрофлоры. Они нужны для нормальной работы желудочно-кишечного тракта, для поддержания иммунной системы человека, для нормального функционирования всех органов и систем организма. Представителями облигатной флоры считаются всем известные лактобактерии, бифидобактерии и кишечная палочка. Еще к ним относят бактероиды и энтерококки. Наполняя внутреннее содержание кишечника, они никак на него не влияют. Их количество может достигать 97% от общего числа микроорганизмов ЖКТ ребенка.
Бактерии этой группы считаются обязательными компонентами микрофлоры. Они нужны для нормальной работы желудочно-кишечного тракта, для поддержания иммунной системы человека, для нормального функционирования всех органов и систем организма. Представителями облигатной флоры считаются всем известные лактобактерии, бифидобактерии и кишечная палочка. Еще к ним относят бактероиды и энтерококки. Наполняя внутреннее содержание кишечника, они никак на него не влияют. Их количество может достигать 97% от общего числа микроорганизмов ЖКТ ребенка.