АПУД-теория в клиническом аспекте | Лукьянчиков В.С.
В 2006 году исполнится 40 лет первой публикации, посвященной АПУД-теории, но эта теория по-прежнему привлекает пристальное внимание ученых-медиков и практических врачей. Причина в том, что АПУД-теория, с одной стороны, содержит все признаки фундаментальной медико-биологической концепции, с другой – отражает серьезную клиническую проблему, представленную множеством онкологических, обменно-эндокринных и других болезней и синдромов.
Дефиниции и эволюция AПУД-теории
Суть АПУД- теории, предложенной А. Pearse с соавторами, заключается в следующем. В организме наряду с нервной и эндокринной системами имеется дополнительная система регуляции, которая состоит из особых клеток, расположенных повсеместно и обладающих специфическими ультраструктурными и цитохимическими свойствами. Особенностью ультраструктуры является наличие цитоплазматических, связанных с клеточной оболочкой, микрогранул, заполненных биоактивными субстанциями.
Сначала AПУД-теорию встретили критически, особенно то ее положение, что AПУД–клетки происходят исключительно из нейроэктодермы, точнее, из гребешка эмбриональной нервной трубки. Причина этого первоначального заблуждения, видимо, в том, что апудоциты, кроме пептидов и аминов, содержат нейронспецифические ферменты и субстанции: енолазы (NSE), хромогранин А, синаптофизин, а также демонстрируют другие «нейрокрестопатические» свойства. Позже авторы и сторонники АПУД-теории признали, что апудоциты имеют разное происхождение: одни из гребешка нервной трубки, другие, например, апудоциты гипофиза и кожи, развиваются из эктодермы, в то время как апудоциты желудка, кишечника, панкреас, легких, щитовидной железы, ряда других органов являются дериватами мезодермы [10].
 Впрочем, разночтения по этому аспекту АПУД-теории cегодня уже не принципиальны, поскольку доказано, что в онтогенезе, (или в условиях патологии) может происходить структурная и функциональная конвергенция разных по происхождению клеток [21].
Впрочем, разночтения по этому аспекту АПУД-теории cегодня уже не принципиальны, поскольку доказано, что в онтогенезе, (или в условиях патологии) может происходить структурная и функциональная конвергенция разных по происхождению клеток [21].В 70-80-е годы прошлого века усилиями многих исследователей, в том числе R. Gilleman, удостоенного Нобелевской премии именно за открытие пептидой нейроэндокринной регуляции в ЦНС, AПУД-теория была преобразована в концепцию диффузной пептидергической нейроэндокринной системы (ДПНЭС). Относящиеся к этой системе клетки были идентифицированы в ЦНС и АНС, сердечно-сосудистой, дыхательной, пищеварительной системах, урогенитальном тракте, эндокринных железах, коже, плаценте, т.е. фактически всюду. Повсеместное представительство этих «химерных» клеток или трансдюсеров [7], сочетающих свойства нервной и эндокринной регуляции, полностью отвечало главной идее AПУД-теории, что по структуре и функции ДПНЭС служит связующим звеном между нервной и эндокринной системами.

Дальнейшее развитие AПУД-теория получила в связи с открытием гуморальных эффекторов иммунной системы – цитокинов, хемокинов, интегринов, дефенсинов и т.д. Связь ДПНЭС с иммунной системой стала очевидной, когда было установлено, что эти субстанции образуются не только в органах и клетках иммунной системы, но и в апудоцитах [17,19]. С другой стороны, выяснилось, что клетки иммунной системы обладают AПУД-характеристиками [20]. В результате возникла современная версия AПУД-теории [1,3,10,11]. Согласно этой версии в организме человека имеется многофункциональная и широко распространенная, иными словами, диффузная нейроиммунноэндокринная система (ДНИЭС), соединяющая нервную, эндокринную и иммунную системы в единый комплекс, с дублирующими и отчасти взаимозаменяемыми структурами и функциями (табл. 1). Физиологическая роль ДНИЭС – это регуляция фактически всех биологических процессов, на всех уровнях – от субклеточного до системного. Не случайно, первичная патология ДНИЭС отличается яркостью и многообразием клинико-лабораторных проявлений, а ее вторичные, (т.
 е. реактивные) нарушения сопровождают фактически любой патологический процесс.
е. реактивные) нарушения сопровождают фактически любой патологический процесс.На основе ДНИЭС-концепции сформировалась новая интегральная биомедицинская дисциплина – нейроиммуноэндокринология [1], которая утверждает системный, а не нозологический подход к патологии человека. Основой «нозологизма» является постулат, согласно которому каждая болезнь или синдром имеют специфическую причину, четкий патогенез, характерные клинико-лабораторные и морфологические стигматы. Концепция ДНИЭС снимает эти методологические шоры, давая возможность интегрально трактовать причины и механизмы патологического процесса [6].
 Соответствующие клинико-лабораторно-морфологические синдромы и их ассоциации представлены в таблице 2.
Соответствующие клинико-лабораторно-морфологические синдромы и их ассоциации представлены в таблице 2.Этиопатогенез
и морфогенез апудопатий
Повсеместное присутствие и функциональная полипотентность ДНИЭС предполагает, что ее формированием и активностью управляют десятки генов. Наследственно-генетический фактор в этиологии апудопатий прослеживается четко. Чаще апудопатии наследуются как аутосомно-доминантный признак, хотя возможны рецессивная или полигенная трансмиссия и спорадические случаи – результат случайной мутации. Врожденные или приобретенные генетические «дефекты» могут затронуть любые клетки ДНИЭС. При этом характерной чертой апудопатий является то, что в патологический процесс одновременно или последовательно вовлекается несколько видов клеток в разных анатомических областях.
Еще одна особенность в том, что такой процесс может быть не только продуктивным – неоплазия или гиперплазия апудоцитов, но и дегенеративным, в частности, протекать в форме аутоиммунной атаки.

Таким образом, апудопатии характеризуются широким спектром функциональных и анатомо-морфологических нарушений (табл. 2,3). Этиологию апудопатий определяют наследственно-генетические и средовые факторы. Патогенез представлен сложными, взаимообусловленными комбинациями обменно-эндокринных, иммунопатологических и нейропатических расст-ройств. Патоморфология апудопатий включает фактически весь спектр соответствующих процессов и состояний: воспаление и дистрофию, гиперплазию и атрофию, дисэмбриогенез и метаплазию.
Клинические аспекты теории ДНИЭС
Есть основания утверждать, что апудопатии имеют большой удельный вес в структуре заболеваемости. Но распознают их редко, очевидно, потому, что клинические и лабораторные проявления апудопатий неотличимы от хорошо известных болезней и синдромов другой этиологии.
 В рамках патологии ДНИЭС выделяют два синдрома: эктопическая продукция пептидных гормонов и биогенных аминов, обусловленная опухолевым, воспалительным или другим повреждением апудоцитов, и синдром множественной эндокринной неоплазии (МЭН). Типичные клинико-гормонально-морфологические ассоциации этих двух вариантов апудопатий приведены в таблицах 2 и 3.
В рамках патологии ДНИЭС выделяют два синдрома: эктопическая продукция пептидных гормонов и биогенных аминов, обусловленная опухолевым, воспалительным или другим повреждением апудоцитов, и синдром множественной эндокринной неоплазии (МЭН). Типичные клинико-гормонально-морфологические ассоциации этих двух вариантов апудопатий приведены в таблицах 2 и 3. Анализ этих ассоциаций позволяет сделать следующие выводы. Во-первых, по этиопатогенезу и морфологии апудопатии близки онкологическому процессу, но не идентичны ему. Во-вторых, клинические маски болезней и синдромов, относящихся к апудопатиям, не ограничиваются обменно-эндокринной патологией. В-третьих, эндокринная часть ДНИЭС включает не только пептидэргические и аминэргические структуры, но эндокринные железы “стероидно-тирозиновой” группы – кору надпочечников, половые железы, щитовидную железу. В-четвертых, анатомо-морфологические и функциональные нарушения в рамках АПУД-патологии могут протекать по типу гиперплазии и атрофии, гиперфункции или гипофункции.

Для практических врачей, особенно специалистов по интроскопии, приведенные в таблицах 2 и 3 клинические и анатомо-морфологические сочетания должны служить поводом к постоянной настороженности в отношении апудопатий, к их настойчивому поиску. Ведь апудопатии чаще всего проявляются опухолью, обычно множественной, нередко злокачественной и очень агрессивной. Только ранняя диагностика оставляет больному шанс на выздоровление. Врач любой специальности обязан хорошо знать клинические маски апудопатий и типичные локализации апудом, а также синдромные сочетания при МЭН (табл. 3).
Есть основания полагать, что одной из форм патологии ДНИЭС или, как минимум, маркером апудопатий могут быть аутоиммунные болезни и синдромы, (например, аутоиммунный тиреоидит). Дело в том, что дисфункция или дисплазия клеток ДНИЭС неизбежно «привлекает внимание» иммунной системы, следовательно, индуцирует аутоиммунную реакцию. Более того, с учетом тройственной природы ДНИЭС, апудопатия может изначально иметь иммунологический акцент, причем аутоиммунная атака не обязательно должна быть направлена на апудоциты – она может захватывать любые ткани и органы [1,13].
 Реальность подобных патогенетических сценариев подтверждает упомянутый выше факт, что при апудопатиях морфологические нарушения не всегда первичны. Примером первично функциональной апудопатии служит аспирин-чувствительная бронхиальная астма, развитие которой связывают с гипофункцией апудоцитов, секретирующих мелатонин [4].
Реальность подобных патогенетических сценариев подтверждает упомянутый выше факт, что при апудопатиях морфологические нарушения не всегда первичны. Примером первично функциональной апудопатии служит аспирин-чувствительная бронхиальная астма, развитие которой связывают с гипофункцией апудоцитов, секретирующих мелатонин [4].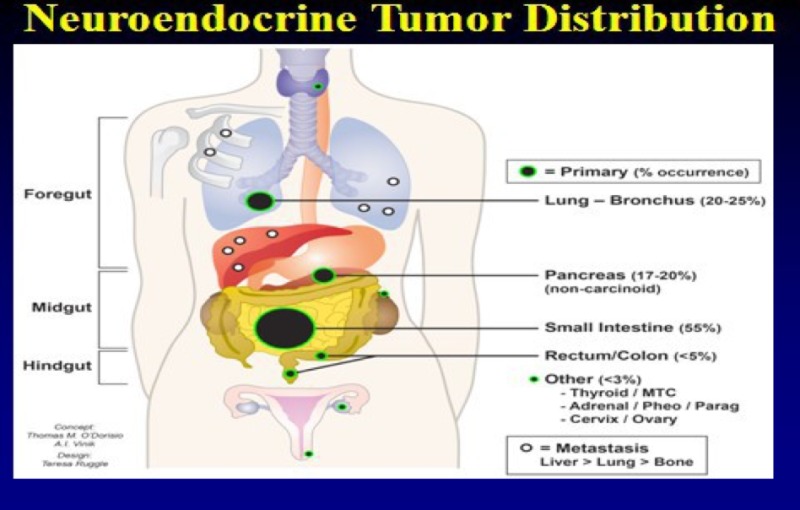 Успехи иммунофармакологии и генно-инженерных технологий создают веские предпосылки к решению этой проблемы [9].
Успехи иммунофармакологии и генно-инженерных технологий создают веские предпосылки к решению этой проблемы [9].Литература
1. Акмаев И.Г. Взаимодействие основных регуляторных систем (нервной, эндокринной и иммунной) и клиническая манифестация их нарушений // Клинич. медиц. –1997.- № 11.-С.8-13.
2. Гипоталамические синдромы (краткое практическое руководство). / Ред. В.Г. Вогралик.– ГМИ. Горький: -1989. –52 стр.
3. Дулин П.А. Диагностика нейроэндокринных опухолей в клинике внутренних болезней. Автореф.. дисс. докт.:-М.-2002. –34 с.
4. Evsyukova H. Aspirin-sensitive asthma due to diffuse neuroendocrine system pathology. // Neuroendocr. Lett. –2002. –Vol.-23.№4. –P.87-88.
5. Кокряков В.Н. Алешина Г.М. Шамова О.В. и др. Достижения и проблемы в изучении антибиотических пептидов животного происхождения. // Вестник РАМН. –2002. -№12. –С. 15-20
6. Лукьянчиков В.С. Калинин А.П. Батлаева Н.К. Современная концепция феохромоцитомы (обзор литературы). // Терапевтический архив. — 1998.-№11.- С.83-87.
— 1998.-№11.- С.83-87.
7. Ноздрачев Д.Н. Физиология вегетативной нервной системы./ М. Ленинград:-1983.-294 с.
8. Овсянников А.И. Интеграция нейромедиаторов и гормонов в пищеварительной системе. // Вестник РАМН. –1996. -№1. –С.33-36.
9. Петров Р.В. Иммунореабилитация и стратегия медицины. // Int. J. Immunoreabil.-1994. -№1 (suppl.5).-Р.5-6.
10. Райхлин Н.Т. АПУД-система (диффузная эндокринная система): oснов- ные представления, эндокринноклеточные опухоли (апудомы), иммуногистохимическая диагностика./ В кн.: Руководство по иммуногистохимической диагностике опухолей человека. Ред. С.В. Петрова, Н.Т. Рахайлин. 2-е изд. -Казань: 2000.-Гл.12.-С.222-237.
11. Симоненко В.Б. Нейроэндокринные опухоли./ Москва. Медицина:-2003.
12. Черкашин В.А.Семин Г.Ф. Веретенко А.А. Оптимизация функций сердечно-сосудистой системы пептидными биорегуляторами. // Клин. мед.–2002.-№5.–С.30-34
13. Шинкаркина А.П. Виноградова Ю.Е. Виноградов Д.Л. Поверенный А.М. Аутоантитела к щитовидной железе при гемобластозах и цитопениях. // Тер. архив.-2003.-№2.-С.62-65
// Тер. архив.-2003.-№2.-С.62-65
14. Everitt A. The neuroendocrine system and aging. // Gerontology. -1980.-Vol.26.-№2.–P.108-119
15. Frohman L. Эндокринные проявления опухолевых болезней. / В кн.: Внутр. болезни. .Ред. Е. Браунвальд и др.(пер. с англ.).-. М. Москва:-1996.–Том 8.–С.115-22
16. Gould V. Moll R. Moll I. et al. Neuroendocrine (Merkel) cells of the skin: hyperplasiаs, displasias and neoplasms // Lab.Invest. –1985.-Vol.52.-№1. –P.334-335.
17. Hopkins S. Rothwell N. Cytokines and the nervous system I: expression and recognition. // Trends Neurosci. –1995. –Vol.18.-№1.-P.83-88.
18. Ligier S. Sternberg E. Neuroendocrine host factors and inflammatory disease susceptibility. // Env. Health Persp.–1999.–Vol.107.Suppl.5.–P.129-132.
19. Reichlin S. Neuroendocrine-immune interactions. // New Engl. J. Medic. –1993.-Vol.329. –P.1246.
20. Saltez M. Immune cells express endocrine markers. // Neuroendосrinol. Lett.-2002.-Vol.23. -№3.-P.8-9.
21. Schimke R. Множественные нарушения функции эндокринной системы./ В кн.: Внутр. болезни. (пер.с англ.). Ред. Е.Браунвальд и др. -М. Москва:–1997.-Том. 9. –С.339-347.
Множественные нарушения функции эндокринной системы./ В кн.: Внутр. болезни. (пер.с англ.). Ред. Е.Браунвальд и др. -М. Москва:–1997.-Том. 9. –С.339-347.
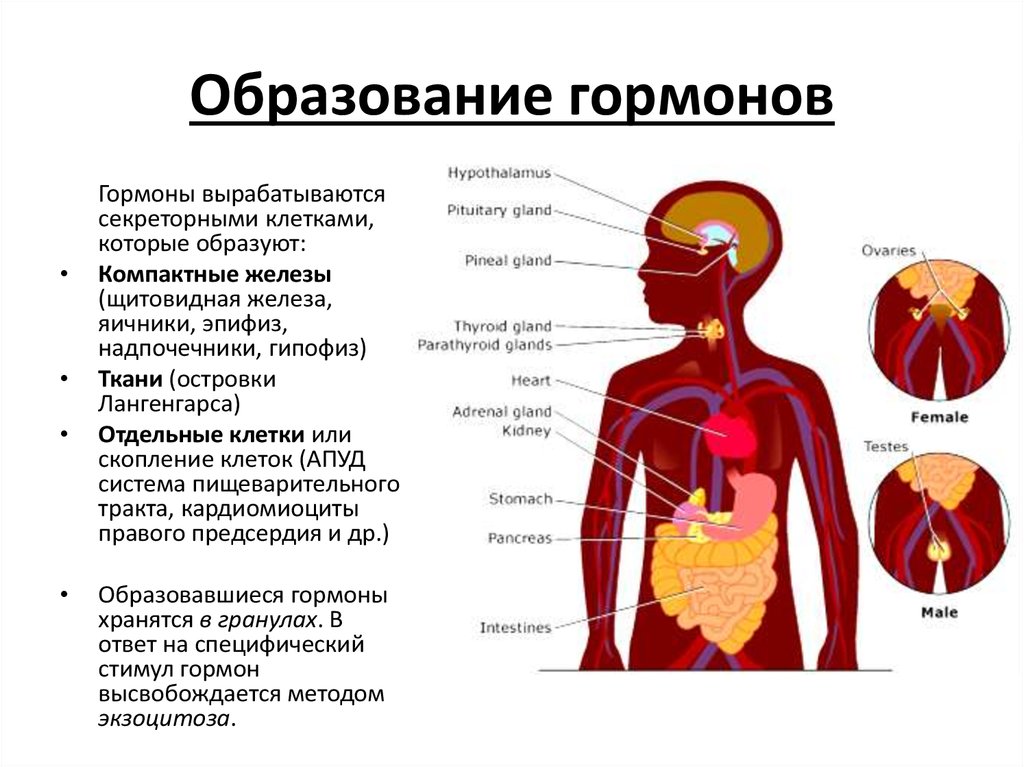
1. Apud-система и ее морфологические основы
Гормоны желудочно-кишечного тракта и места их образования
Предположение о наличии в слизистой оболочке желудочно-кишечного тракта клеток, выполняющих эндокринную функцию, было высказано еще в 1914 году П. Массо-ном. Большую роль в развитии учения о данной функции пищеварительного тракта сыграли работы А. Пирса (1968-1976). Согласно его мнению существуют своеобразные клетки, характеризующиеся эмбриологической общностью, определенными морфологическими и биохимическими свойствами, составляющие своеобразную систему APUD (Amine Precursor Uptake Decarboxylation).
Эти
клетки характеризуются высоким
содержанием аминов (Amine).
способностью к
усвоению предшественников аминов
(Precursor
Uptake)
и наличием фермента декар-боксилазы
(Decarboxylation).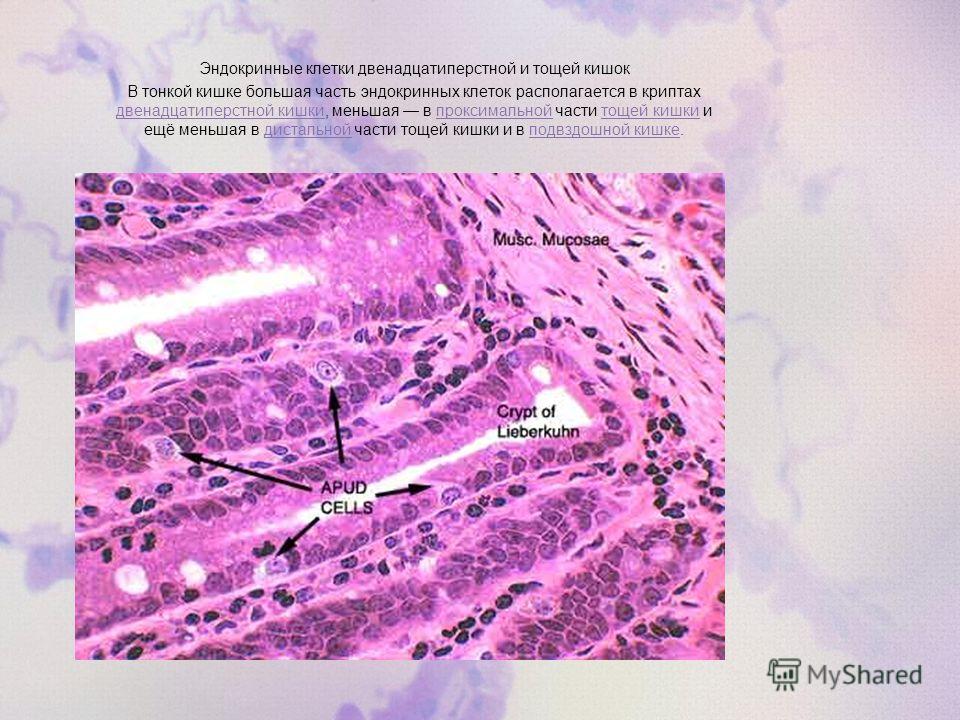
APUD-клетки локализованы в гипоталамусе, гипофизе, щитовидной железе, мозговом слое надпочечников, пищеварительном тракте. Как отмечает К. Welbourn с соавт. (1974) «пищеварительный тракт является самой большой эндокринной фабрикой организма».
К APUD-клеткам относится 36 разновидностей клеток, 28 из которых являются производными эктодермы (A.Pearse et all., 1976), источник остальных 18 разновидностей пока не выяснен.
Количество клеток с неидентифицированными функциями по окраске и данным электронной микроскопии, относящихся к системе APUD, а также гормонов неясного происхождения, как отмечают М. Grossman с соавт., (1974) и A. Pearse (1974), еще достаточно значительно.
Всю систему APUD-клеток подразделяют на 3 группы (A. Pearse, I. Polak. 1978): 1. Нейроэндокринные клетки, происходящие из нервного гребешка (их 7 типов, например, С-клетки, продуцирующие калыщтонин).
2. Клетки, происходящие из нейтральной
эктодермы (их 20 типов). Они в подавляющем
большинстве локализованы в мозговой
ткани, продуцирующие, например, люлиберин,
тиреолиберин и др.
Клетки, происходящие из нейтральной
эктодермы (их 20 типов). Они в подавляющем
большинстве локализованы в мозговой
ткани, продуцирующие, например, люлиберин,
тиреолиберин и др.
3. Клетки желудочно-кишечно-панкреатической системы (GEP-celes). Они имеют эктобластическое происхождение. Это самая большая группа клеток APUD-системы.
Название гормона | Место выработки гормона | Типы эндокринных клеток |
Соматостатин | Желудок, проксимальный отдел тонкой кишки, поджелудочная железа | D-клетки |
Вазоактивный интести-нальный пептид (ВИП) | Во всех отделах ЖКТ | Di -клетки |
Панкреатический полипептид (ПП) | Поджелудочная железа | D:-клетки |
Гастрин | Антральная часть желудка, поджелудочная железа, проксимальный отдел тонкой кишки | G-клетки |
Гастрон | Антральный отдел желудка | G-клетки |
Бульбогастрон | Антральньгй отдел желудка | G-клетки |
Дуокринин | Антральный отдел желудка | G-клетки |
Бомбезии | Желудок и проксимальный отдел тонкой кишки | Р-клетки ■ |
Секретин | Тонкий кишечник | S-клетки |
Холецистокинин-панкреозимин (ХЦК-ПЗ) | Тонкий кишечник | 1-клетки |
Энтероглюкагон | Тонкий кишечник | Ed-клетки |
Мотилин | Проксимальный отдел тонкой кишки | ЕС;-клетки |
Гастроингибирующий пептид (GIP) | Тонкий кишечник | К-клетки |
Нейротензин | Дистальный отдел тонкой кишки | N-клетки |
Энкефалины (эндорфины) | Проксимальный отдел тонкой кишки и поджелудоч- | L-клетки |
ная железа | ||
Субстанция Р | Тонкая кишка | ЕС 1-клетки |
Вилликинин | Двенадцатиперстная кишка | ЕС i -клетки |
Энтерогастрон | Двенадцатиперстная кишка | ЕС i-клетки |
Серотонин | Желудочно-кишечный тракт | ЕС]. |
Инсулин | Поджелудочная железа | В-клетки |
Глюкагон | Поджелудочная железа | а-клетки |
Эндокринные клетки ЖКТ характеризуются следующими особенностями, отличающими их от кишечных клеток (энтероцитов):
Низким уровнем гранулярного эндоплазматического ретикулюма.
Высоким содержанием свободных рибосом.
Высоким уровнем гладкого ретикулюма в форме везикул.
Электронноплотными и лабильными при фиксации митохондриями.
Связанными с мембраной секреторными пузырьками с оксинофяльным содержи- мыым.
Согласно выработанной единой терминологии, получившей название Висбаден-ской (1970), с новыми поправками, сделанными на встрече пяти исследовательских групп (в том числе участников Висбаденского соглашения и группы японских ученых) в Болонье (1973), в ЖКТ классифицируют следующие типы эндокринных клеток:
В
желудке — ЕС, G,
ECL,
AL,
D,
D,.
В кишке — ЕС, S, EG, G, I, D, D,.
В поджелудочной железе — А, В, D, Di.
G-клетки. Методами иммуноморфологического, иммунофлюоресцентного анализа, с использованием антигастриновои сыворотки доказана связь данного типа клеток с продукцией гормона гастрина. Указанные клетки локализованы в слизистой пилорической области желудка, его кардиальной и антральной частях, в двенадцатиперстной кишке, особенно в ее луковице, тощей кишке (в меньшем количестве). На апикальной мембране G-клеток имеются микроворсинки.
ЕС-клетки. Клетки
данного типа (аргентоффинные,
энтерохромаффинные, клетки Кульчицкого)
встречаются вдоль всего ЖКТ, локализуясь
преимущественно у основания
пилорических желез желудка или в
криптальнои области ворсинок тонкой
кишки,
Апикальная поверхность данных клеток
снабжена небольшими микроворсинками.
ЕС-клетки являются продуцентами
5-гидрокситриптамина. Однако результаты
исследований,
полученные в последние годы, позволяют
полагать, что кроме указанного вещества
ЕС-клетками продуцируется полипептидный
продукт, являющийся мотили-ном.
В фундальной части желудка встречаются энтерохромаффинаподобные клетки ECL, отличающиеся от ЕС-клеток по некоторым деталям ультраструктуры.
EG-клетки (энтероглюкагоновые). Локализованы в слизистой оболочке на всем протяжении тонкого и толстого кишечника. Клетки данного типа являются продуцентами энтероглюкагона.
1-клетки. Встречаются в слизистой оболочке двенадцатиперстной и тощей кишок. Их гранулы схожи с гранулами EG- и S-клеток по электронной плотности, но по размерам занимают промежуточное место (это определило название клеток — intermediate). I-клетки являются продуцентами холецистокинина-панкреозимина.
S-клетки. Располагаются в криптах двенадцатиперстной кишки и в проксимальных отделах тощей. У человека их количество сравнительно невелико. S-клетки являются продуцентами секретина.
D-клетки. Располагаются
в слизистой оболочке фундальной и
пилорической частей желудка
и тощей кишки. Клетки данного типа
синтезируют соматостатин.
Клетки данного типа
синтезируют соматостатин.
.Огклетки. Локализованы преимущественно в двенадцатиперстной и тощей кишках. а также обнаруживаются в желудке. С деятельностью Di-клеток связывают продукцию вазоактивного интестинального полипептида (ВИП).
Для гастроинтестиналъных гормонов М. Grossman (1974) предложил следующую классификацию:
I. Гормоны
Холецистокинин-панкреозимин
Гастрин
Секретин
П. Кандидаты в гормоны
А. Происхождение из желудочно-кишечного тракта и последовательность аминокислот установлены.
Гастроингибирующий полипептид (GIP)
Кишечный глюкагон
Могилин
Серотонин
Соматостатин
Вазоактивный интестинальный полипептид (VIP)
Б.
Последовательность аминокислот или
структура неизвестны и происхождение
из ЖКТ
не может быть с уверенностью подтверждено.
Антральный халон
Бомбезин
Бульбогастрон
Химоденин
Когерин
Дуокринин
Энтерокринин
Энтерогастрон
Энтероглюкагон
Энтерооксинтин
Гастрон
Инкретин
Полипептид, освобождающий инсулин
Панкретон
Субстанция Р
Урогастрон
Вагогастрон
Вилликинин
Однако последующие исследования многих авторов позволили установить еше целый ряд новых пептидов, образующихся в ЖКТ (А.М.Уголев.1978; П.К.Климов
.1983 ;MGrossman, 1978 и др.).
Для ряда гормонов ЖКТ характерна множественность молекулярных форм. В частности, различают различные формы гастрина (мини-, большой и самый большой гаст-
рян),
холецистокинина-панкреозимина, две
иммунореактивные формы ГИП, секретина
(двух и даже трех форм).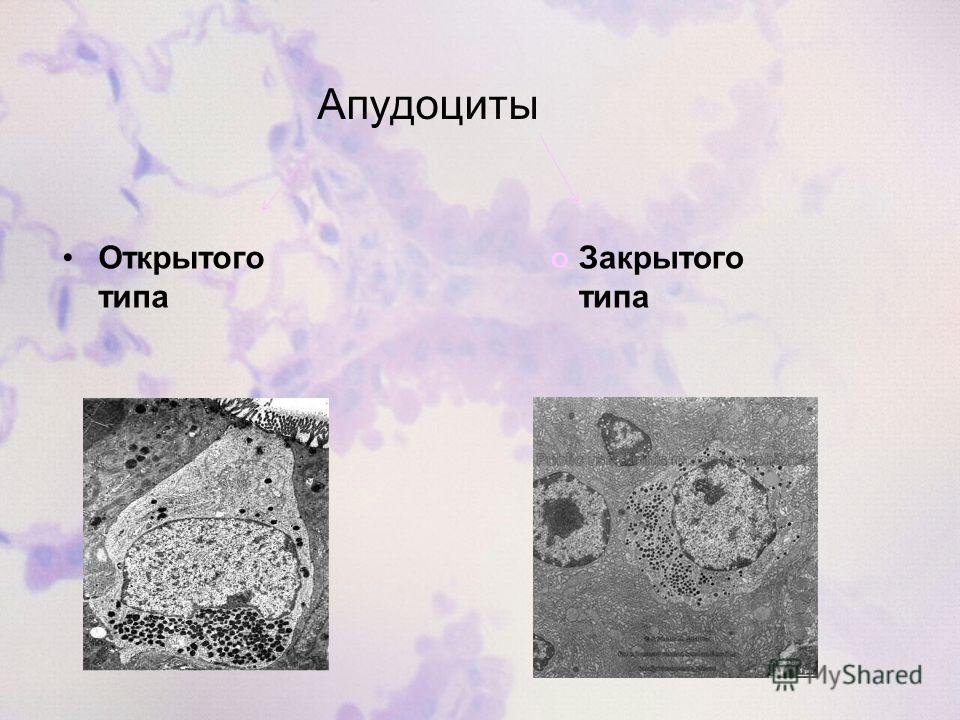 Многие гормоны
отличаются между собой длиной пептидной
цепочки
(например, лей- и метэнкефалины).
Многие гормоны
отличаются между собой длиной пептидной
цепочки
(например, лей- и метэнкефалины).
Наличие у ряда гормонов идентичных С-терминальных пентапептидных фрагментов определяет их биологическую активность (например, гастрин и холешстокинин). Большая схожесть в структуре характерна для ВИП, ГИП. секретина и глюкагона, что объясняется общностью их эволюционного Происхождения. Вместе с тем молекулярная гетерогенность гормонов ЖКТ, вероятно, связана с метаболическими превращениями основной формы пептида-предшественника или же как результат модификации ДНК и РНК. Разрыв пептидных связей пептида-предшественника с длинной цепью, приводящий к образованию пептидов с более короткими связями, обусловливает гетерогенность гормонов ЖКТ. Такой процесс характерен для образования гастрина G-17. Аналогичная последовательность аминокислот характерна для пептида-предшественника и других гормонов (проинсулина, проглюкагона, липотропина и др.).
Молекулярная
гетерогенность наиболее изучена у таких
гормонов как гастрин, эн-дорфины,
инсулин, холецистокинин. Для этих целей
используются высокоразрешающие
методы анализа (гель-хроматография,
электрофорез и др.), а также сочетание
радиоиммунологического и
гель-хроматографического методов.
Для этих целей
используются высокоразрешающие
методы анализа (гель-хроматография,
электрофорез и др.), а также сочетание
радиоиммунологического и
гель-хроматографического методов.
Гормональные пептиды по заключению Блума и Полака (S.Bloom, J. Polak. 1978 г), выполняют роль как трансмиттеров, так и факторов паракринной регуляции. При этом авторы выделяют следующие виды действия пептидов.
1. Экзокринный. Выделение пептидов из эндокринных клеток в просвет полости. . 2. Паракринный. Выделение пептидов из эндокринных клеток в межклеточное пространство и их действие реализуется локально.
Нейрокринный. Выделение пептидов из нервных окончаний в результате деполя ризации аксонов и их действие реализуется в синапсах, аналогично таким медиато рам как адетилхолин или катехоламины. Такие нервные окончания получили название пептидергические.
Нейроэндокринный. Выделение пептидов из нервных окончаний в общую цир куляцию и они выполняют нейроэндокринную функцию.

Гормональный. Выделяются пептиды из эндокринных клеток в кровоток и вы полняют эндокринную функцию. Однако учитывая то, что период полураспада для
10
большинства пептидов довольно короткий (до 10 мин), то действие их в основном является паракринным.
Для ряда гастроинтестинальных гормонов характерным является сходство химической структуры и биологического действия. В частности, выделяют так называемое семейство гастрина, включающее различные формы гастрина и холецистокинин. семейство секретина, включающее ВИП, ГИП. Этим объясняется сходство клинических проявлений как со стороны пищеварительной, так и других систем при избыточной или же сниженной продукции различных гормонов пищеварительной системы того или иного семейства.
2. ГОРМОНЫ ПИЩЕВАРИТЕЛЬНОЙ СИСТЕМЫ, ИХ СТРУКТУРА, СВОЙСТВА И ФИЗИОЛОГИЧЕСКАЯ РОЛЬ
Система APUD и ее apudomas
Обзор
. 1981; 4: 255–76.
1981; 4: 255–76.
W J Temple, EV Sugarbaker, A S Ketcham
- PMID: 6114040
Обзор
W J Temple et al. Int Adv Surg Oncol. 1981.
. 1981; 4: 255–76.
Авторы
W J Temple, EV Sugarbaker, A S Ketcham
- PMID: 6114040
Абстрактный
По мере разработки чувствительных радиоиммуноанализов для обнаружения полипептидных гормонов захватывающее открытие диффузно распределенной системы взаимосвязанных эндокринных клеток положило начало новой эре эндокринологии. Эта система, хотя и анатомически разобщена, связана рядом общих черт, таких как ее биосинтетический механизм, гистохимические и ультраструктурные особенности и эмбриологическое происхождение (таблица I).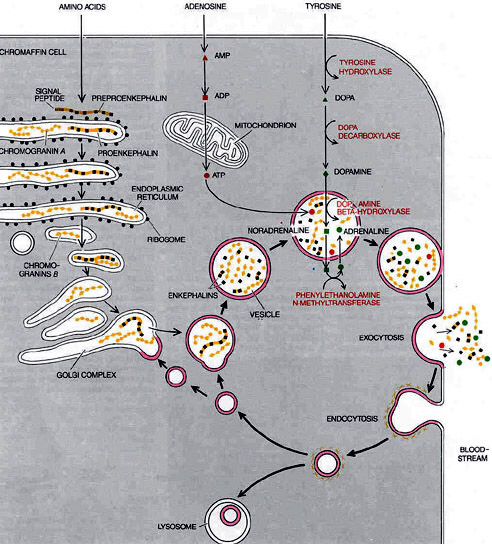 Однако наиболее заметной особенностью являются их пути биосинтеза для производства гормонов, от которых и произошло сокращение APUD. Это способность к поглощению предшественников аминов, таких как ДОФА, с последующим декарбоксилированием, что приводит к синтезу биоактивных аминов или полипептидных гормонов. Гиперплазии или новообразования этих клеток определяются как апудомы. За последние десять лет большое количество исследований быстро изменило первоначальные концепции этой системы, особенно с точки зрения ее эмбриологического происхождения, физиологических взаимосвязей, классификации, а также добавления многих новых членов клеток APUD. Они будут рассмотрены, и происхождение, диагностика и лечение каждой признанной апудомы будут синтезированы в свете ее членства в системе APUD.
Однако наиболее заметной особенностью являются их пути биосинтеза для производства гормонов, от которых и произошло сокращение APUD. Это способность к поглощению предшественников аминов, таких как ДОФА, с последующим декарбоксилированием, что приводит к синтезу биоактивных аминов или полипептидных гормонов. Гиперплазии или новообразования этих клеток определяются как апудомы. За последние десять лет большое количество исследований быстро изменило первоначальные концепции этой системы, особенно с точки зрения ее эмбриологического происхождения, физиологических взаимосвязей, классификации, а также добавления многих новых членов клеток APUD. Они будут рассмотрены, и происхождение, диагностика и лечение каждой признанной апудомы будут синтезированы в свете ее членства в системе APUD.
Похожие статьи
APUD-клетки и апудомы. Концепция, относящаяся к анестезии и эндокринологии.

Уитвам Дж.Г. Уитвам Дж. Анестезия. 1977 г., 32 октября (9): 879–88. doi: 10.1111/j.1365-2044.1977.tb10110.x. Анестезия. 1977. PMID: 23705 Обзор.
Диффузная нейроэндокринная (АПУД) система.
Лоне Дж. М., Табуто Ф., Хаймар М., Ганем Ю., Виллетт Дж. М., Дре С., Дебу-Гиймен М. С., Розето А., Пери Дж. Лоней Дж. М. и соавт. Биомед Фармаколог. 1983;37(7):322-8. Биомед Фармаколог. 1983. PMID: 6141820 Обзор.
Нечастые опухоли системы APUD.
Виссер П.А., Фризен С.Р. Виссер П.А. и соавт. Surg Clin North Am. 1979 февраля; 59(1):143-58. doi: 10.1016/s0039-6109(16)41740-8. Surg Clin North Am. 1979.
 PMID: 36675
Аннотация недоступна.
PMID: 36675
Аннотация недоступна.Эндокринные опухоли нервного гребня происхождения: нейролофомы, апудомы и концепция APUD.
Пирс АГ, Полак Дж.М. Пирс АГ и др. мед. биол. 1974 г., февраль; 52 (1): 3–18. мед. биол. 1974. PMID: 4157328 Обзор. Аннотация недоступна.
APUD-клетки, апудомы и нервный гребень.
Андрей А. Эндрю А. S Afr Med J. 1976 May 29; 50 (23): 890-8. S Afr Med J. 1976. PMID: 935982
Посмотреть все похожие статьи
Типы публикаций
термины MeSH
вещества
Список опухолей | ВИДЯЩАЯ Обучение
Различные типы тканей тела вызывают различные опухоли, как доброкачественные, так и злокачественные. В следующих таблицах показаны различные виды опухолей, которым подвержен каждый из следующих типов тканей:
В следующих таблицах показаны различные виды опухолей, которым подвержен каждый из следующих типов тканей:
- Соединительная ткань
- Эндотелий и мезотелий
- Кровь и лимфоидные клетки
- Мышцы
- Эпителиальные ткани
- Нейронный
- Система APUD (APUD — поглощение и декарбоксилирование предшественника амина)
- Другие клетки, происходящие из нервного гребня
- Опухоли
- Опухоли гонад
Соединительная ткань
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Фиброзная ткань взрослых | Фиброма | Фибросаркома |
| Эмбриональная (миксоматозная) фиброзная ткань | Миксома | Миксосаркома |
| Жир | Липома | Липосаркома |
| Хрящ | Хондрома | Хондросаркома |
| Кость | Остеома | Остеосаркома |
| Хорда | — | Хордома |
| Соединительная ткань, вероятно, фиброзная | Фиброзная гистиоцитома | Злокачественная фиброзная гистиоцитома |
Эндотелий и мезотелий
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Кровеносные сосуды | Гемангиома, гемангиоперицитома | Гемангиосаркома, ангиосаркома |
| Лимфатические сосуды | Лимфангиома | Лимфангиосаркома |
| Мезотелий | — | Мезотелиома |
Кровь и лимфоидные клетки
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Кроветворные клетки | «Прелейкозы», «миелопролиферативные заболевания» | Лейкемия различных типов; алейкемический лейкоз |
| Лимфоидная ткань | Плазмоцитоз | Плазмоцитома; множественная миелома; Ходжкинская лимфома и неходжкинская лимфома |
Мышцы
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Гладкая мускулатура | Лейомиома | Лейомиосаркома |
| Поперечно-полосатые мышцы | Рабдомиома | Рабдомиосаркома |
Эпителиальные ткани
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Многослойная чешуйчатая | Папиллома Себорейный кератоз и некоторые опухоли придатков кожи | Плоскоклеточный рак; эпидермоидная карцинома и некоторые злокачественные опухоли придатков кожи |
Железистый эпителий
| Аденома Аденома печени | Аденокарцинома Гепатома: гепатоцеллюлярная карцинома |
| Переходный эпителий | Переходно-клеточная папиллома | Переходно-клеточная карцинома |
| Плацента | Пузырный крот | Хориокарцинома |
| Семенник | — | Семинома; эмбрионально-клеточная карцинома |
Нейронный
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Глиальные клетки (несколько типов) | — | Глиома I-III степени, анапластическая; мультиформная глиобластома (IV степень) |
| Нервные клетки | — | Нейробластома |
| Мозговые оболочки | Менингиома | Злокачественная менингиома |
| Оболочка нерва | Шваннома, неврилеммома Нейрофиброма | Злокачественная менингиома Злокачественная шваннома Нейрофибросаркома |
Система APUD (APUD — поглощение и декарбоксилирование предшественника амина)
Система APUD представляет собой недавно определенный ряд клеток, которые выполняют эндокринные функции, поскольку они секретируют один из множества малых аминовых или полипептидных гормонов. Запасные формы этих гормонов, расположенные в цитоплазме, представляют собой небольшие гранулы с плотным ядром, связанные мембраной, видимые при электронной микроскопии. Некоторые из этих клеток, по-видимому, происходят из клеток нервного гребня, которые мигрируют в различные органы. Ткани системы APUD дают доброкачественные и злокачественные опухоли, указанные в таблице G.
Запасные формы этих гормонов, расположенные в цитоплазме, представляют собой небольшие гранулы с плотным ядром, связанные мембраной, видимые при электронной микроскопии. Некоторые из этих клеток, по-видимому, происходят из клеток нервного гребня, которые мигрируют в различные органы. Ткани системы APUD дают доброкачественные и злокачественные опухоли, указанные в таблице G.
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Гипофиз | Базофильная аденома Эозинофильная аденома Хромофобная аденома | — — — |
| Паращитовидная железа | Аденома паращитовидной железы | Рак паращитовидной железы |
| Щитовидная железа (С-клетки) | С-клеточная гиперплазия | Медуллярный рак щитовидной железы |
| Бронхиальная прокладка (клетки Кульчицкого) | — | Бронхиальный карциноид; овсяноклеточная карцинома |
| мозговое вещество надпочечников феохромоцитома | Феохромоцитома | Злокачественный Феохромоцитома |
| Поджелудочная железа | Островковая целладенома; Инсулинома; гастринома | Островковая клеточная карцинома |
| Желудок и кишечник | Карциноид | Злокачественный карциноид |
| Каротидное тельце и система хеморецепторов | Хемодектома; параганглиома | Злокачественный карциноид Злокачественная параганглиома |
Другие клетки, полученные из нервного гребня
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Пигмент-продуцирующие клетки кожи, глаз и иногда других участков | Невус | Меланома |
| Шванновские клетки периферической нервной системы | Шваннома или нейрилеммома | Злокачественная шваннома |
| Клетки Меркеля в плоском эпителии (функция неизвестна) | — | Новообразование из клеток Меркеля (аналогично клеткам овса) |
Опухоли
| Ткань | Доброкачественные опухоли | Злокачественные опухоли |
|---|---|---|
| Грудь | Фиброаденома | Филлоидная цистосаркома |
| Зачаток почки | — | Опухоль Вильмса |
Опухоли половых желез
Терминология для опухолей гонад или опухолей яичника и яичка несколько более запутанна. Один общий класс опухолей возникает из мультипотенциальных клеток, которые дают начало опухолям, содержащим различные типы тканей, часто в пределах одной и той же опухоли. Эти «зародышевые» опухоли включают семиному (дисгерминому у женщин), хориокарциному, эмбриональную карциному, опухоль энтодермального синуса и тератокарциному. Хотя все эти опухоли чаще всего встречаются в яичниках или яичках, они также встречаются в экстрагонадных локализациях.
Один общий класс опухолей возникает из мультипотенциальных клеток, которые дают начало опухолям, содержащим различные типы тканей, часто в пределах одной и той же опухоли. Эти «зародышевые» опухоли включают семиному (дисгерминому у женщин), хориокарциному, эмбриональную карциному, опухоль энтодермального синуса и тератокарциному. Хотя все эти опухоли чаще всего встречаются в яичниках или яичках, они также встречаются в экстрагонадных локализациях.
Другая группа опухолей половых желез возникает из соединительнотканной стромы. У мужчин к ним относятся опухоли из клеток Сертоли-Лейдига (гомологичные опухоли у женщин могут быть арренобластомами, хотя большинство патологоанатомов используют «клетки Сертоли-Лейдига»), а у женщин — гранулезо-тека-клеточные опухоли, опухоли из прикорневых клеток и опухоли из липидных клеток. Хотя технически все эти опухоли возникают из соединительной ткани, им даются отдельные названия из-за специализированной природы и функции стромальных клеток гонад.

 ЕСг-клетки
ЕСг-клетки

 PMID: 36675
Аннотация недоступна.
PMID: 36675
Аннотация недоступна.