Серные пробки: новый взгляд на старую проблему | Гаров Е.В., Сударев П.А.
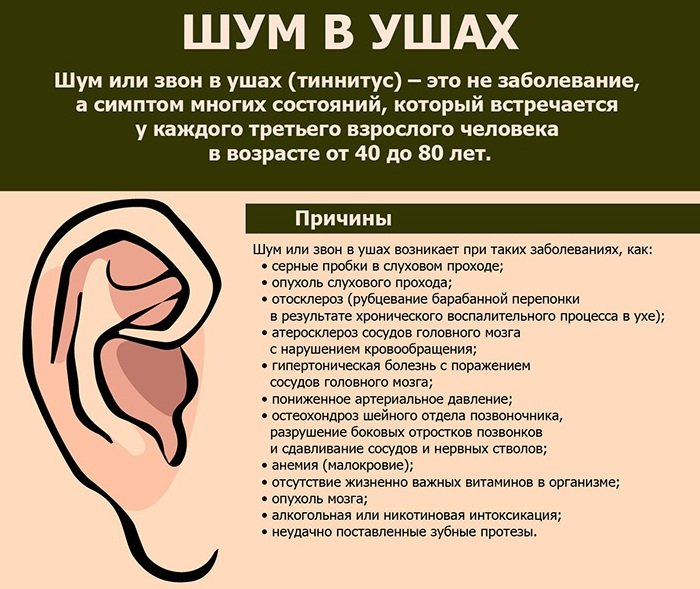
Проблема серных пробок достаточно распространена и актуальна во всем мире. По данным В.С. Козлова, около 4% населения Российской Федерации сталкиваются с этим явлением. Всего в РФ серные пробки отмечаются у 4 млн лиц трудоспособного возраста, у 750 тыс. пожилых людей и 860 тыс. детей [1].
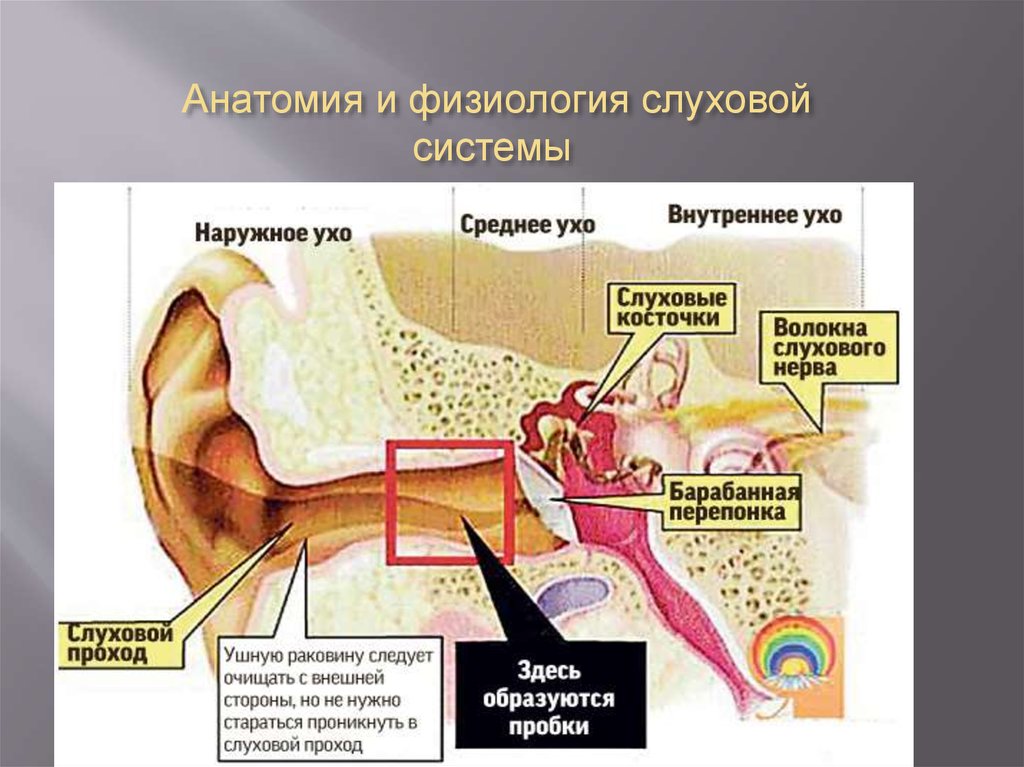
Ушная сера представляет собой композицию из секрета серных и сальных желез, а также слущенного эпителия кожи наружного слухового прохода. Она обеспечивает очищение слухового прохода от инородных частиц, его увлажнение и защиту от негативного влияния экзогенных и биологических факторов. В наружном ухе около 2000 серных желез, которые вырабатывают приблизительно 15–20 мг ушной серы в месяц. Физические и физиологические свойства ушной серы связаны с ее биохимическим составом. Так как основными ее компонентами являются липиды, холестерол и ненасыщенные жирные кислоты, ушная сера не растворяется в воде и выступает в качестве естественной смазки, препятствующей высыханию тонкого эпителия наружного слухового прохода и барабанной перепонки.
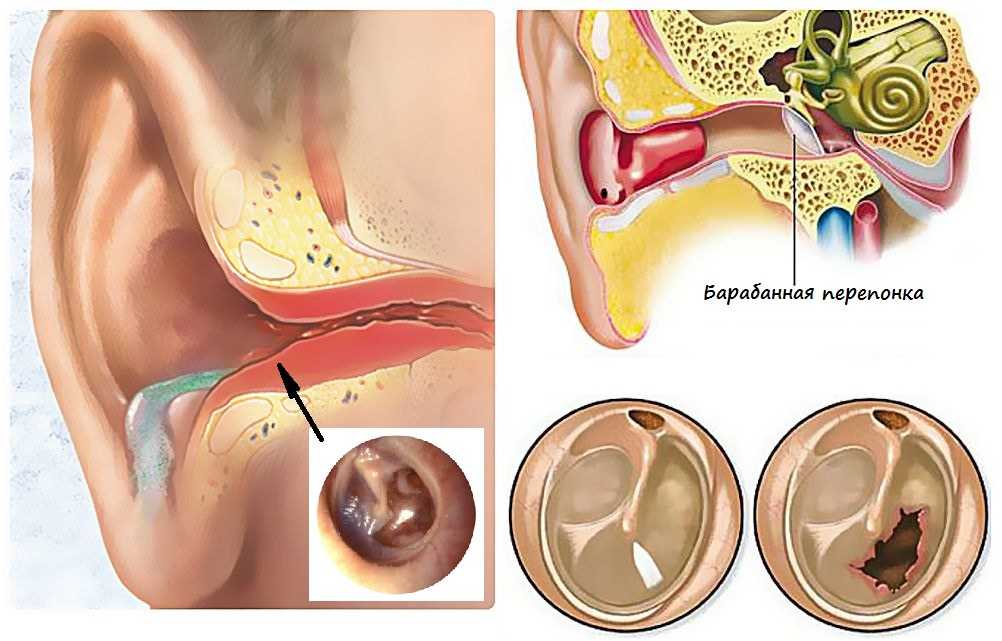
В норме ушная сера удаляется самопроизвольно при движениях височно–нижнечелюстного сустава. Однако в определенных условиях затрудняется очищение наружного слухового прохода от накопившегося секрета, и может образовываться так называемая серная пробка. Среди причин ее образования следует выделить врожденные или приобретенные особенности анатомии наружного слухового прохода (сужение и выраженный изгиб его костной части), естественную склонность к гиперсекреции серы, заболевания и реконструктивные вмешательства в этой области, использование слуховых аппаратов, длительное нахождение в запыленных условиях, избыточный рост волос внутри слухового прохода и неправильный гигиенический уход за наружным ухом. Каждая из этих причин непосредственно или опосредованно (механически или через изменение биохимического состава серы) может влиять на формирование серных пробок.
 Сопутствующие эндокринные или кожные заболевания также являются провоцирующим моментом их образования.
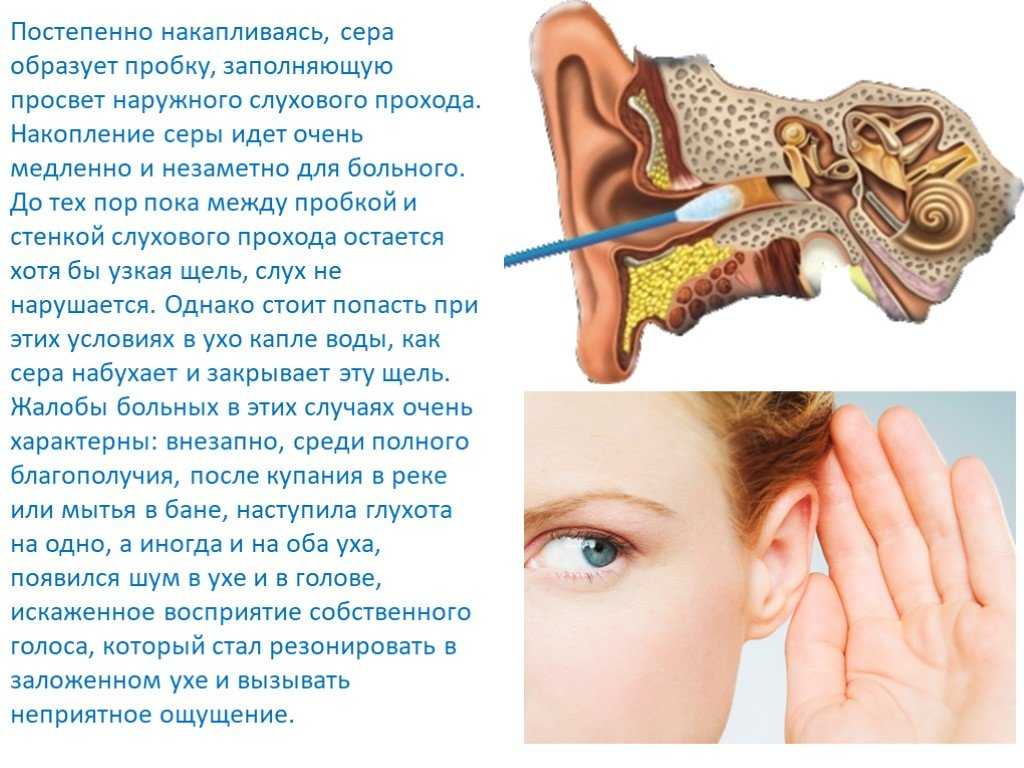
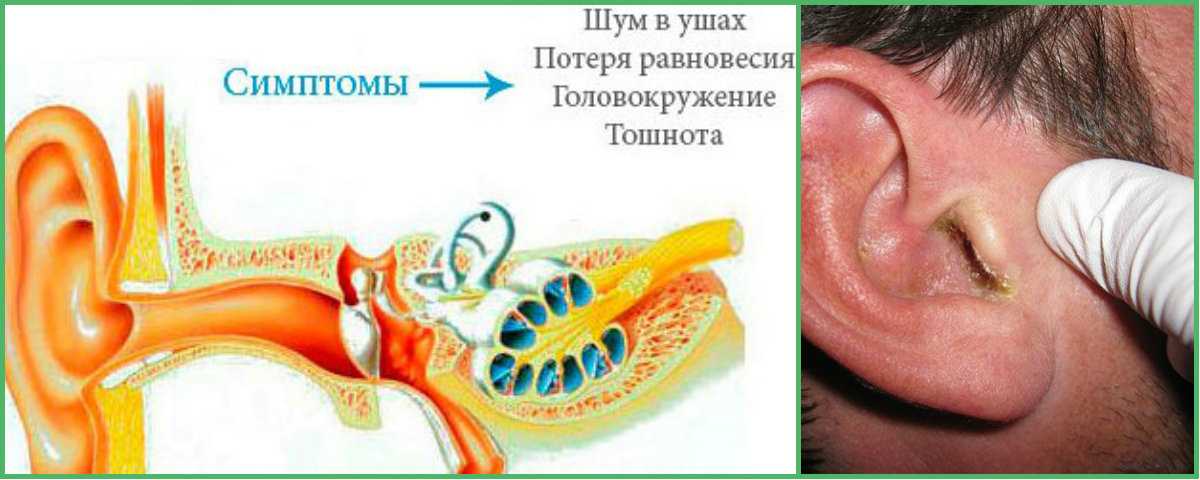
Сопутствующие эндокринные или кожные заболевания также являются провоцирующим моментом их образования. Диагноз «серная пробка» (код по МКБ 10 – H61.2) ставится на основании анамнеза и типичной клинической картины. Серная пробка может длительно существовать бессимптомно, если она не перекрывает полностью слуховой проход. Но достаточно в него попасть небольшому количеству воды, и ушная сера набухает. В результате этого внезапно снижается слух, возникают ощущение заложенности и гул/шум в ухе, в некоторых случаях – боль в слуховом проходе. Если пробка давит на барабанную перепонку, могут появляться головные боли, головокружение, тошнота и кашель [2].
Основным диагностическим методом является отоскопия, посредством которой определяются наличие серной пробки, ее консистенция и причины образования. Как правило, при исследовании слуха камертональными тестами у пациентов выявляется кондуктивная тугоухость.
 Данные процедуры выполняются при непосредственном участии оториноларинголога. Результатами неквалифицированных или самостоятельных (с помощью ватных палочек, зубочисток и др.) попыток удаления являются травма кожи слухового прохода, уплотнение образования, смещение серы к барабанной перепонке и ее разрыв с нарушением цепи слуховых косточек или без. Около 70% случаев перфорации барабанной перепонки в детском возрасте вызвано неправильным применением ватных палочек. Часто на прием к отоларингологу пациенты приходят не в связи с серными пробками, а из–за печальных последствий самостоятельного применения «народных» методов их удаления.
Данные процедуры выполняются при непосредственном участии оториноларинголога. Результатами неквалифицированных или самостоятельных (с помощью ватных палочек, зубочисток и др.) попыток удаления являются травма кожи слухового прохода, уплотнение образования, смещение серы к барабанной перепонке и ее разрыв с нарушением цепи слуховых косточек или без. Около 70% случаев перфорации барабанной перепонки в детском возрасте вызвано неправильным применением ватных палочек. Часто на прием к отоларингологу пациенты приходят не в связи с серными пробками, а из–за печальных последствий самостоятельного применения «народных» методов их удаления.Церуменолиз – один из древних, эффективных и безопасных способов удаления серных пробок путем применения размягчающих или растворяющих препаратов (3% раствор перекиси водорода, раствор би– или гидрокарбоната натрия, их сочетания, масла, Ремо–Вакс, А–Церумен, Ауди–беби, Ауди–спрей, церумекс и др.) [1]. Данные препараты применяются и для гигиенического туалета наружного слухового прохода как мера профилактики образования серных пробок.
 Но церуменолизис не всегда бывает эффективным, и требуется дополнительное использование других способов удаления остатков серной пробки. Учитывая, что после применения церуменолитических средств серная пробка становится рыхлой, она легко удаляется с помощью аспирации или ирригации.
Но церуменолизис не всегда бывает эффективным, и требуется дополнительное использование других способов удаления остатков серной пробки. Учитывая, что после применения церуменолитических средств серная пробка становится рыхлой, она легко удаляется с помощью аспирации или ирригации. Инструментальное удаление (кюретаж) серной пробки эффективно и безопасно только при использовании оптики (микроскоп) и специальных инструментов (рис. 1). При этом удаляются образования любого размера и консистенции. Однако данное оборудование не всегда имеется в поликлиниках.

На сегодняшний день самым распространенным среди отоларингологов способом удаления серной пробки является ее вымывание (ирригация). При мягкой консистенции пробки и правильном выполнении данная процедура эффективна. При плотной консистенции и абсолютной обтурации слухового прохода требуются назначение церуменолитических средств и повторение процедуры. Несоблюдение методики выполнения процедуры с помощью шприца типа Жане (J. Janet) вызывает травму кожи наружного слухового прохода, барабанной перепонки, цепи слуховых косточек, развитие вестибулярных нарушений, а также наружного и среднего отита (примерно у одного на тысячу промываний).
Кроме того, сам инструмент (Ш–712, объем 100–200 мл) неудобен в работе и способен создать струю силой в 10 атмосфер, а здоровая барабанная перепонка выдерживает максимум 2 атмосферы (рис. 2). Поэтому вымывание серных пробок с помощью шприца Жане даже в руках специалиста нельзя считать достаточно безопасной процедурой. Во многих странах от данной методики отказались.

Около 30 лет назад В.С. Козлов разработал способ эффективного и безопасного вымывания серной пробки посредством использования ниппеля на конце обычного шприца объемом 20,0 мл. Применение шприца такого объема удобно для специалиста и безопасно в силу невозможности создать им струи высокого давления. Эффективность вымывания обеспечивалась колебаниями ниппеля при создании давления в шприце и низком количестве расхода растворов. Однако предложенная простая методика не нашла применения.
 Кроме того, данный компактный прибор может работать как от сети, так и автономно на аккумуляторах, что позволяет использовать его не только в поликлиниках, но и на дому. При этом для промывания может использоваться любой антисептик. Ирригатор соответствует всем стандартам безопасности ЕС и предназначен для поддержания рекомендуемого уровня гигиены и минимизации риска перекрестной инфекции.
Кроме того, данный компактный прибор может работать как от сети, так и автономно на аккумуляторах, что позволяет использовать его не только в поликлиниках, но и на дому. При этом для промывания может использоваться любой антисептик. Ирригатор соответствует всем стандартам безопасности ЕС и предназначен для поддержания рекомендуемого уровня гигиены и минимизации риска перекрестной инфекции.В отделе микрохирургии уха Московского научно–практического центра оториноларингологии на поликлиническом приеме в течение 2 мес. с помощью ирригатора Propulse проведено удаление серных пробок у 48 пациентов (в том числе у 11 детей) и вымывание отделяемого из полостей у 27 больных хроническим гнойным средним отитом, перенесших открытые санирующие операции. Для механического отмывания использовался теплый 0,9% раствор хлорида натрия с последующим высушиванием и обработкой наружного слухового прохода или послеоперационной полости антисептическими или антимикотическими препаратами. У всех пациентов был достигнут положительный результат после одного посещения при низком расходе вымывающих растворов.

Таким образом, учитывая непрекращающиеся осложнения после самостоятельного или поликлинического удаления серных пробок, необходимо усилить просветительную работу среди населения и шире использовать новые, атравматичные методики выполнения этой простой, но опасной процедуры.
Литература
1. Оториноларингология: национальное руководство (под ред. В.Т. Пальчуна). М.: ГЭОТАР–Медиа, 2008. С. 541–544.
2. Hartmann A. Учебник по ушным болезням. СПб.: Практическая медицина, 1900. С. 15–18, 81–84.
H61.2 — Серная пробка — список препаратов нозологической группы в справочнике МКБ-10
Препараты нозологической группы H61.2
Найдено препаратов:17
| МИ | А-Церумен Плюс | Средство многофункциональное отоларингологическое д/промывания слухового прохода: фл. | Laboratoires GILBERT (Франция) контакты: | |
| Бон-Дижон | Порошок д/пригот. | МОСКОВСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА (Россия) | ||
| Мундизал | Гель д/местн. прим. 8.7%: туба 8 г рег. №: П N011976/01 от 15.02.08 | MUNDIPHARMA (Германия) | ||
| Натрия бикарбонат | Р-р д/инф. | ЛИКВОР (Армения) | ||
| Натрия бикарбонат | Р-р д/инф. 8.4%: фл. 20 мл 30 шт. рег. №: ЛСР-001057/08 от 26.02.08 | ЛИКВОР (Армения) | ||
| Натрия гидрокарбонат | Порошок д/пригот. | ЯРОСЛАВСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА (Россия) | ||
| Натрия гидрокарбонат | Порошок д/пригот. р-ра д/приема внутрь и местн. прим. 25 г: банки рег. №: ЛСР-001058/08 от 26.02.08 | ЯРОСЛАВСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА (Россия) | ||
| Натрия гидрокарбонат | Р-р д/инф. | ДАЛЬХИМФАРМ (Россия) | ||
| Натрия гидрокарбонат | Р-р д/инф. 5%: 100 мл, 200 мл или 400 мл бут. рег. №: ЛП-002770 от 17.12.14 | МОСФАРМ (Россия) | ||
| Натрия гидрокарбонат | Р-р д/инф. | БИОСИНТЕЗ (Россия) | ||
| Натрия гидрокарбонат-Эском | Р-р д/инф. 42 мг/мл: 100 мл или 200 мл бут. 1 или 28 шт., 400 мл бут. 1 или 15 шт. рег. №: ЛСР-009036/10 от 31.08.10 | ЭСКОМ НПК (Россия) | ||
| Натрия гидрокарбонат-Эском | Р-р д/инф. | ЭСКОМ НПК (Россия) | ||
| Натрия гидрокарбонат-Эском | Р-р д/инф. 84 мг/мл: 100 мл или 200 мл бут. 1 или 28 шт., 400 мл бут. 1 или 15 шт. рег. №: ЛСР-009036/10 от 31.08.10 | ЭСКОМ НПК (Россия) | ||
| Отинум | Капли ушные 20%: фл. | VIATRIS HEALTHCARE (Германия) Произведено: ICN POLFA RZESZOW (Польша) контакты: | ||
| МИ | Средство многофункциональное отоларингологическое для промывания ушного прохода «А-Церумен» | Раствор: фл. | Laboratoires GILBERT (Франция) | |
| МИ | Средство многофункциональное отоларингологическое для промывания ушного прохода «А-Церумен» | Спрей: фл. 40 мл с распылительной насадкой рег. №: ФСЗ 2011/10222 от 19.07.11 | Laboratoires GILBERT (Франция) |
Описания препаратов с недействующими рег. уд. или не поставляемые на рынок РФ
уд. или не поставляемые на рынок РФ
| Натрия гидрокарбонат | Порошок д/пригот. р-ра д/приема внутрь и местн. прим. 10 г: пак. 10 шт. рег. №: Р N000409/01-2001 от 07.08.08 Дата перерегистрации: 17.11.08 | МОСКОВСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА (Россия) |
Описания активных веществ под международным непатентованным наименованием
| натрия гидрокарбонат (sodium bicarbonate) | BP | список |
| холина салицилат (choline salicylate) | Rec. INN INN | список |
Метаболиты серы, способствующие переносу углерода океаническим фитопланктоном и бактериями
1. Fuhrman JA. Морские вирусы и их биогеохимические и экологические эффекты. Природа. 1999; 399:541. дои: 10.1038/21119. [PubMed] [CrossRef] [Google Scholar]
2. Morán XAG, Ducklow HW, Erickson M. Потоки углерода через эстуарные бактерии отражают взаимодействие с фитопланктоном. Mar Ecol Prog Сер. 2013; 489:75–85. doi: 10.3354/meps10428. [CrossRef] [Google Scholar]
3. Ханселл Д.А. Упорные растворенные органические фракции углерода. Энн Рев, морская наука. 2013;5:421–45. doi: 10.1146/annurev-marine-120710-100757. [PubMed] [CrossRef] [Академия Google]
4. Dupont CL, Rusch DB, Yooseph S, Lombardo M-J, Richter RA, Valas R, et al. Геномный взгляд на SAR86, многочисленную и некультивируемую линию морских бактерий. ISME J. 2012; 6: 1186–99. doi: 10.1038/ismej.2011.189. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Tripp HJ, Kitner JB, Schwalbach MS, Dacey JW, Wilhelm LJ, Giovannoni SJ. Морским бактериям SAR11 для роста требуется экзогенная восстановленная сера. Природа. 2008; 452:741–4. doi: 10.1038/nature06776. [PubMed] [CrossRef] [Академия Google]
Tripp HJ, Kitner JB, Schwalbach MS, Dacey JW, Wilhelm LJ, Giovannoni SJ. Морским бактериям SAR11 для роста требуется экзогенная восстановленная сера. Природа. 2008; 452:741–4. doi: 10.1038/nature06776. [PubMed] [CrossRef] [Академия Google]
6. Sunda W, Kieber D, Kiene R, Huntsman S. Антиоксидантная функция DMSP и DMS в морских водорослях. Природа. 2002; 418:317–20. doi: 10.1038/nature00851. [PubMed] [CrossRef] [Google Scholar]
7. Strom S, Wolfe G, Slajer A, Lambert S, Clough J. Химическая защита в микропланктоне II: ингибирование питания простейших бета-диметилсульфониопропионатом (DMSP) Limnol Oceanogr. 2003; 48: 230–7. doi: 10.4319/lo.2003.48.1.0230. [CrossRef] [Google Scholar]
8. Kiene RP, Linn LJ, Bruton JA. Новые и важные роли DMSP в морских микробных сообществах. J Sea Res. 2000;43:209–24. doi: 10.1016/S1385-1101(00)00023-X. [CrossRef] [Google Scholar]
9. Кайзер К., Беннер Р. Трансформация органического вещества в верхней мезопелагической зоне северной части Тихого океана: химический состав и связь со структурой микробного сообщества. J Geophys Res Oceans. 2012;C10123:117.
J Geophys Res Oceans. 2012;C10123:117.
10. Моппер К., Шульц К.А., Шеволо Л., Жермен С., Ревуэлта Р., Доусон Р. Определение сахаров в неконцентрированной морской воде и других природных водах жидкостной хроматографией и импульсным амперометрическим детектированием. Технологии экологических наук. 1992;26:133–138. doi: 10.1021/es00025a014. [CrossRef] [Google Scholar]
11. Азам Ф., Малфатти Ф. Микробное структурирование морских экосистем. Nat Rev Microbiol. 2007; 5: 782–91. doi: 10.1038/nrmicro1747. [PubMed] [CrossRef] [Google Scholar]
12. McCarren J, Becker JW, Repeta DJ, Shi Y, Young CR, Malmstrom RR, et al. Транскриптомы микробных сообществ выявляют микробы и метаболические пути, связанные с круговоротом растворенных органических веществ в море. Proc Natl Acad Sci USA. 2010;107:16420–7. doi: 10.1073/pnas.1010732107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Порецкий Р.С., Сун С., Моу Х, Моран М.А. Гены-транспортеры экспрессируются прибрежным бактериопланктоном в ответ на растворенный органический углерод. Окружающая среда микробиол. 2010;12:616–27. doi: 10.1111/j.1462-2920.2009.02102.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Окружающая среда микробиол. 2010;12:616–27. doi: 10.1111/j.1462-2920.2009.02102.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Сатински Б.М., Крамп Б.С., Смит К.Б., Шарма С., Зелински Б.Л., Доэрти М. и др. Паттерны микропространственной экспрессии генов в шлейфе реки Амазонки. Proc Natl Acad Sci USA. 2014; 111:11085–90. doi: 10.1073/pnas.1402782111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Ланда М., Бернс А.С., Рот С.Дж., Моран М.А. Ремоделирование бактериального транскриптома во время последовательного совместного культивирования с морскими динофлагеллятами и диатомовыми водорослями. ISME J. 2017; 11: 2677–90. doi: 10.1038/ismej.2017.117. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Sunagawa S, Coelho LP, Chaffron S, Kultima JR, Labadie K, Salazar G, et al. Структура и функции микробиома глобального океана. Наука. 2015;348:1261359. doi: 10.1126/science.1261359. [PubMed] [CrossRef] [Академия Google]
17. Киене Р.П., Сервис СК. Разложение растворенных ДМСП и ДМС в эстуарных водах: зависимость от температуры и концентрации субстрата. Mar Ecol Prog Сер. 1991;76:1–11. doi: 10.3354/meps076001. [CrossRef] [Google Scholar]
Киене Р.П., Сервис СК. Разложение растворенных ДМСП и ДМС в эстуарных водах: зависимость от температуры и концентрации субстрата. Mar Ecol Prog Сер. 1991;76:1–11. doi: 10.3354/meps076001. [CrossRef] [Google Scholar]
18. Стюарт Ф.Дж., Оттесен Э.А., Делонг Э.Ф. Разработка и количественный анализ универсального протокола вычитания рРНК для микробной метатранскриптомики. ISME J. 2010; 4: 896–907. doi: 10.1038/ismej.2010.18. [PubMed] [CrossRef] [Академия Google]
19. Лангмид Б., Зальцберг С.Л. Быстрое выравнивание с промежутками чтения с помощью Bowtie 2. Nat Methods. 2012; 9: 357–9. doi: 10.1038/nmeth.1923. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Anders S, Pyl PT, Huber W. HTSeq — платформа Python для работы с высокопроизводительными данными секвенирования. Биоинформатика. 2015;31:166–9. doi: 10.1093/биоинформатика/btu638. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Wagner GP, Kin K, Lynch VJ. Измерение количества мРНК с использованием данных секвенирования РНК: измерение RPKM несовместимо между образцами.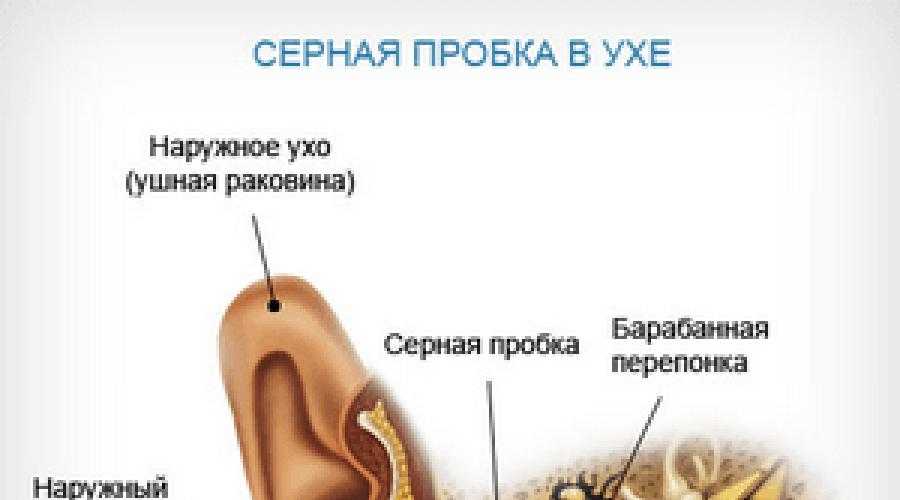 Теория Биологии. 2012; 131: 281–5. doi: 10.1007/s12064-012-0162-3. [PubMed] [CrossRef] [Академия Google]
Теория Биологии. 2012; 131: 281–5. doi: 10.1007/s12064-012-0162-3. [PubMed] [CrossRef] [Академия Google]
22. Лав М., Андерс С., Хубер В. Дифференциальный анализ данных подсчета — пакет DESeq2. Геном биол. 2014;15:550. doi: 10.1186/s13059-014-0550-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Oksanen J, Blanchet FG, Friendly M, Kindt R, Legendre P, McGlinn D et al. веган: Экологический пакет сообщества. 2017. https://CRAN.R-project.org/package=vegan.
24. Бухфинк Б., Се С., Хьюсон Д.Х. Быстрое и чувствительное выравнивание белков с помощью Diamond. Нат Методы. 2014;12:59–60. doi: 10.1038/nmeth.3176. [PubMed] [CrossRef] [Google Scholar]
25. Басби В.Ф. Сульфопропандиальная и цистеиновая кислоты в диатоме. Биохим Биофиз Акта. 1966; 121: 160–1. doi: 10.1016/0304-4165(66)90360-6. [PubMed] [CrossRef] [Google Scholar]
26. Басби В.Ф., Бенсон А.А. Метаболизм сульфоновой кислоты у диатомей Navicula pelliculosa . Физиология клеток растений. 1973; 14: 1123–32. [Google Scholar]
1973; 14: 1123–32. [Google Scholar]
27. Durham BP, Sharma S, Luo H, Smith CB, Amin SA, Bender SJ, et al. Скрытые циклы углерода и серы между планктоном на поверхности океана. Proc Natl Acad Sci USA. 2015;112:453–7. doi: 10.1073/pnas.1413137112. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Mayer J, Huhn T, Habeck M, Denger K, Hollemeyer K, Cook AM. 2, 3-дигидроксипропан-1-сульфонат, расщепленный Cupriavidus pinatubonensis JMP134: очистка дигидроксипропансульфонат-3-дегидрогеназы. Микробиология. 2010; 156:1556–64. doi: 10.1099/микрофон 0.037580-0. [PubMed] [CrossRef] [Google Scholar]
29. Сибуя И., Яги Т., Бенсон А.А. В Японском обществе физиологов растений, изд. Изучение микроводорослей и фотосинтезирующих бактерий. Токио: Издательство Токийского университета; 1963. с. 627–36.
30. Денгер К., Леманн С., Кук А.М. Молекулярная генетика и биохимия деградации N -ацетилтаурина Cupriavidus necator h26. Микробиология.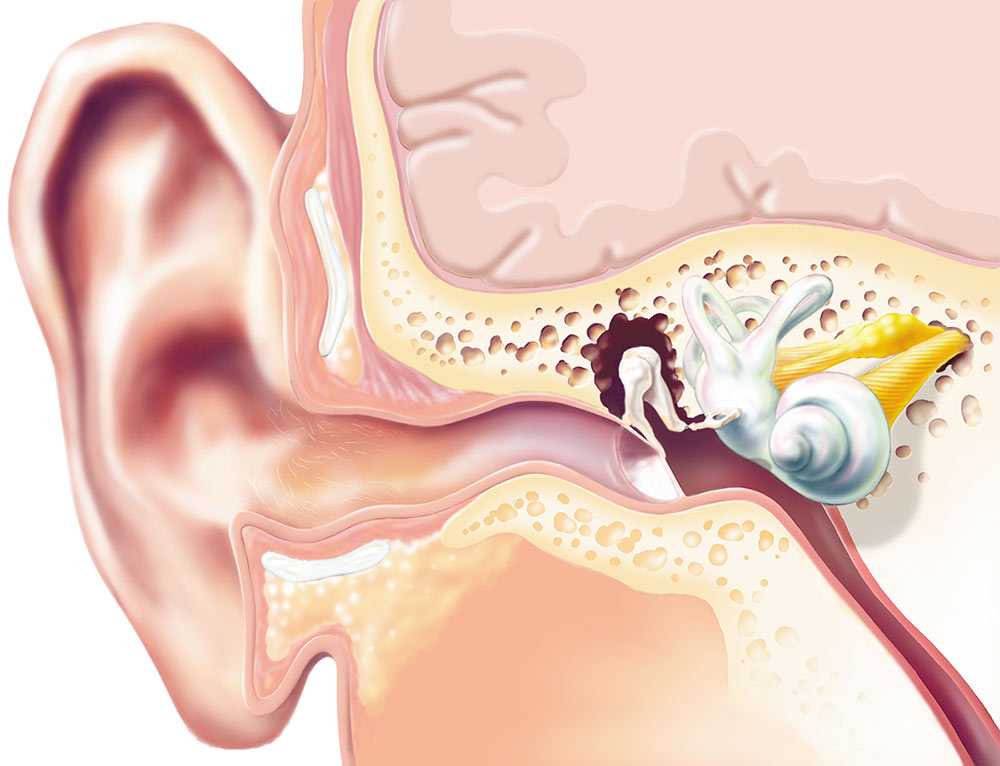 2011;157:2983–91. doi: 10.1099/микрофон 0.048462-0. [PubMed] [CrossRef] [Google Scholar]
2011;157:2983–91. doi: 10.1099/микрофон 0.048462-0. [PubMed] [CrossRef] [Google Scholar]
31. Горжинская А.К., Денгер К., Кук А.М., Смитс Т.Х. Индуцируемая транскрипция генов, участвующих в поглощении и диссимиляции таурина, с помощью Silicibacter pomeroyi DSS-3T. Арка микробиол. 2006; 185:402. doi: 10.1007/s00203-006-0106-8. [PubMed] [CrossRef] [Академия Google]
32. Weinitschke S, Sharma PI, Stingl U, Cook AM, Smits TH. Кластеры генов, участвующих в деградации изетионата наземными и морскими бактериями. Appl Environ Microbiol. 2010;76:618–21. doi: 10.1128/AEM.01818-09. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Jackson AE, Ayer SW, Laycock MV. Влияние солености на рост и аминокислотный состав морских диатомей Nitzschia pungens . Может Джей Бот. 1992; 70: 2198–201. дои: 10.1139/b92-272. [Перекрестная ссылка] [Академия Google]
34. Боруджерди А.Ф., Ли П.А., ДиТуллио Г.Р., Джанеч М.Г., Виед С.Б., Берден Д.В. Идентификация изетионовой кислоты и других низкомолекулярных метаболитов Fragilariopsis cylindrus с помощью ядерного магнитного резонанса. Анальный биоанальный хим. 2012; 404:777–84. doi: 10.1007/s00216-012-6169-2. [PubMed] [CrossRef] [Google Scholar]
Анальный биоанальный хим. 2012; 404:777–84. doi: 10.1007/s00216-012-6169-2. [PubMed] [CrossRef] [Google Scholar]
35. Lidbury I, Kimberley G, Scanlan DJ, Murrell JC, Chen Y. Сравнительный анализ геномики и мутагенеза метаболизма холина в морской ветви Roseobacter. Окружающая среда микробиол. 2015;17:5048–62. дои: 10.1111/1462-2920.12943. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Ikawa M, Taylor RF. In Martin D, Padilla G, редакторы. Морская фармакогнозия. Холин и родственные ему вещества в водорослях. Нью-Йорк: Академическая пресса; 1973. с. 203–40.
37. Тейлор Р.Ф., Икава М., Саснер Дж.Дж., младший, Терберг Ф.П., Андерсен К.К. Присутствие сложных эфиров холина в морских дионфлагеллятах Amphidinium carteri . Дж. Фикол. 1974; 10: 279–83. [Google Scholar]
38. Kiene RP, Linn LJ, Gonzalez J, Moran MA, Bruton JA. Диметилсульфониопропионат и метантиол являются важными предшественниками метионина и белковой серы в морском бактериопланктоне. Appl Environ Microbiol. 1999;65:4549–58. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Appl Environ Microbiol. 1999;65:4549–58. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Keller MD, Bellows WK, Guillard RR. В Saltzman ES, Cooper WJ, редакторы. Биогенная сера в окружающей среде. Продукция диметилсульфида в морском фитопланктоне. Вашингтон, округ Колумбия: публикации ACS; 1989. с. 167–82.
40. Керсон А.Р., Тодд Дж.Д., Салливан М.Дж., Джонстон А.В. Катаболизм диметилсульфониопропионата: микроорганизмы, ферменты и гены. Nat Rev Microbiol. 2011;9:849. doi: 10.1038/nrmicro2653. [PubMed] [CrossRef] [Академия Google]
41. Симо Р. Производство атмосферной серы океаническим планктоном: биогеохимические, экологические и эволюционные связи. Тенденции Экол Эвол. 2001; 16: 287–94. doi: 10.1016/S0169-5347(01)02152-8. [PubMed] [CrossRef] [Google Scholar]
42. Moran MA, Reisch CR, Kiene RP, Whitman WB. Геномное понимание бактериальных трансформаций DMSP. Annu Rev Mar Sci. 2012; 4: 523–42. doi: 10.1146/annurev-marine-120710-100827. [PubMed] [CrossRef] [Google Scholar]
43. Eyice Ö, Schäfer H. Методы, зависящие от культуры, и независимые от культуры методы позволяют выявить разнообразные метилотрофные сообщества в земной среде. Арка микробиол. 2016;198:17–26. doi: 10.1007/s00203-015-1160-x. [PubMed] [CrossRef] [Google Scholar]
Eyice Ö, Schäfer H. Методы, зависящие от культуры, и независимые от культуры методы позволяют выявить разнообразные метилотрофные сообщества в земной среде. Арка микробиол. 2016;198:17–26. doi: 10.1007/s00203-015-1160-x. [PubMed] [CrossRef] [Google Scholar]
44. Suylen G, Large P, Van Dijken J, Kuenen J. Метилмеркаптаноксидаза, ключевой фермент метаболизма метилированных соединений серы с помощью Hyphomicrobium EG. Микробиология. 1987; 133: 2989–97. doi: 10.1099/00221287-133-11-2989. [CrossRef] [Google Scholar]
45. Eyice Ö, Myronova N, Pol A, Carrión O, Todd JD, Smith TJ, et al. Бактериальный SBP56 идентифицирован как Cu-зависимая метантиолоксидаза, широко распространенная в биосфере. ИСМЕ Дж. 2017; 12:145. doi: 10.1038/ismej.2017.148. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Гонсалес Дж.М., Киен Р.П., Моран М.А. Трансформация соединений серы многочисленной линией морских бактерий в α-подклассе класса протеобактерий. Appl Environ Microbiol. 1999;65:3810–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1999;65:3810–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Тодд Д.Д., Керсон А.Р., Салливан М.Дж., Кирквуд М., Джонстон А.В. Ген Ruegeria pomeroyi acuI играет роль в катаболизме DMSP и напоминает yhdH из E. coli и других бактерий в придании устойчивости к акрилату. ПЛОС ОДИН. 2012;7:e35947. doi: 10.1371/journal.pone.0035947. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Varaljay VA, Robidart J, Preston CM, Gifford SM, Durham BP, Burns AS, et al. Однотактные полевые измерения регуляции бактериального гена, контролирующего судьбу DMSP. ISME J. 2015; 9: 1677–86. doi: 10.1038/ismej.2015.23. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Леманн С. Сульфитдегидрогеназы в органотрофных бактериях: ферменты, гены и регуляция. Констанц, Германия: Констанцский университет; 2013.
50. Ленк С., Морару С., Ханке С., Арндс Дж., Рихтер М., Кубе М. и соавт. Бактерии клады Roseobacter многочисленны в прибрежных отложениях и кодируют новую комбинацию генов окисления серы. ISME J. 2012; 6: 2178–87. doi: 10.1038/ismej.2012.66. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ISME J. 2012; 6: 2178–87. doi: 10.1038/ismej.2012.66. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Denger K, Smits TH, Cook AM. L-цистеатсульфолиаза, широко распространенный пиридоксаль-5′-фосфат-связанный десульфонирующий фермент, очищенный из Silicibacter pomeroyi DSS-3T. Биохим Дж. 2006; 394: 657–64. doi: 10.1042/BJ20051311. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Reisch CR, Crabb WM, Gifford SM, Teng Q, Stoudemayer MJ, Moran MA, et al. Метаболизм диметилсульфониопропионата Ruegeria pomeroyi DSS-3. Мол микробиол. 2013; 89: 774–91. doi: 10.1111/mmi.12314. [PubMed] [CrossRef] [Google Scholar]
53. Lei L, Cherukuri KP, Alcolombri U, Meltzer D, Tawfik DS. Семейство диметилсульфониопропионатных (DMSP) лиаз и лиазоподобных купинов состоит из настоящих DMSP-лиаз, а также других ферментов с неизвестной функцией. Биохимия. 2018;57:3364–77. doi: 10.1021/acs.biochem.8b00097. [PubMed] [CrossRef] [Google Scholar]
54. Curson AR, Williams BT, Pinchbeck BJ, Sims LP, Martinez AB, Rivera PPL, et al. DSYB катализирует ключевой этап биосинтеза диметилсульфониопропионата во многих фитопланктонах. Нат микробиол. 2018;3:430. doi: 10.1038/s41564-018-0119-5. [PubMed] [CrossRef] [Google Scholar]
Curson AR, Williams BT, Pinchbeck BJ, Sims LP, Martinez AB, Rivera PPL, et al. DSYB катализирует ключевой этап биосинтеза диметилсульфониопропионата во многих фитопланктонах. Нат микробиол. 2018;3:430. doi: 10.1038/s41564-018-0119-5. [PubMed] [CrossRef] [Google Scholar]
55. Galí M, Devred E, Levasseur M, Royer S-J, Babin M. Алгоритм дистанционного зондирования планктонного диметилсульфониопропионата (DMSP) и анализ глобальных закономерностей. Окружающая среда удаленных датчиков. 2015; 171:171–84. doi: 10.1016/j.rse.2015.10.012. [Перекрестная ссылка] [Академия Google]
56. Stefels J. Физиологические аспекты продукции и превращения ДМСП в морских водорослях и высших растениях. J Sea Res. 2000;43:183–97. doi: 10.1016/S1385-1101(00)00030-7. [CrossRef] [Google Scholar]
57. Denger K, Weiss M, Felux A-K, Schneider A, Mayer C, Spiteller D, et al. Сульфогликолиз в Escherichia coli K-12 закрывает пробел в биогеохимическом цикле серы. Природа. 2014; 507:114–7.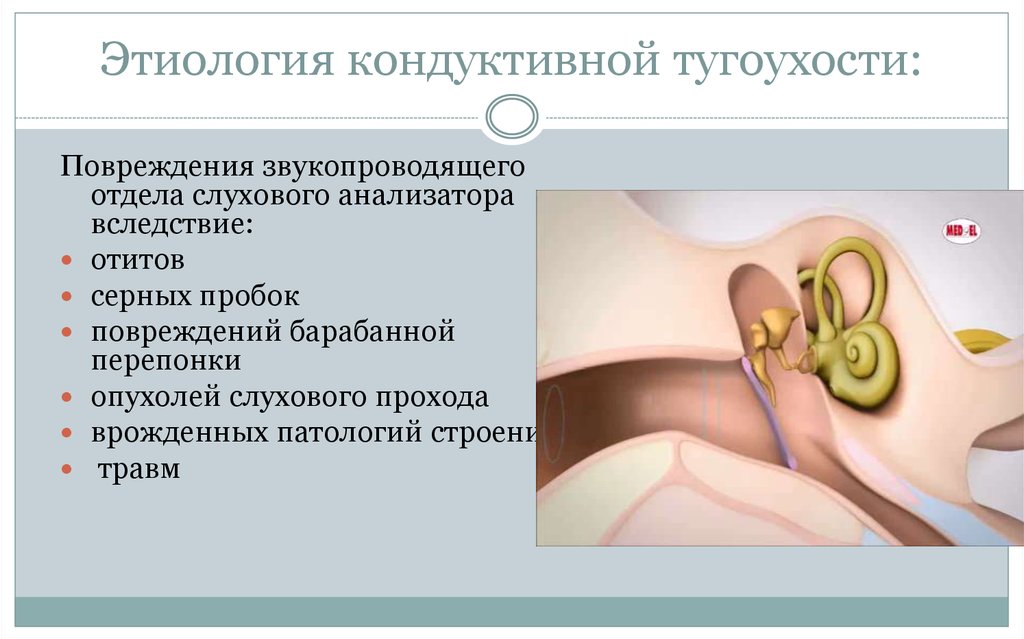 doi: 10.1038/nature12947. [PubMed] [CrossRef] [Академия Google]
doi: 10.1038/nature12947. [PubMed] [CrossRef] [Академия Google]
58. Саидха Т., Стерн А.И., Шифф Дж.А. Конъюгаты таурина в липидной фракции клеток Euglena и их митохондрий. Микробиология. 1993; 139: 251–7. [Google Scholar]
59. Клиффорд Э.Л., Ханселл Д.А., Варела М.М., Нието-Сид М., Херндл Г.Дж., Синтес Э. Зоопланктон ракообразных выделяет в океан большое количество растворенного органического вещества в виде таурина. Лимнол океаногр. 2017;62:2745–58. doi: 10.1002/lno.10603. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Thume Kathleen, Gebser Björn, Chen Liang, Meyer Nils, Kieber David J., Pohnert Georg. Метаболит диметилсульфоксония пропионат удлиняет морской сероорганический цикл. Природа. 2018;563(7731):412–415. doi: 10.1038/s41586-018-0675-0. [PubMed] [CrossRef] [Академия Google]
61. Ksionzek KB, Lechtenfeld OJ, McCallister SL, Schmitt-Kopplin P, Geuer JK, Geibert W, et al. Растворенная органическая сера в океане: биогеохимия инвентаризации петаграмм. Наука. 2016; 354:456–9. doi: 10.1126/science.aaf7796. [PubMed] [CrossRef] [Google Scholar]
Наука. 2016; 354:456–9. doi: 10.1126/science.aaf7796. [PubMed] [CrossRef] [Google Scholar]
62. Howard EC, Henriksen JR, Buchan A, Reisch CR, Bürgmann H, Welsh R, et al. Бактериальные таксоны, ограничивающие поток серы из океана. Наука. 2006; 314: 649–52. doi: 10.1126/science.1130657. [PubMed] [CrossRef] [Академия Google]
63. Reisch CR, Stoudemayer MJ, Varaljay VA, Amster IJ, Moran MA, Whitman WB. Новый путь усвоения диметилсульфониопропионата, широко распространенного среди морских бактерий. Природа. 2011; 473: 208–11. doi: 10.1038/nature10078. [PubMed] [CrossRef] [Google Scholar]
64. Bullock HA, Reisch CR, Burns AS, Moran MA, Whitman WB. Регуляторное и функциональное разнообразие метилмеркаптопропионат-коэнзим-лигаз из пути деметилирования диметилсульфониопропионата у Ruegeria pomeroyi DSS-3 и других протеобактерий. J Бактериол. 2014;196: 1275–85. doi: 10.1128/JB.00026-14. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Wirth JS. Филогеномика и метаболизм соединений серы в группе Roseobacter.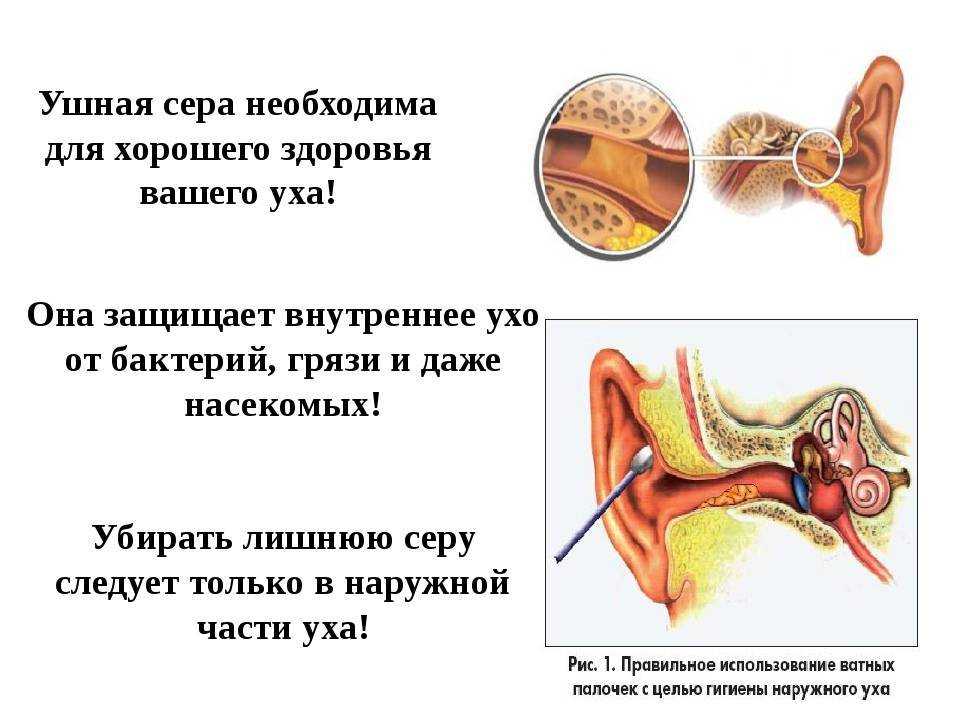 Афины, Джорджия, США: Университет Джорджии; 2019.
Афины, Джорджия, США: Университет Джорджии; 2019.
66. Тодд Д.Д., Кирквуд М., Ньютон-Пейн С., Джонстон А.В. DddW, третья DMSP-лиаза в модели морской бактерии Roseobacter, Ruegeria pomeroyi DSS-3. ISME J. 2012; 6: 223–6. doi: 10.1038/ismej.2011.79. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Тодд Д.Д., Роджерс Р., Ли Ю.Г., Векслер М., Бонд П.Л., Сан Л. и соавт. Структурные и регуляторные гены необходимы для производства диметилсульфида в бактериях. Наука. 2007; 315: 666–9. doi: 10.1126/science.1135370. [PubMed] [CrossRef] [Google Scholar]
68. Todd J, Curson A, Dupont C, Nicholson P, Johnston A. Ген dddP, кодирующий новый фермент, превращающий диметилсульфониопропионат в диметилсульфид, широко распространен в метагеномах океана и морских бактерий, а также встречается у некоторых аскомицетов. Окружающая среда микробиол. 2009 г.;11:1376–85. doi: 10.1111/j.1462-2920.2009.01864.x. [PubMed] [CrossRef] [Google Scholar]
69. Тодд Д. Д., Керсон А.Р., Кирквуд М., Салливан М.Дж., Грин Р.Т., Джонстон А.В. DddQ, новая диметилсульфониопропионатлиаза, содержащая купин, в морских розеобактериях и в некультивируемых морских бактериях. Окружающая среда микробиол. 2011;13:427–38. doi: 10.1111/j.1462-2920.2010.02348.x. [PubMed] [CrossRef] [Google Scholar]
Д., Керсон А.Р., Кирквуд М., Салливан М.Дж., Грин Р.Т., Джонстон А.В. DddQ, новая диметилсульфониопропионатлиаза, содержащая купин, в морских розеобактериях и в некультивируемых морских бактериях. Окружающая среда микробиол. 2011;13:427–38. doi: 10.1111/j.1462-2920.2010.02348.x. [PubMed] [CrossRef] [Google Scholar]
70. Brüggemann C, Denger K, Cook AM, Ruff J. Ферменты и гены диссимиляции таурина и изетионата в Paracoccus denitrificans . Микробиология. 2004; 150:805–16. doi: 10.1099/микрофон 0.26795-0. [PubMed] [CrossRef] [Google Scholar]
Сероводород — Обзор | Управление по безопасности и гигиене труда
- Темы по безопасности и гигиене труда
- Сероводород
Сероводород
Обзор
Основные моменты
Сероводород является одной из основных причин смерти от вдыхания газов на рабочем месте в США. По данным Бюро статистики труда (BLS), в период с 2011 по 2017 год сероводород стал причиной смерти 46 рабочих.
По данным Бюро статистики труда (BLS), в период с 2011 по 2017 год сероводород стал причиной смерти 46 рабочих.
Почему сероводород так опасен?
- Он легко воспламеняется и токсичен даже при низких концентрациях.
- Он тяжелее воздуха и может перемещаться по земле.
- Он может накапливаться в низинах и в замкнутых пространствах (в том числе в закрытых, плохо проветриваемых помещениях, таких как навозные ямы, канализация, люки и подземные хранилища).
- Через некоторое время при низкой концентрации или быстрее при высокой концентрации вы больше не сможете почувствовать его запах, чтобы предупредить вас, что он там.
- Может быстро, практически сразу, одолеть неподготовленных рабочих, в том числе и спасателей.
Сероводород (также известный как H 2 S, канализационный газ, болотный газ, вонючая влага и кислая влага) представляет собой бесцветный газ, известный своим резким запахом «тухлых яиц» при низких концентрациях.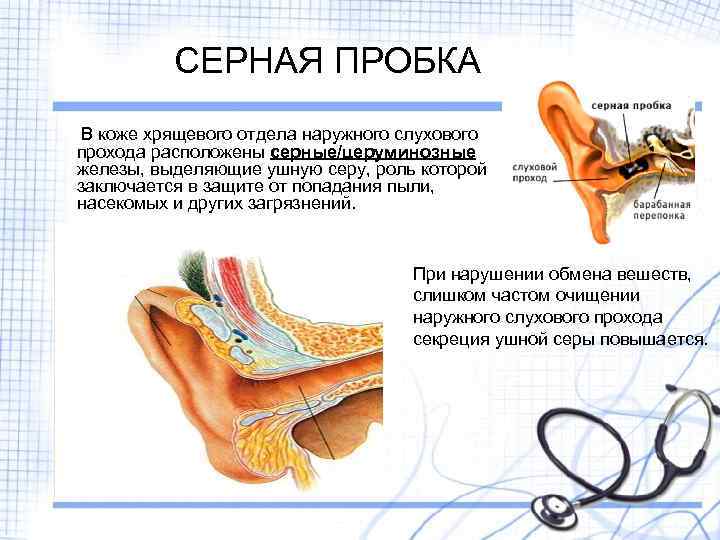 Он чрезвычайно легко воспламеняется и очень токсичен.
Он чрезвычайно легко воспламеняется и очень токсичен.
Сероводород используется или производится в ряде отраслей промышленности, таких как
- Переработка нефти и газа
- Горнодобывающая промышленность
- Дубление
- Целлюлозно-бумажная промышленность
- Вискоза производство
Сероводород также встречается в природе в канализации, навозных ямах, колодезной воде, нефтяных и газовых скважинах и вулканах. Поскольку сероводород тяжелее воздуха, он может скапливаться в низменных и замкнутых пространствах, таких как люки, канализация и подземные телефонные хранилища. Его присутствие делает работу в замкнутом пространстве потенциально очень опасной.
Воздействие сероводорода на здоровье зависит от того, сколько H 2 S дышит рабочий и как долго. Однако многие эффекты наблюдаются даже при низких концентрациях. Эффекты варьируются от легких, головных болей или раздражения глаз, до очень серьезных, потери сознания и смерти.
На этой веб-странице представлена информация о том, как сероводород может повлиять на ваше здоровье, где его можно найти и как предотвратить вредное воздействие.
Стандарты
Воздействие сероводорода рассматривается в конкретных стандартах OSHA для общей промышленности, морского судоходства и строительства.
Подробнее »
Опасности
Предоставляет информацию о влиянии сероводорода на безопасность и здоровье.
Подробнее »
Сероводород на рабочих местах
Обсуждает, где можно найти сероводород.
Подробнее »
Оценка/Контроль воздействия
Предоставляет информацию об оценке наличия газообразного сероводорода и о том, как по возможности устранить или контролировать источник.
Подробнее »
Дополнительные ресурсы
Содержит ссылки и ссылки на дополнительные ресурсы, связанные с сероводородом.
Подробнее »
Основные моменты
Сероводород является одной из основных причин смерти от вдыхания газов на рабочем месте в Соединенных Штатах.

 р-ра д/приема внутрь и местн. прим. 10 г: пак. 10 шт.
р-ра д/приема внутрь и местн. прим. 10 г: пак. 10 шт. 8.4%: бут. 200 мл 30 шт.
8.4%: бут. 200 мл 30 шт. р-ра д/приема внутрь и местн. прим. 10 г: пакеты 5 шт.
р-ра д/приема внутрь и местн. прим. 10 г: пакеты 5 шт. 40 мг/мл: 100 мл бут. 1 или 35 шт., 200 мл бут. 1 или 28 шт., 400 мл бут. 1 или 15 шт.
40 мг/мл: 100 мл бут. 1 или 35 шт., 200 мл бут. 1 или 28 шт., 400 мл бут. 1 или 15 шт. 5%: 200 мл бут. 1 или 24 шт., 400 мл бут. 1 или 12 шт.
5%: 200 мл бут. 1 или 24 шт., 400 мл бут. 1 или 12 шт.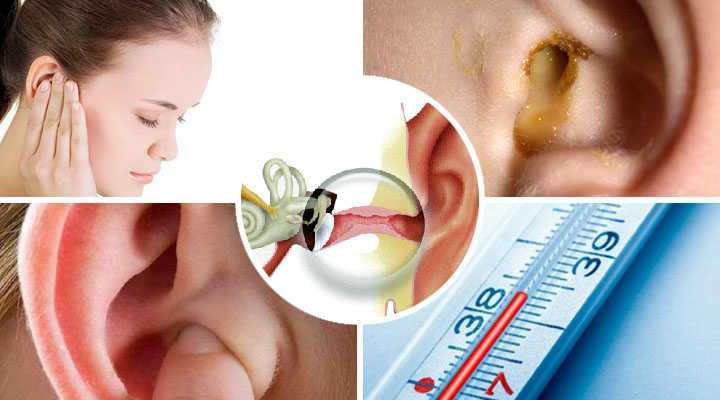 5%: фл. 100 мл, 200 мл или 400 мл
5%: фл. 100 мл, 200 мл или 400 мл -капельница 10 г
-капельница 10 г -капельн. 2 мл 2, 5 или 10 шт.
-капельн. 2 мл 2, 5 или 10 шт.