Саркомы мягких тканей | Содействие больным саркомой
Саркомы мягких такней
Саркомы мягких тканей это группа злокачественных новообразований, развивающихся в мышцах, в жировой, соединительной или фиброзной тканях. Опухоли могут развиваться где угодно, но излюбленным местом локализации являются нижние конечности, особенно, бедра.
Саркомы мягких тканей выглядят, как узлы бело-серового цвета. Они могут иметь как бугристую, так и почти гладкую поверхность. По консистенции опухоль может быть мягкой (липосаркома) или плотной (фибросаркома). Не имея капсулы, саркома мягких тканей склонна по мере роста провоцировать уплотнение окружающих тканей и образование так называемой ложной капсулы, придающей патологическому очагу четкие очертания. Чаще всего опухоли располагаются единично, но бывают и исключения. Метастазируют они гематогенным путем (через кровеносное русло).
Симптомы развития сарком мягких тканей
Патология характеризуется появлением безболезненного узелка или незначительной припухлости.
С увеличением роста новообразования часто возникает расширенная венозная сеть и язвенные участки. Во время движения могут возникать дискомфортные ощущения, хотя выраженного нарушения подвижности конечности при этом заболевании не наблюдается.
Лечение сарком мягких тканей
В лечении сарком мягких тканей используются комплексные методики, включающие хирургическое вмешательство, химиотерапию и лучевое воздействие. Опухоль иссекается с большим захватом здоровой ткани. При ее прорастании в костную ткань часто проводится ампутация конечности и всего участка пораженной ткани. Для уменьшения размера опухоли перед операцией применяют лучевую терапию.
После резекции опухоли курс лучевого лечения повторяют, что позволяет значительно снизить риск развития рецидива заболевания. Из современных методов лечения распространена адъювантная химиотерапия. Она способствует стойкой ремиссии злокачественного процесса и предотвращает распространение метастазов.
Из современных методов лечения распространена адъювантная химиотерапия. Она способствует стойкой ремиссии злокачественного процесса и предотвращает распространение метастазов.
Комплексный подход к лечению сарком мягких тканей позволяет повысить качество жизни больных и сохранить им жизнь. При своевременном лечении большой процент людей добивается полного выздоровления и возвращается к привычному образу жизни. Для успешного исхода болезни очень важно подобрать грамотных специалистов, имеющих успешный опыт лечения подобных заболеваний.
Злокачественная фиброзная гистиоцитома
Злокачественная фиброзная гистиоцитома является одной из самых распространенных среди сарком. Она может локализоваться в различных внутренних органах, но особенно часто развивается в забрюшинном пространстве и конечностях. Выглядит опухоль как узел с нечеткими краями и мелкими кровоизлияниями. Иногда опухоль развивается и в костях.
Злокачественная гистиоцитома считается наиболее распространенной формой опухолей мягких тканей. На ее долю приходится более 40% от этих злокачественных новообразований. Практически всегда опухоль локализуется в средних или глубоких мышечных слоях. Поражает людей 40-65 лет. Фиброксантосаркома отличается плотной консистенцией, медленным ростом, склонным к неожиданным скачкам.
На ее долю приходится более 40% от этих злокачественных новообразований. Практически всегда опухоль локализуется в средних или глубоких мышечных слоях. Поражает людей 40-65 лет. Фиброксантосаркома отличается плотной консистенцией, медленным ростом, склонным к неожиданным скачкам.
Признаки развития опухоли
Если злокачественная фиброзная гистиоцитома локализуется в костной ткани, то признаком болезни будет болевой приступ. С ростом опухоли повышается нагрузка на кость и она склонна ломаться даже при незначительном падении. При пальпации опухоль болезненная.
При гистиоцитоме брюшной полости опухоль может давить на рядом расположенные органы, провоцируя нарушение работы мочевого пузыря, матки и прямой кишки. Клиника болезни может быть различной, так как существует множество разновидностей злокачественных фиброзных гистиоцитом.
Способы диагностики опухоли
Для выявления злокачественной гистиоцитомы используют следующие методы диагностики:
- ультразвуковое исследование;
- рентгенография;
- магнито-резонансная, компьютерная томография;
- пункция, биопсия;
- гистологическое исследование.

При появлении неожиданных болей, припухлостей, нарушении в подвижности необходимо пройти комплексное обследование. Чем раньше будет диагностирована опухоль, тем легче ее лечить с использованием малотравматичных хирургических вмешательств. Уровень развития современной медицины позволяет проводить минимально травматичные операции, с сохранением функциональных способностей организма и высокого качества жизни.
Способы лечения ЗФГ
Пациентам с злокачественной фиброзной гистиоцитомой показано комплексное лечение, включающее как хирургическое иссечение опухоли, так и лучевое и химиотерапевтическое лечение. Лучевое воздействие используется до оперативного вмешательства и после него. Химиотерапия показана при наличии крупных опухолей.
В современных онкологических центрах сегодня стали применять химиотерапевтические препараты нового поколения, которые не оказывают таких выраженных побочных эффектов. Но, к сожалению, когда злокачественная фиброзная гистиоцитома метастазирует, помочь человеку и удалить все имеющиеся метастазы бывает крайне сложно..jpg)
Основном лечебным мероприятием при наличии этой опухоли является полное ее иссечение. При операции помимо патологического очага хирург удаляет и здоровые ткани. Часто приходится прибегать к радикальной эксции, иссекая более половины мышечного слоя. Ампутации пораженной конечности — тоже не редкость.
Злокачественная фиброзная гистиоцитома зачастую после хирургического лечения рецидивирует. Более 25% пациентов после удаления опухоли сталкиваются с единичными случаями рецидивов, 10% — с множественными очагами опухолевидного процесса. У более 90% прооперированных больных местный рецидив развивается в течение первых пяти лет после проведенного лечения.
Злокачественная фиброзная гистиоцитома начинает метастазировать в течение первого года после обнаружения. Если предпринять все меры к ее успешному удалению, то можно надеяться на успешный исход лечения. В 80% опухоль дает метастазы в легкие, гораздо реже — в забрюшинное пространство, кости и лимфатические сосуды.
Прогноз
На продолжительность больных с фиброзной гистиоцитомой влияет множество факторов: размер опухоли, стадия развития ее к моменту лечения, выраженность метастазирования, степень злокачественности.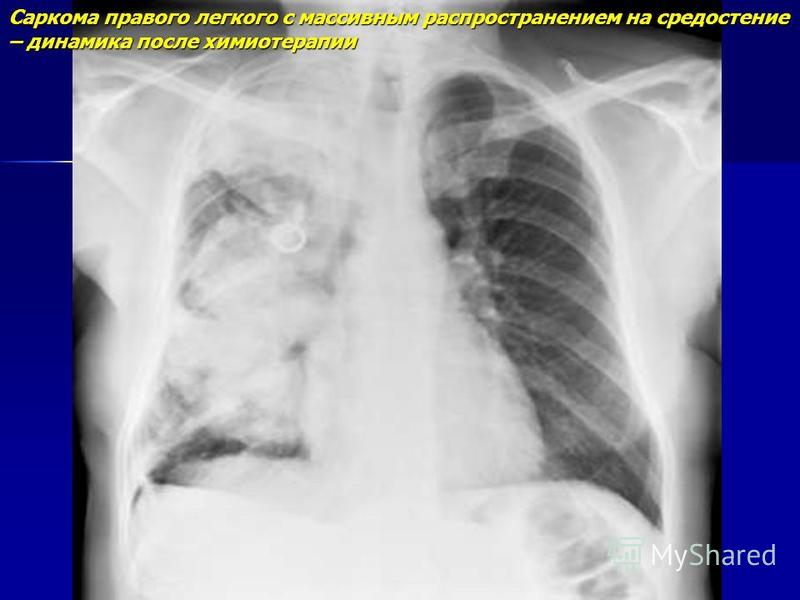
В среднем, более 70% пациентов с благоприятными показателями течения болезни и лечения живут более 7-10 лет. При наличии выраженного метастазирования, многократных случаев рецидивов срок уменьшается вдвое. Эффективность проводимого лечения во многом зависит от опыта хирурга и его компетентности. Злокачественные опухоли оперируются только подготовленными специалистами, знакомыми с особенностями течения и локализации того или иного злокачественного новообразования.
Липосаркома
Липосаркома — это опухоль, возникающая из клеток жировой ткани. По частоте обнаружения эта опухоль занимает второе место среди всех новообразований мягких тканей. Излюбленное место локализации липосаркомы — нижние конечности, особенно, область бедра. Довольно часто встречаются подобные опухоли и в забрюшинном пространстве. Средний возраст пациентов с липосаркомами — 50-60 лет.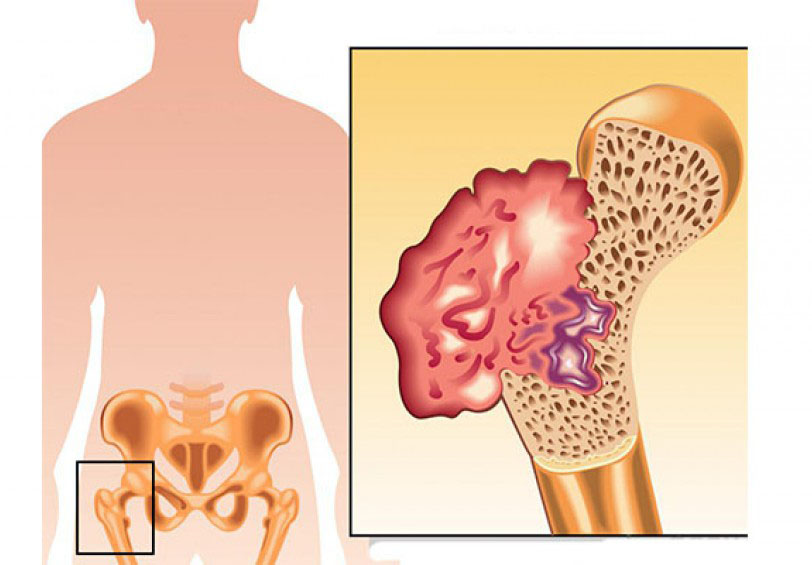
Симптомы липосаркомы
Липосаркома часто локализуется в глубоких слоях кожи, вплоть до околосуставных тканей. Во время пальпации опухоль обычно безболезненна. Вследствие этой особенности опухоль диагностируется не сразу, а только при появлении выраженных признаков болезни:
- увеличение размера конечности или той области, в которой располагается липосаркома;
- появление функциональных расстройств внутренних органов при локализации опухоли в забрюшинном пространстве.
Диагностика липосаркомы
В начальной стадии развития липосаркому необходимо дифференцировать от липомы. Для полноценного обследования клиника должна иметь современное оборудование и специалистов-онкологов, которым часто приходится сталкиваться с саркомами и успешно их диагностировать.
Среди распространенных методов диагностики можно выделить следующие:
- ультразвуковое исследование;
- компьютерная, магнито-резонансная томография;
- сцинтиграфия скелета.

При пальпации липосаркома имеет эластичную консистенцию, ограниченную поверхность, дольчатое строение. Опытный специалист без труда определяет вид опухоли при прощупывании.
Липосаркомы бывают нескольких видов: эмбриональная липома, липобластическая, миксоматозная, вымсокодифференцированная липосаркомы. Ускоренным ростом отличается миксоматозная опухоль. Она быстро увеличивается в размерах в течение короткого промежутка времени. Высокодифференцированные липосаркомы растут очень медленно и обычно диагностируются при большом размере. Их часто обнаруживают совершенно случайно, во время прохождения профилактического обследования.
Способы лечения липосаркомы
Как и любой вид сарком, липосаркома лечится в основном хирургически. При проведении операции удалению подлежит не только сама опухоль, но и часть окружающих ее тканей. Если липосаркома локализуется глубоко в тканях нижних конечностей, имеет большой размер, то иногда приходится осуществлять частичную резекцию кости с последующей трансплантацией.
После хирургического иссечения патологического участка проводится радиотерапия. В современных клиниках возможно применение точного радиационного лечения, воздействуя на определенный участок или орган. С помощью подобной тактики удается свести к минимуму негативное воздействие ионизирующего облучения на здоровые ткани. Если липосаркома не подлежит операции или успела дать множественные метастазы, то показано химиотерапевтическое лечение. Химиопрепараты оказывают частичное влияние на злокачественные клетки липосаркомы, успевшие распространиться по организму. Эта методика используется и в том случае, если пациенту противопоказано хирургическое вмешательство.
Пациенты с липосаркомами нуждаются в тщательно спланированном комплексном лечении. Врачебная тактика выбирается с учетом размера опухоли, ее локализации, степени злокачественности и общего самочувствия больного. Огромная роль в благоприятном исходе заболевания отведена дифференциальной диагностике и своевременным лечебным мероприятиям.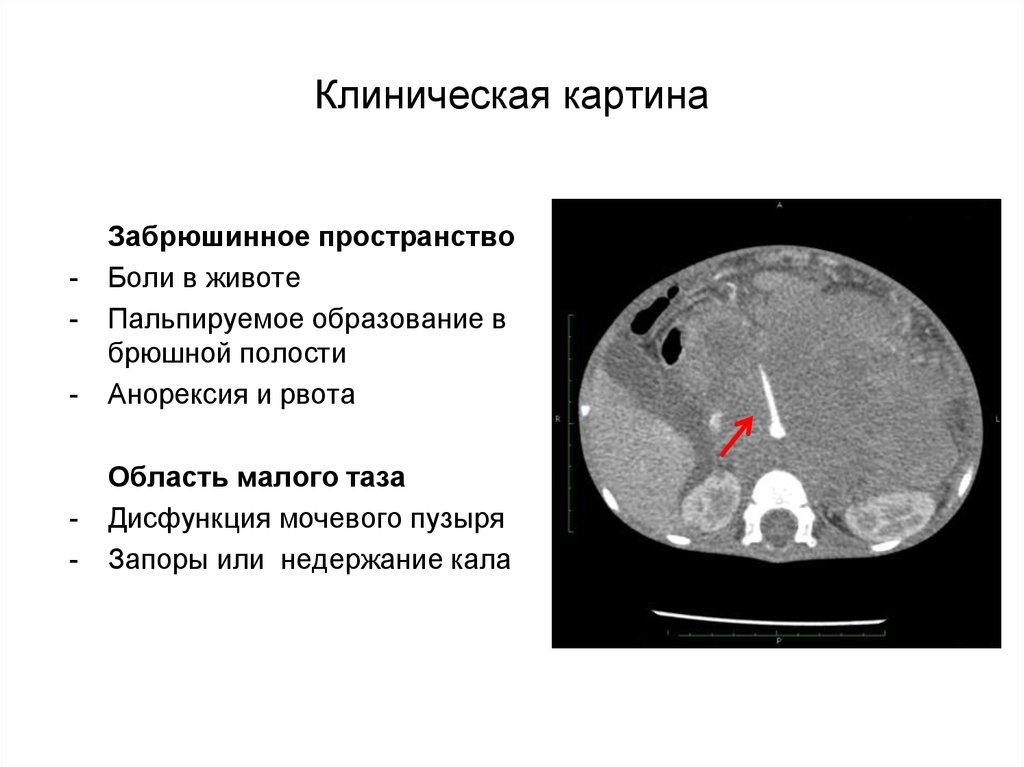 Чем раньше и точнее будет поставлен диагноз, тем качественнее будет назначенное лечение.
Чем раньше и точнее будет поставлен диагноз, тем качественнее будет назначенное лечение.
Прогноз
Прогноз зависит от гистологического типа опухоли и степени ее злокачественности. Если больному будет проведена операция с полным удалением патологических клеток, то риск развития рецидива будет минимальным. С помощью диагностики должны быть выявлены все возможные метастазы. В целом, частота рецидивирования среди прооперированных пациентов составляет 35%. Полное выздоровление наблюдается в 30% случаев. Пятилетняя выживаемость после проведенного курса лечения — более 55%.
Леймиосаркома
Леймиосаркома это онкологическое новообразование, развивающееся из гладких мышечных волокон, разновидность злокачественной лейомиомы. Опухоль может локализоваться в матке, на нижних конечностях, шее или голове, реже — во внутренних органах. Средний возраст заболевших — 40-65 лет.
Леймиосаркома отличается высокой степенью злокачественности и быстрым ростом.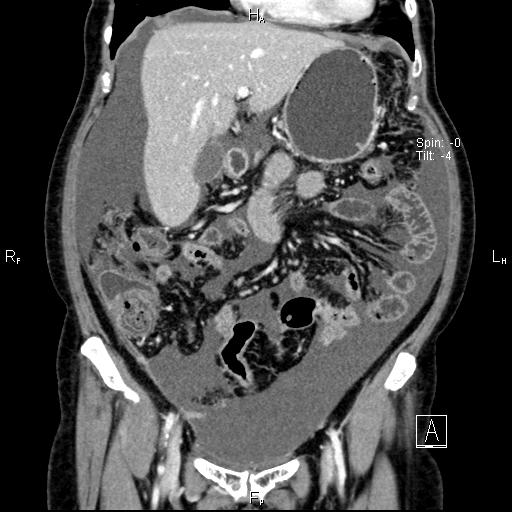 Опухоль склонна к раннему метастазированию. Заболевание крайне злокачественное, встречается довольно редко.
Опухоль склонна к раннему метастазированию. Заболевание крайне злокачественное, встречается довольно редко.
Признаки леймиосаркомы
Основным признаком патологии является обнаружение на осмотре или с помощью обследования опухоли с прогрессирующим ростом. По мере развития леймиосаркомы могут возникать следующие признаки:
- появление патологического новообразования на коже головы, шеи или нижних конечностей в виде бляшки с неровными краями — эластичной и плотной, залегающей в глубоких слоях кожи;
- склонность новообразования покрываться язвами и кровоточить;
- характерный цвет кожного покрова над опухолью: светло-желтый, красный или синий;
- болезненность опухоли;
- сбои в работе внутренних органов (при прорастании опухоли и ее давлении на соседние ткани).
Диагностика леймиосаркомы
Своевременно проведенная диагностика повышает шансы на полное выздоровление и предотвращает метастазирование опухоли. Для выявления заболевания применяются следующие методики:
- биопсия опухолевых тканей: если леймиосаркома локализуется во внутренних органах, то для забора материала используют пункционные или эндоскопические методы;
- гистологическое исследование забранного материала во время биопсии;
- ультразвуковая диагностика;
- рентгеновское исследование;
- магнито-резонансная, компьютерная томография.

Диагностику злокачественных новообразований необходимо проводить как можно раньше, в специализированных диагностических центрах. Расшифровкой полученных результатов должны заниматься опытные специалисты, знакомые с особенностями развития леймиосаркомы и их отображением на снимках.
Способы лечения леймиосаркомы
Лечение леймиосаркомы должно быть комплексным, с непременным учетом стадии болезни, степени озлокачествления и возможных рисков для жизни пациента. Опухоли подобного вида подлежат обязательному хирургическому иссечению.
Если леймиосаркома располагается на поверхности кожи, то ее удаляют с небольшим захватом здоровой ткани. При подкожных опухолях хирург должен устранить новообразование вместе с ее капсулой и рядом расположенными тканями. При обнаружении метастазирования в легких, печени, костном мозге или других органах метастазы удаляют вместе с опухолью.
Если леймиосаркома имеет внушительные размеры и высокую степень злокачественности, то в обязательном порядке проводится лучевая терапия.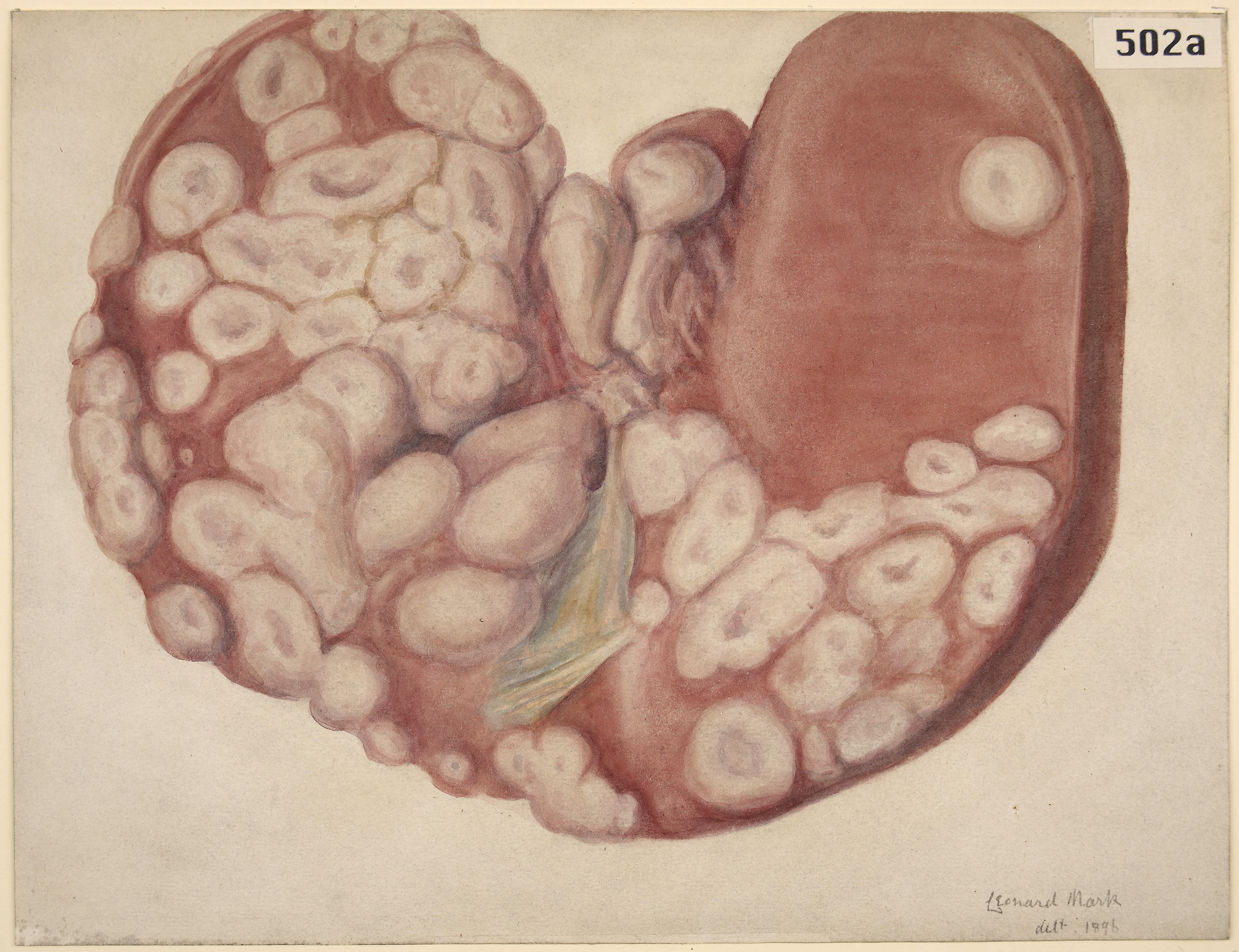 В некоторых случаях показана полная ампутация конечности, что позволяет сохранить пациенту жизнь и избежать частых случаев рецидивов. Согласно статистике, в 80% случаев после радикального удаления опухоли рецидивы возникает спустя 2-6 месяцев.
В некоторых случаях показана полная ампутация конечности, что позволяет сохранить пациенту жизнь и избежать частых случаев рецидивов. Согласно статистике, в 80% случаев после радикального удаления опухоли рецидивы возникает спустя 2-6 месяцев.
Химиотерапевтические препараты используются при распространении метастазов во внутренние органы и ткани. Цитостатики часто применяются не только после хирургического вмешательства, но и до оперативного лечения — с целью уменьшения роста опухоли и частичного уничтожения метастазов. В связи с высоким риском озлокачествления пациенты с леймиосаркомами подлежат комплексному лечению, объединяющему традиционные лечебные процедуры.
Прогноз
Несмотря на неблагоприятный прогноз, пациенты с леймиосаркомой имеют шансы на выздоровление. Очень важно сразу же после обнаружения опухоли начать лечение, желательно, в специализированной онкологической клинике, имеющей современное техническое оснащение. Профессиональные хирурги-онкологи и радиотерапевты подберут эффективную схему терапии в соответствии со степенью заболевания и состоянием организма больного.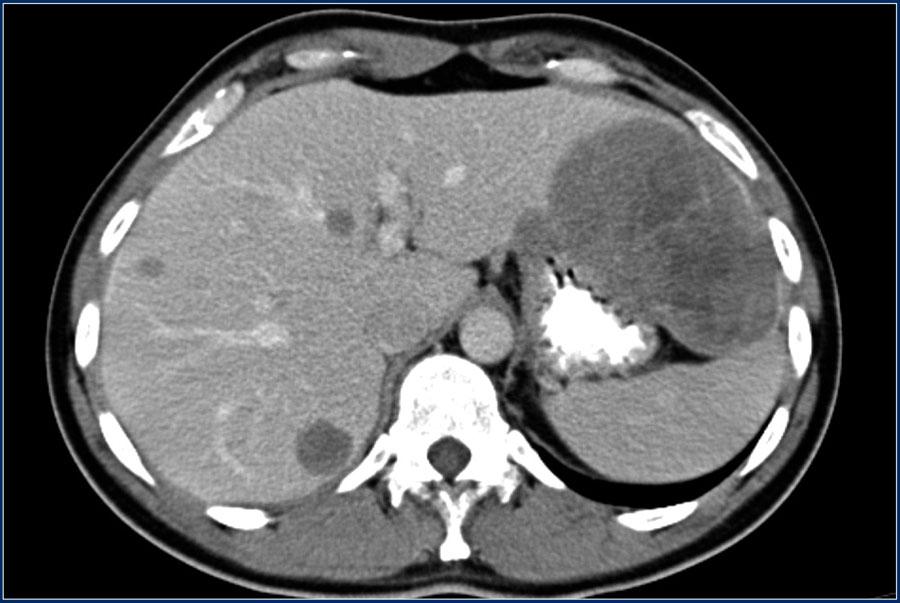 При соблюдении врачебных рекомендаций и применении усовершенствованных способов лечения удается избежать рецидивирования болезни и распространения метастазов.
При соблюдении врачебных рекомендаций и применении усовершенствованных способов лечения удается избежать рецидивирования болезни и распространения метастазов.
Синовиальная саркома
Синовиальная саркома (синовиома злокачественная) — одно из самых распространенных злокачественных новообразований мягких тканей, способных прорастать в костную ткань. Чаще всего развивается из синовиальной оболочки суставных структур нижних конечностей. Болезнь поражает людей трудоспособного возраста, как правило, до 50-60 лет. Опухоль метастазирует не сразу, а по мере прогрессирования процесса, как правило, в кости и легкие. В 40% случаев синовиальная саркома поражает голеностопный и коленный суставы.
Точной причины развития злокачественной синовиомы нет. Считается, что существуют определенные факторы риска, способные приводить к возникновению патологии, среди которых и изменения на генетическом уровне, и радиационное воздействие, и канцерогенное влияние на организм человека. Иногда синовиомы возникают на фоне посттравматического состояния.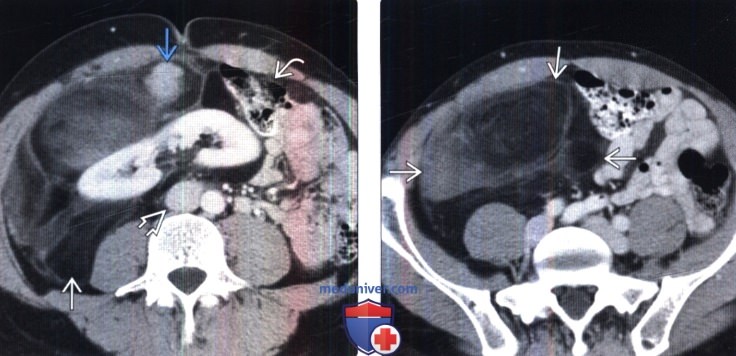
Признаки синовиальной саркомы
При пальпации опухоли она имеет консистенцию средней плотности. При кальцификации опухоль на новообразование становится более твердым. Сама опухоль, как правило, имеет щелевидные пространства и кисты, а также некротизированные участки с признаками кровоизлияния.
Кистозные полости часто содержат характерное содержимое, напоминающее синовиальную жидкость. С ростом злокачественной синовиомы возникают суставные боли, ограничение в подвижности пораженного злокачественным процессом сустава. При метастазировании могут появляться признаки недомогания, местное увеличение размера лимфатических сосудов, снижение аппетита и массы тела.
Диагностика синовиальной саркомы
Злокачественная синовиома требует проведения комплексной диагностики, включающей следующие методы:
- рентгеновские методы исследования;
- компьютерная, магнито-резонансная томография;
- ангиография;
- гистологическое исследование;
- биопсия новообразования;
- радиоизотопное сканирование;
- пункция лимфоузлов для подтверждения метастазирования;
- сцинтиграфия;
- ультразвуковое исследование.

Эффективная диагностика синовиальной саркомы подразумевает сочетание передовых методов исследования. Опухоль необходимо дифференцировать от фибросаркомы, мезотелиомой и эпителиоидной саркомы.
Современные онкологические центры сегодня очень хорошо оснащены. Часто саркомы выявляются во время профилактических осмотров. В любом случае лечение синовиальной саркомы не требует отлагательств и должно начинаться сразу же после обнаружения опухоли.
Способы лечения злокачественной синовиомы
Злокачественную синовиому лечат комбинированными методами, включающими:
- хирургическое иссечение патологического очага;
- лучевое лечение;
- химиотерапию.
Во время операции удаляются не только злокачественные ткани, но и здоровые в пределах 4-х сантиметров. Если синовиома имеет внушительный размер, возможно проведение полной ампутации конечности или резекции всего сустава с дальнейшим проведением эндопротезирования.
До и после оперативного вмешательства показано лучевое облучение. Лучевая терапия помогает остановить или уменьшить рост опухоли, а также предотвратить развитие рецидивов в послеоперационном периоде. Данная методика проводится курсами, схема лечения подбирается индивидуально. Химиотерапия проводится не всегда, а в случае выраженного метастазирования и высокой степени злокачественности опухоли. Прием современных цитостатиков позволяет негативно воздействовать на микрометастазы и значительно улучшать качество жизни пациентов с саркомами.
Лучевая терапия помогает остановить или уменьшить рост опухоли, а также предотвратить развитие рецидивов в послеоперационном периоде. Данная методика проводится курсами, схема лечения подбирается индивидуально. Химиотерапия проводится не всегда, а в случае выраженного метастазирования и высокой степени злокачественности опухоли. Прием современных цитостатиков позволяет негативно воздействовать на микрометастазы и значительно улучшать качество жизни пациентов с саркомами.
Прогноз
Самый злокачественной считается монофазная синовиома. Она часто метастазирует в легкие, склонна рецидивировать даже после полного иссечения патологического очага в 20% случаев у всех пациентов, прошедших полный курс лечения. Процент выживаемости низкий. Но при своевременном лечении удается избежать распространения метастазов и добиться стойкой ремиссии. Бифазная форма синовиальной саркомы отличается более благоприятным течением. Около 50% пациентов с такой опухолью полностью выздоравливают и не испытывают никаких ограничений в дальнейшей жизни.
Рабдомиосаркома
Рабдомиосаркома — редкая разновидность злокачественной опухоли, произрастающей из поперечно-полосатых мышц. Патологический процесс характеризуется неконтролируемым ростом и делением клеток скелетной мускулатуры, вследствие чего они приобретают сходство с рабдомиобластами — зачаточными мышечными эмбриональными клетками. Опухоль поражает в основном пациентов детского возраста, до 10 лет. Мальчики болеют несколько чаще, чем девочки.
Причины развития рабдомиосарком
До сих пор ученые не выявили точные причины развития рабдомиосарком. Но многолетние наблюдения за пациентами с данной группой сарком позволили выявить ряд предрасполагающих факторов:
- повышенная лучевая нагрузка на ребенка во время внутриутробного развития или уже после рождения;
- травмы, повреждения;
- генные мутации;
- интоксикация, негативное влияние отравляющих и токсических веществ.
У пациентов с подобными опухолями часто диагностируют пороки развития мочеполовой системы, ЦНС и пищеварительного тракта. Рабдомиосаркома нередко развивается на фоне патологий, предусматривающих предрасположенность к развитию злокачественных опухолей: синдромов Ли-Флаумени, Рубинстайна-Тейби, Видемана-Беквита.
Рабдомиосаркома нередко развивается на фоне патологий, предусматривающих предрасположенность к развитию злокачественных опухолей: синдромов Ли-Флаумени, Рубинстайна-Тейби, Видемана-Беквита.
Диагностика рабдомиосаркомы
Для постановки диагноза пациентам с подозрениями на рабдомиосаркому проводят следующие процедуры:
- ультразвуковую диагностику;
- рентгенологическое исследование;
- позитронно-эмиссионную томографию;
- биопсию опухоли;
- экскреторная урография;
- сцинтиграфию;
- ЛОР-диагностику;
- цитологическое исследование ликвора;
- компьютерную, магнито-резонансную томографию.
Метод исследования выбирается в зависимости от места локализации опухоли и течения болезни. Часто приходится проводить комплексную диагностику, иногда ткань опухоли удается забирать посредством малоинвазивных эндоскопических процедур. Диагностику рабдомиосаркомы необходимо проводить в специализированных онкологических центрах, с соответствующим техническим оснащением и штатом профессиональных докторов.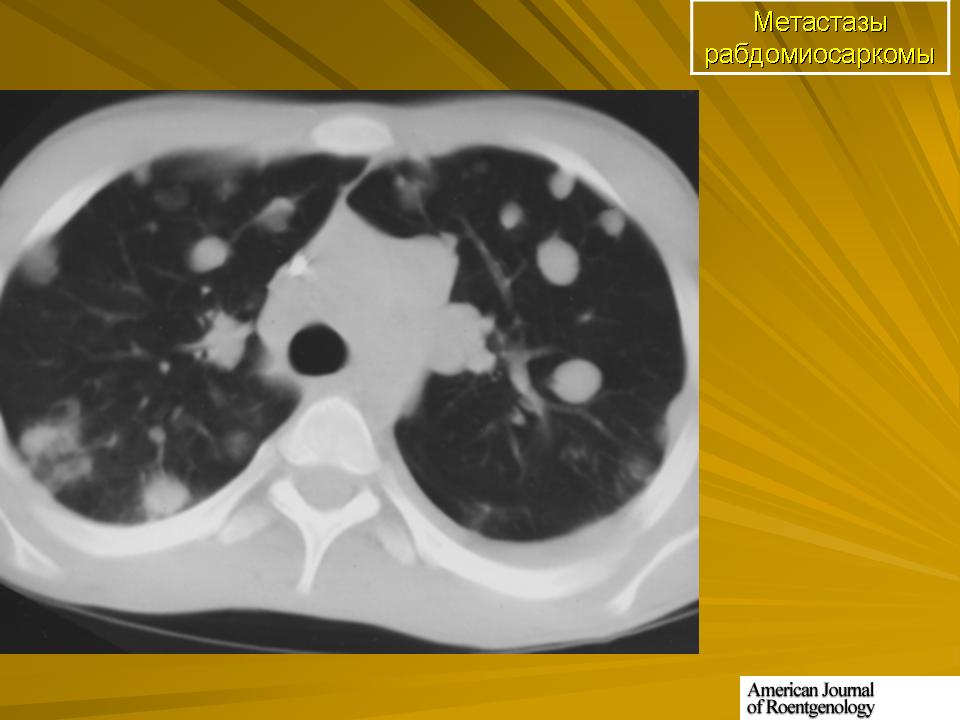
Симптомы развития рабдомиосаркомы
Рабдосаркома возвышается над поверхностью кожи, имеет плотную консистенцию. Метастазирует чаще всего в легкие и кости. Симптомы опухоли зависят от места ее локализации. Рабдомиосаркома шеи иногда протекает с частичным или полным исчезновением голоса.
Если опухоль локализуется в носовой полости, то она приводит к хроническим синуситам, носовым кровотечениям. При прорастании новообразования в тазу может наблюдаться нарушение мочеиспускания, вплоть до острой задержки мочи, кровянистые выделения из половых путей, резь во время мочеиспускания и затруднения акта дефекации, во влагалище могут обнаруживаться гроздевидные скопления опухоли. Новообразование в области лица и шеи часто сопровождается параличом, дыхательной недостаточностью.
Методы лечения рабдомиосаркомы
Лечение рабдомиосаркомы должно быть комплексным. В него входят: радикальное удаление опухоли, химиотерапевтические методики, лучевое воздействие. Современные цитостатики (циклофосфамид, винкристин, этопозид, дактиномицин) позволяют значительно снизить риск развития осложнений даже во время длительного курса химиотерапии.
При наличии крупной опухоли перед хирургическим вмешательством проводится лучевая терапия с локальным облучением злокачественной зоны. Патологический очагах иссекается в пределах здоровой ткани, иногда вместе с регионарными лимфатическими узлами. Если опухоль поражает мягкие ткани конечностей и прорастает в костную ткань, то, как правило, требуется проведение ампутации.
Локализация рабдомиосаркомы в половых органах часто требует их полного удаления. Это позволяет снизить риск рецидивирования патологии в будущем. Радикальное лечение саркомы этого типа подразумевает хирургическое удаление метастазов в местах, где это возможно сделать. Самым неблагоприятным течением болезни является метастазирование опухоли в костную систему.
Прогноз
Прогноз выживаемости больных с рабдомиосаркомой зависит от степени злокачественности процесса и стадии развития опухоли. На последнем этапе течения болезни прогноз неблагоприятный. Начальные стадии опухоли имеют высокую степень выживаемости и полного выздоровления. Чем моложе пациент, тем более успешно проходит лечение данного заболевания.
Чем моложе пациент, тем более успешно проходит лечение данного заболевания.
Что такое саркомы | Университетская клиника г. Фрайбурга
Диагноз по всем саркомам ставится на основании гистологического исследования ткани, образец которой берется посредством биопсии. При подозрении на саркому, забор пробы ткани проводится только врачами, имеющими опыт лечения сарком. Симптомы сарком могут быть следующие: на начальной стадии это часто – безболезненные местные опухания. И только позднее, в связи с вытесняющим ростом опухоли, могут возникнуть ограничения функций и болевые ощущения. Снижение веса тела, как правило, возникает на прогрессирующей стадии опухоли. Саркомы, находящиеся в брюшной области, часто дают симптомы слишком поздно. При наличии опуханий и симптомов, необходимо сделать визуализацию опухоли, лучше всего – с помощью МРТ, а уже после этого — биопсию. В зависимости от результатов исследования мягких тканей, проводятся последующие обследования, чтобы исключить наличие метастазов.
Остеосаркома также, сначала проявляет себя в виде опуханий, затвердеваний, перегрева и болей. В связи с вытесняющим ростом опухоли также могут возникнуть ограничения функций органов. Для подтверждения диагноза также служит биопсия, но до ее взятия следует сделать визуализацию опухоли. Часто, первым средством диагностики является обычный рентгеновский снимок, который затем дополняется снимком МРТ. После подтверждения диагноза делаются другие обследования, чтобы исключить наличие метастазов (рентген и КТ грудной клетки, сонография брюшной полости, сцинтиграфия костей скелета с применением 3-фазной цифровой техники, редко – ангиография). Поскольку при остеосаркоме, как правило, всегда проводится химиотерапия, следует сделать соответствующие обследования функций органов (эхо сердца, ЭКГ, функции почек, тест на слух).
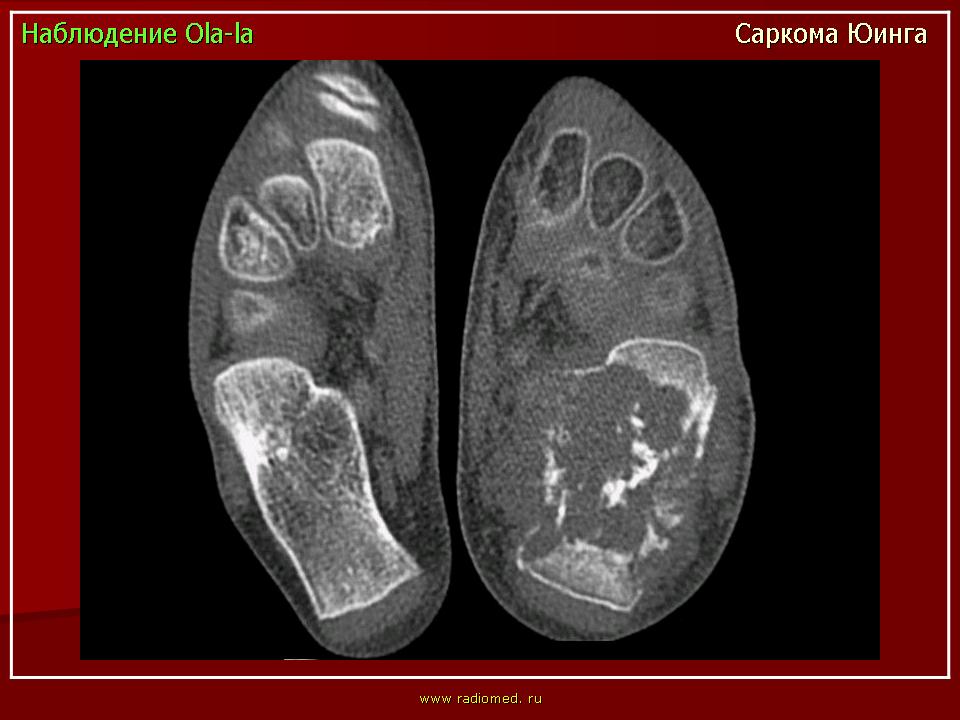
При саркоме Эвинга также могут возникнуть местные боли, опухания, затвердения, перегрев, симптомы вытеснения с возможными нарушениями функций органов. И в этом случае следует подтвердить диагноз после визуализации, путем получения пробы ткани (биопсии) для дальнейшего исследования. Поскольку и в этих случаях всегда проводится химиотерапия, следует сделать соответствующие обследования функции органов, как при остеосаркоме.
Поскольку и в этих случаях всегда проводится химиотерапия, следует сделать соответствующие обследования функции органов, как при остеосаркоме.
Рабдомиосаркома | Фонд «Подари жизнь»
Суть болезни
Рабдомиосаркома (РМС) – одна из злокачественных опухолей, характерных в основном для детского возраста. Понятие «саркома» означает, что речь идет о злокачестенной опухоли соединительной ткани, а приставка «рабдомио» означает, что это опухоль возникает из клеток-предшественников поперечно-полосатых, то есть скелетных, мышц («рабдо» — палочкообразный, «мио» — мышечный).
Рабдомиосаркома относится к саркомам мягких тканей. Существуют и другие мягкотканые саркомы: липосаркома, ангиосаркома, фибросаркома, синовиальная саркома и т.п. РМС выделяется среди них более частой встречаемостью в детском возрасте, поэтому именно это заболевание рассматривается здесь подробно.
РМС может обнаруживаться практически в любом участке тела, включая и области, не заполненные мышцами. Так, РМС может возникнуть в различных органах головы и шеи (включая мягкие ткани глазных орбит, носоглотку, придаточные пазухи носа, область возле шейного отдела позвоночника), в руках, ногах, мочеполовой системе, в брюшной полости и др. Метастазы могут обнаруживаться в легких, костном мозге, костях, лимфоузлах, головном мозге.
Так, РМС может возникнуть в различных органах головы и шеи (включая мягкие ткани глазных орбит, носоглотку, придаточные пазухи носа, область возле шейного отдела позвоночника), в руках, ногах, мочеполовой системе, в брюшной полости и др. Метастазы могут обнаруживаться в легких, костном мозге, костях, лимфоузлах, головном мозге.
В соответствиии с международной классификацией выделяют различные типы РМС.
- Эмбриональная рабдомиосаркома – опухоль, характерная для детей раннего возраста. Большинство случаев РМС относится именно к этому варианту. Наиболее частые локализации опухоли при эмбриональной РМС – органы головы и шеи, органы мочеполовой системы. Выделяют также особые подтипы эмбриональной РМС – ботриоидный и веретеноклеточный; как правило, они связаны с лучшим прогнозом.
- Альвеолярная рабдомиосаркома (около 25% всех случаев РМС) чаще встречается в более старшем возрасте, включая подростковый. Название «альвеолярная» связано с тем, что внешний вид опухоли при ее микроскопическом исследовании напоминает вид легочных альвеол.
 Наиболее типичные локализации – мышцы конечностей и туловища, а также органы малого таза.
Наиболее типичные локализации – мышцы конечностей и туловища, а также органы малого таза.
Выделяют также плеоморфную, или анапластическую РМС. Этот редкий вариант опухоли не характерен для детей (большинство заболевших – взрослые в возрасте от 30 до 50 лет) и обычно локализуется на конечностях. Также известны смешанные варианты и недифференцированные саркомы.
При РМС выделяют различные стадии опухолевого процесса и клинические группы. Так, согласно международной классификации IRS, выделяются 4 группы:
- Группа I: Опухоль может быть полностью удалена хирургически.
- Группа II: Опухоль может быть удалена хирургически, но опухолевые клетки обнаруживаются в окружающих тканях и/или в близлежащих лимфоузлах. Отдаленных метастазов нет.
- Группа III: Полное хирургическое удаление опухоли невозможно. Нет отдаленных метастазов.
- Группа IV: В момент установления диагноза обнаруживаются отдаленные метастазы.

Применяется также определение стадии болезни согласно общепринятой системе TNM, где T соответствует размеру опухоли, N – поражению регионарных (близлежащих) лимфатических узлов, а M – наличию отдаленных метастазов.
Частота встречаемости и факторы риска
Рабдомиосаркома составляет около 4% случаев злокачественных новообразований детского возраста; частота ее приблизительно равна 6 случаям на 1 миллион детского населения.
РМС – опухоль, характерная почти исключительно для детского возраста. После 20 лет она встречается уже крайне редко. Большинство больных младше 10 лет. Мальчики болеют несколько чаще девочек. Факторы внешней среды, которые могли бы повлиять на частоту возникновения РМС, неизвестны, как и для большинства других опухолей детского возраста.
Частота возникновения РМС, как и ряда других злокачественных опухолей, несколько повышена при определенных наследственных заболеваниях – таких как нейрофиброматоз типа I, синдром Ли-Фраумени и т. д. Однако в подавляющем большинстве случаев появление опухоли не связано ни с какими врожденными генетическими аномалиями.
д. Однако в подавляющем большинстве случаев появление опухоли не связано ни с какими врожденными генетическими аномалиями.
Признаки и симптомы
Симптомы РМС зависят прежде всего от расположения первичной опухоли. К счастью, нередко ее удается обнаружить сравнительно рано, так как РМС часто возникает в тех областях, где она быстро становится заметной. Приблизительно в 1/3 случаев опухоль удается обнаружить в момент, когда ее еще можно практически полностью удалить хирургическим путем (хотя обычно при этом есть микрометастазы или остаточная опухоль, для лечения которых необходима химиотерапия). И менее чем у 20% больных обнаруживается опухоль уже с отдаленными метастазами.
Так, опухоль, расположенную неглубоко под кожей, можно либо заметить визуально, то есть по возникновению припухлости, либо прощупать (пропальпировать). Если опухоль развивается в тканях глазной орбиты, то глаз выпячивается (экзофтальм) или начинает косить; возможны также жалобы на двоение в глазах. Если опухоль возникает в носовой полости, то болезнь может проявляться заложенностью носа, кровотечениями или кровянисто-слизистыми выделениями. Если поражен слуховой проход, то могут обнаруживаться выделения из уха и/или ухудшение слуха. При опухоли мочевого пузыря возможны затруднения с мочеиспусканием или наличие крови в моче. При опухолях в области половых органов нередко возникает отечность мошонки у мальчиков и кровянистые или слизистые выделения у девочек. При опухолях в брюшной области или области таза могут наблюдаться боли в животе, запоры, рвота. В редких случаях рабдомиосаркома развивается в области желчных протоков и приводит к желтухе.
Если опухоль возникает в носовой полости, то болезнь может проявляться заложенностью носа, кровотечениями или кровянисто-слизистыми выделениями. Если поражен слуховой проход, то могут обнаруживаться выделения из уха и/или ухудшение слуха. При опухоли мочевого пузыря возможны затруднения с мочеиспусканием или наличие крови в моче. При опухолях в области половых органов нередко возникает отечность мошонки у мальчиков и кровянистые или слизистые выделения у девочек. При опухолях в брюшной области или области таза могут наблюдаться боли в животе, запоры, рвота. В редких случаях рабдомиосаркома развивается в области желчных протоков и приводит к желтухе.
Что касается опухолей, поражающих конечности (обычно это альвеолярная РМС у старших детей), то их не всегда сразу правильно диагностируют, поскольку часто принимают за результат ушиба. Поэтому в случае возникновения любых припухлостей и «шишек», быстро растущих или не проходящих в течение нескольких недель, следует обратиться к врачу.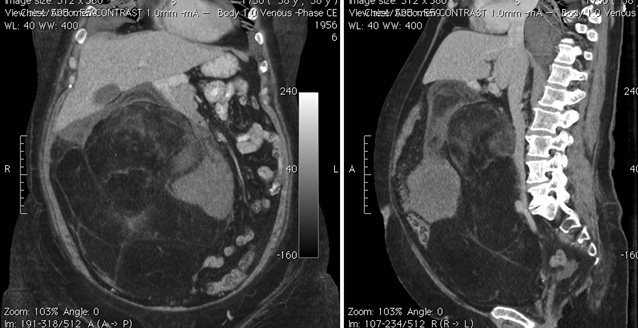 Следует отметить, что при РМС эти «шишки» обычно безболезненны.
Следует отметить, что при РМС эти «шишки» обычно безболезненны.
При дальнейшем развитии болезни возникают симптомы общего характера: вялость, снижение аппетита, потеря веса, слабость. При метастазах в лимфоузлы наблюдается их увеличение.
Диагностика
При подозрении на РМС обязательно осуществляется открытая биопсия и анализ полученного образца ткани, при котором уточняется диагноз и устанавливается вариант РМС. Опухолевая ткань исследуется под микроскопом; производится также иммуногистохимическое исследование на клеточные маркеры, характерные для рабдомиосаркомы.
Эмбриональная и альвеолярная РМС различаются по микроскопической картине опухоли. Кроме того, они имеют свои хромосомные особенности, поэтому для уточнения диагноза применяются цитогенетические (в некоторых случаях – молекулярно-генетические) исследования. Так, для альвеолярной РМС характерна транслокация t(1;13) или t(2;13).
Чтобы оценить размеры опухоли, степень ее проникновения в окружающие ткани, наличие и расположение метастазов, используются различные визуализирующие исследования: ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ).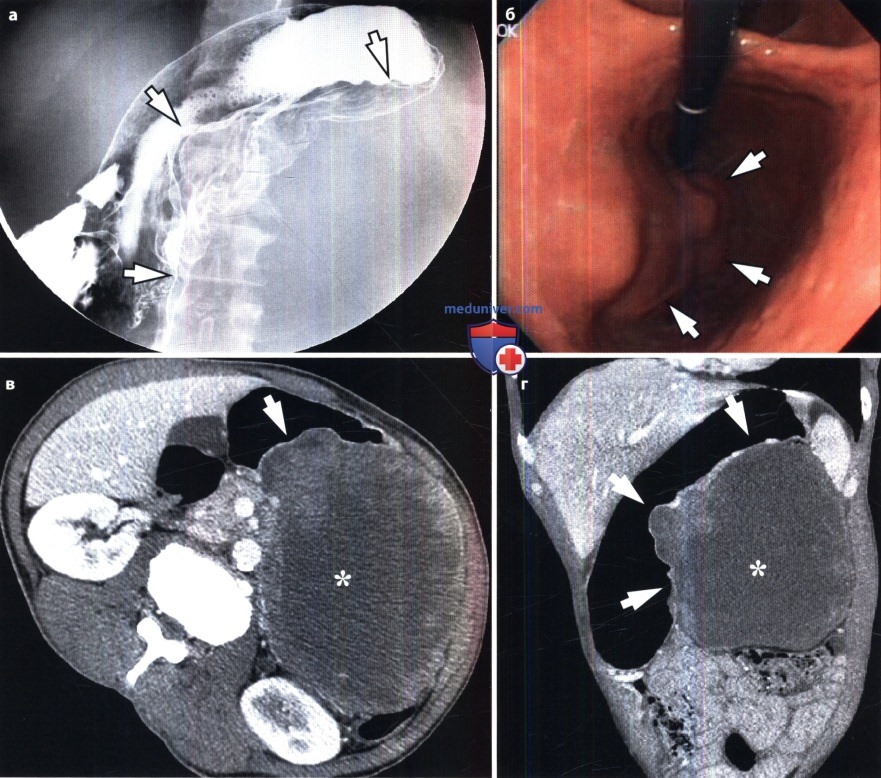 Для уточнения полученных данных может применяться также позитронно-эмиссионная томография (ПЭТ). Так как при РМС одной из обычных областей метастазирования являются легкие, производится рентгенография легких. Для выявления возможных костных метастазов используется остеосцинтиграфия с технецием (99Tc).
Для уточнения полученных данных может применяться также позитронно-эмиссионная томография (ПЭТ). Так как при РМС одной из обычных областей метастазирования являются легкие, производится рентгенография легких. Для выявления возможных костных метастазов используется остеосцинтиграфия с технецием (99Tc).
Поражение костного мозга устанавливается или исключается при помощи анализа его образца, взятого в ходе костномозговой пункции. Если опухоль находится близко к оболочкам головного или спинного мозга, то может также производиться пункция спинномозгового канала для исследования ликвора.
Лечение
Стратегия лечения при РМС зависит от группы риска (которая определяется многими факторами, включая стадию болезни, ее конкретный вариант, возраст больного, местоположение опухоли и т.п.), но практически всегда она включает в себя оперативное лечение и химиотерапию. Часто проводится также лучевая терапия.
Хирургическое удаление опухоли при РМС головы и шеи часто затруднено, так как опухоль окружена жизненно важными структурами. Поэтому стратегия хирургического лечения может корректироваться: так, нередко невозможна широкая резекция опухоли (с «захватом» достаточного количества здоровых окружающих тканей). Кроме того, может понадобиться помощь нейрохирургов и/или специалистов по сосудистой и пластической хирургии.
Поэтому стратегия хирургического лечения может корректироваться: так, нередко невозможна широкая резекция опухоли (с «захватом» достаточного количества здоровых окружающих тканей). Кроме того, может понадобиться помощь нейрохирургов и/или специалистов по сосудистой и пластической хирургии.
Если опухоль поражает руку или ногу, то в некоторых случаях для увеличения шансов на выживание может потребоваться ампутация, так как опухоли этой локализации часто бывают агрессивными и быстро метастазируют.
Химиотерапия при РМС может применяться до хирургического удаления опухоли с целью уменьшения ее размера (неоадъювантная химиотерапия). Что же касается периода после удаления опухоли, даже если оно произведено полностью, то в это время химиотерапия обязательна для уничтожения оставшихся опухолевых клеток – иначе вероятность рецидива резко повышается.
Выбор конкретных химиопрепаратов и их комбинации зависят от вида и стадии РМС. В число препаратов, которые могут применяться для химиотерапии РМС, входят винкристин, дактиномицин (космеген), циклофосфамид, а также ифосфамид, этопозид, доксорубицин, препараты платины и другие химиопрепараты. Иногда используются также препараты из числа ингибиторов топоизомеразы I: топотекан, иринотекан.
Иногда используются также препараты из числа ингибиторов топоизомеразы I: топотекан, иринотекан.
Лучевая терапия чаще всего применяется для уничтожения оставшихся злокачественных клеток после операции и последующей химиотерапии, но иногда может проводиться и до операции. Если опухоль расположена недалеко от оболочек головного или спинного мозга (параменингеальная локализация) или распространяется в кости черепа и/или центральную нервную систему, облучение может быть начато сразу после постановки диагноза.
В некоторых случаях при РМС могут быть рекомендованы особые методы лучевой терапии, включая протонное облучение и брахитерапию.
При высоком риске может быть рекомендована высокодозная химиотерапия с последующей аутологичной трансплантацией костного мозга. Однако до сих пор неясно, приводит ли она к существенному повышению выживаемости.
Прогноз
Как и при большинстве злокачественных опухолей, прогноз при РМС зависит от многих факторов: стадия, на которой диагностирована болезнь; размер и локализация опухоли; возможность ее полного или почти полного хирургического удаления; возраст больного; цитогенетические характеристики клеток.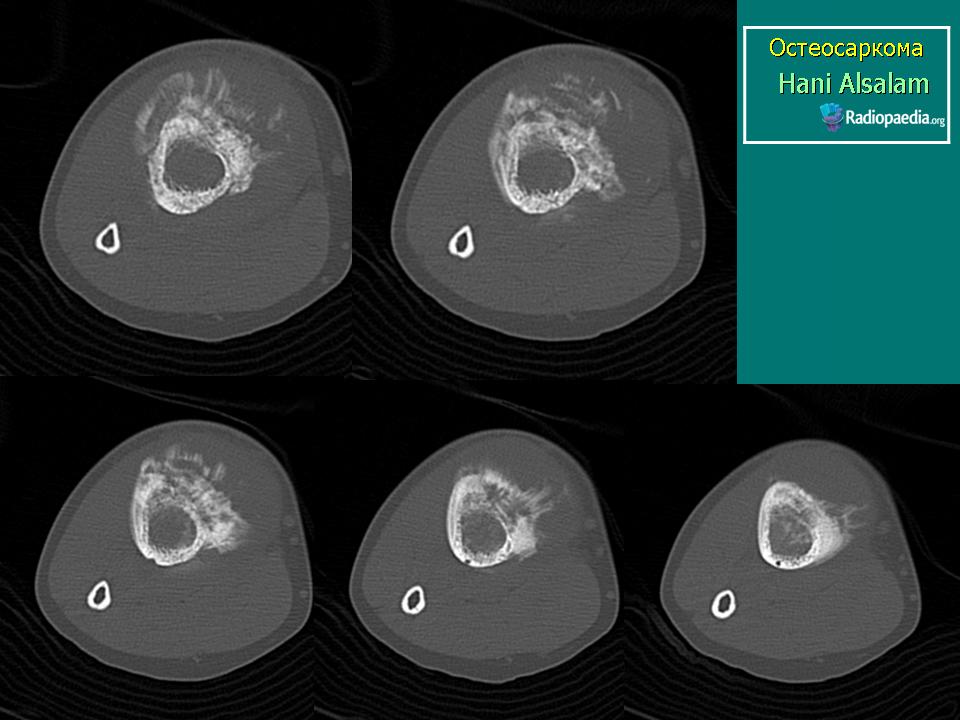
За последние десятилетия в лечении рабдомиосаркомы был достигнут серьезный прогресс. При локализованной (не метастазировавшей) опухоли прогноз достаточно хороший: примерно 80% таких больных излечивается. Прогноз при распространенной опухоли с отдаленными метастазами намного хуже: выздоравливает около 30% больных. Наилучшие результаты достигаются при лечении опухолей, расположенных в области головы и шеи, а также половых органов. Наиболее благоприятная возрастная группа – дети от 1 до 9 лет. Альвеолярная РМС в среднем имеет худший прогноз, чем эмбриональная РМС.
Как и при большинстве онкологических заболеваний, пятилетняя ремиссия фактически означает выздоровление, так как вероятность возвращения болезни уже невелика. Однако возможны отдаленные последствия лечения, прежде всего лучевой терапии, применяемой при лечении маленьких детей: замедление роста облученных участков костей, ухудшение зрения или катаракта при облучении области глаз, рубцевание легочной ткани при облучении легких, проблемы с репродуктивной функцией и так далее.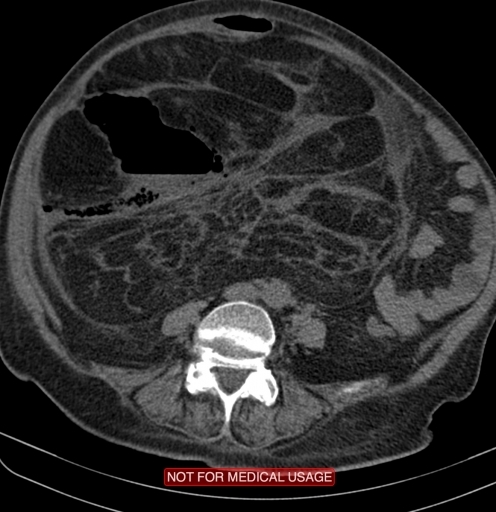 После лечения могут возникнуть вторичные опухоли, однако их частота низка. В случае локального рецидива РМС прогноз ухудшается, однако в ряде случаев все равно возможно эффективное лечение.
После лечения могут возникнуть вторичные опухоли, однако их частота низка. В случае локального рецидива РМС прогноз ухудшается, однако в ряде случаев все равно возможно эффективное лечение.
| « Назад Ежегодно в России умирает около 300 000 человек от рака. Почти каждый в своей жизни сталкивался с такой трагической историей, происшедшей с его родственником или со знакомым. Такие случаи, а их немало, демонстрируют бессилие нашей медицины, но не всё так просто, что – то зависит и от самих пациентов. Как правило, к запущенности опухолевого процесса, а следовательно и к ограничению возможностей лечебного воздействия, приводят две причины: скрытое течение заболевания и позднее обращение больного. Позднее обращение, — в смысле сознательно позднее. Когда человек испытывая симптомы заболевания: боль, слабость, тошноту, похудание и т.д., в тоже время, сознательно откладывает свой визит к врачу. Прогноз при лечении злокачественных новообразований определяется особенностями опухоли, особенностями организма и возможностями лечения. Опухоль характеризуют морфологическое строение (результат гистологического исследования) и стадия. Стадий, как известно, четыре. В лучшие, советские времена, а для развития здравоохранения советский период был не самый худший, с его диспансеризацией и профилактическими осмотрами, официально признавалось, что больных с IV стадией опухолевого процесса не может быть меньше 25% от общего числа заболевших (эти данные, кажется, были опубликованы в журнале «Вопросы онкологии» в начале 80-х годов). Сейчас не меньше, но эти цифры стараются, по возможности, корректировать в отчётах. Симптоматическое лечение, это лечение, направленное на купирование наиболее тяжких симптомов: боль, одышка, рвота и т.д. Обычно, в этом случае, онколог выступает как консультант, а лечением занимается участковый терапевт или хоспис. Но до этого лучше, конечно, не доводить. Теперь о раннем выявлении рака. Начальные стадии заболевания, как правило, протекают без симптомов, но опухоль на этом этапе можно выявить при профилактическом осмотре и комплексном обследовании. Флюорография органов грудной клетки должна выполняться ежегодно, а в каких-то случаях и чаще. Метод простой и доступный, а пользы от него много. Исследование можно заменить выполнением обзорного рентгеновского снимка органов грудной клетки. Ещё тема — опухоли кожи, здесь самая большая неприятность – меланома. Опухоль очень злая и смерть в результате её прогрессирования редкостью не является. Поэтому появилась какая-то новая родинка, или старая изменила свой внешний вид, сразу к онкологу, доктор разберется. Пигментные образования, кстати, биопсии не подлежат, сразу иссекаются в пределах здоровых тканей. Не прижигаются, не лечатся криодеструкцией, а иссекаются (удаляются), чтобы было возможно полноценное гистологическое исследование удаленного материала. Ещё часто обращаются к онкологу с увеличенными лимфатическими узлами: шейными, подмышечными, паховыми. Здесь может быть и последствия перенесенной инфекции, а может быть что-то и более серьёзное, — лимфомы, метастазы рака, меланомы. Но надо разбираться в каждом случае. К сожалению, заболеваемость злокачественными новообразованиями меньше не становится и онкологи в ближайшем обозримом будущем вряд ли останутся без работы. онколог Александр Барышев КомментарииКомментариев пока нет |
Ветеринарная онкология / Ветеринарная клиника АСВЕТ Одинцово
Владельцам об онкологии животных
Основным условием эффективности лечения любого заболевания является ранняя диагностика, но особенно следует подчеркнуть важность этого положения в онкологии. В поздней стадии излечение злокачественной опухоли — редкое исключение.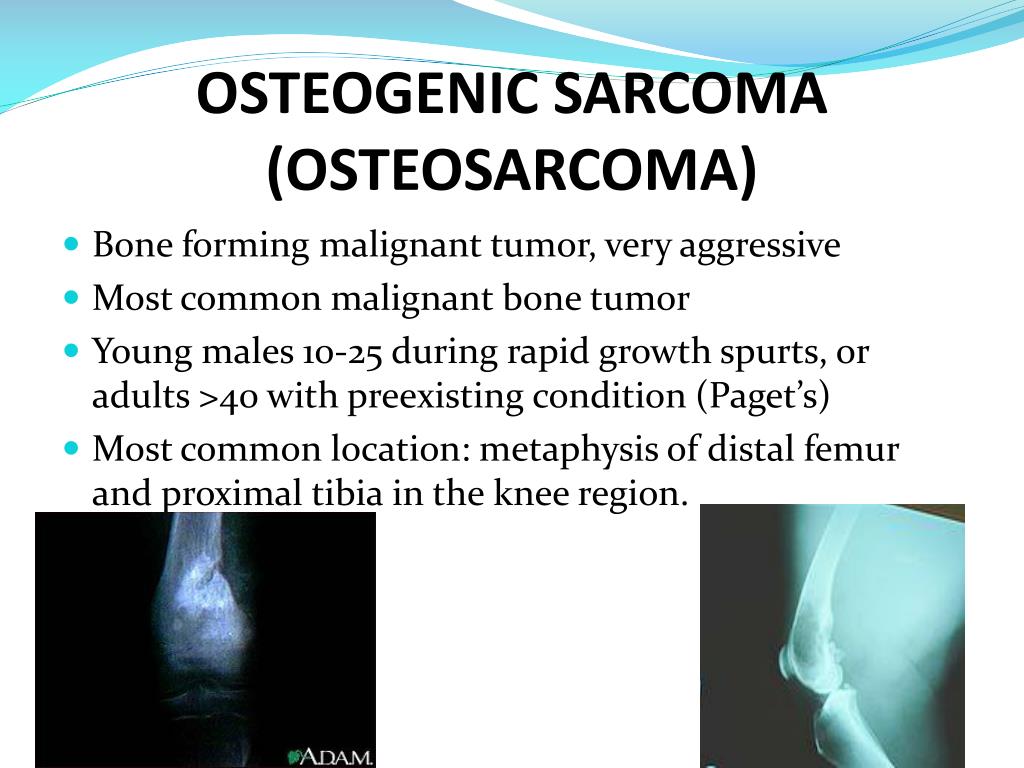
Среди причин общей смертности у собак и кошек, опухолевые заболевания уверенно удерживают второе место. 1-ое и 2-ое занимают опухоли кожи и молочных желез соответственно. Учитывая большую частоту выявления онкологических болезней у домашних животных, онкологическую настороженность следует проявлять и врачам, и владельцам животных.
Когда владелец животного спрашивает у врача, что вызвало рак у его питомца, чаще всего, его вопрос абстрактный. Он не имеет намерения узнать, что такое гистоны, метилирование ДНК и канцерогенез 3 стадии. На самом деле владелец подразумевает: почему мое животное заболело; вы можете его вылечить; каков прогноз в отношении каждого метода лечения?
Наша задача заключается в том, чтобы сделать эту тайну понятной.
Почему мое животное заболело?
Нормальные (здоровые) клетки обладают саморегуляцией. Ненормальные (больные клетки) активируют ген-супрессор р53, который задерживает клеточное деление до тех пор, пока нарушения не будут исправлены.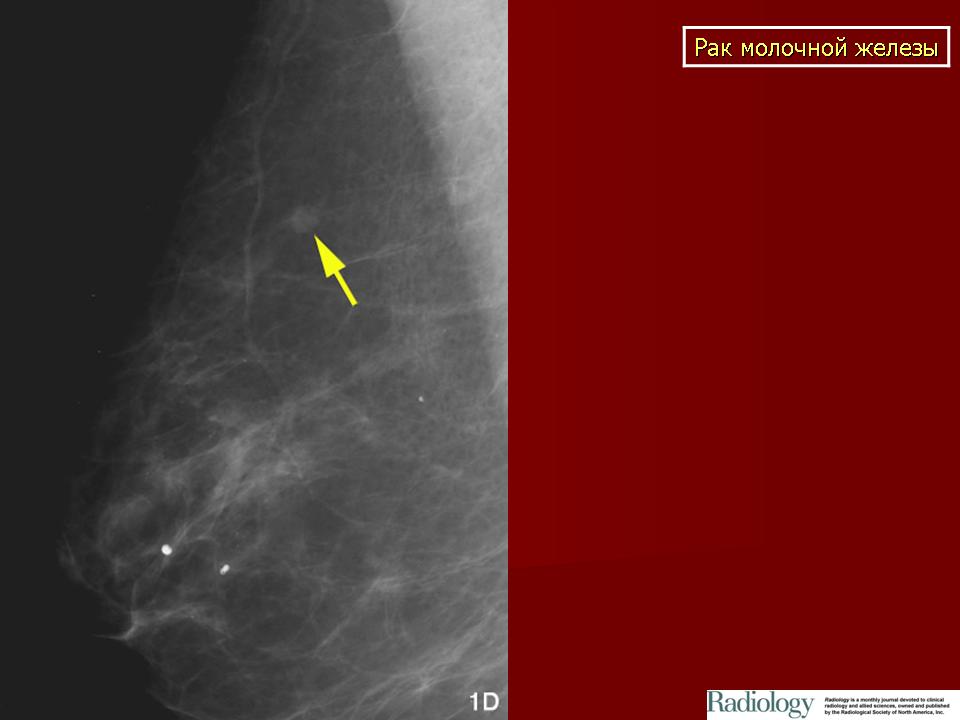 Если коррекции не произошло, р53 вызывает запрограммированную гибель клеток — апоптоз.
Если коррекции не произошло, р53 вызывает запрограммированную гибель клеток — апоптоз.
Раковые клетки несут мутации и ошибки в генах, в том числе и в гене р53. Они избегают апоптоза и таким образом, приобретают «бессмертие». После перерождения для нерегулируемых быстро делящихся раковых клеток характерно и постепенное изменение генотипа.
Генетические сбои могут быть спонтанными или могут быть вызваны вирусами, химическими веществами, паразитами, радиоактивным излучением, возникать под воздействием световых лучей, в результате нарушения эндокринных/метаболических процессов и др. механизмов.
Итак, опухоль — это группа клеток, характеризующаяся непрерывным ростом и размножением, не контролируемым организмом. «Бессмертие», постоянное деление и нарушение регуляции генов предоставляют раковым клеткам преимущества, которые доброкачественные клетки не имеют.
Доброкачественные опухоли, в отличие от злокачественных, не проникают за пределы тканей, в которых они начали развиваться, или в другие части организма.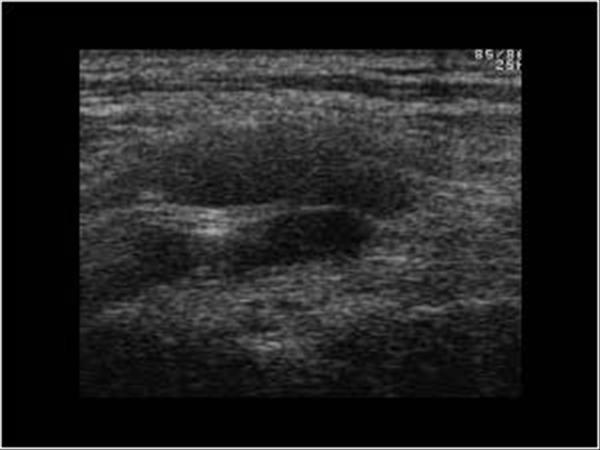 В большинстве случаев, прогноз при доброкачественных опухолях благоприятен. Однако они могут иметь тяжелые последствия, если, например, сдавливают жизненно важные структуры, такие, как кровеносные сосуды и нервы.
В большинстве случаев, прогноз при доброкачественных опухолях благоприятен. Однако они могут иметь тяжелые последствия, если, например, сдавливают жизненно важные структуры, такие, как кровеносные сосуды и нервы.
Злокачественные опухоли характеризуются местным прорастанием в окружающие ткани, высокой скоростью роста, поэтому они возникают вновь (рецидивируют) после хирургического удаления. Раковые клетки способны метастазировать. Метастазирование — это процесс распространения опухолевых клеток через межклеточные пространства в кровеносное русло и лимфу, дающий возможность возникновения новых очагов опухолевого роста в различных частях тела.
В зависимости от времени появления и места развития, различают ранние и поздние, регионарные и отдаленные метастазы. Чем раньше появляются метастазы, тем злокачественнее опухоль. Отдаленные метастазы (не регионарные лимфоузлы, органы) являются фактором неблагоприятного прогноза.
Важно отметить, что опухоли, которые развились как доброкачественные, могут со временем приобретать злокачественный характер.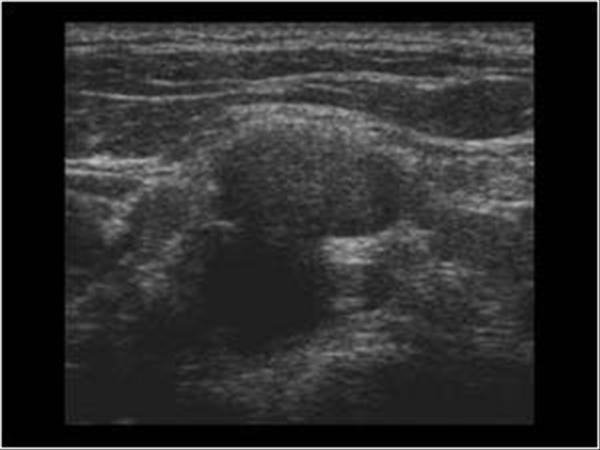 Также, выделяется определенная группа заболеваний, которые имеют высокий риск перехода в злокачественную опухоль: хронический гастрит, длительно не заживающие язвы слизистых оболочек и кожи, железистое перерождение эндометрия матки, аденофиброзная мастопатия, сопровождающиеся резкой пролиферацией эпителия и др.
Также, выделяется определенная группа заболеваний, которые имеют высокий риск перехода в злокачественную опухоль: хронический гастрит, длительно не заживающие язвы слизистых оболочек и кожи, железистое перерождение эндометрия матки, аденофиброзная мастопатия, сопровождающиеся резкой пролиферацией эпителия и др.
Онкологическая настороженность владельца
К сожалению, зачастую животные с онкологическими заболеваниями поступают к врачам-онкологам при достаточно запущенных стадиях процесса. Это сказывается на выборе лечения животного, прогнозе, а также качестве жизни пациента. Для ранней диагностики и полного излечения важно внимательное и ответственное отношение к животному самих владельцев, знание основных признаков возможной злокачественности ряда заболеваний. Среди подавляющего большинства владельцев бытует мнение, что рак бывает только у пожилых старых животных. Такой стереотип снижает онкологическую настороженность, приводит к позднему обращению к врачу с уже неизлечимой стадией болезни.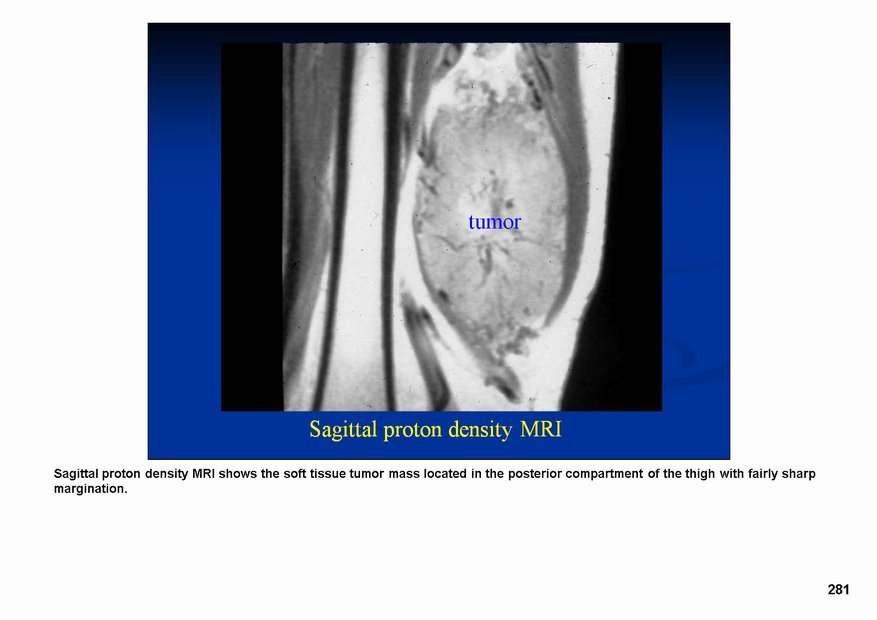
Например, опухоли молочной железы собак занимают 25 % от всех опухолевых заболеваний у собак и стоят на втором месте по частоте встречаемости после опухолей кожи у самок. Пик заболевания приходится на возрастную группу 7 — 10 лет. Почти 50 % случаев у собак заболевание носит злокачественный характер и в 25 % случаев имеет неблагоприятный прогноз. Факторами развития данной патологии являются гормональные нарушения (отсутствие родов, частые ложные щенности, медикаментозное подавление лактации, кистозные перерождения в яичниках). Один из важных критериев прогноза жизни при раке молочной железы это размер опухоли. При величине опухоли молочных желёз более 3 см у кошек и более 5 см у собак ставят третью (из возможных четырёх) стадию процесса и рекомендуют животному не только хирургическую операцию, но ещё и химиотерапию. При четвертой стадии заболевания, даже при проводимой терапии, средняя продолжительность жизни составляет от 1-го до 2-х месяцев.
У кошек рак молочной железы отличается крайне агрессивным течением, высокой степенью злокачественности и плохим прогнозом. Только в 10 – 14 % случаев в молочной железе кошек можно встретить доброкачественные процессы, в то время, как злокачественные опухоли диагностируются в 86 – 90 %. Заболеванию подвержены преимущественно животные в возрасте от 10 – 12 лет, однако есть наблюдения заболевания кошек и в молодом возрасте. Опухоли молочных желез легко диагностируются самим владельцами. Но, к сожалению, часто обращение в клинику происходит уже тогда, когда опухоль разрастается до значительных размеров, и это начало беспокоить кошку или собаку.
Только в 10 – 14 % случаев в молочной железе кошек можно встретить доброкачественные процессы, в то время, как злокачественные опухоли диагностируются в 86 – 90 %. Заболеванию подвержены преимущественно животные в возрасте от 10 – 12 лет, однако есть наблюдения заболевания кошек и в молодом возрасте. Опухоли молочных желез легко диагностируются самим владельцами. Но, к сожалению, часто обращение в клинику происходит уже тогда, когда опухоль разрастается до значительных размеров, и это начало беспокоить кошку или собаку.
Симптомы у больных онкологией разнообразны, они зависят, прежде всего, от локализации новообразования.
Рак кожи — наиболее распространенный вид рака у собак и кошек. Обнаружить образования можно во время купания и поглаживания Вашего питомца. Опухоли кожи и мягких тканей выглядят как утолщение на коже или под ней. Очень часто они не беспокоят животных, и владельцы обнаруживают их случайно. Некоторые опухоли кожи внешне похожи на обычный дерматит, и порой только отсутствие эффекта от лечения может натолкнуть на мысли исследования на онкологию. Если опухоль имеет нечеткие границы, неподвижна относительно подлежащих тканей, характеризуется быстрым ростом, прорастает кожные покровы (наличие изъязвлений) — это свидетельствует о злокачественном процессе и животному необходима консультация врача.
Если опухоль имеет нечеткие границы, неподвижна относительно подлежащих тканей, характеризуется быстрым ростом, прорастает кожные покровы (наличие изъязвлений) — это свидетельствует о злокачественном процессе и животному необходима консультация врача.
На наличие опухоли в ротовой полости у животного указывает усиленное слюнотечение, неприятный запах изо рта, нарушение глотания, потеря веса или ухудшение аппетита, а также увеличение и уплотнение нижнечелюстных и окологлоточных лимфоузлов, выявляемое при пальпации, потеря интереса к жевательным игрушкам, расчесывание рта лапами.
Признаки наличия опухоли в носовой полости — экзофтальм (выпячивание глазного яблока), асимметрия морды, чихание, хронические, не поддающиеся лечению, выделения из носа и глазных щелей, кровотечения, хрипы.
На скелетно-мышечные опухоли приходится 3,5 — 5% всех опухолей собак и кошек. Большинство из них — это новообразования костей, которые подразделяются на: первичные (остеосаркома, хондросаркома, фибросаркома) и метастатические.
Первичные костные опухоли преимущественно злокачественные (98% от общего числа) и по частоте встречаемости в 5 раз превосходят метастатические.
Остеосаркома или остеогенная саркома — это наиболее распространенная первичная злокачественная опухоль костей у собак и кошек. При остеогенной саркоме в основном поражаются конечности. Боль локализуется в месте опухоли, может появляться припухлость, разлитой отек. При этом, может нарушиться подвижность сустава, возникнуть патологический перелом конечности в области новообразования. Опухоли костей встречаются у собак в возрасте 6-7 лет, хотя, как считают, они возникают и раньше. Медленно развиваясь, иногда многие годы, ничем себя не проявляют. Первыми клиническими признаками опухоли, если она развивается в костях конечности, является хромота, явное нежелание собаки вставать со своего места, особенно после залеживания. Толчком к развитию остеосаркомы у животных крупных пород может стать перенесенная травма, хотя на сегодняшний день не ясно, так ли это на самом деле. Но высказываются предположения, что повреждения могут спровоцировать заболевание. Считается, что злокачественные опухоли кости — это болезни гигантских и крупных пород. Среди пациентов регистрируют сенбернаров, доберманов-пинчеров, ирландских сеттеров, датских догов, немецких овчарок, золотых ретриверов. И тем не менее, по мнению специалистов, размеры животного являются более весомым фактором появления остеосаркомы, нежели принадлежность к определенной породе.
Но высказываются предположения, что повреждения могут спровоцировать заболевание. Считается, что злокачественные опухоли кости — это болезни гигантских и крупных пород. Среди пациентов регистрируют сенбернаров, доберманов-пинчеров, ирландских сеттеров, датских догов, немецких овчарок, золотых ретриверов. И тем не менее, по мнению специалистов, размеры животного являются более весомым фактором появления остеосаркомы, нежели принадлежность к определенной породе.
Опухоли семенников составляют 15% от всех опухолей, возникающих у самцов. Средний возраст животных 7 лет. Образования легко обнаружить при осмотре и ощупывании мошонки. В большинстве случаев опухоли возникают в одном семеннике, причем около трети их поражают не опустившийся семенник. В таком случае опухоль располагается в паховом канале или в брюшной полости.
Опухоли преддверия влагалища — мочеполового канала, заканчивающегося наружным отверстием, — это преимущественно саркомы. Начальные стадии их развития протекают бессимптомно. Однако многие собаки в это время становятся беспокойными, часто мочатся. Позже, из половой щели начинает выделяться кровянистая слизь. Иногда она бывает кирпично-красной или напоминает мясные помои. Поэтому частое облизывание наружных половых органов может быть признаком развития опухоли у собаки. При сильном ее увеличении происходит выпячивание промежности. Опухоль стенки влагалища (чаще — доброкачественная лейомиома) встречается преимущественно у самок старше 5 лет. В отличие от саркомы, она представляет собой гладкий мышечный четко очерченный узел и не проявляет кровоточивости, благодаря чему, можно различить эти два заболевания. В случаях, когда новообразование растет в сторону окружающих влагалище тканей, его можно прощупать через промежность собаки. Клиническими симптомами будут являться затруднение акта мочеиспускания, реже -дефекации.
Однако многие собаки в это время становятся беспокойными, часто мочатся. Позже, из половой щели начинает выделяться кровянистая слизь. Иногда она бывает кирпично-красной или напоминает мясные помои. Поэтому частое облизывание наружных половых органов может быть признаком развития опухоли у собаки. При сильном ее увеличении происходит выпячивание промежности. Опухоль стенки влагалища (чаще — доброкачественная лейомиома) встречается преимущественно у самок старше 5 лет. В отличие от саркомы, она представляет собой гладкий мышечный четко очерченный узел и не проявляет кровоточивости, благодаря чему, можно различить эти два заболевания. В случаях, когда новообразование растет в сторону окружающих влагалище тканей, его можно прощупать через промежность собаки. Клиническими симптомами будут являться затруднение акта мочеиспускания, реже -дефекации.
Выделения из препуция — кожной складки, прикрывающей пенис собаки, тоже должны настораживать владельца, особенно, если они усиливаются и становятся гнойными, грязно-коричневыми, с неприятным запахом (что происходит при распаде опухоли).
Опухоли внутренних органов у собак трудны для диагностики ввиду отсутствия каких-либо специфических признаков и клинических проявлений, которые могли бы указывать на опухолевое поражение того или иного органа. Даже когда опухоль достигает значительной величины и происходят изменения в деятельности организма, то и тогда симптоматика имеет весьма общий характер, не позволяющий заподозрить опухолевый процесс. К числу таких общих явлений, наблюдающихся, например, при опухолях печени и селезенки, можно отнести асцит (скопление жидкости в брюшной полости), бледность слизистых оболочек (как внешнее проявление анемии), слабость, отказ от пищи, жажду. Опухоли яичника в клиническом отношении могут проявляться в нарушении течки, удлинении фазы эструса с постоянными кровянистыми выделениями. При опухолях мочевого пузыря и почек могут отмечаться гематурия (кровь в моче), дизурические явления (нарушение мочеиспускания), слабость, адинамия. При опухолях желудка развиваются явления, связанные прежде всего с непроходимостью (рвота съеденным, истощение, слабость). Опухоли внутренних органов приводят к снижению их функции, что будет проявляться своими симптомами. Желтушность кожи и слизистых оболочек, снижение веса, проблемы с пищеварением могут появляться при онкологии печени. Опухоль на кишечнике может приводить к симптомам непроходимости – прежде всего частая, продолжительная рвота , нарушения стула (видимая кровь в стуле, изменение цвета, регулярности, затруднение акта дефекации).Поводом для немедленного обращения к врачу являются также кашель, одышка, нарушение координации движений, синкопы (кратковременные обмороки), непереносимость физических нагрузок.
Опухоли внутренних органов приводят к снижению их функции, что будет проявляться своими симптомами. Желтушность кожи и слизистых оболочек, снижение веса, проблемы с пищеварением могут появляться при онкологии печени. Опухоль на кишечнике может приводить к симптомам непроходимости – прежде всего частая, продолжительная рвота , нарушения стула (видимая кровь в стуле, изменение цвета, регулярности, затруднение акта дефекации).Поводом для немедленного обращения к врачу являются также кашель, одышка, нарушение координации движений, синкопы (кратковременные обмороки), непереносимость физических нагрузок.
Биохимические продукты опухолей на поздних стадиях часто вызывают недомогание и анорексию (отказ от корма). В то же время, другие вещества, могут опосредовать химические сигналы, имитирующие заживление раны, и в обманутом истощенном организме будут происходить катаболические процессы для предоставления опухоли белков и питательных веществ. Поэтому наиболее распространенным состоянием при раке является недоедание и кахексия (истощение).
Это далеко не полный список тревожных симптомов, которые могут проявляться как отдельно, так и сочетаться, требующих немедленного обследования и постановки диагноза.
Диагноз необходим для прогноза и правильного лечения
Диагностика начинается со сбора анамнеза. Врач попросит Вас оценить динамику роста опухоли, длительность и последовательность симптомов. Возраст и порода, пол, вид животного тоже учитываются.
Далее, для правильного лечения необходимо ответить на два основных вопроса:
1.Что это такое (включая диагностику и степень злокачественности)?
2.Распространяется ли опухоль (местно, регионарно, системно)?
Ответы на эти вопросы будут получены посредством диагностики и определения стадии новообразования.
Определение стадии — важно для установления степени поражения. Оно основывается на исследовании опухоли, местных и регионарных лимфатических узлов и отдаленных областей, таких как легкие. Области для исследования выбираются с учетом известных биологических характеристик опухоли.
Для определения типа опухоли и ее стадии проводится:
Минимальный спектр диагностики:
1. Тонкоигольная аспирационная биопсия -это цитологичекое исследование (на клеточном уровне). Процедура быстрая. Используется, чтобы дать первоначальную оценку опухоли и диагностировать либо воспаление, либо неоплазию. Когда результатов только одного цитологического исследования недостаточно, проводят биопсию (исследование на тканевом уровне).
2. Толстоигольная биопсия. Этот вид биопсии позволяет получить несколько больший по размеру участок ткани. Для ее проведения используется толстая игла, оснащенная режущим устройством. Преимущество данного вида биопсии заключается в том, что больший по размеру участок ткани для гистологического исследования позволяет точнее выставить диагноз.
3. Инцизионная биопсия. Этот метод биопсии заключается в проведении иссечения небольшого кусочка ткани опухоли. Он уже больше похож на оперативное вмешательство. Данный вид биопсии проводится под местной анестезией. Зачастую инцизионная биопсия проводится в случае, когда результатов аспирационной биопсии недостаточно.
Зачастую инцизионная биопсия проводится в случае, когда результатов аспирационной биопсии недостаточно.
Исследование ткани с использованием биопсии позволяет подтвердить результат цитологии и является «принятым стандартом диагностики» для оценки полноты удаления и определения стадии злокачественности опухоли, что помогает сделать прогноз.
Однако, повреждение опухоли может привести к тому, что раковые клетки могут быть превнесены в раневой канал, поэтому место прокола или разреза должно быть расположено таким образом, чтобы при иссечении оно также было удалено.
Наиболее частой формой биопсии у животных является полное удаление опухоли с последующим гистологическим исследованием.
4. Рентгенография грудной клетки и ультразвуковое исследование брюшной полости для исключения факта метастазирования опухоли.
5. Гематологические исследования (анализы крови). Если расположение опухоли остается неизвестным или требуется дополнительная доказательная информация применяются:
6. Эндоскопические методы исследования,
Эндоскопические методы исследования,
7. Магнитно-резонансная томография, компьютерная томография.
8. Лабораторные методы включают морфологическое исследование крови, костного мозга.
Если есть наличие жидкости в грудной и брюшной полостях — они тоже подвергаются цитологическому исследованию.
Если рак подтвержден
Прежде всего, необходимо постараться не впадать в отчаяние и не рассматривать рак как «последнее» заболевание нашего времени, прочно связанное со страданием. Ветеринарная онкология интенсивно развивается. Накопленные знания практикующих врачей в этой области позволят либо вылечить животное полностью, либо существенно продлить его жизнь, снизив интенсивность заболевания, т.е. улучшить состояние животного за счет снижения темпов развития болезни и продления хорошего качества жизни.
Варианты лечения
Цель всех вариантов лечения рака — торможение деления опухолевых клеток и необратимое их разрушение, то есть подавление возможного возобновления заболевания.
Методы локального (местного) воздействия: хирургия, лучевая терапия, криодеструкция, гипертермия и др.
Методы системного воздействия: химиотерапия, иммуномодулирующая терапия.
Хирургическая операция является наиболее распространенным методом лечения рака у домашних животных и может быть очень эффективным средством, если рак локализован и удаляется достаточное количество ткани. Диагностика в сочетании с исчерпывающим определением стадии позволяет принять решение о необходимости проведения только операции или одновременного использования дополнительной терапии
Химиотерапия чаще всего используется для лечения системного, а не местного рака, она также может быть использована при введении в полость или внутрь поврежденной ткани(интерстициально). Химиотерапия показана, когда известно, что опухоль к ней чувствительна, также при неизвестном или повышенном риске развития системного рака.
Каждый из методов имеет свои преимущества и недостатки. В зависимости от локализации опухоли и ее чувствительности к выбранному методу лечения, один вариант лечения будет эффективнее другого. Иногда для достижения цели необходимо совмещение нескольких видов лечения, так называемая комбинированная терапия.
Иногда для достижения цели необходимо совмещение нескольких видов лечения, так называемая комбинированная терапия.
Цели лечения
После того, как владелец проинформирован о диагнозе, стадии, вариантах лечения и ответе на лечение, владелец и ветеринарный врач выбирают цель лечения.
Цели лечения: излечение, продление и улучшение качества жизни, временное облегчение симптомов и наблюдение.
Терапия, направленная на излечение, имеет цель полностью избавить от болезни. Это радикальное лечение с обеспечением максимального уровня избавления от рака наряду с сохранением нормальных тканей, что подразумевает использование таких нехирургических методов лечения, как химиотерапия и облучение областей, которые могут содержать жизнеспособные раковые клетки. Излечение всегда является оптимальной целью, но не всегда возможно из-за поставленного диагноза/стадии болезни, резервов организма и финансовых возможностей владельца или границ риска.
Снижение интенсивности заболевания — это лечение, направленное на снижение темпов развития рака, продление высокого качества жизни.
Облегчение — это лечение, направленное на минимизацию страданий животного и возможное продление жизни с сохранением ее хорошего качества, однако завершающим этапом является эвтаназия.
Наблюдение- постоянное целенаправленное обследование, которое необходимо, чтобы изменить или установить другую цель лечения. Во время наблюдения животное может получать, а может и не получать лечение. Всем животным, получившим лечение, необходимо регулярное медицинское наблюдение с учетом изменений в течение болезни.
Онкологическая настороженность – залог успешного лечения рака
Обнаружив у Вашего питомца опухоль, не стоит рассчитывать, что она исчезнет сама по себе. Не теряйте такое драгоценное для Вас и для врачей время. На поздних стадиях диагностика злокачественности опухоли не вызывает трудностей, но лечение намного сложнее. Чаще всего, именно по этой причине мы не в состоянии помочь нашим пациентам, и они по-прежнему умирают от рака.
Помните, что полное излечение возможно только при своевременном обращении и ранней диагностике опухолей.
В нашей клинике ведет прием специализированный ветеринарный онколог Швыдкина Елена Николаевна.
Прием онколога ведется по записи.
Сколько лет живут пациенты при онкологии толстой кишки. Booking Health
Прогнозы жизни при онкологии кишечника индивидуальны, но, в то же время, связаны с основными факторами: стадией, на которой было выявлено новообразование, расположением и типом опухоли, наличием сопутствующих заболеваний, методикой лечения. Всемирные статистические данные постоянно обновляются и позволяют предположить, насколько успешным будет лечение рака толстой кишки на каждой стадии.
Содержание
- Ожидаемый срок жизни на 1 стадии
- Ожидаемый срок жизни на 2 стадии
- Ожидаемый срок жизни на 3 стадии
- Ожидаемый срок жизни на 4 стадии
- Причины смерти при раке кишки
- Цены на лечение рака толстой кишки за рубежом
Ожидаемый срок жизни на 1 стадии
Поскольку ответ на вопрос сколько живут с раком кишечника зависит от физического размера первичной опухоли и качественного выявления метастазов, важно вовремя пройти специальное обследование при появлении клиники рака толстой кишки: постоянной боли в животе и проблем со стулом, появлении крови или гноя в кале.
При выявлении болезни на первой стадии прогнозы при онкологии толстой кишки максимально благоприятны. Согласно данным Национального института рака, 5-тилетняя выживаемость достигает 92 %.
Это означает, что при проведении лечения согласно стандартному протоколу более 92 % заболевших людей хорошо его перенесут, достигнут ремиссии и успешно проживут после этого более пяти лет. Операции при раке толстой кишки преимущественно проводятся на этой стадии.
Ожидаемый срок жизни на 2 стадии
Прогнозы при онкологии отделов кишечника 2 стадии напрямую зависят от масштабов поражения злокачественной опухолью стенки кишки. На стадии 2a заболевание поражает стенку кишки полностью, но не выходит за ее пределы. При этом онкологический очаг можно четко отделить от окружающих тканей, что повышает эффективность оперативного лечения.
На стадии 2b опухоль переходит на соседние органы – печень, мочевой пузырь, матку у женщин. Относительно благоприятный прогноз и высокая продолжительность жизни при раке кишечника связаны с полным отсутствием метастазов в других участках тела или распространения онкологического заболевания по лимфатической системе.
Согласно данным Национального института рака, 5-тилетняя выживаемость на этой стадии рака кишечника достигает 87 % на стадии 2a и 63 % на стадии 2b. При этом женщины имеют более благоприятный прогноз при поражении различных отделов кишечника – это связано с особенностями роста опухолевого очага на фоне влияния женских половых гормонов. Изучая цифры статистики, стоит помнить о том, что они, по сути, отражают ситуацию пятилетней давности. Хирургические методики постоянно совершенствуются, позволяя устранять патологические очаги более тщательно, а иногда и выполнять малоинвазивные оперативные вмешательства. Соответственно, с течением времени накопятся обновленные, более благоприятные и актуальные, статистические данные.
Понимание того, сколько живут больные раком кишечника, и какую именно методику лечения стоит выбрать, основывается на результатах предварительного медицинского обследования. Важно максимально корректно определить стадию заболевания и не пропустить его распространение в абдоминальной полости, метастазирование в другие органы или вовлечение в патологический процесс лимфоузлов.
То, сколько лет осталось прожить пациенту с онкологией кишечника, определяется профессионализмом оперирующего врача и полнотой выполнения операции. В случае полноценного удаления онкологического очага период послеоперационного восстановления протекает легче, а в перспективе требуется минимальный курс химиотерапии при раке толстой кишки.
Ожидаемый срок жизни на 3 стадии
Прогноз и клинические признаки при раке толстой кишки 3 стадии зависят от размера и расположения опухоли в стенке толстой кишки в сочетании с количеством и расположением пораженных лимфоузлов. На стадии 3a опухолевое образование достигает небольшого размера и располагается преимущественно в просвете кишечника, она не влияет на смежные органы. Несмотря на это, при тщательном обследовании доктор выявляет распространение процесса на близкорасположенные лимфоузлы. При этом прогноз онкологии кишечника на стадии 3a относительно благоприятен – 89 % заболевших преодолевают 5-летний рубеж вслед за точной постановкой диагноза.
Следующая стадия, 3b, отличается большим размером опухоли и ее более агрессивным распространением по стенке кишечникам и органам брюшной полости. На то, сколько лет живут пациенты с раком кишечника 3b стадии, дополнительно влияет развитие осложнений заболевания.
К наиболее частым осложнениям относятся:
- Острая непроходимость кишечника, которая чаще развивается при расположении новообразования в начальных отделах кишечника
- Инфекционные осложнения, флегмоны и абсцессы забрюшинной клетчатки
- Симптомы поражения смежных с опухолью органов
Сколько лет проживут пациенты с онкологией толстой кишки этой стадии – 5-летная выживаемость достигает 69 %.
Стадия 3с отличается от предыдущих стадий распространением патологического процесса на большое количество лимфоузлов. В то же время сама опухоль может быть компактной, не выходить за пределы кишки и не приводить к развитию типичных осложнений. Невозможность полного удаления всех онкологических очагов на стадии 3с снижает 5-летнюю выживаемость до 53 %. В этом случае за хирургическим лечением обязательно последует второй этап – полихимиотерапия. Современные фармакологические разработки позволяют улучшить ожидания в отношении того, сколько времени проживет пациент с онкологией кишечника. Также в таких клинических случаях может проводиться лучевая терапия при раке толстой кишки.
В этом случае за хирургическим лечением обязательно последует второй этап – полихимиотерапия. Современные фармакологические разработки позволяют улучшить ожидания в отношении того, сколько времени проживет пациент с онкологией кишечника. Также в таких клинических случаях может проводиться лучевая терапия при раке толстой кишки.
Ожидаемый срок жизни на 4 стадии
Важная отличительная черта рака толстой кишки 4 стадии – выявление метастазов в отдаленных участках тела. На ранних стадиях метастазы формируются в печени, через которую проходит кровь от органов абдоминальной полости и малого таза. Реже очаги появляются в легких, половых органах, костях, поджелудочной железе и надпочечниках. Число и локализация метастазов существенно влияют на то, сколько времени живут пациенты с онкологией кишечника на 4 стадии. В частности, при поражении легких применяются дополнительные методики – интенсифицированный курс полихимиотерапии либо же эмболизация метастазов химиопрепаратами. По ответу на лечение, уменьшению метастазов в размерах или их полному исчезновению на КТ / МРТ, доктор может определить, сколько времени осталось жить пациенту с 4 стадией онкологии кишки.
Согласно данным Национального института рака, 5-тилетняя выживаемость пациентов с онкологией кишечника 4 стадии достигает лишь 11 %. Зачастую это обусловлено поздним диагностированием рака или некорректным подбором индивидуального лечения. Несмотря на неутешительные статистические данные, прогнозы при онкологии кишки 4 стадии крайне индивидуальны.
Наибольшее значение при лечении рака толстой кишки 4 степени и определении прогнозов имеют следующие факторы:
- Возраст, у пациентов в возрасте до 60 лет шансы на восстановление более высоки
- Пол, при этом прогноз более благоприятен у мужчин
- Наличие сопутствующих заболеваний, наиболее важны в этом отношении нарушения функции печени и почек, состояние сердечно-сосудистой системы
- Наличие онкологии в анамнезе, при первичном диагностировании прогноз при раке кишечника 4 стадии более благоприятен
- Чувствительность опухолевых клеток к химиотерапии
Для прогнозирования того, сколько осталось прожить пациенту с раком кишечника 4 стадии, важно оценивать не только медицинские факторы и возможность проведения специализированного лечения, но и психо-эмоциональный настрой пациента..png) Безусловно, важно своевременно выполнить операцию, а также провести химиотерапию для борьбы с метастазами. Тем не менее, грамотная психологическая поддержка помогает человеку найти силы для борьбы с болезнью и поверить в достижимость ремиссии.
Безусловно, важно своевременно выполнить операцию, а также провести химиотерапию для борьбы с метастазами. Тем не менее, грамотная психологическая поддержка помогает человеку найти силы для борьбы с болезнью и поверить в достижимость ремиссии.
Имеет значение не только то, сколько времени живут пациенты при онкологии кишечника 4 степени, но и качество и полноценность жизни.
Полезным будет:
- Посещение индивидуальных и групповых сеансов поддерживающей психотерапии
- Подбор лечащим врачом грамотного режима физической нагрузки
- Общение с пациентами в посвященных заболеванию сообществах, знакомство с теми, кто вылечился от заболевания
Причины смерти при раке кишки
К сожалению, в определенных ситуациях заболевание быстро распространяется и не отвечает на лечение. То, как быстро умирают от рака кишечника, зависит от осложнений заболевания и возможности их лечения.
Наиболее грозными осложнениями и частыми причинами смерти являются:
- Хроническая интоксикация продуктами распада опухоли
- Кровотечение из сосудов опухоли или пораженных ею органов
- Поражение метастазами жизненно важных органов (головной мозг, печень, почки)
Стоит помнить, что симптомы новообразований кишечника не всегда легко распознать. При отсутствии квалифицированной диагностики рака толстой кишки пациенты могут длительно получать бесполезные медикаменты от колита или хронического панкреатита, в то время, как умирают от рака кишечника.
При отсутствии квалифицированной диагностики рака толстой кишки пациенты могут длительно получать бесполезные медикаменты от колита или хронического панкреатита, в то время, как умирают от рака кишечника.
Цены на лечение рака толстой кишки за рубежом
Стоимость обследования и лечения в зарубежных клиниках зависит, прежде всего, от страны и уровня клиники. Также на стоимость медицинской программы влияют возраст пациента, наличие сопутствующих заболеваний, стадия рака и тип опухоли.
Цены на лечение рака толстой кишки в разных странах:
| Стоимость | |
|---|---|
| Германия | от 18 300 евро |
| Израиль | от 17 000 евро |
| Турция | от 15 900 евро |
Если Вы хотите узнать цены на лечение рака толстой кишки в Германии, лечение рака толстой кишки в Израиле или других странах – обратитесь к оператору медицинского туризма Booking Health. Заполните форму «Отправить запрос» на сайте компании, и с в тот же день с Вами свяжется медицинский консультант.
Заполните форму «Отправить запрос» на сайте компании, и с в тот же день с Вами свяжется медицинский консультант.
Выбирайте лечение за рубежом и Вы, несомненно, получите отличный результат!
Авторы: Доктор Валерия Кружилина, Доктор Надежда Иванисова
Читайте:
Почему Booking Health – Вопросы и ответы
Как не ошибиться в выборе клиники и специалиста
7 причин доверять рейтингу клиник на сайте Booking Health
Booking Health – Стандарты качества
Саркома юинга
Саркома Юинга занимает второе место по частоте среди злокачественных опухолей костей у детей (после остеогенной саркомы) была впервые описана Д. Юингом в 1921 году и получила название по имени автора.
Эта опухоль редко встречается у детей младше 5 лет и у взрослых старше 30 лет. Наиболее часто эта опухоль возникает у подростков в возрасте от10 до 15 лет. Встречаются случаи внекостной саркомы Юинга с поражением мягких тканей.
Другая опухоль детского возраста — примитивная нейроэктодермальная опухоль (ПНЕТ) имеет много общих черт с костной и внекостной саркомой Юинга, которая может первично поражать как кости, так и мягкие ткани. Все эти опухоли развиваются из одного и того же типа клеток.
Костная саркома Юинга составляет 87%, внекостная саркома Юинга — 8% и ПНЕТ -5%.
Обычно такие опухоли развиваются в центральной части длинных трубчатых костей верхних и нижних конечностей, однако могут выявляться также в тазовых костях и в костях и мягких тканях, образующих грудную клетку.
Частота возникновения саркомы Юинга
Среди злокачественных опухолей у детей саркома Юинга составляет 1,8% и является второй по частоте среди злокачественных опухолей костей у детей (10-15%).
Ежегодно в США эта опухоль выявляется у 150 детей и подростков. Чаще заболеванию подвержены лица мужского пола.
Существует некоторая связь между возникновением саркомы Юинга и наличием аномалий костей скелета и мочеполовой системы.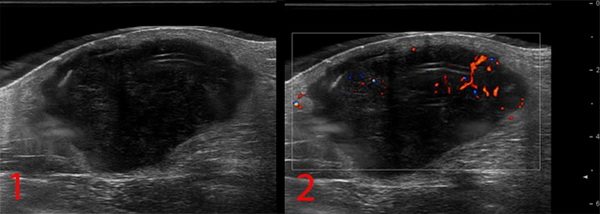
В 30% случаев в момент диагностики уже имеется метастатическое поражение легких и костей.
Факторы риска развития саркомы юинга
В настоящее время известно несколько факторов риска, связанных с возникновением саркомы Юинга.
Пол. Саркома Юинга несколько чаще встречается среди мальчиков по сравнению с девочками.
Возраст. В 64% случаев саркома Юинга встречается в возрасте от 10 до 20 лет.
Раса. Наиболее часто саркома Юинга наблюдается у белого населения.
Профилактика саркомы Юинга, как и большинства других опухолей детского возраста, в настоящее время невозможна, так как образ жизни детей и их родителей не влияет на частоту возникновения данной опухоли.
Диагностика саркомы юинга
Признаки и симптомы саркомы юинга
Наиболее частым симптомом саркомы Юинга является боль, которая встречается у 85% детей с поражением кости. Боль может быть вызвана как распространением процесса на надкостницу, так и переломом пораженной кости.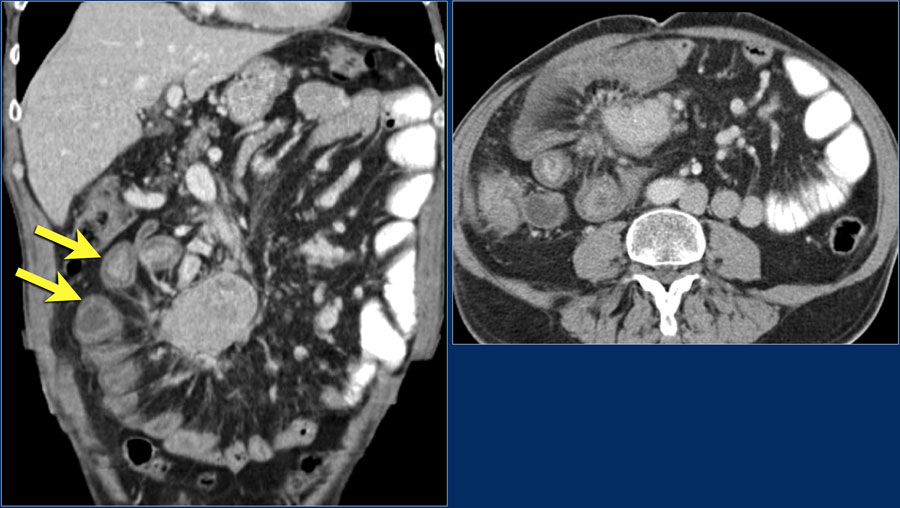
У 60% больных с костной саркомой Юинга и почти у всех пациентов с внекостной опухолью появляется припухлость или уплотнение. В 30% случаев опухоль бывает мягкой и теплой на ощупь. У больных имеется повышенная температура тела.
Данные признаки и симптомы могут наблюдаться также при ушибах и воспалении костной ткани, однако они проходят после лечения антибиотиками.
При распространенной (метастатической) саркоме Юинга больные могут жаловаться на повышенную утомляемость и похудание. В редких случаях, например, при поражении позвоночника возможна резкая слабость в нижних конечностях и даже паралич.
Анализ периферической крови. Выявление опухолевых клеток в крови больного указывает на поражение костного мозга при саркоме Юинга.
Биохимический анализ крови. Повышение уровня ЛДГ (лактатдегидрогеназы) дает право заподозрить метастатический процесс у больного саркомой Юинга.
Рентгенологическое исследование костей позволяет с определенной уверенностью диагностировать саркому Юинга.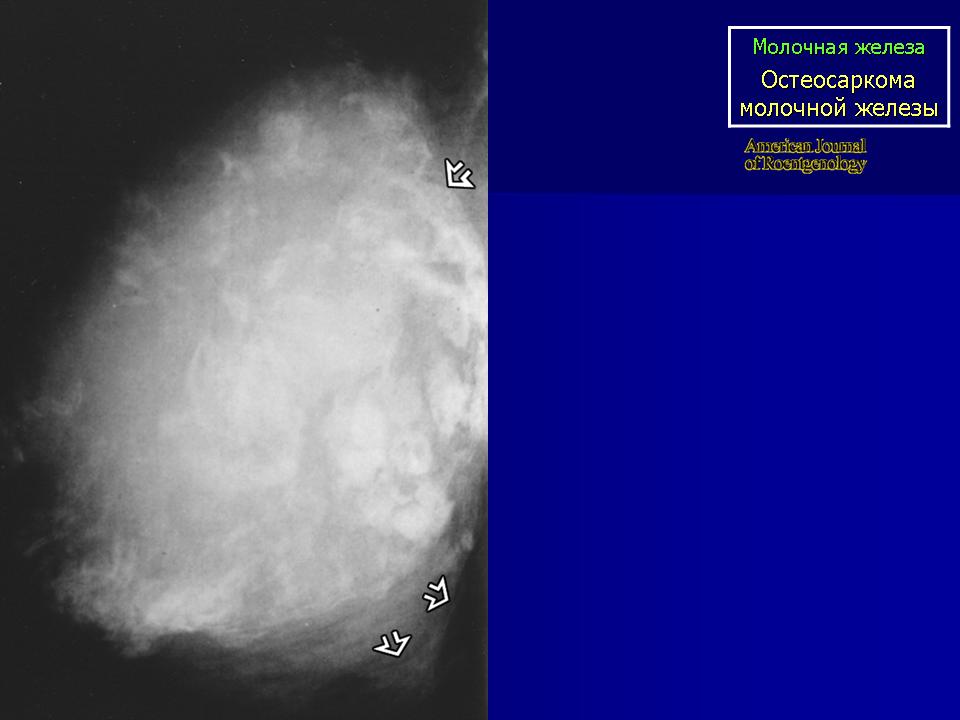
Рентгенологическое исследование грудной клетки дает возможность обнаружить метастазы саркомы Юинга в легких.
Компьютерная томография (КТ) (иногда с дополнительным контрастированием) костей грудной и брюшной полости позволяет уточнить локализацию и размер опухоли, выявить наличие метастазов в легких, лимфатических узлах и печени.
Магнитно-резонансная томография (МРТ) дает дополнительную информацию относительно состояния костного мозга, мышц и соединительной ткани вокруг пораженных костей и помогает определить степень распространения опухоли.
Радионуклидное сканирование (сцинтиграфия) с помощью технеция-99 выявляет поражение других костей и мягких тканей.
Пункция и биопсия костного мозга необходимы для выявления его поражения при саркоме Юинга.
Биопсия опухоли (взятие кусочка опухоли для исследования) является окончательным и обязательным методом для уточнения диагноза саркомы Юинга
Определение стадии (распространенности) саркомы юинга
Уточнение стадии саркомы Юинга важно как для определения прогноза (исхода) заболевания, так и для планирования лечения. При саркоме Юинга выделяют две стадии заболевания — локализованную и метастатическую.
При саркоме Юинга выделяют две стадии заболевания — локализованную и метастатическую.
При локализованной стадии опухоль ограничена тканью, из которой она возникла, но может также распространяться на окружающие мышцы и сухожилия.
Отсутствие видимых метастазов не исключает наличие мелких очагов (микрометастазов) опухоли, которые можно обнаружить только при микроскопическом исследовании.
Метастатическая стадия означает распространение опухоли в легкие, кости, костный мозг, лимфатические узлы, печень.
Лечение саркомы юинга
ОПЕРАЦИЯ
Выбор типа операции зависит от локализации опухоли и влияния операции на функцию пораженной части тела.
Во многих случаях пораженная кость или мягкие ткани могут быть полностью удалены хирургическим путем без нарушения функции органа. В других случаях сохранение функции органа после полного удаления опухолевой ткани невозможно.
Если много лет тому назад саркому Юинга верхних и нижних конечностей лечили с помощью ампутации, то в настоящее время чаще всего выполняются сохранные операции.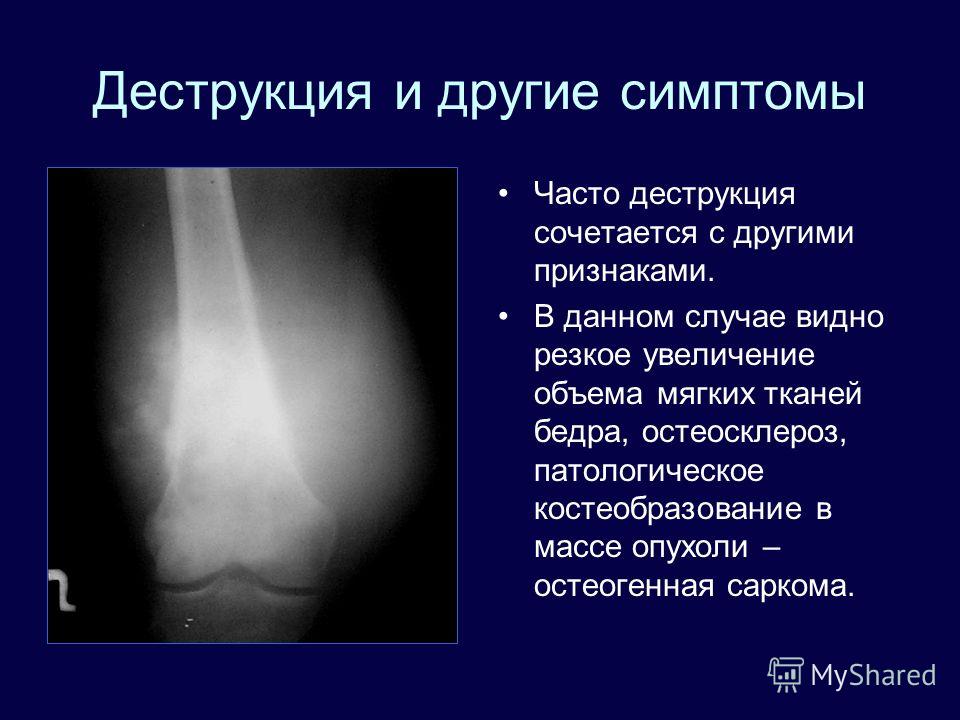 При этом удаленные кости и суставы замещаются трансплантатами или протезами. Сохранные операции проводятся даже больным с поражением тазовых костей.
При этом удаленные кости и суставы замещаются трансплантатами или протезами. Сохранные операции проводятся даже больным с поражением тазовых костей.
У больных саркомой Юинга с поражением жизненно важных нервов и сосудов вместо операции может быть применена лучевая терапия.
В случае локализации саркомы Юинга на грудной клетке выполняется удаление опухоли вместе с несколькими ребрами, которые замещаются синтетическим материалом.
Метастатические узлы в легких удаляются во время операции торакотомии. После операции таким больным проводится лучевая терапия на легочную ткань.
Из непосредственных и отдаленных последствий оперативного лечения саркомы Юинга следует отметить плохое заживление ран и инфекционные осложнения. Это объясняется ранее примененной химиотерапией и облучением. После операции многие больные саркомой Юинга нуждаются в восстановительном лечении.
Химиотерапия больным саркомой Юинга проводится с помощью противоопухолевых препаратов, вводимых, как правило, внутривенно и редко внутрь.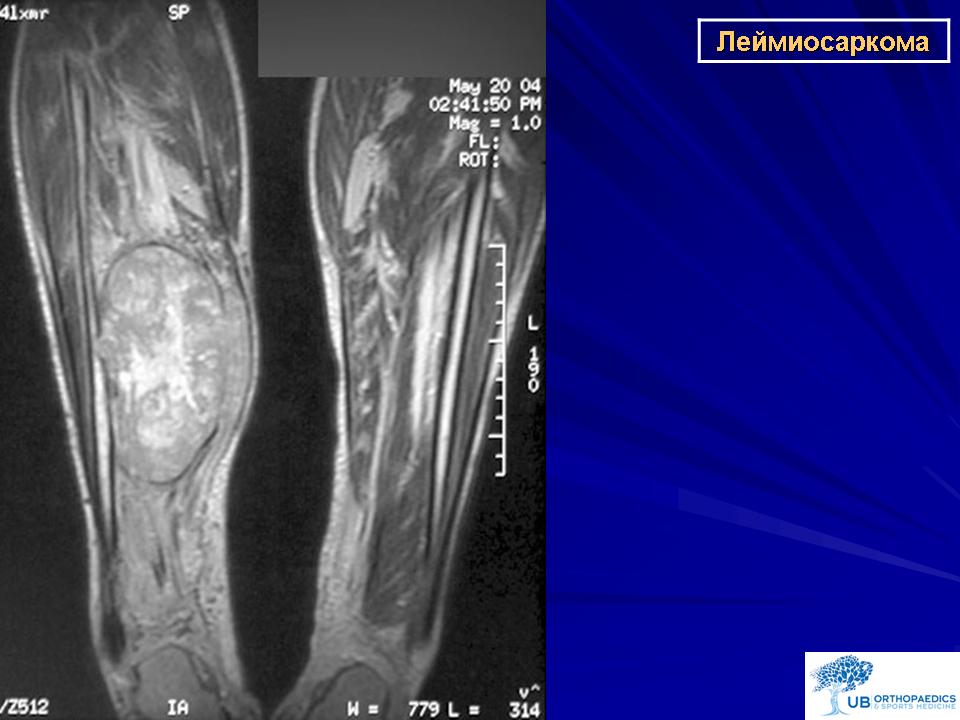 Этот метод лечения применяется всем больным, независимо от стадии болезни.
Этот метод лечения применяется всем больным, независимо от стадии болезни.
Это объясняется тем, что даже у больных с локализованным процессом могут быть микрометастазы, выявляемые только с помощью микроскопического исследования. Поэтому отказ от химиотерапии у больных с локализованной стадией в конце концов приведет к росту этих микрометастазов.
Для химиотерапии саркомы Юинга применяются различные комбинации (сочетания) противоопухолевых препаратов, которые назначаются каждые 3-4 недели.
Сначала применяется комбинация таких препаратов, как винкристин, адриамицин (доксорубицин) и циклофосфан. После того, как проходят побочные эффекты химиотерапии, назначают вторую комбинацию, включающую ифосфамид и этопозид. Такие циклы химиотерапии повторяют 4-5 раз.
Химиотерапия может сопровождаться различными побочными эффектами в виде тошноты, рвоты, потери аппетита, облысения, поражения слизистой оболочки полости рта и мочевого пузыря, повышения восприимчивости к инфекции, нарушения менструального цикла, бесплодия, повреждения сердечной мышцы.
Самым серьезным, хотя и редким, осложнением химиотерапии может быть возникновение второй злокачественной опухоли, в частности, острого миелоидного лейкоза.
ЛУЧЕВАЯ ТЕРАПИЯ
У больных саркомой Юинга применяется наружное облучение источниками высоких энергий. Эта опухоль является высоко чувствительной к облучению, и большинство больных можно излечить комбинацией химиотерапии и облучения.
Суммарная доза лучевой терапии на очаг обычно составляет 45-55 грей. По показаниям проводится облучение легких, однако дозы лучевой терапии при этом снижаются.
К серьезному осложнению лучевой терапии относится нарушение роста костей. При этом, чем моложе ребенок, тем более выражены побочные эффекты и осложнения. Лучевая терапия может вызвать укорочение конечности, деформацию лица и пр.
При облучении области таза возможно поражение мочевого пузыря и толстой кишки. Лучевая терапия на область сустава может вызвать ограничение его функции за счет образования рубцов.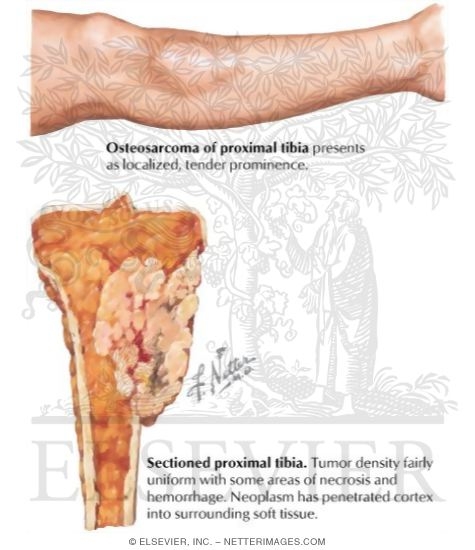
Побочные явления и осложнения лучевой терапии при воздействии на спинной и головной мозг проявляются через 1-2 года и заключаются в головной боли и ухудшении умственной деятельности.
Высокие дозы лучевой терапии (свыше 60 грей) в 20% случаев приводят к развитию второй злокачественной опухоли.
Трансплантация костного мозга и периферических стволовых клеток
В последнее время больным с плохим прогнозом, в частности с метастазами в кости и костный мозг, имеющим выживаемость менее 10%, применяется более интенсивное лечение — химиотерапия высокими дозами препаратов с облучением тела и трансплантацией костного мозга или периферических стволовых клеток. Такой подход позволяет излечить более 30% больных с метастатическим процессом.
После окончания лечения
После осуществления всей программы лечения саркомы Юинга больные должны находиться под наблюдением врачей и проходить периодическое обследование для выявления осложнений, возможного рецидива или второй опухоли.
Интервалы между посещениями врача со временем удлиняются.
Саркома мягких тканей: Статистика | Cancer.Net
НА ЭТОЙ СТРАНИЦЕ: Вы найдете информацию о количестве людей, которым ежегодно ставится диагноз STS. Вы также прочтете общую информацию о том, как пережить болезнь. Помните, что выживаемость зависит от нескольких факторов. Используйте меню для просмотра других страниц.
В этом году в США около 13 130 человек (7 470 мужчин и 5 660 женщин) будут диагностированы СТС.
Ожидается, что в этом году от этой болезни умрут примерно 5350 взрослых и детей (2870 мужчин и 2480 женщин).
Саркомы описываются как локализованные, локально распространенные или метастатические , когда они впервые обнаруживаются.
Локализованный означает, что опухоль находится только в 1 области тела.
Местнораспространенное означает, что опухоль поражает близлежащие ткани или органы или прикрепляется к ним.
 Это часто означает, что невозможно удалить опухоль из-за ее расположения, размера или органов, в которые она вовлечена.
Это часто означает, что невозможно удалить опухоль из-за ее расположения, размера или органов, в которые она вовлечена.Метастатический означает, что саркома распространилась на части тела, находящиеся далеко от того места, где саркома началась.
Этот раздел включает информацию о том, как часто саркомы проявляются как локализованные, локально распространенные или метастатические. Кроме того, есть информация о выживаемости для каждой ситуации. Эта информация применима к саркомам в целом и может не относиться к конкретному типу сарком. Поговорите со своей медицинской бригадой, чтобы получить дополнительную информацию о вашем конкретном диагнозе.
В целом статистика рака часто включает 5-летнюю выживаемость для определенного типа рака.5-летняя выживаемость показывает, какой процент людей живет не менее 5 лет после обнаружения рака. Процент означает сколько из 100. Общая 5-летняя выживаемость при саркоме составляет 65%.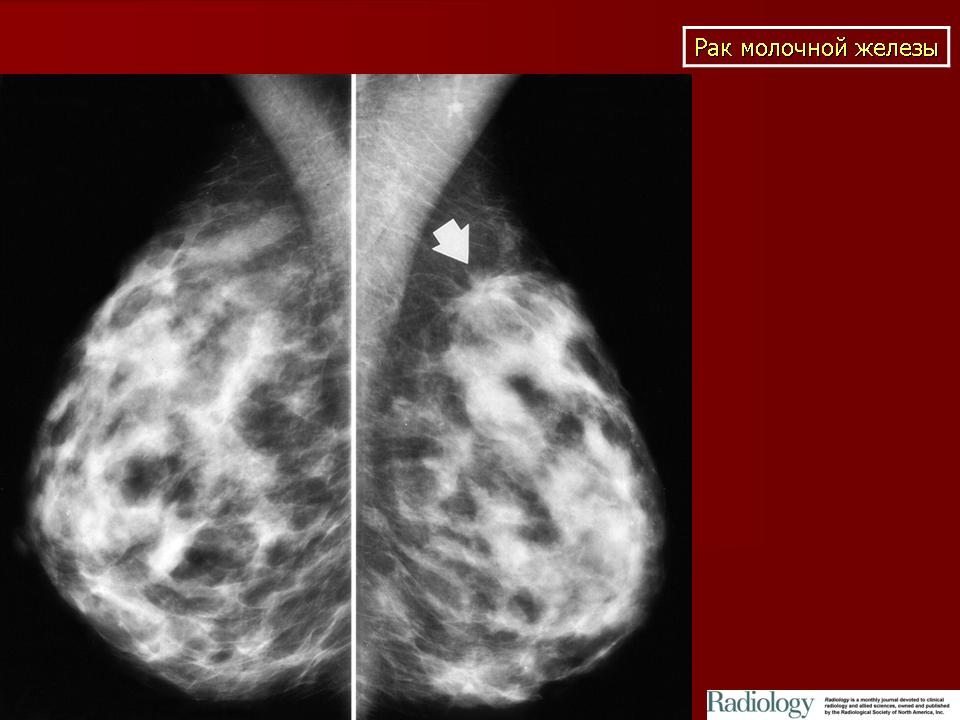
Около 60% сарком являются локализованными саркомами. 5-летняя выживаемость людей с локализованной саркомой составляет 81%.
Около 19% сарком находятся на локально распространенной стадии. 5-летняя выживаемость людей с местнораспространенной саркомой составляет 57%.
Около 15% сарком находятся в метастатической стадии. 5-летняя выживаемость для людей с метастатической саркомой составляет 16%.
Важно отметить, что продолжительность жизни человека с саркомой зависит от многих факторов, включая тип саркомы, размер, место расположения и скорость роста и деления опухолевых клеток. оценка. Если саркома обнаружена на ранней стадии и не распространилась с того места, где она возникла, хирургическое лечение часто оказывается очень эффективным и многие люди излечиваются.Однако, если саркома распространилась на другие части тела, лечение обычно позволяет контролировать опухоль, но часто это неизлечимо. Узнайте больше в разделе «Этапы и оценки».
Важно помнить, что статистические данные о выживаемости людей с STS являются приблизительными. Оценка основана на ежегодных данных, основанных на количестве людей с этим раком в Соединенных Штатах. Также каждые 5 лет специалисты измеряют статистику выживаемости. Таким образом, оценка может не отражать результаты более точной диагностики или лечения, доступного менее чем за 5 лет.Поговорите со своим врачом, если у вас есть какие-либо вопросы по поводу этой информации. Узнайте больше о статистике.
Статистика адаптирована из публикации Американского онкологического общества (ACS), Cancer Facts & Figures 2020 , веб-сайта ACS и программы Национального института рака по надзору, эпидемиологии и конечным результатам (SEER) (все источники по состоянию на январь 2020 г.).
Следующий раздел в этом руководстве — Медицинские иллюстрации . Предлагает чертежи частей тела, часто поражаемых STS.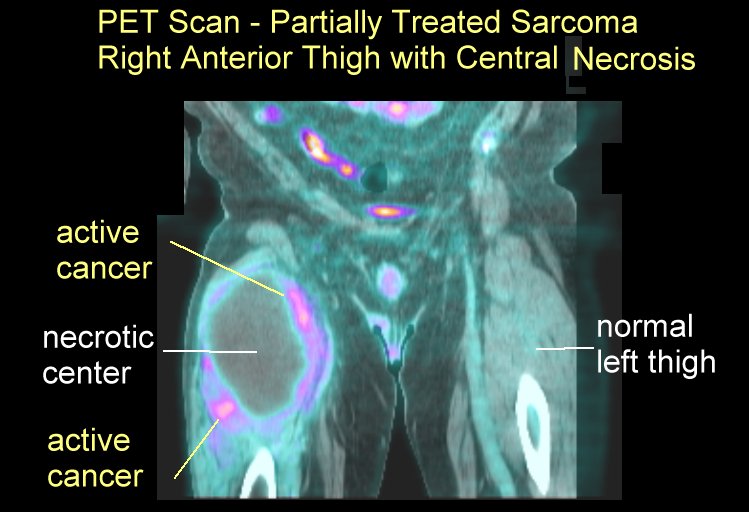 Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Лечение сарком мягких тканей, по этапам
Лучший шанс вылечить саркому мягких тканей состоит в том, чтобы удалить ее хирургическим путем, поэтому операция по возможности является частью лечения всех сарком мягких тканей. Важно, чтобы ваш хирург и другие врачи имели опыт лечения сарком. Эти опухоли трудно поддаются лечению и требуют как опыта, так и специальных знаний.Исследования показали, что пациенты с саркомой добиваются лучших результатов, когда их лечат в специализированных онкологических центрах, имеющих опыт лечения саркомы.
Саркома мягких тканей I стадия
Саркомы мягких тканей I стадии — это низкосортные опухоли любого размера. Небольшие (менее 5 см или около 2 дюймов в диаметре) опухоли рук или ног можно лечить только хирургическим путем. Цель операции — удалить опухоль вместе с нормальной тканью вокруг нее. Если раковые клетки обнаруживаются на краях удаленной ткани или рядом с ними (называются положительными или близкими границами), это может означать, что некоторые виды рака остались позади.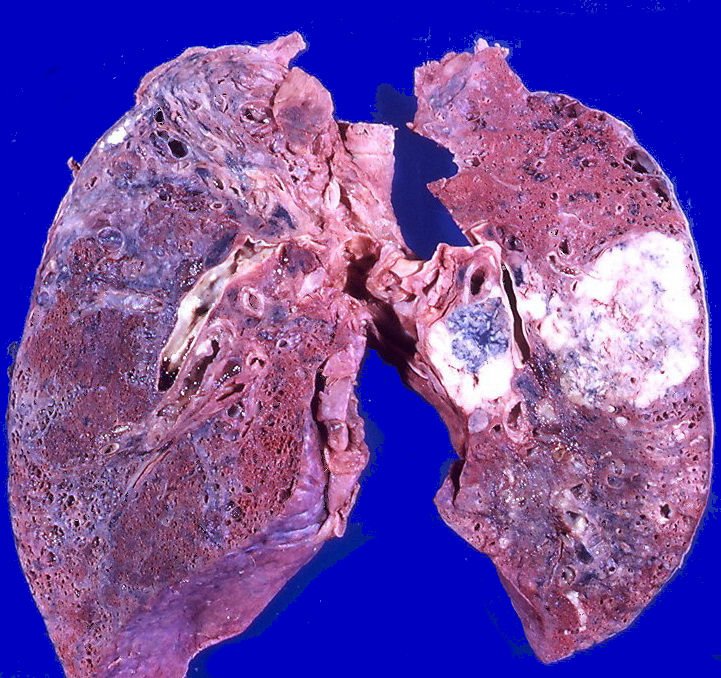 Часто лучший вариант для положительных или близких границ — это дополнительная операция. Другой вариант — лечение лучевой терапией после операции. Это снижает вероятность рецидива рака.
Часто лучший вариант для положительных или близких границ — это дополнительная операция. Другой вариант — лечение лучевой терапией после операции. Это снижает вероятность рецидива рака.
Если опухоль находится не в конечности (например, в голове, шее или брюшной полости), может быть сложнее удалить всю опухоль с достаточным количеством нормальной ткани вокруг нее. Для этих опухолей перед операцией может быть проведено облучение с химиотерапией или без нее. Это может позволить уменьшить опухоль настолько, чтобы полностью удалить ее хирургическим путем.Если облучение не используется до операции, оно может быть назначено после операции, чтобы уменьшить вероятность рецидива опухоли.
Саркома мягких тканей II и III стадии
Большинство сарком II и III стадии — опухоли высокой степени злокачественности. Они имеют свойство быстро расти и распространяться. Некоторые опухоли III стадии уже распространились на близлежащие лимфатические узлы. Даже если эти саркомы еще не распространились на лимфатические узлы, риск распространения (на лимфатические узлы или отдаленные участки) очень высок. Эти опухоли также имеют тенденцию расти снова в той же области после их удаления.(Это называется местное повторение .)
Эти опухоли также имеют тенденцию расти снова в той же области после их удаления.(Это называется местное повторение .)
При всех саркомах II и III стадии хирургическое удаление опухоли является основным методом лечения. Лимфатические узлы также будут удалены, если они содержат рак. Радиация может быть назначена после операции.
Если опухоль большая или находится в месте, которое затрудняет операцию, но не в лимфатических узлах, перед операцией пациента можно лечить химиотерапией, лучевой терапией или и тем, и другим. (При больших опухолях рук или ног, химиотерапия путем изолированной перфузии конечностей тоже вариант.) Цель лечения — уменьшить опухоль, облегчить ее удаление. После операции также могут быть назначены химиотерапия, лучевая терапия или и то, и другое. Эти методы лечения снижают вероятность того, что опухоль вернется в то же место или рядом с тем местом, где она возникла.
Небольшие опухоли можно лечить сначала хирургическим путем, а затем облучением, чтобы снизить риск рецидива опухоли.
В редких случаях требуется ампутация для удаления всей конечности с опухолью.
Лучевая терапия с химиотерапией или без нее может использоваться отдельно, когда расположение или размер опухоли или состояние здоровья пациента в целом делают операцию невозможной.
Саркома мягких тканей IV стадия
Саркома считается IV стадией, когда она распространилась на отдаленные части тела. Саркомы IV стадии редко поддаются лечению. Но некоторые пациенты могут быть излечены, если основная (первичная) опухоль и все области распространения рака (метастазы) могут быть удалены хирургическим путем. Лучший показатель успеха — когда он распространился только на легкие. Основные опухоли у этих пациентов должны лечиться как на стадиях II или III, и метастазы должны быть полностью удалены, если это возможно.Это все еще та область, в которой врачи расходятся во мнениях относительно того, какое лечение лучше всего и какие пациенты, скорее всего, выиграют.
Людям, у которых первичная опухоль и все метастазы не могут быть полностью удалены хирургическим путем, часто используются лучевая терапия и / или химиотерапия для облегчения симптомов. Химиопрепараты доксорубицин и ифосфамид часто оказываются первым выбором — вместе или вместе с другими препаратами. Гемцитабин и доцетаксел могут быть назначены, если первая комбинация перестает работать (или не работает).Пациентам с ангиосаркомой может быть полезно лечение паклитакселом (Таксол) или доцетакселом (Таксотер) с винорелбином (Навельбин). Для некоторых типов сарком мягких тканей лечение новыми таргетными препаратами также может быть вариантом.
Химиопрепараты доксорубицин и ифосфамид часто оказываются первым выбором — вместе или вместе с другими препаратами. Гемцитабин и доцетаксел могут быть назначены, если первая комбинация перестает работать (или не работает).Пациентам с ангиосаркомой может быть полезно лечение паклитакселом (Таксол) или доцетакселом (Таксотер) с винорелбином (Навельбин). Для некоторых типов сарком мягких тканей лечение новыми таргетными препаратами также может быть вариантом.
Рецидивная саркома
Рак называется рецидивирующим , когда он возвращается после лечения. Рецидив может быть локальным (в том же месте или рядом с ним) или отдаленным (распространяться на другие органы или ткани, такие как легкие или мозг).
Если саркома возвращается в той же области, где возникла, ее можно вылечить хирургическим путем.Лучевая терапия может быть назначена после операции, особенно если лучевая терапия не была частью лечения исходной опухоли. Если раньше использовалось внешнее лучевое излучение, возможна брахитерапия.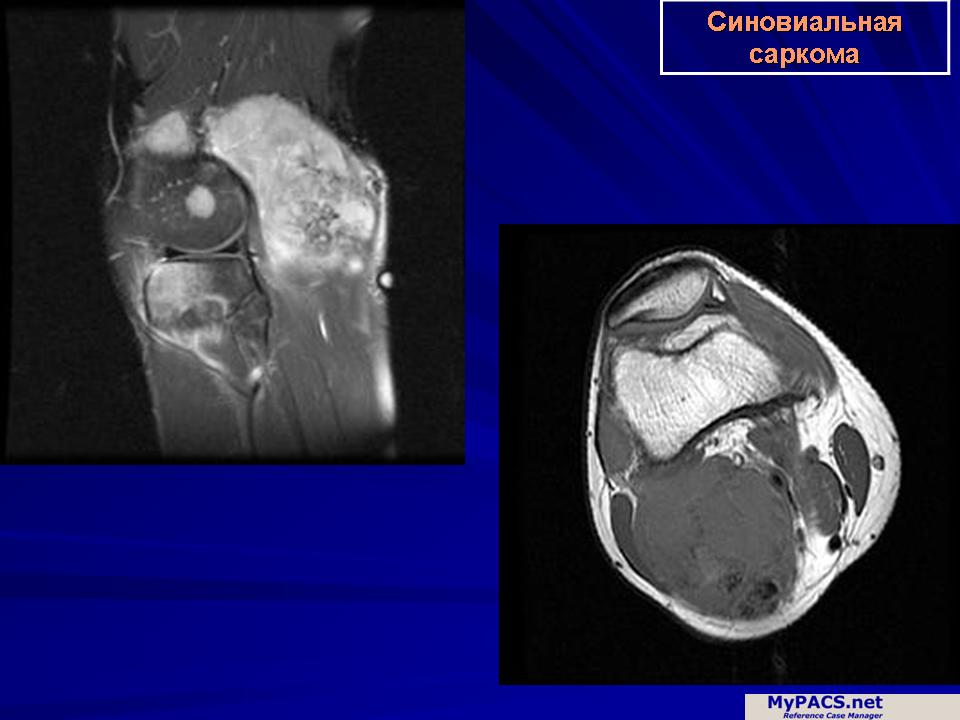
Если саркома возвращается в отдаленную часть тела, можно использовать химиотерапию или таргетную терапию. Если саркома распространилась только на легкие, возможно, удастся удалить все области распространения хирургическим путем. Радиация часто используется для лечения сарком, которые распространяются на мозг, а также любых рецидивов, вызывающих такие симптомы, как боль.
Саркома мягких тканей: ваши шансы на выздоровление (прогноз)
Какой прогноз?
Прогноз — это слово, которое ваша медицинская бригада может использовать для описания вашего вероятного исхода от рака и лечения рака. Прогноз — это расчетное предположение. Это вопрос, который задают многие люди, когда узнают, что у них рак.
Делаем выбор
Решение спросить о вашем прогнозе является личным. Вам решать, сколько вы хотите знать.Некоторым людям легче справляться и планировать заранее, когда они знают свой прогноз и статистику того, насколько хорошо лечение может работать. Другие люди считают статистику запутанной и пугающей. Или они могут подумать, что статистика слишком общая, чтобы быть полезной.
Другие люди считают статистику запутанной и пугающей. Или они могут подумать, что статистика слишком общая, чтобы быть полезной.
Медицинский работник, который лучше всех знает ваше здоровье, лучше всего сможет обсудить с вами ваш прогноз. Он или она может объяснить, что статистика может означать в вашем случае. При этом следует помнить, что ваш прогноз может измениться.Результаты лечения рака и рака трудно предсказать. Например, благоприятный прогноз (что означает, что у вас, скорее всего, все будет хорошо) может измениться, если рак распространяется на ключевые органы или не реагирует на лечение. Может измениться и неблагоприятный прогноз. Это может произойти, если лечение сокращается и контролирует рак, чтобы он не разрастался и не распространялся.
Что входит в прогноз
При определении вашего прогноза ваш лечащий врач учтет все факторы, которые могут повлиять на рак и его лечение.Ваш лечащий врач изучит оценку риска для типа и стадии (степени) вашего рака. Эти оценки основаны на результатах, которые исследователи наблюдали за многие годы у других людей с таким же типом и стадией рака.
Эти оценки основаны на результатах, которые исследователи наблюдали за многие годы у других людей с таким же типом и стадией рака.
Если ваш рак, вероятно, хорошо поддается лечению, ваш лечащий врач скажет, что у вас благоприятный прогноз. Если ваш рак трудно контролировать, ваш прогноз может быть менее благоприятным. Важно помнить, что в прогнозе указывается, что является вероятным или вероятным.Это не предсказание того, что обязательно произойдет. Ни один поставщик медицинских услуг не может быть полностью уверен в исходе.
Ваш прогноз зависит в основном от:
Тип вашей саркомы
Расположение рака
Стадия (степень) рака
Ваш возраст и общее состояние здоровья
Насколько хорошо рак поддается лечению
Оценка выживаемости
Показатели выживаемости показывают, какая часть людей живет в течение определенного периода времени после того, как им сообщили, что они больны раком. Ставки сгруппированы для людей с определенными типами и стадиями рака. Часто используемые числа относятся к 5-летней выживаемости. Именно столько людей живет через 5 лет после постановки диагноза. Выживаемость включает:
Ставки сгруппированы для людей с определенными типами и стадиями рака. Часто используемые числа относятся к 5-летней выживаемости. Именно столько людей живет через 5 лет после постановки диагноза. Выживаемость включает:
Люди, свободные от рака
Люди, у которых все еще есть признаки рака. Обратите внимание, что эти люди могут получать или не получать лечение от рака.
Каковы показатели выживаемости при саркоме мягких тканей?
В целом, прогноз для людей с саркомой мягких тканей обычно лучше, если рак обнаружен на ранней стадии, а не на более поздней стадии.
Вот 5-летняя выживаемость при саркоме мягких тканей по данным Национального института рака .
В целом, 5-летняя выживаемость сарком мягких тканей составляет около 65%.
5-летняя выживаемость при раке, поразившем близлежащие органы или лимфатические узлы, составляет около 50%.
После того, как саркома мягких тканей распространилась на другие части тела, 5-летняя выживаемость составляет около 18%.

Эти числа скорректированы с учетом того факта, что некоторые люди с саркомой мягких тканей могут умереть от других причин.
Поговорите со своим врачом
Вы можете спросить своего врача о выживаемости и о том, чего вы можете ожидать. Но помните, что статистика основана на больших группах людей. Их нельзя использовать, чтобы сказать, что с вами произойдет. Нет двух одинаковых людей. Лечение и то, насколько хорошо люди реагируют на лечение, различаются.
Выживание | Саркома мягких тканей
Выживание зависит от множества различных факторов. Поэтому никто не может сказать вам точно, сколько вы проживете. Зависит от вашего:
- тип и стадия рака
- уровень физической подготовки
- предыдущее лечение
Это общая статистика, основанная на больших группах пациентов. Помните, они не могут сказать вам, что произойдет в вашем конкретном случае.
Ваш врач может дать вам дополнительную информацию о вашем собственном прогнозе (прогнозе).Вы также можете поговорить об этом с медсестрами отдела исследования рака Великобритании по бесплатному телефону 0808 800 4040 с 9 до 17 часов с понедельника по пятницу.
Выживаемость при различных типах сарком мягких тканей
Существует много различных типов сарком мягких тканей. Ваше мировоззрение зависит от того, какой у вас тип. Если вы хотите узнать больше о вашем конкретном типе саркомы, поговорите со своим специалистом.
Приведенные ниже статистические данные относятся к саркомам, диагностированным в Англии в период с 1985 по 2009 год. Они получены от Национальной сети онкологической разведки.У нас есть информация о:
- лейомиосаркома
- липосаркома
- фибробластная саркома
- рабдомиосаркома
- саркома Юинга мягких тканей
- синовиальная саркома
- сосудистая саркома (опухоль ангиосаркома 13)
- сосудистая саркома (опухоль ангиосаркома 13)
- сосудистая саркома (ангиосаркома 13)
- Почти 50 из каждых 100 человек (почти 50%) переживут рак в течение 5 или более лет после постановки диагноза
- хорошо дифференцированная липосаркома
- миксоидная липосаркома
- плеоморфная липосаркома
- липосаркома БДУ (не указано иное)
- злокачественная фиброзная гистиоцитома (MFH)
- дерматофибросаркома
- фибросаркома
- миксофибросаркома
- эмбриональная рабдомиосаркома
- альвеолярная рабдомиосаркома
- плеоморфная рабдомиосаркома
- более 40 из каждых 100 человек (более 40%) выживают после рака в течение 5 лет или более после постановки диагноза
- почти 60 из каждых 100 человек (почти 60%) выживают после рака в течение 5 лет и более
- ангиосаркома
- гемангиоэндотелиома
- более 75 из каждых 100 человек (более 75%) переживут рак в течение 5 или более лет после постановки диагноза.
- более 50 из каждых 100 человек (более 50%) выживут после рака в течение 5 лет или более после постановки диагноза.
- 75 из 100 человек (75%) выживают после рака в течение 1 года или более после постановки диагноза
- Почти 55 из 100 человек (почти 55%) выживают после рака в течение 5 лет и более после постановки диагноза
- 45 из 100 человек (45%) выживают после рака в течение 10 и более лет после постановки диагноза
- Саркомы мягких тканей более распространены и имеют около 50 подтипов, включая липосаркому, синовиальная саркома, плеоморфная недифференцированная саркома и многие другие.
- Костные саркомы , также называемые раком костей, включают остеосаркомы, Саркома Юинга, хондросаркома и несколько других подтипов.
В целом, для лейомиосаркомы:
Перспективы лейомиосаркомы зависят от возраста. У людей моложе 60 лет внешний вид лучше, чем у людей старше 60 лет.
У людей моложе 60 лет внешний вид лучше, чем у людей старше 60 лет.
Перспективы также зависят от того, какая часть тела поражена.
Кожа
95 из каждых 100 человек (95%) с лейомиосаркомой кожи выживают после рака в течение 5 и более лет после постановки диагноза.
Рука или нога (конечности)
Около 70 из каждых 100 человек (около 70%) с лейомиосаркомой конечностей выживают после рака в течение 5 или более лет после постановки диагноза.
Основная часть тела (туловище)
40 из каждых 100 человек (40%) с лейомиосаркомой соединительной ткани туловища выживают после рака в течение 5 или более лет после постановки диагноза. Соединительная ткань включает мышцы, нервы или кости.
Пищеварительная система (например, пищеварительный тракт, желудок или кишечник)
Около 40 из каждых 100 человек (около 40%) с лейомиосаркомой пищеварительной системы выживают после рака в течение 5 лет или более после постановки диагноза.
Женские половые органы (например, матка или яичники)
Около 40 из каждых 100 человек (около 40%) с лейомиосаркомой женских половых органов выживают после рака в течение 5 или более лет после постановки диагноза.
Перспективы липосаркомы зависят от типа липосаркомы и от того, где она находится в организме.
Существует четыре подтипа липосаркомы:
Термин, не обозначенный иначе ‘(БДУ) — термин, используемый врачами вместе некоторые виды рака, не принадлежащие к определенной группе.
Хорошо дифференцированная липосаркома
Почти 90 из каждых 100 человек (почти 90%) с хорошо дифференцированной липосаркомой выживают после рака в течение 5 или более лет после постановки диагноза.
Почти каждый (почти 100%) с хорошо дифференцированной липосаркомой рук или ног переживет рак в течение 5 или более лет после постановки диагноза.
Около 90 из 100 человек (около 90%) с хорошо дифференцированными липосаркомами соединительной ткани туловища выживают после рака в течение 5 или более лет после постановки диагноза.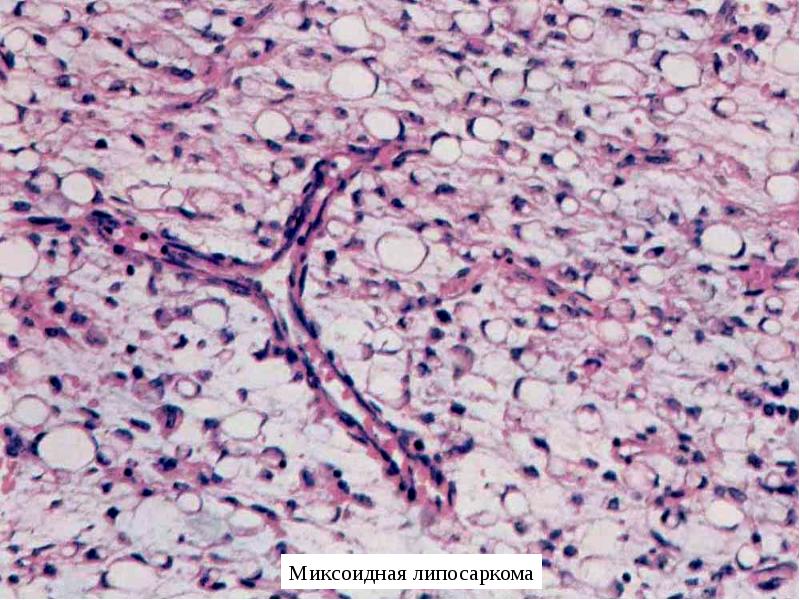 Соединительная ткань включает мышцы, кости или нервы. Туловище — это основная часть тела, включая грудь, живот (живот) и область таза.
Соединительная ткань включает мышцы, кости или нервы. Туловище — это основная часть тела, включая грудь, живот (живот) и область таза.
Около 60 из каждых 100 человек (около 60%) с хорошо дифференцированной липосаркомой позади органов в области живота (забрюшинная липосаркома) выживают после рака в течение 5 или более лет после постановки диагноза.
Перспективы фибробластной саркомы зависят от типа фибробластной саркомы и ее местонахождения в организме.
Статистические данные ниже относятся к 4 типам фибробластной саркомы:
Врачи обычно не используют термин MFH.Большинство опухолей, которые раньше назывались MFH, теперь более точно диагностируются как другие типы сарком. Небольшое количество, которое все еще называлось бы MFH, теперь известно как недифференцированная плеоморфная саркома.
Изменения в том, как врачи диагностируют и классифицируют фибробластную саркому, затруднили предоставление точной статистики выживаемости по каждому подтипу. Следующие цифры основаны на пациентах, диагностированных между 2000 и 2004 годами, до того, как эти изменения произошли.
Дерматофибросаркома
Практически все люди (около 99%) переживают рак в течение 5 или более лет после постановки диагноза.
Миксофибросаркома
75 из 100 человек (75%) выживают после рака в течение 5 или более лет после постановки диагноза.
Злокачественная фиброзная гистиоцитома
60 из 100 человек (60%) выживают после рака в течение 5 или более лет после постановки диагноза.
Фибросаркома
60 из 100 человек (60%) переживают рак в течение 5 или более лет после постановки диагноза.
Перспективы фибробластной саркомы также варьируются в зависимости от того, где она находится в организме.
Руки или ноги (конечности)
Около 70 из каждых 100 человек (около 70%) с фибробластной саркомой конечностей выживают после рака в течение 5 или более лет после постановки диагноза.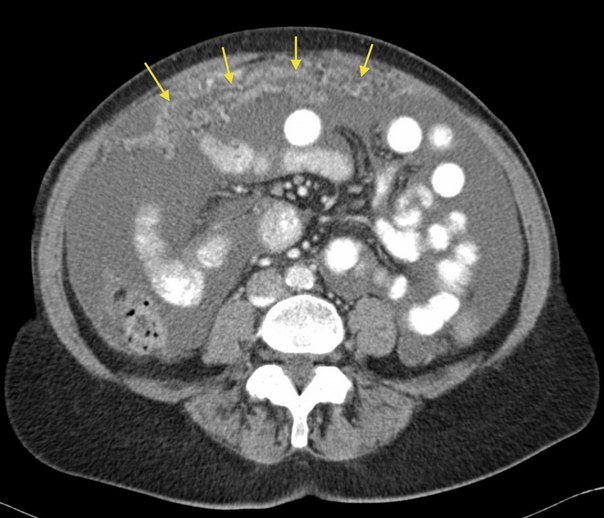
Основная часть тела (туловище)
Около 60 из каждых 100 человек (около 60%) с фибробластической саркомой в стволе их тела переживут рак в течение 5 или более лет после постановки диагноза.
Перспективы рабдомиосаркомы зависят от типа рабдомиосаркомы и вашего возраста.
Перспектива лучше при рабдомиосаркоме, развивающейся в области головы и шеи, чем в руках, ногах или основной части (туловище) тела. Эта разница может быть из-за возраста. В основном рабдомиосаркомами головы и шеи болеют дети.
К различным подтипам рабдомиосаркомы относятся:
Эмбриональная рабдомиосаркома 1000002 на каждые 60 лет или более
человек выживают после диагнозаиз 60 лет.
Альвеолярная рабдомиосаркома
Более 30 из каждых 100 человек (более 30%) переживут рак в течение 5 или более лет после постановки диагноза.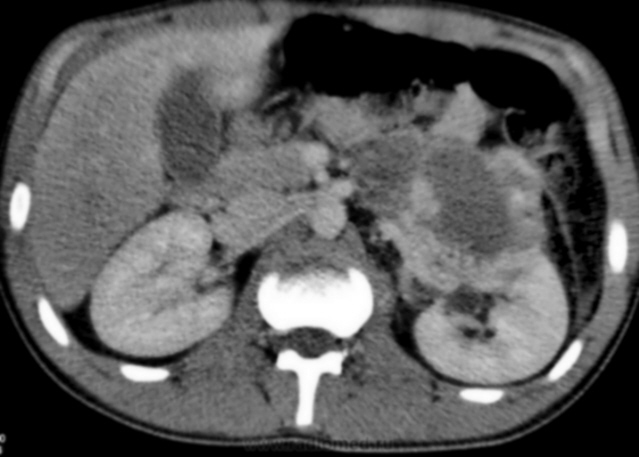
Плеоморфная рабдомиосаркома
Более 30 из каждых 100 человек (более 30%) выживут после рака в течение 5 или более лет после постановки диагноза.
Возраст влияет на прогноз эмбриональной рабдомиосаркомы, и у молодых пациентов прогноз лучше, чем у пациентов старшего возраста.
Моложе 15 лет
70 из каждых 100 человек (70%) моложе 15 лет выживают после рака в течение 5 или более лет после постановки диагноза.
Старше 15
Около 50 из 100 человек (около 50%) старше 15 лет переживают рак в течение 5 лет или более после постановки диагноза.
В целом, для людей с саркомой Юинга мягких тканей:
В самых последних данных о выживаемости такие факторы, как возраст или местонахождение саркомы, не оказали значительного влияния на результат.Другие факторы, такие как размер опухоли и ее распространение, не были включены в эти данные, но они повлияют на ваш прогноз.
В целом, для людей с синовиальной саркомой:
На результат влияет ваш возраст и расположение саркомы в вашем теле.
30 или моложе
Около 75 из каждых 100 человек (около 75%) в возрасте 30 лет и младше переживают рак в течение 5 лет или более после постановки диагноза.
Старше 30
50 из каждых 100 человек (50%) старше 30 лет переживают рак в течение 5 или более лет после постановки диагноза
На выживаемость также влияет то, где в вашем теле находится синовиальная саркома .
Руки или ноги (конечности)
Около 65 из каждых 100 человек (около 65%) с синовиальной саркомой конечностей выживают после рака в течение 5 или более лет после постановки диагноза.
Основная часть тела (туловище)
Почти 40 из каждых 100 человек (почти 40%) с синовиальной саркомой туловища выживают после рака в течение 5 и более лет после постановки диагноза.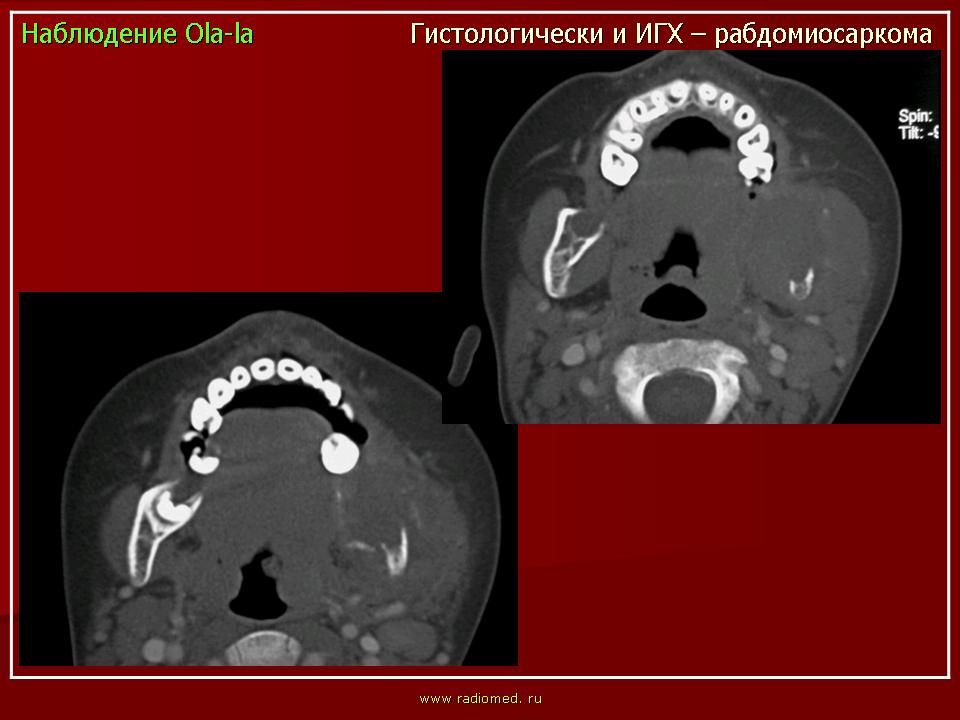
Перспективы сосудистой саркомы зависят от вашего типа сосудистой саркомы и места расположения саркомы в вашем теле.
2 типа сосудистых сарком:
Ангиосаркома
Около 30 из каждых 100 человек (около 30%) с ангиосаркомой переживут рак в течение 5 или более лет после постановки диагноза.
Гемангиоэндотелиома
Около 40 из каждых 100 человек (около 40%) с гемангиоэндотелиомой выживают после рака в течение 5 или более лет после постановки диагноза.
Ваше мировоззрение также зависит от того, где в вашем теле находится саркома.
Грудь
Около 65 из 100 человек (около 65%) с ангиосаркомой груди переживут рак в течение 5 или более лет после постановки диагноза.
Орган в основной части (туловище) тела (например, печень или желудок)
Около 10 из 100 человек (около 10%) с сосудистой саркомой в таком органе, как печень или желудок, выживают после рака в течение 5 и более лет после постановки диагноза.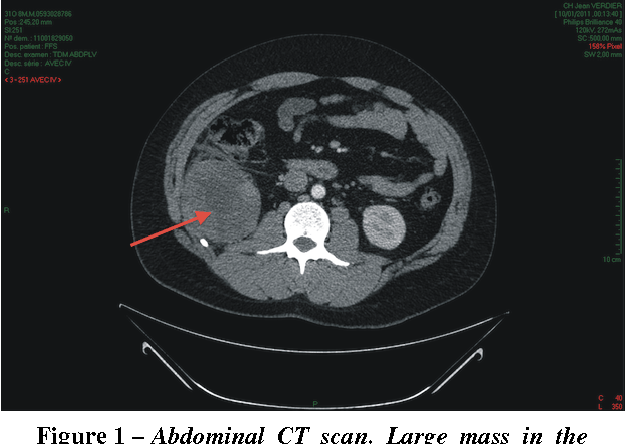
В целом, для людей с саркомой Капоши:
У мужчин результат лучше, чем у женщин. Мы действительно не знаем, почему это так.
В целом для людей с опухолями нервных оболочек:
На эту статистику не влияют другие факторы, такие как возраст или расположение саркомы в организме.
Заболеваемость саркомой мягких тканей и выживаемость Опухоли, диагностированные в Англии в период с 1985 по 2009 год
Национальная сеть онкологической разведки (NCIN), декабрь 2012 г.
Эти статистические данные относятся к относительной выживаемости. Относительное выживание учитывает, что некоторые люди умрут не от рака, а от других причин. Это дает более точную картину выживаемости при раке.
Это дает более точную картину выживаемости при раке.
Выживаемость по стадиям
Статистические данные по выживаемости по стадиям саркомы в Великобритании отсутствуют. Приведенная ниже статистика из Америки. Имейте в виду, что из-за различий в системах здравоохранения, сборе данных и населении эти цифры не являются истинной картиной выживания в Великобритании.
Следующие статистические данные относятся к саркоме мягких тканей рук или ног.
1 этап
Около 90 из 100 человек (около 90%) живут 5 лет и более.
2 этап
Около 80 из 100 человек (около 80%) живут 5 лет и более.
3 этап
Почти 60 из 100 человек (почти 60%) проживут 5 и более лет.
4 этап
Статистические данные по саркомам, распространившимся на другие части тела (стадия 4), отсутствуют, но они имеют более низкую выживаемость, чем стадия 3.
AJCC Руководство по стадированию рака (7-е издание)
Американский объединенный комитет по раку
Springer, 2010
Выживаемость при всех стадиях и типах саркомы мягких тканей
Обычно для людей с саркомой мягких тканей в Великобритании:
Эти статистические данные относятся к людям, у которых в Великобритании была диагностирована саркома мягких тканей в период с 1996 по 2009 год..jpg)
Статистические данные предоставлены Группой знаний и разведки общественного здравоохранения Англии (Уэст-Мидлендс), по запросу, 2013 г.
Эти статистические данные относятся к относительной выживаемости. Относительное выживание учитывает, что некоторые люди умрут не от рака, а от других причин. Это дает более точную картину выживаемости при раке.
Об этой статистике
Термины 1 год выживания и 5 лет не означают, что вы проживете только 1 или 5 лет. Некоторые люди живут намного дольше 5 лет.
Дополнительная статистика
Для получения более подробной информации о выживаемости и саркоме мягких тканей перейдите в раздел «Статистика рака».
Лечение саркомы: ответы онколога Кэрол Моррис
Саркома — это злокачественная или раковая опухоль, которая возникает из соединительной ткани, такой как кости, жир, хрящи и мышцы. Саркомы редки — они составляют всего 1 процент всех раковых заболеваний. Ежегодно саркома диагностируется примерно у 15 000 человек в США.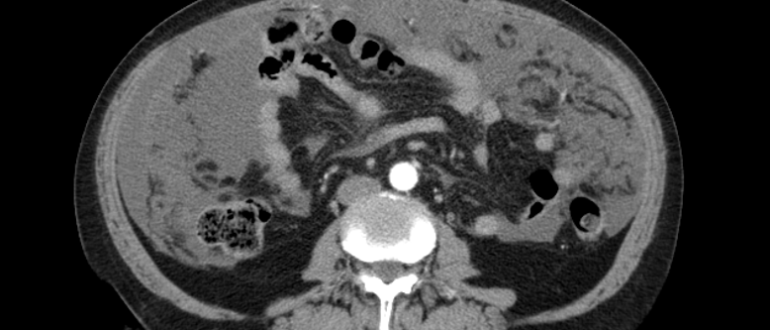
Доктор Кэрол Моррис, руководитель отделения ортопедической онкологии и содиректор программы по лечению саркомы Онкологического центра Джонса Хопкинса и Сидни Киммела, обсуждает варианты лечения саркомы и прогноз.
Какие бывают виды сарком?
Существует два основных типа саркомы:
Что вызывает саркому?
Причина большинства сарком неизвестна. Саркомы могут развиваться у детей и взрослые по непонятной причине. В некоторых случаях саркомы были связаны с прошлое воздействие радиации, определенных химикатов или вирусов.
Саркомы передаются по наследству?
Не то, чтобы мы об этом знали. Однако вы можете унаследовать гены, которые могут сделать вас
с большей вероятностью заболеет саркомой. Например, дети с семейным
синдром ретинобластомы имеет генную мутацию, которая делает их предрасположенными к остеосаркома.
Однако вы можете унаследовать гены, которые могут сделать вас
с большей вероятностью заболеет саркомой. Например, дети с семейным
синдром ретинобластомы имеет генную мутацию, которая делает их предрасположенными к остеосаркома.
Где может распространяться саркома?
Как и большинство видов рака, саркома может распространяться или метастазировать в другие части тела. твое тело. Чем больше опухоль или чем выше класс, тем больше вероятность это метастазировать. Легкие — наиболее частое место, где саркомы распространения, хотя метастазы были зарегистрированы в большинстве органов, в том числе печень, лимфатические узлы и кости.
Как лечится саркома?
Когда вас направляют к специалисту по саркоме, независимо от того, ортопед-онколог или онколог-хирург, специалист оценит размер и
расположение опухоли, а также проверка на наличие метастазов. В раке Киммела
Center, мы проводим различные тесты — от МРТ и Компьютерная томография к
сканирование костей и
биопсии — чтобы мы могли получить полную картину вашего состояния.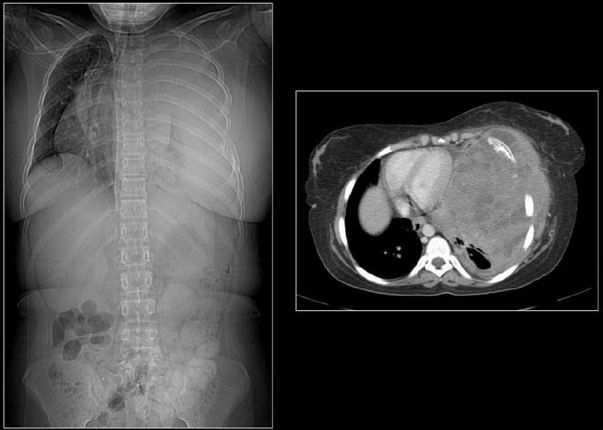
План лечения каждого пациента с саркомой может быть разным.В Johns Hopkins, мы используем мультидисциплинарный подход к лечению саркомы в котором участвует большая команда экспертов, которые вместе работают над поиском лучших лечение для вас. Как правило, лечение саркомы может включать химиотерапию, лучевая терапия и хирургия. Например, лечение остеосаркомы может включает девять недель химиотерапии, операцию по удалению опухоли и восстановлению кость и еще пять месяцев химиотерапии. Однако опыт может отличаются для разных людей.
Может ли саркома вернуться?
Как и большинство других видов рака, саркома может повторяться.Когда мы выполняем саркому хирургии в Johns Hopkins, мы стремимся к тому, что мы называем отрицательной маржей . Это означает удаление опухоли и достаточно окружающие ткани, чтобы удалить как можно больше раковых клеток. Мы можем также используйте лучевую терапию или химиотерапию, чтобы убить оставшуюся саркому клетки.
Хотя такой подход улучшает выживаемость и ожидаемую продолжительность жизни, возможно
что саркома может вернуться. Некоторые саркомы имеют тенденцию снова появляться в том же
пятно, а другие растут в новых местах.Обычно, если саркома все же наступает
назад, это происходит в течение первых двух-пяти лет после операции.
Некоторые саркомы имеют тенденцию снова появляться в том же
пятно, а другие растут в новых местах.Обычно, если саркома все же наступает
назад, это происходит в течение первых двух-пяти лет после операции.
Что, если саркома распространилась на мои легкие?
Если саркома распространяется на легкие, мы пытаемся определить, могут ли опухоли быть безопасно снято. Если операция невозможна, другие методы лечения, такие как может быть рекомендована биологическая терапия, химиотерапия и лучевая терапия. Биологическая терапия использует живые микроорганизмы для нацеливания на раковые клетки напрямую или стимулировать всю вашу иммунную систему.Один из примеров биологического терапия — препарат пазопаниб, который был одобрен для лечения мягких тканевые саркомы. Лучевая и химиотерапия — два других варианта саркома, распространившаяся на легкие. Если эти методы лечения не успешно, вы можете иметь право участвовать в клиническом исследовании.
Предотвращает ли облучение рецидив саркомы?
Облучение помогает предотвратить повторное появление сарком в одном и том же месте (местное
повторение). Когда радиация доставляется во время операции, также известная как
интраоперационная лучевая терапия (ИОЛТ), она «стерилизует» ткани вокруг
опухоль, убивая раковые клетки.
Когда радиация доставляется во время операции, также известная как
интраоперационная лучевая терапия (ИОЛТ), она «стерилизует» ткани вокруг
опухоль, убивая раковые клетки.
Что происходит после операции по поводу саркомы?
После завершения операции вы пройдете период восстановления. Это может включать реабилитация, физиотерапия, трудотерапия и другие виды ухода за боком последствия вашего лечения.
Даже после того, как вы вернетесь к своей повседневной жизни, вы должны придерживаться График наблюдения, рекомендованный врачом для наблюдения за вашим состоянием. Это называется наблюдением. Это расписание выполняется каждые три-шесть месяцев и обычно включает компьютерную томографию, рентген или другой тест. в зависимости от типа саркомы.
Есть ли связь между диетой и рецидивом саркомы?
Здоровая диета полезна независимо от того, есть у вас саркома или нет. Но там
Связь между диетой и рецидивом саркомы неизвестна. Несмотря на это, получение
питательные вещества из здоровой пищи могут помочь вашему организму лучше справиться с побочными эффектами
лечения саркомы..jpg)
Есть ли какие-нибудь новые методы лечения саркомы?
Персонализированная медицина — одно из новых средств лечения саркомы, которое может стать предпочтительный подход к лечению рака.Это означает сбор данных о вашем тела и рака на молекулярном уровне, чтобы подобрать вам лекарство, наибольшее влияние и минимальные побочные эффекты для вашего конкретного типа опухоль. Иматиниб — один из таких препаратов, нацеленный на определенные типы рака, включая опухоли стромы желудочно-кишечного тракта (GIST), которые являются наиболее общая саркома желудочно-кишечного тракта.
Узнайте больше о различных типах саркомы в нашей библиотеке здоровья
Бремя симптомов, выживаемость и паллиативная помощь при расширенной саркоме мягких тканей
Введение .Бремя симптомов и роль паллиативной помощи (ПК) у пациентов с запущенной саркомой мягких тканей (STS) не определены. Методы . В этом исследовании ретроспективно рассматривались как симптомы, так и вовлечение ПК у пациентов, известных в справочный центр STS, которые умерли в течение одного календарного года. Результатов . 81 пациент соответствовал критериям включения, из которых 27% имели местнораспространенное заболевание и 73% метастазов при первичном направлении. Среднее количество симптомов медленно прогрессировало в диапазоне от 2 (диапазон 0–5) до химиотерапии первой линии (= 50) до 3 (диапазон 1–6) во время принятия решения о наилучшей поддерживающей терапии (= 48). ).Наиболее частыми симптомами были боль и одышка. Средняя общая выживаемость после решения BSC составила 3,4 недели. 88% имели поражение ПК (либо в больнице, либо в сообществе, либо и то, и другое) со средним временем от первого обращения к врачу до смерти 16 (диапазон 0–110) недель. Выводы . Пациенты с метастатическим STS имеют значительное бремя симптомов, что оправдывает раннее направление к специалисту по ПК. Боль, включая невропатическую боль, представляет собой серьезную проблему. Одышка является распространенным, прогрессирующим заболеванием и, по-видимому, не лечится. Время от решения BSC до смерти невелико, и необходимы проспективные исследования, чтобы определить, связано ли это с чрезмерным лечением или очень быстрым прогрессированием терминальной стадии заболевания.
Результатов . 81 пациент соответствовал критериям включения, из которых 27% имели местнораспространенное заболевание и 73% метастазов при первичном направлении. Среднее количество симптомов медленно прогрессировало в диапазоне от 2 (диапазон 0–5) до химиотерапии первой линии (= 50) до 3 (диапазон 1–6) во время принятия решения о наилучшей поддерживающей терапии (= 48). ).Наиболее частыми симптомами были боль и одышка. Средняя общая выживаемость после решения BSC составила 3,4 недели. 88% имели поражение ПК (либо в больнице, либо в сообществе, либо и то, и другое) со средним временем от первого обращения к врачу до смерти 16 (диапазон 0–110) недель. Выводы . Пациенты с метастатическим STS имеют значительное бремя симптомов, что оправдывает раннее направление к специалисту по ПК. Боль, включая невропатическую боль, представляет собой серьезную проблему. Одышка является распространенным, прогрессирующим заболеванием и, по-видимому, не лечится. Время от решения BSC до смерти невелико, и необходимы проспективные исследования, чтобы определить, связано ли это с чрезмерным лечением или очень быстрым прогрессированием терминальной стадии заболевания.
1. Введение
Саркомы мягких тканей — это злокачественные опухоли соединительной ткани, включающие более 50 различных гистологических подтипов, которые различаются по своему клиническому поведению и реакции на лечение [1, 2]. Хирургическое вмешательство, часто дополняемое адъювантной лучевой терапией, предлагает единственный надежный шанс излечить локализованное заболевание [2, 3]; однако более чем у 50% пациентов с саркомой мягких тканей (STS) развиваются метастазы [4, 5]. В то время как метастазэктомия становится все более возможной [6], паллиативное лечение обычно состоит из лучевой терапии при местнораспространенном «неоперабельном» рецидиве и системной химиотерапии при широко распространенном метастатическом заболевании [1–3].Целью такого паллиативного лечения является установление контроля над заболеванием, что улучшает выживаемость и симптоматику [2].
Медиана общей выживаемости (ОВ) после начала паллиативной химиотерапии первой и второй линий составляет 12 месяцев [7, 8] и 8 месяцев [9] соответственно. Системная химиотерапия обладает потенциалом значительной токсичности [10], и хотя это обычно регистрируется в рамках клинических испытаний [11], обобщенных данных о распространенности симптомов STS мало. Недавнее исследование популяции STS в целом в одном отделении саркомы Соединенного Королевства (Великобритания) показало, что распространенность боли на момент оценки составляла 53%, из которых 63% были описаны как недостаточно контролируемые [12].
Системная химиотерапия обладает потенциалом значительной токсичности [10], и хотя это обычно регистрируется в рамках клинических испытаний [11], обобщенных данных о распространенности симптомов STS мало. Недавнее исследование популяции STS в целом в одном отделении саркомы Соединенного Королевства (Великобритания) показало, что распространенность боли на момент оценки составляла 53%, из которых 63% были описаны как недостаточно контролируемые [12].
Симптомы, связанные с заболеванием или лечением, часто лечат онкологи; однако более сложный контроль симптомов может оказаться сложной задачей и потребовать участия специалиста. Учитывая возможность появления симптомов и ограниченный прогноз, может показаться очевидной роль участия бригады паллиативной помощи (ПК) в популяции продвинутых пациентов с ИППП.
Паллиативная помощь определяется Всемирной организацией здравоохранения (ВОЗ) как «подход, который улучшает качество жизни пациентов и их семей, сталкивающихся с проблемами, связанными с опасными для жизни заболеваниями, за счет предотвращения и облегчения страданий посредством раннего выявления. и безупречная оценка и лечение боли и других проблем, физических, психосоциальных и духовных »[13].Команды ПК в Великобритании предоставляют спектр услуг, включая (i) группы консультирования / поддержки больниц, (ii) хосписы, обеспечивающие госпитализацию для контроля симптомов, передышки или ухода в конце жизни, и (iii) общественные группы ПК, которые оценивают и лечат пациентов в собственных домах.
В рамках политики здравоохранения Великобритании, руководство № Национального института здоровья и клинического совершенства (NICE) 2006 г. «Улучшение результатов для людей с саркомой» не обнаружило конкретных доказательств, подтверждающих роль бригад ПК в лечении пациентов с саркомой [14].Тем не менее, он предложил большую часть своих рекомендаций в документе 2004 г. по улучшению поддерживающей и паллиативной помощи для взрослых с раком. [15] было применимо. В частности, это указывает на эффективность участия специализированной команды ПК для контроля боли и симптомов рака. Однако в нем не говорилось, когда и может ли быть целесообразным направление ПК для контроля симптомов или комплексной поддержки.
Было показано, что раннее участие бригады ПК улучшает качество жизни, настроение и выживаемость у пациентов с недавно диагностированным метастатическим немелкоклеточным раком легкого, состоянием с прогнозом, аналогичным метастатическому STS [16].Однако во многих случаях ПК поставляется слишком поздно, чтобы быть эффективным [17, 18].
Имеются неофициальные сообщения как от клиницистов, так и от пациентов с STS, что, несмотря на запущенное заболевание, пациенты с STS сохраняют хорошее качество жизни с умеренными симптомами до быстрого спада в последние недели [19]. Хотя нет никаких данных, подтверждающих это, было высказано предположение, что ухудшение отличается от более «предсказуемого» постепенного ухудшения, которое испытывают люди с другими видами рака, такими как немелкоклеточный рак легкого [19].Если это правда, можно ожидать, что направление к специалистам группы ПК может быть получено слишком поздно, чтобы принести пользу населению STS. Важно оценить бремя симптомов и влияние ПК при местнораспространенном и метастатическом STS, чтобы дать рекомендации по оптимальному времени вовлечения ПК.
В этой статье представлены результаты ретроспективного обзора физических симптомов и участия бригады ПК у пациентов с местнораспространенным «неоперабельным» / метастатическим STS, получавших лечение в одном специализированном центре в Великобритании.
Цели заключались в том, чтобы лучше определить количество и тяжесть физических симптомов во время каждого нового решения о лечении, например, перед химиотерапией первой линии, перед химиотерапией второй линии и т. Д. Для местнораспространенных / метастатических STS.Мы также хотели установить наиболее распространенные симптомы в каждой группе и долю пациентов, направленных в группу ПК до смерти, а также их ОС с момента постановки диагноза с метастатическим заболеванием.
2. Материалы и методы
Были проанализированы записи всех пациентов с гистологическим диагнозом местнораспространенного / метастатического STS в возрасте старше 18 лет, известных отделению и рассматриваемых для проведения паллиативной химиотерапии, которые умерли в течение 2009 календарного года. Пациенты были исключены из анализа, если лечение не включало оценку паллиативной химиотерапии (те, кто лечился только хирургическим вмешательством или паллиативной лучевой терапией), если отделение STS предоставило только заключение о лечении и если смерть считалась не связанной с диагнозом STS.Пациенты со стромальными опухолями желудочно-кишечного тракта (ГИСО) также были исключены, так как в этой четко определенной подгруппе лечение с использованием агентов молекулярной направленности, таких как иматиниб, может обеспечить долгосрочную выживаемость.
Данные были собраны из больничных электронных карт пациентов и ручного поиска бумажных записей. Отсутствующие данные из больничных карт были получены от бригады первичной медико-санитарной помощи пациента.
Карты каждого пациента были проанализированы от первого направления с запущенным заболеванием до смерти.Собранные данные включали демографическую информацию, данные об опухоли, решения о лечении, задокументированные симптомы и информацию, касающуюся поражения ПК.
В частности, задокументированные соматические симптомы записывались из записей перед каждым новым решением о лечении, например, перед паллиативной химиотерапией первого ряда, и регистрировались по четырем категориям; «Присутствует под контролем», «присутствует неконтролируемо», «задокументировано отсутствует» или «не задокументировано».
Термин «тяжесть симптомов» можно определить как симптомы, испытываемые пациентом в результате самого заболевания или связанных с ним методов лечения [20].
В этом исследовании мы оценивали задокументированные соматические симптомы перед принятием нового решения о лечении. Влияние системной терапии на тяжесть симптомов напрямую не изучалось. Общая выживаемость (ОС) измерялась от начала каждого нового решения о лечении до смерти. До сбора данных было получено разрешение комитета по клиническому аудиту.
3. Результаты
Сто сорок два пациента с STS с местнораспространенным / метастатическим заболеванием, известным отделению STS, умерли в течение отчетного периода с 1 января 2009 г. по 31 декабря 2009 г.Шестьдесят один пациент не соответствовал критериям включения в обзор (см. Рис. 1), в результате чего был проанализирован 81 история болезни.
3.1. Демографические данные и информация, относящаяся к опухолям
Демографические и специфические для опухоли данные этих пациентов описаны в таблице 1. Тридцать пять пациентов (43%) были мужчинами со средним возрастом на момент смерти 55 лет в диапазоне от 18 до 84 лет. Семьдесят шесть пациентов (94%) поступили с «новым» запущенным «неоперабельным» / метастатическим заболеванием и 5 (6%) уже получали лечение по поводу запущенного заболевания в других онкологических центрах до рассмотрения его отделением медицинской онкологии STS.Пятьдесят девять пациентов (73%) имели метастатическое заболевание на момент направления, 17 (29%) имели полиорганное заболевание.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Сто пятьдесят шесть пациентов были приняты к сведению, и были сделаны записи о лечении для каждого из них. к каждому из этих решений.Пятьдесят пациентов получили химиотерапию первой линии, 28 — второй линии, 15 — третьей линии и 7 — четвертой линии. Восемь пациентов были направлены на испытания лекарственных препаратов фазы 1, и 48 пациентов получили лучшую поддерживающую терапию (BSC), то есть больше не принималось никаких решений об активном лечении со стороны подразделения STS.
Кроме того, семи пациентам (9%) была выполнена метастазэктомия после положительного ответа на химиотерапию. 18 (22%) получили паллиативную лучевую терапию в какой-то момент после направления к специалисту с задокументированными целями, такими как уменьшение размера первичной опухоли (7 пациентов), обезболивание (5 пациентов), лечение метастазов в головной мозг (5 пациентов) и лечение компрессии спинного мозга (1 пациент).
3.2. Бремя симптомов
Среднее количество симптомов, задокументированных перед каждым новым решением о лечении, варьировалось от 2 во время химиотерапии первой линии до 3 в BSC (рис. 2). В таблице 2 показаны все задокументированные симптомы на момент принятия каждого нового решения о лечении: боль, одышка и тошнота / рвота — три самых распространенных. Другие симптомы включают усталость, запор и кашель. Оба рисунка показывают, что до начала различных линий химиотерапии бремя симптомов было постоянным, но увеличивалось до того, как оба приняли решение направить в группу исследования фазы 1 (медиана 2.5 симптомов) и оптимальное поддерживающее лечение (медиана 3). Двумя наиболее частыми зарегистрированными симптомами были боль и одышка.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(a) Боль
Боль была наиболее частым симптомом при всех решениях о лечении / на всех стадиях заболевания.Пятьдесят процентов пациентов, начавших химиотерапию первой линии, испытали боль; однако доля пациентов с болью увеличилась до 82% (23/28) при химиотерапии второй линии и осталась аналогичной при решении BSC (79%, 38/48). Двадцать процентов (10/50) пациентов имели неконтролируемую боль при химиотерапии первой линии по сравнению с 48% (23/48) пациентов при решении BSC (таблица 3). Золотым стандартом эффективного лечения онкологической боли является следование трехступенчатой анальгетической лестнице ВОЗ [21].В таблице 4 описывается общее применение анальгезии у этих пациентов. Он показывает, что 86% (70/81) пациентов использовали обычный анальгетик «шага 1», например парацетамол, в среднем за 40 недель до смерти, тогда как 64% (52/81) требовали регулярного обезболивания «шага 3» — например, сильный опиоид, такой как пероральный морфин, в среднем за 14 недель до смерти. Интересно, что 28% (23/81) назначали нейропатический агент, такой как габапентин, что означает, что доля испытывающих невропатическую боль составляла не менее 28%.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||
(b) Одышка
Одышка была вторым наиболее частым симптомом при всех решениях / стадиях заболевания, за исключением химиотерапии первой линии. У 20% пациентов, начавших химиотерапию первой линии, наблюдалась одышка; однако доля пациентов увеличилась до 39% (11/28) при химиотерапии второй линии и еще больше увеличилась (44%, 21/48) после решения BSC (см. Таблицу 2).Это коррелирует с тем, что легкие являются наиболее частым местом метастазирования STS. У шести процентов (3/50) пациентов была задокументирована неконтролируемая одышка при химиотерапии первой линии по сравнению с 31% (15/48) пациентов при решении BSC. В целом, лекарства, специально задокументированные для облегчения одышки (опиоиды или бензодиазепины), назначались только 15% (12/81) пациентов, что свидетельствует о недостаточном лечении этого симптома.
3.3. Общая выживаемость
Медиана выживаемости с момента первого обращения к специалисту независимо от лечения (= 81) составила 38.7 недель (таблица 5), что указывает на относительно плохой прогноз для этой когорты STS. Среднее время выживаемости от начала химиотерапии первой и второй линии соответствует установленным данным [7–9]. Из 59% с задокументированным решением BSC OS от принятия решения составила 3,4 недели (диапазон 1–62).
| |||||||||||||||||||||||||||||||||||||||||||||||
3.4. Вовлеченность бригады паллиативной помощи
71 пациенту (88%) команда ПК была направлена либо в бригаду больницы (7/71), либо в бригаду сообщества (26 из 71), либо в обе группы (38 из 71). Среднее время до смерти от первого направления PC-команды было 15.8 недель (диапазон 0,1–110,3).
4. Обсуждение
Пациенты с местнораспространенным / метастатическим STS обычно проходят химиотерапию в качестве паллиативного эффекта, а не излечения. В этой статье показано, что эти пациенты испытывают значительное бремя симптомов, которое трудно контролировать. Авторы надеются, что эти данные о распространенности симптомов будут обобщенными и, следовательно, ценными для онкологов, лечащих STS.
Среднее количество задокументированных симптомов варьировалось от 2 при химиотерапии первой линии до 3 при решении BSC, что свидетельствует о стойких и медленно прогрессирующих симптомах.Распространенность документированной боли до принятия различных решений о паллиативном лечении постоянно превышала 50%. Это коррелирует с систематическим обзором van den Beuken-van Everdingen et al. предполагая, что распространенность боли составляет 64% у пациентов с распространенным / метастатическим / терминальным раком любого типа [22]. Более того, недавнее исследование, посвященное распространенности боли в популяции STS, показало, что ее распространенность составляет 53% [12], из которых 36% имеют нейропатическую боль. Хотя документально подтвержденная интерпретация типа боли не была записана, 28% пациентов в этой статье были прописаны нейропатические анальгетики, что соответствует этим недавно опубликованным данным.
Одышка может иметь многофакторную этиологию; однако высокая распространенность документированной одышки коррелирует с легкими как наиболее частым местом метастазов при STS. На момент направления у 38 из 59 пациентов (64%) с метастазами были метастазы в легкие; это сопоставимо с результатами других исследований [7, 8, 23]. Растущая распространенность одышки при химиотерапии, вероятно, отражает прогрессирование заболевания в легких. Небольшое количество пациентов, принимающих лекарства, специально предназначенные для облегчения одышки (12 пациентов), может свидетельствовать об отсутствии у клиницистов уверенности в лечении этого симптома или отсутствии документации, объясняющей, почему эти лекарства (например,ж., опиаты или бензодиазепины).
Одна поразительная статистика — то, что у тех, кто принял решение BSC (48/81), медиана ОС составила всего 3,4 недели. Это может означать, что «активное» лечение продолжается на поздних стадиях развития болезни, вопреки рекомендациям, вытекающим из национального отчета Великобритании, в котором рассматриваются случаи смерти в течение 30 дней после получения системной противоопухолевой терапии [24]. И наоборот, это может также подкрепить анекдотическое наблюдение о том, что пациенты с STS остаются относительно здоровыми и имеют хорошее качество жизни до поздних стадий заболевания, а затем быстрое ухудшение к терминальной фазе [19].
Важно отметить, что медиана ОС для всех пациентов была значительно меньше одного года. Стратегия оказания помощи в конце жизни Министерства здравоохранения Великобритании [25] отстаивает важность индивидуальных планов ухода и участия ПК в последний год жизни. Учитывая эту политику, все пациенты в этой статье должны были иметь какое-либо участие ПК. Обнадеживает то, что 88% пациентов были направлены в команду ПК, при этом высокая доля из них (64/71, 90%) известна командам ПК сообщества. Хотя это и не рассматривалось, это, возможно, позволило установить и упростить перспективное планирование ухода, например, предпочтительное для пациентов место оказания помощи и смерти.Среднее время от первого направления ПК до смерти, составляющее 15,8 недели, может означать, что пациенты в этот центр направляются достаточно рано, чтобы потенциально получить пользу от услуги ПК. Данные также предполагают, что у большинства пациентов симптомы появляются раньше, часто в результате первоначального диагноза местнораспространенного / метастатического заболевания, что, таким образом, добавляет дополнительный вес к раннему рассмотрению ПК.
В этом центре нет инструкций относительно уместности или сроков направления к группе ПК.Решения о направлении принимаются в индивидуальном порядке бригадой онкологов или терапевтом после консультации с пациентом. Общенациональный опрос американских врачей показал, что 13 недель до смерти наиболее подходящее время для обращения в хосписы [26]. Однако исследования, проведенные в Америке и других странах, показали, что врачи направляют больных раком в бригады ПК / программы ухода за больными в хосписах, которые гораздо ближе к смерти — при этом средняя выживаемость с момента первоначального направления составляет от 3 до 8 недель [27–32]. Препятствия на пути к раннему направлению к специалистам по ПК включают (i) ограничения доступа к ПК между странами и внутри стран, (ii) нежелание пациентов / семей обращаться к ним из-за непонимания того, что может предложить ПК / его предполагаемой связи с неминуемой смертью, и (iii) сопротивление клиницистами для направления пациентов, которые все еще проходят «активное» лечение / их нежелание обсуждать вопросы, связанные с окончанием жизни [33–35].Интересно, что наши данные показывают, что 48% (23/48) пациентов в этом обзоре имели документально подтвержденную неконтролируемую боль и 31% (15/48) имели неконтролируемую одышку на момент принятия решения о BSC. К этому моменту большинство из них уже было направлено в команду разработчиков ПК. Это может указывать на недостаточный доступ к услугам ПК, несмотря на направление к специалистам, или на то, что быстрое нарастание «трудно поддающейся контролю» боли / одышки является прогностическим фактором для терминальной фазы у пациентов с STS.
Авторы признают, что эти данные взяты из единственного онкологического центра Великобритании.Результаты будут свидетельствовать об индивидуальной практике подразделений STS, а также о политике здравоохранения Великобритании, которая ограничивает обобщение на национальном или глобальном уровне. В других странах могут быть другие протоколы и пороги лечения, которые могут повлиять на результаты. Тем не менее, данные об общей выживаемости при химиотерапии первой и второй линии были аналогичны таковым для более крупных когорт [7–9].
Доступность компьютерных услуг варьируется в Великобритании [36] и в значительной степени между / внутри других европейских и западных стран [37–41], что отражает неоднородность систем здравоохранения, потребностей пациентов и культур.В Великобритании имеется относительно активная сеть ПК, и ее правительство недавно инвестировало в ресурсы ПК и уход за пациентами в конце жизненного цикла [25, 42].
Ретроспективный дизайн исследований также является потенциальным источником серьезной систематической ошибки: данные о симптомах основаны на документации клинициста, где такие факторы, как неадекватная оценка, нехватка времени и выборочная документация положительных результатов, могут способствовать неточности. Проспективная регистрация симптомов с использованием проверенных показателей результатов, сообщаемых пациентами, может привести к более точной оценке / результатам [43].Пациенты, смерть которых не считалась связанной с STS, были исключены: это трудно установить; следовательно, все смерти следовало проанализировать.
5. Выводы
Местно-распространенные «неоперабельные» / метастатические пациенты с STS имеют значительное бремя симптомов, которое медленно прогрессирует и обычно включает боль и одышку. Уровень и время направления команды ПК в рамках этой оценки единого центра Великобритании были обнадеживающими. Однако было документально подтверждено, что боль неконтролируема у 48% пациентов во время химиотерапии первой линии, и пациенты имели по крайней мере два симптома на момент принятия всех решений о лечении.Было также предположение, что одышка не лечилась. Короткое время от задокументированного решения BSC до смерти вызывает беспокойство: это может означать, что пациенты продолжают активное лечение слишком долго или что это связано с чрезвычайно быстрым прогрессированием заболевания в терминальной фазе.
Учитывая распространенность симптомов, потенциальную токсичность лечения и низкую общую выживаемость, предполагаемые данные о качестве жизни могут помочь в принятии решений в популяции STS. Учитывая потенциал ПК для улучшения качества жизни и выживаемости у пациентов с распространенным раком, эти данные подтверждают необходимость раннего направления пациентов с метастатическим STS.Отсутствие перспективных исследований в этой важной области указывает на необходимость дальнейших исследований.
Забрюшинные саркомы: степень тяжести и выживаемость | Онкология | JAMA Surgery
Фон Выживаемость пациентов с забрюшинными саркомами зависит от возможности полной резекции и степени опухоли.
Гипотеза Высокая частота полной резекции, широкое, а не местное иссечение, когда это возможно, и политика быстрой повторной операции при местном рецидиве — все это улучшает выживаемость.
Методы Обзор 130 последовательных пациентов с саркомами забрюшинных мягких тканей (1977-2001).
Результаты Частота полной резектабельности составила 95%: 99% (78/79) для первичных опухолей и 90% (46/51) для опухолей, отнесенных с местным рецидивом. Местный рецидив после полной резекции произошел у 41% (32/79) пациентов с первичными опухолями и у 61% (31/51) пациентов с местным рецидивом ( P = 0,06).Частота местных рецидивов составила 63% после местного иссечения и 39% после широкой резекции ( P = 0,02). Из 83 пациентов с рецидивом 37 (45%) были избавлены от хирургического вмешательства. Расчетная 5-летняя (10 лет в скобках) выживаемость после первой операции в нашем центре составила 65% (56%) для пациентов с первичными опухолями и 53% (34%) для пациентов, направленных с местным рецидивом ( P = .23). Для первичных опухолей 5- и 10-летняя выживаемость составила 70% и 60% соответственно после широкой резекции и 47% и 39%, соответственно, после местного иссечения ( P =.04). Для первичных опухолей 5-летняя выживаемость составила 92%, 54% и 48% для степеней I, II и III соответственно ( P = 0,02). Для пациентов с местным рецидивом эти показатели составили 76%, 45% и 19% для степеней I, II и III соответственно ( P <0,001).
Выводы При забрюшинных саркомах возможна высокая резектабельность (95%). Оценки выживаемости аналогичны оценкам после резекции сарком мягких тканей конечностей, учитывая эффективную политику повторной операции при местных рецидивах.Широкая резекция снижает частоту местных рецидивов и значительно улучшает выживаемость. Выживаемость значительно зависит от степени опухоли.
РЕТРОПЕРИТОНЕАЛЬНЫЕ саркомы, как хорошо известно, представляют трудности при их полной резекции из-за их недоступности и отсутствия ранних симптомов, что приводит к образованию опухолей большого размера к моменту постановки диагноза. В коллективной обзорной статье, в которой анализировались сообщения о саркомах забрюшинных мягких тканей из крупных центров, было обнаружено, что полная резекция была возможна у 294 (53%) из 560 пациентов, пролеченных в крупных центрах, с 5-летней выживаемостью только 34%, в основном потому, что Почти у половины пациентов опухоль не удалена. 1 В этой статье мы представляем наш опыт лечения сарком мягких тканей забрюшинного пространства.
Были проанализированы карты 130 последовательных пациентов с саркомами забрюшинных мягких тканей, пролеченных с 1 июля 1977 г. по 30 сентября 2001 г. Все пациенты были прооперированы одним из нас (C.P.K.), первыми 90 пациентами в онкологическом институте Розуэлл-Парк, Буффало, штат Нью-Йорк, и последующими 40 пациентами в больнице Калейда Хелс — Миллард Филмор, Буффало.Средний срок наблюдения после первой операции в нашем центре составил 55 месяцев (в среднем 41 месяц; диапазон от 3 до 215 месяцев). 61 женщина и 69 мужчин. Средний возраст составлял 56 лет, а средний возраст — 57 лет, в диапазоне от 13 до 88 лет. Все это были пациенты с неметастатической первичной или местно-рецидивирующей забрюшинной саркомой, выявленной в течение периода исследования, и все подверглись диагностической лапаротомии. В этот обзор не были включены висцеральные саркомы.
Семьдесят девять пациентов были направлены с первичной опухолью и 51 — с местным рецидивом.Гистологический тип различных опухолей показан в Таблице 1. Степени опухолей показаны в Таблице 2. Полная резекция представляла собой удаление всей видимой и пальпируемой опухоли как единого целого, так что в конце процедуры в операционном поле не было ткани, которая при осмотре или пальпации могла быть расценена как свидетельство остаточного заболевания. Полная резекция — это местное иссечение с минимальным количеством нормальной ткани (1-9 мм) вокруг опухолевой массы, или широкое иссечение с минимальным краем нормальной ткани в 1 см или больше вокруг опухоли, или гемипельвэктомия у нескольких пациентов. при саркомах тазовой стенки.Минимальный запас нормальной ткани вокруг опухолевой массы, идентифицированный патологом, определил классификацию процедуры как местную или широкую резекцию. Местное иссечение было выполнено у 41 пациента (32%), широкое — у 77 (59%), гемипельвэктомия — в 6 случаях (5%) с саркомами таза с поражением стенки таза с одной стороны. Частичное иссечение использовалось у 6 пациентов (5%), у 5 — с местно рецидивирующими опухолями. Полная резекция была возможна у 78 (99%) из 79 пациентов, направленных с первичной саркомой, и у 46 (90%) из 51 пациента, направленного с местно-рецидивирующей саркомой.
Расчетные распределения выживаемости были рассчитаны по методу Каплана-Мейера. 2 Критерии значимости распределений выживаемости были основаны на лог-ранговом тесте. 3 Выживаемость рассчитывалась после первой операции в нашем центре. При оценке выживаемости учитывались все пациенты, в том числе с частичным удалением опухоли.
При забрюшинных саркомах верхних квадрантов живота часто применяли торакоабдоминальный разрез, соединяющий середину верхнего срединного разреза брюшной полости, при этом пациент находился в боковом положении.Резекция опухоли единым блоком выполнялась с любыми смежными пораженными структурами, такими как диафрагма, почка и толстая кишка, включая, при необходимости, с левой стороны селезенку, хвост поджелудочной железы и часть желудка, а также правая часть, часть правой доли печени.
При ретроперитонеальных саркомах на боковых сторонах пациента также помещали в латеральное положение и использовали боковой трансперитонеальный доступ в сочетании с Т-образным расширением и разрезом по средней линии.Опухоль была мобилизована сначала со всех остальных прикреплений (заднебоковых и передних), а затем были обработаны медиальные прикрепления к аорте или нижней полой вене. Доступ к забрюшинным саркомам средней части живота и среднего таза проводился через разрез по средней линии, когда пациент находился в положении лежа на спине. Воздействие на верхние брыжеечные сосуды проводилось для опухолей в основании брыжейки, чтобы определить резектабельность и обеспечить самый широкий и безопасный край вокруг опухоли. Для сарком таза по средней линии разрез по нижней средней линии продлили до лонного симфиза и оттуда поперек лонных бугорков с каждой стороны, пересекая прямую мышцу живота и влагалище прямой мышцы живота от лобкового гребня.
При саркомах нижних квадрантов живота с фиксацией к подвздошной ямке, стенке малого таза или наружным подвздошным сосудам использовался абдоминально-паховый разрез 4 для экспонирования пациента в положении лежа на спине. В редких случаях гемипельвэктомия требовалась при саркоме таза с обширной инвазией на одну боковую стенку таза.
Послеоперационных летальных исходов не было. Из 130 пациентов, поступивших с локализованной забрюшинной саркомой, опухоль была удалена у 124 (95%).Диаметр опухоли был менее 5 см у 3 пациентов, 5 см у 3 пациентов и более 5 см у 124 пациентов (95%).
При среднем сроке наблюдения 41 месяц частота местных рецидивов составила 41% (32/79) для пациентов с первичной забрюшинной саркомой и 61% (31/51) для пациентов, направленных с местным рецидивом ( P =. 06). Тем не менее, местные рецидивы продолжали возникать в течение многих лет, так что из 79 пациентов с первичными опухолями 43% через 5 лет и 34% через 10 лет выжили без местного рецидива (рис. 1).Частота местных рецидивов после местного иссечения составила 63% (26/41), а после широкого иссечения — 39% (30/77) ( P = 0,02). Частота местных рецидивов для пациентов, получавших только хирургическое лечение (n = 98), составила 53%, а для пациентов с резекцией и послеоперационным облучением (n = 32) — 38% ( P = 0,16). У всех пациентов частота местных рецидивов опухолей I, II и III степени составила 48%, 56% и 46% соответственно. Расчетная 5- и 10-летняя выживаемость составила 54% и 39%, соответственно, для пациентов с 1 или более локальными рецидивами (n = 61) после первичной операции в нашем центре, тогда как соответствующие оценки для пациентов без местного рецидива (n = 61). = 63) составили 66% и 58% соответственно ( P =.05). В целом отдаленный рецидив наблюдался у 48 (37%) из 130 пациентов, у 34% пациентов с первичной забрюшинной саркомой и у 41% пациентов с местным рецидивом. Для сарком III степени 5-летняя выживаемость пациентов с адъювантной химиотерапией по протоколу ADIC (доксорубицин гидрохлорид плюс дакарбазин) (n = 15) составила 20%, а для пациентов без адъювантной химиотерапии (n = 34) — 49%. .
Из пациентов, перенесших резекцию (n = 124), 36 остались живы без рецидива, 5 умерли без признаков заболевания в течение периода наблюдения по другим причинам, а остальные 83 пациента имели рецидив и / или умерли от болезнь.При среднем последующем наблюдении в 41 месяц 73 пациента (59%) были живы и не имели болезни, т. Е. 37 (45%) из 83 были восстановлены до состояния отсутствия болезни через 1 или более операций по поводу их рецидива (ов). .
Общая расчетная 5-летняя выживаемость после первой операции в нашем центре составила 60%, из них 65% для пациентов с первичными забрюшинными саркомами и 53% для пациентов с местным рецидивом. 10-летняя выживаемость для всех пациентов составила 48%, из них 56% для первичных забрюшинных сарком и 34% для пациентов, первоначально направленных с местным рецидивом ( P =.23) (Рисунок 2).
Для первичных забрюшинных сарком оценка 5- и 10-летней выживаемости составила соответственно 47% и 39% после местной резекции (n = 19), 70% и 60% после широкого иссечения (n = 54) и 50%. % и 50% после гемипельвэктомии (n = 4). Разница в выживаемости между пациентами, получавшими местное иссечение и широкую резекцию, была значительной ( P = 0,04). При многомерном анализе, охватывающем всех пациентов, значимыми прогностическими факторами выживаемости была степень ( P =.001) с последующей процедурой (широкое и локальное иссечение; P = 0,01), тогда как размер опухоли как непрерывная переменная не был значимым ( P = 0,49). Повышение выживаемости после широкой резекции по сравнению с локальной резекцией не может быть объяснено каким-либо предубеждением, вызванным благоприятным распределением степеней (таблица 3).
Пятилетняя выживаемость значительно варьировала в зависимости от степени опухоли, составляя для всей серии 84% для пациентов с опухолями I степени (n = 55), 50% для пациентов с опухолями II степени (n = 26) и 39%. для пациентов с опухолями III степени (n = 49) ( P <.001). Показатели выживаемости в зависимости от степени также значительно различались в подгруппах первичных и местно-рецидивных опухолей (Таблица 2) (Рисунок 3 и Рисунок 4).
Забрюшинные саркомы обычно достигают больших размеров до того, как вызывают у пациентов какие-либо симптомы, и их часто обнаруживают из-за пальпируемого образования без каких-либо сопутствующих симптомов. В нашей серии только у 3 пациентов опухоль имела массу менее 5 см в диаметре. Частота полной резекции варьируется в литературе от 38% 5 , 6 до 74%, 7 , другие сообщения попадают между ними, 8 -12 , тогда как средний показатель полной резектабельности в коллективном обзоре было 53%. 1 Уровень резектабельности в литературе низок, поскольку в большинстве центров пациенты с забрюшинными саркомами оперируются в положении лежа на спине через разрез брюшной полости по средней линии, который не использует силу тяжести для пациентов с опухолями верхнего квадранта или боковых сторон. Часто используется неправильная стратегия, т. Е. Настаивание на том, чтобы сначала отделить опухолевую массу от основных забрюшинных сосудов, например аорты и нижней полой вены, в качестве раннего детерминанта резектабельности, что является поверхностно логичной политикой, но часто заставляет хирурга отказаться процедура, поскольку она несет в себе ощутимый (и фактический) риск неконтролируемого кровотечения.Правильная стратегия для образования массы, примыкающей к большим забрюшинным сосудам, состоит в том, чтобы мобилизовать ее по всему периметру, от передних, боковых и задних прикреплений, а затем в качестве последнего шага для отделения ее от аорты или нижней полой вены, в зависимости от случая. может быть. По нашему опыту, общая частота резектабельности первичной и местно-рецидивной забрюшинной саркомы составила 95%. В целом, 5-летняя выживаемость (10-летняя в скобках) в нашей серии составила 65% (56%) для первичных забрюшинных сарком и 53% (34%) для пациентов с местным рецидивом.Эти оценки приближаются к оценкам сарком мягких тканей конечностей. Основной проблемой забрюшинных сарком является проблема местного рецидива после очевидной полной резекции из-за трудностей с получением широких краев по всему периметру опухоли. Частота местных рецидивов в нашей серии составила 42% для первичных опухолей и 51% для пациентов с местным рецидивом. Однако частота местных рецидивов продолжает расти с годами наблюдения (рис. 1). Была тенденция ( P =.16) в сторону уменьшения местных рецидивов с помощью послеоперационного облучения. Пациенты без местного рецидива на протяжении периода наблюдения имели лучшую выживаемость ( P = 0,05). Широкая резекция снизила частоту местных рецидивов (39%) по сравнению с таковой после местного иссечения (63%) ( P = 0,02). В группе первичных опухолей широкая резекция привела к оценке 5- и 10-летней выживаемости 70% и 60%, тогда как соответствующие цифры после местного иссечения составили 47% и 39% ( P =.04). При многофакторном анализе процедура (широкое и локальное иссечение) была значимым прогностическим показателем ( P = 0,01). Разница в выживаемости между широким и местным иссечением не могла быть объяснена какой-либо заметной разницей в частоте различных степеней, встречающихся в каждой хирургической группе (Таблица 3). Принято считать, что широкая резекция снижает частоту местных рецидивов по сравнению с местным иссечением; однако, насколько нам известно, ранее не сообщалось о том, что это также приводит к значительно более высокой выживаемости при забрюшинных саркомах, и, следовательно, этот момент требует дальнейшего изучения в будущих (желательно проспективных) исследованиях.
В отчете крупного онкологического центра 13 полная резекция была достигнута у 65% пациентов с первичными забрюшинными саркомами, затем частота местных рецидивов составила 49%, а полная резекция местно-рецидивных заболеваний достигнута у 44%. В коллективном обзоре 1 частота местных рецидивов в течение длительного периода наблюдения превышала 90%.
В других отчетах полная резекция была возможна в 59%, 14 75% (5- и 10-летняя выживаемость 31% и 19% соответственно), 15 65%, 16 и 78%. 17 Выживаемость повысилась за счет многократных резекций. 17 Вероятность местного рецидива составила 85% через 5 лет в одном отчете. 18 Рецидивы продолжают происходить в течение длительных периодов времени, поскольку в одном исследовании у 40% пациентов, у которых не было заболевания через 5 лет, были рецидивы через 10 лет. 19 В последнем отчете Мемориального онкологического центра Слоуна-Кеттеринга фактическая 5-летняя выживаемость пациентов с полной или частичной резекцией составила 36%. 19
После полной резекции опухоли наиболее важным биологическим фактором, определяющим выживаемость, была степень забрюшинной саркомы. 1 , 20 В нашей серии частота полной резектабельности оставалась стабильной (95%) на протяжении многих лет. 21 Пятилетняя выживаемость опухолей I, II и III степени в нашей серии составила 84%, 50% и 39% соответственно ( P <0,001) (Таблица 2), что подтверждает прогностическую важность оценка. При многофакторном анализе значимыми факторами выживаемости были степень ( P = 0,001), за которой следовала процедура (широкое и локальное иссечение; P = 0,01), тогда как размер опухоли не был значимым ( P = .49). При среднем сроке наблюдения 41 месяц 73 (59%) пациентов, перенесших резекцию (n = 124), были живы и не имели заболевания, из которых 36 остались живы без рецидива в течение всего периода наблюдения и 37 (из 83 с рецидивом) были восстановлены до состояния отсутствия болезни посредством 1 или более операций по поводу их рецидива (ов). Таким образом, очевидно, что в дополнение к высокой начальной степени резектабельности, стратегия быстрой повторной операции по поводу местного рецидива является важным компонентом лечения высокой выживаемости пациентов с забрюшинными саркомами.
Автор, ответственный за переписку: Константин П. Каракусис, доктор медицины, доктор философии, отделение хирургии, Kaleida Health, больница Милларда Филмора, 3 Гейтс Серкл, Буффало, Нью-Йорк, 14209 (электронная почта: [email protected]).
Принята к публикации 19 октября 2002 г.
1. буря FKMahvi DM Диагностика и лечение саркомы забрюшинных мягких тканей. Ann Surg. 1991; 2142-10Google ScholarCrossref 2.Каплан ELMeier P Непараметрическая оценка по неполным наблюдениям. J Am Stat Assoc. 1958; 53457-481Google ScholarCrossref 3.Cox DR регрессионные модели и таблицы дожития. J R Stat Soc B. 1971; 34187–220 Google Scholar4.Karakousis CP Абдоминально-паховый разрез при резекции опухолей малого таза с боковой фиксацией. Am J Surg. 1992; 164366-371Google ScholarCrossref 5.Cody HSTurnbull ADFortner JGHajdu С.И. Продолжающаяся проблема забрюшинных сарком. Рак. 1981; 472147-2152Google ScholarCrossref 6. McGrath PCNeifeld JP Лоуренс-младший W и другие. Повышенная выживаемость после полного удаления сарком забрюшинного пространства. Ann Surg. 1984; 200200-204Google ScholarCrossref 7. Гленн JSindelar WFKinsella Т и другие. Результаты комплексной терапии резектабельных сарком мягких тканей забрюшинного пространства. Хирургия. 1985; 97316-325 Google Scholar8. Каракусис CPVelez А.Ф.Эмрих LJ Управление забрюшинными саркомами и выживаемость пациентов. Am J Surg. 1985; 150376-380Google ScholarCrossref 9. Брааш JWMon AB Первичные опухоли забрюшинного пространства. Surg Clin North Am. 1967; 47663–678Google Scholar 10.Jaques DPCoit Д.Г.Бреннан М.Ф. Саркома мягких тканей забрюшинного пространства. Шиу MHBrennan MFeds. Хирургическое лечение саркомы мягких тканей Philadelphia, Pa Lea & Febiger 1989; 157–169Google Scholar11.Dalton RRDonohue JHMucha Jr Пван Херден Я.А. Рейман HMChen С.П. Ведение сарком забрюшинного пространства. Хирургия. 1989; 106725-733Google Scholar12.Storm FKEilber FRMirra JMorton DL Забрюшинные саркомы: новый взгляд на лечение. J Surg Oncol. 1981; 171-7Google ScholarCrossref 13.Jaques DPCoit Д.Г.Хайду С.И.Бреннан MF Лечение первичной и рецидивирующей саркомы мягких тканей забрюшинного пространства. Ann Surg. 1990; 21251-59Google ScholarCrossref 14. Zornig CWeh HJKrull А и другие.Забрюшинная саркома в серии из 51 взрослого. Eur J Surg Oncol. 1992; 18475-480 Google Scholar 15. Макела JKiviniemi HLaitinen S Прогностические факторы, прогнозирующие выживаемость при лечении саркомы забрюшинного пространства. Eur J Surg Oncol. 2000; 26552-555Google ScholarCrossref 16.Stoeckle Экоиндре JMBonvalot S и другие. Группа саркомы Французской федерации онкологических центров, Прогностические факторы забрюшинной саркомы: многомерный анализ серии из 165 пациентов группы сарком Федерации онкологических центров Франции. Рак. 2001; 92359-368Google ScholarCrossref 17. Килкенни III JWBland KICopeland III Е. М. Забрюшинная саркома: опыт Флоридского университета. J Am Coll Surg. 1996; 182329-339Google Scholar18.Alvarenga JCBall ABFisher CFryatt Айджонс LThomas Ю.М. Ограничения хирургического вмешательства при лечении саркомы забрюшинного пространства. Br J Surg. 1991; 78912–916Google ScholarCrossref 19.Heslin MJLewis JJNadler E и другие.Прогностические факторы, связанные с долгосрочным выживанием при забрюшинной саркоме: значение для лечения. J Clin Oncol. 1997; 152832-2839Google Scholar20.Bevilacqua Р.Г.Гатко АХайду С.И.Бреннан MF Факторы прогноза при первичных саркомах забрюшинных мягких тканей. Arch Surg.
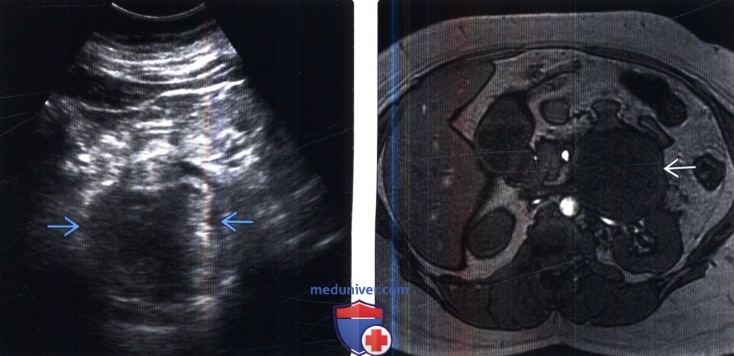

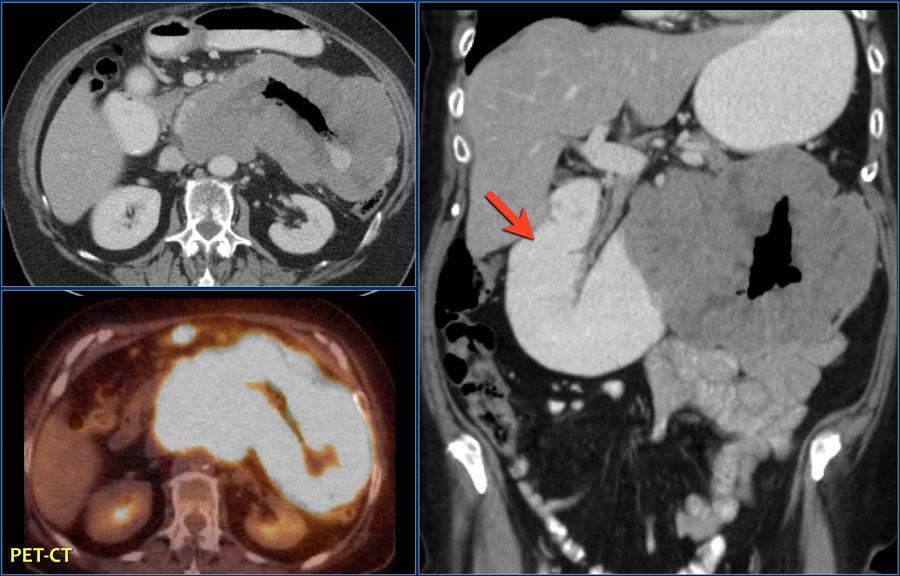

.jpg) Наиболее типичные локализации – мышцы конечностей и туловища, а также органы малого таза.
Наиболее типичные локализации – мышцы конечностей и туловища, а также органы малого таза.
 Мотивация самая разная, в большинстве случаев — это работа, многие держатся за работу в буквальном смысле «до последнего дыхания». Это тема отдельная и не такая веселая, особенно для мужчин 40 лет и немного старше. За скрытым течением заболевания, как правило, прячется тоже некоторое невнимание к своему здоровью, хотя здесь будут исключения.
Мотивация самая разная, в большинстве случаев — это работа, многие держатся за работу в буквальном смысле «до последнего дыхания». Это тема отдельная и не такая веселая, особенно для мужчин 40 лет и немного старше. За скрытым течением заболевания, как правило, прячется тоже некоторое невнимание к своему здоровью, хотя здесь будут исключения.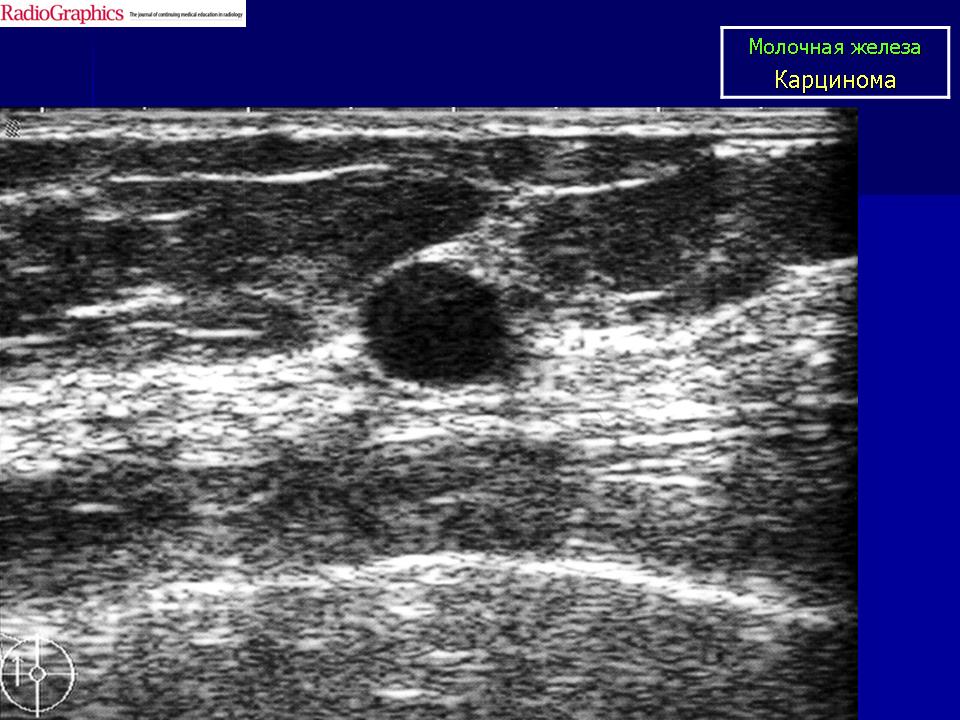 Зависимость от стадии процесса следующая: чем меньше стадия, тем лучше прогноз. Особенности организма – это, как правило, сопутствующая патология, возраст, беременность и т.д. Понятно, что у пожилого человека с сахарным диабетом или с декомпенсированной сердечной патологией, лечение будет как-то отличаться от лечения человека средних лет с хорошим запасом жизненной силы. (Жизненная сила, — это не официальный медицинский термин, это выражение приверженцев гомеопатии и виталистов, но оно представляется очень удачным) Морфология, — это гистологическое заключение исследованного образца опухолевой ткани, взятого при биопсии или исследованный операционный материал. В настоящее время плановая операция по удалению опухоли не выполняется без предварительной биопсии образования. Здесь могут быть раки – злокачественные опухоли из эпителия, саркомы – злокачественные опухоли из соединительной ткани. Саркомы более агрессивные, растут быстро. Если не леченый рак может протекать в течение нескольких лет, то не леченая саркома, — это месяцы болезни.
Зависимость от стадии процесса следующая: чем меньше стадия, тем лучше прогноз. Особенности организма – это, как правило, сопутствующая патология, возраст, беременность и т.д. Понятно, что у пожилого человека с сахарным диабетом или с декомпенсированной сердечной патологией, лечение будет как-то отличаться от лечения человека средних лет с хорошим запасом жизненной силы. (Жизненная сила, — это не официальный медицинский термин, это выражение приверженцев гомеопатии и виталистов, но оно представляется очень удачным) Морфология, — это гистологическое заключение исследованного образца опухолевой ткани, взятого при биопсии или исследованный операционный материал. В настоящее время плановая операция по удалению опухоли не выполняется без предварительной биопсии образования. Здесь могут быть раки – злокачественные опухоли из эпителия, саркомы – злокачественные опухоли из соединительной ткани. Саркомы более агрессивные, растут быстро. Если не леченый рак может протекать в течение нескольких лет, то не леченая саркома, — это месяцы болезни. Лечение в онкологии может быть радикальное, паллиативное и симптоматическое. Предполагается, что радикальное лечение устраняет болезнь радикально. Как правило, это хирургическое лечение. Химиотерапия в редких случаях рассматривается как радикальный метод, исключение составляет лечение лимфом, опухолей из лимфоидной ткани. В этих случаях химиотерапия выступает как самостоятельный метод, хотя далеко не во всех случаях. Вообще, опухоли есть чувствительные к химиотерапии, как например лимфомы, опухоли яичка, мелкоклеточный рак лёгкого, рак яичников, рак молочной железы; а также малочувствительные, — это почти все остальные. Опухоли яичка, вообще считаются витриной возможности современной химиотерапии, здесь с положительным эффектом заявили о себе препараты из платины. Паллиативное лечение направлено на улучшение качества и продолжительности жизни пациентов. С паллиативной целью может проводиться лучевая терапия, химиотерапия; эти виды лечения применяются для уменьшения объёма новообразований, и как следствие, уменьшение вызванного этим страданий.
Лечение в онкологии может быть радикальное, паллиативное и симптоматическое. Предполагается, что радикальное лечение устраняет болезнь радикально. Как правило, это хирургическое лечение. Химиотерапия в редких случаях рассматривается как радикальный метод, исключение составляет лечение лимфом, опухолей из лимфоидной ткани. В этих случаях химиотерапия выступает как самостоятельный метод, хотя далеко не во всех случаях. Вообще, опухоли есть чувствительные к химиотерапии, как например лимфомы, опухоли яичка, мелкоклеточный рак лёгкого, рак яичников, рак молочной железы; а также малочувствительные, — это почти все остальные. Опухоли яичка, вообще считаются витриной возможности современной химиотерапии, здесь с положительным эффектом заявили о себе препараты из платины. Паллиативное лечение направлено на улучшение качества и продолжительности жизни пациентов. С паллиативной целью может проводиться лучевая терапия, химиотерапия; эти виды лечения применяются для уменьшения объёма новообразований, и как следствие, уменьшение вызванного этим страданий.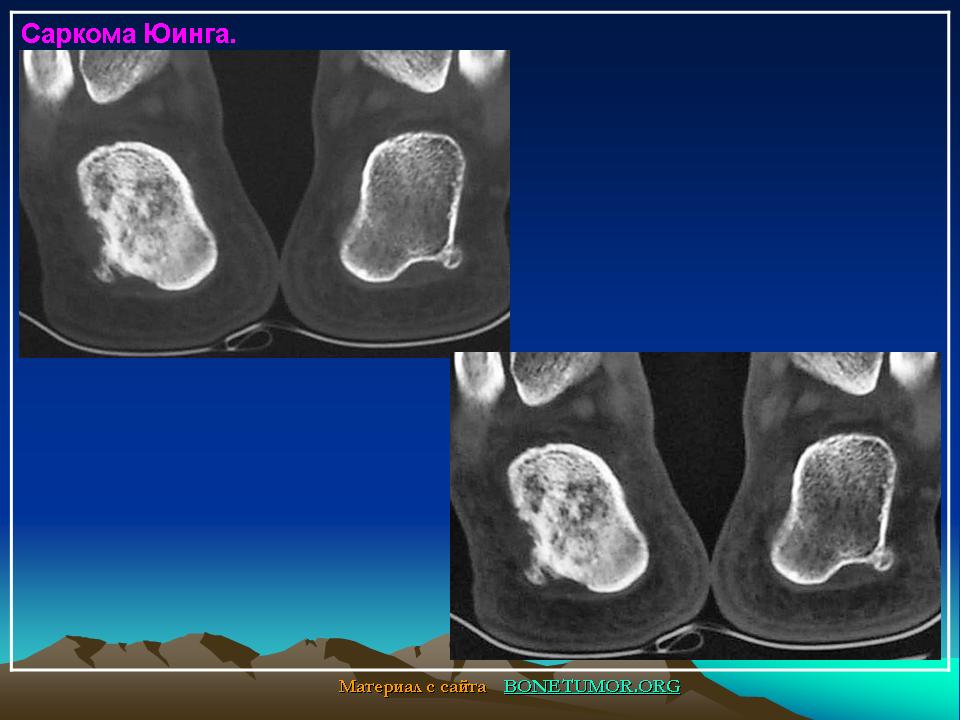 Паллиативными могут быть и хирургические вмешательства, например, наложение обходных путей при опухолях желудочно-кишечного тракта. Так же к паллиативному методу относится популярное сейчас стентирование пищевода при раке этого органа, что позволяет на какое-то время откладывать более калечащее вмешательство.
Паллиативными могут быть и хирургические вмешательства, например, наложение обходных путей при опухолях желудочно-кишечного тракта. Так же к паллиативному методу относится популярное сейчас стентирование пищевода при раке этого органа, что позволяет на какое-то время откладывать более калечащее вмешательство. Для женщин профилактический осмотр гинеколога ежегодно, также, два раза в год осмотр молочных желез и раз в один-два года выполнение маммографии у женщин после 40-45 лет и УЗИ молочных желез у женщин более молодой возрастной группы. Кстати, юридически значимый метод, – это маммография. Отдельная тема – маммолог, у которого надо проверять свои молочные железы. Если поблизости нет маммолога, не надо переживать, маммолог, — это онколог, который сидит на маммологическом приёме, или, как иногда шутят доктора, — это « уставший» онколог, уставший от не очень лёгкого онкологического приёма, от бесед с больными и с их родственниками и нашедший более спокойную работу. По – моему, так работа маммолога довольно однообразная и на любителя. На большого. А вообще молочные железы может посмотреть и хирург, сложностей особых нет. Один раз в месяц женщины должны проверять себя сами. Если появились какие – то уплотнения или образования, — бегом на приём к доктору. Паниковать не надо, не каждое уплотнение может оказаться раком, но в этом случае лучше перебдеть.
Для женщин профилактический осмотр гинеколога ежегодно, также, два раза в год осмотр молочных желез и раз в один-два года выполнение маммографии у женщин после 40-45 лет и УЗИ молочных желез у женщин более молодой возрастной группы. Кстати, юридически значимый метод, – это маммография. Отдельная тема – маммолог, у которого надо проверять свои молочные железы. Если поблизости нет маммолога, не надо переживать, маммолог, — это онколог, который сидит на маммологическом приёме, или, как иногда шутят доктора, — это « уставший» онколог, уставший от не очень лёгкого онкологического приёма, от бесед с больными и с их родственниками и нашедший более спокойную работу. По – моему, так работа маммолога довольно однообразная и на любителя. На большого. А вообще молочные железы может посмотреть и хирург, сложностей особых нет. Один раз в месяц женщины должны проверять себя сами. Если появились какие – то уплотнения или образования, — бегом на приём к доктору. Паниковать не надо, не каждое уплотнение может оказаться раком, но в этом случае лучше перебдеть. Ещё одна популярная тема – онкомаркеры. Их много, они разные. Сразу замечу, ни один онкомаркер, никогда не заменит полноценного обследования. Это скрининговый метод, который позволяет обозначить группу риска или проводить мониторинг после лечения. Самые ходовые онкомаркеры, это ПСА у мужчин (позволяет заподозрить опухоль предстательной железы, после 45 лет мужчинам надо обязательно его определять, желательно 2 раза в год), РЭА (раково – эмбриональный антиген, откликается на опухоли желудочно – кишечного тракта и некоторые другие), СА -125 (опухоли яичников у женщин), Са – 15,3 (опухоли желудочно-кишечного тракта, а так же может отреагировать на рак молочных желез (хотя он и так, по-моему, хорошо виден, если есть). Необходимо добавить, что онкомаркер может ничего и не показать, при явном присутствии новообразования, или наоборот быть увеличенным при отсутствии явной причины для его увеличения. Скрининговых методов раннего выявления злокачественных новообразований желудочно – кишечного тракта пока не существует.
Ещё одна популярная тема – онкомаркеры. Их много, они разные. Сразу замечу, ни один онкомаркер, никогда не заменит полноценного обследования. Это скрининговый метод, который позволяет обозначить группу риска или проводить мониторинг после лечения. Самые ходовые онкомаркеры, это ПСА у мужчин (позволяет заподозрить опухоль предстательной железы, после 45 лет мужчинам надо обязательно его определять, желательно 2 раза в год), РЭА (раково – эмбриональный антиген, откликается на опухоли желудочно – кишечного тракта и некоторые другие), СА -125 (опухоли яичников у женщин), Са – 15,3 (опухоли желудочно-кишечного тракта, а так же может отреагировать на рак молочных желез (хотя он и так, по-моему, хорошо виден, если есть). Необходимо добавить, что онкомаркер может ничего и не показать, при явном присутствии новообразования, или наоборот быть увеличенным при отсутствии явной причины для его увеличения. Скрининговых методов раннего выявления злокачественных новообразований желудочно – кишечного тракта пока не существует.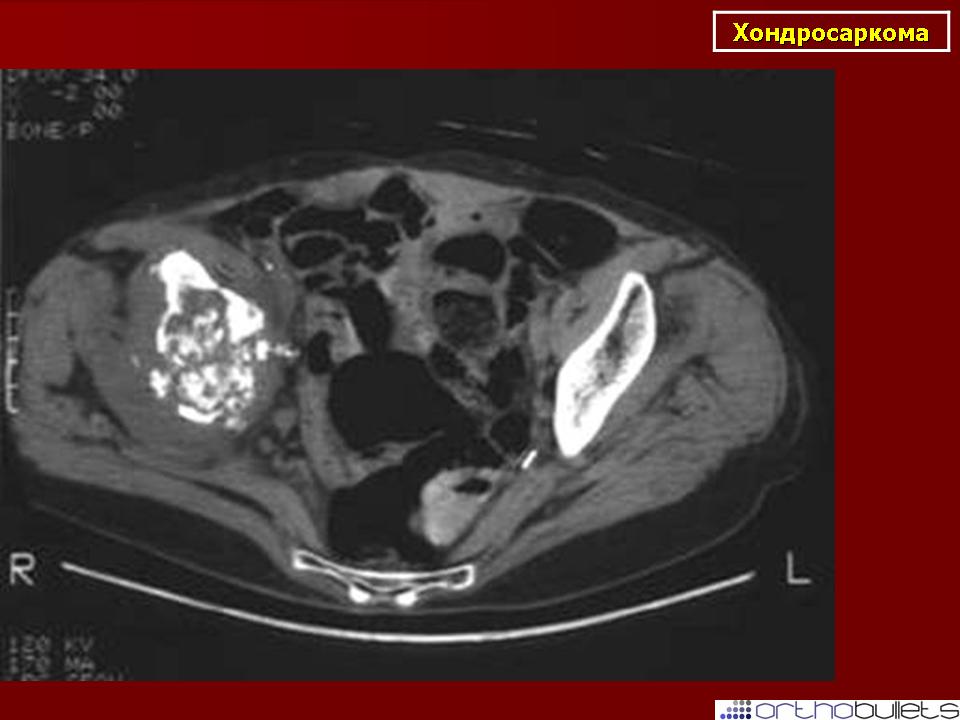 (Здесь исключение составит Япония, где рак желудка чрезвычайно распространен, и где до недавних пор выполнялась флюорография желудка, как массовое исследование населения) Существуют самые обычные и надёжные, в большинстве случаев, методы диагностики: эндоскопический, рентгенологический, ультразвуковой. Однако, мало кто при отсутствии жалоб захочет обследоваться, но даже если захочет, то в районной поликлинике вряд ли направят на исследование просто так, на основании «мне хочется обследоваться». Надо отметить, что выявления опухолей органов брюшной полости и забрюшинного пространства на ранних стадиях, часто являются случайными находками. Выполнили УЗИ брюшной полости по поводу каких то непонятных болей в животе, — вместе с камнями в желчном пузыре, которые боль и вызывали, выявили опухоль почки небольших размеров, которая себя ещё никак клинически не проявила. Пожаловался человек на изжогу и тошноту при гастрите, — направили на фиброгастроскопию (ФГС) желудка, выявили ранний рак желудка, прооперировали, прогноз явно неплохой.
(Здесь исключение составит Япония, где рак желудка чрезвычайно распространен, и где до недавних пор выполнялась флюорография желудка, как массовое исследование населения) Существуют самые обычные и надёжные, в большинстве случаев, методы диагностики: эндоскопический, рентгенологический, ультразвуковой. Однако, мало кто при отсутствии жалоб захочет обследоваться, но даже если захочет, то в районной поликлинике вряд ли направят на исследование просто так, на основании «мне хочется обследоваться». Надо отметить, что выявления опухолей органов брюшной полости и забрюшинного пространства на ранних стадиях, часто являются случайными находками. Выполнили УЗИ брюшной полости по поводу каких то непонятных болей в животе, — вместе с камнями в желчном пузыре, которые боль и вызывали, выявили опухоль почки небольших размеров, которая себя ещё никак клинически не проявила. Пожаловался человек на изжогу и тошноту при гастрите, — направили на фиброгастроскопию (ФГС) желудка, выявили ранний рак желудка, прооперировали, прогноз явно неплохой.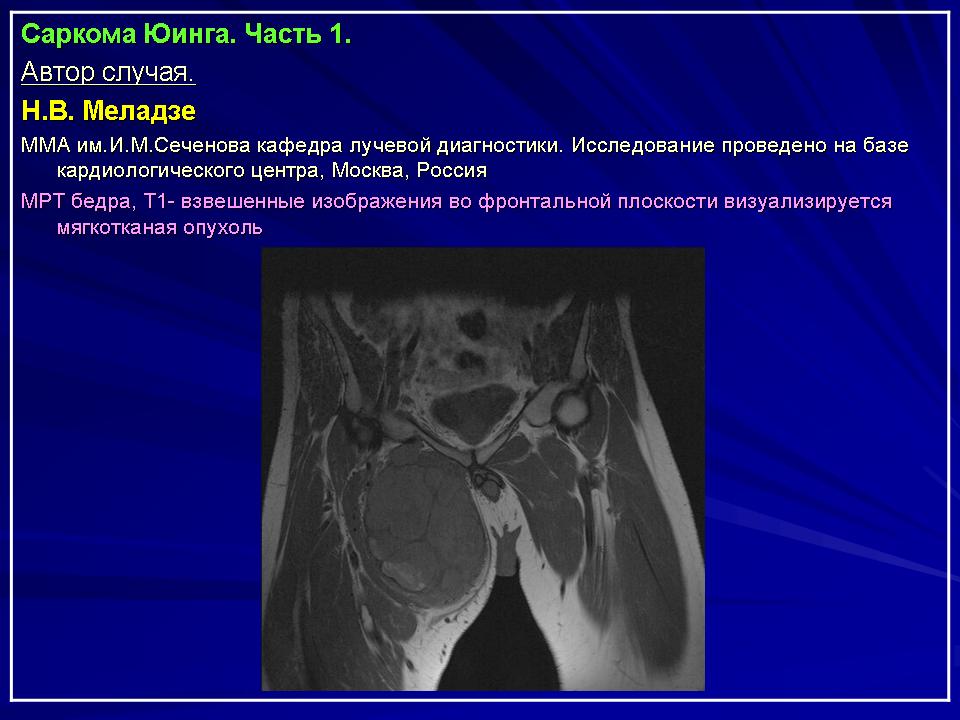 Вывод такой: есть жалобы — надо обследоваться, а УЗИ брюшной полости раз в год – полтора выполнять и без жалоб, профилактически.
Вывод такой: есть жалобы — надо обследоваться, а УЗИ брюшной полости раз в год – полтора выполнять и без жалоб, профилактически.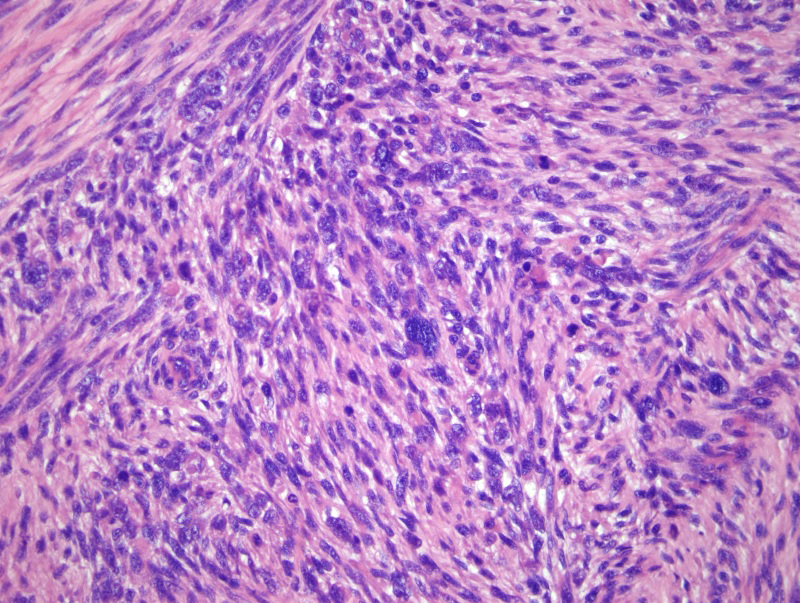 Но наука на месте не стоит и регулярно радует онкологов новыми противоопухолевыми препаратами, не всегда, правда, оправдывающих возлагаемые на них надежды. На сегодняшний день оправдан только один принцип, приводящий к заметному успеху в лечении: раннее выявление опухоли. Поэтому, нам всем не помешает быть немного более внимательными к своему здоровью, лишний раз показаться врачу, выполнить какое-то плановое исследование. Потому что своим близким, коллегам и друзьям мы нужны здоровыми.
Но наука на месте не стоит и регулярно радует онкологов новыми противоопухолевыми препаратами, не всегда, правда, оправдывающих возлагаемые на них надежды. На сегодняшний день оправдан только один принцип, приводящий к заметному успеху в лечении: раннее выявление опухоли. Поэтому, нам всем не помешает быть немного более внимательными к своему здоровью, лишний раз показаться врачу, выполнить какое-то плановое исследование. Потому что своим близким, коллегам и друзьям мы нужны здоровыми..jpg) Это часто означает, что невозможно удалить опухоль из-за ее расположения, размера или органов, в которые она вовлечена.
Это часто означает, что невозможно удалить опухоль из-за ее расположения, размера или органов, в которые она вовлечена.