Пробиотики | Как принимать пробиотики, их действие и состав
Пробиотики после антибиотиков
Антибактериальные препараты в наше время являются средством лечения многих заболеваний бактериального генеза. Они используются при бронхитах, синуситах, циститах и огромного количества другой патологии.
Конечно, назначение антибиотиков оправдано только при наличии бактериального возбудителя, ведь в случае его отсутствия данные препараты будут только угнетать иммунную систему, тем самым препятствуя борьбе с настоящим патогенным микроорганизмом.
Однако не только иммунитет страдает от приема антибактериальных средств, но и пищеварительный тракт, а именно микрофлора кишечника. Спектр воздействия антибиотика может распространяться на бактерии, которые заселяют кишечник и являются полезными.
В результате у человека наблюдается нарушение работы кишечника с развитием диареи. Во избежание этого рекомендуется принимать пробиотики после антибиотиков или же во время их приема. Некоторые пробиотики следует применять с первого дня курса антибактериальной терапии для препятствования гибели нормальной микрофлоры.
Как принимать пробиотики?
Многие люди сталкивались с дисбактериозом, однако далеко не все знают, как его лечить и как принимать пробиотики? Способ использования и дозировки зависят от формы их выпуска. Так, различают сухие и жидкие пробиотики. Сухая форма представлена таблетками, порошком или капсулами, где находятся высушенные бактерии. Жидкая – имеет питательную среду, помимо основных составляющих.
Для малышей до 1-го года необходимо использовать жидкие пробиотики (биогая), так как другая форма не подойдет. В связи с этим перед применением следует определиться с формой лекарственного препарата.
Детям более старшего возраста могут принимать капсулы или порошок, например, линекс, лактовит форте. До 2-х лет рекомендуется принимать 1 капсулу пару раз в день. В дальнейшем дозировка увеличивается до нескольких капсул за один прием.
Пробиотик следует использовать после приема пищи по истечении часа. В некоторых случаях можно разбавить дозу препарата для облегчения приема. При применении параллельно с антибактериальными средствами нужно соблюдать правила приема.
Пробиотики и пребиотики
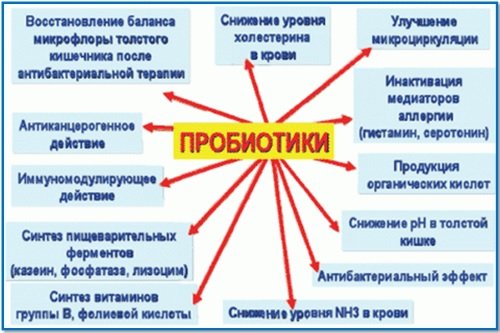
Пробиотики и пребиотики относятся в группу лекарственных средств, которые оказывают благотворное воздействие на микрофлору человека. Пробиотики представляют собой живые микроорганизмы, представленные в основном лакто- и бифидобактериями, иногда дрожжами.
Все эти бактерии являются обитателями микрофлоры и выполняют важные функции, такие как помощь в переваривании пищи и иммунной системе. Кроме того полезные микроорганизмы, прикрепляясь к слизистой оболочке, заполняют собой свободные места, тем самым препятствуя размножению патогенной флоры.
К пребиотикам относятся неперевариваемые компоненты пищи, способные оказывать стимулирующее воздействие на полезные бактерии, активируя их рост и метаболическую активность.
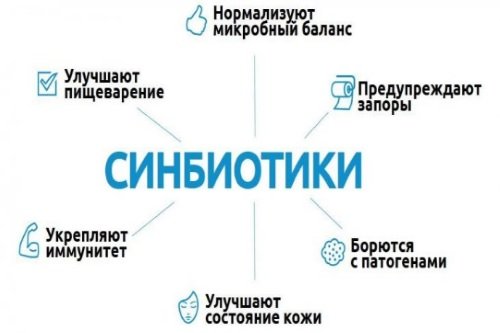
Среди пребиотиков стоит выделить низкомолекулярные углеводы, инсулин, лактулозу, фруктозоолигосахариды и лактитол. Данные средства содержаться в большей степени в молочных продуктах, хлебных изделиях, крупе, хлопьях кукурузы, чесноке, луке, горохе и бананах. Особенную роль играют олигосахариды с фруктозой, что целенаправленно действует на полезные бактерии. Пробиотики и пребиотики, которые входят в состав одного препарата, формируют синбиотик.
Эубиотики и пробиотики
Эубиотики и пробиотики считаются помощниками микрофлоры человека, ведь благодаря им происходит нормализация соотношения полезных и патогенных микроорганизмов микрофлоры.
Таким образом, устраняются клинические проявления дисбактериоза и восстанавливается полноценная функциональность кишечника. Кроме того полезные бактерии, формируя микрофлору, обеспечивают высокий уровень иммунной защиты организма.
Пробиотики также применяются при диарее путешественников, когда организм не успевает привыкнуть к новым продуктам питания, с чем помогают именно данные препараты. Не стоит забывать о влиянии антибактериальных средств на микрофлору, влияние которых нивелируется пробиотиками.
Эубиотики представляют собой добавку (биологически активную) в рацион питания, в состав которой входят живые микроорганизмы, а также их метаболиты. Некоторые утверждают, что эубиотики и пробиотики являются одним и тем же препаратом, однако пробиотики оказывают незаменимую пользу микрофлоре, доставляя полезные бактерии. В свою очередь эубиотик не может оказывать настолько мощное действие, хотя так де содержат бактерии.
[30], [31]
Пробиотики для влагалища
Пробиотики для влагалища являются средствами для нормализации состава микрофлоры при наличии дисбактериоза. Нарушение соотношения бактерий может происходить вследствие снижения уровня иммунных сил в результате какой-либо сопутствующей патологии, например, сахарного диабета или ВИЧ. Подобные заболевания способствуют снижению количества полезных бактерий на слизистой влагалища.
Кроме того микрофлора может страдать вследствие гормональных изменений, которые наблюдаются в подростковом периоде, при менопаузе или беременности. Пробиотики для влагалища также необходимы при длительном приеме антибактериальных средств в качестве лечебной терапии при большинстве болезней органов половой системы.
Нарушение микрофлоры слизистой влагалища может наблюдаться при ее изменении в кишечнике. В таком случае пробиотике вдвойне нужны. Их следует принимать параллельно основным препаратам, которые устраняют инфекцию.
Благодаря полезным бактериям, входящим в состав пробиотиков, восстанавливается иммунная защита влагалища. Так, рекомендуется принимать линекс для приема внутрь, или бифидумбактерин, лактобактерин в виде свечей или же гинофор – специальные таблетки для влагалища.
Пробиотики при молочнице
Пробиотики при молочнице оказывают незаменимое действие, ведь приводят в норму количественный и качественный состав полезных и патогенных микроорганизмов. Препарат состоит из привычных для микрофлоры бактерий, которые, попав в организм, стараются избавиться от чрезмерного числа болезнетворных микроорганизмов.
В силу воздействия определенных негативных факторов, например, прием антибактериальных препаратов или изменение в рационе питания, могут повлечь за собой дисбаланс бактерий флоры. В результате происходит активация патогенных бактерий, а также размножение дрожжевых грибов.
Пробиотики при молочнице угнетают процесс активации грибков и стабилизирует соотношение бактерий микрофлоры. Кроме того стоит выделить, что не только фармацевтические средства способны оказать пользу, но и обычные продукты питания.
Это могут быть представители кисломолочной группы продуктов – кефир, сыр, творог, йогурт, а также квашеная капуста, лук, чеснок, бананы и многие другие. При регулярном их употреблении обеспечивается профилактика дисбактериоза и развития молочницы.
Пробиотики для похудения
Пробиотики необходимы для борьбы с патогенными бактериями, постепенно вытесняя их из микрофлоры организма. Нормализовав бактериальное соотношение, препарат способствует быстрому выведению токсинов, что является важным фактором при похудении.
Не зря диетическое питание разрешает употребление нежирного кефира, йогурта и других молочнокислых продуктов, ведь именно они содержат полезные для микрофлоры микроорганизмы.
Также не стоит забывать о квашеной капусте, рисе, крупах и бананах. Все эти продукты обеспечивают нормализацию пищеварения, в процессе которого перевариваются все поступающие с пищей вещества, не откладываясь на боках.
Кроме того пробиотики для похудения прекрасно работают в сочетании с растворимой клетчаткой, которая обеспечивает чувство насыщенности, поддерживая уровень глюкозы в крови. В результате не вырабатывается большое количество инсулина для снижения уровня сахара и жир постепенно начинает выходить из своих «тайников» и расщепляться.
Если же количество инсулина растет, то и жир будет оставаться на своих местах.
Пробиотики для иммунитета
Пробиотики для иммунитета играю очень важную роль, так как входящие в состав лакто- и бифидобактерии взаимодействуют с лимфоидными бляшками кишечника и стимулируют выраженный иммунный ответ организма на внедрение инфекции. Благодаря активации процесса размножения иммунных клеток, которые обеспечивают распознавание инфекции антителами, происходит укрепление защиты от воздействия патогенных факторов.
Однако не стоит забывать, что не только пробиотики для иммунитета, но и повседневные продукты питания могут оказывать не меньший эффект. Так, исследованиями было подтверждено, что при употреблении 2 раза в день на протяжении полугода кисломолочной продукции, состоящей из полезных микроорганизмов, наблюдалось укрепление иммунной защиты организма.
Это проявлялось в уменьшении числа случаев заболеваний гриппом и ОРВИ. Особенно данный феномен отмечался у малышей дошкольного возраста. Если же все-таки ребенок болел, то иммунитет быстрее справлялся с инфекцией, а интоксикация характеризовалась менее выраженными клиническими симптомами. Так, малыш быстрее выздоравливал без развития осложнений.
Пробиотики для кожи
Кожные покровы как слизистая кишечника или влагалища заселены огромным количеством бактерий, в число которых входят полезные и патогенные микроорганизмы. Когда соотношение данных видов находится в равновесии, тогда кожа выглядит здоровой и ухоженной.
Однако при появлении дисбаланса в сторону патогенных бактерий, они начинают активироваться и интенсивно размножать, увеличивая свое количество. В дальнейшем при наличии нарушений целостности кожных покровов болезнетворные бактерии проникают в глубоко расположенные слои кожи, что вызывает воспалительную реакцию.
Кроме того в данной ситуации кожа становится незащищенной и подвергается негативному влиянию различных внешних факторов. Тогда следует применять пробиотики для кожи, которые обеспечат восстановление микрофлоры и защиту кожи.
Они представляют собой набор полезных бактерий, выполняющую иммунную и барьерную функцию. Помимо этого после приема пробиотиков изменяется в лучшую сторону внешний вид кожных покровов, обращая на себя внимание своим здоровьем.
Пробиотики для полости рта
Многие считают, что пробиотики для полости рта абсолютно бессмысленная затея, ведь поступая внутрь, препарат расщепляется только лишь в кишечнике, где полезные бактерии начинают размножаться и заполнять свободные места на слизистой оболочке. В результате патогенные микроорганизмы не могут активироваться и увеличить свое количество.
То же самое происходит в ротовой полости, при повышении численности болезнетворных бактерий развиваются воспалительные процессы в деснах и зубах. Пробиотики для полости рта необходимы для защиты слизистой от патогенной флоры и предотвращения возникновения воспаления.
Существует пока один пробиотик EvoraPro, имеющий оригинальные штаммы. Он представляет собой таблетированное средство, которое можно использовать малышам и взрослым, рассасывая таблетку во рту.
С помощью данного лекарственного препарат появляется возможность контролировать состояние зубов и ротовой полости в целом, что предотвращает преждевременное их выпадение. Противопоказанием к применению средства является выраженные иммунодефицитные состояния.
Пробиотики в косметике
Пробиотики в косметике являются относительно недавним открытием. На кожных покровах, как и слизистых кишечника и влагалища находятся полезные бактерии. Они адаптированы к перемене температурного режима, влажности и рН кожи.
Основной их функцией является защитная, ведь поддерживая кислую среду кожных покровов, патогенные бактерии не имеют возможности размножаться.
Случается, что полезные бактерии не выдерживают агрессивных факторов окружающей среды, что ведет за собой дисбаланс между полезными и болезнетворными микроорганизмами. В результате патогенная флора проникает через кожные покровы, и могут вызывать ощущение зуда, гиперемию и проявления раздражения в виде высыпаний.
Кожа становится более чувствительной и бурно реагирует на минимальное повреждение или воздействие любых факторов. Пробиотики в косметике необходимы для восстановления защитной «пленки» на поверхности кожных покровов. Это могут быть гели, крема, лосьоны или тоник для умывания. Они не только защищают кожу, но и увлажняют ее и придают упругости.
Пребиотики для кишечника и кожи лица : состав и характеристика
Существует две формы выпуска пребиотиков: сухие и жидкие. Сухие микроэлементы доступны в виде таблеток, капсул для перорального применения, флаконов и ампул. Изначально был доступен только высушенный биоматериал. Органические соединения подвергаются заморозке, после этого их выпаривают в вакуумном пространстве. Благодаря этому остаются только те клетки, которые были в состоянии анабиоза. То есть полезные бактерии не погибают, а впадают в состояние спячки, просыпаясь в благоприятной обстановке.
Данный процесс называется лиофилизацией. Его преимущество в том, что микроэлементы можно легко транспортировать без потери их полезных свойств. Если полезные бактерии находятся в жидком состоянии, то сохраняют свои свойства и начинают действовать в течение 1-2 часов после применения. Сухие проявляют свою активность через 8 часов после приема. При выборе наиболее эффективных пребиотиков предпочтение лучше отдавать жидким, особенно если их назначают для детей. Так как они быстрее начинают действовать, оказывая лечебное действие.
Пребиотики в таблетках
Полноценная работа организма зависит от регулярного получения полезных веществ и микроэлементов естественным путем, то есть с пищей. Если этого не происходит, то нужны пребиотики в таблетках или других формах выпуска. Подобные медикаментозные средства применяют при дисбактериозе и других расстройствах желудочно-кишечного тракта, которые невозможно вылечить с помощью овощей или фруктов.
Рассмотрим самые популярные таблетированные пребиотики:
- Лактофильтрум – сорбент растительного происхождения с двумя активными компонентами: лигнин и лактулоза. Применяется для дезинтоксикации организма и нормализации кишечной микрофлоры. Обладает иммуномодулирующими свойствами.
- Стимбифид – комбинированное лекарственное средство, в состав которого входят такие компоненты: олигофруктоза, инулин, селен, цинк, витамины. Нейтрализует действие токсинов, останавливает размножение опасных для организма бактерий и вызывает их гибель. Назначается при различных диспепсических расстройствах: тошнота, метеоризм, диарея, запоры.
- Дюфалак, Хилак Форте – это порошковые препараты, применяемых для восстановления нормальной микрофлоры кишечника после приема антибиотиков, операций на органах ЖКТ или при неправильном питании. Отлично поддерживают иммунитет.
Все вышеописанные препараты лучше использовать после консультации с лечащим врачом. Из широкого ассортимента различных медикаментов, доктор поможет выбрать самые эффективные.
[8]
Состав пребиотиков
Существует множество разных по эффективности веществ, входящих в состав пребиотиков. По своей структуре они являются сложными углеводами с разветвленной химической формулой. Это говорит о том, что не существует микроэлементов с одинаковым составом. Выделяют три основные группы:
- Галакто-олигосахариды – лактоза и лактулоза, присутствуют в кисломолочных продуктах, коровьем и грудном молоке.
- Полисахариды (пищевые волокна) – углеводы растительного происхождения: пектин, целлюлоза, инулин, камеди. В них связаны молекулы сахаров.
- Фруктозо-олигосахариды – углеводные вещества, содержащиеся в овощах и фруктах, но безопасные для диабетиков.
Кроме вышеописанных групп, в состав препаратов входят такие пищевые компоненты и органические соединения, как:
- Аргинин
- Валин
- Глутаминовая кислота
- Глутатион
- Инулин
- Каротиноиды
- Клетчатка
- Ксилобиоза
- Лактитол
- Лактулоза
- Олигофруктоза
- Пантотенат кальция
- Парааминобензойная кислота;
- Пектины
- Селен
- Сорбит
- Хитозан
- Эйкозапентаеновая кислота
Пперечисленные вещества входят в состав БАДов или лекарственных препаратов. Микроэлементы могут входить в состав уже готовых продуктов питания.
Характеристика пребиотиков
Пищевые компоненты, которые не перевариваются ферментами и не усваиваются в верхних отделах ЖКТ – это пребиотики. Они являются пищей для полезной микрофлоры, стимулируют ее рост и жизнедеятельность. Характеристика пребиотиков указывает на их избирательное стимулирование полезных для кишечной микрофлоры веществ.
Для того чтобы называться пребиотиком, вещество должно обладать такими свойствами:
- Не расщепляться и не всасываться в тонком и кишечнике и желудке.
- Не влиять на метаболическую активность и рост полезных микробов в кишечнике.
- Вызывать местный или системный ответ организма, нормализовать состав микрофлоры.
Пребиотические вещества оказывают влияние на иммунитет кишечника, что благотворно сказывается на организме вцелом. Именно поэтому их назначают при инфекционных заболеваниях и иммунодефицитных состояниях.
[9], [10], [11], [12], [13], [14]
Виды пребиотиков
Пребиотики являются низкомолекулярными углеводами. Молекулы полимеров соединены между собой бета-гликозидными связями. При этом, чем проще сахарид, тем быстрее он ферментируется в среде ЖКТ и оказывает бифидогенное действие. Микроэлементы имеют определенную классификацию, которая основана на длине их цепи:
- Мономерные (однозвеньевые) – проявляют бифидогенное действие в ротовой полости и пищеводе.
- Димерные – действует в желудке и тонком кишечнике.
- Олигомерные (3-10 звеньев) – активируются в верхних отделах толстого кишечника.
- Полимерные (более 10 звеньев) – начинают работать на протяжении всей толстой кишки.
Если в течение длительного времени принимать вещества единого ряда, то это приводит к активации микроорганизмов на ограниченном участке ЖКТ. Другие штаммы развиваются не пропорционально, поэтому лучше применять комбинированные по составу препараты.
Рассмотрим основные виды пребиотиков, доступных к применению:
- Чистые – в таких препаратах содержатся только полезные вещества. Ярким примером выступает сироп лактулозы, который доступен в лекарствах Лактусан, Дюфалак или Нормазе.
- Комбинированные с энтеросорбентами – восстанавливают микрофлору, связывают и выводят токсические вещества с кишечника. Популярные препараты: Максилак, Лактофильтрум.
Других классификаций не существует, поэтому перед приемом лекарства, необходимо заранее ознакомиться с механизмом его действия.
Живые пребиотики
Полезные вещества, попадающие в организм с натуральными продуктами питания, к примеру с овощами, фруктами или кашами – это живые пребиотики. Они необходимы для поддержания нормальной кишечной микрофлоры организма. Пребиотические вещества, витамины и минералы содержаться в таких продуктах:
- Пищевые волокна (клетчатка) – каши, отруби, морская капуста, сухофрукты и фрукты, овощи, грибы, бобовые, зелень.
- Полисахариды (лактоза, лактулоза) – важное вещество для микрофлоры. Содержатся в молочных продуктах, но при переедании могут спровоцировать аллергические реакции.
- Фруктосахариды – любые свежие овощи и фрукты.
- Пребиотический инсулин – выводит из организма вредный холестерин, оказывает лечебное действие на микрофлору, стимулирует процесс обмена веществ, укрепляет иммунитет. Есть в бананах, чесноке, луке, цикории и пшенице.
Для того чтобы получить суточную дозу живых пребиотиков, достаточно позавтракать овсянкой с йогуртом, отрубями или бананом. Полезные микроэлементы есть в крахмале (пиродекстрины), цитрусовых и яблоках (пектин), томатах, моркови и редиске (арабиногалактан).
Сухие пребиотики
Лиофилизированные культуры микроорганизмов в виде мелкодисперсного порошка – это сухие пребиотики. Они доступны в виде таблеток, капсул и порошков для суспензии. Препараты начинают активироваться через 1-4 часа после применения и оказывают лечебное действие в течение 6-8 часов.
Селективно ферментированные ингредиенты способствуют специфическим изменениям в составе и активности микрофлоры ЖКТ, оказывая благоприятное воздействие на организм. Сухие пребиотики используются в качестве пищевых ингредиентов, к примеру, в каше, молочных продуктах, шоколаде. Самые популярные из них: инулин, лактулоза, олигофруктоза, олигосахариды, галакто-олигосахариды.
[15], [16], [17], [18], [19]
Жидкие пребиотики
Растворы и суспензии с полезными микроорганизмами, которые не подвергались лиофилизации – это жидкие пребиотики. Их выпускают во флаконах и ампулах для перорального применения. Такие растворы содержат живые бактерии и субстрат, который является их питательной средой. Яркий пример таких веществ – это йогурты с живыми бактериями и различными биодобавками. Очень часто жидкие пребиотики дополняют витаминами, пробиотиками, аминокислотами и другими веществами.
Особенность данной формы полезных для микрофлоры кишечника микроэлементов в том, что они начинают действовать сразу после попадания в организм. То есть им не нужно время для активации, как сухим. Еще одно преимущество жидкости – это возможность не только принимать их перорально, но и вводить во влагалище, нос, прямую кишку, наносить на кожу и волосы.
Пребиотики для кишечника
Любые нарушения в работе желудочно-кишечного тракта негативно сказывают на работе всего организма. Пребиотики для кишечника необходимы для восстановления микрофлоры и укрепления местного и общего иммунитета. Они доступны в различных формах выпуска: таблетки, растворы, сухие смеси.
- Данный вид полезных веществ назначают для детей на первых порах жизни. Это различные пюре и специальные смеси, обогащенные витаминами и бактериями. Также могут использоваться и капли: Хилак Форте, BioGaia, Энтерожермина, Лактиале-Малыш.
- Забота о кишечнике нужна и беременным. Для них назначают лекарства с лактулозой и клетчаткой. При этом данные вещества лучше получать в живом, натуральном виде, то есть из продуктов. Это могут быть каши, бананы, бобовые, отруби, чеснок и лук, артишок.
Полезные бактерии необходимы и при запорах: Симбитер, Мутофлор, растительная клетчатка, Инулин, Послабин Лактулоза и другие. Такого рода препараты рекомендуется использовать по врачебному назначению.
Пребиотики после антибиотиков
Для лечения многих заболеваний назначают антибиотики. Данный вид препаратов уничтожает любые бактериальные агенты в организме, но губительное действие сказывается и на полезных бактериях. Антибиотики подавляют полезную микрофлору. Это проявляется как ухудшение пищеварения, появление дисбактериоза и других проблем со стороны ЖКТ.
Пребиотики после антибиотиков направлены на восстановление микрофлоры и устранение разрушающего действия применяемых ранее препаратов. Они выступают подпиткой для полезных бактерий, благодаря чему восстанавливается нормальная работа кишечника. Рассмотрим самые действенные вещества, которые необходимо использовать после антибиотических препаратов:
- Лактулоза – питательная среда для сахаролитических бактерий, входит в различные смеси и препараты для стимуляции роста полезных бактерий у детей.
- Инулин – стимулирует рост лактобактерий и бифидобактерий, повышает всасывание кальция, влияет на расщепление жиров. Оказывает антиканцерогенное действие.
- Олигосахариды (фруктоза, галактоза) – стимулируют рост бифидобактерий, в большом количестве содержатся в грудном молоке.
- Пектин – абсорбирует и выводит из организма токсины, ядовитые вещества и вредные бактерии.
Необходимые микроорганизмы содержаться в кисломолочных продуктах, сырах, квашенной капусте, овощах и фруктах. Полезными для организма являются низкомолекулярные углеводы, в состав которых входят: пектин, лактулоза, растворимые пищевые волокна.
Слабительные пребиотики
Для быстрого и эффективного устранения запоров используют слабительные пребиотики. Они представляют собой пищевые компоненты, которые не перевариваются в верхней части ЖКТ и в неизменном виде достигают толстой кишки, стимулируя рост полезной кисломолочной микрофлоры. Из-за слабительного действия их рекомендуется применять беременным и детям. В данную категорию веществ входят: инулин, лактулоза и фруктосахариды.
Они не оказывают немедленного эффекта, но их применение позволят достичь стойкого слабительного действия. Микроэлементы ускоряют рост микрофлоры кишечника, стимулируют продвижение каловых масс. При их ферментации вырабатываются органические кислоты, улучшающие перистальтику.
Самые эффективные слабительные пребиотики:
- Лактитол – это порошок для приготовления раствора. Применяется при лечении и профилактике запоров и заболеваний толстого кишечника. Облегчает процесс опорожнения, размягчает каловые массы. При длительном применении или превышении рекомендуемой дозировки может вызвать дискомфорт в животе и вздутие.
- Дюфалак, Гудлак, Послабин лактулоза – это препараты на основе лактулозы. Их применяют не только для лечения запоров, но и перед диагностикой органов брюшной полости. Отлично подходят для пациентов детского возраста. Лактулоза улучшает перистальтику, размягчает каловые массы, повышает всасывание фосфора и кальция, вызывает секрецию желчи в тонком кишечнике. Данные препараты не рекомендуется использовать при непроходимости кишечника, непереносимости лактулозы, фруктозы, и с особой осторожностью при сахарном диабете.
Пребиотики назначают для лечения острых и хронических запоров, при дисбактериозе. Они выводят из организма токсины, подавляют размножение патогенных микроорганизмов. Практически не имеют противопоказаний.
Сорбированные пребиотики
Химические органические соединения, применяемые в лечебных и профилактических целях для коррекции микрофлоры кишечника и улучшения иммунной системы – это пребиотики. Они абсолютно безопасны для человеческого организма, входят в состав многих натуральных пищевых продуктов. Сорбированные пребиотики – это полезные бактерии, иммобилизованные на сорбенте. Их действие основано на способности оседать на стенках слизистой кишечника, сорбенте и друг друге.
Сорбированные препараты обладают такими свойствами:
- Повышение колонизации полезных микроорганизмов и бактерий.
- Восстановление микрофлоры и ускорение репаративных процессов во внутренних органах.
- Адгезия полезных веществ к стенкам кишечника.
Сорбенты необходимы для сохранности микроорганизмов при прохождении через организм в кишечник. Они защищают бактерии от кислой среды желудка. Такой вид пребиотиков более эффективный, так как в период абсорбции и прохождения через внутренние органы сохраняет свое количество, быстро размножается, оказывая лечебное действие. Микроколонии пребиотических бактерий улучшают работу ЖКТ и на длительный срок восстанавливают микрофлору кишечника.
Пребиотики для влагалища
Снижение иммунитета, прием антибиотиков, различные воспалительные или инфекционные заболевания, стрессы и даже переохлаждение – это основная причина нарушения микрофлоры влагалища. В этот период появляется множество характерных для дисбиоза симптомов: увеличение количества влагалищных выделений, дискомфорт и сухость в области наружных половых органов, зуд, жжение и боль во влагалище. В особо запущенных случаях нарушение микрофлоры может привести к циститу, инфицированию матки и придатков.
Пребиотики для влагалища – это местные иммуномодуляторы. Их действие направлено на устранение бактерий, вызвавших нарушение, восстановление вагинальной микрофлоры и иммунитета стенок влагалища.
Рассмотрим эффективные пребиотические препараты:
- Вагинорм-С – биопрепарат с действующими веществами: аскорбиновая кислота, лактоза. Применяется для восстановления биоценоза влагалища. Имеет таблетированную форму выпуска, поэтому предназначен для интравагинального введения. Для лечения показано введение 1 таблетки в день, на ночь в течение 10 дней.
- Ацилакт – лиофилизированное средство с высокой антагонистической активностью в отношении патогенных и условно-патогенных микроорганизмов. Применяется в гинекологической практике при нарушениях микрофлоры влагалища. Выпускается в виде вагинальных суппозиториев. Длительность лечение 5-10 дней по одному суппозиторию в сутки перед сном.
- Нормофлорины (Л, Б, Д) – биокомплекс в состав которого входят пребиотики, пробиотики и другие полезные для микрофлоры микроорганизмы. Препарат содержит лактит, действие которого направлено на стимулирование роста собственной защитной микрофлоры. Выпускается во флаконах по 100 мл. Для его применения рекомендуется использовать смоченные в лекарстве тампоны или принимать средство перорально.
Как правило, лечение дисбиоза занимает 3-4 недели. После терапии необходимо пройти осмотр у врача и сдать анализы, для того чтобы убедиться в эффективности лечения. Если анализы нормальные, то применение препаратов прекращают. Но для подержания здоровой микрофлоры необходимо соблюдать профилактические меры, иначе болезнь снова даст о себе знать.
Тампоны с пребиотиками
Для лечения многих заболеваний в гинекологии, особенно воспалительной и инфекционной природы, используют тампоны с пребиотиками. Полезные бактерии восстанавливают нарушенный баланс микрофлоры, снимают болезненные ощущения (зуд, жжение, сухость) и укрепляют местный иммунитет. Специальные тампоны можно приобрести в аптеке или сделать самостоятельно.
Самым популярным средством с лечебным действием и комбинированным составом, являются тампоны Эллен. Они содержат комплекс Лакто Натурель – это смесь различных штаммов молочнокислых бактерий и органических химических соединений. Способствуют восстановлению здоровой микрофлоры влагалища, продуцируя выработку молочной кислоты, регулируют уровень рН.
- Тампоны разработаны таким образом, что действующие вещества высвобождаются только при температуре тела, то есть после введения. Для высвобождения пребиотиков и пробиотиков требуется около 90 минут. За это время действующие вещества распространяются по слизистой оболочке влагалища. Препарат используют во время нескольких циклов менструации, это позволяет достичь стойкого лечебного эффекта.
- Основные показания к применению: нарушение микрофлоры влагалища, кандидозный вагинит и бактериальный вагиноз, зуд, жжение, раздражение, увеличение выделений из влагалища. Тампоны имеют три размера: мини, нормал и супер. Каждый размер обладает определенной степенью поглощения, приспосабливаясь к особенностям менструального цикла. При этом рекомендуется использовать наименьший размер и менять его как можно чаще. Препарат противопоказано использовать при иммунодефиците и тяжелых соматических состояниях. Среди возможных побочных эффектов, выделяют только синдром токсического шока.
Лечебные тампоны с пребиотиками можно сделать самостоятельно. Для этого существует множество рецептов народной медицины, но перед их применением лучше проконсультироваться с гинекологом. Можно использовать уже готовые тампоны или сделать их самостоятельно. Возьмите 40-50 см бинта и ватку, смочите вату в лекарственном средстве и заверните в бинт. При этом необходимо оставить кончик бинта, для того чтобы тампон можно было вытащить из влагалища. В качестве лекарственных растворов используют кефир и мед, облепиховое масло и другие растительные компоненты с пребиотическими свойствами. Курс лечения индивидуален для каждого пациента, но в среднем занимает около 10 дней.
Полоскание горла пребиотиками
Сезонные простудные заболевания – это самая распространенная причина боли в горле. Для предупреждения возможных осложнений и устранения уже имеющихся заболеваний, используют различные препараты: капли, растворы, спреи, таблетки. Полоскание горла пребиотиками это еще один метод лечения, который чаще всего сочетают с основной противовирусной терапией. Полезные бактерии ускоряют восстановление слизистой и укрепляют местный иммунитет. Пребиотические средства используются и при стоматологических заболеваниях, неприятном запахе изо рта и других проблемах. Рассмотрим самые популярные из них:
- Инулин – популярный пребиотик, входящий в состав многих БАДов. Природный натуральный полисахарид состоит из фруктозы. Активирует метаболические процессы в организме, ускоряет рост полезной микрофлоры и регулирует уровень глюкозы в крови. Данное вещество входит в состав многих растений: мать-и-мачеха, одуванчик, девясил, эхинацея. Растения используются для приготовления отваров и настоев для полоскания горла при различных воспалительных процессах, ангине, простуде, вирусных поражениях. Инулин можно приобрести в аптеке, он доступен в форме таблеток и порошка для приготовления растворов.
- Экстракты водорослей – натуральное средство с содержанием йода. Для лечения чаще всего используют ламинарию. Для лечения горла возьмите 1 чайную ложку или 25 капель ламинарии и разбавьте ее в 250 мл теплой воды. Полученный раствор применять для полосканий 2-4 раза в день.
- Пребиотики содержатся в чесноке, поэтому из него готовят настои для полоскания горла. Измельчите два зубка, залейте 250 мл кипяченой воды и дайте настояться, процедите и используйте для полосканий 2-3 раза в день. Средство помогает горлу очиститься от инфекции и насыщает микрофлору витаминами.
- Гель-спрей Sengara – препарат с пребиотиками и бактериофагами. Применяется при галитозе, для профилактики бактериальной ангины, парадонтита, парадонтоза, гингивита и других патологий. Его механизм действия основан на восстановлении нормальной микрофлоры. Рекомендуется применять ежедневно, по 1-2 впрыскивания в сутки.
Полоскание пребиотиками необходимо проводить в том случае, если болезненные ощущения вызваны патогенными микроорганизмами. Полезные бактерии эффективны при прогрессирующей ангине, синусите и других поражениях.
Пребиотик для лица
Молодость, упругость, ровный цвет и гладкость лица зависят от нормальной микрофлоры и естественного состава бактерий в коже. Пребиотики для лица входят во многие косметические средства. Они улучшают микрофлору, снижают кожные воспалительные реакции, заставляют эпидермис вырабатывать больше коллагена и эластина. Пребиотики омолаживают, ускоряют процесс регенерации, заживляют царапинки, ранки, трещины, убирают сухость.
Полезные бактерии устраняют дефекты при акне и угревой болезни. Это происходит благодаря повышению защитных свойств эпидермиса. Микроорганизмы нормализуют состояние кожи и укрепляют ее. На косметическом рынке представлено множество пребиотических препаратов для ухода за кожей, рассмотрим самые популярные из них: Angelini серия Barral Baby Protect, органическая косметика Melvita линия Floral bouquet с пребиотиками для молодой кожи, Faberlic серия Bioeffect с пребиотиком-биотином, лактобактериями и бифидобактериями.
Крем с пребиотиками
Для улучшения состояния кожи, косметологи рекомендуют использовать крема с пребиотиками. Это субстраты и вещества, которые способствуют росту и укреплению здоровой микрофлоры: лактоза (молочный сахар), молочная кислота, инулин и другие. Пребиотическая косметика имеет свой уровень рН, благоприятный для роста полезных бактерий.
Рассмотрим популярное средство: ночной крем био регулятор от Кора.
- Крем содержит такие активные компоненты: инулин, олигосахарид, тысячелистник, миндальное и соевое масла, шалфей, фиалка, авокадо и другие вещества. Подходит для комбинированной и жирной кожи во время ночного отдыха. Идеально устраняет последствия усталости и негативного воздействия внешних раздражителей.
- Натуральные пребиотики выделены из сахарной свеклы и корня цикория. Они восстанавливают баланс, повышают сопротивляемость к внешним факторам, снимают раздражение и покраснение. Небольшое количество крема наносят на очищенную кожу лица и шеи. Стойкий косметический эффект наблюдается через 2 месяца регулярного применения.
Данное косметическое средство рекомендуется применять с 25-30 лет.
[20], [21], [22], [23]
Тоник кора с пребиотиками
Для жирной и смешанной кожи отлично подходит тоник Кора с пребиотиками. Средство содержит фитоэкстракты, лактулозу, салициловую кислоту, кору дуба, пантенол, биосеру, аллантоин, экстракт фиалки, календулы и шалфея. Данные ингредиенты восстанавливают здоровый баланс микрофлоры, подавляют размножение бактерий, провоцирующих воспалительные реакции, подсушивают и увлажняют.
По описанию производителя, применение тоника в течение месяца позволяет достичь таких результатов:
- Восполнение водного баланса после умывания, увлажнение.
- Минимизация раздражения и воспаления, заживление ранок и трещинок.
- Выравнивание цвета и регулирование выделения кожного сала.
- Матирующий эффект и сужение пор.
Средство предназначено для утреннего и вечернего применения. Его наносят на лицо и шею, легкими движениями. Имеет легкий аромат, быстро впитывается, не сушит и не стягивает кожу, не оставляет жирности и липкости.
Маска себобаланс с пребиотиком
Для ухода за проблемной, комбинированной и жирной кожей отлично подходит маска себобаланс с пребиотиком. Данное средство обладает абсорбирующими, подсуживающими и вяжущими свойствами. Регулирует секрецию сальных желез, подавляет размножение болезнетворных микроорганизмов вызывающих акне, снимает воспаление, предупреждает появление черных точек и защищает кожу от действия раздражающих факторов.
Глиняная маска содержит такие компоненты: инулин, альфа-глюкан олигосахарид, кора дуба, ромашка, шалфей, янтарная кислота, аллантоин, кукурузное масло, бетаин. Янтарная кислота – это мощный антиоксидант, нейтрализует свободные радикалы, восстанавливает упругость, освежает цвет и усиливает клеточное дыхание. Аллантоин смягчает ороговевшие участки, удаляет омертвевшие клетки, предупреждает закупорку пор, успокаивает.
Маска белого цвета с рыхлой структурой и легким косметическим ароматом. Ее рекомендуется применять 1-2 раза в день на 15-20 минут, наносить как на все лицо, так и локально, к примеру, на акне. Средство постепенно впитывается и подсыхает, немного стягивая кожу. При регулярном применении подсушивает прыщики, выравнивает тон кожи, снимает покраснение и раздражение, сужает поры.
Био тоник с пребиотиками
Косметические средства с полезными микроорганизмами позволяют восстановить микрофлору кожи и повысить ее иммунитет. Био тоник с пребиотиками обладает нормализующими и укрепляющими эпидермис свойствами. Эффективно снимает зуд, отечность, сухость и раздражение. Идеально подходит для людей, как с проблемной, так и со здоровой кожей.
- Био тоник ChocoLatte с пребиотиками для роста волос
Препарат для оздоровления и питания волос. Обладает антимикробными и противогрибковыми свойствами, оживляет волосы и избавляет их от токсинов. Содержит витамин В, гидролат лопуха и розмарина, комплекс полезных бактерий. Активизирует рост волосяных луковиц, останавливает их выпадение, снимает воспаление, сухость и раздражение кожи, защищает волосы от ультрафиолета, придает им живой вид. Средство доступно во флаконе с распылителем, объемом 100 мл.
- Avalon Organics Lavander Luminosit – тоник для лица с лавандой и пребиотиками
Увлажняющее натуральное средство с успокаивающими и смягчающими свойствами. Благотворно воздействует на кожу, питает ее, улучшает тон и цвет. В его состав входят такие компоненты: сок алоэ, растительные экстракты (лаванда, огурец, эхинацея, ромашка, зеленый чай, олива, чайный гриб), гликозиды пшеничных отрубей, натуральные масла (лаванда, лайм, лимон, шиповник), салициловая кислота и другие. Перед нанесением, кожу нужно очистить от загрязнений и тщательно высушить. Для нанесения лучше использовать ватный тампон, обрабатывать не только на область лица, но и на шею. Препарат доступен в объеме 237 мл.
[24]
ТОП-12 Лучших пробиотиков для кишечника
Как выбрать пробиотики
После антибиотиков часто возникают проблемы с пищеварением. Почему так происходит? Дело в том, что они убивают не только вредные, но и полезные бактерии. Пробиотики восстанавливают их количество и повышают активность уже имеющихся, а также укрепляют кишечный иммунитет. Приведем краткий обзор критериев их выбора:
- Общее состояние здоровья. Многие пробиотики нельзя принимать, например, при непереносимости лактозы или совместно с антибиотиками. Внимательно читайте инструкцию по применению.
- Наличие аллергии. Аллергическая реакция может возникнуть на любой компонент препарата, поэтому людям, склонным к аллергии, нужно тщательно изучать состав и принимать лекарства с большой осторожностью.
- Образ жизни. Разовая доза пробиотика зависит от образа жизни: при заболеваниях ЖКТ требуются более высокие дозы, чем при профилактическом приеме. Здоровые люди обычно принимают их при смене климата или погрешностях в диете.
- Лекарственная форма. Маленьким детям рекомендуются пробиотики в форме капель из-за анатомических особенностей пищевода. Взрослым подходит любая форма.
- Совместимость с другими лекарственными средствами. Некоторые антибиотики уничтожают пробиотики, некоторые на них не действуют, поэтому схема приема варьируется от препарата к препарату. Подробнее о совместимости написано в инструкции по применению.
Пробиотики нового поколения отличаются тем, что в их состав входят сорбенты — частицы, которые «всасывают» в себя вредные вещества и токсины, образующиеся в результате деятельности болезнетворных бактерий. Простой пример — активированный уголь, знакомый каждому. Подбирая список лучших пробиотиков мы учли все перечисленные выше критерии, а также отзывы покупателей и мнения специалистов. В топ вошли наиболее качественные препараты.
Полезные материалы по выбору
Разновидности пробиотиков
Пробиотики могут содержаться не только в лекарственных препаратах, но и в пищевых добавках и пищевых продуктах, таких как йогурт, кефир и даже маринованные огурцы. Важный момент: маринад на основе уксуса убивает эти бактерии, поэтому при проблемах с пищеварением они не помогут. В этом разделе речь пойдет о лекарственных препаратах. Они выпускаются в 4 разных формах, давайте разберемся, чем они отличаются
- Сухие — выпускаются в виде порошка, который нужно разводить водой. Как понятно из названия, это высушенные бактерии. Однако в процессе сушки они теряют часть своих свойств, которые восстанавливаются лишь через 8-10 часов. Также при прохождении через желудок могут погибнуть до 90% микроорганизмов, поэтому эффект от таких форм пробиотиков слабый и кратковременный, поэтому в настоящее время предпочтение отдается жидким и капсульным вариантам, о них ниже.
- Жидкие — содержат не только сами бактерии, но и питательную среду, которая обеспечивает им условия для выживания при прохождении через желудок и сохраняет все полезные вещества, которые они вырабатывают. Важной особенностью является то, что жидкую форму можно применять и у детей, например, при коликах.
- В капсулах — главное преимущество пробиотиков в капсулах, как понятно из названия, — это наличие желатиновой капсулы, которая обеспечивает защиту препарата от негативного воздействия кислотной среды желудка. Внутри капсулы содержится порошок, по свойствам аналогичный сухим формам пробиотиков. Такие формы нежелательны для применения у детей — существует риск попадания капсулы в дыхательные пути, но их также можно разводить водой и принимать как раствор, однако в таком случае нужно помнить о недостатках порошковых форм.
- Сорбционные — являются препаратами нового поколения благодаря наличию сорбента в составе, который обеспечивает эффективное избавление от симптомов интоксикации организма при кишечных инфекциях, вызываемых патогенными бактериями, — снимает боль, температуру, выводит токсины. Поэтому сорбционные пробиотики оказывают комплексное воздействие на кишечник — восстанавливают нормальную микрофлору и снимают симптомы, вызванные заболеванием. В качестве сорбента могут использоваться пребиотики.
Из вышесказанного можно сделать следующий вывод: в настоящее время чаще всего используются жидкие, капсульные и сорбционные формы, которые практически не разрушаются при прохождении через желудочно-кишечный тракт и сохраняют все свои полезные свойства, обеспечивая эффективную борьбу с заболеванием.
Часто задаваемые вопросы
Пребиотики или пробиотики?
Пробиотики (синоним — эубиотики) — живые микроорганизмы, населяющие кишечник человека. Пребиотики — химические вещества, которые создают питательную среду для развития «полезных» бактерий и стимулируют образование естественной микрофлоры. Эти препараты часто принимаются совместно, они могут присутствовать в сорбционных пробиотиках.
Чем различаются пробиотики?
Различий может быть очень много. Это и то, какие в них находятся бактерии и их количество, и наличие других вспомогательных веществ. Глобально, все препараты, в зависимости от времени создания пробиотика, делятся на несколько поколений:
- Монокомпонентные — 1 поколение препаратов, наиболее простые по своему действию, так как содержат только 1 вид микроорганизмов (бифидобактерии, лактобактерии).
- Антагонисты — 2 поколение, содержат споры бактерий или грибки, которые в норме не содержатся в кишечнике, однако подавляют патогенную микрофлору и со временем выводятся из организма.
- Поликомпонентные (Симбиотики) — 3 поколение, содержат несколько видов бактерий, которые усиливают действие друг друга.
- Синбиотики — 4 поколение, содержат 1 вид бактерий и питательную среду для их размножения.
- Поликомпонентные синбиотики — 5 поколение, содержат несколько видов бактерий и питательную среду.
В настоящий момент используются пробиотики всех поколений, однако выбор зависит от причины заболевания и тяжести состояния. Самостоятельно подобрать правильную категорию очень тяжело, рекомендуем делать это вместе со специалистом.
Какие пробиотики лучше принимать после антибиотиков?
Важный момент: пробиотики лучше принимать вместе с антибиотиками, пока изменения в желудочно-кишечном тракте выражены не сильно. Если опоздать, нарушения будут серьезнее, а курс лечения дольше. В качестве пробиотиков можно использовать пищевые продукты (йогурты, кефир, сыр), а также лекарственные препараты.
В таких случаях часто назначаются средства, содержащие лактобактерии и бифидобактерии.
Задать свой вопрос
Лучшие монокомпонентные пробиотики
- Особый вид бифидобактерий
- Страна: Россия
- Цена: 569 Р
- Рейтинг (2020): 9
Компания Био-Веста была основана сотрудниками научного центра «Вектор», что изначально внушает доверие к препарату. Пробиотик Биовестин содержит бифидобактерии и относится к I поколению. Главная его особенность — высокая скорость размножения и активность бифидобактерий, что способствует ускоренному выздоровлению после перенесенных инфекций и восстановлению микрофлоры кишечника, поэтому Биовестин не идет ни в какое сравнение с другими средствами. При хранении флакона в открытом виде детям его принимать нельзя, для взрослых открытый флакон годен в течение суток.
- Достоинства
- Широкий спектр применения
- Недостатки
- Противопоказан при непереносимости молочного белка
- Цена
- Лучший при аллергии
- Страна: Россия
- Цена: 168 Р
- Рейтинг (2020): 8
НПО Биомед — пермский филиал компании Микроген. Препарат Лактобактерин относится к I поколению, содержит лактобактерии. Имеет широкий спектр действия: лечение дисбактериоза, инфекций, передающихся половым путем, аллергических реакций. Этот пробиотик также способствует повышению иммунитета, поэтому подходит и для профилактики ОРВИ у людей, склонных к частым респираторным заболеваниям.
- Достоинства
- Можно применять у детей с рождения
- Подходит для беременных
- Недостатки
- Самый дешевый
- Страна: Россия
- Цена: 81 Р
- Рейтинг (2020): 8
Такой недорогой препарат как Бифидумбактерин — пробиотик I поколения — содержит бифидобактерии и применяется для лечения не только кишечных инфекций и дисбактериоза, но и некоторых гинекологических заболеваний, бронхитов и пневмоний. Его можно принимать в комбинации с витаминами (особенно группы B) для усиления эффекта. Из побочных эффектов встречается только аллергическая реакция, по некоторым данным — сонливость. Может применяться у детей с рождения, а также у беременных и для профилактики мастита у кормящих.
- Достоинства
- Бюджетный
- Нет строгой схемы применения
- Недостатки
Лучшие поликомпонентные пробиотики
- Лучший для ребенка
- Страна: Испания
- Цена: 465 Р
- Рейтинг (2020): 9
Без этого пробиотика список был бы неполным. Он предназначен специально для детей и содержит в своем составе лактобактерии и бифидобактерии, которые помогают организму ребенка адаптироваться при введении в рацион новых продуктов, обеспечивают правильное пищеварение и, как и все пробиотики, подходят для коррекции микрофлоры после приема антибиотиков.
Препарат стимулирует образование молочной кислоты, тем самым создавая благоприятные условия для развития собственной микрофлоры ребенка, а также усиливает сокращения кишечника, способствуя избавлению от запоров. Перед применением консультация с врачом обязательна.
- Достоинства
- Состав
- Повышает иммунитет
- Недостатки
- Возможна аллергическая реакция
- Богатый состав
- Страна: Германия
- Цена: 231 Р
- Рейтинг (2020): 9.5
Хилак Форте содержит продукты жизнедеятельности бактерий, которые стимулируют образование собственной кишечной микрофлоры. Они нормализуют синтез витаминов, а также корректируют водно-электролитный баланс в организме, нарушения которого вызваны такой кишечной инфекцией, как сальмонеллез. На фоне приема ускоряется выведение патогенных бактерий и выздоровление. Побочные эффекты не наблюдались, но возможны такие осложнения, как сыпь, зуд, боли в животе, которые проходят самостоятельно после отмены препарата. Отличное средство, достойное включения в наш топ.
- Достоинства
- Комплексное лечение кишечных инфекций
- Недостатки
- Неприятный вкус
- Возможны аллергические реакции
- Хорошо переносится
- Страна: Словения
- Цена: 329 Р
- Рейтинг (2020): 7.5
В состав Линекса входят 3 вида бактерий, однако использовать его изолированно при лечении кишечных инфекций нельзя (в отличие от Хилака Форте или сорбционных пробиотиков), поэтому при появлении симптомов интоксикации (высокая температура, диарея с кровью) необходимо сразу обратиться к врачу и не заниматься самолечением при помощи этого препарата. Пробиотик положительно влияет на иммунитет (участвует в синтезе аскорбиновой кислоты), а также способствует образованию собственных веществ с антибактериальными свойствами, благодаря чему возможно самостоятельное лечение легких форм кишечных инфекций.
- Достоинства
- Состав
- Можно принимать вместе с антибиотиками
- Недостатки
- Возможны аллергические реакции
- Можно принимать здоровым людям
- Страна: США
- Цена: 334 Р
- Рейтинг (2020): 9
ЛактоБаланс отлично сочетается с антибиотиками, уменьшая вероятность развития побочных эффектов. В состав входят лактобактерии и бифидобактерии. В составе содержатся только натуральные компоненты, что обуславливает крайне редкое появление аллергических реакций. Подходит при погрешностях в диете (переедание, большое количество жирной пищи в рационе), при нарушениях пищеварения в результате длительного стресса, при кандидозе полости рта и влагалища.
- Достоинства
- Цена
- Не нужно хранить в холодильнике
- Недостатки
- Подходит для облегчения симптомов непереносимости лактозы
- Страна: Италия
- Цена: 438 Р
- Рейтинг (2020): 9.5
Данный препарат содержит в составе 2 вида бактерий, отличающихся высокой устойчивостью и скоростью роста и размножения. Он нормализует функцию не только толстого, но и тонкого кишечника, где происходит всасывание всех питательных веществ, тем самым способствуя нормальному усваиванию полезных веществ, поступающих с пищей, и других лекарственных препаратов. Важной особенностью средства является наличие у капсулы двухслойной оболочки, что обеспечивает усиленную защиту от разрушения в желудке.
- Достоинства
- Отсутствие побочных эффектов
- Можно использовать одновременно с антибиотиками
- Недостатки
Лучшие сорбционные пробиотики
- Эффект наступает быстро
- Страна: Россия
- Цена: 653 Р
- Рейтинг (2020): 8
В состав пробиотика входят бифидобактерии и активированный уголь. Он используется при лечении кишечных инфекций, в т.ч. в тех случаях, когда не выявлен возбудитель. Может применяться совместно с витаминами, которые усиливают эффект препарата. При необходимости приема с антибиотиками интервал должен быть не мене 3-4 часов, можно смешивать с молочными продуктами. Важное преимущество — можно использовать у недоношенных и ослабленных детей, а также у больных со значительно сниженным иммунитетом и женщин при подготовке к кесареву сечению.
- Достоинства
- Широкий спектр применения
- Подходит для беременных и кормящих
- Недостатки
- Противопоказан при непереносимости лактозы и нарушении всасывания глюкозы-галактозы
- Цена
- Отсутствие побочных эффектов
- Страна: Россия
- Цена: 379 Р
- Рейтинг (2020): 9
Этот пробиотик содержит в составе бифидобактерии и знакомый всем активированный уголь, который до сих пор используется при лечении диареи, в том числе инфекционной, хотя и несколько реже, чем раньше. Также препарат применяется при лечении пищевых отравлений, диареи или запоров, вызванных стрессом, а также при нарушениях всасывания питательных веществ в тонком кишечнике. Бифидумбактерин Форте можно запивать молоком, однако нежелателен прием совместно с другими лекарственными веществами, ведь уголь воздействует не только на токсические вещества.
- Достоинства
- Цена
- Курс 7 дней
- Недостатки
- Нежелателен у людей с непереносимостью лактозы
- Содержит лактозу в качестве пребиотика
- Страна: Россия
- Цена: 242 Р
- Рейтинг (2020): 9.5
Лекарственное средство Флорин форте содержит комплекс из двух видов бактерий: лактобактерии и бифидобактерии, поэтому относится к III поколению. Пробиотики III поколения хорошо усваиваются, подходят детям и пожилым и имеют более выраженный эффект восстановления микрофлоры кишечника, чем пробиотики I поколения, и хорошие отзывы это доказывают. Качественный препарат, достойный 1 места в нашем рейтинге пробиотиков.
- Достоинства
- Широкий спектр действия
- Улучшает переваривание пищи при ферментных нарушениях (панкреатит)
- Недостатки
- Нежелателен у людей с непереносимостью лактозы
- Широкий спектр действия
- Страна: Россия
- Цена: 381 Р
- Рейтинг (2020): 9.5
В состав этого пробиотика входит сорбент цеолит, пребиотик для стимуляции образования естественных бактерий кишечника и продукты жизнедеятельности сенной палочки. Этот комплекс создает благоприятные условия для образования всех необходимых бактерий, а также способствуют синтезу интерферона (вещества, помогающего бороться с ОРВИ и другими инфекциями) и веществ с антибактериальными свойствами, благодаря чему может повышаться иммунитет. Препарат может применяться при гастритах, панкреатитах и др. заболеваний, связанных с недостатком ферментов.
- Достоинства
- Широкий спектр действия
- Можно использовать с другими препаратами
- Недостатки
- Противопоказан при беременности и кормлении грудью
Пребиотики, пробиотики и метапребиотики | Стимбифид Плюс
Нормальный баланс микрофлоры толстого кишечника является важным условием не только для комфортного пищеварения, но и для создания надежной иммунной защиты организма. Под влияние внешних или внутренних негативных факторов наблюдается развитие дисбактериоза (дисбиоза), который негативно отражается на общем состоянии организма. Говоря о том, в чём разница между пребиотиками и пробиотиками, необходимо ознакомиться с их функцией и характером влияния на организм человека.
Что такое пребиотики
Пребиотики по своей структуре и функциональной значимости представляют собой биологически-активные компоненты, стимулирующие рост и размножение полезной кишечной микрофлоры. Эти компоненты не подвергаются воздействию пищеварительных ферментов и не расщепляются под влиянием желудочного сока. Говоря простым языком пребиотики это вещества, создающие в просвете толстого кишечника благоприятную среду для восстановления баланса кишечной микрофлоры.
Особой ценностью эти вещества обладают для маленьких детей. С момента рождения, кишечник ребёнка стерилен. После контакта с внешней средой, слизистая оболочка толстого кишечника новорожденного заселяется микроорганизмами бактериальной природы. В течение первого года жизни, соотношение полезных и условно патогенных микроорганизмов составляет 9:1. Нередко, дети грудного возраста сталкиваются с дисбиозом, который приводит к развитию тяжелой симптоматики и расстройств пищеварения. Предупредить развитие дисбактериоза у новорожденных и эффективно лечить его помогают средства, содержащие пребиотики.
В группу пребиотиков входят такие компоненты:
- Моносахариды (сорбит, рафиноза, ксилобиоза).
- Олигосахариды (фруктоолигосахариды, соевый олигосахарид, галактоолигосахариды).
- Дисахариды (лактулоза).
- Полисахариды (гемицеллюлоза, целлюлоза, камеди, декстрин, слизи). Несмотря на пользу для организма человека, пробиотики и пребиотики выполняют разную функцию.
Что такое пробиотики
Пробиотики представляют собой микрокультуры, формирующие микрофлору толстого кишечника. Польза пребиотиков в комбинации с пребиотиками заключается в том, что они участвуют в формировании кишечного иммунитета, расщеплении пищевых компонентов и выработку некоторых витаминов. Современная фармацевтическая промышленность выпускает лактобактерии и бифидобактерии в одном препарате, что позволяет решать проблему дисбактериоза. Кроме того, выпускаются препараты, содержащие не только полезные бактерии, но и вещества, способствующие их росту. К перечню лучших пребиотиков и пробиотиков в одном препарате для кишечника, относят:
- Пробиотикс.
- Максилак.
- Ламинолакт.
- Нормоспектрум.
- Пробиен.
- Биовестин-лакто.
- Бифилар.
В ходе клинических испытаний был составлен рейтинг эффективности различных препаратов при дисбиозе кишечника после длительного приёма антибиотиков. Сравнительная экспериментальная оценка эффективности проводилась в отношении таких препаратов:
- Лакто-фильтрум.
- Бактистатин.
- Биовестин лакто.
- Бифиформ.
- Бак-сет форте.
- Аципол.
- Актофлор-С.
- Максилак.
- Линекс Форте.
- Нормофлорин.
- Стимбифид.
- *Стимбифид Плюс.
Большинство перечисленных средств показали низкую эффективность, недостаточную для решения проблемы дисбаланса кишечной микрофлоры. В результатах исследования была отмечена максимальная эффективность метапребиотика Стимбифид Плюс, который за короткий промежуток времени создавал лучшие условия для быстрого размножения бифидум и лактобактерий, решая тем самым проблему дисбаланса кишечных микроорганизмов.
Отвечая на вопрос о том, что это такое метабиотики, можно сказать, что это препараты, содержащие активные метаболиты полезных микроорганизмов, обитающих в просвете толстого кишечника. Благодаря уникальному составу Стимбифид Плюс является лидером в списке препаратов метабиотиков. Кроме способности эффективно бороться с антибиотико-ассоциированным дисбактериозом, метапребиотик Стимбифид Плюс обладает такими свойствами:
- Подавляет размножение патогенных микроорганизмов в просвете толстого кишечника.
- Эффективно уничтожает бактерию Helicobacter pylory. Инновационный метапребиотик Стимбифид Плюс подавляет рост микроорганизмов, являющихся одной из главных причин развития гастрита и язвенной болезни желудка. Действие препарата было экспериментально доказано, при этом в клинических испытаниях принимали участие люди с острым течением воспалительного процесса в желудке. Полная эрадикация бактерий наблюдалась у 100% пациентов, при этом лечение не включало приём антибиотиков.
Состав метапребиотика Стимбифид Плюс
Уникальное средство для борьбы с дисбактериозом и гастритом, спровоцированным бактерией Helicobacter pylory имеет двухкомпонентный состав. Препарат состоит и пребиотиков (фруктополисахариды и фруктоолигосахариды), которые представляют собой эксклюзивный питательный субстрат для бифидобактерий, находящихся по всей длине толстого кишечника. Также, в состав препарата входит метабиотик — лактат кальция. Это вещество активно стимулирует рост полезных бактерий в кишечнике, потенцируя эффект пребиотиков.
По сравнению с другими препаратами, содержащими пребиотики и пробиотики, Стимбифид Плюс обладает такими преимуществами:
- Стимулирует моторно-эвакуаторную функцию толстого кишечника и предупреждает развитие запоров.
- Уменьшает газообразование в кишечнике.
- Снижает вероятность развития колоректального рака.
- Ускоряет обменные процессы в организме.
- Благоприятно влияет на когнитивные функции центральной нервной системы.
- Предупреждает развитие остеопороза.
- Стимулирует защитные силы организма.
Стимбифид Плюс это метапребиотик не имеющий структурных аналогов. Уникальный состав стимулирует восстановление естественной микрофлоры кишечника, популяция которой была подавлена влиянием внешних или внутренних негативных факторов.
/ Доктор Стимбифид
Поделиться в соцсетях:
что это такое, их отличия и список препаратов
Нарушения микрофлоры кишечника (дисбактериоз) – это опасное состояние, которое способствует возникновению патологий пищеварительной системы и ухудшению состояния организма в целом. Для лечения дисбактериоза применяются специальные средства – пробиотики и пребиотики.
Пробиотики – это препараты, в состав которых входят полезные для организма человека бактерии. Они представляют собой основу новой микрофлоры, которая развивается на месте нарушенного кишечного микробиоза.
Пребиотики – это препараты, которые содержат питательные вещества, необходимые для нормального размножения бактерий-симбионтов. Препараты из этой группы благоприятно воздействуют на уже имеющиеся в кишечнике микроорганизмы, стимулируя их активность.
В чем разница между пробиотиками и пребиотиками?
Пробиотики и пребиотики оказывают на микрофлору одинаковый эффект – восстанавливают ее численность и активность. Однако механизм действия этих препаратов различается.
Пребиотики – это препараты, которые поддерживают полезные микроорганизмы, уже имеющиеся в кишечнике. Питательные вещества не всасываются в кровоток и в практически неизмененном виде доходят до толстого кишечника, где их употребляют полезные бактерии. Благодаря этому они могут выполнять свои функции и активнее размножаться.
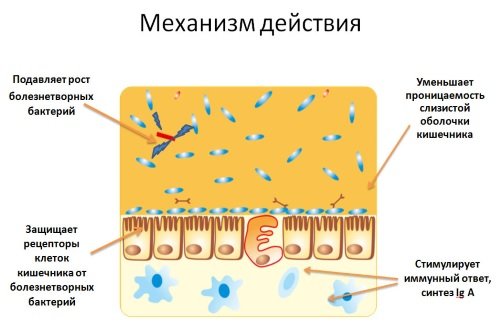
Пробиотики – это препараты живых бактерий. Фактически, они являются средствами заместительной терапии. Микроорганизмы из лекарства доходят до кишечника пациента и входят в состав его микрофлоры. Повышение содержания полезных бактерий сдерживают размножение патогенных микроорганизмов. Со временем восстанавливается нормальный состав флоры кишечника.
Полезные свойства
| Пробиотики | Пребиотики |
|
Список препаратов
Пробиотики
- Монокомпонентные лекарства (Лактобактерин, Бифидумбактерин, Колибактерин). Препараты содержат только один штамм бактерии-симбионта.
- Поликомпонентные средства (Ацилакт, Аципол, Бифиформ). Лекарства включают сразу несколько видов полезных микроорганизмов.
- Сорбционные препараты (Бифидубактерин форте, Экофлор). В состав лекарств этой группы входят бактерии нормальной микрофлоры и энтеросорбенты.
- Рекомбинантные средства. Лекарства включают микроорганизмы, генетически модифицированные в соответствии с потребностями человеческого организма.

Пребиотики
- Средства, содержащие лактулозу. Данное вещество относится к группе дисахаридов. Лактулоза доставляется в толстый кишечник по пищеварительной системе, не всасываясь в верхних отделах. Питательное вещество благоприятно воздействует на сахаролитические микроорганизмы.
- Препараты на основе пектина. Пектин – это полисахарид. Он, как и лактулоза, является субстратом для бактерий, перерабатывающих углеводы. Кроме того, у лекарства есть антитоксическое воздействие. Препарат связывает токсины, которые вырабатывают патогенные микроорганизмы, благодаря чему состояние человека при дисбактериозе улучшается.
- Инулин. Вещество представляет собой полисахарид. Он стимулирует размножение бифидобактерий и лактобактерий. Дополнительным благоприятным воздействием инулина является стимуляция всасывания кальция. Это играет большую роль в профилактике рахита (у детей) и остеопороза (у пациентов пожилого возраста).
- Препараты на основе олигосахаридов (углеводов, включающих галактозу, фруктозу, глюкозу). Вещества стимулируют размножение полезных микроорганизмов, в первую очередь бифидобактерий.

Комбинированные средства (синбиотики)
Эффективным средством для борьбы с дисбактериозом являются синбиотики – препараты, которые одновременно содержат и полезные микроорганизмы, и питательные вещества для их активного размножения. В эту группу входят:
- Максилак. Выпускается в капсулах, не требует хранения в холодильнике. В составе 9 культур пробиотических бактерий и олигофруктоза.
- Максилак бэби. Производится в виде порошка, разрешён к приёму с 4 месяцев. В составе 9 штаммов пробиотических бактерий и фруктоолигосахариды.
- Нормобакт L. Выпускается в виде порошков, которые включают в свой состав лактобактерии и фруктоолигосахариды. Разрешён к применению с 1 месяца.
- Нормоспектурм. Выпускается в виде капсул и порошков. В состав входят бифидо- и лактобактерии, инулин, олигофруктоза.
- Бифистим. Производится в жевательных таблетках и порошках. В составе находятся: бифидо- и лактобактерии, инулин, олигофрутоза, пектин и витамины.
- Бифидумбактерин 1000. Препарат представляет собой комбинацию из лактулозы и бифидобактерий.
- Бифилар. Средство содержит сразу несколько видов микроорганизмов (лактобактерии и бифидобактерии), а также фруктозные олигосахариды.

Есть ли противопоказания?
Пробиотики и пребиотики являются практически безвредными препаратами. Единственным противопоказанием к их применению является индивидуальная непереносимость какого-либо компонента препарата. Например, у многих пациентов может быть аллергическая реакция на введение пребиотиков, в состав которых входят углеводы. При выраженной гиперчувствительности рекомендуется подобрать другой пребиотик или заменить его на пробиотическое средство.
Рекомендации по применению препаратов
Универсальной схемы приема пробиотиков не существует. Для каждого препарата существуют свои рекомендации по использованию – время приема, дозировки, продолжительность курса лечения. Особенности применения лекарства зависят также от того заболевания, которое вызвало дисбактериоз, а также от особенностей его течения.
При острых состояниях (выраженном диарейном синдроме) назначается большая дозировка препаратов. Срок лечения при этом минимальный – примерно 1-2 недели. При хронических состояниях (постоянном поносе, нарушении перистальтики, присоединении метеоризма) лечение проводится малыми дозами. При этом продолжительность терапии довольно большая: препараты назначаются минимум на срок от 1 до 3 месяцев. Отменять их можно только после нормализации состояния кишечника.
Осторожно стоит назначать препараты пациентам, которые имеют повышенную склонность к аллергическим реакциям. Им лекарство назначается в минимальной дозировке, которая последовательно увеличивается до оптимальной. Отдельно определяется прием лекарства для детей. Обычно им назначается ½ или ¼ взрослой дозировки.
Можно ли принимать препараты для профилактики?
Препараты из групп пробиотиков и пребиотиков могут использоваться для профилактики дисбактериоза. Однако бесконтрольно принимать их, не консультируясь со специалистами, не рекомендуется.
 Вреда от назначения лекарств не будет, но и польза в некоторых случаях сомнительная. Человек с нормальной микрофлорой кишечника не нуждается в заселении новыми полезными бактериями, входящими в состав пробиотиков. Это же касается и пребиотиков. Человеку без нарушений в составе микрофлоры достаточно будет употреблять продукты питания, которые благоприятно влияют на микроорганизмы пищеварительной системы (см. ниже). От грамотно подобранного рациона в этом случае будет больше пользы, чем от лекарственных средств.
Вреда от назначения лекарств не будет, но и польза в некоторых случаях сомнительная. Человек с нормальной микрофлорой кишечника не нуждается в заселении новыми полезными бактериями, входящими в состав пробиотиков. Это же касается и пребиотиков. Человеку без нарушений в составе микрофлоры достаточно будет употреблять продукты питания, которые благоприятно влияют на микроорганизмы пищеварительной системы (см. ниже). От грамотно подобранного рациона в этом случае будет больше пользы, чем от лекарственных средств.
Профилактика дисбактериоза пробиотиками показана при высоком риске развития дисбактериоза кишечника. Например, если человек прошел продолжительный курс антибактериального лечения, то стоит подобрать подходящий препарат полезных бактерий и пройти курс приема. Использование специализированных лекарств оправдано после перенесения тяжелых кишечных инфекций, которые являются факторами риска в развитии дисбактериоза.
Пробиотики и пребиотики в продуктах питания
- Фрукты: цитрусовые, яблоки, авокадо, ананасы, бананы, дыни, груши, чернослив.
- Овощи: батат, помидоры, зеленый горошек, морковь, свекла.
- Крупы: бобы, рожь, ячмень, коричневый рис.
- Специи: корица, семена аниса, имбирь, куркума.
- Молочные продукты: мягкий сыр, пахта, кефир.
что это такое, в чем разница
1446 Просмотров 0Если вы думаете, что здоровье кишечника — это всего лишь очередное новомодное увлечение, тогда посмотрите на эту статистику: производство пробиотиков, выпускаемых в виде добавок, йогуртов и прочее, оценивается в 504 миллиона долларов США и, по прогнозам, эта цифра будет только расти. На чем базируется эта вся шумиха вокруг полезных бактерий? Стоит ли принимать пробиотические добавки или это просто пустая трата денег?

Что такое пробиотики?
Это дружественные микроорганизмы, которые живут в тонком кишечнике и выстилают собой весь пищеварительный тракт. Там они поглощают питательные вещества из еды, синтезируют определенные витамины, создают ферменты и производят жирные кислоты с короткими цепями.
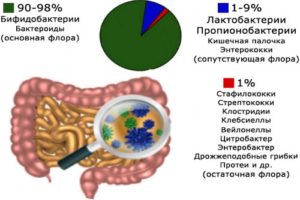
Миллионы этих полезных бактерий, что примерно в десять раз больше общего количества клеток в организме, работают для того, чтобы поддерживать здоровье человека на оптимальном уровне.
Откуда берутся эти микроорганизмы? При рождении ребенка его желудочно-кишечный тракт абсолютно стерилен. При попадании в организм микроорганизмов матери и из окружающей среды кишечник ребенка начинает заполняться полезными микроорганизмами.
Типы бактерий, которые населяют желудочно-кишечный тракт, зависят от множества факторов, в том числе от того, были ли роды естественными или нет, гестационного возраста, типа вскармливания младенца (грудное молоко/ молочная смесь), уровня санитарии и воздействия антибиотиков.
По данным исследований кишечник новорожденного характеризуется небольшим разнообразием кишечных бактерий. Однако к концу первого года жизни микрофлора кишечника уникальна, как отпечаток пальца человека. Исследователи отмечают, что уже к 2.5 годам микрофлора кишечника ребенка полностью напоминает нормальную флору взрослого человека по составу.
Для взрослого человека крайне важно иметь выносливую и разнообразную по составу колонию пробиотиков в желудочно-кишечном тракте, поскольку он играет значимую роль в поддержании стабильного эмоционального состояния, функционировании иммунной системы, выработке энергии и пищеварении.
Есть несколько способов укрепить здоровье кишечника с помощью правильного рациона питания, либо приема недорогих пробиотических добавок, контролируя при этом уровень стресса и активно занимаясь спортом.

Как пробиотики влияют на здоровье?
Изучение природных пробиотиков и здоровья желудочно-кишечного стремительно развивается, поскольку все больше внимания уделяется микробиому и влиянию кишечника на общее состояние здоровья.
По словам доктора Джошуа Акс они могут укреплять иммунную систему, предотвращать и лечить инфекции мочевыводящих путей, улучшать пищеварение, снижать симптомы гриппа и простуды, лечить воспалительные заболевания кишечника, контролировать экзему и другие проблемы с кожей, а также справляться с депрессией и некоторыми расстройствами настроения.
В кишечнике есть как полезные, так и вредные микроорганизмы. Доктор Акс и другие специалисты в данной области отмечают, что соотношение должно быть примерно таким: 85% хороших и 15% вредных бактерий. Когда этот баланс нарушается, может возникнуть дисбактериоз или дисбаланс бактерий, дрожжей или грибков. И прием добавок внутрь в данный период может помочь вернуть правильное соотношение.
Ученые обнаружили, что добавки лучше всего работают после того, как кишечные бактерии были скомпрометированы, например, после курса антибиотиков.

Нужно ли принимать добавки с пробиотиками и пребиотиками?
Крайне важно питать полезные бактерии в толстом кишечнике. Можно начать с основ здорового питания, уделяя основное внимание свежим, органическим овощам и фруктам, избегая при этом обработанную пищу, сладкие продукты и напитки.
Однако из-за постоянной спешки современному поколению в крайне сложно питаться правильно и регулярно, еще сложнее потреблять достаточное количество ферментированных продуктов и продуктов с высоким содержанием клетчатки. Именно поэтому добавки могут стать прекрасным дополнением к рациону питания при их дефиците и для восстановления дисбаланса микроорганизмов в толстой и тонкой кишке. Исследования показали, что лучшими пребиотическими добавками являются те, в составе которых есть два типа клетчатки, получаемых из корня цикория: инулин и олигофруктоз (не сахар). Такие лекарственные препараты питают полезные микроорганизмы толстой кишки, хорошо приживаются и препятствует росту нежелательной микробиоты.
Показанием к приему пробиотических добавок является пройденный курс или несколько курсов антибиотиков, чувство слабости или истощения, или соблюдение диеты, в которой не хватает фруктов, овощей, бобовых, цельных зерен и ферментированных продуктов.
Но прежде чем начать принимать любые добавки необходимо поговорить со своим врачом. Хотя в большинстве случаев противопоказанием к их приему является лишь индивидуальная непереносимость.
При поиске пробиотика знайте, что не все бутылочки с микроорганизмами одинаковы. Обычно они продаются в аптеках или продуктовых магазинах, хранятся в прохладном месте. Ищите дешевые добавки, содержащие 15–100 млрд. организмов и не менее 10–30 различных штаммов микроорганизмов. Скорее всего тратиться на добавки не придется, если вы питаетесь сбалансированно, то есть в рационе присутствуют овощи, фрукты, цельные зерна, бобовые, фасоль, мясо и яйца, а также ферментированные продукты, такие как кимчи, йогурт, кефир и квашеная капуста. На самом деле, поддержание здоровья кишечника этими полезными ферментированными продуктами может улучшить его работу и состав бактерий в нем. В таком случае таблетки даже не нужны будут.
Если вы чувствуете себя хорошо, принимая пробиотические добавки — тогда отлично. Если нет, тогда лучше заняться своим рационом питания и добавить в него побольше ферментированных продуктов.
Пробиотики и пребиотики
Хотя пребиотики и пробиотики звучат почти одинаково, эти добавки очень разные и играют разные роли в пищеварительной системе (или кишечнике).
- ПРЕБИОТИЧЕСКИЕ ВОЛОКНА — это неперевариваемая часть таких продуктов, как бананы, лук и чеснок, топинамбур, кожура яблок, корень цикория, бобы и многие другие. Пребиотические волокна проходят через тонкую кишку непереваренными и ферментируется в толстой кишки.
Этот процесс ферментации питает полезные колонии бактерий, включая пробиотические, и помогает увеличить их количество в пищеварительной системе, что улучшает здоровье и снижает риск заболеваний.
- ПРОБИОТИКИ — это живые полезные бактерии, которые создаются естественным образом в процессе ферментации в таких продуктах, как йогурт, квашеная капуста, мисо-суп, кимчи и другие.
Они также доступны в виде жидких и порошкообразных добавок и в качестве дополнительного ингредиента в таких продуктах, как йогурт, кефир и различные закваски.
Кефир — это молочный ферментированный напиток, который является самым богатым источником пробиотиков. По словам диетолога Жаннетт Хайд он содержит лактобациллы и бифидобактерии в больших количествах, а также более 50 других типов бактерий. Когда вы пьете кефир, который имеет консистенцию питьевого йогурта, эти бактерии проходят через пищеварительный тракт, чтобы осесть в толстой кишке. Хотя многие виды бактерий относятся к пробиотикам, большинство из них разделяют на две группы:
- Лактобактерии — самый распространенный пробиотик, содержащийся в йогурте и других ферментированных продуктах. Помогает при диарее и тем, кто не может переваривать молочный сахар (лактозу).
- Бифидобактерии — также содержится в некоторых молочных продуктах. Может ослабить симптомы синдрома раздраженного кишечника (СРК) и связанных с ним состояний. Естественно присутствующие в толстой кишке бифидобактерии борются с вредными бактериями в желудочно-кишечном тракте, предотвращают запоры и стимулируют иммунную систему. Кроме того, они помогают снизить в кишечнике концентрацию некоторых канцерогенных веществ.

Для понимания разницы между пребиотиком и пробиотиком представим сад. Так вот семена — это пробиотические бактерии, тогда как пребиотическое волокно — это вода и удобрение, которые помогают семенам расти и цвести.
И пробиотики, и пребиотики добавляют в некоторые смеси и продукты детского питания для улучшения здоровья кишечника.
Преимущества пробиотиков
Полезные свойства пробиотиков доказаны многочисленными исследованиями. Врачи часто рекомендуют пробиотики в форме добавок пациентам, принимающим антибиотики, чтобы восстановить правильное соотношение полезных и вредных микроорганизмов, поскольку антибиотики убивают и те, и другие.
Пробиотики могут бороться с побочными эффектами от приема лекарств для желудочно-кишечного тракта и снижают рост бактерий, приводящий к дрожжевым инфекциям. Поскольку каждый организм индивидуален, необходимо прежде всего определить, какие пробиотики будут полезны именно вам. Кроме того, важно убедиться, что микроорганизмы в пробиотических добавках живы, так они крайне чувствительны к кислотной среде желудка, теплу и временным рамкам.
«Самое большое влияние на состояние слизистой оболочки кишечника и здоровье микробиома оказывает питание, за которым необходимо регулярно следить». Джанетт Хайд, ведущий диетолог, доктор биологических наук, комментатор BBC.
Преимущества пребиотиков
Исследователи обнаружили, что пребиотики помогают увеличить количество полезных микроорганизмов в кишечнике, которые снижают риск заболеваний и улучшают общее самочувствие. Пребиотическое волокно очень прочное, поэтому оно менее подвержено воздействию тепла, желудочной кислоты или времени.
Увеличение потребления пребиотических волокон поддерживает иммунитет, здоровье пищеварительной системы, мозга, плотность костей, нормализует стул.
Сравнение пробиотиков и пребиотиков
В таблице ниже приведено сравнение про- и пребиотиков
| ПРЕБИОТИКИ | ПРОБИОТИКИ |
| Это особая форма пищевых волокон, которая действует как удобрение для полезных бактерий в кишечнике. | Это живые бактерии, которые можно найти в йогурте и других ферментированных продуктах. Существуют сотни видов этих микроорганизмов. |
| Добавки в виде порошка не подвержены воздействию тепла, холода, желудочного сока или времени. | Пробиотические бактерии должны оставаться живыми, чтобы быть активными. Они могут погибнуть от жары, желудочного сока или просто умереть со временем. |
| Они питают полезные бактерии, которые уже есть в кишечнике. | Они должны конкурировать с более чем 1000 видов бактерий, уже находящихся в кишечнике. |
| Добавки с пребиотиками помогают при расстройствах пищеварения, ожирении и потере костной массы. | Некоторые пробиотические бактерии полезны при детской диарее, болезни раздраженного кишечника и при рецидиве некоторых инфекций кишечника. |
Какая пища поможет увеличить количество полезных бактерий?
Как обсуждалось ранее, ферментированные продукты, такие как квашеная капуста, кефир и йогурт, являются богатыми источниками пробиотических бактерий, которые попадают непосредственно в кишечник.
Увеличивая общее суточное потребление клетчатки, вы также увеличите количество пребиотического волокна, которое является пищей для пробиотиков и других полезных штаммов бактерий в кишечнике.
Таблица ниже включает в себя продукты с высоким содержанием пребиотической клетчатки.
Список продуктов, богатых пребиотической клетчаткой:
| Корень цикория
| Около 65% корня цикория состоит из клетчатки и является чрезвычайно богатым источником пребиотических волокон. |
| Лук и чеснок
| ½ стакана содержит 2 грамма (17%) пребиотического волокна |
| Овсяные хлопья
| ½ стакана содержит 2 грамма (17%) пребиотического волокна |
| Белый хлеб с пшеничными отрубями
| 1 ломтик содержит 1 грамм клетчатки. Почти 70%от общего содержания клетчатки приходится на пребиотическое волокно. |
| Спаржа
| 2-3 грамма преобиотической клетчатки на порцию 100 грамм (полстакана) |
| Листья одуванчика
| 4 грамма клетчатки на порцию 100 грамм (полстакана) |
| Топинамбур
| 2 грамма на порцию в 100 грамм (полстакана), 76% из них приходится на инулин (пребиотическое волокно) |
| Перловка
| 3-8 грамм преобиотического волокна на порцию 100 грамм (полстакана) |
| Яблоко с кожурой
| 2 грамма клетчатки на пол-яблока (в основном в кожуре) приходится на пектин, который обладает пребиотическими свойствами и составляет около 50% от общего количества клетчатки в яблоке |
Когда лучше всего начинать принимать добавки?
Добавки с пребиотиками и пробиотиками лучше всего принимать регулярно. Обе можно принимать одновременно, причем ежедневно. Мы рекомендуем принимать их в одно и то же время каждый день. И ваш микробиом будет вам благодарен!
Источник:
- https://www.organicauthority.com/energetic-health/do-you-really-need-to-take-a-probiotic-supplement
- https://www.prebiotin.com/prebiotin-academy/what-are-prebiotics/prebiotics-vs-probiotics/
Пробиотики и пребиотики — обволакивающие препараты с бактериями для желудка и кишечника

Кишечная микрофлора — важная составляющая здорового организма. Хотя до сих пор сложно с точностью установить, каким должен быть “нормальный” ее состав. Принято считать, что из 400 видов микробов, живущих в пищеварительных органах человека, вредоносных должно быть не более 15%.
Нужны ли для нашего желудка и кишечника дополнительные препараты, содержащие живые бактерии, можно ли выбрать хорошие пробиотики, ориентируясь на одно лишь название лекарств, и какие из них составят список лучших в зависимости от влияния на микрофлору ЖКТ.
Состав микрофлоры
Человек может носить в себе до 3 килограмм микроорганизмов. Причем их концентрация увеличивается с верхних отделов ЖКТ к нижним. Так, желудок — наименее “населенный” орган, в основном здесь встречаются стрептококки.
Тонкий кишечник, отвечающий за первичное всасывание, является домом для дрожжеподобных грибков, бифидобактерий, бактероидов, палочковидных бактерий (в частности Escherichia coli, или кишечная палочка), которые нам нужны для:
- борьбы с чужеродными бактериями, попадающими в кишечник из желудка вместе с пищей;
- поглощения поступающего кислорода, губительного для анаэробных микроорганизмов толстого кишечника.
В толстом кишечнике не только происходит окончательное расщепление пищи на микроэлементы, но и вытягивание из поступающих масс воды для дальнейшей ее транспортировки по всему человеческому телу. Наиболее многочисленными жителями органа являются лактобактерии (Lactobacillus), бифидобактерии (Bifidobacteria) и бактероиды.
Полезные микробы незаменимы для нормального функционирования желудка и кишечника, ведь они:
- защищают стенки внутренних органов;
- оказывают помощь в расщеплении и усвоении пищи;
- активно участвуют в обмене веществ, продуцируя витамины и аминокислоты, нормализуя уровень холестерина;
- ведут борьбу с микробами-вредителями и составляют основу нашей иммунной системы.
К нарушению баланса между благотворными и патогенными микроорганизмами может приводить ряд причин, в результате которых создаются условия для развития дисбактериоза:
- длительный прием антибиотиков;
- кишечные инфекции;
- хирургические операции на органах брюшной полости;
- неправильное питание;
- ослабление иммунитета.
Появляется необходимость не только в корректировке питания, но и в дополнительном приеме препаратов, содержащих живые бактерии для нормального функционирования пищеварительных органов.
Пробиотики и пребиотики для кишечника
В чем функциональное различие этих лекарственных средств. Первые в большом количестве содержат микроорганизмы, препятствующие размножению микробов-вредителей. Вторые — не являются микробными, способствуют восстановлению здоровой микрофлоры. Различают несколько видов лекарств в зависимости от основы.
Кишечные препараты с лактобактериями
Форма выпуска: таблетки — Лактобактерин, капсулы — Лацидофил, Регулин, или детские капли Рела Лайф, жидкость — Эуфлорин-L, порошок — Биобактон, Наринэ, Ацилакт. Последний представлен также в виде ректальных свечей, которые оказывают местное действие, не снижая активности полезных микроорганизмов.
Возможно сочетание пробиотиков из данного списка с антибактериальными средствами. Являясь монопрепаратами (включающими в свой состав только 1 активный фермент), они не могут быть использованы для всестороннего лечения в тяжелых случаях дисбактериоза.
Препараты на основе бифидобактерий
Нельзя сказать, что это самые лучшие пробиотики для здоровья кишечника, однако их применение очень распространено и является оптимальным. За счет широкого спектра действия их использование оправдано для быстрого восстановления внутренней среды пищеварительного тракта.
Линейка представлена большим разнообразием средств, выпускаемых в различных формах: порошкообразной — Пробифор, Бифинорм, жидкой — Эуфлорин-В, таблеторной — Бифидумбактерин форте (одновременный прием которого с антибиотиками строго противопоказан). Последний существует и в виде свечей, и в виде концентрированной взвеси.
Для детей, не достигших трех лет, без назначения терапевта таблетки и ректальные свечи не применяют.
Лакто- и бифидобактерии
Флорин Форте — порошкообразный пробиотик, подходящий для профилактики и лечения дисбактериоза независимо от возраста. Применяют его во время еды. Младенцам, находящимся на грудном вскармливании, рекомендуют растворять препарат в молоке.
Условия хранения — холодильник (при температуре от 0 до 10 градусов). Назначается средство врачом при отсутствии одновременного приема некоторых антибиотиков.
Линекс, кроме сочетания бифидо- и лактобактерий, включает еще энтерококки, которые являются постоянными жителями здоровой микрофлоры. Линекс используют во время антибактериальной терапии, он практически не имеет ограничений — подходит и для беременных, и кормящих матерей, а также для грудничков. А хранить лекарство можно и при комнатной температуре.
Медикаменты данной группы включают в свой состав биологически активные вещества — эубиотики, действие которых может спровоцировать аллергию. В категорию риска попадают и лица, страдающие иммунодефицитом. Прием данных препаратов необходимо начинать только после консультации с врачом.
Бифидобактерии в совокупности с другими микроорганизмами
Сюда входят такие лекарственные вещества, как:
- порошкообразный Бификол (его состав также обогащен кишечной палочкой), препарат несовместим с антибиотиками;
- капсулы Бифиформа с бактериями-энтерококками. Капсульная форма позволяет доставить препарат непосредственно в кишечник без растворения в кислой среде верхних отделов ЖКТ. Возможно применение лекарства с антибактериальными препаратами. Без консультации с врачом запрещено лечение Бифиформом детей младше двух лет.
Фармацевтические пробиотические препараты бывают сухие и жидкие. Сухая форма – высушенные миркроорганизмы, которые активизируют свою деятельность в нашем организме через несколько часов после приема. Такие лекарства представляют собой порошки, таблетки или капсулы.
Живые бактерии, находящиеся в жидкой форме, “включаются” сразу после проникновния в ЖКТ или нанесения на кожные и слизистые покровы. В качестве примера можно привести такие лекарственные названия — Трилакт (лактобактерии), Бифидум, Биовестин, Флористин (бифидобактерии), Нормофлорин.
Препараты содержат не только живые микроорганизмы, но и питательную среду для их жизнедеятельности. Возможно применение этих лекарств внутрь и наружно, использование в качестве полосканий и закапываний.
Пребиотические средства
Наиболее популярным препаратом, регулирующим баланс кишечной микрофлоры, является Хилак Форте, обогащенный лактобактериями. Для восстановления нормального уровня кислотности органов ЖКТ в состав препарата включена молочная кислота.

Хилак Форте способствует и нормализации водного баланса в организме, а за счет обволакивающего эффекта данный препарат является прекрасным защитным средством для слизистой желудка и кишечника. Лекарство можно принимать в любом возрасте и в сочетании с антибиотиками.
Список пребиотиков на основе лактулозы
Данные препараты используются для нейтрализации патогенных микроорганизмов в толстом кишечнике за счет расщепления фруктозо-галактозного дисахарида и образования органических кислот малой молекулярной массы. Лактулоза является благоприятной средой для размножения собственных бифидо- и лактобактерий.
- Лактусан
- сиропы Дюфалак, Ромфалак, Нормазе;
- порошкообразный Дюфалак;
- Прелаксан;
- Порталак.
Медикаменты безопасны для беременных, кормящих и детей. С осторожностью и только после врачебного назначения применяют для лечения пациентов, страдающих аллергией на фруктозу, кровотечениями или непроходимостью прямой кишки.
Читайте также: симбиотики и синбиотики
Список данных пробиотиков и пребиотиков может быть дополнен пищевыми продуктами, положительно влияющими на состояние микрофлоры кишечника:
- некоторые кисломолочные продукты содержат лактулозу;
- кефир, йогурты, сыворотка, закваски, простокваша, ряженка обогащены бифидобактериями даже при традиционном способе производства;
- творог и сыр;
- продукты из сои — тофу (соевый сыр), соевый соус, темпе;
- квашеная капуста;
- домашний хлеб на закваске;
- квашеные и соленые блюда без добавления уксуса — помидоры, огурцы, яблоки;
- свежие овощи и фрукты (бананы, артишоки, репчатый лук).
В период восстановления организма после перенесенных кишечных инфекций, язвенных поражений и других заболеваний, приведших к повреждению слизистой, рекомендуется:
- слизистый настой из семени льна, овсяная каша или овсяный кисель, которые мягко защищают оболочку органов ЖКТ;
- препараты, снижающие кислотность желудка (только в случае врачебной рекомендации!) — Альмагель, Гастал, Де-Нол.
Лучшим пробиотик или пребиотик будет считаться в зависимости от недуга, которым страдает человек, условий лечения, принимаемых лекарственных средств, конкретных особенностей организма. Как не существует универсального медикамента, так нет и универсального про- и пребиотического препарата. Вот почему терапию не начинают без посещения специалиста.
Пробиотические бактерии влияют на состав и функцию кишечной микробиоты
Пробиотики имеют ряд предлагаемых преимуществ для здоровья потребителя, которые могут включать регулирование уровней полезных элементов в микробиоте. Недавние исследования с использованием молекулярных подходов выявили микробиоту кишечника человека, включающую более 1000 филотипов. Механизмы воздействия пробиотиков на кишечную микробиоту включают конкуренцию за субстраты, прямой антагонизм со стороны ингибирующих веществ, конкурентное исключение и потенциально опосредованные хозяином эффекты, такие как улучшение барьерной функции и изменение иммунного ответа.Теперь у нас есть инвентаризация микробов и генетические планы, позволяющие приступить к изучению микробной экологии кишечника на беспрецедентном уровне детализации, чему способствует понимание того, что пищевые компоненты могут по-разному использоваться отдельными филотипами. Необходимы контролируемые интервенционные исследования на людях с использованием новейших молекулярных технологий для обобщения данных о видах бактерий, влияющих на микробиоту. Механистическое понимание должно быть обеспечено метаболомикой и другими аналитическими методами для малых молекул.Строгая характеристика взаимодействий между диетой, микробиотой и пробиотическими бактериями откроет новые возможности для изменения микробиоты в целях улучшения здоровья человека.
История микробиологической в исследованиях преобладали исследования возбудителей инфекционных заболеваний человека. болезнь. На основе стремления культивировать, охарактеризовать и понять механизмы патогенности этих организмов, несколько столетий микробиологические исследования завершились разработкой широкого спектра противомикробных терапии, вакцины и иммунизации.В последние годы аналогичные были применены аналитические методологии для облегчения эксплуатации бактерии для промышленного применения. Две смежные отрасли микробиологии — экологическая микробиологии, а также изучение кишечных комменсалов (ответвление первой в чистейшие термины) — отставал до относительно недавнего времени. С середины 1990-х годов целый ряд методов позволял микробиологи-экологи для выявления почвенных микроорганизмов на месте , не прибегая к культура, основанная на пробах гена малой субъединицы РНК рибосом.Естественный расширение этого подхода заключалось в секвенировании большого количества клонированных рибосомных Ампликоны генов РНК, дающие каталоги всех организмов (микробиота) присутствует в сложных образцах. В последнее время область метагеномики предоставила технические подходы к секвенированию больших фракций всей микробной ДНК присутствует в экологической системе. В сочетании с применением молекулярных инструменты для изучения комменсальных бактерий, многие из которых изначально были разработаны для изучения патогенов теперь существует захватывающая связь между технологиями и исследовательские центры, с помощью которых комменсальные бактерии могут быть изучены в контексте кишечные экосистемы.В этом обзоре будут обобщены все, что известно об эффекте. внесения пробиотических бактерий на состав и активность микробиоты, с акцентом на недавние исследования с использованием методов, не зависящих от культуры. В Обсуждаются вероятные механизмы, посредством которых комменсалы оказывают свое влияние, и намечаются направления будущих исследований.
2. Концепции пробиотиков и пребиотиков
Представление о том, что некоторые кишечные микроорганизмы могут принести пользу хозяину.
.Есть ли роль пробиотиков в заболеваниях печени?
Кишечная микробиота играет важную роль в здоровье и болезнях. Изменение его здорового гомеостаза может привести к развитию многочисленных заболеваний печени, включая осложнения цирроза печени. С другой стороны, восстановление и модуляция кишечной флоры с помощью пробиотиков потенциально является новой терапевтической стратегией. Появляется все больше доказательств того, что пробиотики эффективны при лечении скрытой и явной печеночной энцефалопатии, а также в профилактике рецидивов энцефалопатии.Благоприятный эффект пробиотиков распространяется также на функцию печени при циррозе, неалкогольной жировой болезни печени и алкогольной болезни печени. С другой стороны, данные о пробиотиках и портальной гипертензии скудны и противоречивы. Также не было показано, что терапия пробиотиками предотвращает первичный или вторичный спонтанный бактериальный перитонит. Прежде чем пробиотики можно будет рекомендовать в качестве средства лечения заболеваний печени, необходимы более масштабные клинические исследования.
1. Введение
Пробиотики определены Всемирной организацией здравоохранения как живые микроорганизмы, приносящие пользу здоровью хозяина при введении в адекватных количествах [1].Концепция пробиотиков не нова. Более века назад лауреат Нобелевской премии Эли Мечников предположил, что долгая жизнь болгарских крестьян была результатом потребления ими кисломолочных продуктов [2]. Он продолжил вводить в свой рацион кислое молоко, ферментированное бактериями, которые он назвал «болгарскими бациллами», и обнаружил, что его здоровье улучшилось [3]. На самом деле, практика использования пробиотиков в повседневной жизни для улучшения здоровья существует уже тысячелетия. Даже в Древней Греческой и Римской империях настоятельно рекомендовалось употребление сыра и ферментированных продуктов [4].Хотя термин «пробиотик» был приписан Лилли и Стиллвеллу [5], которые в 1965 году описали пробиотики как микроорганизмы, которые действуют на другие микроорганизмы, современная терминология и определение пробиотиков были придуманы Паркером [6], который в 1974 году определил пробиотики как организмы. и вещества, которые оказывают благотворное влияние на животное-хозяина, способствуя его микробному балансу в кишечнике. Потребление пробиотиков современной эпохи было преобладающим на протяжении десятилетий, даже до того, как была установлена правильная терминология.Еще в 1930 году Широта в Японии начал культивировать молочнокислые бактерии (штамм Lactobacillus casei Shirota), которые он впоследствии представил на рынке как Yakult в 1935 году [7]. Сегодня Yakult продается в 33 странах, и ежедневно потребляется 30 миллионов бутылок.
В этом обзоре использования пробиотиков и заболеваний печени основное внимание уделяется следующим аспектам: профилактика инфекций, печеночная энцефалопатия, функция печени при циррозе, неалкогольная жировая болезнь печени, алкогольная болезнь печени и портальная гипертензия.
2. Микрофлора кишечника
Между печенью и кишечником существует тесная взаимосвязь — так называемая ось печени-кишечника. Кишечник снабжает кровью портальную систему, а содержимое кишечной крови активирует функции печени. С другой стороны, печень выделяет желчь и влияет на функцию кишечника [8].
Микрофлора кишечника образует сложную экологическую систему. В нем содержится большое количество микробов весом более 1 кг. Это количество в 10 раз превышает количество клеток в организме человека.Микробное сообщество кишечника состоит из более чем 500 видов, большинство из которых не культивируются, а многие еще предстоит идентифицировать. Микрофлора кишечника содержит как бактерии, закрепленные в кишечнике (автохтонные, резидентные), так и бактерии, которые проходят только через кишечник (временные аллохтонные) [9]. Большинство бактерий в кишечнике образуют анаэробный биореактор, который помогает переваривать сложные полисахариды и синтезирует питательные микроэлементы, включая витамины и короткоцепочечные жирные кислоты.Продукты ферментации этих бактерий могут обеспечивать до 10% дневной энергии, необходимой человеку [10].
Микрофлора кишечника выполняет множество важных физиологических функций. Он производит витамины, разлагает желчные кислоты, переваривает питательные вещества и образует важный барьер против патогенов, создавая местный и общий иммунитет [11].
У пациентов с циррозом печени хорошо известна аномальная колонизация тонкой кишки кишечными бактериями. По крайней мере, у 50% наблюдается избыточный бактериальный рост в кишечнике.Это по сравнению со здоровыми людьми, у которых в тонком кишечнике лишь небольшое количество этих бактерий. Считается, что основными причинами являются гипохлоргидрия, снижение секреции IgA, снижение перистальтики кишечника и недоедание. В клинических условиях было показано, что фармакологическое увеличение перистальтики тонкого кишечника с помощью цизаприда снижает избыточный бактериальный рост у пациентов с циррозом [12]. При такой тесной взаимосвязи между печенью и флорой кишечника неудивительно, что многие постулируют роль кишечного барьера в патогенезе заболеваний печени и их осложнений.
3. Бактериальная транслокация
Бактериальная транслокация определяется как миграция бактерий из просвета кишечника в мезентериальные лимфатические узлы других внекишечных участков [13]. Наиболее эффективными бактериями для транслокации в мезентериальные лимфатические узлы являются грамотрицательные представители семейства Enterobacteriaceae, такие как Escherichia coli и Klebsiella spp, энтерококков и другие стрептококков видов [14]. В исследовании на животных распространенность бактериальной транслокации в брыжеечные лимфатические узлы составляет около 40% у циррозных крыс с асцитом [15] и около 80% у таких животных со спонтанным бактериальным перитонитом [16].Имеющиеся данные свидетельствуют о том, что бактерии, выделенные из мезентериальных лимфатических узлов, генетически идентичны штаммам, вызывающим спонтанный бактериальный перитонит (SBP) у того же животного [17]. У пациентов, перенесших трансплантацию или резекцию печени, положительная культура брыжеечных лимфатических узлов на кишечные бактерии была обнаружена почти у 31% пациентов с циррозом класса C по Чайлд-Пью, что в 5 раз выше, чем у пациентов с классом A или B по Чайлд-Пью [18]. У пациентов с циррозом печени, перенесших частичную гепатэктомию, почти у 20% была обнаружена положительная культура мезентериальных лимфатических узлов, и большинство послеоперационных инфекций были вызваны теми же бактериями [19].
Бактериальная ДНК обнаруживается примерно у одной трети пациентов с циррозом печени с портальной гипертензией и асцитом, отрицательным по культуре, причем Escherichia coli являются наиболее часто определяемыми видами бактерий [20]. Наличие бактериальной ДНК связано с повышенным локальным уровнем провоспалительных цитокинов, что может быть клинически значимым [21]. Также постулируется, что эндотоксемия увеличивает давление в воротной вене и ухудшает гемостаз [22], а также способствует индукции кровотечения из варикозно расширенных вен [23].
Патогенез бактериальной транслокации при циррозе печени сложен. Помимо чрезмерного бактериального роста в кишечнике, циррозы также проявляют изменения в слизистой оболочке кишечника и кишечном иммунитете. Оксид азота способствует морфологическим изменениям стенки кишечника, поскольку он расширяет плотные соединения в культивируемых эпителиальных клетках кишечника [24]. Это представляет собой нарушение первой линии защиты слизистой оболочки от параклеточной абсорбции и, следовательно, повышенный потенциал бактериальной транслокации.Расширение межклеточного пространства ниже плотных контактов, которое является второй линией защиты от параклеточной абсорбции, также происходит при циррозе [25]. Толстостенные, расширенные капилляры вместе с отеком собственной пластинки, фиброзно-мышечной пролиферацией, уменьшенным соотношением ворсинок / крипт и утолщением мышечной слизистой оболочки тонкой кишки обнаруживаются при циррозе печени [26] и, как предполагается, играют роль в бактериальной транслокации. [27]. Кроме того, нарушается иммунитет кишечника.Исследование на животных продемонстрировало повышенное количество интраэпителиальных лимфоцитов со значительным нарушением пролиферативной активности и способности продуцировать интерферон-, что коррелирует с увеличением бактериальной транслокации [28]. Подводя итог, можно сказать, что основными механизмами, ведущими к транслокации бактерий, являются избыточный бактериальный рост, дефицит местного иммунного ответа слизистой оболочки, снижение фагоцитарной активности макрофагов, а также нейтрофилов и увеличение проницаемости кишечного барьера [29 ].
4. Пробиотики: механизмы пользы
Механизмы положительного воздействия пробиотиков до конца не изучены. Однако были описаны четыре общих преимущества [30]: (1) подавление роста, связывания эпителия или инвазии патогенными бактериями [31], (2) улучшение барьерной функции кишечника [32], (3) модуляция иммунной системы. система; они включают индукцию защитных цитокинов, таких как IL-10 [33] и TGF-бета, и подавление провоспалительных цитокинов, таких как TNF [34]; также описано подавление миграции T-Helper 1 клеток [35], (4) модуляция восприятия боли в кишечнике путем индукции экспрессии микропиоидных и каннабиноидных рецепторов [36].
5. Профилактика инфекций
Спонтанные бактериальные инфекции, такие как САД и бактериемия, часто встречаются у госпитализированных пациентов с циррозом печени. Они также коррелируют с тяжестью цирроза печени. Эти инфекции связаны со значительной заболеваемостью и смертностью. Например, распространенность САД у госпитализированных пациентов с циррозом и асцитом достигает 30% [37], и, несмотря на агрессивную терапию, каждый пятый пациент все еще умирает от САД [38].
Причинная связь между бактериальной транслокацией и САД хорошо продемонстрирована [17].Использование пробиотиков в этой обстановке привлекательно из-за их способности модулировать кишечную флору, благоприятствуя защитным анаэробным организмам, а также из-за его влияния на продвижение функции кишечного барьера [39]. Добавки с пробиотиками повышают устойчивость к кишечной инфекции у мышей с дефицитом ИЛ-10 [17]. В клинических исследованиях пробиотики продемонстрировали эффективность в снижении эндотоксемии у пациентов с циррозом печени [40], которая является индикатором бактериальной транслокации, за счет снижения количества жизнеспособных количеств потенциально патогенной грамположительной и грамотрицательной кишечной флоры у пациентов с циррозом печени [41] .Пробиотики также уменьшают риск инфицирования после ортотопической трансплантации печени [42].
Текущая литература, хотя и скудная, не поддерживает идею о том, что пробиотики предотвращают возникновение САД. У крыс с циррозом и асцитом пробиотики не смогли предотвратить бактериальную транслокацию и инфекцию асцитической жидкости, несмотря на успешную колонизацию кишечника [43]. Недавнее клиническое исследование показало, что добавление пробиотиков к норфлоксацину не улучшило его эффективность в предотвращении первичного или вторичного САД или в снижении смертности у пациентов с циррозом и асцитом [44].
6. Печеночная энцефалопатия
Полученный из кишечной микрофлоры аммиак широко признан в качестве основного фактора патогенеза печеночной энцефалопатии. Фармакологическое регулирование кишечной флоры остается основой лечения в настоящее время. Это включает лактулозу и невсасывающиеся антибиотики, такие как неомицин и рифаксимин.
Еще в 1965 году была впервые подвергнута испытанию идея заселения просвета толстой кишки бактериями, не продуцирующими уреазу, в качестве лечения печеночной энцефалопатии.Неконтролируемое исследование показало, что высокие пероральные дозы Lactobacillus acidophilus могут иметь положительный эффект у пациентов с декомпенсированным циррозом и печеночной энцефалопатией [45]. Впоследствии было показано, что Lactobacillus acidophilus обеспечивает клиническое улучшение у пациентов с энцефалопатией, резистентных к одному неомицину [46]. Было показано, что пробиотики снижают уровень аммиака в сыворотке и приводят к улучшению различных нейрокогнитивных тестов, а также к улучшению психического статуса [47].
Комбинация пребиотиков и пробиотиков (симбиотический подход) улучшила минимальную печеночную энцефалопатию, а также уменьшила количество грамотрицательных микроорганизмов при декомпенсированном циррозе печени. Вторичной конечной точкой для пациентов, получавших симбиотическую терапию, было улучшение общей функции печени, измеренное по шкале Чайлд-Пью [48]. Аналогичным образом применение Bifidobacterium longum у пациентов с циррозом улучшает как минимальную [49], так и явную [50] печеночную энцефалопатию. Однако использование пробиотиков в обычной клинической практике требует дальнейших исследований.В недавнем Кокрановском обзоре сделан вывод о том, что имеющиеся в настоящее время исследования страдают от высокого риска предвзятости и игры случая [51]. Хотя пробиотики действительно снижали концентрацию аммиака в плазме, нельзя сделать вывод об их эффективности в изменении клинически значимых результатов.
Изучена эффективность пробиотиков у пациентов с компенсированным циррозом и минимальной печеночной энцефалопатией. Лечение препаратом пробиотиков, содержащим Lactobacillus acidophilus , Lactobacillus rhamnosus , Bifidobacterium longum и Saccharomyces boulardii , не привело к значительному улучшению различных параметров, оцениваемых у 52 пациентов с минимальной плацебо-патологией [энцефалопатия]. .В отличие от этих исследований, другое исследование дало противоположные результаты, демонстрирующие, что трехмесячный прием пробиотиков с VSL # 3, который представляет собой коктейль из пробиотиков, был эффективен в предотвращении HE у пациентов с циррозом, поскольку он значительно снижал уровни артериального аммиака, SIBO и время прохождения через рот вместе с увеличением психометрических показателей печеночной энцефалопатии по сравнению с исходным уровнем [53].
Была изучена роль пробиотиков во вторичной профилактике HE.По сравнению с плацебо, лечение пробиотиками давало такой же значительный положительный эффект, как и лактулоза, в уменьшении рецидивов HE в течение 12-месячного периода наблюдения [54].
7. Функция печени при циррозе
Имеющиеся исследования показывают, что терапия пробиотиками может улучшить параметры функции печени у пациентов с циррозом. В исследовании синбиотической терапии, описанном ранее [48], улучшение по классу Чайлд-Пью было зарегистрировано почти у половины пациентов, рандомизированных для приема синбиотиков.Авторы предположили, что улучшение было вторичным по отношению к снижению уровня эндотоксина в сыворотке. Аналогичные, но статистически менее надежные результаты были получены с использованием Escherichia coli Nissle [40]. Пациенты, получавшие этот пробиотик в течение 42 дней, продемонстрировали тенденцию к снижению уровня эндотоксина и улучшению показателей по шкале Чайлд-Пью, хотя они не были статистически значимыми. У пациентов с циррозом, связанных с неалкогольным стеатогепатитом, при использовании VSL # 3 наблюдалось улучшение сывороточных тестов печени, а также снижение провоспалительных цитокинов [55].
С другой стороны, у пациентов с первичным склерозирующим холангитом лечение коктейлем пробиотиков, содержащим четыре штамма Lactobacillus и два штамма Bifidobacillus , не улучшило клинических симптомов или показателей функции печени [56]. Авторы объясняют это отсутствие эффективности тем фактом, что все пациенты с ПСХ в исследовании уже находились в стадии ремиссии по ВЗК, с ограниченными возможностями для дальнейшего улучшения ВЗК и, следовательно, ПСХ. Поскольку у большинства пациентов с ПСХ имеется сопутствующее воспалительное заболевание кишечника (ВЗК) [57], токсические вещества, происходящие из воспаленного кишечника, также могут быть причиной повреждения печени и желчных путей.Уже установлено, что пробиотики полезны при ВЗК [58] и поучите [59]. Поэтому весьма вероятно, что такой же положительный эффект может распространяться и на ПСХ. Тем не менее, прежде чем можно будет сделать какой-либо вывод, необходимы более крупные клинические исследования.
8. Неалкогольная жировая болезнь печени
Исследования на животных показывают, что избыточный бактериальный рост кишечника играет важную роль в патогенезе неалкогольной жировой болезни печени (НАЖБП) [60]. Более того, у пациентов с ожирением и избыточным бактериальным ростом после операции тощего шунтирования наблюдалось быстрое ухудшение их НАЖБП [61], что указывает на причинную связь.Эндотоксемия усугубляет НАЖБП, стимулируя печеночные клетки Купфера продуцировать TNF- α , который стимулирует фиброз печени [62].
Loguercio et al. продемонстрировали улучшение сывороточных функциональных тестов печени, а также снижение провоспалительных цитокинов при цирротических заболеваниях, связанных с неалкогольным стеатогепатитом, с использованием VSL # 3 [55]. Кокрановский системный обзор 2007 г. пришел к выводу, что из-за отсутствия рандомизированных контролируемых испытаний использование пробиотиков при НАЖБП нельзя ни подтвердить, ни опровергнуть [63].После этого Solga и Diehl обследовали четырех пациентов с НАЖБП и оценили уровень жира в печени после 4 месяцев терапии VSL # 3 [64]. К сожалению, они обнаружили, что все четыре пациента испытали увеличение жира в печени, как это было измерено с помощью протонной магнитно-резонансной спектроскопии. Совсем недавно было показано, что пробиотики улучшают уровень аминотрансфераз в печени и снижают уровень липополисахаридов у пациентов с НАЖБП, хотя антропометрические параметры и факторы риска сердечно-сосудистых заболеваний остались неизменными после лечения [65, 66].В более крупном исследовании сравнивали пробиотики и фруктоолигосахариды с изменениями образа жизни при НАЖБП, причем группа пробиотиков значительно снижала TNF- α , СРБ, уровни AST в сыворотке, оценку модели гомеостаза инсулинорезистентности, эндотоксин сыворотки, стеатоз и индекс активности NASH [67 ]. Длительный прием пробиотиков может значительно снизить содержание жира в печени и аспартатаминотрансферазы сыворотки [68]. Принимая во внимание эти новые исследования, недавний метаанализ показал, что пробиотическая терапия может снизить аминотрансферазы печени, общий холестерин и TNF-α и улучшить инсулинорезистентность у пациентов с НАЖБП [69].Однако к этим выводам следует относиться осторожно, поскольку общее количество пациентов невелико, некоторые пациенты — дети, а результаты не основаны на гистологии, которая является золотым стандартом диагностики НАСГ.
9. Алкогольная болезнь печени
Алкогольный стеатогепатит и тяжелая алкогольная болезнь печени (ALD) встречаются у 30% лиц, злоупотребляющих алкоголем [70], что позволяет предположить, что другие факторы также могут играть причинную роль. Патогенез ALD — это динамичный и неизвестный процесс, характеризующийся несколькими взаимодействиями с участием иммунной системы и промежуточных продуктов метаболизма алкоголя [71].Это включает связанный с метаболизмом этанола окислительный стресс, аномальный метаболизм метионина, опосредованную этанолом индукцию утечки эндотоксинов кишечника и активацию клеток Купфера [72–74]. Хронический алкоголизм также связан с более высоким уровнем Proteobacteria (грамотрицательные бактерии, которые включают несколько патогенных видов, таких как Salmonella и Escherichia ) и более низким содержанием Bacteroidetes [75]. Возникающая в результате эндотоксемия запускает провоспалительные пути, вызывающие алкогольный стеатогепатит.
Лечение пробиотиками Escherichia coli Nissle было показано, чтобы восстановить микрофлору кишечника, включая Lactobacilli и Bifidobacilli , уменьшить эндотоксемию и улучшить функцию печени [40]. Этот положительный эффект подтвержден в другом более крупном исследовании с использованием пробиотического препарата, содержащего Bifidobacterium bifidum и Lactobacillus plantarum [76]. Новые данные также показали положительный эффект Lactobacillus casei Shirota на восстановление фагоцитарной способности нейтрофилов [77], маркера, связанного с повышенным риском инфекции и смертности при ALD [78].
10. Портальная гипертензия
Транслокация бактерий играет роль в увеличении портального давления, способствуя обострению гипердинамического состояния кровообращения и увеличению сопротивления сосудов печени [79].
С помощью измерения градиента печеночного венозного давления (HVPG) была исследована взаимосвязь между портальной гипертензией и пробиотиками. Использование дополнительных пробиотиков (VSL # 3) увеличивало скорость ответа на HVPG (процент пациентов, у которых снижение от исходного уровня ≥20% или до ≤12 мм рт.ст.) по сравнению с одним пропранололом, и было аналогично ответу на дополнительные антибиотики.Среднее снижение HVPG было больше при использовании дополнительных пробиотиков или дополнительных антибиотиков, чем при использовании одного пропранолола [80]. 6-недельное введение VSL # 3 привело к снижению HVPG, а также к улучшению системной гемодинамики, включая сердечный индекс и среднее артериальное давление [81].
Однако данные в этой области противоречивы. Два исследования с использованием VSL # 3 не снизили портальное давление у пациентов с компенсированным или декомпенсированным циррозом печени. Кроме того, не было значительных изменений в микробиоте стула, оцененных по полиморфизму длины конечных рестрикционных фрагментов, до и после терапии [79, 82].
11. Потенциальный риск
Хотя пробиотики обычно хорошо переносятся, даже среди пациентов с циррозом [77], они сопряжены с риском, особенно у пациентов с тяжелым заболеванием или с ослабленным иммунитетом. Исследование пациентов с прогнозируемым тяжелым острым панкреатитом, получавших профилактику пробиотиками с помощью коктейля из шести различных бактерий, было связано с повышенным риском смертности [83].
12. Заключение
Растет признание того, что изменение микробиоты кишечника оказывает причинное влияние на патогенез многих заболеваний печени, включая осложнения цирроза печени.Как следствие, растет интерес к использованию пробиотиков для профилактики и лечения этих состояний. Однако роль пробиотиков в этом контексте остается спорным. Новые данные обнадеживают, особенно в области печеночной энцефалопатии и НАСГ, хотя необходимы дальнейшие исследования, прежде чем пробиотики могут быть включены в соответствующие алгоритмы лечения.
Конфликт интересов
У авторов нет потенциального конфликта интересов.
.Какую роль пробиотики играют в искоренении Helicobacter pylori? Текущие знания и продолжающиеся исследования
С ростом глобальной распространенности устойчивости к антибиотикам скорость уничтожения Helicobacter pylori (HP) продолжает снижаться. Пробиотики полезны для здоровья человека и могут быть дополнительной терапией для увеличения скорости эрадикации HP, снижения побочных эффектов, связанных с лечением, и уменьшения воспаления желудка, связанного с HP. Однако противоречивые результаты испытаний не позволили сделать выводы о терапевтических свойствах пробиотиков для лечения HP.Механизмы действия пробиотиков включают выработку веществ, которые ингибируют или убивают HP или конкурируют с HP за сайт адгезии на эпителиальных клетках желудка. Пробиотики также могут снижать высвобождение воспалительных факторов, регулируя местный иммунный ответ хозяина. Мы провели поиск в доступной литературе полных статей, посвященных роли пробиотиков в управлении HP. В этом обзоре представлены последние достижения в этой области.
1. Введение
Helicobacter pylori (HP) является основной причиной хронического активного гастрита, язвенной болезни, лимфомы лимфоидной ткани, связанной со слизистой оболочкой желудка, и рака желудка.Диспепсия, необъяснимая анемия и идиопатическая тромбоцитопеническая пурпура также тесно связаны между собой [1]. Примерно половина всех людей имеет HP, который является наиболее частой причиной хронического гастрита во всем мире. Согласно принятому в 2015 году консенсусу в Киото, HP-гастрит является инфекционным заболеванием, и те, у кого результат теста положительный, должны получать лечение, направленное на искоренение инфекции [2]. В настоящее время ни одна схема лечения не может гарантировать 100% искоренение HP. Скорость эрадикации зависит от многих факторов, включая режим лечения, толерантность пациента к побочным реакциям, комплаентность пациента, генетический полиморфизм пациента, курение, диабет и другие факторы [3–5].Среди них устойчивость HP к антибиотикам является основной причиной неэффективности эрадикационного лечения HP [6]. Консенсус Маастрихт V / Флоренция предполагает, что в регионах, где устойчивость к кларитромицину превышает 15%, или в регионах с высокой устойчивостью к кларитромицину и метронидазолу, в качестве схемы эрадикации первой линии рекомендуется 10–14-дневная четырехкратная терапия висмутом [7]. В Северной Америке средние показатели устойчивости HP к метронидазолу, кларитромицину и левофлоксацину в период с 2009 по 2011 год составляли 20%, 16% и 31%, соответственно, изолятов [8].Недавнее исследование, проведенное в Китае, показало, что средняя частота резистентности HP к метронидазолу, кларитромицину и левофлоксацину составляет 63,8%, 28,9% и 28%, соответственно, изолятов [9]. Хотя увеличение дозы и курса антибиотиков может увеличить скорость эрадикации HP, могут быть последствия. Тяжелые побочные реакции во время терапии антибиотиками могут включать диарею, запор, вздутие живота, тошноту, боль в животе, дискомфорт в животе, дисбактериоз кишечной флоры, нарушение функции печени и грибковую инфекцию.Сообщаемая частота побочных реакций во время эрадикационной терапии колеблется от 5 до 30%, в некоторых случаях лечение прекращается. Кроме того, описана повышенная распространенность штаммов Escherichia coli , устойчивых к метициллину Staphylococcus aureus и штаммов бета-лактамаз расширенного спектра действия, выделенных из кишечника после лечения эрадикацией HP [10]. Кроме того, висмут нейротоксичен, что ограничивает его использование у детей и пожилых людей.У пациентов слизистую оболочку желудка получают с помощью гастроэндоскопии для культивирования HP для определения чувствительности к антибиотикам. Осмотрительный выбор антибиотиков по результатам тестирования лекарственной чувствительности может эффективно повысить скорость эрадикации HP. Однако суровые условия роста HP и длительный цикл роста не гарантируют успеха HP-культивирования, что препятствует широкому использованию методов HP-культивирования [11]. Методы молекулярной биологии, такие как полимеразная цепная реакция (ПЦР) и флуоресцентная маркировка нуклеиновой кислоты in situ гибридизация (FISH), могут использоваться для обнаружения участков устойчивости к HP в свежих или залитых парафином тканях слизистой оболочки желудка и фекалиях, но только к кларитромицину и хинолонам. .Сайты резистентности к метронидазолу не могут быть определены из-за задействованных сложных механизмов лекарственной устойчивости [12].
Эти проблемы побудили исследовать новые индивидуальные подходы к лечению инфекций HP. Среди появившихся многих адъювантных методов эрадикации HP — пероральная вакцина против HP [13], китайская фитотерапия [14], пробиотики и средство для удаления зубного камня [15, 16], а также средства защиты слизистой оболочки желудка [17]. Среди них пробиотики в последние годы привлекают все большее внимание из-за их безопасности.В большом количестве клинических и фундаментальных исследований сообщается, что некоторые специфические пробиотики могут повышать скорость эрадикации HP и значительно снижать побочные реакции во время лечения эрадикацией, что способствует лучшему соблюдению пациентом режима терапии [18–20]. Эти качества, по-видимому, должны сделать пробиотики многообещающим адъювантным лечением.
Однако, согласно консенсусу, достигнутому в Торонто 2016 г., недостаточно доказательств того, что добавление пробиотиков может увеличить скорость эрадикации HP и снизить побочные реакции [21].В клинических рекомендациях ACG от 2017 года, основанных на данных метаанализа, сообщается, что пробиотики действительно могут увеличить скорость эрадикации HP и снизить общую частоту побочных реакций. Однако исследования, включенные в метаанализ, в основном были клиническими испытаниями, проведенными в Китае, и имели высокий риск систематической ошибки. Таким образом, в настоящее время нет заключения о наилучшем выборе пробиотиков, а также о дозе и курсе лечения [8]. В пятом консенсусном мнении китайских HP указано, что вывод о том, что некоторые штаммы пробиотиков могут облегчить побочные эффекты со стороны желудочно-кишечного тракта после эрадикации HP, широко распространен.Может ли добавление пробиотиков увеличить скорость эрадикации HP, требует подтверждения в будущих хорошо спланированных исследованиях. На данный момент механизмы действия пробиотиков против HP остаются неясными. В контексте высокой глобальной распространенности устойчивости к антибиотикам важно определение роли пробиотиков в искоренении HP, а также возможность использования бактерий для лечения бактерий. Здесь у нас есть обзор последних достижений в роли пробиотиков в лечении инфекций HP.
2. Определение и классификация пробиотиков
Продовольственная и сельскохозяйственная организация Объединенных Наций и Всемирная организация здравоохранения определяют пробиотики как живые микроорганизмы, полезные для жизни; может переносить воздействие желудочного сока, желчи и панкреатического сока; может колонизировать желудочно-кишечный тракт или репродуктивную систему хозяина; вызвать реакцию хозяина; и сбалансировать кишечную флору для улучшения здоровья [22]. В настоящее время сложные пробиотики, состоящие из различных видов микроорганизмов, широко используются во всем мире, в основном для лечения диареи, вызванной дисбактериозом кишечника, и для регулирования иммунных функций организма.
В 2013 году Международная научная ассоциация пробиотиков и пребиотиков классифицировала пробиотики следующим образом: (1) бактерии рода Lactobacillus , включая Lactobacillus acidophilus , Clostridium butyricum , L. reuteri 0004, L. , L. casei , L. paracasei L. rhamnosus , L. salivarius и L. plantarum ; (2) бактерии рода Bifidobacterium , в том числе Bifidobacterium infantis , B.adolescentis , B. animalis , B. longum , B. breve и двойной яичник Bacteroides ; (3) грамположительные кокки, такие как Streptococcus thermophilus , S. faecalis и Lactococcus ; и (4) дрожжи, такие как Saccharomyces boulardii . В настоящее время коммерчески доступные пробиотические продукты включают йогурт с добавлением пробиотиков, инкапсулированные живые бактерии, бактериальный порошок, жидкости для полости рта и различные препараты отдельных штаммов.
3. Теоретические основы микроэкологической терапии
Кожа человека, желудочно-кишечный, респираторный и урогенитальный тракты содержат огромное количество колонизированных микробов, которые играют важную роль в регулировании иммунной функции человеческого организма, чтобы противостоять колонизации патогенов [23]. Эти микроорганизмы включают полезные бактерии, условные патогены и патогенные бактерии, которые в организме человека достигли нормального состояния микроэкологического баланса. Окружающая среда желудка особенно сурова и трудна для колонизации микробиоты.Долгое время считалось, что желудок стерилен, потому что около 80% микробов не культивируются. С развитием технологии высокопроизводительного секвенирования эта точка зрения была опровергнута. HP уже не единственный обитатель слизистой оболочки желудка; микробное сообщество, не относящееся к HP, было признано и называется желудочной микробиотой [24]. На патогенность HP может влиять сообщество, в котором они живут [25]. Микробиота желудка принадлежит в основном к типам Proteobacteria, Firmicutes, Actinobacteria и Fusobacterium, большинство из которых представляют собой Streptococcus и Staphylococcus [26].Инфекция HP может повлиять на баланс микробиоты желудка, а микробные взаимодействия являются основным фактором в регулировании местной микробиоты. Отчеты показали, что микробиота желудка у HP-отрицательных субъектов более разнообразна, чем у HP-положительных пациентов [27].
Факторы адгезии и вирулентности HP способствуют патогенности. Колонизация желудка HP влияет на распределение и количество исходных желудочных бактерий и нарушает микроэкологический баланс, что приводит к заболеванию.Например, в желудке, инфицированном HP, меньше лактобацилл, чем в желудке, не инфицированном HP [23]. HP приводит к микроэкологическому дисбалансу, главным образом, из-за производства антибактериального пептида, называемого цекропином. Этот пептид может вызывать «аутогенный автолиз» других бактерий [28]. Отсутствие конкуренции со стороны этих бактерий позволяет HP беспрепятственно размножаться. Ряд факторов вирулентности способен стимулировать клетки эпителия желудка, что приводит к апоптозу и воспалению.В контексте глобальной распространенности устойчивости к антибиотикам увеличение дозы антибиотиков или продление курса антибиотиков для увеличения скорости эрадикации HP не является идеальным методом, поскольку он может способствовать дальнейшему развитию устойчивости к антибиотикам.
Микроэкологическая терапия внесла новые идеи в лечение HP. Изменение микроэкологического баланса в желудке может уменьшить колонизацию HP. Что касается животной модели инфекции HP, то легче всего установить стерильных, иммунодефицитных или нокаутных животных.Использование обычных мышей затруднено из-за сложности установления хронической инфекции HP. Анализ компонентов микробиоты желудка у стерильных и нормальных мышей показал, что количество бактерий в желудке здоровых мышей достигало 10 × 8 колониеобразующих единиц (КОЕ) / г, при этом преобладали Lactobacillus [29]. В эксперименте на животных, проведенном в Китае, нормальные мыши получали суспензии HP в течение 7 дней. В результате уровень заражения HP составил 30%. Если мышей сначала кормили смесью гентамицина и азитромицина в течение 3 дней для устранения исходной микробиоты желудка, 7-дневное введение HP приводило к 100% инфицированию HP.После того, как баланс микробиоты желудка был изменен путем кормления суспензией Lactobacillus и Bifidobacterium в течение 7 дней, частота инфицирования HP снизилась до 30%, а колонизация HP значительно уменьшилась. Некоторые эксперименты подтверждают, что некоторые компоненты микробиоты желудка проявляют антибактериальные свойства и могут управлять переходом HP из спирали в кокковидную форму [30, 31]. Полученные данные подтверждают предположение, что иммунная система и нормальная микробиота желудка могут эффективно противодействовать колонизации HP, в то время как нарушение баланса микробиоты желудка увеличивает восприимчивость к инфекции HP.Эти данные представляют собой теоретическую основу для клинического использования пробиотиков для увеличения скорости эрадикации HP.
4. Влияние пробиотиков на эрадикацию HP
Многие мета-анализы и клинические испытания подтвердили, что добавление пробиотиков может увеличить скорость эрадикации HP и снизить побочные реакции во время эрадикации. Из анализа литературы можно сделать вывод, что не все пробиотики обладают антагонистическим действием на HP, а разные пробиотики обладают специфическим действием. Антагонистический эффект смешанных штаммов пробиотиков на HP был больше, чем у одного штамма.Сами по себе пробиотики не могут полностью устранить HP, но могут снизить количество HP-нагрузки в желудке, снизить дельта-значение UBT и облегчить воспаление слизистой оболочки желудка. Более подробную информацию о роли пробиотиков в степени эрадикации HP можно увидеть в таблицах 1–4.
| ||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Некоторые клинические испытания доказали, что пробиотики могут снижать значения DOB UBT, несмотря на то, что полное искоренение HP не было достигнуто [ 32–34].Отражают ли значения DOB количественно плотность HP желудка — вопрос спорный. На значение DOB влияют многие факторы, такие как плотность колонизации HP, активность уреазы и опорожнение желудка. Различные пробиотики могут снижать значение DOB за счет ингибирования активности уреазы [35] или уменьшения прикрепления HP к слизистой оболочке желудка, подавляя плотность HP [36].
5. Механизм действия пробиотиков
5.1. Производство веществ, подавляющих или убивающих HP
Антагонистический механизм пробиотиков к HP неясен.Пробиотические микроорганизмы могут продуцировать различные вещества, которые ингибируют HP и индуцируют секрецию антител хозяином. Неполный список антибактериальных соединений включает бактериоцины, молочную кислоту, уксусную кислоту и перекись водорода (H 2 O 2 ). Различные штаммы пробиотиков продуцируют разные антибактериальные вещества. Strep. lactis может производить низин. Эта положительно заряженная молекула может соединяться с клеточными мембранами за счет электростатических и гидрофобных взаимодействий с последующим внедрением в мембрану с образованием проницаемого канала, который препятствует автолизу и гибели клеток [56]. Bacillus subtilis продуцирует антибиотик амикумацин А и аналогичные изокумарины, а L. roche продуцирует множество реотермов, которые все ингибируют рост и активность HP. Одной из характеристик HP является секреция уреазы, которая расщепляет мочевину в желудке с образованием аммиака и нейтрализует желудочную кислоту, чтобы защитить бактерии от повреждения желудочной кислотой. Большинство лактобацилл вырабатывают молочную кислоту, которая может подавлять активность уреазы. Молочная кислота вредна для HP.Происходящие морфологические изменения не зависят от pH [57]. Fujimura et al. совместно культивировали стандартный штамм HP и L. gasseri OLL2716 на агаре в течение 24 часов. Электронно-микроскопическое исследование выявило сферическую форму HP. Бактерии также утратили способность к росту [58]. Еще одна характеристика HP — активность каталазы. Пробиотики могут производить H 2 O 2 . Действие каталазы приводит к выработке многих кислородных радикалов, которые обладают антибактериальным действием из-за их влияния на активность фермента HP.Живые пробиотики противодействуют HP, но жизнеспособность бактерий не может быть предпосылкой для вредоносной активности. Инактивированный нагреванием L. johnsonii № 1088 (HK-LJ88) может убить HP in vitro и, при совместном культивировании с HP в течение 24 часов, может привести к изменению морфологии HP и лизису. Пероральный прием HK-LJ88 может уменьшить колонизацию HP в желудке мышей. Анти-HP эффект HK-LJ88 не включает коагглютинацию бактерий. Скорее, некоторые поверхностные молекулы HK-LJ88 не инактивируются под действием тепла [59].В другом исследовании совместного культивирования HP с L. acidophilus CRL 639 в течение 24 часов, последний оказался лизированным, а высвободившиеся белковые соединения деформировали или убили HP [60].
5.2. Влияние на колонизацию HP в желудке
Колонизация HP в эпителии желудка является предпосылкой для заболевания. HP имеет несколько жгутиков на одном конце, которые обеспечивают бактерии механическое проникновение в толстый слой слизи и колонизацию поверхности эпителиальных клеток желудка, а не вывод через перистальтику желудка.Поверхность HP содержит адгезии, такие как белок-активатор нейтрофилов, фибриллярный N-ацетилнейраминиллактозосвязывающий гемагглютинин (NLBH), Bab A, антиген Льюиса, белок теплового шока, Alp A и Alp B. Клетки желудочного эпителия содержат рецепторы муцина, мукополисахарид рецепторы, вещества группы крови Льюиса, рецепторы гликолипидов и другие соответствующие рецепторы. Связывание адгезинов HP с рецепторами опосредует колонизацию HP в слизистой оболочке желудка. Определение способности пробиотических бактерий колонизировать слизистую желудка является первым шагом в скрининге пробиотиков, которые могут противодействовать адгезии и колонизации HP.Такие пробиотики могут конкурировать с HP за место адгезии эпителиальных клеток желудка, чтобы уменьшить колонизацию HP в желудке. Mukai et al. обнаружили, что L. reuteri влияет на колонизацию HP за счет секреции ганглиозидов сиаловой кислоты и тиолатов, которые ингибируют гликолипидную связь HP с эпителиальными клетками желудка, а также конкурируют с HP за адгезию асиало-ганглио-N-тетраозилцерамида и сульфатида. [61]. Эксперименты in vitro подтвердили, что Lactobacillus могут подавлять экспрессию адгезина HP sabA и снижать адгезию HP к слизистой оболочке желудка [62].Другие продемонстрировали, что рост Lactobacillus и HP в желудке антагонистичен друг другу. Если лактобациллы существуют в желудке, количество HP будет уменьшено [63]. Инфекция HP не обязательно приводит к заболеванию, которое связано с вирулентностью и количеством HP. Пептические язвы не развиваются, если плотность HP антрального отдела желудка <10 5 КОЕ / г [64]. Вышеизложенное подтверждает мнение о том, что, хотя пероральное введение пробиотиков может не полностью устранить HP, адгезия HP может быть уменьшена и воспаление слизистой оболочки желудка может быть уменьшено.Для детей и пожилых людей, у которых нет симптомов пищеварения, пероральный прием пробиотиков для уменьшения колонизации HP превосходит традиционное лечение.
5.3. Подавление воспаления после инфицирования HP
Инфекция HP приводит к воспалению слизистой оболочки желудка. Это может начать путь, который называется каскадом Корреа, от хронического гастрита к атрофическому гастриту, кишечной метаплазии и атипичной гиперплазии, завершающимся раком желудка. Это наиболее частый образец развития после инфицирования слизистой оболочки желудка HP.Уреаза, цитотоксин-ассоциированный ген A (CagA), вакуолизирующий цитотоксин A (VacA) и белок, активирующий нейтрофилы (NAP), являются общими факторами вирулентности HP. Как следует из названия, NAP активирует нейтрофилы. Он также способствует выработке активных форм кислорода в нейтрофилах и опосредует адгезию эпителиальных клеток желудка к нейтрофилам, что приводит к активации каскадной реакции воспаления желудка после инфекции HP. Интерлейкин- (IL-) 8 — это самый ранний обнаруженный цитокин, связанный с HP-гастритом.Это хемотаксическое соединение, которое может активировать нейтрофилы, вызывать дегенерацию и некроз клеток слизистой оболочки желудка, а также стимулировать моноциты слизистой оболочки и дендритные клетки к выработке фактора некроза опухоли, IL-1 и IL-6. Активность дендритных клеток вызывает воспалительный каскад. Этих ответов недостаточно для устранения инфекции HP, но они вызывают хроническое воспаление [65]. Вирулентность и воспалительные факторы в настоящее время используются для приготовления вакцин, ассоциированных с HP. Исследования на животных продемонстрировали значительную (80%) эффективность пероральных вакцин на основе NAP [66].Некоторые штаммы пробиотиков также могут снижать высвобождение воспалительных факторов, регулируя местный иммунный ответ хозяина и снимая воспалительный ответ слизистой оболочки желудка. Исследование in vitro подтвердило, что HP-индуцированная секреция IL-8 в эпителиальных клетках желудка может быть снижена за счет L. salivarius [67]. Другое исследование показало, что экзополисахарид Strep. thermophilus CRL1190 снижает колонизацию HP клетками AGS, а также снимает воспалительный ответ клеток AGS, вызванный HP [68].Механизм, с помощью которого пробиотики регулируют иммунные реакции слизистых оболочек, неясен. L. reuteri может ингибировать активацию ядерного фактора-каппа B (NF- κ B) и нижестоящих факторов, блокируя высвобождение фактора некроза опухоли из макрофагов. L. acidophilus может ингибировать экспрессию Smad7, инактивировать трансдукцию пути NF- κ B и ослаблять HP-индуцированный воспалительный ответ слизистой оболочки желудка [69]. L. plantarum и L.acidophilus , применяемый перед инфекцией HP, снижает степень гастрита. Фосфорилирование киназы Janus 2 и экспрессия цитостатических факторов, супрессоров передачи сигналов цитокинов — (SOCS-) 2 и 3, увеличиваются в пути JAK-STAT. SOCS-2 и SOCS-3 могут ингибировать различные пути передачи сигнала, что снижает высвобождение воспалительных факторов [70]. Пробиотики могут снижать высвобождение ИЛ-8, гамма-интерферона и других воспалительных факторов путем ингибирования пути передачи сигнала Toll-подобного рецептора 4-NF- κ B [71]. L. salivarius UCC118 и UCC119 могут снижать секрецию IL-8 слизистой оболочкой желудка после инфекции HP. Этот эффект не имеет ничего общего с жизнью или смертью L. salivarius , но пробиотическое тело должно быть полноценным. L. salivarius UCC118 и UCC119 могут разрушать систему секреции типа IV, кодируемую cagPAI гена, связанного с токсином HP, и блокировать проникновение эффекторной молекулы cagA в эпителиальные клетки хозяина [72]. Пробиотическая смесь Enterococcus faecalis , B.longum и L. acidophilus , как сообщается, переносили кислую среду в желудке и выживали в течение 8 часов. Эти три пробиотика не могут уменьшить колонизацию HP в желудке, но могут уменьшить высвобождение воспалительных факторов, таких как фактор некроза опухоли альфа, IL-1 β , IL-10, IL-6, фактор, стимулирующий колонию гранулоцитов, и воспалительный белок макрофагов 2 путем ингибирования путей передачи сигнала NF- κ B и митоген-активируемой протеинкиназы [73].Аргинин — субстрат для синтеза оксида азота, одного из сильнейших медиаторов воспаления. Активность аргининдезиминазы после введения L. brevis вызывает дефицит аргинина и предотвращает образование полиамина из пролиферирующих клеток [52].
6. Заключение
С углублением исследований микрофлоры кишечника все большее внимание уделяется микроэкологической терапии. Пробиотики могут помочь улучшить скорость эрадикации HP и уменьшить побочные реакции.Однако не все пробиотики, а только некоторые специфические штаммы пробиотиков обладают такими эффектами. Вот несколько исследовательских препятствий, которые еще предстоит преодолеть. Во-первых, на микрофлору кишечника человека влияют различные факторы, такие как окружающая среда, диета, генетика и образ жизни, и трудно напрямую изучить влияние пробиотиков на организм человека. Во-вторых, из-за синергетического или антагонистического эффекта между бактериями трудно обобщить эффекты определенных пробиотических штаммов в различных комбинациях пробиотиков.В-третьих, из-за специфики штаммов и противоречивых результатов исследований полученные на сегодняшний день результаты могут быть поставлены под сомнение.
Полученные на сегодняшний день результаты неизменно подтверждают эффективность пробиотиков в облегчении побочных реакций при ликвидации HP. Однако остаются вопросы. Могут ли пробиотики увеличить скорость эрадикации HP? Если да, то каков механизм? Какой пробиотический штамм имеет лучший анти-HP эффект? Какова оптимальная доза и время приема лекарств (т.е. до или после эрадикации)? Есть ли разница в эффективности между отдельными штаммами и смешанными штаммами? Есть ли побочные эффекты у дополнительных экзогенных пробиотиков? Ответы ждут будущих фундаментальных и клинических исследований.
Конфликт интересов
Авторы заявляют об отсутствии конкурирующих интересов.
Вклад авторов
Хан-И Сун занимался литературным поиском, дизайном и написанием. Лун Чжоу провел анализ и интерпретацию. Дун-янь Лю сделал критические обзоры. Синь-Цзе Яо занимался сбором и обработкой данных. Ян Ли занимался концепцией и наблюдением.
.Их текущее использование и полезность
Воспалительные заболевания кишечника — это хронические заболевания, поражающие желудочно-кишечный тракт, основными формами которых являются болезнь Крона (БК) и язвенный колит (ЯК). Их этиология до сих пор неясна, хотя несколько факторов были определены как главные детерминанты индукции или рецидивов. Среди них роль «забытого органа», кишечной микробиоты, в последние годы стала более оцененной. Тонкие симбиотические отношения между микробиотой кишечника и хозяином, по-видимому, теряются при ВЗК.С этой точки зрения было проведено несколько исследований для оценки роли пребиотиков и пробиотиков в модуляции микробиоты кишечника. Этот мини-обзор направлен на то, чтобы в удобном формате (простые вопросы-простые ответы) ответить на некоторые общие проблемы, связанные с темой. Обновленная информация о роли отдельных компонентов микробиоты кишечника в патогенезе ВЗК представлена вместе с анализом эффективности модуляции микробиоты кишечника с помощью введения пребиотиков и пробиотиков в лечении ВЗК.
1. Введение
Микрофлора человека, известная как «микробиота», включает бактерии, грибы, бактериофаги и вирусы и действует как «орган» синергетически с хозяином, создавая экосистему. Он способен колонизировать кожу, мочеполовую систему, дыхательную систему и, прежде всего, кишечник.
Микробиота кишечника включает около тысячи различных видов и более 15000 различных штаммов бактерий, общий вес которых составляет около 1 кг. Желудок и тонкий кишечник относительно бедны бактериями, в то время как в толстой кишке содержится около 10 12 микроорганизмов [1], в основном принадлежащих к типам Firmicutes и Bacteroidetes [2].Другие представленные домены — это домены Archaea [3] и Eukarya, а также многие вирусы и бактериофаги [4]. Микробиота кишечника также является приютом для нескольких семейств дрожжей, роль которых в физиологии желудочно-кишечного тракта, а также в заболеваниях все еще остается неясной.
Поскольку большинство видов, кажется, невосприимчивы к культивированию с использованием обычных методов, независимые от культуры молекулярные методы, такие как генотипирование 16S рДНК, используются для характеристики микрофлоры кишечника как по образцам фекалий, так и по биопсии кишечника [5–8].
При рождении кишечник человека бесплоден, и первая колонизация происходит во время родов и первого кормления. Впоследствии микробиота изменяется под влиянием возраста, пола, состояния иммунного созревания и факторов окружающей среды. По прошествии первых двух лет микробиота становится более стабильной, хотя стабильная эндогенная флора может отличаться от временной, которая, наоборот, более чувствительна к внешним раздражителям, поскольку слизистая оболочка кишечника является первой линией связи с экзогенными агенты [9, 10].
В течение первых лет жизни микробиота кишечника стимулирует врожденный иммунитет, индуцируя ассоциированную с кишечником лимфоидную систему, и приобретенный иммунитет, стимулируя специфические системные и местные иммунные ответы [11]. В кишечнике бактериальные фрагменты стимулируют специфические рецепторы, такие как TLR9 (toll-подобный рецептор 9, экспрессируемый на эпителиальных и иммунных клетках) и инфламмасомы, которые способны распознавать бактериальную ДНК [12].
В нормальных условиях стимуляция иммунной системы слизистой оболочки кишечной микробиотой определяет состояние «физиологического воспаления низкой степени» [13], состояние продолжающейся активации иммунной системы слизистой оболочки в ответ на комменсалы и, в случае потребности, в том числе и по отношению к патогенам.Гомеостаз слизистой оболочки требует постоянного баланса между провоспалительными и противовоспалительными компонентами. В последние годы в нескольких исследованиях изучалась корреляция между дисбактериозом и кишечными и внекишечными заболеваниями, включая нарушение иммунной системы, ожирение, аллергии, аутоиммунные заболевания, синдром раздраженного кишечника (СРК) и воспалительное заболевание кишечника (ВЗК) [14, 15].
ВЗК — это хронические рецидивирующие многофакторные состояния, поражающие пищеварительный тракт. К ним в основном относятся язвенный колит (ЯК) и болезнь Крона (БК).Хотя этиология этих заболеваний до сих пор не ясна, основная гипотеза состоит в том, что ВЗК являются результатом чрезмерного иммунного ответа на эндогенные бактерии, который возникает у генетически предрасположенных людей [16, 17].
Большинство традиционных методов лечения ВЗК нацелены на изменение иммунной системы. Для лечения этих заболеваний постоянно используются соединения 5-аминосалициловой кислоты (ASA), кортикостероиды, азатиоприн / 6-меркаптопурин, метотрексат, циклоспорин и агенты против TNF α . Некоторые и, вероятно, менее охарактеризованные методы лечения в качестве дополнения или альтернативы традиционным методам лечения в более легких случаях направлены на прямое или косвенное регулирование микробиоты кишечника.Например, антибиотики используются при ВЗК, и они считаются особенно эффективными при перианальной и послеоперационной БК, а также при поучите [18].
Пробиотики содержат жизнеспособные организмы, достаточные количества которых достигают кишечника в активном состоянии, таким образом оказывая положительное влияние на здоровье [19]. В основном это бактерии, продуцирующие молочную кислоту, и дрожжи, которые достигают кишечника в неизмененном виде, не причиняя вреда хозяину [18, 20]. Их механизмы действия до сих пор неясны; они, вероятно, регулируют проницаемость мембран и иммунную систему слизистой оболочки, удерживая патогены от поверхности слизистой оболочки кишечника. Lactobacillus и Bifidobacteria продуцируют вредные вещества для грамположительных и грамотрицательных бактерий, и они конкурируют с патогенами (например, бактериодетами , Clostridium, Staphylococcus, и Enterobacter ) за клеточную адгезию [18, 21, 22 ].
С другой стороны, пребиотики представляют собой селективно ферментированные ингредиенты, которые допускают определенные изменения как в составе, так и в активности микрофлоры желудочно-кишечного тракта, принося пользу для благополучия и здоровья хозяина [19].Они представляют собой неперевариваемые олигосахариды, такие как фруктоолигосахариды (ФОС), галактоолигосахариды (ГОС), лактулоза и инулин, и они могут стимулировать рост селективных и полезных кишечных бактерий [18]. Из-за своего состава они не могут адсорбироваться до тех пор, пока не достигнут толстой кишки, где они могут ферментироваться определенной микрофлорой в жирные кислоты с малой цепью (SCFA) и лактат [23].
Их точный механизм действия до сих пор неясен. Недавние свидетельства выдвинули гипотезу о том, что они способны увеличивать продукцию SCFA и модулировать выработку цитокинов в слизистой оболочке кишечника, изменяя состав кишечной флоры.Синергетическая комбинация пробиотиков и пребиотиков называется «синбиотиком» [19] (рис. 1).
2. Есть ли роль конкретных патогенов в ВЗК?
Первоначально предполагалось, что ВЗК зависит от одного патогенного штамма бактерий. В 1984 году Чиодини и др. [24] показали сильную связь между Mycobacterium avium подвидом paratubercalosis (MAP) и CD, но эта гипотеза была подтверждена лишь несколькими исследованиями. Более того, неэффективность противотуберкулезных антибиотиков у пациентов с БК усилила критику в адрес МАП [25, 26].
Escherichia coli обычно выделяется во многих биопсиях кишечника пациентов с БК. В частности, адгезивно-инвазивные штаммы (AIEC) обнаруживаются у пациентов с БК подвздошной кишки [27]. Также предполагается, что Yersinia и Pseudomonas действуют как триггеры при болезни CD [28]. С другой стороны, Salmonella, Campylobacter jejuni, Clostridium difficile, Adenovirus, и Mycoplasma были идентифицированы как агенты, связанные с рецидивом заболевания, но не с индукцией [29, 30].
Исследование, проведенное Willing et al. [31] показали, что у пациентов с БК подвздошной кишки Faecalibacterium и Roseburia недостаточно представлены, в то время как Enterobacteriaceae (например, E. coli ) и Ruminococcus gnavus увеличены.
Fusobacterium varium была локализована в толстой кишке пациентов с ЯК и вызывает ЯК у мышей при введении через клизму [32, 33]. Более того, он был оценен как разрастание E.coli у пациентов с ЯК, что предполагает возможную роль в генезе и / или поддержании заболевания [34].
2.1. Есть ли роль комменсальной флоры в патогенезе ВЗК?
Несколько свидетельств подтверждают гипотезу о том, что микробиота кишечника играет роль в патогенезе ВЗК, особенно в исследованиях с участием животных моделей или моделей in vitro. Здесь мы решили представить ограниченные данные, полученные на экспериментальных моделях, уделяя больше внимания исследованиям на людях.
Наиболее воспаленные участки кишечника у пациентов с ВЗК такие же, в них наблюдается наибольшее количество кишечных бактерий.Доказательства того, что у здоровых мышей не развивается тяжелый колит, подтверждают это открытие [35]. Кроме того, частота рецидивов послеоперационной БК и поучита выше, когда восстанавливается каловой поток [15, 36].
Пациенты с ВЗК демонстрируют пониженное количество доминантных комменсальных бактерий, таких как Firmicutes (в частности, Clostridium кластеров IX и IV ) и Bacteriodetes , с увеличением числа Proteobacteria и Actinobacteria .Это наблюдение связано со снижением уровня SCFA в кале пациентов с ВЗК. Среди SCFAs снижение уровня бутирата было связано с воспалительным заболеванием кишечника, поскольку он способен ингибировать высвобождение провоспалительных цитокинов, увеличивая продукцию муцина и антимикробных пептидов и обеспечивая энергией колоноциты [37–39].
Среди Firmicutes уменьшение Faecalibacterium prausnitzii недавно стало очень частой находкой при CD; как показано в Sokol et al., введение Faecalibacterium prausnitzii обладает противовоспалительной активностью, как показали исследования in vivo и in vitro [37].
Подобные результаты были получены Joossens et al. Была проанализирована фекальная микробиота 68 пациентов с CD, 84 здоровых родственников и 55 контрольных пациентов, и у пациентов с CD был обнаружен дисбактериоз. В частности, было оценено снижение Faecalibacterium prausnitzii , Bifidobacterium adolescentis , Dialister invisus и неизвестного вида кластеров Clostridium XIVA , тогда как Ruminococcus gnavus увеличилось.Этот отчет является крупнейшим популяционным исследованием, посвященным составу кишечной микробиоты при ВЗК, где родственники представляли контрольную группу, а различия были обнаружены, несмотря на общие привычки и генетику. Более того, различный состав микробиоты был оценен у родственников ВЗК по сравнению с контрольной группой из-за более высокой распространенности бактерий, способных разлагать муцин [40].
Другая микробиота кишечника была обнаружена также у пациентов с поучитом по сравнению с контрольной группой со сниженной концентрацией Bacteriodetes и Faecalibacterium prausnitzii и увеличением Proteobacteria [41, 42].
Более того, более высокий уровень сульфатредуцирующих бактерий (SRB) также наблюдался при ВЗК, в основном у пациентов с ЯК и паучитом. SRB связаны с более высоким уровнем сероводорода, но с меньшим производством бутирата. Предполагается, что это вызывает гиперпролиферацию клеток [43]. Интересно, что предполагается, что SRB имеют решающее значение для индукции колита DSS у мышей [44]. Среди них исследование, проведенное Rowan et al. [45] продемонстрировали увеличение количества подвидов Desulfovibrio при остром и хроническом язвенном колите, при этом их продукты подавлялись применением 5-аминосалициловой кислоты [46].
Влияние микробиоты на ВЗК также подтверждается потенциальной ролью трансплантации фекалий, эффективно используемой при тяжелой инфекции Clostridium difficile , но также и при ВЗК, особенно у пациентов с ЯК [47, 48].
С другой стороны, значение грибковой флоры при ВЗК все еще неясно. Присутствие антител к Saccharomyces Cerevisiae у пациентов с БК стало отправной точкой для размышлений о роли грибов в патогенезе ВЗК. Увеличенные популяции Candida spp., Penicillium spp., и Saccharomyces sp. были обнаружены у пациентов с ВЗК по сравнению с контрольной группой. Однако необходимы дополнительные исследования, чтобы выяснить, является ли разнообразие грибов при ВЗК триггером для инициации заболевания или, скорее, вторичным эффектом изменений в составе бактерий и терапии [49] (Таблица 1).
3.Влияет ли аппендэктомия на клиническое течение ВЗК?Основная роль в патогенезе ВЗК, по-видимому, связана с функциями отростка слепой кишки, которую следует рассматривать не как след [51], а, скорее, как один из наиболее важных иммунных органов желудочно-кишечного тракта, как впервые предположил Берри [52]. Аппендикс поддерживает гомеостаз кишечной микробной флоры, производя и сбрасывая биопленки с целью модуляции регенерации эпителия и защиты от патогенных микробов [53–55].Большое количество аппендикулярной лимфоидной ткани обуславливает попадание в просвет слепой кишки таких соединений, как муцин и IgA. Доказательства увеличения концентрации SIgA в образцах фекалий пациентов с ВЗК — особенно у пациентов с БК — в сторону здоровых людей [56] подтверждают центральную роль иммунной системы в патогенезе этих воспалительных заболеваний. Несколько исследований в литературе пытаются решить проблему установления веса аппендикса и аппендэктомии при ВЗК. Большинство из них подтверждают весьма значимую обратную связь между аппендэктомией и необходимостью хирургического вмешательства и применения иммунодепрессантов у пациентов с ЯК [57–59] без значительных различий в результатах активности [60].На сегодняшний день несколько исследований о взаимосвязи между аппендиксом, аппендэктомией и БК показывают противоречивые результаты [61]. 4. Какая роль пре- и пробиотиков в модуляции состава микробиоты кишечника?Модуляция микробиоты кишечника может быть достигнута с помощью нескольких подходов, включая антибиотики, добавки про- и пребиотиков, диету и коррекцию предрасполагающих факторов, ответственных за изменения микробиоты кишечника. Несмотря на простоту этого утверждения, немногие отчеты действительно рассматривают способность этих факторов модулировать состав микробиоты кишечника. Вентури и др. сообщили, что использование VSL # 3 у 20 пациентов с ЯК с непереносимостью или аллергией на 5-АСК было связано с увеличением фекальных концентраций Streptococcus salivarius ssp. thermophilus , Lactobacilli, и Bifidobacteria , которые оставались стабильными на протяжении всего исследования. Через 15 дней после отмены уровни вернулись к базальным. Напротив, не сообщалось об изменении концентрации в фекалиях Bacteroides, Clostridia , колиформ, аэробных и анаэробных бактерий [62].Cui et al. продемонстрировали, что лечение BIFICO индуцировало увеличение Bacilli , Enterococci , Bifidobacteria, и Lactobacilli с уменьшением на Bacteroides и Bifidobacteria [63]. Наконец, Welters et al. продемонстрировали снижение количества Bacteriodetes в кале пациентов с хроническим поучитом, получавших 24 г инулина в день [64]. Большинство доказательств способности пробиотиков и пребиотиков модулировать микробиоту кишечника основано на косвенных исследованиях, демонстрирующих клиническую эффективность этих препаратов при ВЗК, о которых будет синтетически сообщено ниже. 5. Есть ли вопросы, связанные с методологией, используемой для изучения кишечных бактерий?Кишечные бактерии не растут в обычных питательных средах. Это, вероятно, было связано в прошлом с явной недооценкой роли микробиоты кишечника в здоровье и болезнях человека. это поле [5–8]. Обилие кишечной микробиоты в организме человека предполагает, что мы в основном состоим из бактерий [2], и в будущем мы, вероятно, поймем, что являемся образом баланса между нами и бактериями внутри нас. 6. Может ли модуляция кишечной микробиоты вылечить ВЗК?6.1. Пробиотики и IBDЕсть несколько исследований эффективности пробиотиков при БК. Эти исследования включают небольшое количество пациентов. Только одно исследование включено в Кокрановский обзор рандомизированных контролируемых исследований. В нем сравнивалась эффективность Lactobacillus GG по сравнению с плацебо у пациентов с БК. Было отобрано одиннадцать пациентов, только 5 из 11 завершили исследование, и никаких существенных различий между двумя группами не наблюдалось [65].В 2005 году Bousvaros et al. провели рандомизированное двойное слепое плацебо-контролируемое исследование, чтобы установить эффективность Lactobacillus GG в качестве адъюванта к стандартной терапии для поддержания ремиссии у семидесяти пяти пациентов с БК. Никаких различий между двумя группами не обнаружено [66]. Более того, Saccharomyces boulardii продемонстрировал положительный эффект на поддержание более длительной ремиссии при БК [77] и улучшение проницаемости кишечного барьера [78]. Впоследствии Кокрановский обзор семи исследований [67] и недавний метаанализ [68] восьми рандомизированных плацебо-контролируемых клинических исследований подтвердили, что пробиотики бесполезны для поддержания ремиссии и предотвращения рецидивов БК.Их неэффективность проверена также на послеоперационном БК [69]. Для UC описан другой сценарий. Эффективность VSL # 3 ( Bifidobacterium breve, Bifidobacterium longum, Bifidobacterium infantis, Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus paracasei, Lactobacillus bulgaricus и Streptococcus thermophilus была доказана на нескольких пациентах с UCS ). Bibiloni et al. изучили 34 взрослых пациента с ЯК легкой-средней степени тяжести при отсутствии побочных эффектов [71].Вентури и др. оценили его положительный эффект у 20 пациентов с ЯК с непереносимостью или аллергией на 5-АСК [62]. Эффективность VSL # 3 была также проверена в исследовании, проведенном на детях с впервые диагностированным ЯК [72]. В 2004 году Kruis et al. показали, что не было никакой разницы в использовании пробиотика E. coli Nissle 1917 и месалазина для поддержания ремиссии у пациентов с ЯК. С другой стороны, Cui et al. продемонстрировали эффективность BIFICO в предотвращении обострений у пациентов с ЯК [63, 73]. В 2006 году другое исследование показало эффективность Lactobacillus GG в поддержании ремиссии у 187 пациентов с ЯК [70].В 2007 году в Кокрановском обзоре Mallon et al. [79] пришли к выводу, что пробиотики могут обеспечивать эффективность в поддержании ремиссии у пациентов с ЯК легкой-средней степени тяжести, в то время как ограниченная эффективность может быть предсказана для умеренно-тяжелого заболевания. Несмотря на эти положительные результаты об эффективности пробиотиков в поддержании ремиссии при ЯК, необходимы дальнейшие исследования [74, 80]. In pouchitis, Gionchetti et al. устойчивая эффективность VSL # 3 в исследовании, проведенном с участием 40 пациентов с анастомозом подвздошно-анальный мешок.Двадцать пациентов получали VSL # 3 и 20 получали плацебо: только у 10% пациентов, получавших VSL # 3, развился поучит по сравнению с 40% пациентов, получавших плацебо [75]. Mimura et al. подтвердили эти данные [76]. На основании этого VSL № 3 одобрен для профилактики и поддержания ремиссии поучита, а его эффективность также указана в справочных европейских руководствах [18, 74] (Таблица 2).
6.2. Пребиотики и IBDЭффективность пребиотиков при IBD в основном ограничивается исследованиями in vitro [87] и на животных моделях (колит, вызванный DSS и TNBS) [88–91]. Тем не менее, есть также несколько исследований на людях, включающих небольшое количество пациентов. Одно из первых проведенных исследований включало 10 пациентов с БК, получавших 15 г фруктоолигосахаридов (ФОС). У этих пациентов индекс активности заболевания был снижен, а бифидобактерии слизистой оболочки были увеличены [81]. Эффективность FOS при БК была также проверена Benjamin et al.в исследовании, опубликованном в 2011 году. Сто три пациента с CD были рандомизированы для получения 15 г / день FOS или плацебо в течение 4 недель. У пациентов, получавших FOS, не наблюдалось значительного клинического улучшения, но у них наблюдалось снижение доли интерлейкин (IL) -6-положительных дендритных клеток lamina propria (DC) и усиление окрашивания DC IL-10. В производстве Ил-12п40 изменений не было. Достоверной разницы в количестве Bifidobacteria и F. prausnitzii в кале не наблюдалось [82]. В 2002 году Bamba et al. продемонстрировали потенциальную роль продуктов питания из проросшего ячменя (GBF) в индукции ремиссии у пациентов с активным язвенным колитом легкой и средней степени тяжести [83]. Тот же результат был подтвержден исследованием, проведенным Kanauchi et al. [84]. Потенциальная эффективность другого пребиотика, шелухи испагулы , была обнаружена Hallert et al. [85]. Проспективное рандомизированное плацебо-контролируемое пилотное исследование с участием 19 пациентов с ЯК, получавших месалазин, показало, что группа, получавшая добавку инулина, обогащенного олигофруктозой, имела более низкий уровень кальпротектина в фекалиях, чем контрольная группа.Калпротектин в фекалиях является маркером воспаления, поэтому можно предположить, что пребиотики могут уменьшить воспаление у пациентов с ЯК [86]. Кроме того, Welters et al. продемонстрировали, что добавление инулина при поучите было связано со снижением воспаления, на что указывает повышенный уровень бутирата, более низкая концентрация Bacteroides fragilis и вторичных желчных кислот в кале, а также уменьшение эндоскопического воспаления [64] (Таблица 3).
7.Ограничения и перспективы на будущееТем не менее, некоторые сомнения и ограничения остаются нерешенными. Состав кишечной микробиоты здоровых людей до сих пор не ясен. Нет исследований с основной целью, направленной на конкретную терапию изменений микробиоты кишечника. Использование пробиотиков часто не основано на доказательствах, поскольку механизмы действия все еще не ясны, такие как кишечная биодоступность бактериальных штаммов, доза и время лечения. Кроме того, полезные методы характеристики микробиоты кишечника имеют высокую стоимость и не стандартизированы.В будущем практика, вероятно, предоставит характеристику микробиоты кишечника, которая будет полезна для различных типов применения. Пре- и / или пробиотическая терапия будет заключаться в добавлении определенного подмножества бактериальных штаммов, что обеспечит желаемое изменение состава микробиоты кишечника. 8. ВыводыМикробиота кишечника играет решающую роль в запуске, поддержании и обострении ВЗК. Некоторые микробы могут быть чрезмерно представлены при ВЗК, в то время как другие, кажется, обладают защитным действием.Уменьшение микробного биоразнообразия было обнаружено в слизистой оболочке и фекалиях пациентов с ВЗК вместе с увеличением количества грибков. Пре- и пробиотики могут представлять собой действенный арсенал для регулирования микробиоты кишечника и, возможно, для лечения ВЗК. Однако имеющиеся данные показывают четкую клиническую эффективность некоторых семейств пробиотиков только при поучите и язвенном колите, но не при болезни Крона. Эта эффективность преимущественно ассоциировалась с легкой формой заболевания и, по-видимому, играет более важную роль в поддержании ремиссии по сравнению с ее индукцией. Необходимы дальнейшие исследования, чтобы лучше охарактеризовать точную роль пробиотиков при ВЗК, их специфические механизмы действия, включая прямое влияние на гомеостаз слизистой оболочки или заживление. Поскольку пробиотики становятся законным вариантом лечения, необходимо определить, какие штаммы пробиотиков обладают наибольшей эффективностью, являются ли они более эффективными в отдельности или в сочетании с другими пробиотиками или пребиотиками, и каков их период полувыведения в желудочно-кишечном тракте. . На основании этих данных можно точно рассчитать кратность приема и дозу. . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||