Острый лимфобластный лейкоз (ОЛЛ) у детей и подростков
Три фазы лечения
Лечение ОЛЛ включает в себя 3 фазы и длится от 2 до 3 лет. Основным методом лечения ОЛЛ является химиотерапия. В химиотерапии используются мощные лекарственные препараты для остановки роста опухолевых клеток, уничтожая их или препятствуя их делению. Детям чаще всего назначают комбинацию различных лекарственных препаратов. Эти препараты могут вводиться в кровоток (внутривенно), приниматься внутрь (перорально) или же вводиться непосредственно в спинномозговую жидкость (интратекально).
Выбор метода химиотерапии и лекарственных средств зависит от группы риска ребенка. Дети с лейкозом высокого риска обычно получают больше противоопухолевых препаратов и/или более высокие дозы, чем дети с ОЛЛ низкого риска.
1. Индукция
Целью индукционной терапии является уничтожение бластных клеток в крови и костном мозге и перевод заболевания в ремиссию. Эта фаза обычно длится 4–6 недель.
Для лечения используется комбинация химиотерапевтических препаратов. Эти препараты могут включать в себя винкристин, стероиды и пэгаспаргазу или аспарагиназу Erwinia, иногда с препаратом антрациклинового ряда, таким как доксорубицин или даунорубицин. В некоторых протоколах во время индукционной терапии применяют схему лечения, включающую циклофосфамид, цитарабин и 6-меркаптопурин.
2. Фаза консолидации/интенсификации
Целью терапии консолидации/интенсификации является уничтожение любых оставшихся клеток, способных к росту и вызывающих рецидив лейкоза. Эта фаза обычно длится 8-16 недель.
Пациенту назначают различные лекарственные средства, такие как циклофосфамид, цитарабин и или 6-меркаптопурин (6-МП). Также может назначаться метотрексат с терапией под защитой лейковорином или без нее.
Также может назначаться метотрексат с терапией под защитой лейковорином или без нее.
3. Фаза стабилизации/продолжения
Целью поддерживающей терапии, последней и наиболее долгой фазы, является уничтожение любых опухолевых клеток, которые могли бы выжить после первых 2 фаз. Фаза стабилизации может продолжаться 2 или 3 года.
Эта фаза может включать в себя применение таких препаратов, как метотрексат, винкристин, стероиды, 6-меркаптопурин (6-МП). Пациентам с высоким риском могут назначаться антрациклиновые препараты, циклофосфамид и цитарабин.
Острый лимфобластный лейкоз (ОЛЛ) — Гематология и онкология
Лейкозные клетки могут повторно появиться в костном мозге, ЦНС, яичках и в других органах. Наиболее опасен костномозговой рецидив. Хотя новый курс химиотерапии приводит к второй ремиссии у большинства детей и около трети взрослых, последующие ремиссии, как правило, недолгие. При химиотерапии лишь небольшая часть больных с ранним костномозговым рецидивом достигает длительной безрецидивной вторичной ремиссии или излечения.
Новые подходы к иммунотерапии показывают впечатляющие результаты при рецидивирующем/рефрактерном ОЛЛ. Антитела, такие как блинатумомаб, которые приносят Т клетки к лейкозным бластам, показывают эффективность при рецидивирующем ОЛЛ. Химерный антигенный рецептор Т-клеток (CAR-T), созданный и полученный от Т-клеток пациента, успешно вызывает ремиссию у пациента с рецидивом ОЛЛ, хотя и обладает существенной токсичностью (2).
Доступные сеансы иммунотерапии для рецидивирующего или рефрактерного ОЛЛ включают
-
Инотузумаб озогамицин
-
Тисагенлеклейсел
Блинатумомаб, биоспецифический CD19-направленный активатор CD3 T-клеток, продлевает общую выживаемость у детей и взрослых с рецидивирующим или рефрактерным пре-B-клеточным ОЛЛ, будь то Ph+ или Ph-. Опасные для жизни токсические эффекты могут включать синдром высвобождения цитокинов и симптомы токсического поражения нервной системы (например, судороги, энцефалопатию с нарушением сознания и нарушением речи, координации и/или равновесия). Может потребоваться прерывание или прекращение использования блинатумомаба с применением высокой дозы дексаметазона или без него. Наиболее распространенными неврологическими симптомами после применения блинатумомаба являются головная боль и тремор (3).
Может потребоваться прерывание или прекращение использования блинатумомаба с применением высокой дозы дексаметазона или без него. Наиболее распространенными неврологическими симптомами после применения блинатумомаба являются головная боль и тремор (3).
Инотузумаб озогамицин, CD22-направленное, нагруженное лекарством антитело с калихеамицином, также доступен для применения у взрослых с рецидивирующим или рефрактерным про-B-клеточным ОЛЛ. Одно из исследований показало, что частота ремиссии значительно выше после 1–2 циклов терапии инотузумаба озогамицином в сравнении со стандартной химиотерапией (4). Инотузумаб может вызывать гепатотоксичность, в том числе смертельные и угрожающие жизни веноокклюзионные заболевания, и его применение связано с более высокой смертностью после трансплантации, не зависящей от рецидива заболевания.
Тисагенлеклейсел, препарат CD19-направленной генетически модифицированной аутологичной Т-клеточной иммунотерапии, доступен для лечения пациентов в возрасте до 25 лет с ОЛЛ из В-клеточных предшественников в невосприимчивой форме, либо со вторым или с последующим рецидивами.
Другие лекарства, которые на данный момент доступны, но для которых при этом клинически значимые результаты не были убедительно показаны, включают:
-
Липосомный винкристин (алкалоид барвинка): для взрослых с Ph-негативным ОЛЛ, по крайней мере, во время 2-го рецидива или прогрессирования, несмотря на ≥ 2 курса противолейкозной терапии
-
Клофарабин (аналог пуринового нуклеозида): для пациентов в возрасте от 1 до 21 года с рецидивирующим или рефрактерным ОЛЛ после ≥ 2 предыдущих схем
-
Аналог пролекарственного препарата с использованием арабинозида гуанозида препарат неларабин (пуриновый нуклеозид): для Т-клеток ОЛЛ, которые не дают ответа, или рецидив которых произошел после ≥ 2 предыдущих схем лечения.

Трансплантация стволовых клеток при наличии HLA-идентичных сиблингов после индукционной химиотерапии или иммунотерапии дает самую большую вероятность достижения долгосрочной ремиссии или излечения. Иногда используются клетки от других родственных доноров или от совместимых с реципиентом доноров, несовместимых с реципиентом доноров. Трансплантация редко используется для пациентов > 65 лет, потому что вероятность успешного исхода очень мала, а побочные эффекты, скорее всего, будут смертельными.
При рецидивах с поражением ЦНС применяется интратекальное введение метотрексата (с или без цитарабина или кортикостероидов) дважды в неделю до исчезновения всех симптомов. Роль продолжительного применения интратекальных препаратов и облучения ЦНС остается неясной.
Рецидив в яичках может клинически проявляться безболезненным плотным увеличением тестикул или может быть выявлен при биопсии. При клинических признаках одностороннего поражения необходимо проведение биопсии непораженного яичка. Лечение включает лучевую терапию пораженного яичка и системную реиндукцию.
Лечение включает лучевую терапию пораженного яичка и системную реиндукцию.
Острый лимфобластный лейкоз | Фонд «Подари жизнь»
Суть болезни
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обусловливает основные симптомы заболевания. Кроме того, эти опухолевые клетки могут накапливаться в лимфоузлах, печени, селезенке, центральной нервной системе и других органах, также вызывая появление специфических симптомов.
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»). Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты относятся к миелоидной линии. Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других лейкоцитов (миелобластные, миелоидные, миелолейкозы).
Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других лейкоцитов (миелобластные, миелоидные, миелолейкозы).
Острый лимфобластный лейкоз (ОЛЛ) – самый распространенный вид лейкоза у детей, но это заболевание нередко встречается и во взрослом возрасте. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «лимфобластный» означает, что незрелые клетки, составляющие основу болезни, являются лимфобластами, то есть предшественниками лимфоцитов.
Частота встречаемости и факторы риска
На долю ОЛЛ приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Именно ОЛЛ – самое распространенное онкологическое заболевание у детей. Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается немного чаще, чем у девочек.
У мальчиков эта болезнь встречается немного чаще, чем у девочек.
Вероятность возникновения ОЛЛ несколько повышена у людей, ранее получавших лечение от какой-либо другой болезни (обычно злокачественной опухоли) с использованием облучения или определенных видов цитостатической химиотерапии. Также риск ОЛЛ повышен у детей с некоторыми генетическими нарушениями – например, с синдромом Дауна, нейрофиброматозом типа I или первичными иммунодефицитными состояниями.
Риск заболеть для ребенка выше среднего, если у его брата- или сестры-близнеца уже был диагностирован лейкоз.
Впрочем, в большинстве случаев ОЛЛ не удается обнаружить никакого из перечисленных факторов риска, и причины, вызвавшие болезнь, остаются неизвестными.
Признаки и симптомы
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться совершенно по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения: избыток аномальных бластных клеток при ОЛЛ сочетается с недостаточным количеством нормальных функциональных клеток крови.
Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка — как говорят, возникает гепатоспленомегалия.
Часто наблюдаются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Из-за недостаточного количества нормальных зрелых лейкоцитов возможны частые инфекции. Повышение температуры может наблюдаться как в связи с возникшей на фоне лейкоза инфекцией, так и из-за опухолевой интоксикации. Иногда одним из проявлений острого лейкоза является продолжительная ангина, плохо поддающаяся терапии антибиотиками.
В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы — нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
Диагностика
При ОЛЛ возникают изменения в обычном клиническом анализе крови: понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки. Очень высокий лейкоцитоз возможен, но, вопреки распространенному мнению, наблюдается не во всех случаях. В целом же надежно поставить диагноз можно только при исследовании образца костного мозга; для этой цели необходима костномозговая пункция.
При морфологическом исследовании диагноз «острый лимфобластный лейкоз» ставится при обнаружении более 25% бластных клеток в костном мозге (в противном случае речь может идти о лимфобластной лимфома). Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток). Дело в том, что при диагностике очень важно не только надежно отличить ОЛЛ от острого миелоидного лейкоза, но и определить конкретный вариант ОЛЛ, поскольку он сильно влияет на терапию и прогноз заболевания.
Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток). Дело в том, что при диагностике очень важно не только надежно отличить ОЛЛ от острого миелоидного лейкоза, но и определить конкретный вариант ОЛЛ, поскольку он сильно влияет на терапию и прогноз заболевания.
Так, ОЛЛ может быть B-клеточным (около 80% случаев) и T-клеточным, в зависимости от того, относятся ли лейкемические клетки к B- или T-лимфоцитарной линии. В зависимости от «степени зрелости» бластных клеток среди как В-, так и Т-клеточных лейкозов выделяют несколько вариантов; их установление в ходе иммунофенотипирования важно для определения стратегии лечения. Все большую важность для определения терапии приобретают и генетические особенности опухолевых клеток.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала.
Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала.
Возможны и дополнительные диагностические процедуры для исследования пораженных лимфоузлов и внутренних органов – компьютерная томография (КТ), ультразвуковое исследование (УЗИ) и так далее.
Диагностические исследования позволяют для каждого конкретного больного определить ту или иную группу риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Перечислим некоторые из них.
- Возраст больного: менее благоприятным считается возраст до 1 года или старше 10 лет.
- Количество лейкоцитов: риск увеличивается при очень высоком лейкоцитозе в момент диагноза.
- Т-клеточный ОЛЛ у детей традиционно считается связанным с несколько более высоким риском по сравнению с В-клеточным.

- Хромосомные аномалии в лейкемических клетках, связанные с числом хромосом и транслокациями. При некоторых из них усложняется лечение болезни. Так, филадельфийская хромосома – транслокация t(9;22) – требует подключения дополнительных таргетных лекарств к терапии. Транслокация t(4;11) часто требует трансплантации костного мозга. В то же время, например, транслокация t(12;21) чаще всего связана с относительно хорошим прогнозом.
- Распространение ОЛЛ в другие органы, помимо костного мозга (например, возникновение нейролейкемии), определяет более высокий риск.
- При раннем или повторном рецидиве лейкоза риск значительно повышается.
Лечение
Как упомянуто в предыдущем разделе, современное лечение ОЛЛ основано на разделении пациентов на группы риска – в зависимости от того, насколько вероятно у них достижение и сохранение ремиссии при одинаковой терапии. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
Индукция ремиссии (то есть терапия, направленная на достижение ремиссии) проводится в течение нескольких первых недель лечения. Под ремиссией здесь подразумеваеся содержание менее 5% бластных клеток в костном мозге и отсутствие их в обычной (периферической) крови в сочетании с признаками восстановления нормального кроветворения.
В ходе индукции проводится интенсивная многокомпонентная химиотерапия лекарствами-цитостатиками, которые вызывают разрушение лейкемических клеток. На этом этапе могут применяться, в зависимости от протокола, такие лекарства, как гормоны-глюкокортикостероиды, аспарагиназа и пэгаспаргаза, винкристин, антрациклины (даунорубицин и др.), иногда и другие препараты. Индукция позволяет достигнуть ремиссии более чем у 95% детей и у 75-90% взрослых с ОЛЛ. При плохом ответе на терапию индукции пациент переводится в группу более высокого риска.Консолидация (закрепление) ремиссии направлена на уничтожение остаточных аномальных бластных клеток во избежание рецидива заболевания.
 Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться, опять-таки в зависимости от конкретного протокола, метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться, опять-таки в зависимости от конкретного протокола, метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно, в условиях больничного стационара или стационара одного дня.Поддерживающая терапия проводится для поддержания ремиссии, то есть для дополнительного снижения риска рецидива после этапов индукции и консолидации. Продолжительность поддерживающей терапии – полтора-два года. На этом этапе основными препаратами являются 6-меркаптопурин и метотрексат.
Поддерживающая терапия представляет собой этап наименее интенсивного лечения. Лекарства принимаются в виде таблеток, их прием не требует пребывания в больнице.
Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. Для интратекального введения при ОЛЛ используется метотрексат, цитарабин и гормоны-глюкокортикостероиды. У некоторых пациентов используется и облучение головы – краниальное облучение.
Существует также понятие реиндукции: это периодически повторяемые уже после достижения ремиссии циклы интенсивной полихимиотерапии. Реиндукция позволяет дополнительно снизить число лейкемических клеток и тем самым повысить «надежность» ремиссии.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия. Выбор метода лечения рецидива зависит от сроков его возникновения (ранний или поздний) и от того, является ли рецидив костномозговым или экстрамедуллярным. К сожалению, при раннем рецидиве шансы на успех лекарственной терапии значительно снижаются.
В этом случае проводится противорецидивная терапия. Выбор метода лечения рецидива зависит от сроков его возникновения (ранний или поздний) и от того, является ли рецидив костномозговым или экстрамедуллярным. К сожалению, при раннем рецидиве шансы на успех лекарственной терапии значительно снижаются.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске (например, после раннего рецидива или при плохом ответе на терапию индукции), поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
В числе «обычных» побочных эффектов химиотерапии можно также назвать тошноту, рвоту, облысение. Серьезнае проблема связана с возможностью аллергических реакций на химиопрепараты, вплоть до анафилактического шока – жизнеугрожающего состояния, которое характеризуется отеком, затруднением дыхания, сильным зудом и т.д. Так, сравнительно часто встречается аллергия на аспарагиназу, и может быть необходимо использование аналогов этого препарата (онкаспар, эрвиназа).
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений. Опасны как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Интенсивное лечение ОЛЛ накладывает серьезные ограничения на образ жизни больного. Необходимо соблюдать определенную диету и строгие гигиенические требования. Во избежание инфекций ограничиваются контакты с внешним миром. При очень низком уровне тромбоцитов нельзя не только допускать травмы, но даже, например, чистить зубы зубной щеткой, чтобы не спровоцировать кровотечение из десен. После достижения ремиссии строгость этих ограничений постепенно снижается. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
В последние годы появилось несколько новых возможностей лечения сложных случаев ОЛЛ. Особо следует отметить иммунопрепарат блинатумомаб и CAR T-клеточную терапию, применяемые при В-клеточном ОЛЛ.
Прогноз
Без лечения ОЛЛ приводит к гибели больного в течение нескольких месяцев или даже недель. Однако использование современных протоколов лечения дает при ОЛЛ очень хороший результат: можно вылечить 85-90% больных детей. У взрослых, особенно пожилых, результаты хуже, но, тем не менее, примерно у 40% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов болезни в течение многих лет.
У взрослых, особенно пожилых, результаты хуже, но, тем не менее, примерно у 40% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов болезни в течение многих лет.
Ранняя диагностика острого лимфобластного лейкоза у детей
Ранняя диагностика онкогематологических заболеваний у детей чрезвычайно сложна ввиду неспецифичности первичных симптомов, которые часто скрываются под «масками» других заболеваний [2, 27]. Онкологическая настороженность и знание вероятных симптомов позволит практическому врачу раньше диагностировать данную патологию и, следовательно, существенно улучшить прогноз для больного [1, 3, 4, 5].
У большинства детей острый лимфобластный лейкоз (ОЛЛ) манифестирует бурно и характеризуется полиморфизмом клиники. Стадия предлейкоза не имеет характерных клинических симптомов [6, 7], а анализ симптомов начального периода проводится ретроспективно [7], в связи с чем, диагноз не бывает поставлен вовремя. Несмотря на прогресс лабораторной диагностики, выявить лейкоз у детей на ранних этапах сложно, т. к. для появления характерных изменений гемограмме опухоль должна достичь критической массы [4], а манифестация ОЛЛ связана с бластной инфильтрацией различных органов с нарушением их функции [8]. Клиническая симптоматика в данном случае опережает лабораторные изменения, и ребенок не госпитализируется в специализированный гематологический стационар [55].
к. для появления характерных изменений гемограмме опухоль должна достичь критической массы [4], а манифестация ОЛЛ связана с бластной инфильтрацией различных органов с нарушением их функции [8]. Клиническая симптоматика в данном случае опережает лабораторные изменения, и ребенок не госпитализируется в специализированный гематологический стационар [55].
ОЛЛ встречается преимущественно у детей от 0-15 лет, при этом в возрасте 2-5 лет наблюдается пик заболеваемости [54]. Более благоприятный прогноз и эффект от проводимой терапии наблюдается у детей от 1 до 10 лет, в то время как у детей младше 1 года и старше 10 лет ОЛЛ протекает неблагоприятно и трудно поддается лечению [46].
Гендерные различия:
Исследования, направленные на изучение межполовых различий при ОЛЛ показали, что при В-ОЛЛ распределение по полу было одинаковым: мальчики — 51%, девочки — 49 %, а то время как Т-вариант обнаруживался преимущественно у мальчиков (90 %).
Конституциональные особенности. В литературе имеются данные о связи дебюта и течения начального периода ОЛЛ с конституциональным типом ребенка (астеноидный, торакально-мышечный, дигестивный): наиболее тяжелое течение наблюдается у детей с дигестивным типом телосложения [55].
В литературе имеются данные о связи дебюта и течения начального периода ОЛЛ с конституциональным типом ребенка (астеноидный, торакально-мышечный, дигестивный): наиболее тяжелое течение наблюдается у детей с дигестивным типом телосложения [55].
Предрасполагающие факторы. В диагностике ОЛЛ врач должен учитывать и большой спектр предрасполагающих факторов, которые могут привести к развитию ОЛЛ: социально-экономический статус семьи ребенка, хромосомные аномалии, синдром Дауна, нейрофиброматоз, вариабельный иммунодефицит, дефицит Ig А, анемия Фанкони, синдром Швахмана, врожденная Х-сцепленная агаммаглобулинемия [56].
В клинической картине острого лимфобластного лейкоза наиболее часто встречаются 5 основных синдромов (таблица 1):
- Интоксикационный синдром. Наиболее часто больных беспокоит длительная лихорадка неясного генеза, интоксикация различной степени, слабость, лихорадка, недомогание, потеря массы тела.
 Лихорадка может быть связана и с наличием бактериальной, вирусной, грибковой или протозойной (реже) инфекцией, особенно у детей с нейтропенией [7].
Лихорадка может быть связана и с наличием бактериальной, вирусной, грибковой или протозойной (реже) инфекцией, особенно у детей с нейтропенией [7]. - Костно-суставной синдром. Проявления со стороны опорно-двигательного аппарата выявляются преимущественно у детей с В-клеточным ОЛЛ, который характеризуется меньшим вовлечением экстрамедуллярных органов и нечеткими изменениями в периферической крови [18]. Костно-суставной синдром часто является первым проявлением ОЛЛ у детей [9, 10]. Проведенные исследования показали, что у пациентов с ОЛЛ в 54% случаев регистрировался костно-суставной синдром, с более высокой частотой у детей от 1 до 9 лет. Наличие болезненности суставов отмечалось у 16,2% детей с ОЛЛ, артрит – у 26,6%, изменение походки у 32,8%. Чаще поражались крупные суставы: коленные — 10,6%, голеностопные — 9,4%, локтевые — 4,4%, плечевые — 3,6% [11]. При осмотре выявлялась отечность суставов, наличие выпота и нарушение функции пораженной конечности [12].
 Нередко больные предъявляли жалобы на частые и множественные переломы, в основе которых могут лежать явления остеопороза [13]. Также необходима уточняющая диагностика при подозрении на рецидивирующий мультифокальный остеомиелит [14]. Острый лимфобластный лейкоз в редких случаях проявляется остеоартритом, неправильная интерпретация которого может привести ошибкам в дифференциальной диагностике с ювенильным ревматоидным артритом (ЮРА). У детей с ОЛЛ отмечается асимметричный олигоартрит, который проявляется лихорадкой, бледностью, артритом, ночными болями, болями в костях [19]. Для поражения костной системы в дебюте ОЛЛ характерен полиморфизм рентгенологических проявлений. В одних случаях они малоинформативны (выявляется лишь незначительная периостальная реакция) [15], в других случаях выявлялись остеолиз, остеопения, остеосклероз, патологические переломы, периостальные реакции и смешанные поражения в виде лизис-склероза [16]. Важным симптомом является несоответствие клинической симптоматики рентгенологическим данным.
Нередко больные предъявляли жалобы на частые и множественные переломы, в основе которых могут лежать явления остеопороза [13]. Также необходима уточняющая диагностика при подозрении на рецидивирующий мультифокальный остеомиелит [14]. Острый лимфобластный лейкоз в редких случаях проявляется остеоартритом, неправильная интерпретация которого может привести ошибкам в дифференциальной диагностике с ювенильным ревматоидным артритом (ЮРА). У детей с ОЛЛ отмечается асимметричный олигоартрит, который проявляется лихорадкой, бледностью, артритом, ночными болями, болями в костях [19]. Для поражения костной системы в дебюте ОЛЛ характерен полиморфизм рентгенологических проявлений. В одних случаях они малоинформативны (выявляется лишь незначительная периостальная реакция) [15], в других случаях выявлялись остеолиз, остеопения, остеосклероз, патологические переломы, периостальные реакции и смешанные поражения в виде лизис-склероза [16]. Важным симптомом является несоответствие клинической симптоматики рентгенологическим данным. Сочетание гипертермии, интоксикационного и суставного синдромов может имитировать септический артрит. Однако отсутствие адекватного ответа на антибактериальную терапию позволяет заподозрить ОЛЛ. Патологический процесс в данном случае развивается вследствие метафизарного склероза [3]. Некупируемые болевой и суставной синдромы, характерные для ювенильного идиопатического артрита, необходимо рассматривать с позиций дифференциальной диагностики с ОЛЛ [16]. Подобная клиническая симптоматика в сочетании с панцитопенией характерна для некроза вещества костного мозга [17]. Эти данные подчеркивают важность включения ОЛЛ в дифференциальную диагностику нарушений опорно-двигательного аппарата даже при явно нормальной картине периферической крови.
Сочетание гипертермии, интоксикационного и суставного синдромов может имитировать септический артрит. Однако отсутствие адекватного ответа на антибактериальную терапию позволяет заподозрить ОЛЛ. Патологический процесс в данном случае развивается вследствие метафизарного склероза [3]. Некупируемые болевой и суставной синдромы, характерные для ювенильного идиопатического артрита, необходимо рассматривать с позиций дифференциальной диагностики с ОЛЛ [16]. Подобная клиническая симптоматика в сочетании с панцитопенией характерна для некроза вещества костного мозга [17]. Эти данные подчеркивают важность включения ОЛЛ в дифференциальную диагностику нарушений опорно-двигательного аппарата даже при явно нормальной картине периферической крови. - Лимфопролиферативный синдром. Увеличение лимфатических узлов связано с лейкозной инфильтрацией тканей [57]. Наиболее часто увеличиваются шейные, паховые, подмышечные лимфатические узлы, которые имеют плотноэластическую консистенцию, при пальпации безболезненны, не спаяны с окружающей клетчаткой, подвижны, кожа над ними не изменена.
 У некоторых детей может наблюдаться симптомокомплекс Микулича (одновременное увеличение лимфатических узлов в подчелюстной, околоушной и окологлазничной области). Возможно значительное увеличение лимфоузлов средостения вплоть до сдавления верхней полой вены (одышка, цианоз, одутловатость лица, пастозность век, выбухание шейных вен). Наряду с лимфоаденопатией в 75% случаев выявляется гепатоспленомегалия, которая не сопровождается болевым синдромом [2, 6].
У некоторых детей может наблюдаться симптомокомплекс Микулича (одновременное увеличение лимфатических узлов в подчелюстной, околоушной и окологлазничной области). Возможно значительное увеличение лимфоузлов средостения вплоть до сдавления верхней полой вены (одышка, цианоз, одутловатость лица, пастозность век, выбухание шейных вен). Наряду с лимфоаденопатией в 75% случаев выявляется гепатоспленомегалия, которая не сопровождается болевым синдромом [2, 6]. - Анемический синдром характеризуется нарастающей бледностью при ухудшении общего состояния, головокружениями и головной боль, одышкой, тахикардией [2].
- Геморрагический синдром связан как с тромбоцитопенией, так и с внутрисосудистым тромбозом (особенно при гиперлейкоцитозе) [46]. Больные могут предъявлять жалобы на полиморфные кровоизлияния (от петехий до кровоизлияний крупных размеров) на коже и в подкожножировой клетчатке различной локализации. Наблюдаются кровотечения из слизистых оболочек (носовые, десневые, желудочно-кишечные, почечные, маточные) [2, 58].

В клинике могут наблюдаться, а в ряде случаев и преобладать [27], клинические проявления со стороны других органов (таблица 1).
- Поражения слизистых оболочек. Одним из ранних симптомов ОЛЛ у детей являются поражения слизистой оболочки полости рта в виде эритемы, язв и отека губ, языка, неба и десен [21]. Нередко постановка диагноза сопровождается трудностями в дифференциальной диагностике с хирургической патологией лица. Так, описан случай ОЛЛ у девочки с отеком носогубной области, который был расценен как флегмона. Вышеописанные изменения были связаны с инфильтрацией слизистой оболочки и мягких тканей бластными клетками [22].
- Кожные проявления. ОЛЛ у детей в некоторых случаях манифестирует в виде различных кожных проявлений, в основе которых лежит, как правило, лейкозный инфильтрат с поражением кожи и подкожных тканей. Локализация может быть различна: поражается область головы в виде небольших узелков [23], либо другие участки кожи [24].
 Описан случай поражения кожи наружного слухового прохода, при котором ребенку первоначально был выставлен диагноз «Диффузный наружный отит» [25].
Описан случай поражения кожи наружного слухового прохода, при котором ребенку первоначально был выставлен диагноз «Диффузный наружный отит» [25]. - Поражения глаз. Офтальмологические проявления у больных, страдающих острым лимфобластным лейкозом, могут быть и его первым проявлением [26, 27]. Жалобы и клинические проявления при этом отличаются полиморфизмом [28]. Наиболее частым признаком поражения глаз при ОЛЛ являются кровоизлияния в различные отделы глазного яблока: сетчатку, субконьюнктивальные кровоизлияния [29]. При осмотре глазного дна может выявляться отек соска зрительного нерва и инфильтрация сосудов.
- Абдоминальный синдром. Абдоминальный синдром проявляется в виде болей в животе неясной этиологии, чередования поносов и запоров, что связано с лимфоидной инфильтрацией паренхиматозных органов и стенки кишечника. В редких случаях ОЛЛ может скрываться под «маской» острого панкреатита, который плохо поддается лечению [30], а также тифлита [31], что требует дополнительной дифференциальной диагностики.

- Поражение мочеполовой системы. Клинические проявления заболеваний почек, вызванные злокачественной инфильтрацией, могут быть первичным проявлением заболевания у пациентов с ОЛЛ и представлены острой почечной недостаточностью [32, 33], ренальной артериальной гипертензией [34], синдромом пальпируемого образования и двухстронней нефромегалией, которые необходимо дифференцировать с опухолью Вильмса [35, 36]. Особенностью клиники ОПН в таких случаях является отсутствие олигурии на фоне выраженной нефромегалии [37, 38]. Кроме того, имеются данные о первичном проявлении ОЛЛ в виде ночного энуреза у ребенка [39].
- Неврологическая симтоматика. Неврологическая симптоматика является не только признаком развития нейролейкемии у детей с ОЛЛ, но может быть и единственным ранним клиническим проявлением заболевания. Клиническая картина преимущественно связана с поражением черепно-мозговых нервов (ЧМН). В одном из случаев при поражении двигательной ветви тройничного нерва у ребенка единственным симптомом являлся тризм жевательной мускулатуры [40], а в другом, при поражении чувствительной ветви, отмечалась сенсорная нейропатия (Numb chin syndrome) [41].
 Первичным проявлением ОЛЛ в ряде наблюдений явилось изолированное поражение отводящего нерва с соответствующими глазодвигательными симптомами [42, 43]. Помимо поражения ЧМН в клинике могут наблюдаться и проявления нейродегенерации (атаксия-телеангиоэктазия Луи-Бар) с соответствующими иммунными и гематологическими нарушениями [44]. ОЛЛ может дебютировать в виде паранеопластического неврологического синдрома (ПНС), проявляющегося острой мышечной слабостью проксимальных мышц верхних и нижних конечностей [20].
Первичным проявлением ОЛЛ в ряде наблюдений явилось изолированное поражение отводящего нерва с соответствующими глазодвигательными симптомами [42, 43]. Помимо поражения ЧМН в клинике могут наблюдаться и проявления нейродегенерации (атаксия-телеангиоэктазия Луи-Бар) с соответствующими иммунными и гематологическими нарушениями [44]. ОЛЛ может дебютировать в виде паранеопластического неврологического синдрома (ПНС), проявляющегося острой мышечной слабостью проксимальных мышц верхних и нижних конечностей [20]. - Поражение легких. Нарушения дыхательной системы могут быть связаны с увеличенными лимфоузлами средостения, характерными для Т-клеточной лейкемии, приводящими к развитию синдрома верхней полой вены или дыхательной недостаточности. Могут быть лейкемическая инфильтрация легочной ткани и/или кровоизлияния в нее. Иногда сложно дифференцировать эти осложнения с инфекционным процессом [45].
- Нарушения минерального обмена. Развивающиеся при ОЛЛ нарушения минерального обмена характеризуются гиперкальциемией, которая может быть первым симптомом заболевания [50, 51], либо его осложнением [52].
 У пациентов с гиперкальциемией превалируют жалобы со стороны ЖКТ и костно-суставной системы [53].
У пациентов с гиперкальциемией превалируют жалобы со стороны ЖКТ и костно-суставной системы [53]. - Инфекционные заболевания. В ряде случаев дебют ОЛЛ может протекать под «маской» некоторых инфекционных заболеваний, например, острая респираторная вирусная инфекция, инфекционный мононуклеоз, ангина, коклюш, паракоклюш, пневмония, эпидемический паротит [59, 60, 61, 62].
Гематологические изменения. Важнейшим диагностическим исследованием, позволяющим предположить ОЛЛ, является общий клинический анализ крови с подсчетом лейкоцитарной формулы.
Гематологические сдвиги при ОЛЛ не имеют четких закономерностей, и часто их выраженность может не соответствовать клинической симптоматике, изменения в анализе крови, характерные для ОЛЛ, могут отсутствовать, что указывает на проведение комплексной оценки клинических и лабораторных данных.
Наиболее часто в гемограмме выявляется выраженный лейкоцитоз, при этом количество лейкоцитов варьирует в широких пределах и зависит от варианта ОЛЛ.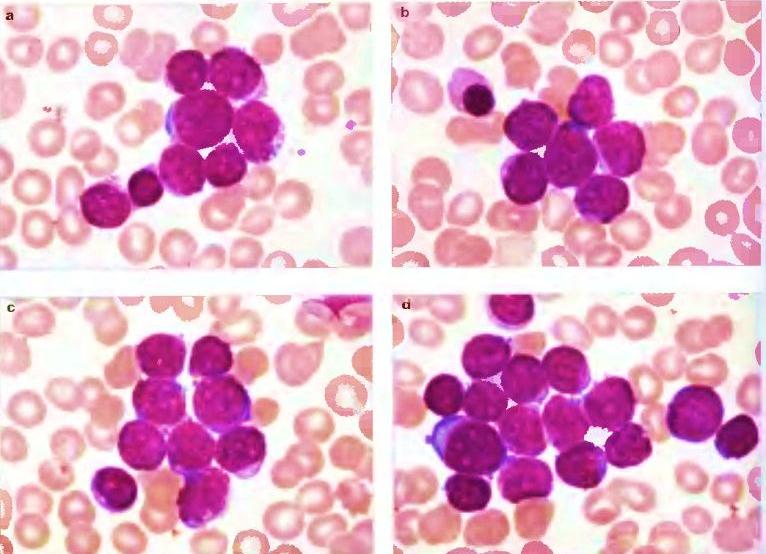 Так, среднее количество лейкоцитов у детей с В-варианте ОЛЛ составило 37,1 ± 12,2*109/л, при Т-варианте ОЛЛ – 123,3 ± 36,5*109/л [63]. Отмечается, что формы ОЛЛ с гиперлейкоцитозом прогностически более неблагоприятны [46].
Так, среднее количество лейкоцитов у детей с В-варианте ОЛЛ составило 37,1 ± 12,2*109/л, при Т-варианте ОЛЛ – 123,3 ± 36,5*109/л [63]. Отмечается, что формы ОЛЛ с гиперлейкоцитозом прогностически более неблагоприятны [46].
Наряду с лейкоцитозом, наблюдается бластемия до 80-90% [27], причем небольшой процент бластных клеток не дает оснований для постановки диагноза ОЛЛ, в то время как и их отсутствие не позволяет полностью его исключить [47, 64].
В редких случаях в дебюте заболевания отмечается стойкая необъяснимая гиперэозинофилия (до 80%), которая может сочетаться с кожными проявлениями [48], а в 25-30% случаев — лимфоцитоз. Для цитопенического варианта ОЛЛ характерна лейкопения и абсолютная нейтропения [4]. Увеличение лейкоцитарного пула приводит к угнетению других ростков кроветворения, что сопровождается снижением количества эритроцитов и гемоглобина, а также тромбоцитопенией [27, 46, 65, 66].
В ряде работ имеются данные о развитии метаболического лактоацидоза в начальном периоде ОЛЛ [49].
Таким образом, первичные клинические проявления острого лимфобластного лейкоза у детей характеризуются выраженным полиморфизмом, что требует от врачей всех специальностей онкологической настороженности, комплексной оценки анамнеза, последовательного анализа клинических данных со стороны всех систем организма, применение адекватного комплекса лабораторно-инструментальных исследований. В сомнительных случаях ребенок должен быть направлен на консультацию к детскому гематологу-онкологу.
Острый лимфобластный лейкоз | Больница «Шиба»
- Главная >Онкология >Острый лимфобластный лейкоз
Острый лимфобластный лейкоз — это злокачественное заболевание, возникающее в крови, костном мозге или средостении. Патологические клетки препятствуют образованию нормальных лейкоцитов, функцией которых является защита от инфекций, а также тромбоцитов, участвующих в процессе свёртывания крови. Ежегодно в США диагностируются приблизительно 4000 новых случаев острого лимфобластного лейкоза. Большинство детей своевременно прошедших лечение выздоравливают. Несмотря на то, что эти показатели у взрослых несколько ниже, они также могут излечиться от данного заболевания.
Ежегодно в США диагностируются приблизительно 4000 новых случаев острого лимфобластного лейкоза. Большинство детей своевременно прошедших лечение выздоравливают. Несмотря на то, что эти показатели у взрослых несколько ниже, они также могут излечиться от данного заболевания.
Украинские врачи дали нам совет, лететь в Израиль
Мы полетели в Шибу после того, как наши врачи посоветовали нам ехать в Израиль, так как ребенок очень маленький, а лейкоз не простой формы а осложненной.
Виктория
Кто наиболее подвержен развитию острого лимфобластного лейкоза?
Острый лимфобластный лейкоз (ОЛЛ) является наиболее распространённым видом лейкоза среди детей. Приблизительно 60% пациентов, страдающих этим заболеванием, составляют пациенты моложе 20 лет. Пик распространённости ОЛЛ приходится на возраст 2-5 лет чаще распространено у мальчиков. Среди взрослых наибольший риск развития острого лимфобластного лейкоза существует в возрасте старше 70 лет. К другим факторам риска относятся ранее пройденная химиотерапия или радиотерапия, а также случаи заболевания ОЛЛ у братьев или сестёр. Генетические нарушения, такие как синдром Дауна, и воздействие ионизирующего излучения также повышают риск развития острого лимфобластного лейкоза.
Пик распространённости ОЛЛ приходится на возраст 2-5 лет чаще распространено у мальчиков. Среди взрослых наибольший риск развития острого лимфобластного лейкоза существует в возрасте старше 70 лет. К другим факторам риска относятся ранее пройденная химиотерапия или радиотерапия, а также случаи заболевания ОЛЛ у братьев или сестёр. Генетические нарушения, такие как синдром Дауна, и воздействие ионизирующего излучения также повышают риск развития острого лимфобластного лейкоза.
Отзыв о лечении лейкоза в Израиле
Первые признаки недуга проявили себя в 2012 году, подвижный прежде ребенок стал слабым, быстро уставал, спустя несколько месяцев увеличился лимфатический узел в паху.
Родители поняли, что необходимо показать малыша врачам и Сережу повезли в Херсон на обследование в одну из ведущих больниц.
Симптомы острого лимфобластного лейкоза
- повышение температуры тела
- слабость
- повышенная утомляемость
- спонтанные возникновение синяков
- частые кровотечения
- одышку
- снижение массы тела
- отсутствие аппетита
- боль в костях или желудке
- возникновение безболезненных опухолей в области шеи, подмышечных и паховых областях
Эти симптомы могут присутствовать и при других состояниях и не являются специфическими для лейкозов, поэтому при их наличии следует обратиться к лечащему врачу для проведения обследования.
Острый лимфобластный лейкоз характеризуется пролиферацией незрелых лимфоидных клеток, называемых лимфобласты, которые неспособны созревать до состояния нормальных лимфоцитов.
Функцией зрелых лимфоцитов является борьба с инфекциями. Вместо них при ОЛЛ организм вырабатывает большое количество незрелых абнормальных лимфоцитов, которые вытесняют здоровые белые и красные клетки, а также тромбоциты, что снижает способность организма противостоять инфекциям. Избыточное образование лимфобластов приводит к состоянию, известному как лейкоз.
Диагностика острого лимфобластного лейкоза в Израиле
После сбора анамнеза и физикального обследования в больнице Шиба лечащий врач может направить пациента на проведение дополнительных исследований, включая общий анализ крови или мазок периферической крови, который выполняется для определения количества эритроцитов, лейкоцитов и тромбоцитов, а также выявления патологически изменённых клеток.
При подозрении на лейкоз может потребоваться проведение аспирации и биопсии костного мозга, забор которого осуществляется при помощи иглы из тазовой кости или грудины. Специалист-патолог исследует полученные образцы под микроскопом с целью выявления злокачественных клеток. Кроме того, может быть выполнен цитогенетический анализ образца костного мозга для выявления хромосомных изменений, ассоциированных с лейкозами.
Специалист-патолог исследует полученные образцы под микроскопом с целью выявления злокачественных клеток. Кроме того, может быть выполнен цитогенетический анализ образца костного мозга для выявления хромосомных изменений, ассоциированных с лейкозами.
Другим возможным диагностическим исследованием является иммунофенотипирование, при котором патолог определяет из какого типа лимфоцитов – В или Т происходит заболевание. Определение типа лейкоза позволяет специалистам подобрать оптимальный вид лечения. Приблизительно в 85% случаев ОЛЛ происходит из В-лимфоцитов. Этот вид заболевания считается менее злокачественным, чем ОЛЛ, происходящий из Т-лимфоцитов.
Для определения масштаба распространения заболевания в организме пациент может быть направлен на проведение рентгенографии грудной клетки, люмбальной пункции (забор на исследование спинномозговой жидкости), ультразвукового исследования или компьютерной томографии.
Лечение острого лимфобластного лейкоза в Израиле
Выбор наиболее подходящего вида лечения в больнице Шиба производится специалистом-патологом совместно с лечащим врачом после получения результатов всех необходимых исследований. При этом учитывается возраст пациента, проводилось ли ранее лечение. В соответствии с этим заболевание классифицируется как нелеченное, в состоянии ремиссии или рецидив.
При этом учитывается возраст пациента, проводилось ли ранее лечение. В соответствии с этим заболевание классифицируется как нелеченное, в состоянии ремиссии или рецидив.
Отзыв о лечении рака крови в Израиле
Я твердо верю и знаю, что диагноз рак крови – не приговор, и что в Израиле не на словах помогают вернуть утраченное здоровье.
Я буду жить!
Лечение острого лимфобластного лейкоза (ОЛЛ)проводится в два этапа. Первый этап заключается в уничтожении лейкемических клеток, находящихся в крови с достижением ремиссии заболевания. На втором этапе выполняется уничтожение остаточного заболевания для профилактики возникновения рецидива.
На каждом этапе, как правило, проводится профилактическая химиотерапия центральной нервной системы (CNS sanctuary therapy). При этом виде лечения химиопрепараты направляются непосредственно в мембраны, окружающие спинной мозг для того чтобы достичь лейкемических клеток, что невозможно при проведении обычной химиотерапии.
При этом виде лечения химиопрепараты направляются непосредственно в мембраны, окружающие спинной мозг для того чтобы достичь лейкемических клеток, что невозможно при проведении обычной химиотерапии.
Параллельно может проводиться системная химиотерапия, направленная на уничтожение злокачественных клеток во всех частях организма или местная химиотерапия, направленная на уничтожение злокачественного процесса в каких-либо отдельных частях тела.
Химиотерапия с трансплантацией стволовых клеток
Такой метод лечения острого лимфобластного лейкоза позволяет проводить более агрессивную противоопухолевую терапию с более высокими дозами химиопрепаратов и/или облучения. При таком виде лечения, проводимом в стационаре, уничтожаются не только злокачественные клетки миеломы, но и здоровые клетки кроветворной системы, находящиеся в костном мозге. После их уничтожения производится пересадка здоровых стволовых клеток путём инфузии через крупную вену на шее или груди пациента. В дальнейшем из пересаженных здоровых стволовых клеток, которые могут быть аутологичными (забранными из здоровых частей собственного организма пациента) либо аллогенными (полученными от донора) образуются здоровые клетки крови.
Лечащий персонал
| Доктор Авраам Авигдор — заведующий отделением онкогематологии медицинский центр «Шиба», Тель-а-Шомер, Израиль. | Доктор Елена Ривковски, ведущий врач отделения гематологии медицинский центр «Шиба», Тель-а-Шомер. | Доктор Юлия Волчек — главврач отделения гематологии медицинский центр «Шиба», Тель-а-Шомер, Израиль. |
УНИКАЛЬНАЯ ТЕХНОЛОГИЯ ЛЕЧЕНИЯ ЛЕЙКОЗА: CAR T-СELL THERAPY
«Шиба» – единственный медицинский центр в Израиле, располагающий уникальной технологией: CAR T-СELL THERAPY. Начиная с прошлого года, новейший подход к лечению лейкоза, разработанный при спонсорской поддержке семьи Лемельбаум, практикуется в Институте по изучению меланомы «Элла» при больнице «Шиба».
Читать дальше »
Лечение острого лимфобластного лейкоза у детей. Обзор литературы | Алескерова
1. Riehm H, Gadner H, Henze G et al. The Berlin childhood acute lymphoblastic leukemia therapy study, 1970-1976. Am J Pediatr Hematol Oncol. 1980. 2: 299-306.
Riehm H, Gadner H, Henze G et al. The Berlin childhood acute lymphoblastic leukemia therapy study, 1970-1976. Am J Pediatr Hematol Oncol. 1980. 2: 299-306.
2. Riehm H, Gadner H, Henze G et al. The Berlin childhood acute lymphoblastic leukemia therapy study, 1970-1976. Am J Pediatr Hematol Oncol. 1980. 2: 299-306.
3. Булычева Т.И. Состояние иммунитета и принципы иммунотерапии больных острыми лейкозами. Автореф. дисс. д-ра мед.наук. М., 1979, 31 с.
4. Барышников А.Ю., Кадагидзе З.П, Махонова Л.А., Тупицын Н.Н. Иммунологический фенотип лейкозной клетки. М.: Медицина, 1989, 240 с.
5. Ленская РВ. Цитологические критерии диагноза и прогноза острого лейкоза у детей. Автореф.дисс. д-ра биол.наук. М., 1983. с. 48.
д-ра биол.наук. М., 1983. с. 48.
6. Маякова С.А. Некоторые методы иммунотерапии острого лейкоза у детей. Дисс канд мед наук, М., 1969. 212 с.
7. Rivera G, Raimondi S, Hancock M et al. Improved outcome in childhood acute lympho-blastc leukaemia with reinforced early treatment and rotational combination chemotherapy. The Lancet. 1991. 337(8733): 61-66.
8. Goldie JH, Coldman AJ, Gudauskas GA. Rationale for the use of alternating non-cross-resistant chemotherapy. Cancer Treat rep. 1982. 66: 439-449.
9. Davey FR, Castella A, Lauenstein K et al. Prognostic significance of the revised French-American-British classification for acute lymphocytic leukaemia. Clin Lab Haematol. 1983. 5(4): 343-51.
5(4): 343-51.
10. Veerman AJ, Hogeman PH, Huismans DR et al. Peanut agglutinin, a marker for T-cell acute lymphoblastic leukemia with a good prognosis. Cancer Res. 1985. 45(4): 1890-3.
11. Pinkel D., Woo S. Prevention and treatment of meningeal leukemia in children. Blood. 1994. 84: 355-366.
12. Aur RG, Simone J, Hustu HO et al. Central nervous system therapy and combination chemotherapy of Childhood lymphocytic leukemia. Blood. 1971. 37(3): 272-81.
13. Relling MV, Rubnitz JE, Rivera GK et al. High incidence of secondary brain tumors after radiotherapy and antimetabolites. Lancet. 1999. 354: 34-9.
14. Sullivan MP, Chen T, Dyment PG et al. Equivalence of intrathecal chemotherapy and radiotherapy as central nervous system prophylaxis in children with acute lymphoblastic leukemia: a pediatric oncology group study. Blood, 1982. 60(4): 948-58.
Sullivan MP, Chen T, Dyment PG et al. Equivalence of intrathecal chemotherapy and radiotherapy as central nervous system prophylaxis in children with acute lymphoblastic leukemia: a pediatric oncology group study. Blood, 1982. 60(4): 948-58.
15. Clarke M, Gaynon P, Hann J et aL CNS-directed therapy for childhood acute lymphoblastic leukemia: childhood collaborative group overview of 43 randomized trials. J.Clin.Oncol. 2003. 21: 1798-1809.
16. Leukemia in children, ed. by G.L. Mentkevich, S.A.Mayakova. Prakticheskaya Meditsina, М., 2009. p. 381.
17. Axel E.M. Malignant neoplasms in children. Statistika / Onkopediatriya. 2015. 2. 2: 154-157.
18. Pediatric Oncology. National Guidelines / ed. by M.D. Aliyev, V.G. Polyakov, G.L. Mentkevich, S.A. Mayakova. Prakticheskaya Meditsina, M. 2012. p. 681.
by M.D. Aliyev, V.G. Polyakov, G.L. Mentkevich, S.A. Mayakova. Prakticheskaya Meditsina, M. 2012. p. 681.
19. Alekseyev N.A. Hematology and Immunology of Childhood. Hippocrates. S.-Pb. 2009. p. 1039.
20. Burchenal J.H. Therapy of acute leukemia. Dia Med. 1952. 24(72): 1883-4.
21. Pearson OH, Eliel LP. Use of pituitary adrenocorticotropic hormone (ACTH) and cortisone in lymphomas and leukemias. J Am Med Assoc. 1950. 144(16): 1349-53.
22. Makhonova L.A. Findings on clinical patterns and treatment (chemotherapy and immunotherapy) of acute leukemia in children. Synopses from PhD Med dissertation. М.,1973. p. 31.
23. Mayakova S.A. Treatment and prognosis of acute lymphoblastic leukemia in children. Synopses from Med. D. dissertation. М., 1986.
Mayakova S.A. Treatment and prognosis of acute lymphoblastic leukemia in children. Synopses from Med. D. dissertation. М., 1986.
24. Pinkel D. Five year foolow-up of “total therapy” of childhood lymphocytic leukemia. JAMA. 1971. 216: 648.
25. Bulycheva T.I. Immunity status and principles of immunotherapy of patients with acute leukemia. Synopses from Med. D. dissertation. Мoscow, 1979, 31 p.
26. Baryshnikov A.Y., Kadagidze Z.G., Mahonova L.A., Tupitsin N.N. Immunological leukemic cell phenotype. M. Meditsina, 1989, 240 p.
27. Lenskaya R.V. Cytological criteria for the diagnosis and prognosis of acute leukemia in children. Synopses from Biol. D. dissertation. M. 1983. p. 48.
28. Mayakova S.A. Some methods of immunotherapy of acute leukemia in children. PhD Dissertation (Medicine), M. 1969. 212 p.
29. Tubergen DG, Gilchrist GS, O’Brien RT et al. Prevention of CNS disease in intermediate-risk acute lymphoblastic leukemia: comparison of cranial radiation and intrathecal methotrexate and the importance of systemic therapy: a Childrens Cancer Group report. J.Clin.Oncol. 1993. 11(3): 520-6.
30. Childhood ALL Collaborative Group. Duration and intensity of maintenance chemotherapy in acute lymphoblastic leukaemia: overview of 42 trials involving 12 000 randomised children. Lancet. 1999. 347: 1783-1788.
31. Riehm H, Reiter A, Schrappe M et al. Corticosteroid-dependent reduction of leukemic count in blood as a prognostic factor in acute lymphoblastic leukemia in childhood (therapy study ALL-BFM 83). Klin Padiatr. 1987. 199: 151-160.
Klin Padiatr. 1987. 199: 151-160.
32. Arico M, Valsecchi MG, Conter V et al. Improved outcome in high-risk childhood acute lymphoblastic leukemia defined by prednisone-poor response treated with double Berlin-Frankfurt-Muenster protocol II. Blood. 2002. 100(2): 420-426.
33. Rumyantsev A.G., Maschan A.A., Samochatova E.V. Supportive care and prevention of infections in hematology and oncology. М.: Medpraktika-M. 2006. p. 503.
34. Eckhof-Donovan S, Schwamborn D, Korholz D et al. Thrombosis in children with acute lymphoblastic leukaemia treated with the COALL-protocol. Klin Padiatr. 1994. 206(4): 327-330.
35. Janka GE, Winkler K, Jürgens H et al. Acute lymphoblastic leukemia in childhood: the COALL studies. Klin Padiatr. 1986. 198(3): 171-7.
Klin Padiatr. 1986. 198(3): 171-7.
36. Gobrecht O, Gobel U, Graubner U, Janka-Shaub G et al. Effect of dose intensity and therapy-included leukocytopenia in childhood. Results in 213 patients of the COALL-85 study. Klin Padiatr. 1992. 204(4): 230-235.
37. Janka-Shaub G, Harms D, Goebel U et al. for the Coall Study Group. Randomized comparison of rational chemotherapy in high-risk acute lymphoblastic leukaemia of childhood — follow up after 9 years. Eur J Pediatr. 1996. 55: 640-648.
38. Janka-Shaub GE, Kortum BU, Winkler K et al. Initial response to therapy as an important prognostic factor in acute lymphoblastic leukaemia in childhood Coall Study Group. Klin Padiatr. 1991. 203(4): 231-235.
39. Escherich G, Gobel U, Jorch N et al. Daunorubicin-induced cell kill with 1-hour versus 24-hour infusions a randomized comparison in children with newly diagnosed acute lymphoblastic leukemia. Klin Padiatr. 2007. 219: 134-138.
Escherich G, Gobel U, Jorch N et al. Daunorubicin-induced cell kill with 1-hour versus 24-hour infusions a randomized comparison in children with newly diagnosed acute lymphoblastic leukemia. Klin Padiatr. 2007. 219: 134-138.
40. Erb N, Harms D, Janka-Schaub GE. Pharmacokinetics and metabolism of thiopurines in children with acute lymphoblastic leukemia receiving 6-thioguanine versus 6-mercaptopurine. Cancer Chemother Pharmacol. 1998. 42: 266-272.
41. Harms DO, Gobel U, Spaar HJ et al., for the COALL Study Group. Thioguanine offers no advantage over mercaptopurine in maintenance treatment of childhood ALL: results of the randomized trial COALL-92. Blood. 2003. 102: 2736-2740.
42. Janka G, Harms D, Escherich G et al. Thioguanine offers no advantage over mercaptopurine in maintenance therapy of childhood ALL. Med Pediatr Oncol. 1999. 33: 217.
Med Pediatr Oncol. 1999. 33: 217.
43. Schrappe M, Reiter A, Sauter S et al. Concept and interim result of the ALL-BFM 90 therapy study in treatment of acute lymphoblastic leukemia in children and adolescents: the significance of initial therapy response in blood and bone marrow. Klin Padiatr. 1994. 206(4): 208-21.
44. Harms DO, Janka-Schaub GE. Co-operative study group for childhood acute lymphoblastic leukemia (COALL): long-term follow-up of trials 82, 85, 89 and 92. Leukemia. 2000. 14(12): 2234-9.
45. Schrappe M, Reiter A, Ludwig WD, et al. Improved outcome in childhood acute lymphoblastic leukemia despite reduced use of anthracyclines and cranial radiotherapy: results of trial ALL-BFM 90. German-Austrian-Swiss ALL-BFM Study Group. Blood. 2000. 95(11): 3310-3322.
46. Igarashi S, Manabe A, Ohara A et al. No advantage of dexamethasone over prednisolone for the outcome of standard- and intermediate-risk childhood acute lymphoblastic leukemia in the Tokyo Children’s Cancer Study Group L95-14 protocol. J Clin Oncol. 2005. 23(27): 6489-6498.
47. Bostrom BC, Sensel MR, Sather HN et al. Dexamethasone versus prednisone and daily oral versus weekly intravenous mercaptopurine for patients with standard-risk acute lymphoblastic leukemia: a report from the Children’s Cancer Group. Blood. 2003 May 15. 101(10): 3809-17.
48. Harms DO, Göbel U, Spaar HJ et al. Thioguanine offers no advantage over mercaptopurine in maintenance treatment of childhood ALL: results of the randomized trial COALL-92. Blood. 2003. 102(8): 2736-40.
49. McLeod HL, Lin JS, Scott EP, Pui CH, Evans WE. Thiopurine methyltransferase activity in American white subjects and black subjects. Clin Pharmacol Ther. 1994. 55: 15.
McLeod HL, Lin JS, Scott EP, Pui CH, Evans WE. Thiopurine methyltransferase activity in American white subjects and black subjects. Clin Pharmacol Ther. 1994. 55: 15.
50. Relling MV, Hancock ML, Boyett JM et al. Prognostic importance of 6-mercaptopurine dose intensity in acute lymphoblastic leukemia. Blood. 1999. 93(9): 2817-2823.
51. Dervieux T, Hancock ML, Evans WE et al. Effect of methotrexate polyglutamates on thioguanine nucleotide concentrations during continuation therapy of acute lymphoblastic leukemia with mercaptopurine. Leukemia. 2002. 16: 209-212.
52. Giverhaug T, Loennechen T, Aarbakke J. Increased concentrations of methylated 6-mercaptopurine metabolites and 6-thioguanine nucleotides in human leukemic cells in vitro by methotrexate. Biochem Pharmacol. 1998. 55: 1641-1646.
1998. 55: 1641-1646.
53. Rivard GE, Infante-Rivard C, Dresse MF et al. Circadian time-dependent response of childhood lymphoblastic leukemia to chemotherapy: a long-term follow-up study of survival. Chronobiol Int. 1993. 10: 201-204.
54. Lonsdale D, Gehan EA, Fernbach DJ, Sullivan MP, Lane DM, Ragab AH. Interrupted vs. continued maintenance therapy in childhood acute leukemia. Cancer. 1975. 36: 341-352.
55. Frei E, Karon M, Levin RH et al. The effectiveness of combinations of antileukemic agents in inducing and maintaining remission in children with acute leukemia. Blood. 1965. 26: 642-656.
56. Kamps WA, Veerman AJ, van Wering ER et al. Long-term follow-up of Dutch Childhood Leukemia Study Group (DCLSG) protocols for children with acute lymphoblastic leukemia, 1984-1991. Leukemia. 2000. 14(12): 2240-6.
Leukemia. 2000. 14(12): 2240-6.
57. Maloney KW, Shuster JJ, Murphy S et al. Long-term results of treatment studies for childhood acute lymphoblastic leukemia: Pediatric Oncology Group studies from 1986-1994. Leukemia. 2000. 14(12): 2276-85.
58. Schrappe M, Reiter A, Zimmermann M et al. Long-term results of four consecutive trials in childhood ALL performed by the ALL-BFM study group from 1981 to 1995. Berlin-Frankfurt-Münster. Leukemia. 2000. 14(12): 2205-22.
59. Conter V, Aricò M, Basso G et al. Long-term results of the Italian Association of Pediatric Hematology and Oncology (AIEOP) Studies 82, 87, 88, 91 and 95 for childhood acute lymphoblastic leukemia. Leukemia. 2010. 24(2): 255-64.
60. Conter V, Aricò M, Valsecchi MG et al. Intensive BFM chemotherapy for childhood ALL: interim analysis of the AIEOP-ALL 91 study. Associazione Italiana Ematologia Oncologia Pediatrica. Haematologica. 1998. 83(9): 791-9.
Conter V, Aricò M, Valsecchi MG et al. Intensive BFM chemotherapy for childhood ALL: interim analysis of the AIEOP-ALL 91 study. Associazione Italiana Ematologia Oncologia Pediatrica. Haematologica. 1998. 83(9): 791-9.
61. Aricò M, Valsecchi MG, Rizzari C. et al. Long-term results of the AIEOP-ALL-95 Trial for Childhood Acute Lymphoblastic Leukemia: insight on the prognostic value of DNA index in the framework of Berlin-Frankfurt-Muenster based chemotherapy. J Clin Oncol. 2008. 26(2): 283-9.
62. Reiter A, Schrappe M, Ludwig WD. et al. Chemotherapy in 998 unselected childhood acute lymphoblastic leukemia patients. Results and conclusions of the multicenter trial ALL-BFM 86. Blood. 1994. 84(9): 3122-33.
63. Gaynon PS, Trigg ME, Heerema NA et al. Children’s Cancer Group trials in childhood acute lymphoblastic leukemia: 1983-1995. Leukemia. 2000. 14(12): 2223-33.
Leukemia. 2000. 14(12): 2223-33.
64. Escherich G, Horstmann MA, Zimmermann M et al. Cooperative study group for childhood acute lymphoblastic leukaemia (COALL): long-term results of trials 82,85,89,92 and 97. Leukemia. 2010. 24(2): 298-308.
65. Schorin MA, Blattner S, Gelber RD et al. Treatment of childhood acute lymphoblastic leukemia: results of Dana-Farber Cancer Institute/Children’s Hospital Acute Lymphoblastic Leukemia Consortium Protocol 85-01. J Clin Oncol. 1994. 12(4): 740-7.
66. Schmiegelow K, Forestier E, Hellebostad M et al. Long-term results of NOPHO ALL-92 and ALL-2000 studies of childhood acute lymphoblastic leukemia. Leukemia. 2010. 24(2): 345-54.
67. Flohr T, Schrauder A, Cazzaniga G, Panzer-Grumayer R et al. , International BFM Study Group (I-BFM-SG). Minimal residual disease-directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOP-BFM ALL 2000 for childhood acute lymphoblastic leukemia. Leukemia. 2008. 22: 771-782.
, International BFM Study Group (I-BFM-SG). Minimal residual disease-directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOP-BFM ALL 2000 for childhood acute lymphoblastic leukemia. Leukemia. 2008. 22: 771-782.
Острый лимфобластный лейкоз у детей
У детей лейкозы занимают ведущее место в структуре онкологических заболеваний и составляют 30—35% всех злокачественных новообразований, из которых на острый лимфобластный лейкоз (ОЛЛ) приходится 80%, на острый миелобластный лейкоз — 15—17%. Доля хронического миелолейкоза незначительна, всего 3—5%. Частота острого лейкоза у детей до 15 лет составляет 4,1±0,4 случая на 100 000 детского населения с соотношением мальчиков и девочек 1:3.
Острые лейкозы — это гетерогенная группа клоновых опухолевых заболеваний системы крови, возникающих в результате мутации и последующих структурных изменений в геноме гемопоэтических клеток-предшественников. Заболевания характеризуются вытеснением нормальных элементов морфологически незрелыми злокачественными кроветворными клетками и инфильтрацией ими различных тканей и органов. Согласно клоновой теории рост лейкозной популяции происходит из одной клетки, а скорость роста опухолевого клона зависит от доли активно про-лиферирующих клеток, их генерационного времени, числа клеток с ограниченной продолжительностью жизни, скорости потери клеток. Когда лейкемическая популяция достигает определенной массы, происходит торможение дифференцировки нормальных стволовых клеток и резко снижается их нормальная продукция. Клинические симптомы острого лейкоза у детей обусловлены степенью инфильтрации костного мозга бластными клетками и экстрамедуллярным распространением процесса.
Заболевания характеризуются вытеснением нормальных элементов морфологически незрелыми злокачественными кроветворными клетками и инфильтрацией ими различных тканей и органов. Согласно клоновой теории рост лейкозной популяции происходит из одной клетки, а скорость роста опухолевого клона зависит от доли активно про-лиферирующих клеток, их генерационного времени, числа клеток с ограниченной продолжительностью жизни, скорости потери клеток. Когда лейкемическая популяция достигает определенной массы, происходит торможение дифференцировки нормальных стволовых клеток и резко снижается их нормальная продукция. Клинические симптомы острого лейкоза у детей обусловлены степенью инфильтрации костного мозга бластными клетками и экстрамедуллярным распространением процесса.
В течении острого лейкоза выделяют следующие периоды: предлейкозный, острый, ремиссии, рецидив и терминальный. Разумеется, наличие последних 3 периодов у пациента зависит от эффекта проведенной терапии: в случае излечения больного отсутствуют рецидив и терминальный период, в случае первичной резистентности — периоды ремиссии и рецидива.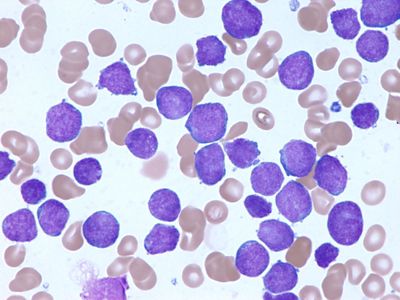
Предлейкозный период представляет лишь академический интерес, так как в связи с отсутствием симптомов он практически не диагностируется. Острый период у большинства детей имеет бурное начало и характеризуется полиморфизмом клинических симптомов, которые обусловлены процессами гиперплазии опухолевой ткани (бластная трансформация костного мозга, увеличение лимфатических узлов, паренхиматозных органов и др.) и подавлением нормального кроветворения (анемия, гранулоцитопения, тромбоцитопения).
Ранними признаками являются симптомы общей интоксикации, анорексия без значительной потери массы тела, боли в костях и суставах. Наиболее характерным симптомом острого периода у детей является увеличение печени, селезенки и лимфатических узлов (наиболее часто шейных, подмышечных и паховых). Одновременное увеличение лимфатических узлов в подчелюстной, околоушной и окологлазничной областях характеризует симптомокомплекс Микулича. Кожные покровы и видимые слизистые оболочки у большинства больных отличаются бледностью.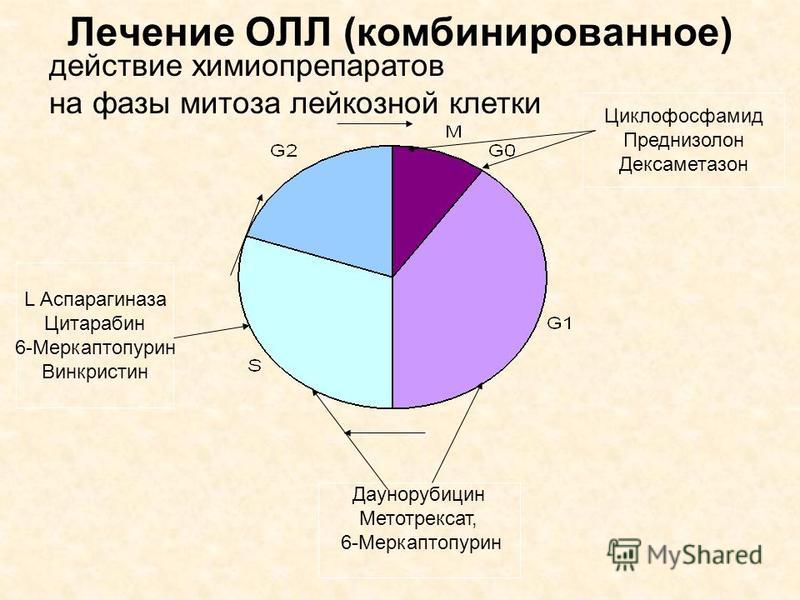 Характерным признаком является геморрагический синдром, выражающийся полиморфными кровоизлияниями (от петехий до кровоизлияний крупных размеров) на коже и кровотечений со слизистых оболочек (носовые, желудочно-кишечные, почечные). Описанные признаки являются следствием развития анемии и тромбоцитопении, обусловленных подавлением нормального кроветворения за счет бластной инфильтрации костного мозга.
Характерным признаком является геморрагический синдром, выражающийся полиморфными кровоизлияниями (от петехий до кровоизлияний крупных размеров) на коже и кровотечений со слизистых оболочек (носовые, желудочно-кишечные, почечные). Описанные признаки являются следствием развития анемии и тромбоцитопении, обусловленных подавлением нормального кроветворения за счет бластной инфильтрации костного мозга.
К редким проявлениям острого лейкоза, связанным с лейкемической инфильтрацией слизистых оболочек, тканей и сосудов, наличием кровоизлияний и присоединением инфекций, относятся изменения на коже и в подкожной клетчатке в виде лейкемидов, некротические поражения кожи, слизистой оболочки ротовой полости и кишечника. При остром лимфобластном и значительно реже при остром миелобластном лейкозе у детей в процесс вовлекаются центральная нервная система (ЦНС), половые органы, глаза и легкие. Перечисленные клинические симптомы более характерны для рецидивов заболевания. Появление их в начальном периоде острого лейкоза — плохой прогностический признак.
Диагностика острого лейкоза основывается на данных цитологического исследования клеток периферической крови и костного мозга. Основными признаками являются значительное увеличение количества бластных клеток в костномозговом пунктате и появление их в анализах периферической крови. Для подтверждения диагноза острого лейкоза необходимо проведение комплексного обследования, главным образом морфологическим методом. В анализах периферической крови обычно наблюдается снижение уровня гемоглобина, количества эритроцитов и тромбоцитов. Количество лейкоцитов может колебаться в широких пределах. В зависимости от лейкоцитоза различают случаи с нормальным, сниженным (1,0 -109/л и менее) и повышенным (20,0 -109/л и более, вплоть до 1,0 -1012/л) количеством лейкоцитов. Повышенное количество лейкоцитов (более 10,0 -109/л) определяется приблизительно у 1/2 больных, а более 50,0 -109/л — у 1/5 пациентов. Абсолютным показателем заболевания является появление бластных клеток в периферической крови, доля которых в общем количестве лейкоцитов может варьировать (от 1—2 до 90% и более). Однако в ряде случаев бластные клетки в периферической крови могут отсутствовать.
Однако в ряде случаев бластные клетки в периферической крови могут отсутствовать.
В костномозговом пунктате количество бластных клеток может колебаться в широких пределах (вплоть до полного вытеснения нормальных кроветворных клеток — 100% бластоз). Кроме того, отмечается нарушение нормальных клеточных соотношений. Диагноз острого лейкоза может быть установлен при количестве бластов в костном мозге >25%. Однако возможны варианты с небольшим содержанием патологических клеток (20—30%). Если в этих случаях диагноз вызывает сомнения, необходимы трепанобиопсия и гистологическое исследование костного мозга. Более тонкая идентификация бластов проводится на основании иммунофенотипирования и цитогенетического исследования.
Пункция лимфатических узлов при их увеличении, а также пункция опухолевых образований, если они имеются, являются обязательными для получения цитологического подтверждения диагноза и наличия экстрамедуллярных проявлений.
При рентгенологическом исследовании костной системы часто выявляется остеопороз в трубчатых костях и позвоночнике.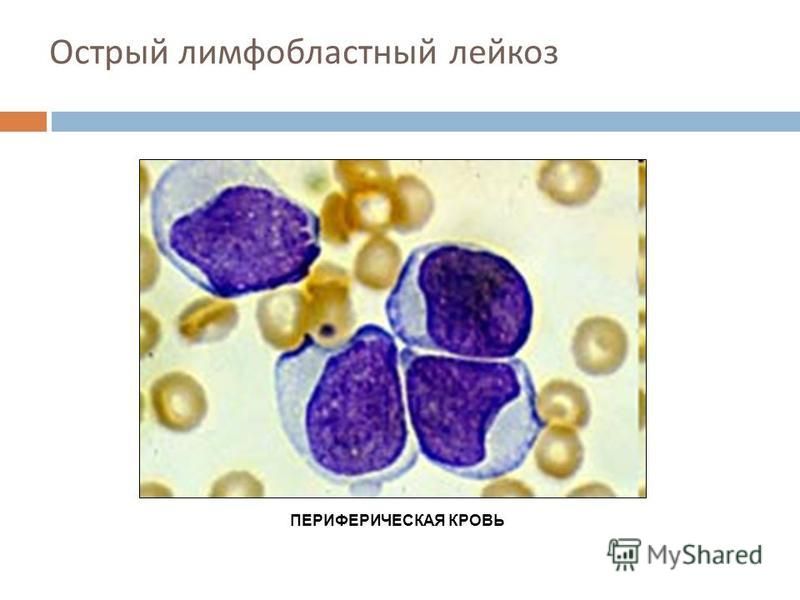 Кроме того, при рентгенологическом исследовании грудной клетки может быть обнаружено расширение средостения за счет увеличенных внутригрудных лимфатических узлов, когда дифференциальный диагноз следует проводить с неходжкинской лимфомой.
Кроме того, при рентгенологическом исследовании грудной клетки может быть обнаружено расширение средостения за счет увеличенных внутригрудных лимфатических узлов, когда дифференциальный диагноз следует проводить с неходжкинской лимфомой.
Спинномозговая пункция позволяет диагностировать поражение нервной системы даже при отсутствии клинической симптоматики. При увеличении количества ядерных элементов в ликворе следует думать о нейролейкозе, чаще всего при этом увеличивается и уровень белка. Однако возможны случаи, когда клинически определяются неврологические симптомы, а в ликворе увеличения цитоза нет. В таких ситуациях следует обращать внимание на увеличение количества белка. С помощью новых методов стало возможным обнаружение даже минимального числа лимфобластов в спинномозговой жидкости.
С целью диагностики поражения нервной системы проводятся также дополнительные методы исследования: рентгеновская компьютерная томография, электроэнцефалография и эхоэнцефалография.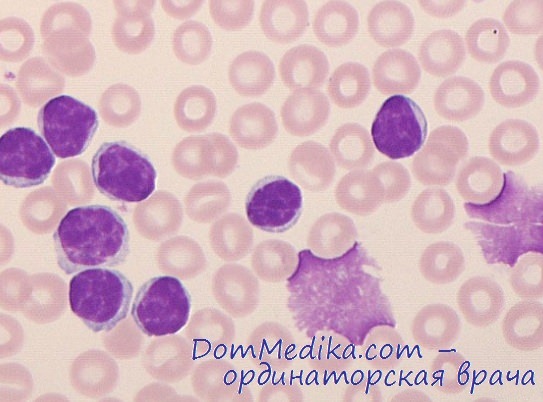
В 1976 г. франко-американо-британская (FAB) группа сотрудничества предприняла попытку уточнить морфологическую классификацию острого лейкоза и предложила критерии для выделения типов опухолевых клеток на основании цитоморфологических и цитохимических исследований. По морфологическим критериям бластных клеток, при ОЛЛ имеется 3 типа клеток — L1, L2, L3. Около 85% детей с ОЛЛ имеют тип L1, 14% — L2 и 1% — L3. Лимфобласты типа L3 имеют поверхностные иммуноглобулины и другие маркеры В-клеток. Учитывая, что у многих больных встречается смешанная популяция лимфобластов, выделяются типы L1/L2 и L2/L1.
Лейкозные лимфобласты дают отрицательную реакцию на пероксидазу и хлорацетатэстеразу, не содержат липидов. Для лимфобластов характерно гранулярное распределение материала в ШИК-реакции в виде пурпурных гранул по периферии цитоплазмы. Иммунологическими методами выявляется гетерогенность ОЛЛ в пределах морфологически однородных популяций лейкозных клеток. Внедрение гибридомной технологии и получение панели диагностических моноклональных антител к дифференцировочным антигенам гемопоэтических клеток позволили типировать бластные клетки больных ОЛЛ по многим маркерным характеристикам в совокупности с цитохимическими и морфологическими характеристиками.
В настоящее время с точки зрения биологических основ возникновения ОЛЛ принято выделение Т-клеточного и не Т-клеточного (В-линейного) иммунологических подвариантов ОЛЛ с дальнейшим углублением иммунологической классификации в пределах каждого из этих типов. Приблизительно 80—85% ОЛЛ у детей принадлежат к В-линии, остальные — к Т-линии. Различные морфологические варианты ОЛЛ характеризуются специфическими хромосомными аномалиями. Современные цитогенетические технологии позволили установить хромосомные нарушения приблизительно в 90% случаев ОЛЛ. Гипердиплоидность (более 50 хромосом) чаще наблюдается при пре-пре-В-клеточном варианте ОЛЛ и является наиболее благоприятной в прогностическом отношении. Сравнительный анализ особенностей клинико-гематологических, иммунологических и цитогенетических данных при ОЛЛ выявил гетерогенность этого заболевания, что послужило основанием для дифференцированного подхода к лечению ОЛЛ с помощью изучения прогностического значения различных параметров, таких, как клинические, гематологические, цитологические и др.
При идентификации факторов прогноза ОЛЛ у детей стало очевидно, что при этом заболевании могут быть выделены прогностические или стадийные группы с помощью характеристик, значительно и независимо влияющих на прогноз. В этом имелась необходимость для создания отдельных терапевтических протоколов лечения. Больные с хорошим прогнозом, имеющие очень высокие шансы на излечение, должны получать стандартную терапию со сведением до минимума риска вторичных эффектов. В более интенсивном лечении нуждаются больные с плохим прогнозом, которые при проведении стандартной терапии имеют малоудовлетворительные отдаленные результаты.
Лечение ОЛЛ
Прогресс в увеличении выживаемости детей с ОЛЛ произошел при переходе от монотерапии в 1940 г. к полихимиотерапии и поддерживающему лечению в 1950—1960 гг., а также в результате внедрения в программы лечения профилактики поражения ЦНС в 1960 г.
В последние годы многие терапевтические подходы в онкологии основывались на ОЛЛ у детей как уникальной модели генерализованной опухоли. В результате были отработаны и внедрены в клиническую практику наиболее эффективные химиопрепараты и их комбинации, разработаны стратегия и тактика лечения различных лейкозов. Результаты терапии ОЛЛ у детей можно назвать эталоном онкологической эффективности. Ни при каких злокачественных опухолях кроветворной системы человека не получено столь впечатляющих долгосрочных результатов (Felix C., 2000). Принципиальным в лечении ОЛЛ у детей являются использование нескольких не обладающих перекрестной резистентностью препаратов, применение их в разное время и в разной последовательности. Длительными исследованиями было показано, что продолжительность индуцированной ремиссии при ОЛЛ определяется строгим соблюдением принципов этапного лечения заболевания: адекватной индукционной терапии, интенсификации-консолидации ремиссии, направленной на элиминацию резидуальных бластных клеток, химио- и химиолучевой профилактики нейролейкоза, противорецидивного (поддерживающего) лечения, предполагающего наличие в организме остаточных очагов лейкозной инфильтрации.
В результате были отработаны и внедрены в клиническую практику наиболее эффективные химиопрепараты и их комбинации, разработаны стратегия и тактика лечения различных лейкозов. Результаты терапии ОЛЛ у детей можно назвать эталоном онкологической эффективности. Ни при каких злокачественных опухолях кроветворной системы человека не получено столь впечатляющих долгосрочных результатов (Felix C., 2000). Принципиальным в лечении ОЛЛ у детей являются использование нескольких не обладающих перекрестной резистентностью препаратов, применение их в разное время и в разной последовательности. Длительными исследованиями было показано, что продолжительность индуцированной ремиссии при ОЛЛ определяется строгим соблюдением принципов этапного лечения заболевания: адекватной индукционной терапии, интенсификации-консолидации ремиссии, направленной на элиминацию резидуальных бластных клеток, химио- и химиолучевой профилактики нейролейкоза, противорецидивного (поддерживающего) лечения, предполагающего наличие в организме остаточных очагов лейкозной инфильтрации. Для больных с высоким риском существенным компонентом лечения являются периодические курсы интенсификации и реиндукции.
Для больных с высоким риском существенным компонентом лечения являются периодические курсы интенсификации и реиндукции.
Значительно улучшились результаты лечения детей с ОЛЛ при применении так называемой тотальной терапии, заключающейся в использовании комбинации химиопрепаратов для достижения ремиссии, осуществлении мер, направленных на профилактику нейролейкоза (химиолучевая терапия), и длительном противорецидивном (поддерживающем) лечении в периоде ремиссии (R. Aur, 1979). Благодаря тотальной терапии американскими авторами была впервые объявлена перспектива достижения 50% выживаемости детей с ОЛЛ более 5 лет. Несмотря на то, что в настоящее время достигнуты гораздо более впечатляющие результаты лечения больных ОЛЛ, на тот момент эти показатели представлялись революционными.
Анализ результатов лечения ОЛЛ у детей в России и за рубежом свидетельствует о повсеместной унификации схем индукционной терапии.
В индукции ремиссии базисными препаратами являются преднизолон, винкристин, антрациклиновые антибиотики и L-аспарагиназа. Достижение ремиссии в результате индукционного курса характеризуется отсутствием клинических признаков заболевания, нормоклеточностью пунктата костного мозга с количеством бластов менее 5% при отсутствии их в периферической крови и количестве гранулоцитов более 0,5 -109/л и тромбоцитов более 100,0 -Ю’/л. Имеет значение также отсутствие признаков лейкозного поражения ЦНС или других экстрамедуллярных проявлений.
Достижение ремиссии в результате индукционного курса характеризуется отсутствием клинических признаков заболевания, нормоклеточностью пунктата костного мозга с количеством бластов менее 5% при отсутствии их в периферической крови и количестве гранулоцитов более 0,5 -109/л и тромбоцитов более 100,0 -Ю’/л. Имеет значение также отсутствие признаков лейкозного поражения ЦНС или других экстрамедуллярных проявлений.
Концепция профилактики поражения ЦНС при ОЛЛ у детей основывается на наличии там «убежища» для лейкозных клеток, не определяемых в момент диагностики заболевания и недоступных для цитостатиков при проведении системной химиотерапии. Для профилактики нейролейкоза традиционно используются эндолюмбальное введение метотрексата и гамматерапия на область головного мозга (в дозе 12—18 Гр). В настоящее время имеются попытки снижения доз лучевой терапии (вплоть до полной ее отмены) у больных со стандартным и даже средним риском. Это связано с появлением отдаленных последствий этого вида лечения. В некоторых программах терапии применяется эндолюмбальное введение 3 препаратов: метотрексата, цитозинарабинозида и гидрокортизона. Значение интенсификации-консолидации заключается в дальнейшей редукции популяции лейкозных клеток, достигнутой в период индукции ремиссии. Для этого применяются либо препараты, с помощью которых была достигнута ремиссия, либо комбинация химиопрепаратов, не использованная в период индукции и способная довести до минимума развитие перекрестной резистентности, в частности высокие дозы метотрексата (1000—5000 мг/м2).
В некоторых программах терапии применяется эндолюмбальное введение 3 препаратов: метотрексата, цитозинарабинозида и гидрокортизона. Значение интенсификации-консолидации заключается в дальнейшей редукции популяции лейкозных клеток, достигнутой в период индукции ремиссии. Для этого применяются либо препараты, с помощью которых была достигнута ремиссия, либо комбинация химиопрепаратов, не использованная в период индукции и способная довести до минимума развитие перекрестной резистентности, в частности высокие дозы метотрексата (1000—5000 мг/м2).
Цель поддерживающего лечения — максимальная редукция лейкемического клона. Наличие резидуальной (остаточной) лейкемии документируется в некоторых случаях биопсийным материалом. Имеется несколько гипотез объяснения существования лейкемических клеток в периоде ремиссии: развитие биохимической лекарственной резистентности, наличие физиологических или фармакологических «убежищ» (ЦНС, яички и др.), поддержание популяции лейкозных клеток, находящихся в фазе Go и соответственно менее чувствительных к химиотерапии, и др. Наиболее часто для поддержания ремиссии используются 6-меркаптопурин и метотрексат. Длительность поддерживающей терапии до конца не определена (2—3 года). Из-за риска возникновения рецидива (особенно тестикулярного) у мальчиков большинство авторов проводят лечение у них не менее 3—3,5 года. Интерес представляют данные по эффективности применения поддерживающего лечения в течение 2 лет по программе BFM (Берлин — Франкфурт — Мюнстер).
Наиболее часто для поддержания ремиссии используются 6-меркаптопурин и метотрексат. Длительность поддерживающей терапии до конца не определена (2—3 года). Из-за риска возникновения рецидива (особенно тестикулярного) у мальчиков большинство авторов проводят лечение у них не менее 3—3,5 года. Интерес представляют данные по эффективности применения поддерживающего лечения в течение 2 лет по программе BFM (Берлин — Франкфурт — Мюнстер).
В большинстве современных протоколов лечения ОЛЛ у детей (BFM, DFCI, POG, CCSG, UKALL, Dutch ALL-VI и др.), применяемых в США, Германии, Великобритании и Голландии, используется интенсивная полихимиотерапия с обязательным включением профилактики нейролейкоза. Применение программного лечения позволило увеличить долгосрочную выживаемость до 70—80%. Высокую эффективность показали программы, разработанные немецкими авторами, ОЛЛ-BFM (BFM-83, BFM-87, BFM-90, BFM-95), которые получили широкое распространение в Европе и России. Лечение рецидивов ОЛЛ проводится по интенсивным программам химиотерапии с применением повышенных доз препаратов. В последние годы все больше внедряется трансплантация костного мозга и гемопоэтических стволовых клеток.
В последние годы все больше внедряется трансплантация костного мозга и гемопоэтических стволовых клеток.
Таким образом, за 60 лет ОЛЛ у детей превратился из абсолютно фатального в излечимое заболевание с отдаленной выживаемостью в 75—85%. Важным является своевременное применение интенсивных программ химиотерапии, которые должны осуществляться в специализированных стационарах, имеющих хорошо обученный медицинский персонал. Кроме того, необходимыми условиями проведения адекватного лечения являются оснащение клиник современным оборудованием и бесперебойное снабжение лекарственными средствами — как необходимыми химиопрепаратами, так и препаратами для сопроводительного лечения (антибиотики, компоненты крови и др.).
Автор: С.А. Маякова НИИ детской онкологии и гематологии ГУ РОНЦ им. Н.Н. Блохина РАМН
«Вместе против рака. Врачам всех специальностей» № 1 2006 г.
Острый лимфобластный лейкоз (ALL) — Детская исследовательская больница Сент-Джуда
Что такое острый лимфобластный лейкоз?
Острый лимфобластный лейкоз (ОЛЛ) — это рак, поражающий лейкоциты. Эти клетки борются с инфекциями и помогают защитить организм от болезней.
Эти клетки борются с инфекциями и помогают защитить организм от болезней.
У пациентов с ОЛЛ слишком много незрелых лейкоцитов в костном мозге. Эти клетки вытесняют нормальные белые кровяные тельца. Без достаточного количества нормальных лейкоцитов организму сложнее бороться с инфекциями.
ALL влияет на тип лейкоцитов, называемых лимфоцитами, заставляя их накапливаться в печени, селезенке и лимфатических узлах.
Насколько распространен острый лимфобластный лейкоз?
ALL — это наиболее распространенный тип рака у детей. Чаще всего встречается у детей в возрасте от 3 до 5 лет и чаще поражает мальчиков, чем девочек. ALL чаще всего встречается у детей латиноамериканского происхождения, за которыми следуют дети белого и афроамериканского происхождения.
В США ежегодно обнаруживается, что около 3000 человек моложе 20 лет болеют ОЛЛ.
Братья и сестры детей, больных лейкемией, имеют немного более высокий риск развития ОЛЛ, но этот показатель все еще довольно низок: не более 1 на 500.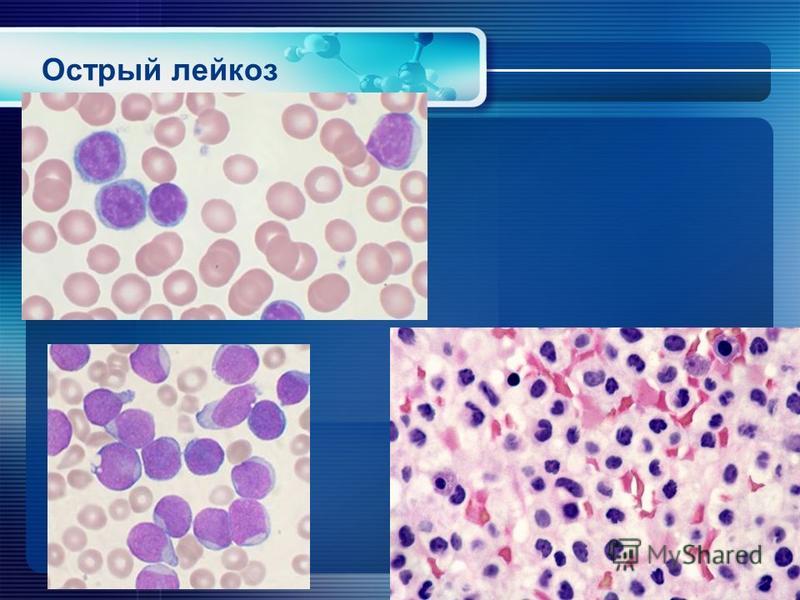
Каковы симптомы острого лимфобластного лейкоза?
Симптомы ВСЕХ включают:
- Частые инфекции
- Лихорадка
- Легкие синяки
- Трудно остановить кровотечение
- Плоские темно-красные пятна на коже (петехии) из-за кровотечения под кожей
- Боль в кости или суставы
- Шишки в шее, подмышках, животе или паху
- Боль или ощущение полноты под ребрами
- Слабость, утомляемость
- Бледность
- Потеря аппетита
- Одышка
Как лечить острый лимфобластный лейкоз ?
Ожидайте, что ВСЕ лечение вашего ребенка будет включать три фазы:
- Индукция — убивает лейкозные клетки в крови и костном мозге и приводит болезнь в ремиссию (возврат к нормальному количеству клеток крови)
- Консолидация / интенсификация — чтобы избавить организм от любых оставшихся клеток, которые могут начать расти и вызвать возврат лейкемии (рецидив)
- Техническое обслуживание — уничтожить любые раковые клетки, которые могли выжить в первые две фазы
Четыре типа лечение может быть использовано во время любой из этих фаз лечения:
- Химиотерапия («химиотерапия») — использует сильнодействующие лекарства для уничтожения раковых клеток или остановки их роста (деления) и образования новых раковых клеток.

- Химиотерапию можно вводить в кровоток, чтобы она могла распространяться по всему телу.
- Некоторое количество химиотерапии можно вводить через рот.
- В комбинированной терапии одновременно используются несколько видов химиотерапии.
- Трансплантация стволовых клеток — включает замену кроветворных клеток в костном мозге, которые были убиты химиотерапией и / или лучевой терапией:
- Трансплантация стволовых клеток дает пациенту новые клетки крови из донорской крови или кости костный мозг.Эти клетки превращаются в здоровые клетки крови, чтобы заменить те, которые потерял пациент.
- Некоторые типы трансплантатов стволовых клеток можно назвать «трансплантатами костного мозга», потому что клетки поступают из костного мозга донора.
- Лучевая терапия — использует высокоэнергетические рентгеновские лучи или другие виды излучения для уничтожения раковых клеток или остановки их роста.
- Таргетная терапия — использует лекарства или другие методы лечения, которые нацелены на определенные раковые клетки и атакуют их без вреда для нормальных клеток.

Какова выживаемость при остром лимфобластном лейкозе?
- Около 98% детей с ОЛЛ достигают ремиссии в течение нескольких недель после начала лечения.
- Около 90% этих детей можно вылечить. Пациенты считаются вылеченными после 10 лет ремиссии.
Почему стоит выбрать St. Jude для лечения ВСЕГО вашего ребенка?
- Сент-Джуд — единственный комплексный онкологический центр, назначенный Национальным институтом рака и предназначенный исключительно для детей.
- В Сент-Джуде было проведено больше клинических испытаний рака, чем в любой другой детской больнице в Соединенных Штатах.
- Соотношение количества медсестер и пациентов в Сент-Джуде не имеет себе равных — в среднем 1: 3 в гематологии и онкологии и 1: 1 в отделении интенсивной терапии.
- Проведенные в больнице исследования лейкемии стали первопроходцами в области лечения детской лейкемии.
- Пациенты из Сент-Джуда с ОЛЛ имеют выживаемость 94%, что является лучшим во всем мире исходом для этого заболевания.

- ул.Джуд был первой больницей в США, которая исключила краниальное облучение при лечении ОЛЛ (а позже и острого миелоидного лейкоза и неходжкинской лимфомы) без ущерба для показателей выживаемости.
- Исследователи из Сент-Джуда обнаружили неожиданные генетические изменения в смертельном типе детской лейкемии под названием ETP-ALL, которые могут изменить диагноз и лечение детей с этим заболеванием. Открытие стало возможным благодаря проекту детского онкологического генома Детской исследовательской больницы Св. Джуда при Вашингтонском университете.Этот проект раскрывает генетическую основу некоторых из самых смертоносных онкологических заболеваний у детей.
- В Сент-Джуде впервые были проведены амбулаторные клинические испытания детей с лейкемией, что снизило необходимость пребывания в стационаре.
Острый лимфобластный лейкоз (ВСЕ) | Детская больница Филадельфии
Острый лимфобластный лейкоз (ОЛЛ), иногда называемый острым лимфоцитарным лейкозом, является наиболее распространенной формой лейкемии у детей, составляющей около 30 процентов всех онкологических заболеваний у детей.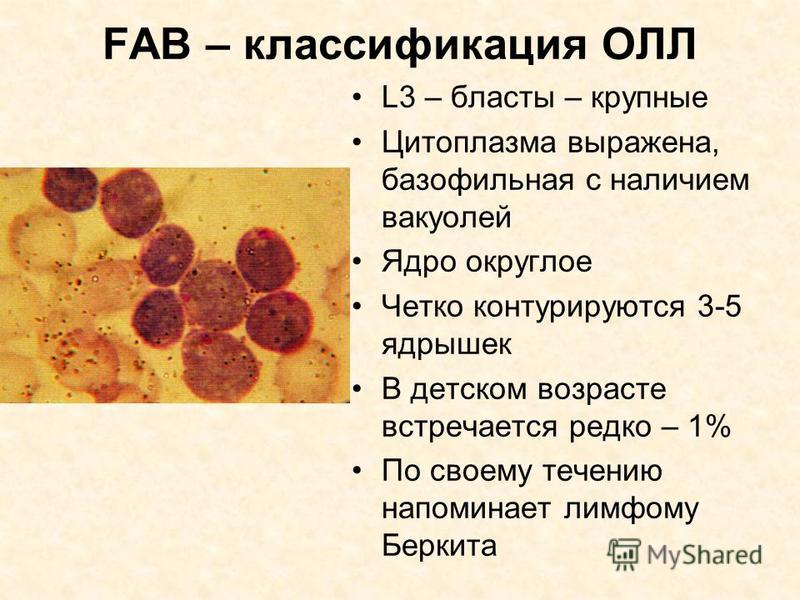 Ежегодно в Соединенных Штатах регистрируется около 3000 случаев ОЛЛ у детей и подростков в возрасте до 21 года. У ALL один из самых высоких показателей излечения от всех детских онкологических заболеваний.
Ежегодно в Соединенных Штатах регистрируется около 3000 случаев ОЛЛ у детей и подростков в возрасте до 21 года. У ALL один из самых высоких показателей излечения от всех детских онкологических заболеваний.
Острый лимфобластный лейкоз поражает незрелые формы белых кровяных телец, называемые лимфоцитами. Существует два основных типа лимфоцитов: B-лимфоциты и T-лимфоциты, и их незрелые формы являются источником двух соответствующих подгрупп ALL, T-ALL и B- или pre-B ALL.
Задача лимфоцитов — идентифицировать и уничтожать чужеродные белки в организме, такие как бактерии и вирусы.При ОЛЛ костный мозг производит слишком много незрелых лимфоцитов (называемых лимфобластами), которые не созревают правильно. Незрелые клетки крови (бласты) не обладают способностью бороться с инфекцией. Лимфобласты перепроизводят и вытесняют нормальные кроветворные клетки в костном мозге.
Наиболее частыми признаками и симптомами острого лимфобластного лейкоза у детей являются:
- Анемия.
 Анемия возникает, когда нормальные красные кровяные тельца не могут быть произведены, потому что костный мозг переполнен лейкозными клетками.Ребенок с анемией может быть более уставшим, больше спать, выглядеть бледным, а его сердце может биться чаще. Количество эритроцитов в анализе крови (выраженное как «гемоглобин» или «гематокрит») будет ниже нормы.
Анемия возникает, когда нормальные красные кровяные тельца не могут быть произведены, потому что костный мозг переполнен лейкозными клетками.Ребенок с анемией может быть более уставшим, больше спать, выглядеть бледным, а его сердце может биться чаще. Количество эритроцитов в анализе крови (выраженное как «гемоглобин» или «гематокрит») будет ниже нормы. - Кровотечение и / или синяк. Когда костный мозг не может производить достаточное количество тромбоцитов, может возникнуть кровотечение, особенно если количество тромбоцитов меньше 10-20 000 / мм3. Низкий уровень тромбоцитов может вызвать у ребенка более легкие синяки или кровотечение.
- Боль в костях и суставах. Боль в костях и суставах обычно возникает из-за того, что костный мозг переполнен лейкозными бластами. Это часто ошибочно принимают за «боли роста».
- Рецидивирующие лихорадки / инфекции. У ребенка с лейкемией часто проявляются неспецифические симптомы инфекции, такие как лихорадка и утомляемость.
 Хотя анализ крови ребенка, больного лейкемией, может показать большое количество лейкоцитов, эти клетки незрелые и обычно не борются с инфекцией. В результате у ребенка могут возникнуть трудности с выздоровлением от обычной детской инфекции или у него могут развиться необычные инфекции.
Хотя анализ крови ребенка, больного лейкемией, может показать большое количество лейкоцитов, эти клетки незрелые и обычно не борются с инфекцией. В результате у ребенка могут возникнуть трудности с выздоровлением от обычной детской инфекции или у него могут развиться необычные инфекции. - Боль в животе. Клетки лейкемии могут накапливаться в почках, печени и селезенке, вызывая увеличение этих органов, что может вызвать боль в животе. Эта боль может привести к потере аппетита и потере веса.
- Увеличение лимфатических узлов. Лимфатические узлы фильтруют кровь. Клетки лейкемии часто скапливаются в узлах, вызывая отек. Отек возникает в лимфатических узлах на шее, под мышками, в паху и груди. Иногда бывает трудно отличить лимфатические узлы лейкемии от лимфатических узлов, которые являются нормальной частью реакции организма на инфекцию или аллергию.
- Затрудненное дыхание. При лейкемии, особенно при Т-клеточном ОЛЛ, клетки могут скапливаться вместе в вилочковой железе, железе под грудиной и вокруг горла.
 Эта масса клеток может вызвать затруднение дыхания. Любое свистящее дыхание, кашель и / или затрудненное или болезненное дыхание требует немедленной медицинской помощи.
Эта масса клеток может вызвать затруднение дыхания. Любое свистящее дыхание, кашель и / или затрудненное или болезненное дыхание требует немедленной медицинской помощи.
Диагноз острого лимфобластного лейкоза у детей основывается на полном анамнезе и физикальном обследовании, а также на следующих диагностических тестах:
- Общий анализ крови. Кровь, взятая через руку или через капельницу, используется для определения количества лейкоцитов, а также тромбоцитов. Анализы крови могут быть выполнены для оценки состояния печени и почек, а также того, как кровь свертывается.
- Аспират и биопсия костного мозга. При аспирации и биопсии костного мозга вводят иглу в кость в тазу или позвоночнике и извлекают около 2 чайных ложек костного мозга для исследования. Исследования костного мозга требуют обезболивающих и, как правило, седативных препаратов или общей анестезии.
- Люмбальная пункция (спинномозговая пункция).
 Спинальная пункция включает введение иглы в нижнюю часть спины, между костями позвоночника или позвоночника, для удаления жидкости, окружающей головной и спинной мозг. Эту же иглу можно использовать для введения лекарств для профилактики или лечения лейкемии в головном или спинном мозге (интратекальная химиотерапия).
Спинальная пункция включает введение иглы в нижнюю часть спины, между костями позвоночника или позвоночника, для удаления жидкости, окружающей головной и спинной мозг. Эту же иглу можно использовать для введения лекарств для профилактики или лечения лейкемии в головном или спинном мозге (интратекальная химиотерапия). - Рентген грудной клетки. Рентген грудной клетки делается для того, чтобы увидеть, есть ли в тимусе масса клеток, которые могут повлиять на дыхание.
Лечение острого лимфобластного лейкоза обычно начинается с устранения признаков и симптомов, которые есть у вашего ребенка, таких как анемия, кровотечение и / или инфекция. Кроме того, лечение лейкемии будет включать большую часть следующего:
- Химиотерапия. Химиотерапия — это лекарства, которые помогают бороться с раком. Их вводят внутрь, в вену, в мышцы или под кожу.
- Интратекальные препараты / химиотерапия. Интратекальная химиотерапия — это химиотерапия, которая вводится в спинномозговую жидкость для предотвращения или лечения лейкемии в головном и спинном мозге.
 Интратекальные препараты / химиотерапия включают введение лекарств через иглу в заполненное жидкостью пространство вокруг спинного мозга.
Интратекальные препараты / химиотерапия включают введение лекарств через иглу в заполненное жидкостью пространство вокруг спинного мозга. - Переливания крови. Переливание крови используется для пациентов с анемией, которые не могут вырабатывать собственные эритроциты. Тромбоциты обычно переливают при низком уровне тромбоцитов. Химиотерапия, вызывающая анемию и низкий уровень тромбоцитов, часто требует переливания крови.
- Антибиотики. Антибиотики используются для профилактики или лечения инфекций.
- Размещение постоянной линии. Когда центральная венозная линия используется для забора крови или приема лекарств, пластиковая трубка или катетер вводится в большую вену на груди, шее или руке. Использование центральной линии предотвращает множество уколов иглой.
- Лучевая терапия. Лучевая терапия использует волны высокой энергии, такие как рентгеновские лучи, для уничтожения или уменьшения раковых клеток.
 Он редко используется для лечения лейкемии в центральной нервной системе или других местах, таких как глаза или яички.
Он редко используется для лечения лейкемии в центральной нервной системе или других местах, таких как глаза или яички. - Трансплантация крови и костного мозга. Трансплантация крови и костного мозга состоит из трех этапов: 1) забор здоровых стволовых клеток у здорового донора или у самого пациента; 2) введение высоких доз химиотерапии и, возможно, лучевой терапии для уничтожения оставшихся лейкозных клеток; и 3) инфузия здоровых стволовых клеток через внутривенную линию для получения нормальных кроветворных клеток. Трансплантация костного мозга или стволовых клеток обычно используется для лечения ОЛЛ, не поддающегося лечению химиотерапией или имеющего очень высокий риск рецидива.
Этапы лечения
Лечение острого лимфобластного лейкоза занимает месяцы или годы и проходит в три или более этапов.
Индукция
Индукция относится к первому месяцу лечения или около того, во время которого вводится комбинация химиотерапевтических препаратов для уменьшения количества лейкозных клеток с видимых до невидимых под микроскопом. Цель этого этапа лечения — уменьшить количество лейкозных клеток в костном мозге до минимума и освободить место для возвращения нормальных эритроцитов, лейкоцитов и тромбоцитов.Когда это происходит, говорят, что лейкемия находится в «ремиссии».
Цель этого этапа лечения — уменьшить количество лейкозных клеток в костном мозге до минимума и освободить место для возвращения нормальных эритроцитов, лейкоцитов и тромбоцитов.Когда это происходит, говорят, что лейкемия находится в «ремиссии».
Консолидация
При ОЛЛ консолидация включает в себя один или два месяца медикаментозного лечения. На этом этапе мишенью становятся редкие оставшиеся лейкозные клетки. Пациенту еженедельно делают спинномозговую пункцию, чтобы предотвратить попадание лейкемии в мозг / спинномозговую жидкость.
Промежуточное обслуживание
Пациенты получают метотрексат в сочетании с другими химиотерапевтическими средствами. В некоторых протоколах метотрексат следует назначать в стационаре.
Усиление
При ОЛЛ интенсификация включает повторение химиотерапевтических комбинаций, аналогичных тем, которые использовались для индукции и консолидации несколько месяцев спустя. Этот этап немного более интенсивен, и около половины пациентов попадают в больницу из-за лихорадки, инфекции или других побочных эффектов.
Техническое обслуживание
Этот этап лечения включает повторные курсы менее интенсивной химиотерапии каждые 28 дней в течение дополнительных 2–3 лет. Ежемесячные амбулаторные посещения необходимы для определения реакции на лечение, выявления любых рецидивов заболевания и устранения побочных эффектов лечения.
У некоторых детей, лечившихся от острого лимфобластного лейкоза, спустя годы могут развиться осложнения. Наша программа по выживанию после рака предоставляет информацию о потенциальных долгосрочных эффектах конкретного лечения, полученного вашим ребенком, включая способы отслеживания и лечения этих эффектов.
О детском остром лимфобластном лейкозе (ОЛЛ) — Институт рака Дана-Фарбер
Острый лимфобластный лейкоз (ОЛЛ), также известный как острый лимфолейкоз, представляет собой быстро прогрессирующее заболевание, при котором в костном мозге (мягком губчатом центре длинных костей) обнаруживается слишком много аномальных лейкоцитов. Острый лимфобластный лейкоз
на нее приходится от 75 до 80 процентов детских лейкозов, и 85 процентов вновь диагностированных пациентов становятся выжившими без каких-либо событий. В некоторых случаях у детей, которые лечатся от ОЛЛ и достигают первоначальной полной ремиссии, будет заболевание.
вернуть; это известно как рецидивирующий острый лимфобластный лейкоз.
Острый лимфобластный лейкоз
на нее приходится от 75 до 80 процентов детских лейкозов, и 85 процентов вновь диагностированных пациентов становятся выжившими без каких-либо событий. В некоторых случаях у детей, которые лечатся от ОЛЛ и достигают первоначальной полной ремиссии, будет заболевание.
вернуть; это известно как рецидивирующий острый лимфобластный лейкоз.
Дети и подростки с острым лимфобластным лейкозом лечатся в Детском онкологическом центре Дана-Фарбер / Бостон по программе детской лейкемии.
Dana-Farber / Boston Children’s предлагает широкий спектр услуг и программ поддержки для педиатрических пациентов и их семей во время и после лечения рака.
Симптомы детства ВСЕ
Поскольку лейкоз — это рак костного мозга, начальные симптомы часто связаны с нарушением функции костного мозга. Костный мозг отвечает за производство клеток крови в организме, включая эритроциты, лейкоциты и тромбоциты. Хотя ваш ребенок может испытывать симптомы по-разному, некоторые из наиболее распространенных ВСЕ-симптомов включают:
- Анемия : Лейкемия часто вызывает анемию (низкое количество эритроцитов), потому что костный мозг становится слишком переполненным лейкозными клетками, чтобы производить нормальные эритроциты.
 Ваш ребенок может выглядеть усталым и бледным, и он может дышать быстрее.
чтобы компенсировать снижение способности ее клеток переносить кислород.
Ваш ребенок может выглядеть усталым и бледным, и он может дышать быстрее.
чтобы компенсировать снижение способности ее клеток переносить кислород. - Боль в костях и суставах : Ваш ребенок может испытывать боли в костях и суставах. Эта боль обычно является результатом переполнения и переполнения костного мозга. Многие дети испытывают боли в пояснице или хромают.
- Синяки или петехии : Когда костный мозг слишком переполнен для выработки тромбоцитов, у вашего ребенка могут возникать синяки.Вы можете заметить петехии или крошечные красные точки на коже, если у вашего ребенка мало тромбоцитов. Эти очень маленькие кровеносные сосуды, которые «просочились» или кровоточили. Хотя эти симптомы не представляют непосредственного риска, они указывают на возможность более серьезной основной проблемы. Анализ крови покажет аномально низкое количество тромбоцитов.
- Лихорадка : У многих детей с ОЛЛ лихорадка не связана с конкретной инфекцией, хотя иногда лихорадка во время постановки диагноза может быть признаком инфекции.

- Рецидивирующие инфекции : Хотя в анализе крови вашего ребенка может быть необычно высокое количество лейкоцитов, эти лейкоциты еще не созрели и не борются с инфекцией. У вашего ребенка могли быть несколько вирусных или бактериальных инфекции, возникшие в течение последних нескольких недель, и могут проявляться симптомы инфекции, такие как жар, насморк и кашель.
- Боль в животе : Боль в животе также может быть симптомом лейкемии. Клетки лейкемии могут накапливаться в почках, печени и селезенке вашего ребенка, вызывая увеличение этих органов.Боль в животе может привести к потере аппетита у ребенка. и похудеть.
- Увеличение лимфатических узлов : У вашего ребенка также может быть опухоль лимфатических узлов под мышками или в паху, груди и шее. Клетки лейкемии могут скапливаться в узлах, вызывая отек.
- Одышка (затрудненное дыхание) : В некоторых случаях ОЛЛ лейкозные клетки имеют тенденцию слипаться и образовывать массу в середине грудной клетки. Эта масса в груди может вызвать у ребенка боль и затруднение дыхания.Свистящее дыхание, кашель и / или болезненное дыхание требует немедленной медицинской помощи.
ALL может вызывать различные симптомы у детей в зависимости от их возраста и типа заболевания. Имейте в виду, что симптомы ALL могут напоминать другие более распространенные состояния или проблемы со здоровьем. Всегда консультируйтесь с терапевтом вашего ребенка для постановки диагноза.
B-клеточный Острый лимфобластный лейкоз у детей: симптомы, лечение и многое другое
Острый лимфобластный лейкоз (ОЛЛ) является наиболее распространенным типом рака у детей.Он влияет на определенные клетки иммунной системы, называемые В-клетками и Т-клетками. ОЛЛ обычно поражает В-клетки у детей.
Естественно беспокоиться, узнав, что у вашего ребенка острый лимфобластный лейкоз, но имейте в виду, что почти все дети могут быть излечены от этого заболевания.
B-клетка ALL повышает вероятность заражения вашего ребенка инфекциями, потому что у них нет защиты этих B-клеток.
Болезнь начинается в костном мозге вашего ребенка, который является губчатым центром костей, где растут новые клетки крови.Клетки лейкемии растут очень быстро и переполняют костный мозг, поэтому костный мозг не может производить достаточно нормальных клеток.
Ваш ребенок будет проходить курс химиотерапии для лечения болезни. Некоторым детям может потребоваться пересадка стволовых клеток. Во время лечения важно не подпускать больных, чтобы ребенок не улавливал то, что у них есть.
После того, как ваш ребенок закончит лечение, он может освободиться от ВСЕГО. Им нужно будет идти на прием к врачу, чтобы он не вернулся.
Причины
В большинстве случаев врачи не знают, что вызывает В-клеточный ОЛЛ у детей.
Некоторые факторы делают это заболевание более вероятным, включая воздействие высоких доз рентгеновских лучей и других форм радиации или лечение рака с помощью химиотерапии. Дети с определенными генетическими заболеваниями, такими как синдром Дауна, также более подвержены ОЛЛ.
Симптомы
ВСЕ симптомы начинаются, когда лейкозные клетки вытесняют нормальные клетки крови в костном мозге. Типы симптомов вашего ребенка будут зависеть от количества раковых клеток и здоровых клеток крови.
Дети с В-клетками ОЛЛ могут:
- Кровотечение или синяк более легко, чем обычно
- Чувство сильной усталости
- Чаще заражаются
- Теряют аппетит
Другие симптомы включают:
Если раковые клетки перемещаются Что касается печени и селезенки вашего ребенка, эти органы могут вырасти достаточно большими, чтобы вызвать вздутие живота. У некоторых мальчиков яички также могут увеличиваться в размерах.
Получение диагноза
Чтобы узнать, есть ли у вашего ребенка В-клеточный ALL, врач может задать вам такие вопросы, как:
- Когда вы заметили изменения в своем ребенке?
- Какие симптомы есть у вашего ребенка?
- Есть ли у кого-нибудь в вашей семье ВСЕ?
- Есть ли у вашего ребенка синдром Дауна или другое генетическое заболевание?
Врач может провести анализы крови, чтобы выяснить, есть ли у вашего ребенка ВСЕ, и если да, то какого он типа.Они используют анализы крови, чтобы проверить количество кровяных телец и найти больные лейкоциты.
Вашему ребенку может потребоваться исследование костного мозга. Врач возьмет образцы костного мозга, как правило, из ноги или позвоночника.
Для этого теста ваш ребенок ляжет на стол и сделает укол, от которого онемеет. Затем врач с помощью очень тонкой иглы берет небольшое количество жидкого костного мозга и проверяет его под микроскопом, глядя на размер и форму лейкоцитов.Те, которые выглядят так, будто они не полностью развились, могут быть признаком того, что у вашего ребенка ВСЕ В-клетки.
Вопросы, которые следует задать своему врачу
Когда у вашего ребенка диагностирован какой-либо вид рака, у вас обязательно возникнет много вопросов к врачу, например:
- Какие методы лечения будут лучше всего работать для ВСЕГО моего ребенка?
- Как долго это продлится?
- Каковы шансы, что он вылечит моего ребенка?
- Какие побочные эффекты это может вызвать? Как долго продлятся эти побочные эффекты?
- Что я должен рассказать своему ребенку о раке и его лечении?
Лечение
Поскольку этот тип ОЛЛ быстро растет, вашему ребенку необходимо как можно скорее начать лечение.Лучше всего это делать в центре, специализирующемся на онкологических заболеваниях у детей.
Ваш ребенок будет лечиться поэтапно:
Первый этап: Ваш ребенок пойдет в больницу и получит химиотерапевтические препараты, чтобы убить все лейкозные клетки, которые врачи смогут найти. Цель — добиться ремиссии рака. Это не лекарство, но оно позволит костному мозгу вашего ребенка снова вырабатывать здоровые клетки крови. У большинства детей ремиссия наступает через 1 месяц лечения. Ваш врач может назвать эту фазу «индукцией».»
Продолжение
Фаза 2: Ваш ребенок получит химиотерапевтические препараты, чтобы убить любые раковые клетки, оставшиеся в его теле. Ваш врач может назвать эту фазу консолидацией или усилением. Она длится от 4 до 6 месяцев.
Далее, Ваш ребенок получит терапию, чтобы избавиться от всех злокачественных новообразований в организме и предотвратить его повторное появление. Это называется поддерживающей терапией. Он будет получать более низкие дозы химиотерапии в течение 2–3 лет.
Ваш врач внимательно изучит, как идет лечение.Они проверит костный мозг вашего ребенка вскоре после начала лечения, чтобы убедиться, что он побеждает лейкоз. В конце лечения врач может сделать анализы крови, чтобы убедиться, что рак полностью исчез. Если врач обнаружит раковые клетки, вашему ребенку может потребоваться дополнительное лечение.
Трансплантация стволовых клеток . Если вашему ребенку не станет лучше после лечения или ВСЕ вернется, ему может потребоваться пересадка стволовых клеток, чтобы костный мозг снова заработал. Это не «эмбриональные» стволовые клетки, о которых вы можете услышать в новостях.Это клетки, которые живут в костном мозге и помогают создавать новые клетки крови.
Продолжение
Когда вашему ребенку сделают трансплантацию стволовых клеток, он получит клетки от донора. Этот человек может быть близким родственником, например братом или сестрой, или подходящим донором, которого нет в вашей семье. Клетки также могут поступать из пожертвованной пуповины.
Чтобы подготовиться к трансплантации, врачи, вероятно, назначат вашему ребенку высокие дозы радиации или химиотерапии, чтобы убить раковые клетки.После этого они получат новые стволовые клетки через капельницу. Это не повредит.
После трансплантации стволовым клеткам потребуется не менее нескольких дней, чтобы размножиться и начать производить новые клетки крови. В течение этого времени им, возможно, придется оставаться в больнице до тех пор, пока количество лейкоцитов не поднимется достаточно, чтобы защитить их от инфекции.
Когда ваш ребенок вернется домой, ему нужно будет каждый день в течение нескольких недель посещать клинику для проверки. Может пройти около 6 месяцев, прежде чем количество нормальных кровяных телец в их организме вернется к должному.
Продолжение
CAR Т-клеточная терапия . FDA одобрило тип генной терапии как для детей, так и для взрослых, у которых В-клеточный ОЛЛ не улучшается с помощью других методов лечения.
CAR Т-клеточная терапия использует некоторые из ваших собственных иммунных клеток, известных как Т-клетки, для лечения вашего рака. Врачи извлекают клетки из вашей крови и изменяют их, добавляя новые гены. Новые Т-клетки могут лучше работать, чтобы находить и уничтожать раковые клетки.
Забота о ребенке
Лечение B-клеточного ОЛЛ может повысить вероятность инфицирования.Старайтесь держать их подальше от больных. Всем, кто близок вашему ребенку, следует сделать прививки от таких болезней, как грипп и пневмония, и часто мыть руки.
Диагноз рака может быть очень сложным для ребенка. У них могут быть вопросы или опасения, о которых вы не знаете. Убедитесь, что ваш ребенок получает необходимую эмоциональную поддержку в это время. Друзья, члены семьи, социальные работники и терапевты могут оказать большую помощь. Вашему ребенку также может потребоваться дополнительное обучение, чтобы наверстать потерянное время в школе.
Чего ожидать
За последние 30 лет методы лечения В-клеточных ВСЕХ значительно улучшились. Сегодня у большинства детей, лечившихся от этого рака, нет рака.
После излечения вашему ребенку все равно нужно будет часто посещать врача, чтобы убедиться, что рак не вернется. Врач также проверит наличие проблем, которые могут вызвать ВСЕ виды лечения, включая повреждение сердца и другие виды рака. Со временем ваш ребенок будет реже посещать врача.
Получение поддержки
Чтобы узнать больше о В-клеточном остром лимфобластном лейкозе у детей или найти группу поддержки в вашем районе, посетите веб-сайты Фонда детской лейкемии и Общества лейкемии и лимфомы.
Острый лимфобластный лейкоз у детей: основы практики, предпосылки, патофизиология
Pui CH, Robison LL, Look AT. Острый лимфобластный лейкоз. Ланцет . 2008 22 марта. 371 (9617): 1030-43. [Медлайн].
Кампана Д. Роль мониторинга минимальных остаточных заболеваний при остром лимфобластном лейкозе у взрослых и детей. Гематол Онкол Клин Норт Ам . 2009 г., 23 (5): 1083-98, vii. [Медлайн]. [Полный текст].
Рибера Дж. М., Ориол А.Острый лимфобластный лейкоз у подростков и молодых людей. Гематол Онкол Клин Норт Ам . 2009 октября, 23 (5): 1033-42, vi. [Медлайн].
Марголин Дж.Ф., Стеубер С.П., Поплак Д.Г. Острый лимфобластный лейкоз. Pizzo PA Poplack DG, ред. Принципы и практика детской онкологии . 15 изд. 2006. 538-90.
Hunger SP, Lu X, Devidas M, Camitta BM, Gaynon PS, Winick NJ, et al. Повышение выживаемости детей и подростков с острым лимфобластным лейкозом в период с 1990 по 2005 год: отчет детской онкологической группы. Дж. Клин Онкол . 2012 10 мая. 30 (14): 1663-9. [Медлайн]. [Полный текст].
Pui CH, Mullighan CG, Evans WE, Relling MV. Острый лимфобластный лейкоз у детей: куда мы идем и как мы туда доберемся ?. Кровь . 2012, 9 августа. 120 (6): 1165-74. [Медлайн]. [Полный текст].
Ribeiro KB, Buffler PA, Metayer C. Социально-экономический статус и заболеваемость острым лимфолейкозом в детском возрасте в Сан-Паулу, Бразилия. Инт Дж. Рак .2008 15 октября. 123 (8): 1907-12. [Медлайн].
Питерс Р., Шраппе М., Де Лоренцо П., Ханн И., Де Росси Г., Феличе М. и др. Протокол лечения младенцев младше 1 года с острым лимфобластным лейкозом (Interfant-99): обсервационное исследование и многоцентровое рандомизированное исследование. Ланцет . 21 июля 2007 г. 370 (9583): 240-50. [Медлайн].
Маграт I, Шанта В., Адвани С., Адде М., Арья Л.С., Банавали С. и др. Лечение острого лимфобластного лейкоза в странах с ограниченными ресурсами; уроки от использования единого протокола в Индии за двадцатилетний период [исправлено]. Eur J Cancer . 2005 июл. 41 (11): 1570-83. [Медлайн].
Муваккит С., Аль-Ариди С., Самра А., Сааб Р., Махфуз Р.А., Фарра С. и др. Внедрение интенсивного протокола стратифицированного по риску лечения детей и подростков с острым лимфобластным лейкозом в Ливане. Ам Дж. Гематол . 2012 Июль 87 (7): 678-83. [Медлайн].
de Labarthe A, Rousselot P, Huguet-Rigal F, Delabesse E, Witz F, Maury S и др. Иматиниб в сочетании с индукционной или консолидационной химиотерапией у пациентов с острым лимфобластным лейкозом de novo Филадельфии с положительной хромосомой: результаты исследования GRAAPH-2003. Кровь . 2007 15 февраля. 109 (4): 1408-13. [Медлайн].
Dubansky AS, Boyett JM, Falletta J, Mahoney DH, Land VJ, Pullen J, et al. Изолированная тромбоцитопения у детей с острым лимфобластным лейкозом: редкое событие в групповом исследовании детской онкологии. Педиатрия . 1989 декабрь 84 (6): 1068-71. [Медлайн].
Gaynon PS. Острый лимфобластный лейкоз и рецидив в детстве. Br J Haematol . 2005 декабрь 131 (5): 579-87.[Медлайн].
Ганесан П., Тулкар С., Гупта Р., Бахши С. Детский алейкемический лейкоз с гиперкальциемией и поражениями костей, имитирующими метаболическое заболевание костей. Дж. Педиатр Эндокринол Метаб . 2009 Май. 22 (5): 463-7. [Медлайн].
Kawedia JD, Kaste SC, Pei D, Panetta JC, Cai X, Cheng C и др. Фармакокинетические, фармакодинамические и фармакогенетические детерминанты остеонекроза у детей с острым лимфобластным лейкозом. Кровь .2011, 24 февраля, 117 (8): 2340-7; викторина 2556. [Medline]. [Полный текст].
te Loo DM, Kamps WA, van der Does-van den Berg A, van Wering ER, de Graaf SS. Прогностическое значение бластов в спинномозговой жидкости без плейоцитоза или травматической люмбальной пункции у детей с острым лимфобластным лейкозом: опыт Голландской группы детской онкологии. Дж. Клин Онкол . 2006 20 мая. 24 (15): 2332-6. [Медлайн].
FDA одобрило применение препарата Гливек для детей с острым лимфобластным лейкозом [пресс-релиз].Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Доступно по адресу http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm336868.htm. Доступ: 1 февраля 2013 г.
Ли С., Ким Й.Дж., Мин С.К., Ким Х.Дж., Эом К.С., Ким Д.В. и др. Влияние промежуточной терапии иматинибом первой линии на исход аллогенной трансплантации стволовых клеток у взрослых с впервые диагностированным острым лимфобластным лейкозом, положительным по филадельфийской хромосоме. Кровь . 2005 1 мая. 105 (9): 3449-57. [Медлайн].
Pulsipher MA, Peters C, Pui CH.Острый лимфобластный лейкоз у детей высокого риска: трансплантировать или не трансплантировать ?. Пересадка костного мозга Biol . 2011 17 января (1 приложение): S137-48. [Медлайн]. [Полный текст].
Schultz KR, Bowman WP, Aledo A, Slayton WB, Sather H, Devidas M и др. Улучшение ранней бессобытийной выживаемости с применением иматиниба при остром лимфобластном лейкозе с положительной хромосомой в Филадельфии: исследование детской онкологической группы. Дж. Клин Онкол . 2009, 1. 27 (31): 5175-81. [Медлайн].[Полный текст].
Schrappe M, Hunger SP, Pui CH, Saha V, Gaynon PS, Baruchel A, et al. Исходы после неудачной индукции при остром лимфобластном лейкозе у детей. N Engl J Med . 2012 Апрель 12, 366 (15): 1371-81. [Медлайн]. [Полный текст].
Buitenkamp TD, Израэли S, Zimmermann M, Forestier E, Heerema NA, van den Heuvel-Eibrink MM, et al. Острый лимфобластный лейкоз у детей с синдромом Дауна: ретроспективный анализ группы исследования Понте ди Леньо. Кровь . 2014 2 января 123 (1): 70-7. [Медлайн]. [Полный текст].
Bhojwani D, Pui CH. Рецидив острого лимфобластного лейкоза в детском возрасте. Ланцет Онкол . 2013 май. 14 (6): e205-17. [Медлайн].
Mullighan CG, Phillips LA, Su X, Ma J, Miller CB, Shurtleff SA и др. Геномный анализ клонального происхождения рецидивирующего острого лимфобластного лейкоза. Наука . 28 ноября 2008 г. 322 (5906): 1377-80. [Медлайн]. [Полный текст].
Blincyto (блинатумомаб) [вкладыш в упаковке]. Таузенд-Окс, Калифорния: Amgen Inc., декабрь 2014 г. Доступно на [Полный текст].
Schlegel P, Lang P, Zugmaier G, Ebinger M, Kreyenberg H, Witte KE, et al. Педиатрический посттрансплантационный рецидивирующий / рефрактерный B-предшественник острого лимфобластного лейкоза демонстрирует стойкую ремиссию при терапии блинатумомабом, участвующим в биспецифических антителах к Т-клеткам. Haematologica . 2014 июл.99 (7): 1212-9. [Медлайн].[Полный текст].
Паркер С., Уотерс Р., Лейтон С., Хэнкок Дж., Саттон Р., Мурман А.В. и др. Влияние митоксантрона на исходы у детей с первым рецидивом острого лимфобластного лейкоза (ALL R3): открытое рандомизированное исследование. Ланцет . 2010 г. 11 декабря. 376 (9757): 2009-17. [Медлайн]. [Полный текст].
Campana D, Leung W. Клиническое значение минимальной остаточной болезни у пациентов с острым лейкозом, перенесших трансплантацию гемопоэтических стволовых клеток. Br J Haematol . 2013 Июль 162 (2): 147-61. [Медлайн].
Одобрение FDA дает первую генную терапию в Соединенных Штатах. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . 30 августа 2017 г. Доступно по адресу https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm574058.htm.
Eapen M, Raetz E, Zhang MJ и др. совместное исследование Детской онкологической группы и Центра международных исследований трансплантации крови и костного мозга. Кровь . 15 июня. 107 (12): 4961-7.
Cheok MH, Evans WE. Острый лимфобластный лейкоз: модель фармакогеномики терапии рака. Нат Рев Рак . 2006 Февраль 6 (2): 117-29. [Медлайн].
Джонс Л.К., Саха В. Филадельфийский острый лимфобластный лейкоз у детей. Br J Haematol . 2005 августа 130 (4): 489-500. [Медлайн].
Brentjens RJ, Curran KJ. Новые клеточные методы лечения лейкемии: Т-клетки, модифицированные CAR, нацелены на антиген CD19. Образовательная программа по гематологии и соц.гематол . 2012. 2012: 143–51. [Медлайн].
CAR Т-клетки: разработка иммунных клеток пациентов для лечения их рака. Национальный институт рака. Доступно по адресу https://www.cancer.gov/about-cancer/treatment/research/car-t-cells#option. 7 августа 2017 г .; Доступ: 30 августа 2017 г.
Смит М., Гудман Б. FDA одобряет первое в своем роде лечение рака. Медицинские новости Medscape. Медицинские новости Медскейп .30 августа 2017 г. Доступно по адресу: http://www.webmd.com/cancer/news/20170830/fda-approves-breakthrough-cancer-treatment?ecd=wnl_nal_083017&ctr=wnl-nal-083017_nsl-ld-stry_1&mb=jt7Y3G4gtU2VE3GcIFTYV2 % 40qU% 3d.
Kymriah (tisagenlecleucel) [вставка в упаковку]. Восточный Ганновер, Нью-Джерси: Novartis Pharmaceuticals Corporation. Август 2017 г. Доступно в [Полный текст].
Mullighan CG, Su X, Zhang J, Radtke I., Phillips LA, Miller CB, et al.Удаление IKZF1 и прогноз при остром лимфобластном лейкозе. N Engl J Med . 2009 29 января. 360 (5): 470-80. [Медлайн]. [Полный текст].
Mullighan CG, Zhang J, Harvey RC, Collins-Underwood JR, Schulman BA, Phillips LA, et al. Мутации JAK при остром лимфобластном лейкозе у детей высокого риска. Proc Natl Acad Sci U S A . 2009 г. 9 июня. 106 (23): 9414-8. [Медлайн]. [Полный текст].
Fuster JL, Bermúdez M, Galera A, Llinares ME, Calle D, Ortuño FJ.Мезилат иматиниба в сочетании с химиотерапией у четырех детей с de novo и поздней стадией филадельфийского хромосомно-положительного острого лимфобластного лейкоза. Haematologica . 2007 декабрь 92 (12): 1723-4. [Медлайн].
Hackethal V. TKI могут стать новым вариантом лечения ВСЕХ подтипов. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/831525. Доступ: 24 сентября 2014 г.
Робертс К.Г., Ли Й., Пейн-Тернер Д., Харви Р.С., Ян Ю.Л., Пей Д. и др.Целевые поражения, активирующие киназу, при Ph-подобном остром лимфобластном лейкозе. N Engl J Med . 2014 11 сентября. 371 (11): 1005-15. [Медлайн]. [Полный текст].
Боггс В. Неврологические изменения происходят спустя долгое время после детской лимфоидной злокачественной опухоли. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/810241. Доступ: 11 сентября 2013 г.
Gordijn MS, Gemke RJ, van Dalen EC, Rotteveel J, Kaspers GJ. Подавление оси гипоталамус-гипофиз-надпочечники (HPA) после лечения глюкокортикоидной терапией острого лимфобластного лейкоза у детей. Кокрановская база данных Syst Rev . 2012 16 мая. 5: CD008727. [Медлайн].
Henze G, v Stackelberg A, Eckert C. ALL-REZ BFM — последовательные испытания для детей с рецидивирующим острым лимфобластным лейкозом. Клинский Падиатр . 2013 май. 225 Приложение 1: S73-8. [Медлайн].
Hijiya N, Barry E, Arceci RJ. Клофарабин при остром лейкозе у детей: современные данные и проблемы. Рак крови у детей . 2012 Сентябрь 59 (3): 417-22.[Медлайн].
Хилл Ф.Г., Ричардс С., Гибсон Б., Ханн И., Лиллейман Дж., Кинси С. и др. Успешное лечение без краниальной лучевой терапии детей, получающих усиленную химиотерапию острого лимфобластного лейкоза: результаты стратифицированного по риску рандомизированного исследования лечения центральной нервной системы MRC UKALL XI (ISRC TN 16757172). Br J Haematol . 2004, январь 124 (1): 33-46. [Медлайн].
Хонг Д., Гупта Р., Анклифф П., Атцбергер А., Браун Дж., Сонеджи С. и др.Инициирующие и распространяющие рак клетки при детской лейкемии, связанной с TEL-AML1. Наука . 2008 18 января. 319 (5861): 336-9. [Медлайн].
Ландье В., Бхатия С., Эшелман Д.А., Форте К.Дж., Суини Т., Хестер А.Л. и др. Разработка основанных на оценке рисков руководящих принципов для детей, переживших рак: Долгосрочные последующие рекомендации Детской онкологической группы Комитета по поздним эффектам детской онкологической группы и сестринской дисциплины. Дж. Клин Онкол . 2004 15 декабря.22 (24): 4979-90. [Медлайн].
le Viseur C, Hotfilder M, Bomken S, Wilson K, Röttgers S, Schrauder A, et al. При остром лимфобластном лейкозе у детей бласты на разных стадиях иммунофенотипического созревания обладают свойствами стволовых клеток. Раковые клетки . 2008 июл 8. 14 (1): 47-58. [Медлайн]. [Полный текст].
Mulcahy N. FDA одобряет Иматиниб для лечения ВСЕХ педиатрических препаратов. Медицинские новости Medscape. 25 января 2013 г. Medscape Medical News. Доступно по адресу http: // www.medscape.com/viewarticle/778062. Доступ: 1 февраля 2013 г.
Натан П.С., Василевски-Маскер К., Янцен, Л.А. Отдаленные результаты у лиц, переживших острый лимфобластный лейкоз в детском возрасте. Гематол Онкол Клин Норт Ам . 2009 октября, 23 (5): 1065-82, vi-vii. [Медлайн].
Pui CH, Campana D, Pei D, Bowman WP, Sandlund JT, Kaste SC, et al. Лечение острого лимфобластного лейкоза у детей без облучения черепа. N Engl J Med .2009, 25 июня. 360 (26): 2730-41. [Медлайн]. [Полный текст].
Pui CH, Carroll WL, Meshinchi S, Arceci RJ. Биология, стратификация риска и терапия острых лейкозов у детей: обновленная информация. Дж. Клин Онкол . 2011 10 февраля. 29 (5): 551-65. [Медлайн]. [Полный текст].
Schuitema I, Deprez S, Van Hecke W., Daams M, Uyttebroeck A, Sunaert S, et al. Ускоренное старение, снижение целостности белого вещества и связанная с ним нейропсихологическая дисфункция через 25 лет после детских лимфоидных злокачественных новообразований. Дж. Клин Онкол . 2013 20 сентября. 31 (27): 3378-88. [Медлайн].
Schultz KR, Pullen DJ, Sather HN, Shuster JJ, Devidas M, Borowitz MJ, et al. Классификация острого лимфобластного лейкоза детского предшественника B-предшественника на основе риска и реакции: комбинированный анализ прогностических маркеров из группы детской онкологии (POG) и детской онкологической группы (CCG). Кровь . 2007 г., 1 февраля. 109 (3): 926-35. [Медлайн]. [Полный текст].
Teachey DT, Hunger SP.Прогнозирование риска рецидива острого лимфобластного лейкоза у детей. Br J Haematol . 2013 Сентябрь 162 (5): 606-20. [Медлайн].
Томас Д.А., Фадерл С., Кортес Дж., О’Брайен С., Джайлс Ф.Дж., Корнблау С.М. и др. Лечение острого лимфоцитарного лейкоза с положительной хромосомой в Филадельфии с помощью гипер-CVAD и мезилата иматиниба. Кровь . 2004 15 июня. 103 (12): 4396-407. [Медлайн].
Гор Л., Кернс П.Р., де Мартино М.Л., Ли, Де Соуза, Калифорния, Бертран И. и др.Дазатиниб у педиатрических пациентов с хроническим миелоидным лейкозом в хронической фазе: результаты исследования фазы II. Дж. Клин Онкол . 1 мая 2018 г. 36 (13): 1330-1338. [Медлайн].
Slayton WB, Schultz KR, Kairalla JA, Devidas M, Mi X, Pulsipher MA и др. Дазатиниб плюс интенсивная химиотерапия у детей, подростков и молодых людей с филадельфийской хромосомно-положительной острой лимфобластной лейкемией: результаты исследования группы детской онкологии AALL0622. Дж. Клин Онкол .1 августа 2018 г. 36 (22): 2306-2314. [Медлайн].
Острый лимфолейкоз — Симптомы и причины
Обзор
Острый лимфоцитарный лейкоз (ОЛЛ) — это разновидность рака крови и костного мозга — губчатой ткани внутри костей, в которой образуются клетки крови.
Слово «острый» при остром лимфоцитарном лейкозе происходит от того факта, что болезнь быстро прогрессирует и приводит к образованию незрелых клеток крови, а не зрелых.Слово «лимфоцитарный» при остром лимфоцитарном лейкозе относится к лейкоцитам, называемым лимфоцитами, на которые влияет ALL . Острый лимфолейкоз также известен как острый лимфобластный лейкоз.
Острый лимфоцитарный лейкоз — наиболее распространенный тип рака у детей, и лечение дает хорошие шансы на излечение. Острый лимфолейкоз также может возникать у взрослых, хотя вероятность излечения значительно снижается.
Продукты и услуги
Показать больше товаров от Mayo ClinicСимптомы
Симптомы острого лимфолейкоза могут включать:
- Кровотечение из десен
- Боль в костях
- Лихорадка
- Частые инфекции
- Частые или сильные носовые кровотечения
- Шишки, вызванные увеличением лимфатических узлов в области шеи, подмышек, живота или паха и вокруг них
- Бледная кожа
- Одышка
- Слабость, утомляемость или общее снижение энергии
Когда обращаться к врачу
Запишитесь на прием к своему врачу или врачу вашего ребенка, если вы заметили какие-либо постоянные признаки и симптомы, которые вас беспокоят.
Многие признаки и симптомы острого лимфолейкоза имитируют симптомы гриппа. Однако со временем признаки и симптомы гриппа улучшаются. Если признаки и симптомы не улучшаются должным образом, запишитесь на прием к врачу.
Причины
Острый лимфоцитарный лейкоз возникает, когда в клетке костного мозга развиваются изменения (мутации) в ее генетическом материале или ДНК. ДНК клетки содержит инструкции, которые говорят клетке, что ей делать.Обычно ДНК говорит клетке расти с заданной скоростью и умереть в заданное время. При остром лимфолейкозе мутации заставляют клетку костного мозга продолжать расти и делиться.
Когда это происходит, производство клеток крови выходит из-под контроля. Костный мозг производит незрелые клетки, которые развиваются в лейкемические белые кровяные тельца, называемые лимфобластами. Эти аномальные клетки не могут нормально функционировать и могут накапливаться и вытеснять здоровые клетки.
Неясно, что вызывает мутации ДНК, которые могут привести к острому лимфолейкозу.
Факторы риска
Факторы, которые могут увеличить риск острого лимфолейкоза, включают:
- Прошедшее лечение рака. Дети и взрослые, прошедшие определенную химиотерапию и лучевую терапию от других видов рака, могут иметь повышенный риск развития острого лимфолейкоза.
- Воздействие радиации. Люди, подвергшиеся очень высоким уровням радиации, например, выжившие после аварии на ядерном реакторе, имеют повышенный риск развития острого лимфолейкоза.
- Генетические нарушения. Определенные генетические нарушения, такие как синдром Дауна, связаны с повышенным риском острого лимфолейкоза.
10 февраля 2021 г.
Симптомы, причины, лечение, перспективы и многое другое
Лейкемия — это тип рака, поражающий кровь. Двумя наиболее распространенными типами у детей являются острый лимфобластный лейкоз и острый миелогенный лейкоз.
У человека, больного лейкемией, клетки крови попадают в кровоток еще до того, как полностью сформировались, поэтому в организме меньше здоровых клеток крови.
Ниже мы описываем типы детской лейкемии, симптомы и методы лечения. Затем мы выясняем, когда обращаться к врачу, какие вопросы задавать и где искать поддержку.
Детский лейкоз — самая распространенная форма рака у детей. Ежегодно он поражает до 3800 детей в возрасте до 15 лет в Соединенных Штатах.
Лейкемия возникает, когда костный мозг выпускает новые клетки крови в кровоток до того, как они полностью созреют.
Эти незрелые клетки крови не функционируют должным образом, и в конечном итоге количество незрелых клеток превышает количество здоровых.
Лейкемия может поражать красные и белые кровяные тельца и тромбоциты.
Костный мозг производит стволовые клетки. Стволовая клетка крови может стать миелоидной стволовой клеткой или лимфоидной стволовой клеткой.
Лимфоидные стволовые клетки становятся лейкоцитами.Миелоидные стволовые клетки могут стать:
- эритроцитами
- лейкоцитами
- тромбоцитами
Лейкоз обычно бывает острым или хроническим, а хронические типы у детей встречаются редко. Они могут включать хронический миелоидный лейкоз или хронический лимфолейкоз.
Большинство детских лейкозов являются острыми, что означает, что они быстро прогрессируют и требуют как можно скорее лечения.
Острый лимфобластный лейкоз
Острый лимфобластный лейкоз (ОЛЛ) — наиболее распространенный тип у детей, на который приходится 75% случаев лейкемии у детей.
Поражает клетки, называемые лимфоцитами, тип белых кровяных телец.
У человека с ОЛЛ костный мозг выделяет большое количество недоразвитых белых кровяных телец, называемых бластными клетками. По мере увеличения их количества количество красных кровяных телец и тромбоцитов уменьшается.
Существует два подтипа ALL: B-клетка и T-клетка.
В большинстве случаев ОЛЛ в детстве рак развивается из ранних форм В-клеток. Другой тип, Т-клеточный ОЛЛ, обычно поражает детей старшего возраста.
Исследования 2020 года показывают, что большинство людей с диагнозом ОЛЛ моложе 18 лет и обычно в возрасте от 2 до 10 лет.
Американское онкологическое общество сообщает, что дети в возрасте до 5 лет имеют самый высокий риск развития ОЛЛ и что этот риск постепенно снижается, пока человеку не исполнится 25 лет.
Перспективы для ВСЕХ зависят от подтипа, возраста человека и факторов, специфичных для каждого человека.
Острый миелогенный лейкоз
На миелоидные лейкозы приходится примерно 20% случаев лейкозов у детей, и большинство миелоидных лейкозов являются острыми.
Острый миелогенный лейкоз (ОМЛ) влияет не на лимфоциты, а на белые кровяные тельца. Это также может повлиять на эритроциты и тромбоциты.
AML может начаться в:
- миелобластов, которые превращаются в белые кровяные тельца, называемые гранулоцитами
- монобласты, которые превращаются в белые кровяные тельца, называемые моноцитами и макрофагами
- эритробласты, которые превращаются в красные кровяные тельца
- мегакариобласты, которые превращаются в в клетки костного мозга, называемые мегакариоцитами
Ювенильный миеломоноцитарный лейкоз (ЮММЛ) составляет примерно 1-2% случаев лейкемии у детей.
Этот редкий тип не является ни острым, ни хроническим. JMML начинается в миелоидных клетках и обычно поражает детей младше 2 лет.
Симптомы могут включать:
- бледная кожа
- лихорадка
- кашель
- легкое кровотечение или синяк
- сыпь
- увеличенная селезенка
- увеличенная печень
- увеличенные лимфатические узлы
- затрудненное дыхание
Симптомы лейкемии могут быть неспецифическими — сходными с симптомами других распространенных детских болезней.
Врач спросит, как долго ребенок испытывает симптомы, которые могут включать:
- кашель
- высыпания
- потеря веса и аппетита
- отек десен, боль и кровотечение
- опухшие лимфатические узлы
- опухоль в лице и руках
- головные боли
- рвота
- крайняя усталость и слабость
- боли в костях и суставах
- затрудненное дыхание
- судороги
Дети могут испытывать специфические симптомы в зависимости от типа клеток крови, на которые влияет лейкоз .
Низкое количество эритроцитов может вызвать:
- холод
- бледность кожи
- головокружение
- одышку
- слабость
Низкое количество здоровых лейкоцитов может вызвать инфекции или лихорадку без других признаков инфекции.
Низкое количество тромбоцитов может вызвать:
- легкое кровотечение
- легкое образование синяков
- частое или сильное носовое кровотечение
- кровоточивость десен
Различные факторы могут увеличить риск лейкемии у ребенка, и большинство из них невозможно предотвратить.
Генетические факторы риска
Следующие генетические состояния могут повышать риск лейкемии:
- Синдром Дауна
- Синдром Ли-Фраумени
- Атаксия-телеангиэктазия
- Синдром Вискотта-Олдрича
- Синдром Блума
- Синдром Швахмана-Даймонда
Кроме того, наличие брата или сестры с лейкемией может увеличить риск ее развития.
Факторы риска окружающей среды
Они могут включать воздействие:
Если у ребенка есть симптомы, которые могут указывать на лейкемию, врач может выполнить или запросить:
- медицинский осмотр
- анализы крови
- аспирацию костного мозга
- биопсия
- люмбальная пункция или спинномозговая пункция
- биопсия лимфатического узла
- визуализационные тесты, такие как компьютерная томография и магнитно-резонансная томография
Аспирация костного мозга включает использование шприца для взятия жидкого образца клеток костного мозга.Врач может дать ребенку лекарство, которое позволяет ему уснуть во время этого теста.
Вопросы, которые нужно задать
В процессе диагностики человек может спросить:
- Какие тесты потребуются?
- Кто будет проводить эти тесты?
- Где они будут выполняться?
- Что повлекут за собой эти испытания?
- Как и когда появятся результаты?
- Кто может объяснить результаты?
- Что будет дальше?
Врач может порекомендовать различные методы лечения детской лейкемии, и лучший вариант зависит от ряда факторов, специфичных для каждого человека.
Лечение обычно состоит из двух этапов. Первая направлена на уничтожение лейкозных клеток в костном мозге ребенка, а вторая — на предотвращение повторного появления рака.
Ребенку могут понадобиться:
- Химиотерапия: Это включает использование смеси лекарств для уничтожения лейкозных клеток. Он может быть в виде инъекций, капель или таблеток.
- Целевые препараты: Они предназначены только для уничтожения лейкозных клеток без повреждения здоровых клеток.
- Иммунотерапия: Этот препарат помогает организму атаковать и разрушать лейкозные клетки.
- Пересадка стволовых клеток: Это включает разрушение костного мозга и замену стволовых клеток посредством трансплантата.
- Излучение: Это включает использование лучей высокой энергии для уничтожения лейкозных клеток.
Вопросы, которые следует задать
До или во время лечения человек может спросить врача:
- Какой тип или комбинацию лечения он рекомендует и почему?
- Какова цель каждого лечения?
- Какие еще типы понадобятся ребенку?
- Каковы побочные эффекты и как их уменьшить?
- Помогут ли витамины или специальные диеты?
- Как скоро следует начать лечение?
- Что можно сделать, чтобы к нему подготовиться?
- Какие записи следует вести во время лечения?
- Что делать дальше?
Вопросы, которые следует задать после лечения, могут включать:
- Когда ребенок почувствует себя лучше?
- Каков график посещений после ухода и последующих посещений?
- Какие анализы необходимы после лечения и как часто?
- Какие долгосрочные последствия для здоровья ожидаются?
- Каковы шансы, что лейкемия вернется?
- Какие симптомы могут возникнуть?
- Если симптомы появятся, к кому следует обратиться?
Детям, прошедшим курс лечения лейкемии, требуется последующий уход, так как лечение часто вызывает отдаленные эффекты.
Они могут развиться у любого, кто проходил лечение от рака, и они могут не возникать в течение месяцев или лет после окончания лечения.
К лечению, которое может вызвать отдаленные эффекты, относятся:
Эти осложнения могут повлиять на:
- функции органов и тканей
- развитие и рост
- психологические корректировки, возможно, связанные с настроением, чувствами и поведением
- обучение, память, и навыки мышления
- риск развития второй формы рака
Поздние эффекты, которые могут возникнуть, также могут зависеть от типа лечения и формы лейкемии.
Поскольку многие симптомы лейкемии могут указывать на другие проблемы, бывает трудно понять, когда обращаться к врачу.
В целом, лучше всего обратиться за медицинской помощью, если у ребенка проявляются симптомы или поведение, которое для него не является нормальным.
Если ребенку поставили диагноз лейкемии, последствия могут распространяться на родителей, других членов семьи, опекунов и друзей.
Человек может получить поддержку и дополнительные ресурсы по адресу:
Следующие организации, базирующиеся в Соединенном Королевстве, также предоставляют поддержку и рекомендации:
Детский лейкоз может повлиять на психическое, а также на физическое здоровье.
Узнайте больше о ресурсах по психическому здоровью здесь.
По данным Американского онкологического общества, у большинства детей, больных лейкемией, нет известных факторов риска. Невозможно предотвратить развитие лейкемии.
Поскольку существует очень мало причин детского лейкоза, связанных с образом жизни или окружающей средой, очень маловероятно, что лицо, осуществляющее уход, может что-то сделать, чтобы предотвратить болезнь.
Внешний вид ребенка зависит от типа лейкемии. Важно помнить, что текущие оценки не принимают во внимание последние достижения в области технологий и медицины.
Например, самые последние оценки 5-летней выживаемости отражают опыт детей, которым поставили диагноз и провели лечение более 5 лет назад.


 Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться, опять-таки в зависимости от конкретного протокола, метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться, опять-таки в зависимости от конкретного протокола, метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
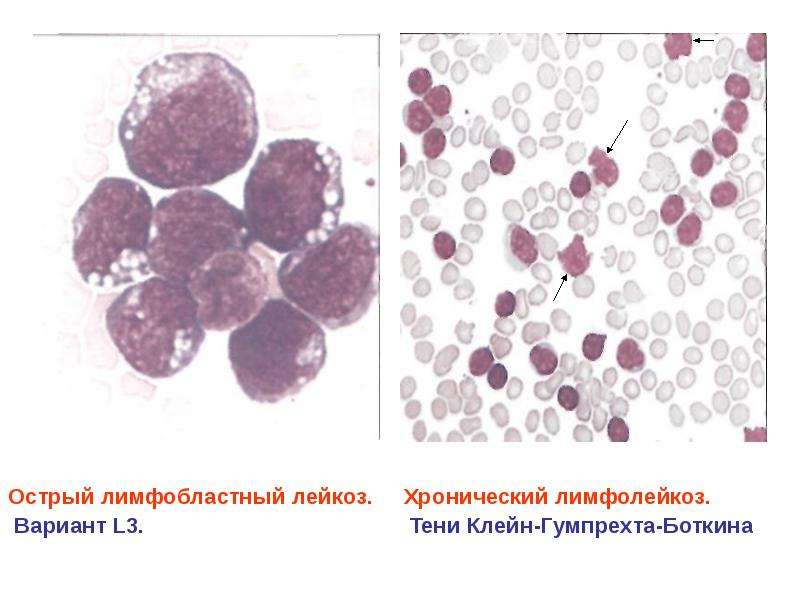 Лихорадка может быть связана и с наличием бактериальной, вирусной, грибковой или протозойной (реже) инфекцией, особенно у детей с нейтропенией [7].
Лихорадка может быть связана и с наличием бактериальной, вирусной, грибковой или протозойной (реже) инфекцией, особенно у детей с нейтропенией [7]. Нередко больные предъявляли жалобы на частые и множественные переломы, в основе которых могут лежать явления остеопороза [13]. Также необходима уточняющая диагностика при подозрении на рецидивирующий мультифокальный остеомиелит [14]. Острый лимфобластный лейкоз в редких случаях проявляется остеоартритом, неправильная интерпретация которого может привести ошибкам в дифференциальной диагностике с ювенильным ревматоидным артритом (ЮРА). У детей с ОЛЛ отмечается асимметричный олигоартрит, который проявляется лихорадкой, бледностью, артритом, ночными болями, болями в костях [19]. Для поражения костной системы в дебюте ОЛЛ характерен полиморфизм рентгенологических проявлений. В одних случаях они малоинформативны (выявляется лишь незначительная периостальная реакция) [15], в других случаях выявлялись остеолиз, остеопения, остеосклероз, патологические переломы, периостальные реакции и смешанные поражения в виде лизис-склероза [16]. Важным симптомом является несоответствие клинической симптоматики рентгенологическим данным.
Нередко больные предъявляли жалобы на частые и множественные переломы, в основе которых могут лежать явления остеопороза [13]. Также необходима уточняющая диагностика при подозрении на рецидивирующий мультифокальный остеомиелит [14]. Острый лимфобластный лейкоз в редких случаях проявляется остеоартритом, неправильная интерпретация которого может привести ошибкам в дифференциальной диагностике с ювенильным ревматоидным артритом (ЮРА). У детей с ОЛЛ отмечается асимметричный олигоартрит, который проявляется лихорадкой, бледностью, артритом, ночными болями, болями в костях [19]. Для поражения костной системы в дебюте ОЛЛ характерен полиморфизм рентгенологических проявлений. В одних случаях они малоинформативны (выявляется лишь незначительная периостальная реакция) [15], в других случаях выявлялись остеолиз, остеопения, остеосклероз, патологические переломы, периостальные реакции и смешанные поражения в виде лизис-склероза [16]. Важным симптомом является несоответствие клинической симптоматики рентгенологическим данным. Сочетание гипертермии, интоксикационного и суставного синдромов может имитировать септический артрит. Однако отсутствие адекватного ответа на антибактериальную терапию позволяет заподозрить ОЛЛ. Патологический процесс в данном случае развивается вследствие метафизарного склероза [3]. Некупируемые болевой и суставной синдромы, характерные для ювенильного идиопатического артрита, необходимо рассматривать с позиций дифференциальной диагностики с ОЛЛ [16]. Подобная клиническая симптоматика в сочетании с панцитопенией характерна для некроза вещества костного мозга [17]. Эти данные подчеркивают важность включения ОЛЛ в дифференциальную диагностику нарушений опорно-двигательного аппарата даже при явно нормальной картине периферической крови.
Сочетание гипертермии, интоксикационного и суставного синдромов может имитировать септический артрит. Однако отсутствие адекватного ответа на антибактериальную терапию позволяет заподозрить ОЛЛ. Патологический процесс в данном случае развивается вследствие метафизарного склероза [3]. Некупируемые болевой и суставной синдромы, характерные для ювенильного идиопатического артрита, необходимо рассматривать с позиций дифференциальной диагностики с ОЛЛ [16]. Подобная клиническая симптоматика в сочетании с панцитопенией характерна для некроза вещества костного мозга [17]. Эти данные подчеркивают важность включения ОЛЛ в дифференциальную диагностику нарушений опорно-двигательного аппарата даже при явно нормальной картине периферической крови.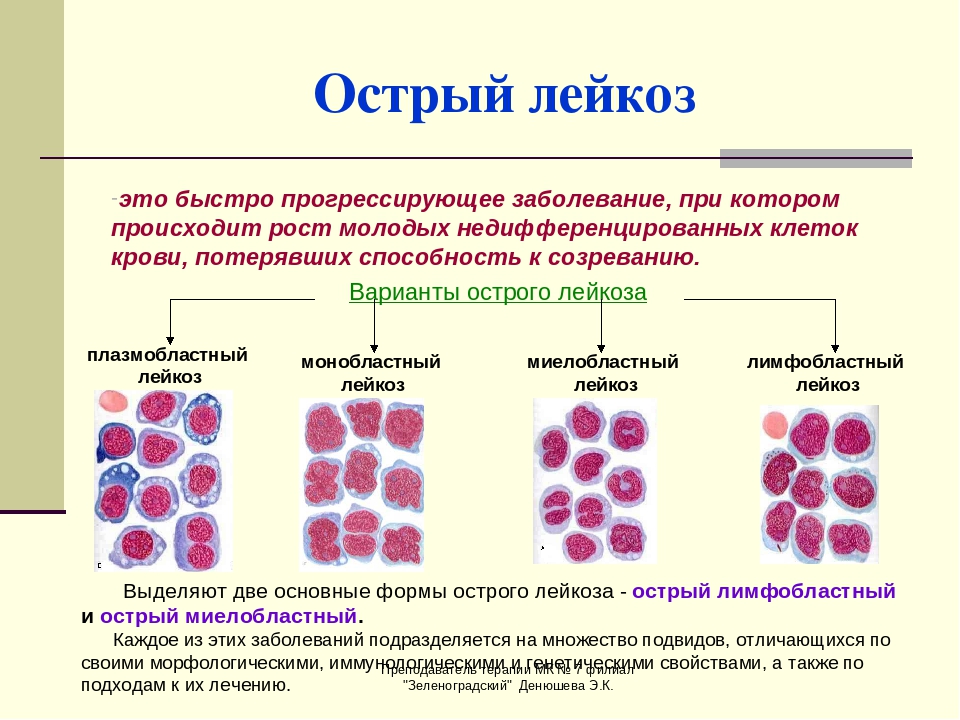 У некоторых детей может наблюдаться симптомокомплекс Микулича (одновременное увеличение лимфатических узлов в подчелюстной, околоушной и окологлазничной области). Возможно значительное увеличение лимфоузлов средостения вплоть до сдавления верхней полой вены (одышка, цианоз, одутловатость лица, пастозность век, выбухание шейных вен). Наряду с лимфоаденопатией в 75% случаев выявляется гепатоспленомегалия, которая не сопровождается болевым синдромом [2, 6].
У некоторых детей может наблюдаться симптомокомплекс Микулича (одновременное увеличение лимфатических узлов в подчелюстной, околоушной и окологлазничной области). Возможно значительное увеличение лимфоузлов средостения вплоть до сдавления верхней полой вены (одышка, цианоз, одутловатость лица, пастозность век, выбухание шейных вен). Наряду с лимфоаденопатией в 75% случаев выявляется гепатоспленомегалия, которая не сопровождается болевым синдромом [2, 6].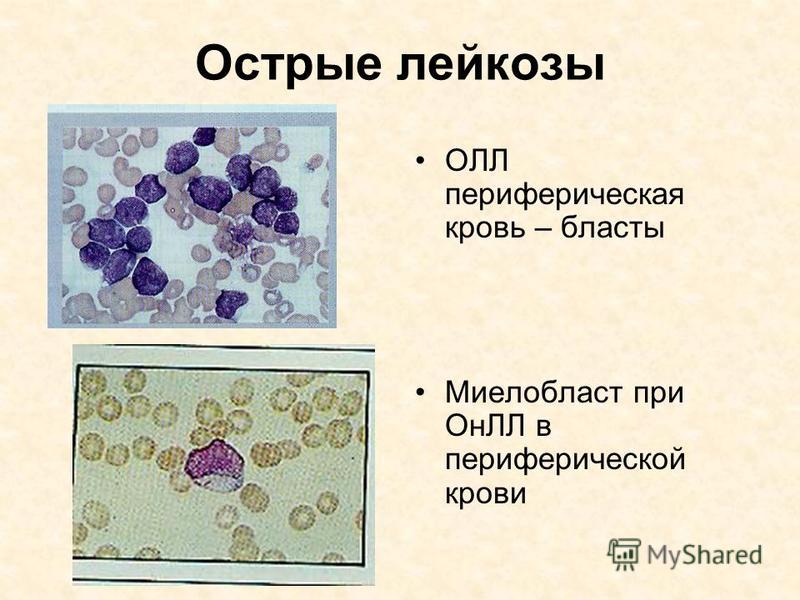
 Описан случай поражения кожи наружного слухового прохода, при котором ребенку первоначально был выставлен диагноз «Диффузный наружный отит» [25].
Описан случай поражения кожи наружного слухового прохода, при котором ребенку первоначально был выставлен диагноз «Диффузный наружный отит» [25].
 Первичным проявлением ОЛЛ в ряде наблюдений явилось изолированное поражение отводящего нерва с соответствующими глазодвигательными симптомами [42, 43]. Помимо поражения ЧМН в клинике могут наблюдаться и проявления нейродегенерации (атаксия-телеангиоэктазия Луи-Бар) с соответствующими иммунными и гематологическими нарушениями [44]. ОЛЛ может дебютировать в виде паранеопластического неврологического синдрома (ПНС), проявляющегося острой мышечной слабостью проксимальных мышц верхних и нижних конечностей [20].
Первичным проявлением ОЛЛ в ряде наблюдений явилось изолированное поражение отводящего нерва с соответствующими глазодвигательными симптомами [42, 43]. Помимо поражения ЧМН в клинике могут наблюдаться и проявления нейродегенерации (атаксия-телеангиоэктазия Луи-Бар) с соответствующими иммунными и гематологическими нарушениями [44]. ОЛЛ может дебютировать в виде паранеопластического неврологического синдрома (ПНС), проявляющегося острой мышечной слабостью проксимальных мышц верхних и нижних конечностей [20]. У пациентов с гиперкальциемией превалируют жалобы со стороны ЖКТ и костно-суставной системы [53].
У пациентов с гиперкальциемией превалируют жалобы со стороны ЖКТ и костно-суставной системы [53].


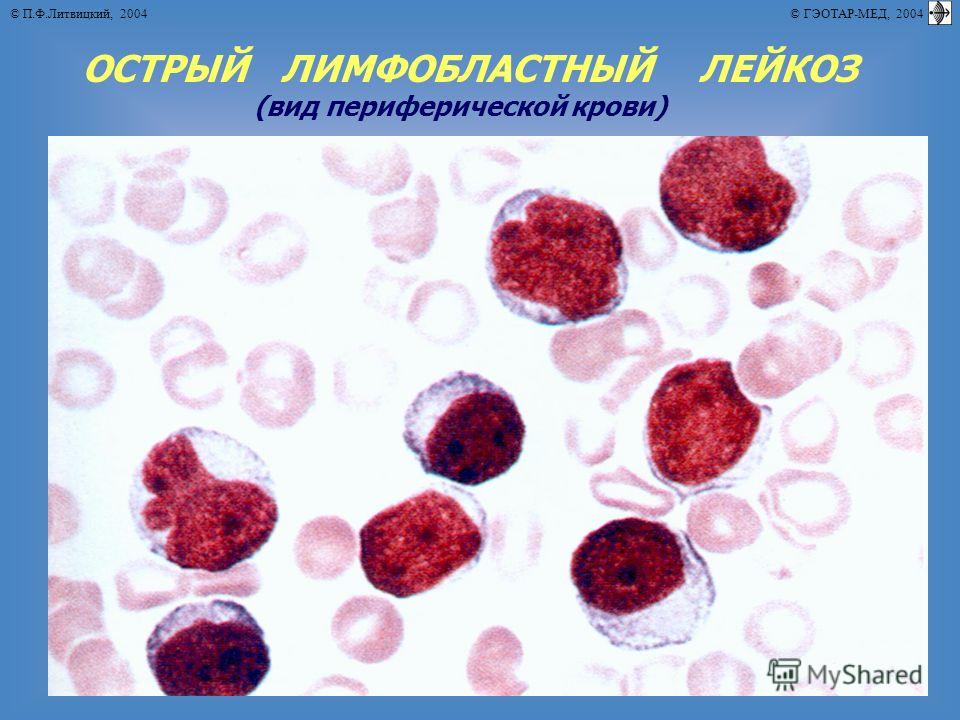 Анемия возникает, когда нормальные красные кровяные тельца не могут быть произведены, потому что костный мозг переполнен лейкозными клетками.Ребенок с анемией может быть более уставшим, больше спать, выглядеть бледным, а его сердце может биться чаще. Количество эритроцитов в анализе крови (выраженное как «гемоглобин» или «гематокрит») будет ниже нормы.
Анемия возникает, когда нормальные красные кровяные тельца не могут быть произведены, потому что костный мозг переполнен лейкозными клетками.Ребенок с анемией может быть более уставшим, больше спать, выглядеть бледным, а его сердце может биться чаще. Количество эритроцитов в анализе крови (выраженное как «гемоглобин» или «гематокрит») будет ниже нормы.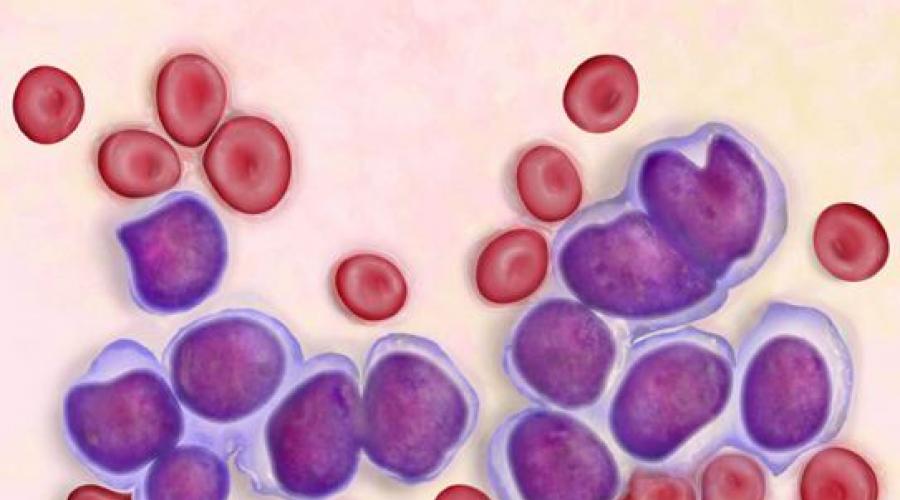 Хотя анализ крови ребенка, больного лейкемией, может показать большое количество лейкоцитов, эти клетки незрелые и обычно не борются с инфекцией. В результате у ребенка могут возникнуть трудности с выздоровлением от обычной детской инфекции или у него могут развиться необычные инфекции.
Хотя анализ крови ребенка, больного лейкемией, может показать большое количество лейкоцитов, эти клетки незрелые и обычно не борются с инфекцией. В результате у ребенка могут возникнуть трудности с выздоровлением от обычной детской инфекции или у него могут развиться необычные инфекции. Эта масса клеток может вызвать затруднение дыхания. Любое свистящее дыхание, кашель и / или затрудненное или болезненное дыхание требует немедленной медицинской помощи.
Эта масса клеток может вызвать затруднение дыхания. Любое свистящее дыхание, кашель и / или затрудненное или болезненное дыхание требует немедленной медицинской помощи. Спинальная пункция включает введение иглы в нижнюю часть спины, между костями позвоночника или позвоночника, для удаления жидкости, окружающей головной и спинной мозг. Эту же иглу можно использовать для введения лекарств для профилактики или лечения лейкемии в головном или спинном мозге (интратекальная химиотерапия).
Спинальная пункция включает введение иглы в нижнюю часть спины, между костями позвоночника или позвоночника, для удаления жидкости, окружающей головной и спинной мозг. Эту же иглу можно использовать для введения лекарств для профилактики или лечения лейкемии в головном или спинном мозге (интратекальная химиотерапия). Интратекальные препараты / химиотерапия включают введение лекарств через иглу в заполненное жидкостью пространство вокруг спинного мозга.
Интратекальные препараты / химиотерапия включают введение лекарств через иглу в заполненное жидкостью пространство вокруг спинного мозга. Он редко используется для лечения лейкемии в центральной нервной системе или других местах, таких как глаза или яички.
Он редко используется для лечения лейкемии в центральной нервной системе или других местах, таких как глаза или яички.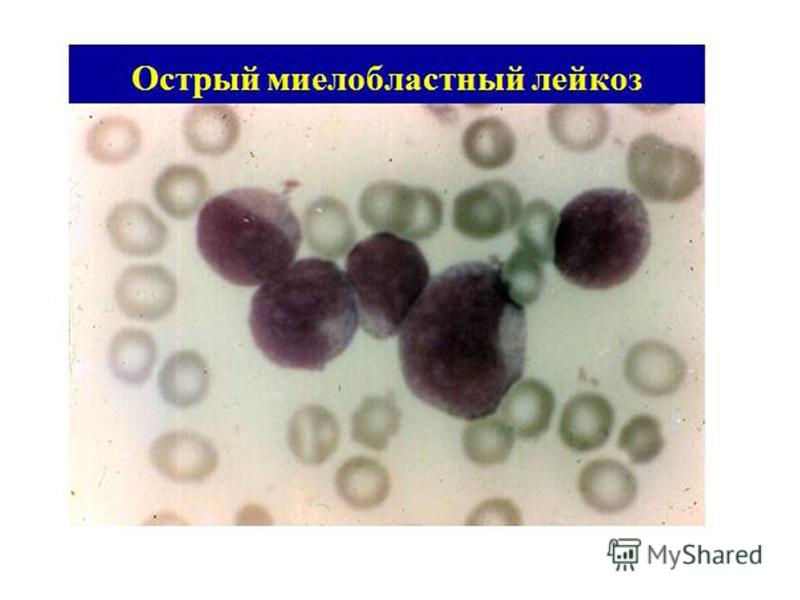 Ваш ребенок может выглядеть усталым и бледным, и он может дышать быстрее.
чтобы компенсировать снижение способности ее клеток переносить кислород.
Ваш ребенок может выглядеть усталым и бледным, и он может дышать быстрее.
чтобы компенсировать снижение способности ее клеток переносить кислород.