Хронический гнойный средний отит: терминология, диагностика и лечебная тактика | Гаров Е.В.
Определение. Хронический гнойный средний отит (ХГСО) – заболевание среднего уха, характеризующееся наличием перфорации барабанной перепонки, периодическими выделениями из среднего уха, шумом в ухе и снижением слуха.
МКБ–10:
H66.1. Хронический туботимпальный гнойный средний отит (хр. туботимпанальная болезнь, мезотимпанит).
H66.2. Хронический эпитимпано–антральный гнойный средний отит (хр. эпитимпано–антральная болезнь, эпитимпанит).
Эпидемиология
ХГСО – распространенная патология среднего уха поликлинического и стационарного уровня оториноларингологической помощи. В структуре заболеваний уха на долю ХГСО приходится 27,2%. Распространенность ХГСО в нашей стране составляет от 8,4 до 39,2 на 1000 населения. Среди пациентов с ЛОР–патологией, которым оказывается помощь в ЛОР–стационарах, 5,7–7% страдают ХГСО, а в сурдологических отделениях – около 40%. ХГСО с частыми обострениями является причиной отогенных осложнений, которые в настоящее время возникают у 3,2% больных: у 1,97% наблюдаются интракраниальные (менингит, абсцесс мозга и др.), у 1,35% – экстракраниальные (субпериостальный абсцесс, лабиринтит и др.) осложнения. Смертность от осложнений при ХГСО составляет 16,1%. Одной из причин развития деструкции в среднем ухе является холестеатома, которая выявляется у 24–63% больных ХГСО при любой локализации перфорации барабанной перепонки. Костная резорбция при отите с холестеатомой, по данным ряда авторов, обнаруживается в 78,8% случаев.
Профилактика. Профилактика ХГСО – это рациональное лечение больных экссудативным и острым средним отитом, а также устранение причин, вызывающих тубарную дисфункцию.

Скрининг. Профилактические осмотры оториноларингологом детского и взрослого населения позволяют выявлять бессимптомные формы данного заболевания. При выявлении тугоухости требуется консультация сурдолога.
Классификация
Согласно 10–й Международной классификации болезней различают хронический туботимпальный гнойный средний отит (мезотимпанит) и хронический эпитимпано–антральный гнойный средний отит (эпитимпанит). В нашей стране придерживаются классификации И.И. Потапова (1959), основанной на локализации, размере перфорации барабанной перепонки и вариантах течения заболевания, где выделяются мезотимпанит, эпитимпанит и эпимезотимпанит. Внедрение эндомикроскопии в практику и результаты патоморфологических исследований при ХГСО показали условность этой классификации вследствие различных морфологических вариантов воспаления и его последствий независимо от локализации дефекта перепонки. Сегодня при длительном течении ХГСО можно встретить сочетание катарального воспаления слизистой оболочки с участками фиброзирования, тимпаносклероза, кариеса и холестеатомы, что отражает динамику воспаления и его исходы. Такой полиморфизм проявлений затрудняет четкое разграничение клинических форм ХГСО (доброкачественный или нет) и объясняет активную хирургическую тактику в каждом случае заболевания.
Жалобы и анамнез. Пациентов с ХГСО беспокоят выделения из больного уха слизистого или гнойного характера, снижение слуха и низкочастотный шум в ухе. Характерными для холестеатомы являются гнойные выделения с неприятным (ихорозным) запахом. При обострении заболевания наблюдаются оталгия, обильные гнойные выделения, головная боль и клинические проявления осложнений (системное головокружение и др.). Частота обострений зависит от локализации перфорации, провоцирующих факторов заболевания и иммунной защиты организма. Для эпитимпанита характерно бессимптомное течение в отличие от мезо– и эпимезотимпанита, для хронического катарального воспаления слизистой оболочки (так называемого мукозита) – постоянные скудные слизистые выделения из среднего уха.

Физикальное обследование. Диагностика ХГСО основывается на характерной отоскопической картине. При отоскопии (отомикроскопии) можно оценить количество и характер отделяемого в слуховом проходе и барабанной полости, дефект барабанной перепонки и ее ретракцию, изменение слизистой оболочки медиальной стенки (от гиперплазии до полипа), состояние окон лабиринта, кариозную деформацию латеральной стенки аттика, рукоятки молоточка и наковальни, выявить грануляции и холестеатому (рис. 1).
При обострении верифицировать эти изменения затруднительно из–за воспалительных изменений кожи слухового прохода, барабанной перепонки и слизистой барабанной полости (рис. 2).
В оценке провоцирующих факторов важную роль играет эндоскопия полости носа и носоглотки.
Исследование слуховой функции с помощью разговорной речи, камертональных тестов (Ринне, Федеричи и Вебера) и тональной пороговой аудиометрии позволяет уточнить степень и характер слуховых нарушений. При ХГСО у больных наблюдается кондуктивная и смешанная тугоухость. На степень тугоухости влияет не только локализация дефекта барабанной перепонки, но и сохранность, подвижность цепи слуховых косточек, наличие адгезий и лабиринтных осложнений.
Комплексное отоневрологическое исследование проводится при системном головокружении у пациента с ХГСО для диагностики отогенных осложнений (фистула лабиринта, лабиринтит и др.).
Инструментальные и лабораторные исследования.
 Для определения распространения процесса и наличия костной деструкции при ХГСО используется рентгенография височных костей по Шюллеру и Маейру. Однако данные исследования представляют меньшую информацию в сравнении с компьютерной томографией (КТ) височных костей. Высокоразрешающая КТ шагом 1–2 мм в аксиальной и коронарной проекции, выполненная в стадии ремиссии, дает полную информацию о состоянии структур височной кости (рис. 4).
Для определения распространения процесса и наличия костной деструкции при ХГСО используется рентгенография височных костей по Шюллеру и Маейру. Однако данные исследования представляют меньшую информацию в сравнении с компьютерной томографией (КТ) височных костей. Высокоразрешающая КТ шагом 1–2 мм в аксиальной и коронарной проекции, выполненная в стадии ремиссии, дает полную информацию о состоянии структур височной кости (рис. 4). Больным ХГСО для назначения адекватной терапии проводится бактериологическое исследование отделяемого из уха на флору и ее чувствительность к антибиотикам. Часто выявляется полиморфная флора, но в то же время для мезотимпанитов характерна аэробная, а для эпитимпанитов – анаэробная флора.
Дифференциальная диагностика
1) Мирингит (бактериальный, грибковый). Характеризуется скудными гнойными выделениями из уха и заложенностью уха. При отоскопии определяются утолщенность барабанной перепонки, грануляции на ее поверхности и грибковые мицелии без нарушения целостности барабанной перепонки (проба Вальсаль).
2) Холестеатома наружного слухового прохода. Проявляется скудными гнойными выделениями с неприятным запахом, грануляциями и деструкцией нижней стенки наружного слухового прохода. Предпосылками для образования служат узкий костный отдел и экзостозы наружного слухового прохода или его травма. Отсутствует снижение слуха. Помощь в диагностике оказывает КТ височных костей.
3) Врожденная холестеатома височной кости. Выявляется, как правило, при КТ височных костей, так как длительное время не проявляет себя клинической симптоматикой. Отсутствует в анамнезе острый средний отит, хорошо развита клеточная система сосцевидного отростка. Клинические проявления обусловлены ростом холестеатомы и деструкцией лабиринта.

4) Туберкулезный перфоративный средний отит. Характеризуется атипичностью течения заболевания, белым фибринозным налетом на медиальной стенке барабанной полости, ранним периферическим парезом лицевого нерва и отсутствием эффекта от общепринятой консервативной терапии. В диагностике важную роль играют патоморфологические исследования биоптатов, рентгеновское исследование грудной клетки и проба Манту.
Показания к консультации других специалистов. При появлении отогенных осложнений (экстракраниальных или интракраниальных) показано проведение магнитно–резонансной томографии головного мозга, консультации невролога, окулиста и нейрохирурга для определения тактики лечения пациента.
Лечение
Цель лечения – ликвидация очага инфекции в среднем ухе для профилактики и коррекции тугоухости, предупреждения отогенных осложнений.
Показания к госпитализации:
• экстренные – при развитии отогенных осложнений на фоне обострения ХГСО госпитализация в ЛОР–отделение ургентной помощи для обследования и хирургического лечения в объеме санации;
• отсроченные – при обострении ХГСО госпитализация в оториноларингологическое отделение для обследования и проведения консервативной терапии;
• плановые – при ремиссии ХГСО госпитализация в сурдологическое отделение для санации и реконструкции структур среднего уха.
Медикаментозное лечение
При обострении ХГСО эффективна местная терапия с применением антибактериальных (ушные капли «Ципромед», «Отофа», «Нормакс», «Данцил» и др.) с учетом чувствительности идентифицированной микрофлоры, гормональных (эмульсия гидрокортизона, р–р дексаметазона) или комбинированных (ушные капли «Комбинил Дуо») препаратов транстимпанально 2 раза в сутки, после удаления отделяемого из уха в течение 7 дней.
 Наличие признаков интоксикации и осложнений определяет парентеральное назначение антибактериальной, дезинтоксикационной и симптоматической терапии.
Наличие признаков интоксикации и осложнений определяет парентеральное назначение антибактериальной, дезинтоксикационной и симптоматической терапии.Консервативная терапия при вялотекущем процессе у больных ХГСО оправдана в течение 10 дней в качестве подготовки пациента к хирургическому вмешательству. В этот период проводится и обследование пациента. Местное лечение в качестве транстимпанальных нагнетаний целесообразно осуществлять с применением антибактериальных (0,5–1% р–р диоксидина, 0,01% р–р мирамистина и др.), муколитических (ацетилцистеин) и гормональных или комбинированных препаратов 2 раза в сутки. Комбинации вышеперечисленных препаратов с местными физическими факторами воздействия (лазерным облучением, электростимуляцией мышц слуховой трубы и др.) уменьшают явления катарального воспаления слизистой оболочки барабанной полости (так называемого мукозита) и улучшают функции слуховой трубы. При диагностике холестеатомы в аттикальной зоне на дооперационном этапе рекомендуется максимально возможное удаление холестеатомных масс и использование препаратов на спиртовой основе (3% р–р борного или левомицетинового спирта) для уменьшения перифокального воспаления посредством дегидратации.
В качестве основного вида лечения консервативная терапия, носящая паллиативный характер, оправдана только у больных с тяжелыми сопутствующими заболеваниями при условии регулярного наблюдения.
Хирургическое лечение
Хирургическая санация при обострении ХГСО с отогенными осложнениями выполняется в экстренном или отсроченном порядке под общей анестезией в объеме аттикоантротомии с удалением задней стенки слухового прохода или в расширенном ее варианте в зависимости от осложнений.

В плановом порядке хирургическое вмешательство у больных ХГСО проводится через 6–12 месяцев после обострения в условиях специализированного отделения. Хирургия на «сухом» ухе всегда менее радикальна, позволяет дифференцировать и сохранить структуры среднего уха, избежать ятрогенных осложнений и добиться лучших результатов. Вместе с тем выбор методики операции индивидуален и определяется длительностью течения ХГСО, степенью распространения и выраженности патологического процесса, анатомическими особенностями сосцевидного отростка, уровнем слуховых нарушений, состоянием слуховой трубы, квалификацией хирурга и наличием современной аппаратуры. В связи с этим отохирурги используют интрамеатальный, эндауральный, заушный или комбинированный хирургические подходы.
При «сухих» центральных дефектах барабанной перепонки у пациентов с ХГСО интрамеатальным подходом после ревизии барабанной полости выполняется тимпанопластика I–III типа (по Х. Вульштейну) с применением в качестве пластических материалов аутотканей (аутохряща, аутофасции и меатального лоскута). При тотальных и субтотальных перфорациях тимпанальной мембраны эффективна только многослойная пластика, где в качестве опорного каркаса используется аутохрящевая пластина, которая при толщине 0,5 мм не влияет на звукопроведение.
У больных ХГСО и мукозитом после ревизии всех отделов барабанной полости и иссечения гиперплазированных участков слизистой оболочки вне зависимости от размера дефекта барабанной перепонки применяется многослойная пластика с (или без) дренирования барабанной полости, что в значительной степени повышает эффективность операции. Как показывают собственные наблюдения, проявления мукозита барабанной полости у больных ХГСО в силу незнания этой патологии часто принимают за обострение с элементами остеодеструкции, что является причиной необоснованного проведения больших по объему санирующих операций.
У пациентов с ХГСО и холестеатомой в зависимости от активности кариозного процесса, его распространенности и наличия осложнений используются щадящие закрытые и открытые методики санирующих хирургических вмешательств с одновременной реконструкцией звукопроводящей цепи аутотканями.
 При кистовидной невоспаленной холестеатоме в аттике и адитусе выполняется аттикоадитотомия интрамеатальным (эндауральным) подходом с удалением холестеатомы, реконструкцией аттика и тимпанопластикой I–III типа (закрытый вариант). При распространении невоспаленной холестеатомы в антрум предпочтительной является раздельная аттикоантротомия с тимпанопластикой комбинированным подходом, которая обеспечивает адекватную санацию и сохранение задней стенки слухового прохода. В зарубежной практике эта методика самая распространенная (69% всех операций при холестеатоме). Обязательным условием выполнения закрытых санирующих вариантов операций является ревизия зоны локализации холестеатомы через 1 год. В случаях воспаленной или стелющейся холестеатомы в зависимости от ее распространения и наличия лабиринтных осложнений проводятся полуоткрытые (аттикоадитотомия) или открытые варианты операции (аттикоантротомия с удалением задней стенки слухового прохода) с тимпанопластикой III–IV типа эндауральным или заушным подходом. При невозможности одновременной тимпанопластики она может быть выполнена вторым этапом через 8–12 месяцев. Результаты тимпанопластики одновременно с санирующей операцией или выполненной вторым этапом существенно не различаются. Формирование большой мастоидальной полости требует мастоидопластики или удаления верхушки сосцевидного отростка для уменьшения послеоперационной полости.
При кистовидной невоспаленной холестеатоме в аттике и адитусе выполняется аттикоадитотомия интрамеатальным (эндауральным) подходом с удалением холестеатомы, реконструкцией аттика и тимпанопластикой I–III типа (закрытый вариант). При распространении невоспаленной холестеатомы в антрум предпочтительной является раздельная аттикоантротомия с тимпанопластикой комбинированным подходом, которая обеспечивает адекватную санацию и сохранение задней стенки слухового прохода. В зарубежной практике эта методика самая распространенная (69% всех операций при холестеатоме). Обязательным условием выполнения закрытых санирующих вариантов операций является ревизия зоны локализации холестеатомы через 1 год. В случаях воспаленной или стелющейся холестеатомы в зависимости от ее распространения и наличия лабиринтных осложнений проводятся полуоткрытые (аттикоадитотомия) или открытые варианты операции (аттикоантротомия с удалением задней стенки слухового прохода) с тимпанопластикой III–IV типа эндауральным или заушным подходом. При невозможности одновременной тимпанопластики она может быть выполнена вторым этапом через 8–12 месяцев. Результаты тимпанопластики одновременно с санирующей операцией или выполненной вторым этапом существенно не различаются. Формирование большой мастоидальной полости требует мастоидопластики или удаления верхушки сосцевидного отростка для уменьшения послеоперационной полости. За рубежом у 73% больных ХГСО с холестеатомой проводятся закрытые операции, у 27% – открытые, в том числе только у 1,3% больных выполняется радикальная санирующая операция на ухе. Многие авторы отмечают одинаковую частоту послеоперационных холестеатом, реперфораций и кохлеарных нарушений при открытых и закрытых методиках операций.
Представленная тактика лечения больных ХГСО позволяет у 92,4% добиться эффективности тимпанопластики, а при холестеатоме у 60% – выполнить операцию по закрытому варианту и у 93% больных провести тимпанопластику с хорошим функциональным результатом.
Прогноз заболевания благоприятный при постоянном наблюдении оториноларинголога, раннем выполнении санирующих, реконструктивных операций и качественном лечении обострений.
Литература
1. Крюков А. И. и соавт. Показатели заболеваемости и качество оказания амбулаторной лор–помощи больным с патологией уха и верхних дыхательных путей в городе Москве // Мат–лы VII науч.–практ. конференции «Фармакологические и физические методы лечения в оториноларингологии». – М., 2008. – с. 10–13.
2. Загайнова Н. С., Бродовская О. Б. О хирургическом лечении хронического гнойного среднего отита // Российская оториноларингология. – 2008. – Прил. 2. – с. 247–249.
3. Тарасов Д. И., Федорова О. К., Быкова В. П. Заболевания среднего уха. – М.: Медицина, 1988. – 185 с.
4. Тос М. Руководство по хирургии среднего уха. – Томск, 2005. – Т. 1, 2.
5. Ajalloueyan M. Experience with surgical management of cholesteatomas // Arch. Otolaryngol. Head Neck Surg., 2006; 132 (9): 931–933.
6. Gacek R. Ear surgery. – Springer – Verlag, Berlin, Heidelberg, 2008: 120 s.
7. Ikeda M. et al. Canal wall down tympanoplasty with canal reconstruction for middle–ear cholesteatoma: post–operative hearing, cholesteatoma recurrence, and status of re–aeration of reconstructed middle–ear cavity // J. Laryngology & Otology, 2003; 117 (4): 249–255.
8. Mishiro Y. et al.Tympanoplasty with and without mastoidectomy for non–cholesteatomatous chronic otitis media // Eur. Arch. Otorhinolaryngol., 2001; 258: 13–15.
9. Osma U., Cureoglu S., Hosoglu S. The complications of chronic otitis media: report of 93 cases // J. Laryngology & Otology. – 2000; 114 (2): 97–100.
10. Sasaki T. et al. Results of hearing tests after total middle ear reconstruction // Acta Otolaryngologica, 2007; 127 (5): 474–479.
11. Syms M., Luxford W. Management of Cholesteatoma: Status of the Canal Wall // Laryngoscope, 2003; 113 (3): 443–448.
12. Yung M. The use of middle ear endoscopy: has residual cholesteatoma been eliminated? // J. Laryngology & Otology, 2001; 115 (12): 958–961.
.
Порекомендуйте статью вашим коллегам
Заболевания среднего уха и сосцевидного отростка
11 Болезни уха и сосцевидного отростка
Непосредственно поражения среднего уха
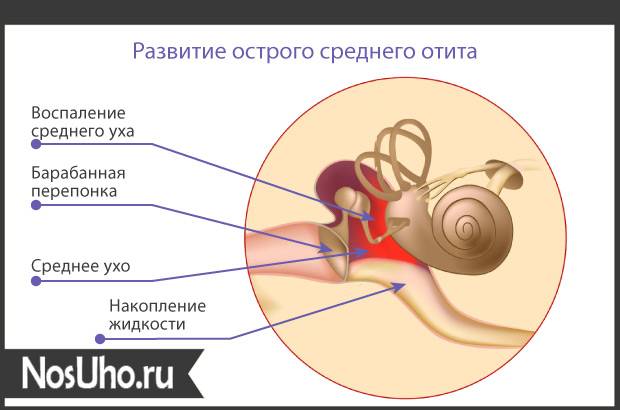
Средний отит
Невоспалительный средний отит
AA80 Острый серозный или слизистый средний отит
AA81 Острый несерозный невоспалительный средний отит
AA82 Хронический серозный или слизистый средний отит
AA83 Неинфекционный средний отит с выпотом
AA8Z Невоспалитеьный средний отит, неуточненный
Гнойный отит
AA90 Острый гнойный отит
AA91 Хронический гнойный отит
AA91.0 Хронический туботимпанический гнойный отит
AA91.1 Хронический аттикоантральный гнойный отит
AA91.2 Другой уточненный хронический гнойный средний отит
AA91.Z Хронический гнойный средний отит, неуточненный
AA9Y Другие уточненные гнойные средние отиты
AA9Z Гнойные отиты, неуточненные
AB00 Острый средний отит
AA81 Острый несерозный невоспалительный средний отит
AA90 Острый гнойный средний отит
AB01 Хронический средний отит
AA82 Хронический серозный или слизистый средний отит
AA91 Хронический гнойный отит
AB0Y Другие уточненные средние отиты
AB0Z Средние отиты, неуточненные
AB10 Заболевания евстахиевой трубы
AB10.0 Дивертикул евстахиевой трубы
AB10.1 Зияющая евстахиева труба
AB10.2 Воспаление евстахиевой трубы
AB10.3. Закупорка евстахиевой трубы
AB10.Y Другие уточненные заболевания евстахиевой трубы
AB10.Z Заболевания евстахиевой трубы, неуточненные
AB11 Мастоидит или связанные с ним состояния
AB11.0 Острый мастоидит
AB11.1 Хронический мастоидит
AB11.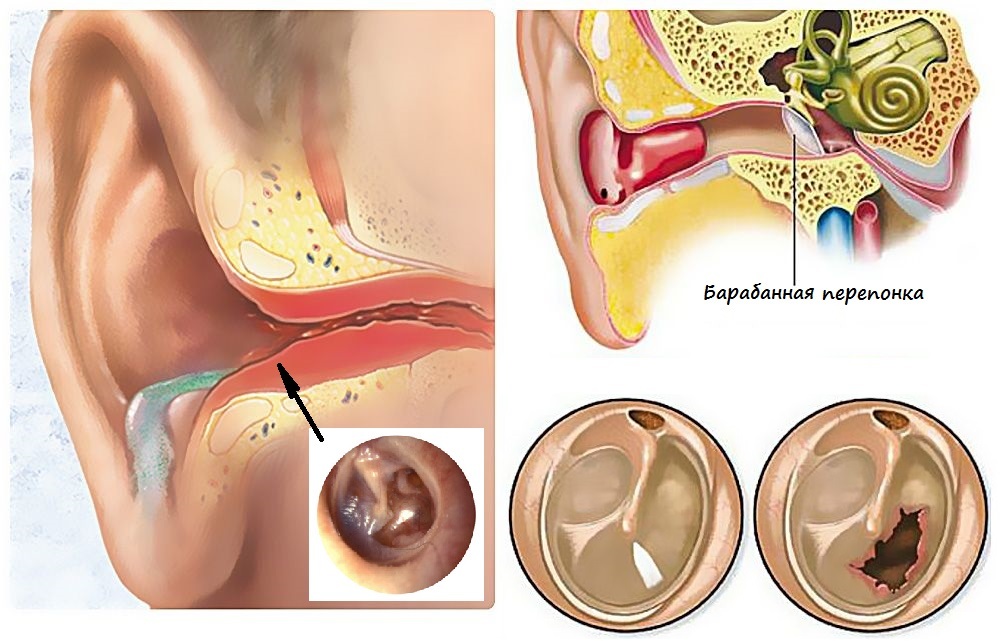 2 Петрозит
2 Петрозит
AB11.3 Мастоидиты, не классифицированные в других рубриках
AB11.Y Другие уточненные мастоидиты или связанные с ними состояния
AB11.Z Мастоидит или связанные с ним состояния, неуточненные
AB12 Холестеатома среднего уха
AB13 Перфорация барабанной перепонки
AB13.0 Центральная перфорация барабанной перепонки
AB13.1 Аттическая перфорация барабанной перепонки
AB13.2 Другие краевые перфорации барабанной перепонки
AB13.Y Другая уточненная перфорация барабанной перепонки
AB13.Z Перфорация барабанной перепонки, неуточненная
AB14 Острый мирингит
AB15 Хронический мирингит
AB16 Тимпаносклероз
AB17 Адгезивные заболевания среднего уха
AB18 Разрыв или дислокация слуховых косточек
AB19 Приобретенные аномалии слуховых косточек, не связанные с разрывом или вывихом
AB1A Полип среднего уха
AB1A.0 Ауральный полип
AB1A.Y Другой уточненный полип среднего уха
AB1A.Z Полип среднего уха, неуточненный
AB1B Шрам среднего уха
AB50.0 Врожденная кондуктивная потеря слуха
AB33 Отосклероз
AB50.2 Врожденная смешанная кондуктивная и нейросенсорная потеря слуха
AB1Y Другие уточненные заболевания среднего уха или сосцевидного отростка
AB1Z Болезни среднего уха или сосцевидного отростка, неуточненные
код по МКБ 10: наружный, острый, средний
МКБ 10 — это международная классификация болезней 10-го пересмотра, принятая в 1999-м году. Каждому заболеванию присваивается код или шифр для удобства хранения и обработки статистических данных. Периодически (каждые десять лет) происходит пересмотр МКБ 10, в ходе которого система корректируется и дополняется новыми сведениями.
Отит представляет собой болезнь воспалительного типа, которая базируется в ухе. В зависимости от того, в каком отделе органа слуха локализуется воспаление, в МКБ 10 отит разделяется на три основные группы: наружный, средний, внутренний. Заболевание может иметь дополнительную маркировку в каждой группе, указывающую на причину развития или форму протекания патологии.
Заболевание может иметь дополнительную маркировку в каждой группе, указывающую на причину развития или форму протекания патологии.
Содержание статьи
Наружный отит H60
Наружное воспаление уха, которое также называют «ухом пловца», — это воспалительное заболевание внешнего слухового прохода. Недуг получил такое название в связи с тем, что риск подхватить заражение наиболее велик именно у пловцов. Объясняется это тем, что воздействие влаги на протяжении длительного время провоцирует инфицирование.
Также наружное воспаление уха часто развивается у людей, которые работают во влажной и жаркой атмосфере, пользуются слуховыми аппаратами или затычками для ушей. Незначительная царапина на внешнем слуховом проходе тоже может стать причиной развития болезни.
Основные симптомы:
- зуд, боль в слуховом проходе инфицированного уха;
- выделение гнойных масс из пораженного уха.
Наружный отит
Внимание! В случае закупоривания уха гнойными массами не прочищайте инфицированное ухо в домашних условиях, это может быть чревато осложнением заболевания. При обнаружении выделений из уха рекомендуется сразу же обратиться к врачу.
По МКБ 10 код наружного отита имеет дополнительную маркировку:
- Н60.0 — формирование нарыва, гнойника, скопление гнойных выделений;
- Н60.1 — целлюлит наружного уха — поражение ушной раковины;
- Н60.2 — злокачественная форма;
- Н60.3 — диффузный или геморрагический наружный отит;
- Н60.4 — образование опухоли с капсулой в наружном отделе уха;
- Н60.5 — неинфицированное острое воспаление наружного уха;
- Н60.6 — иные формы патологии, в том числе хроническая форма;
- Н60.7 — неуточненный наружный отит.
Средний отит H65-H66
Медики стараются как можно глубже проникнуть в тайны болезней для их более эффективного лечения. На данный момент различают много видов патологии, среди которых есть и негнойные виды с отсутствием воспалительных процессов в среднем ухе.
На данный момент различают много видов патологии, среди которых есть и негнойные виды с отсутствием воспалительных процессов в среднем ухе.
Негнойное воспаление среднего уха характерно накоплением жидкости, которую больной ощущает не сразу, а уже на более поздних сроках заболевания. Болевые ощущения при протекании болезни могут отсутствовать полностью. Отсутствие повреждений барабанной перепонки может также затруднить диагностику.
Справка. Чаще всего негнойное воспаление в среднем ухе наблюдается у мальчиков до 7 лет.
Данную болезнь можно разделить по многим факторам, среди которых особенно выделяют:
- время течения заболевания;
- клинические стадии болезни.
Острый средний отит
В зависимости от времени течения заболевания выделяют следующие его формы:
- Острая, при которой воспаление уха длится до 21 дня. Несвоевременное лечение или его отсутствие может привести к необратимым последствиям.
- Подострая — более сложная форма патологии, которая лечится в среднем до 56 дней и часто приводит к осложнениям.
- Хроническая — самая сложная форма заболевания, которая может затухать и возвращаться на протяжении всей жизни.
Выделяют следующие клинические стадии болезни:
- катаральная — длится до 30 дней;
- секреторная — болезнь протекает до года;
- мукозная — затяжное лечение или усложнение болезни до двух лет;
- фиброзная — самая тяжелая стадия болезни, которая может лечиться более двух лет.
Основные симптомы заболевания:
- дискомфорт в области уха, его заложенность;
- чувство, что собственный голос звучит слишком громко;
- ощущение переливающейся жидкости в ухе;
- устойчивое снижение уровня слуха.
Важно! При первых подозрительных симптомах воспаления уха сразу же обратитесь к врачу.
Вовремя поставленный диагноз и необходимая терапия помогут избежать многих осложнений.
Негнойный средний отит (код по МКБ 10 — H65) дополнительно маркируется, как:
- H65.0 — острый средний серозный отит;
- H65.1 — иные острые негнойные средние отиты;
- H65.2 — хронический серозный средний отит;
- H65.3 — хронический слизистый средний отит;
- H65.4 — иные хронические средние отиты негнойного типа;
- H65.9 — негнойный средний отит неуточненный.
Хронический гнойный средний отит
Гнойный средний отит (H66) имеет разделение на блоки:
- Н66.0 — острый гнойный средний отит;
- Н66.1 — хронический туботимпанальный гнойный средний отит или мезотимпанит, сопровождающийся разрывом ушной перепонки;
- Н66.2 — хронический эпитимпано-антральный гнойный средний отит, при котором происходит разрушение слуховых косточек;
- Н66.3 — иные хронические гнойные средние отиты;
- Н66.4 — гнойный средний отит неуточненный;
- Н66.9 — средний отит неуточненный.
Внутренний отит Н83
Одним из наиболее опасных видов воспаления органа слуха врачи считают лабиринтит или внутренний отит (код по МКБ 10 — H83.0). В острой форме патология имеет ярко выраженные симптомы и быстро развивается, в хронической — болезнь протекает медленно с периодическим проявлением симптомов.
Внимание! Несвоевременное лечение лабиринтита может привести к весьма серьезным последствиям.
Локализуется заболевание внутри слухового анализатора. Из-за воспаления, которое находится рядом с мозгом, признаки такого заболевания весьма трудно распознать, так как они могут указывать на разные болезни.
Клинические проявления:- Головокружение, которое может продолжаться довольно долго и исчезать мгновенно.
 Такое состояние очень сложно купировать, поэтому пациент может страдать от слабости и нарушений с вестибулярным аппаратом весьма продолжительное время.
Такое состояние очень сложно купировать, поэтому пациент может страдать от слабости и нарушений с вестибулярным аппаратом весьма продолжительное время. - Нарушение координации движений, которое появляется из-за давления на головной мозг.
- Постоянный шум и потеря слуха — верные признаки заболевания.
Данный вид болезни нельзя лечить самостоятельно, поскольку лабиринтит может быть смертельно опасен и приводить к полной глухоте. Очень важно начать правильное лечение как можно раньше, только так есть большая вероятность обойтись без последствий.
Благодаря наличию понятной классификации (МКБ-10) открывается возможность вести аналитические исследования и накапливать статистику. Все данные берутся из обращений граждан и последующих постановок диагнозов.
Untitled — МКБ-10 :: Хронический экссудативный негнойный…
Международная статистическая классификация болезней и проблем, связанных со здоровьем
Десятый пересмотр
Полный перечень трехзначных рубрик, четырехзначных подрубрик и их содержание
Класс VIII.
Болезни уха и сосцевидного отростка (H60-H95)
Этот класс содержит следующие блоки:
Болезни среднего уха и сосцевидного отростка (H65-H75)
•
H65
Негнойный средний отит
Включено:
с мирингитом
H65.0
Острый средний серозный отит
Острый и подострый секреторный отит
H65.1
Другие острые негнойные средние отиты
Средний отит, острый и подострый:
• аллергический (слизистый) (геморрагический) (серозный)
• слизистый
• негнойный БДУ
• геморрагический
• серозно-слизистый
Исключено:
отит в результате баротравмы (T70.0)
отит средний (острый) БДУ (H66.9)
H65.2
Хронический серозный средний отит
Хронический туботимпанальный катар
H65. 3
3
Хронический слизистый средний отит
“Клейкое” ухо
Хронический средний отит:
• слизистый
• секреторный
• транссудативный
Исключено:
адгезивная болезнь среднего уха (H74.1)
H65.4
Другие хронические негнойные средние отиты
Хронический средний отит:
• аллергический
• экссудативный
• негнойный БДУ
• серозно-муцинозный
• с выпотом (негнойны)
H65.9
Негнойный средний отит неуточненный
Средний отит:
• аллергический
• катаральный
• экссудативный
• слизеподобный
• секреторный
• серозно-слизистый
• серозный
• транссудативный
• с выпотом (негнойный)
•
H66
Гнойный и неуточненный средний отит
Включено:
с мирингитом
H66.0
Острый гнойный средний отит
H66.1
Хронический туботимпанальный гнойный средний отит
Доброкачественный хронический гнойный средний отит
Хроническая туботимпанальная болезнь [мезотимпанит]
H66.2
Хронический эпитимпано-антральный гнойный средний отит
Хроническая эпитимпано-антральная болезнь [эпитимпанит]
H66.3
Другие хронические гнойные средние отиты
Хронический гнойный средний отит БДУ
H66.4
Гнойный средний отит неуточненный
Гнойный средний отит БДУ
H66.9
Средний отит неуточненный
Средний отит:
• БДУ
• острый БДУ
• хронический БДУ
•
H67*
Средний отит при болезнях, классифицированных в других рубриках
H67.0*
Средний отит при бактериальных болезнях, классифицированных в других рубриках
Средний отит при:
• скарлатине (АЗ8 †)
• туберкулезе (A18.6 †)
H67.1*
Средний отит при вирусных болезнях, классифицированных в других рубриках
Средний отит при:
• гриппе (J10-J11 †)
• кори (В05. 3 †)
3 †)
H67.8*
Средний отит при других болезнях, классифицированных в других рубриках
•
H68
Воспаление и закупорка слуховой [евстахиевой] трубы
H68.0
Воспаление слуховой [евстахиевой] трубы
H68.1
Закупорка слуховой [евстахиевой] трубы
Слуховой [евстахиевой] трубы:
• Сдавление
• Стеноз
• Стриктура
•
H69
Другие болезни слуховой [евстахиевой] трубы
H69.0
Зияющая слуховая [евстахиева] труба
H69.8
Другие уточненные болезни слуховой [евстахиевой] трубы
H69.9
Болезнь слуховой [евстахиевой] трубы неуточненная
•
H70
Мастоидит и родственные состояния
H70.0
Острый мастоидит
Сосцевидного отростка:
• Абсцесс
• Эмпиема
H70.1
Хронический мастоидит
Сосцевидного отростка:
• Кариес
• Свищ
H70.2
Петрозит
Воспаление каменистой части височной кости (острое) (хроническое)
H70.8
Другие мастоидиты и родственные состояния
H70.9
Мастоидит неуточненный
•
H71
Холестеатома среднего уха
Холестеатома барабанной перепонки
Исключено:
рецидивирующая холестеатома после мастоидэктомии (H95.0)
холестеатома наружного уха (H60.4)
•
H72
Перфорация барабанной перепонки
Включено:
перфорация барабанной перепонки:
• послевоспалительная
• устойчивая посттравматическая
Исключено:
травматический разрыв барабанной перепонки (S09.2)
H72.0
Центральная перфорация барабанной перепонки
H72.1
Перфорация барабанной перепонки в области аттика
Перфорация pars flaccida
H72.2
Другие краевые перфорации барабанной перепонки
H72.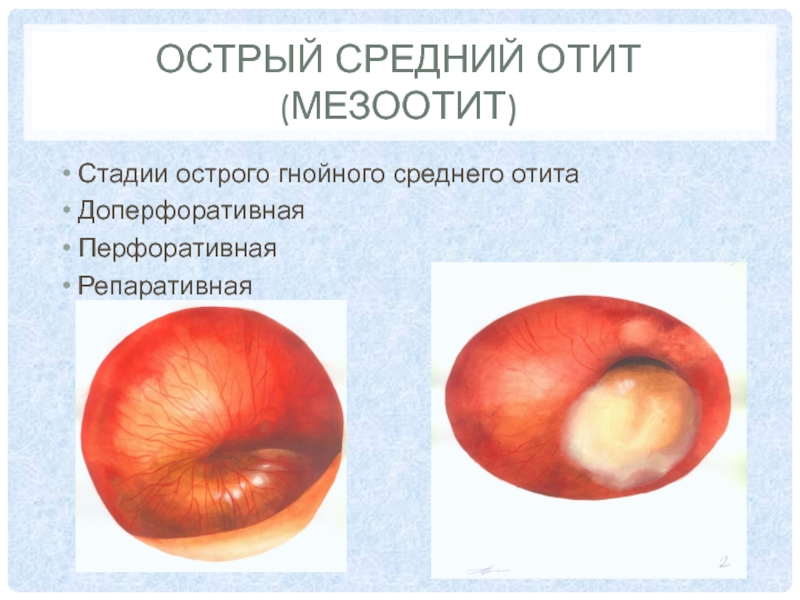 8
8
Другие перфорации барабанной перепонки
Перфорация(ции) барабанной перепонки:
• множественные
• полная
H72.9
Перфорация барабанной перепонки неуточненная
•
H73
Другие болезни барабанной перепонки
H73.0
Острый мирингит
Острый тимпанит
Буллезный мирингит
Исключено:
со средним отитом (H65-H66)
H73.1
Хронический мирингит
Хронический тимпанит
Исключено:
со средним отитом (H65-H66)
H73.8
Другие уточненные болезни барабанной перепонки
H73.9
Болезнь барабанной перепонки неуточненная
•
H74
Другие болезни среднего уха и сосцевидного отростка
H74.0
Тимпаносклероз
H74.1
Адгезивная болезнь среднего уха
Адгезивный отит
Исключено:
“клейкое” ухо (H65.3)
H74.2
Разрыв и дислокация слуховых косточек
H74.3
Другие приобретенные дефекты слуховых косточек
Слуховых косточек:
• Анкилоз
• Частичная утрата
H74.4
Полип среднего уха
H74.8
Другие уточненные болезни среднего уха и сосцевидного отростка
H74.9
Болезнь среднего уха и сосцевидного отростка неуточненная
•
H75*
Другие поражения среднего уха и сосцевидного отростка при болезнях, классифицированных в других рубриках
H75.0*
Мастоидит при инфекционных и паразитарных болезнях, классифицированных в других рубриках
Туберкулезный мастоидит (А18.0 †)
H75.8*
Другие уточненные болезни среднего уха и сосцевидного отростка при болезнях, классифицированных в других рубриках
Содержание
На нашем форуме вы можете задать вопросы о проблемах своего здоровья, получить
поддержку и бесплатную профессиональную рекомендацию специалиста, найти новых знакомых и
поговорить на волнующие вас темы. Это позволит вам сделать собственный выбор на основании
полученных фактов.
Это позволит вам сделать собственный выбор на основании
полученных фактов.
Обратите внимание! Диагностика и лечение виртуально не проводятся! Обсуждаются только возможные пути сохранения вашего здоровья.
Подробнее см. Правила форума
Последние сообщения
Реальный консультативный прием ограничен.
Ранее обращавшиеся пациенты могут найти меня по известным им реквизитам.
Нажми на картинку —
узнай подробности!
Ссылки на внешние страницы
20.05.12
Уважаемые пользователи!
Просьба сообщать о неработающих ссылках на внешние страницы, включая ссылки, не выводящие прямо на нужный материал,
запрашивающие оплату, требующие личные данные и т.д. Для оперативности вы можете сделать это через форму отзыва, размещенную на каждой странице.
Ссылки будут заменены на рабочие или удалены.
Тема от 05.09.08 актуальна!
Остался неоцифрованным 3-й том МКБ. Желающие оказать помощь могут заявить об этом на нашем форуме
05.09.08
В настоящее время на сайте готовится полная
HTML-версия МКБ-10 — Международной классификации болезней, 10-я редакция.
Желающие принять участие могут заявить об этом на нашем форуме
25.04.08
Уведомления об изменениях на сайте можно получить через
раздел форума “Компас здоровья” — Библиотека сайта “Островок здоровья”
отит средний катаральный острый — это… Что такое отит средний катаральный острый?
- отит средний катаральный острый
- (о. media catarrhalis acuta; син. катар среднего уха острый) О. с., характеризующийся появлением в барабанной полости транссудата; возникает в результате распространения воспалительного процесса из полости носа или носоглотки.
Большой медицинский словарь. 2000.
- отит средний гнойный хронический
- отит средний катаральный хронический
Смотреть что такое «отит средний катаральный острый» в других словарях:
отит средний менингококковый — (о.
 media meningococcica) острый катаральный О. с., иногда с образованием очагов некроза слизистой оболочки стенок барабанной полости; возникает как осложнение менингококковой инфекции, гл. обр. в первые дни болезни … Большой медицинский словарь
media meningococcica) острый катаральный О. с., иногда с образованием очагов некроза слизистой оболочки стенок барабанной полости; возникает как осложнение менингококковой инфекции, гл. обр. в первые дни болезни … Большой медицинский словарьСредний отит — Отит МКБ 10 H65.65. H67.67. МКБ 9 3813 … Википедия
ОТИТ — (от греч. ous, otos ухо), воспаление уха; т. к. анатомически ухо делится на наружное (ушная раковина, наружный слуховой проход), среднее (Евстахиева труба, барабанная полость) и внутреннее (лабиринт), то различают отиты наружные, средние и… … Большая медицинская энциклопедия
Отит — I Отит (otitis; греч. us, ōtos ухо + itis) воспаление уха. Различают наружный, средний и внутренний О. Наружный О. см. Наружное ухо, внутренний О. см. Лабиринтит. Воспаление слуховой (евстахиевой) трубы и передних отделов барабанной полости… … Медицинская энциклопедия
ОТИТ — – воспаление уха. Различают наружный, средний и внутренний отит. Наружный отит. Выделяют ограниченный наружный отит (фурункул наружного слухового прохода) и диффузный (разлитой) наружный отит. Ограниченный наружный отит возникает в результате… … Энциклопедический словарь по психологии и педагогике
катар среднего уха острый — см. Отит средний катаральный острый … Большой медицинский словарь
Ката́р сре́днего у́ха о́стрый — см. Отит средний катаральный острый (Отит) … Медицинская энциклопедия
Дуоденит — МКБ 10 K29.829.8 Дуоденит (duodenitis; анат. duodenum двенадцатиперстная кишка + itis) воспалительное заболевание двенадцатиперстной кишки, чаще только слизистой оболочки … Википедия
Гингивит — Острый и хронический гингивит Тяжелая форма гингивита д … Википедия
Патологическая анатомия вирусных детских инфекций — Среди вирусных детских инфекций особое значение имеют корь, полиомиелит, эпидемический паротит, ветряная оспа и инфекционный мононуклеоз.
 Первые три относятся к РНК вирусным заболеваниям; ветряную оспу и инфекционный мононуклеоз вызывают ДНК… … Википедия
Первые три относятся к РНК вирусным заболеваниям; ветряную оспу и инфекционный мононуклеоз вызывают ДНК… … Википедия
| H60-H62 | Болезни наружного уха (H60-H62) |
| H60 | Наружный отит |
| H60.0 | Абсцесс наружного уха (карбункул, фурункул) |
| H60.1 | Целлюлит наружного уха |
| H60.2 | Злокачественный наружный отит |
| H60.3 | Другие инфекционные наружные отиты |
H60. 4 4 | Холестеатома наружного уха |
| H60.5 | Острый наружный отит неинфекционный |
| H60.8 | Другие наружные отиты |
| H60.9 | Наружный отит неуточненный |
| H61 | Другие болезни наружного уха |
| H61.0 | Перихондрит наружного уха |
| H61.1 | Неинфекционные болезни ушной раковины |
H61. 2 2 | Серная пробка |
| H61.3 | Приобретенный стеноз наружного слухового канала |
| H61.8 | Другие уточненные болезни наружного уха |
| H61.9 | Болезнь наружного уха неуточненная |
| H62 | Поражения наружного уха при болезнях, классифицированных в других рубриках |
| H62.0 | Наружный отит при бактериальных болезнях, классифицированных в других рубриках |
H62. 1 1 | Наружный отит при вирусных болезнях, классифицированных в других рубриках |
| H62.2 | Наружный отит при микозах |
| H62.3 | Наружный отит при других инфекционных и паразитарных болезнях, классифицированных в других рубриках |
| H62.4 | Наружный отит при других болезнях, классифицированных в других рубриках |
| H62.8 | Другие поражения наружного уха при болезнях, классифицированных в других рубриках |
| H65-H75 | Болезни среднего уха и сосцевидного отростка (H65-H75) |
| H65 | Негнойный средний отит |
H65. 0 0 | Острый средний серозный отит |
| H65.1 | Другие острые негнойные средние отиты |
| H65.2 | Хронический серозный средний отит |
| H65.3 | Хронический слизистый средний отит |
| H65.4 | Другие негнойные средние отиты |
| H65.9 | Негнойный средний отит неуточненный |
| H66 | Гнойный и неуточненный средний отит |
H66. 0 0 | Острый гнойный средний отит |
| H66.1 | Хронический туботимпальный гнойный средний отит |
| H66.2 | Хронический эпитимпано-антральный гнойный средний отит |
| H66.3 | Другие хронические гнойные средние отиты |
| H66.4 | Гнойный средний отит неуточненный |
| H66.9 | Средний отит неуточненный |
| H67 | Средний отит при болезнях, классифицированных в других рубриках |
H67. 0 0 | Средний отит при бактериальных болезнях, классифицированных в других рубриках |
| H67.1 | Средний отит при вирусных болезнях, классифицированных в других рубриках |
| H67.8 | Средний отит при других болезнях, классифицированных в других рубриках |
| H68 | Воспаление и закупорка слуховой [евстахиевой] трубы |
| H68.0 | Воспаление слуховой [евстахиевой] трубы |
| H68.1 | Закупорка слуховой [евстахиевой] трубы |
| H69 | Другие болезни слуховой [евстахиевой] трубы |
H69. 0 0 | Зияющая слуховая [евстахиева] труба |
| H69.8 | Другие уточненные болезни слуховой [евстахиевой] трубы |
| H69.9 | Болезнь слуховой [евстахиевой] трубы неуточненная |
| H70 | Мастоидит и родственные состояния |
| H70.0 | Острый мастоидит |
| H70.1 | Хронический мастоидит |
| H70.2 | Петрозит |
H70. 8 8 | Другие мастоидиты и родственные состояния |
| H70.9 | Мастоидит неуточненный |
| H71 | Холестеатома среднего уха |
| H72 | Перфорация барабанной перепонки |
| H72.0 | Центральная перфорация барабанной перегородки |
| H72.1 | Перфорация барабанной перепонки в области аттика |
| H72.2 | Другие краевые перфорации барабанной перепонки |
H72.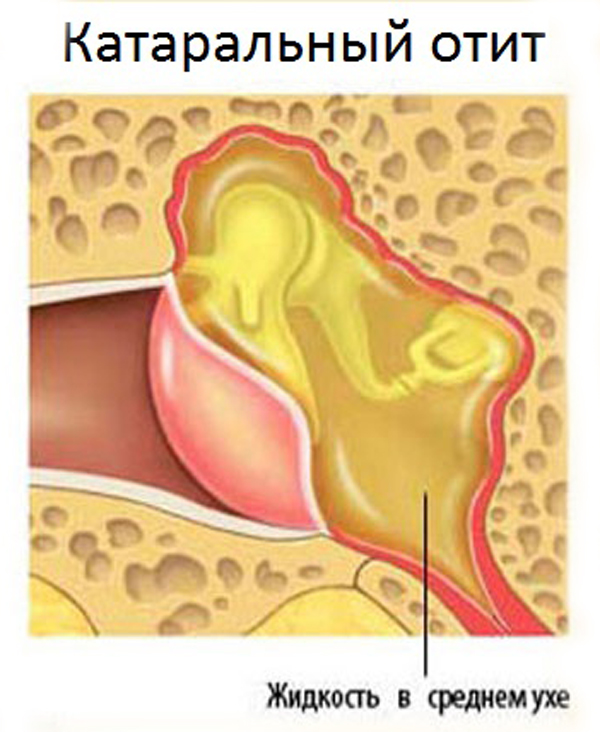 8 8 | Другие перфорации барабанной перепонки |
| H72.9 | Перфорация барабанной перепонки неуточненная |
| H73 | Другие болезни барабанной перепонки |
| H73.0 | Острый мирингит |
| H73.1 | Хронический мирингит |
| H73.8 | Другие уточненные болезни барабанной перепонки |
H73.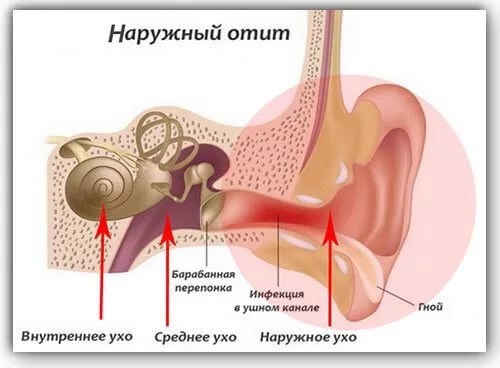 9 9 | Болезнь барабанной перепонки неуточненная |
| H74 | Другие болезни среднего уха и сосцевидного отростка |
| H74.0 | Тимпаносклероз |
| H74.1 | Адгезивная болезнь среднего уха |
| H74.2 | Разрыв и дислокация слуховых косточек |
| H74.3 | Другие приобретенные дефекты слуховых косточек |
| H74.4 | Полип среднего уха |
H74. 8 8 | Другие уточненные болезни среднего уха и сосцевидного отростка |
| H74.9 | Болезнь среднего уха и сосцевидного отростка неуточненная |
| H75 | Другие поражения среднего уха и сосцевидного отростка при болезнях, классифицированных в других рубриках |
| H75.0 | Мастоидит при инфекционных и паразитарных болезнях, классифицированных в других рубриках |
| H75.8 | Другие уточненные болезни среднего уха и сосцевидного отростка при болезнях, классифицированных в других рубриках |
| H80-H83 | Болезни внутреннего уха (H80-H83) |
| H80 | Отосклероз |
H80. 0 0 | Отосклероз, вовлекающий овальное окно, необлитерирующий |
| H80.1 | Отосклероз, вовлекающий овальное окно, облитерирующий |
| H80.2 | Кохлеарный отосклероз |
| H80.8 | Другие формы отосклероза |
| H80.9 | Отосклероз неуточненный |
| H81 | Нарушения вестибулярной функции |
| H81.0 | Болезнь Меньера |
H81. 1 1 | Доброкачественное пароксизмальное головокружение |
| H81.2 | Вестибулярный нейронит |
| H81.3 | Другие периферические головокружения |
| H81.4 | Головокружение центрального происхождения |
| H81.8 | Другие нарушения вестибулярной функции |
| H81.9 | Нарушения вестибулярной функции неуточненное |
| H82 | Вестибулярные синдромы при болезнях, классифицированных в других рубриках |
| H83 | Другие болезни внутреннего уха |
H83. 0 0 | Лабиринтит |
| H83.1 | Лабиринтная фистула |
| H83.2 | Лабиринтная дисфункция |
| H83.3 | Шумовые эффекты внутреннего уха |
| H83.8 | Другие уточненные болезни внутреннего уха |
| H83.9 | Болезнь внутреннего уха неуточненная |
| H90-H95 | Другие болезни уха (H90-H95) |
| H90 | Кондуктивная и нейросенсорная потеря слуха |
H90. 0 0 | Кондуктивная потеря слуха двусторонняя |
| H90.1 | Кондуктивная потеря слуха односторонняя с нормальным слухом на противоположном ухе |
| H90.2 | Кондуктивная потеря слуха неуточненная |
| H90.3 | Нейросенсорная потеря слуха двусторонняя |
| H90.4 | Нейросенсорная потеря слуха односторонняя с нормальным слухом на противоположном ухе |
| H90.5 | Нейросенсорная потеря слуха неуточненная |
| H90.6 | Смешанная кондуктивная и нейросенсорная тугоухость двусторонняя |
H90. 7 7 | Смешанная кондуктивная и нейросенсорная тугоухость односторонняя с нормальным слухом на противоположном ухе |
| H90.8 | Смешанная кондуктивная и нейросенсорная тугоухость неуточненная |
| H91 | Другая потеря слуха |
| H91.0 | Ототоксическая потеря слуха |
| H91.1 | Пресбиакузис |
| H91.2 | Внезапная идиопатическая потеря слуха |
| H91.3 | Мутационная глухота, не классифицированная в других рубриках |
H91.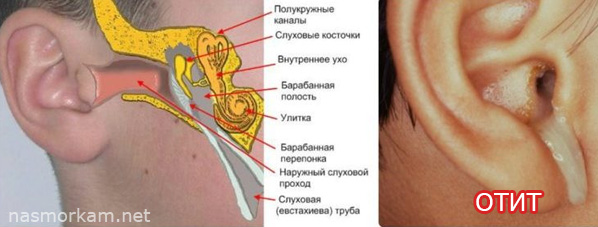 8 8 | Другие уточненные потери слуха |
| H91.9 | Потеря слуха неуточненная |
| H92 | Оталгия и выделения из уха |
| H92.0 | Оталгия |
| H92.1 | Оторея |
| H92.2 | Кровотечение из уха |
| H93 | Другие болезни уха, не классифицированные в других рубриках |
H93. 0 0 | Дегенеративные и сосудистые болезни уха |
| H93.1 | Шум в ушах (субъективный) |
| H93.2 | Другие аномалии слухового восприятия |
| H93.3 | Болезни слухового нерва |
| H93.8 | Другие уточненные болезни уха |
| H93.9 | Болезнь уха неуточненная |
| H94 | Другие поражения уха при болезнях, классифицированных в других рубриках |
H94.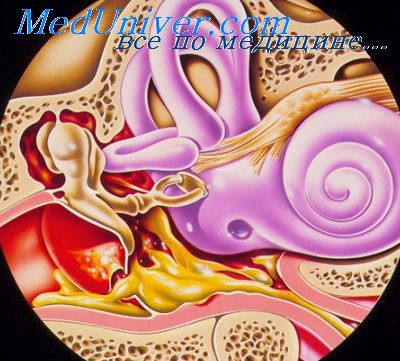 0 0 | Кохлеарный неврит при инфекционных и паразитарных болезнях, классифицированных в других рубриках |
| H94.8 | Другие уточненные поражения уха при болезнях, классифицированных в других рубриках |
| H95 | Поражения уха и сосцевидного отростка после медицинских процедур, не классифицированные в других рубриках |
| H95.0 | Рецидивирующая холестеатома полости после мастоидэктомии |
| H95.1 | Другие поражения после мастоидэктомии |
| H95.8 | Другие поражения уха и сосцевидного отростка после медицинских процедур |
H95. 9 9 | Поражение уха и сосцевидного отростка после медицинских процедур неуточненное |
симптомы, диагностика, лечение отита в ТС Клинике в Краснодаре
Наружный отит проявляется сильной болью в ухе из-за присутствия бактерий в ушном канале. Особенно часто такими заболеваниями страдают люди, занимающиеся плаваньем, так как их уши часто подвергаются воздействию влаги и микробов, присутствующих в воде. Поэтому часто болезнь называют «ухом пловца». Наружный отит может вызывать высокую температуру и сильную боль в ушах: это называется очаговым наружным отитом. Наружный отит называют тяжелым, когда он вызывает сужение слухового прохода с последующим нагноением в ушах и высокой температурой.
Острый средний отит (или острое воспаление среднего уха) — инфекция в среднем ухе, вызванная бактериями или вирусами. Острым средним отитом могут страдать люди всех возрастов, включая маленьких детей. Ему часто предшествует назофарингит, что приводит к снижению слуха, болям в ушах и повышению температуры. В случае суперинфекции ушей отит может проявляться кровотечением, если барабанная перепонка перфорирована или выпячена. Примерно в 30% случаев перенесенный в детском возрасте отит является причиной тугоухости у взрослых.
Внутренний отит или лабиринтит — очень редкая форма ушной инфекции, которая может привести к значительной потере слуха. Заболевание проявляется постепенным ухудшением слуха, тошноты и головокружения. Внутренний отит может возникнуть в результате операции на среднем ухе, вызвавшей бактериальную инфекцию или более распространенные инфекции, такие как назофарингит.
Перед любым лечением отита необходимо сначала определить причины и форму отита. Лечение ушных инфекций назначается в зависимости от возраста пострадавшего. Пациентам обычно назначают лечение антибиотиками.Но! Обычно это комплексное лечение медикаментами совместно с физиотерапевтическим лечением. Только так возможно добиться хорошего эффекта лечения без осложнений. Иногда пациентам врач-отоларинголог рекомендует оперативное лечение для удаления жидкости из среднего уха. Но такое вмешательство является малоинвазивным, его бояться не стоит.
ОЧЕНЬ ВАЖНО! ПРИ ПЕРВЫХ СИМПТОМАХ ЗАБОЛЕВАНИЯ НЕ ЗАНИМАТЬСЯ САМОЛЕЧЕНИЕМ И ЗАПИСАТЬСЯ НА ПРИЕМ К ВРАЧУ- ОТОЛАРИНГОЛОГУ! Отсутствие необходимого лечения может привести к потере слуха или даже полной глухоте в самых тяжелых случаях.
Мы рекомендуем прислушаться к нашим простым советам, следуя которым ежедневно, вы сможете существенно снизить риск возникновения опасных заболеваний:
границ | Геномика среднего отита (OM): подходы молекулярной генетики к характеристике патофизиологии заболевания
Введение
Средний отит (ОМ) определяется как инфекционно-воспалительное заболевание среднего уха. Хотя ОМ ассоциируется со значительной неоднородностью клинических проявлений, к широким типам относятся острый средний отит (АОМ), хронический гнойный средний отит (ХСОМ) и хронический средний отит с выпотом (ОМО). Предыдущие исследования показали, что совокупная частота АОМ составляет около 11% во всем мире, причем 51% случаев приходится на детей в возрасте до пяти лет (Monasta et al., 2012). Рецидив AOM может привести к OME, частота которой во всем мире достигает 5% (Monasta et al., 2012). И АОМ, и ОМ по-прежнему связаны с обращением за медицинской помощью в виде антибактериальной терапии, посещения врача и отделения неотложной помощи, а также обычных хирургических процедур, таких как тимпаностомические трубки, хотя появление эффективной противомикробной терапии привело к значительному снижению бремени CSOM (Thomas et al. , 2004). В меньшем количестве исследований также описана связь между инфекциями среднего уха и речевым и языковым дефицитом, подчеркивая роль ОМ в развитии детей (Roberts et al., 2004).
, 2004). В меньшем количестве исследований также описана связь между инфекциями среднего уха и речевым и языковым дефицитом, подчеркивая роль ОМ в развитии детей (Roberts et al., 2004).
Наиболее распространенные бактерии, выделяемые из среднего уха пациентов с АОМ, включают Streptococcus pneumoniae и Haemophilus influenzae , хотя Moraxella catarrhalis , Streptococcus pyogenes и Staphylococcus aureus встречаются реже. Напротив, Pseudomonas aeruginosa и S. aureus являются наиболее часто наблюдаемыми патогенами CSOM (Giebink and Canafax, 1991).
OM представляет собой многофакторное заболевание, которое может быть связано с комбинацией этиологических факторов, включая иммунологические, генетические, экологические и анатомические характеристики.Часто наблюдаемыми причинами являются сезонная восприимчивость к микробам и дисфункция евстахиевой трубы (Swanson and Hoecker, 1996; Fireman, 1997). Хорошо известно, что вирусы из дыхательных путей также играют решающую роль в патогенезе АОМ (Nokso-Koivisto et al., 2015). Кроме того, воздействие табачного дыма, использование соски-пустышки и посещение детских садов входят в число факторов риска ОМ, в то время как грудное вскармливание и пневмококковые вакцины обладают защитным действием (Swanson and Hoecker, 1996; Lubianca Neto et al., 2006; Абрахамс и Лаббок, 2011; Norhayati et al., 2017).
Помимо факторов окружающей среды, генетический фон также определяет восприимчивость к ОМ, хотя механизм заболевания до конца не изучен. Известно, что несколько генов, связанных с ОМ, идентифицированных в ходе исследований на людях и на животных моделях, играют фундаментальную роль в различных биологических процессах, включая (1) развитие расщелины среднего уха и евстахиевой трубы, (2) иммунный ответ, (3) ) бактериальная адгезия и скорость вирусной инфекции, (4) регуляция внеклеточного матрикса и (5) клиренс патогенов (см. Таблицы 1, 2 для конкретных исследований).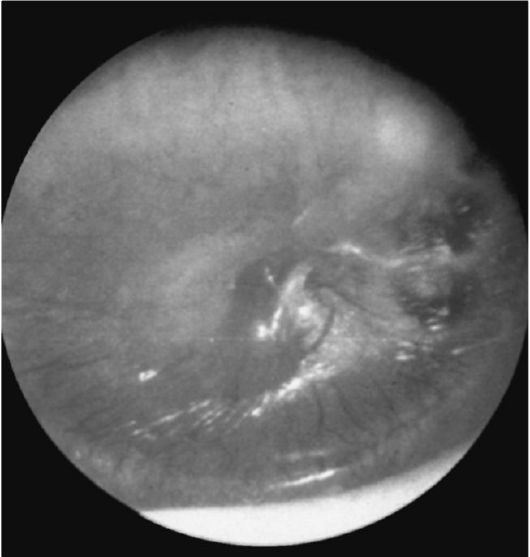 В этом обзоре мы суммировали геномные варианты и факторы, о которых сообщалось у пациентов с различными формами ОМ. Также вкратце обсуждаются ранние генетические исследования ассоциации, мыши, от мыши к человеку, кандидат от человека, а также общегеномные исследования ассоциации, которые коррелируют ОМ и генетические вариации. Тем не менее, мы особенно сосредоточились на недавних открытиях ассоциации ферментов A2ML1 и FUT с ОМ и предложили нашу точку зрения на потенциальный механизм заболевания, который интуитивно может привести к ОМ у людей, укрывающих варианты FUT2 .
В этом обзоре мы суммировали геномные варианты и факторы, о которых сообщалось у пациентов с различными формами ОМ. Также вкратце обсуждаются ранние генетические исследования ассоциации, мыши, от мыши к человеку, кандидат от человека, а также общегеномные исследования ассоциации, которые коррелируют ОМ и генетические вариации. Тем не менее, мы особенно сосредоточились на недавних открытиях ассоциации ферментов A2ML1 и FUT с ОМ и предложили нашу точку зрения на потенциальный механизм заболевания, который интуитивно может привести к ОМ у людей, укрывающих варианты FUT2 .
Таблица 1. Наиболее распространенные локусы, связанные со средним отитом в исследованиях на мышах.
Таблица 2. Наиболее распространенные локусы, связанные со средним отитом в исследованиях на людях.
Ранние исследования
Генетический вклад в восприимчивость к ОМ стал очевиден в 1980-х годах после того, как несколько исследований показали, что распространенность ОМ была непропорционально высокой у некоторых этнических групп (коренные американцы и австралийские аборигены) и относительно низкой у лиц африканского происхождения (Clements, 1968; Bhutta, 2015). ).Наблюдательное исследование носительства в ухе и носоглотке было проведено среди отдаленных австралийских аборигенов в 2013 году и показало, что 50% маленьких детей (средний возраст 13 месяцев) имели ОМЭ, 37% имели АОМ и 12% имели КСОМ (Leach et al., 2016). Сегодня CSOM по-прежнему играет важную роль в распространении нарушений слуха и обучения в общинах австралийских аборигенов (Morris, 1998).
Одно из самых ранних генетических исследований ОМ, проведенное в 1983 году, проанализировало группы крови (ABO) в когорте из 610 детей с хроническим средним отитом с выпотом (COME) и пришло к выводу, что группа крови «A» была генетическим фактором риска для ОМ на основании их наблюдения за его более высокой распространенностью у детей с КОМЭ по сравнению с здоровыми детьми (Mortensen et al. , 1983). Более поздние исследования показали, что человеческий лейкоцитарный антиген (HLA) 2 и HLA3 сильно связаны с АОМ, тогда как пациенты с СОМЭ имеют более низкую частоту HLA2 (Kalm et al., 1991, 1994). Наследственность и генетические компоненты времени и количество эпизодов ОМЕ и АОМ в течение первых 2 лет жизни также были исследованы в исследовании с близнецами и тройняшками в 1999 г., и была обнаружена сильная связь между продолжительностью или количеством эпизодов. ОМ и генетический состав (Casselbrant et al., 1999).
, 1983). Более поздние исследования показали, что человеческий лейкоцитарный антиген (HLA) 2 и HLA3 сильно связаны с АОМ, тогда как пациенты с СОМЭ имеют более низкую частоту HLA2 (Kalm et al., 1991, 1994). Наследственность и генетические компоненты времени и количество эпизодов ОМЕ и АОМ в течение первых 2 лет жизни также были исследованы в исследовании с близнецами и тройняшками в 1999 г., и была обнаружена сильная связь между продолжительностью или количеством эпизодов. ОМ и генетический состав (Casselbrant et al., 1999).
Вклад генетики в восприимчивость к ОМ подтверждается исследованиями, в которых сообщается о более высокой заболеваемости ОМ у детей с хромосомными аномалиями. Например, распространенность ОМЕ у детей с синдромом Дауна приближается к 38% (Austeng et al., 2013). Гены, присутствующие на хромосоме 21, в сочетании с черепно-лицевыми дефектами, такими как гипоплазия средней зоны лица, короткое небо и дисфункция евстахиевой трубы (Shibahara and Sando, 1989), а также дефекты иммунной системы (Ram and Chinen, 2011), наблюдаемые у детей с синдромом Дауна, могут способствовать к их повышенному риску ОМ. Ets1 Ген , кодирующий протоонкоген, недавно был связан с черепно-лицевыми аномалиями и ОМ в исследовании на мышах (см. Раздел «Исследования на мышах и от мыши к человеку») (Carpinelli et al., 2015). У человека ген ETS2 , который также принадлежит к семейству генов протоонкогенов, присутствует на хромосоме 21 и может способствовать восприимчивости к ОМ при синдроме Дауна.
В нескольких исследованиях, проведенных на когортах с синдромом Тернера, генетическим заболеванием частичной или полной потери хромосомы X у женщин, описана высокая вариабельность (от 9 до 9.От 1 до 91%) заболеваемости АОМ (Sculerati et al., 1990; Bois et al., 2018). Хотя анализ кариотипа не выявил какой-либо подгруппы значительно высокого риска, женщины с синдромом Тернера также имеют более высокую распространенность и более длительную патологию среднего уха (Gawron et al. , 2008; Bois et al., 2018). Эти данные указывают на причастность некоторых генов Х-хромосомы к развитию, функционированию или здоровью среднего уха.
, 2008; Bois et al., 2018). Эти данные указывают на причастность некоторых генов Х-хромосомы к развитию, функционированию или здоровью среднего уха.
Исследования с использованием мышей и от мыши к человеку
Разработка и фенотипирование трансгенных и нокаутных моделей мышей за последние 30 лет значительно помогли идентифицировать несколько генов и генетических вариаций, которые придают чувствительность к ОМ у мышей.Большинство этих моделей мышей спонтанно развивают OM; изучение морфологии и функции их ушей позволило понять патофизиологию заболевания на молекулярном уровне. Например, Eriksson et al. (2006) показали, что у мышей с дефицитом плазминогена ( Plg ) спонтанно развивается хронический ОМ к 18-недельному возрасту. Плазмин, активная форма фермента сериновой протеиназы PLG, в основном участвует в диссоциации фибриновых сгустков и способствует деградации внеклеточного матрикса (Ayon-Nunez et al., 2018). Плазмин играет решающую роль в нескольких клеточных процессах, включая заживление ран, иммунитет, ремоделирование тканей, воспаление и миграцию клеток (Tefs et al., 2006). Недавние исследования показали, что некоторые бактерии обладают адгезиями, связывающими плазминоген, на своей клеточной поверхности, чтобы использовать фибринолитическую систему, способствуя захвату и инвазии бактерий (Raymond and Djordjevic, 2015; Ayon-Nunez et al., 2018).
Роль факторов транскрипции в патологии ОМ стала очевидной благодаря исследованиям на мутантных мышах, лишенных генов Eya4 , Evi1 , Tgif , Ets1 и Fli1 (Hardisty-Hughes et al., 2006; Паркинсон и др., 2006; Depreux et al., 2008; Татеосян и др., 2013; Carpinelli et al., 2015). У мышей, лишенных Eya4 , наблюдается дисфункция евстахиевой трубы, что ведет к увеличению частоты OME и нарушений слуха (Depreux et al., 2008). Было показано, что варианты Evi1 у мышей Junbo вызывают восприимчивость к CSOM. Мыши Junbo накапливают выпоты в среднем ухе и развивают гипоксию, воспаление и утолщение слизистой оболочки надкостницы (Parkinson et al., 2006; Bhutta et al., 2014). Более поздние исследования показали, что потеря BPIFA1, одного из самых распространенных секреторных белков в верхних дыхательных путях (Musa et al., 2012), усугубляет тяжесть ОМ у мышей Junbo . В то время как мутантные мыши Bpifa1 не проявляли какой-либо чувствительности к ОМ, делеция Bpifa1 у мышей, несущих вариант Evi1 Junbo , приводит к утолщению слизистой оболочки среднего уха и увеличению отложения коллагена (Mulay et al., 2018) .Потеря Tgif1 , который кодирует TGIF1, приводит к ОМЕ, сопровождающемуся утолщением эпителиальной выстилки среднего уха, увеличением популяции бокаловидных клеток, повышенными уровнями TNF-α и IL-1β в ушных жидкостях и кондуктивной тугоухостью. у мышей (Tateossian et al., 2013). Точно так же гаплонедостаточность для Ets1 и Fli1 у мышей приводит к черепно-лицевым аномалиям, в том числе к уменьшению полости среднего уха и сращиванию косточек со стенками среднего уха (Carpinelli et al., 2015). Кроме того, Fli1 ± и Ets1 ± двойных мутантных мышей имеют нарушение слуха, а их слизистая оболочка среднего уха инфильтрована провоспалительными клетками, что приводит к ОМ (Carpinelli et al., 2015).
Hardisty et al. (2003) показали, что мутантных мышей Jeff , несущих вариант Fbxo11 , имеют черепно-лицевые аномалии, повышенный порог слышимости и выпот в среднем ухе. У мутантных мышей Fbxo11 наблюдались дефекты кавитации булл, которые в конечном итоге приводили к спайкам среднего уха и минерализации мягких тканей костной анатомии (Del-Pozo et al., 2019). Используя мутагенез N-этил-N-нитрозомочевины, Crompton et al. (2017) показали, что патогенный вариант p.Leu972Pro, также известный как вариант edison , в гене Nischarin ( Nisch ) приводит к легким черепно-лицевым дефектам, спонтанной ОМ к 20 неделям и прогрессирующей потере слуха. Недавние исследования сообщили об ассоциации локусов TGIF1 и NISCH как потенциальных областей риска для ОМ у людей (Bhutta et al., 2017), что подтверждает актуальность знаний, полученных на мышиных моделях, для патофизиологии ОМ у людей.
Наконец, у мышей с мутантными факторами транскрипции Eda и Edar ( Eda Ta и Edar dlJ / dlJ ) также развились хронический ринит и ОМ (Azar et al., 2016). У этих мутантов железистый эпителий носоглотки не развивается, что приводит к потере секреции лизоцима, снижению мукоцилиарного клиренса и чрезмерному росту комменсальных бактерий. Распространение носовых с.aureus у Eda Ta мышей и Escherichia coli у Edar dlJ / dlJ мышей в булл среднего уха потенциально вызывает воспаление и ОМ (Azar et al., 2016). Неполный список наиболее распространенных локусов, ассоциированных с ОМ у мышей, представлен в Таблице 1.
Исследования на основе генов-кандидатов и полногеномные ассоциации человека
В то время как ранние исследования OM на основе генов-кандидатов проводились в основном на кавказских пациентах с рецидивирующим AOM и хроническим OME (см. Раздел Ранние исследования), более поздние генетические исследования были сосредоточены на этнических группах или сообществах, для которых браки в семьях относительно распространены. (е.g., коренная филиппинская община или пакистанские семьи) (Santos-Cortez et al., 2015, 2018). Эти исследования выявили несколько новых генов и вариантов, которые придают предрасположенность к семейному ОМ (см. Раздел «Восприимчивость к ОМ, инбридинг и секвенирование всего экзома): A2ML1 и FUT2 (Santos-Cortez et al., 2015, 2018).
Кандидатские генные исследования
Многие варианты в геноме ассоциированы с инфекционными заболеваниями (Клебанов, 2018). В некоторых случаях клинические признаки и биологические механизмы, такие как иммунный ответ, воспаление, бактериальная адгезия, вирусная инфекция и мукоцилиарный клиренс, вовлеченные в эти инфекционные заболевания, совместимы с механизмами, задействованными во время эпизода ОМ, что позволяет маркировать гены. известны этими расстройствами как главные кандидаты на предрасположенность и рецидивы ОМ.В исследованиях на основе генов-кандидатов OM в основном участвовали гены, связанные с врожденным иммунитетом и воспалением (Sale et al., 2011). Эти исследования были выполнены на когортах со всего мира, включая США, Финляндию, Австралию, Нидерланды, Грецию и Бельгию, и выявили более 100 аллелей, которые придают чувствительность к различным формам ОМ (см. Таблицу 2 с неполным списком этих аллелей. , гены и связанные с ними клинические особенности). Как видно из этого неполного списка, идентифицированные гены относятся к нескольким различным сигнальным каскадам и процессам развития, включая (а) иммунный ответ и воспаление ( MBL2 , TLR2 , TLR4 , CD14 , FCGR2A ). , TGFB1 и PAI1 ) (Nuytinck et al., 2006; Wiertsema et al., 2006a, b; Emonts et al., 2007; Ли Ю. et al., 2008; Илья и др., 2014; Hafren et al., 2015), (b) цитокины ( IL6 , IL10 , IL1A , IL1B , TNFA и IFNG ) (Patel et al., 2006; Alper et al. , 2009; Revai et al., 2009; Ilia et al., 2014), (c) клиренс тканей ( SFPTA , SFTPA1 , SFTPD , SLC11A1 , MUC2 , MUC5AC и MUC5B ) (Ramet et al., 2001; Sale et al., 2011; Рай и др., 2013; MacArthur et al., 2014), (d) модуляция транскрипции ( SMAD2 и SMAD4 ) (Rye et al., 2011), (e) химиочувствительность ( CX3CR1 ) (Nokso-Koivisto et al., 2014) , (е) модификация белка ( CPT1A и FBXO11 ) (Rye et al., 2011, 2012) и (g) активность канала ( SCN1B ) (Sale et al., 2011). Некоторые из этих генов, такие как FBXO11 , были реплицированы в нескольких независимых исследованиях, что еще больше усилило их роль в восприимчивости к ОМ (Segade et al., 2006; Рай и др., 2011).
Исследования геномных ассоциаций
Было проведено несколько полногеномных ассоциативных исследований (GWAS) для выявления новых общих (частота 75% или выше) маркеров низкого риска (OR <1,5), связанных с подтипами OM. Здесь резюмируются результаты пяти основных GWAS. В исследовании Западной Австралии по беременности и родам (Рейн) когорта из 416 пациенток с предрасположенностью к ОМ и 1075 нормальных субъектов была проанализирована на 2524817 SNP. Хотя первоначальный анализ выявил некоторую связь, ни один из SNP не достиг значимости GWAS ( P <10 –8 ) и не мог быть воспроизведен как в австралийской, так и в американской когортах (Rye et al., 2012; Allen et al., 2014). Интересно, что GWAS когорт Миннесоты и Питтсбурга идентифицировал SNP (rs10497394 на хромосоме 2), который показал значительную связь (открытие GWAS P = 1,30 × 10 -5 , независимая популяция среднего отита P мета = 1,52 × 10 –8 ) с предрасположенностью к хроническому ОМЕ или рецидивирующему АОМ (Allen et al., 2013). Наконец, в финской когорте (829 затронутых детей и 2118 случайно выбранных контролей) варианты rs16974263 (открытие GWAS P = 1.77 × 10 –7 , анализ субфенотипа P мета = 2,92 × 10 –8 ), rs268662 ( P = 1,564 × 10 –6 ) и rs4150992 ( P = 3,37 × 10 –6 ) были наиболее значимыми вариантами, связанными с COME (Einarsdottir et al., 2016). В van Ingen et al. (2016) выполнили GWAS на когорте детей с ОСА европейского происхождения и сообщили о статистически значимой ассоциации в локусе 6q25.3 (rs2
9, P meta = 2.15 × 10 –9 ). Это исследование также продемонстрировало, что ассоциированные варианты коррелируют со статусом метилирования (cg05678571, p = 1,43 × 10 –6 ) и уровнями экспрессии ( p = 9,3 × 10 –5 ) FNDC1 ген. Кроме того, независимое исследование GWAS с участием более 200000 особей европейского происхождения сообщило о 14 геномных регионах, в том числе FUT2 ( p — значение: 3,51 × 10 -30 ), TBX1 (1.17 × 10 –19 ), HLA-DRB1 (rs4329147, 9,55 × 10 –12 ), ABO (3,67 × 10 –11 ), EFEMP1 (1,47 × 10 –10 ), AUTS2 (3,75 × 10 –9 ), CDHR3 (5,40 × 10 –9 ), BSN (1,56 × 10 –8 ) и PLG (3,78 × 10 –8 ), которые были в значительной степени связаны с инфекцией уха у детей (Tian et al., 2017), что дополнительно подчеркивает вклад генетических факторов, ответственных за ОМ у людей.
OM Восприимчивость, инбридинг и секвенирование всего экзома
A2ML1
В большой кровной родословной коренных филиппинцев с высокой частотой OM, Santos-Cortez et al. (2015) показали с помощью всего экзома и секвенирования по Сэнгеру, что дупликация 8 п.н. в гене A2ML1 (оценка LOD 7,5) связана с восприимчивостью к OM. Такая же дупликация была обнаружена гетерозиготным или гомозиготным образом у трех человек (европейские американцы и латиноамериканцы) из другой когорты из 123 детей, предрасположенных к ОМ и отсутствующей у детей, не склонных к отиту, и более чем 62000 последовательностей следующего поколения.Авторы идентифицировали семь дополнительных гетерозиготных вариантов A2ML1 у пациентов европейско-американского и латиноамериканского происхождения с ОМ. A2ML1 кодирует альфа-2-макроглобулин-подобный белок 1 (A2ML1), белок, который улавливает протеиназы и расщепляет их. Последующее исследование выявило 16 дополнительных вариантов A2ML1 у субъектов с ОМ в коренных филиппинских и пакистанских семьях, а также у американских пробандов (Larson et al., 2019). Основываясь на экспрессии в эпителии слизистой оболочки среднего уха мыши, было высказано предположение, что A2ML1 может выполнять защитную функцию, регулируя протеазы, присутствующие в полости среднего уха, а также может регулировать десквамацию эпидермиса (Galliano et al., 2006). Недавно путем секвенирования 16S рРНК микробиоты среднего уха коренной филиппинской общины, склонной к ОМ, и выделения вариантов A2ML1 , хотя и не имеющих статистически значимой разницы между случаями и контролем, таксономический анализ выявил относительную численность Тип Fusobacteria и Bacteroidetes и род Fusobacterium у носителей A2ML1 по сравнению с не-носителями (Santos-Cortez et al., 2016).
FUT2
В той же большой кровной родословной коренных филиппинцев с высокой частотой ОМ, частично из-за вариантов A2ML1 , подмножество особей было диким типом для A2ML1 , но было предрасположено к ОМ (Santos-Cortez et al., 2015) . Дальнейший генетический анализ показал, что вариант FUT2 (p.Arg202 * , оценка LOD 4.0) придает чувствительность к OM у этих людей (Santos-Cortez et al., 2018). Скрининг образцов ДНК из 609 дополнительных многоэтнических семей и субъектов с симплексным случаем с ОМ с помощью прямого секвенирования по Сэнгеру, анализа сцепления, точного анализа Фишера и тестов на неравновесие передачи выявил несколько других вариантов FUT2 (стр.Arg138Cys, p.Trp154 ∗ и p.Ala104Val), которые придают чувствительность к ОМ (Santos-Cortez et al., 2018).
ферментов FUT участвуют в пути гликозилирования белков. FUT переносят L-фукозный сахар, полученный из GDP-фукозы (донорный субстрат), на белок (акцепторный субстрат). Семейство FUT состоит из 13 членов (FUT1 – FUT13), и многие из FUT необходимы для синтеза антигенов группы крови. FUT представляют собой однопроходные мембранные белки типа II, резидентные в транс-Гольджи, в то время как каталитический домен белков FUT находится в просвете Гольджи.У человека FUT1 и FUT2 кодируют галактозид 2-L-фукозилтрансферазу, а FUT3 кодирует галактозид 3 (4) -L-фукозилтрансферазу. FUT1 и FUT2 переносят L-фукозу на производное β-D-галактозил- (1 → 4) -N-ацетил-β-D-глюкозаминила и создают олигосахарид FuC-альфа [(1,2) Gal-бета-], также известный как H-антиген, который представляет собой растворимый предшественник, необходимый для заключительного этапа синтеза растворимых антигенов A и B. FUT3 переносит L-фукозу на производное β-D-галактозил- (1 → 4) -N-ацетил-β-D-глюкозаминила или на H-антиген, чтобы создать антигены Льюиса группы крови.
FUT1 и FUT2 по-разному экспрессируются в разных типах клеток. Например, экспрессия FUT1 ограничена клетками мезодермального происхождения (например, эритроцитами), а экспрессия FUT2 ограничена клетками энтодермального происхождения (такими как клетки слизистой оболочки среднего уха). Следовательно, антигены A и B будут экспрессироваться на поверхности эритроцитов под контролем FUT1, тогда как антигены A и B будут экспрессироваться на поверхности клеток слизистой оболочки под контролем FUT2.Естественно, существуют генетические вариации в FUT1 и FUT2 . Некоторые варианты FUT1 и FUT2 приводят к нефункциональным ферментам, в то время как определенные вариации в FUT2 также могут приводить к снижению его экспрессии (Santos-Cortez et al., 2018). Например, вариант FUT1 p.Tyr154Cys устраняет функциональную активность каталитического домена, что приводит к отсутствию антигенов A, B или H на поверхности эритроцитов (также известный как фенотип Бомбея).Точно так же вариант FUT2 p.Trp154 ∗ вызывает отсутствие антигенов A, B или H на поверхности клеток слизистой оболочки (он же несекреторный статус) (Domino et al., 2001a, b). Вариант FUT2 p.Trp154 ∗ также отвечает за несекреторный фенотип в европейских и африканских популяциях (47 и 42% соответственно).
Известно, чтоA, B, H и антигены Льюиса служат источником энергии, а также регулируют адгезию бактерий к поверхности клетки (Ewald and Sumner, 2018; Рисунок 1).Интуитивно понятно, что различные антигены группы крови и их количество на поверхности клеток эпителия слизистой оболочки среднего уха могут влиять на микробиоту, присутствующую в полости среднего уха, и различные группы крови были связаны с ОМ (Wiesen et al. др., 2019). Например, исследования в финской когорте сообщили о защитном эффекте группы крови O против рецидивирующего АОМ, тогда как группа крови А была связана с повышенным риском хронического ОМЕ (Wiesen et al., 2019). При тестировании in vitro четыре варианта FUT2 , связанные с ОМ (стр.Ala104Val, p.Arg138Cys, p.Trp154 ∗ и p.Arg202 ∗ ) снижали уровни антигена A, в то время как два бессмысленных варианта также снижали уровни белка FUT2. Более того, Fut2 временно активируется в среднем ухе мыши после инокуляции нетипируемым H. influenza (Santos-Cortez et al., 2018). Предполагается, что связанные с ОМ варианты FUT2 модифицируют микробиом среднего уха посредством регуляции уровней антигена А в слизистой оболочке среднего уха, тем самым повышая чувствительность к ОМ (Santos-Cortez et al., 2018).
Рисунок 1. Роль FUT2 в регуляции группы крови и антигенов Льюиса на поверхности реснитчатых клеток слизистой оболочки среднего уха: показаны секреторный и несекреторный статус. Дисбаланс оптимальных бактерий (зеленый) и патогенных бактерий (красный) показан у несекреторных индивидуумов, склонных к острому среднему отиту.
В то время как различия в микробном богатстве, структуре и составе не были статистически значимыми между контрольными индивидуумами и индивидуумами, предрасположенными к ОМ, в коренной филиппинской общине, разделяющей FUT2 p.Вариант Arg202 ∗ , люди из когорты Колорадо, предрасположенные к ОМ и носители варианта FUT2 p. Trp154 ∗ , имели относительно высокую численность Lactobacillales и Gamma-proteobacteria в среднем ухе (Santos -Cortez et al., 2018). Для полного понимания механизма ОМ, связанного с FUT2, необходимы дальнейшие исследования на животных моделях.
Заключение
Современные генетические и молекулярные данные выявили связь ОМ с дефицитом каждого из следующих механизмов: (1) развитие полости среднего уха и евстахиевой трубы, (2) иммунный ответ, (3) бактериальная адгезия и вирусная инфекция, ( 4) регуляция внеклеточного матрикса и (5) клиренс среднего уха.
На рисунке 2 мы попытались построить сеть, которая включает в себя большинство известных человеческих белков, которые были связаны с ОМ, и нашу гипотезу о потенциальном воздействии на микробиом полости среднего уха, когда эти белки дисфункциональны из-за ОМ- связанные генетические варианты. Вкратце, ABO и FUT2 локализуются в аппарате Гольджи клеток слизистой оболочки среднего уха; Эти два белка вместе создают антигены Льюиса группы крови, потенциальные источники энергии для микробиома.Эти антигены также обеспечивают платформу адгезии для микробиоты. Точно так же бокаловидные клетки секретируют MUC5AC, MUC5B, MUC2 SFPTA, SFPTA1 и SFPTD с образованием слизи и поверхностно-активных веществ в полости среднего уха. Бактерии присутствуют в этих выделениях и выводятся из полости среднего уха реснитчатыми клетками, чтобы поддерживать здоровый микробиом. Клетки среднего уха также секретируют интерлейкины, хемокины, интерфероны, факторы некроза и роста, чтобы задействовать иммунные клетки во внеклеточном матриксе.Эти клетки борются с инфекцией и удаляют мертвые клетки. Во время воспалительной стадии внеклеточный матрикс ремоделируется протеазами, что способствует инфильтрации иммунных клеток. Эти протеазы регулируются и ингибируются A2ML1 и PAI1. Патогенная генетическая изменчивость любого из этих генов в конечном итоге приведет к инфекции среднего уха и ОМ.
Рис. 2. Белковые пути, способствующие среднему отиту (ОМ) у человека: гипотетическая сеть белков человека в слизистой оболочке среднего уха, которые были связаны с ОМ.Когда эти белки дисфункциональны из-за генетических вариантов, связанных с ОМ, они потенциально могут влиять на микробиоту полости среднего уха.
Будущие исследования обогащения определенной микробиоты у людей с конкретными генетическими вариантами могут в конечном итоге помочь в идентификации пациентов до того, как начнется хроническая ОМ, или в разработке парадигмы лечения для конкретного пациента в будущем.
Авторские взносы
AG, SA, AI, IA, SR и ZA написали черновик и доработали его.
Финансирование
Исследования в лаборатории Ахмеда были поддержаны Национальными институтами здравоохранения / NIDCD R01DC012564 и R01DC016295.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим г-жу Бернадин Монари, Димитрию Гомес и доктора Элоди Ричард за их критику рукописи.
Список литературы
Аллен, Э. К., Чен, В. М., Уикс, Д. Э., Чен, Ф., Хоу, Х., Маттос, Дж. Л. и др. (2013). Полногеномное исследование ассоциации хронического среднего отита с выпотом и рецидивирующим средним отитом идентифицирует новый локус восприимчивости на хромосоме 2. J. Assoc. Res. Отоларингол. 14, 791–800. DOI: 10.1007 / s10162-013-0411-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аллен, Э. К., Маничайкул, А., Чен, В. М., Рич, С.С., Дейли К. А., Сейл М. М. и др. (2014). Оценка репликации вариантов, связанных с генетическим риском среднего отита. PLoS One 9: e104212. DOI: 10.1371 / journal.pone.0104212
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альпер К. М., Винтер Б., Хендли Дж. О. и Дойл В. Дж. (2009). Полиморфизм цитокинов позволяет прогнозировать частоту среднего отита как осложнения риновирусной и RSV-инфекции у детей. евро. Arch. Оториноларингол. 266, 199–205. DOI: 10.1007 / s00405-008-0729-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Остенг, М. Э., Акре, Х., Эверланд, Б., Абдельнур, М., Фалькенберг, Э. С., и Квернер, К. Дж. (2013). Средний отит с выпотом у детей с синдромом Дауна. Внутр. J. Pediatr. Оториноларингол. 77, 1329–1332. DOI: 10.1016 / j.ijporl.2013.05.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Айон-Нуньес, Д. А., Фрагозо, Г., Бобс, Р. Дж., И Лаклетт, Дж. (2018). Плазминоген-связывающие белки как механизм уклонения от врожденного иммунитета хозяина при инфекционных заболеваниях * . Biosci. Реп. 38,
Google Scholar
Азар А., Пиччинелли К., Браун Х., Хедон Д. и Чизман М. (2016). Дефицит передачи сигналов эктодисплазина на мышиных моделях гипогидротической эктодермальной дисплазии приводит к патологии среднего уха и носа. Hum. Мол. Genet. 25, 3564–3577. DOI: 10.1093 / hmg / ddw202
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхутта, М.Ф. (2015). Эволюция и средний отит: обзор и модель, объясняющая высокую распространенность среди коренного населения. Hum. Биол. 87, 92–108. DOI: 10.13110 / humanbiology.87.2.0092
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхутта, М. Ф., Чизмен, М. Т., и Браун, С. Д. (2014). Миринготомия в модели хронического среднего отита у мышей Junbo снимает воспаление и клеточную гипоксию. Ларингоскоп 124, E377 – E383. DOI: 10.1002 / lary.24698
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхутта, М.F., Lambie, J., Hobson, L., Goel, A., Hafrén, L., Einarsdottir, E., et al. (2017). Исследование генов-кандидатов от мыши к человеку выявило ассоциацию хронического среднего отита с локусами TGIF1 и FBXO11. Sci. Реп. 7: 12496. DOI: 10.1038 / s41598-017-12784-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Буа, Э., Нассар, М., Зенати, Д., Леже, Дж., Ван ден Аббеле, Т., и Тейсье, Н. (2018). Отологические нарушения при синдроме Тернера. евро. Аня. Оториноларингол.Голова Шея Дис. 135, 21–24. DOI: 10.1016 / j.anorl.2017.08.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карпинелли, М. Р., Круз, Э. А., Архатари, Б. Д., Дебринкат, М. А., Ожье, Дж. М., Борис, Дж. С. и др. (2015). Мыши с гаплонедостаточностью для Ets1 и Fli1 демонстрируют аномалии среднего уха и модельные аспекты синдрома Якобсена. г. J. Pathol. 185, 1867–1876. DOI: 10.1016 / j.ajpath.2015.03.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кассельбрант, М.Л., Мандель, Э. М., Фолл, П. А., Рокетт, Х. Э., Курс-Ласки, М., Блюстоун, К. Д. и др. (1999). Наследственность отита: двойное и тройное исследование. JAMA 282, 2125–2130.
PubMed Аннотация | Google Scholar
Чизмен, М. Т., Тайрер, Х. Э., Уильямс, Д., Хаф, Т. А., Патак, П., Ромеро, М. Р. и др. (2011). Пути HIF-VEGF имеют решающее значение для хронического среднего отита у мутантов мышей Junbo и Jeff. PLoS Genet. 7: e1002336. DOI: 10,1371 / журнал.pgen.1002336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, J., Ingham, N., Clare, S., Raisen, C., Vancollie, V.E., Ismail, O., et al. (2013). Мыши с дефицитом Mcph2 обнаруживают роль MCPh2 в среднем отите. PLoS One 8: e58156. DOI: 10.1371 / journal.pone.0058156
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клементс, Д. А. (1968). Средний отит и потеря слуха в небольшом сообществе аборигенов. Med. Дж.Aust. 1, 665–667. DOI: 10.5694 / j.1326-5377.1968.tb28789.x
CrossRef Полный текст | Google Scholar
Кромптон, М., Пурнелл, Т., Тайрер, Х. Э., Паркер, А., Болл, Г., Харди-Хьюз, Р. Э. и др. (2017). Мутация в нишарине вызывает средний отит через пути LIMK1 и NF-kappaB. PLoS Genet. 13: e1006969. DOI: 10.1371 / journal.pgen.1006969
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дель-Посо, Дж., Макинтайр, Н., Азар, А., Гловер, Дж., Милн, Э., Чизмен, М. (2019). Хронический средний отит инициируется дефектом кавитации булл у мыши FBXO11 модели * . Дис. Модель Mech. 12, DOI: 10.1242 / dmm.038315
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Депре, Ф. Ф., Дэрроу, К., Коннер, Д. А., Иви, Р. Д., Либерман, М. К., Зайдман, К. Е. и др. (2008). Мыши с дефицитом Eya4 являются моделью наследственного среднего отита. J. Clin. Вкладывать деньги. 118, 651–658.DOI: 10.1172 / JCI32899
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Domino, S. E., Zhang, L., and Lowe, J. B. (2001b). Молекулярное клонирование, геномное картирование и экспрессия двух генов секреторной группы крови альфа (1,2) фукозилтрансферазы, дифференцированно регулируемых в эпителии матки и желудочно-кишечном тракте мышей. J. Biol. Chem. 276, 23748–23756. DOI: 10.1074 / jbc.m100735200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Домино, С.Э., Чжан Л., Гиллеспи П. Дж., Сондерс Т. Л. и Лоу Дж. Б. (2001a). Дефицит альфа (1,2) фукозилированных гликанов репродуктивного тракта и нормальная фертильность у мышей с целевыми делециями локуса альфа (1,2) фукозилтрансферазы FUT1 или FUT2. Мол. Cell Biol. 21, 8336–8345. DOI: 10.1128 / mcb.21.24.8336-8345.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Einarsdottir, E., Hafrén, L., Leinonen, E., Bhutta, M. F., Kentala, E., Kere, J., et al.(2016). Полногеномный ассоциативный анализ выявляет варианты на хромосоме 19, которые способствуют детскому риску хронического среднего отита с выпотом. Sci. Реп. 6: 33240. DOI: 10.1038 / srep33240
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Emonts, M., Veenhoven, R.H., Wiertsema, S.P., Houwing-Duistermaat, J.J., Walraven, V., de Groot, R., et al. (2007). Генетические полиморфизмы генов иммунореагирования TNFA, IL6, IL10 и TLR4 связаны с рецидивирующим острым средним отитом. Педиатрия 120, 814–823. DOI: 10.1542 / педс.2007-0524
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрикссон, П. О., Ли, Дж., Нью-Йорк, Т., и Хеллстрём, С. (2006). Спонтанное развитие среднего отита у мышей с дефицитом плазминогена. Внутр. J. Med. Microbiol. 296, 501–509. DOI: 10.1016 / j.ijmm.2006.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пожарный, П. (1997). Средний отит и дисфункция евстахиевой трубы: связь с аллергическим ринитом. J. Allergy Clin. Иммунол. 99, S787 – S797.
PubMed Аннотация | Google Scholar
Гальяно, М. Ф., Тулза, Э., Галлинаро, Х., Йонка, Н., Исида-Ямамото, А., Серре, Г. и др. (2006). Новый ингибитор протеазы семейства альфа2-макроглобулинов, экспрессирующийся в эпидермисе человека. J. Biol. Chem. 281, 5780–5789. DOI: 10.1074 / jbc.m508017200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гаврон, В., Викьера, Б., Ростковская-Надольская, Б., Орендорз-Франчковска К. и Ночиньска А. (2008). Оценка органа слуха у пациентов с синдромом Тернера. Внутр. J. Pediatr. Оториноларингол. 72, 575–579. DOI: 10.1016 / j.ijporl.2008.01.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джентиле, Д. А., Дойл, В. Дж., Зееви, А., Хоу-Адамс, Дж., Кападиа, С., Треки, Дж. И др. (2003). Полиморфизм генов цитокинов умеренной степени тяжести у младенцев с респираторно-синцитиальной вирусной инфекцией. Hum. Иммунол. 64, 338–344. DOI: 10.1016 / s0198-8859 (02) 00827-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гесснер Б. Д., Гиллингем М. Б., Вуд Т. и Келлер Д. М. (2013). Ассоциация генетического варианта карнитин-пальмитоилтрансферазы 1A с инфекциями у детей коренных народов Аляски. J. Pediatr. 163, 1716–1721. DOI: 10.1016 / j.jpeds.2013.07.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гибинк, Г.С., и Канафакс Д. М. (1991). Антимикробное лечение среднего отита. Семин. Респир. Заразить. 6, 85–93.
PubMed Аннотация | Google Scholar
Хафрен, Л., Эйнарсдоттир, Э., Кентала, Э., Хаммарен-Мальми, С., Бхутта, М. Ф., Макартур, К. Дж. И др. (2015). Предрасположенность к детскому среднему отиту и генетический полиморфизм в локусе toll-подобного рецептора 4 (TLR4). PLoS One 10: e0132551. DOI: 10.1371 / journal.pone.0132551
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, Ф., Yu, H., Li, P., Zhang, J., Tian, C., Li, H., et al. (2012). Мутация в гене Phex предрасполагает мышей BALB / c-Phex (Hyp-Duk) / Y к среднему отиту. PLoS One 7: e43010. DOI: 10.1371 / journal.pone.0043010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hardisty, R. E., Erven, A., Logan, K., Morse, S., Guionaud, S., Sancho-Oliver, S., et al. (2003). Мутантная глухая мышь Джефф (Jf) представляет собой единственную генную модель среднего отита. J. Assoc. Res. Отоларингол. 4, 130–138.DOI: 10.1007 / s10162-002-3015-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hardisty-Hughes, R. E., Tateossian, H., Morse, S. A., Romero, M. R., Middleton, A., Tymowska-Lalanne, Z., et al. (2006). Мутация в гене F-бокса, Fbxo11, вызывает средний отит у мышей Джеффа. Hum. Мол. Genet. 15, 3273–3279. DOI: 10.1093 / hmg / ddl403
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрнандес, М., Лейхтл, А., Пак, К., Ebmeyer, J., Euteneuer, S., Obonyo, M., et al. (2008). Ген 88 первичного ответа миелоидной дифференцировки необходим для разрешения среднего отита. J. Infect. Дис. 198, 1862–1869. DOI: 10.1086 / 5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Илия, С., Гулиелмос, Г. Н., Самонис, Г., и Галанакис, Э. (2014). Полиморфизм генов IL-6, IL-10, TNF-альфа, IFN-гамма и TGF-beta1 и предрасположенность к острому среднему отиту в раннем младенчестве. Педиатр. Заразить. Дис. J. 33, 518–521. DOI: 10.1097 / INF.0000000000000229
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йоки-Эрккила В. П., Пухакка Х. и Хурме М. (2002). Полиморфизм гена цитокинов при рецидивирующем остром среднем отите. Arch. Отоларингол. Head Neck Surg. 128, 17–20.
PubMed Аннотация | Google Scholar
Кальм, О., Джонсон, У., и Прелльнер, К. (1994). Частота HLA у пациентов с хроническим секреторным средним отитом. Внутр. J. Pediatr. Оториноларингол. 30, 151–157. DOI: 10.1016 / 0165-5876 (94) -8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кальм, О., Джонсон, У., Прелльнер, К., и Нинн, К. (1991). Частота HLA у пациентов с рецидивирующим острым средним отитом. Arch. Отоларингол. Head Neck Surg. 117, 1296–1299. DOI: 10.1001 / archotol.1991.01870230112019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кершнер, Дж.Е., Хонг, В., Тейлор, С. Р., Кершнер, Дж. А., Кампанг, П., Врег, К. С. и др. (2013). Новая модель спонтанного среднего отита с выпотом (OME) у мышей с нокаутом Oxgr1. Внутр. J. Pediatr. Оториноларингол. 77, 79–84. DOI: 10.1016 / j.ijporl.2012.09.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Larson, E. D., Magno, J. P. M., Steritz, M. J., Llanes, E. G. D. V., Cardwell, J., Pedro, M., et al. (2019). A2ML1 и средний отит: новые варианты, дифференциальная экспрессия и соответствующие пути. Hum. Мутат. 40, 1156–1171. DOI: 10.1002 / humu.23769
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лич, А. Дж., Виггер, К., Бейсбарт, Дж., Вольтринг, Д., Эндрюс, Р., Чатфилд, М. Д. и др. (2016). Общее состояние здоровья, средний отит, носоглотка и микробиология среднего уха в Северной территории Дети-аборигены, вакцинированные в течение последовательных периодов 10-валентными или 13-валентными конъюгированными пневмококковыми вакцинами. Внутр. J. Pediatr. Оториноларингол. 86, 224–232. DOI: 10.1016 / j.ijporl.2016.05.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х. Ю., Такешита, Т., Шимада, Дж., Акопян, А., Ву, Дж. И., Пан, Х. и др. (2008). Для индукции бета-дефенсина 2 с помощью NTHi требуется TLR2-опосредованный сигнальный путь MyD88 и IRAK-TRAF6-p38MAPK в эпителиальных клетках среднего уха человека. BMC Infect. Дис. 8:87. DOI: 10.1186 / 1471-2334-8-87
CrossRef Полный текст | Google Scholar
Ли Ю.К., Ким, К., Шим, Дж. С., Бьюн, Дж. Й., Парк, М. С., Ча, С. И. и др. (2008). Toll-подобные рецепторы 2 и 4 и их мутации у пациентов со средним отитом и выпотом в среднем ухе. Clin. Exp. Оториноларингол. 1, 189–195. DOI: 10.3342 / генеральный директор.2008.1.4.189
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Leichtle, A., Hernandez, M., Ebmeyer, J., Yamasaki, K., Lai, Y., Radek, K., et al. (2010). Хемокиновый лиганд 3 CC преодолевает бактерицидный и фагоцитарный дефекты макрофагов и ускоряет выздоровление от экспериментального среднего отита у TNF — / — мышей. J. Immunol. 184, 3087–3097. DOI: 10.4049 / jimmunol.0
7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, К., Ли, Ю. Х., Шталь, Г. Л., Турман, Дж. М., Хе, Ю. и Тонг, Х. Х. (2011). Существенная роль фактора B альтернативного пути комплемента в активации комплемента и опсонофагоцитозе во время острого среднего пневмококкового отита у мышей. Заражение. Иммун. 79, 2578–2585. DOI: 10.1128 / IAI.00168-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х., Xu, L., Li, J., Li, B., Bai, X., Strauss, J. F. I. I. I., et al. (2014). Средний отит у мышей с дефицитом спермо-ассоциированного антигена 6 (Spag6). PLoS One 9: e112879. DOI: 10.1371 / journal.pone.0112879
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lubianca Neto, J. F., Hemb, L., and Silva, D. B. (2006). Систематический обзор литературы по изменяемым факторам риска рецидивирующего острого среднего отита в детстве. J. Pediatr. 82, 87–96. doi: 10.2223 / jped.1453
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макартур, К. Дж., Уилмот, Б., Ван, Л., Шуллер, М., Лайтхолл, Дж., И Трун, Д. (2014). Генетическая предрасположенность к хроническому среднему отиту с выпотом: однонуклеотидные полиморфизмы гена-кандидата. Ларингоскоп 124, 1229–1235. DOI: 10.1002 / lary.24349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Магуайр, С., Эстабель, Дж., Ингхэм, Н., Пирсон, С., Райдер, Э., Каррагер Д. М. и др. (2014). Нацеливание на Slc25a21 связано с орофациальными дефектами и средним отитом из-за нарушения экспрессии соседнего гена. PLoS One 9: e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Митчелл, К. Р., Кемптон, Дж. Б., Скотт-Тайлер, Б., и Трун, Д. Р. (1997). Заболеваемость средним отитом и влияние на слуховой ответ ствола головного мозга у мышей C3H / HeJ, не отвечающих на липополисахариды. Отоларингол. Head Neck Surg. 117, 459–464. DOI: 10.1016 / s0194-5998 (97) 70014-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Monasta, L., Ronfani, L., Marchetti, F., Montico, M., Vecchi Brumatti, L., Bavcar, A., et al. (2012). Бремя болезней, вызываемых средним отитом: систематический обзор и глобальные оценки. PLoS One 7: e36226.
PubMed Аннотация | Google Scholar
Моррис, П. С. (1998). Систематический обзор клинических исследований, посвященных распространенности, этиологии, диагностике, прогнозу и терапии среднего отита у детей австралийских аборигенов. J. Paediatr. Здоровье детей 34, 487–497. DOI: 10.1046 / j.1440-1754.1998.00299.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мортенсен, Э. Х., Лилдхольдт, Т., Гаммельгард, Н. П., и Кристенсен, П. Х. (1983). Распределение групп крови ABO при секреторном среднем отите и холестеатоме. Clin. Отоларингол. Allied Sci. 8, 263–265. DOI: 10.1111 / j.1365-2273.1983.tb01439.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мулай, А., Худ, Д. У., Уильямс, Д., Рассел, К., Браун, С. Д. М., Бингл, Л. и др. (2018). Потеря гомеостатического белка BPIFA1 приводит к обострению тяжести среднего отита в модели мышей Junbo. Sci. Реп. 8: 3128. DOI: 10.1038 / s41598-018-21166-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Муса, М., Уилсон, К., Сан, Л., Мулай, А., Бингл, Л., Марриотт, Х. М. и др. (2012). Дифференциальная локализация BPIFA1 (SPLUNC1) и BPIFB1 (LPLUNC1) в носовой и ротовой полостях мышей. Cell Tissue Res. 350, 455–464. DOI: 10.1007 / s00441-012-1490-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Накамура Ю., Комори М., Ямакава К., Хамадзима Ю., Судзуки М., Ким Ю. и др. (2013). Math2, ретиноевая кислота и TNF-альфа синергетически способствуют дифференцировке слизистых клеток в эпителиальных клетках среднего уха мыши in vitro. Педиатр. Res. 74, 259–265. DOI: 10.1038 / pr.2013.103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ноксо-Койвисто, J., Чонмейтри, Т., Дженнингс, К., Маталон, Р., Блок, С., и Патель, Дж. А. (2014). Полиморфизмы генов иммунитета и предрасположенность к среднему отиту у детей. PLoS One 9: e93930. DOI: 10.1371 / journal.pone.0093930
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Норхаяти, М. Н., Хо, Дж. Дж., И Азман, М. Ю. (2017). Вакцины против гриппа для профилактики острого среднего отита у младенцев и детей. Кокрановская база данных Syst. Ред. 10: CD010089.DOI: 10.1002 / 14651858.CD010089.pub3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нуйтинк, Л., Де Мистер, Э., и Ван Тилен, М. (2006). Govaerts Роль генотипирования маннозо-связывающего лектина (MBL2) в прогнозировании риска рецидива среднего отита (rOM). Adv. Exp. Med. Биол. 586, 281–290. DOI: 10.1007 / 0-387-34134-x_19
CrossRef Полный текст | Google Scholar
Parkinson, N., Hardisty-Hughes, R.E., Tateossian, H., Tsai, H.Т., Брукер Д., Морс С. и др. (2006). Мутация в локусе Evi1 у мышей Junbo вызывает предрасположенность к среднему отиту. PLoS Genet. 2: e149. DOI: 10.1371 / journal.pgen.0020149
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Патель, Дж. А., Наир, С., Реваи, К., Грейди, Дж., Саид, К., Маталон, Р. и др. (2006). Связь полиморфизма генов провоспалительных цитокинов с предрасположенностью к среднему отиту. Педиатрия 118, 2273–2279. DOI: 10.1542 / педс.2006-0764
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамет, М., Лёфгрен, Дж., Алхо, О. П., и Халлман, М. (2001). Локус гена поверхностно-активного белка А, ассоциированный с рецидивирующим средним отитом. J. Pediatr. 138, 266–268. DOI: 10.1067 / mpd.2001.110133
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раймонд Б. Б. и Джорджевич С. (2015). Использование плазмина (огена) бактериальными патогенами, имеющими ветеринарное значение. Вет. Microbiol. 178, 1–13. DOI: 10.1016 / j.vetmic.2015.04.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Реваи, К., Патель, Дж. А., Грейди, Дж. Дж., Наир, С., Маталон, Р., и Чонмейтри, Т. (2009). Связь между полиморфизмом генов цитокинов и риском инфекции верхних дыхательных путей и острого среднего отита. Clin. Заразить. Дис. 49, 257–261. DOI: 10.1086 / 599833
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Робертс, Дж.Э., Розенфельд Р. М. и Цейсель С. А. (2004). Средний отит и речь и язык: метаанализ проспективных исследований. Педиатрия 113 (3, часть 1), e238 – e248. DOI: 10.1542 / педс.113.3.e238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рай, М. С., Уоррингтон, Н. М., Скаман, Э. С., Виджаясекаран, С., Коутс, Х. Л., Андерсон, Д. и др. (2012). Полногеномное ассоциативное исследование для определения генетических детерминант восприимчивости к среднему отиту в детстве. PLoS One 7: e48215. DOI: 10.1371 / journal.pone.0048215
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рай, М. С., Виртсема, С. П., Скаман, Э. С., Ооммен, Дж., Сан, В., Фрэнсис, Р. В. и др. (2011). FBXO11, регулятор пути TGFbeta, связан с тяжелым средним отитом у детей Западной Австралии. Genes Immun. 12, 352–359. DOI: 10.1038 / gene.2011.2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рай, М.С., Виртсема, С. П., Скаман, Э. С., Торнтон, Р., Фрэнсис, Р. В., Виджаясекаран, С. и др. (2013). Генетические и функциональные доказательства роли SLC11A1 в восприимчивости к среднему отиту в раннем детстве у населения Западной Австралии. Заражение. Genet. Evol. 16, 411–418. DOI: 10.1016 / j.meegid.2013.03.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сейл, М. М., Чен, В. М., Уикс, Д. Э., Михалецкий, Дж. К., Хоу, Х., Марион, М. и др. (2011).Оценка 15 функциональных генов-кандидатов на связь с хроническим средним отитом с выпотом и / или рецидивирующим средним отитом (COME / ROM). PLoS One 6: e22297. DOI: 10.1371 / journal.pone.0022297
CrossRef Полный текст | Google Scholar
Сантос-Кортез, Р. Л. П., Чионг, К. М., Франк, Д. Н., Райан, А. Ф., Гиз, А. П. Дж., Бутпетч Робертс, Т. и др. (2018). Варианты FUT2 придают предрасположенность к семейному среднему отиту. г. J. Hum. Genet. 103, 679–690.DOI: 10.1016 / j.ajhg.2018.09.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сантос-Кортез, Р. Л., Чионг, К. М., Рейес-Квинтос, М. Р., Тантоко, М. Л., Ван, X., Ачарья, А. и др. (2015). Редкие варианты A2ML1 вызывают предрасположенность к среднему отиту. Нац. Genet. 47, 917–920. DOI: 10,1038 / нг.3347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сантос-Кортез, Р. Л., Хатчинсон, Д. С., Аджами, Н. Дж., Рейес-Квинтос, М.Р., Тантоко, М. Л., Лабра, П. Дж. И др. (2016). Различия микробиома среднего уха у коренных филиппинцев с хроническим средним отитом из-за дупликации гена A2ML1. Заражение. Дис. Бедность 5, 97.
PubMed Аннотация | Google Scholar
Скулерати, Н., Ледесма-Медина, Дж., Файнджолд, Д. Н., и Стул, С. Е. (1990). Средний отит и потеря слуха при синдроме Тернера. Arch. Отоларингол. Head Neck Surg. 116, 704–707.
PubMed Аннотация | Google Scholar
Сегаде, Ф., Дейли, К. А., Оллред, Д., Хикс, П. Дж., Кокс, М., Браун, М. и др. (2006). Связь гена FBXO11 с хроническим средним отитом с выпотом и рецидивирующим средним отитом: семейное исследование COME / ROM Миннесоты. Arch. Отоларингол. Head Neck Surg. 132, 729–733.
PubMed Аннотация | Google Scholar
Шибахара Ю. и Сандо И. (1989). Врожденные аномалии евстахиевой трубы при синдроме Дауна. Отчет о гистопатологическом случае. Ann. Отол. Ринол. Ларингол. 98 (7 Pt 1), 543–547. DOI: 10.1177 / 000348948
0709
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шимада, Дж., Мун, С. К., Ли, Х. Ю., Такешита, Т., Пан, Х., Ву, Дж. И. и др. (2008). Дефицит лизоцима М приводит к повышенной восприимчивости к среднему отиту, вызванному Streptococcus pneumoniae. BMC Infect. Дис. 8: 134. DOI: 10.1186 / 1471-2334-8-134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шин, С.Г., Кох, С. Х., Ву, К. Х., Лим, Дж. Х. (2014). PAI-1 подавляет развитие хронического среднего отита и тимпаносклероза на мышиной модели среднего отита. Acta Otolaryngol. 134, 1231–1238. DOI: 10.3109 / 00016489.2014.940554
CrossRef Полный текст | Google Scholar
Судзукава К., Томлин Дж., Пак К., Чавес Э., Кураби А., Бэрд А. и др. (2014). Модель среднего отита на мышах идентифицирует HB-EGF как медиатор индуцированной воспалением пролиферации слизистой оболочки. PLoS One 9: e102739.DOI: 10.1371 / journal.pone.0102739
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Swanson, J. A., и Hoecker, J. L. (1996). Краткий обзор для врачей первичного звена. Мэйо. Clin Proc. 71, 179–183.
PubMed Аннотация | Google Scholar
Татеосян, Х., Морс, С., Паркер, А., Мбуру, П., Варр, Н., Асеведо-Арозена, А., и др. (2013). Средний отит у мышей с нокаутом по Tgif предполагает передачу сигналов TGFbeta в хроническое воспалительное заболевание среднего уха. Hum. Мол. Genet. 22, 2553–2565. DOI: 10.1093 / hmg / ddt103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tefs, K., Gueorguieva, M., Klammt, J., Allen, C.M., Aktas, D., Anlar, F.Y., et al. (2006). Молекулярно-клинический спектр недостаточности плазминогена I типа: серия из 50 пациентов. Кровь 108, 3021–3026. DOI: 10.1182 / кровь-2006-04-017350
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томас, С.Х., Мейерс, А. Д., Аллен, Г. К., и Трэшер, Р. Д. (2004). Средний отит с выпотом. Педиатрия 113, 1412–1429.
Google Scholar
Тиан К., Харрис Б. С. и Джонсон К. Р. (2016). Внематочная минерализация и кондуктивная потеря слуха у мышей с мутантами enpp1asj, новая модель среднего отита и тимпаносклероза. PLoS One 11: e0168159. DOI: 10.1371 / journal.pone.0168159
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тиан, К., Hromatka, B. S., Kiefer, A. K., Eriksson, N., Noble, S. M., Tung, J. Y., et al. (2017). Полногеномные исследования ассоциаций и точного картирования областей HLA выявляют локусы восприимчивости к множественным распространенным инфекциям. Нац. Commun. 8: 599. DOI: 10.1038 / s41467-017-00257-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тиан, К., Ю, Х., Ян, Б., Хань, Ф., Чжэн, Ю., Бартельс, К. Ф. и др. (2012). Средний отит на новой мышиной модели синдрома CHARGE с делецией в гене Chd7. PLoS One 7: e34944. DOI: 10.1371 / journal.pone.0034944
PubMed Аннотация | CrossRef Полный текст | Google Scholar
van Ingen, G., Li, J., Goedegebure, A., Pandey, R., Li, Y. R., March, M. E., et al. (2016). Полногеномное исследование ассоциации острого среднего отита у детей идентифицирует FNDC1 как ген, вызывающий заболевание. Нац. Commun. 7: 12792. DOI: 10.1038 / ncomms12792
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wiertsema, S.П., Хогенкамп А., Виртсема С. П., Харторн Л. Ф., Лунстра Р., Хартог А. и др. (2006a). Ассоциация полиморфизма промотора CD14 со средним отитом и реакциями пневмококковой вакцины. Clin. Вакцина Иммунол. 13, 892–897. DOI: 10.1128 / cvi.00100-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виртсема, С. П., Винховен, Р. Х., Вальравен, В., Уитервал, К. С., Шильдер, А. Г., Райкерс, Г. Т. и др. (2006b). Эффективность пневмококковой вакцины против пневмококковых инфекций слизистых оболочек зависит от полиморфизма рецептора Fcgamma IIa. Vaccine 24, 792–797. DOI: 10.1016 / j.vaccine.2005.08.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Визен, Б. М., Хафрен, Л., Эйнарсдоттир, Э., Кере, Дж., Маттила, П. С., Сантос-Кортез, Р. Л. и др. (2019). Генотип ABO и группа крови связаны со средним отитом. Genet. Тест Мол. Биомаркеры 23, 823–827. DOI: 10.1089 / gtmb.2019.0135
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ву, Дж. И., Пан, Х., О, С., Лим, Д. Дж., И Мун, С. К. (2010). MCP-1 / CCL2, происходящий из фиброцитов спиральной связки, способствует воспалению внутреннего уха, вторичному по отношению к нетипируемому вызванному H.influenzae отиту. BMC Infect. Дис. 10: 314. DOI: 10.1186 / 1471-2334-10-314
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ян, Б., Тиан, К., Чжан, З. Г., Хан, Ф. К., Азем, Р., Ю, Х. и др. (2011). Мыши Sh4pxd2b являются моделью черепно-лицевой дисморфологии и среднего отита. PLoS One 6: e22622. DOI: 10.1371 / journal.pone.0022622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yao, W., Frie, M., Pan, J., Pak, K., Webster, N., Wasserman, S. I., et al. (2014). Изоформы N-концевой киназы C-Jun (JNK) играют разные роли при среднем отите. BMC Immunol. 15:46. DOI: 10.1186 / s12865-014-0046-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Ю., Ю, Х., Сюй, М., Хань, Ф., Тянь, К., Ким, С. и др. (2012). Патологические особенности мутантных мышей LmnaDhe / + обеспечивают новую модель человеческого отита и ламинопатий. г. J. Pathol. 181, 761–774. DOI: 10.1016 / j.ajpath.2012.05.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Молекулярно-генетические подходы к характеристике патофизиологии болезней
Abstract
Средний отит (ОМ) — это инфекционно-воспалительное заболевание, которое, как известно, является основной причиной нарушения слуха во всех возрастных группах.И острая, и хроническая ОМ приводят к значительному использованию медицинских услуг, связанных с назначением антибиотиков и хирургическими процедурами, необходимыми для лечения. Хотя несколько исследований предоставили доказательства того, что генетика играет важную роль в восприимчивости к ОМ, до недавнего времени у нас были ограниченные знания о генах, связанных с ОМ. Здесь мы суммировали известные генетические факторы, которые определяют восприимчивость к различным формам ОМ у мышей и людей и их генетическую нагрузку, а также связанные с ними клеточные сигнальные пути.В этом обзоре особо выделяются ферменты фукозилтрансферазы (FUT), которые участвуют в патогенезе OM. Всестороннее понимание функций генов, связанных с ОМ, может предоставить потенциальные возможности для его диагностики и лечения.
Ключевые слова: средний отит (OM), омический, генетический, FUT, фукозилтрансфераза, A2ML1
Введение
Средний отит (OM) определяется как инфекционно-воспалительное заболевание среднего уха. Хотя ОМ ассоциируется со значительной неоднородностью клинических проявлений, к широким типам относятся острый средний отит (АОМ), хронический гнойный средний отит (ХСОМ) и хронический средний отит с выпотом (ОМО).Предыдущие исследования показали, что совокупная заболеваемость АОМ составляет около 11% во всем мире, причем 51% случаев приходится на детей в возрасте до пяти лет (Monasta et al., 2012). Рецидив AOM может привести к OME, частота которой во всем мире достигает 5% (Monasta et al., 2012). И АОМ, и ОМ по-прежнему связаны с обращением за медицинской помощью в виде антибактериальной терапии, посещения врача и отделения неотложной помощи, а также общих хирургических процедур, таких как тимпаностомические трубки, хотя появление эффективной противомикробной терапии привело к существенному снижению бремени CSOM (Thomas et al., 2004). В меньшем количестве исследований также описана связь между инфекциями среднего уха и речевым и языковым дефицитом, подчеркивая роль ОМ в развитии детей (Roberts et al., 2004).
Наиболее распространенные бактерии, выделяемые из среднего уха пациентов с АОМ, включают Streptococcus pneumoniae и Haemophilus influenzae , хотя Moraxella catarrhalis , Streptococcus pyogenes и Staphylococcus aureus наблюдаются реже.Напротив, Pseudomonas aeruginosa и S. aureus являются наиболее часто наблюдаемыми патогенами CSOM (Giebink and Canafax, 1991).
OM представляет собой многофакторное заболевание, которое может быть связано с комбинацией этиологических факторов, включая иммунологические, генетические, экологические и анатомические характеристики. Часто наблюдаемыми причинами являются сезонная восприимчивость к микробам и дисфункция евстахиевой трубы (Swanson and Hoecker, 1996; Fireman, 1997). Хорошо известно, что вирусы из дыхательных путей также играют решающую роль в патогенезе АОМ (Nokso-Koivisto et al., 2015). Кроме того, воздействие табачного дыма, использование соски-пустышки и посещение детских садов входят в число факторов риска для ОМ, в то время как грудное вскармливание и пневмококковые вакцины обладают защитным действием (Swanson and Hoecker, 1996; Lubianca Neto et al., 2006; Abrahams and Labbok). , 2011; Norhayati et al., 2017).
Помимо факторов окружающей среды, генетический фон также определяет восприимчивость к ОМ, хотя механизм заболевания до конца не изучен. Известно, что несколько генов, связанных с ОМ, идентифицированных в ходе исследований на людях и на животных моделях, играют фундаментальную роль в различных биологических процессах, включая (1) развитие расщелины среднего уха и евстахиевой трубы, (2) иммунный ответ, (3) ) бактериальная адгезия и скорость вирусной инфекции, (4) регуляция внеклеточного матрикса и (5) клиренс патогенов (см. конкретные исследования).В этом обзоре мы суммировали геномные варианты и факторы, о которых сообщалось у пациентов с различными формами ОМ. Также вкратце обсуждаются ранние генетические исследования ассоциации, мыши, от мыши к человеку, кандидат от человека, а также общегеномные исследования ассоциации, которые коррелируют ОМ и генетические вариации. Тем не менее, мы особенно сосредоточились на недавних открытиях ассоциации ферментов A2ML1 и FUT с ОМ и предложили нашу точку зрения на потенциальный механизм заболевания, который интуитивно может привести к ОМ у людей, укрывающих варианты FUT2 .
ТАБЛИЦА 1
Наиболее распространенные локусы, связанные со средним отитом в исследованиях на мышах.
| Локус | Белок | Функция / фенотип белка в мутанте мыши | OMIM | Ссылки | мышей штамма | TLR4 мышей предрасположены к бактериальной инфекции | 603030 | Mitchell et al., 1997 | ||
| Ccl3 | Хемокин с мотивом СС 3 | Ниже TNF-опосредованных путей воспаления | 182283 | Leichtle et al., 2010 | ||||||
| фактор B | Cfb Streptococcus pneumoniae индуцировал повышенную экспрессию гена фактора B альтернативного пути комплемента и C3 в эпителии среднего уха мыши | 138470 | Li et al., 2011 | |||||||
| Chd7 | Хромодомен-геликаза-ДНК-связывающий белок 7 | ОМ с излиянием | 608892 | Tian et al., 2012 | ||||||
| Eda | Ectodysplasin-A | Средний отит, ринит и назофарингит | 300451 | Azar et al., 2016 | ||||||
| рецептор T | ||||||||||
| рецептор | Средний отит, ринит и назофарингит | 604095 | Azar et al., 2016 | |||||||
| Enpp1 | Ectonucleotide pyrophosphatase эфф / фосфодиэстераза | 0 | 0 | 0 | 0 | 09106 мутантные мыши | 173335 | Tian et al., 2016 | ||
| Ets1 | E26, специфичные для трансформации 1 | Черепно-лицевые аномалии, небольшая полость среднего уха, короткая носовая кость, нарушение слуха, средний отит, слияние косточек со стенкой среднего уха и деформированные стремени | 164720 | Carpinelli et al., 2015 | ||||||
| Evi1 | Эктотропная вирусная интеграция 1 | Хроническая гнойная ОМ с отореей | 165215 | Parkinson et al., 2006 | ||||||
| Eya4 | Глаза отсутствуют, гомолог 4 | Аномальная полость среднего уха и евстахиева труба | 603550 | Depreux et al., 2008 | ||||||
1126 Fbxo11 толькоFbxo56 | Составные гетерозиготы, несущие аллели Джеффа и Матта, продемонстрировали укороченное лицо, снижение слуха и ОМ Черепно-лицевые аномалии, малая полость среднего уха, короткая носовая кость, нарушение слуха, средний отит, сращение косточек со стенкой среднего уха и деформированные стремени | 1 | Carpinelli et al., 2015 | |||||||
| Hbegf | Гепарин-связывающий EGF-подобный фактор роста | Гиперплазия эпителия слизистой оболочки | 126150 | Suzukawa et al., 2014 | ||||||
| 26 Hypoia | 269 прерывание сигнала | 603348 | Cheeseman et al., 2011 | |||||||
| Jnk1 | JNK1 | Мыши C57BL / 6, дефицитные по JNK1, демонстрируют усиленное утолщение слизистой оболочки Yahoo | и др., 2014||||||||
| Jnk2 | JNK2 | JNK2 — / — мыши демонстрируют отсроченную гиперплазию слизистой оболочки, задержку рекрутирования нейтрофилов и неэффективность бактериального клиренса | 602896 | Yao10 и др. Лизоцим M | Лизоцим M | Дефицит лизоцима M приводит к повышенной чувствительности к ОМ, индуцированному Streptococcus pneumoniae , | 153450 | Shimada et al., 2008 | ||
| Lmna | Prelamin-A / C | У всех мышей с мутантом Lmna (Dhe / +) | 150330 | наблюдались аномалии и аномальное расположение евстахиевой трубы, сопровождающиеся ОМ Zhang et al., 2012 | ||||||
| MyD88 | Белок первичного ответа миелоидной дифференцировки MyD88 | Задержка рекрутирования нейтрофилов и макрофагов | 602170 | Hernandez et al., 2008 | ||||||
| Mcp1 / Ccl2 | Хемокин с мотивом CC 2 | MCP-1 / CCL2 способствует воспалению внутреннего уха вторично по отношению к NTHi-индуцированному OM | 158105 | Woo1056 et al. Math2 | Белковый атональный гомолог 1 | Важен для дифференцировки слизистых клеток | 601461 | Nakamura et al., 2013 | ||
| Mph2 | Нарушение слуха в области средней ноги | a Мыши с мутантами Mcph2 (tm1a) (/ tm1a)300227 | Chen et al., 2013 | |||||||
| Oxgr1 | Рецептор 2-оксоглутарата 1 | COME | 606922 | Kerschner et al., 2013 | ||||||
Активатор Pai1| PAI1 | | ингибитор Plasmin Plas мутантные мыши показали низкие уровни воспаления против NTHi на ранней стадии OM173360 | Shin et al., 2014 | |||||||
| Pax9 | Парный бокс-белок Pax-9 | Экспрессия снижена в Slc25a21 (tm1a21 (tm1a КОМП) Wtsi) мутантных мышей; приводит к воспалению среднего уха | 167416 | Maguire et al., 2014 | ||||||
| Phex | Фосфат-регулирующая нейтральная эндопептидаза PHEX | Мутация в гене Phex предрасполагает мышей BALB / c-Phex (Hyp-Duk) / Y к OM | 300 ., 2012||||||||
| Plg | Плазминоген | Инфильтрация нейтрофилов и макрофагов, а также присутствие Т- и В-клеток в слизистой оболочке среднего уха | 173350 | Eriksson et al., 2006 | ||||||
| Spag6 | Спермоассоциированный антиген 6 | Spag6 мутантные мыши склонны к развитию ОМ из-за накопления жидкости и слизи, вторичных по отношению к дисфункции ресничек. | 605730 | Li et al., 2014 | ||||||
| Sh4pxd2b | Белок 2B, содержащий Sh4 и PX домен слизистую оболочку уха у мышей с мутантами Sh4pxd2b (nee) наблюдали | 613293 | Yang et al., 2011 | |||||||
| Slc25a21 | Носитель растворенного вещества Член семьи 25 21 | Гомозиготность по Slc25a21 (tm1a (KOMP) Wtsi) приводит к появлению у мышей орофациальных аномалий, нарушений слуха и воспаления в структурах запястья и складок. среднее ухо | 607571 | Maguire et al., 2014 |
ТАБЛИЦА 2
Наиболее распространенные локусы, связанные со средним отитом в исследованиях на людях.
| Ген | Chr: | Белок | Функция / путь | Маркер | Страна | Размер выборки| 910 Клинический исход | Ссылки | | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A2ML1 | 12 | Альфа-2-макроглобулин-подобный протеин 1 (A2ML1) | Активность ингибитора пептидазы | c.2478_2485dupGG CTAAAT (p.Ser829Trpfs * 9), p.Glu972 * | Филиппины | Семейный (затронутый = 38, незатронутый = 13) | LOD = 7,5 | OM | Santos-Cortez, 2015 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ABO | 9 | Системная трансфераза группы крови ABO | Группа крови | Тип O: c.260insG (p.Val87_ Thr88fs *) Тип A | Финляндия | 214 пробандов | OR = 2,14; 95% ДИ: 1,04–4,50; p = 0.03) тип O: (OR = 0,33; 95% CI: 0,11–1,04; p = 0,04)RAOM / COME A увеличивает риск COME c.260insG (p.Val87_Thr88fs *) вариант, а тип O защищает от RAOM | Wiesen et al., 2019 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD14 | 5 | Кластер дифференцировки 14 (CD14) | Иммунный ответ, корецептор TRL4 | rs2569190 | Нидерланды co = 35 | p = 0,004 | AOM | Wiertsema et al., 2006a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CPT1A | 11 | Карнитинпальмитоилтрансфераза типа 1A (CPT1A) | Окисление жирных кислот | rs80356779 | pt | 9105 910 co = 910OM | Gessner et al., 2013 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CX3CR1 | 3 | CX3C рецептор хемокина 1 | Связывается с хемокином | rs3732378 | США038 | Nokso-Койвисто и др., 2014 | 91 073||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FBXO11 | 2 | F-коробка только белок 1 (FBXO11) | Белок убиквитинирование | rs10182633 rs12620679 rs12712997 rs13430439 rs2710163 rs33787 rs6713506 rs6728843 rs12712997 | Австралия | ca = 253, co = 866 | p = 0,0009 p = 0,001 p = 0,0002 p = 0,0061 p = 0,0003 p = 6.9 × 10 –6 p = 0,0074 p = 0,0061 | AOM | Rye et al., 2011 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RS33016787 | co = 561p = 0,009 p = 0,053 | RAOM / COME | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FCGR2A | 1 | Fc-гамма-рецептор 11a (FCGR210 рецептор) 11a (FCGR210 рецептор) | rs1801274 | Нидерланды | ca = 383 | p = 0.03 | ОМ после PV | Wiertsema et al., 2006b | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FNDC1 | 6 | Белок 1, содержащий домен III типа фибронектина (FNDC1) | Может быть активатором 910 rs2956 | белка G32910 | Европейский | 825 случаев и 7 936 контрольных | p мета = 2,15 × 10 –09 | AOM | van Ingen et al., 2016 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Галактозид 2-альфа-L-фукозилтрансфераза 2 (FUT2) | Создает H-антиген, необходимый для образования антигенов группы крови ABO | rs1800022, rs601338, rs14 14, rs602662 | anguineФилиппины, США | , Пакистан, США родословная 609 мультиэтнических семей и простых пациентов с OMLOD = 4.0 | COME, AOM, OM | Santos-Cortez et al., 2018 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IFNG | 12 | IFN γ | Цитокины, иммунный ответ | rs2430561 ca | 9 co = 57p = 0,04 | ОМ с инфекцией RSV | Gentile et al., 2003 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IL10 | 1 | Интерлейкин 10 (IL-10) | Цитокины, иммунный ответ | rs1554286, rs1800872, rs1800890, rs1800893, rs1800896, rs3024509 | USA | 142 семейства | p (ht) = 0.012, p (ht) = 0,039, p (ht) = 0,017, p (ht) = 0,017, p (ht) = 0,017, p = 0,040 | RAOM / COME | Sale et al., 2011 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| rs1800896 | Нидерланды | ca = 348, co = 463 | p = 0,01 | Защита для AOM после PV | и др.Emonts | rs1800871 | Греция | ca = 96, c = ноль | p <0.0001 | AOM | Ilia et al., 2014 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| rs1800896, rs1800871, rs1800872 | США | 02 = 0,05 p = 0,05| ОМ следует за RSV / RV | IL1A | 2 | Интерлейкин I- (IL-1 альфа) | Цитокины181053 | Финляндия, иммунный ответ ca = 63, co = 400 | p = 0.03 | RAOM | Joki-Erkkila et al., 2002 | IL1B | 2 | Интерлейкин 1-β (IL-1β) | Цитокины, иммунный ответ | 56 США | rs = 653, co = nil OR = 1,35 | OM (склонность) | Nokso-Koivisto et al., 2014 | rs1143634 | = 24 | p = 0.02 | АОМ (воспаление) | IL6 | 7 | Интерлейкин 6 (IL-6) | Цитокины, иммунный ответ | rs1800795 | , co | OR> 1,45; p = 0,02 | AOM | Emonts et al., 2007 | rs1800795 | США | ca = 68, | 01 | RAOM | Revai et al., 2009 | rs1800795 | USA | ca = 192, co = 192 | и др., 2006 | rs1800795 | США | ca = 77, co = 80 | p <0,01 | AOM No | -910, 2014 MBL2 | 10 | Маннозосвязывающие лектины (MBL) | Иммунный ответ | rs11003125, rs1800450, rs1800451, rs50307109 = | OR (ht) = 2,9 | AOM | Nuytinck et al., 2006 | мДНК | mt | н / д | Митохондриальная ДНК | car1956C Чехия = 355 | p = 0.032 | AOM | Sale et al., 2011 | MUC2 | 11 | Муцин-2 | Гелеобразующий муцин, смазка, вязкоупругость | rs73 | p = 0,049 | RAOM / COME | Sale et al., 2011 | rs7396030 | США | 441 семья | .022 | RAOM / COME | MUC5AC | 11 | Mucin-5AC | Гелеобразующий муцин, смазка, вязкоупругость | MUC5AC (интроник | = | США =) ca США = 40 p = 0,025 | RAOM / COME | Ubell et al., 2010 | MUC5B | 11 | Mucin-5B | Вязкость, образующая гель | США | ca = 102, co = 83 | p = 0.033 | COME | MacArthur et al., 2014 | rs2075859 | США | 142 семейства | и др. , 2011 | rs2735733 | США | 142 семьи | p = 0,02 | RAOM / COME | Sale et al., 2011 | PAI1 | 7 | Ингибитор активатора плазминогена-1 (PAI1) | Воспаление | rs1799889 | Нидерланды | ca = 226, co10 | 0,05 Emonts et al., 2007 | SCN1B | 19 | Субблок натриевого канала β1 (SCN 1 β) | Связывание ионного канала, активность потенциалзависимого ионного канала | rs81 | rs81 США | ca = 142 семьи | p = 0.013 | RAOM / COME | Sale et al., 2011 | SFTPA1 | 10 | SFTPA1 | Фосфо-липопротеины, сурфактант | sa4-110 | гаплотип Финляндия = 278 | p (ht) = 0,03 | RAOM | Ramet et al., 2001 | SFTPD | 10 | SFTPD | Фосфо-липопротеины1210 910 910 910 | США | семьи p = 0.039 | RAOM / COM | Sale et al., 2011 | SLC11A1 | 2 | Семья носителей растворенных веществ 11 член (SLC11A1) | Транспортер, удаление патогенов | 334 rs22 | Австралия | ca = 531 семейство, co = 660 | p (ht) = 0,008 | OM Проходность | Rye et al., 2013 | SMAD2 | 18 | Транскрипционный модулятор по TGF-beta | rs17 | Австралия | ca = 434 семьи, co = 561 | p = 0.038 | RAOM / COME | Rye et al., 2011 | SMAD4 | 18 | SMAD4 | Семейства транскрипционных модуляторов, активируемых BMP | rs10502913 | , Австралия | co = 561 | p = 0,048 | RAOM / COME | Rye et al., 2011 | TGFB1 | 19 | Трансформирующий фактор роста бета 1 (TGF-β1) | Связывание с антигеном | rs1982073 | Греция | ca = 96 | p = 0.002 | AOM | Ilia et al., 2014 | TLR2 | 4 | Толл-подобный рецептор 2 (TLR2) | Воспаление, инициаторы системы врожденного иммунитета | ca = 85, co-100 | Значительно высокий | COME | Lee HY et al., 2008 | TLR4 | 9 | Толл-подобный рецептор 4 (TLR4) | Воспаление, инициаторы системы врожденного иммунитета | rs1800896, rs1800871, | 10531053 США,10531053 США co = 83 p = 0.005 p = 0,05 p = 0,05 | AOM | Илия и др., 2014 | rs11788318, rs481011496253 rs11788318, rs48101149514956, rs481011496495, rs11788318, rs4810114951456, rs 102, co = 83 | p = 0,008, p = 0,031, p = 0,007, p = 0,023, p = 0,021 | COME | MacArthur et al., 2014 | rs10116253, rs12377632, rs22770146, rs5030717 | США | 142 семейства | p (ht) = 0.025, p (ht) = 0,014, p = 0,026, p (ht) = 0,017 | COME / RAOM | Sale et al., 2011 | rs5030790, rs5032790, rs5032790 rs1329057 | Финляндия | ca = 624, co = 778 1269 трио 403 семьи ca = 100, co = 104 | OR 1,33, p = 0,003 OR 1,33, p = 0,002 OR 1,29, p = 0,003 | COME / RAOM | Hafren et al., 2015 | TNFA | 6 | Фактор некроза опухоли α (TNF α) | 192 Цитокины, иммунный ответ | 00629 USA rs1856006 , co = 192 | p = 0.05 | AOM | Emonts et al., 2007 | ca = 222, co = 120 | 10 | 1056 | Нидерланды | p = 0,07 | AOM | Revai et al., 2009 | 00 79356 556 556 rs ca = 68, co = 145 | 16 | 16 | 9356 9356 93565642 RAOM | Revai et al., 2009 | rs1800750 | USA | 10 | 9310 | восприимчивость стала очевидной в 1980-х годах после того, как несколько исследований показали, что распространенность ОМ была непропорционально высокой у некоторых этнических групп (коренные американцы и австралийские аборигены) и относительно низкой у лиц африканского происхождения (Clements, 1968; Bhutta, 2015).Наблюдательное исследование носительства в ухе и носоглотке было проведено среди отдаленных австралийских аборигенов в 2013 году и показало, что 50% маленьких детей (средний возраст 13 месяцев) имели ОМЭ, 37% имели АОМ и 12% имели КСОМ (Leach et al., 2016). Сегодня CSOM по-прежнему играет важную роль в распространении нарушений слуха и обучения в общинах австралийских аборигенов (Morris, 1998). | Одно из самых ранних генетических исследований ОМ, проведенное в 1983 году, проанализировало группы крови (ABO) в когорте из 610 детей с хроническим средним отитом с выпотом (COME) и пришло к выводу, что группа крови «A» была генетическим фактором риска. для OM на основании их наблюдения за его более высокой распространенностью у детей с КОМЭ по сравнению с здоровыми детьми (Mortensen et al., 1983). Более поздние исследования показали, что человеческий лейкоцитарный антиген (HLA) 2 и HLA3 сильно связаны с АОМ, тогда как пациенты с СОМЭ имеют более низкую частоту HLA2 (Kalm et al., 1991, 1994). Наследственность и генетические компоненты времени и количество эпизодов ОМЕ и АОМ в течение первых 2 лет жизни также были исследованы в исследовании с близнецами и тройняшками в 1999 г., и была обнаружена сильная связь между продолжительностью или количеством эпизодов. ОМ и генетический состав (Casselbrant et al., 1999). Вклад генетики в восприимчивость к ОМ подтверждается исследованиями, в которых сообщается о более высокой заболеваемости ОМ у детей с хромосомными аномалиями. Например, распространенность ОМЕ у детей с синдромом Дауна приближается к 38% (Austeng et al., 2013). Гены, присутствующие на хромосоме 21, в сочетании с черепно-лицевыми дефектами, такими как гипоплазия средней зоны лица, короткое небо и дисфункция евстахиевой трубы (Shibahara and Sando, 1989), а также дефекты иммунной системы (Ram and Chinen, 2011), наблюдаемые у детей с синдромом Дауна, могут способствовать к их повышенному риску ОМ. Ets1 Ген , кодирующий протоонкоген, недавно был связан с черепно-лицевыми аномалиями и OM в исследовании на мышах (см. Раздел «Исследования на мышах и от мыши к человеку») (Carpinelli et al., 2015). У человека ген ETS2 , который также принадлежит к семейству генов протоонкогенов, присутствует на хромосоме 21 и может вносить вклад в чувствительность к ОМ при синдроме Дауна. В нескольких исследованиях, проведенных на когортах с синдромом Тернера, генетическим заболеванием частичной или полной потери хромосомы X у женщин, описана высокая вариабельность (от 9 до 9).От 1 до 91%) заболеваемости АОМ (Sculerati et al., 1990; Bois et al., 2018). Хотя анализ кариотипа не выявил какой-либо подгруппы значительно высокого риска, женщины с синдромом Тернера также имеют более высокую распространенность и более длительную патологию среднего уха (Gawron et al., 2008; Bois et al., 2018). Эти данные указывают на причастность некоторых генов Х-хромосомы к развитию, функционированию или здоровью среднего уха. Исследования на мышах и от мыши к человекуРазработка и фенотипирование трансгенных и нокаутных моделей мышей за последние 30 лет значительно помогли идентифицировать несколько генов и генетических вариаций, которые придают чувствительность к ОМ у мышей.Большинство этих моделей мышей спонтанно развивают OM; изучение морфологии и функции их ушей позволило понять патофизиологию заболевания на молекулярном уровне. Например, Eriksson et al. (2006) показали, что у мышей с дефицитом плазминогена ( Plg ) спонтанно развивается хронический ОМ к 18-недельному возрасту. Плазмин, активная форма фермента сериновой протеиназы PLG, в основном участвует в диссоциации фибриновых сгустков и способствует деградации внеклеточного матрикса (Ayon-Nunez et al., 2018). Плазмин играет решающую роль в нескольких клеточных процессах, включая заживление ран, иммунитет, ремоделирование тканей, воспаление и миграцию клеток (Tefs et al., 2006). Недавние исследования показали, что некоторые бактерии обладают адгезиями, связывающими плазминоген, на своей клеточной поверхности, чтобы использовать фибринолитическую систему, способствуя захвату и инвазии бактерий (Raymond and Djordjevic, 2015; Ayon-Nunez et al., 2018). Роль факторов транскрипции в патологии ОМ стала очевидной в результате исследований мутантных мышей, лишенных генов Eya4 , Evi1 , Tgif , Ets1 и Fli1 (Hardisty-Hughes et al., 2006; Паркинсон и др., 2006; Depreux et al., 2008; Татеосян и др., 2013; Carpinelli et al., 2015). У мышей, лишенных Eya4 , наблюдается дисфункция евстахиевой трубы, что ведет к увеличению частоты OME и нарушения слуха (Depreux et al., 2008). Было показано, что варианты в Evi1 у мышей Junbo вызывают восприимчивость к CSOM. Мыши Junbo накапливают выпоты в среднем ухе и развивают гипоксию, воспаление и утолщение слизистой оболочки надкостницы (Parkinson et al., 2006; Bhutta et al., 2014). Более поздние исследования показали, что потеря BPIFA1, одного из самых распространенных секреторных белков в верхних дыхательных путях (Musa et al., 2012), усугубляет тяжесть ОМ у мышей Junbo . В то время как мутантные мыши Bpifa1 не проявляли какой-либо чувствительности к ОМ, делеция Bpifa1 у мышей, несущих вариант Evi1 Junbo , приводит к утолщению слизистой оболочки среднего уха и увеличению отложения коллагена (Mulay et al., 2018) .Потеря Tgif1 , который кодирует TGIF1, приводит к OME, сопровождающемуся утолщением эпителиальной выстилки среднего уха, увеличением популяции бокаловидных клеток, повышенными уровнями TNF-α и IL-1β в ушных жидкостях и кондуктивной тугоухостью. у мышей (Tateossian et al., 2013). Точно так же гаплонедостаточность для Ets1 и Fli1 у мышей приводит к черепно-лицевым аномалиям, в том числе к уменьшению полости среднего уха и сращиванию косточек со стенками среднего уха (Carpinelli et al., 2015). Более того, у Fli1 ± и Ets1 ± двойных мутантных мышей нарушен слух, и их слизистая оболочка среднего уха инфильтрирована провоспалительными клетками, что приводит к ОМ (Carpinelli et al., 2015). Hardisty et al. (2003) показали, что Jeff мутантных мышей, несущих вариант Fbxo11 , имеют черепно-лицевые аномалии, повышенный порог слышимости и выпот в среднем ухе. У мутантных мышей Fbxo11 и наблюдались дефекты кавитации булл, которые в конечном итоге приводят к спайкам среднего уха и минерализации мягких тканей костной анатомии (Del-Pozo et al., 2019). Используя мутагенез N-этил-N-нитрозомочевины, Crompton et al. (2017) показали, что патогенный вариант p.Leu972Pro, также известный как вариант edison , в гене Nischarin ( Nisch ) приводит к легким черепно-лицевым дефектам, спонтанной ОМ к 20 неделям и прогрессирующей потере слуха. Недавние исследования сообщили об ассоциации TGIF1 и NISCH локусов как областей потенциального риска для ОМ у людей (Bhutta et al., 2017), что подтверждает актуальность знаний, полученных на мышиных моделях, для патофизиологии ОМ у людей. Наконец, у мышей с мутантными факторами транскрипции Eda и Edar ( Eda Ta и Edar dlJ / dlJ ) также развились хронический ринит и ОМ (Azar et al., 2016) . У этих мутантов железистый эпителий носоглотки не развивается, что приводит к потере секреции лизоцима, снижению мукоцилиарного клиренса и чрезмерному росту комменсальных бактерий. Распространение назальных S. aureus у мышей Eda Ta и Escherichia coli у Edar dlJ / dlJ мышей в булл среднего уха потенциально вызывает воспаление и др. al., 2016). Неполный список наиболее распространенных локусов, ассоциированных с ОМ у мышей, представлен в. Исследования на основе генов-кандидатов и полногеномные ассоциации на людяхВ то время как ранние исследования ОМ на основе генов-кандидатов проводились в основном на кавказских пациентах с рецидивирующим АОМ и хроническим ОМЕ (см. Раздел Ранние исследования), более недавние генетические исследования были сосредоточены об этнических группах или сообществах, для которых браки в семьях относительно распространены (например, коренное филиппинское сообщество или пакистанские семьи) (Santos-Cortez et al., 2015, 2018). Эти исследования выявили несколько новых генов и вариантов, которые придают предрасположенность к семейному ОМ (см. Раздел «Восприимчивость к ОМ, инбридинг и секвенирование всего экзома»): A2ML1 и FUT2 (Santos-Cortez et al., 2015, 2018). Кандидатские исследования на основе геновМногие варианты генома ассоциированы с инфекционными заболеваниями (Клебанов, 2018). В некоторых случаях клинические признаки и биологические механизмы, такие как иммунный ответ, воспаление, бактериальная адгезия, вирусная инфекция и мукоцилиарный клиренс, вовлеченные в эти инфекционные заболевания, совместимы с механизмами, задействованными во время эпизода ОМ, что позволяет маркировать гены. известны этими расстройствами как главные кандидаты на предрасположенность и рецидивы ОМ.В исследованиях на основе генов-кандидатов OM в основном участвовали гены, связанные с врожденным иммунитетом и воспалением (Sale et al., 2011). Эти исследования были выполнены на когортах со всего мира, включая США, Финляндию, Австралию, Нидерланды, Грецию и Бельгию, и выявили более 100 аллелей, которые придают чувствительность к различным формам ОМ (см. Неполный список этих аллелей, гены и связанные с ними клинические особенности). Как видно из этого неполного списка, идентифицированные гены принадлежат к нескольким различным сигнальным каскадам и процессам развития, включая (а) иммунный ответ и воспаление ( MBL2 , TLR2 , TLR4 , CD14 , FCGR2A , TGFB1 и PAI1 ) (Nuytinck et al., 2006; Wiertsema et al., 2006a, b; Emonts et al., 2007; Ли Ю. et al., 2008; Илья и др., 2014; Hafren et al., 2015), (b) цитокины ( IL6 , IL10 , IL1A , IL1B , TNFA и IFNG ) (Patel et al., 2006; Alper et al. , 2009; Revai et al., 2009; Ilia et al., 2014), (c) клиренс ткани ( SFPTA , SFTPA1 , SFTPD , SLC11A1 , MUC2 , MUC5AC и MUC5B ) (Ramet et al., 2001; Sale et al., 2011; Рай и др., 2013; MacArthur et al., 2014), (d) модуляция транскрипции ( SMAD2 и SMAD4 ) (Rye et al., 2011), (e) химиочувствительность ( CX3CR1 ) (Nokso-Koivisto et al., 2014) (f) модификация белка ( CPT1A и FBXO11 ) (Rye et al., 2011, 2012) и (g) активность канала ( SCN1B ) (Sale et al., 2011). Некоторые из этих генов, такие как FBXO11 , были реплицированы в нескольких независимых исследованиях, что еще больше усилило их роль в восприимчивости к ОМ (Segade et al., 2006; Рай и др., 2011). Полногеномные исследования ассоциацииБыло проведено несколько полногеномных ассоциативных исследований (GWAS) для выявления новых общих (частота 75% или выше) маркеров низкого риска (OR <1,5), связанных с подтипами OM. Здесь резюмируются результаты пяти основных GWAS. В исследовании Западной Австралии по беременности и родам (Рейн) когорта из 416 пациенток с предрасположенностью к ОМ и 1075 нормальных субъектов была проанализирована на 2524817 SNP. Хотя первоначальный анализ выявил некоторую связь, ни один из SNP не достиг значимости GWAS ( P <10 –8 ) и не мог быть воспроизведен как в австралийской, так и в американской когортах (Rye et al., 2012; Allen et al., 2014). Интересно, что GWAS когорт Миннесоты и Питтсбурга идентифицировал SNP (rs10497394 на хромосоме 2), который показал значительную связь (открытие GWAS P = 1,30 × 10 -5 , независимая популяция среднего отита P мета = 1,52 × 10 –8 ) с предрасположенностью к хроническому ОМЕ или рецидивирующему АОМ (Allen et al., 2013). Наконец, в финской когорте (829 затронутых детей и 2118 случайно выбранных контролей) варианты rs16974263 (открытие GWAS P = 1.77 × 10 –7 , анализ субфенотипа P мета = 2,92 × 10 –8 ), rs268662 ( P = 1,564 × 10 –6 ) и rs4150992 ( P = 3,37 × 10 –6 ) были наиболее значимыми вариантами, связанными с COME (Einarsdottir et al., 2016). В van Ingen et al. (2016) выполнили GWAS на когорте детей с ОСО европейского происхождения и сообщили о статистически значимой ассоциации в локусе 6q25.3 (rs2 9, P meta = 2.15 × 10 –9 ). Это исследование также продемонстрировало, что ассоциированные варианты коррелируют со статусом метилирования (cg05678571, p = 1,43 × 10 –6 ) и уровнями экспрессии ( p = 9,3 × 10 –5 ) FNDC1 ген. Кроме того, независимое исследование GWAS с участием более 200000 человек европейского происхождения сообщило о 14 геномных регионах, в том числе FUT2 ( p -значение: 3,51 × 10 -30 ), TBX1 (1.17 × 10 –19 ), HLA-DRB1 (rs4329147, 9,55 × 10 –12 ), ABO (3,67 × 10 –11 ), EFEMP1 (1,47 × 10 –10 ), AUTS2 (3,75 × 10 –9 ), CDHR3 (5,40 × 10 –9 ), BSN (1,56 × 10 –8 ) и PLG (3,78 × 10 –8 ), которые были в значительной степени связаны с инфекцией уха у детей (Tian et al., 2017), что дополнительно подчеркивает вклад генетических факторов, ответственных за ОМ у людей. OM Восприимчивость, инбридинг и секвенирование всего экзомаA2ML1В большой кровной родословной коренных филиппинцев с высокой частотой встречаемости OM Santos-Cortez et al. (2015) с помощью всего экзома и секвенирования по Сэнгеру показали, что дупликация 8 п.н. в гене A2ML1 (оценка LOD 7,5) была связана с восприимчивостью к ОМ. Такая же дупликация была обнаружена гетерозиготным или гомозиготным образом у трех человек (европейские американцы и латиноамериканцы) из другой когорты из 123 детей, предрасположенных к ОМ и отсутствующей у детей, не склонных к отиту, и более чем 62000 последовательностей следующего поколения.Авторы идентифицировали семь дополнительных гетерозиготных вариантов A2ML1 у пациентов европейско-американского и латиноамериканского происхождения с ОМ. A2ML1 кодирует альфа-2-макроглобулин-подобный белок 1 (A2ML1), белок, который улавливает протеиназы и расщепляет их. Последующее исследование выявило 16 дополнительных вариантов A2ML1 у субъектов с ОМ в коренных филиппинских и пакистанских семьях, а также у американских пробандов (Larson et al., 2019). Основываясь на экспрессии в эпителии слизистой оболочки среднего уха мыши, было высказано предположение, что A2ML1 может выполнять защитную функцию, регулируя протеазы, присутствующие в полости среднего уха, а также может регулировать десквамацию эпидермиса (Galliano et al., 2006). Недавно, путем секвенирования 16S рРНК микробиоты среднего уха коренного филиппинского сообщества, склонного к ОМ, и разделения A2ML1 вариантов, хотя и не имеющих статистически значимой разницы между случаями и контролем, таксономический анализ показал относительную численность типы Fusobacteria и Bacteroidetes и род Fusobacterium у носителей A2ML1 по сравнению с не-носителями (Santos-Cortez et al., 2016). FUT2В той же большой кровной родословной коренных филиппинцев с высокой частотой ОМ, частично из-за вариантов в A2ML1 , подмножество особей относилось к дикому типу для A2ML1 , но были предрасположены к ОМ (Santos-Cortez et al. ., 2015). Дальнейший генетический анализ показал, что вариант FUT2 (p.Arg202 * , оценка LOD 4.0) придает чувствительность к OM у этих людей (Santos-Cortez et al., 2018). Скрининг образцов ДНК от 609 дополнительных многоэтнических семей и субъектов с симплексным случаем с ОМ с помощью прямого секвенирования по Сэнгеру, анализа сцепления, точного определения Фишера и тестов на неравновесие передачи выявил несколько других вариантов FUT2 (стр.Arg138Cys, p.Trp154 ∗ и p.Ala104Val), которые придают чувствительность к ОМ (Santos-Cortez et al., 2018). Ферменты FUT участвуют в пути гликозилирования белков. FUT переносят L-фукозный сахар, полученный из GDP-фукозы (донорный субстрат), на белок (акцепторный субстрат). Семейство FUT состоит из 13 членов (FUT1 – FUT13), и многие из FUT необходимы для синтеза антигенов группы крови. FUT представляют собой однопроходные мембранные белки типа II, резидентные в транс-Гольджи, в то время как каталитический домен белков FUT находится в просвете Гольджи.У человека FUT1 и FUT2 кодируют галактозид 2-L-фукозилтрансферазу, а FUT3 кодирует галактозид 3 (4) -L-фукозилтрансферазу. FUT1 и FUT2 переносят L-фукозу на производное β-D-галактозил- (1 → 4) -N-ацетил-β-D-глюкозаминила и создают олигосахарид FuC-альфа [(1,2) Gal-бета-], также известный как H-антиген, который представляет собой растворимый предшественник, необходимый для заключительного этапа синтеза растворимых антигенов A и B. FUT3 переносит L-фукозу на производное β-D-галактозил- (1 → 4) -N-ацетил-β-D-глюкозаминила или на H-антиген, чтобы создать антигены Льюиса группы крови. FUT1 и FUT2 по-разному экспрессируются в разных типах клеток. Например, экспрессия FUT1 ограничена клетками мезодермального происхождения (например, эритроцитами), а экспрессия FUT2 ограничена клетками энтодермального происхождения (такими как клетки слизистой оболочки среднего уха). Следовательно, антигены A и B будут экспрессироваться на поверхности эритроцитов под контролем FUT1, тогда как антигены A и B будут экспрессироваться на поверхности клеток слизистой оболочки под контролем FUT2.Естественно существуют генетические вариации в FUT1 и FUT2 . Некоторые варианты FUT1 и FUT2 приводят к нефункциональным ферментам, в то время как определенные вариации в FUT2 также могут приводить к снижению его экспрессии (Santos-Cortez et al., 2018). Например, вариант FUT1 p.Tyr154Cys устраняет функциональную активность каталитического домена, что приводит к отсутствию антигенов A, B или H на поверхности эритроцитов (также известный как фенотип Бомбея).Точно так же вариант FUT2 p.Trp154 ∗ вызывает отсутствие антигенов A, B или H на поверхности клеток слизистой оболочки (он же несекреторный статус) (Domino et al., 2001a, b). Вариант FUT2 p.Trp154 ∗ также отвечает за несекреторный фенотип в европейских и африканских популяциях (47 и 42% соответственно). Известно, чтоA, B, H и антигены Льюиса служат источником энергии, а также регулируют адгезию бактерий к поверхности клетки (Ewald and Sumner, 2018;).Интуитивно понятно, что различные антигены группы крови и их количество на поверхности клеток эпителия слизистой оболочки среднего уха могут влиять на микробиоту, присутствующую в полости среднего уха, и различные группы крови были связаны с ОМ (Wiesen et al. др., 2019). Например, исследования в финской когорте сообщили о защитном эффекте группы крови O против рецидивирующего АОМ, тогда как группа крови А была связана с повышенным риском хронического ОМЕ (Wiesen et al., 2019). При тестировании in vitro четыре варианта FUT2 , связанных с ОМ (стр.Ala104Val, p.Arg138Cys, p.Trp154 ∗ и p.Arg202 ∗ ) снижали уровни антигена A, в то время как два бессмысленных варианта также снижали уровни белка FUT2. Более того, Fut2 временно активируется в среднем ухе мыши после инокуляции нетипируемым H. influenza (Santos-Cortez et al., 2018). Предполагается, что варианты FUT2 , связанные с ОМ, модифицируют микробиом среднего уха посредством регуляции уровней антигена А в слизистой оболочке среднего уха, тем самым повышая чувствительность к ОМ (Santos-Cortez et al., 2018). Роль FUT2 в регуляции группы крови и антигенов Льюиса на поверхности мерцательных клеток слизистой оболочки среднего уха: показаны секреторный и несекреторный статус. Дисбаланс оптимальных бактерий (зеленый) и патогенных бактерий (красный) показан у несекреторных индивидуумов, склонных к острому среднему отиту. В то время как различия в микробном богатстве, структуре и составе не были статистически значимыми между контрольными индивидуумами и индивидуумами, предрасположенными к ОМ, в коренной филиппинской общине, разделяющей FUT2 p.Вариант Arg202 ∗ , люди из когорты Колорадо, предрасположенные к OM и носители варианта FUT2 p.Trp154 ∗ , имели относительно высокую численность Lactobacillales и Gamma-proteobacteria в среднем ухе (Santos -Cortez et al., 2018). Для полного понимания механизма ОМ, связанного с FUT2, необходимы дальнейшие исследования на животных моделях. Является ли хронический гнойный средний отит забытым тропическим заболеванием?Хронический гнойный средний отит (CSOM) — одно из самых распространенных детских заболеваний во всем мире, и, по данным Всемирной организации здравоохранения (ВОЗ), от него страдают от 65 до 330 миллионов человек во всем мире, но в основном в развивающихся странах [1, 2,3].Недавнее эпидемиологическое исследование показало, что страны с самыми высокими показателями заболеваемости CSOM проживают в бедных тропических и субтропических регионах, хотя также наблюдается аномально высокая распространенность CSOM среди уязвимых групп населения в странах с высоким уровнем дохода, таких как аборигены и коренные народы, проживающие в Австралии и Аляска, США соответственно [2,4] (). Хотя точное определение CSOM все еще обсуждается, ВОЗ в настоящее время определяет его как хроническое воспаление полости среднего уха с периодическими выделениями через барабанную перфорацию в течение трех месяцев или более [2] ().Считается, что CSOM чаще всего возникает в течение первых шести лет детства, часто из-за плохого ведения острого среднего отита (AOM) [2,5,6]. Поскольку точный момент времени, когда AOM становится CSOM, все еще активно обсуждается, точная диагностика CSOM остается сложной задачей. В целом, в исследовании Global Burden of Disease Study 2010 было определено 4,68 миллиона лет жизни с поправкой на инвалидность (DALY) для среднего отита, бремени болезни, которое почти не уступает кишечным гельминтозам [7]. Правое ухо: субтотальная перфорация, эрозия наковальни и хроническое воспаление слизистой оболочки среднего уха со слизистым дренажом.Изображение любезно предоставлено доктором Джеффри Т. Врабек. Осложняющие факторы CSOM включают затрудненный обзор барабанной перепонки из-за отореи и ненадежный анамнез пациента относительно частоты и продолжительности эпизодов среднего отита [2]. Эти клинические препятствия, наряду с высокой распространенностью в развивающихся странах, побудили ВОЗ включить CSOM в расширенный список забытых состояний, помимо группы из 17 забытых тропических болезней (NTD) [8].Однако есть много дополнительных осложнений и последствий. Экстракраниальные осложнения, такие как абсцесс сосцевидного отростка и паралич лицевого нерва, а также опасные для жизни внутричерепные осложнения, такие как абсцесс мозга и менингит, были связаны с CSOM [1,2,9]. Эти результаты, наряду с исследованиями, показывающими, что CSOM является ведущей причиной кондуктивной потери слуха от легкой до умеренной, предполагают, что CSOM можно рассматривать как истинную NTD [1,2]. Большинство NTD также имеют серьезные социально-экономические последствия.CSOM ничем не отличается. Неблагоприятные последствия CSOM для здоровья усугубляются его широко распространенными и значительными последствиями для развития и общества. Взаимосвязь между потерей слуха и успеваемостью у детей хорошо известна. Поскольку умеренная кондуктивная потеря слуха является одним из основных осложнений, связанных с CSOM, важно измерить интеллектуальное развитие детей, страдающих CSOM. Школьники разного социально-экономического класса в Йемене и Нигерии с CSOM и потерей слуха продемонстрировали статистически значимое снижение успеваемости, при этом результаты тестов и речевое развитие отставали от показателей у более здоровых детей [5,6,10].Основываясь на исследованиях Эрика Ханушека и Пола Петерсона из Института Гувера, которые связывают снижение академической успеваемости с заработной платой и экономическим процветанием, можно сделать вывод, что CSOM может иметь значительное экономическое влияние на развивающиеся страны мира, в которых люди живут в крайняя бедность [11]. Также важно обратить внимание на социальные недостатки, с которыми пациенты CSOM сталкиваются в дополнение к их интеллектуальному развитию. Более 70% пациентов с CSOM в Нигерии сообщают о значительном социальном затруднении, вызванном периодическими выделениями из ушей и потерей слуха [1].Однако интересно отметить, что оторея часто считается «нормальной» частью детства в развивающихся странах, где высок уровень CSOM, и пациенты часто даже не упоминают об этих проблемах в своей истории [2]. Исследования показали, что более 50% родителей детей со средним отитом в развивающихся странах не знают об этом заболевании [12]. Это непонимание, к сожалению, является одной из причин, по которым CSOM по-прежнему игнорируется и недооценивается.Поэтому повышение осведомленности и просвещение общественности имеет решающее значение, как и в случае с такими заболеваниями, как туберкулез, малярия и другие NTD. Более того, хотя не было исследований, изучающих депрессию как осложнение CSOM, уже было установлено, что существует сильная связь между нарушением слуха и депрессией у взрослых [13]. Признание ВОЗ высокой распространенности CSOM в бедных странах и изнурительных проблем, которые это заболевание представляет для детей, живущих в бедности, является важным первым шагом в повышении его значения как глобальной угрозы здоровью.Среди мер, необходимых для предотвращения CSOM и его осложнений, есть четырехэтапная инициатива, известная как HEAR — гигиена уха, раннее лечение AOM, антибиотики и повышение осведомленности [8]. Гигиена является особенно сложной задачей из-за низкого уровня жизни в некоторых развивающихся странах. В результате часто встречаются дети со стойкой ринореей и рецидивирующими инфекциями верхних дыхательных путей (URI). Многие исследования продемонстрировали причинно-следственную связь между рецидивирующими URI и средним отитом [14,15,16,17].Таким образом, определение причин URI и стойкой ринореи (например, увеличение аденоидов, аллергия и синусит) может сыграть важную роль в профилактике среднего отита и, в конечном итоге, CSOM. К концу 2009 г. ВОЗ провела систематический анализ влияния укороченных (≤3 дней) курсов антибиотиков (включая азитромицин) на лечение острого среднего отита и в качестве одной из форм профилактической химиотерапии CSOM [18]. Также было показано, что амоксициллин снижает количество перфораций барабанной перепонки и замедляет прогрессирование среднего отита с выпотом у младенцев-аборигенов, что указывает на возможную защитную меру против CSOM [19].Однако стоимость производства и доставки этих антибиотиков в развивающиеся страны все еще может быть проблемой [20]. Давнее заболевание может привести к хронической перфорации барабанной перепонки и образованию холестеатомы. Лечение этих осложнений в слаборазвитых странах сопряжено с различными проблемами, поэтому методы, используемые в США, не обязательно применимы. Препятствия для лечения анатомических последствий среднего отита включают обучение врачей, приобретение специализированных инструментов, включая операционные микроскопы, а также соответствующее больничное оборудование и вспомогательные службы.Факторами, влияющими на пациента, являются близость к лечебному учреждению и легкость транспортировки. Даже когда эти логистические препятствия устранены, результаты хирургического лечения в медицинских миссиях остаются хуже, чем в развитых странах [21]. Причины более неблагоприятных исходов включают неадекватное последующее наблюдение или, скорее всего, высокую частоту рецидивов заболевания. Слуховые аппараты используются в развитых странах для лечения кондуктивной тугоухости. Применение этой технологии в слаборазвитых регионах вряд ли приведет к успеху, если не будет инфраструктуры для питания устройства и выполнения надлежащего обслуживания.В настоящее время настоятельно необходимо продвигать разработку доступных и высококачественных слуховых аппаратов, как, например, усилия неправительственной организации (НПО) World Wide Hearing [22]. Однако выполнение такой задачи потребует сотрудничества множества заинтересованных сторон, помимо НПО, включая филантропов, производителей и государства-члены [22]. Конечно, привлечение правительств стран с высокой распространенностью CSOM к разработке программ профилактики и управления, направленных на своевременную борьбу с этим заболеванием, также будет иметь решающее значение для снижения бремени болезней. Стоимость хирургического вмешательства, антибиотиков и слуховых аппаратов высока, а их влияние на частоту основного заболевания почти незначительно. В результате необходимо найти решение, которое может бороться с CSOM быстрым и более экономичным способом. Вакцины против бактериальных причин CSOM могут оказаться эффективным решением с результатами, аналогичными тем, которые наблюдаются при комплексном лечении гельминтозов с быстрым воздействием. Профилактика с помощью вакцинации является хорошо обоснованным объяснением сокращения хронических заболеваний уха в более развитых частях мира [2].Текущее исследование использования вакцин против CSOM в развивающихся странах в значительной степени отсутствует. В одном исследовании изучалась эффективность лечения CSOM с помощью Broncasma Berna, инактивированной бактериальной вакцины [23]. Эти пациенты (средний возраст: 57 лет) с CSOM получили подкожные инъекции вакцины и показали заметное уменьшение количества отореи с барабанными перепонками, которые почти полностью высохли в течение двух месяцев. В более позднем исследовании изучалась эффективность пневмококковой вакцинации детей аборигенов в Австралии для профилактики среднего отита [24].Хотя не было значительных изменений в распространенности или возникновении АОМ, у вакцинированных субъектов, по-видимому, наблюдалось снижение рецидивов перфорации барабанной перепонки. Исследования также показали связь между носоглоточной колонизацией Staphylococcus pneumonia e и AOM, таким образом, поиск вакцины, нацеленной на все соответствующие серотипы, может предоставить метод для остановки развития CSOM на ранней стадии [25]. Хотя эти результаты позволяют предположить, что в будущем мы сможем предоставить эффективное решение против CSOM, потребуются дополнительные тесты, прежде чем официальный пакет лечения может быть выпущен. Очевидно, что влияние CSOM на развивающиеся регионы мира, а также отсутствие в настоящее время эффективных вариантов лечения делают его сильным кандидатом на то, чтобы стать настоящим NTD. В конечном итоге глобальная борьба с CSOM потребует как стратегий лечения, так и профилактики, а также усилий по повышению осведомленности об этом заболевании и его влиянии на здоровье и экономику на развивающиеся страны. Подходы молекулярной генетики к характеристике патофизиологии заболеванияfgene-11-00313 21 апреля 2020 г. Время: 14:38 # 13 Giese et al.Геномика среднего отита эктодермальная дисплазия приводит к патологии среднего уха и носа. Гул. Мол. Genet. 25, 3564–3577. DOI: 10.1093 / hmg / ddw202 Бхутта, М. Ф. (2015). Эволюция и средний отит: обзор и модель, объясняющая высокую распространенность среди коренного населения. Гул. Биол. 87, 92–108. DOI: 10. 13110 / humanbiology.87.2.0092 Бхутта, М. Ф., Чизмен, М. Т., и Браун, С. Д. (2014). Миринготомия на модели хронического среднего отита на мышах Junbo снимает воспаление и клеточную гипоксию .Ларингоскоп 124, E377 – E383. DOI: 10.1002 / lary.24698 Bhutta, M. F., Lambie, J., Hobson, L., Goel, A., Hafrén, L., Einarsdottir, E., et al. (2017). Исследование генов-кандидатов от мыши к человеку выявило ассоциацию хронического среднего отита с локусами TGIF1 и FBXO11. Sci. Реп.7: 12496. DOI: 10.1038 / s41598-017-12784-8 Bois, E., Nassar, M., Zenaty, D., Léger, J., Van Den Abbeele, T., and Teissier, N. ( 2018). Отологические нарушения при синдроме Тернера.Евро. Аня. Оториноларингол. Голова шеи Dis. 135, 21–24. DOI: 10.1016 / j.anorl.2017.08.006 Carpinelli, M. R., Kruse, E. A., Arhatari, B. D., Debrincat, M. A., Ogier, J. M., Bories, J. C., et al. (2015). Мыши, гаплоиндуцирующие по Ets1 и Fli1, демонстрируют аномалии среднего уха и модельные аспекты синдрома Якобсена. Являюсь. J. Pathol. 185, 1867–1876. DOI: 10.1016 / j.ajpath.2015.03.026 Кассельбрант, М. Л., Мандель, Э. М., Фолл, П. А., Rockette, H.E., Kurs-Lasky, M., Bluestone, C.D., et al. (1999). Наследственность отита: двойное и тройное исследование . JAMA 282, 2125–2130. Чизмен, М. Т., Тайрер, Х. Э., Уильямс, Д., Хаф, Т. А., Патак, П., Ромеро, ,М. Р. и др. (2011). Пути HIF-VEGF имеют решающее значение для хронического среднего отита у мутантов мышей Junbo и Je. PLoS Genet. 7: e1002336. DOI: 10,1371 / журнал. pgen.1002336 Chen, J., Ingham, N., Clare, S., Raisen, C., Vancollie, V.E., Ismail, O., et al. (2013). Mcph2-дефицитные мыши обнаруживают роль MCPh2 в среднем отите. PLoS One 8: e58156. DOI: 10.1371 / journal.pone.0058156 Clements, D. A. (1968). Средний отит и потеря слуха в небольшом сообществе аборигенов . Med. J. Aust. 1, 665–667. doi: 10.5694 / j.1326-5377.1968.tb28789.x Crompton, M., Purnell, T., Tyrer, H.E., Parker, A., Ball, G., Hardisty-Hughes, R.E. и др.(2017). Мутация в нишарине вызывает средний отит через LIMK1 и пути NF-kappaB. PLoS Genet. 13: e1006969. DOI: 10.1371 / journal.pgen. 1006969 Дел-Посо, Дж., Макинтайр, Н., Азар, А., Гловер, Дж., Милн, Э., и Чизмен, М. (2019). Хронический средний отит инициируется дефектом кавитации булл у мыши FBXO11 * .Dis. Модель Mech. 12, DOI: 10.1242 / dmm.038315 Depreux, F. F., Darrow, K., Conner, D. A., Eavey, R. D., Liberman, M. C., Seidman, ,C. E., et al. (2008). Eya4-дефицитные мыши являются моделью наследственного среднего отита. J. Clin. Вкладывать деньги. 118, 651–658. DOI: 10.1172 / JCI32899 Domino, S. E., Zhang, L., and Lowe, J. B. (2001b). Молекулярное клонирование, геномное картирование и экспрессия двух генов секреторной группы крови альфа (1,2) фукозилтрансфераз, дифференцированно регулируемых в эпителии матки мыши и желудочно-кишечном тракте. J. Biol. Chem. 276, 23748–23756. doi: 10.1074 / jbc.m100735200 Domino, S. E., Zhang, L., Gillespie, P. J., Saunders, T. L., and Lowe, J. B. (2001a). Дефицит альфа (1,2) фукозилированных гликанов репродуктивного тракта и нормальная фертильность у мышей с целевыми делециями локуса альфа (1,2) фукозилтрансферазы FUT1 или FUT2 . Мол. Cell Biol. 21, 8336–8345. DOI: 10.1128 / mcb.21.24.8336-8345.2001 Эйнарсдоттир, Э., Хафрен, Л., Лейнонен, Э., Бхутта, М.F., Kentala, E., Kere, J., et al. (2016). Полногеномный ассоциативный анализ выявляет варианты на хромосоме 19 , которые способствуют детскому риску хронического среднего отита с элюцией. Sci. Реп. 6: 33240. DOI: 10.1038 / srep33240 Emonts, M., Veenhoven, R.H., Wiertsema, S.P., Houwing-Duistermaat, J.J., Walraven, V., de Groot, R., et al. (2007). Генетический полиморфизм в генах иммунного ответа TNFA, IL6, IL10 и TLR4 связаны с рецидивирующими острыми средними отитами.Педиатрия 120, 814–823. DOI: 10.1542 / peds.2007- 0524 Эрикссон, П. О., Ли, Дж., Нью-Йорк, Т. и Хеллстрём, С. (2006). Спонтанное развитие отита у мышей с дефицитом плазминогена. Int. J. Med. Microbiol. 296, 501–509. DOI: 10.1016 / j.ijmm.2006.04.002 Эвальд, Д. Р., Самнер, С. К. Дж. (2018). Микробиота человека, антигены групп крови, и болезни. Wiley Interdiscip. Rev. Syst. Biol.Med. 10: e1413. DOI: 10.1002 / WSBM. 1413 Пожарный, П.(1997). Средний отит и дисфункция евстахиевой трубы: связь с аллергическим ринитом. J. Allergy Clin. Иммунол. 99, S787 – S797. Galliano, M. F., Toulza, E., Gallinaro, H., Jonca, N., Ishida-Yamamoto, A., Serre, ,G., et al. (2006). Новый ингибитор протеазы семейства альфа2-макроглобулинов , экспрессируемый в эпидермисе человека. J. Biol. Chem. 281, 5780–5789. doi: 10.1074 / jbc.m508017200 Гаврон, В., Викьера, Б., Ростковска-Надольска, Б., Orendorz-Fra¸czkowska, K., и Noczy´ nska, A. (2008). Оценка органа слуха у пациентов с синдромом Тернера . Int. J. Pediatr. Оториноларингол. 72, 575–579. DOI: 10.1016 / j.ijporl. 2008.01.021 Джентиле, Д. А., Дойл, В. Дж., Зееви, А., Хоу-Адамс, Дж., Кападиа, С., Треки, Дж., и др. (2003). Полиморфизм генов цитокинов умеренной степени тяжести у младенцев с респираторно-синцитиальной вирусной инфекцией. Гул.Иммунол. 64, 338–344. DOI: 10.1016 / s0198-8859 (02) 00827-3 Гесснер, Б. Д., Гиллингем, М. Б., Вуд, Т., и Келлер, Д. М. (2013). Ассоциация генетического варианта карнитин пальмитоилтрансферазы 1A с инфекциями у детей коренных жителей Аляски. J. Pediatr. 163, 1716–1721. DOI: 10.1016 / j.jpeds.2013.07. 010 Гибинк, Г. С., и Канафакс, Д. М. (1991). Антимикробное лечение среднего отита. Семин. Респир. Заразить.6, 85–93. Hafren, L., Einarsdottir, E., Kentala, E., Hammarén-Malmi, S., Bhutta, M. F., MacArthur, C.J., et al. (2015). Предрасположенность к детскому среднему отиту и генетических полиморфизмов в локусе toll-подобного рецептора 4 (TLR4). PLoS One 10: e0132551. DOI: 10.1371 / journal.pone.0132551 Han, F., Yu, H., Li, P., Zhang, J., Tian, C., Li, H., et al. (2012). Мутация в гене Phex предрасполагает мышей BALB / c-Phex (Hyp-Duk) / Y к среднему отиту.PLoS One 7: e43010. DOI: 10.1371 / journal.pone.0043010 Hardisty, R.E., Erven, A., Logan, K., Morse, S., Guionaud, S., Sancho-Oliver, S., et al. (2003). Мутантная глухая мышь Je (Jf) представляет собой модель единственного гена отита media. J. Assoc. Res. Отоларингол. 4, 130–138. DOI: 10.1007 / s10162-002-3015-9 Hardisty-Hughes, R. E., Tateossian, H., Morse, S. A., Romero, M. R., Middleton, A., Tymowska-Lalanne, Z., et al. (2006). Мутация в гене F-бокса, Fbxo11, , вызывает средний отит у мышей Je.Гул. Мол. Genet. 15, 3273–3279. DOI: 10.1093 / hmg / ddl403 Эрнандес, М., Лейхтл, А., Пак, К., Эбмейер, Дж., Этенойер, С., Обоньо, М. и др. (2008). Ген 88 первичного ответа миелоидной дифференцировки необходим для разрешения среднего отита. J. Infect. Дис. 198, 1862–1869. DOI: 10.1086 / 5 Илия, С., Гулиелмос, Г. Н., Самонис, Г., и Галанакис, Э. (2014). Полиморфизм генов IL-6, IL-10, TNF-альфа, IFN-гамма и TGF-beta1 и предрасположенность к острому среднему отиту в раннем детстве.Педиатр. Заразить. Дис. J. 33, 518–521. DOI: 10.1097 / INF.0000000000000229 Йоки-Эрккила В. П., Пухакка Х. и Хурме М. (2002). Полиморфизм гена цитокина при рецидивирующем остром среднем отите. Arch. Отоларингол. Голова Шея Surg. 128, 17–20. Кальм, О., Джонсон, У., и Прелльнер, К. (1994). Частота HLA у пациентов с хроническим секреторным средним отитом. Int. J. Pediatr. Оториноларингол. 30, 151–157. doi: 10.1016 / 0165-5876 (94) -8 Kalm, O., Джонсон, У., Преллнер, К., и Нинн, К. (1991). Частота HLA у пациентов с рецидивирующим острым средним отитом. Arch. Отоларингол. Head Neck Surg. 117, 1296–1299. DOI: 10.1001 / archotol.1991.01870230112019 Kerschner, J. E., Hong, W., Taylor, S. R., Kerschner, J. A., Khampang, P., Wrege, K. C., et al. (2013). Новая модель спонтанного среднего отита с эффектом (OME) у мышей с нокаутом Oxgr1. Int. J. Pediatr. Оториноларингол. 77, 79–84.DOI: 10.1016 / j.ijporl.2012.09.037 Клебанов Н. (2018). Генетическая предрасположенность к инфекционным заболеваниям. Cureus 10: e3210. doi: 10.7759 / cureus.3210 Larson, E. D., Magno, J. P. M., Steritz, M. J., Llanes, E. G. D. V., Cardwell, J., Pedro, M., et al. (2019). A2ML1 и средний отит: новые варианты, дифференциальная экспрессия, и соответствующие пути. Гул. Мутат. 40, 1156–1171. DOI: 10.1002 / humu.23769 Лич, А. Дж., Виггер, К., Бейсбарт, Дж., Woltring, D., Andrews, R., Chatfield, M. D., et al. (2016). Общее состояние здоровья, средний отит, носоглоточное носительство и среднее Микробиология уха в Северной территории Дети-аборигены, вакцинированные в течение последовательных периодов 10-валентных или 13-валентных пневмококковых конъюгированных вакцин. Внутр. J. Pediatr. Оториноларингол. 86, 224–232. DOI: 10.1016 / j.ijporl.2016.05.011 Ли, Х. Ю., Такешита, Т., Шимада, Дж., Акопян, А., Ву, Дж. И., Пан, Х., и другие. (2008). Для индукции бета-дефенсина 2 с помощью NTHi требуется TLR2-опосредованный сигнальный путь MyD88 и IRAK-TRAF6-p38MAPK в эпителиальных клетках среднего уха человека . BMC Infect. Дис. 8:87. DOI: 10.1186 / 1471-2334-8-87 Ли, Ю. К., Ким, К., Шим, Дж. С., Бьюн, Д. Ю., Парк, М. С., Ча, К. И. и др. (2008). Toll-подобных рецепторов 2 и 4 и их мутации у пациентов со средним отитом и Границы в генетике | www.frontiersin.org 13 апреля 2020 г. | Том 11 | Статья 313 Рандомизированное контролируемое исследование влияния вентиляционных трубок (люверсов) на качество жизни в возрасте 1-2 летОтит с выпотом, распространенный в детском возрасте, обычно связан с потерей слуха от легкой до умеренной. За последние три десятилетия было проведено множество исследований влияния ОМЕ на развитие детей1. Некоторые исследования показали нарушения в развитии, но другие не смогли показать такой связи.1-3 Это может быть результатом ограничений в дизайне, методологии или отдельных исследуемых популяциях. Было опубликовано лишь несколько адекватно спланированных проспективных исследований о влиянии ОМЕ на развитие1. Использование вентиляционных трубок (люверсов) снижает нарушение слуха у детей с OME4-6 и, следовательно, может предотвратить проблемы с развитием. Большинство исследований, посвященных влиянию вентиляционных трубок, касались развития речи, языкового развития, когнитивного развития или поведения, которые измерялись с помощью стандартных тестов.Напротив, качество жизни (КЖ), сфокусированное на субъективном восприятии родителями состояния здоровья своих детей, в основном игнорировалось, в то время как теоретически можно было предположить, что нарушение развития будет связано с общим состоянием здоровья. QoL в широком смысле включает аспекты физического, психологического и социального функционирования. Отсутствие четкого определения отражено во многих инструментах, которые были предложены для измерения качества жизни, каждый из которых основан на различных концепциях качества жизни.7 Инструменты качества жизни ориентированы либо на измерение общего состояния здоровья, либо на благополучие по конкретным заболеваниям. Конкретное благополучие может быть более чувствительным к влиянию болезни, в то время как общие тесты больше подходят для сравнения с другими заболеваниями8. Клиницисты, работающие с ОМЕ, часто сталкиваются со спонтанными комментариями родителей после того, как их ребенку вставили вентиляционные трубки. Они записывают такие события, как улучшение режима сна, повышение осведомленности, а также появление менее раздражительного и гораздо более счастливого ребенка.9 В исследовании Розенфельда и Бхая 10 родителей сообщили о меньшем количестве физических симптомов и меньшем эмоциональном стрессе у своих детей. Однако ограничением этих исследований является отсутствие контрольной группы для сравнения. Другая проблема заключается в том, что были включены только дети от 3 лет и старше. В настоящее время ОМЕ выявляют в более раннем возрасте, и вентиляционные трубки вводятся в более молодом возрасте.11 Более того, симптомы и скорость развития у младенцев и детей дошкольного возраста различны; это также может по-разному влиять на качество жизни. Таким образом, мы исследовали влияние лечения вентиляционными трубками на качество жизни младенцев (в возрасте 1-2 лет) со стойким двусторонним ОМЭ. Мы провели многоцентровое рандомизированное контролируемое исследование, в котором сравнивали лечение вентиляционными трубками с периодом бдительного ожидания. Пациенты и методыПАЦИЕНТОВКогорта из 30 099 детей, родившихся в восточной части Нидерландов в период с 1 января 1996 г. по 1 апреля 1997 г., была приглашена на плановую проверку слуха в возрасте 9 месяцев.Для целей исследования те, кто не прошел три последовательных теста, были направлены в одну из 13 участвующих поликлиник уха, носа и горла (ЛОР) для диагностики и последующего наблюдения (n = 1081). Родители младенцев, у которых во время последующих наблюдений хирург-ЛОР поставил диагноз стойкого (от четырех до шести месяцев) двустороннего ОМЕ (подтвержденного тимпанометрией и отоскопией) (n = 386), для участия в нашем рандомизированном контролируемом исследовании. Дети, для которых было получено информированное согласие, были случайным образом распределены в одну из двух групп: лечение с помощью вентиляционных трубок (группа VT; n = 93) или период бдительного ожидания (группа WW; n = 94).Качество жизни измерялось на исходном уровне, а также через шесть и 12 месяцев наблюдения с помощью анкет и оценок стандартных видеозаписей. Мы получили одобрение всех этических комитетов 13 участвующих больниц. МЕТОДЫБыла использована программа сбалансированного распределения для повышения сопоставимости на исходном уровне12, при этом 187 детей были сбалансированы по пяти прогностическим факторам: полу, возрасту, сезону при рандомизации, образовательному уровню матери и больнице. Для измерения качества жизни мы использовали опросник TAIQOL (TNO-AZL Infant Quality of Life).13 Поскольку взаимодействие родителей и детей можно рассматривать как часть качества жизни, зависящую от предметной области, мы также измерили это взаимодействие с помощью шкал Эриксона14. Опросник TAIQOL был разработан для детей в возрасте 1–4 лет и заполняется по одному. родитель. Анкета содержит 46 вопросов, охватывающих 13 областей (легкие, желудок, кожа, сон, аппетит, проблемы с питанием, агрессивное поведение, положительные эмоции, эмоции паники, жизнеспособность, социальное поведение, двигательные проблемы и общение). Мы не ожидали, что три из 13 доменов (легкие, желудок, кожа) будут связаны с OME, поэтому исключили их из анализа после того, как результаты в этих доменах не изменились с течением времени.Кроме того, мы исключили область положительных эмоций, поскольку эта шкала не показала никаких изменений. В 19 из 46 пунктов мы оценили только возникновение конкретных жалоб, в то время как остальные 27 пунктов представляют собой комбинацию возникновения конкретных жалоб и эмоциональной реакции родителей на жалобу. В ходе анализа мы разделили два набора предметов; эмоциональная реакция изучалась только тогда, когда было обнаружено различие в возникновении. Возникновение было почти для всех доменов, оцененных по 12-балльной шкале (чем выше оценка, тем больше жалоб).Две области (двигательные проблемы и агрессивное поведение) не оценивались по 12-балльной шкале, но были скорректированы по другим шкалам. Взаимодействие родителей и детей измерялось с помощью шкал Эриксона. Каждую пару родитель-ребенок снимали на видео в структурированной игровой обстановке в течение 13 минут в палате больницы. В комнате были размещены три игрушки, представляющие интеллектуальную, физическую и социальную сферы развития. Через 0, 6 и 12 месяцев использовались разные игрушки: набор А состоял из пазла из пяти частей, набора «Ферма Бо-пип» и трех разных книг; набор B состоял из пазла из 14 деталей, игры «кормить животное» и трех разных книг; набор C состоял из пазла из 14 частей, игры-сюрприз с машинкой и трех разных книг.Родителям сказали, что следователя интересовало, как родители и ребенок играют вместе. Родителей попросили начать играть в головоломку (в течение трех минут), затем в игру (в течение пяти минут) и книги (в течение пяти минут). Затем следователь вышел из комнаты и через три, пять и пять минут постучал в дверь, чтобы сообщить родителям, когда менять игрушки. Из записей пять детских шкал (негативизм, уступчивость, привязанность к матери, избегание матери и опора на мать) и пять родительских шкал (поддерживающее присутствие, уважение автономии, структуры и ограничений, качества обучения и враждебности) оценивались по семибалльной шкале (от 1 = низкое взаимодействие до 7 = высокое взаимодействие).14 Видеозаписи оценивали два ассистента психолога. Надежность оценки между наблюдателями была высокой ( r > 0,8). OME был определен в соответствии с протоколом MOMES 15, который в основном основан на тимпанометрии. Если тимпанометрия не могла быть выполнена или тимпанограммы были сомнительными (тип C2), для постановки диагноза использовалась отоскопия. Слух оценивали с помощью портативного набора для аудиометрии с визуальным подкреплением. Это оказалось хорошей альтернативой стандартной аудиометрии визуального подкрепления в многоцентровых исследованиях.Более подробное описание дано в другом месте16. Расчетная мощность для этого испытания в первую очередь основывалась на результатах по языковому развитию (которые описаны в другом месте17). Однако при пересчете мощности в этом исследовании с участием 187 рандомизированных детей мы смогли бы выделить разницу 0,5 (по 12-балльной шкале) в улучшении TAIQOL между двумя группами. СТАТИСТИЧЕСКИЙ АНАЛИЗВсе анализы были выполнены в соответствии с принципом намерения лечить.Различия в домене через 0, 6 и 12 месяцев наблюдения между группами были проверены с помощью теста Вилкоксона, поскольку оценки не были нормально распределены. Чтобы скорректировать возможные исходные различия, мы также изучили различия в баллах между шестимесячным периодом наблюдения и исходным уровнем, а также различия между 12-месячным периодом наблюдения и исходным уровнем. Чтобы внести поправку на потенциальные искажающие факторы и изучить возможные модификаторы эффекта, мы построили логистические модели с дихотомическими оценками, основанными на улучшении (дети, у которых улучшилось по сравнению с другими) через шесть месяцев и через 12 месяцев наблюдения в качестве зависимой переменной. Возможными искажающими факторами были: уровень образования матери (высокий / средний / низкий), старшие братья и сестры (да / нет), посещение дневного стационара (да / нет), пол (женский / мужской) и аденоидэктомия до рандомизации (да / нет ). Эти переменные также были включены в качестве модификаторов потенциального эффекта. Кроме того, уровень слуха при рандомизации (дБ) был проверен на взаимодействие с лечением. Изучая эти возможные взаимодействия, мы попытались выделить подгруппы детей, которым лечение с помощью вентиляционных трубок может принести больше пользы. Многофакторный дисперсионный анализ (MANOVA) был проведен для обнаружения эффекта лечения для всех доменов вместе взятых; для этого анализа мы смоделировали показатели улучшения через шесть и 12 месяцев наблюдения. РезультатыВсего было рандомизировано 187 детей: 93 в группу VT и 94 в группу WW. Девятнадцать детей выбыли сразу после рандомизации (15 из группы WW и четыре из группы VT). Эти дети были исключены из исследования и поэтому не были включены в 187 рандомизированных детей.Еще 11 детей выбыли в оставшееся время наблюдения (восемь детей из группы WW и трое из группы VT). Кроме того, 10 детей из группы WW в течение испытательного периода получали лечение с помощью вентиляционных трубок. Средний возраст детей при рандомизации составлял 19,5 месяцев в группе VT и 19,4 месяца в группе WW. Средняя потеря слуха (измеренная на частотах 500, 1000, 2000 и 4000 Гц) в лучшем ухе при рандомизации составила 46,4 дБ (95% доверительный интервал (ДИ) 44.От 2 до 48,6) в группе VT и 43,4 дБ (95% ДИ от 41,0 до 45,8) в группе WW. Через шесть месяцев наблюдения улучшение уровня слуха в группе VT составило 10,2 дБ по сравнению с 4,6 дБ в группе WW; через 12 месяцев наблюдения эти значения составили 13,1 дБ и 8,5 дБ соответственно. Через 3, 6, 9 и 12 месяцев наблюдения 14,6%, 29,3%, 26,9% и 26,6% детей в группе ЖТ были диагностированы как имеющие двусторонний ОМЭ, соответственно. В группе WW эти проценты составили 77,2%, 65.9%, 57,3% и 53,2% соответственно. ТАЙКОЛТаблица 1 показывает средние баллы TAIQOL. На Рисунке 1 показана разница в баллах между 12 и 0 месяцами наблюдения. Качество жизни улучшилось в шести поддоменах, при этом увеличилось количество жалоб на аппетит, тревогу и агрессию. За исключением тревоги, группа VT показала большее улучшение или меньшее ухудшение, чем группа WW. Однако различия не были статистически значимыми. От исходного уровня до шести месяцев и от шести до 12 месяцев наблюдения средние баллы не благоприятствовали лечению с помощью вентиляционных трубок. Таблица 1Средние баллы по девяти поддоменам TAIQOL на исходном уровне, через шесть и 12 месяцев наблюдения фигура 1Разница в баллах по поддоменам TAIQOL между 12 и 0 месяцами наблюдения. * Из-за отклонения в этой шкале (максимальный балл 16 вместо 12) мы скорректировали этот балл разницы в соответствии с другими шкалами. † Из-за отклонения этой шкалы (максимальный балл 21 вместо 12) мы скорректировали этот балл разницы в соответствии с другими шкалами. ‡ Положительная разница говорит о росте жалоб; отрицательная разница указывает на уменьшение.(Обратите внимание, что разница в баллах между 6 и 0 месяцами наблюдения показала аналогичные результаты). В логистических моделях вероятности улучшения в конкретной области через шесть или 12 месяцев мы смогли скорректировать возможные искажающие факторы и определить модификаторы эффекта. Значимого эффекта от лечения не обнаружено. В большинстве областей только оценка на исходном уровне была помехой, которую необходимо было скорректировать. MANOVA по всем объединенным доменам не выявил каких-либо различий в эффекте лечения между группой VT и группой WW через шесть или 12 месяцев наблюдения (p = 0.22 и p = 0,94 с тестом Хотеллинга – Лоули). ВЕСЫ ERICKSONВ таблицах 2 и 3 показаны средние значения шкал Эриксона. На рисунке 2 показаны различия в баллах ребенка и родителей по шкале Эриксона между 12 и 0 месяцами наблюдения. Некоторые небольшие различия были обнаружены в пользу группы WW в большинстве областей, но была небольшая разница в «уступчивости» и «враждебности» в пользу детской группы VT. Ни одно из этих различий нельзя было отличить от случайности.Однако при сравнении абсолютных средних баллов через шесть и 12 месяцев наблюдения были обнаружены небольшие, но значимые различия в пользу группы WW, особенно по родительским шкалам. Таблица 2Средние баллы по пяти поддоменам шкалы Эриксона (детская) на исходном уровне, через шесть и 12 месяцев наблюдения Таблица 3Средние баллы по пяти поддоменам шкалы Эриксона (родительская) на исходном уровне, через шесть и 12 месяцев наблюдения фигура 2Средняя разница баллов по шкалам Эриксона (детская) (А) и (родительская) (В) между 12 и 0 месяцами наблюдения.* Положительная разница указывает на улучшение взаимодействия между родителями и детьми; отрицательная разница указывает на износ. Логистические модели вероятности улучшения позволили уточнить конфаундер и поиск модификации эффекта. Мы не обнаружили различий между двумя группами. Не было обнаружено никакой связи между улучшением во всех комбинированных областях и лечением (MANOVA) через шесть или 12 месяцев наблюдения (p = 0,19 и p = 0,38 для детских шкал, по сравнению с p = 0,21 и p = 0.95 для родительских весов соответственно). МАКСИМАЛЬНАЯ КОНТРАСТНОСТЬСпонтанное разрешение OME в группе WW и рецидив OME в группе VT могли скрыть контраст между двумя группами. Чтобы проверить нашу этиологическую модель (потеря слуха, вызванная ОМЕ, ухудшает качество жизни, а функциональные вентиляционные трубки улучшают качество жизни), мы также провели объяснительный анализ, в котором сравнили детей с выпотом в течение всего периода наблюдения (n = 28). тем, у кого не было выпота во время наблюдения (n = 54).Мы не обнаружили никаких различий в 13 доменах TAIQOL, в то время как по шкалам Эриксона было различие только в одном (негативизм) из 10 доменов. Что касается негативизма, мы обнаружили большее увеличение взаимодействия родителей и детей у детей без излияний во время последующего наблюдения (эти дети проявляли меньше гнева, неприязни или враждебности по отношению к своей матери). ОбсуждениеВ отличие от более ранних исследований, 9 10 наши результаты не показали, что вентиляционные трубки улучшают качество жизни маленьких детей со стойким ОМЕ.Эти предыдущие исследования были неконтролируемыми, базировались на больницах и были сосредоточены на детях старшего возраста, тогда как наше исследование было контролируемым, основанным на популяциях, и дети были в возрасте 1-2 лет. Кроме того, мы использовали общий тест QoL, в то время как Facione9, Rosenfeld и Bhaya10 задавали конкретные вопросы OME. Хотя тесты QoL для конкретных заболеваний могут быть более чувствительными, 8 несколько областей шкал TAIQOL и Эриксона (например, режим сна, проблемы с питанием, избегание) были априори релевантными для OME. Формально шкалы Эриксона не измеряют качество жизни, но взаимодействие родителей и детей можно рассматривать как специфическую часть качества жизни.Шкалы Эриксона хорошо проверены и более объективны, чем самозаполненные анкеты, и поэтому подходят в качестве дополнительного теста. Нормы численности населения для TAIQOL отсутствуют. Следовательно, средние баллы нельзя сравнивать с эквивалентными баллами детей без постоянного ОМЕ. Некоторые сравнения возможны со шкалами Эриксона. В нашем исследовании показатели взаимодействия между родителями и детьми у детей с постоянным ОМЕ были немного хуже, чем у детей, не страдающих заболеваниями, по данным Дрентен и Риксен-Вальравен18. Возможно, что OME не оказывает большого влияния на QoL; мы не обнаружили существенных различий между детьми с выпотом в течение всего периода наблюдения и детьми, у которых в этот период не было выпота. Кроме того, учитывая частые сообщения родителей о благоприятных послеоперационных изменениях 9, ожидался эффект плацебо: родители часто не хотят признавать, что после операции ничего не изменилось. Однако наши результаты не показали такого эффекта плацебо, что усиливает вывод об отсутствии разницы в QoL между группами VT и WW. Незначительные, но значимые различия в абсолютных средних значениях были обнаружены по родительским шкалам Эриксона в пользу группы WW. Это различие во взаимодействии родителей и детей может быть объяснено тем фактом, что родители будут пытаться скорректировать свое поведение: когда родители знают о возможных проблемах со слухом, языком или поведением в результате OME, они будут пытаться компенсировать это лучшим Взаимодействие между родителями и детьми — например, будьте более благосклонны и / или постарайтесь придать больше структуры. Несмотря на сбалансированную процедуру рандомизации, различия в оценках TAIQOL и Эриксона были обнаружены между группой VT и группой WW на исходном уровне. Эти различия можно частично объяснить тем фактом, что 19 родителей, давших осознанное согласие, забрали своего ребенка сразу же после того, как услышали результат процедуры рандомизации; 15 детей были рандомизированы в группу VT и четыре — в группу WW. Данные аудиометрии показали, что средний уровень слуха у четырех детей, которые были рандомизированы в группу WW, был хуже, чем у остальных детей WW.Чтобы сравнить эффект вентиляционных трубок с эффектом бдительного ожидания, нам пришлось использовать баллы разницы или скорректировать эти различия на исходном уровне в наших анализах. Некоторая предвзятость могла возникнуть из-за того, что 10 детей из группы WW получили вентиляционные трубки в течение периода исследования. Эти дети были старше, и девочек было больше по сравнению с оставшимися детьми WW. Анализы чувствительности, в которых эти дети были исключены или проанализированы как получавшие лечение, не изменили результат этого исследования. Еще 11 детей выбыли из исследования (восемь из группы WW и трое из группы VT). Их прогностические факторы были аналогичны таковым у детей, завершивших испытание. Следовательно, от этих выпадений не ожидается никакой предвзятости. Другой возможностью смещения может быть разница в факторах риска между рандомизированными и подходящими, но не рандомизированными детьми. Мы изучили сопоставимость измеренных факторов риска и не обнаружили больших различий.Таким образом, результаты, по-видимому, могут быть обобщены на популяцию предметной области, включенную в данное исследование (все они представляют собой детей грудного возраста, выявленных на скрининге, с постоянным двусторонним ОМЕ). Обобщение на популяции за пределами этой области (дети старшего возраста) не может быть оправдано на основании результатов этого исследования. В заключение, вентиляционные трубки не оказали существенного дополнительного влияния на качество жизни младенцев с постоянным ОМЕ. Однако возможно, что лечение с помощью вентиляционных трубок принесет пользу подгруппам детей.Мы попытались выделить такие подгруппы в этом исследовании, но не обнаружили существенных различий. Мощность изучения таких подгрупп была низкой, поэтому нельзя исключать ошибки типа II. Необходимы дальнейшие исследования для изучения возможных подгрупп, а также для изучения конкретных вопросников OME, которые могут сигнализировать о небольших, но значимых эффектах. БлагодарностиМы благодарим родителей и детей, принявших участие в этом исследовании, хирургов ЛОР, которые обеспечили медицинское обслуживание, Йоста Энгеля за его ценные предложения относительно этой статьи и Соню ван Остерхаут за управление исследованием и ввод данных.Этот проект финансировался Голландским фондом следственной медицины Национального совета по страхованию здоровья. ЛОР-хирургами были: J van Leeuwen, Госпиталь Rijnstate, Арнем; G Pluimers, H Vencker, J Mol и A. Frima-van Aarem, больница Eemland, Амерсфорт; Дж. Энгель и С. Дж. Де Фрис, больница Канисиус Вильгельмина, Неймеген; К. Ингельс, Университетская больница Санкт-Радбауд, Неймеген; М. Нийс, П. Герритсма и П. ван ден Вен, больница Слингеланд, Дутинхем; SJ Rietema, больница Gelderse Valei, Эде; Э. Теуниссен и Дж. Ван де Меераккер, больница Каролус Лидуина, Хертогенбос; Э. Квадейк и А де Вишер, GZG, Хертогенбос; H Cats, больница Виллем-Александр, Хертогенбос; Т. Брюггинк и С. Хофстад, Госпиталь Ривьерланд, Тиль; Г. Петерс и Д. Эльпрана, Сен-Мартенсгастуис, Венло; Дж. Альварадо-ван Ос, больница Беатрикс, Винтерсвейк; и F Mud, Ch Sepmeijer, больница Het Nieuwe Spittaal, Зютфен.
Потеря слуха у взрослых, переживших пневмококковый менингит, связана с отитом и пневмококковым серотипомAbstractМы оценили частоту потери слуха и ее связь с клиническими характеристиками и серотипами пневмококка у взрослых, перенесших пневмококковый менингит. Мы проанализировали потерю слуха у 531 взрослого, пережившего пневмококковый менингит, включенного в два проспективных общенациональных когортных исследования, проведенных с апреля 1998 г. по октябрь 2002 г. и с марта 2006 г. по январь 2009 г. |

 Вовремя поставленный диагноз и необходимая терапия помогут избежать многих осложнений.
Вовремя поставленный диагноз и необходимая терапия помогут избежать многих осложнений. Такое состояние очень сложно купировать, поэтому пациент может страдать от слабости и нарушений с вестибулярным аппаратом весьма продолжительное время.
Такое состояние очень сложно купировать, поэтому пациент может страдать от слабости и нарушений с вестибулярным аппаратом весьма продолжительное время. media meningococcica) острый катаральный О. с., иногда с образованием очагов некроза слизистой оболочки стенок барабанной полости; возникает как осложнение менингококковой инфекции, гл. обр. в первые дни болезни … Большой медицинский словарь
media meningococcica) острый катаральный О. с., иногда с образованием очагов некроза слизистой оболочки стенок барабанной полости; возникает как осложнение менингококковой инфекции, гл. обр. в первые дни болезни … Большой медицинский словарь Первые три относятся к РНК вирусным заболеваниям; ветряную оспу и инфекционный мононуклеоз вызывают ДНК… … Википедия
Первые три относятся к РНК вирусным заболеваниям; ветряную оспу и инфекционный мононуклеоз вызывают ДНК… … Википедия