Инфильтративный рак легкого — Онкология и рак
Инфильтрация лёгочной ткани – это уплотнение в лёгких, которое вызвано скоплением в тканях жидкости, клеток или некоторых химических веществ. При этом размер ткани увеличивается и приобретает иной оттенок. В больном лёгком появляется болезненность, плотность лёгочной ткани увеличивается. Инфильтрат опухолевого характера состоит из раковых клеток, главным признаком онкологического заболевания станет инфильтрат. При инфильтрации химического характера уплотнение образуется из-за насыщения тканей лекарственными препаратами или медицинским спиртом.
Причины патологии
Инфильтративные изменения в лёгких – это патологическое состояние, которое может развиться в любом возрасте. Основными причинами заболевания становятся:
- болезнетворные микроорганизмы;
- травмы лёгких;
- сильное переохлаждение;
- оперативное вмешательство;
- гнойный аппендицит;
- неправильно выполненные инъекции лекарственных препаратов.

Возбудители заболевания – это микроорганизмы, которые есть у каждого человека в ротовой полости. Инфекция может проникнуть в лёгкие контактным путём и лимфогенным. В последнем случае причиной болезни может стать любая инфекция, которая есть в организме.
Более предрасположены к образованию инфильтратов пожилые люди и любители покурить.
Симптомы
Инфильтрат в лёгких – это воспалительный процесс, который протекает с уплотнением лёгочной ткани. Этот патологический процесс развивается на протяжении нескольких суток. Заболевание проявляется специфическими симптомами:
- Температура тела слегка повышена, но такое состояние продолжается долгое время.
- В некоторых случая в зоне инфильтрата обнаруживается опухоль небольшого размера.
- Появляется боль в области поражённого лёгкого.
- По сравнению с пневмонией инфильтрация лёгких протекает с менее выраженными симптомами и более гладко.

- Основным признаком заболевания становится выделение крови при кашле, хотя кашель возникает очень редко. Наличие крови в мокроте говорит о том, что инфильтрат начал разлагаться.
- При этом заболевании у больного кожные покровы сильно бледные. Такой признак чаще всего говорит о туберкулёзе инфильтративного характера.
Эозинофильные инфильтраты чаще всего возникают в верхних долях лёгких. Определить сразу, есть ли жидкость в уплотнении невозможно, для этого нужно провести ряд обследований.
Инфильтрации чаще всего появляются при туберкулёзе и воспалении лёгких.
Разновидности инфильтраций
Есть несколько типов инфильтративных изменений в лёгких, каждый из них отличается своими особенностями течения и лечения:
- Воспалительная форма. В таком случае уплотнение состоит из разных клеток – лейкоцитов, эритроцитов, лимфоидных клеточек и других. При лечении подобные инфильтраты рассасываются или расплавляются, хотя могут подвергнуться и склерозированию, с дальнейшим образованием соединительной ткани.

- Опухолевая форма. Это уплотнение состоит из раковых клеток разного характера. Такое явление бывает при злокачественных опухолях, при этом инфильтрат быстро увеличивается в размерах.
- Химическая форма. Такое состояние характерно после проведения операций на лёгких. Уплотнение возникает вследствие введения в ткани лекарственных препаратов.
При инфильтрации лёгочной ткани часть лёгких выключается из дыхательного процесса. Если ткани уплотнены на большом участке лёгкого, то это создаёт большую угрозу для жизни человека.
При осмотре больного врач может отметить учащённое дыхание и небольшое отставание в дыхательном процессе той части грудины, где расположен очаг поражения тканей.
Диагностика
Диагностируют заболевание на основании данных рентгенографии. На снимке уплотнение выглядит в виде затемнённого участка, размером больше 1 см. При долевой инфильтрации на снимке можно увидеть большой участок поражённой ткани. Контуры затемнений зависят от формы заболевания, а также от расположения уплотнения.
Контуры затемнений зависят от формы заболевания, а также от расположения уплотнения.
При воспалительной форме инфильтрации на снимке можно увидеть неровные очертания и совсем неправильную форму тёмной части. Подобный инфильтрат в лёгких бывает при пневмонии. В острой фазе болезни контуры очертания не резкие и постепенно переходят в ткани, что окружат лёгкие.
При хронической форме болезни края инфильтрата зазубрены, но просматриваются намного чётче. При пневмонической форме инфильтрации на снимке часто обнаруживаются две светлые полосы, это видны бронхи, наполненные воздухом.
Если заболевание вызвано патогенными микроорганизмами, то часто наблюдается некроз тканей разной степени тяжести. Это отягощает течение болезни.
Главная задача при диагностировании болезни – это определение характера инфильтрации у пациента. Долевые воспаления чаще всего наблюдаются при туберкулёзе или пневмонии. Если характер уплотнения опухолевый, то вся доля не захватывается воспалительным процессом.
Когда у больного по снимку видно уплотнение не долевого характера, то это состояние дифференцируют со злокачественной опухолью. При этом начальная стадия болезни проходит совершенно бессимптомно, и у человека совершенно нет никаких жалоб.
На рентгеновском снимке инфильтрат воспалительной природы отличается от злокачественной опухоли. Уплотнения воспалительного характера всегда неправильной формы, в то время как онкологические заболевания всегда проявляются стандартными очертаниями. Если воспаление перешло на наружный слой клетчатки бронха, то диагностируется перибронхиальная инфильтрация легких.
Кроме рентгена, при диагностике применяют бронхоскопию. Этот метод позволяет выявить изменения в дыхательных органах и исключить некоторые болезни.
При каких патологиях могут быть инфильтраты в лёгких
Инфильтраты в лёгких разного характера могут возникать при ряде заболеваний как воспалительного, так и инфекционного характера:
- Воспаление лёгких.
 В этом случае воспаляются лёгочные ткани, при этом в патологический процесс вовлечены различные доли лёгкого. Симптомами такой болезни являются усталость, ощущение боли в груди и разные признаки дыхательной недостаточности. Высокая температура при воспалении лёгких бывает не всегда, в ряде случаев она субфебрильная или несколько понижается.
В этом случае воспаляются лёгочные ткани, при этом в патологический процесс вовлечены различные доли лёгкого. Симптомами такой болезни являются усталость, ощущение боли в груди и разные признаки дыхательной недостаточности. Высокая температура при воспалении лёгких бывает не всегда, в ряде случаев она субфебрильная или несколько понижается. - Туберкулёз. В этом случае течение болезни плавное, присутствует сильный кашель и на снимке можно увидеть очаг поражения в верхней доле лёгкого.
- Эозинофильная пневмония. Считается, что это заболевание вызывают паразиты, грибки и аллергены. При этом заболевании наблюдается сильный кашель, с выделением жёлтой мокроты, общая слабость и кожные высыпания. Температура обычно не превышает 37,5 градуса.
- Метастазы при онкологии. При этом состоянии наблюдается непродуктивный кашель и регулярное появление очагов воспаления на одном и том же участке лёгкого. На снимке можно увидеть большое количество теней округлой формы.
 Такое состояние часто наблюдается при периферическом инфильтрате левого или правого лёгкого.
Такое состояние часто наблюдается при периферическом инфильтрате левого или правого лёгкого. - Уплотнения при доброкачественных опухолях. Опухоль просматривается в форме шара, который имеет чёткие границы.
Кроме этого, инфильтраты могут быть при кисте или же гангрене лёгких. Участки уплотнения могут наблюдаться ещё некоторое время после лечения туберкулёза.
Правильно поставить диагноз сможет только опытный врач. Поэтому при любых подозрительных симптомах необходимо срочно обращаться в больницу.
Особенности лечения
Прежде чем приступать к лечению инфильтрата в лёгком, необходимо правильно организовать режим дня больного и исключить чрезмерные физические нагрузки. Врачи рекомендуют больным с такой патологией соблюдать постельный режим до полного выздоровления. На протяжении болезни больной должен питаться полезной и легкоусвояемой пищей. В продуктах должно быть достаточное количество витаминов, микроэлементов и углеводов.
При лечении обязательно назначают антибиотики разных групп. Монотерапия антибиотиками очень эффективно, но здесь необходимо соблюдать осторожность.
Нельзя одновременно принимать бактериостатические и бактерицидные препараты. В этом случае могут быть серьёзные последствия, иногда уже необратимые. При взаимодействии лекарственных препаратов этих двух групп организм подвергается сильному токсическому воздействию.
Назначают лекарственные препараты с учётом чувствительности возбудителя. Это определяется путём бакпосева мокроты или взятии образцов биоматериала при бронхоскопии. Чаще всего назначают антибиотики широкого спектра действия, многие врачи предпочитают препараты пенициллиновой группы. Больной принимает антибиотики до тех пор, пока инфильтрат полностью не рассосётся.
Антибиотики одной лекарственной группы можно принимать не более 10 дней. После этого времени, при необходимости, препараты меняют на другую лекарственную группу. Курс лечения определяет лечащий врач, этот показатель может значительно меняться от особенностей течения заболевания.
При длительном приёме одних и тех же антибиотиков может развиться суперинфекция, которая плохо поддаётся лечению.
Для лечения инфильтратов в лёгких могут быть назначены и такие лекарственные препараты:
- противовирусные;
- мочегонные;
- отхаркивающие;
- муколитические.
Противовирусные препараты могут назначаться совместно с антибиотиками, если доказано, что болезнь спровоцирована вирусами, но затем осложнилась бактериями.
Мочегонные препараты назначаются для устранения отёка воспалённых тканей. Совместно с муколитиками эти препараты способствуют восстановлению функций бронхов и улучшают отхождение мокроты.
Важную роль в лечении и инфильтратов лёгких играют физические упражнения. Курс упражнений показывает лечащий врач, проводить их необходимо несколько раз в сутки, при этом больной должен лежать на стороне инфильтрата. Глубина вдоха при выполнении комплекса упражнений должна быть ограниченной. За счёт этого активизируются дыхательные процессы в неповреждённом лёгком, и улучшается периферическое кровообращение.
При лечении и инфильтратов в лёгких очень важно соблюдать все рекомендации врача. При злокачественных опухолях часто показана операция.
Народные методы лечения
Дополнить, прописанное доктором лечение, можно и народными рецептами. Одним из наиболее предпочтительных способов лечения является вдыхание паров чеснока. В чесноке содержатся особые компоненты, которые губительно действуют на многие болезнетворные организмы.
Для приготовления берут несколько крупных зубчиков чеснока, очищают их и натирают на тёрке. Полученную кашицу пересыпают в небольшую банку и дышат парами 5-10 минут. При этом необходимо попеременно дышать носом и ртом. Проводить эту процедуру нужно несколько раз в сутки.
Для укрепления общего иммунитета больной может принимать смесь из листьев алоэ, лимона и мёда. Для приготовления снадобья берут 5 крупных листов алоэ, выдерживают их в холодильнике 3-4 дня, затем перекручивают вместе с одним лимоном и добавляют 1 стакан мёда. Всё тщательно перемешивают и принимают по 1 чайной ложке 3 раза в сутки.
Перед использованием любых народных методов лечения необходима консультация доктора!
При вовремя начатом лечении прогноз хороший, особенно если имеет место воспалительная форма заболевания. Онкологические заболевания лёгких на первых порах протекают бессимптомно, поэтому диагноз может быть поставлен поздно. Чтобы исключить позднюю диагностику, нужно взять за правило, раз в год обязательно проходить флюорографию.
Source: pulmono.ru
Глава 11. Инфильтративный туберкулез легких
вания. Со временем различия между разными инфильтратами в значительной степени утрачиваются.
По локализации и объему поражения ткани легкого выде ляют бронхолобулярный инфильтрат, захватывающий обычно две-три легочные дольки, сегментарный — в пределах одного сегмента, а также полисегментарный, или долевой, инфильтра ты. Инфильтрат, развивающийся по ходу главной или доба вочной междолевой щели, называют перисциссуритом.
При прогрессирующем течении инфильтративный туберку лез легких трансформируется в казеозную пневмонию или ка вернозный туберкулез.
Регрессирующее течение инфильтративного туберкулеза ха рактеризуется рассасыванием воспалительных изменений. Вы раженность и длительность этого процесса зависят от характе ра экссудата, распространенности поражения, обширности казеозного некроза, реактивности организма больного. Ин фильтраты небольшой протяженности с серозным экссудатом на фоне адекватного лечения могут рассосаться относительно быстро. При серозно-фибринозном или геморрагическом экс судате рассасывание происходит медленнее и сочетается с раз витием фиброза. Казеозные массы по мере рассасывания инфильтративных изменений уплотняются и осумковываются. На месте полости распада постепенно формируется фиброз ный очаг с включениями сухого казеоза. В дальнейшем на мес те очага может образоваться линейный или звездчатый рубец.
Патогенез инфильтративного туберкулеза легких представ лен на схеме 11.1.
Клиническая картина. Начало инфильтративного туберку леза легких примерно в половине случаев бывает острым и напоминает заболевание гриппом или острой пневмонией.
Относительно слабая выраженность клинических проявле ний чаще встречается у больных с бронхолобулярным или ок руглым инфильтратом. У них обычно наблюдаются повышен ная утомляемость, снижение аппетита, эпизодические повы шения температуры тела после физической нагрузки. Больные часто не воспринимают эти симптомы как проявления болез ни и туберкулезный инфильтрат, имеющий ограниченную протяженность, обнаруживают случайно при медицинском обследовании в связи с устройством на работу или при кон трольной флюорографии во время диспансеризации.
Облаковидный инфильтрат с поражением одного или не скольких легочных сегментов и перисциссурит обычно характе ризуются острым началом с выраженными симптомами инток сикации, небольшим кашлем с мокротой, иногда кровохаркань ем. Вовлечение в патологический процесс плевры приводит к появлению болей в грудной клетке на стороне поражения, кото рые связаны с дыхательными движениями. Дальнейшее прогрессирование туберкулезного воспаления с развитием лобита
Инфильтративный туберкулез легких
Инфильтративный туберкулез легких
Инфильтративный туберкулез легких – вторичная туберкулезная инфекция, характеризующаяся распространенным поражением легких с экссудативным типом воспалительной реакции и формированием очагов казеозного распада. В клинической картине преобладает интоксикационный синдром, гипертермия, продуктивный кашель, боли в боку, кровохарканье. В диагностике инфильтративного туберкулеза легких информативны данные физикального, рентгенологического, лабораторного обследования, результаты туберкулиновых проб. Лечение стационарное, с проведением специфической химиотерапии противотуберкулезными препаратами.
МКБ-10
Общие сведения
Инфильтративный туберкулез легких – клинико-морфологическая форма туберкулеза органов дыхания, протекающая с образованием экссудативно-пневмонических очагов в легких с казеозным распадом в центре. Среди всех форм туберкулеза легких инфильтративная форма встречается наиболее часто – в 60-70% случаев. В этой связи организованное выявление более ранних форм туберкулеза является приоритетной задачей пульмонологии и фтизиатрии. Инфильтративный туберкулез легких относится к числу социально-опасных заболеваний. Болеют в основном взрослые (чаще – лица молодого возраста), имеющие неблагоприятные бытовые условия и низкие гигиенические навыки, страдающие вредными привычками. В структуре смертности от туберкулезной инфекции инфильтративная форма занимает около 1%.
Причины
В основе возникновения инфильтративного туберкулеза легких лежит один из двух механизмов: эндогенная реактивация либо экзогенная суперинфекция. Реактивация характеризуется прогрессированием старых или свежих очагов туберкулеза, появлением вокруг них зоны инфильтрации и развитием экссудативной тканевой реакции. Экзогенная суперинфекция, как причина инфильтративного туберкулеза легких, связана с наличием участков гиперсенсибилизации в легких (т. е. зон, ранее контактировавших с туберкулезной инфекцией). При повторном массивном попадании микобактерий туберкулеза в этих очагах развивается гиперергическая реакция, сопровождающаяся инфильтративным воспалением. В обоих случаях обязательным условием заболеваемости выступает наличие специфического противотуберкулезного (вторичного) иммунитете на момент заражения.
Категорию повышенного риска по развитию инфильтративного туберкулеза легких составляют лица, перенесшие контакт с бацилловыделителем, нервно-психическую травму; страдающие алкоголизмом, никотиновой зависимостью, ВИЧ-инфекцией, наркоманией; ведущие асоциальный образ жизни; имеющие хронические заболевания (сахарный диабет, ХНЗЛ и др.) и профессиональные заболевания; подвергающиеся гиперинсоляции и т. д.
Первоначально в легочной ткани образуется инфильтрат диаметром около 3 см, границы которого имеют тенденцию к расширению вплоть до поражения нескольких сегментов или целой доли легкого. Инфильтрат представляет очаг полиморфной экссудации, состоящей из фибрина, мононуклеаров, макрофагов, полиморфноядерных лейкоцитов, альвеолярного эпителия. При слиянии и расширении инфильтратов возникает специфическая долевая пневмония или бронхопневмония.
На следующем этапе участки инфильтрации подвергаются казеозному расплавлению. Лечение инфильтративного туберкулеза легких может способствовать полному рассасыванию инфильтрата, рубцеванию участков, инкапсуляции зоны инфильтрата с образованием туберкуломы легкого. В случае дальнейшего прогрессирования инфильтративного туберкулеза возможны два варианта развития: переход в казеозную пневмонию (устар. – «скоротечная чахотка») либо распад легочной ткани с формированием каверн (кавернозный туберкулез).
Классификация
В современной фтизиатрии принято выделять пять клинико-рентгенологических вариантов инфильтративного туберкулеза легких:
- Облаковидный инфильтрат – рентгенологически определяется в виде слабоинтенсивной гомогенной тени, имеющей расплывчатые контуры. Имеет склонность к быстрому распаду и формированию свежих каверн.
- Круглый инфильтрат – на рентгенограммах имеет вид округлого гомогенного фокуса (иногда с участком распада в виде просветления) с четко очерченными границами; чаще локализуется в подключичной области.
- Дольковый (лобулярный) инфильтрат – при рентгеновском исследовании выявляется негомогенное затемнение неправильной формы, образованное слиянием нескольких очагов, часто с распадом в центре.
- Краевой инфильтрат (перисциссурит) – обширная облаковидная инфильтрация, снизу ограниченная междолевой бороздой. Имеет треугольную форму с углом, обращенным в сторону корня легкого, а основанием – кнаружи. Нередко возникает поражение междолевой плевры, иногда с развитием туберкулезного плеврита.
- Лобит – обширный инфильтрат в легком, занимающий целую долю. Рентгенологически характеризуется негомогенным фокусом с наличием в нем полостей распада.
По размеру различают малые (1-2 см), средние (2-4 см), крупные (4-6 см) и распространенные (более 6 см) инфильтраты. Отдельно выделяют казеозную пневмонию, характеризующуюся инфильтративной реакцией с преобладанием некротических процессов. Казеозно-пневмонические очаги поражают долю или все легкое. Казеозная пневмония чаще развивается на фоне сахарного диабета, беременности, легочных кровотечений, сопровождающихся аспирацией крови, обсемененной микобактериями.
Симптомы инфильтративного туберкулеза легких
Вариант клинического течения зависит от типа инфильтрата. Острое начало характерно для лобита, перисциссурита, некоторых случаев облаковидного инфильтрата. Бессимптомное и малосимптомное течение наблюдается при наличии круглого, лобулярного и облаковидного инфильтратов. В целом же острая манифестация отмечается 15-20% пациентов, постепенная – у 52-60%, бессимптомная – в 25% случаев.
В большинстве наблюдений первым неспецифическим симптомом инфильтративного туберкулез легких служит подъем температуры тела до 38-38,5°С, которая держится 2-3 недели. Гипертермия сопровождается потливостью, болезненностью мышц, разбитостью, кашлем с выделением мокроты. В целом клиника напоминает грипп, бронхит или острую пневмонию. Иногда заболевание манифестирует с кровохарканья или легочного кровотечения. Среди наиболее распространенных жалоб следует отметить боли в груди на стороне поражения, снижение аппетита, нарушение сна, общую слабость, сердцебиение. Бессимптомные и малосимптомные формы инфильтративного туберкулеза легких, как правило, выявляют во время диспансеризации или профилактического медосмотра по результатам флюорографии.
Осложнения
В числе осложнений инфильтративного туберкулеза легких можно встретить казеозную пневмонию, ателектаз легкого, пневмоторакс, плеврит, легочное кровотечение, туберкулезный менингит, реактивный миокардит, сердечную недостаточность. Начало казеозной пневмонии всегда острое: лихорадка достигает 40-41°С, типичны перепады между дневной и вечерней температурой, резко выражена туберкулезная интоксикация. Больных беспокоит одышка, кашель с гнойной мокротой, боли в грудной клетке, прогрессирующее похудание.
Диагностика
Поскольку клинические признаки инфильтративного туберкулеза легких малоспецифичны или отсутствуют совсем, основное значение в диагностике имеют объективные, инструментальные и лабораторные данные. Аускультативная картина характеризуется наличием звучных хрипов; перкуссия обнаруживает притупление звука над областью инфильтрата. Особенно эти изменения выражены при лобите и наличии распада инфильтрата с формированием каверны. Воспалительные изменения крови (сдвиги в лейкоформуле, ускорение СОЭ) незначительны.
Туберкулиновая проба у больных чаще положительная. Рентгенография легких позволяет не только обнаружить инфильтративные изменения, но и оценить характер тени, проследить динамику лечения. Выявить МБТ можно как с помощью микроскопического исследования, так и методом бактериологического посева мокроты или смывных вод бронхов, полученных при проведении бронхоскопии. Подтвердить наличие тубинфекции в организме позволяют новые, высоко достоверные исследования крови: T-SPOT.TB и квантиферон-тест.
Бронхоальвеолярный лаваж легких мышей для анализа инфильтрации воспалительных клеток
БАЛ — полезный метод получения цитологической и биохимической информации в ответ на инфекции или лекарства. Первоначально БАЛ использовался для контроля чрезмерного образования слизи у людей, страдающих от токсичности фосгена 3 . В настоящее время этот метод используется на людях для исследования патогенеза легких, диагностики и лечения заболеваний 3 , 24 .У лабораторных животных БАЛ обычно используется для мониторинга воспалительных реакций, иммунных механизмов и инфекционных процессов, протекающих в легочных дыхательных путях 1 , 2 .
Для изучения воспалительного клеточного паттерна на моделях респираторных заболеваний после БАЛ следует проводить абсолютный и дифференциальный подсчет клеток. Помимо абсолютного количества ячеек, интерес представляют также относительные номера ячеек. Например, модели заживления и рака показывают очень незначительное увеличение количества клеток ЖБАЛ или его отсутствие.В этой модели полезна оценка клеточного состава. Используя окрашивание клеток в сочетании с оптической микроскопией, можно идентифицировать различные типы клеток, такие как эозинофилы, нейтрофилы, макрофаги и лимфоциты на основе морфологии 25 , 26 , 27 , 28 , 29 , 30 . Проточная цитометрия может использоваться для конкретных оценок, например, для идентификации различных фенотипов Т-клеток 7 , 31 .В дополнение к идентификации различных популяций инфильтрирующих клеток неклеточный состав легких может быть исследован с помощью БАЛ. Такие методы, как ELISA, иммуноблоттинг, набор гранул цитокинов, иммуногистохимия и количественная полимеразная цепная реакция, выполняются на жидкости БАЛ для определения цитокинов, факторов роста и других воспалительных компонентов. Для определения повреждения легких также можно измерить уровни общего белка и лактатдегидрогеназы в БАЛ 32 , 33 .
С развитием новых диагностических инструментов геномная и протеомная характеристика компонентов БАЛ станет возможной в ближайшем будущем. Сочетание расширяющихся вычислительных возможностей и технологий экспрессии генов с высокой пропускной способностью позволит определить профили экспрессии конкретных генов для различных болезненных состояний. Выполнение этих методов на жидкости БАЛ может обеспечить образцы экспрессии генов и белков для идентификации важных молекул, участвующих в различных фазах заболеваний легких.
Основным ограничением данных, полученных с помощью жидкости БАЛ, является отсутствие сопоставимости между различными исследовательскими исследованиями 3 , 9 . Существует большая степень вариативности техники лаважа и последующей обработки жидкости БАЛ. Чтобы иметь возможность сравнивать каждое испытание БАЛ, необходимо стандартизировать тип закапываемой жидкости для лаважа, место инстилляции и фракцию, которая должна быть проанализирована на клеточный и неклеточный состав.Существуют значительные различия в количестве фракций промывания между разными испытаниями, от одного до 14 раз 34 , 35 , 36 . Эта разница может повлиять на предполагаемое общее количество клеток в легких. Важно знать, какая фракция жидкости БАЛ содержит большинство клеток. Song et al. показал, что примерно 70% от общего количества клеток было извлечено во фракциях от 1 до 3 22 .Однако другие отчеты предполагали, что второй лаваж содержал больше клеток, чем первый 37 , 38 . Из этих исследований мы можем сделать вывод, что промывание только одной фракцией не представляет все легкое, что приводит к неверной интерпретации результатов.
Неклеточный состав жидкости БАЛ содержит ценную информацию о состоянии здоровья легких 33 , 39 , 40 . Вариации разбавления жидкости БАЛ вносят вклад в разницу в количественном определении растворимой фракции и, следовательно, в различия в результатах между испытаниями.Song et al. сравнил уровни протеина и лактатдегидрогеназы каждой фракции лаважа и пришел к выводу, что первая фракция лаважа содержала в два-три раза больше, чем вторая фракция.
Чтобы получить репрезентативный образец БАЛ для анализа, решающее значение имеют некоторые технические соображения. Один из них — провести правильное обезболивание. Очень важно проверить рефлекс стопы мыши, чтобы убедиться в окончательной седации. Это важно не только по этическим соображениям, но и потому, что катетер сложно разместить и удерживать в правильном положении, если мышь не анестезирована должным образом.
Вторым важным техническим аспектом является положение катетера в трахее. Если катетер ввести слишком глубоко, это может повредить структуру легких. Дистальный конец катетера не должен доходить до легких во время процедуры БАЛ. Катетер также следует стабилизировать и перевязать хлопковой нитью. Если катетер не стабилизирован, введенный физиологический раствор может течь вверх в полость носа, а не вниз в легкие. Во время инъекции и аспирации физиологического раствора важно держать катетер неподвижно.
Данные, полученные из жидкости БАЛ, должны представлять все легкое мыши. Поэтому важно закапать адекватный объем физиологического буфера (, т.е. 3 мл, разделенный на 3 аликвоты по 1 мл каждая). Нет линейной зависимости между выходом клеток и выходом жидкости БАЛ. Важно аккуратно собрать раствор, массируя грудную клетку мыши. Если силы сдвига слишком велики, жизнеспособность, функция и структура клеток в дыхательных путях и БАЛ могут быть нарушены.Если аспирированная жидкость не видна в шприце, осторожно продвиньте катетер глубже или выше в трахее.
Особое внимание следует уделить конкретным аспектам обработки и анализа BAL. Это позволит максимально увеличить объем информации, полученной из образцов BAL. После БАЛ клетки находятся в бедной питательными веществами солевой среде. Поэтому очень важно обработать образцы в течение 1 часа после отбора проб БАЛ. Если необходимо длительное хранение, необходимо использовать питательную среду.
Чтобы сохранить жизнеспособность клеток, избегайте пробирок, которые способствуют прикреплению клеток к поверхности. Избегайте центрифугирования клеточных суспензий на скоростях, которые могут нарушить целостность клеток или предотвратить равномерное ресуспендирование извлеченных клеток ЖБАЛ. Жидкость БАЛ, содержащая клетки, следует центрифугировать при 400 x g и 4 ° C в течение 7 мин. Важно помнить, что во время обработки суспензии клеток следует выдерживать при температуре 4 ° C.
Frontiers | Состав иммунных клеток при немелкоклеточном раке легкого человека
Введение
Рак легких является ведущей причиной смерти от рака во всем мире с высокой ежегодной заболеваемостью и 5-летней выживаемостью <20% (1).Немелкоклеточный рак легкого (НМРЛ) - наиболее распространенный тип рака легких, составляющий ~ 90% всех случаев (2). Двумя наиболее распространенными подтипами НМРЛ являются аденокарцинома и плоскоклеточный рак, составляющие 50 и 40% всех случаев соответственно (3, 4). В настоящее время прогноз и выбор лечения в основном основаны на системе определения стадии TNM, которая классифицирует степень рака по четырем категориям, стадии I-IV, на основе размера первичной опухоли (T), свидетельств наличия раковых клеток в региональном разрезе. лимфатические узлы (N) и наличие дистальных метастазов (M) (5).Однако клинические исходы могут сильно различаться у пациентов на одной и той же стадии TNM (6).
Несколько сообщений показали, что тип, плотность и расположение иммунных клеток в микроокружении опухоли играют центральную роль в прогрессировании заболевания. Сообщалось, что при раке яичников (7), колоректальном раке (8, 9), раке молочной железы (10) и раке легких (6, 11–13) иммунологические параметры лучше предсказывают клинический результат, чем стадия TNM. Поэтому было предложено включить иммуноядер, основанный на иммунологическом анализе микроокружения опухоли, как отдельный компонент в систему классификации (8).Преимущества включения иммунных параметров в стадию TNM распространяются на индивидуальный выбор лечения (14). Недавняя разработка ингибиторов иммунных контрольных точек, таких как блокирующие антитела против молекул CTLA-4 или PD-1 / PD-L1, значительно улучшила лечение рака и увеличила выживаемость пациентов. Однако частота объективных ответов на блокаду контрольных точек при НМРЛ в настоящее время составляет всего около 20% (15–18). Следовательно, существует острая необходимость в создании надежных методов для характеристики иммунного ответа в опухолях НМРЛ, чтобы иметь возможность прогнозировать выживаемость и ответ на иммунотерапию для отдельных пациентов.
Ранние попытки идентифицировать иммунные клетки при НМРЛ использовали иммуногистохимию (19–22). Эти исследования показали, что опухоли НМРЛ содержат множество типов иммунных клеток, включая Т-клетки (23), В-клетки (24), макрофаги (25), NK-клетки (26) и дендритные клетки (ДК) (24, 26) и различные Сообщалось о связи между плотностью иммунных клеток и выживаемостью пациентов (21, 27). Однако в этих исследованиях на основе иммуногистохимии обычно использовалось одно моноклональное антитело для идентификации данного типа иммунных клеток, чего обычно недостаточно.Чтобы получить более надежную идентификацию иммунных клеток при НМРЛ, в нескольких недавних отчетах использовалась проточная цитометрия с множественными антителами (28–30). Первое исследование проточной цитометрии, в котором была подробно изучена небольшая группа пациентов ( n = 6) с аденокарциномой легкого, подтвердило наличие большого количества типов иммунных клеток в опухолях (28). Напротив, второе исследование, посвященное Т-клеткам, сообщило только о шести различных линиях иммунных клеток в опухолях НМРЛ: Т-клетки CD4 + , Т-клетки CD8 + , гранулоциты, моноциты, В-клетки и NK-клетки (29).Неожиданный вывод из третьего исследования заключался в том, что нейтрофилы были наиболее распространенным типом иммунных клеток в опухолях НМРЛ (30). К сожалению, эти исследования включали ограниченную информацию о стратегии стробирования проточной цитометрии, что затрудняло сравнение результатов (28–30). В результате этих противоречивых данных и неясной методологии точное содержание иммунных клеток в опухолях НМРЛ остается неопределенным.
Для того, чтобы точно установить состав иммунных клеток при НМРЛ, мы проанализировали с помощью 4-лазерной проточной цитометрии большую группу пациентов ( n = 68), всех оперированных в университетской больнице Осло.Точный тип клеток был определен для> 95% всех иммунных клеток CD45 + в опухолях NSCLC. Чтобы сделать метод доступным для других лабораторий, мы подробно представляем установленные панели антител и стратегии стробирования, используемые для идентификации различных иммунных клеток. Всего было идентифицировано тринадцать различных типов иммунных клеток. Кроме того, наблюдались четыре субпопуляции B-клеток и два субнабора NK-клеток. Эта работа должна представлять собой полезный ресурс для создания иммунного ядра для прогноза пациента и выбора лечения при НМРЛ.
Материалы и методы
Заявление об этике
Все образцы были собраны у пациентов с диагнозом НМРЛ, оперированных в университетской больнице Осло с января 2013 года по декабрь 2016 года. Все пациенты, включенные в исследование, подписали письменное информированное согласие. Исследование было одобрено Региональным комитетом по этике медицинских и медицинских исследований (Осло, Норвегия, исх. № S-05307).
Пациенты и клинические материалы
Образцы тканей и крови были взяты у пациентов, перенесших лобэктомию, билобэктомию или пневмонэктомию.Пациенты были прооперированы в отделении кардиоторакальной хирургии больниц Рикшоспиталет и Уллевол, университетской больницы Осло, Осло, Норвегия. Пациенты с иммунодефицитом или пациенты, которые ранее получали лечение рака, были исключены из исследования. Были исследованы образцы от 68 пациентов с диагнозом первичного НМРЛ от IA до IIIB (таблица 1) (5). Из 68 пациентов у 38 была диагностирована аденокарцинома, у 26 — плоскоклеточная карцинома, а у 4 пациентов были диагностированы другие, редкие типы НМРЛ (таблица 1).На основании истории курения пациенты были разделены на 3 группы: (i) активные / настоящие курильщики ( n = 32), (ii) бывшие курильщики ( n = 28) и (iii) те, кто никогда не курил. ( n = 8; обозначены некурящие, таблица 1). Активными или настоящими курильщиками были пациенты, которые активно курили во время операции, и те, кто курил по крайней мере за 6 месяцев до операции. Чтобы считаться бывшим курильщиком, пациент должен был бросить курить не позднее, чем за 6 месяцев до операции.
Таблица 1 . Характеристика популяции пациентов ( n = 68).
У пациентов были взяты четыре разных образца: образец опухоли, образец дистального отдела легкого, половина регионарного лимфатического узла и кровь. Образец незлокачественной легочной ткани, называемой дистальным отделом легкого, брали наиболее далеко от опухоли в резецированной доле. Лимфатические узлы были взяты на станции 10 (вокруг бронха) резецированной доли после того, как доля была извлечена у пациента.Лимфатические узлы были резецированы в соответствии с европейскими рекомендациями по хирургии рака легких (31). Отбор образцов лимфатических узлов не повлиял на диагностический процесс, и для исследования использовалась только половина лимфатических узлов каждого пациента. Ткани транспортировали на льду в среде DMEM (Gibco, Thermo Fisher Scientific, Уолтем, Массачусетс, США, каталожный номер: 10565-018) с добавлением 0,25 мкг / мл амфотерицина (Sigma-Aldrich, Сент-Луис, Миссури, США, Каталожный номер: A2942). Образцы опухоли и дистального отдела легкого были тщательно промыты (и отжаты) DMEM / амфотерицином, чтобы удалить кровь в максимально возможной степени.Для создания суспензий единичных клеток ткани (опухоль, дистальный отдел легкого и лимфатический узел) механически диссоциировали с помощью ножниц, а затем инкубировали с DMEM с добавлением 2 мг / мл коллагеназы A (Roche, Базель, Швейцария, № по каталогу: 10103586001) и 50 единиц / мл ДНКазы (Roche, № по каталогу: 11284932001) в течение 1 ч с магнитом для перемешивания при 37 ° C. Переваренные ткани фильтровали через фильтр 100 мкм (Falcon, Corning, NY, USA, № по каталогу: 35236) для удаления крупных клеточных остатков и агрегатов. Суспензии отдельных клеток центрифугировали при 410 g в течение 6 минут при 4 ° C, и осадки ресуспендировали в DMEM с 10% фетальной бычьей сывороткой (FBS) (Sigma-Aldrich, № по каталогу: F7524).Кровь брали из центрального венозного катетера непосредственно перед операцией, но после анестезии пациента. Образцы крови хранили при комнатной температуре перед выделением мононуклеарных клеток периферической крови (PBMC) с использованием градиента плотности Lymphoprep в соответствии с протоколом производителя (Axis-Shield, Dundee, UK, № по каталогу: 07811).
Проточная цитометрия
Суспензии единичных клеток опухоли, дистального отдела легкого, лимфатического узла и РВМС анализировали с помощью проточной цитометрии. Чтобы заблокировать неспецифическое связывание антител, клетки инкубировали с 12.5 мкг / мл мышиного IgG (Sigma-Aldrich, № по каталогу: I8765-10MG), разведенного в фосфатно-солевом буфере (PBS, Sigma, № ссылки: 14190-094) в течение 15 минут на льду. Затем клетки окрашивали моноклональными антителами, меченными флуорохромом. Мы создали 6 различных панелей антител для идентификации различных иммунных клеток (дополнительные таблицы 1–6). Для определения положительных и отрицательных событий использовали контрольные антитела, соответствующие изотипу. Антитела разбавляли в проточном буфере, состоящем из PBS с 10% FBS (Sigma, № по каталогу: F7524).Суспензии единичных клеток из тканей и РВМС инкубировали со смесью антител в 96-луночных планшетах с v-дном (Corning, Costar, № по каталогу: 3894) на льду в темноте в течение 20 мин. После инкубации в каждую лунку добавляли 100 мкл проточного буфера, и планшеты центрифугировали при 410 g в течение 6 минут при 4 ° C. Супернатанты удаляли, а осадки клеток ресуспендировали в 150 мкл проточного буфера на лунку и снова центрифугировали (410 g в течение 6 минут при 4 ° C). Осадки клеток ресуспендировали в 200 мкл буфера для потока и фильтровали через сито 100 мкм (Falcon, № по каталогу: 352360).Суспензии клеток окрашивали йодидом пропидия (PI) 5 мкг / мл непосредственно перед анализом на проточном цитометре BD LSRFortessa (BD Bioscience). Данные анализировали с помощью программного обеспечения FlowJo V10 (FlowJo, LLC).
Иммуногистохимия
Были выбранырепрезентативных областей для количества воспаления в каждой опухоли. Иммуноокрашивание проводили на опухолевой ткани FFPE толщиной 2,5 мкм с использованием прибора Dako Autostainer (Dako, Agilent Technologies, Санта-Клара, Калифорния, США, модель Link 48).Извлечение эпитопов выполняли с помощью Dako Flex HpH в соответствии с протоколом производителя (Dako EnVision FLEX, № по каталогу: K8000). Срезы тканей инкубировали в течение 20 мин с первичными моноклональными антителами против CD45 (клоны 2B11 и PD7 / 26, разведенные 1: 300; Dako, № по каталогу: M0701). Вторичное обнаружение проводили с помощью Dako EnVision TM Flex (Dako, каталожный номер: K8000) в течение 20 минут с последующим окрашиванием диаминобензидином (DAB) в течение 10 минут (Dako EnVision FLEX, каталожный номер K800021-2). После этого слайды обрабатывали 0.5% CuSO 4 в течение 5 минут перед контрастным окрашиванием гематоксилином (Merck, № по каталогу: 1.15938.0100) для визуализации ядер клеток. Срезы тканей исследовали с помощью микроскопа Nikon Eclipse model N i -U (Nikon, Tokyo, Japan), оснащенного линзами объектива Nikon Plan-Fluor (2 ×, 10 ×, 20 ×, 40 × и 60 ×), и изображения были сняты цифровой камерой Infinity 2 (Lumenera Corporation, Непеан, Онтарио, Канада).
Статистика
Статистические расчеты были выполнены с использованием призмы Graph Pad 6.0 (GraphPad). Процентное содержание различных популяций иммунных клеток рассчитывали из общего количества CD45 + живых лейкоцитов. Чтобы определить, были ли различия между тремя или более группами статистически значимыми, мы использовали непараметрический дисперсионный анализ Краскела-Уоллиса и тест множественного сравнения post-hoc Данна. Результаты считались статистически значимыми, когда значение p было <0,05.
Результаты
Лейкоциты проникают в опухоли аденокарциномы легкого в более высокой степени, чем дистальный отдел легкого
Чтобы охарактеризовать состав иммунных клеток при НМРЛ, мы собрали свежие образцы из четырех разных анатомических участков: опухоль, дистальный отдел легкого (образец доброкачественной легочной ткани, взятой наиболее далеко от опухоли в резецированной доле), региональный лимфатический узел и кровь. .Отдельные клетки, выделенные из этих образцов, анализировали с помощью многопараметрической проточной цитометрии. В стратегии стробирования, используемой для идентификации лейкоцитов, ворота ядерных клеток на основе FSC-A и SSC-A были настроены для удаления дебриса из дальнейшего анализа (рис. 1A). Одноклеточный вентиль на основе FSC-A и FSC-H использовался для исключения дублетов и агрегатов клеток (рис. 1B), а ворота с живыми клетками были сделаны с использованием йодида пропидия (PI) для исключения мертвых клеток (рис. 1C). . Затем использовали панлейкоцитарный маркер CD45, и живые лейкоциты были определены как клетки CD45 + PI — (рис. 1D).Доля лейкоцитов среди всех живых клеток в опухолях аденокарциномы и плоскоклеточного рака варьировала от 34 до 96% в когорте пациентов (Рисунки 1E, F). На инфильтрацию лейкоцитов в опухолях НМРЛ, по-видимому, не повлияло лечение кортикальными стероидами некоторых пациентов, страдающих хронической обструктивной болезнью легких (ХОБЛ) (дополнительный рисунок 1), как предполагается в недавнем отчете (32). Процент лейкоцитов был значительно выше в ткани опухоли аденокарциномы по сравнению с дистальным отделом легкого (рис. 1E p = 0.026). Аналогичная тенденция наблюдалась для плоскоклеточного рака, но разница не достигла статистической значимости ( p = 0,068, рис. 1F). Иммуногистологическое окрашивание CD45 на срезах опухолевой ткани NSCLC проводилось на нескольких случайно выбранных образцах, и результаты подтвердили результаты, полученные с помощью проточной цитометрии. Образцы пациентов с высоким количеством лейкоцитов CD45 + при проточной цитометрии также показали большое количество клеток CD45 + в иммуноокрашенных срезах ткани (рисунки 1G – H).Напротив, более низкая частота клеток CD45 + , измеренная с помощью проточной цитометрии, соответствовала наблюдению меньшего количества инфильтрирующих клеток CD45 + в иммуноокрашенных срезах ткани (Фигуры 1I, J).
Рисунок 1 . Опухоли NSCLC инфильтрированы различным количеством лейкоцитов CD45 + . (A – F) Данные получены методом проточной цитометрии 57 пациентов, 32 пациентов с аденокарциномой и 25 пациентов с плоскоклеточным раком. (A) Размер событий (FSC-A) использовался для исключения клеточного дебриса и определения всех клеток. (B) Отдельные клетки идентифицировали с использованием FSC-A и FSC-H, а дублеты выделяли. (C) Живые клетки отрицательны по окрашиванию йодидом пропидия (PI). (D) Живые лейкоциты были определены как клетки CD45 + PI — . (E) и (F) показывают лейкоциты (CD45 + PI —) как процент от всех живых клеток, идентифицированных проточной цитометрией аденокарциномы (E) и плоскоклеточной карциномы (F) .Каждый символ на графиках (E, F) представляет данные одного пациента. Статистические расчеты были выполнены с помощью непараметрического анализа Краскела-Уоллиса и пост-теста Данна, сравнивая опухоль с дистальным отделом легкого и лимфатическим узлом (LN). Красные точки на графиках (E), и (F), показывают образцы пациентов, также проанализированные иммуногистохимическим методом. (G – J) Иммуногистохимический анализ срезов тканей опухолей четырех пациентов с НМРЛ. Окрашивание НЕ (синий) и окрашивание анти-CD45 иммунных клеток (коричневый) при 100-кратном увеличении.Область, показанная на фотографиях, представляет воспаление в опухоли в целом. (G) Опухоль аденокарциномы, показывающая высокую инфильтрацию клеток CD45 + (91% всех клеток при проточной цитометрии). (H) Опухоль плоскоклеточного рака с высокой инфильтрацией клеток CD45 + (96% всех клеток по данным проточной цитометрии). (I) Низкая инфильтрация клеток CD45 + в плоскоклеточный рак (45% всех клеток по данным проточной цитометрии). (J) Низкая инфильтрация клеток CD45 + в опухоль аденокарциномы (52% всех клеток при проточной цитометрии).
Т-клетки доминируют в составе иммунных клеток в NSCLC
Для исследования содержания Т-клеток в опухолях НМРЛ мы сначала определили отдельные живые клетки CD45 + , обозначив популяцию живых лейкоцитов (рисунки 2A – C). Ворота лимфоцитов были установлены на основе параметров FSC и SSC (рисунок 2D). Лимфоциты были идентифицированы на основе экспрессии CD3 и CD19, и наблюдались три популяции: CD19 — CD3 + Т-клетки, CD19 + CD3 — В-клетки и CD19 — CD3 — двойные отрицательные клетки (Рисунок 2E).Т-клетки дополнительно исследовали на экспрессию CD4 и CD8, в результате чего были выделены три популяции: CD4 + Т-клетки, CD8 + Т-клетки и CD4 — CD8 — двойные отрицательные (DN) Т-клетки ( Рисунок 2F). Каждая из трех популяций Т-клеток проявляла фенотип памяти / эффектора или наивный фенотип, определяемый экспрессией поверхностных маркеров CD45RO и CD45RA, соответственно (Рисунки 2G – I). Большинство Т-клеток представляли собой CD45RA — CD45RO + клетки памяти / эффекторные клетки.Тот факт, что соотношение наивных Т-клеток / Т-клеток памяти было намного ниже в опухолевой ткани (рис. 2) по сравнению с РВМС (дополнительный рис. 2), показывает, что загрязнение крови в образцах опухолей было очень низким. Кроме того, хотя наивные Т-клетки классически определяются как CD45RA + CD45RO — , следует отметить, что CD45RA + эффекторные / память CD8 + Т-клетки (так называемые клетки T EMRA ) были сообщил (33, 34). Иммунофлуоресцентное окрашивание срезов опухолевой ткани NSCLC выявило присутствие CD45RA + CD3 + Т-клеток как в строме опухоли (предположительно, T EMRA ), так и в третичных лимфоидных структурах (TLS), которые образуются на периферии опухоли. (24) (Дополнительный рисунок 3).CD45RA + CD3 + Т-клетки в TLS, вероятно, будут наивными Т-клетками (по крайней мере, для некоторых из них), потому что CD45RA + CD3 + наивные Т-клетки, как сообщается, обогащены TLS при НМРЛ ( 35).
Рисунок 2 . Анализ проточной цитометрии Т-клеток в опухолевой ткани НМРЛ. (A) Gate для ядерных клеток в зависимости от размера и сложности события (FCS-A и SSC-A, соответственно). (B) Ядерные клетки затем наносили на график в FSC-A и FSC-H для гейтирования одиночных клеток и исключения дублетов. (C) Из ворот одиночных клеток живые лейкоциты были определены как CD45 + PI — . (D) Гейт лимфоцитов был создан на основе FSC-A и SSC-H. (E) В-клетки CD19 + были исключены из популяции лимфоцитов, а популяция CD19 — CD3 + была определена как Т-клетки. (F) Т-клетки были дополнительно разделены на популяции CD4 + , CD8 + и CD4 —, CD8 —.Каждую подгруппу исследовали на наличие наивного фенотипа CD45RA + CD45RO – и фенотипа эффектора / памяти CD45RA – CD45RO + . (G) Фенотипирование наивно / с памятью CD8 + Т-клеток. (H) Фенотипирование наивно / с памятью CD4 — CD8 — Т-клеток. (I) Наивное фенотипирование с памятью CD4 + Т-клеток. Проценты, представленные на рисунке, являются средними значениями всех пациентов с НМРЛ, проанализированных на Т-клетки ( n = 30; 15 аденокарцинома, 14 плоскоклеточная карцинома, одна крупноклеточная карцинома).Проценты рассчитывали от общего количества живых лейкоцитов (CD45 + PI — популяция). DN, двойные отрицательные Т-клетки.
CD3 + Т-клетки составляли в среднем 49,5% при аденокарциноме и 41,1% при плоскоклеточной карциноме всех инфильтрирующих опухоль лейкоцитов CD45 + (рис. 3А). Среди CD3 + Т-лимфоциты CD4 + Т-клетки были наиболее частыми (28,6% при аденокарциноме и 22,1% при плоскоклеточном раке, рисунок 3B), за которыми следовали CD8 + Т-клетки (23.9% при аденокарциноме и 18,2% при плоскоклеточной карциноме, рисунок 3C). CD4 – CD8 –, DN Т-клетки составляли небольшую часть популяции Т-клеток (1,5% при аденокарциноме и 1,3% при плоскоклеточном раке, рис. 3D). В последующих анализах мы сравнили репрезентативность CD3 + Т-клеток в различных анатомических участках (опухоль, дистальный отдел легкого, кровь, лимфатический узел), гистологических подтипах опухолей, стадиях опухоли и историях курения. Статистически значимых различий между образцами опухоли и дистального отдела легкого не наблюдалось (дополнительные рисунки 4, 5).Взятые вместе, эти данные показывают, что CD4 + Т-клетки представляют собой наиболее многочисленную популяцию Т-клеток при НМРЛ (25,9%), за которой следуют Т-клетки CD8 + (21,7%). CD4 — CD8 — Т-клетки составляли лишь небольшую часть проникающих в опухоль иммунных клеток (1,4%). Большинство Т-клеток в опухоли — это Т-клетки памяти / эффекторные Т-клетки.
Рисунок 3 . Процент Т-клеток в опухолях НМРЛ разных гистологических типов. Приведены данные для аденокарциномы и плоскоклеточного рака.Стратегия стробирования описана на рисунке 2. Процентное содержание (A) всех CD3 + Т-клеток, (B) CD3 + CD4 + Т-клеток, (C) CD3 + CD8 + Т-клеток и (D) CD3 + CD4 — CD8 — Т-клеток, то есть дважды отрицательных Т-клеток. Процент Т-клеток рассчитывали из общего количества живых лейкоцитов (CD45 + PI — ) в образце. Каждый символ представляет данные для одного пациента ( n = 42; 25 аденокарцинома, 17 плоскоклеточный рак), а средние значения указаны синими линиями.Статистические расчеты были выполнены с использованием непараметрического анализа Краскела-Уоллиса и пост-теста Данна, и никаких значительных различий между группами не наблюдалось.
B-клетки в опухолях НМРЛ многочисленны и разнообразны
Чтобы охарактеризовать В-клетки в опухолях НМРЛ, мы сначала исключили дебрис, скопления клеток, мертвые клетки и клетки CD45 – и определили ворота лимфоцитов (рисунки 4A – D). Из этой популяции лимфоцитов были исключены макрофаги CD14 + (рис. 4E).Остальные клетки были разделены на основе экспрессии CD3 и CD19 на три популяции: CD19 — CD3 + Т-клетки, CD19 + CD3 — В-клетки и CD19 — CD3 — , дважды отрицательные. население (Рисунок 4F). Для дальнейшего анализа субпопуляций B-клеток мы использовали номенклатуру, установленную Jackson et al. и Germain et al. (36, 37). Паттерны экспрессии IgM и IgD были использованы для идентификации трех популяций клеток: IgM + , IgD + , IgM — , IgD — и IgM + , IgD — B-клеток (рисунок 4H).Из популяции IgM — IgD — DN, CD27 и CD38 были использованы для идентификации субпопуляции CD27 + CD38 +/− B-клеток, а также CD27 + CD38 ++ плазмы ячеек (рисунок 4G). Субпопуляция В-клеток CD27 + CD38 +/- может состоять либо из В-клеток памяти, либо из В-клеток зародышевого центра, либо из того и другого (38, 39). Из популяции IgM + IgD + CD27 и CD38 были использованы для идентификации наивных В-клеток, являющихся CD38 +/- CD27 — (рис. 4I).Для сравнения, стратегия стробирования для субпопуляций B-клеток в крови (PBMC) показана на дополнительном рисунке 6.
Рисунок 4 . Анализ проточной цитометрии субпопуляций В-клеток в опухолях НМРЛ. (A) График FSC-A и SSC-A использовали для идентификации ядерных клеток. (B) На графике FSC-A и FSC-H отдельные клетки были заблокированы, а дублеты исключены. (C) Живые лейкоциты были определены как CD45 + PI — . (D) Гейт лимфоцитов был установлен на графике FSC-A и SSC-H. (E) CD14 + макрофагов были исключены. (F) Ворота для В-клеток, определяющие все В-клетки как CD19 + и CD3 — . (G – I) Определение субпопуляций В-клеток. (G) Характеристика IgM — IgD — B-клеток. Были идентифицированы две популяции: CD27 + CD38 ++ плазматические клетки и CD27 + CD38 +/- клетки (H) График IgD / IgM был использован для идентификации IgM + IgD — субпопуляции В-клеток и для определения гейтов IgM — , IgD — и IgM + , IgD + . (I) Дальнейшая характеристика IgM + IgD + B-клеток: наивные B-клетки определены как CD27 — CD38 +/- . Представленные на рисунке процентные числа представляют собой средние значения всех пациентов с НМРЛ, проанализированных для указанных субпопуляций В-клеток ( n = 23; 12 аденокарцинома, 11 плоскоклеточная карцинома). Для каждого пациента процентное содержание В-клеток и их субпопуляций рассчитывалось из общего количества живых лейкоцитов.
CD19 + В-клетки составляли в среднем 18% всех иммунных клеток CD45 + при аденокарциноме и 12,7% при плоскоклеточном раке (рисунки 5A, B). Сравнение процентного содержания В-клеток в различных тканях выявило повышенную инфильтрацию В-клеток CD19 + в опухоль по сравнению с дистальным отделом легкого (Фигуры 5A, B). Это было очевидно как для аденокарциномы ( p <0,0001), так и для плоскоклеточного рака ( p = 0,007). Повышенный процент В-клеток в опухоли может быть следствием увеличения количества В-клеток CD27 + CD38 +/- (Рисунки 5C, D).Процент плазматических клеток был одинаковым между опухолью и дистальным отделом легкого (рисунки 5E, F). При плоскоклеточной карциноме процент В-клеток IgM + IgD – был выше в опухоли по сравнению с дистальным отделом легкого (Рисунки 5G, H). Процент наивных В-клеток был одинаковым между опухолью и дистальным отделом легкого (рисунки 5I, J). Наблюдались высокие различия в процентном содержании опухоли, инфильтрирующей CD19 + В-клетки между отдельными пациентами (рисунки 5A, B). Процент внутриопухолевых В-клеток не был связан с гистологическим типом опухоли, стадией заболевания или историей курения пациента (дополнительные рисунки 7–9).
Рисунок 5 . Процент всех CD19 + В-клеток и субпопуляций В-клеток в различных тканях от пациентов с НМРЛ. (A, B) Сравнение процентного содержания CD19 + B-клеток у пациентов с диагнозом аденокарцинома (A) ( n = 33) и (B) плоскоклеточный рак ( n = 23) . (C, D) Процент CD27 + CD38 +/− B-клеток в тканях пациентов с диагнозом (C) аденокарцинома ( n = 12) и (D) плоскоклеточная карцинома ( n = 11). (E) Наличие плазматических клеток при аденокарциноме ( n = 12) и (F) при плоскоклеточном раке ( n = 11). (G) Процент IgM + IgD — B-клеток в аденокарциноме ( n = 12) и (H) плоскоклеточной карциноме ( n = 11). (I) Процент наивных В-клеток при аденокарциноме ( n = 12) и (J) плоскоклеточный рак ( n = 11).Клетки были заблокированы, как показано на фиг. 4. Каждый символ представляет данные одного пациента в процентах от общего числа живых лейкоцитов (CD45 + PI — ), а синие линии указывают средние значения. Статистический анализ проводился с использованием непараметрического анализа Краскела-Уоллиса и пост-теста Данна, сравнивающего опухоль, дистальный отдел легкого и лимфатический узел (ЛУ).
Опухоли NSCLC содержат макрофаги с высокой экспрессией HLA-DR и тремя подгруппами дендритных клеток (DC)
Чтобы охарактеризовать мононуклеарные фагоциты при НМРЛ, мы сначала идентифицировали живые лейкоциты (Рисунки 6A – C) и исключили CD19 + B-клеток (Рисунок 6E).Для идентификации макрофагов и DC использовались три отдельные стратегии, как показано стрелками разного цвета на фиг. 6. Макрофаги были определены как клетки HLA-DR + CD14 + (зеленая стрелка, фиг. 6F). HLA-DR и CD123 использовали для идентификации HLA-DR + CD123 + плазмацитоидных дендритных клеток (pDC, красная стрелка, фигура 6H). Эту популяцию исследовали на предмет экспрессии CD14 + и CD11c + (красная стрелка, фиг. 6I), чтобы убедиться, что макрофаги и другие DC были исключены из ворот, определяющих pDC.Чтобы идентифицировать миелоидные дендритные клетки (mDC), мы использовали HLA-DR и CD11c и наблюдали отдельную популяцию клеток HLA-DR + CD11c + (фиолетовая стрелка, рисунок 6D). Из популяции HLA-DR + CD11c + были исключены макрофаги CD14 + (рис. 6G). Чтобы исследовать mDC более внимательно, мы использовали маркеры CD1c и CD141 (фиолетовая стрелка, рис. 6J). Мы наблюдали CD141 — CD1c + DC, CD141 + CD1c — DC и третью популяцию клеток CD141 — CD1c — DN.CD14 + Макрофаги HLA-DR + составляли 4,7% от всех инфильтрирующих опухоль лейкоцитов, тогда как три популяции DC вместе составляли 2,1% всех лейкоцитов в опухоли. Плазмацитоидные ДК были основной подгруппой ДК в опухолях НМРЛ (1,2%), за ними следовали мДК CD1c + (0,8%) и ДК CD141 + (0,1%). Следует отметить, что CD11c не является специфическим маркером ДК у человека, поскольку все моноциты человека в крови экспрессируют CD11c (40). Кроме того, макрофаги bona fide CD14 + HLA-DR + в опухолях NSCLC также экспрессируют CD11c (а также CD11b) (дополнительная фигура 10).Следовательно, CD11c + HLA-DR + CD14 — CD1c — CD141 — «DN» клеточная популяция, составляющая 0,5% лейкоцитов в опухоли (Рисунок 6J), может содержать либо CD1c — . CD141 — мДК или CD14 — макрофагов (или оба). Стратегия стробирования для моноцитов и DC в PBMC показана на дополнительном рисунке 11. Процент DC в опухоли, по-видимому, не различается у пациентов с NSCLC с разными стадиями заболевания, за исключением, возможно, DC CD141 + , которые чаще встречаются на стадии I. по сравнению с НМРЛ II стадии, хотя значение p было погранично значимым ( p = 0.04) и потребуется подтверждение на более широкой когорте пациентов (дополнительный рисунок 12).
Рисунок 6 . Анализ проточной цитометрии макрофагов и ДК в опухолях НМРЛ. (A) FSC-A и SSC-A использовали для гейтирования ядерных клеток. (B) FSC-A и FSC-H использовали для блокировки одиночных клеток и исключения дублетов. (C) Живые лейкоциты были определены как CD45 + PI — . (E) Исключение CD19 + B-клеток. (D) Gate для ячеек HLA-DR + и CD11c + . (F) Макрофаги были определены как клетки CD14 + HLA-DR + . Экспрессия HLA-DR на макрофагах считалась высокой или низкой, как показано на графике. (G) Миелоидные DC были определены как CD11c + CD14 — . (H) Плазмацитоидные DC были определены как HLA-DR + CD123 + , а также (I) CD11c — и CD14 — . (J) Были идентифицированы два подмножества миелоидных DC: CD141 + DC и CD1c + DC. Также наблюдалась двойная отрицательная (DN) популяция. Процентное содержание клеточных популяций, показанное на рисунке, было рассчитано на основе общего количества живых лейкоцитов и представляет собой средние значения для 30 пациентов (16 аденокарцином, 13 плоскоклеточных карцином и одна крупноклеточная карцинома).
Процент макрофагов CD14 + HLA-DR + был ниже в опухоли (для аденокарциномы и всех пациентов с НМРЛ) по сравнению с дистальным отделом легкого (рисунки 7A – C).Не наблюдалось существенной разницы в процентном соотношении подмножеств DC (всех лейкоцитов CD45 + ) между опухолью и дистальным отделом легкого (дополнительная фигура 13). Однако дальнейший анализ данных показал, что относительная частота (в процентах от всех DC) может быть разной для разных тканей, причем pDC встречаются чаще, а CD1c + mDC реже встречаются в опухоли по сравнению с дистальной тканью легкого (дополнительные рисунки 14, 15). ). Мы также наблюдали снижение процента инфильтрирующих CD11c + HLA-DR + CD14 – CD141 – CD1c – «DN» клеток в опухоли по сравнению с дистальными отделами легкого при рассмотрении всех исследованных пациентов с НМРЛ (рисунки 7D– F).Кроме того, было обнаружено, что фракция макрофагов экспрессирует высокие уровни HLA-DR (рис. 6F), а уровни экспрессии HLA-DR оказались выше на макрофагах в опухоли, дистальном отделе легкого и лимфатическом узле по сравнению с моноцитами в PBMC ( Рисунок 8A). Фактически, некоторые моноциты в крови пациентов с НМРЛ имели очень низкую экспрессию HLA-DR или ее отсутствие (рис. 8A) и могут соответствовать ранее сообщенным CD14 + HLA-DR — / low популяции клеток-супрессоров миелоидного происхождения ( 41). Мы дополнительно проанализировали популяцию макрофагов, разделив клетки на клетки с высокой и низкой экспрессией HLA-DR (рис. 8A).Используя этот критерий, мы обнаружили, что фракция макрофагов HLA-DR high была больше в опухоли по сравнению с дистальным отделом легкого как при аденокарциноме, так и при плоскоклеточной карциноме (рис. 8B). Эти внутриопухолевые макрофаги HLA-DR с высоким уровнем могут потенциально представлять макрофаги, активированные интерфероном-γ (IFN-γ), с противоопухолевой активностью (42–46), поскольку было показано, что IFN-γ специфически индуцирует экспрессию HLA-DR на макрофагах (47). .
Рисунок 7 . Макрофаги и миелоидные клетки DN менее распространены в опухолях NSCLC, чем в дистальных отделах легкого. (A) Процент макрофагов / моноцитов у пациентов с аденокарциномой ( n = 18), (B) пациентов с плоскоклеточным раком ( n = 14) и (C) NSCLC ( n = 33). (D) Процент миелоидных клеток DN (предположительно DC и / или макрофагов) в аденокарциноме ( n = 16), (E) плоскоклеточной карциноме ( n = 13) и (F) НМРЛ ( n = 29). Клетки были закрыты, как показано на рисунке 6.Проценты рассчитывали от общего количества живых лейкоцитов (CD45 + PI — ). Каждый символ представляет данные одного пациента. Средние значения обозначены синими линиями. Статистические расчеты были выполнены с помощью непараметрического анализа Краскела-Уоллиса и пост-теста Данна, сравнивающего опухоль, дистальный отдел легкого и лимфатический узел (ЛУ).
Рисунок 8 . Макрофаги в опухолях NSCLC экспрессируют высокие уровни HLA-DR. (A) Макрофаги и моноциты были разделены на две популяции в зависимости от уровня экспрессии HLA-DR на поверхности: группы с высокой и с низкой экспрессией HLA-DR, как указано. (B) Процент макрофагов, экспрессирующих высокие уровни HLA-DR у пациентов с аденокарциномой ( n = 11) и плоскоклеточным раком ( n = 9). Клетки регистрировали, как показано на фиг. 6. Процентное содержание рассчитывали от общего числа макрофагов / моноцитов, определенных как клетки CD14 + HLA-DR + . Каждый символ представляет данные одного пациента. Средние значения обозначены синими линиями. Статистические расчеты были выполнены с помощью непараметрического анализа Краскела-Уоллиса и пост-теста Данна, сравнивающего опухоль, дистальный отдел легкого и лимфатический узел (ЛУ).
Опухоли аденокарциномы имеют пониженный процент NK-клеток
Для идентификации NK-клеток использовались ворота лимфоцитов (Рисунки 9A – D). CD19 + B-клетки и CD14 + макрофаги были исключены (Фигуры 9E, F). Остальные клетки были разделены на основе экспрессии CD3 и CD56 на CD3 + Т-клетки и CD3 — NK-клетки CD56 + (фигура 9G). Популяция двойных положительных клеток CD3 + CD56 + , наблюдаемая на фиг. 9G, может состоять либо из NK T-клеток, либо из обычных T-клеток, экспрессирующих маркер NK / NKT CD56 (48).Дополнительные маркеры потребуются, чтобы отличить NK T-клетки от обычных T-клеток, экспрессирующих CD56. CD3 — NK-клетки CD56 + были дополнительно исследованы на экспрессию CD16, определив два подмножества, NK-клетки CD16 + и CD16 —, соответственно (фигура 9H). Стратегия гейтирования для NK-клеток в PBMC показана на дополнительном рисунке 16. Общая популяция NK-клеток составляла 4,5% от живых лейкоцитов в опухоли. Процентное содержание CD16 — NK-клеток (2.2%) и NK-клетки CD16 + (2,3%) были аналогичными. Было обнаружено, что процент всех NK-клеток CD56 + ниже в опухоли (для аденокарциномы и для всех пациентов с НМРЛ) по сравнению с дистальным отделом легкого (Рисунки 10A – C). Это различие, по-видимому, в основном связано с уменьшением процента подмножества NK-клеток CD16 + в опухолевой ткани (Фигуры 10D – F). Напротив, процентное содержание NK-клеток CD16 – мало отличалось между тканями (Рисунки 10G – I). Таким образом, опухоли NSCLC содержат две популяции NK-клеток (CD16 + и CD16 — ), и процент NK-клеток в опухоли снижен по сравнению с доброкачественной тканью легких.
Рисунок 9 . Анализ проточной цитометрии NK-клеток в опухолях NSCLC. (A) График FSC-A и SSC-A использовали для идентификации ядерных клеток. (B) Отдельные клетки были закрыты, а дублеты исключены. (C) Живые лейкоциты были определены как клетки CD45 + PI — . (D) Ворота лимфоцитов были установлены на основе размера и гранулярности клеток. (E) CD19 + B-клетки были исключены. (F) CD14 + макрофагов были исключены. (G) NK-клетки были определены как CD3 — CD56 + . (H) Были идентифицированы два подмножества NK-клеток: NK-клетки CD16 + и CD16 —. Процентное соотношение всех популяций было рассчитано на основе общего количества живых лейкоцитов, и представлены средние значения для 19 пациентов (11 аденокарцином, 8 плоскоклеточных карцином).
Рисунок 10 . Процент NK-клеток ниже в опухолях NSCLC по сравнению с дистальным отделом легкого. (A – C) Процент всех CD56 + NK-клеток в различных тканях пациентов с диагнозом аденокарцинома (A) ( n = 11), (B) плоскоклеточный рак ( n = 8), и (C) NSCLC ( n = 19). (D – F) Процентное содержание CD56 + CD16 + NK-клеток в аденокарциноме (D) , плоскоклеточной карциноме (E) и NSCLC (F) . (G – I) Процентное содержание NK-клеток CD56 + CD16 – в аденокарциноме (G) , плоскоклеточной карциноме (H) и НМРЛ (I) .Стратегия стробирования представлена на рисунке 9. Каждый символ представляет данные одного пациента в процентах от всех живых лейкоцитов (CD45 + PI — ). Средние значения указаны для
Паразитарная пневмония и поражение легких
Паразитарные инвазии снизились за последнее десятилетие в результате улучшения гигиенических практик и улучшения социально-экономических условий. Тем не менее, глобальная иммиграция, увеличение числа людей с ослабленным иммунитетом, поездки за границу, глобальное потепление и быстрая урбанизация городов повысили восприимчивость населения мира к паразитарным заболеваниям.Ряд новых паразитов человека, таких как Plasmodium knowlesi , в дополнение ко многим потенциальным паразитам, вызвали интерес научного сообщества. Широкий спектр простейших паразитов часто поражает дыхательную систему, особенно легкие. Диагностика паразитарных заболеваний дыхательных путей является сложной задачей из-за большого разнообразия клинических и рентгенографических проявлений. Поэтому подробное изучение истории путешествий в эндемичные районы имеет решающее значение для клиницистов или пульмонологов в управлении этим объектом.Мигрирующие взрослые черви могут вызывать механическую обструкцию дыхательных путей, а личинки могут вызывать воспаление дыхательных путей. В этой статье представлен всесторонний обзор как протозойных, так и глистных инвазий, которые влияют на систему дыхательных путей, особенно легкие, включая клинические и рентгенографические представления, диагностические тесты и терапевтические подходы.
1. Введение
Протозойные и гельминтозные паразитарные пневмонии и поражение легких распространены в тропиках [1] за некоторыми исключениями; они чаще всего встречаются в западном мире и являются заболеваниями хозяев с ослабленным иммунитетом [2].В США Toxoplasma gondii пневмония чаще всего наблюдается у пациентов с синдромом приобретенного иммунодефицита (СПИД). Легочный стронгилоидоз выявляется у пациентов, получающих химиотерапию или лечение глюкокортикоидами, и является эндемическим для Юго-Востока США, тогда как заражение аскаридами и анкилостомами может проявляться эозинофилией и легочными инфильтратами на стадии миграции личинок [2]. Тем не менее, протозойные инвазии обычно не вызывают эозинофилию крови и тканей, за исключением глистных инвазий [1].В 1932 году Loffler описал первые четыре случая с минимальными респираторными симптомами, эозинофилией периферической крови и легочными инфильтратами на рентгенограммах грудной клетки [3]. Эозинофильные заболевания легких, которые особенно распространены в тропиках, часто связаны с паразитарными инвазиями [4], тогда как поражение легких Entamoeba histolytica , Paragonimus и Dirofilaria встречается реже [2].
2. Легочная малярия
Четыре типа малярийных паразитов: Plasmodium falciparum , Plasmodium malariae , Plasmodium vivax и Plasmodium ovale , а простейшие Plasmodium и Plasmodium 20 в первую очередь вызывают малярию рода Plasmodaria передается при укусе инфицированной самки комара Anopheles и заражает людей [5].Затем малярийные паразиты заражают гепатоциты человека в форме спорозоитов, шизонтов и мерозоитов соответственно [6]. Эта стадия называется «стадией печени человека», которая занимает приблизительно 4,5 дня для Plasmodium falciparum [6]. В случае заражения Plasmodium vivax , одна из двух форм ( Plasmodium vivax и Plasmodium ovale ) рецидивирующей малярии для заражения людей, которая наиболее распространена в Юго-Восточной Азии и Южной Америке, может переходить в состояние покоя. в печени («гипнозоит») и может реактивироваться через несколько месяцев или лет, способствуя приступу малярии на внутриэритроцитарной стадии, несмотря на отсутствие укусов комаров [6, 7].Затем мерозоиты вырываются из гепатоцитов и снова инфицируют эритроциты человека в форме кольца, трофозоитов, шизонтов и мерозоитов [6]. Этот цикл занимает приблизительно 43–48 часов для Plasmodium falciparum , и этот цикл может вызвать клинические симптомы [6]. В другом цикле форма внутриэритроцитарного кольца трансформируется в интраэритроцитарный гаметоцит перед тем, как заразить комара [6]. Эта стадия занимает приблизительно 9 дней для Plasmodium falciparum [6].Стадия печени человека и стадия интраэритроцита человека относятся к асексуальным стадиям [6]. После поглощения комарами крови человека, инфицированной малярией (интраэритроцитарные гаметоциты), гаметоцит трансформируется в микрогаметоцит и микрогаметоцит, что занимает примерно 15 минут, а затем превращается в диплоидную зиготу за один час в течение Plasmodium falciparum , соответственно, в средней кишке комара [6 ]. Затем диплоидная зигота превращается в оокинет примерно за 12–36 часов для Plasmodium falciparum , прежде чем превратиться в ооцисты и спорозоиты в слюнной железе комара перед передачей спорозоита человеку при укусе комара [6].Стадия паразита малярии у комара называется «стадия комара или половая стадия» [6]. В большинстве случаев инкубационный период составляет от 7 до 30 дней [7]. Более короткие периоды инкубации продемонстрированы у Plasmodium falciparum , а более длинные — у Plasmodium malariae [7]. Возвращающиеся путешественники должны напоминать своим медицинским работникам о любых поездках в районы, где наблюдается малярия, в течение последних 12 месяцев [7]. Основным результатом у пациентов с малярией falciparum, которая является наиболее смертоносным типом малярийной инфекции, является секвестрация эритроцитов, содержащих зрелые формы Plasmodium falciparum в микрососудистом русле органов, и количественно оценивается путем измерения Plasmodium falciparum специфического белка, богатого гистидином. 2 (PfHRP2) с использованием количественного иммуноферментного анализа с захватом антигена [8].Газообмен значительно нарушен у пациентов с тяжелой формой малярии [9].
У пациентов с неосложненной малярией классический (но редко наблюдаемый) приступ малярии длится 6–10 часов, который состоит из стадии холода (ощущение холода, дрожь), горячей стадии (лихорадка, головные боли, рвота и судороги у молодых людей). дети) и стадии потоотделения (потливость, нормализация температуры, усталость) [7]. Как правило, приступы паразитов «tertian» малярии ( Plasmodium falciparum , Plasmodium vivax, и Plasmodium ovale ) происходят через день, а паразиты «quartan» — каждые 3 дня ( Plasmodium malariae ) [ 7].Чаще у пациентов наблюдается сочетание следующих симптомов: общее недомогание, лихорадка, озноб, головные боли, ломота в теле, тошнота и рвота [7]. Физикальные признаки могут включать повышение температуры тела, слабость, потоотделение, учащенное дыхание, легкую желтуху, увеличение печени и увеличение селезенки [7]. У пациентов с тяжелой формой малярии клинические проявления включают церебральную малярию (ненормальное поведение, нарушение сознания, судороги, кому или другие неврологические нарушения), тяжелую анемию из-за гемолиза, гемоглобинурию из-за гемолиза, нарушение свертываемости крови, низкое кровяное давление, острый почечная недостаточность, гиперпаразитемия (больше, чем эритроцитов, инфицированных малярийными паразитами, гипогликемия, метаболический ацидоз и острый респираторный дистресс-синдром) [7].Рецидивирующие инфекции, вызванные Plasmodium falciparum , могут привести к тяжелой анемии [7]. Нефротический синдром может быть результатом повторных инфекций, вызванных Plasmodium malariae [7]. Гиперреактивная малярийная спленомегалия (или называемая «синдромом тропической спленомегалии») характеризуется значительным увеличением селезенки и печени, анемией, аномальными иммунологическими показателями и восприимчивостью к другим инфекциям и объясняется аномальным иммунным ответом на повторные малярийные инфекции [7]. Plasmodium falciparum может вызвать более тяжелое заболевание у матери и может привести к преждевременным родам или рождению ребенка с низкой массой тела [7].Неврологические дефекты могут иногда сохраняться после церебральной малярии, особенно у детей [7]. В редких случаях Plasmodium vivax может вызвать разрыв селезенки [7]. Наиболее частыми проявлениями малярии falciparum в исследовании были лихорадка, за которой следовали желтуха, поражение почек, церебральная малярия, тяжелая анемия, проявления кровотечения и гипогликемия [10]. Золотым стандартом диагностики малярии является исследование под световым микроскопом тонких и толстых окрашенных мазков крови [1, 11].Дополнительные лабораторные данные могут включать легкую анемию, легкую тромбоцитопению, повышение уровня аминотрансферазы и повышение уровня билирубина в сыворотке [7]. Введена ПЦР-детекция Plasmodium falciparum в моче и слюне человека [11]. При тяжелой форме малярии, вызванной falciparum, рентгенографические проявления включают диффузный интерстициальный отек, отек легких, плевральный выпот и дольчатую консолидацию [11]. Sanklecha et al. сообщили о трех случаях детской малярии falciparum в семье и выявили, что в двух случаях наблюдались двусторонние пушистые легочные инфильтраты, тогда как в оставшемся случае рентгенограмма грудной клетки была нормальной [12].Рентгенограммы грудной клетки в трех случаях малярии с серповидноклеточной анемией также показали, что у всех зарегистрированных пациентов наблюдались двусторонние легочные инфильтраты [13]. Рентгенограммы грудной клетки обычно неспецифичны, но их следует распознавать в высокоэндемичных по малярии районах [13]. Рентгенограмма грудной клетки пациента с малярией Plasmodium vivax показала диффузное двустороннее помутнение альвеол, что указывало на острый респираторный дистресс-синдром [14]. Три случая ОРДС с малярией Plasmodium vivax также были зарегистрированы в Индии, и один случай был продемонстрирован с двусторонними перихилярными инфильтратами, один случай с двусторонними диффузными обширными помутнениями и еще один случай с двусторонними базальными помутнениями матового стекла на рентгенограммах грудной клетки [15].Отек легких — универсальная находка при вскрытии [16]. Альвеолы заполнены паразитарными эритроцитами, непаразитарными эритроцитами, нейтрофилами и макрофагами, насыщенными пигментом [16]. Во многих тяжелых случаях альвеолы выстланы ламинированной периодической кислотно-шиффовой (PAS) положительной мембраной, которая в конечном итоге разрушает и встраивает в себя альвеолярную стенку [16]. Это связано с обильным отеком жидкости и расширением сосудов легких и может иметь выраженный воспалительный инфильтрат [16]. В альвеолах образуется гиалиновая мембрана, что указывает на утечку белковой жидкости, особенно при малярии falciparum [16].Большинство кровеносных сосудов показало секвестрацию эритроцитов паразита в капиллярах перегородки и мелких кровеносных сосудах в легких в тяжелых случаях [17]. Макрофаги, насыщенные пигментом мононуклеарных клеток, были замечены в смеси с паразитическими эритроцитами в микрососудах альвеолярных перегородок [17]. Окклюзия легочных сосудов может возникать как у пациентов с неосложненной малярией, так и у пациентов с тяжелой малярией [9]. Недавнее исследование продемонстрировало, что активация рецептора фактора активации тромбоцитов имеет решающее значение в патогенезе легочного повреждения, связанного с инфекцией штамма Plasmodium berghei ANKA на модели мышей [18].Около 60% этих инфицированных мышей имели гипоксемию, одышку, плевральный выпот, обструкцию дыхательных путей, отек легких и легочное кровотечение [18]. О патогенезе острого повреждения легких, связанного с малярией, и респираторного дистресс-синдрома (ОРДС) у взрослых мало известно [19]. Повышенная проницаемость эндотелия и медиаторы воспаления могут играть важную роль, тогда как секвестрация паразитов может играть второстепенную роль, что поддерживается повышением уровня фактора роста сосудистого эндотелия, обнаруженного на модели мышей [19].В исследованиях in vitro , мерозоитные белки Plasmodium falciparum могли увеличивать проницаемость эндотелия легких, тогда как инфицированные эритроциты Plasmodium falciparum не демонстрировали те же свойства, что указывает на то, что воздействие малярийных паразитов на эндотелий легких, вероятно, опосредовано активность киназ Src-семейства [19]. Было обнаружено повышенное содержание воды в легких инфицированных мышей, которое способствовало развитию отека легких [19].Исследование на мышах DBA2, инфицированных Plasmodium berghei K173, показало, что в легких инфицированных мышей накапливаются белки и воспалительные клетки, в основном CD4 + и CD8 + лимфоциты, моноциты и нейтрофилы [19]. Van den Steen et al. измерили уровни цитокинов и хемокинов, связанных с ОРДС, и продемонстрировали экспрессию фактора некроза опухоли- α , интерферона-, γ , CXCL10 и CXCL11, а также хемокинов хемоаттрактанта нейтрофилов и моноцитов (CCL2, KC) в легкие [19].Легочные проявления неосложненной малярии могут включать субклинические нарушения функции легких, такие как нарушение альвеолярной вентиляции, снижение газообмена и повышенная фагоцитарная активность легких [19]. Несмотря на то, что ОРДС чаще всего идентифицируется как осложнение у пациентов с малярией Plasmodium falciparum , также сообщалось о пациентах с ОРДС с Plasmodium vivax , Plasmodium ovale и Plasmodium knowlesi [19]. Наибольшая тяжесть и частота ОРДС в случаях малярии связаны с Plasmodium falciparum и могут частично объясняться восстановлением и секвестрацией инфицированных паразитами эритроцитов в легочной микроциркуляции [19].Тяжелая паразитемия и агглютинаты белых кровяных телец связаны с ОРДС у пациентов с малярией Plasmodium vivax и, в основном, могут быть следствием нарушения регуляции продукции цитокинов [19]. Повышенная паразитемия у пациентов, инфицированных Plasmodium knowlesi указывает на то, что паразитоспецифические эффекты увеличивают проницаемость легочных капилляров, но могут способствовать гипоксемии и метаболическому ацидозу [19]. Внутривенный хлорохин является препаратом выбора для чувствительных к хлорохину инфекций Plasmodium falciparum и редких случаев опасной для жизни малярии, вызванной Plasmodium vivax , Plasmodium malariae и Plasmodium ovale [1, Plasmodium ovale ].Точечная мутация в гене переносчика устойчивости к хлорохину (PfCRT) Plasmodium falciparum ответственна за устойчивую к хлорохину малярию falciparum [20], тогда как исчезновение мутации K76T в PfCRT связано с восприимчивостью к хлорохину [21]. Комбинированная пероральная терапия на основе артемизинина (артесунат + мефлохин, артесунат + сульфадоксин-пириметамин, артесунат + амодиахин или артеметер + люмефантрин) являются лучшими противомалярийными препаратами [22, 23]. Кроме того, Всемирная организация здравоохранения (ВОЗ) рекомендует пероральное лечение дигидроартемизинином плюс пиперахин, как только пациенты смогут принимать пероральные препараты, но не ранее, чем через 24 часа парентерального лечения [24].ВОЗ рекомендовала, чтобы внутривенный артесунат использовался преимущественно перед хинином для лечения тяжелой малярии, вызываемой любыми видами Plasmodium , как у детей, так и у взрослых [25]. Комбинированная пероральная терапия на основе артемизинина также продемонстрировала эквивалентную (если не лучшую) эффективность в лечении неосложненной малярии, вызываемой всеми видами Plasmodium и устойчивым к хлорохину Plasmodium vivax как у детей, так и у взрослых [25]. Следовательно, традиционные терапевтические схемы продолжают оставаться эффективными [25].Лечение рецидива малярии следует проводить после лечения первого приступа [7]. Доказано, что обработанные инсектицидом надкроватные сетки, в которых инсектицид включен в сеточные волокна, являются лучшим способом предотвращения малярии [26]. Показано, что вакцина RTS, S / ASO2, продемонстрировала многообещающие результаты в эндемичных регионах [26]. Дексаметазон может быть включен в дополнительную химиотерапию с противовоспалительными препаратами из-за ингибирования инфильтрации CD8 + Т-клеток и макрофагов в легкие на модели ОРДС, связанной с малярией на грызунах [19].
3. Легочный амебиаз
Entamoeba histolytica , хорошо известная патогенная амеба, связана как с кишечными, так и с внекишечными инфекциями [27]. И цисты, и трофозоиты передаются с фекалиями человека [27]. Кисты обычно обнаруживаются в стуле, тогда как трофозоиты обычно обнаруживаются в стуле при диарее [27]. Люди заражаются при попадании зрелых кист с фекально-загрязненной пищей, водой или руками [27]. Эксцистанция происходит в тонкой кишке, и трофозоиты высвобождаются, которые мигрируют в толстую кишку [27].Трофозоиты размножаются путем бинарного деления и образуют цисты, и обе стадии проходят с фекалиями [27]. Благодаря защите, обеспечиваемой их стенками, цисты могут выживать от нескольких дней до недель во внешней среде и имеют потенциал передачи [27]. Напротив, трофозоиты, попавшие с диарейным стулом, быстро разрушаются после выхода из организма, и при попадании в организм они не выживают при воздействии среды желудка [27]. Удивительно, но у многих пациентов трофозоиты остаются ограниченными просветом кишечника (неинвазивная инфекция) лиц, которые являются бессимптомными носителями и выделяют кисты в стуле [27].В некоторых случаях трофозоиты проникают в слизистую оболочку кишечника (кишечное заболевание) или кровоток, внекишечные участки, такие как печень, легкие и мозг, что приводит к амебиазу печени, амебиазу легких, амебиазу головного мозга и т. Д. [27]. Легочный амебиаз, вызываемый простейшим паразитом, Entamoeba histolytica , возникает в основном за счет распространения амебного абсцесса печени [28, 29]. Установлены инвазивные и неинвазивные формы: Entamoeba histolytica и Entamoeba dispar соответственно [27]. Entamoeba histolytica идентифицируется с проглоченными эритроцитами (эритрофагоцитоз) [27]. Передача цист или трофозоитов может происходить через контакт с фекалиями во время полового контакта [27]. Иммунный механизм, который объясняет, почему только у подгруппы людей, подвергшихся воздействию Entamoeba histolytica , развивается клиническое заболевание, до конца не изучен [30]. Влияние микробиоты на иммунный ответ на Entamoeba histolytica и его вирулентность пока не известны [30].Присутствие цист или трофозоитов амебы в стуле не означает, что болезнь вызвана Entamoeba histolytica , поскольку два других непатогенных вида, обнаруженных у человека ( Entamoeba dispar и Entamoeba moshkovskii ), морфологически неотличимы, но не различимы. Быстро, точно и эффективно диагностировать с помощью однократной ПЦР [1, 31, 32]. Другие методы диагностики включают культивирование Entamoeba histolytica , иммуноферментный анализ (ELISA), непрямой флуоресцентный тест на антитела (IFAT) и тест непрямой гемагглютинации (IHA) [1, 31, 32].Комбинация серологических тестов с идентификацией паразита с помощью ПЦР или обнаружения антигена — лучший диагностический подход [33]. Активные трофозоиты Entamoeba histolytica можно идентифицировать в мокроте или образце плевры [1]. Физикальное обследование выявляет лихорадку, боль в груди, болезненную гепатомегалию и кашель, а также указывает на плевролегочный амебиаз [1]. У некоторых пациентов может наблюдаться кровохарканье, отхаркивание гноя, напоминающее соус из анчоусов, респираторный дистресс и шок [1]. Рентгенографические данные включают плевральный выпот, базальное поражение легких и подъем гемидиафрагмы [1].Метронидазол — препарат выбора [34]. Дилоксанид фуроат, просветный амебицидный препарат, может устранить кишечные кисты Entamoeba [35]. Лактоферрин и лактоферрицины, амебицидные препараты, можно назначать одновременно с низкой дозой метронидазола для снижения токсичности метронидазола [35]. Идентификация возможных вакцин-кандидатов против амебиаза находится в стадии прогрессирующих исследований [36].
4. Легочный лейшманиоз
Легочный или висцеральный лейшманиоз, также называемый «кала азар», вызывается Leishmania donovani и Leishmania chagasi или infantum [37], передается различными видами Phlebotom песчаной мухи [38]. Amastigotes Leishmania можно идентифицировать в легочных перегородках, альвеолах и ЖБАЛ [39, 40]. Плевральный выпот, лимфаденопатия средостения и пневмонит были зарегистрированы у ВИЧ-инфицированных пациентов с висцеральным лейшманиозом и пациентов с трансплантацией легких [39, 40]. Распространение эпидемии ВИЧ-инфекции / СПИДа на лейшманиоз, особенно в эндемичных по висцеральному лейшманиозу регионах, увеличило число пациентов с коинфекцией [41], что указывает на то, что висцеральный лейшманиоз является оппортунистическим заболеванием у ВИЧ-инфицированных / больных СПИДом, хотя еще не считается СПИД -определяющее заболевание [42].Согласно общему иммунному компромиссу механизмов обеих инфекций с Leishmania infantum и ВИЧ-1, которые могут влиять на контроль паразитов у пациентов с коинфекцией висцерального лейшманиоза [42]. По сравнению с пациентами, страдающими только висцеральным лейшманиозом, пациенты с коинфекцией представляют собой более тяжелое заболевание с повышенным количеством паразитов, частыми рецидивами и устойчивостью к антилейшманиозным препаратам [41, 43]. С другой стороны, инфекция Leishmania может нарушать как хроническую активацию иммунной системы, так и истощение лимфоцитов, а также ускорять прогрессирование СПИДа, особенно у ВИЧ-1-инфицированных лиц [44, 45].Следовательно, серологические тесты на латентную инфекцию, вызванную видами Leishmania , показаны в предтрансплантационном скрининге из эндемичных районов [46]. Активация иммунной системы может существенно повлиять на клиническое течение и прогноз висцерального лейшманиоза, приводя к увеличению риска смерти даже при лечении лейшманиоза [47]. Пятивалентная сурьма; пентамидин; и амфотерицин B, особенно липосомальные композиции; и милтефозин являются лекарствами для лечения лейшманиоза [48].Предыдущее исследование продемонстрировало, что вакцина Poly / hsp / pcDNA может значительно снизить количество паразитов в селезенке и печени, что указывает на осуществимый, эффективный и практичный подход к висцеральному лейшманиозу [49].
5. Легочный трипаносомоз
Африканский трипаносомоз человека (HAT) или сонная болезнь вызывается внеклеточным простейшим паразитом, называемым « Trypanosoma brucei gambiense » [50], « Trypanosoma brucei rhodesie » [51] Trypanosoma cruzi », который был открыт Карлосом Шагасом в 1909 году [52] и является эндемичным для Западной и Центральной Африки, в основном в Демократической Республике Конго, Анголе, Чаде, Центральноафриканской Республике, Уганде и Судане [50].HAT продолжает угрожать более 60 миллионам человек в 36 странах к югу от Сахары [50, 53]. В модели на мышах выявляются гиперцеллюлярность и отек альвеолярных стенок, примерно в 10 раз толще нормальной альвеолярной стенки, что приводит к утолщению стенок, хотя паразиты в альвеолах не обнаруживаются [52]. Наблюдались утолщение и отек бронхиальных стенок малых и средних бронхов из-за инфильтрации паразитов и выраженной воспалительной реакции (за исключением больших бронхов) на модели мышей [52].Эти воспалительные изменения бронхов приводят к уменьшению просвета бронхов [52]. У большинства инфицированных мышей наблюдается инфильтрация стенок крупных кровеносных сосудов обширными скоплениями паразитов в миоцитах мышечного слоя, сопровождающаяся воспалительной реакцией, интерстициальным отеком и разрывом мышечных волокон [52]. Эти патологические изменения в легких могут способствовать легочному альвеолярному кровотечению, бронхиолиту и пневмониту [52]. Эмфизема легких наблюдалась также в легких инфицированных крыс [54].Статистический анализ показал, что разница между экспериментальными группами в распределении легочных паразитов и степени воспалительной реакции не показала статистической разницы [52]. Большинство мексиканских штаммов демонстрируют кардиомиотропизм [52] и могут вызывать легочную гипертензию, которая может приводить к расширению правого желудочка, что является типичной характеристикой болезни Шагаса, вызываемой Trypanosoma cruzi , не затрагивая левый желудочек [52]. Однако многие случаи болезни Шагаса с легочной гипертензией, связанной с дилатацией правого желудочка, могут быть связаны с недостаточностью левого желудочка [55].Предыдущее исследование лечения рецидивирующего трипаносомоза среди населения Гамбии показало, что 7-дневный курс внутривенного введения эфлорнитина был удовлетворительным и привел к значительной экономии средств по сравнению со стандартным 14-дневным режимом, хотя предыдущий режим был хуже стандартного и мог быть более эффективным. используется национальными программами контроля в эндемичных районах при условии тщательного мониторинга его эффективности, тогда как меларсопрол остается единственным эффективным терапевтическим методом для новых случаев [56].В экспериментальных исследованиях на животных эфлорнитин и меларсопрол синергетически действуют против трипаносом, поскольку первый препарат снижает выработку трипанотиона, мишени второго препарата [8, 57]. Недавнее исследование продемонстрировало, что окислительный стресс может способствовать сохранению паразитов в тканях хозяина и разработке препаратов против Trypanosoma cruzi [58].
6. Легочные личиночные мигранты
Toxocara larval migrans, вызванные Toxocara canis , паразитом в кишечнике собак, и Toxocara cati , паразитом в кишечнике кошек, инфицированным промежуточным хозяином, людьми, при приеме внутрь эти зародыши яиц Toxocara , которые вылупляются в инфекционные личинки в кишечнике человека [1].Затем инфекционные личинки проникают в стенку кишечника и переносятся кровообращением во многие органы, включая легкие, печень, центральную нервную систему, глаза и мышцы [1]. Затем в этих органах появляются гранулемы, а затем развиваются фиброз и кальцификация [1]. Легочные проявления обнаруживаются у 80% пациентов с тяжелой астмой [1]. Клинические проявления могут демонстрировать рассеянные хрипы и хрипы при аускультации, включая лихорадку, кашель, гепатоспленомегалию, генерализованное увеличение лимфатических узлов, боль в глазах, косоглазие, белый зрачок, одностороннюю потерю зрения, боль в животе и неврологические проявления [1].Некоторые случаи могут проявляться тяжелой эозинофильной пневмонией и могут способствовать развитию респираторного дистресс-синдрома [59–61]. Рентгенограмма грудной клетки может показать локализованные очаговые инфильтраты [1]. Этот синдром обычно связан с эозинофилией, повышенными титрами антител к Toxocara Canis и повышенным уровнем общего сывороточного IgE [62, 63]. Около 25% пациентов детского возраста не имеют эозинофилии [64]. Сообщалось об идентификации сывороточных IgE-антител с помощью ELISA [65] и выделения экскреторно-секреторных антигенов Toxocara методом вестерн-блоттинга для диагностики [66].Тем не менее, серодиагностические методы не позволяют различить прошлые и текущие инфекции [65, 66]. Яйца или личинки Toxocara не могут быть идентифицированы в кале, поскольку человек не является окончательным хозяином [1]. Гистопатологическое исследование образцов биопсии легких или печени может выявить гранулемы с многоядерными гигантскими клетками, эозинофилы и фиброз [1]. Toxocara migrans личинок может быть спонтанным разрешением; Таким образом, пациенты с легкими и умеренными симптомами не нуждаются в лечении [1].Однако пациентов с тяжелой формой личиночной миграции Toxocara можно лечить диэтилкарбамазином (6 мг / кг / день, 21 день) [67], мебендазолом (20-25 мг / кг / день, 21 день) [68] или альбендазолом. (10 мг / кг / сут, 5 дней) [69]. Может произойти обострение воспалительных реакций в тканях из-за гибели личинок; поэтому рекомендуется применение антигельминтных средств и кортикостероидов [1].
7. Легочный токсоплазмоз
Клеточный простейший паразит, называемый « Toxoplasma gondii », который в основном переносится кошками, является причинным микроорганизмом [70].Люди заражаются при употреблении в пищу сырых молочных продуктов, овощей или мяса, зараженных паразитарными цистами [1]. Клиническими проявлениями являются гриппоподобное заболевание, миалгия или увеличение лимфатических узлов [1], что является наиболее частым признанным клиническим проявлением [71]. Все чаще сообщается о поражении легких у ВИЧ-инфицированных / больных СПИДом [1]. Легочные проявления могут быть интерстициальной пневмонией, диффузным поражением альвеол или некротической пневмонией [72]. Тем не менее, обструктивная или крупозная пневмония была зарегистрирована у 49-летнего испанского гетеросексуального мужчины [71].Ранняя беременность с токсоплазмозом может вызвать гибель плода, хориоретинит и неврологические симптомы у новорожденного, тогда как хроническое заболевание может вызвать хориоретинит, желтуху, судороги и энцефалит [1]. Диагностика токсоплазмоза основана на обнаружении в тканях организма простейших паразитов [1]. Исследование мокроты использовалось в диагностике легочного или диссеминированного токсоплазмоза у 14-летнего реципиента аллогенного костного мозга с реакцией «трансплантат против хозяина» путем выявления тахизоитов Toxoplasma gondii в мазках мокроты [73].Серодиагностика не позволяет различить активную и хроническую инфекцию Toxoplasma gondii из-за способности повышать уровни антител без активного заболевания [1]. Анализ жидкости БАЛ на основе ПЦР в реальном времени был проведен у ВИЧ-инфицированных / больных СПИДом [74]. Токсоплазмоз можно лечить комбинированной схемой приема пириметамина и сульфадиазина [1].
8. Легочный бабезиоз
Заболевание вызывается гемопротозойными паразитами, Babesia divergens и Babesia microti [75].Люди заражаются при укусе инфицированного клеща Ixodes scapularis или при переливании зараженной крови [76]. Паразиты могут атаковать красные кровяные тельца и могут способствовать неправильной диагностике Plasmodium [76]. Симптомы включают жар, головную боль, потерю аппетита, миалгию, усталость и сильный пот [77]. Пациенты с бабезиозом часто осложняются некардиогенным диффузно-двусторонне-интерстициальным отеком легких и респираторным дистресс-синдромом взрослых [78].Исследование мазка тонкой крови с окрашиванием по Гимзе, определение специфических антител и метод ПЦР являются специфической диагностикой легочного бабезиоза [75]. Лечение выбора — комбинация клиндамицина (600 мг каждые 6 часов) и хинина (650 мг каждые 8 часов) или атоваквона (750 мг каждые 12 часов) и азитромицина (500-600 мг в первый день и 250-600 мг в последующие дни). дней) на 7–10 дней [79, 80].
9. Филяриальные паразиты, ассоциированные с тропической легочной эозинофилией
Этот синдром возникает в результате иммунологической гиперчувствительности к человеческим филяриатным паразитам, Wuchereria bancrofti и Brugia malayi [81].Тропическая легочная эозинофилия (ТПЭ) является одной из основных причин легочной эозинофилии в тропических странах и широко распространена в эндемичных по филяриям регионах мира, особенно в Юго-Восточной Азии [81, 82]. Клинические данные включают кашель, лихорадку, боль в груди и потерю массы тела в сочетании с массивной эозинофилией крови [83]. Рентгенограммы грудной клетки демонстрируют военные инфильтраты обоих легких, имитирующие милиарный туберкулез или немилиарные инфильтраты [84]. Кроме того, могут быть выступающие хилы с обильными сосудистыми отметинами [85–88], но в 20% случаев обнаруживаются нормальные рентгенограммы грудной клетки [89].Некоторые предыдущие исследования компьютерной томографии грудной клетки продемонстрировали наличие воздушной ловушки, лимфаденопатию средостения, кальциноз и бронхоэктазы [90]. По крайней мере, 120 миллионов человек во всем мире инфицированы лимфатическим филяриозом, передаваемым комарами [89], но только менее 1% филяриозной инфекции вызывает ТПЭ [91], тогда как различные исследования показали, что филяриатная инфекция является причиной ТПЭ [81, 92] ]. Положительная немедленная реакция на внутрикожные кожные пробы с антигенами Dirofilaria immitis была продемонстрирована у пациентов с ТПЭ [93].Микрофилярии, анатомические особенности Wuchereria bancrofti , были продемонстрированы в легких, печени и лимфатических узлах пациентов с ТПЭ [94–96], но редко обнаруживаются в крови [94]. При ТПЭ наблюдалось повышение концентрации специфичных к филяриям IgG и IgE [97]. Периферические базофилы пациентов с TPE высвобождали большее количество гистамина при заражении антигенами Wuchereria или Brugia , чем антигеном Dirofilaria [97].Это указывает на то, что TPE является результатом иммунологической гиперчувствительности к человеческим филяриатным паразитам [97]. Феномен адгезии лейкоцитов в сыворотках от пациентов с ТПЭ с использованием Wuchereria bancrofti показал максимальные положительные результаты по сравнению с Dirofilaria immitis и Dirofilaria repens [98]. Демонстрация живой взрослой особи Wuchereria bancrofti в лимфатических сосудах семенного канатика пациентов с ТПЭ подтверждается ультразвуковым исследованием [99] и биопсией шишки в семенном канатике, выявляющей дегенерирующую взрослую женскую филяриальную червь с маткой, полной микрофилярий [99]. 100].После 6–14 дней терапии диэтилкарбамазин цитратом (ДЭК) наблюдается заметное снижение уровней специфичных для филярий IgG и IgE в жидкости эпителиальной выстилки легких [101] и улучшение рентгенологического состояния [102, 103]. Стандартным лечением, рекомендованным Всемирной организацией здравоохранения, является пероральный прием ДЭК (6 мг / кг / день) в течение трех недель [104]. Полезность DEC в лечении TPE дополнительно акцентирует внимание на его филяриальной этиологии [105, 106].
10. Легочный дирофиляриоз
Легочный дирофиляриоз человека, заболевание взрослых людей среднего возраста [107], вызывается в основном незрелыми филяриозными нематодами Dirofilaria immitis [108–112] Другие виды, Dirofilaria repens и tenuis , как известно, инфицируют людей [113].Эти организмы, а именно собачий червь [1], обычно передаются от домашних собак или других плотоядных животных (лиса, волк, кошка, выдра, ондатра, койот, шакал и морской лев) [113–115] человеку (случайный хозяин) [114] инфицированными комарами ( Aedes , Culex или Anopheles ) [116], с распространением в Азии, Австралии, Южной Европе, а также в Северной и Южной Америке [114]. Чаще всего заболевание обнаруживается на периферии легких, особенно в правой нижней доле [113, 117, 118].Поражение легкого может представлять собой узелок в виде одиночной монеты или множественные узелки, обычно размером менее 3 см [109], как отмечено на рентгенограмме грудной клетки [1, 114]. Патологически поражение легкого проявляется как сферический инфаркт с центром обструктивной артерии [113]. Клинические проявления могут включать лихорадку, озноб, боль в груди, кровохарканье и недомогание [1, 119–121]. По крайней мере, у 50% пациентов симптомы отсутствуют [1, 113, 122]. Только у 17% обследованных пациентов в японской серии была выявлена эозинофилия [122].Серологические тесты, цитологический анализ мокроты, промывание бронхов и трансторакальная пункционная биопсия обеспечивают низкую специфичность для точного диагноза [123]. Окончательный гистопатологический диагноз может быть поставлен с помощью клиновидной биопсии образцов ткани с помощью методов видеоторакоскопии [122] и полимеразной цепной реакции (ПЦР) [124, 125]. Клиновидная резекция легочного узла обычно излечивает без специальной медикаментозной терапии [126]. Некоторые предложения указывают на использование ивермектина с ДЭК или без него для лечения легочного дирофиляриоза, но эти предложения не получили широкого признания [127].
11. Легочный стронгилоидоз
Сообщалось об очень небольшом количестве паразитарных заболеваний, вызывающих пневмонию у ВИЧ-инфицированных / больных СПИДом [128]. Гельминт Strongyloides stercoralis , который обычно встречается во многих тропических и субтропических регионах, иногда упоминается как причина легочной болезни [128]. Распространенность этого гельминта в образцах стула варьируется от региона к региону следующим образом: 26–48% в Африке к югу от Сахары, 15–82% в Бразилии, 1–16% в Эквадоре и 4–40% в США [129 ].Хотя распространенность инфекции Strongyloides в Юго-Восточной Азии высока, в англоязычной литературе о случаях заболевания не сообщалось [128]. Сообщается относительно немного случаев заражения гельминтами у больных СПИДом в тропиках, несмотря на его высокую распространенность [128]. В предыдущем исследовании, проведенном в Бразилии, 10% из 100 пациентов со СПИДом были инфицированы Strongyloides sterco
Некоторые патологические особенности легких домашних и диких жвачных животных с одиночными и смешанными инфекциями протостронгилидов
Легкие 40 жвачных животных из Болгарии с естественным мелким легочным червем (Nematoda: Protostrongylidae) были исследованы инфекции, в том числе 16 коз, 15 овец, 7 муфлонов и 2 серны. Muellerius capillaris, M. tenuispiculatus, Cystocaulus ocreatus, Neostrongylus linearis, и Protostrongylus brevispiculum Инфекции преимущественно ассоциировались с узловыми поражениями, а Protostrongylus rufescens, Protostrongylus и обширные поражения были связаны с обширными 9011e длина больших бронхов. Степень патологии легких была наиболее серьезной у овец. При исследовании под микроскопом были обнаружены альвеолит, паразитарные гранулемы, повреждение альвеолярных перегородок, гиперплазия лимфоидной ткани, связанной с легкими, и склероз паренхимы.У коз по сравнению с овцами и муфлонами концевые бронхи, бронхиолы и альвеолы были поражены сильнее, чем интерстиций. Наши исследования показывают, что патологические поражения в легких у жвачных, инфицированных протостронгилидами, зависят как от гельминтов, так и от вида хозяина. Насколько нам известно, эта работа является первой, в которой представлены данные о патоморфологических поражениях легких муфлонов, инфицированных протостронгилидами.
1. Введение
Протостронгилидозы — широко распространенные гельминтозы у домашних и диких жвачных животных, вызывающие серьезные проблемы со здоровьем во многих странах во всем мире.Их этиологическими агентами являются так называемые мелкие легочные черви (Nematoda: Protostrongylidae). Эти инфекции в основном связаны с респираторными нарушениями [1, 2], развитием очаговой пневмонии [3, 4] и вторичными бактериальными инфекциями легких [5–7]. Потеря веса, более низкая продуктивность животных, снижение количества потомства, абортов или неонатальных смертей и повышение смертности [3, 8–11] также связаны со многими протостронгилидозами. Патологические особенности этих недугов были подробно изучены, но полученные данные показывают, что внутри поражений могут быть обнаружены различные виды воспалительных реакций.Поэтому, исходя из того факта, что типы повреждения легких, вызываемые протостронгилидами, многочисленны и различаются по степени тяжести и степени в различных исследованиях [8, 12–19], целью настоящего исследования был анализ наиболее частых патологических поражений в легкие коз, овец, муфлонов и серны из Болгарии отнесены к разным видам протостронгилидов, чтобы получить более подробную характеристику конкретных паразитарных инфекций у разных хозяев.
2. Материалы и методы
Легкие сорока жвачных животных из разных регионов Болгарии, в том числе 16 коз ( Capra aegagrus f.Domestica L.), 15 овец ( Ovis Ammon f. domestica L.), 7 муфлонов ( Ovis musimon L.) и 2 серны ( Rupicapra rupicapra L.). Легкие домашних жвачных были собраны во время стандартного патологоанатомического исследования на нескольких бойнях в Велико Тырново и Софийской области. Информация о возрасте животных была получена владельцами стад. Легкие диких жвачных были получены в результате выборочной охоты на животных, обитающих в заповедниках Добричской и Смолянской областей.Все процедуры были одобрены Комитетом по этике Института экспериментальной патологии и паразитологии и соответствовали требованиям Постановления № 22 / 14.12.2005 о сокращении до минимума страданий животных во время убоя или умерщвления (обнародовано в ИК 22 от 14 декабря 2005 г.). 2005 и транспонирующую Директиву 93/119 / EC о защите животных во время убоя или умерщвления) и руководящие принципы Европейского Союза по размещению и уходу за животными, используемыми в экспериментальных и других научных целях (2007/526 / EC).Материалы были немедленно доставлены в лабораторию, за исключением 20 легких (8 коз, 5 овец, 5 муфлонов и 2 серны), которые были глубоко заморожены и транспортированы позже.
Сначала был составлен топографический эскиз поверхностных аномалий в легких. После этого было выполнено плановое вскрытие легких. Гельминты в конкретном поражении были обнаружены, и их вид был определен под микроскопом. С целью найти мелких, едва заметных червей, расположенных в бронхиолах и альвеолах, аномальные ткани легких исследовали следующим образом: отбирали 1-2 см3 части пораженных участков легких и кипятили в 40% -ной молочной кислоте на водяной бане на 1 раз.5 час. После этого небольшие (2-3 мм) кусочки этих деталей были сжаты и исследованы под световым микроскопом. Таким образом, легочные черви стали ярче, и половые структуры самцов стали отчетливо видны. Идентификацию наблюдаемых гельминтов проводили по их морфометрическим характеристикам [5].
Местность, консистенция, цвет, образование узелков, наличие абсцессов, наличие других непаразитарных поражений и диссеминация принимались во внимание при оценке макроскопических поражений в инфицированных легких.По степени распространения макроскопические поражения были субъективно классифицированы следующим образом: легкие (небольшие, едва заметные поражения), легкие (поражающие до 1/6 поверхности легких), тяжелые (поражающие от 1/6 до 1/2 легких). поверхности) и очень тяжелые (затрагивают более 1/2 поверхности легкого
Что делают легкие?
Самая важная функция легких — забирать кислород из окружающей среды и передавать его в кровоток.
более 6 миллионов вдохов в год, легкие влияют на все аспекты нашего тела и здоровья.
В этой статье рассматриваются форма и функция легких, болезни, поражающие легкие, и способы поддержания здоровья легких.
Краткие сведения о легких
- Левое и правое легкие имеют разные размеры.
- Легкие выполняют множество функций, в том числе регулируют кислотность организма.
- Курение табака — самая большая причина заболеваний легких.
- Профилактические меры и меры, связанные с образом жизни, могут помочь сохранить здоровье легких.
Легкие расположены в груди, за грудной клеткой по обе стороны от сердца. Они имеют примерно коническую форму с закругленным концом на вершине и более плоским основанием в месте пересечения с диафрагмой.
Хотя они и парные, легкие не равны по размеру и форме.
В левом легком есть выемка, граничащая с местом расположения сердца, называемая сердечной выемкой. Правое легкое короче, чтобы оставить место для печени.
В целом левое легкое имеет немного меньший вес и емкость, чем правое.
Легкие окружены двумя оболочками, известными как легочные плевры. Внутренний слой непосредственно выстилает внешнюю поверхность легких, а внешний слой прикреплен к внутренней стенке грудной клетки.
Пространство между двумя мембранами заполнено плевральной жидкостью.
Основная роль легких заключается в том, чтобы приносить воздух из атмосферы и передавать кислород в кровоток. Оттуда он циркулирует в остальной части тела.
Для правильного дыхания требуется помощь структур за пределами легких.Чтобы дышать, мы используем мышцу диафрагмы, межреберные мышцы (между ребрами), мышцы живота, а иногда даже мышцы шеи.
Диафрагма — это мышца, имеющая куполообразную форму вверху и расположенную под легкими. Он обеспечивает большую часть работы, связанной с дыханием.
По мере сокращения он движется вниз, освобождая больше места в грудной полости и увеличивая способность легких расширяться. По мере увеличения объема грудной клетки давление внутри падает, и воздух всасывается через нос или рот и опускается в легкие.
Когда диафрагма расслабляется и возвращается в исходное положение, объем легких уменьшается, потому что давление внутри грудной полости повышается, и легкие вытесняют воздух.
Легкие подобны мехам. Когда они расширяются, воздух засасывается кислородом. Когда они сжимаются, обмененные отходы углекислого газа выталкиваются обратно во время выдоха.
Когда воздух попадает в нос или рот, он движется по трахее, также называемой дыхательным горлом. После этого он достигает участка, называемого киля.У киля трахея разделяется на две части, образуя два главных бронха. Один ведет к левому легкому, а другой — к правому.
Оттуда, как ветви дерева, трубчатые бронхи снова разделились на более мелкие бронхи, а затем еще более мелкие бронхиолы. Этот постоянно сокращающийся трубопровод в конечном итоге заканчивается в альвеолах, которые представляют собой небольшие окончания воздушного мешка.
Здесь происходит газообмен.
Альвеолы - это конечная точка пути кислорода из внешнего мира к глубинам легких.
Альвеолы - это крошечные мешочки микроскопических размеров, каждый из которых обернут тонкой сеткой капилляров.
У каждого человека около 700 миллионов индивидуальных альвеол. Общая площадь поверхности мембраны, которую обеспечивают альвеолы, составляет 70 квадратных метров. Часто говорят, что он размером с половину теннисного корта.
После легких организм забирает кислород из кровотока в другие ткани, перемещаясь по кровеносной системе.
Кровь, отдавшая кислород в обмен на углекислый газ из тканей, затем проходит через сердце и направляется в легкие, чтобы достичь капилляров, окружающих альвеолы.
Альвеолы теперь содержат новый запас кислорода, которым вдохнул человек. Этот кислород проходит через мембрану, называемую альвеолярно-капиллярной мембраной, в кровоток.
В то же время углекислый газ, скопившийся в кровотоке во время своего путешествия по телу, попадает в альвеолы. Оттуда во время выдоха он снова выдыхается в атмосферу.
Проще говоря, когда кислород входит, углекислый газ выходит наружу. Это газовый обмен.
Специальные клетки альвеол вырабатывают соединение, известное как легочное сурфактант. Он состоит из липидов, белков и углеводов.
Поверхностно-активное вещество имеет как гидрофильные, так и гидрофобные участки. Гидрофильные участки притягиваются к воде, а гидрофобные участки отталкиваются водой.
Легочный сурфактант выполняет ряд жизненно важных функций.
К ним относятся:
- для повышения эффективности дыхания
- для предотвращения спада альвеол на самих себя
Каждая альвеола похожа на пластиковый пакет, влажный внутри.Если бы не было поверхностно-активного вещества, мешок схлопнулся бы сам по себе, и внутренние стороны слиплись бы. Поверхностно-активное вещество предотвращает это с альвеолами.
Легочный сурфактант выполняет свою роль, уменьшая величину поверхностного натяжения. Таким образом уменьшается усилие, необходимое для надувания альвеол.
До рождения производство сурфактанта начинается только на последних неделях беременности.
Вот почему у недоношенных детей возникают проблемы с дыханием, называемые респираторным дистресс-синдромом у детей (RDS).
Дыхание — самая известная роль легких, но они выполняют и другие важные функции.
Баланс pH : Слишком много углекислого газа может вызвать закисление организма. Если легкие обнаруживают повышение кислотности, они увеличивают скорость вентиляции, чтобы удалить больше нежелательного газа.
Фильтрация : Легкие фильтруют небольшие сгустки крови, и они могут удалять мелкие пузырьки воздуха, известные как воздушные эмболии, если они возникают.
Защитный : Легкие могут действовать как амортизатор для сердца при определенных типах столкновений.
Защита от инфекций: Определенные мембраны в легких выделяют иммуноглобулин А. Это защищает легкие от некоторых инфекций.
Мукоцилиарный зазор : слизь, выстилающая дыхательные пути, улавливает частицы пыли и бактерии. Крошечные волоскоподобные выступы, известные как реснички, перемещают эти частицы вверх в положение, в котором они могут откашляться или проглотиться и разрушиться пищеварительной системой.
Резервуар для крови : Количество крови в легких может варьироваться в любой момент.Эта функция может быть полезна, например, во время тренировки. Количество крови, которое могут содержать легкие, может варьироваться от 500 до 1000 миллилитров (мл). Легкие взаимодействуют с сердцем и могут помочь ему работать более эффективно.
Речь : Без воздушного потока человечество было бы без своего любимого времяпрепровождения.
Респираторные заболевания могут поражать любую часть дыхательной системы, от верхних дыхательных путей до бронхов и вплоть до альвеол.
Заболевания органов дыхания — распространенные.Ежегодно в США регистрируются миллионы случаев простуды.
Воспалительные заболевания легких
В эту группу входят:
ХОБЛ обычно возникает в результате повреждения легких, которое курение табака вызывает.
Астма проявляется обструктивным сужением и отеком дыхательных путей и выделением избыточной слизи. Это вызывает одышку и хрипы.
Триггеры включают:
- табачный и древесный дым
- пылевые клещи
- загрязнение воздуха
- аллергены тараканов
- плесень
- стресс
- инфекции
- некоторые продукты питания
Никто точно не знает, почему некоторые люди поражают астму не другие.
Ограничительные заболевания легких
Это означает, что дыхательные пути ограничены.
Это может произойти в результате:
- жесткости легких
- проблемы со стенкой грудной клетки или дыхательных мышц, например, как при идиопатическом муковисцидозе
- искривлении позвоночника
- ожирении
Количество воздуха, которое может принять человек, уменьшается, и вдыхать становится труднее.
Инфекции дыхательных путей
Инфекции могут возникнуть в любом месте дыхательных путей.Их можно описать как:
Инфекция верхних дыхательных путей : Наиболее частым заболеванием является простуда (вирусная). Другие включают ларингит, фарингит и тонзиллит.
Инфекция нижних дыхательных путей : Наиболее распространенный тип — бактериальная инфекция, особенно бактериальная пневмония. Другие причины инфекции нижних дыхательных путей включают вирусы и грибки.
Эти типы инфекций могут вызвать осложнения, включая абсцессы легких и распространение инфекции в плевральную полость.
Опухоли
Опухоли дыхательной системы могут быть злокачественными и доброкачественными.
Злокачественные опухоли : 14 процентов всех новых диагнозов рака приходится на первичный рак легкого. Рак легких является вторым по распространенности типом рака и основной причиной смерти от рака как у мужчин, так и у женщин.
Большинство случаев рака легких возникает из-за курения сигарет. Вся кровь в организме проходит от сердца через легкие, поэтому рак может легко распространиться на другие части тела.
Доброкачественные опухоли : Доброкачественные опухоли — менее частая причина респираторных заболеваний. Один из примеров — гамартома. Они могут сдавливать окружающие ткани, но обычно протекают бессимптомно.
Заболевания плевральной полости
Плевральная полость — это промежуток между внутренней и внешней плевральными мембранами, которые покрывают внешнюю часть легких.
Плевральный выпот : Жидкость скапливается в плевральной полости, часто из-за рака в грудной полости или около нее.Это также может быть связано с застойной сердечной недостаточностью или циррозом печени. Другие причины включают воспаление плевры, которое может возникнуть при инфекции.
Пневмоторакс : Это может быть результатом травмы, например, пулевого ранения. Воздух внутри плевральной полости называется пневмотораксом. Это сжимает легкие, а в тяжелых случаях заставляет их схлопываться, как воздушный шар.
Заболевания сосудов легких
Заболевания сосудов легких поражают сосуды, по которым кровь проходит через легкие.
Примеры включают:
Эмболия легочной артерии : сгусток крови образуется в другом месте тела и перемещается с кровотоком в сердце, а затем в легкие, где он застревает. Это может привести к внезапной смерти. Реже эмболия может состоять из жира, околоплодных вод или воздуха.
Легочная артериальная гипертензия : В легочных артериях может возникнуть повышенное давление. Иногда причины этого неясны.
Отек легких : чаще всего возникает в результате застойной сердечной недостаточности.Утечка жидкости из капилляров в воздушные пространства внутри альвеол.
Легочное кровотечение : Поврежденные и воспаленные капилляры могут просачивать кровь в альвеолы. Симптомом может быть кашель с кровью.
Способы сохранения здоровья легких включают:
Отказ от курения : Курение табака, как первых, так и вторых рук, может привести к раку легких и ХОБЛ, включая хронический бронхит и эмфизему. Курение приводит к сужению дыхательных путей, вызывает воспаление легких и со временем разрушает ткани.Сделайте свой дом зоной, свободной от табачного дыма.
Предотвратить инфекцию : Способы предотвращения распространения респираторных инфекций, включая мытье рук, избегать скопления людей в сезон гриппа и спрашивать вашего врача о вакцинации от гриппа и пневмонии.
Упражнение : Аэробные упражнения улучшают объем легких, а поддержание формы может предотвратить другие заболевания, которые могут повлиять на легкие.
Осмотры : регулярные проверки здоровья, даже если вы чувствуете себя хорошо, могут выявить проблемы на ранних стадиях, когда их легче лечить.
Как избежать воздействия загрязняющих веществ : Химические вещества, используемые в саду или дома, могут повредить легкие. При использовании сильнодействующих химикатов наденьте маску. Радон — это химическое вещество естественного происхождения, от которого ежегодно умирает 21 000 случаев рака легких в США. Около 2 900 из этих людей никогда не курили.
Контроль влажности : Поддерживайте влажность в помещении на приемлемом уровне с помощью вытяжных вентиляторов и вентиляционных отверстий. По возможности держите влажные поверхности чистыми и сухими. Хорошая идея — обеспечить проветривание дома свежим воздухом.
Узелки в легких: причины, симптомы и лечение
Узелки в легких — это небольшие образования в легких, которые могут быть доброкачественными или злокачественными. Рост обычно должен быть меньше 3 сантиметров, чтобы его можно было квалифицировать как узелок.
Доброкачественные узелки доброкачественные, обычно не агрессивные и не распространяются на другие части тела.
Злокачественные узелки являются злокачественными и могут быстро расти. Они могут распространяться на другие близлежащие ткани и отдаленные органы.
Врачи обычно называют новообразования размером более 3 сантиметров (см) в легких, и они обычно имеют более высокий шанс быть злокачественным.
В этой статье мы рассмотрим возможные причины узелков в легких, их симптомы, а также способы их диагностики и лечения.
Поделиться на Pinterest Человек с узелками в легких может испытывать боль в груди и одышку.Хотя диагноз любого разрастания в легком может быть пугающим, узелок в легком не всегда указывает на рак легких.
Узелки в легких очень распространены. По данным Американского торакального общества, узелки в легких видны почти на 50% КТ грудной клетки у взрослых.Менее 5% узелков в легких в конечном итоге становятся раком.
Доброкачественные узелки в легких могут иметь множество причин, в том числе:
- Инфекция: Воспаление в легких может возникнуть из-за ряда инфекций, таких как туберкулез (ТБ) или грибковые инфекции. Группа клеток, называемая гранулемой, может развиваться вокруг воспаленного участка легкого. Иногда узелки представляют собой область рубцов от предыдущей инфекции.
- Неинфекционное воспаление: Воспаление, возникшее не из-за инфекции, также может привести к образованию узелков в легких.Ревматоидный артрит (РА) или саркоидоз, например, может способствовать развитию неинфекционного воспаления.
- Доброкачественные опухоли: Другие доброкачественные новообразования также могут развиваться в легких. Одним из примеров этого является фиброма, доброкачественное образование соединительной ткани.
Хотя большинство узелков в легких не являются злокачественными, некоторые из них оказываются злокачественными и требуют немедленного лечения.
Определенные факторы риска повышают вероятность злокачественного новообразования в легком, в том числе:
- в анамнезе курения
- в пожилом возрасте
- в семейном или личном анамнезе рака
Более крупные узелки в легких также больше вероятно, будет злокачественным.
Узелок в легких часто не вызывает симптомов. Эти небольшие образования обычно недостаточно велики, чтобы мешать дыханию.
Однако могут возникать симптомы состояния, которое вызывает узел. Например, если узелок в легких вызван раком легких, симптомы могут включать:
- одышку
- боль в груди
- кашель с кровью
- боль в спине
- потеря веса
Когда у человека есть симптомы респираторного заболевания или инфекции, врач обычно запрашивает рентген грудной клетки или компьютерную томографию.На одном из снимков часто можно увидеть узелок в легких.
Узелок будет отображаться на рентгеновском снимке в виде пятна или тени. Если рентген показывает признаки узелка, врач может запросить повторную компьютерную томографию. Этот тип визуализации может предоставить больше деталей, чем рентген.
Обнаружив узелок в легком, врач оценит его размер, форму и внешний вид. Некоторые особенности могут указывать на то, что узелок с большей вероятностью является злокачественным. Например, более крупные узелки с большей вероятностью являются раком.
Расположение, форма и размер узелка могут увеличить риск его злокачественного образования. Врач также рассмотрит историю болезни человека, в том числе историю курения, чтобы оценить риск возникновения злокачественных узлов.
Нужна ли биопсия?
Если признаки узелка указывают на злокачественность, врач может порекомендовать биопсию. Эта процедура включает удаление небольшого количества ткани из узла с помощью иглы или во время бронхоскопии.
При бронхоскопии тонкая трубка вводится по трахее в легкое через рот или нос.
Трубка имеет небольшую камеру, которая позволяет врачу наблюдать за дыхательными путями. Затем они будут использовать специальные инструменты, чтобы получить образец ткани из узелка.
Другой вариант — пункционная биопсия, при которой игла вводится в легкое через стенку грудной клетки. Врач обычно использует компьютерную томографию, чтобы направить введение.
Процедура, которую медицинские работники используют для доступа к образцу ткани, зависит от размера и местоположения узелка.
После получения образца врач отправляет ткань в лабораторию.Патолог исследует ткань под микроскопом, чтобы найти раковые клетки.
Врачу не всегда нужно проводить биопсию, когда у человека обнаруживаются узелки в легких. Если человек относится к группе низкого риска и особенности узелка предполагают низкую вероятность рака, биопсия может принести больше вреда, чем пользы.
Проведение биопсии небольшого узелка в легком может быть трудным, и могут возникнуть осложнения, такие как кровотечение или коллапс легкого.
Подробнее о биопсии легких здесь.
Лечение узелков в легких часто зависит от того, есть ли у них особенности, представляющие риск рака.
Лечение доброкачественного узелка
Если узел имеет характеристики, свидетельствующие о низком риске рака, врач может порекомендовать осторожное ожидание. Этот подход включает в себя мониторинг узелка с помощью регулярных компьютерных томографов с течением времени для выявления любых потенциально злокачественных изменений, таких как увеличение размера.
Бдительное ожидание может продолжаться несколько лет, чтобы убедиться, что узелок не разрастается.Врач будет использовать различные факторы, чтобы определить, как часто человеку необходимо повторное сканирование. Эти факторы включают общий риск рака человека и размер узелка.
Если узелок в легком не меняется в течение примерно 2 лет, маловероятно, что он злокачественный. В этом случае дальнейшие визуальные исследования могут не потребоваться.
Если узелок в легких образовался в результате активной инфекции, лечение основного заболевания — лучший способ справиться с узелком.
Примером этого является случай, когда узелок вызван туберкулезом, и врач прописывает курс лечения инфекции.
Лечение злокачественного узелка
Злокачественный узелок в легком чаще всего возникает из-за рака легких, лимфомы или рака, распространившегося в легкие из другого органа.
Если результаты биопсии показывают, что узел является злокачественным, варианты лечения зависят от типа и стадии рака. Врач также может изменить методы лечения во время лечения, если состояние пациента улучшится.
В некоторых случаях врач может запросить удаление ракового узла с помощью торакотомии.Это хирургическая процедура, при которой хирург делает разрез грудной клетки в легком, чтобы удалить узелок.
Дополнительное лечение раковых узелков в легких может включать химиотерапию, лучевую терапию и другие хирургические вмешательства.
Перспективы людей со злокачественным узлом в легких варьируются в зависимости от стадии заболевания. Во многих случаях раннее выявление и лечение улучшают долгосрочные перспективы человека.
Доброкачественные узелки в легких выглядят хорошо и обычно не вызывают каких-либо осложнений.

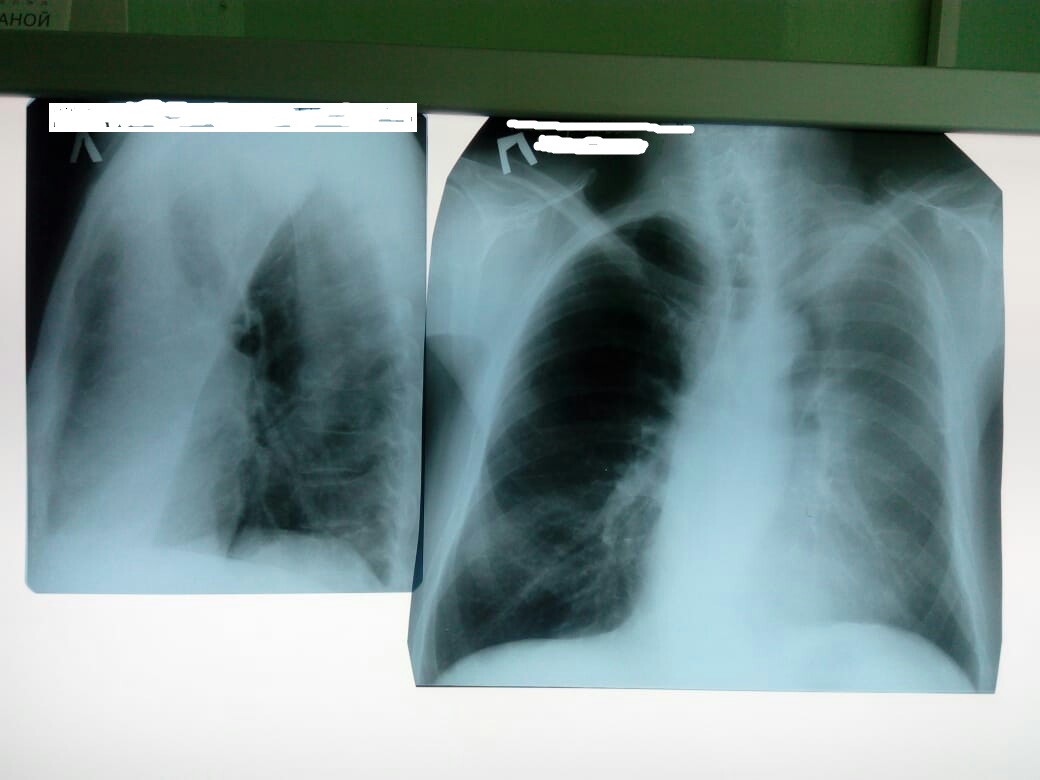


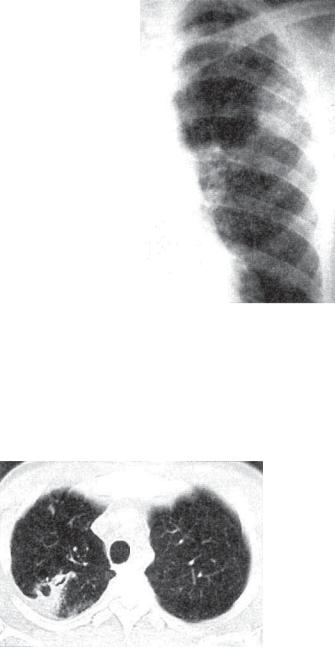 В этом случае воспаляются лёгочные ткани, при этом в патологический процесс вовлечены различные доли лёгкого. Симптомами такой болезни являются усталость, ощущение боли в груди и разные признаки дыхательной недостаточности. Высокая температура при воспалении лёгких бывает не всегда, в ряде случаев она субфебрильная или несколько понижается.
В этом случае воспаляются лёгочные ткани, при этом в патологический процесс вовлечены различные доли лёгкого. Симптомами такой болезни являются усталость, ощущение боли в груди и разные признаки дыхательной недостаточности. Высокая температура при воспалении лёгких бывает не всегда, в ряде случаев она субфебрильная или несколько понижается. Такое состояние часто наблюдается при периферическом инфильтрате левого или правого лёгкого.
Такое состояние часто наблюдается при периферическом инфильтрате левого или правого лёгкого.