Постинфекционный синдром раздраженного кишечника | #07/10
В анамнезе многих больных синдромом раздраженного кишечника (СРК) можно проследить упоминания о перенесенных острых кишечных инфекциях (ОКИ) и их влиянии на течение СРК [1–3]. На основании многолетних исследований мы установили у 69,9% больных СРК этиотропную и патогенетическую связь с кишечной инфекцией и назвали этот вариант заболевания постинфекционным синдромом раздраженного кишечника (ПСРК) [4].
Этиология и патогенез. В Римских критериях III (2006 г.) впервые указано, что у 1/3 больных развитие СРК связано с перенесенной кишечной инфекцией [5]. У этих больных обнаружена воспалительная инфильтрация слизистой оболочки толстой кишки, повышенный уровень провоспалительных цитокинов, а в просвете тонкой кишки — избыточный бактериальный рост. Предложено новое объяснение висцеральной гиперчувствительности, свойственной больным СРК, согласно которому болевые ощущения могут быть следствием повреждения энтеральной нервной системы в условиях изменения состава бактериальной микрофлоры кишечника или в результате перенесенной кишечной инфекции [5].
Стресс и ПСРК. S. P. Dunlop и соавт. (2005) развитие ПСРК и воспалительную реакцию слизистой оболочки кишечника связали с более высоким, чем в группе сравнения, уровнем психосоциальных проблем, наблюдавшихся у больных в период переносимых ими ОКИ [9]. Существенных различий в висцеральной пороговой чувствительности и моторики у больных с ПСРК не было обнаружено. Развитию ПСРК, возможно, способствует и ЦНС, которая вносит вклад в увеличение экспрессии провоспалительных цитокинов через гипоталамо-гипофизарно-адреналовую ось [5].
Иммунная система и ПСРК. В современных условиях многие ОКИ приобрели ряд клинических особенностей. Н. Д. Ющук объясняет это преобладанием микст-инфекций, снижением иммунных механизмов защиты и затяжным течением инфекционного процесса.
Благодаря современным иммунологическим методам и полимеразной цепной реакции (ПЦР) обнаружена новая форма взаимодействия организма с патогенной микрофлорой — длительная циркуляция ее маркеров. Длительная персистенция маркеров кишечных инфекций — малоизученное явление с неясными отдаленными последствиями для больного.
По нашим данным, в патогенезе ПСРК большое значение имеют изменения иммунного статуса организма: снижение фагоцитарной активности, ослабление клеточного и гуморального иммунитета, дефицит Т-хелперов, рост NK-клеток, снижение цитолитической активности комплемента, относительно низкий уровень IgG, лимфо- и лейкопения. Это создает условия для роста условно-патогенной микрофлоры [4].
Морфологические изменения слизистой оболочки кишечника у больных ПСРК. При морфологическом исследовании слизистая оболочка тонкой кишки у больных ПСРК не изменена, а в толстой кишке у 8,1% наблюдается умеренная инфильтрация собственной пластинки лимфоцитами и плазматическими клетками на фоне ее отека, свидетельствующая о возможности воспалительного процесса [4].
При морфологическом исследовании слизистая оболочка тонкой кишки у больных ПСРК не изменена, а в толстой кишке у 8,1% наблюдается умеренная инфильтрация собственной пластинки лимфоцитами и плазматическими клетками на фоне ее отека, свидетельствующая о возможности воспалительного процесса [4].
Особенности профиля личности больных ПСРК. У больных ПСРК частота измененного профиля личности значительно ниже, чем при СРК, и патологические изменения психоэмоциональной сферы встречаются не чаще, чем в общей популяции [4].
Клиника. Больные ПСРК, у которых определялись антигены шигелл, жаловались на боль в животе, преимущественно в левой подвздошной области, т. е. в проекции сигмовидной кишки, которая усиливалась перед дефекацией. Беспокоили также запор и ложные позывы к дефекации (тенезмы). При осмотре у них пальпировалась спастически сокращенная сигмовидная кишка.
Больные, у которых были выявлены антигены иерсиний, чаще жаловались на жидкий стул, боль преимущественно локализовалась в правом нижнем квадранте живота, т. е. в илеоцекальной области, уменьшалась после стула. Некоторых беспокоила субфебрильная лихорадка и боль в суставах. При колоноскопии у них можно было видеть гиперплазию лимфоидных фолликулов в терминальном отделе подвздошной кишки.
е. в илеоцекальной области, уменьшалась после стула. Некоторых беспокоила субфебрильная лихорадка и боль в суставах. При колоноскопии у них можно было видеть гиперплазию лимфоидных фолликулов в терминальном отделе подвздошной кишки.
Больные, у которых были определены антигены сальмонелл, отмечали разлитую боль в животе, уменьшавшуюся после стула, понос с примесью слизи.
У больных с признаками перенесенной микст-инфекции клиническая картина отличалась значительным разнообразием. Их беспокоили понос, боль вокруг пупка или в проекции ободочной кишки ноющего характера, уменьшавшаяся после дефекации, и снижение массы тела. Большинство жаловались на боль в суставах, субфебрильную температуру тела, а у 45,6% наблюдались высыпания на коже по типу угревой сыпи, крапивницы или дерматита.
Если ПСРК предшествовала энтеровирусная инфекция, выявленная с помощью ПЦР, то клиническая картина болезни характеризовалась частым жидким необильным стулом с примесью слизи, разлитой болью в животе схваткообразного характера, преимущественно перед стулом, и некоторым снижением массы тела.
У 1/3 больных ПСРК выявлялся избыточный бактериальный рост в тонкой кишке, а клиническая картина отличалась рецидивирующей диареей. Нарушения состава фекальной микрофлоры имелись у большинства больных. Обычно в кале снижалась численность бифидумбактерий и лактобацилл, а также кишечной палочки с нормальной ферментативной активностью. Одновременно отмечался рост условно-патогенной микрофлоры с различными сочетаниями групп микроорганизмов. Чаще всего нарастало количество дрожжеподобных грибов, кокковой микрофлоры, клостридий, протея, клебсиелл. Но клиническая картина ПСРК не зависела от особенностей состава фекальной микрофлоры.
У больных ПСРК не было выраженных отклонений в психоэмоциональной сфере.
Таким образом, ПСРК характеризуется более или менее выраженной диареей и болью в проекции ободочной кишки. Психоэмоциональные нарушения и внекишечная симптоматика у большинства больных отсутствуют.
Диагноз. В результате проведенной работы нами разработаны следующие диагностические критерии ПСРК.
В результате проведенной работы нами разработаны следующие диагностические критерии ПСРК.Упоминание в анамнезе о перенесенной ОКИ.
Обнаружение маркеров ОКИ в биологических средах больного.
Наличие в крови антител к ОКИ в низких титрах.
Изменения фекальной микрофлоры в бактериологических посевах кала.
Высокий бактериальный рост в тонкой кишке.
Снижение напряженности иммунитета.
Лечение. Исходя из особенностей патогенеза ПСРК, в лечении больных следует предусматривать антибактериальные препараты и пробиотики для устранения дисбиоза, а также иммуномодуляторы.
Коррекция нарушенной микрофлоры кишечника. Показаны кишечные антисептики и пробиотики. Из антибактериальных препаратов предпочтительнее производные 8-оксихинолина (5-НОК, нитроксолин), хинолоны (Невиграмон) и Интетрикс, производные нитрофурана (Фуразолидон, Фурадонин), Эрсефурил.
Иммуномодуляторы. В результате исследований иммунного статуса больных ПСРК установлено, что рост условно-патогенной микрофлоры или длительная персистенция маркеров кишечных инфекций развиваются на фоне снижения иммунного ответа. Поэтому для успешного лечения дисбактериоза кишечника необходимо в комплексную терапию включать иммуномодуляторы, например, Гепон. Он обладает противовоспалительными свойствами, противовирусной активностью, способностью к активации местного иммунитета, повышению устойчивости слизистой оболочки к инфекциям.
Этиотропное и патогенетическое лечение ПСРК позволяет по нашим данным добиться стойкой ремиссии на протяжении не менее года у 76,3% больных.
Таким образом, для ПСРК характерен еще один критерий — хороший терапевтический эффект антибактериальных, биологически активных препаратов (пре- и пробиотиков) и иммуномодуляторов.
Для закрепления результатов лечения и профилактики рецидивов больным показаны продукты функционального питания, содержащие пробиотики. Этими свойствами, как показали наши исследования, обладает Активиа [10].
Активиа содержит бифидобактерии ActiRegularis (штамм DN-173 010) (рис.).
Эффективность пищевого продукта оценивали по: а) динамике клинической картины СРК, б) составу фекальной микрофлоры кишечника, в) изменениям показателей иммунного статуса больных. Результаты сравнивали с данными группы сравнения, больные которой получали только стандартную терапию, не содержащую антибактериальных препаратов и пробиотиков.
Активиа способствует уменьшению запора и улучшению состава кишечной микрофлоры у больных СРК. Механизм его действия связан с улучшением моторики кишечника, сокращением времени транзита каловых масс, ростом облигатной микрофлоры толстого кишечника и подавлением условно-патогенной микрофлоры. Он способствует повышению метаболической активности микрофлоры толстой кишки и приводит к повышению абсолютного суммарного содержания короткоцепочечных жирных кислот, в частности абсолютной концентрации пропионовой кислоты, участвующей в нормализации моторной функции толстой кишки.
Он способствует повышению метаболической активности микрофлоры толстой кишки и приводит к повышению абсолютного суммарного содержания короткоцепочечных жирных кислот, в частности абсолютной концентрации пропионовой кислоты, участвующей в нормализации моторной функции толстой кишки.
Активиа рекомендуется для длительного приема с целью профилактики и лечения запора.
Заключение
В настоящее время из нозологической формы «синдром раздраженного кишечника» выделен ПСРК. Клинико-лабораторными критериями ПСРК являются: 1) упоминание в анамнезе ОКИ, предшествовавшей заболеванию; 2) обнаружение маркеров ОКИ в биологических средах больного; 3) признаки дисбиоза в бактериологических посевах кала; 4) избыточный бактериальный рост в тонкой кишке; 5) cнижение напряженности иммунитета; 6) положительный эффект терапии кишечными антисептиками, энтеросорбентами, пробиотиками и иммуномодуляторами.
В патогенезе ПСРК большое значение имеют изменения иммунного статуса организма: снижение фагоцитарной активности, ослабление клеточного и гуморального иммунитета, дефицит Т-хелперов, рост натуральных киллеров, снижение цитолитической активности комплемента, относительно низкий уровень IgG, лимфо- и лейкопения, что создает условия для роста условно-патогенной микрофлоры в кишечнике.
Этиотропное и патогенетическое лечение, направленное на восстановление нормальной кишечной микрофлоры и иммунного статуса, позволяет добиться стойкой ремиссии на протяжении года у подавляющего большинства больных ПСРК.
Литература
Парфенов А. И., Ручкина И. Н., Крумс Л. М. Клиническое значение выявления антигенов возбудителей острых кишечных инфекций в биологических субстратах больных хроническими заболеваниями кишечника // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1993; 2 (3): 39–42.
Парфенов А. И., Екисенина Н. И., Ручкина И. Н. Антибактериальная терапия при синдроме раздраженного кишечника // Клин. мед. 1996; 5: 41–43.
Парфенов А. И., Ручкина И. Н. Синдром раздраженного кишечника // В сб.: Акт. вопросы совершенствования лечебно-диагностического процесса на поликлиническом этапе. М.: 1996. С. 64–66.
Парфенов А.
 И., Ручкина И. Н., Атауллаханов Р. И. и др. Постинфекционный синдром раздраженного кишечника // Тер. арх. 2009; 81 (2): 39–45.
И., Ручкина И. Н., Атауллаханов Р. И. и др. Постинфекционный синдром раздраженного кишечника // Тер. арх. 2009; 81 (2): 39–45.Drossman D. A. The Functional Gastrointestinal Disorders and the Rome III Process // Gastroenterology. 2006; 130 (5): 1377–1390.
Chadwick V. S., Chen W., Shu D., Paulus B., Bethwaite P. et al. Activation of the mucosal immune system in irritable bowel syndrome // Gastroenterology. 2002; 122: 1778–83.
Dunlop S. P., Jenkins D., Neal K. R., Spiller R. C. Relative importance of enterochromaffin cell hyperplasia, anxiety, and depression in postinfections IBS // Gastroenterology. 2003; 125: 1651–1659.
Gwee K. A., Collins S. M., Read N. W., Rajnakova A., Deng Y. et al. Increased rectal mucosal expression of interleukin 1 beta in recently acquired post-infectious irritable bowel syndrome // Gut. 2003; 52: 523–526.
Dunlop S. P., Coleman N. S.
 , Blackshaw E., Perkins A. C., Singh G., Marsden C. A. et al. Abnormalities of 5-hydroxytryptamine metabolism in irritable bowel syndrome // Clin. Gastroenterol. Hepatol. 2005; 3: 349–357.
, Blackshaw E., Perkins A. C., Singh G., Marsden C. A. et al. Abnormalities of 5-hydroxytryptamine metabolism in irritable bowel syndrome // Clin. Gastroenterol. Hepatol. 2005; 3: 349–357.Лазебник Л. Б., Парфенов А. И., Ручкина И. Н. Результаты клинических исследований по теме «Оценка эффективности кисломолочного продукта питания «Актимель» в терапии СРК с преобладанием поносов». М., 2005. 20 с.
А. И. Парфенов, доктор медицинских наук, профессор
И. Н. Ручкина, доктор медицинских наук
Центральный НИИ гастроэнтерологии, Москва
Контактная информация об авторах для переписки: [email protected].
Узелковая лимфоидная гиперплазия кишечника: симптомы, лечение
Доброкачественная узелковая лимфоидная гиперплазия тонкой кишки при общем вариабельном иммунодефиците
В проблеме патологии тонкой кишки особый интерес вызывают иммунодефицитные состояния, сопровождающиеся развитием одной из разновидностей лимфопролиферативных процессов — доброкачественной узелковой лимфоидной гиперплазии.
Тонкая кишка, имея обширную пограничную поверхность, находится в постоянном контакте с многочисленными антигенами: алиментарными, вирусными, лекарственными, патогенной и оппортунистической (условно-патогенной) флорой кишечника.
В связи с тесным контактом с антигенами в слизистой оболочке тонкой кишки развивается мощная лимфоидная ткань, образующая иммунокомпетентную систему, в которой происходят реакции клеточного типа, а также сенсибилизация лимфоцитов с последующей дифференцировкой в плазматические клетки, синтезирующие иммуноглобулины.
Лимфоидные структуры тонкой кишки входят в состав единой MALT-системы (англ. MALT — mucosal associated lymphoid tissue) — лимфоидной ткани, ассоциированной со слизистыми оболочками, образующей особую секреторную систему, в которой циркулируют клетки, синтезирующие иммуноглобулины.
Лимфоидная ткань стенки тонкой кишки представлена следующими структурами, расположенными на различных анатомических уровнях: интраэпителиальными лимфоцитами, локализованными между энтероцитами эпителия ворсинок и крипт слизистой оболочки; лимфоцитами, входящими в состав ее собственной пластинки; групповыми лимфоидными фолликулами подслизистой основы и солитарными фолликулами.
Причины развития и патогенез узелковой лимфоидной гиперплазии кишечника
Источником интраэпителиальных лимфоцитов являются лимфоциты собственной пластинки слизистой оболочки, которые могут мигрировать через базальную мембрану покровного эпителия в обоих направлениях и иногда выходить в просвет кишки. Интраэпителиальные лимфоциты в норме составляют около 20% от всех клеток покровного эпителия слизистой оболочки тонкой кишки. В среднем на 100 энтероцитов в тощей кишке приходится 20 интраэпителиальных лимфоцитов, в подвздошной — 13 лимфоцитов. P. van den Brande и соавт. (1988) при изучении материала, взятого из подвздошной кишки, в контрольных препаратах обнаружили, что в основном интраэпителиальные лимфоциты — это Т-лимфоциты (Т-супрессоры), редко — В-формы. Согласно данным, приводимым Л. Йегером (1990), интраэпителиальные лимфоциты представлены Т-клетками, из них 80-90% клеток Т-супрессоры, единичные клетки имели маркер NK-клеток, В-лимфоциты отсутствовали. Однако существует и другая точка зрения: интраэпителиальные лимфоциты принадлежат к особому подтипу лимфоцитов.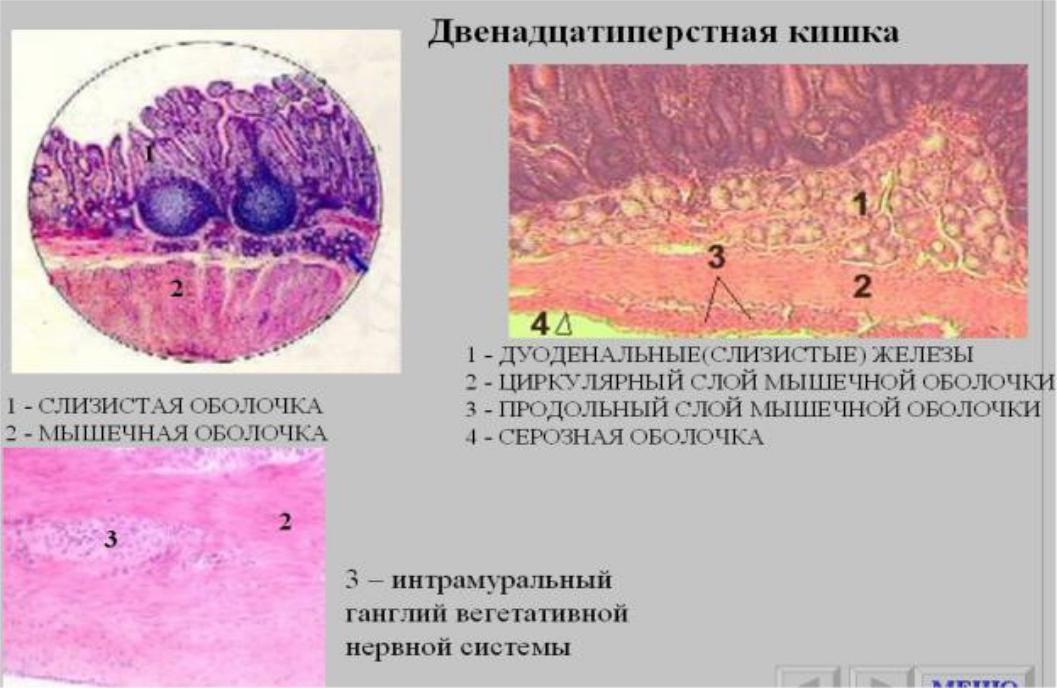
Интраэпителиальные лимфоциты обладают иммунорегуляторной активностью, оказывая влияние на процесс синтеза иммуноглобулинов В-клетками стромы собственной пластинки слизистой оболочки. Их цитотоксический потенциал относительно низок.
Количество лимфоцитов, диффузно расположенных в строме собственной пластинки слизистой оболочки тонкой кишки у здорового человека, составляет 500-1100 клеток на 1 мм2 площади. В их состав входят В- и Т-лимфоциты, обнаружены также и «нулевые» клетки. Среди В-лимфоцитов преобладают клетки, синтезирующие IgA В нормальной слизистой оболочке кишки около 80% плазматических клеток синтезируют IgA, 16% — IgM, около 5% — IgG. Т-лимфоциты представлены в основном Т-хелперами и Т-супрессорами с преобладанием Т-хелперов в неизмененной слизистой оболочке.
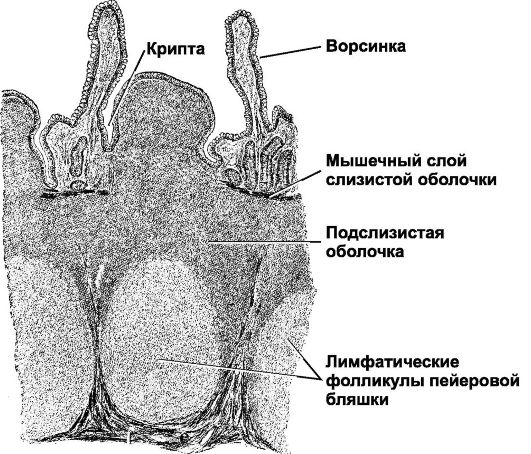
Особой структурой обладают групповые лимфоидные фолликулы (пейеровы бляшки), расположенные в подслизистой основе на всем протяжении слизистой оболочки тонкой кишки, но особенно хорошо развитые в подвздошной кишке.
Над групповыми лимфоидными фолликулами находится «свод» — участок слизистой оболочки полушаровидной формы, в области которого отсутствуют ворсинки и количество бокаловидных клеток резко уменьшено. Структурной особенностью эпителия, покрывающего «свод», является наличие специализированных М-клеток, на апикальной поверхности которых отсутствуют микроворсинки, гликокаликс, а в цитоплазме — терминальная сеть и лизосомы. Характерно развитие вместо микроворсинок микроскладок, в основе которых лежат своеобразные выросты и извилины. М-клетки находятся в тесной пространственной связи с интраэпителиальными лимфоцитами, которые содержатся в крупных складках цитолеммы или ее карманах, идущих от базальной поверхности М-клеток. Существует тесный контакт между М-клетками и рядом расположенными каемчатыми энтероцитами, а также с макрофагами и лимфоцитами собственной пластинки слизистой оболочки. М-клетки способны к выраженному пиноцитозу и участвуют в транспорте макромолекул из полости кишки в пейеровы бляшки. Основная функция М-клеток — прием и транспорт антигена, т. е. они играют роль специализированных клеток, обеспечивающих всасывание антигенов.
Основная функция М-клеток — прием и транспорт антигена, т. е. они играют роль специализированных клеток, обеспечивающих всасывание антигенов.
Герминативный центр фолликулов пейеровых бляшек, по данным P. van den Brande и соавт. (1988), в норме содержит большие и малые В-лимфоциты и небольшое количество Т-хелперов и Т-супрессоров. В состав мантийной зоны входят IgM-продуцирующие В-лимфоциты и кольцо, образованное Т-лимфоцитами, в котором Т-хелперов значительно больше, чем Т-супрессоров. Лимфоциты пейеровых бляшек не обладают свойствами киллеров. Также имеются данные, что В-клетки пейеровых бляшек не способны образовывать антитела. Эта особенность может быть обусловлена низким содержанием макрофагов в их герминативных центрах. Однако лимфоциты пейеровых бляшек — важные предшественники для Ig-npoдуцирующих клеток собственной пластинки слизистой оболочки тонкой кишки.
Через специализированные эпителиальные М-клетки антигены проникают в пейеровы бляшки и стимулируют антигенреактивные лимфоциты. После активации лимфоциты с лимфой проходят через мезентериальные лимфатические узлы, попадают в кровь и собственную пластинку слизистой оболочки тонкой кишки, где превращаются в клетки-эффекторы, продуцирующие иммуноглобулины, в основном IgA и защищающие обширные участки кишки, синтезируя антитела. Подобные клетки мигрируют и в другие органы. В пейеровых бляшках из числа всех клеточных элементов, входящих в их структуру, 55% составляют В-лимфоциты, в периферической крови их 30%, в селезенке — 40%, в красном костном мозге — 40%, в лимфатических узлах — 25%, в вилочковой железе — всего 0,2%. Столь высокое содержание В-лимфоцитов в групповых лимфоидных фолликулах свидетельствует о главенствующей роли пейеровых бляшек в продукции В-лимфоцитов.
После активации лимфоциты с лимфой проходят через мезентериальные лимфатические узлы, попадают в кровь и собственную пластинку слизистой оболочки тонкой кишки, где превращаются в клетки-эффекторы, продуцирующие иммуноглобулины, в основном IgA и защищающие обширные участки кишки, синтезируя антитела. Подобные клетки мигрируют и в другие органы. В пейеровых бляшках из числа всех клеточных элементов, входящих в их структуру, 55% составляют В-лимфоциты, в периферической крови их 30%, в селезенке — 40%, в красном костном мозге — 40%, в лимфатических узлах — 25%, в вилочковой железе — всего 0,2%. Столь высокое содержание В-лимфоцитов в групповых лимфоидных фолликулах свидетельствует о главенствующей роли пейеровых бляшек в продукции В-лимфоцитов.
Солитарные лимфоидные фолликулы слизистой оболочки тонкой кишки не имеют тесной связи с эпителием. В их состав входят В-лимфоциты, Т-лимфоциты и макрофаги. До настоящего времени особенности функции изучены недостаточно.
Большое значение в системе иммунных механизмов имеет также состояние местного иммунитета в слизистых оболочках организма, в частности тонкой кишки.
Инфицирование слизистых оболочек вирусами и бактериями начинается с их адгезии на эпителиальных клетках покровного эпителия. Функцию защиты во внешних секретах выполняет в основном секреторный IgA (SIgA). Будучи связанным с бактериями и вирусами, SIgA предотвращает их адгезию к поверхности эпителия и обеспечивает «первую линию обороны» слизистых оболочек от влияния антигенов.
SIgA содержится в секретах всех экзокринных желез: молоке, слюне, желудочно-кишечных секретах, секретах слизистых оболочек дыхательных путей (носового, фарингеального, трахеобронхиального), в слезной жидкости, поте, секретах мочеполовой системы.
Секреторный IgA — сложный комплекс, состоящий из димера, молекулы секреторного компонента, защищающего SIgA от протеолиза, и молекулы J-цепи. J-цепь (joing — соединяющий) — обогащенный цистеином полипептид с молекулярной массой 15 000. J-цепь синтезируется, как и IgA, преимущественно плазматическими клетками lamina propria слизистой оболочки тонкой кишки. Секреторный компонент (secretory piece) является гликопротеином и состоит из одной полипептидной цепи с молекулярной массой 60 000 и синтезируется локально клетками эпителия.
Секреторный компонент (secretory piece) является гликопротеином и состоит из одной полипептидной цепи с молекулярной массой 60 000 и синтезируется локально клетками эпителия.
Таким образом, лимфоидная ткань тонкой кишки играет роль активного барьера при внедрении чужеродных антигенов. У здорового человека ее работа гармонична и полностью обеспечивает защиту организма от действия патогенных факторов. Однако в патологии, в частности при развитии общего вариабельного иммунодефицита с преобладанием недостатка продукции антител, в ответ на интенсивную антигенную стимуляцию в слизистой оболочке тонкой кишки и в отдельных случаях в антральном отделе желудка и толстой кишки развивается дополнительная структура — доброкачественная узелковая лимфоидная гиперплазия, вносящая определенную корреляцию в синтез иммуноглобулинов благодаря выбросу большого количества лимфоцитов в строму собственной пластинки слизистой оболочки.
Согласно гистологической классификации опухолей кишечника ВОЗ, принятой в Женеве в 1981 г. , узелковая лимфоидная гиперплазия отнесена к доброкачественным опухолеподобным поражениям, имеющим вид множественных полиповидных образований в слизистой оболочке тонкой кишки, в основе которых лежит реактивно гиперплазированная лимфоидная ткань (Женева, 1981).
, узелковая лимфоидная гиперплазия отнесена к доброкачественным опухолеподобным поражениям, имеющим вид множественных полиповидных образований в слизистой оболочке тонкой кишки, в основе которых лежит реактивно гиперплазированная лимфоидная ткань (Женева, 1981).
Впервые в 1958 г. В. G. Fircin и С. R. Blackborn обнаружили на вскрытии в слизистой оболочке тонкой кишки многочисленные узелки, основу которых составляла лимфоидная ткань.
Для доброкачественной узелковой лимфоидной гиперплазии характерны яркая эндоскопическая картина, четкие рентгенологические признаки, определенные морфологические критерии и особенности клиники заболевания.
Сравнительно недавно исследователи обратили внимание на связь развития доброкачественной узелковой лимфоидной гиперплазии с общим вариабельным иммунодефицитом.
По данным P. Hermans и др., частота развития доброкачественной узелковой лимфоидной гиперплазии у больных общим вариабельным иммунодефицитом составляет 17-70%.
Макроскопически доброкачественная узелковая лимфоидная гиперплазия имеет вид множественных полиповидных структур, не имеющих ножки, размером от 0,2 до 0,5 см в диаметре, выступающих над поверхностью слизистой оболочки тонкой кишки.
Доброкачественная узелковая лимфоидная гиперплазия, как правило, — эндоскопическая находка, выявляемая в виде узелков на фоне гиперемированной слизистой оболочки тонкой кишки.
Для определения степени развития и распространенности данного процесса в тонкой кишке в диагностике доброкачественной узелковой лимфоидной гиперплазии успешно применяют зондовую энтерографию — одну из разновидностей рентгенологического исследования.
В последние годы в нашей стране и за рубежом уделяется большое внимание изучению иммунодефицитных состояний, при которых наблюдаются как изолированные дефекты клеточного и гуморального звеньев иммунитета, так и их сочетание.
В патологии органов пищеварения, в частности тонкой кишки, большое значение имеет вариабельный иммунодефицит с нарушением гуморального и клеточного иммунитета. Термин «вариабельный иммунодефицит с преобладанием недостаточности иммуноглобулинов» был предложен ВОЗ в 1978 г.
В настоящее время ряд авторов используют также термины «общая вариабельная приобретенная гипогаммаглобулинемия с поздним началом».
В августе 1985 г. на специальном заседании ВОЗ, посвященном первичным иммунодефицитам, была предложена классификация, согласно которой выделяют следующие 5 основных форм первичных иммунодефицитных состояний (WHO classification, 1985):
- иммунодефицита с преобладанием дефекта антител;
- комбинированный иммунодефицит;
- иммунодефицит, обусловленный другими крупными дефектами;
- дефицит комплемента;
- дефекты функции фагоцитов.
Общий вариабельный иммунодефицит (common variabeliti immunodeficiency) относят к комбинированным иммунодефицитам и подразделяют на общий вариабельный иммунодефицит с преобладанием недостаточности клеточного иммунитета и с преобладанием дефицита антител.
Общий вариабельный иммунодефицит с преобладанием дефицита антител, сопровождающийся развитием доброкачественной узелковой лимфоидной гиперплазии тонкой кишки, — большая клиническая проблема, так как, с одной стороны, узелковая лимфоидная гиперплазия, являясь реактивным образованием, в какой-то степени способствует компенсации недостатка синтеза антител в условиях развившегося иммунодефицита, особенно на его ранних стадиях, а с другой — она сама может стать источником развития злокачественных новообразований — лимфом желудочно-кишечного тракта.
Клиника доброкачественной узелковой лимфоидной гиперплазии тонкой кишки у больных общим вариабельным иммунодефицитом с преобладанием дефицита антител включает все симптомы синдрома данной иммунологической недостаточности и признаки, присущие узелковой лимфоидной гиперплазии.
Больные отмечают болевые ощущения в области живота, преимущественно вокруг пупка. При значительном увеличении количества лимфоидных узелков боль становится приступообразной, а из-за периодической инвагинации может возникать кишечная непроходимость. Кроме того, характерны пищевые интолерантности, вздутие живота, диарея, потеря массы тела.
Средний возраст больных составляет 39,36+15,28 года, средняя продолжительность заболевания — 7,43±6,97 года, потеря массы тела — 7,33±3,8 кг. Установлена связь между развитием узелковой лимфоидной гиперплазии и лямблиозом. У данного контингента больных отмечен повышенный риск развития злокачественных опухолей.
В период обострения заболевания больные отмечают повышенную утомляемость, общую слабость, снижение или полную утрату трудоспособности.
Одним из постоянных признаков иммунной недостаточности при данной патологии является снижение резистентности организма к инфекциям. «Входными воротами» инфекции служат так называемые контактные поверхности: слизистая оболочка кишечника, дыхательные пути, кожа. При синдроме недостаточности антителообразования преобладают бактериальные инфекции, вызванные стафилококками, пневмококками, стрептококками, а также Haemophilus influenzae.
Характерны рецидивирующие хронические заболевания органов дыхания: повторные пневмонии, повторные трахеобронхиты, а также синуситы, отиты, циститы, хронический пиелонефрит, фурункулез. При длительном течении заболевания может развиться эмфизема легких, пневмосклероз. Одним из основных симптомов является возникновение спленомегалии.
Результаты исследований последних лет позволяют утверждать, что иммунодефицитам сопутствуют такие заболевания аутоиммунного характера, как гемолитическая и пернициозная анемии, аутоиммунная нейтропения, тромбоцитопеническая пурпура. Поражается также соединительная ткань: может развиться дерматомиозит, склеродермия, ревматоидный артрит. При синдроме недостаточности антителообразования чувствительность к вирусам энцефалита, менингита высока.
Поражается также соединительная ткань: может развиться дерматомиозит, склеродермия, ревматоидный артрит. При синдроме недостаточности антителообразования чувствительность к вирусам энцефалита, менингита высока.
Наиболее часто общему вариабельному иммунодефициту сопутствует синдром нарушенного всасывания различной степени тяжести (в 35-95% случаев), часто — II и III степени тяжести. Развитие синдрома нарушенного всасывания III степени тяжести сопровождается большой потерей массы тела, гипопротеинемическими отеками, анемией, гипокальциемической тетанией, остеомаляцией, гиперкатаболической экссудативной энтеропатией, снижением всасывания витамина B12 и электролитов.
Диагностика узелковой лимфоидной гиперплазии кишечника
Одним из главных признаков заболевания является снижение содержания в сыворотке крови всех трех классов иммуноглобулинов (А М, G), особенно значимое по классу А, который выполняет основную барьерную функцию в защите слизистой оболочки от проникновения чужеродных антигенов во внутреннюю среду организма. При данной форме иммунодефицита с узелковой лимфоидной гиперплазией у ряда больных наблюдалось значительное колебание содержания различных иммуноглобулинов, выявленных методом радиальной иммунодиффузии по Манчини. Однако применение в математической обработке непараметрических критериев, в частности Крускалла-Уоллеса, позволило выявить общую закономерность в изменении данных показателей: снижение уровня IgA до 36,16% от контрольного, принятого за 100% (р = 0,001), снижение содержания IgM до 90,54% (р = 0,002) и IgG до 87,59% (р = 0,001) от контрольных величин, принятых за 100%.
При данной форме иммунодефицита с узелковой лимфоидной гиперплазией у ряда больных наблюдалось значительное колебание содержания различных иммуноглобулинов, выявленных методом радиальной иммунодиффузии по Манчини. Однако применение в математической обработке непараметрических критериев, в частности Крускалла-Уоллеса, позволило выявить общую закономерность в изменении данных показателей: снижение уровня IgA до 36,16% от контрольного, принятого за 100% (р = 0,001), снижение содержания IgM до 90,54% (р = 0,002) и IgG до 87,59% (р = 0,001) от контрольных величин, принятых за 100%.
При математической обработке лабораторных данных 44 больных узелковой лимфоидной гиперплазией и общим вариабельным иммунодефицитом было установлено увеличение содержания лимфоцитов в периферической крови до 110,11 % (р = 0,002) по сравнению с контролем, принятым за 100%.
Однако результаты исследования P. van den Brande и соавт. (1988) показали, что при узелковой лимфоидной гиперплазии тонкой кишки и общем вариабельном иммунодефиците В-клетки периферической крови не могут продуцировать IgG in vitro в ответ на стимуляцию митогенами. У 2 из 5 обследованных пациентов с данной патологией продукция IgM была индуцирована in vitro, что свидетельствует о неполном блоке в дифференцировке В-клеток.
У 2 из 5 обследованных пациентов с данной патологией продукция IgM была индуцирована in vitro, что свидетельствует о неполном блоке в дифференцировке В-клеток.
При иммунологическом обследовании больных доброкачественной узелковой лимфоидной гиперплазией было снижено общее количество Т-лимфоцитов в периферической крови за счет уменьшения содержания Т-хелперов. Наблюдали увеличение количества Т-супрессоров, что может привести к дисбалансу пропорции CD4/CD8.
Исследование белкового спектра крови показало, что для узелковой лимфоидной гиперплазии и общего вариабельного иммунодефицита характерно статистически достоверное повышение содержания а-глобулинов до 141,57% (р = 0,001), бета-глобулинов — до 125,99% (р = 0,001) по сравнению с контрольными величинами, принятыми за 100%. Математическая обработка позволила выявить статистически достоверное снижение содержания в крови а-глобулинов, у-глобулинов, билирубина и холестерина. Сахарная кривая отличалась более сниженным приростом сахара в крови после нагрузки, свойственным синдрому нарушенного всасывания, по сравнению с нормой.
Структурно-фукциональной единицей доброкачественной узелковой лимфоидной гиперплазии является лимфоидный фолликул, в котором сбалансированы продукция, иммиграция, эмиграция клеток и их смерть
При общем вариабельном иммунодефиците лимфоидные узелки могут локализоваться в слизистой оболочке одного, двух или всех трех отделов тонкой кишки. Иногда в процесс вовлекаются антральный отдел желудка и толстая кишка.
Лимфоидные фолликулы располагаются непосредственно под покровным эпителием, вблизи базальной мембраны, или в поверхностных слоях собственной пластинки слизистой оболочки тонкой кишки. От мантийной зоны фолликулов по направлению к покровному эпителию отмечается миграция лимфоцитов в виде лимфоидных дорожек. В зоне lamina propria, расположенной между эпителием и фолликулами, сосредоточены В-лимфоциты, а также Т-лимфоциты двух подтипов: Т-хелперы и Т-супрессоры, из которых при общем вариабельном иммунодефиците преобладают Т-супрессоры.
В области расположения лимфоидных фолликулов ворсинки тонкой кишки нередко отсутствуют, поверхность слизистой оболочки сглажена.
В этих участках отмечается значительное увеличение высоты каемчатых энтероцитов, достигавших 52,5±5,0 мкт. Бокаловидные клетки единичные. Однако специализации энтероцитов в местах расположения лимфоидных фолликулов не наблюдалось. Отмечалось значительное увеличение количества интраэпителиальных лимфоцитов, представленных Т-супрессорами.
Результаты изучения светооптических препаратов, полученных из биоптата, взятого из различных отделов тонкой кишки, показали, что при узелковой лимфоидной гиперплазии и общем вариабельном иммунодефиците наблюдались истончение щеточной каемки энтероцитов, уменьшение содержания в ней нейтральных гликозаминогликанов, а также дистрофические изменения в цитоплазме. В строме собственной пластинки слизистой оболочки на фоне увеличенного содержания малых лимфоцитов и эозинофилов наблюдается уменьшение количества плазматических и лимфоплазмацитоидных клеток, особенно выраженное при тяжелом течении общего вариабельного иммунодефицита.
При одновременном электронно-микроскопическом исследовании биоптатов слизистой оболочки двенадцатиперстной, тощей и подвздошной кишки наблюдались однотипные изменения каемчатых энтероцитов ворсин.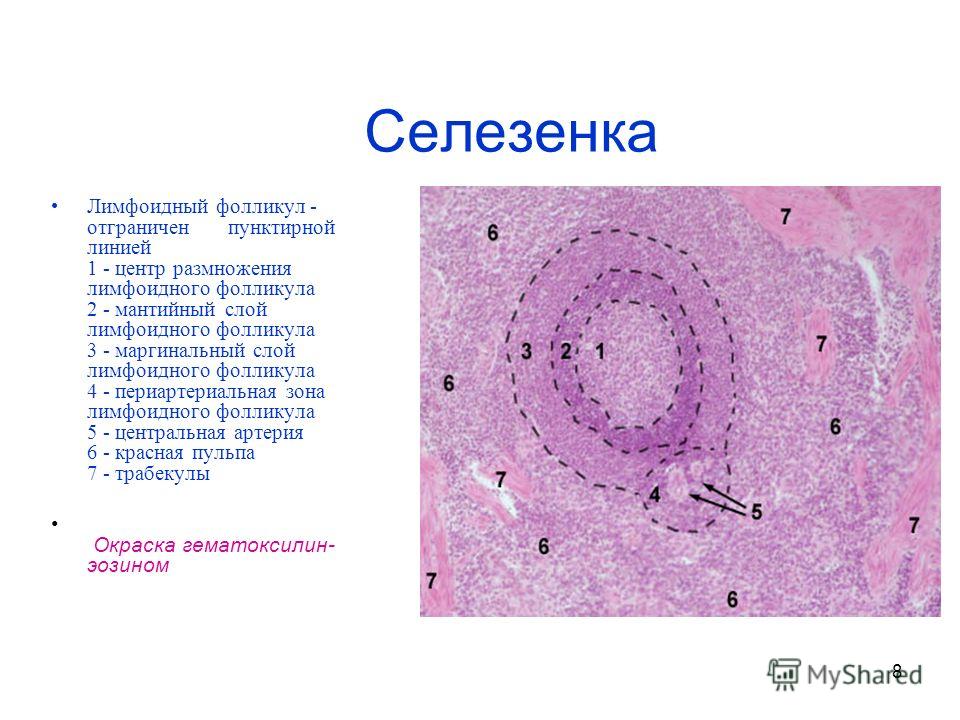 На апикальной поверхности ряда энтероцитов отмечали укорочение и разрежение микроворсинок, их нерегулярное расположение, а при развитии синдрома нарушенного всасывания III степени — локальное исчезновение. Гликокаликс на поверхности микроворсинок обнаружен в незначительном количестве, а местами он совсем отсутствовал. В цитоплазме многих энтероцитов выявлены различной степени выраженности признаки дезорганизации: расширение канальцев гранулярной и агранулярнои цитоплазматической сети, набухание митохондрий с уменьшением количества крист в их матриксе и образованием миелиноподобных структур, гипертрофия пластинчатого комплекса.
На апикальной поверхности ряда энтероцитов отмечали укорочение и разрежение микроворсинок, их нерегулярное расположение, а при развитии синдрома нарушенного всасывания III степени — локальное исчезновение. Гликокаликс на поверхности микроворсинок обнаружен в незначительном количестве, а местами он совсем отсутствовал. В цитоплазме многих энтероцитов выявлены различной степени выраженности признаки дезорганизации: расширение канальцев гранулярной и агранулярнои цитоплазматической сети, набухание митохондрий с уменьшением количества крист в их матриксе и образованием миелиноподобных структур, гипертрофия пластинчатого комплекса.
Лимфоидные фолликулы образованы герминативными центрами (фолликулярными, светлыми центрами) и мантийными зонами. Герминативные центры были нередко расширены. В их состав, согласно классификации К. Lennert (1978), входят следующие клеточные элементы: иммунобласты, центробласты, центроциты, малые лимфоциты, макрофаги, стромальные клетки. Мантийная зона образована центробластами, малыми лимфоцитами, плазматическими клетками и стромальными клеточными элементами. При изучении клеточного состава лимфоидных фолликулов с помощью моноклональных антител при доброкачественной узелковой лимфоидной гиперплазии и общем вариабельном иммунодефиците было обнаружено, что в их состав входят преимущественно В-лимфоциты, не дифференцирующиеся в Ig-продуцирующие клетки, и небольшое количество Т-клеток, среди которых было больше всего Т-супрессоров. Вокруг фолликулов также преобладали Т-супрессоры.
При изучении клеточного состава лимфоидных фолликулов с помощью моноклональных антител при доброкачественной узелковой лимфоидной гиперплазии и общем вариабельном иммунодефиците было обнаружено, что в их состав входят преимущественно В-лимфоциты, не дифференцирующиеся в Ig-продуцирующие клетки, и небольшое количество Т-клеток, среди которых было больше всего Т-супрессоров. Вокруг фолликулов также преобладали Т-супрессоры.
Однако A. D. В. Webster (1987) обнаружил IgM в еюнальном соке, а в собственной пластинке слизистой оболочки тонкой кишки — IgM-содержащие клетки, отмечалось также снижение интенсивности свечения плазматических клеток, содержащих IgA, IgM и IgG у больных общим вариабельным иммунодефицитом с узелковой лимфоидной гиперплазией, что свидетельствует о неполном блоке в дифференцировке В-лимфоцитов. Обоснованно предположение о том, что в области, расположенной вокруг фолликулов, созревание В-лимфоцитов до плазматических клеток, способных продуцировать иммуноглобулины, подавляется Т-супрессорами.
Результаты морфометрии клеточных элементов фолликулов доброкачественной узелковой лимфоидной гиперплазии с применением метода калиброванных квадратиков с последующей математической обработкой позволили выявить цикличность изменения герминативных центров и мантийных зон, включающих 6 основных фаз развития. В герминативных зонах выделены следующие фазы:
- I фаза — преобладание центробластов. В I фазе центробласты составляют 80% от всех клеточных элементов центра, центроциты -3,03%, макрофаги — 5,00%.
- II фаза — уменьшение содержания центробластов и возрастаниеколичества центроцитов. Во II фазе количество центробластов уменьшается до 59,96%, центроцитов повышается до 22,00%, малых лимфоцитов — до 7,09%.
- III фаза — одинаковое содержание центроцитов и центробластов. В III фазе количество центробластов составляет 39,99%, центроцитов — 40,0%, малых лимфоцитов — 9,93%, макрофагов — 3,53%.
- IV фаза — уменьшение содержания центробластов и центроцитов и повышение количества малых лимфоцитов.
 В IV фазе содержание центробластов понижается до 25,15%, центроцитов составляет 30,04%, малых лимфоцитов увеличивается до 33,76%, макрофагов составляет 2,98%.
В IV фазе содержание центробластов понижается до 25,15%, центроцитов составляет 30,04%, малых лимфоцитов увеличивается до 33,76%, макрофагов составляет 2,98%. - V фаза — прогрессивная трансформация герминативного центра. В V фазе развития герминативного центра центробласты содержатся в небольшом количестве, составляя 3,03%; количество центроцитов уменьшается до 10,08%, преобладают малые лимфоциты, уровень которых возрастает до 75,56%. В массе малых лимфоцитов теряются другие клеточные элементы.
- VI фаза — регрессивная трансформация герминативного центра. В VI фазе герминативный центр выражен незначительно. Преобладают стромальные клетки, составляющие 93,01% от всех клеточных элементов герминативного центра. Малые лимфоциты немногочисленны.
Содержание иммунобластов во всех фазах варьирует от 1,0% до 0. Хорошо развитая модель «звездного неба» наблюдалась в I, II, III, IV и V фазах.
В мантийной зоне соотношение клеточных элементов стабильнее: преобладают малые лимфоциты. Однако и в данной зоне наблюдаются циклические изменения: постепенное уменьшение содержания центробластов и малых лимфоцитов, наиболее выраженное в VI фазе, увеличение содержания стромальных клеток.
Однако и в данной зоне наблюдаются циклические изменения: постепенное уменьшение содержания центробластов и малых лимфоцитов, наиболее выраженное в VI фазе, увеличение содержания стромальных клеток.
При доброкачетвенной гиперплазии лимфоидных фолликулов при общем вариабельном иммунодефиците в отличие от цикла герминативных центров в норме отсутствует зональное распределение центробластов и центроцитов в герминативном центре, «звездное небо» не является самостоятельной фазой, характерна фаза прогрессивной и регрессивной трансформации герминативного центра, что наблюдается при неспецифическом лимфадените у человека.
VI фаза доброкачественной узелковой лимфоидной гиперплазии чаще развивается у больных с тяжелыми формами общего вариабельного иммунодефицита, являясь прогностически неблагоприятным признаком.
При общем вариабельном иммунодефиците с доброкачественной узелковой лимфоидной гиперплазией страдает секреторная иммунная система.
Прослеживается определенная связь между количеством, распространенностью, фазами развития лимфоидных фолликулов доброкачественной узелковой лимфоидной гиперплазии и выраженностью клинической картины заболевания.
При общем вариабельном иммунодефиците, сопровождающемся развитием доброкачественной узелковой лимфоидной гиперплазии или без нее, больные должны в течение всей жизни получать заместительное лечение у-глобулином, при синдроме нарушенного всасывания без атрофии слизистой оболочки — диету № 4-4в. Лечение хронической диареи проводят коррекцией метаболических нарушений. Назначают повторные курсы антибактериальной терапии, при показаниях — курсы лечения лямблиоза.
Цикличность в развитии доброкачественной узелковой лимфоидной гиперплазии диктует необходимость ранней диагностики общего вариабельного иммунодефицита с обязательным эндоскопическим исследованием тонкой кишки и последующим морфофункциональным анализом.
Доброкачественная узелковая лимфоидная гиперплазия, являясь частым спутником общего вариабельного иммунодефицита, может также развиться при патологии тонкой кишки с повышенным содержанием иммуноглобулинов в сыворотке крови, однако она имеет ряд клинико-морфологических особенностей.
Больные с абдоминальным дискомфортом, диареей, дисбалансом в иммунной системе, сопровождающихся развитием доброкачественной узелковой лимфоидной гиперплазии тонкой кишки, должны обследоваться более тщательно и всесторонне.
Узловая лимфоидная гиперплазия желудочно-кишечного тракта у взрослых пациентов: обзор
1. Ranchod M, Lewin KJ, Dorfman RF. Лимфоидная гиперплазия желудочно-кишечного тракта. Изучение 26 случаев и обзор литературы. Ам Дж. Сург Патол. 1978; 2: 383–400. [PubMed] [Google Scholar]
2. Rambaud JC, De Saint-Louvent P, Marti R, Galian A, Mason DY, Wassef M, Licht H, Valleur P, Bernier JJ. Диффузная фолликулярная лимфоидная гиперплазия тонкой кишки без первичного иммуноглобулинового дефицита. Am J Med. 1982;73:125–132. [PubMed] [Google Scholar]
3. Рубио-Тапия А., Эрнандес-Каллерос Дж., Тринидад-Эрнандес С., Усканга Л. Клинические характеристики группы взрослых с узловой лимфоидной гиперплазией: опыт одного центра. Мир J Гастроэнтерол. 2006; 12:1945–1948. [PMC free article] [PubMed] [Google Scholar]
[PMC free article] [PubMed] [Google Scholar]
4. Баран Б., Гуллуоглу М., Акюз Ф. Узловая лимфоидная гиперплазия двенадцатиперстной кишки, вызванная лямблиозом. Клин Гастроэнтерол Гепатол. 2013;11:А22. [PubMed] [Академия Google]
5. Шварц Д.С., Коул К.Е., Сан Ю., Джейкоби Р.Ф. Диффузная узловая лимфоидная гиперплазия толстой кишки: синдром полипоза или вариант нормы? Гастроинтест Эндоск. 2003; 58: 630–632. [PubMed] [Google Scholar]
6. Айдукевич А.Б., Янгс Г.Р., Бушье И.А. Узловая лимфоидная гиперплазия с гипогаммаглобулинемией. Кишка. 1972; 13: 589–595. [PMC free article] [PubMed] [Google Scholar]
7. Colarian J, Calzada R, Jaszewski R. Узловая лимфоидная гиперплазия толстой кишки у взрослых: распространена ли она? Гастроинтест Эндоск. 1990;36:421–422. [PubMed] [Google Scholar]
8. История болезни Массачусетской больницы общего профиля. Еженедельные клинико-патологические упражнения. Дело 8-1997. 65-летний мужчина с периодическими болями в животе в течение пяти лет.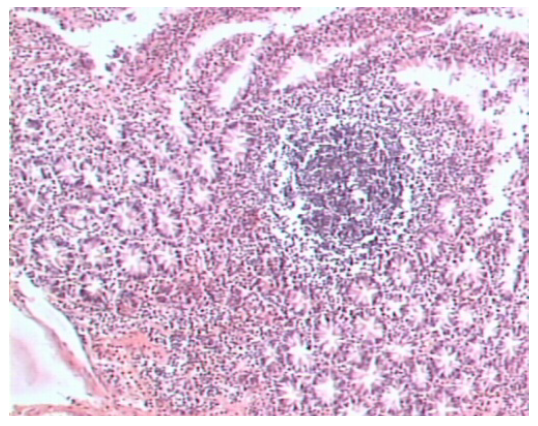 N Engl J Med. 1997; 336: 786–793. [PubMed] [Google Scholar]
N Engl J Med. 1997; 336: 786–793. [PubMed] [Google Scholar]
9. Swartley RN, Stayman JW. Лимфоидная гиперплазия кишечного тракта, требующая оперативного вмешательства. Энн Сург. 1962; 155: 238–240. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Canto J, Arista J, Hernández J. [Узловая лимфоидная гиперплазия кишечника. Клинико-патологические характеристики в 11 случаях] Rev Invest Clin. 1990;42:198–203. [PubMed] [Google Scholar]
11. Hermans PE, Huizenga KA, Hoffman HN, Brown AL, Markowitz H. Дисгаммаглобулинемия, связанная с узловой лимфоидной гиперплазией тонкой кишки. Am J Med. 1966; 40: 78–89. [PubMed] [Google Scholar]
12. Colón AR, DiPalma JS, Leftridge CA. Кишечная лимфонодулярная гиперплазия детского возраста: особенности проявления. Дж. Клин Гастроэнтерол. 1991; 13: 163–166. [PubMed] [Google Scholar]
13. Iacono G, Ravelli A, Di Prima L, Scalici C, Bolognini S, Chiappa S, Pirrone G, Licastri G, Carroccio A. Лимфоидная узловая гиперплазия толстой кишки у детей: связь с пищевой гиперчувствительностью . Клин Гастроэнтерол Гепатол. 2007; 5: 361–366. [PubMed] [Академия Google]
Клин Гастроэнтерол Гепатол. 2007; 5: 361–366. [PubMed] [Академия Google]
14. Вебстер А.Д. Заболевания кишечника и иммунодефицитные состояния. Клин Гастроэнтерол. 1976; 5: 323–340. [PubMed] [Google Scholar]
15. Kiefte-de Jong JC, Escher JC, Arends LR, Jaddoe VW, Hofman A, Raat H, Moll HA. Факторы питания младенцев и функциональные запоры в детстве: исследование Generation R. Am J Гастроэнтерол. 2010; 105:940–945. [PubMed] [Google Scholar]
16. Tokuhara D, Watanabe K, Okano Y, Tada A, Yamato K, Mochizuki T, Takaya J, Yamano T, Arakawa T. Беспроводная капсульная эндоскопия у детей: первая серия из Японии . J Гастроэнтерол. 2010; 45: 683–69.1. [PubMed] [Google Scholar]
17. Ward EM, Wolfsen HC. Обзорная статья: синдромы ненаследственного полипоза желудочно-кишечного тракта. Алимент Фармакол Тер. 2002; 16: 333–342. [PubMed] [Google Scholar]
18. Хуроо М.С., Хуроо Н.С., Хуроо М.С. Диффузная узловая лимфоидная гиперплазия двенадцатиперстной кишки: большая группа пациентов, этиологически связанных с инфекцией Helicobacter pylori. БМК Гастроэнтерол. 2011;11:36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
БМК Гастроэнтерол. 2011;11:36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Hermans PE, Diaz-Buxo JA, Stobo JD. Идиопатический дефицит иммуноглобулинов с поздним началом. Клинические наблюдения у 50 больных. Am J Med. 1976;61:221–237. [PubMed] [Google Scholar]
20. Chiaramonte C, Glick SN. Узловая лимфоидная гиперплазия тонкой кишки, осложненная лимфомой тощей кишки, у больного с распространенным вариабельным синдромом иммунодефицита. AJR Am J Рентгенол. 1994; 163:1118–1119. [PubMed] [Google Scholar]
21. Rubio CA. Непротрузионные колоректальные новообразования: эпидемиологическая точка зрения. Мир J Surg. 2000; 24:1098–1103. [PubMed] [Google Scholar]
22. Lai Ping So A, Mayer L. Желудочно-кишечные проявления первичных иммунодефицитных состояний. Семин Гастроинтест Дис. 1997;8:22–32. [PubMed] [Google Scholar]
23. Washington K, Stenzel TT, Buckley RH, Gottfried MR. Патология желудочно-кишечного тракта у больных с общим вариабельным иммунодефицитом и Х-сцепленной агаммаглобулинемией. Ам Дж. Сург Патол. 1996; 20:1240–1252. doi: 10.1097/00000478-199610000-00010. [PubMed] [CrossRef] [Google Scholar]
Ам Дж. Сург Патол. 1996; 20:1240–1252. doi: 10.1097/00000478-199610000-00010. [PubMed] [CrossRef] [Google Scholar]
24. Luzi G, Zullo A, Iebba F, Rinaldi V, Sanchez Mete L, Muscaritoli M, Aiuti F. Дуоденальная патология и клинико-иммунологические последствия у пациентов с общим вариабельным иммунодефицитом. Am J Гастроэнтерол. 2003;98:118–121. [PubMed] [Google Scholar]
25. Атарод Л., Раисси А., Агамохаммади А., Фархуди А., Ходадад А., Мойн М., Пурпак З., Мовахеди М., Чарагозлоу М., Резаи Н. Обзор желудочно-кишечных расстройств у пациентов с первичным иммунодефицитах антител за 10-летний период (1990-2000 гг.), в медицинском центре детской больницы. Иран J Аллергия Астма Иммунол. 2003; 2: 75–79. [PubMed] [Google Scholar]
26. Teahon K, Webster AD, Price AB, Weston J, Bjarnason I. Исследования энтеропатии, связанной с первичной гипогаммаглобулинемией. Кишка. 1994;35:1244–1249. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Nagura H, Kohler PF, Brown WR. Иммуноцитохимическая характеристика лимфоцитов при узловой лимфоидной гиперплазии кишечника. Лаборатория Инвест. 1979; 40: 66–73. [PubMed] [Google Scholar]
Иммуноцитохимическая характеристика лимфоцитов при узловой лимфоидной гиперплазии кишечника. Лаборатория Инвест. 1979; 40: 66–73. [PubMed] [Google Scholar]
28. Webster AD, Kenwright S, Ballard J, Shiner M, Slavin G, Levi AJ, Loewi G, Asherson GL. Узловая лимфоидная гиперплазия кишечника при первичной гипогаммаглобулинемии: изучение функции лимфоцитов in vivo и in vitro. Кишка. 1977;18:364–372. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Ходадад А., Агамохаммади А., Парванех Н., Резаи Н., Махджуб Ф., Башашати М., Мовахеди М., Фазлоллахи М.Р., Занди Ф., Рухи З. и др. Желудочно-кишечные проявления у больных с общим вариабельным иммунодефицитом. Dig Dis Sci. 2007; 52: 2977–2983. [PubMed] [Google Scholar]
30. Said-Criado I, Gil-Aguado A. Узловая лимфоидная гиперплазия при общем вариабельном иммунодефиците. Ланцет. 2014;383:e2. [PubMed] [Академия Google]
31. Bästlein C, Burlefinger R, Holzberg E, Voeth C, Garbrecht M, Ottenjann R. Общий синдром вариабельного иммунодефицита и узловая лимфоидная гиперплазия в тонкой кишке. Эндоскопия. 1988; 20: 272–275. [PubMed] [Google Scholar]
Эндоскопия. 1988; 20: 272–275. [PubMed] [Google Scholar]
32. Postgate A, Despott E, Talbot I, Phillips R, Aylwin A, Fraser C. Необычная причина диареи: диффузная узловая лимфоидная гиперплазия кишечника в сочетании с селективным дефицитом иммуноглобулина A (с видео ) Гастроинтест Эндоск. 2009; 70: 168–19.; обсуждение 169. [PubMed] [Google Scholar]
33. Jacobson KW, deShazo RD. Селективный дефицит иммуноглобулина А, связанный с модульной лимфоидной гиперплазией. J Аллергия Клин Иммунол. 1979; 64: 516–521. [PubMed] [Google Scholar]
34. Пясчик М., Рыдзевска Г., Павлик М., Милевский Дж., Фурманек М.И., Вронска Е., Полковский М., Бутрук Е. Диффузная узловая лимфоидная гиперплазия желудочно-кишечного тракта у пациентов с селективным дефицитом иммуноглобулина А. и саркоид-подобный синдром — клинический случай. Adv Med Sci. 2007;52:296–300. [PubMed] [Google Scholar]
35. Joo M, Shim SH, Chang SH, Kim H, Chi JG, Kim NH. Узелковая лимфоидная гиперплазия и гистологические изменения, имитирующие глютеновую болезнь, коллагеновую спру и лимфоцитарный колит у пациента с селективным дефицитом IgA. Патол Res Pract. 2009; 205: 876–880. [PubMed] [Google Scholar]
Патол Res Pract. 2009; 205: 876–880. [PubMed] [Google Scholar]
36. Levendoglu H, Rosen Y. Узловая лимфоидная гиперплазия кишечника при ВИЧ-инфекции. Am J Гастроэнтерол. 1992; 87: 1200–1202. [PubMed] [Google Scholar]
37. Агарвал С., Майер Л. Диагностика и лечение желудочно-кишечных расстройств у пациентов с первичным иммунодефицитом. Клин Гастроэнтерол Гепатол. 2013; 11:1050–1063. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Олмез С., Аслан М., Явуз А., Булут Г., Дульгер А.С. Диффузная узловая лимфоидная гиперплазия тонкой кишки, связанная с общим вариабельным иммунодефицитом и лямблиозом: редкий клинический случай. Вена Клин Wochenschr. 2014; 126: 294–297. [PubMed] [Google Scholar]
39. de Weerth A, Gocht A, Seewald S, Brand B, van Lunzen J, Seitz U, Thonke F, Fritscher-Ravens A, Soehendra N. Узловая лимфоидная гиперплазия двенадцатиперстной кишки, вызванная инфекцией лямблиоза у пациента с иммунодефицитом. Гастроинтест Эндоск. 2002; 55: 605–607. [PubMed] [Академия Google]
[PubMed] [Академия Google]
40. Онбаши К., Гюншар Ф., Син А.З., Ардениз О., Кокулудаг А., Себик Ф. Общий вариабельный иммунодефицит (ОВИН), проявляющийся мальабсорбцией из-за лямблиоза. Терк Дж. Гастроэнтерол. 2005; 16: 111–113. [PubMed] [Google Scholar]
41. Ward H, Jalan KN, Maitra TK, Agarwal SK, Mahalanabis D. Узловая лимфоидная гиперплазия тонкой кишки у пациентов с лямблиозом и нормальными сывороточными иммуноглобулинами. Кишка. 1983; 24: 120–126. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Misra SP, Misra V, Dwivedi M, Singh PA. Helicobacter pylori-индуцированная лимфонодулярная гиперплазия: новая причина обструкции выхода из желудка. J Гастроэнтерол Гепатол. 1998;13:1191–1194. [PubMed] [Google Scholar]
43. Shull LN, Fitts CT. Лимфоидный полипоз, связанный с семейным полипозом и синдромом Гарднера. Энн Сург. 1974; 180:319–322. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Dorazio RA, Whelan TJ. Лимфоидная гиперплазия терминального отдела подвздошной кишки, связанная с семейным полипозом толстой кишки. Энн Сург. 1970; 171: 300–302. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Энн Сург. 1970; 171: 300–302. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Thomford NR, Greenberger NJ. Лимфоидные полипы подвздошной кишки, ассоциированные с синдромом Гарднера. Арка Сур. 1968;96:289–291. [PubMed] [Google Scholar]
46. Venkitachalam PS, Hirsch E, Elguezabal A, Littman L. Множественный лимфоидный полипоз и семейный полипоз толстой кишки: генетическая связь. Расстройство прямой кишки. 1977; 21: 336–341. [PubMed] [Google Scholar]
47. Monsanto P, Lérias C, Almeida N, Lopes S, Cabral JE, Figueiredo P, Silva M, Julião M, Gouveia H, Sofia C. Кишечная узловая лимфоидная гиперплазия и внекишечная лимфома — редкая ассоциация. Акта Гастроэнтерол Белг. 2012; 75: 260–262. [PubMed] [Академия Google]
48. Матучанский С., Тушар Г., Лемэр М., Бабин П., Демеок Ф., Фонк Ю., Мейер М., Преуд’Хомм Дж. Л. Злокачественная лимфома тонкой кишки, ассоциированная с диффузной узловой лимфоидной гиперплазией. N Engl J Med. 1985; 313: 166–171. [PubMed] [Google Scholar]
49. Garg V, Lipka S, Rizvon K, Singh J, Rashid S, Mustacchia P. Диффузная узловая лимфоидная гиперплазия кишечника при селективном дефиците подкласса IgG 2, аутоиммунном тиреоидите и аутоиммунной гемолитической анемии: отчет о клиническом случае и обзор литературы. J Желудочно-кишечный тракт печени Dis. 2012;21:431–434. [PubMed] [Академия Google]
Garg V, Lipka S, Rizvon K, Singh J, Rashid S, Mustacchia P. Диффузная узловая лимфоидная гиперплазия кишечника при селективном дефиците подкласса IgG 2, аутоиммунном тиреоидите и аутоиммунной гемолитической анемии: отчет о клиническом случае и обзор литературы. J Желудочно-кишечный тракт печени Dis. 2012;21:431–434. [PubMed] [Академия Google]
50. Чандра С. Доброкачественная узловая лимфоидная гиперплазия толстой кишки: отчет о двух случаях. Индийский J Гастроэнтерол. 2003; 22: 145–146. [PubMed] [Google Scholar]
51. Шухайбер Дж., Дженнингс Л., Бергер Р. Узловая лимфоидная гиперплазия: причина скрытого массивного желудочно-кишечного кровотечения. J Pediatr Surg. 2005;40:E17–E19. [PubMed] [Google Scholar]
52. Джонс Д.Р., Хоффман Дж., Дауни Р., Хаккани М. Массивное желудочно-кишечное кровотечение, связанное с гиперплазией подвздошной лимфоидной ткани при болезни Гоше. Постград Мед J. 1991;67:479–481. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Freiman JS, Gallagher ND. Увеличение брыжеечных узлов как причина кровотечения из варикозно расширенных вен кишечника при узловой лимфоидной гиперплазии. Дж. Клин Гастроэнтерол. 1985; 7: 422–424. [PubMed] [Google Scholar]
Увеличение брыжеечных узлов как причина кровотечения из варикозно расширенных вен кишечника при узловой лимфоидной гиперплазии. Дж. Клин Гастроэнтерол. 1985; 7: 422–424. [PubMed] [Google Scholar]
54. Ersoy E, Gündoğdu H, Uğraş NS, Aktimur R. Случай диффузной узловой лимфоидной гиперплазии. Терк Дж. Гастроэнтерол. 2008; 19: 268–270. [PubMed] [Google Scholar]
55. Бхарадвадж Г., Триадафилопулос Г. Эндоскопические проявления лимфоидных узлов толстой кишки: новые грани старого гистопатологического образования. Am J Гастроэнтерол. 1995;90:946–950. [PubMed] [Google Scholar]
56. Smith MB, Blackstone MO. Лимфоидные узлы толстой кишки: еще одна причина симптома красного кольца. Гастроинтест Эндоск. 1991; 37: 206–208. [PubMed] [Google Scholar]
57. Straub RF, Wilcox CM, Schwartz DA. Вариабельный эндоскопический вид лимфоидной ткани толстой кишки. Дж. Клин Гастроэнтерол. 1994;19:158–64; обсуждение 164-5. [PubMed] [Google Scholar]
58. Molaei M, Kaboli A, Fathi AM, Mashayekhi R, Pejhan S, Zali MR. Узловая лимфоидная гиперплазия при общем синдроме вариабельного иммунодефицита, имитирующая семейный аденоматозный полипоз при эндоскопии. Индиан Дж. Патол Микробиол. 2009 г.;52:530–533. [PubMed] [Google Scholar]
Узловая лимфоидная гиперплазия при общем синдроме вариабельного иммунодефицита, имитирующая семейный аденоматозный полипоз при эндоскопии. Индиан Дж. Патол Микробиол. 2009 г.;52:530–533. [PubMed] [Google Scholar]
59. Bayraktar Y, Ersoy O, Sokmensuer C. Результаты капсульной эндоскопии у пациентов с синдромом общего вариабельного иммунодефицита. Гепатогастроэнтерология. 2007; 54: 1034–1037. [PubMed] [Google Scholar]
60. Шифф А.Д., Шихан Д.Г., Шварц С.С. Узловая лимфоидная гиперплазия в дефункционализированной толстой кишке. Гастроинтест Эндоск. 1973; 19: 144–145. [PubMed] [Google Scholar]
61. Леонидас Дж. К., Красна И. Х., Штраус Л., Беккер Дж. М., Шнайдер К. М. Рентгенограмма исключенной кишки после колостомии по поводу детской болезни Гиршпрунга. Am J Roentgenol Radium Ther Nucl Med. 1971;112:116–122. [PubMed] [Google Scholar]
62. Tomita S, Kojima M, Imura J, Ueda Y, Koitabashi A, Suzuki Y, Nakamura Y, Mitani K, Terano A, Fujimori T. Диффузная узловая лимфоидная гиперплазия толстой кишки без гипогаммаглобулинемия или синдром мальабсорбции: клинический случай и обзор литературы. Международный Дж. Сург Патол. 2002; 10: 297–302. [PubMed] [Google Scholar]
Международный Дж. Сург Патол. 2002; 10: 297–302. [PubMed] [Google Scholar]
63. Ruskoné-Fourmestraux A, Delmer A, Lavergne A, Molina T, Brousse N, Audouin J, Rambaud JC. Множественный лимфоматозный полипоз желудочно-кишечного тракта: проспективное клинико-патологическое исследование 31 случая. Groupe D’Etude des Lymphomes Digestifs. Гастроэнтерология. 1997;112:7–16. [PubMed] [Google Scholar]
64. Yatabe Y, Nakamura S, Nakamura T, Seto M, Ogura M, Kimura M, Kuhara H, Kobayashi T, Taniwaki M, Morishima Y, et al. Множественные полиповидные поражения первичной лимфоидной лимфомы толстой кишки, ассоциированной со слизистой оболочкой. Гистопатология. 1998; 32: 116–125. [PubMed] [Google Scholar]
65. Йошино Т., Мияке К., Ичимура К., Маннами Т., Охара Н., Хамазаки С., Акаги Т. Увеличение частоты фолликулярной лимфомы в двенадцатиперстной кишке. Ам Дж. Сург Патол. 2000; 24: 688–69.3. [PubMed] [Google Scholar]
66. Jeon JY, Lim SG, Kim JH, Lee KM, Cho SR, Han JH. Узловая лимфоидная гиперплазия желудка у больного с множественными подслизистыми опухолями. Кровь Рез. 2013; 48: 287–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Кровь Рез. 2013; 48: 287–291. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Ament ME, Rubin CE. Связь лямблиоза с аномальной структурой и функцией кишечника при синдромах желудочно-кишечного иммунодефицита. Гастроэнтерология. 1972; 62: 216–226. [PubMed] [Google Scholar]
68. Ryan JC. Предраковые состояния тонкой кишки. Семин Гастроинтест Дис. 1996;7:88–93. [PubMed] [Google Scholar]
69. Кастеллано Г., Морено Д., Гальвао О., Баллестин К., Колина Ф., Мольехо М., Морильяс Д.Д., Солис Эррузо Д.А. Злокачественная лимфома тощей кишки с распространенной вариабельной гипогаммаглобулинемией и диффузной узловой гиперплазией тонкой кишки. Тематическое исследование и обзор литературы. Дж. Клин Гастроэнтерол. 1992; 15: 128–135. [PubMed] [Google Scholar]
70. Harris M, Blewitt RW, Davies VJ, Steward WP. Неходжкинская лимфома высокой степени злокачественности, осложняющая полиповидно-узелковую лимфоидную гиперплазию и множественный лимфоматозный полипоз кишечника. Гистопатология. 1989;15:339–350. [PubMed] [Google Scholar]
Гистопатология. 1989;15:339–350. [PubMed] [Google Scholar]
71. Кан Л.Б., Новис Б.Х. Узловая лимфоидная гиперплазия тонкой кишки, связанная с первичной ретикулярно-клеточной лимфомой тонкой кишки. Рак. 1974; 33: 837–844. [PubMed] [Google Scholar]
72. Lamers CB, Wagener T, Assmann KJ, van Tongeren JH. Тощекишечная лимфома у пациента с первичной гипогаммаглобулинемией во взрослом возрасте и узловой лимфоидной гиперплазией тонкой кишки. Dig Dis Sci. 1980; 25: 553–557. [PubMed] [Академия Google]
73. Агилар Ф.П., Альфонсо В., Ривас С., Лопес Альдегер Дж., Портилья Дж., Беренгер Дж. Злокачественная лимфома тощей кишки у пациента с гипогамма-глобулинемией во взрослом возрасте и узловой лимфоидной гиперплазией тонкой кишки. Am J Гастроэнтерол. 1987; 82: 472–475. [PubMed] [Google Scholar]
74. Gonzalez-Vitale JC, Gomez LG, Goldblum RM, Goldman AS, Patterson M. Иммунобластная лимфома тонкой кишки, осложняющая поздний иммунодефицит. Рак. 1982; 49: 445–449. [PubMed] [Академия Google]
75. Дарем Дж. К., Стивенс Д. С., Римланд Д., Нассар В. Х., Спира Т. Дж. Распространенная вариабельная гипогаммаглобулинемия, осложненная необычной Т-супрессорной/цитотоксикоклеточной лимфомой. Рак. 1987; 59: 271–276. [PubMed] [Google Scholar]
Дарем Дж. К., Стивенс Д. С., Римланд Д., Нассар В. Х., Спира Т. Дж. Распространенная вариабельная гипогаммаглобулинемия, осложненная необычной Т-супрессорной/цитотоксикоклеточной лимфомой. Рак. 1987; 59: 271–276. [PubMed] [Google Scholar]
76. Matuchansky C, Morichau-Beauchant M, Touchard G, Lenormand Y, Bloch P, Tanzer J, Alcalay D, Babin P. Узловая лимфоидная гиперплазия тонкой кишки, связанная с первичной злокачественной лимфомой тощей кишки . Доказательства в пользу цитогенетической связи. Гастроэнтерология. 1980;78:1587–1592. [PubMed] [Google Scholar]
77. Schaefer PS, Friedman AC. Узловая лимфоидная гиперплазия тонкой кишки с лимфомой Беркитта и дисгаммаглобулинемией. Гастроинтест Радиол. 1981; 6: 325–328. [PubMed] [Google Scholar]
78. Jonsson OT, Birgisson S, Reykdal S. Разрешение узловой лимфоидной гиперплазии желудочно-кишечного тракта после химиотерапии внекишечной лимфомы. Dig Dis Sci. 2002; 47: 2463–2465. [PubMed] [Google Scholar]
Отчет о клиническом случае: Кишечная узловая лимфоидная гиперплазия как первое проявление активированного синдрома PI3Kδ из-за нового варианта PIK3CD
Введение
Лимфоидные фолликулы являются частью лимфоидной ткани, ассоциированной с кишечником (GALT), и в норме могут быть обнаружены в слизистом и подслизистом слоях желудочно-кишечного тракта, где они в основном участвуют в иммунном надзоре и восстановлении слизистой оболочки (1). Физиологически они располагаются преимущественно в терминальном отделе подвздошной кишки и в аноректальной области, тогда как в желудке и двенадцатиперстной кишке они представлены незначительно (1).
Физиологически они располагаются преимущественно в терминальном отделе подвздошной кишки и в аноректальной области, тогда как в желудке и двенадцатиперстной кишке они представлены незначительно (1).
Кишечная узловая лимфоидная гиперплазия (НЛГ) — доброкачественное лимфопролиферативное заболевание, характеризующееся диффузной или очаговой гиперплазией лимфоидных фолликулов вдоль кишечника из-за скопления незлокачественных лимфоидных клеток в слизистой оболочке кишечника (2). При эндоскопии НЛГ определяется как скопление ≥10 выдавливающихся лимфоидных узелков, каждый диаметром не менее 2 мм (3). В основном наблюдается в тонком кишечнике, реже в толстом кишечнике и реже в желудке или двенадцатиперстной кишке. Гистологически НЛГ характеризуется наличием полиморфных гиперпластических лимфоидных фолликулов с высокоактивными центрами зародыша и четко выраженными лимфоцитарными мантиями и ограничивается собственной пластинкой и/или поверхностной подслизистой оболочкой (2, 4). Точная эпидемиология НЛГ неизвестна, так как опубликованная литература в основном включает описания случаев и небольшие серии пациентов. НЛГ наблюдается в любом возрасте, но чаще всего о нем сообщают в детстве (4). Клинические проявления включают диарею, нарушение всасывания, желудочно-кишечное кровотечение и боль в животе, но у многих больных заболевание может протекать бессимптомно, а НЛГ может быть случайной находкой (5, 6). Несмотря на то, что НЛГ является неклональным доброкачественным поражением, его наличие было сообщено как фактор риска кишечной лимфомы (4). Патогенез НЛГ в значительной степени неизвестен, но с его развитием связаны несколько состояний. К ним относятся вирусные (ЦМВ, ВЭБ и ВИЧ), бактериальные ( Helicobacter pylori, Yersinia enterocolitica ) или паразитарные ( Giardia lamblia ) инфекции, аллергия на белок коровьего молока, семейная средиземноморская лихорадка (ССЛ) и другие врожденные нарушения иммунитета (ИЭИ) (3, 7). Среди пациентов с ИЭИ НЛГ ассоциируется с общим вариабельным иммунодефицитом и селективным дефицитом IgA (2). На сегодняшний день ни одно генетически обусловленное заболевание, кроме ССЛ, не вызывает изолированную НХЛ.
НЛГ наблюдается в любом возрасте, но чаще всего о нем сообщают в детстве (4). Клинические проявления включают диарею, нарушение всасывания, желудочно-кишечное кровотечение и боль в животе, но у многих больных заболевание может протекать бессимптомно, а НЛГ может быть случайной находкой (5, 6). Несмотря на то, что НЛГ является неклональным доброкачественным поражением, его наличие было сообщено как фактор риска кишечной лимфомы (4). Патогенез НЛГ в значительной степени неизвестен, но с его развитием связаны несколько состояний. К ним относятся вирусные (ЦМВ, ВЭБ и ВИЧ), бактериальные ( Helicobacter pylori, Yersinia enterocolitica ) или паразитарные ( Giardia lamblia ) инфекции, аллергия на белок коровьего молока, семейная средиземноморская лихорадка (ССЛ) и другие врожденные нарушения иммунитета (ИЭИ) (3, 7). Среди пациентов с ИЭИ НЛГ ассоциируется с общим вариабельным иммунодефицитом и селективным дефицитом IgA (2). На сегодняшний день ни одно генетически обусловленное заболевание, кроме ССЛ, не вызывает изолированную НХЛ. Мы сообщаем здесь о пациенте с синдромом активированной PI3 киназы δ (APDS) из-за нового варианта в PIK3CD с изолированной тяжелой НХЛ.
Мы сообщаем здесь о пациенте с синдромом активированной PI3 киназы δ (APDS) из-за нового варианта в PIK3CD с изолированной тяжелой НХЛ.
Материалы и методы.
Генетический анализ. ).
Культура клеток
Мононуклеарные клетки периферической крови человека (РВМС) выделяли центрифугированием в градиенте плотности Фиколла, дважды промывали в стерильном растворе Hank’s BSS (BioConcept, Allschwil, CH) и ресуспендировали в концентрации 1 × 10 6 клеток/мл с полной средой RPMI-1640 (Biochrom AG, Berlin, DE), содержащей 10% фетальной телячьей сыворотки (FBS), 2 мМ L -глутамин (Life Technologies, Карлсбад, США) и пенициллин/стрептомицин антибиотики (100 ЕД/мл, Life Technologies, Карлсбад, США). Клетки стимулировали 1 мкг/мл анти-CD3-антитела (BD Biosciences, США) и 100 МЕ/мл человеческого IL-2 (Cell Guidance Systems, Великобритания). Контрольные клетки культивировали без IL-2 и анти-CD3-антитела. Через 3 дня стимулированные Т-клетки и контрольные клетки промывали и собирали для лизиса.
Вестерн-блоттинг
Белки экстрагировали из активированных Т-клеток с помощью T-PER и 5 М буфера для лизиса NaCl вместе со смесью ингибиторов протеазы и фосфатазы (Sigma-Aldrich, Darmstadt, DE). Белок количественно определяли с помощью набора для анализа белка Pierce BSA (Thermo Fisher Scientific, Великобритания). Равные количества белков (20 мкг) разделяли с использованием гелей SDS-PAGE и переносили на поливинилидендифторидные (PVDF) мембраны Immobilon-p (Merck-Millipore, Darmstadt, DE). Мембраны блокировали с помощью I-block™ (Thermo Fisher Scientific, Waltham, MA) в течение не менее 1 ч при комнатной температуре, а затем инкубировали в течение ночи при 4°C при постоянном встряхивании с первичным антителом против p-Akt Ser 473 (Cell Signaling). Technology, IT) или Akt (Cell Signaling Technology, IT). β-Актин (Sigma-Aldrich, Сент-Луис, Миссури) использовали в качестве контроля нагрузки. Затем мембраны инкубировали с конъюгированными с пероксидазой хрена (HRP) антимышиными и антикроличьими антителами (GE Healthcare, IT). Все полосы были визуализированы с помощью ECL Select (GE Healthcare, IT), получены с помощью системы GelDoc 2000 (Bio-Rad, IT) и количественно определены измерениями денситометрии с использованием программного обеспечения ImageJ.
Все полосы были визуализированы с помощью ECL Select (GE Healthcare, IT), получены с помощью системы GelDoc 2000 (Bio-Rad, IT) и количественно определены измерениями денситометрии с использованием программного обеспечения ImageJ.
Кратность изменения (FC) pAkt/Akt рассчитывали в каждом образце как отношение между pAkt и общим Akt в стимулированных и нестимулированных клетках. Были получены средние значения и стандартная ошибка среднего по трем независимым экспериментам. Множественный тест t использовали для расчета статистической разницы между pAkt/Akt в стимулированных (+) и контрольных (–) клетках в каждом образце.
Описание случая
Пациентка является единственной дочерью некровных родителей итальянского происхождения. В возрасте 5 лет у нее были повторные эпизоды гематохезии, которые постепенно переросли в хроническую кровянистую слизистую диарею, продолжавшуюся более 4 недель (9).). Когда девочку впервые осмотрели в возрасте 5,5 лет, физикальное обследование было нормальным, рост был равномерным. Ее семейная и личная история были ничем не примечательны, без какой-либо оппортунистической или тяжелой инфекции. Посев кала на бактерии и анализы кала на вирусы и паразиты были отрицательными. Фекальный кальпротектин показал многократно повышенные результаты (>2100 мкг/г, нормальное значение <50 мкг/г), в то время как С-реактивный белок и скорость оседания эритроцитов были нормальными. Антинейтрофильные цитоплазматические антитела (ANCA) и анти- Антитела к Saccharomyces cerevisiae (ASCA) были отрицательными. Проницаемость кишечника для сахара была заметно изменена (соотношение лактулоза/маннит 0,09, нормальное значение <0,03). Эндоскопия верхних и нижних отделов желудочно-кишечного тракта показала многочисленные мелкие узелки по всему желудочно-кишечному тракту от желудка до прямой кишки (рис. 1A-F), гистопатологические признаки которых соответствовали диагнозу НЛГ (рис. 1G-I). При множественных биопсиях, взятых при эндоскопии, признаков хронического воспаления кишечника или аутоиммунной энтеропатии, таких как апоптоз энтероцитов, не наблюдалось.
Ее семейная и личная история были ничем не примечательны, без какой-либо оппортунистической или тяжелой инфекции. Посев кала на бактерии и анализы кала на вирусы и паразиты были отрицательными. Фекальный кальпротектин показал многократно повышенные результаты (>2100 мкг/г, нормальное значение <50 мкг/г), в то время как С-реактивный белок и скорость оседания эритроцитов были нормальными. Антинейтрофильные цитоплазматические антитела (ANCA) и анти- Антитела к Saccharomyces cerevisiae (ASCA) были отрицательными. Проницаемость кишечника для сахара была заметно изменена (соотношение лактулоза/маннит 0,09, нормальное значение <0,03). Эндоскопия верхних и нижних отделов желудочно-кишечного тракта показала многочисленные мелкие узелки по всему желудочно-кишечному тракту от желудка до прямой кишки (рис. 1A-F), гистопатологические признаки которых соответствовали диагнозу НЛГ (рис. 1G-I). При множественных биопсиях, взятых при эндоскопии, признаков хронического воспаления кишечника или аутоиммунной энтеропатии, таких как апоптоз энтероцитов, не наблюдалось.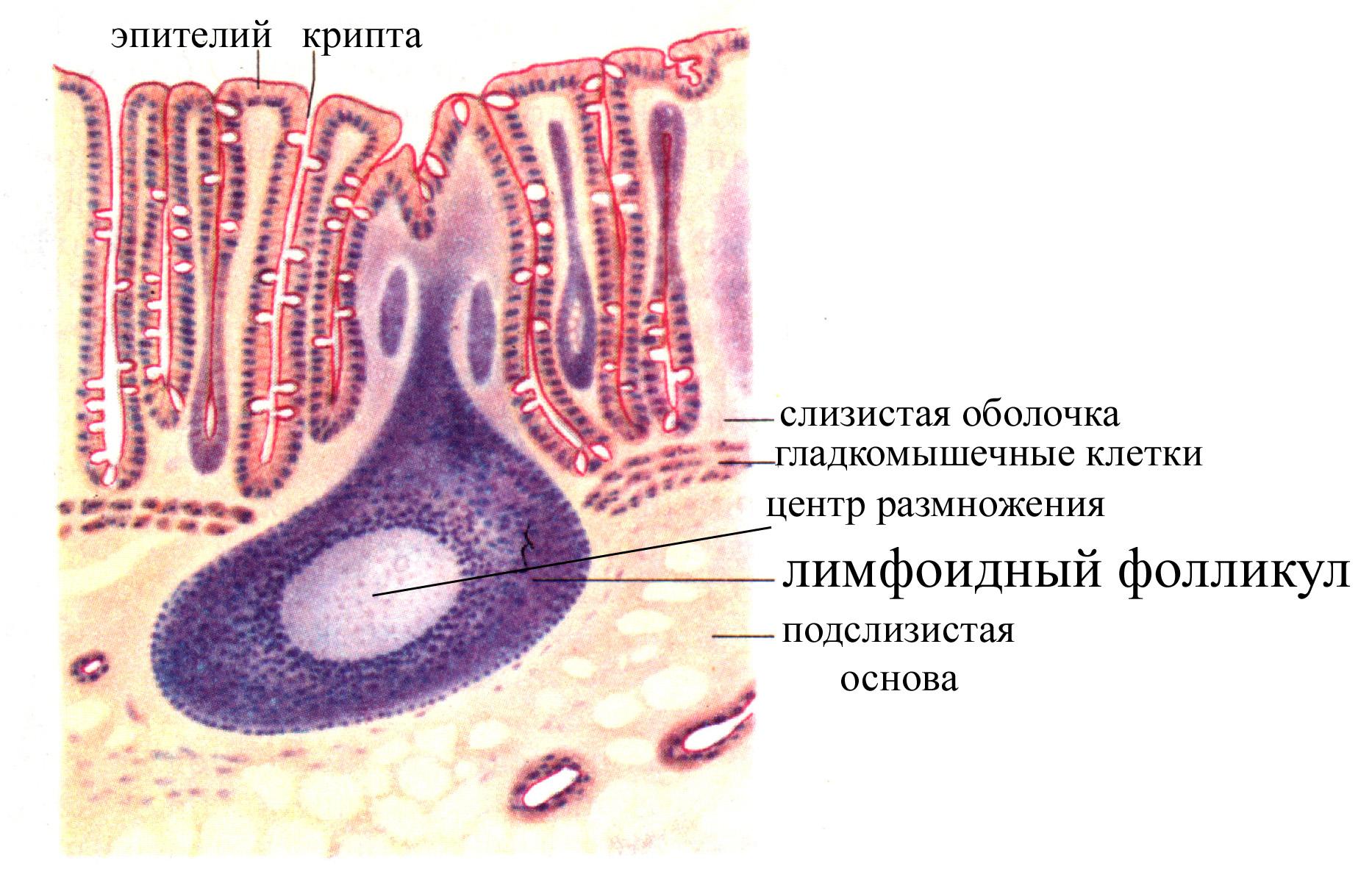 Известные инфекционные причины НЛГ, а именно ЦМВ, ВЭБ, ВИЧ, 9Инфекции 0165 Yersinia enterocolitica, Helicobacter pylori и Giardia lamblia были исключены (3). Семейная средиземноморская лихорадка была исключена прямым секвенированием гена MEFV (7). Была проведена полная иммунологическая оценка, показывающая значительное повышение общего IgG с нормальным анализом подгруппы лимфоцитов первой линии и достоверным серологическим ответом на столбнячный и дифтерийный анатоксины (таблица 1). Чтобы исключить аллергию на коровье молоко (10), была предпринята попытка диеты, исключающей белок коровьего молока, без улучшения. Впоследствии пациент получил короткий курс стероидов (пероральный преднизолон в начальной дозе 1,5 мг/кг/день) с полным исчезновением симптомов и нормализацией кальпротектина во время лечения, но с быстрым клиническим и биохимическим (например, повышение уровня кальпротектина) рецидивом после прекращения лечения. .
Известные инфекционные причины НЛГ, а именно ЦМВ, ВЭБ, ВИЧ, 9Инфекции 0165 Yersinia enterocolitica, Helicobacter pylori и Giardia lamblia были исключены (3). Семейная средиземноморская лихорадка была исключена прямым секвенированием гена MEFV (7). Была проведена полная иммунологическая оценка, показывающая значительное повышение общего IgG с нормальным анализом подгруппы лимфоцитов первой линии и достоверным серологическим ответом на столбнячный и дифтерийный анатоксины (таблица 1). Чтобы исключить аллергию на коровье молоко (10), была предпринята попытка диеты, исключающей белок коровьего молока, без улучшения. Впоследствии пациент получил короткий курс стероидов (пероральный преднизолон в начальной дозе 1,5 мг/кг/день) с полным исчезновением симптомов и нормализацией кальпротектина во время лечения, но с быстрым клиническим и биохимическим (например, повышение уровня кальпротектина) рецидивом после прекращения лечения. .
Рисунок 1 .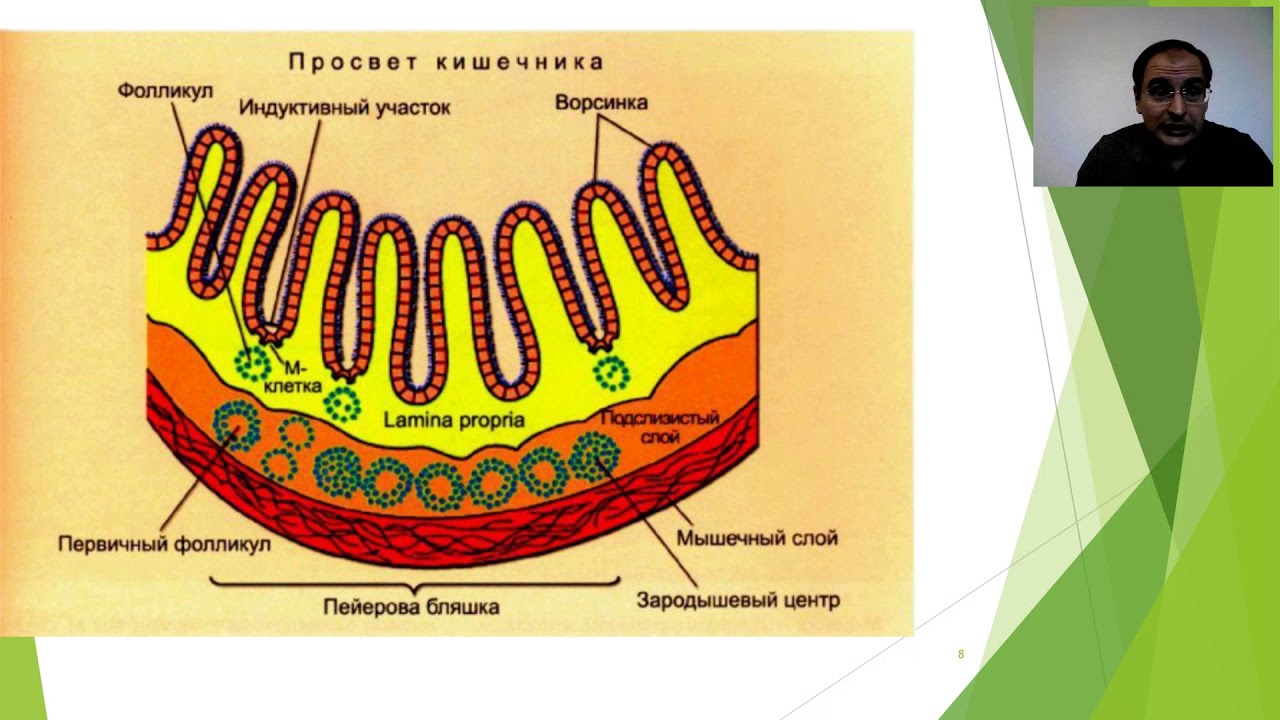 Эндоскопическая и гистологическая картина НЛГ у пациента. (A–F) Эндоскопия верхних и нижних отделов желудочно-кишечного тракта, демонстрирующая наличие множественных узлов (диаметром от 0,2 до 1 см) по всему желудочно-кишечному тракту (белые стрелки): желудок (A) , двенадцатиперстная кишка (B) , терминальный отдел подвздошной кишки (C) , восходящая, поперечная и нисходящая ободочная кишка (репрезентативное изображение), (D) сигмовидная кишка (E) и прямая кишка (Ф) . Узелки были особенно заметны в ректо-сигмовидном тракте, где они имели полиповидный вид, имели тенденцию облитерировать просвет и представляли собой «симптом красного кольца» вокруг основания (белая стрелка) и изъязвления слизистой оболочки сверху (черные стрелки) (Э, Ф). (G–I) Гистологическое исследование образцов слизистой оболочки, собранных вдоль желудочно-кишечного тракта, показало диффузную гиперплазию лимфоидных фолликулов (белые стрелки), что согласуется с диагнозом НЛГ (окрашивание H&E, ×10).
Эндоскопическая и гистологическая картина НЛГ у пациента. (A–F) Эндоскопия верхних и нижних отделов желудочно-кишечного тракта, демонстрирующая наличие множественных узлов (диаметром от 0,2 до 1 см) по всему желудочно-кишечному тракту (белые стрелки): желудок (A) , двенадцатиперстная кишка (B) , терминальный отдел подвздошной кишки (C) , восходящая, поперечная и нисходящая ободочная кишка (репрезентативное изображение), (D) сигмовидная кишка (E) и прямая кишка (Ф) . Узелки были особенно заметны в ректо-сигмовидном тракте, где они имели полиповидный вид, имели тенденцию облитерировать просвет и представляли собой «симптом красного кольца» вокруг основания (белая стрелка) и изъязвления слизистой оболочки сверху (черные стрелки) (Э, Ф). (G–I) Гистологическое исследование образцов слизистой оболочки, собранных вдоль желудочно-кишечного тракта, показало диффузную гиперплазию лимфоидных фолликулов (белые стрелки), что согласуется с диагнозом НЛГ (окрашивание H&E, ×10). Гистологическое исследование (H & E, × 10) образцов слизистой оболочки, собранных вдоль желудочно-кишечного тракта, показало диффузную гиперплазию лимфоидных фолликулов (белые стрелки) без воспаления, гранулем или других гистологических поражений.
Гистологическое исследование (H & E, × 10) образцов слизистой оболочки, собранных вдоль желудочно-кишечного тракта, показало диффузную гиперплазию лимфоидных фолликулов (белые стрелки) без воспаления, гранулем или других гистологических поражений.
Таблица 1 . Эволюция клинических симптомов, фекального кальпротектина и иммунологических параметров с течением времени.
Наблюдение тяжелой панэнтеральной НЛГ у ребенка раннего возраста в сочетании с исключением кишечных инфекций и наличием хронических рецидивирующих симптомов вызвало диагностическое подозрение на наследственный иммунологический дефект, несмотря на нормальные тесты первой линии. Учитывая отсутствие направляющего диагностического элемента, был проведен высокопроизводительный генетический тест для изучения генетических причин иммунной дисрегуляции и иммунодефицита. Было проведено полноэкзомное секвенирование с анализом на основе фенотипа с упором на гены, в первую очередь участвующие в иммунологических заболеваниях (11, 12), и выявлено присутствие гетерозиготного варианта p. Glu525Gly (c.1574A>G) в PIK3CD ген. Секвенирование по Сэнгеру подтвердило наличие этого варианта, а анализ сегрегации продемонстрировал его возникновение de novo (рис. 2А, В). Эта вариация затрагивает один и тот же кодон двух ранее зарегистрированных вариантов PIK3CD , вызывающих APDS, а именно c.1573G>A, p.(Glu525Lys) и c.1573A>C, p.(Glu525Ala) (рис. 2C) (13, 14). ). Ранее он не был идентифицирован и отсутствует в крупнейших базах данных частот аллелей (gnomAD, EVS и 1000 Genomes Project). Алгоритмы прогнозирования PolyPhen-2, SIFT, CADD-Phred и MutationTaster с высокой достоверностью указывают на вредное воздействие на полученный белок. Инструменты сохранения, такие как phyloP, GERP и PhastCons, указывают на то, что область ДНК, содержащая вариант, в высокой степени эволюционно консервативна.
Glu525Gly (c.1574A>G) в PIK3CD ген. Секвенирование по Сэнгеру подтвердило наличие этого варианта, а анализ сегрегации продемонстрировал его возникновение de novo (рис. 2А, В). Эта вариация затрагивает один и тот же кодон двух ранее зарегистрированных вариантов PIK3CD , вызывающих APDS, а именно c.1573G>A, p.(Glu525Lys) и c.1573A>C, p.(Glu525Ala) (рис. 2C) (13, 14). ). Ранее он не был идентифицирован и отсутствует в крупнейших базах данных частот аллелей (gnomAD, EVS и 1000 Genomes Project). Алгоритмы прогнозирования PolyPhen-2, SIFT, CADD-Phred и MutationTaster с высокой достоверностью указывают на вредное воздействие на полученный белок. Инструменты сохранения, такие как phyloP, GERP и PhastCons, указывают на то, что область ДНК, содержащая вариант, в высокой степени эволюционно консервативна.
Рисунок 2 . Генетическая и функциональная характеристика. (A) Родословная семейства, указывающая на возникновение варианта de novo . (B) Электрофореграммы Сенгера. (C) График домена белка PIK3CD , показывающий известные активирующие варианты (вверху) (15) и описанный здесь вариант (внизу). (D) Иммуноблот стимулированных (+) и нестимулированных (–) Т-клеток, полученных из РВМС, собранных у пациентки, ее матери и отца, и нормального контроля (CTRL). Показана экспрессия Akt и p-Akt (S473). β-актин использовали в качестве контроля загрузки. (E) Кратность изменения фосфорилирования p-Akt (S473)/Akt в активированных Т-клетках (+) и неактивированных клетках (–) у пациента, родителей и здорового контроля. Столбцы представлены как среднее ± SEM. * р < 0,05; нс: не имеет значения.
(B) Электрофореграммы Сенгера. (C) График домена белка PIK3CD , показывающий известные активирующие варианты (вверху) (15) и описанный здесь вариант (внизу). (D) Иммуноблот стимулированных (+) и нестимулированных (–) Т-клеток, полученных из РВМС, собранных у пациентки, ее матери и отца, и нормального контроля (CTRL). Показана экспрессия Akt и p-Akt (S473). β-актин использовали в качестве контроля загрузки. (E) Кратность изменения фосфорилирования p-Akt (S473)/Akt в активированных Т-клетках (+) и неактивированных клетках (–) у пациента, родителей и здорового контроля. Столбцы представлены как среднее ± SEM. * р < 0,05; нс: не имеет значения.
Для подтверждения патогенной роли варианта p.Glu525Gly было проведено расширенное иммунологическое фенотипирование и функциональных тестов in vitro . Детальный анализ иммунного подмножества продемонстрировал снижение количества CD4+CD45RA+ и CD8+CD45RA+CD27+ наивных Т-хелперов и повышение уровня CD19. +IgM+CD38+ переходные В-клетки (табл. 1). Пролиферация Т-клеток нарушалась при стимуляции митогенами (ФГА и анти-CD3), столбнячным анатоксином, Candida и антигенами вируса ветряной оспы. Учитывая, что PI3Kδ-активирующие мутации, ответственные за APDS, индуцируют чрезмерную активацию пути Akt/mTOR (13, 16), количество и активация AKT (pAkt-Ser473) были протестированы у пациентки, у ее родителей (ни один из них несущий вариант p.Glu525Gly), так и в здоровом контроле. После стимуляции РВМС анти-CD3-антителом и ИЛ-2 у пациентки наблюдалось значительное гиперфосфорилирование остатка S473 AKT по сравнению с ее родителями и здоровым контролем (рис. 2D, E), что доказывает, что вариант p.Glu525Gly ведет себя как с усилением функции и вызывает гиперактивацию PI3Kδ (13). Таким образом, девушке поставили диагноз APDS.
+IgM+CD38+ переходные В-клетки (табл. 1). Пролиферация Т-клеток нарушалась при стимуляции митогенами (ФГА и анти-CD3), столбнячным анатоксином, Candida и антигенами вируса ветряной оспы. Учитывая, что PI3Kδ-активирующие мутации, ответственные за APDS, индуцируют чрезмерную активацию пути Akt/mTOR (13, 16), количество и активация AKT (pAkt-Ser473) были протестированы у пациентки, у ее родителей (ни один из них несущий вариант p.Glu525Gly), так и в здоровом контроле. После стимуляции РВМС анти-CD3-антителом и ИЛ-2 у пациентки наблюдалось значительное гиперфосфорилирование остатка S473 AKT по сравнению с ее родителями и здоровым контролем (рис. 2D, E), что доказывает, что вариант p.Glu525Gly ведет себя как с усилением функции и вызывает гиперактивацию PI3Kδ (13). Таким образом, девушке поставили диагноз APDS.
В связи с этим, несмотря на отсутствие респираторных симптомов, была проведена КТ грудной клетки, которая выявила множественные мелкие узелки в паренхиме легких и медиастинальные лимфаденопатии.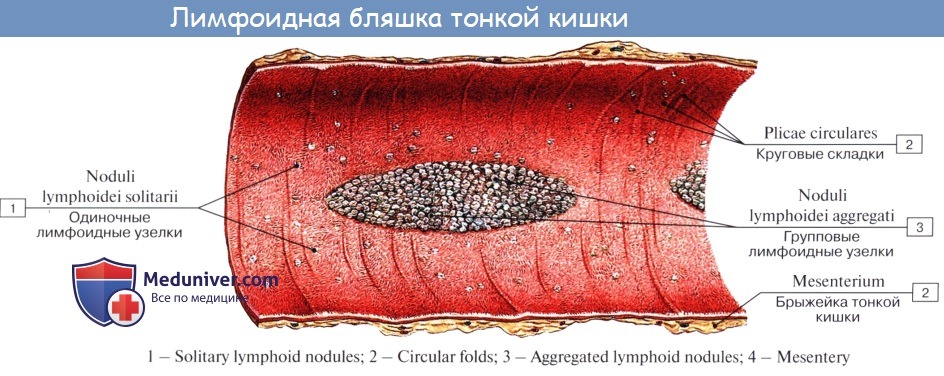 Затем было начато лечение сиролимусом (начальная доза 2 мг/м 2 с целью достижения уровней 4–12 нг/мл, с оптимальной целью 9 нг/мл), что привело к постепенному разрешению желудочно-кишечных симптомов и нормализации фекального кальпротектина в течение одного года (таблица 1). В связи с возникновением нескольких эпизодов респираторной инфекции, в том числе одного эпизода пневмонии, и представления о нарушении эффективности иммуноглобулинов, несмотря на нормальные уровни у пациентов с APDS (17), заместительная терапия иммуноглобулином и профилактика азитромицином (10 мг/кг/день, 3 дня/ неделя) были начаты с быстрой остановкой рецидивирующих инфекций. При последней оценке пациенту было 7,5 лет, и он был бессимптомным. В течение 18 месяцев лечения у нее не было никаких клинически значимых инфекций или аутоиммунных нарушений. Более того, количество наивных Т-клеток и переходных В-клеток вернулось к нормальным значениям (таблица 1). В возрасте 7,5 лет у пациента была диагностирована детская абсансная эпилепсия, которая была сочтена не связанной с APDS, на основании отсутствия связи двух расстройств в литературе.
Затем было начато лечение сиролимусом (начальная доза 2 мг/м 2 с целью достижения уровней 4–12 нг/мл, с оптимальной целью 9 нг/мл), что привело к постепенному разрешению желудочно-кишечных симптомов и нормализации фекального кальпротектина в течение одного года (таблица 1). В связи с возникновением нескольких эпизодов респираторной инфекции, в том числе одного эпизода пневмонии, и представления о нарушении эффективности иммуноглобулинов, несмотря на нормальные уровни у пациентов с APDS (17), заместительная терапия иммуноглобулином и профилактика азитромицином (10 мг/кг/день, 3 дня/ неделя) были начаты с быстрой остановкой рецидивирующих инфекций. При последней оценке пациенту было 7,5 лет, и он был бессимптомным. В течение 18 месяцев лечения у нее не было никаких клинически значимых инфекций или аутоиммунных нарушений. Более того, количество наивных Т-клеток и переходных В-клеток вернулось к нормальным значениям (таблица 1). В возрасте 7,5 лет у пациента была диагностирована детская абсансная эпилепсия, которая была сочтена не связанной с APDS, на основании отсутствия связи двух расстройств в литературе. Магнитно-резонансная томография головного мозга в начале эпилепсии ничем не примечательна.
Магнитно-резонансная томография головного мозга в начале эпилепсии ничем не примечательна.
Обсуждение
APDS (OMIM # 615513) — врожденная ошибка иммунитета, вызванная аутосомно-доминантными вариантами приобретения функции в генах PIK3CD или PIK3R1 , которые кодируют каталитическую и регуляторную субсубъединицы. это из комплекс фосфоинозитид-3-киназы δ (13, 16, 18). Варианты, лежащие в основе APDS, вызывают гиперактивацию сигнального каскада киназы PI3K/AKT/mTOR/S6, который контролирует рост, пролиферацию и метаболизм клеток (19, 20). Поскольку PIK3CD и PIK3R1 в основном экспрессируются в лимфоцитах, наиболее заметные физиологические изменения этого состояния обнаруживаются в иммунной системе. APDS вызывает усиленное старение Т-клеток с уменьшением числа наивных Т-клеток и нарушением В-клеточного ответа (21). Фолликулярные хелперные Т-клетки (Tfh) увеличиваются, что приводит к расширению зародышевых центров в периферических лимфоидных органах (22). Эти иммунологические механизмы лежат в основе клинического фенотипа пациентов с APDS, характеризующегося рецидивирующими бактериальными и вирусными инфекциями, аутоиммунными нарушениями, тяжелой лимфаденопатией и повышенным риском лимфомы, подобно другим ИЭИ, связанным с нарушением регуляции иммунитета (23, 24). Желудочно-кишечные проявления отмечаются у 50% пациентов и включают широкий спектр нарушений (колит, аутоиммунная энтеропатия и НЛГ) (17, 25). Однако поражение желудочно-кишечного тракта, как правило, не является изолированным и обычно возникает на более поздних стадиях заболевания (15).
Эти иммунологические механизмы лежат в основе клинического фенотипа пациентов с APDS, характеризующегося рецидивирующими бактериальными и вирусными инфекциями, аутоиммунными нарушениями, тяжелой лимфаденопатией и повышенным риском лимфомы, подобно другим ИЭИ, связанным с нарушением регуляции иммунитета (23, 24). Желудочно-кишечные проявления отмечаются у 50% пациентов и включают широкий спектр нарушений (колит, аутоиммунная энтеропатия и НЛГ) (17, 25). Однако поражение желудочно-кишечного тракта, как правило, не является изолированным и обычно возникает на более поздних стадиях заболевания (15).
APDS обычно подозревают, когда у пациентов развиваются рецидивирующие легочные инфекции, лимфаденопатия или гепатоспленомегалия в течение первого десятилетия жизни, а не у пациентов с изолированным НЛГ. Диагноз APDS может быть сложным, поскольку иммунологические тесты первого уровня (количество лимфоцитов, уровни иммуноглобулинов и основные субпопуляции лимфоцитов) могут быть нормальными, а гастроэнтерологи могут иметь ограниченные знания о недавно выявленных ИЭИ. Диагноз APDS также затруднен из-за необходимости функционального подтверждения усиление функции влияние новых вариантов в PIK3CD , поскольку его нельзя предсказать только с помощью вычислительных методов. Действительно, каждый новый вариант PIK3CD требует специальной функциональной проверки для подтверждения его патогенности (26). Наш отчет еще больше расширяет список вариантов, связанных с этим расстройством, и может быть полезен для центров, не имеющих доступа к функциональному тестированию с быстрым временем выполнения.
Диагноз APDS также затруднен из-за необходимости функционального подтверждения усиление функции влияние новых вариантов в PIK3CD , поскольку его нельзя предсказать только с помощью вычислительных методов. Действительно, каждый новый вариант PIK3CD требует специальной функциональной проверки для подтверждения его патогенности (26). Наш отчет еще больше расширяет список вариантов, связанных с этим расстройством, и может быть полезен для центров, не имеющих доступа к функциональному тестированию с быстрым временем выполнения.
Признание APDS причиной НЛГ имело важные последствия для лечения нашего пациента. Во-первых, это позволило установить таргетную терапию APDS (т. е. сиролимус), которая, даже если обычно не применялась для лечения НЛГ, приводила к полному исчезновению желудочно-кишечных симптомов (25). Во-вторых, это побудило нас исследовать и выявить внекишечные осложнения заболевания (т. е. субклиническое поражение легких). В-третьих, это позволило начать замену иммуноглобулина и введение азитромицина для предотвращения респираторных инфекций и бронхоэктазов, которые являются частым осложнением APDS (17).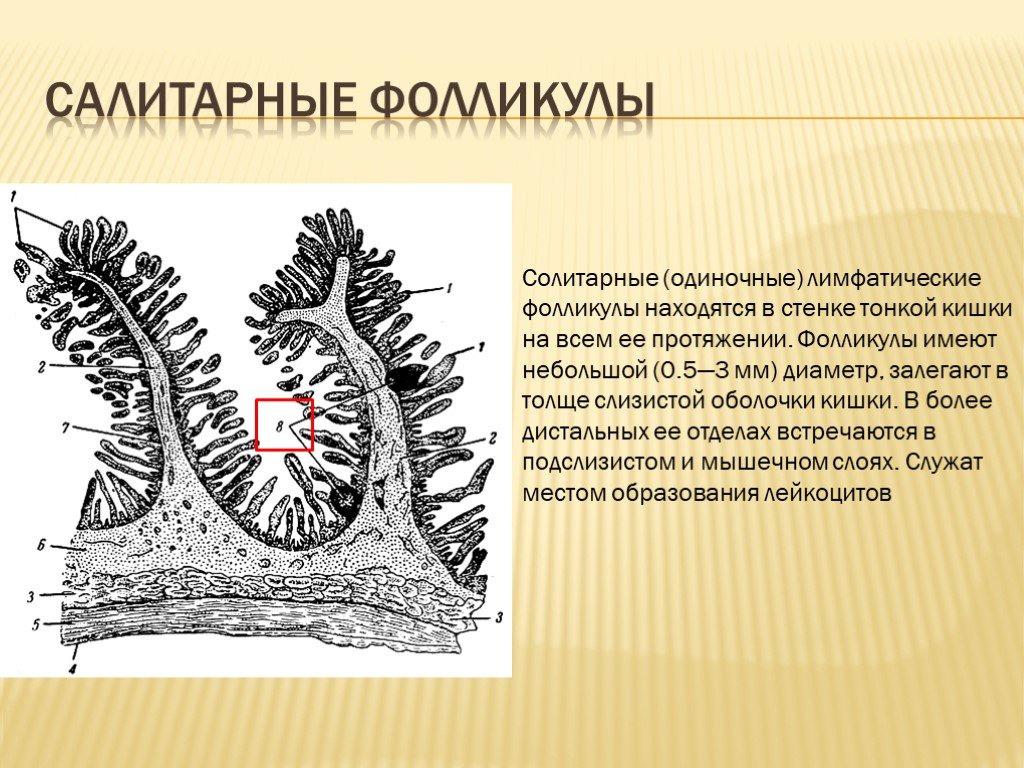 Диагноз APDS также принесет пользу пациенту в будущем, поскольку он расширит терапевтические возможности, когда станут доступны новые специфические методы лечения APDS (например, специфические ингибиторы PI3K, такие как лениолисиб или селеталисиб) (27, 28).
Диагноз APDS также принесет пользу пациенту в будущем, поскольку он расширит терапевтические возможности, когда станут доступны новые специфические методы лечения APDS (например, специфические ингибиторы PI3K, такие как лениолисиб или селеталисиб) (27, 28).
В заключение, наличие изолированного НЛГ, особенно тяжелого, распространенного через желудочно-кишечный тракт или панэнтерального, должно вызвать подозрение на врожденную ошибку иммунитета, такую как APDS, даже при отсутствии других клинических признаков иммунодефицита. и с нормальным иммунологическим тестом первой линии. В таких обстоятельствах следует проводить обширные иммунологические исследования, в том числе мультигенный панельный анализ, чтобы гарантировать быстрое назначение целевого потенциально спасающего жизнь лечения.
Заявление о доступности данных
Данные, представленные в исследовании, размещены в репозитории ClinVar, инвентарный номер SCV001810147.1
Заявление об этике
В соответствии с местным законодательством и институциональные требования. Письменное информированное согласие на участие в этом исследовании было предоставлено участниками или их законными опекунами/ближайшими родственниками. От участников или их законных опекунов/ближайших родственников было получено письменное информированное согласие на публикацию любых потенциально идентифицируемых изображений или данных, включенных в эту статью.
Письменное информированное согласие на участие в этом исследовании было предоставлено участниками или их законными опекунами/ближайшими родственниками. От участников или их законных опекунов/ближайших родственников было получено письменное информированное согласие на публикацию любых потенциально идентифицируемых изображений или данных, включенных в эту статью.
Вклад авторов
AM, PG, LB, LR, FB, AB, GP и MC оказывали непосредственную клиническую помощь пациенту. SB и AC провели функциональное тестирование варианта PIK3CD . DC и AL выполнили секвенирование всего экзома и интерпретацию вариантов. КМ провел гистопатологическое исследование. AM, SB и MC написали рукопись. Все авторы рассмотрели и одобрили рукопись.
Финансирование
Работа финансировалась за счет гранта Fondazione Città della Speranza ONLUS (http://cittadellasperanza.org/), Associazione di Promozione Sociale Genitori in fuga (https://www.genitoriinfuga.org/) и Associazione sportiva dilettantistica NCO Crew to AM и SB.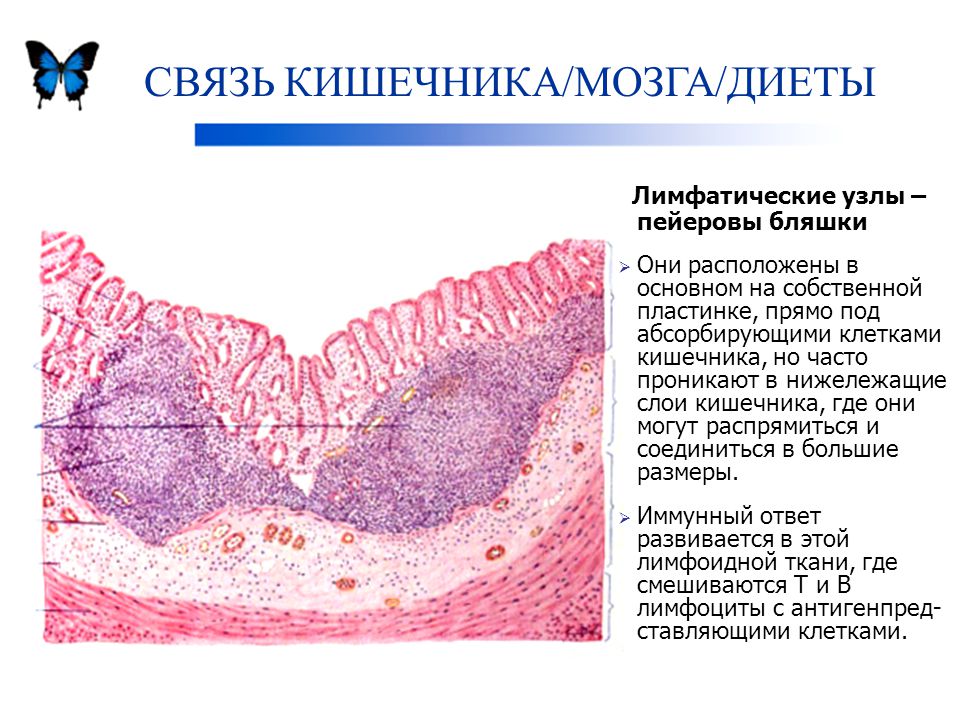
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечание издателя
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций или издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Благодарности
Авторы выражают благодарность Марии Елене Маккари (Фрайбург, Германия) и Свену Кракеру (Париж, Франция) за их помощь в тестировании pAkt. Мы благодарим Istituto di Ricerca Pediatrica за поддержку нашей научной работы.
Ссылки
1. Sipos F, Muzes G. Изолированные лимфоидные фолликулы в толстой кишке: точки переключения между воспалением и колоректальным раком? Мир J Гастроэнтерол. (2011) 17:1666–73. дои: 10.3748/wjg.v17.i13.1666
(2011) 17:1666–73. дои: 10.3748/wjg.v17.i13.1666
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
2. Albuquerque A. Узловая лимфоидная гиперплазия желудочно-кишечного тракта у взрослых пациентов: обзор. World J Gastrointest Endosc. (2014) 6: 534–40. doi: 10.4253/wjge.v6.i11.534
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Mansueto P, Iacono G, Seidita A, D’Alcamo A, Sprini D, Carroccio A. Обзорная статья: кишечная лимфоидная узловая гиперплазия у детей – связь с пищевой гиперчувствительностью. Aliment Pharmacol Ther. (2012) 35:1000–9. doi: 10.1111/j.1365-2036.2012.05062.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4. Элхоли С., Могавер С., Фараг А. Узловая лимфоидная гиперплазия желудочно-кишечного тракта: всесторонний обзор. Acta Gastroenterol Белг. (2017) 80:405–410.
Реферат PubMed | Google Scholar
5. Колон А.Р., ДиПальма Дж. С., Leftridge CA. Кишечная лимфонодулярная гиперплазия детского возраста: особенности проявления. J Clin Гастроэнтерол. (1991) 13:163–6. doi: 10.1097/00004836-199104000-00009
С., Leftridge CA. Кишечная лимфонодулярная гиперплазия детского возраста: особенности проявления. J Clin Гастроэнтерол. (1991) 13:163–6. doi: 10.1097/00004836-199104000-00009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Piscaglia AC, Laterza L, Cesario V, Gerardi V, Landi R, Lopetuso LR, et al. Узловая лимфоидная гиперплазия: маркер слабовыраженного воспаления при синдроме раздраженного кишечника? Мир J Гастроэнтерол. (2016) 22:10198–209. doi: 10.3748/wjg.v22.i46.10198
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
7. Гуркан О.Е., Йылмаз Г., Аксу А.У., Демирташ З., Акьол Г., Далгич Б. Лимфоидная узловая гиперплазия толстой кишки в детстве: причины семейной средиземноморской лихорадки требуют особого внимания. J Pediatr Gastroenterol Nutr. (2013) 57:817–21. doi: 10.1097/MPG.0b013e3182a9083b
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Марзолло А. , Колавито Д., Сартори С., Фанелли Г.Н., Путти М.С. Церебральная лимфопролиферация у пациента с синдромом Кабуки. Дж Клин Иммунол. (2018) 38:475–7. doi: 10.1007/s10875-018-0516-9
, Колавито Д., Сартори С., Фанелли Г.Н., Путти М.С. Церебральная лимфопролиферация у пациента с синдромом Кабуки. Дж Клин Иммунол. (2018) 38:475–7. doi: 10.1007/s10875-018-0516-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Шанкар С., Розенбаум Дж. Хроническая диарея у детей: практический алгоритмический подход. J Педиатр Детское здоровье. (2020) 56:1029–38. doi: 10.1111/jpc.14986
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Iacono G, Ravelli A, Di Prima L, Scalici C, Bolognini S, Chiappa S, et al. Лимфоидная узловая гиперплазия толстой кишки у детей: связь с пищевой гиперчувствительностью. Клин Гастроэнтерол Гепатол. (2007) 5:361–6. doi: 10.1016/j.cgh.2006.12.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Смедли Д., Робинсон П.Н. Стратегии, основанные на фенотипе, для приоритизации экзома генов менделевской болезни человека. Геном Мед. (2015) 7:81. doi: 10.1186/s13073-015-0199-2
(2015) 7:81. doi: 10.1186/s13073-015-0199-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Tangye SG, Al-Herz W, Bousfiha A, Chatila T, Cunningham-Rundles C, Etzioni A, et al. Врожденные ошибки иммунитета человека: 2019 г.обновленная информация о классификации от экспертного комитета международного союза иммунологических обществ. Дж Клин Иммунол. (2020) 18:20. doi: 10.1007/s10875-019-00737-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Lucas CL, Kuehn HS, Zhao F, Niemela JE, Deenick EK, Palendira U, et al. Доминантно-активирующие мутации зародышевой линии в гене, кодирующем каталитическую субъединицу PI(3)K p110δ, приводят к старению Т-клеток и иммунодефициту человека. Нат Иммунол. (2014) 15:88–97. doi: 10.1038/ni.2771
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Цуджита Ю., Мицуи-Секинака К., Имаи К., Йех Т.В., Мицуики Н., Асано Т. , Ониши Х., Като З., Секинака Ю., Заха К. и др. Мутация гомолога фосфатазы и тензина (PTEN) может вызывать иммунодефицит, подобный синдрому активированной фосфатидилинозитол-3-киназы δ. J Allergy Clin Immunol. (2016) 138:1672–80.e10. doi: 10.1016/j.jaci.2016.03.055
, Ониши Х., Като З., Секинака Ю., Заха К. и др. Мутация гомолога фосфатазы и тензина (PTEN) может вызывать иммунодефицит, подобный синдрому активированной фосфатидилинозитол-3-киназы δ. J Allergy Clin Immunol. (2016) 138:1672–80.e10. doi: 10.1016/j.jaci.2016.03.055
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
15. Джейми М., Монири С., Заки-Дизаджи М., Ольбрих П., Яздани Р., Джадиди-Ниараг Ф. и соавт. Клинические, иммунологические и генетические особенности у пациентов с активированным синдромом PI3Kδ (APDS): систематический обзор. Clin Rev Allergy Immunol. (2020) 59: 323–33. doi: 10.1007/s12016-019-08738-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Angulo I, Vadas O, Garcon F, Banham-Hall E, Plagnol V, Leahy TR, et al. Мутация гена фосфоинозитид-3-киназы предрасполагает к респираторным инфекциям и повреждению дыхательных путей. Наука (80-). (2013) 342:866–71. doi: 10.1126/science. 1243292
1243292
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Coulter TI, Chandra A, Bacon CM, Babar J, Curtis J, Screaton N, Goodlad JR, Farmer G, Steele CL, Leahy TR, et al. Клинический спектр и особенности синдрома активированной фосфоинозитид-3-киназы δ: исследование большой когорты пациентов. J Allergy Clin Immunol. (2017) 139: 597–606.e4. doi: 10.1016/j.jaci.2016.06.021
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
18. Lucas CL, Zhang Y, Venida A, Wang Y, Hughes J, McElwee J, et al. Гетерозиготная сплайс-мутация в PIK3R1 вызывает иммунодефицит человека с лимфопролиферацией из-за доминантной активации PI3K. J Exp Med. (2014) 211:2537–47. doi: 10.1084/jem.20141759
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19. Марзолло А., Маэстрини Г., Ла Старца Р., Элия Л., Мальфона Ф., Пьерини Т., Третти С., Коппе А., Бортолуцци С., Биффи А. и др. Новый вариант зародышевой линии в PIK3R1 приводит к синдрому SHORT, связанному с острым лимфобластным лейкозом Т-клеток TAL/LMO. Am J Гематол. (2020) 95:E335–8. doi: 10.1002/ajh.25998
Am J Гематол. (2020) 95:E335–8. doi: 10.1002/ajh.25998
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
20. Edwards ESJ, Bier J, Cole TS, Wong M, Hsu P, Berglund LJ, Boztug K, Lau A, Gostick E, Price DA, et al. Активирующие мутации PIK3CD нарушают дифференцировку и функцию цитотоксических лимфоцитов человека и иммунитет к EBV. J Allergy Clin Immunol. (2019) 143: 276–291.e6. doi: 10.1016/j.jaci.2018.04.030
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
21. Асано Т., Окада С., Цумура М., Йех Т.В., Мицуи-Секинака К., Цуджита Ю. и др. Повышенное фосфорилирование AKT циркулирующих В-клеток у пациентов с активированным синдромом PI3Kδ. Фронт Иммунол. (2018) 9:568. doi: 10.3389/fimmu.2018.00568
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Тауланд Т.Дж., Пеллерин Л., Огами Р.С., Бакчетта Р., Бьютт М.Дж. Тематическое исследование: механизм повышенного развития фолликулярных хелперных Т-клеток при активированном дельта-синдроме PI3K. Фронт Иммунол. (2019) 10:753. doi: 10.3389/fimmu.2019.00753
Фронт Иммунол. (2019) 10:753. doi: 10.3389/fimmu.2019.00753
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Теш В.К., Абольхассани Х., Шадур Б., Зобель Дж., Марейка Ю., Шарапова С. и др. Отдаленные результаты дефицита LRBA у 76 пациентов после различных методов лечения, оцениваемые по шкале активности иммунодефицита и дисрегуляции (IDDA). J Allergy Clin Immunol. (2020) 145:1452–63. doi: 10.1016/j.jaci.2019.12.896
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
24. Bosa L, Batura V, Colavito D, Fiedler K, Gaio P, Guo C, et al. Новые варианты CARMIL2 с потерей функции связаны с воспалительным заболеванием кишечника у детей. Sci Rep. (2021) 11:1–13. doi: 10.1038/s41598-021-85399-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Maccari ME, Abolhassani H, Agamohammadi A, Aiuti A, Aleinikova O, Bangs C, et al. Эволюция заболевания и реакция на рапамицин при синдроме активированной фосфоинозитид-3-киназы δ: регистр Европейского общества иммунодефицитов-активированной фосфоинозитид-3-киназы δ.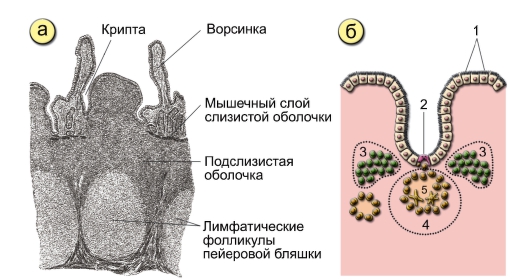

 И., Ручкина И. Н., Атауллаханов Р. И. и др. Постинфекционный синдром раздраженного кишечника // Тер. арх. 2009; 81 (2): 39–45.
И., Ручкина И. Н., Атауллаханов Р. И. и др. Постинфекционный синдром раздраженного кишечника // Тер. арх. 2009; 81 (2): 39–45. , Blackshaw E., Perkins A. C., Singh G., Marsden C. A. et al. Abnormalities of 5-hydroxytryptamine metabolism in irritable bowel syndrome // Clin. Gastroenterol. Hepatol. 2005; 3: 349–357.
, Blackshaw E., Perkins A. C., Singh G., Marsden C. A. et al. Abnormalities of 5-hydroxytryptamine metabolism in irritable bowel syndrome // Clin. Gastroenterol. Hepatol. 2005; 3: 349–357. В IV фазе содержание центробластов понижается до 25,15%, центроцитов составляет 30,04%, малых лимфоцитов увеличивается до 33,76%, макрофагов составляет 2,98%.
В IV фазе содержание центробластов понижается до 25,15%, центроцитов составляет 30,04%, малых лимфоцитов увеличивается до 33,76%, макрофагов составляет 2,98%.