Аденомэктомия — Клиника 29
Аденомэктомия – это операция, которая проводится с целью удаления доброкачественного разрастания предстательной железы.
В настоящее время аденомэктомия может проводиться двумя способами:
- чреспрузырным (трансвезикальным)
- трансуретральным.
Чреспузырный доступ является открытым доступом. Это означает, что для удаления аденомы простаты хирург вскрывает мочевой пузырь (отсюда и название – чреспузырная). Кроме этого способа, существует также и другой, более щадящий в плане травматизации окружающих тканей, а, следовательно, характеризующийся более легким течением послеоперационного периода – это так называемый трансуретральный способ. Такая операция проводится с помощью эндоскопической техники. При этом в уретру мужчины вводится тонкая трубочка, через которую хирург может проводить необходимые манипуляции на простате и все это видеть на экране монитора.
Показания к чреспузырнойаденомэктомии
Чреспузырнаяаденомэктомияпоказана при аденоме простаты.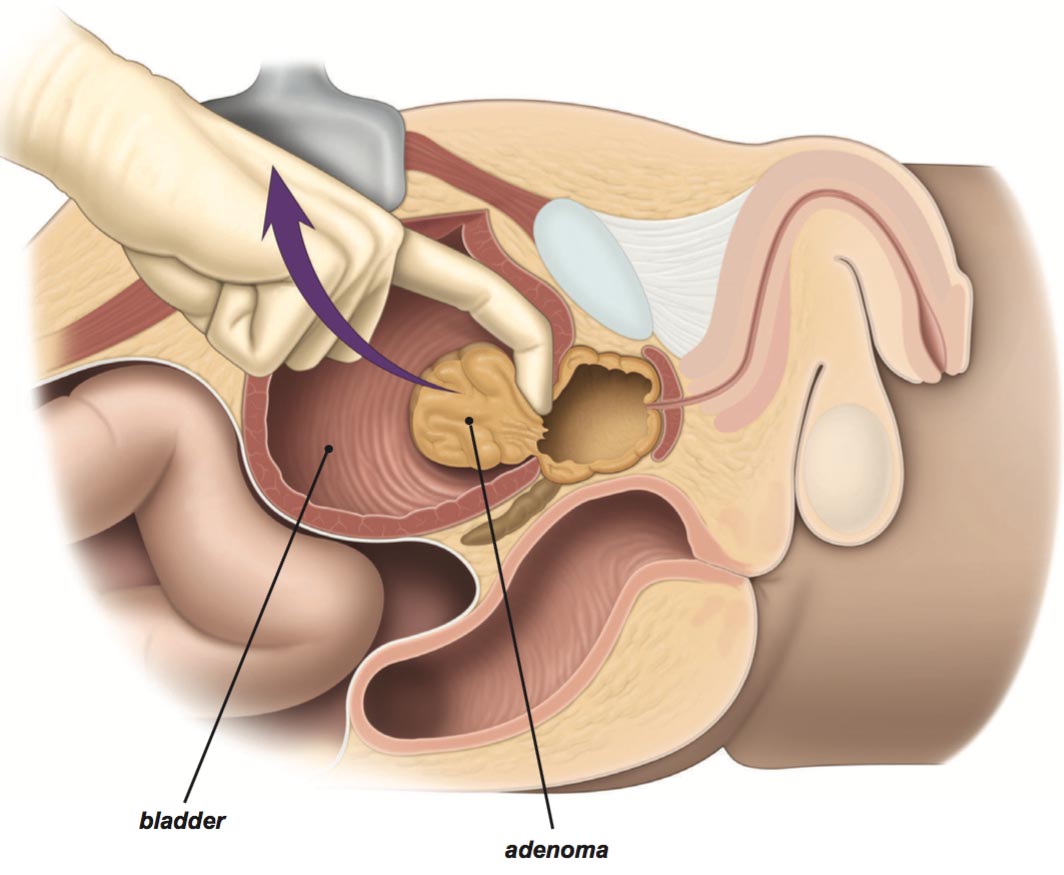
Противопоказания к открытойаденомэктомии
Противопоказаниями к открытой аденомэктомии могут быть только тяжелые сопутствующие заболевания, имеющие плохой прогноз.
Подготовка к открытой аденомэктомии
Как и перед любой другой операцией, перед открытой аденомэктомией требуется проведение анализов крови и мочи. Из анализов крови, прежде всего, выполняются:
- общий анализ крови
- анализ крови на свертываемость
- анализ крови на сахар
- биохимический анализ крови
Перед операцией больного осматривает анестезиолог. Он решает, какой вид анестезии будет наиболее оптимальным для данного больного. Открытаяаденомэктомия может выполняться выполняется под общим наркозом либо под регионарной анестезией – эпидуральной анестезией. При этом в течение всей больной находится в сознании.
Перед операцией больной должен (сам или с помощью медперсонала) сбрить волосы в области лобка. Перед операцией больной не должен есть и пить в течение 8 часов.
Методика операции
Открытая чреспузырнаяаденомэктомия заключается в том, что хирург доступом через разрез мочевого пузыря вылущивает гиперплазированную (увеличенную) часть простаты. Больной лежит на операционном столе на спине. Предварительно в мочевой пузырь устанавливается мочевой катетер. Хирург делает продольный разрез в надлобковой области. После того, как осуществляется доступ к мочевому пузырю, хирург берет его на специальные держалки в двух местах (прошивая нитью), за которые он приподнимает стенку пузыря. Образующуюся складку рассекают и производят вскрытие мочевого пузыря. По внутреннему концу мочевого катетера хирург определяет область шейки мочевого пузыря.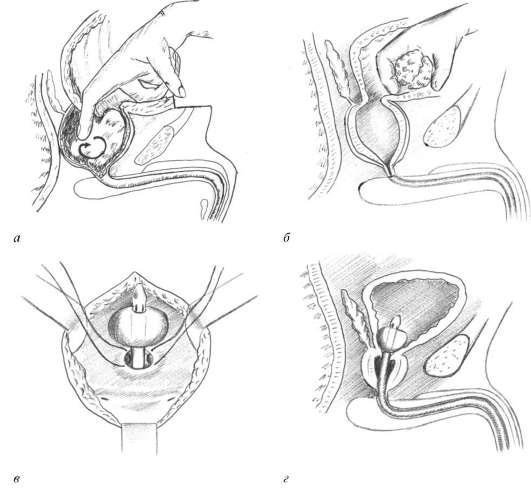
После этого этапа операции производится остановка кровотечения в области, где была аденома простаты. Далее мочевой пузырь ушивается, а в нем через рану оставляют тонкую трубочку. Это делается для того, чтобы в послеоперационном периоде промывать мочевой пузырь от образующихся сгустков крови в нем. Обычно для промывания используется стерильный раствор фурациллина.
В уретре после операции на 7 – 10 суток остается мочевой катетер. Это нужно для того, чтобы вокруг нее сформировался новый участок уретры (как Вы помните, часть уретры проходит через простату и во время операции она просто удаляется).
Осложнения во время операции
При правильной технике операции никаких осложнений быть не должно. Тем не менее, иногда могут быть такие осложнения:
- кровотечение вследствие повреждения кровеносного сосуда либо нарушения свертываемости крови,
- аллергическая реакция на анестезию,
- повреждение уретры.
Послеоперационный период
В послеоперационном периоде больной получает:
- Антибиотики – для профилактики инфекционный и гнойных осложнений в ране.
- Обезболивающие (обычно, промедол, анальгин и др.).
В течение первых суток после операции проводится промывание мочевого пузыря фурациллином. Это делается так: к трубочке (дренаж), которая остается в ране мочевого пузыря после операции, подсоединяется капельница с фурациллином. Отток фурациллина идет через катетер в уретре. Необходимость такой процедуры связана с профилактикой тромбообразования в мочевом пузыре и закупорки его сгустками.
Если операция проводилась под общим наркозом, то обычно сразу после нее больной на несколько часов помещается в реанимационную палату/отделение.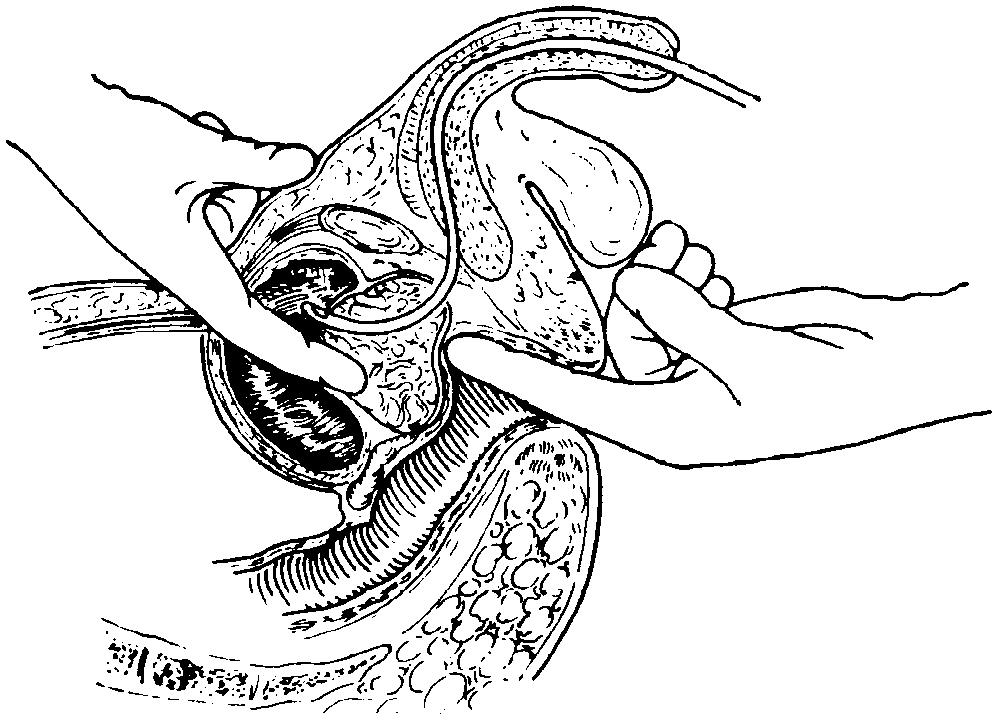 Раз в несколько дней проводится смена стерильных повязок. Швы снимаются на 7 – 8-й день после операции.
Раз в несколько дней проводится смена стерильных повязок. Швы снимаются на 7 – 8-й день после операции.
Удаление мочевого катетера производится обычно на 10-е сутки. Перед этим мочевой пузырь через катетер наполняется фурациллином или физраствором, чтобы больной мог сразу после его извлечения помочиться.
Осложнения в послеоперационном периоде
Частота осложнений после аденомэктомии колеблется в пределах 8,8 — 18,8 %. Среди осложнений различают ранние и поздние (отдаленные). В послеоперационном периоде можно отметить следующие осложнения:
- Инфекционные. При нарушении правил асептики и антисептики во время операции или при перевязках, а также при ослабленном иммунитете у больного в ране может развиться инфекционный процесс. Он проявляется воспалением: в ране отмечается отек, болезненность, покраснение, кроме того, повышается температура тела.
- Стриктуры уретры. Стриктура уретры – самое неприятное осложнение после аденомэктомии, так как зачастую для своего разрешения требует оперативного лечения.
 Стриктура – это заращение уретры на определенном протяжении. Чаще всего это связано с воспалением в уретре, наличием сгустков в ней и т.д.
Стриктура – это заращение уретры на определенном протяжении. Чаще всего это связано с воспалением в уретре, наличием сгустков в ней и т.д. - Недержание мочи.Это осложнение также часто встречается после операции аденомэктомии. Связано оно с тем, что при манипуляции в области простаты происходит травматизация сфинктера мочевого пузыря, который отвечает за его опорожнение.
- Образование «предпузыря». Это образование остаточной полости в месте, где была удалена аденома простаты. Чаще всего это осложнение сочетается со стриктурой уретры. В основном это осложнение проявляется подтеканием мочи.
Подробнее об осложнениях аденомэктомии и их лечении рассказано в соответствующем разделе.
Рекомендации в послеоперационном периоде
Обычно операция аденомэктомии проводится больным зрелого и пожилого возраста. А как известно, больные такого возраста ведут малоподвижный образ жизни. Это чревато тем, что послеоперационный период у таких больных может осложняться застойными пневмониями, нарушением моторной функции кишечника, что приводит к запорам.
Диета. Рекомендуется пища, богатая белком и клетчаткой. Желательно на первых порах ограничить продукты, способствующие газообразованию в кишечнике и вздутию живота. Кроме того, очень важен питьевой режим. Желательно пить больше жидкости, чем обычно. Это важно как во время нахождения в уретре мочевого катетера, так и после того, как катетер удален. Необходимость этого связана с профилактикой такого осложнения аденомэктомии, как стриктуры уретры – образование сужений на ее протяжении.
Урология » Надлобковая чреспузырная аденомэктомия периуретральных желез с глухим швом мочевого пузыря
Урология » Надлобковая чреспузырная аденомэктомия периуретральных желез с глухим швом мочевого пузыряНадлобковая чреспузырная аденомэктомия периуретральных желез с глухим швом мочевого пузыря
Ситдыков Э.
Н., Зубков Э.А. Кафедра урологии (зав. – проф. М. Э. Ситдыкова) ГБОУ ВПО «Казанский ГМУ» Минздрава России
Представлен опыт 524 открытых надлобковых чреспузырных аденомэктомий с глухим швом мочевого пузыря и гемостазом ложа аденомы съемными кетгутовыми лигатурами. Среди преимуществ данного вида операции отмечены раннее восстановление уретрального мочеиспускания (2–4-е сутки), нормализация уродинамических показателей, восстановление анатомофункционального состояния верхних мочевыводящих путей (91% больных), ускоренная эпителизации ложа аденомы и низкая частота воспалительных и обструктивных осложнений.
Литература
 Ф., Экстрауретральная аденомэктомия. Практическая медицина. М., 2012. 355 с.
Ф., Экстрауретральная аденомэктомия. Практическая медицина. М., 2012. 355 с.
Об авторах / Для корреспонденции
Автор для связи: Э. Н. Ситдыков, e-mail: [email protected]
Похожие статьи
{«loading»:»\u0417\u0430\u0433\u0440\u0443\u0437\u043a\u0430…»,»close»:»\u0417\u0430\u043a\u0440\u044b\u0442\u044c»,»yes»:»\u0414\u0430″,»no»:»\u041d\u0435\u0442″,»proceed»:»\u041f\u0440\u043e\u0434\u043e\u043b\u0436\u0438\u0442\u044c»,»conf_del»:»\u0412\u044b \u0434\u0435\u0439\u0441\u0442\u0432\u0438\u0442\u0435\u043b\u044c\u043d\u043e \u0445\u043e\u0442\u0438\u0442\u0435 \u0443\u0434\u0430\u043b\u0438\u0442\u044c»,»cancel»:»\u041e\u0442\u043c\u0435\u043d\u0438\u0442\u044c»}
Преимущества и отличительные особенности экстрауретральной аденомэктомии перед эндоуретральной, трансуретральной и позадилобковой
Преимущества и отличительные особенности экстрауретральной аденомэктомии перед эндоуретральной, трансуретральной и позадилобковой
Н. Ф. Сергиенко, М.И. Васильченко, О.И. Кудряшов, А.И. Бегаев, А.В. Щекочихин, С.П. Шершнев, О.Л. Рейнюк, М.М. Лотоцкий
Ф. Сергиенко, М.И. Васильченко, О.И. Кудряшов, А.И. Бегаев, А.В. Щекочихин, С.П. Шершнев, О.Л. Рейнюк, М.М. Лотоцкий
Главный военный клинический госпиталь им. Н.Н. Бурденко, 2-й центральный военный клинический госпиталь им. П.В. Мандрыки, Государственный институт усовершенствования врачей МО РФ, Москва
Аденома предстательной железы (АПЖ)* по данным международной статистики наблюдается в среднем у 80% мужчин старше 60 лет.Она является наиболее частой причиной госпитализации больных в урологические стационары.
Послеоперационные результаты лечения больных аденомой предстательной железы, общая выживаемость, длительность послеоперационного периода, количество послеоперационных осложнений и реабилитация больных в послеоперационном периоде зависят от выбранного метода оперативного лечения. Длительное консервативное лечение больных АПЖ в большинстве случаев малоэффективно или совсем не эффективно.
Эффект консервативного лечения АПЖ проявляется или может проявиться в определенной степени только при первой-второй стадии формирования узловых структур в ацинусах в период, когда заболевание клинически еще не проявляется или протекает с малозаметными симптомами, на которые пациент не обращает внимания [1].
В клинической урологической практике применяются три основных метода лечения АПЖ: трансуретральная резекция (ТУР) простаты, открытая чреспузырная и позадилобковая аденомэктомии. В Главном госпитале и в других госпиталях, а также в лечебных учреждениях системы здравоохранения применяется усовершенствованный метод открытого оперативного вмешательства на предстательной железе (ПЖ) — экстрауретральная аденомэктомия (ЭУА) [2,3]. С появлением и внедрением в клиническую практику резектоскопов стала широко применять ТУР ПЖ [4], и многие этот метод называют «золотым стандартом» оперативного лечения АПЖ [5]. Однако ТУР ПЖ имеет много ограничений. При лечении аденомы больших размеров основным оперативным методом является чреспузырная аденомэктомия [6, 7].
Рост количества эндоскопических вмешательств, увеличение числа урологов, владеющих так называемым «золотым стандартом» оперативного вмешательства при аденоме простаты, привел к росту частоты осложнений и увеличению летальности после ТУР, в связи с чем наметились тенденции к ограничению показаний для выполнения этой операции [8-10].
Нередко при больших объемах аденоматозной ткани в простате выполняется открытая эндоуретральной аденомэктомии, которая в отечественной и зарубежной литературе в большинстве случаев именуется как операция Федорова-Фрейера, при которой нередко отмечается обильная кровопотеря, тяжелое послеоперационное течение, высокий процент послеоперационных осложнений и высокий летальный исход.
После кропотливых анатомоморфологических исследований предстательной железы с аденоматозными тканями, предстательного отдела мочеиспускательного канала, мочевого пузыря и прилегающих тканей в нашей стране родился новый способ аденомэктомии. Способ первоначально был опубликован как «Малотравматический способ удаления аденомы простаты» [3,11], затем обратились к «Вопросу о «щадящей» аденомэктомии простаты» [2], и к «Способу аденомэктомии» [4]. В журнале «Урология и нефрология» в 1979 году было окончательно определено название «Чреспузырная экстрауретральная аденомэктомия» [5].
В нашей стране и за рубежом относительно широко применяется позадилобковая аденомэктомия, как альтернатива радикальной эндоуретральной аденомэктомии и эта операция признана классическим способом оперативного вмешательства на предстательной железе [5-15]. В результате изучения клинических, литературных сообщений установлены факты необоснованного удаления предстательного отдела уретры вместе с аденоматозной тканью, открытия уретрального сосудистого сплетения и пересечения дорзальных сосудов простаты в момент позадилобковой аденомэктомии.
В результате изучения клинических, литературных сообщений установлены факты необоснованного удаления предстательного отдела уретры вместе с аденоматозной тканью, открытия уретрального сосудистого сплетения и пересечения дорзальных сосудов простаты в момент позадилобковой аденомэктомии.
МАТЕРИАЛЫ И МЕТОДЫ
В ГВКГ им. Н.Н. Бурденко в анатомическом отделении и клинике отработан метод ЭУА до мелких подробностей. С 1977 г. она является основной операцией и выполнена более чем у 3000 больных АПЖ. Методика ЭУА освоена большинством урологов госпиталя и внедрена в клиническую практику во 2-м ЦВКГ им. П.В. Мандрыки, в урологической клинике ВМА Санкт-Петербурга и других лечебных учреждениях России.
ЭУА выполняется оперативным доступом через внебрюшинный разрез мягких тканей передней брюшной стенки, передней стенки мочевого пузыря и полуовальный или клиновидный разрез пузырно-уретрального сегмента. Таким доступом фрагментарно и радикально удаляются аденоматозные ткани, иссекается патологически измененная задняя полуокружность только проксимальной части предстательного отдела мочеиспускательного канала при полном сохранении непрерывности его передней и боковых поверхностей, что позволяет сохранить и уретральное сосудистое сплетение.
Сохранение непрерывности пузырно-уретрального сегмента при полном удалении аденоматозных тканей независимо от их объема является первой отличительной особенностью ЭУА. После энуклеации аденоматозных узлов под визуальным контролем выполняется коррекция дефекта пузырно-уретрального сегмента, замыкательного аппарата мочевого пузыря и полный гемостаз. Это вторая отличительная особенность ЭУА. Целостность уретры и сохранность уретрального сосудистого сплетения обеспечивают минимальную интраоперационную кровопотерю. Фрагментарное удаление аденоматозных тканей позволяет выполнить радикальную аденомэктомию при любых размерах измененной простаты. Это третья отличительная особенность ЭУА.
Для сравнительного изучения ближайших и отдаленных результатов операций в исследование было включено 1000 пациентов после ЭУА (I группа) и 750 больных, перенесших ТУР ПЖ (II группа) и 249 больных после выполнения эндоуретральной аденомэктомии по Федорову-Фрейеру (III группа).
Среди больных, перенесших ЭУА, 2-я стадия заболевания диагностирована у 724 (72,4%), 3-я стадия — у 276 (27,9%) больных.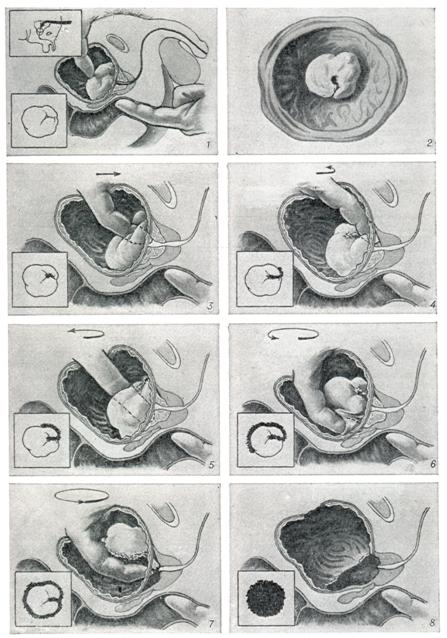 Среди больных после ТУР ПЖ 2-я и 3-я стадия заболевания была соответственно у 526 (70,1%) и у 224 (29,9%) больных. Объем аденоматозных тканей варьировал от 50 до 420 см3 в I группе и от 20 до 60 см3 — во II группе.
Среди больных после ТУР ПЖ 2-я и 3-я стадия заболевания была соответственно у 526 (70,1%) и у 224 (29,9%) больных. Объем аденоматозных тканей варьировал от 50 до 420 см3 в I группе и от 20 до 60 см3 — во II группе.
В нашей практике используется четырехстадийная клиническая классификация АПЖ по Н.Ф. Сергиенко [16].
Операция выполнялась под эпидуральной анестезией, что позволяло в первые дни проводить адекватное обезболивание.
При сравнении полученных результатов нас интересовало прежде всего то, как часто встречались интра- и послеоперационные осложнения и что могло служить причиной их развития, какова динамика клинической картины после восстановления мочеиспускания, частота и выраженность клинического эффекта проведенного оперативного лечения.
В ближайшем послеоперационным периоде у большинства больных I группы отмечалось окрашивание промывной жидкости кровью, интенсивность которого уменьшалась или совсем прекращалась на 3-5-е сутки.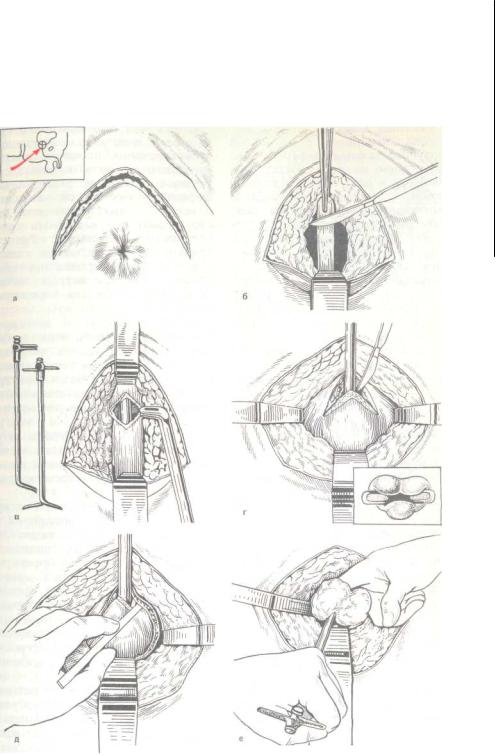 При недостаточной анестезии больных беспокоили резко болезненные спастические сокращения мочевого пузыря. В этих наблюдениях отмечалась макрогематурия. Удаление уретрального катетера позволяло вести больного без обезболивающих препаратов. Больному разрешался активный палатный режим. Наличие надлобковой дренажной трубки позволяло больному активизироваться за пределами палаты. Заживление операционной раны и полное восстановление акта мочеиспускания наступали на 12-16 сутки. Больного выписывали на амбулаторное лечение на 18-21 сутки.
При недостаточной анестезии больных беспокоили резко болезненные спастические сокращения мочевого пузыря. В этих наблюдениях отмечалась макрогематурия. Удаление уретрального катетера позволяло вести больного без обезболивающих препаратов. Больному разрешался активный палатный режим. Наличие надлобковой дренажной трубки позволяло больному активизироваться за пределами палаты. Заживление операционной раны и полное восстановление акта мочеиспускания наступали на 12-16 сутки. Больного выписывали на амбулаторное лечение на 18-21 сутки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В раннем послеоперационном периоде у больных I группы в большинстве наблюдений выявлялась макрогематурия, обусловленная кровоточивостью рыхлой слизистой мочевого пузыря и ложа аденомы, купированная капельным орошением мочевого пузыря антисептическими растворами. В позднем периоде у 24 (2,4%) пациентов отмечены инфекционно-воспалительные осложнения — обострение хронического пиелонефрита (13), острый эпидидимоорхит (5), послеоперационный цистит, простатит (6), поддававшиеся адекватному консервативному лечению, у 2 (0,2%) пациентов — рубцовые изменения шейки мочевого пузыря, у 3 (0,3%) — стриктура уретры. Обострение сердечной недостаточности наблюдалось у 12 (1,2%) больных. После ЭУА умерли 4 (0,4%) больных от тромбоэмболии легочной артерии и инфарктной пневмонии. В целом осложнения после ЭУА возникли у 56 (5,6%) больных.
Обострение сердечной недостаточности наблюдалось у 12 (1,2%) больных. После ЭУА умерли 4 (0,4%) больных от тромбоэмболии легочной артерии и инфарктной пневмонии. В целом осложнения после ЭУА возникли у 56 (5,6%) больных.
Осложнения во время ТУР ПЖ и после нее (II группа) отмечены у 215 (28,7%) больных. Первичные и вторичные внутрипузырные кровотечения имели место у 29 (3,86%) оперированных больных. Для остановки кровотечения из зоны операции в 8 наблюдениях потребовалось надлобковое сечение мочевого пузыря. В остальных наблюдениях кровотечение остановлено эндоскопическими методами. Интраоперационные осложнения в виде неполной перфорации хирургической капсулы были у 6 (0,8%), перфорации стенки мочевого пузыря — у 5 (0,66%), повреждения устьев мочеточников, не потребовавшие перехода на открытую операцию, — у 7 (0,93%) больных. В ближайшем послеоперационном периоде у 7 (0,93%) больных развился ТУР-синдром, у 2 — острая почечная недостаточность, у 91 (12,13%) больного — инфекционновоспалительные осложнения. В ближайшем послеоперационном периоде умерли 5 (0,66%) больных.
В ближайшем послеоперационном периоде умерли 5 (0,66%) больных.
В отдаленном периоде у 28 (3,73%) больных сформировалась стриктура уретры, у 19 (2,53%) — рубцовый стеноз шейки мочевого пузыря, у 7 больных отмечено недержание мочи. Такое осложнение, как ретроградная эякуляция после ТУР ПЖ является «неизбежным» практически у всех пациентов (от 77,8 до 97%) при условии субтотальной и тотальной резекции аденоматозных тканей [13, 14].
Большой интерес представляет сравнительная динамика восстановления мочеиспускания у больных, перенесших ЭУА и ТУР ПЖ. Через 3 недели после открытой операции у больных отмечалось полноценное восстановление акта мочеиспускания. Дизурия купировалась практически через 1,5 — 2 мес. При этом у больных I группы средняя скорость потока мочи возрастала примерно в 3 раза, тогда как после ТУР ПЖ — в 1,5-2 раза. Дизурия у большинства больных после ТУР сохранялась на протяжении 2-6 мес.
ТУР ПЖ при аденоме отличается от ЭУА отсутствием разреза мягких тканей передней брюшной стенки, но сопровождается удалением проксимальной части предстательного отдела уретры, замыкательного аппарата мочевого пузыря и почти всегда оставлением в простате неудаленных аденоматозных тканей. Образуется внутренняя раневая полость, занимающая ложе аденомы, окруженной хирургической капсулой и дефектом нижней части мочевого пузыря. Полагаем, что это четвертая отличительная особенность ЭУА от ТУР ПЖ. Кроме того, раневая полость после электрорезекции остается покрытой термально поврежденным слоем тканей. В процессе заживления раны, поврежденные ткани в виде струпа отторгаются, на их место со стороны слизистой мочевого пузыря и уретры нарастает уротелий. Очищение раневой поверхности и покрытие ее уротелием происходит в сроки от 6 до 18 мес. В этот период пациенты находятся под наблюдением и на постоянном лечении в амбулаторных условиях.
Образуется внутренняя раневая полость, занимающая ложе аденомы, окруженной хирургической капсулой и дефектом нижней части мочевого пузыря. Полагаем, что это четвертая отличительная особенность ЭУА от ТУР ПЖ. Кроме того, раневая полость после электрорезекции остается покрытой термально поврежденным слоем тканей. В процессе заживления раны, поврежденные ткани в виде струпа отторгаются, на их место со стороны слизистой мочевого пузыря и уретры нарастает уротелий. Очищение раневой поверхности и покрытие ее уротелием происходит в сроки от 6 до 18 мес. В этот период пациенты находятся под наблюдением и на постоянном лечении в амбулаторных условиях.
Послеоперационная реабилитация больных после ЭУА завершается заживлением раны передней брюшной стенки, мочевого пузыря и полным восстановлением свободного безболезненного мочеиспускания через 3-4 недели. После ТУР ПЖ самостоятельное свободное безболезненное мочеиспускание восстанавливается после покрытия уротелием раневой поверхности ложа аденомы спустя 1-1,5 года.
Хирургическая капсула простаты в какой-то степени компенсирует функциональное состояние нижних мочевыводящих путей. Пятая отличительная особенность ТУР ПЖ от ЭУА состоит в том, что после оперативного вмешательства не подлежит коррекции удаленный проксимальный отдел уретры и у пациентов на всю оставшуюся жизнь сохраняется потенциальная возможность развития множественных, сопряженных с этим оперативным вмешательством, осложнений.
Паллиативный характер ТУР ПЖ обеспечивает пациенту, как правило, повторное оперативное лечение АПЖ. Это шестая отличительная особенность ТУР ПЖ, в то время как «открытая» ЭУА выполняется однократно и радикально.
Сравнительно непродолжительная послеоперационная реабилитация (1-1,5 мес.) пациентов после ЭУА в амбулаторно-поликлинических условиях позволяет им приступить к выполнению своих социальных обязанностей и многие годы (8-12 лет) не обращаться к урологу, в то время как после ТУР ПЖ пациенты нуждаются в клинико-поликлиническом наблюдении и консервативном лечении в течение 6-18 мес. Это седьмая отличительная особенность ЭУА.
Это седьмая отличительная особенность ЭУА.
В связи с тем, что после ЭУА сохраняются ткани предстательной железы и ее объем восстанавливается во многих наблюдениях до исходных анатомических размеров, у этих пациентов сохраняется функциональная активность простаты. Это восьмая отличительная особенность ЭУА.
После выполнения эндоуретральной аденомэктомии по Федорову- Фрейеру (249 больных) в послеоперационном периоде отмечены осложнения у 68 (27,3%) больных, из них умерло 17 (6,8%) человек; 8 — от обострения сердечно-сосудистой недостаточности, 7 — от обострения хронического пиелонефрита и почечной недостаточности, 2 — от тромбоэмболии легочной артерии. Отмечено, что у умерших больных кровопотеря во время операции была значительной и превышала 500 мл [15].
В отдаленном периоде после удаления аденоматозных тканей по эндоуретральной методике Федорова- Фрейера у 33% больных сохранялась дизурия в течение года и у 19% — в течение 2 лет; у 7% больных операция не привела к улучшению мочеиспускания; у 3 больных в течение 4 лет дважды и у 1 больного трижды произведена повторная реконструктивная операция на шейке мочевого пузыря и предстательной части уретры. У 2 больных наступила облитерация внутреннего отверстия уретры, что также потребовало восстановительной операции.
У 2 больных наступила облитерация внутреннего отверстия уретры, что также потребовало восстановительной операции.
Усовершенствованная позадилобковая экстрауретральная аденомэктомия по методике Сергиенко отличается от операции Лидского-Мили- на направлением разреза фиброзной капсулы простаты и сохранением предстательного отдела уретры и сосудистого сплетения. По передней поверхности как правой, так и левой половины предстательной железы, отступив от средней линии на 1-1,5 см, в продольном направлении, минуя основные венозный и артериальный стволы, производится по два параллельных «обвивных» гемостатических шва длиной до 3-4 см. После чего между швами (продольно!) рассекают вначале фиброзную капсулу, а затем и всю хирургическую капсулу до аденоматозных тканей. Длина разреза варьирует и зависит от величины аденомы, обычно он меньше на 1-2 см ее продольного размера. Если фиброзная капсула не прошита лигатурой, то рана тотчас наполняется кровью, которая поступает из пересеченных сосудов, расположенных внутрикапсулярно.
При выполнении ЭУА во всех случаях в уретре сохраняется уретральный катетер. Продольные разрезы позволяют выделить и удалить аденоматозные ткани, сохранив предстательный отдел уретры и сосуды уретрального и дорзального сплетений.
Лучшим вариантом для позадилобковой аденомэктомии является локализация аденомы только в боковых долях простаты. Выполненная экстрауретрально адено- мэктомия в послеоперационном периоде протекает без осложнений. Выздоровление больного заканчивается заживлением раны передней брюшной стенки и восстановлением свободного самостоятельного мочеиспускания.
Преимущество экстрауретральной аденомэктомии перед другими способами удаления аденоматозных тканей и трансуретральной резекцией, состоит в сравнительно малой травматичности оперативного вмешательства на предстательной железе. Радикальность удаления аденоматозных тканей обеспечивается сохранением пузырно-уретрального сегмента, предстательного отдела уретры и уретрального и дорзального сосудистых сплетений при энуклеации любых объемов аденом. Сохранение замыкательного аппарата мочевого пузыря, предстательного отдела уретры, сохранение сосудистых сплетений обеспечивает минимальную интраоперационную кровопотерю, что в последующем составляет относительно непродолжительный послеоперационный и социальный периоды реабилитации больных.
Сохранение замыкательного аппарата мочевого пузыря, предстательного отдела уретры, сохранение сосудистых сплетений обеспечивает минимальную интраоперационную кровопотерю, что в последующем составляет относительно непродолжительный послеоперационный и социальный периоды реабилитации больных.
ЗАКЛЮЧЕНИЕ
Результаты наших исследований и данные других авторов демонстрируют перспективность широкого применения методики ЭУА. Она остается эффективным способом лечения больных АПЖ и сравнительно малотравматичным методом, несмотря на разрез мягких тканей передней брюшной стенки. ЭУА выполняется при всех формах роста и при разном объеме аденоматозных тканей, в том числе и при наличии в мочевом пузыре дивертикулов, опухолей, камней и аномалийного расположения устьев мочеточников. ЭУА выполняется при уретеро- и пиелоэктазии и при почечной недостаточности. Минимальная кровопотеря позволяет выполнять радикальную аденомэктомию больным с учетом сердечнолегочной недостаточности и других сопутствующих заболеваний**.
** Мнение редакции не совпадает с выводами авторов. Однако их авторитет и клинический опыт заслуживают внимания и обсуждения.
Ключевые слова: экстрауретральная аденомэктомия, эндоуретральная аденомэктомия, трансуретральная резекция простаты, позадилобковая аденомэктомия.
Keywords: BPH, extraurethral adenomectomy, endourethral adenomectomy, TURP, retropubic adenomectomy.
ЛИТЕРАТУРА
- Кудрявцев Ю.В., Сивков А.В. Морфологические изменения в ткани предстательной железы при доброкачественной гиперплазии // Экспериментальная и клиническая урология. 2010. № 1. С. 18-22.
- Сергиенко Н.Ф. К вопросу о «щадящей» аденомэктомии простаты //Актуальные вопросы гастроэнтерологии. М. 1975. С. 165-167.
- Сергиенко Н.Ф. Малотравматичный способ удаления аденомы простаты // Хирургия. 1975. № 7. С. 84-87.
- Сергиенко Н.Ф. Способ аденомэктомии. Авт. свидетельство 628891, 1977.
- Сергиенко Н.
 Ф. Чреспузырная экстрауретральная аденомэктомия // Урол. и нефрол. 1979. № 2. С. 30-34.
Ф. Чреспузырная экстрауретральная аденомэктомия // Урол. и нефрол. 1979. № 2. С. 30-34. - Лидский А. Т. Позадилобковая аденомэктомия // Астраханский медицинский журнал. 1923. № 10-12.
- Milin T. Retropubic prostatectomy // Lancet. 1945. Vol. 2. P. 639-696.
- Кан Д.В., Степанов И.И. Позадилобковая внепузырная аденомэктомия // Урол. и нефрол. 1978. № 3. С.41-43.
- Рябинский В.С., Чеченин М.Г. Место трансуретральной электрорезекции в оперативном лечении больных аденомой предстательной железы. // Материалы Пленума Всероссийского общества урологов. Москва, 1988. C. 117-118.
- Переверзев А.С., Сергиенко Н.Ф. Позадилобковая аденомэктомия // Аденома предстательной железы. Киев 1998. С. 169-174.
- Сергиенко Н.Ф. О технике аденомэктомии // Тезисы докладов 4-го Пленума Всесоюзного общества урологов. 1973. С. 37.
- К вопросу о выборе способа операции при аденоме предстательной железы. / Сергиенко Н.Ф., Бегаев А.И., Щекочихин А.
 В., Васильченко М.И. // Воен. мед. журнал. 2006. № 7. С. 38-42.
В., Васильченко М.И. // Воен. мед. журнал. 2006. № 7. С. 38-42. - Модификация позадилобковой аденомэктомии предстательной железы./ Серняк П.С., Виненцов Ю.А., Шамраев С.Н., Кобец В.Г. // Аденома предстательной железы. Материалы научных трудов 5-го Международного конгресса урологов. Харьков. 1997. С. 164-167.
- Синкевичус Ч.А. Позадилобковая внепузырная аденомэктомия // Урол. и нефрол. 1978. № 3. С. 38-41.
- Сергиенко Н.Ф. Экстрауретральная аденомэктомия. Иллюстрированное руководство. Москва. Издательство Патриот. 2010. 335 с.
- Сергиенко Н.Ф. Клиническая классификация аденомы простаты // Военно-мед. ж. 1976. № 8. С. 40-43.
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 168.28 кб |
Чреспузырная аденомэктомия
С возрастом у мужчин в предстательной железе отмечается формирование плотной соединительной ткани вокруг мочеиспускательного канала, оттесняющей на периферию железистую ткань органа. Такие изменения структуры простаты констатируются у 14% мужчин в возрасте 40–49 лет, а в возрасте старше 80 лет достигают 90%. Плотные структуры могут способствовать развитию нарушений мочеиспускания, вплоть до его задержки, что существенно снижает качество жизни зрелого мужчины, достигшего высот в профессиональной деятельности.С возрастом у мужчин в предстательной железе отмечается формирование плотной соединительной ткани вокруг мочеиспускательного канала, оттесняющей на периферию железистую ткань органа. Такие изменения структуры простаты констатируются у 14% мужчин в возрасте 40–49 лет, а в возрасте старше 80 лет достигают 90%. Плотные структуры могут способствовать развитию нарушений мочеиспускания, вплоть до его задержки, что существенно снижает качество жизни зрелого мужчины, достигшего высот в профессиональной деятельности.
Такие изменения структуры простаты констатируются у 14% мужчин в возрасте 40–49 лет, а в возрасте старше 80 лет достигают 90%. Плотные структуры могут способствовать развитию нарушений мочеиспускания, вплоть до его задержки, что существенно снижает качество жизни зрелого мужчины, достигшего высот в профессиональной деятельности.С возрастом у мужчин в предстательной железе отмечается формирование плотной соединительной ткани вокруг мочеиспускательного канала, оттесняющей на периферию железистую ткань органа. Такие изменения структуры простаты констатируются у 14% мужчин в возрасте 40–49 лет, а в возрасте старше 80 лет достигают 90%. Плотные структуры могут способствовать развитию нарушений мочеиспускания, вплоть до его задержки, что существенно снижает качество жизни зрелого мужчины, достигшего высот в профессиональной деятельности.
Современные препараты позволяют длительное время сохранять приемлемые показатели мочеиспускания. Однако, при значительном объеме (свыше 150-200 кубических сантиметров) гиперплазированной железы и неэффективности консервативной терапии мужчине может быть предложено выполнение хирургического лечения – простатэктомии, или как ее называют в России – аденомэктомии. Наибольшее число проблем такого рода в современной урологии решается с помощью эндоскопической хирругии – трансуретральной резекции и лазерной или трансуретральной абляции предстательной железы. Остается место и для открытой хирургии.
Наибольшее число проблем такого рода в современной урологии решается с помощью эндоскопической хирругии – трансуретральной резекции и лазерной или трансуретральной абляции предстательной железы. Остается место и для открытой хирургии.
Много лет назад описана и выполняется по сию пору чреспузырная аденомэктомия, предполагающая разрез передней стенки живота и визуальный доступ к мочевому пузырю и аденоме простаты:
1. при выраженной «средней доле» железы,
2. при наличии 3-х компонентного фаллопротеза: резервуар располагается перед мочевым пузырем и может быть случайно поврежден при выполнении операции (см. ссылку на позадилонную аденомэктомию),
3. при выраженных сосудистых коллатералях малого таза, которые рискованно повредить при ином доступе к простате.
Больной лежит на операционном столе на спине, в мочевой пузырь устанавливается катетер. Для удаления аденоматозной ткани вскрывают мочевой пузырь продольным разрезом в надлобковой области. Пальцем вылущивается гиперплазированная часть простаты, которая мешает больному мочиться. Выполняется остановка кровотечения из зоны удаленной ткани, в мочевой пузырь устанавливается катетер на несколько дней, проводится орошение полости мочевого пузыря растворами антисептических средств. Катетер служит для заживления зоны операции и формирования анатомических структур, что позволит мужчине свободно мочиться после выписки из стационара.
Пальцем вылущивается гиперплазированная часть простаты, которая мешает больному мочиться. Выполняется остановка кровотечения из зоны удаленной ткани, в мочевой пузырь устанавливается катетер на несколько дней, проводится орошение полости мочевого пузыря растворами антисептических средств. Катетер служит для заживления зоны операции и формирования анатомических структур, что позволит мужчине свободно мочиться после выписки из стационара.
В ходе операции могут встречаться осложнения:
• кровотечение вследствие разрыва кровеносного сосуда,
• аллергическая реакция на анестезию,
• повреждение уретры.
В послеоперационном периоде больной получает антибиотики и анальгетики, проводится промывание мочевого пузыря фурацилином и/или раствором бетадина. Швы (или скобки) с послеоперационной раны удаляют на 10-й день. Уретральный катетер может быть удален несколько раньше, в зависимости от конкретной клинической ситуации.
Старцев Владимир Юрьевич,
2018-01-13.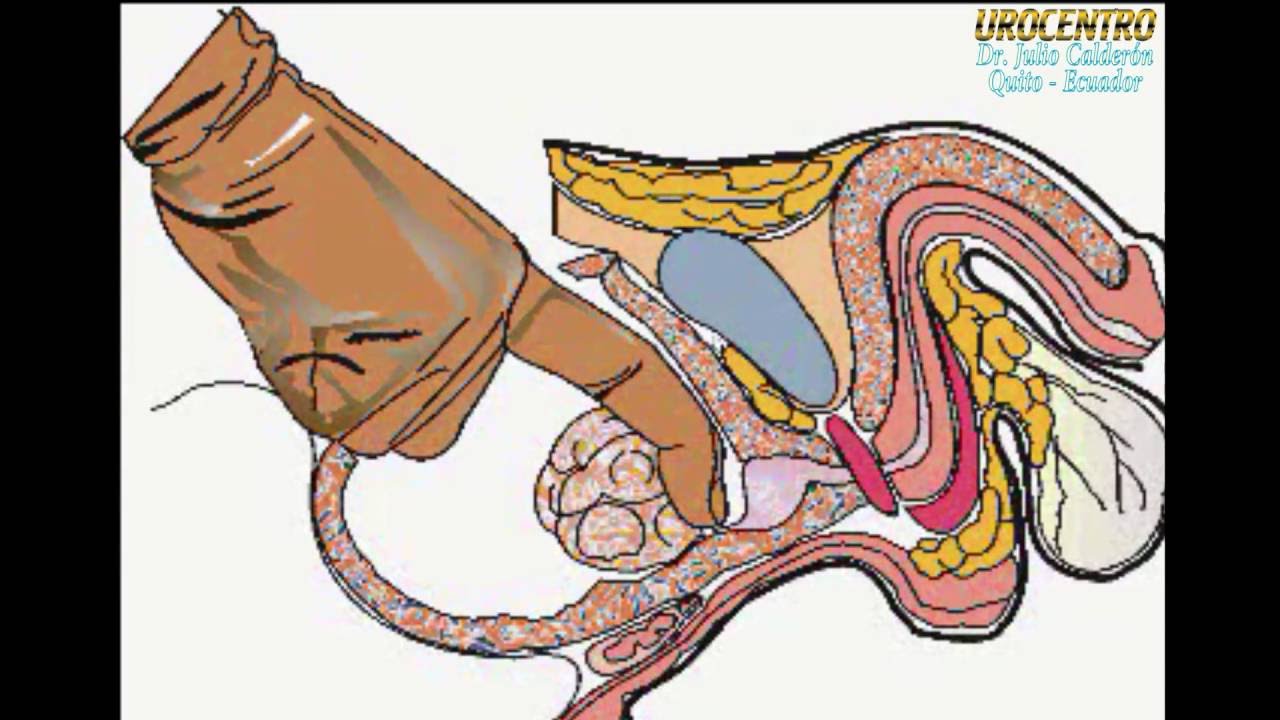
Чреспузырная аденомэктомия и трансуретральная резекция в лечении доброкачественной гиперплазии предстательной железы Текст научной статьи по специальности «Клиническая медицина»
78
МЕТОДИКА
острые волны, что указывало на отрицательную динамику процесса. Появилась грубая патологическая активность в покое с преобладанием положительных острых волн (рис. 8). Рекомендована консультация нейрохирурга.
Отдавая себе отчет в том, что вместе с большими возможностями, как и всякий другой диагностический метод, ЭНМГ имеет свои ограничения, и поставив во главу угла клинические данные, тем не менее следует отметить, что использование ЭНМГ позволяет специалистам быстрее и точнее установить верный диагноз, отслеживать динамику патологического процесса и увереннее проводить дифференциальную диагностику поражений нервно-мышечной системы.
Литература
1. Болезни нервной системы / под ред. Н.Н. Яхно. — М.: Медицина, 2005.
2. Гехт Б.М., Касаткина Л.Ф., Самойлов М.И., Са-надзе А.Г. Электромиография в диагностике нервно-
УДК 616.65-007.61-089
Н.В. Сапожников
ЧРЕСПУЗЫРНАЯ АДЕНОМЭКТОМИЯ И ТРАНСУРЕТРАЛЬНАЯ РЕЗЕКЦИЯ В ЛЕЧЕНИИ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Сахалинская областная больница (г. Южно-Сахалинск)
Ключевые слова: доброкачественная гиперплазия предстательной железы, хирургическое лечение.
У мужчин старшего возраста самым распространенным доброкачественным новообразованием является гиперплазия предстательной железы. К 60 годам этим заболеванием страдают до 46% мужчин, к 90-летнему возрасту этот показатель достигает 85—90% [4]. Социальная значимость и актуальность данной проблемы очевидна — демографические исследования ВОЗ однозначно свидетельствуют о росте численности пожилого населения планеты. Сахалинская область здесь не является исключением: число мужчин пожилого и старческого возраста составляет 46 546 из 532 000 населения региона.
К 60 годам этим заболеванием страдают до 46% мужчин, к 90-летнему возрасту этот показатель достигает 85—90% [4]. Социальная значимость и актуальность данной проблемы очевидна — демографические исследования ВОЗ однозначно свидетельствуют о росте численности пожилого населения планеты. Сахалинская область здесь не является исключением: число мужчин пожилого и старческого возраста составляет 46 546 из 532 000 населения региона.
В течение 2004—2006 гг. в урологическом отделении Сахалинской областной больницы наблюдались 494 мужчины с доброкачественной гиперплазией предстательной железы (ДГПЖ) в возрасте от 51 года до 87 лет. Внедрение в клиническую практику методов консервативной терапии привело к пересмотру показаний к оперативному лечению ДГПЖ [5]. Так, число пациентов, пролеченных консервативно, из указанной группы составило 67%. Тем не менее, несмотря на успехи консервативной фармакотерапии, доля пациентов с ДЖПГ,
мышечных заболеваний. — Таганрог : Изд-во ТГРУ, 1997.
— Таганрог : Изд-во ТГРУ, 1997.
3. Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней. — М. : МЕДпресс-информ, 2004.
4. Команцев В.Н., Заболотных В.А. Методические основы клинической электронейромиографии. — СПб. : Лань, 2001.
Поступила в редакцию 27.04.2007.
THE ROLE OF THE ELECTRONEUROMYOGRAPHY IN DIAGNOSTICS AND THE RESULTS OF TREATMENT OF THE NEURO-MUSCULAR DISEASES D.A. Trayan
Sakhalin Regional Hospital (Yuzhno-Sakhalinsk)
Summary — In the article the brief review of the electromyography opportunities is resulted, as well as the methods of its use and practical examples of diagnostics of various diseases. The author concludes, that wide introduction of this method of research into the clinical practice will improve the diagnostics of the neuromuscular diseases.
Pacific Medical Journal, 2007, No. 3, p. 76—78.
нуждающихся в оперативном пособии, остается достаточно высокой. За три года нами были прооперированы 163 человека.
Чреспузырная аденомэктомия и трансуретральная резекция простаты являются основными оперативными методами лечения ДГПЖ. На собственном материале выбор оперативного вмешательства основывался на расчете объема органа. Предпочтение открытой операции отдавалось при объеме предстательной железы более 100 см3, при наличии конкрементов или опухоли мочевого пузыря. Также на выбор метода лечения влияли наличие и тяжесть сопутствующих заболеваний. На сегодняшний день трансуретральная резекция занимает первое место среди оперативных вмешательств по поводу ДГПЖ, учитывая меньшее количество послеоперационных осложнений и раннюю активизацию больных [3]. Однако преувеличение преимуществ этого вмешательства опасно для пациента.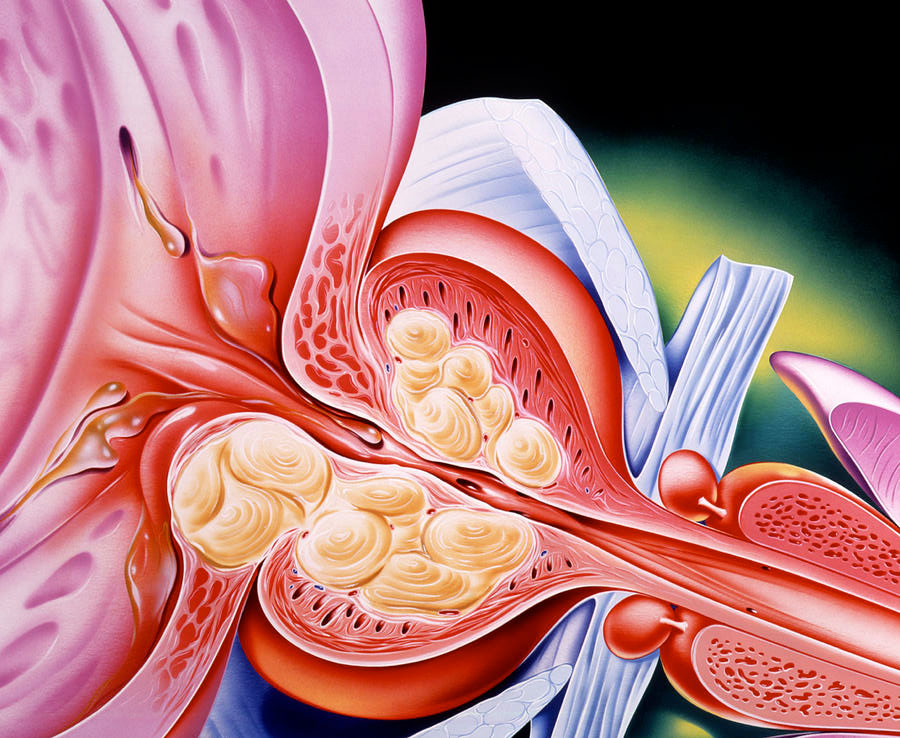 Опыт отечественных и зарубежных урологических стационаров показывает, что проблема выбора способа операции при ДГПЖ далека от окончательного разрешения [1]. Отдаленные результаты оценки эффективности оперативных вмешательств свидетельствуют об определенных преимуществах чреспузырной простатэктомии перед трансуретральной резекцией [2].
Опыт отечественных и зарубежных урологических стационаров показывает, что проблема выбора способа операции при ДГПЖ далека от окончательного разрешения [1]. Отдаленные результаты оценки эффективности оперативных вмешательств свидетельствуют об определенных преимуществах чреспузырной простатэктомии перед трансуретральной резекцией [2].
Чреспузырная простатэктомия была выполнена 95 пациентам (1-я группа, средний возраст — 67,7 года), трансуретральная резекция — 68 пациентам (2-я группа, средний возраст — 71,3 года). Последняя преимущественно делалась у лиц, имевших тяжелую сопутствующую патологию (гипертоническая болезнь, сахарный диабет, сердечная недостаточность и пр.). Здесь операцией выбора была паллиативная трансуретральная резекция: бороздчатая от шейки до семенного бугорка на 5, 7 и 12 часах условного циферблата, с резекцией доли, максимально
МЕТОДИКА
79
сдавливающей уретру, воронкообразная от шейки до семенного бугорка. Операция осуществлялась в основном при помощи резектоскопов с постоянной ирригацией и диаметром тубуса 24—27 Fr с набором стандартных петель и коагуляционных электродов (К. Storz, 01утрш). В качестве ирригиционного раствора использовалась 5% глюкоза.
Операция осуществлялась в основном при помощи резектоскопов с постоянной ирригацией и диаметром тубуса 24—27 Fr с набором стандартных петель и коагуляционных электродов (К. Storz, 01утрш). В качестве ирригиционного раствора использовалась 5% глюкоза.
Дооперационный койкодень в обеих группах оперированных был примерно одинаков — 3,5—3,7. Длительность послеоперационного пребывания на койке лиц, перенесших чреспузырную простатэкто-мию, составила 21,8 дня, а для больных, подвергшихся трансуретральной резекции, — 15,9 дня. Средний койкодень соответственно равнялся 24,8 и 19,4. Консервативная терапия с одинаковой частотой применялась до оперативного вмешательства у пациентов обеих групп.
В послеоперационном периоде пациенты, перенесшие трансуретральную резекцию предстательной железы, субъективно чувствовали себя лучше. Из осложнений оперативного вмешательства в первой группе зафиксированы кровотечения из ложа аденомы (4 случая), тромбоэмболия легочной артерии (1 случай), орхит (6 случаев) и восходящий пиелонефрит (2 случая).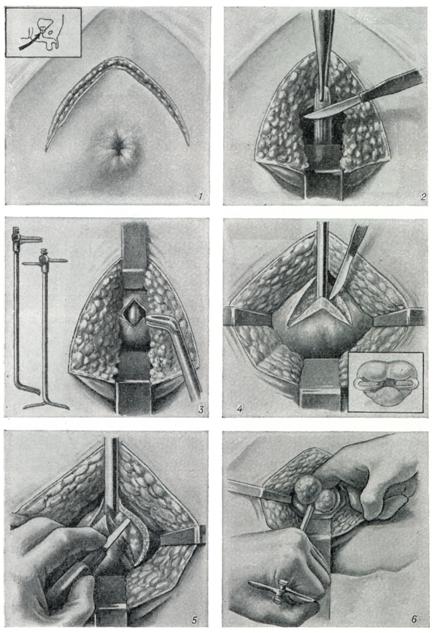 После трансуретральной резекции отмечены кровотечения из ложа аденомы (2 случая), перфорация мочевого пузыря (2 случая), стриктуры уретры (3 случая), орхит (1 случай), недержание мочи (3 случая) и восходящий пиелонефрит (1 случай). Эти данные говорят о некотором преимуществе трансуретральной резекции в связи с более агрессивным характером чреспузырной аденомэк-томии и большим числом серьезных осложнений
После трансуретральной резекции отмечены кровотечения из ложа аденомы (2 случая), перфорация мочевого пузыря (2 случая), стриктуры уретры (3 случая), орхит (1 случай), недержание мочи (3 случая) и восходящий пиелонефрит (1 случай). Эти данные говорят о некотором преимуществе трансуретральной резекции в связи с более агрессивным характером чреспузырной аденомэк-томии и большим числом серьезных осложнений
УДК 616.831-001.32-089.168
П.И. Лисименко, А.В. Антонов, М.И. Шпак,
Р.В. Аношкин
РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОЧАГОВ РАЗМОЗЖЕНИЯ ГОЛОВНОГО МОЗГА
Сахалинская областная больница (г. Южно-Сахалинск)
Ключевые слова: черепно-мозговая травма, диагностика, оперативное лечение.
Очаги размозжения головного мозга — это макроскопически обнаруживаемые участки деструкции мозгового вещества, обычно имбибированные кровью, образовавшиеся вследствие механической травмы и последующих дисгемических нарушений. Неудовлетворительные результаты удаления только внутричерепных гематом у больных с деструкцией мозговой ткани послужили основанием для совершенствования хирургических методов лечения очагов размозжения больших полушарий головного мозга [2].
послеоперационного периода. Относительно большее число осложнений трансуретральной резекции простаты было следствием неправильно определенных показаний к данному вмешательству, недостаточной предоперационной подготовки, технических погрешностей в период освоения эндоскопических технологий.
Литература
1. Винаров А.З., Асламазов Э. Г. // Материалы Х Российского съезда урологов. — М., 2002. — С. 33—42.
Г. // Материалы Х Российского съезда урологов. — М., 2002. — С. 33—42.
2. Камалов А.А., Гущин Б.Л., Дорофеев С.Д. и др. //Урология и нефрология. — 2004. — № 1. — С. 30—34.
3. Лопаткин Н.А. // Урология и нефрология. — 1982. — № 1. — С. 3-9.
4. Лоран О.Б., Лукьянов И.В., Марков А.В. // Урология и нефрология. — 2005. — № 3. — С. 15-18.
5. Мартов А.Г., Гущин Б.Л., Меринов Д.С. и др. // Урология и нефрология. — 2004. — № 1. — С. 54-57.
Поступила в редакцию 27.04.2007.
TRANSBLADDER ADENOMECTOMY AND TRANSURETHRAL RESECTION IN THE TREATMENT OF BENIGN TUMORS OF THE PROSTATA H.V. Sapozhnikov
Sakhalin Regional Hospital (Yuzhno-Sakhalinsk)
Summary — The review of a clinical material — 494 cases of the benign prostate tumors. One third of patients (32.9%) are treated operatively: transbladder adenomectomy (95 interventions) and transurethral prostate resections (68 cases). In the postoperative period the severe complications were marked in the first group of patients more often. The conclusion about indications to the transurethral resections is shown, also because the long-term results testify the greater efficiency of open surgery.
One third of patients (32.9%) are treated operatively: transbladder adenomectomy (95 interventions) and transurethral prostate resections (68 cases). In the postoperative period the severe complications were marked in the first group of patients more often. The conclusion about indications to the transurethral resections is shown, also because the long-term results testify the greater efficiency of open surgery.
Pacific Medical Journal, 2007, No. 3, p. 78-79.
В первые дни после травмы в области очага раз-мозжения выделяют три зоны:
1) зона деструкции (ишемия),
2) переходная зона (редуцированный кровоток),
3) пограничная зона (увеличенный кровоток).
Дискуссионным является вопрос объема оперативного вмешательства — удалять ли, например, всю височную долю при наличии очага размозжения ее полюса, удалять ли очаг в пределах переходной зоны и осуществлять ли отмывание мозгового детрита и субпиальное отсасывание нежизнеспособной ткани [1, 3, 4].
Были проанализированы результаты лечения 32 больных с очагами размозжения головного мозга. Наличие очагов было верифицировано с помощью магнитно-резонансной и компьютерной томографии, интраоперационно и по данными аутопсии. На этапе дооперационного обследования всем больным выполнены рентгенография черепа и эхоэнцефалогра-фия. Магнитно-резонансная томография головного мозга использована в 18 случаях, компьютерная томография — в 3. Необходимо отметить большую информативность магнитно-резонансной томографии
Хирургическое лечение аденомы предстательной железы. Аденомэктомия — модифицированная техника
Модифицированная техника позадилонной аденомэктомии (техника РМАПО)
Введение. Аденома предстательной железы (АПЖ) как самое частое урологическое заболевание мужчин старшего возраста по-прежнему находится в зоне пристального внимания специалистов. При этом одной из наиболее дискуссионных проблем является лечение больных с большими размерами предстательной железы (ПЖ). Несмотря на успешное применение малоинвазивных технологий в лечении аденомы предстательной железы больших размеров (подробнее…), результаты которого широко обсуждаются в медицинской литературе последних лет, руководство большинства национальных урологических ассоциаций признают открытую аденомэктомию методом выбора в лечении данной категории пациентов [1–4]. Два основных метода открытой аденомэктомии: чреспузырная (ЧАЭ) и позадилонная (ПАЭ) – были описаны еще в конце ХIX и середине XX в. соответственно [5–7]. Оценка результатов лечения АПЖ больших размеров с использованием данных техник остается весьма противоречивой до настоящего времени. Так, исследования последних лет, посвященные сравнению ПАЭ и ЧАЭ, характеризуют позиции ПАЭ как более предпочтительные [8–10]. Тем не менее, несмотря на выявленную эффективность, ПАЭ не получила столь широкого применения, как ЧАЭ (отчет AUA от 2010 г.) [4]. В обзоре методов открытой аденомэктомии среди 12 рассматриваемых рандомизированных исследований упоминается только одно, посвященное изучению результатов ПАЭ, тогда как ЧАЭ посвящено 6 исследований.
Несмотря на успешное применение малоинвазивных технологий в лечении аденомы предстательной железы больших размеров (подробнее…), результаты которого широко обсуждаются в медицинской литературе последних лет, руководство большинства национальных урологических ассоциаций признают открытую аденомэктомию методом выбора в лечении данной категории пациентов [1–4]. Два основных метода открытой аденомэктомии: чреспузырная (ЧАЭ) и позадилонная (ПАЭ) – были описаны еще в конце ХIX и середине XX в. соответственно [5–7]. Оценка результатов лечения АПЖ больших размеров с использованием данных техник остается весьма противоречивой до настоящего времени. Так, исследования последних лет, посвященные сравнению ПАЭ и ЧАЭ, характеризуют позиции ПАЭ как более предпочтительные [8–10]. Тем не менее, несмотря на выявленную эффективность, ПАЭ не получила столь широкого применения, как ЧАЭ (отчет AUA от 2010 г.) [4]. В обзоре методов открытой аденомэктомии среди 12 рассматриваемых рандомизированных исследований упоминается только одно, посвященное изучению результатов ПАЭ, тогда как ЧАЭ посвящено 6 исследований. Остальных 5 исследований этой серии либо включали оба метода, либо не конкретизировали метод открытой аденомэктомии. Причинами, сдерживающими широкое применение ПАЭ, явились опасения развития различных осложнений, таких как остеит лобковых костей и различные виды кровотечений. Нами была предложена модификация данного вмешательства, которая позволила снизить частоту осложнений ПАЭ и повысить эффективность лечения. Таким образом, недостаточное освещение современных результатов ПАЭ и внедрение в практику модифицированной нами техники операции обусловили актуальность настоящего исследования.
Остальных 5 исследований этой серии либо включали оба метода, либо не конкретизировали метод открытой аденомэктомии. Причинами, сдерживающими широкое применение ПАЭ, явились опасения развития различных осложнений, таких как остеит лобковых костей и различные виды кровотечений. Нами была предложена модификация данного вмешательства, которая позволила снизить частоту осложнений ПАЭ и повысить эффективность лечения. Таким образом, недостаточное освещение современных результатов ПАЭ и внедрение в практику модифицированной нами техники операции обусловили актуальность настоящего исследования.
Материалы и методы. Проанализированы результаты обследования и лечения 125 больных АПЖ с объемом ПЖ более 75 см3, которым с января 2007 по март 2011 г. проводилось оперативное лечение в урологической клинике РМАПО. Из них у 83 пациентам была выполнена ПАЭ по методике, предложенной клиникой урологии и хирургической андрологии РМАПО (техника РМАПО), 42 пациентам была проведена ЧАЭ.
Рисунок. Этапы модифицированной операции ПАЭ.
Этапы модифицированной операции ПАЭ.
Модифицированная нами техника выполнения ПАЭ заключалась в следующем:
• Рассекали капсулу ПЖ между лигатурами, наложенными на дорзальный венозный комплекс
(см. рис. а).
• Латеральные участки рассеченной капсулы обрабатывали аппаратом LigaSure (см. рис. б), после
чего ее рассекали.
• Край рассеченной капсулы в области латеральных углов разреза приподнимали и удерживали путем
наложения зажима Люэра (с гемостатической и манипуляционной целью). Мобилизацию узлов
гиперплазии проводили с использованием биполярных ножниц (без использования пальцевой диссекции) (см. рис. в). Узлы гиперплазии в процессе диссекции удерживали и приподнимали пулевыми
щипцами, при этом среднюю долю удаляли с тканью одной из боковых долей аденомы (см. рис. г).
• Процесс выделения и удаления узлов гиперплазии осуществляли с сохранением задней части уретральной пластинки, по возможности сохраняли простатический отдел уретры (см. рис. д, е).
рис. д, е).
После удаления узлов гиперплазии капсулу ПЖ ушивали непрерывным однорядным швом (викрил
2/0–0) (см. рис. ж).
Затем ПЖ ушивали рану наглухо, оставив в ретциевом пространстве дренаж, выведенный через контрапертуру. ЧАЭ выполняли по стандартной методике. Статистическую обработку данных проводили, используя критерий Манна–Уитни, с помощью пакета прикладных программ Statistica v.7.0 производства компании StatSoft (2007).
Результаты и обсуждение. В разное время были предложены различные модификации ряда этапов операции, направленных на обеспечение надежного гемостаза, уменьшение травматизации уретры и повышение герметичности уретры.
Добиться минимальной кровопотери при ПАЭ удалось за счет анатомичного доступа непосредственно к ПЖ, использования электрохирургических инструментов и лучшей визуализации при выполнении
всех этапов операции, что позволяло более деликатно обрабатывать сосуды ПЖ. Закономерным следствием такого преимущества ПАЭ перед ЧАЭ по объему интраоперационной кровопотери являлись лучшие показатели ПАЭ по двум зависимым от кровопотери показателям: снижение уровня гемоглобина и частота трансфузий после оперативного вмешательства.
Одним из преимуществ ПАЭ является отсутствие необходимости дренирования мочевого пузыря эпицистостомой. Поэтому сроки дренирования мочевого пузыря при ПАЭ указывали по срокам нахождения уретрального катетера. Так как при ЧАЭ имел место как эпицистостомический дренаж, так и уретральный катетер, сроки дренирования были указаны по времени того варианта дренирования, который имел максимальный показатель.
К случаям интра- и послеоперационного кровотечения отнесены наблюдения, требовавшие проведения трансфузий. Достоверно лучшие поздние результаты оперативного лечения (до 24 мес после вмешательства) были характерны для ПАЭ. Представленные данные исследования свидетельствуют о высокой эффективности и безопасности модифицированной нами техники ПАЭ в лечении АПЖ больших размеров. Анализ данных литературы показал, что совершенствование техники ПАЭ шло по пути, направленному в первую очередь на уменьшение интраоперационной кровопотери. Так, W. Gregoir [11] рекомендовал
разделять дистальную комиссуру в области верхушки ПЖ, чтобы управлять глубокой дорзальной веной и восходящими ветвями пенильной дорзальной артерии, и накладывать одну лигатуру на латеральную везикопростатическую ножку с каждой стороны, чтобы прерывать артериальный кровоток и связи между заднелатеральным и передним простатическим венозными сплетениями. Автор также предлагал в конце операции накладывать поперечные швы на переднюю поверхность капсулы ПЖ с целью обеспечения продольного сжатия капсулы и лучшего контроля перфорирующих сосудов.
Автор также предлагал в конце операции накладывать поперечные швы на переднюю поверхность капсулы ПЖ с целью обеспечения продольного сжатия капсулы и лучшего контроля перфорирующих сосудов.
Р. Walsh и соавт. [12] усовершенствовали способ Gregoir путем пересечения пубопростатических связок и использования массивной лигатуры на глубокий дорзальный венозный комплекс на более дистальном уровне, что должно было более эффективно контролировать восходящий венозный кровоток. Они также рекомендовали накладывать более широкую лигатуру на латеральные простатические ножки в области везикопростатического соединения.
Однако риск существенного кровотечения после этих маневров сохранялся, потому что отсутствовал контроль над венозными каналами в боковой и передней стенках капсулы ПЖ и шейке мочевого пузыря. В последующих работах было показано, что у части пациентов эти ветви начинали кровоточить после выделения аденомы из-за ослабления ранее наложенного дистального ряда поперечных пронизывающих кровоостанавливающих швов или в результате бокового надрыва капсульного разреза. Кроме того, дистальная обработка и массивное лигатурование глубокого дорзального венозного комплекса могли увеличить риск повреждения дистального сфинктера мочеиспускательного канала, приведя к повышению вероятности развития недержания мочи
Кроме того, дистальная обработка и массивное лигатурование глубокого дорзального венозного комплекса могли увеличить риск повреждения дистального сфинктера мочеиспускательного канала, приведя к повышению вероятности развития недержания мочи
[13]. J. Amen-Palma и соавт. [14] предложили накладывать дополнительные пронизывающие швы на боковую стенку капсулы ПЖ после энуклеации аденоматозных узлов. Авторы методики накладывали швы на 3 и 9 ч условного циферблата на капсуле ПЖ. На примере лечения 117 пациентов они продемонстрировали возможность значительного уменьшения кровопотери – ее средний объем составил 175 мл. П. И. Пивоваров и соавт. [15] совершенствовали методику улучшения гемостаза путем использования несъемных кетгутовых швов и смещения слизистой оболочки задней полуокружности шейки мочевого пузыря в просвет мочеиспускательного канала с фиксацией ее к стенкам ложа АПЖ.
На устранение недостатков существующих техник была направлена методика, разработанная M. Srougi и соавт. [16], суть которой заключалась в следующем. Вначале накладывали широкую лигатуру атравматической нитью (полиглактин 0) в заднелатеральной области везикопростатического соединения с каждой стороны, прерывая артериальные и венозные пути кровотока, идущие к передней поверхности ПЖ и шейке мочевого пузыря. После тракции ПЖ кпереди к начальному шву
[16], суть которой заключалась в следующем. Вначале накладывали широкую лигатуру атравматической нитью (полиглактин 0) в заднелатеральной области везикопростатического соединения с каждой стороны, прерывая артериальные и венозные пути кровотока, идущие к передней поверхности ПЖ и шейке мочевого пузыря. После тракции ПЖ кпереди к начальному шву
добавляли кзади от него по одной лигатуре с каждой стороны, тем самым обеспечивая лучший контроль над простатической артерией в месте ее вхождения. После обработки боковых простатических ножек накладывали еще кровоостанавливающие швы на переднюю поверхность капсулы ПЖ, чтобы заблокировать восходящий кровоток из ветвей глубокой дорзальной вены, и завязывали их. Указанные передние и боковые швы представляли первый ряд. Второй ряд широких и более поверхностных поперечных швов накладывали проксимальнее и параллельно первому ряду – ближе к шейке мочевого пузыря, но дистальнее нее. Их также завязывали до капсулотомии. Наконец третий ряд глубоких швов (полиглактин 0) накладывали на переднюю поверхность ПЖ, дистальнее первого ряда. Эти швы не завязывали до полного удаления аденомы, так как энуклеация аденоматозных узлов приводила к ослаблению дистального ряда швов, что могло стать причиной
Эти швы не завязывали до полного удаления аденомы, так как энуклеация аденоматозных узлов приводила к ослаблению дистального ряда швов, что могло стать причиной
профузного кровотечения в зоне дистальной границы капсулотомии. Затем с помощью электроножа выполняли поперечную капсулотомию длиной 4–5 см до аденоматозной ткани. До начала энуклеации на каждый угол капсульного разреза накладывали восьмиобразный шов (полиглактин 0) и завязывали, что уменьшало риск бокового надрыва разреза капсулы. Затем накладывали еще три дистальных капсульных шва, которые завязывали уже после полного удаления аденоматозных узлов. После этого ложе аденомы «тригонизировали», в мочевой пузырь устанавливали 3-ходовой катетер Foley 22 Ch и ушивали капсулу непрерывным швом.
Принцип лигирования глубоких дорзальных вен полового члена и латеральных простатических ножек до энуклеации аденомы заключен в методике, представленной I. Filiadis и соавт. [17]. Авторы сообщили, что даже при очень больших размерах ПЖ (медиана объема ПЖ составляла 145,4 см3) с помощью такого подхода можно добиться существенного снижения кровопотери. Показаний к гемотрансфузиям в их наблюдениях не было отмечено.
Показаний к гемотрансфузиям в их наблюдениях не было отмечено.
Н. Ф. Сергиенко [18], напротив, предлагает производить рассечение капсулы ПЖ двумя продольными параллельными разрезами после предварительного ее прошивания без пересечения сосудов дорзального венозного комплекса с сохранением простатического отдела уретры и с минимальным использованием электрохирургических инструментов.
Использование приведенных выше модификаций безусловно способствовало улучшению результатов операции. Однако следует подчеркнуть крайнюю сложность и трудоемкость исполнения еречисленных конкурентных методик. Предлагаемая нами модифицированная техника ПАЭ позволяет существенно сократить время вмешательства без ущерба для надежности гемостаза благодаря использованию возможностей современного электрохирургического оборудования и анатомичного подхода к выполнению всех этапов операции. Кроме того, удалось добиться и снижения риска поздних послеоперационных осложнений, что позитивно отразилось на отдаленных результатах лечения.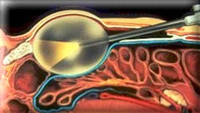
Заключение. На протяжении длительного периода времени ПАЭ была незаслуженно обделена вниманием специалистов. Причиной отказа от нее в пользу выбора ЧАЭ служил высокий риск различных осложнений после ПАЭ. Предложенные в разное время попытки улучшить различные аспекты техники выполнения ПАЭ широкого применения не получили из-за высокой технической сложности. Поэтому нами была предложена новая техника операции, которая показала возможность существенного улучшения результатов лечения больных ДГПЖ больших размеров.
Выполнение ПАЭ по технике РМАПО способствовало достоверному улучшению основных периоперационных результатов по сравнению с ЧАЭ: уменьшению продолжительности оперативного вмешательства, снижению объема интраоперационной кровопотери и частоты трансфузий, уменьшению степени снижения гемоглобина в первые сутки после операции, сокращению сроков дренирования мочевого пузыря, времени пребывания пациента в стационаре и др.
Таким образом, наш опыт дает право рекомендовать технику РМАПО ПАЭ для более широкого внедрения в урологическую практику.
Авторы: Велиев Е.И., Соколов А.Е., Богданов А.Б., Илюшин Л.В. Кафедра урологии и хирургической андрологии (зав. – член-корр. РАМН, проф. О.Б. Лоран) РМАПО, Москва
Литература:
1. Novara G., Galfano A., Gardi M. et al. Critical review of guidelines for BPH diagnosis and treatment strategy. Eur. Urol. 2006;5(4) Suppl.:418–429.
2. de la Rosette J., Alivizatos G., Madersbacher S. et al. European Association of Urology. Guidelines on benign prostatic hyperplasia, 2008. URL: http://www.uroweb.org/fileadmin/tx_eauguidelines/2004/Full/BPH.pdf (Дата обращения: 29.08.2011).
3. Nickel J.C., M?ndez-Probst C.E., Whelan T.F. et al. 2010 Update: Guidelines for the management of benign prostatic hyperplasia. Can. Urol. Assoc J. 2010;4(5):310–316.
4. American Urological Association guideline: management of benign prostatic hyperplasia (BPH) (Revised, 2010). URL: http://www.auanet.org/content/guidelines-and-quality-care (Дата обращения: 02. 08.2011).
08.2011).
5. Freyer P.J. A clinical lecture on total extirpation of the prostate for radical cure of enlargement of that organ: with four successful cases: delivered at the Medical Graduates’ College. London, June 26th. Br. Med. J. 1901;2(2116):125–129.
6. Лидский А.Т. Хирургические подступы к предстательной железе при гипертрофии ее. Астраханский медицинский журнал. 1923;10–12:52–111.
7. Millin T. Retropubic prostatectomy; a new extravesical technique; report of 20 cases. Lancet. 1945;2(6380): 693–696.
8. Dall’Oglio M.F., Srougi M., Antunes A.A. et al. An improved technique for controlling bleeding during simple retropubic prostatectomy: a randomized controlled study. BJU Int. 2006;98(2):384–387.
9. Bernie J.E., Schmidt J.D. Simple perineal prostatectomy: lessons learned from a modern series. J. Urol. 2003;170(1):115–118.
10. Kozlowski J.M., Smith N.D., Grayhack J.T. Suprapubic transvesical prostatectomy and simple perineal prostatectomy for the treatment of benign prostatic hyperplasia. Management of benign prostatic hypertrophy, edited by K.T. McVary. Totowa, New Jersey: Humana Press. 2004:221–226.
Management of benign prostatic hypertrophy, edited by K.T. McVary. Totowa, New Jersey: Humana Press. 2004:221–226.
11. Gregoir W. Haemostatic prostatic adenomectomy. Eur. Urol. 1978;4(1):1–8.
12. Walsh P.C., Oesterling J.E. Improved hemostasis during simple retropubic prostatectomy. J. Urol. 1990;143(6):1203–1204.
13. Nesrallah L., Srougi M., Henrique A. T?cnica hemost?tica de Gregoir-Walsh en prostatectom?a retrop?bica: experiencia preliminary. J. Bras. Urol. 1993;19(1):141–144.
14. Amen-Palma J.A., Arteaga R.B. Hemostatic technique: extracapsular prostatic adenomectomy. J. Urol. 2001;166(4):1364–1367.
15. Пивоваров П.И., Гурский Б.Ф., Максимов В.Д., Горовой В.И. Методика гемостаза при внепузырной позадилобковой аденомэктомии. Урология и нефрология. 1991;2:37–41.
16. Srougi M., Dall’oglio M.F., Bomfim A.C. et al. An improved technique for controlling bleeding during simple retropubic prostatectomy. BJU Int. 2003;92(7):813–817.
17. Filiadis I.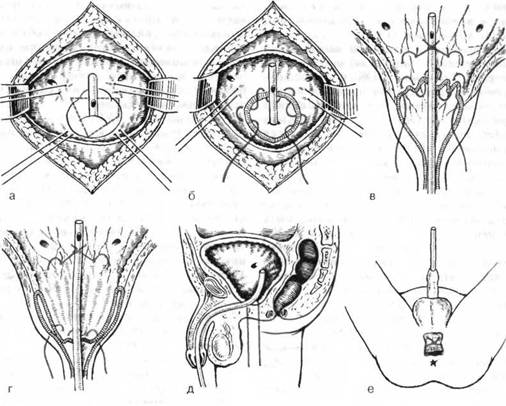 , Adamopoulos V., Konstandinidis E. Modification of retropubic adenomectomy: improved hemostasis and outcome. Int. Urol. Nephrol. 2007;39(1):169–172.
, Adamopoulos V., Konstandinidis E. Modification of retropubic adenomectomy: improved hemostasis and outcome. Int. Urol. Nephrol. 2007;39(1):169–172.
18. Сергиенко Н.Ф. Экстрауретральная аденомэктомия. М.: Патриот, 2010; 222–236.
Сравнительная оценка результатов различных методов операции у больных доброкачественной гиперплазией предстательной железы больших размеров | Кадыров
1. Доброкачественная гиперплазия предстательной железы в общемедицинской практике. Методические рекомендации. Под ред. О.Б. Лорана и др. М., 2008. 45 с.
2. EAU BHP Guidelines. Eds. M. Oelke, A. Bachmann, A. Descazeaud et al. EAU, 2010. 38 p.
3. Schulman C.C. Lower Urinary Tract Symptoms (LUTS): Initial Choices and Final Outcomes. Euro Urol 2001;40 (Suppl 4):21–30.
Euro Urol 2001;40 (Suppl 4):21–30.
4. Temml C., Obermayr R., Marszalek M. et al. Are lower urinary tract symptoms influenced by metabolic syndrome? Urology 2009;73(3):544–8.
5. Щепин О.П. Здоровье населения – основа развития здравоохранения. Самара, 2010. 181 с.
6. Мартов А.Г., Лопаткин Н.А. Руководство по трансуретральной эндоскопической электрохирургии доброкачественной гиперплазии простаты. М., 1997.
7. Arrighi H.M., Metter E.J., Guess H.A., Fozzard J.L. Natural history of benign prostatic hyperplasia and risk of prostatectomy. The Baltimore Longitudinal Study of Aging. Urology 1991;38:4–8.
8. Tubaro A., Carter S., Hind A. et al. A prospective study of the safety and efficacy of suprapubic transvesical prostatectomy in patients with benign prostatic hyperplasia. J Urol 2001;166:172–6.
Tubaro A., Carter S., Hind A. et al. A prospective study of the safety and efficacy of suprapubic transvesical prostatectomy in patients with benign prostatic hyperplasia. J Urol 2001;166:172–6.
9. Урология: Национальное руководство. Под ред. Н.А. Лопаткина. М., 2009.
10. Коротеев М.А., Кореньков Д.Г. Профилактика обострений сопутствующих инфекционно-воспалительных заболеваний после трансуретральной резекции доброкачественной гиперплазии предстательной железы. Воен мед журн 2008;329(2):66–7.
11. Голайко В.Ю. Снижение риска кровопотери при аденомэктомии у больных доброкачественной гиперплазией предстательной железы старческого возраста. Автореф. дис. … канд. мед. наук. M.,
12.
13. Tkocz M., Prajsner A. Comparison of long-term results of transurethral incision of the prostate with transurethral resectionof the prostate, in patients with benign prostatic hypertrophy. Neurourol Urodyn 2002;21:112–6.
14. Serretta V., Morgia G., Fondacaro L. et al. Open prostatectomy for benign prostatic enlargement in Southern Europe in the late 1990s: a contemporary series of 1800 interventions. Urology 2002;60:623–7.
15. Мартов А.Г., Меринов Д.С., Павлов Д.А. и др. Новые эндоскопические технологии в лечении доброкачественной гиперплазии предстательной железы. Урология 2003;2:56–64.
16. Аляев Ю.Г., Рапопорт Л.М., Григорье в Н.А. и др. Новое направление электрохирургии gростаты – биполярная трансуретральная резекция. Здравоохр Башкортостана 2005;3:265–6.
Здравоохр Башкортостана 2005;3:265–6.
17. Аляев Ю.Г., Еготе А.К., Рапопорт Л.М. Биполярная трансуретральная эндоскопическая электрохирургия в лечении больных доброкачественной гиперплазией предстательной
18. железы. Малоинвазивные технологии в хирургии. Межрегиональная научно-практическая конференция. Махачкала, 27–28 мая 2005 г. С. 36–38.
19. Аляев Ю.Г., Рапопорт Л.М., Цариченк о Д.Г., Еготе А.К. Сравнительный анализ осложнений биполярной и монополярной трансуретральной резекции у больных гиперплазией предстательной железы. Мужское здоровье. Материалы 3-й Всероссийской конференции. Москва, 18–20 октября 2006 г. С. 93–94. Д5.
20. Севрюков Ф.А. Комплексные медико-социальные и клинико-экономические аспекты профилактики и лечения доброкачественной гиперплазии предстательной железы. Автореф. дис. … д-ра мед. наук. М., 2012.
Автореф. дис. … д-ра мед. наук. М., 2012.
21. Nickel J., Hersechorn S., Corcos J. et al. Canadian guidelines for the management of benign prostatic hyperplasia. Can J Urol 2005;12(3):2677–83.
22. Norara G., Galfuno A., Gardi M. et al. Critical review of guidelines for BPH diagnosis and treatment strategy. Eur Urol Suppl 2006;5:418–29.
23. Bulent O., Gokhan K., Hakan V. et al. Extraperitoneal simple prostatectomy for benign prostate hyperplasia. J Urol 2011;8:107–12.
24. Porpiglia F., Terrone C., Renard J. et al. Transcapsular adenomectomy (Millin): a comparative study, extraperitoneal laparoscopy versus open surgery. Eur Urol 2006;49:120.
25. Baumert H., Ballaro A, Dugardin F., Kaisary A.V. Laparoscopic versus open simple prostatectomy: a comparative study. J Urol 2006;175:1691–4.
Baumert H., Ballaro A, Dugardin F., Kaisary A.V. Laparoscopic versus open simple prostatectomy: a comparative study. J Urol 2006;175:1691–4.
26. Sotelo R., Clavijo R., Carmona O. et al. Robotic simple prostatectomy. J Urol 2008;179:513–5.
27. Yuh B., Laungani R., Perlmutter A. et al. Robot-assisted Millin’s retropubic prostatectomy: case series. Can J Urol 2008;15:4101–5.
28. Sotelo R.J., Astigueta J.C., Desai M.M. et al. Laparoendoscopic single-site surgery simple prostatectomy: initial report. Urology 2009;74:626–30.
Трансвезикальная аденомэктомия — Доктор Риккардо Паньи Медико Чирурго
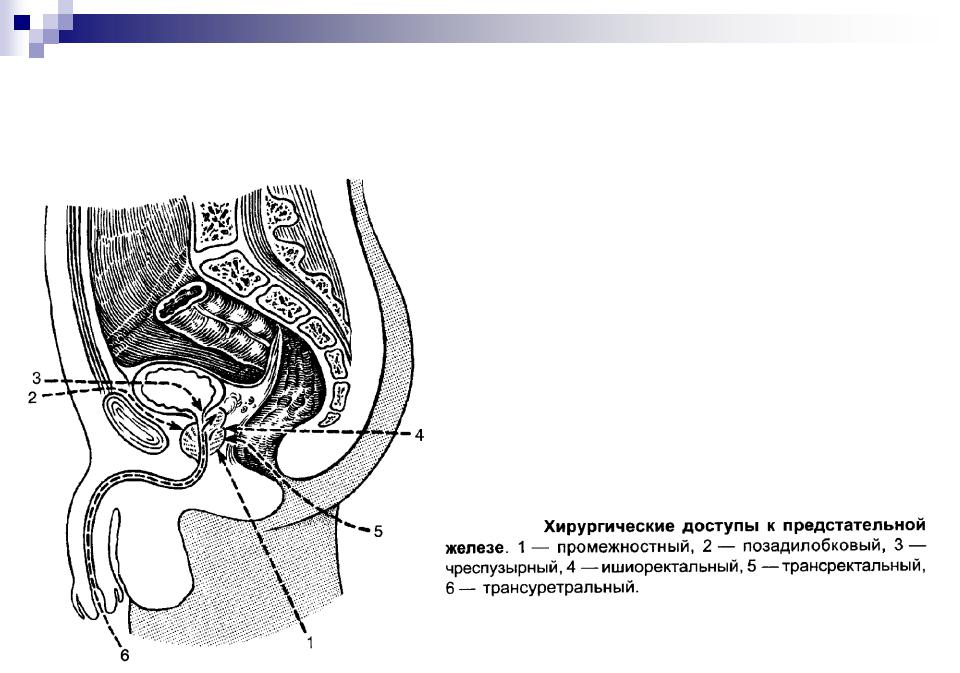
1. Определение:
Открытая операция, выполняемая с помощью разреза скальпелем на брюшной полости для удаления доброкачественной опухоли простаты (аденомы или доброкачественной гипертрофии простаты), которая, увеличиваясь, препятствует опорожнению мочевого пузыря.
Особенность транспузырной аденомэктомии заключается в том, что аденоматозная ткань удаляется путем прохождения отверстия на уровне мочевого пузыря, а не путем вскрытия капсулы простаты (позадилонная аденомэктомия).Этот тип хирургии приводит к лучшему обнажению мочевого пузыря и шейки мочевого пузыря.
2. Показания:
Показанием к открытой (а не эндоскопической) операции обычно является чрезмерный объем предстательной железы и сопутствующее наличие:
Объемный дивертикул мочевого пузыря.
Анкилоз тазобедренного сустава, который не позволяет пациенту правильно расположиться при эндоскопической операции.
3. Противопоказания:
- Маленькая простата.
- Предыдущая аденомэктомия, при которой лучше всего показано эндоскопическое вмешательство
- Установлен рак простаты
4. Описание методики:
Пациенту может быть сделана аденомэктомия под общей или местно-регионарной анестезией (введение анестетиков для поясничного отдела позвоночника, позволяющих полностью осознать пациента). С помощью скальпеля вы делаете разрез кожи на животе от пупка до лобка или, альтернативно, поперечный разрез над лобком, через который вы попадаете в мочевой пузырь.Это выгравировано, и, оказавшись внутри его полости, идентифицируются шейка мочевого пузыря и предстательная железа. После разреза скальпелем шейки мочевого пузыря для выявления аденомы предстательной железы (доброкачественный рак предстательной железы, подлежащего удалению) хирург выполнит энуклеационный маневр с помощью указательного пальца и, при необходимости, ножниц и скальпеля, оставив на месте остальное. предстательной железы. В конце операции устанавливается специальный трехходовой уретральный катетер, который обеспечивает надлежащую «промывку мочевого пузыря» путем непрерывной ирригации (цистоклиза).В конце остается небольшая трубка для дренажа брюшной полости (предупреждение о любом кровотечении или скоплении мочи в области рядом с пораженным участком), которая соединяется с мешком для сбора.
С помощью скальпеля вы делаете разрез кожи на животе от пупка до лобка или, альтернативно, поперечный разрез над лобком, через который вы попадаете в мочевой пузырь.Это выгравировано, и, оказавшись внутри его полости, идентифицируются шейка мочевого пузыря и предстательная железа. После разреза скальпелем шейки мочевого пузыря для выявления аденомы предстательной железы (доброкачественный рак предстательной железы, подлежащего удалению) хирург выполнит энуклеационный маневр с помощью указательного пальца и, при необходимости, ножниц и скальпеля, оставив на месте остальное. предстательной железы. В конце операции устанавливается специальный трехходовой уретральный катетер, который обеспечивает надлежащую «промывку мочевого пузыря» путем непрерывной ирригации (цистоклиза).В конце остается небольшая трубка для дренажа брюшной полости (предупреждение о любом кровотечении или скоплении мочи в области рядом с пораженным участком), которая соединяется с мешком для сбора.
5. До и после операции
До и после операции
До вмешательства желательно:
- Ультразвуковое исследование верхних отделов мочевыделительной системы, а также мочевого пузыря и предстательной железы.
- Перед операцией следует приостановить прием препаратов, которые могут помочь кровотечению: например, антикоагулянтов или обезболивающих, подобных аспирину.
- Всегда рекомендуется парентеральная антибактериальная профилактика.
- Если послеоперационный курс регулярный, пациент может начать кормление и мобилизацию рано (через 12-24 часа).
- Приостановка непрерывного орошения (цистоклиза) будет зависеть от характеристик мочи (наличие или отсутствие макроэматурии).
- Дренажная трубка таза обычно удаляется через 4 дня после операции вместе с катетером мочевого пузыря, если не возникают осложнения.
- Пациенты могут быть выписаны через 4-5 дней и возвращены для приема лекарств и снятия швов. Остаточный линейный кожный рубец останется.
6. Продолжительность операции:
Продолжительность операции:
Всего 1-2 часа (включая время до операции, анестезию и время пробуждения)
7. Тип и продолжительность госпитализации:
Госпитализация обычная. Послеоперационный период обычно длится от 5 до 7 дней.
8. Результаты:
Удаление обструкции мочевого пузыря, вызванной аденомой, для опорожнения мочевого пузыря при низком давлении (без усилий) во избежание осложнений для мочевого пузыря и / или мочевыводящей системы (мочеточников и почек).
9. Преимущества:
Открытая операция по аденомэктомии, проводимая пациенту с чрезмерным увеличением объема предстательной железы, обеспечивает улучшение динамики мочеиспускания при благоприятных сроках и режимах операции. Для хирурга главное преимущество — возможность быстро удалить массивную аденому простаты под прямым контролем без риска длительной эндоскопической резекции простаты. К этому следует добавить возможность лечения за одну операцию любой другой патологии (дивертикул мочевого пузыря, камень мочевого пузыря).
10. Недостатки :
- Основным недостатком всех хирургических вмешательств является то, что рубцы требуют более длительного времени заживления и, следовательно, большей дегенерации, чем эндоскопические методы.
- Наибольший риск интраоперационного кровоизлияния, требующего переливания с учетом эндоскопических методов.
11. Побочные эффекты:
- Чрезмерная частота мочеиспусканий и невозможность их откладывать с возможной потерей мочи — нормальные симптомы после операции.Они связаны с раздражительностью мочевого пузыря. Обычно этот симптом исчезает через несколько недель или самое большее через несколько месяцев (в зависимости от предоперационного состояния мочевого пузыря). Если этого требует степень проблемы, могут быть назначены лекарства, которые помогут восстановить нормальную динамику мочеиспускания.
- Ретроградная эякуляция, то есть прохождение спермы во время эякуляции в мочевой пузырь, а не наружу, как обычно.
 Это происходит из-за потери механизма закрытия шейки мочевого пузыря (что наблюдается после всех операций, проведенных по поводу IPB), и подразумевает невозможность продолжения рода при сохранении нормальной эрекции.Это состояние встречается у 80-90% пациентов, перенесших аденомэктомию.
Это происходит из-за потери механизма закрытия шейки мочевого пузыря (что наблюдается после всех операций, проведенных по поводу IPB), и подразумевает невозможность продолжения рода при сохранении нормальной эрекции.Это состояние встречается у 80-90% пациентов, перенесших аденомэктомию.
12. Осложнения:
- Кровоизлияние во время или после операции, требующей переливания крови, встречается чаще, чем эндоскопическая техника (19% против 8,8% ТУРП).
- Недержание мочи (уринома) может быть осложнением сразу после операции и заключается в прохождении мочи через швы, наложенные на мочевой пузырь. Обычно это вызвано неисправностью уретрального катетера.Профилактика этого осложнения осуществляется постоянным контролем за правильным дренированием катетера и потоком ирригационной жидкости. Однако проблема решается самопроизвольно после того, как будет обеспечен адекватный дренаж декантированных жидкостей.
- Недержание мочи после трансвезикальной аденомэктомии наблюдается примерно в 2-3%.
 В основном это «стрессовое» недержание мочи или проявляется при резком повышении внутрибрюшного давления (кашель, чихание, слабость, поднятие тяжестей).Только 0,3% случаев имеют полное недержание мочи. Такой тип недержания мочи обычно связан с поражением наружного сфинктера уретры и, в зависимости от степени тяжести, может быть исправлен эндоскопической или, в конечном итоге, протезной хирургией.
В основном это «стрессовое» недержание мочи или проявляется при резком повышении внутрибрюшного давления (кашель, чихание, слабость, поднятие тяжестей).Только 0,3% случаев имеют полное недержание мочи. Такой тип недержания мочи обычно связан с поражением наружного сфинктера уретры и, в зависимости от степени тяжести, может быть исправлен эндоскопической или, в конечном итоге, протезной хирургией. - Острый эпидидимит (болезненный отек придатка яичка).
- Склероз шейки мочевого пузыря (травма после операции) наблюдается в 2-3% случаев и возникает примерно через 6-12 недель после операции. Симптомы — это симптомы непроходимости пахового пузыря.Однако это осложнение можно исправить с помощью эндоскопической хирургии, которая включает в себя удар в мочевой пузырь.
- Лихорадка и раневая инфекция (связанная с выделением мочи сразу после операции) — это редкие явления, частота которых была минимизирована за счет использования шпионской дренажной трубки и профилактики антибиотиками.

- Общие осложнения: тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда и церебральный инсульт. Каждый из них затрагивает около 1% случаев, а общая смертность в результате вмешательства близка к нулю.Все они связаны с коагуляционными турбинами, которые можно в некоторой степени предотвратить с помощью профилактики тромбоэмболии и / или использования эластичных чулок и ранней мобилизации.
13. При выписке следует обратиться к врачу:
Если послеоперационный курс является регулярным, пациент обычно увольняется через 5-6 дней после операции. В случае инфекций мочевыводящих путей или кровотечения Пациенту следует увеличить количество воды и проконсультироваться с врачом для получения соответствующей терапии.
Эндоскопическая трансвезикальная аденомэктомия простаты (ЭТАП). Результаты минимально инвазивного доступа у семнадцати пациентов в неакадемической больнице.
Введение
Минимально инвазивная хирургия и особенно недавние достижения в области лапароскопии и робототехники обладают огромным потенциалом для урологической помощи. При лечении пациентов с доброкачественной гиперплазией простаты (ДГП) большого объема (> 80 г) использование лапароскопического доступа кажется ограниченным.Наше отделение твердо верит в то, что эндоскопия может быть использована в лечении аденомы простаты.
При лечении пациентов с доброкачественной гиперплазией простаты (ДГП) большого объема (> 80 г) использование лапароскопического доступа кажется ограниченным.Наше отделение твердо верит в то, что эндоскопия может быть использована в лечении аденомы простаты.
Цель / Методы
Мы хотели бы представить новую эндоскопическую трансвезикальную технику энуклеации аденомы простаты у пациентов с умеренными и тяжелыми СНМП / ДГПЖ на основе большого объема ДГПЖ (> 80 г) с использованием трех троакаров (1×10 мм и 2х5 мм). Мы представляем до-, пери- и послеоперационные характеристики и результаты первых семнадцати пациентов в ретроспективном анализе, которые лечились в период с марта 2014 г. по октябрь 2015 г.Все пациенты лечились в неакадемическом центре. Насколько нам известно, это первое описание такой минимально инвазивной техники.
Результаты
Дооперационные характеристики нашей когорты показывают средний возраст 73 года. Все пациенты получали лечение альфа-адреноблокаторами или комбинированную терапию. Ультразвуковые измерения простаты показывают средний расчетный объем 108 куб.см, средний дооперационный показатель IPPS составил 21,6. Средняя продолжительность операции составила 113 минут, потеря крови составила 180 мл.Пациенты находились в больнице в среднем на пять дней и нуждались в катетере в среднем на 10,4 дня. После операции мы наблюдали в среднем 81,4 грамма удаленной ткани простаты, улучшение максимальной скорости потока мочи с 8,4 мл / сек до среднего 21,5 мл / сек и остаточного объема мочи после мочеиспускания с 355 мл до до 35 мл в среднем. В течение первых 30 дней наблюдалось восемь незначительных осложнений (инфекции мочевыводящих путей, дизурия и стойкая гематурия) и два основных осложнения (11,7%): тяжелая гематурия с необходимостью повторного вмешательства (коагуляция в операционной).Через 90 дней произошло одно осложнение; стриктура уретры потребовала уретеротомии по Sachse
Все пациенты получали лечение альфа-адреноблокаторами или комбинированную терапию. Ультразвуковые измерения простаты показывают средний расчетный объем 108 куб.см, средний дооперационный показатель IPPS составил 21,6. Средняя продолжительность операции составила 113 минут, потеря крови составила 180 мл.Пациенты находились в больнице в среднем на пять дней и нуждались в катетере в среднем на 10,4 дня. После операции мы наблюдали в среднем 81,4 грамма удаленной ткани простаты, улучшение максимальной скорости потока мочи с 8,4 мл / сек до среднего 21,5 мл / сек и остаточного объема мочи после мочеиспускания с 355 мл до до 35 мл в среднем. В течение первых 30 дней наблюдалось восемь незначительных осложнений (инфекции мочевыводящих путей, дизурия и стойкая гематурия) и два основных осложнения (11,7%): тяжелая гематурия с необходимостью повторного вмешательства (коагуляция в операционной).Через 90 дней произошло одно осложнение; стриктура уретры потребовала уретеротомии по Sachse
Заключение
Мы представляем первую серию пациентов и их краткосрочное наблюдение, которым проводится ЭТАП.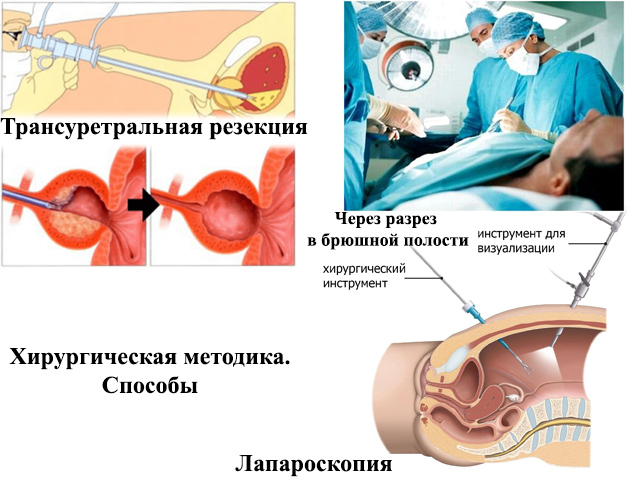 У него есть перспективы в будущем как надежная альтернатива открытой аденомэктомии простаты. Необходимо определить экономическую эффективность и долгосрочные результаты, особенно риск поздних осложнений и функциональных исходов. С этой целью рекомендуется мультицентрическое рандомизированное контролируемое исследование.
У него есть перспективы в будущем как надежная альтернатива открытой аденомэктомии простаты. Необходимо определить экономическую эффективность и долгосрочные результаты, особенно риск поздних осложнений и функциональных исходов. С этой целью рекомендуется мультицентрическое рандомизированное контролируемое исследование.
рецепторов андрогенов в образцах ткани предстательной железы, полученных при трансуретральной резекции и трансвезикальной аденомэктомии
Albert J, Geller J, Nachtsheim DA (1982) Тип частоты тока, используемый при трансуретральной резекции простаты (ТУРП), влияет на рецептор андрогенов. . Простата 3: 221
Google ученый
Bashirelai N, Young JD, Sidh SM, Sanefugi H (1980) Андрогены, эстроген и прогестаген и их распределение в эпителиальных и стромальных клетках простаты человека. В: Schroder FH, Voogt HJ de (eds) Стероидные рецепторы, метаболизм и рак простаты. Excerpta Medica, Амстердам, p 240
В: Schroder FH, Voogt HJ de (eds) Стероидные рецепторы, метаболизм и рак простаты. Excerpta Medica, Амстердам, p 240
Google ученый
Blacklock NJ, Bouskill K (1977) Зональная анатомия простаты у человека и макаки-резуса. Урол Res 5: 163
Google ученый
Bowman SP, Barnes DM, Blacklock NJ (1985) Метод мини-колонки для рутинного измерения рецепторов андрогенов простаты человека.J Стероид Биохим 23: 421
Google ученый
Bowman SP, Barnes DM, Blacklock NJ, Sullivan PJ (1986) Региональные вариации цитозольных рецепторов андрогенов на протяжении болезни предстательной железы человека. Простата 8: 167
Простата 8: 167
Google ученый
Burton KA (1956) Изучение условий и механизма реакции дифениламина для колориметрической оценки дезоксирибонуклеиновой кислоты.Biochem J 62: 315
Google ученый
Castagnetta L, Lo Casto M, Mercadante T, Polito L, Cowan S, Leake RE (1983) Внутриопухолевые изменения статуса рецепторов эстрогена при раке эндометрия. Br J Cancer 47: 261
Google ученый
Castagnetta L, Traina A, Di Carlo A, Latteri AM, Carruba G, Leake RE (1987) Гетерогенность статуса растворимых и ядерных рецепторов эстрогена вовлеченных узлов в отношении первичного рака груди.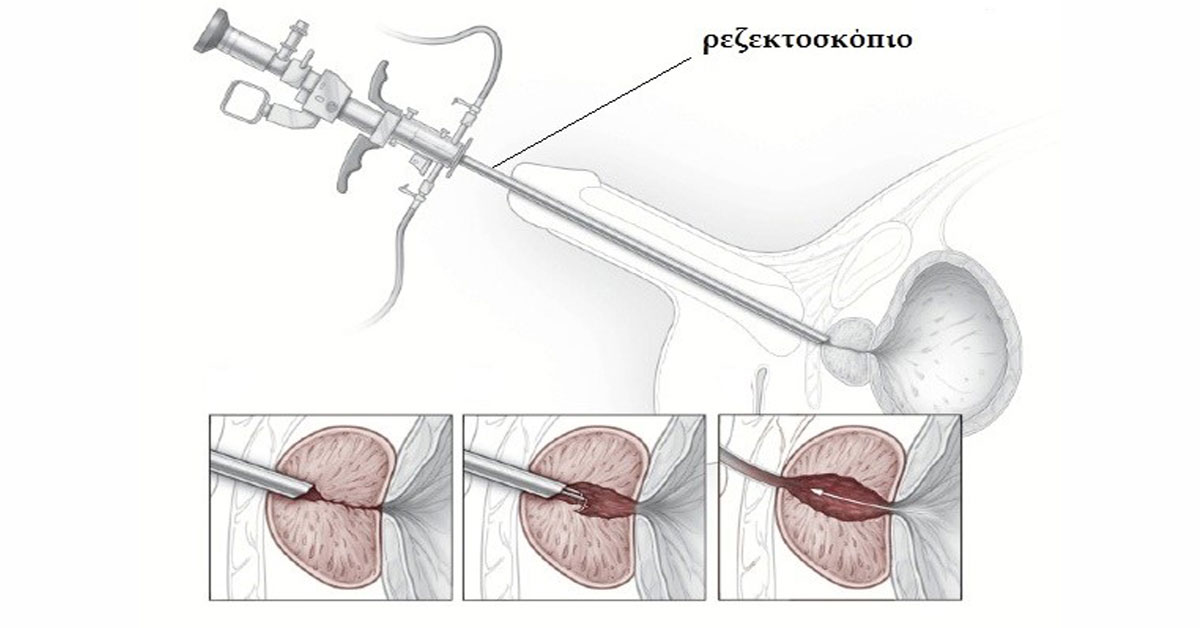 Евро J Рак 23:31
Евро J Рак 23:31
Google ученый
Castagnetta L, Traina A, Di Carlo A, Carruba G, Lo Casto M, Leake RE (1989) Дают ли анализы множественных рецепторов эстрогена значительную дополнительную информацию для лечения рака груди? Br J Рак 59: 636
Google ученый
Clark JH, Peck EJ Jr (1979) Gross F, et al (eds) Рецепторы и функции женских половых стероидов.Springer, Берлин Гейдельберг Нью-Йорк
Google ученый
Crawford D, Cowan S, Hyder S, McMenamin M, Smith D, Leake RE (1984) Новая процедура хранения биопсий опухоли до измерения рецепторов эстрогена.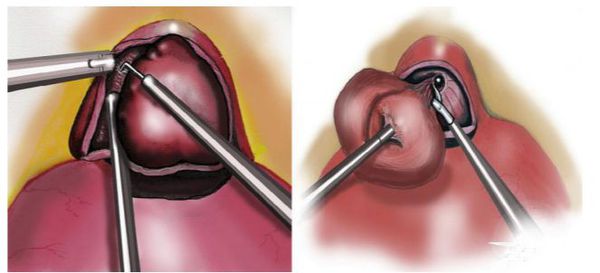 Cancer Res 44: 2348
Cancer Res 44: 2348
Google ученый
Доннелли Б.Дж., Лейки У.Х., МакБлейн В.А. (1984) Сайты связывания андрогенов на ядерном матриксе нормальной и гиперпластической предстательной железы человека.Дж Урол 131: 806
Google ученый
Фенти Д.Д., Лейки У.Х., МакБлейн В.А. (1986) Применимость количественной оценки ядерных рецепторов андрогенов к аденокарциноме предстательной железы человека. Дж Урол 135: 167
Google ученый
Ghanadian R, Auf G (1980) Рецепторные белки для андрогенов при ДГПЖ и карциноме простаты. В: Schroder F, Voogt HJ de (eds) Стероидные рецепторы, метаболизм и рак простаты. Excerpta Medica, Амстердам, p 110
Excerpta Medica, Амстердам, p 110
Google ученый
Ghanadian R, Auf G (1983) Анализ стероидных рецепторов в простате. В: Ghanadian R, (ed) Эндокринология опухолей простаты. MTP Press, Ланкастер, стр 171
Google ученый
Гленистер Т.В. (1962) Развитие матки и так называемой «средней» или «средней» доли простаты человека.J Анат 96: 443
Google ученый
Gonor SE, Lakey WH, McBlain WA (1984) Взаимосвязь между концентрациями извлекаемого и связанного с матрицей ядерного рецептора андрогенов и клиническим ответом на эндокринную терапию аденокарциномы предстательной железы.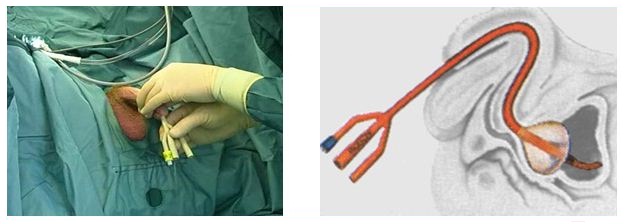 Дж Урол 131: 1196
Дж Урол 131: 1196
Google ученый
Harper ME, Chaisiri P, Slade J, Peeling WB, Griffiths K (1981) Гормональные взаимоотношения, рецепторы и опухолевые маркеры.Последние результаты Cancer Res 78:44
Google ученый
Китано Т., Усуи Т., Ясукава А., Накахара М., Нихира Х., Миячи Ю. (1983) Рецептор андрогенов в образцах, подвергнутых электрорезекции и резекции холодным ударом. Полезность резектоскопа с холодным ударом Каплана. Урология 21: 119
Google ученый
Киприану Н., Уильямс Х., Пилинг В.Б., Дэвис П., Гриффитс К. (1986) Оценка методов биопсии для анализа рецепторов андрогенов в ткани предстательной железы человека.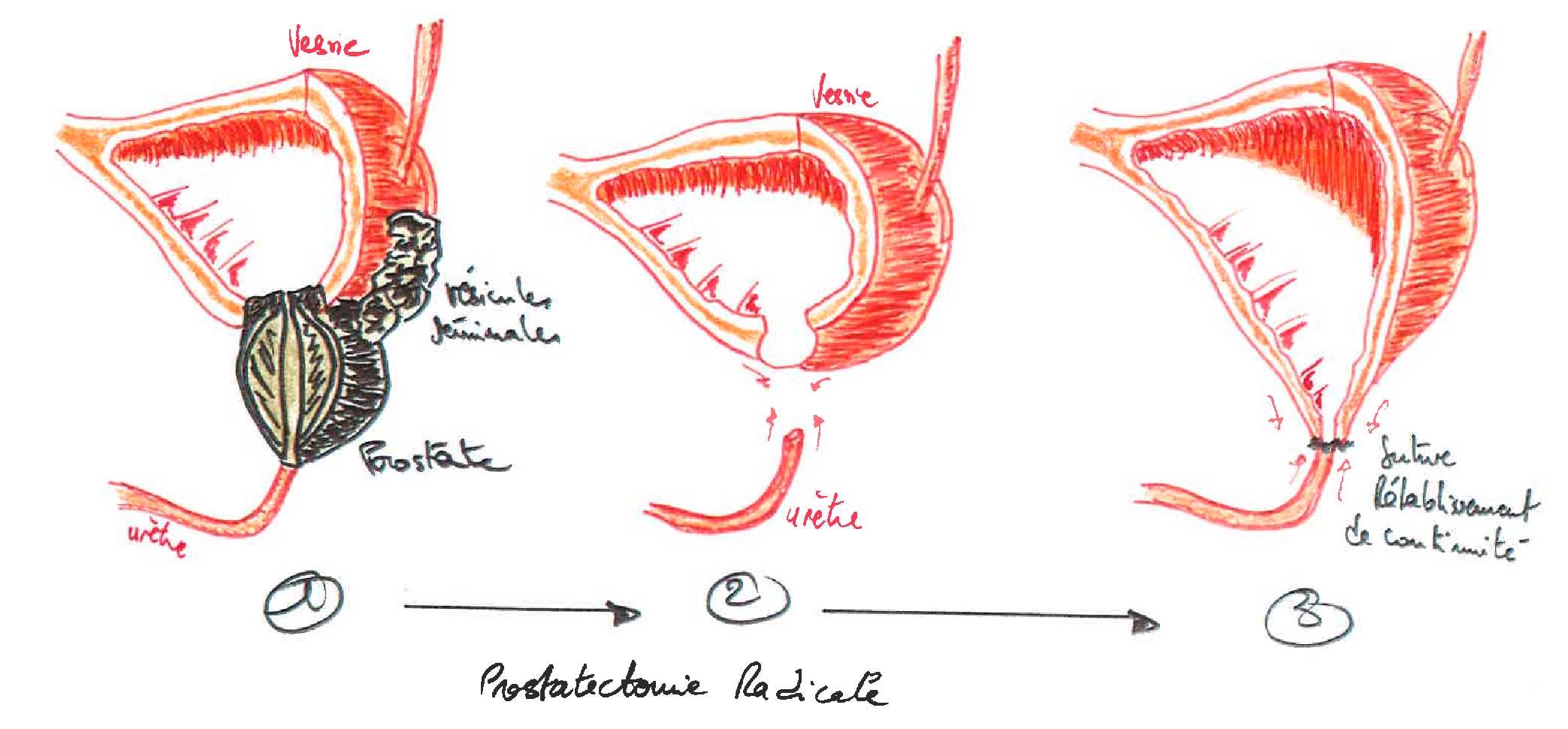 Бр Ж Урол 58:41
Бр Ж Урол 58:41
Google ученый
Lopes MTP, Liberato MH, Widman A, Brentani MM (1987) Занятые и незанятые сайты связывания эстрогена типа II при раке груди человека. J Стероид Биохим 26: 219
Google ученый
McBlain WA, Shyamala G (1980) Инактивация цитоплазматических глюкокортикоидных рецепторов молочной железы в бесклеточных условиях. J Biol Chem 255: 3884
Google ученый
Nozumi K, Sato R, Ito H, Mazuota M, Shimazakai J (1981) Связывание DHT, R1881 и R5020 в цитозолях нормальной, доброкачественной гипертрофической и раковой предстательной железы человека. Урол Инт 36:79
Урол Инт 36:79
Google ученый
Petra PH, Que BG, Namkung PC, Charbonneau H, Walsh KA, Griffin PR, Shabanowitz J, Hunt DF (1988) Маркировка аффинности, молекулярное клонирование и сравнительный анализ аминокислотной последовательности связывающего половые стероиды белка плазма.Междисциплинарный подход к пониманию взаимодействия стероид-белок и его физиологической роли. Ann NY Acad Sci 538: 10
Google ученый
Смит Т., Чисхолм Г.Д., Хабиб Ф.К. (1983) Выбор ткани для определения рецепторов андрогенов в простате человека. Простата 4: 417
Google ученый

Snochowski M, Pousette A, Ekman P, Bression D, Andersson L, Hogberg B, Gustafsson JA (1977) Характеристика и измерение рецептора андрогенов при доброкачественной гиперплазии предстательной железы и карциноме предстательной железы человека.J Clin Endocrinol Metab 45: 920
Google ученый
Trachtenberg J, Walsh PC (1982) Корреляция содержания ядерных андрогенных рецепторов предстательной железы с продолжительностью ответа и выживаемостью после гормональной терапии при распространенном раке простаты J Urol 127: 466
Google ученый
Van Aubel OGJM, Bolt-de Vries J, Blankenstein MA, ten Kate FJW, Schröder FH (1985) Содержание ядерных рецепторов андрогенов в образцах биопсии из гистологически нормальной, гиперпластической и злокачественной ткани предстательной железы человека.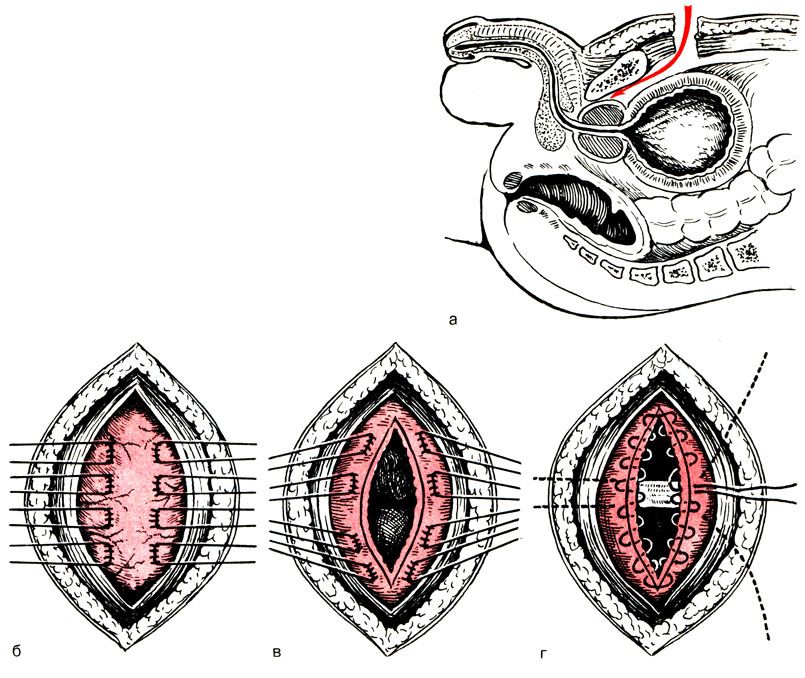 Простата 6: 185
Простата 6: 185
Google ученый
ПРАЙМ PubMed | [Способ гемостаза при транспузырной аденомэктомии]
Цитирование
Кавка, Н. П., et al. «[Метод гемостаза при транспузырной аденомэктомии]». Урология и Нефрология, 1993, стр. 33-6.
Кавка Н.П., Горовой В.И., Кобзин А.Л. и др. [Способ гемостаза при трансвезикальной аденомэктомии]. Урол Нефрол (Моск) . 1993.
Кавка, Н.П., Горовой В.И., Кобзин А.Л., Ткачук О.И., Головенко В.П. (1993). [Способ гемостаза при трансвезикальной аденомэктомии]. Урология и нефрология , (6), 33-6.
Кавка Н.П. и др. [Способ гемостаза при транспузырной аденомэктомии]. Урол Нефрол (Моск). 1993 ноябрь-декабрь; (6) 33-6. PubMed PMID: 7512775.
TY — JOUR
T1 — [Метод гемостаза при трансвезикальной аденомэктомии].
АС — Кавка, Н П,
AU — Горовой, В I,
AU — Кобзин, А Л,
AU — Ткачук, О Я,
AU — Головенко В П,
PY — 1993/11/1 / pubmed
PY — 1993/11/1 / medline
PY — 1993/11/1 / entrez
СП — 33
EP — 6
JF — Урология и нефрология
JO — Урол Нефрол (Моск)
ИС — 6
N2 — Гемостатические техники, предложенные авторами при трансвезикальной аденомэктомии, включают заменяемые кетгутовые лигатуры U-образной формы с круговым захватом пузырьков шейки матки и капсулы простаты с последующим их растяжением уретры. Методика применима при аденомах разного размера, склерозе предстательной железы и везической шейки матки. Процедура использовалась в 112 случаях. Кровопотеря, измеренная у 54 пациентов, составила в среднем 160 мл, что меньше, чем при других методах аденомэктомии. Послеоперационное кровотечение отмечено у 1 пациента (0,9%). Летальность составила 1,8%. Отдаленные послеоперационные инфекционные осложнения возникли у 4,5%, органические (стриктура шейки матки) — у 1,8% обследованных. Методика рекомендуется для внедрения в клиническую практику как простая в исполнении, обеспечивающая надежный гемостаз и снижение интраоперационного кровотечения.SN — 0042-1154
UR — https://www.unboundmedicine.com/medline/citation/7512775/[a_method_for_hemostasis_in_transvesical_adenomectomyestive_
DB — PRIME
DP — несвязанная медицина
ER —
Методика применима при аденомах разного размера, склерозе предстательной железы и везической шейки матки. Процедура использовалась в 112 случаях. Кровопотеря, измеренная у 54 пациентов, составила в среднем 160 мл, что меньше, чем при других методах аденомэктомии. Послеоперационное кровотечение отмечено у 1 пациента (0,9%). Летальность составила 1,8%. Отдаленные послеоперационные инфекционные осложнения возникли у 4,5%, органические (стриктура шейки матки) — у 1,8% обследованных. Методика рекомендуется для внедрения в клиническую практику как простая в исполнении, обеспечивающая надежный гемостаз и снижение интраоперационного кровотечения.SN — 0042-1154
UR — https://www.unboundmedicine.com/medline/citation/7512775/[a_method_for_hemostasis_in_transvesical_adenomectomyestive_
DB — PRIME
DP — несвязанная медицина
ER —
Доброкачественная гиперплазия предстательной железы и последующий риск рака мочевого пузыря
В этом большом когортном исследовании в Швеции мы не обнаружили значительного общего повышенного риска рака мочевого пузыря среди всех пациентов с ДГПЖ. После стратификации по типу лечения ДГП (ТУРП, ТА, без хирургического вмешательства) пациенты с ДГПЖ, получавшие ТУРП, менее инвазивное хирургическое вмешательство, имели значительно повышенный риск рака мочевого пузыря по сравнению с населением Швеции в целом.Однако не было значительного увеличения риска среди пациентов с ДГП без хирургического вмешательства и незначительного снижения риска среди пациентов с ДГПЖ с ТА, открытой хирургической процедурой.
После стратификации по типу лечения ДГП (ТУРП, ТА, без хирургического вмешательства) пациенты с ДГПЖ, получавшие ТУРП, менее инвазивное хирургическое вмешательство, имели значительно повышенный риск рака мочевого пузыря по сравнению с населением Швеции в целом.Однако не было значительного увеличения риска среди пациентов с ДГП без хирургического вмешательства и незначительного снижения риска среди пациентов с ДГПЖ с ТА, открытой хирургической процедурой.
Одной из причин, по которой мы решили изучить риск рака мочевого пузыря после постановки диагноза ДГПЖ, была возможность того, что из-за увеличения задержки мочи и остаточной мочи после мочеиспускания мочевые симптомы, часто связанные с ДГПЖ, могли увеличиваться уротелием мочевого пузыря. контакт и воздействие потенциальных канцерогенов.Однако отсутствие значимой связи риска рака мочевого пузыря с общей ДГПЖ в этом исследовании не подтверждает эту гипотезу. Тем не менее, повышенный риск наблюдался у пациентов с ДГПЖ, получавших ТУРП, и с сопутствующими заболеваниями ЯБ даже после 10 лет наблюдения, что позволяет предположить, что такие симптомы могут способствовать, по крайней мере частично, повышенному риску рака мочевого пузыря у этих пациентов. Действительно, некоторые заболевания мочевыводящих путей, такие как инфекции мочевыводящих путей и камни, были связаны с повышенным риском (Nakata et al, 1995).
Действительно, некоторые заболевания мочевыводящих путей, такие как инфекции мочевыводящих путей и камни, были связаны с повышенным риском (Nakata et al, 1995).
Другие возможные причины повышения у пациентов с ДГПЖ, получавших ТУРП, включают в себя смещение наблюдения или выбора лечения. Вероятность систематической ошибки эпиднадзора, вероятно, невелика, поскольку мы сосредоточились на случаях рака мочевого пузыря, диагностированных по крайней мере через 4 года после постановки диагноза ДГПЖ. Различия в риске между различными подгруппами лечения предполагают, что факторы, связанные с выбором лечения, могли частично повлиять на последующий риск рака мочевого пузыря у пациентов с ДГПЖ. Общее состояние здоровья могло быть одним из таких факторов, влияющих на выбор лечения ДГПЖ.В этом исследовании подгруппа ТА, как правило, является наиболее здоровой, за ней следует группа ТУРП, а затем группа без хирургического вмешательства, о чем свидетельствуют более низкие показатели смертности от сопутствующих заболеваний, не связанных с мочеиспусканием, включая сердечно-сосудистые заболевания, сахарный диабет и респираторные заболевания (Blomqvist et al, 1997). Кроме того, индексный диагноз ДГПЖ при выписке из больницы был основным диагнозом только для 53% нехирургических пациентов по сравнению с 89 и 88% участников ТА и ТУРП соответственно (Blomqvist et al, 1997), что позволяет предположить, что пациенты, перенесшие операцию реже были другие проблемы со здоровьем.
Кроме того, индексный диагноз ДГПЖ при выписке из больницы был основным диагнозом только для 53% нехирургических пациентов по сравнению с 89 и 88% участников ТА и ТУРП соответственно (Blomqvist et al, 1997), что позволяет предположить, что пациенты, перенесшие операцию реже были другие проблемы со здоровьем.
С другой стороны, когда диагноз ДГПЖ был вторичным, вероятна ошибочная классификация ДГПЖ. По сравнению с первичными диагнозами, вторичные диагнозы ДГП чаще ставились врачами, не являющимися специалистами в области урологии. Средняя тяжесть клинических проявлений также могла быть меньше по сравнению с пациентами, у которых ДГПЖ была первичным диагнозом. Если существует истинная связь между ДГПЖ и раком мочевого пузыря, возможная неправильная классификация состояния у некоторых пациентов и в целом менее тяжелое заболевание могло способствовать отсутствию какой-либо наблюдаемой связи у неоперированных пациентов с ДГПЖ.
Среди пациентов с ДГПЖ, перенесших ТУРП, мы наблюдали повышенный риск среди тех, кто впервые был госпитализирован по поводу ДГП до 1975 года, но не среди тех, кто впервые был госпитализирован в более поздний период времени, что позволяет предположить, что более ранние индексные годы связаны с более высоким риском рака мочевого пузыря.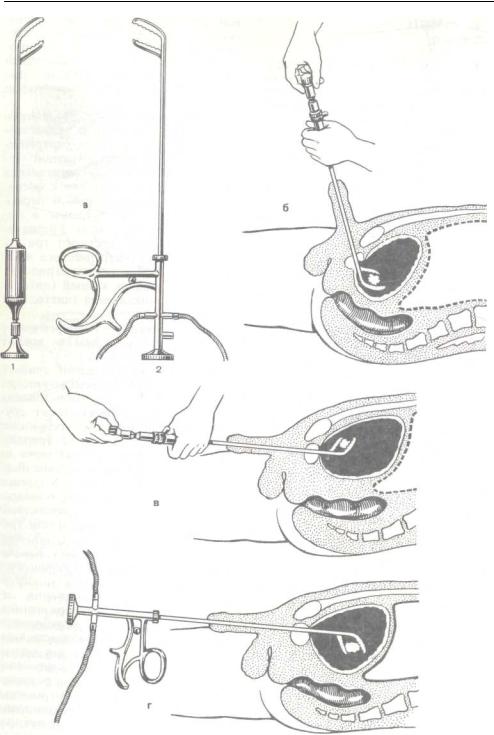 Это открытие может быть результатом длительного латентного периода развития рака мочевого пузыря, что подтверждается выводом о том, что повышенный риск рака мочевого пузыря был более выражен в случаях ДГПЖ с последующим наблюдением более 10 лет. С другой стороны, это может быть результатом изменений в медицинской практике, таких как различия в рекомендациях по ТУРП с течением времени (Blomqvist et al, 1997).В Швеции использование ТУРП росло за период исследования (~ 20% пациентов с ДГПЖ до 1975 г., ~ 60% после 1975 г.).
Это открытие может быть результатом длительного латентного периода развития рака мочевого пузыря, что подтверждается выводом о том, что повышенный риск рака мочевого пузыря был более выражен в случаях ДГПЖ с последующим наблюдением более 10 лет. С другой стороны, это может быть результатом изменений в медицинской практике, таких как различия в рекомендациях по ТУРП с течением времени (Blomqvist et al, 1997).В Швеции использование ТУРП росло за период исследования (~ 20% пациентов с ДГПЖ до 1975 г., ~ 60% после 1975 г.).
Еще одно возможное объяснение наблюдаемого повышенного риска рака мочевого пузыря среди пациентов с ДГПЖ, получавших ТУРП, — это сама процедура ТУРП. Хотя ТУРП считается золотым стандартом лечения ДГПЖ, последующие исследования выявляют неудачи и осложнения у 1–18% пациентов (Мебуст и др., 1989; Фаул, 1993; Бломквист и др., 1997; Борт и др., 2001). По сравнению с ТА, ТУРП может не полностью удалить увеличенную простату, и возможно, что неполное лечение ДГПЖ может увеличить риск побочных эффектов, связанных с ДГПЖ, таких как задержка мочи, остаточная моча после мочеиспускания и другие симптомы мочеиспускания, которые может, в свою очередь, увеличить риск рака мочевого пузыря. С другой стороны, сложное послеоперационное течение может привести к усилению наблюдения, что влечет за собой систематическую ошибку в выявлении. Необходимы дальнейшие исследования, чтобы прояснить природу наблюдаемой ассоциации.
С другой стороны, сложное послеоперационное течение может привести к усилению наблюдения, что влечет за собой систематическую ошибку в выявлении. Необходимы дальнейшие исследования, чтобы прояснить природу наблюдаемой ассоциации.
Это исследование имеет несколько сильных сторон. Во-первых, в отличие от предыдущих исследований аденомы простаты, которые проводились по схеме «случай-контроль», проспективный характер этого исследования исключает систематическую ошибку воспоминаний. Во-вторых, установление случая рака проводилось с использованием всеобъемлющей национальной системы медицинских карт Швеции, которая была практически завершена к концу периода наблюдения (Mattsson and Wallgren, 1984).В-третьих, популяционный характер IPR обеспечивает максимальное представление исследовательской базы. В-четвертых, мы смогли использовать как хирургические, так и диагностические данные, собранные в IPR, включая другие сопутствующие заболевания мочеполового тракта, чтобы исследовать причины наблюдаемых результатов. Наконец, большой размер выборки и длительная продолжительность наблюдения в этом исследовании обеспечивают хорошую статистическую мощность, с которой можно наблюдать связь между ДГПЖ и раком мочевого пузыря, если таковая существует.
Наконец, большой размер выборки и длительная продолжительность наблюдения в этом исследовании обеспечивают хорошую статистическую мощность, с которой можно наблюдать связь между ДГПЖ и раком мочевого пузыря, если таковая существует.
В нашем исследовании есть несколько ограничений.Потенциальные искажающие факторы не были полностью скорректированы в исследовании, поскольку у нас нет информации о некоторых известных факторах риска рака мочевого пузыря (например, курение, род занятий). Кроме того, множественные сравнения и анализ подгрупп могли привести к случайным результатам. Также следует отметить, что мы использовали первую дату госпитализации по поводу ДГПЖ в качестве прокси для даты диагноза ДГПЖ, хотя ясно, что диагноз и начало ДГПЖ могут иметь место до первой госпитализации по поводу ДГПЖ. Из-за характера данных о стационарных пациентах в эту общенациональную базу данных были включены только пациенты с ДГПЖ, которые нуждались в лечении.Мы не смогли включить пациентов с менее тяжелой аденомой простаты, что ограничило возможность обобщения. Кроме того, поскольку мы определили наши подгруппы на основе их лечения ДГПЖ, отмеченного при первой госпитализации по поводу ДГПЖ (вход в когорту), небольшое количество времени человека, отнесенное к нехирургическим подкогортам, должно было быть распределено по хирургическим подкогортам. Причина нашей аналитической техники заключалась в том, чтобы избежать прямого смещения (Любин и Гейл, 1984). Однако, поскольку только 252 из 12 502 пациентов с ДГПЖ в течение 26-летнего периода наблюдения относятся к этой группе, степень ошибочной классификации человеко-времени минимальна.
Кроме того, поскольку мы определили наши подгруппы на основе их лечения ДГПЖ, отмеченного при первой госпитализации по поводу ДГПЖ (вход в когорту), небольшое количество времени человека, отнесенное к нехирургическим подкогортам, должно было быть распределено по хирургическим подкогортам. Причина нашей аналитической техники заключалась в том, чтобы избежать прямого смещения (Любин и Гейл, 1984). Однако, поскольку только 252 из 12 502 пациентов с ДГПЖ в течение 26-летнего периода наблюдения относятся к этой группе, степень ошибочной классификации человеко-времени минимальна.
В заключение, это крупное когортное исследование показало, что ДГПЖ не влияет на последующий риск рака мочевого пузыря в целом. Однако среди мужчин, получавших ТУРП, менее инвазивное хирургическое вмешательство, риск рака мочевого пузыря был повышен, особенно среди мужчин с другими сопутствующими заболеваниями мочевого тракта.
Лучшее хирургическое лечение очень большой доброкачественной непроходимости предстательной железы
Авторские права © 2014 Baishideng Publishing Group Inc. Все права защищены.
Все права защищены.Лучшее хирургическое лечение очень большой доброкачественной обструкции простаты
Иван Д Саес, Хуан Ф де ла Льера, Кристофер Д Хорн, Хосе Ф Лопес, Родриго А Чакон, Педро А Фигероа, Бруно И Вивальди, Фернандо Коз
Иван Д Саес, Хуан Ф де ла Ллера, Кристофер Д Хорн, Хосе Ф Лопес, Родриго А Чакон, Педро А Фигероа, Бруно И Вивальди, Фернандо Коз, Отделение урологии, Военный госпиталь, Медицинский факультет, Университет Andes, Сантьяго 7850000, Чили
Номер ORCID: $ [AuthorORCIDs]
Вклад авторов : Саез И.Д. участвовал в поиске литературы, редактировании, анализе и написании рукописи; de la Llera JF участвовал в редактировании литературы и написании рукописи; Хорн CD и Лопес Дж.Ф. внесли свой вклад в пересмотр литературы; Чакон Р.А., Фигероа П.А. и Вивальди Б.И. внесли свой вклад в редактирование рукописи; Coz F выступил в качестве главного автора.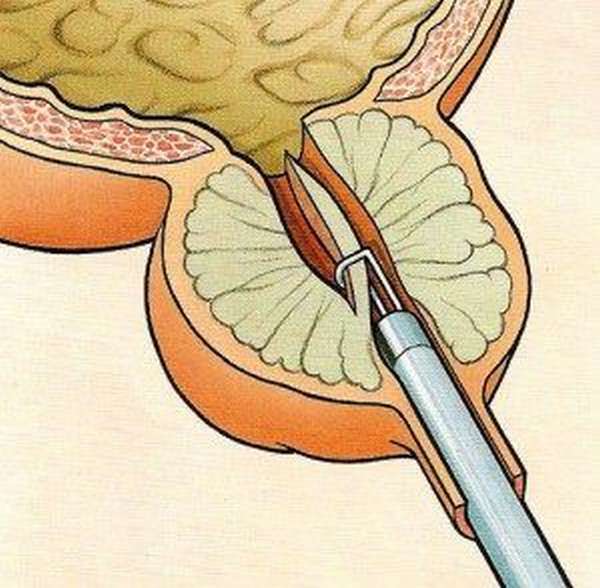
Корреспонденция на номер : Фернандо Коз, доктор медицинских наук, профессор, заведующий кафедрой урологии, военный госпиталь, Медицинский факультет, Университет Андес, Авенида Ларрайн 9100, Столичный регион, Сантьяго 7850000, Чили. [email protected]
Телефон : + 56-2-23316982 Факс: + 56-2-23317168
Получено: 28 апреля 2014 г.
Доработано: 27 июня 2014 г.
Принято: 25 июля 2014 г.
Опубликовано онлайн: 24 ноября 2014 г.
AIM : Исследовать лучшее хирургическое лечение очень большой доброкачественной обструкции предстательной железы (ДПО).
МЕТОДЫ : Обзор литературы был проведен в базе данных PubMed с результатами поиска 167. Ключевые слова для поиска: доброкачественная гиперплазия простаты, хирургическое лечение, большой размер и объем. Критерии включения в это исследование: хирургическое лечение доброкачественной непроходимости предстательной железы размером 80 кубических сантиметров или более. Среди результатов поиска статей 9 выполнили критерий включения и были пересмотрены. Все хирургические методы, включенные в эти статьи, сравнивались друг с другом.Результаты наблюдались, и из них представлены выводы. Статистического анализа нет.
Среди результатов поиска статей 9 выполнили критерий включения и были пересмотрены. Все хирургические методы, включенные в эти статьи, сравнивались друг с другом.Результаты наблюдались, и из них представлены выводы. Статистического анализа нет.
РЕЗУЛЬТАТЫ : Из 5 методов, представленных в отредактированных статьях [открытая трансвезикальная энуклеация, энуклеация простаты гольмиевым лазером (HoLEP), фотоселективная вапоризация простаты с использованием лазера на титанилфосфате калия, трансуретральная резекция с биполярной энергией и трансуретральная энуклеация с биполярная энергия], открытая трансвезикальная энуклеация лучше всего позволяет разрешить обструктивные симптомы.Он обеспечивает отличную максимальную скорость потока, большой объем резецированной ткани и сохранение результатов с течением времени. Эти характеристики объясняют, почему это был золотой стандарт лечения простаты более 80 см3. Однако это происходит за счет большей кровопотери, уретрального катетера и времени пребывания в больнице. С момента своего первого применения в 1996 году трансуретральная энуклеация простаты с помощью гольмиевого лазера стала процедурой, которая имеет аналогичные хирургические результаты с меньшим количеством осложнений по сравнению с открытой операцией, что делает ее интересной альтернативой для очень большого ДГП.Тем не менее, ни одна процедура не устранила открытую операцию как золотой стандарт для очень крупных BPO.
С момента своего первого применения в 1996 году трансуретральная энуклеация простаты с помощью гольмиевого лазера стала процедурой, которая имеет аналогичные хирургические результаты с меньшим количеством осложнений по сравнению с открытой операцией, что делает ее интересной альтернативой для очень большого ДГП.Тем не менее, ни одна процедура не устранила открытую операцию как золотой стандарт для очень крупных BPO.
ЗАКЛЮЧЕНИЕ : Открытая хирургия оказалась золотым стандартом для очень больших BPO. HoLEP представляет собой малоинвазивную альтернативу с такими же преимуществами, но с меньшей болезненностью.
Основной совет: Хотя золотым стандартом хирургического лечения очень большой доброкачественной непроходимости предстательной железы была открытая простатэктомия, последние три десятилетия печально известно об отсутствии публикаций, показывающих результаты этой операции.Единственная процедура с аналогичными результатами и меньшим количеством осложнений — это энуклеация простаты с помощью гольмиевого лазера, что делает ее интересной альтернативой при лечении простаты большого размера.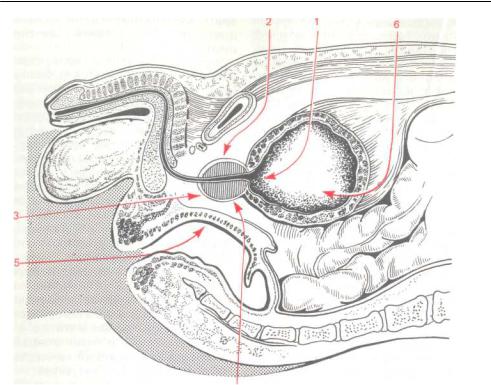 Новые методы лечения простаты больших размеров представляют собой интересную проблему, поскольку как открытая операция, так и энуклеация простаты гольмиевым лазером дают положительные результаты.
Новые методы лечения простаты больших размеров представляют собой интересную проблему, поскольку как открытая операция, так и энуклеация простаты гольмиевым лазером дают положительные результаты.
ВВЕДЕНИЕ
Открытая простатэктомия была одной из старейших процедур, применяемых в урологии для лечения большой доброкачественной непроходимости предстательной железы (ДПП), и остается актуальной и сегодня.Исторические источники делят открытую простатэктомию по разным методикам: промежностный, надлобковый и позадилонный доступ [ 1 , 2 ] .
Первая описанная открытая простатэктомия была произведена Ковилларом через промежностный доступ. В 1639 году он первым удалил среднюю долю простаты через промежностный доступ. Однако именно Гудфеллоу стал первым, кто начал рутинно выполнять открытую простатэктомию промежности. Многие врачи усовершенствовали применяемую впоследствии технику, но именно Янг из Университета Джона Хопкинса в 1905 году опубликовал свою операционную технику [ 3 ] .
Методы надлобковой простатэктомии с использованием перинеальных доступов. В 1894 году Юджин Фуллер считается первым человеком, выполнившим полное надлобковое удаление аденомы простаты. Однако наибольшую известность благодаря трансвезикальной простатэктомии получил в 1900 году Питер Фрейер. Его публикация случаев в British Medical Journal популяризовала эту процедуру [ 4 ] .
Что касается позадилонной простатэктомии, Ван Стокум считается первым человеком, выполнившим энуклеацию аденомы простаты с использованием этого хирургического подхода в 1908 году.Именно Миллин в 1945 году популяризировал этот подход, опубликовав свою оперативную технику и результаты [ 5 ] . Его техника использовалась во всем мире уже более 65 лет с небольшими изменениями.
Появление в 1926 году таких инструментов, как резектоскоп Штерна-Маккарти, открыло новую эру в урологии и хирургии BPO. Он стал одним из ведущих открытий в области урологии в -х гг. -х гг. Этот резектоскоп был использован во всем мире как один из первых эндоурологических подходов к ДГП.Это стало первой малоинвазивной процедурой эндоскопического лечения таких патологий, как новообразования мочевого пузыря и ДГП. Возможно, самый важный шаг вперед в создании этого инструмента был сделан Иглесиасом в 1975 году, который модифицировал его, чтобы обеспечить возможность ирригации и всасывания [ 6 ] . С разработкой новых линз это улучшило видение операционного поля и сократило время операции.
-х гг. Этот резектоскоп был использован во всем мире как один из первых эндоурологических подходов к ДГП.Это стало первой малоинвазивной процедурой эндоскопического лечения таких патологий, как новообразования мочевого пузыря и ДГП. Возможно, самый важный шаг вперед в создании этого инструмента был сделан Иглесиасом в 1975 году, который модифицировал его, чтобы обеспечить возможность ирригации и всасывания [ 6 ] . С разработкой новых линз это улучшило видение операционного поля и сократило время операции.
С тех пор, как Иглесиас опубликовал результаты своего модифицированного резектоскопа, были описаны и опубликованы многочисленные эндоскопические методы.Наиболее важным прорывом с тех пор стала разработка трансуретральной резекции простаты (ТУРП). Первоначально разработанная с монополярной и задней частью с биполярной энергией, ТУРП стала методом выбора при ДГП, особенно при размерах простаты от 30 до 80 куб. См. [ 7 ] . Используемая и по сей день во всем мире, ТУРП сыграла решающую роль в лечении симптомов простатической обструкции простаты малого и среднего размера. Тем не менее, существует мало доказательств, которые обсуждают роль ТУР простаты при размерах простаты более 80 куб. См и особенно более 120 куб. См.
Используемая и по сей день во всем мире, ТУРП сыграла решающую роль в лечении симптомов простатической обструкции простаты малого и среднего размера. Тем не менее, существует мало доказательств, которые обсуждают роль ТУР простаты при размерах простаты более 80 куб. См и особенно более 120 куб. См.
Было опубликовано множество статей, показывающих, что новые методы могут быть новым современным методом лечения такого состояния. Для лечения простаты малых и средних размеров использовались такие процедуры, как трансуретральный разрез простаты, трансуретральная игольная абляция протата, трансуретральная лазерная индуцированная простатэктомия под ультразвуковым контролем, простатрон, Термекс и визуальная лазерная абляция простаты. Получив изначально положительные результаты, большинство из этих методов не смогли стать новым золотым стандартом лечения такого заболевания.Большинство из них никогда не подходили для лечения очень больших BPO. Они использовались только при лечении простаты малого и среднего размера. Эти инструменты быстро перестали быть широко разрекламированными решениями для BPO и превратились в украшение подвалов больниц по всему миру.
Эти инструменты быстро перестали быть широко разрекламированными решениями для BPO и превратились в украшение подвалов больниц по всему миру.
Различные другие методы были разработаны, чтобы не допустить открытой простатэктомии как метода лечения очень большого ДПО. Наиболее распространенной из них была энуклеация простаты гольмиевым лазером (HoLEP).Эта процедура, впервые описанная в 1996 г. в Новой Зеландии Gilling et al [ 8 ] , имеет преимущества по сравнению с другими эндоскопическими процедурами, такими как ТУРП для лечения больших простат.
МАТЕРИАЛЫ И МЕТОДЫ
Для оценки наилучшего хирургического лечения очень большой BPO мы провели тщательный поиск и проверку доступной литературы.
Был проведен систематический поиск в базе данных PubMed по следующим ключевым словам: доброкачественная гиперплазия простаты, хирургическое лечение, большой объем, объем.Всего было найдено 167 статей (включая рандомизированные контролируемые испытания, проспективные и ретроспективные серии). Все публикации были рассмотрены, и те, которые соответствовали критериям включения, были рассмотрены в нашем исследовании. Эти критерии были следующими: объем предстательной железы более 80 мл, измеренный трансректальным ультразвуком (ТРУЗИ), измерение симптомов по международной шкале симптомов простаты, максимальный поток мочи, значения простатического специфического антигена (ПСА) до и после операции и регистр хирургических осложнений с наблюдение не менее 12 мес.Исследования, в которых авторы использовали методы резекции, должны были включать измерение энуклеированной или резецированной ткани. Те, кто использовал методы вапоризации, должны были включать исключительно измерение объема простаты с помощью ТРУЗИ до и после вмешательства.
Все публикации были рассмотрены, и те, которые соответствовали критериям включения, были рассмотрены в нашем исследовании. Эти критерии были следующими: объем предстательной железы более 80 мл, измеренный трансректальным ультразвуком (ТРУЗИ), измерение симптомов по международной шкале симптомов простаты, максимальный поток мочи, значения простатического специфического антигена (ПСА) до и после операции и регистр хирургических осложнений с наблюдение не менее 12 мес.Исследования, в которых авторы использовали методы резекции, должны были включать измерение энуклеированной или резецированной ткани. Те, кто использовал методы вапоризации, должны были включать исключительно измерение объема простаты с помощью ТРУЗИ до и после вмешательства.
Из 167 статей, выбранных для пересмотра, только 9 соответствовали критериям включения (Таблица 1). В этих исследованиях анализируются 5 терапевтических альтернатив хирургии доброкачественной гиперплазии предстательной железы: трансвезикальная или транскапсулярная энуклеация простаты, эндоскопическая резекция с биполярной энергией, вапоризация лазером на основе титанилфосфата калия (KTP), трансуретральная энуклеация с помощью гольмиевого лазера и трансуретральная энуклеация-резекция с биполярной энергией грибная техника). Представлен подробный анализ этих статей, сгруппированных по технике выполнения.
Представлен подробный анализ этих статей, сгруппированных по технике выполнения.
| Арт. | Последующее наблюдение (мес.) | Пациенты ( n ) | Изменение PSA | Изменение симптомов (IPSS) | Максимальное изменение Q Макс. ткань удалена | Время уретрального катетера (ч) | Продолжительность пребывания (ч) | ||||||||||||||||||||
| нг / дл | 354354354 % | мл / сегмент | % | мл | % | ||||||||||||||||||||||
| Трансвезикальный | |||||||||||||||||||||||||||
| Alivizatos3164204 904 904 | 12 | 60 | -4. 3 3 | -68,2 | -13 | -62 | 7,1 | 88,7 | 86 | 89,5 | 120 | 144 | |||||||||||||||
| Ou и др. 204 [ 204 ] 2013 | 12 | 49 | -4,4 | -78,5 | -19,3 | -76,8 | 11,8 | 231,3 | 109,8 | 77,8 | 182 9049 9049 | 77,8 | 182 9049 [ 11 ] , 2013 | 12 | 40 | -3.91 | -86,5 | -21 | -85,7 | 19,7 | 333,8 | 75,2 | 68,3 | 148 | 223 | ||
| HoLEP | и др. 905 ] , 200624 | 225 | -8,1 | -90 | -14,3 | -79,4 | 20 | 250 | 86 | 68,2 | 9049 Матлага и др. [ 13 ] , 2006 | 12 | 86 | -8. 86 86 | -90,2 | -14,5 | -73,9 | 15,8 | 173,6 | 140 | 82,3 | 15,1 | 26 | ||||
| Kuntz 4 9020 и др. 9020 [90] 2008 | 60 | 42 | -19,2 | -86,4 | 20,5 | 539,4 | |||||||||||||||||||||
| PVP с KTP | |||||||||||||||||||||||||||
| Rajbabu 204 и др. | 24 | 54 | -4.6 | -41,8 | -16,3 | -74 | 11 | 137 | 59 | 43,7 | 23 | 11 | |||||||||||||||
| 4 4 4 2008 | 12 | 65 | -3,8 | -61,2 | -11 | -55 | 7,4 | 86 | 38 | 40,8 | 24 | 48 | 9049 | Чжу и др. [ 16 ] , 2009 | 36 | 132 | -4. 17 17 | -57,3 | -18,5 | -86,4 | 15,7 | 237,8 | 58,1 | 72,9 | 69 | 117 | |
| Энуклеасион8 9015 и др. 11 ] , 2013 | 12 | 43 | -4,22 | -88,4 | -21,4 | -86,2 | 20,8 | 358,6 | 65,9 | 56,82 | 129 | ||||||||||||||||
| Ou и др. [ 10 ] , 2013 | 12 | 45 | -4,3 | -72,8 | 9049 -17,699 9049 | 162,7 | 98,7 | 74,7 | 103 | 139 | |||||||||||||||||
РЕЗУЛЬТАТЫ
Простая открытая простатэктомия (трансвезикальная)
Эта методика описана в трех современных статьях, разработанных Фрейером в 1900 году и до сих пор действующей.Аливизатос и другие [ 9 ] , Ou и другие [ 10 ] и Рао и другие [ 11 ] . Вместе они собрали 149 пациентов со средним периодом наблюдения 12 мес. При среднем объеме простаты 115 см3 они достигают средней энуклеации 78 см3 ткани предстательной железы. Это соответствует наибольшему резецированному объему из всех проанализированных методик. Значения ПСА упали на 77% (в среднем 5.От 3 до 1,2 нг / дл). Этот метод имеет самый высокий уровень рекатетеризации — в среднем 4,7% пациентов (Rao et al [ 11 ] имеет частоту повторной катетеризации 7,5%). В этой серии также зарегистрировано наибольшее количество повторных вмешательств: 5,3% пациентов перенесли новое хирургическое вмешательство.
Вместе они собрали 149 пациентов со средним периодом наблюдения 12 мес. При среднем объеме простаты 115 см3 они достигают средней энуклеации 78 см3 ткани предстательной железы. Это соответствует наибольшему резецированному объему из всех проанализированных методик. Значения ПСА упали на 77% (в среднем 5.От 3 до 1,2 нг / дл). Этот метод имеет самый высокий уровень рекатетеризации — в среднем 4,7% пациентов (Rao et al [ 11 ] имеет частоту повторной катетеризации 7,5%). В этой серии также зарегистрировано наибольшее количество повторных вмешательств: 5,3% пациентов перенесли новое хирургическое вмешательство.
Этот метод требует наибольшей продолжительности катетеризации уретры и пребывания в стационаре — 150 и 196 часов соответственно. У этой процедуры также самый высокий показатель переливания — в среднем 9.Переливали 8% пациентов.
Энуклеация предстательной железы с помощью гольмиевого лазера
Опубликованная Gilling et al.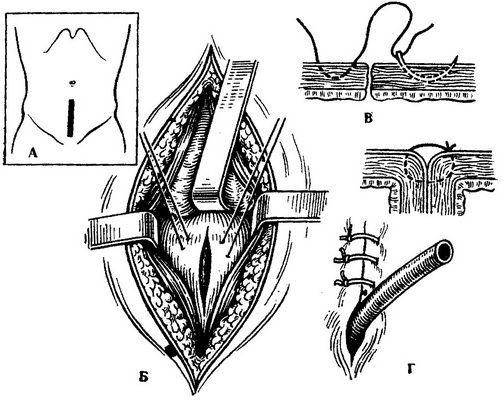 [ 8 ] в 1996 году, в этой методике используется гольмиевый YAG-лазер, позволяющий проводить трансуретральную энуклеацию долей простаты аналогичным образом. при энуклеации пальца в открытых методиках.
[ 8 ] в 1996 году, в этой методике используется гольмиевый YAG-лазер, позволяющий проводить трансуретральную энуклеацию долей простаты аналогичным образом. при энуклеации пальца в открытых методиках.
Три исследовательские группы используют эту технику, в общей сложности 353 пациента и средний период наблюдения 32 месяца (Эльзаят и др. [ 12 ] , Матлага и др. [ 13 ] , Кунц и др. [ 14 ] ).
Это метод резекции второго по величине объема ткани простаты со средним уменьшением объема простаты на 75,2%. Он также имеет наибольшее падение ПСА со степенью снижения на 90,1% (с 9,41 до 0,93 нг / дл). Он обеспечивает максимальное улучшение максимального потока мочи со средним увеличением на 17,9 мл / сегмент по сравнению с исходными значениями.
Тем не менее, этот метод известен как самая медленная процедура. Фактически, это самый медленный из всех, среднее время вмешательства 121 мин.
Фактически, это самый медленный из всех, среднее время вмешательства 121 мин.
Только 1 пациенту потребовалась повторная катетеризация и 1 пациенту потребовалось повторное вмешательство из-за стойкой гематурии. Частота переливаний составила 0,34% (3 из 353 пациентов). Пациентам потребовалось в общей сложности 22,5 часа катетеризации мочи, в то время как пребывание в больнице составило 27,5 часа, что является вторым по времени из сравниваемых методов.
Фотоселективная вапоризация простаты с использованием KTP-лазера
Это единственный рассмотренный метод нерезекции. Он не извлекает ткань, следовательно, нет результатов биопсии или точных общих объемов удаленной ткани (% уменьшения размера предстательной железы достигается с разницей между до и послеоперационной трансректальной эхографией).Это не позволяет адекватно сравнивать с другими методами.
Этот метод представлен в 2 сериях (Rajbabu et al [ 15 ] , Alivizatos et al [ 9 ] ), всего 119 пациентов и 18 месяцев.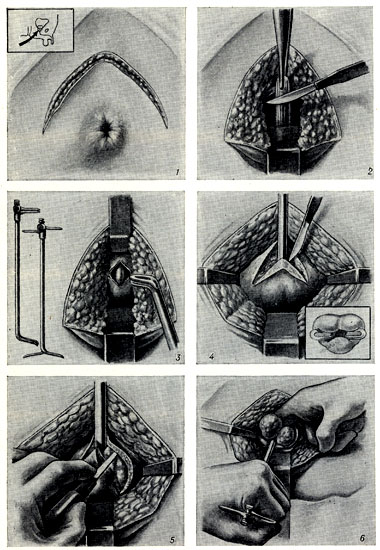 означает последующее наблюдение.
означает последующее наблюдение.
Уменьшение объема предстательной железы на 42%, это метод с наименьшим падением объема. Падение уровня ПСА и максимальный поток мочи также самые низкие — в среднем 51.Улучшение на 5% (с 8,6 до 4,4 нг / дл) и 9,2 мл / с соответственно.
Он не имеет скорости переливания и имеет короткое время пребывания в стационаре и катетере (23,5 часа и 29,5 часа соответственно).
Биполярная энергия
Этот метод используется в двух методах, которые были включены для пересмотра.
Трансуретральная резекция с биполярной энергией
В основном она аналогична классической ТУРП, но с использованием биполярной энергии. Это позволяет проводить орошение физиологическим раствором, что позволяет продлить время операции с меньшим риском развития пост-ТУРП синдрома.
Есть одна статья, в которой используется эта процедура (Zhu et al [ 16 ] ), всего 132 пациента и 36 месяцев наблюдения.
В этой серии показано уменьшение объема предстательной железы на 72,9% после трансвезикальной аденэктомии и HoLEP. Падение ПСА составило 57,3% (от 7,27 до 3,1 нг / дл), в то время как улучшение кровотока составило 15,7 мл по сравнению с исходным уровнем.
Падение ПСА составило 57,3% (от 7,27 до 3,1 нг / дл), в то время как улучшение кровотока составило 15,7 мл по сравнению с исходным уровнем.
Эта исследовательская группа опубликовала частоту повторных операций 4,5% (вторая после открытой операции). Среднее использование мочевого катетера и пребывание в стационаре составило 69 и 117 часов соответственно.
Трансуретральная энуклеация с биполярной энергией (грибовидный метод)
Эта процедура использовалась в двух статьях (Rao et al [ 11 ] , Ou et al [ 10 ]. Оба сравнивали это вмешательство с трансвезикальной открытой операцией (результаты упоминались ранее).
В этих исследованиях приняли участие 88 пациентов, продолжительность наблюдения составила 12 мес. Средний объем до операции составил 124 куб. См с уменьшением ткани на 65.7%. Это ставит его на четвертое место, преодолевая испарение только лазером КТР. Однако у него второе по величине падение уровня ПСА после HoLEP — снижение на 80,6% (с 5,33 до 1,07 нг / дл). Требования к катетеризации и общему пребыванию в больнице были сразу после открытой трансвезикальной хирургии со средним временем 91,1 и 134 часа.
Требования к катетеризации и общему пребыванию в больнице были сразу после открытой трансвезикальной хирургии со средним временем 91,1 и 134 часа.
ОБСУЖДЕНИЕ
В спектре методов, используемых для лечения обструктивной гиперплазии предстательной железы, ТУРП считается золотым стандартом для простаты малого и среднего размера (80 мл или меньше).При столкновении с простатой большего размера исследования не сравнивают ТУРП с другими методами. Кроме того, не было опубликовано серий значительного размера, чтобы показать результаты в этой подгруппе большого объема.
Из 5 представленных методик нет сомнений в том, что открытая трансвезикальная энуклеация позволяет разрешить обструктивные симптомы. Он обеспечивает отличную максимальную скорость потока, большой объем резецированной ткани и сохранение результатов с течением времени. Фактически, это лечение выбора при очень обширном ДГП согласно рекомендациям Американской урологической ассоциации (AUA) и европейским рекомендациям. Эти характеристики объясняют, почему это был золотой стандарт лечения простаты более 80 куб. См [ 12 ] , но за счет большей рекатетеризации, кровопотери, уретрального катетера и продолжительности пребывания в больнице (Таблица 2). Преимущество открытой хирургии заключается в том, что эту процедуру можно выполнять в практически оборудованных хирургических палатах, и ее должны освоить все урологи во всем мире.
Эти характеристики объясняют, почему это был золотой стандарт лечения простаты более 80 куб. См [ 12 ] , но за счет большей рекатетеризации, кровопотери, уретрального катетера и продолжительности пребывания в больнице (Таблица 2). Преимущество открытой хирургии заключается в том, что эту процедуру можно выполнять в практически оборудованных хирургических палатах, и ее должны освоить все урологи во всем мире.
| Повторная операция (%) | Стеноз уретры (%) | Трансфузия (%) | ||
| Техника | ||||
| 7,9 | 9,8 (6,1-13,3) | |||
| HoLEP | 1,33 | 0,66 | 0,84 (0-7,14) | |
| PVP (KTP) | 2,52 (0-399) | 2,52 | (0-2) | 0 |
| Биполярная ТУРП | 4,5 | 4,5 | 0 | |
| Биполярная энуклеация | 2,5 (0-2,2) | 2,4 (2,2-2,599) | 0 -6,6)
В последние несколько лет HoLEP играет важную роль в обсуждении наилучшего лечения доброкачественной простаты больших размеров. Этот метод дает аналогичные результаты по сравнению с открытой простатэктомией как по удаленному объему, так и по параметрам, изучаемым в долгосрочной перспективе. В частности, Kuntz et al. [ 14 ] имеет 5-летнее наблюдение, в течение которого балльные симптомы AUA и максимальная скорость потока сохранялись неизменными с течением времени как в группах открытой аденэктомии, так и в группах HoLEP. Об этом не сообщалось о других методах, что превращает HoLEP в единственный вариант, равный преимуществам открытой операции, но с меньшим количеством переливаний и более короткими сроками пребывания в стационаре и катетером.
Этот метод дает аналогичные результаты по сравнению с открытой простатэктомией как по удаленному объему, так и по параметрам, изучаемым в долгосрочной перспективе. В частности, Kuntz et al. [ 14 ] имеет 5-летнее наблюдение, в течение которого балльные симптомы AUA и максимальная скорость потока сохранялись неизменными с течением времени как в группах открытой аденэктомии, так и в группах HoLEP. Об этом не сообщалось о других методах, что превращает HoLEP в единственный вариант, равный преимуществам открытой операции, но с меньшим количеством переливаний и более короткими сроками пребывания в стационаре и катетером.
Некоторые преимущества, о которых сообщалось при фульгурации KTP-лазера, аналогичны полученным при использовании HoLEP. К ним относятся меньшая потребность в катетере, пребывание в больнице и частота переливаний. Однако HoLEP сообщает о лучшей скорости потока и симптоматических результатах в долгосрочной перспективе.
Большинство урологов утверждают, что кривая обучения HoLEP медленная и оценивается в среднем для 30 случаев.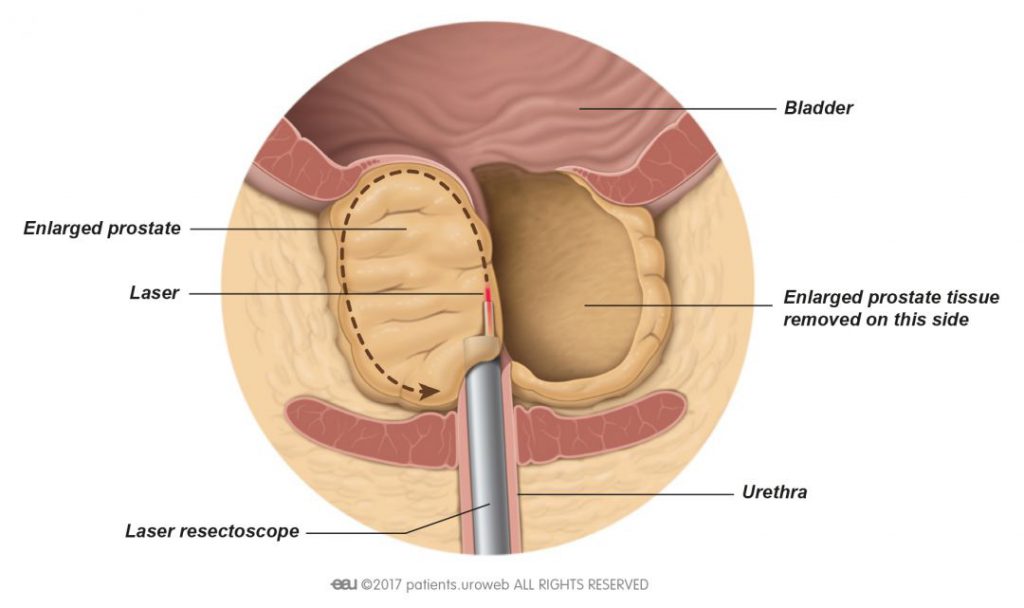 Также для эффективного выполнения этой процедуры требуется сложное оборудование и обученный персонал.
Также для эффективного выполнения этой процедуры требуется сложное оборудование и обученный персонал.
Другими интересными результатами являются те, которые достигаются падением уровня ПСА путем энуклеации с биполярной петлей (грибом), расположенной непосредственно позади HoLEP, даже лучше, чем открытая операция.Это может быть связано как с энуклеацией ткани, так и с фульгурацией капсулы предстательной железы, что снижает количество железистых клеток простаты. Было бы интересно провести тщательное наблюдение и сравнение этих методов в отношении заболеваемости раком простаты в очень долгосрочном плане.
В свете этого обзора кажется правомерным заявить, что идеальным методом лечения простаты размером более 80 см3 является энуклеация. Хотя это выполняется трансвезиально или минимально инвазивно, именно это условие является результатом резекционных или фульгуративных методов.
В попытках сохранить это состояние энуклеации появились альтернативные методы, которые сочетают в себе преимущества менее инвазивной хирургии и преимущества открытой хирургии. Небольшие серии лапароскопической энуклеации с использованием техники Миллина или уникального трансвезикального троакара были впервые описаны Mariano et al [ 17 ] в 2002 году. Недавние публикации, такие как García-Segui et al [ 18 ] в 2012 году сравнивали 17 лапароскопических экстраперитонеальных пациентов с 18 пациентами с открытой методикой Миллина.В группе лапароскопии была более низкая частота кровотечений, меньшее количество орошений, катетеризации и время пребывания в больнице. Нет отчетов в среднесрочной или долгосрочной перспективе. Самая крупная серия, использующая эту технику, — McCullough et al [ 19 ] , которые опубликовали в 2009 году серию из 280 случаев, 96 из которых были выполнены лапароскопическим доступом, с результатами, явно превосходящими открытую операцию. Нет проспективных рандомизированных исследований с адекватным последующим наблюдением, которые позволили бы сделать вывод о потенциальных преимуществах этих методов.
Небольшие серии лапароскопической энуклеации с использованием техники Миллина или уникального трансвезикального троакара были впервые описаны Mariano et al [ 17 ] в 2002 году. Недавние публикации, такие как García-Segui et al [ 18 ] в 2012 году сравнивали 17 лапароскопических экстраперитонеальных пациентов с 18 пациентами с открытой методикой Миллина.В группе лапароскопии была более низкая частота кровотечений, меньшее количество орошений, катетеризации и время пребывания в больнице. Нет отчетов в среднесрочной или долгосрочной перспективе. Самая крупная серия, использующая эту технику, — McCullough et al [ 19 ] , которые опубликовали в 2009 году серию из 280 случаев, 96 из которых были выполнены лапароскопическим доступом, с результатами, явно превосходящими открытую операцию. Нет проспективных рандомизированных исследований с адекватным последующим наблюдением, которые позволили бы сделать вывод о потенциальных преимуществах этих методов. Следовательно, мы не рекомендуем его по сравнению с анализируемыми в этой версии.
Следовательно, мы не рекомендуем его по сравнению с анализируемыми в этой версии.
Было бы очень полезно включить обследования удовлетворенности пользователей и стоимости больниц для пролеченных пациентов, чтобы сделать более обоснованный вывод о том, следует ли склонять баланс в сторону открытой хирургии или HoLEP.
Открытая простатэктомия была золотым стандартом лечения очень больших ДГП в течение последних 65 лет. Это процедура, которая широко практикуется во всем мире и эффективно решает обструктивные симптомы. В последние годы были разработаны новые технологии для лечения очень крупных BPO.Этот обзор показывает, что из этих процедур HoLEP — единственная, которая конкурирует с открытой хирургией бок о бок. Тем не менее, это все еще инкогнито, если HoLEP выдержит испытание временем и станет стандартом хирургической помощи при этой болезни еще через 65 лет.
КОММЕНТАРИИ
Предпосылки
Лечение очень большой доброкачественной непроходимости предстательной железы (ДПО) (80 куб. См или больше) остается сложной задачей в урологической практике. В течение последних 65 лет открытая простатэктомия была золотым стандартом для этих случаев.В настоящее время, в минимально инвазивную эпоху, поиск альтернативы с меньшей заболеваемостью, более коротким пребыванием в больнице и временем восстановления вынуждает авторов оценивать и знакомиться с другими недавно разработанными методиками, которые остаются неизвестными или недоступными для большинства урологов во всем мире.
См или больше) остается сложной задачей в урологической практике. В течение последних 65 лет открытая простатэктомия была золотым стандартом для этих случаев.В настоящее время, в минимально инвазивную эпоху, поиск альтернативы с меньшей заболеваемостью, более коротким пребыванием в больнице и временем восстановления вынуждает авторов оценивать и знакомиться с другими недавно разработанными методиками, которые остаются неизвестными или недоступными для большинства урологов во всем мире.
Границы исследований
Из минимально инвазивных альтернатив, доступных для лечения очень больших ДПО, опубликовано мало данных, подтверждающих, что энуклеация простаты с помощью гольмиевого лазера (HoLEP) является наилучшим хирургическим подходом.Необходимы дополнительные исследования, чтобы сравнить HoLEP с другими минимально инвазивными процедурами, и открытая хирургия, чтобы поддерживать его, является новым золотым стандартом для этого болезненного состояния.
Инновации и прорывы
Открытое хирургическое вмешательство остается единственной альтернативой очень обширному АДП, когда оно связано с определенными коморбидными состояниями. Это тот случай, когда очень большой BPO сосуществует со значительным количеством камней в мочевом пузыре и / или большими дивертикулами мочевого пузыря. Никакая другая процедура не решает одновременно эти сопутствующие заболевания так эффективно, как открытая операция.Также важно отметить, что HoLEP был описан более 18 лет назад. С момента своего появления он доказал высокую эффективность, но с ограниченным распространением. Большинство статей, описывающих преимущества этого метода, были опубликованы только в последние несколько лет. Возможное объяснение этого явления — страна происхождения, в которой он был первоначально описан. Если бы HoLEP был разработан в Европе или в Соединенных Штатах Америки, потребовалось бы более 15 лет, чтобы стать всемирно признанным методом лечения BPO?
Это тот случай, когда очень большой BPO сосуществует со значительным количеством камней в мочевом пузыре и / или большими дивертикулами мочевого пузыря. Никакая другая процедура не решает одновременно эти сопутствующие заболевания так эффективно, как открытая операция.Также важно отметить, что HoLEP был описан более 18 лет назад. С момента своего появления он доказал высокую эффективность, но с ограниченным распространением. Большинство статей, описывающих преимущества этого метода, были опубликованы только в последние несколько лет. Возможное объяснение этого явления — страна происхождения, в которой он был первоначально описан. Если бы HoLEP был разработан в Европе или в Соединенных Штатах Америки, потребовалось бы более 15 лет, чтобы стать всемирно признанным методом лечения BPO?
Приложения
Согласно исследованию авторов, они считают необходимым ознакомиться с минимально инвазивными подходами к лечению ДПО.Из этих методов урологам, возможно, следует специально познакомиться с HoLEP, поскольку он оказался минимально инвазивной и менее болезненной альтернативой для этих пациентов.
Терминология
HoLEP: энуклеация простаты с помощью гольмиевого лазера. Это эндоскопический подход, который позволяет энуклеировать гиперпластическую ткань аналогично открытой хирургии, но с использованием кончика резектоскопа в качестве кончика пальца. Лазерная энергия пронизывает перфорирующие сосуды в плоскости энуклеации. В конце процедуры резецированные доли простаты, помещенные в просвет мочевого пузыря, морцеллируются и аспирируются эндоскопическим морцеллятором, вводимым через резектоскоп; PVP: фотоселективная вапоризация простаты.Он заключается в абляции ткани предстательной железы переходной зоны, поскольку энергия лазера на титанилфосфате калия применяется с использованием бокового волокна.
Рецензия
В статье подробно рассказывается о хирургическом лечении больших (> 80 мл) и очень больших (> 120 мл) простаты.
P- Рецензент: Naselli A S- Редактор: Ji FF L- Редактор: A E- Редактор: Лю SQ
Страница 46 — Читать онлайн
Falavolti et al. Ранний сосудистый контроль в роботизированной хирургии случаи проявления ишемии таза. Тем не менее, простата для простаты больше 80 мл. Урология 2010; 76: 958-61.
Роботизированная лапароскопическая простая простатэктомия - 5. Аливизатос Г., Сколарикос А., Халикопулос Д., Папахристу С.,
рассмотрел новый хирургический подход и перспективный Sopilidis O, Dellis A, Kastriotis I, Deliveliotis C.Трансуретральный
фотоселективная вапоризация по сравнению с трансвезикальной открытой энуклеацией
будущие сравнительные исследования необходимы для определения аденомы простаты> 80 мл: 12-месячные результаты рандомизированного
эффективность этой процедуры. В нашей статье показано проспективное исследование. Eur Urol 2008; 54: 427-37.
предварительные результаты роботизированной лапароскопии 6. Sergi F, Falavolti C, Bove AM, Buscarini M.С помощью роботов
простая простатэктомия с временной внутренней подвздошной лапароскопической простой простатэктомией и дивертикулэктомией мочевого пузыря
пережатие артерий, и мы считаем, что это подход с временным пережатием внутренних подвздошных артерий.
Ранний сосудистый контроль в роботизированной хирургии случаи проявления ишемии таза. Тем не менее, простата для простаты больше 80 мл. Урология 2010; 76: 958-61.
Роботизированная лапароскопическая простая простатэктомия - 5. Аливизатос Г., Сколарикос А., Халикопулос Д., Папахристу С.,
рассмотрел новый хирургический подход и перспективный Sopilidis O, Dellis A, Kastriotis I, Deliveliotis C.Трансуретральный
фотоселективная вапоризация по сравнению с трансвезикальной открытой энуклеацией
будущие сравнительные исследования необходимы для определения аденомы простаты> 80 мл: 12-месячные результаты рандомизированного
эффективность этой процедуры. В нашей статье показано проспективное исследование. Eur Urol 2008; 54: 427-37.
предварительные результаты роботизированной лапароскопии 6. Sergi F, Falavolti C, Bove AM, Buscarini M.С помощью роботов
простая простатэктомия с временной внутренней подвздошной лапароскопической простой простатэктомией и дивертикулэктомией мочевого пузыря
пережатие артерий, и мы считаем, что это подход с временным пережатием внутренних подвздошных артерий. Джей Робот Сург
может быть безопасным хирургическим вариантом для лечения большого 2014; 8: 81-3.
аденомы простаты (> 80 мл), уменьшающие примерно 7. Сотело Р., Клавихо Р., Кармона О., Гарсия А., Банда Е., Миранда М.,
Феджин Р.Простая роботизированная простатэктомия. Дж. Урол 2008; 179: 513-5.
кровопотеря и уменьшение потребности в послеоперационном уходе. 8. Мадерсбахер С., Аливизатос Дж., Нордлинг Дж., Санс ЧР, Эмбертон М., де
la Rosette JJ. Рекомендации ЕАУ 2004 по оценке, терапии и последующему наблюдению.
В заключение, хирургическое лечение большой простаты у мужчин с симптомами нижних мочевых путей, указывающими на доброкачественные
аденомы остаются спорным вопросом.Минимальная непроходимость простаты (рекомендации по ДГПЖ). Eur Urol 2004; 46: 547-54.
инвазивный подход к ДГПЖ заменяет открытую операцию.
Джей Робот Сург
может быть безопасным хирургическим вариантом для лечения большого 2014; 8: 81-3.
аденомы простаты (> 80 мл), уменьшающие примерно 7. Сотело Р., Клавихо Р., Кармона О., Гарсия А., Банда Е., Миранда М.,
Феджин Р.Простая роботизированная простатэктомия. Дж. Урол 2008; 179: 513-5.
кровопотеря и уменьшение потребности в послеоперационном уходе. 8. Мадерсбахер С., Аливизатос Дж., Нордлинг Дж., Санс ЧР, Эмбертон М., де
la Rosette JJ. Рекомендации ЕАУ 2004 по оценке, терапии и последующему наблюдению.
В заключение, хирургическое лечение большой простаты у мужчин с симптомами нижних мочевых путей, указывающими на доброкачественные
аденомы остаются спорным вопросом.Минимальная непроходимость простаты (рекомендации по ДГПЖ). Eur Urol 2004; 46: 547-54.
инвазивный подход к ДГПЖ заменяет открытую операцию. 9. Тубаро А., Картер С., Хинд А., Висентини С., Миано Л. Проспективное исследование.
И лапароскопические, и роботизированные методы демонстрируют безопасность и эффективность надлобковой трансвезикальной простатэктомии при
льготы. Мы предлагаем пациентов с доброкачественной гиперплазией предстательной железы с помощью роботизированной лапароскопии. Дж. Урол 2001; 166: 172-6.
простая простатэктомия с ранним сосудистым контролем как 10.Джанвар А., Синха Р.Дж., Бансал А., Пракаш Г., Сингх К., Сингх В.
Результаты трансуретральной резекции и энуклеации гольмиевым лазером в
методика, способная связать преимущества минимально более 60 г простаты: проспективное рандомизированное исследование. Урол Энн
инвазивная хирургия с минимальной оценкой крови 2017; 9: 45-50.
потеря. Мы считаем, что такой подход может быть безопасным. 11. Naspro R, Gomez Sancha F, Manica M, Meneghini A, Ahyai S, Aho
хирургический вариант лечения большой простаты T, Fiori C, Vavassori I, DA Pozzo LF, Pansadoro V, Montorsi F,
аденомы (> 80 мл), особенно для хирургов Herrmann TR.
9. Тубаро А., Картер С., Хинд А., Висентини С., Миано Л. Проспективное исследование.
И лапароскопические, и роботизированные методы демонстрируют безопасность и эффективность надлобковой трансвезикальной простатэктомии при
льготы. Мы предлагаем пациентов с доброкачественной гиперплазией предстательной железы с помощью роботизированной лапароскопии. Дж. Урол 2001; 166: 172-6.
простая простатэктомия с ранним сосудистым контролем как 10.Джанвар А., Синха Р.Дж., Бансал А., Пракаш Г., Сингх К., Сингх В.
Результаты трансуретральной резекции и энуклеации гольмиевым лазером в
методика, способная связать преимущества минимально более 60 г простаты: проспективное рандомизированное исследование. Урол Энн
инвазивная хирургия с минимальной оценкой крови 2017; 9: 45-50.
потеря. Мы считаем, что такой подход может быть безопасным. 11. Naspro R, Gomez Sancha F, Manica M, Meneghini A, Ahyai S, Aho
хирургический вариант лечения большой простаты T, Fiori C, Vavassori I, DA Pozzo LF, Pansadoro V, Montorsi F,
аденомы (> 80 мл), особенно для хирургов Herrmann TR. От резекции «золотого стандарта» до воспроизводимого «будущего»
начало их кривой обучения. стандартная эндоскопическая энуклеация простаты (ЭЭП): что мы
знать об анатомической энуклеации. Минерва Урол Нефрол 2017; doi:
10.23736 / S0393-2249.17.02834-Х.
Вклад авторов 12. Райх О., Грацке Ч., Штиф Ч.Методы и отдаленные результаты
Оригинальная идея и сбор данных: Хирургические процедуры К. Фалаволти при аденоме простаты. Eur Urol 2006; 49: 970-8.
Данные и статистический анализ: Петитти Т. 13. Мариано М.Б., Грациоттин Т.М., Тефилли М.В. Лапароскопическая простатэктомия
Составление текста: M. Buscarini с сосудистым контролем доброкачественной гиперплазии простаты. Дж Урол
2002; 167: 2528-9.
Финансовая поддержка и спонсорство 14.Porpiglia F, Terrone C, Renard J, Grande S, Musso F, Cossu M, Vacca
Никто.
От резекции «золотого стандарта» до воспроизводимого «будущего»
начало их кривой обучения. стандартная эндоскопическая энуклеация простаты (ЭЭП): что мы
знать об анатомической энуклеации. Минерва Урол Нефрол 2017; doi:
10.23736 / S0393-2249.17.02834-Х.
Вклад авторов 12. Райх О., Грацке Ч., Штиф Ч.Методы и отдаленные результаты
Оригинальная идея и сбор данных: Хирургические процедуры К. Фалаволти при аденоме простаты. Eur Urol 2006; 49: 970-8.
Данные и статистический анализ: Петитти Т. 13. Мариано М.Б., Грациоттин Т.М., Тефилли М.В. Лапароскопическая простатэктомия
Составление текста: M. Buscarini с сосудистым контролем доброкачественной гиперплазии простаты. Дж Урол
2002; 167: 2528-9.
Финансовая поддержка и спонсорство 14.Porpiglia F, Terrone C, Renard J, Grande S, Musso F, Cossu M, Vacca
Никто. F, Скарпа Р.М. Транскапсулярная аденомэктомия (Миллин): сравнительная
исследование, экстраперитонеальная лапароскопия в сравнении с открытой операцией. Eur Urol
2006; 49: 120-6.
Конфликт интересов 15. McCullough TC, Heldwein FL, Soon SJ, Galiano M, Barret E,
Там нет конфликта интересов.Cathelineau X, Prapotnich D, Vallancien G, Rozet F. Лапароскопический
по сравнению с открытой простой простатэктомией: оценка заболеваемости. J
Согласие пациента Endourol 2009; 23: 129-33.
Информированное согласие было получено от всех пациентов. 16. Октай Б., Коч Г., Вурускан Х., Данисоглу М.Э., Кордан Ю. Лапароскопический
экстраперитонеальная простая простатэктомия при доброкачественной гиперплазии простаты:
Утверждение этики с двухлетним опытом.
F, Скарпа Р.М. Транскапсулярная аденомэктомия (Миллин): сравнительная
исследование, экстраперитонеальная лапароскопия в сравнении с открытой операцией. Eur Urol
2006; 49: 120-6.
Конфликт интересов 15. McCullough TC, Heldwein FL, Soon SJ, Galiano M, Barret E,
Там нет конфликта интересов.Cathelineau X, Prapotnich D, Vallancien G, Rozet F. Лапароскопический
по сравнению с открытой простой простатэктомией: оценка заболеваемости. J
Согласие пациента Endourol 2009; 23: 129-33.
Информированное согласие было получено от всех пациентов. 16. Октай Б., Коч Г., Вурускан Х., Данисоглу М.Э., Кордан Ю. Лапароскопический
экстраперитонеальная простая простатэктомия при доброкачественной гиперплазии простаты:
Утверждение этики с двухлетним опытом. Урол Дж 2011; 8: 107-12.
Эта статья отклонена для этического одобрения авторами 17. Yuh B, Laungani R, Perlmutter A, Eun D, Peabody JO, Mohler
принадлежности. JL, Stricker H, Guru KA. Позадилонный позвоночник Миллина с помощью робота
простатэктомия: серия случаев. Кан Дж Урол 2008; 15: 4101-5.
18. Джон Х., Бухер С., Энгель Н., Фишер Б., Фер JL.Предбрюшинный робот
СПИСОК ЛИТЕРАТУРЫ Аденомэктомия простаты. Урология 2009; 73: 811-5.
19. Вора А., Миттал С., Хванг Дж., Банди Г. Простые с помощью роботов.
1. Gratzke C, Bachmann A, Descazeaud A, Drake MJ, простатэктомия Мадерсбахера: мультиинституциональные результаты для желез больше 100
S, Мамулакис C, Oelke M, Tikkinen KA, Gravas S. EAU граммы. Журнал Endourol 2012; 26: 499-502.руководство по ведению пациентов с доброкачественной гиперплазией простаты.
Урол Дж 2011; 8: 107-12.
Эта статья отклонена для этического одобрения авторами 17. Yuh B, Laungani R, Perlmutter A, Eun D, Peabody JO, Mohler
принадлежности. JL, Stricker H, Guru KA. Позадилонный позвоночник Миллина с помощью робота
простатэктомия: серия случаев. Кан Дж Урол 2008; 15: 4101-5.
18. Джон Х., Бухер С., Энгель Н., Фишер Б., Фер JL.Предбрюшинный робот
СПИСОК ЛИТЕРАТУРЫ Аденомэктомия простаты. Урология 2009; 73: 811-5.
19. Вора А., Миттал С., Хванг Дж., Банди Г. Простые с помощью роботов.
1. Gratzke C, Bachmann A, Descazeaud A, Drake MJ, простатэктомия Мадерсбахера: мультиинституциональные результаты для желез больше 100
S, Мамулакис C, Oelke M, Tikkinen KA, Gravas S. EAU граммы. Журнал Endourol 2012; 26: 499-502.руководство по ведению пациентов с доброкачественной гиперплазией простаты. Eur 20. Matei DV, Brescia A, Mazzoleni F, Spinelli M, Musi G, Melegari S,
Урол 2015; 67: 1099-109. Galasso G, Detti S, de Cobelli O. Простая простатэктомия с роботом
2. Джон Х., Бухер С., Энгель Н., Фишер Б., Фер JL. Предбрюшинный робот (РАСП): имеет ли это смысл? BJU Int 2012; 110: E972-9.
аденомэктомия простаты. Урология 2009; 73: 811-5. 21. Шахин А., Куинлан Д.Возможность открытой простой простатэктомии с
3. Грацке С., Шленкер Б., Зейтц М., Карл А., Херманек П., Лак Н., Ранний сосудистый контроль Штифа. BJU Int 2004; 93: 349-52.
К.Г., Райх О. Осложнения и ранний послеоперационный исход после 22 лет. Покорный М., Новара Г., Геуртс Н., Дови З., Де Гроот Р., Плумидис
открытая простатэктомия у пациентов с доброкачественным увеличением простаты: A, Schatteman P, de Naeyer G, Mottrie A. Простая роботизированная операция
результаты проспективного многоцентрового исследования.Дж. Урол 2007; 177: 1419-22.
Eur 20. Matei DV, Brescia A, Mazzoleni F, Spinelli M, Musi G, Melegari S,
Урол 2015; 67: 1099-109. Galasso G, Detti S, de Cobelli O. Простая простатэктомия с роботом
2. Джон Х., Бухер С., Энгель Н., Фишер Б., Фер JL. Предбрюшинный робот (РАСП): имеет ли это смысл? BJU Int 2012; 110: E972-9.
аденомэктомия простаты. Урология 2009; 73: 811-5. 21. Шахин А., Куинлан Д.Возможность открытой простой простатэктомии с
3. Грацке С., Шленкер Б., Зейтц М., Карл А., Херманек П., Лак Н., Ранний сосудистый контроль Штифа. BJU Int 2004; 93: 349-52.
К.Г., Райх О. Осложнения и ранний послеоперационный исход после 22 лет. Покорный М., Новара Г., Геуртс Н., Дови З., Де Гроот Р., Плумидис
открытая простатэктомия у пациентов с доброкачественным увеличением простаты: A, Schatteman P, de Naeyer G, Mottrie A. Простая роботизированная операция
результаты проспективного многоцентрового исследования.Дж. Урол 2007; 177: 1419-22.

 Стриктура – это заращение уретры на определенном протяжении. Чаще всего это связано с воспалением в уретре, наличием сгустков в ней и т.д.
Стриктура – это заращение уретры на определенном протяжении. Чаще всего это связано с воспалением в уретре, наличием сгустков в ней и т.д.
 Ф. Чреспузырная экстрауретральная аденомэктомия // Урол. и нефрол. 1979. № 2. С. 30-34.
Ф. Чреспузырная экстрауретральная аденомэктомия // Урол. и нефрол. 1979. № 2. С. 30-34. В., Васильченко М.И. // Воен. мед. журнал. 2006. № 7. С. 38-42.
В., Васильченко М.И. // Воен. мед. журнал. 2006. № 7. С. 38-42. Это происходит из-за потери механизма закрытия шейки мочевого пузыря (что наблюдается после всех операций, проведенных по поводу IPB), и подразумевает невозможность продолжения рода при сохранении нормальной эрекции.Это состояние встречается у 80-90% пациентов, перенесших аденомэктомию.
Это происходит из-за потери механизма закрытия шейки мочевого пузыря (что наблюдается после всех операций, проведенных по поводу IPB), и подразумевает невозможность продолжения рода при сохранении нормальной эрекции.Это состояние встречается у 80-90% пациентов, перенесших аденомэктомию. В основном это «стрессовое» недержание мочи или проявляется при резком повышении внутрибрюшного давления (кашель, чихание, слабость, поднятие тяжестей).Только 0,3% случаев имеют полное недержание мочи. Такой тип недержания мочи обычно связан с поражением наружного сфинктера уретры и, в зависимости от степени тяжести, может быть исправлен эндоскопической или, в конечном итоге, протезной хирургией.
В основном это «стрессовое» недержание мочи или проявляется при резком повышении внутрибрюшного давления (кашель, чихание, слабость, поднятие тяжестей).Только 0,3% случаев имеют полное недержание мочи. Такой тип недержания мочи обычно связан с поражением наружного сфинктера уретры и, в зависимости от степени тяжести, может быть исправлен эндоскопической или, в конечном итоге, протезной хирургией.
 Ранний сосудистый контроль в роботизированной хирургии случаи проявления ишемии таза. Тем не менее, простата для простаты больше 80 мл. Урология 2010; 76: 958-61.
Роботизированная лапароскопическая простая простатэктомия - 5. Аливизатос Г., Сколарикос А., Халикопулос Д., Папахристу С.,
рассмотрел новый хирургический подход и перспективный Sopilidis O, Dellis A, Kastriotis I, Deliveliotis C.Трансуретральный
фотоселективная вапоризация по сравнению с трансвезикальной открытой энуклеацией
будущие сравнительные исследования необходимы для определения аденомы простаты> 80 мл: 12-месячные результаты рандомизированного
эффективность этой процедуры. В нашей статье показано проспективное исследование. Eur Urol 2008; 54: 427-37.
предварительные результаты роботизированной лапароскопии 6. Sergi F, Falavolti C, Bove AM, Buscarini M.С помощью роботов
простая простатэктомия с временной внутренней подвздошной лапароскопической простой простатэктомией и дивертикулэктомией мочевого пузыря
пережатие артерий, и мы считаем, что это подход с временным пережатием внутренних подвздошных артерий.
Ранний сосудистый контроль в роботизированной хирургии случаи проявления ишемии таза. Тем не менее, простата для простаты больше 80 мл. Урология 2010; 76: 958-61.
Роботизированная лапароскопическая простая простатэктомия - 5. Аливизатос Г., Сколарикос А., Халикопулос Д., Папахристу С.,
рассмотрел новый хирургический подход и перспективный Sopilidis O, Dellis A, Kastriotis I, Deliveliotis C.Трансуретральный
фотоселективная вапоризация по сравнению с трансвезикальной открытой энуклеацией
будущие сравнительные исследования необходимы для определения аденомы простаты> 80 мл: 12-месячные результаты рандомизированного
эффективность этой процедуры. В нашей статье показано проспективное исследование. Eur Urol 2008; 54: 427-37.
предварительные результаты роботизированной лапароскопии 6. Sergi F, Falavolti C, Bove AM, Buscarini M.С помощью роботов
простая простатэктомия с временной внутренней подвздошной лапароскопической простой простатэктомией и дивертикулэктомией мочевого пузыря
пережатие артерий, и мы считаем, что это подход с временным пережатием внутренних подвздошных артерий. Джей Робот Сург
может быть безопасным хирургическим вариантом для лечения большого 2014; 8: 81-3.
аденомы простаты (> 80 мл), уменьшающие примерно 7. Сотело Р., Клавихо Р., Кармона О., Гарсия А., Банда Е., Миранда М.,
Феджин Р.Простая роботизированная простатэктомия. Дж. Урол 2008; 179: 513-5.
кровопотеря и уменьшение потребности в послеоперационном уходе. 8. Мадерсбахер С., Аливизатос Дж., Нордлинг Дж., Санс ЧР, Эмбертон М., де
la Rosette JJ. Рекомендации ЕАУ 2004 по оценке, терапии и последующему наблюдению.
В заключение, хирургическое лечение большой простаты у мужчин с симптомами нижних мочевых путей, указывающими на доброкачественные
аденомы остаются спорным вопросом.Минимальная непроходимость простаты (рекомендации по ДГПЖ). Eur Urol 2004; 46: 547-54.
инвазивный подход к ДГПЖ заменяет открытую операцию.
Джей Робот Сург
может быть безопасным хирургическим вариантом для лечения большого 2014; 8: 81-3.
аденомы простаты (> 80 мл), уменьшающие примерно 7. Сотело Р., Клавихо Р., Кармона О., Гарсия А., Банда Е., Миранда М.,
Феджин Р.Простая роботизированная простатэктомия. Дж. Урол 2008; 179: 513-5.
кровопотеря и уменьшение потребности в послеоперационном уходе. 8. Мадерсбахер С., Аливизатос Дж., Нордлинг Дж., Санс ЧР, Эмбертон М., де
la Rosette JJ. Рекомендации ЕАУ 2004 по оценке, терапии и последующему наблюдению.
В заключение, хирургическое лечение большой простаты у мужчин с симптомами нижних мочевых путей, указывающими на доброкачественные
аденомы остаются спорным вопросом.Минимальная непроходимость простаты (рекомендации по ДГПЖ). Eur Urol 2004; 46: 547-54.
инвазивный подход к ДГПЖ заменяет открытую операцию. 9. Тубаро А., Картер С., Хинд А., Висентини С., Миано Л. Проспективное исследование.
И лапароскопические, и роботизированные методы демонстрируют безопасность и эффективность надлобковой трансвезикальной простатэктомии при
льготы. Мы предлагаем пациентов с доброкачественной гиперплазией предстательной железы с помощью роботизированной лапароскопии. Дж. Урол 2001; 166: 172-6.
простая простатэктомия с ранним сосудистым контролем как 10.Джанвар А., Синха Р.Дж., Бансал А., Пракаш Г., Сингх К., Сингх В.
Результаты трансуретральной резекции и энуклеации гольмиевым лазером в
методика, способная связать преимущества минимально более 60 г простаты: проспективное рандомизированное исследование. Урол Энн
инвазивная хирургия с минимальной оценкой крови 2017; 9: 45-50.
потеря. Мы считаем, что такой подход может быть безопасным. 11. Naspro R, Gomez Sancha F, Manica M, Meneghini A, Ahyai S, Aho
хирургический вариант лечения большой простаты T, Fiori C, Vavassori I, DA Pozzo LF, Pansadoro V, Montorsi F,
аденомы (> 80 мл), особенно для хирургов Herrmann TR.
9. Тубаро А., Картер С., Хинд А., Висентини С., Миано Л. Проспективное исследование.
И лапароскопические, и роботизированные методы демонстрируют безопасность и эффективность надлобковой трансвезикальной простатэктомии при
льготы. Мы предлагаем пациентов с доброкачественной гиперплазией предстательной железы с помощью роботизированной лапароскопии. Дж. Урол 2001; 166: 172-6.
простая простатэктомия с ранним сосудистым контролем как 10.Джанвар А., Синха Р.Дж., Бансал А., Пракаш Г., Сингх К., Сингх В.
Результаты трансуретральной резекции и энуклеации гольмиевым лазером в
методика, способная связать преимущества минимально более 60 г простаты: проспективное рандомизированное исследование. Урол Энн
инвазивная хирургия с минимальной оценкой крови 2017; 9: 45-50.
потеря. Мы считаем, что такой подход может быть безопасным. 11. Naspro R, Gomez Sancha F, Manica M, Meneghini A, Ahyai S, Aho
хирургический вариант лечения большой простаты T, Fiori C, Vavassori I, DA Pozzo LF, Pansadoro V, Montorsi F,
аденомы (> 80 мл), особенно для хирургов Herrmann TR. От резекции «золотого стандарта» до воспроизводимого «будущего»
начало их кривой обучения. стандартная эндоскопическая энуклеация простаты (ЭЭП): что мы
знать об анатомической энуклеации. Минерва Урол Нефрол 2017; doi:
10.23736 / S0393-2249.17.02834-Х.
Вклад авторов 12. Райх О., Грацке Ч., Штиф Ч.Методы и отдаленные результаты
Оригинальная идея и сбор данных: Хирургические процедуры К. Фалаволти при аденоме простаты. Eur Urol 2006; 49: 970-8.
Данные и статистический анализ: Петитти Т. 13. Мариано М.Б., Грациоттин Т.М., Тефилли М.В. Лапароскопическая простатэктомия
Составление текста: M. Buscarini с сосудистым контролем доброкачественной гиперплазии простаты. Дж Урол
2002; 167: 2528-9.
Финансовая поддержка и спонсорство 14.Porpiglia F, Terrone C, Renard J, Grande S, Musso F, Cossu M, Vacca
Никто.
От резекции «золотого стандарта» до воспроизводимого «будущего»
начало их кривой обучения. стандартная эндоскопическая энуклеация простаты (ЭЭП): что мы
знать об анатомической энуклеации. Минерва Урол Нефрол 2017; doi:
10.23736 / S0393-2249.17.02834-Х.
Вклад авторов 12. Райх О., Грацке Ч., Штиф Ч.Методы и отдаленные результаты
Оригинальная идея и сбор данных: Хирургические процедуры К. Фалаволти при аденоме простаты. Eur Urol 2006; 49: 970-8.
Данные и статистический анализ: Петитти Т. 13. Мариано М.Б., Грациоттин Т.М., Тефилли М.В. Лапароскопическая простатэктомия
Составление текста: M. Buscarini с сосудистым контролем доброкачественной гиперплазии простаты. Дж Урол
2002; 167: 2528-9.
Финансовая поддержка и спонсорство 14.Porpiglia F, Terrone C, Renard J, Grande S, Musso F, Cossu M, Vacca
Никто. F, Скарпа Р.М. Транскапсулярная аденомэктомия (Миллин): сравнительная
исследование, экстраперитонеальная лапароскопия в сравнении с открытой операцией. Eur Urol
2006; 49: 120-6.
Конфликт интересов 15. McCullough TC, Heldwein FL, Soon SJ, Galiano M, Barret E,
Там нет конфликта интересов.Cathelineau X, Prapotnich D, Vallancien G, Rozet F. Лапароскопический
по сравнению с открытой простой простатэктомией: оценка заболеваемости. J
Согласие пациента Endourol 2009; 23: 129-33.
Информированное согласие было получено от всех пациентов. 16. Октай Б., Коч Г., Вурускан Х., Данисоглу М.Э., Кордан Ю. Лапароскопический
экстраперитонеальная простая простатэктомия при доброкачественной гиперплазии простаты:
Утверждение этики с двухлетним опытом.
F, Скарпа Р.М. Транскапсулярная аденомэктомия (Миллин): сравнительная
исследование, экстраперитонеальная лапароскопия в сравнении с открытой операцией. Eur Urol
2006; 49: 120-6.
Конфликт интересов 15. McCullough TC, Heldwein FL, Soon SJ, Galiano M, Barret E,
Там нет конфликта интересов.Cathelineau X, Prapotnich D, Vallancien G, Rozet F. Лапароскопический
по сравнению с открытой простой простатэктомией: оценка заболеваемости. J
Согласие пациента Endourol 2009; 23: 129-33.
Информированное согласие было получено от всех пациентов. 16. Октай Б., Коч Г., Вурускан Х., Данисоглу М.Э., Кордан Ю. Лапароскопический
экстраперитонеальная простая простатэктомия при доброкачественной гиперплазии простаты:
Утверждение этики с двухлетним опытом.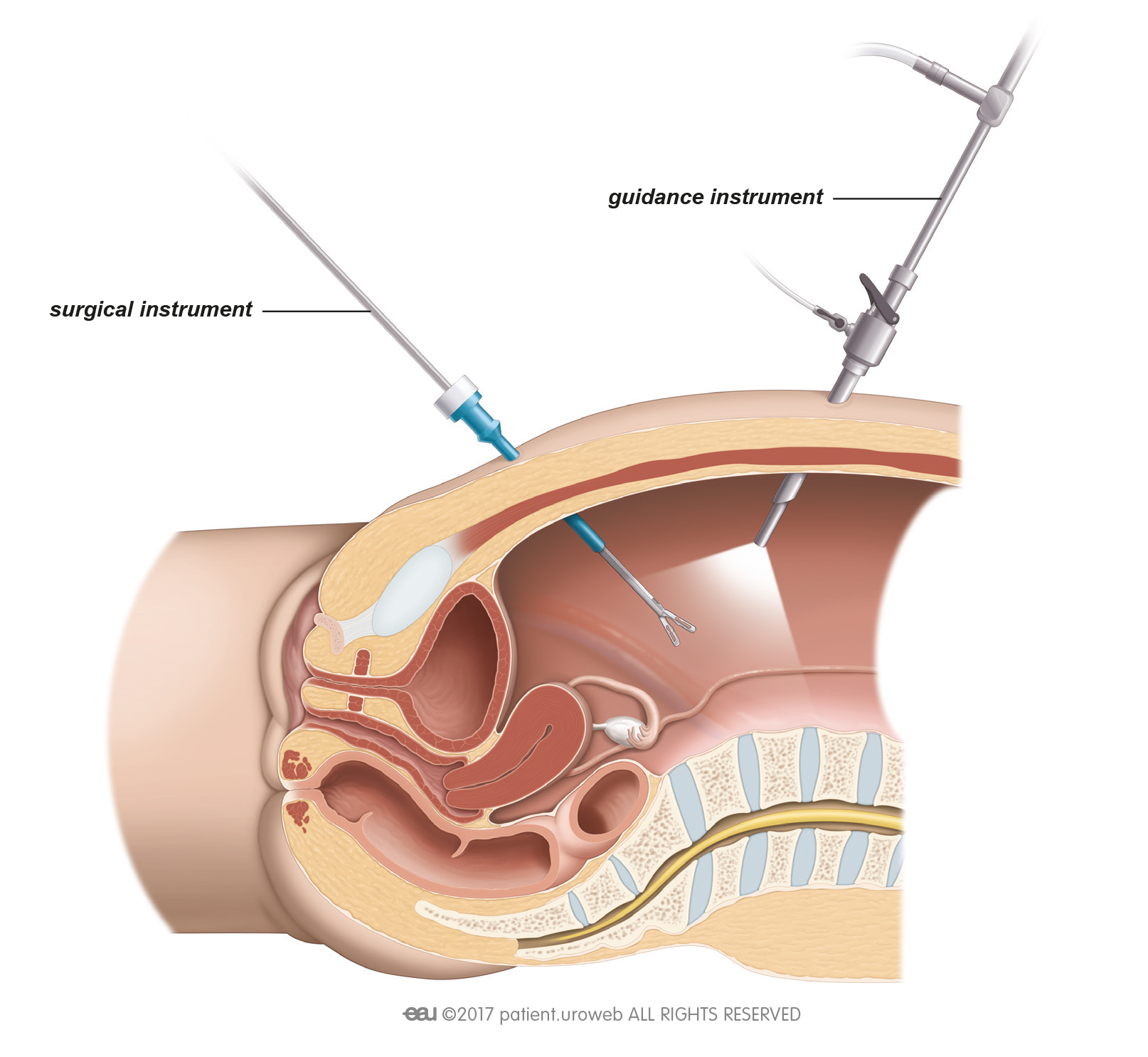 Урол Дж 2011; 8: 107-12.
Эта статья отклонена для этического одобрения авторами 17. Yuh B, Laungani R, Perlmutter A, Eun D, Peabody JO, Mohler
принадлежности. JL, Stricker H, Guru KA. Позадилонный позвоночник Миллина с помощью робота
простатэктомия: серия случаев. Кан Дж Урол 2008; 15: 4101-5.
18. Джон Х., Бухер С., Энгель Н., Фишер Б., Фер JL.Предбрюшинный робот
СПИСОК ЛИТЕРАТУРЫ Аденомэктомия простаты. Урология 2009; 73: 811-5.
19. Вора А., Миттал С., Хванг Дж., Банди Г. Простые с помощью роботов.
1. Gratzke C, Bachmann A, Descazeaud A, Drake MJ, простатэктомия Мадерсбахера: мультиинституциональные результаты для желез больше 100
S, Мамулакис C, Oelke M, Tikkinen KA, Gravas S. EAU граммы. Журнал Endourol 2012; 26: 499-502.руководство по ведению пациентов с доброкачественной гиперплазией простаты.
Урол Дж 2011; 8: 107-12.
Эта статья отклонена для этического одобрения авторами 17. Yuh B, Laungani R, Perlmutter A, Eun D, Peabody JO, Mohler
принадлежности. JL, Stricker H, Guru KA. Позадилонный позвоночник Миллина с помощью робота
простатэктомия: серия случаев. Кан Дж Урол 2008; 15: 4101-5.
18. Джон Х., Бухер С., Энгель Н., Фишер Б., Фер JL.Предбрюшинный робот
СПИСОК ЛИТЕРАТУРЫ Аденомэктомия простаты. Урология 2009; 73: 811-5.
19. Вора А., Миттал С., Хванг Дж., Банди Г. Простые с помощью роботов.
1. Gratzke C, Bachmann A, Descazeaud A, Drake MJ, простатэктомия Мадерсбахера: мультиинституциональные результаты для желез больше 100
S, Мамулакис C, Oelke M, Tikkinen KA, Gravas S. EAU граммы. Журнал Endourol 2012; 26: 499-502.руководство по ведению пациентов с доброкачественной гиперплазией простаты. Eur 20. Matei DV, Brescia A, Mazzoleni F, Spinelli M, Musi G, Melegari S,
Урол 2015; 67: 1099-109. Galasso G, Detti S, de Cobelli O. Простая простатэктомия с роботом
2. Джон Х., Бухер С., Энгель Н., Фишер Б., Фер JL. Предбрюшинный робот (РАСП): имеет ли это смысл? BJU Int 2012; 110: E972-9.
аденомэктомия простаты. Урология 2009; 73: 811-5. 21. Шахин А., Куинлан Д.Возможность открытой простой простатэктомии с
3. Грацке С., Шленкер Б., Зейтц М., Карл А., Херманек П., Лак Н., Ранний сосудистый контроль Штифа. BJU Int 2004; 93: 349-52.
К.Г., Райх О. Осложнения и ранний послеоперационный исход после 22 лет. Покорный М., Новара Г., Геуртс Н., Дови З., Де Гроот Р., Плумидис
открытая простатэктомия у пациентов с доброкачественным увеличением простаты: A, Schatteman P, de Naeyer G, Mottrie A. Простая роботизированная операция
результаты проспективного многоцентрового исследования.Дж. Урол 2007; 177: 1419-22.
Eur 20. Matei DV, Brescia A, Mazzoleni F, Spinelli M, Musi G, Melegari S,
Урол 2015; 67: 1099-109. Galasso G, Detti S, de Cobelli O. Простая простатэктомия с роботом
2. Джон Х., Бухер С., Энгель Н., Фишер Б., Фер JL. Предбрюшинный робот (РАСП): имеет ли это смысл? BJU Int 2012; 110: E972-9.
аденомэктомия простаты. Урология 2009; 73: 811-5. 21. Шахин А., Куинлан Д.Возможность открытой простой простатэктомии с
3. Грацке С., Шленкер Б., Зейтц М., Карл А., Херманек П., Лак Н., Ранний сосудистый контроль Штифа. BJU Int 2004; 93: 349-52.
К.Г., Райх О. Осложнения и ранний послеоперационный исход после 22 лет. Покорный М., Новара Г., Геуртс Н., Дови З., Де Гроот Р., Плумидис
открытая простатэктомия у пациентов с доброкачественным увеличением простаты: A, Schatteman P, de Naeyer G, Mottrie A. Простая роботизированная операция
результаты проспективного многоцентрового исследования.Дж. Урол 2007; 177: 1419-22.
