Гипертрофия левого желудочка при артериальной гипертензии и риск развития аритмий | Фомина
1. Algra A., Tijssen J.G.P., Roelandt J.R.T.C., et al. Heart rate variability from 24-hour electrocardiography and the 2-year risk for sudden death. Circulation 1993; 88: 180-5.
2. Aronow W.S., Epstein S., Koenogsberg M., Schwartz K.S. Usefulnessof echocardiographic LVH ventricular tachycardia and complex ventricular arrhythmias in predicting ventricular fibrillation or sudden cardiac death in elderly patients. Am J Cardiol 1988; 62: 1124-5.
3. Aronson R. Mechanisms of arrhyihmias in ventricular hypertrophy. J Cardiovasc Eleclrophysiol 1991; 2: 249-61.
4. Brilla C.G., Matsubara L.
5. Chakko S., Mulintapang R.F., Huikuri H.V., et al. Alterations in heart rate variability and its circadian rhythm in hypertensive patients with left ventricular hypertrophy free of coronary artery disease. Am Heart J 1993; 126:1364-72.
6. Davey P.P., Bateman J., Mulligan I.P., et al. QT interval dispersion in chronic heart failure and left ventricular hypertrophy: relation to autonomic nervous system and Holter tape abnormalities. Br Heart J 1994; 71: 268-73.
7. Frohlich E.D. Risk mechanisms in hypertensive heart disease. Hypertension 1999; 34:782-9.
8. Lip G.Y.H., Felmeden D.C., Li-Saw-Hee F.L., Beevers D.G. Hypertensive heart disease. A complex syndrome or a hypertensive ‘cardiomyopathy’? Eur Heart J 2000; 21: 1653-65.
Lip G.Y.H., Felmeden D.C., Li-Saw-Hee F.L., Beevers D.G. Hypertensive heart disease. A complex syndrome or a hypertensive ‘cardiomyopathy’? Eur Heart J 2000; 21: 1653-65.
9. Galinier M., Balanescu S., Fourcade J., et al. Prognostic value of arrhythmogenic markers in systemic hypertension. Eur Heart J 1997; 18:1484-91.
10. Ghali J.K., Kadakia S., Cooper R., Liao Y. Impact of LVH on ventricular arrhythmias in the absence of coronary artery disease. JACC 1991; 17:1277-82.
11. Gonzalez-Fernandez R.A., Rivera M., Rodriguez P.J., et al. Prevalence of ectopic ventricular activity after left ventricular mass regression. Am J Hypertens 1993; 6: 308-13.
12. Gonzalez-Juanatey J.R., Garcia-Acuna J.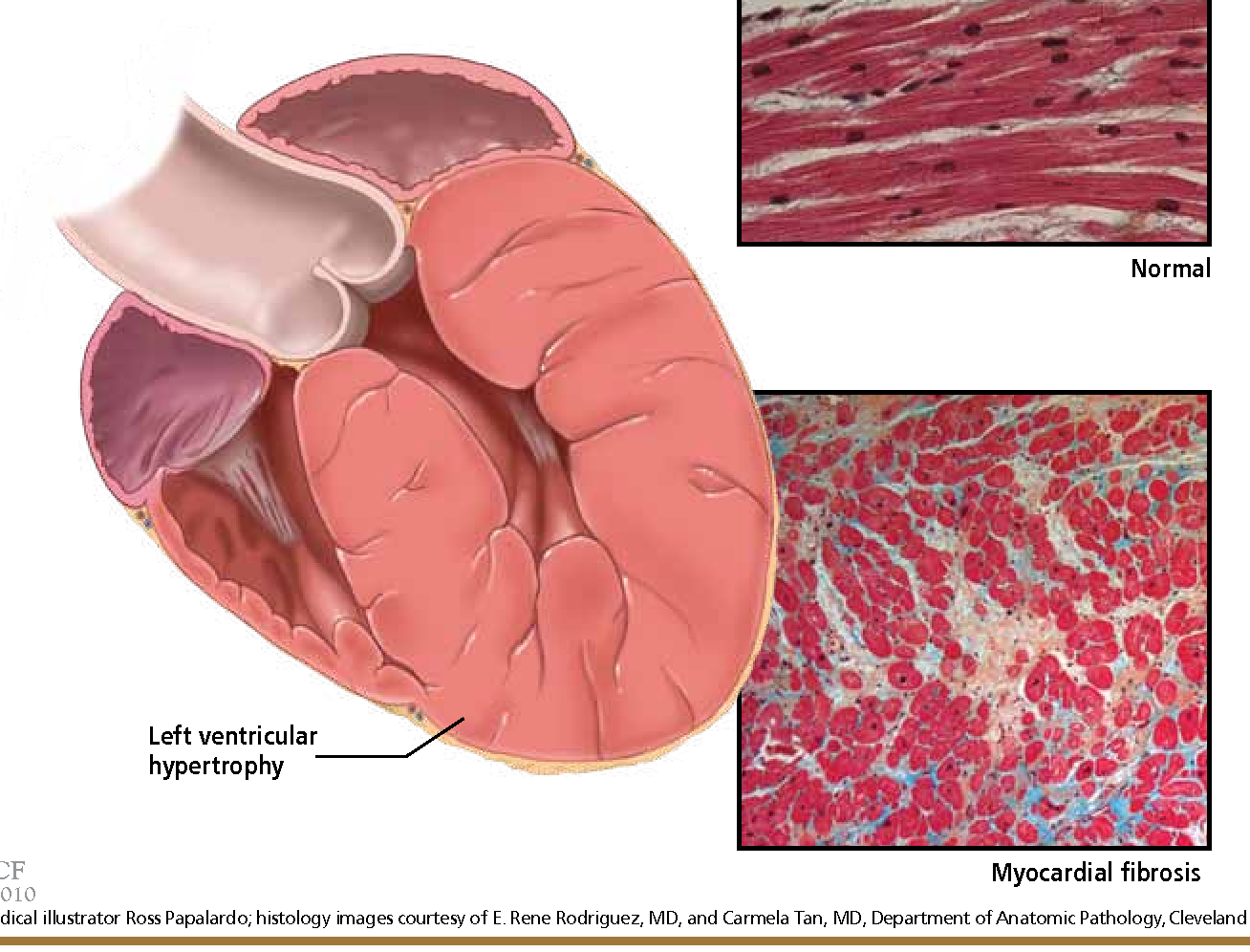 M., Pose A., et al. Reduction of QL and QLc dispersion during long-term treatment of systemic hypertension with enalapril. Am J Cardiol 1998; 81: 170-4.
M., Pose A., et al. Reduction of QL and QLc dispersion during long-term treatment of systemic hypertension with enalapril. Am J Cardiol 1998; 81: 170-4.
13. Hart G. Cellular electrophysiology in cardiac hypertrophy and failure. Cardhvasc Res 1994; 28: 933-46.
14. Hennersdorf M.G., Strauer B.E. Arterial hypertension and cardiac arrhythmias. J Hypertens 2001; 19: 167-77.
15. Ichkhan K., Molnar J., Somberg J. Relation of left ventricular mass and QL dispersion in patients with systematic hypertension. Am J Cardiol 1997; 79: 508-11.16. James M.A., Jones J.V. Ventricular arrhythmia in untreated newly presenting hypertensive patients compared with a matched normal population. J Hypertens 1989; 7:409-15.
17. Kannel W.B. Blood pressure as a cardiovascular risk factor. Engl J Med 1990; 322: 1561-6.
18. Kannel W.B. Prevalence and natural history of electrocardio-graphic left ventricular hypertrophy. Am J Med 1983; 75(Suppl. ЗА): 4-11.
20. Karpanou E.A., Vyssoulis G.P., Psichogios A., et al. Regression of left ventricular hypertrophy results in improvement of QL dispersion in patients with hypertension. Am Heart J 1998; 136: 765-8.
21. Kohya L., Yokoshiki H., Lohse N., et al. Regression of left ventricular hypertrophy prevents ischaemia-induced lethal arrhythmias. Beneficial effect of angiotensin II blockade. Circ Res 1995; 76: 892-9.
Kohya L., Yokoshiki H., Lohse N., et al. Regression of left ventricular hypertrophy prevents ischaemia-induced lethal arrhythmias. Beneficial effect of angiotensin II blockade. Circ Res 1995; 76: 892-9.
22. Koren M.J., Devereux R.B., Casale P.N., et al. Relation of left ventricular mass and geometry to morbidity and mortality in uncomplicated essential hypertension. Ann Intern Med 1991; 114: 345-52.
23. Kostis J.B., Lacy C.R., Shindler D.M., et al. Frequency of ventricular ectopic activity in isolated systolic systemic hypertension. Am J Cardiol 1992; 69: 557-9.
24. Krahn A.D., Manfreda J., Late R.B., et al. Lhe natural history of atrial fibrillation: incidence, risk factors, and prognosis in the Manitoba Follow-Up Study. Am J Med 1995; 98: 476-84.
25. Lavie C.J.Jr., Nunez B.D., Garavaglia G.E., Messerli F.H. Hypertensive concentric left ventricular hypertrophy: when is ventricular ectopic activity increased? South Med J 1988; 81: 696-700.
Lavie C.J.Jr., Nunez B.D., Garavaglia G.E., Messerli F.H. Hypertensive concentric left ventricular hypertrophy: when is ventricular ectopic activity increased? South Med J 1988; 81: 696-700.
26. Levy D., Anderson K.M., Savane D.D., et al. Risk of ventricular arrhythmias in hypertension with left ventricular hypertrophy. Lhe Framingham Heart Study. Am J Cardiol 1987; 60: 560-5.
27. Lim P.O., Nys M., Naas A.A., et al. Irbesartan reduces QL dispersion in hypertensive individuals. Hypertension 1999; 33: 713-8.
28. Lindholm L.H., Dahlof B., Edelman J.E., et al. Effect of losartan on sudden cardiac death in people with diabetes: data from the LIFE study. Lancet 2003; 362: 619-20.
29.
30. Lombardi E. Chaos theory heart rate variability and arrhythmic mortality. Circulation 2000; 101: 8-10.
31. Luque-Otero M., Perez Cascos F., Alcazar J. Increased ventricular arrhythmias in hypertension with left ventricular hypertrophy. J Hypertens 1986; 4(Suppl 6): 66-7.
32. Maimqvist K., Kahan T., Edner M., et al. Comparison of actions of irbesartan versus atenolol on cardiac repolarization in hypertensive left ventricular hypertrophy: results from the Swedish irbesartan left ventricular hypertrophy investigation versus atenolol (SILVHIA). Am J Cardiol 2002; 90: 1107-12.
 Malerba M., Muiesan M.L., Zulli R., et al. Ventricular arrhythmias and changes in blood pressure and left ventricular mass induced by anti-hypertensive treatment in hypertensive patients. J Hypertens 1991; 9(Suppl. 6): SI62.
Malerba M., Muiesan M.L., Zulli R., et al. Ventricular arrhythmias and changes in blood pressure and left ventricular mass induced by anti-hypertensive treatment in hypertensive patients. J Hypertens 1991; 9(Suppl. 6): SI62.34. Manyari D.E., Patterson C., Johnson D., et al. Atrial and ventricular arrhythmias in asymptomatic active elderly subjects: correlation with left atrial size and left ventricular mass. Am Heart J 1990; 119: 1069-76.
35. Mayet J., Shahi M., McGrath K., et al. Left ventricular hypertrophy and QT dispersion in Hypertension. Hypertension 1996; 28: 791-6.
36. McLenachan J.M., Henderson E., Morris K.I., Dargie H.J. Ventricular arrhythmias in hypertensive left ventricular hypertrophy. N Engl J Med 1987; 317: 787-92.37.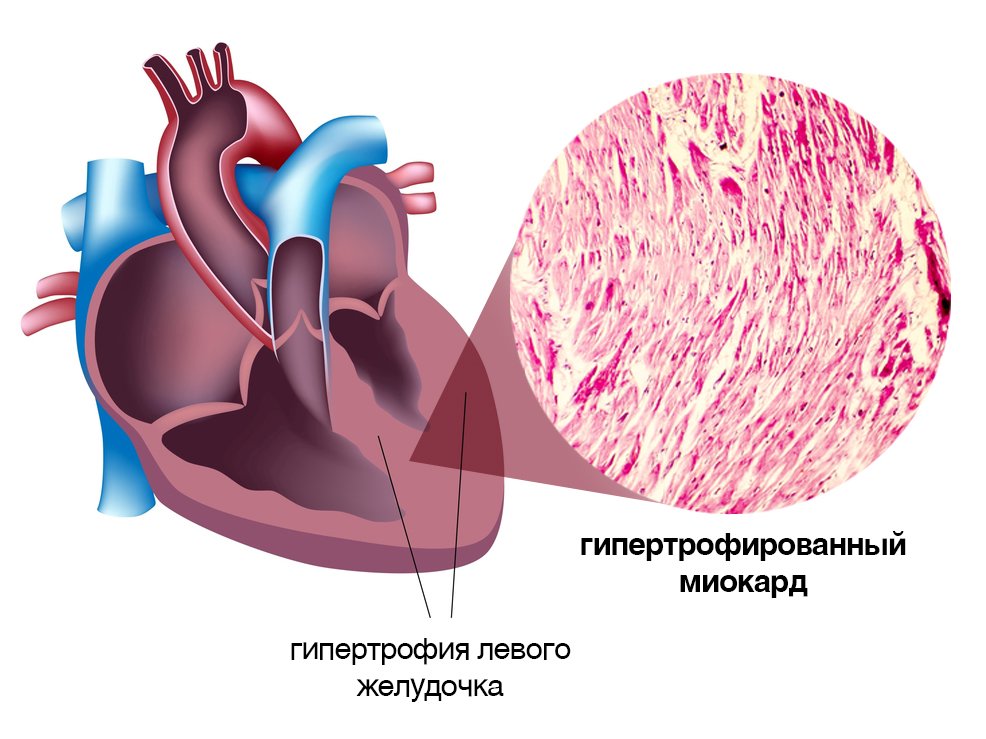 Members of the Sicilian Gambit. New approaches to antiarrhythmic therapy. Emerging therapeutic applications of the cell biology of cardiac arrhythmias. Eur Heart J 2001; 22: 2148-63.
Members of the Sicilian Gambit. New approaches to antiarrhythmic therapy. Emerging therapeutic applications of the cell biology of cardiac arrhythmias. Eur Heart J 2001; 22: 2148-63.
38. Messerli F.H., Nunez B.D., Nunez M.M., et al. Hypertension and sudden death: disparate effects of calcium entry blocker and diuretic therapy on cardiac dysrhythmias. Arch Intern Med 1989; 149: 1263-7.
39. Messerli F.H. Hypertension and sudden cardiac death. Am J Hypertens 1999; 12: 181S-8.
40. Motz W., Vogt M., Rabenau D., et al. Evidence of endothelial dysfunction in coronary resistance vessels in patients with angina pectoris and normal coronary angiograms. Am J Cardiol 1991; 68:996-1003.
41. Novo S., Barbagallo M., Abrignani M.G., et al. Increased prevalence of cardiac arrhythmias and transient episodes of myocardial ischemia in hypertensives with left ventricular hypertrophy but without clinical history of coronary heart disease. Am J Hypertens 1997; 10: 843-51.
Novo S., Barbagallo M., Abrignani M.G., et al. Increased prevalence of cardiac arrhythmias and transient episodes of myocardial ischemia in hypertensives with left ventricular hypertrophy but without clinical history of coronary heart disease. Am J Hypertens 1997; 10: 843-51.
42. Pacifico A., Henry P.D. Structural pathways and prevention of heart failure and sudden death. J Cardiovasc Electrophysiol 2003; 14: 764-75.
43. Panza J.A., Quyami A.A., Brush J.E.Jr., Epstein S.E. Abnormal endothelium-dependent vascular relaxation in patients with essential hypertension. N Engl J Med 1990; 323: 22-7.
44. Perkiomaki J.S., Ikaheimo M.J., Pikkujamsa S.M., et al. Dispersion of the QT interval and autonomic modulation of the heart rate in hypertensive men with and without left ventricular hypertrophy.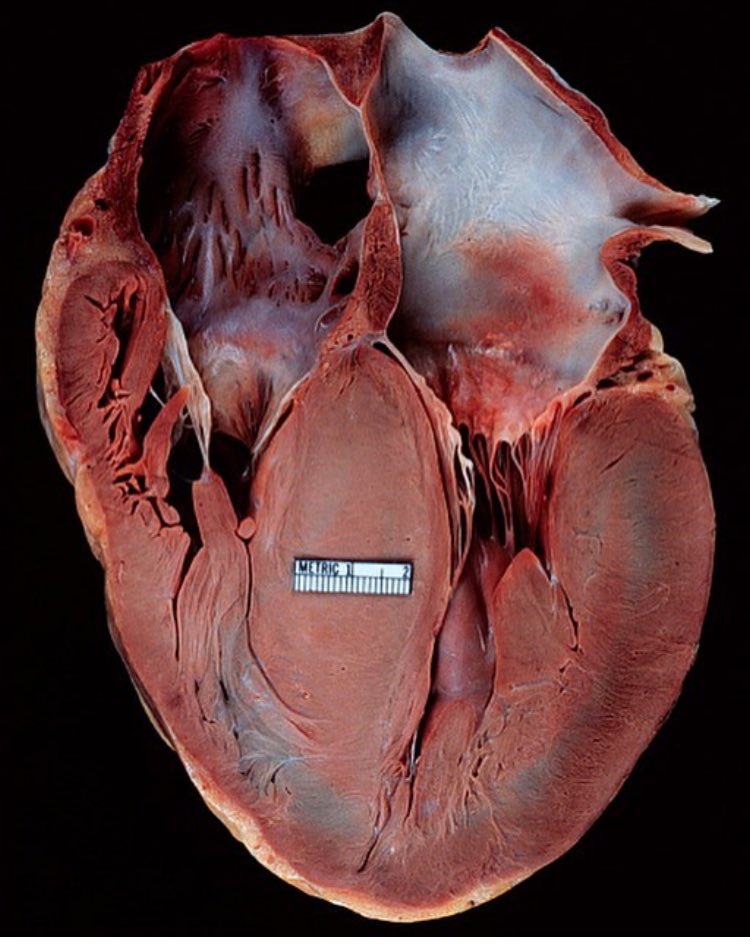 Hypertension 1996; 28: 16-21.
Hypertension 1996; 28: 16-21.
45. Pichard A.D., Gorlin R., Smith H., et al. Coronary flow studies in patients with left ventricular hypertrophy of the hypertensive type. Am J Cardiol 1981; 47: 547-54.
46. Rials S.J., Wu Y., Ford N., et al. Effect of left ventricular hypertrophy and its regression on ventricular electrophysiology and vulnerability to inducible arrhythmia in the feline heart. Circulation 1995;91:426-30.
47. Rosenbaum D.S., Jackson L.E., Smith J.M., et al. Electrical alternans and vulnerability to ventricular arrhythmias. N Engl J Med 1994; 330: 235-41.
48. Scheler S., Motz W., Strauer B.E. Mechanisms of angina pectoris with essential hypertension and normal epicardial arteries by arteriogram. Am J Cardiol 1984; 73: 478-88.
Am J Cardiol 1984; 73: 478-88.
49. Scheler S., Motz W., Strauer B.E. Transient myocardial ischemias in hypertensive patients. Z Kardiol 1990; 78: 197-203.
50. Schmieder R.E., Messerli F.H. Determinants of ventricular ectopy in hypertensive cardiac hypertrophy. Am Heart J 1992; 123: 89-95.
51. Schocn F.J. Systemic, (left-sided) hypertensive heart disease. In Pathologic Basis of Disease, Cotran R.S., Kumar V., Robbins S.L., Eds. W.B. Saunders Company Philadelphia 1994; 541-2.
52. Schwartzkopff B., Motz W., Frenzel H., et al. Structural and functional alterations of the intramyocardial coronary arterioles in patients with arterial hypertension. Circulation 1993; 88: 993-1003.
53. Siegel D., Cheitlin M.D., Black D.M., et al. Risk of ventricular arrhythmias in hypertensive men with left ventricular hypertrophy. Am J Cardiol 1990; 65: 742-7.
54. Singh J.P., Larson M.G., Tsuji H., et al. Reduced heart rate variability and new-onset Hypertension. Insight into pathogenesis of Hypertension: the Framingham Heart Study. Hypertension 1999; 32: 293-7.
55. Strauer B.E. The significance of coronary reserve in clinical heart disease. JACC 1990; 15: 774-83.
56. Strauer B.E. Hypertensive heart disease. Berlin-Heidelberg-New York-Tokyo: Springer-Verlag 1991.
57. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart Rate Variability. Standards of measurement physiological interpretation and clinical use. Circulation 1996; 93: 1043-65.
Heart Rate Variability. Standards of measurement physiological interpretation and clinical use. Circulation 1996; 93: 1043-65.
58. Kalian T., Bergfelt L. Left ventricular hypertrophy in hypertension: its arrhythmogenic potential. Heart 2005; 91: 250-6.
59. Verdecchia P., Angeli F., Borgioni C., et al. Changes in cardiovascular risk by reduction of left ventricular mass in hypertension: a meta-analysis. Am J Hypertens 2003; 11: 895-9.
60. Vester E.G., Kuhls S., Ochinlet-Vester J., et al. Electrophysiological and therapeutic implications of cardiac arrhythmias in hypertension. Eur Heart J 1992; 13(Suppl D): 70-81.
61. Vester E.G., Emschermann C., Stobbe U., et al. Late potentials and heart rate variability in heart muscle disease. Eur Heart J 1994; 15(SupplC): 25-33.
Eur Heart J 1994; 15(SupplC): 25-33.
62. Wolk R. Arrhythmogenic mechanisms in left ventricular hypertrophy. Europace 2000; 2: 216-23.
63. Wolk R., Cobbe S.M. Cardiac arrhythmias in hypertrophy. In: Sheridan D.J., ed. Left Ventricular Hypertrophy. London: Churchill Livingstone 1998: 101-6.
64. Yokoshiki H., Kohya T., Tomita F., et al. Restoration of action potential duration and transient outward current by regression of left ventricular hypertrophy. J Moll Cell Cardiol 1997; 29: 1331-9.
65. Фомина И.Г., Шальнова C.A., Оганов P.Г. Артериальные гипертонии. В кн. Кардиология. Под ред. Оганова Р.Г., Фоминой И.Е Москва «Медицина» 2004; 266-306.
Гипертрофия левого желудочка: прогностическое значение, патогенез и возможность обратного развития.
 Фокус на блокаторы ангиотензиновых рецепторов | Смирнова
Фокус на блокаторы ангиотензиновых рецепторов | Смирнова1. Kannel WB. In: Left ventricular hypertrophy and its regression. Eds. Craickshank JM, Messerli FH. London 1992; 1-11.
2. Kannel WB. Left ventricular hypertrophy as a risk factor in arterial hypertension. Eur Heart J 1996; 13(Suppl D): 82-8.
3. Cooper RS, SimmonsB, CastanerA, et al. Left ventricular hypertrophy is associated with worse survival independence of left ventricular function and coronary arteries severe narrowed. Am J Cardiol 1990; 65: 441-5.
4. Шляхто Е.В., Кондри А.О. Структурно-функциональные изменения миокарда у больных гипертонической болезнью. Кардиология 1999; 2: 49-55.
5. Кушаковский М.С. Гипертоническая болезнь (эссенциальная гипертензия): причины, механизмы, клиника, лечение. Санкт-Петербург 1995; 311с.
Кушаковский М.С. Гипертоническая болезнь (эссенциальная гипертензия): причины, механизмы, клиника, лечение. Санкт-Петербург 1995; 311с.
6. Сидоренко Б.А., Преображенский Д.В. Гипертрофия миокарда левого желудочка: патогенез, диагностика и возможность обратного развития под влиянием гипертензивной терапии. Кардиология 1998; 5: 80-5.
7. Беленков Ю.Н., Агеев Ф.Т., Мареев В.Ю. Знакомьтесь: Диастолическая сердечная недостаточность. Серд недостат 2000; 1(2): 40-4.
8. Арутюнов Г.П., Чернявская Т.К., Розанова А.В. и др. Мониторинг диастолической дисфункции левого желудочка и микроальбуминурии, как критерий эффективности коррекции «мягкой» гипертонии. Серд недостат 2000; 2: 56-60.
9. Вебер В.Р., Рубанова М.П., Жмайлова С.В. и др. Диастолическая дисфункция левого и правого желудочков у больных артериальной гипертонией и возможности ее коррекцию. Серд недостат 2005; 6(3): 107-9.
Вебер В.Р., Рубанова М.П., Жмайлова С.В. и др. Диастолическая дисфункция левого и правого желудочков у больных артериальной гипертонией и возможности ее коррекцию. Серд недостат 2005; 6(3): 107-9.
10. Мазур Н.А., Глотов В.В. Диастолическая функция левого желудочка при гипертонической болезни. Кардиология 1994; 1: 90-2.
11. Post WS, Larson MG, Myers RH, et al. Cardiac structural prescurvers of hypertension the Faminham Heart Study. Circulation 1994; 90: 79-185.
12. Юренев А.П., Quatro VDe, Парфенова И.Е и др. Немая ишемия у больных гипертонической болезнью. Кардиология 1992; 2: 6-8.
13. Thaman R, Gimeno JR, Reith S. Progressive left ventricular remodeling in patients with hypertrophic cardiomyopathy and severe left ventricular hypertrophy. JACC 2004; 44: 398-405.
JACC 2004; 44: 398-405.
14. Юренев А.П., Дубов П.Б., Чарыев Х.Э. Гипертоническое сердце. Ашгабат 1994; 282 с.
15. Обратное развитие гипертрофии левого желудочка на фоне антигипертензивной терапии ассоциируется со снижением сердечно-сосудистой заболеваемости и смертности/ HTML. Cardiosite.ru, по материалам JAMA 2004; 292: 2343-9, 2350-6.
16. Lee RMKW. Vascular changes at the prehypertensive phase in the mesenteric arteries from spontaneously hypertensive rats. Blood vessels 1985; 22: 105-26.
17. Pinto YM. Buikema H, van Gilst WH, et al. Cardiac hypertrophy and dysfunction, independed from blood pressure increase, in transgenic rats expressing the mouse renin-2 gene. Eur Heart J 1994; 15: 567-9.
18. Tanase H, Yamori Y, Hansen CT, Lovenberg W. Heart size in inbred strains of rats. Part 1. Genetic determinants of the development of cardiovascular enlargement in rats 1982. Hypertension 1982; 4: 864-72.
19. Jalil JE, Piddo AM, Cordova S, et al. Prevalence of the angiotensin I converting enzyme insertion/deletion polymorphism, plasma angiotensin converting enzyme activity, and left ventricular mass in a normotensive Chilean population. Am J Hypertens 1999; 12: 697-704.
20. De Simone G, Devereux RB, Poman MJ, et al. Echocardiographic left ventricular mass and electrolite intake predict arterial hypertension. Ann Intern Med 1991; 114: 202-9.
21. Allermann Y, Aeschbacher B, Zwysing P, et al.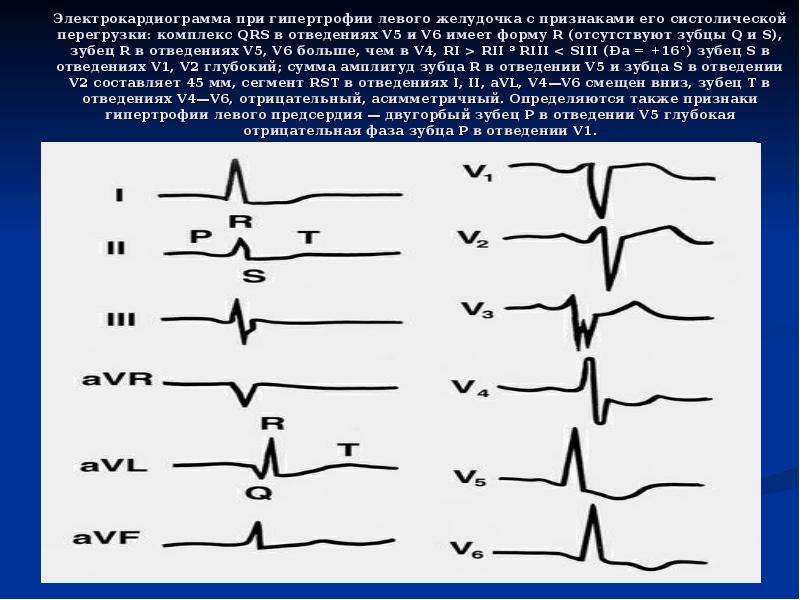 Left ventricular structure and determinants in normotensive offspring of essential hypertensive patients. J Hypertens 1992; 10: 1257-64.
Left ventricular structure and determinants in normotensive offspring of essential hypertensive patients. J Hypertens 1992; 10: 1257-64.
22. Schunkert H, Bryckel U, Hengstenberg C. at al. Familial predisposition of left ventricular hypertrophy. JACC 1999; 33: 1685-91.
23. Post WS, Larson MG, Myers RH. Heritability of left ventricular mass: the Framingham Heart Study. Hypertension 1997; 30: 1025-8.
24. Rizzoni D, Porteri E, Castellano M, et al. Vascular hypertrophy and remodelling in secondary hypertension. Hypertension 1996; 28: 785-90.
25. Levy D, Savage DD, Garrison RJ, et al. Echocardiographic criteria for the left ventricular hypertrophy: the Framingham Heart Study. Am J Cardiol 1987; 59: 956-60.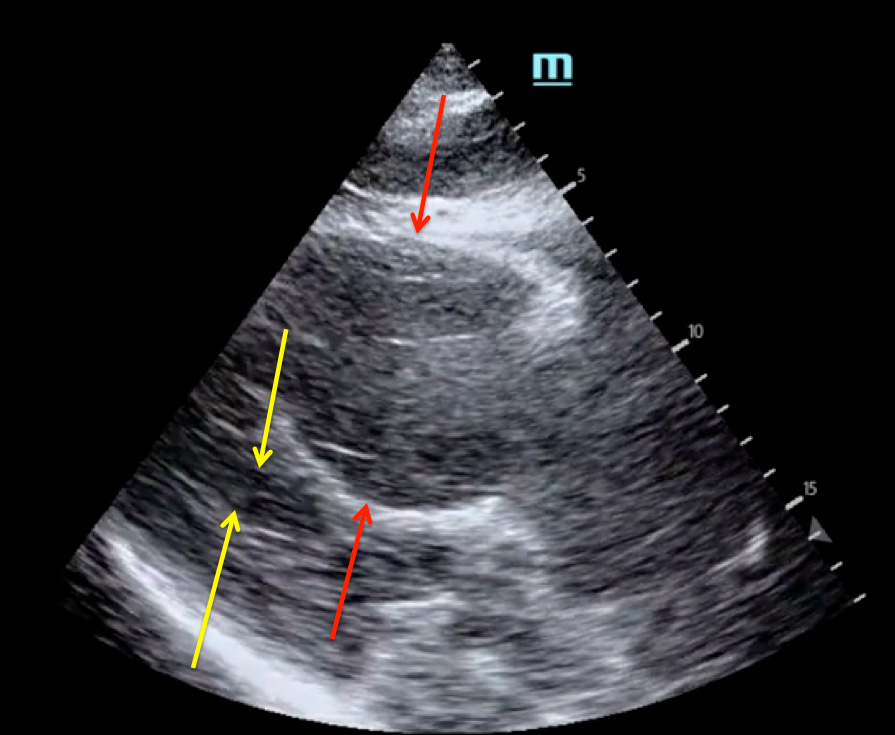
26. Шляхто Е.В., Конради А.О. Роль генетических факторов в ремоделировании сердечно-сосудистой системы при гипертонической болезни. Артер гиперт /media/gyper/02_03/107.shtml:: Sunday, 25-Aug-2002 18:47:01 MSD.
27. Nunez DJR, Clifford CP, Al-Mahdawi S, Dutka D. Hypertensive cardiac hypertrophy – is genetic variance the missing link? Br J clin pharmac 1996; 42: 99-106.
28. Целуйко В.И. Гипертрофия миокарда левого желудочка при артериальной гипертензии. HTML. Solvay.farm/ru.
29. Моисеев В.С. Достижения и спорные вопросы в изучении кардиомиопатии и миокардитов. Практ врач: Прил к журн «Медикал маркет» 1996; 4: 4-10.
30. Busiahn A, Li GH, Faulhaber HD, et al. Beta-2-adrenegic receptor gene variations, blood pressure and heart size in normal twins. Hypertension 2000; 35: 555-603.
Busiahn A, Li GH, Faulhaber HD, et al. Beta-2-adrenegic receptor gene variations, blood pressure and heart size in normal twins. Hypertension 2000; 35: 555-603.
31. Simpson PC. Molecular mechanisms in myocardial hypertrophy. Heart Failure 1989; 5(3): 113-29.
32. Lee YA, Lindpaintner K. Role of the cardiac renin-angiotensin system in hypertensive cardiac hypertrophy. Eur Heart J 1993; 14(Suppl. J): 42-8.
33. Карпов Ю.А. Блокаторы ангиотензиновых рецепторов: обоснование нового направления в современной кардиологии. РМЖ 2000; 8(5): 214-7.
34. Сидоренко Б.А, Преображенский В.В., Сополева Ю.В. Лазартан – первый представитель нового класса гипотензивных препаратов. Кардиология 1996; 1: 84-9.
35. Horiuchi M. Tyrosine phosphatase activation mediates the angiotensin II type receptor induction of apoptosis. J Hypertens 1996; l4: 733-40.
36. Кисляк О.А. Оптимальная блокада ренин-ангиотензин- альдостероновой системы: современные принципы лечения артериальной гипертензии блокаторами ангиотензиновых рецепторов. Фарматека 2005; 20: 34-9.
37. De Rosa ML, Cardace P, Rossi M, et al. Comparative effects of chronic ACE inhibition and AT1 receptor blocked losartan on cardiac hypertrophy and renal function in hypertensive patients. J Hum Hypertens 2002; 16: 133-40.
38. Чихладзе Н.М., Чазова И.Е. Эффективность воздействия блокатора АТ1-ангиотензиновых рецепторов ирбесартана на органы-мишени у больных артериальной гипертонией.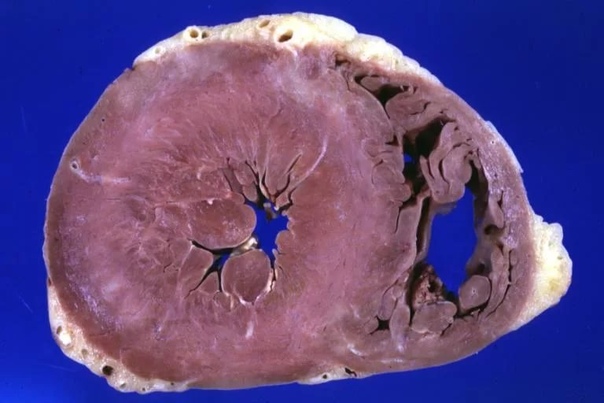 Сист гиперт 2004; 06(2).
Сист гиперт 2004; 06(2).
39. Parving H-H, Osterby R, Ritz E, et al. The effect of irbesartan on the development of diabetic nephropathy in patients with type 2 diabetes. N Engl J Med 2001; 20(345) 12: 870-8.
40. Lindholm LH, Ibsen H, Dahlof B, et al. Cardiovascular morbidity and mortality in patients with diabetes in the Losartan Intervention for Endpoint Reduction in Hypertension study (LIFE): a randomized trial against atenolol. Lancet 2002; 359: 1004-10.
41. Lewis EJ, Hunsicker LG, Clarke WR, et al. Renoprotective effects of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes. N Engl J Med 2001; 20(345) 12: 851-60.
42. Malmqist K, Kohaner T, Edner M, et al. Regression of ventricular hypertrophy in human hypertention with irbesartan. J Hypertens 2001; 19(6): 1167-76.
Regression of ventricular hypertrophy in human hypertention with irbesartan. J Hypertens 2001; 19(6): 1167-76.
43. Kurland L, Melhus H, Karlsson J, et al. Aldosterone synthase (CYP11B2) -344 C/T polymorphism is related to antihypertensive response: result from the Swedish Irbesartan Left Ventricular Hypertrophy Investigation versus Atenolol (SILVHIA) trial. Am J Hypertens 2002; 15(5): 389-93.
44. Kurland L, Melhus H, Karlsson J, et al. Swedish Irbesartan Left Ventricular Hypertrophy Investigation versus Atenolol (SILVHIA) Trial. Angiotensin converting enzyme gene polymorphism predicts blood pressure response to angiotensin II receptor type 1 antagonist treatment in hypertensive patients. J Hypertens 2001; 19(10): 1783-7.
45. Mellen P.B., Herrington D. M. Pharmacogenomics of blood pressure response to antihypertensive treatment. J Hypertens 2005; 23: 1311-25.
M. Pharmacogenomics of blood pressure response to antihypertensive treatment. J Hypertens 2005; 23: 1311-25.
46. Мареев В.Ю., Овчинников А.Г., Агеев Ф.Т., Беленков Ю.Н. Влияние ингибиторов АПФ и антагонистов рецепторов к ангиотензину-II на диастолическую функцию левого желудочка у пациентов с сердечной недостаточностью и относительно сохранной систолической функцией левого желудочка: результаты исследования «Периндоприл, ИРбесартан и АмлодипиН у болЬных с ХСН и сохраненной систолической функцией левого желудочка (ПИРАНЬЯ)». ЖСН 2005; 6(1).
47. Results of a new study show that irbesartan may provide additional benefits for high risk patients with high blood pressure. News Release Thursday 16 May 2002. www/ prnewswire.co.uk.
48. McKenna WJ, Behr ER. Hypertrophic cardiomyopathy: management, risk stratification, and prevention of sudden death. Heart 2002; 87: 169-76.
Heart 2002; 87: 169-76.
49. Expert consensus document on angiotensin converting enzyme inhibitors in cardiovascular disease The Task Force on ACE- inhibitors of the European Society of Cardiology. Eur Heart J 2000; 25(16): 1454-70.
50. McKenna WJ, Sharma S, Elliot PM. Management strategies in hypertrophic cardiomyopathy: influence of age and morphology. Eur Heart J 2004; 3(Suppl L): L10-4.
51. Nugent AW, Daubeney PEF, Chondros P, MSc Clinical Features and Outcomes of Childhood Hypertrophic Cardiomyopathy. Results From a National Population-Based Study. Circulation 2005; 112: 1332-8.
52. Marian A, Roberts R. The molecular genetic basis for hypertrophic cardiomyopathy. J Mol Cell Cardiol 2001: 33: 655-70.
53. Wigle ED, Adelman AG, Silver MD. Pathophysiological consideration in muscular subaortic stenosis.In Wolstenholme GEW, O’Connor M/eds/: Hypertrophic Obstructive Cardiomyopathy. London, UK: Churchill 1971: 63-70.
54. Гуревич М.А Является ли консервативная терапия гипертрофической кардиомиопатии альтернативой хирургическому лечению? РКЖ 2001; 3.
55. Lim DS. Lutucuta S, Bachireddy P, et al. Angiotensin II blockade reverses myocardial fibrosis in a transgenic mouse model of human hypertrophic cardiomyopathy. Circulation 2001; 103(6):789-91.
Гипертрофия левого желудочка неясной этиологии. Клиническая фармакология и терапия
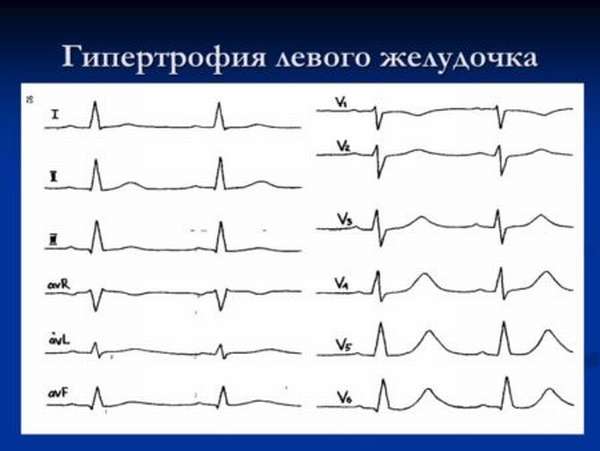
С.В. Моисеев. Гипертрофия левого желудочка (ГЛЖ) часто встречается в практике кардиолога. Она может быть заподозрена на основании ЭКГ, однако более надежными методами оценки массы миокарда являются эхокардиография и особенно магнитно-резонансная томография (МРТ). При эхокардиографии критерием ГЛЖ считают увеличение индекса массы миокарда левого желудочка, соответственно, >115 г/м2 у мужчин и >95 г/м2 у женщин (с поправкой на площадь поверхности тела) или >50 г/м2,7 у мужчин и >47 г/м2,7 у женщин (с поправкой на рост) [1], а при МРТ – >85 г/м2 у мужчин и >81 г/м2 у женщин [2]. В зависимости от относительной толщины стенки (ОТС) левого желудочка [(2 × толщина задней стенки)/ конечный диастолический размер левого желудочка] выделяют концентрическую (ОТС≥0,43) и эксцентрическую (ОТС<0,43) ГЛЖ. Учитывая возможную неоднородность утолщения левого желудочка, в частности асимметричное увеличение толщины межжелудочковой перегородки или верхушки левого желудочка, при диагностике ГЛЖ следует учитывать увеличение толщины перегородки или стенки ≥12 мм.
Она может быть заподозрена на основании ЭКГ, однако более надежными методами оценки массы миокарда являются эхокардиография и особенно магнитно-резонансная томография (МРТ). При эхокардиографии критерием ГЛЖ считают увеличение индекса массы миокарда левого желудочка, соответственно, >115 г/м2 у мужчин и >95 г/м2 у женщин (с поправкой на площадь поверхности тела) или >50 г/м2,7 у мужчин и >47 г/м2,7 у женщин (с поправкой на рост) [1], а при МРТ – >85 г/м2 у мужчин и >81 г/м2 у женщин [2]. В зависимости от относительной толщины стенки (ОТС) левого желудочка [(2 × толщина задней стенки)/ конечный диастолический размер левого желудочка] выделяют концентрическую (ОТС≥0,43) и эксцентрическую (ОТС<0,43) ГЛЖ. Учитывая возможную неоднородность утолщения левого желудочка, в частности асимметричное увеличение толщины межжелудочковой перегородки или верхушки левого желудочка, при диагностике ГЛЖ следует учитывать увеличение толщины перегородки или стенки ≥12 мм.
У подавляющего большинства пациентов причиной ГЛЖ является перегрузка сердца давлением или объемом при артериальной гипертонии или пороках сердца, прежде всего аортальных, однако у части больных очевидные причины ГЛЖ отсутствуют. Распространенность необъяснимой ГЛЖ у взрослых в общей популяции составляет 0,02-0,23% [3]. Отсутствие явных причин гипертрофии миокарда обычно служит основанием для установления диагноза гипертрофической кардиомиопатии (ГКМП), хотя у 5-10% пациентов ГЛЖ неясной этиологии обусловлена другими генетическими и негенетическими заболеваниями, в том числе лизосомными болезнями накопления (болезни Фабри, Данона, Помпе), ATTR- и AL-амилоидозом, нейромышечными заболеваниями (атаксия Фридрейха), митохондриальными кардиомиопатиями и др. Своевременная диагностика некоторых из них, в частности болезней Фабри и Помпе, AL- и ATTR-амилоидоза, имеет важное практическое значение, учитывая возмож ность патогенетического лечения. При проведении дифференциального диагноза следует учитывать возраст пациента, выраженность ГЛЖ и клинических симптомов, наличие семейного анамнеза и различных экстракардиальных проявлений. Некоторые генетические заболевания, например, болезнь Фабри и ATTR-амилоидоз, иногда удается диагностировать только с помощью скрининговых исследований.
Распространенность необъяснимой ГЛЖ у взрослых в общей популяции составляет 0,02-0,23% [3]. Отсутствие явных причин гипертрофии миокарда обычно служит основанием для установления диагноза гипертрофической кардиомиопатии (ГКМП), хотя у 5-10% пациентов ГЛЖ неясной этиологии обусловлена другими генетическими и негенетическими заболеваниями, в том числе лизосомными болезнями накопления (болезни Фабри, Данона, Помпе), ATTR- и AL-амилоидозом, нейромышечными заболеваниями (атаксия Фридрейха), митохондриальными кардиомиопатиями и др. Своевременная диагностика некоторых из них, в частности болезней Фабри и Помпе, AL- и ATTR-амилоидоза, имеет важное практическое значение, учитывая возмож ность патогенетического лечения. При проведении дифференциального диагноза следует учитывать возраст пациента, выраженность ГЛЖ и клинических симптомов, наличие семейного анамнеза и различных экстракардиальных проявлений. Некоторые генетические заболевания, например, болезнь Фабри и ATTR-амилоидоз, иногда удается диагностировать только с помощью скрининговых исследований. Ниже будут рассмотрены наиболее распространенные причины ГЛЖ неясной этиологии.
Ниже будут рассмотрены наиболее распространенные причины ГЛЖ неясной этиологии.
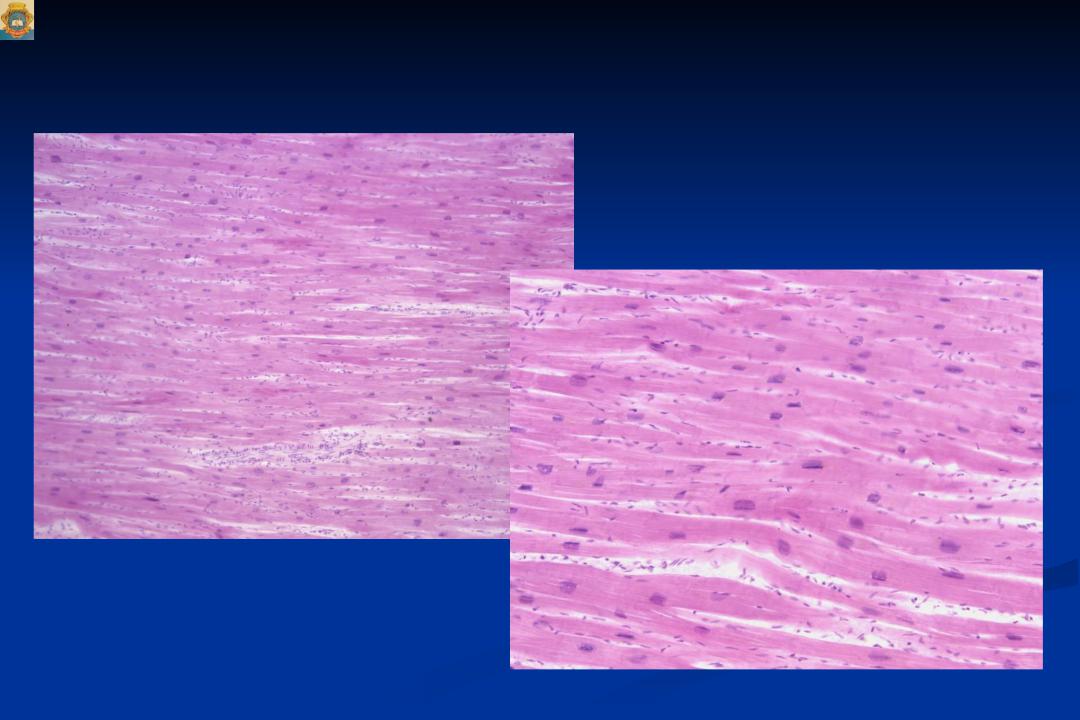
Е.В. Привалова. ГКМП – это наследственное заболевание, которое передается по аутосомно-доминантному типу [4]. В соответствии с рекомендациями Евро пейского общества кардиологов 2014 г., ГКМП может быть диагностирована при наличии гипертрофии миокарда ≥15 мм по крайней мере в одном сегменте левого желудочка, которую нельзя объяснить другими причинами, а у родственников пациента с установленным диагнозом – при наличии гипертрофии миокарда ≥13 мм [3]. Гипертрофия миокарда при ГКМП может быть как асимметричной (рис. 1), так и симметричной. У 4060% пациентов с ГКМП определяются мутации генов, кодирующих белки саркомеров сердца, прежде всего тяжелой цепи бета-миозина (MYH7) и миозин-связывающего белка С (MYBPC3). Реже встречаются мутации генов, кодирующих тропонины I и T (TNNI3, TNNT2), α1-цепи тропомиозина (TPM1) и легкой цепи миозина 3 (MYL3). В целом у пациентов с мутациями генов саркомерных белков выше частота семейного анамнеза ГКМП и внезапной смерти и отмечаются более выраженные ГЛЖ и миокардиальный фиброз, чем у пациентов без мутаций [5]. При обследовании пациента важно оценить наличие обструкции выносящего тракта левого желудочка [6]. Критерием ее является градиент давления в выносящем тракте, который измеряют допплеровским методом, ≥30 мм рт. ст. в покое или после провокационных проб (проба Вальсальвы, физическая нагрузка). Гемодинамически значимым считают увеличение этого показателя ≥50 мм рт. ст. [3].
При обследовании пациента важно оценить наличие обструкции выносящего тракта левого желудочка [6]. Критерием ее является градиент давления в выносящем тракте, который измеряют допплеровским методом, ≥30 мм рт. ст. в покое или после провокационных проб (проба Вальсальвы, физическая нагрузка). Гемодинамически значимым считают увеличение этого показателя ≥50 мм рт. ст. [3].
В.Ю. Каплунова. Пациент К., 45 лет, обследован в клинике госпитальной терапии имени А.А. Остроумова в октябре 2018 г. Старший брат пациента внезапно умер в возрасте 54 лет. ГКМП была диагностирована у другого брата, умершего в возрасте 54 лет, и 29-летней дочери пациента. С 18-летнего возраста у больного выслушивался систолический шум по левому краю грудины при отсутствии клинических проявлений и хорошей переносимости физической нагрузки. В возрасте 27 лет появились одышка, сердцебиение, перебои в работе сердца, головокружение и дурнота, дискомфорт в области сердца при умеренной физической нагрузке. В возрасте 33 лет обнаружена асимметричная ГЛЖ (толщина межжелудочковой перегородки – 20 мм, задней стенки – 12 мм) с признаками обструкции выносящего тракта левого желудочка и градиентом давления в покое 45 мм рт. ст. Диагностирована обструктивная форма ГКМП. С 44-летнего возраста отмечает пароксизмы фибрилляции предсердий с последующим переходом аритмии в постоянную форму. При эхокардиографии было выявлено нарастание гипертрофии межжелудочковой перегородки до 31 мм и увеличение градиента давления до 94 мм рт. ст. в покое. В Научном центре сердечно-сосудистой хирургии им. А.Н. Баку ле ва выполнена миэктомия доступом из правого желудочка, которая привела к уменьшению степени обструкции выносящего тракта левого желудочка и диастолической дисфункции. При молекулярно-генетическом исследовании у пробанда и его дочери выявлена миссенс мутация в 22 экзоне гена, кодирующего тяжелую цепь β миозина (MYHT A870C).
В возрасте 33 лет обнаружена асимметричная ГЛЖ (толщина межжелудочковой перегородки – 20 мм, задней стенки – 12 мм) с признаками обструкции выносящего тракта левого желудочка и градиентом давления в покое 45 мм рт. ст. Диагностирована обструктивная форма ГКМП. С 44-летнего возраста отмечает пароксизмы фибрилляции предсердий с последующим переходом аритмии в постоянную форму. При эхокардиографии было выявлено нарастание гипертрофии межжелудочковой перегородки до 31 мм и увеличение градиента давления до 94 мм рт. ст. в покое. В Научном центре сердечно-сосудистой хирургии им. А.Н. Баку ле ва выполнена миэктомия доступом из правого желудочка, которая привела к уменьшению степени обструкции выносящего тракта левого желудочка и диастолической дисфункции. При молекулярно-генетическом исследовании у пробанда и его дочери выявлена миссенс мутация в 22 экзоне гена, кодирующего тяжелую цепь β миозина (MYHT A870C).
Представленное наблюдение иллюстрирует типичные проявления и течение ГКМП: асимметричная гипертрофия межжелудочковой перегородки, которая была выявлена в молодом возрасте, медленно нарастала и длительное время не сопровождалась клиническими симптомами, в частности застойной сердечной недостаточностью, обструкция выносящего тракта левого желудочка с высоким градиентом давления в его полости, семейный анамнез (диагноз ГКМП и/или случаи внезапной сердечной смерти у близких родственников), мутация гена, кодирующего саркомерный белок, которая была обнаружена как у пробанда, так и его дочери. Лечение ГКМП обычно начинают с β-адреноблокаторов, не обладающих вазодилатирующей активностью, которые уменьшают градиент давления в полости левого желудочка и клинические симптомы. При их неэффективности могут быть использованы дизопирамид или верапамил. При выраженной гипертрофии межжелудочковой перегородки и высоком градиенте давления в левом желудочке может быть выполнена миэктомия, которая более чем в 90% случаев позволяет ликвидировать или значительно уменьшить обструкцию выносящего тракта, улучшить переносимость физической нагрузки и выживаемость [7].
Лечение ГКМП обычно начинают с β-адреноблокаторов, не обладающих вазодилатирующей активностью, которые уменьшают градиент давления в полости левого желудочка и клинические симптомы. При их неэффективности могут быть использованы дизопирамид или верапамил. При выраженной гипертрофии межжелудочковой перегородки и высоком градиенте давления в левом желудочке может быть выполнена миэктомия, которая более чем в 90% случаев позволяет ликвидировать или значительно уменьшить обструкцию выносящего тракта, улучшить переносимость физической нагрузки и выживаемость [7].
Е.В. Привалова. Дифференциальная диагностика ГКМП с другими заболеваниями, сопровождающимися ГЛЖ, может представлять трудности, например, при наличии умеренной гипертрофии миокарда, особенно симметричной, не сопровождающейся обструкцией выносящего тракта левого желудочка, и при отсутствии семейного анамнеза. Мутации генов саркомерных белков определяются не у всех пациентов с ГКМП, а у части больных с необъяснимой ГЛЖ молекулярно-генетическое исследование не проводится по экономическим причинам. Следует учитывать, что асимметричная гипертрофия межжелудочковой перегородки, характерная для ГКМП, встречается и при других заболеваниях, в том числе вторичной гипертрофии миокарда при артериальной гипертонии. Причиной ГЛЖ могут быть не только перегрузка левого желудочка давлением, но и физические тренировки, хотя в крупном исследовании увеличение толщины стенки левого желудочка более 12 мм было выявлено всего у 1,7% из 947 спортсменов, занимающихся различными видами спорта, а толщина стенки не превышала 16 мм. Более частым эхокардиографическим признаком “сердца спортсмена» была дилатация полости левого желудочка, которая определялась в 38% случаев [8]. Важное значение для диагностики некоторых заболеваний, сопровождающихся ГЛЖ, имеет тщательный анализ клинической картины, позволяющий выявить те или иные экстракардиальные проявления болезни, которые отсутствуют при ГКМП. Проведение биопсии миокарда для подтверждения диагноза ГКМП не требуется, однако гистологическое исследование может быть обоснованным для исключения инфильтративных заболеваний, сопровождающихся утолщением стенки левого желудочка.
Следует учитывать, что асимметричная гипертрофия межжелудочковой перегородки, характерная для ГКМП, встречается и при других заболеваниях, в том числе вторичной гипертрофии миокарда при артериальной гипертонии. Причиной ГЛЖ могут быть не только перегрузка левого желудочка давлением, но и физические тренировки, хотя в крупном исследовании увеличение толщины стенки левого желудочка более 12 мм было выявлено всего у 1,7% из 947 спортсменов, занимающихся различными видами спорта, а толщина стенки не превышала 16 мм. Более частым эхокардиографическим признаком “сердца спортсмена» была дилатация полости левого желудочка, которая определялась в 38% случаев [8]. Важное значение для диагностики некоторых заболеваний, сопровождающихся ГЛЖ, имеет тщательный анализ клинической картины, позволяющий выявить те или иные экстракардиальные проявления болезни, которые отсутствуют при ГКМП. Проведение биопсии миокарда для подтверждения диагноза ГКМП не требуется, однако гистологическое исследование может быть обоснованным для исключения инфильтративных заболеваний, сопровождающихся утолщением стенки левого желудочка.
Е.А. Каровайкина. Болезнь Фабри – это редкое заболевание, которое характеризуется нарушением обмена гликофосфолипидов вследствие недостаточности или отсутствия лизосомного фермента – α-галактозидазы А [9]. Причиной дефицита этого фермента являются мутации гена GLA, расположенного на Х-хромосоме, поэтому типичные клинические проявления болезни Фабри наблюдаются чаще и более выражены у гемизиготных мужчин, однако они нередко встречаются и у гетерозиготных женщин. При классическом фенотипе болезни Фабри первые симптомы, в частности нейропатическая боль (эпизоды жгучей боли в кистях и стопах, возникающей при лихорадке, физической нагрузке, стрессе и быстрых изменениях температуры окружающей среды), ангиокератомы (поверхностные ангиомы, локализующиеся на передней брюшной стенке, в частности внутри или вокруг пупка, в паховой области, на ягодицах, верхних конечностях, губах; рис. 2), снижение или отсутствие потоотделения, желудочно-кишечные нарушения, появляются в детском или подростковом возрасте, а в возрасте 20-40 лет развивается поражение внутренних органов, в том числе сердца, почек (протеинурия и прогрессирующее снижение скорости клубочковой фильтрации) и центральной нервной системы (транзиторные ишемические атаки и инсульт).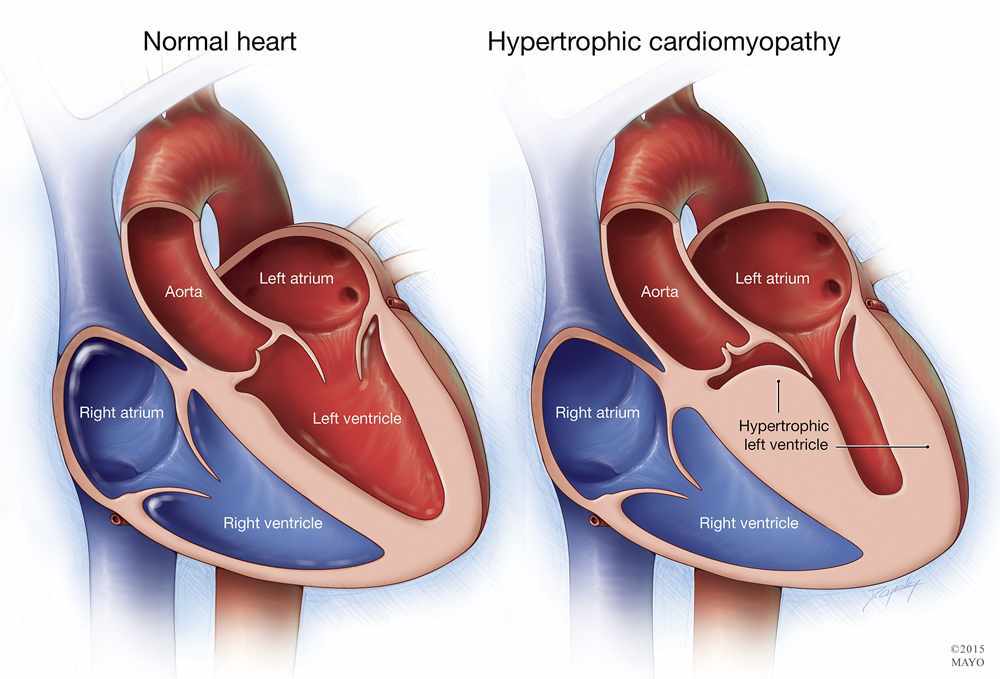 При атипичном “кардиальном» варианте заболевания ГЛЖ развивается в возрасте 40-50 лет и старше при отсутствии ранних симптомов. Результаты нескольких крупных скрининговых исследований свидетельствуют о том, что патогенные мутации гена GLA, ассоциирующиеся с развитием болезни Фабри, могут быть обнаружены у 0,5-1% пациентов с диагнозом ГКМП [10].
При атипичном “кардиальном» варианте заболевания ГЛЖ развивается в возрасте 40-50 лет и старше при отсутствии ранних симптомов. Результаты нескольких крупных скрининговых исследований свидетельствуют о том, что патогенные мутации гена GLA, ассоциирующиеся с развитием болезни Фабри, могут быть обнаружены у 0,5-1% пациентов с диагнозом ГКМП [10].
А.С. Моисеев. Иллюстрацией ГЛЖ, обусловленной болезнью Фабри, могут служить следующие два наблюдения. Пациент Л., 48 лет, был обследован в клинике им. Е.М. Тареева в октябре 2016 года. С 19 лет выраженная лимфедема нижних конечностей и снижение потоотделения. В возрасте 47 лет появились редкие боли за грудиной, не связанные с физической нагрузкой, а при эхокардиографии выявлено утолщение межжелудочковой перегородки и стенки левого желудочка до 14 мм при отсутствии дилатации камер сердца и нарушений систолической функции. Наблюдался у кардиолога с диагнозом ГКМП. Через 1 год при скрининге обнаружено снижение активности α-галактозидазы А в высушенных пятнах крови, увеличение уровня глобо триазилсфингозина (Lyso-GL3) до 117 нг/мл (в норме <1,8) и мутация в гене GLA (с. 145C>G), которые позволили установить диагноз болезни Фабри. На ЭКГ отмечались признаки ГЛЖ (рис. 3). При МРТ сердца наблюдались увеличение индекса массы миокарда левого желудочка до 123 г/м2 и признаки интрамиокардиального фиброза. Кроме того, имелись симптомы поражения почек – снижение расчетной скорости клубочковой фильтрации до 62 мл/мин/1,73 м2 при отсутствии протеинурии.
145C>G), которые позволили установить диагноз болезни Фабри. На ЭКГ отмечались признаки ГЛЖ (рис. 3). При МРТ сердца наблюдались увеличение индекса массы миокарда левого желудочка до 123 г/м2 и признаки интрамиокардиального фиброза. Кроме того, имелись симптомы поражения почек – снижение расчетной скорости клубочковой фильтрации до 62 мл/мин/1,73 м2 при отсутствии протеинурии.
Одновременно мы обследовали 67-летнюю мать пациента, у которой за 2 года до госпитализации в клинику также была выявлена необъяснимая ГЛЖ, сопровождавшаяся постоянной формой фибрилляции предсердий, частой желудочковой экстрасистолией и сердечной недостаточностью, в связи с чем принимала β-адреноблокаторы, мочегонные средства, дигоксин, антикоагулянты. При МРТ сердца определялись утолщение межжелудочковой перегородки (19 мм) и задней стенки левого желудочка (12 мм), увеличение индекса массы миокарда левого желудочка до 141 г/м2 и участки интрамиокардиального фиброза. При МРТ головного мозга выявлены многочисленные очаги в белом веществе, а при осмотре окулистом – воронковидная кератопатия, характерная для болезни Фабри, диагноз которой подтверждался результатами молекулярногенетического исследования (мутация с.145C>G), повышением уровня Lyso-GL3 до 23 нг/мл и снижением активности α-галактозидазы А. Пациент и его мать в течение 1,5 лет получают ферментозаместительную терапию.
При МРТ головного мозга выявлены многочисленные очаги в белом веществе, а при осмотре окулистом – воронковидная кератопатия, характерная для болезни Фабри, диагноз которой подтверждался результатами молекулярногенетического исследования (мутация с.145C>G), повышением уровня Lyso-GL3 до 23 нг/мл и снижением активности α-галактозидазы А. Пациент и его мать в течение 1,5 лет получают ферментозаместительную терапию.
Представленные наблюдения демонстрируют важность скрининга в диагностике болезни Фабри у пациентов с необъяснимой ГЛЖ, так как клинически заподозрить правильный диагноз было сложно в связи с отсутствием типичных ранних симптомов – нейропатической боли и ангиокератом. С целью диагностики болезни Фабри у мужчин необходимо определять активность α-галактозидазы А и/или уровень Lyso-GL3 в высушенных пятнах крови. У женщин активность фермента нередко остается нормальной или снижается незначительно, поэтому более информативным считают определение уровня Lyso-GL3. Для подтверждения диагноза проводят молекулярно-генетическое исследование с целью выявления патогенной мутации гена GLA (в Российской Федерации все эти исследования выполняются бесплатно).
Н.Р. Носова. При анализе клинической картины обращали на себя внимание позднее развитие ГЛЖ и наличие ее не только у пробанда, но и его матери. Как указано выше, поражение внутренних органов при болезни Фабри, в отличие от некоторых других наследственных болезней, у мужчин обычно отмечается в возрасте 30-40 лет, а у женщин – в более старшем возрасте. Наследование болезни Фабри сцеплено с Х-хромосомой, поэтому у матери пациента обычно наблюдаются те или иные проявления заболевания, хотя фенотип его может отличаться. У пробанда с 18-летнего возраста отмечались снижение потоотделения, которое встречается у большинства мужчин с болезнью Фабри, и лимфедема. По данным регистра Fabry Outcomes Survey (n=714), частота лимфедемы при этом заболевании составила 16% у мужчин и 6% у женщин [11]. У матери пробанда была выявлена вихревидная кератопатия (коричнево-золотистые отложения в роговице в виде волнообразных линий, исходящих из одной центральной точки), которая является одним из клинических критериев диагноза болезни Фабри. По нашим данным, частота вихревидной кератопатии у 69 взрослых пациентов с болезнью Фабри составила 65,2%, в том числе 56,4% у мужчин и 76,7% у женщин [12]. В отличие от ГКМП, гипертрофия миокарда как у пробанда, так и его матери была выражена умеренно и не сопровождалась обструкцией выносящего тракта левого желудочка. У взрослых пациентов с болезнью Фабри обычно наблюдается поражение не только сердца, но и почек (альбуминурия/протеинурия, снижение скорости клубочковой фильтрации) и головного мозга (очаговые изменения в белом веществе при МРТ, транзиторные ишемические атаки/инсульт).
По нашим данным, частота вихревидной кератопатии у 69 взрослых пациентов с болезнью Фабри составила 65,2%, в том числе 56,4% у мужчин и 76,7% у женщин [12]. В отличие от ГКМП, гипертрофия миокарда как у пробанда, так и его матери была выражена умеренно и не сопровождалась обструкцией выносящего тракта левого желудочка. У взрослых пациентов с болезнью Фабри обычно наблюдается поражение не только сердца, но и почек (альбуминурия/протеинурия, снижение скорости клубочковой фильтрации) и головного мозга (очаговые изменения в белом веществе при МРТ, транзиторные ишемические атаки/инсульт).
Е.А. Каровайкина. При болезни Фабри проводят заместительную терапию рекомбинантными препаратами α-галактозидазы А (агалсидазой альфа в дозе 0,2 мг/кг или агалсидазой бета в дозе 1 мг/кг), которые вызывают регресс ГЛЖ или по крайней мере замедляют прогрессирование кардиомиопатии. По данным D. Ger main и соавт., у пациентов с болезнью Фабри, начавших лечение в более молодом возрасте (18-30 лет), средняя масса миокарда левого желудочка снижалась на 3,6 г в год, в то время как без лечения у мужчин того же возраста она увеличивалась на 9,5 г в год (р<0,0001) [13].
В.В. Рамеев. Причиной утолщения стенок сердца мо жет быть не только гипертрофия кардиомиоцитов, но и инфильтрация миокарда нерастворимым фибриллярным гликопротеидом – амилоидом. В настоящее время известно около 30 амилоидогенных белков, однако более 95% случаев амилоидоза сердца обусловлены ALамилоидозом или реже транстиретиновым (ATTR) амилоидозом. AL-амилоидоз развивается при отложении моноклональных иммуноглобулинов у больных лимфоплазмаклеточными дискразиями, в том числе множественной миеломой. ATTR-амилоид (мутантный и дикого типа) образуется из транстиретина, синтезируемого в основном печенью и выполняющего функции транспортного белка тироксина и витамина А. Причи ной развития ATTR-амилоидоза дикого типа (стар ческого) считают возрастное снижение активности ферментных систем гепатоцитов, что приводит к пре имущественнои секреции нестабильных мономерных форм транстиретина, которые легко агрегируют в тканях с образованием амилоида. В основе наследственного ATTR-амилоидоза лежат мутации в гене TTR, сопровождающиеся синтезом транстиретина, который не способен образовывать тетрамеры и обладает очень высокой амилоидогенностью.
А.С. Рамеева. Пациентка Б., 50 лет, впервые обследована в клинике им. Е.М. Тареева в январе 2015 года. В течение года беспокоили боли в области сердца и нарастающая сердечная недостаточность. При эхокардиографии выявлено утолщение межжелудочковой перегородки и задней стенки левого желудочка до 14 мм, нарушение диастолической функции по рестриктивному типу. При коронарографии обнаружен умеренный стеноз правой коронарной артерии (50%). При обследовании в российском кардиологическом научном центре в декабре 2014 года определялись небольшая протеинурия (0,14 г/л), снижение вольтажа зубцов ЭКГ (рис. 4), увеличение толщины межжелудочковой перегородки и задней стенки левого желудочка до 18 мм, дилатация левого предсердия при отсутствии дилатации левого желудочка и снижения фракции выброса, при МРТ сердца – диффузное неравномерное субэндокардиальное накопление контрастного вещества. Выс ка зано предположение об амилоидозе, диагноз которого был подтвержден при биопсии миокарда. При исследовании крови методом Freelite отмечено резкое увеличение концентрации свободных легких цепей лямбда типа до 1383 мг/л (в норме 5,7-26,3 мг/л), указывавшее на наличие AL-амилоидоза. При трепанобиопсии диагностирована множественная миелома (увеличение числа плазматических клеток до 20%). Пациентке проводилась терапия бортезомибом, мелфаланом и дексаметазоном, на фоне которой нормализовалась концентрация свободных легких цепей лямбда типа и достигнута компенсация сердечной недостаточности.
При трепанобиопсии диагностирована множественная миелома (увеличение числа плазматических клеток до 20%). Пациентке проводилась терапия бортезомибом, мелфаланом и дексаметазоном, на фоне которой нормализовалась концентрация свободных легких цепей лямбда типа и достигнута компенсация сердечной недостаточности.
В.В. Рамеев. Таким образом, у пациентки был диагностирован AL-амилоидоз с поражением сердца в рамках множественной миеломы. Заподозрить амилоидоз сердца позволяли возраст пациентки, быстрое развитие тяжелой сердечной недостаточности, которая плохо поддавалась симптоматической терапии, эхокардиографические признаки рестриктивного поражения сердца (увеличение левого предсердия при отсутствии дилатации левого желудочка и снижения фракции выброса), симметричное утолщение межжелудочковой перегородки и стенки левого желудочка без обструкции выносящего тракта, снижение вольтажа зубцов комплекса QRS на ЭКГ. Последний признак отличает амилоидоз сердца от ГЛЖ, хотя истинное снижение амплитуды QRS (менее 5 мм в отведениях от конечностей и менее 10 мм в грудных отведениях) наблюдается только у половины больных AL-амилоидозом сердца [14]. Однако даже при отсутствии низкого вольтажа комплексов QRS следует учитывать возможное его несоответствие степени ГЛЖ при эхокардиографии. Важное диагностическое значение имеют результаты МРТ сердца, которая позволяет не только измерить массу миокарда левого желудочка, но и выявить диффузное накопление гадолиния в субэндокарде [15].
Последний признак отличает амилоидоз сердца от ГЛЖ, хотя истинное снижение амплитуды QRS (менее 5 мм в отведениях от конечностей и менее 10 мм в грудных отведениях) наблюдается только у половины больных AL-амилоидозом сердца [14]. Однако даже при отсутствии низкого вольтажа комплексов QRS следует учитывать возможное его несоответствие степени ГЛЖ при эхокардиографии. Важное диагностическое значение имеют результаты МРТ сердца, которая позволяет не только измерить массу миокарда левого желудочка, но и выявить диффузное накопление гадолиния в субэндокарде [15].
В представленном наблюдении диагноз был подтвержден при биопсии миокарда, хотя для гистологического исследования могут быть использованы и другие ткани, более доступные для биопсии, в том числе слизистая оболочка прямой или двенадцатиперстной кишки, подкожно-жировая клетчатка, почка. На наличие AL-амилоидоза указывала моноклональная секреция лямбда-цепей иммуноглобулинов, выявленная с помощью метода Freelite, а также снижение отношения каппа- и лямбда-цепей до 0,01 (для AL-амилоидоза характерна величина этого показателя <0,26 или >1,65). У 7-10% больных AL-амилоидоз развивается в рамках множественной миеломы, для исключения которой всем пациентам следует проводить биопсию костного мозга.
У 7-10% больных AL-амилоидоз развивается в рамках множественной миеломы, для исключения которой всем пациентам следует проводить биопсию костного мозга.
Данный случай демонстрирует возможность “изолированного» поражения сердца при AL-амилоидозе, хотя у большинства пациентов наблюдаются и другие проявления, в том числе протеинурия/нефротический синдром, увеличение печени и селезенки, макроглоссия, периорбитальная пурпура, диарея, невропатия и/или ортостатическая гипотензия. У пациентки имелась небольшая протеинурия, однако она могла быть связана с застоем крови по большому кругу кровообращения.
Современная химиотерапия, включающая в себя ингибитор протеасом бортезомиб, позволяет добиться полного или частичного гематологического ответа у значительной части больных AL-амилоидозом, предупредить отложение амилоида в других органах и прогрессирование сердечной недостаточности.
П.П. Тао. Пациент В., 65 лет, русский, был обследован в клинике им. Е.М. Тареева в декабре 2015 года. В течение трех лет отмечается нарастающее снижение болевой, температурной и тактильной чувствительности в области кистей и стоп по типу “перчаток» и “носков», а в течение одного года – прогрессирующая застойная сердечная недостаточность. При электромиографии выявлены грубые аксонально-демиелинизирующие нарушения, наиболее выраженные в малоберцовых нервах, а при эхокардиографии – картина рестриктивного поражения сердца: дилатация левого предсердия, утолщение стенок левого желудочка, зоны гипокинезии в межжелудочковой перегородке, уплотнение эндокарда, нормальная фракция выброса левого желудочка. Уровень мозгового натрийуретического пропептида был повышен в 30 раз по сравнению с верхней границей нормы. При коронарографии обнаружен стеноз передней межжелудочковой ветви (65%) и правой коронарной артерии (75%). Проведены чрескожная коронарная ангиопластика и стентирование правой коронарной артерии, однако после вмешательства сердечная недостаточность сохранялась, появилась ортостатическая артериальная гипотензия.
В течение трех лет отмечается нарастающее снижение болевой, температурной и тактильной чувствительности в области кистей и стоп по типу “перчаток» и “носков», а в течение одного года – прогрессирующая застойная сердечная недостаточность. При электромиографии выявлены грубые аксонально-демиелинизирующие нарушения, наиболее выраженные в малоберцовых нервах, а при эхокардиографии – картина рестриктивного поражения сердца: дилатация левого предсердия, утолщение стенок левого желудочка, зоны гипокинезии в межжелудочковой перегородке, уплотнение эндокарда, нормальная фракция выброса левого желудочка. Уровень мозгового натрийуретического пропептида был повышен в 30 раз по сравнению с верхней границей нормы. При коронарографии обнаружен стеноз передней межжелудочковой ветви (65%) и правой коронарной артерии (75%). Проведены чрескожная коронарная ангиопластика и стентирование правой коронарной артерии, однако после вмешательства сердечная недостаточность сохранялась, появилась ортостатическая артериальная гипотензия. По данным эхокардиографии, толщина межжелудочковой перегородки достигла 22 мм, определялись множественные очаги зернистости в миокарде, фракция выброса левого желудочка снизилась с 57% до 45%. При МРТ сердца с контрастированием гадолинием на фоне выраженного утолщения стенок левого желудочка отмечено циркулярное субэндокардиальное диффузное накопление контрастного вещества в миокарде левого и передней стенки правого желудочков (рис. 5). Проводилась повторная биопсия слизистой оболочки прямой кишки, однако амилоид выявить не удалось. При иммунохимическом исследовании исключена моноклональная секреция легких цепей иммуноглобулинов, характерная для AL-амилоидоза. При молекулярно-генетическом исследовании обнаружена мутация гена TTR (Val30Met), подтверждающая диагноз наследственного ATTR-амилоидоза. При сцинтиграфии миокарда с 99mTcPYP выявлено накопление радиоизотопного препарата 2 степени, в связи с чем от биопсии миокарда было решено воздержаться. С целью восстановления тетрамерной структуры мутантного транстиретина пациент в течение 2 лет получает тафамидис 20 мг/сут.
По данным эхокардиографии, толщина межжелудочковой перегородки достигла 22 мм, определялись множественные очаги зернистости в миокарде, фракция выброса левого желудочка снизилась с 57% до 45%. При МРТ сердца с контрастированием гадолинием на фоне выраженного утолщения стенок левого желудочка отмечено циркулярное субэндокардиальное диффузное накопление контрастного вещества в миокарде левого и передней стенки правого желудочков (рис. 5). Проводилась повторная биопсия слизистой оболочки прямой кишки, однако амилоид выявить не удалось. При иммунохимическом исследовании исключена моноклональная секреция легких цепей иммуноглобулинов, характерная для AL-амилоидоза. При молекулярно-генетическом исследовании обнаружена мутация гена TTR (Val30Met), подтверждающая диагноз наследственного ATTR-амилоидоза. При сцинтиграфии миокарда с 99mTcPYP выявлено накопление радиоизотопного препарата 2 степени, в связи с чем от биопсии миокарда было решено воздержаться. С целью восстановления тетрамерной структуры мутантного транстиретина пациент в течение 2 лет получает тафамидис 20 мг/сут.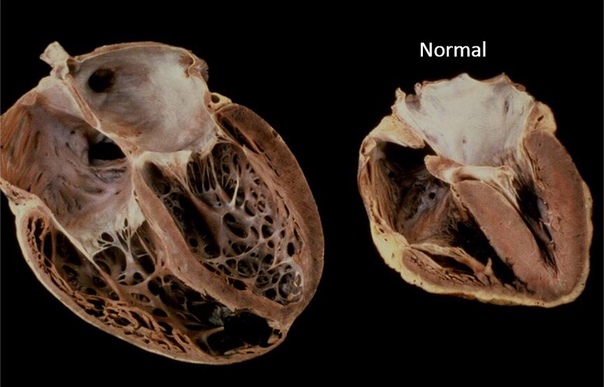 Переносимость лечения удовлетворительная, существенного прогрессирования амилоидоза не произошло.
Переносимость лечения удовлетворительная, существенного прогрессирования амилоидоза не произошло.
В.В. Рамеев. Как и в предыдущем наблюдении, заподозрить амилоидоз у 65-летнего пациента позволяло типичное рестриктивное поражение левого желудочка, характеризующееся развитием тяжелой сердечной недостаточности при отсутствии дилатации и существенного снижения фракции выброса левого желудочка. При эхокардиографии определялись множественные очаги зернистости, которые нередко выявляют у пациентов с амилоидной инфильтрацией миокарда, а при МРТ сердца – диффузное накопление гадолиния в субэндокарде. В пользу системного амилоидоза свидетельствовала и периферическая полиневропатия, которая встречается как при AL-, так и семейном ATTR-амилоидозе и может предшествовать поражению сердца. В большинстве случаев развивается неуклонно прогрессирующая, симметричная дистальная невропатия, начинающаяся с сенсорных расстройств, в первую очередь болевой и температурной чувствительности, с последующим присоединением нарушений вибрационной и позиционной чувствительности и двигательных нарушений.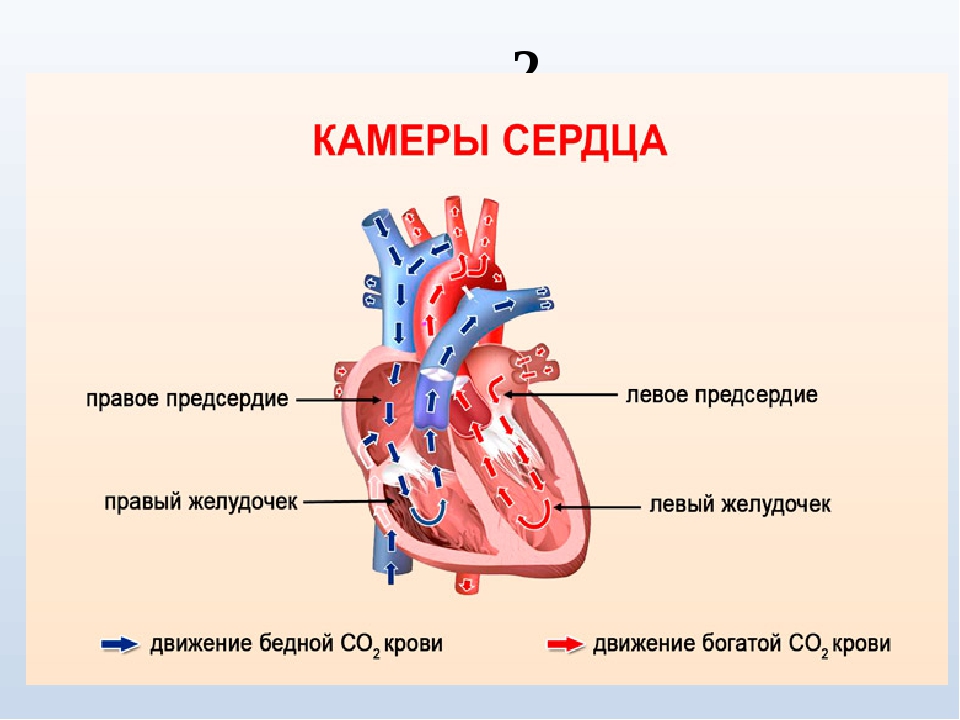 Ранними симптомами невропатии бывают парестезии или мучительные дизестезии. Часто встречается синдром запястного канала, проявляющийся болями и парестезиями в I-III пальцах кисти с постепенной атрофией мышц тенара и обусловленный сдавлением срединного нерва в запястном канале амилоидом, откладывающимся в связках запястья [16].
Ранними симптомами невропатии бывают парестезии или мучительные дизестезии. Часто встречается синдром запястного канала, проявляющийся болями и парестезиями в I-III пальцах кисти с постепенной атрофией мышц тенара и обусловленный сдавлением срединного нерва в запястном канале амилоидом, откладывающимся в связках запястья [16].
Учитывая отсутствие моноклональной секреции легких цепей иммуноглобулинов и наличие мутации гена TTR, был установлен диагноз наследственного ATTRамилоидоза [17]. Диагноз амилоидоза должен быть подтвержден при гистологическом исследовании, однако результаты повторной биопсии прямой кишки оказались отрицательными. Тем не менее, наличие ATTRамилоидоза не вызывало сомнения с учетом типичной клинической картины и результатов молекулярно-генетического исследования. Кроме того, при сцинтиграфии было выявлено накопление 99mTcPYP в миокарде 2 степени (т.е. умеренное накопление, соответствующее таковому в костной ткани). В 2016 году в многоцентровом исследовании было показано, что накопление в миокарде 99mTcPYP 2-3 степени (рис.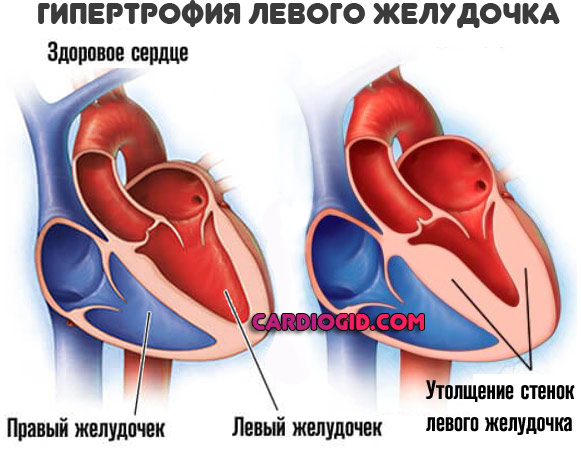 6) при отсутствии моноклональной гаммапатии обладает 100% специфичностью в диагностике ATTR-амилоидоза сердца и фактически позволяет отказаться от биопсии миокарда [18]. Более того, сцинтиграфия с 99mTcPYP дает возможность дифференцировать ATTR-амилоидоз от AL-амилоидоза, при котором накопление радиоактивного препарата в миокарде отсутствует или не превышает 1 степени.
6) при отсутствии моноклональной гаммапатии обладает 100% специфичностью в диагностике ATTR-амилоидоза сердца и фактически позволяет отказаться от биопсии миокарда [18]. Более того, сцинтиграфия с 99mTcPYP дает возможность дифференцировать ATTR-амилоидоз от AL-амилоидоза, при котором накопление радиоактивного препарата в миокарде отсутствует или не превышает 1 степени.
С середины 90-х годов ХХ века для лечения ATTRамилоидоза применяли трансплантацию печени, позволяющую восстановить синтез нормального транс тиретина. В последние годы более перспективной тактикой лечения считают медикаментозную стабилизацию тетрамерной структуры транстиретина и предотвращение образования амилоидогенных мономеров белка. Первый такой препарат – тафамидис – уже применяется в Европе и в Российской Федерации.
С.В. Моисеев. Представленные наблюдения иллюстрируют широкий спектр причин ГЛЖ неясной этиологии, которые включают в себя не только истинную гипертрофию миокарда, но и некоторые инфильтративные заболевания, такие как системный амилоидоз, имитирующие ГКМП. Разработать четкий алгоритм дифференциальной диагностики ГКМП достаточно сложно, учитывая вариабельность течения заболеваний, сопровождающихся ГЛЖ. Например, некоторые тяжелые генетические заболевания, такие как болезнь Помпе (гликогеноз II типа, связанный с дефицитом фермента кислой α-глюкозидазы в лизосомах), могут проявиться в возрасте 40-50 лет и старше, в то время как при системных заболеваниях, в том числе болезни Фабри или амилоидозе, экстракардиальные симптомы иногда отсутствуют. Ключевую роль в диагностике наследственных заболеваний, таких как ГКМП, ATTRамилоидоз, болезни Фабри, Помпе, Данона и др., играют изучение семейного анамнеза и молекулярногенетическое исследование.
Разработать четкий алгоритм дифференциальной диагностики ГКМП достаточно сложно, учитывая вариабельность течения заболеваний, сопровождающихся ГЛЖ. Например, некоторые тяжелые генетические заболевания, такие как болезнь Помпе (гликогеноз II типа, связанный с дефицитом фермента кислой α-глюкозидазы в лизосомах), могут проявиться в возрасте 40-50 лет и старше, в то время как при системных заболеваниях, в том числе болезни Фабри или амилоидозе, экстракардиальные симптомы иногда отсутствуют. Ключевую роль в диагностике наследственных заболеваний, таких как ГКМП, ATTRамилоидоз, болезни Фабри, Помпе, Данона и др., играют изучение семейного анамнеза и молекулярногенетическое исследование.
Психосоматические аспекты изучения гипертрофии левого желудочка у лиц с нормальным уровнем артериального давления | Бастриков
1. Джаиани Н.А. Кардиопротективные и нефропротективные эффекты ингибиторов ангиотензинпревращающего фермента.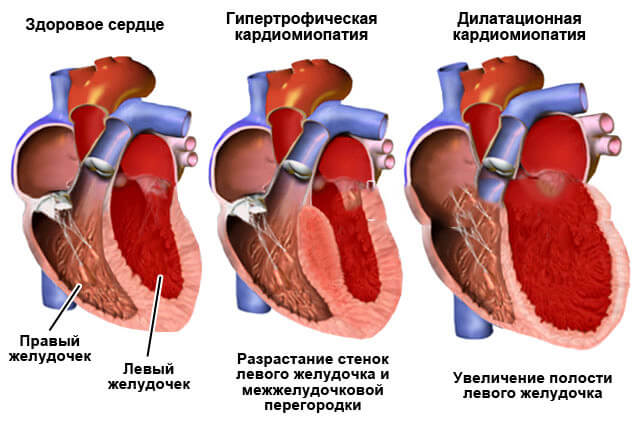 Русский медицинский журнал 2005; 13(27): 1858 – 1862. [Dzhaiani N.A. Cardioprotective and nephroprotective effects of angiotensin converting enzyme inhibitors. Russkiy meditsinskiy zhurnal = Russian medical journal. 2005; 13(27): 1858 – 62. In Russian].
Русский медицинский журнал 2005; 13(27): 1858 – 1862. [Dzhaiani N.A. Cardioprotective and nephroprotective effects of angiotensin converting enzyme inhibitors. Russkiy meditsinskiy zhurnal = Russian medical journal. 2005; 13(27): 1858 – 62. In Russian].
2. Сорокин А.В., Празднов А.С., Коровина О.В. Профессиональный стресс как фактор ремоделирования миокарда левого желудочка у лиц с нормальным артериальным давлением. Клиническая медицина 2007; 11: 39 – 42. [Sorokin A.V., Prazdnov A.S., Korovina O.V. Professional stress as a factor in remodeling of the left ventricle myocardium in individuals with normal blood pressure. Klinicheskaya meditsina = Clinical medicine 2007; 11: 39 – 42. In Russian].
3. Merchant EE, Johnson SW, Nguyen P, Kang C, Mallon WK. Takotsubo cardiomyopathy: a case series and review of the literature. WestJEM. 2008;9:104 – 11.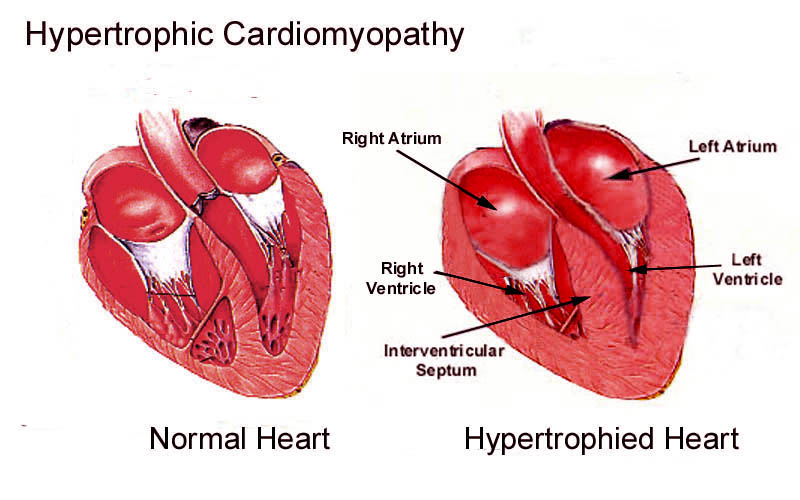
4. Прошина Л.Г., Федорова Н.П., Быкова О.С. Особенности гистохимической и иммуноцитохимической перестройки тканей сердца в процессе адаптации к экстремальным воздействиям. Вестник Новгородского государственного университета. 2010; 59:121 – 123. [Proshina L.G., Fedorova N.P., Bykova O.S. Features of histochemical and immunocytochemical rebuilding heart tissue in the process of adaptation to extreme influences. Vestnik Novgorodskogo gosudarstvennogo universiteta = Vestnik of Novgorod state University. 2010; 59:121 – 123. In Russian].
5. Devereux RB, Reichek N. Echocardiographic determination of left ventricular mass in man: anatomic validation of the method. Circulation. 1977;55:613 – 18.
6. Lang RM, Bierig M, Devereux RB, Flachskampf FA, Foster E, Pellikka PA et al. Рекомендации по количественной оценке структуры и функции камер сердца. Российский кардиологический журнал. Приложение 1. 2012;3:1 – 28. [Lang RM, Bierig M, Devereux RB, Flachskampf FA, Foster E, Pellikka PA et al. Recommendations for measurement of the structure and function of heart chambers // Rossijskij kardiologicheskij zhurnal = Russian Cardiology journal. App. 1. 2012; 95(3):1 – 28. In Russian].
Рекомендации по количественной оценке структуры и функции камер сердца. Российский кардиологический журнал. Приложение 1. 2012;3:1 – 28. [Lang RM, Bierig M, Devereux RB, Flachskampf FA, Foster E, Pellikka PA et al. Recommendations for measurement of the structure and function of heart chambers // Rossijskij kardiologicheskij zhurnal = Russian Cardiology journal. App. 1. 2012; 95(3):1 – 28. In Russian].
7. Ханин Ю.Л. Краткое руководство к применению шкалы реактивной и личностной тревожности Ч.Д. Спилбергера. Л.: ЛНИИ ФК; 1976. 18 с.
8. Андрющенко А.В., Дробижев М.Ю., Добровольский А.В. Сравнительная оценка шкал CES-D, BDI и HADS(d) в диагностике депрессий в общемедицинской практике. Журнал неврологии и психиатрии. 2003; 5: 11 — 18. [Andrjushhenko A.V., Drobizhev M.Ju., Dobrovol’skij A.V. Comparative assessment scales CES-D, BDI and HADS(d) in the diagnosis of depression in general practice.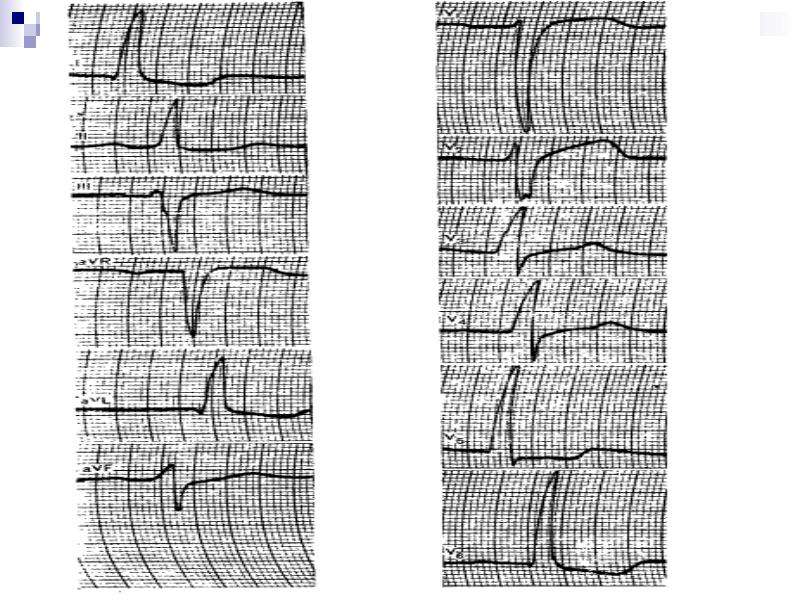 Zhurnal nevrologii i psihiatrii = Journal of neurology and psychiatry. 2003; 5: 11 — 18. In Russian].
Zhurnal nevrologii i psihiatrii = Journal of neurology and psychiatry. 2003; 5: 11 — 18. In Russian].
9. Вассерман Л.И., Иовлев Б.В., Беребин М.А. Методика для диагностики уровня социальной фрустрированности и её практическое применение: методические рекомендации. Спб.; 2004. 16 c.
10. Holmes Т, Rahe R. The Social Readjustment Rating Scale. J. of Psychosomatic Research. 1967; 11: 213 — 18.
11. Рубинштейн С.Я. Экспериментальные методики патопсихологии и опыт применения их в клинике: Практическое руководство. СПб.; 1998. 168 c.
12. Бастриков О.Ю. Модифицированные белки и их ассоциации с психоэмоциональными факторами у лиц с различным уровнем артериального давления. Российский физиологический журнал им.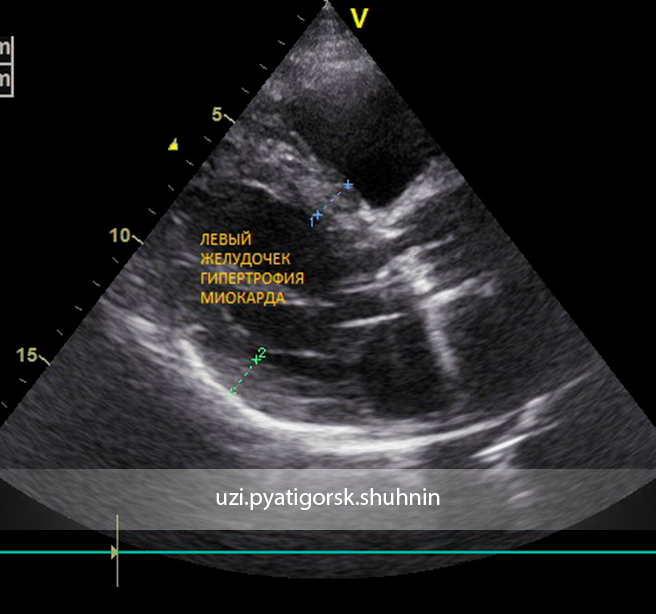 И.М. Сеченова. 2015; 101 (4): 462 — 467. [Bastrikov O.Yu. Modified proteins and their association with psychoemotional factors in patients with various degrees blood pressure // Rossijskij fiziologicheskij zhurnal im. I.M. Sechenova = Russian Journal of Physiology. 2015; 101 (4): 462-467. In Russian].
И.М. Сеченова. 2015; 101 (4): 462 — 467. [Bastrikov O.Yu. Modified proteins and their association with psychoemotional factors in patients with various degrees blood pressure // Rossijskij fiziologicheskij zhurnal im. I.M. Sechenova = Russian Journal of Physiology. 2015; 101 (4): 462-467. In Russian].
13. Бастриков О.Ю. Показатели липопротеинового обмена и их ассоциации с психоэмоциональными факторами у практически здоровых лиц. Российский медицинский журнал. 2015; 21 (1): 24 – 27. [Bastrikov O.Yu. The indicators of lipoprotein metabolism and their association with psycho-emotional factors in healthy individuals // Rossijskij medicinskij zhurnal = Russian Medical Journal. 2015; 21 (1): 24 – 27. In Russian].
14. Бастриков О.Ю., Белов В.В., Цейликман В.Э., Сумеркина В.А. Показатели эндотелиальной функции во взаимосвязи с психоэмоциональными факторами у практически здоровых лиц. Нейрохимия. 2014; 31 (2): 158 – 163. [Bastrikov O.Yu., Belov V.V., Tseilikman V.E., Sumerkina V.A. Indices of Endothelial Function and Their Relationships with Psychoemotional Factors in Practically Healthy People. Nejrohimija = Neurochemical Journal. 2014; 31 (2): 158 – 163. In Russian].
Нейрохимия. 2014; 31 (2): 158 – 163. [Bastrikov O.Yu., Belov V.V., Tseilikman V.E., Sumerkina V.A. Indices of Endothelial Function and Their Relationships with Psychoemotional Factors in Practically Healthy People. Nejrohimija = Neurochemical Journal. 2014; 31 (2): 158 – 163. In Russian].
15. Бастриков О.Ю., Белов В.В. Структурно – функциональные показатели сердца и сосудов во взаимосвязи с психоэмоциональными факторами у практически здоровых лиц. Академический журнал Западной Сибири. 2013; 9 (5): 70 – 74. [Bastrikov O.Yu., Belov V.V. Structural – functional parameters of the heart and blood vessels in correlation with psychoemotional factors in practically healthy individuals. Akademicheskij zhurnal Zapadnoj Sibiri = Academic journal of Western Siberia. 2013; 9 (5): 70 – 74. In Russian].
16. Palatini P. Sympathetic overactivity in hypertension: a risk factor for cardiovascular disease. Curr. at Hypertens. Rep. 2001; 3 (Suppl. 1): 53 – 9.
Curr. at Hypertens. Rep. 2001; 3 (Suppl. 1): 53 – 9.
17. Вебер В.Р., Рубанова М.П., Губская П.М., Карев В.Е., Жмайлова С.В., Евсеев М.Е. Воздействие больших и малых доз адреналина на ремоделирование миокарда левого и правого желудочков сердца крыс линии Вистар в хроническом эксперименте. Фундаментальные исследования. 2014; 10: 258 – 264. [Veber V.R., Rubanova M.P., Gubskaya P.M., Karev V.E., Zhmaylova S.V., Evseev M.E. Myocardial remodeling of the left and right ventricle of Wistar rats following chronic epinephrine administration in large and small doses. Fundamental’nye issledovanija = Fundamental Research. 2014; 10: 258 – 264. In Russian].
18. Hassellund SS, Flaa A, Sandvik L, Kjeldsen SE, Rostrup M. Long-term stability of cardiovascular and catecholamine responses to stress tests: an 18-year follow-up study. Hypertension. 2010; 55 (1): 131 – 6.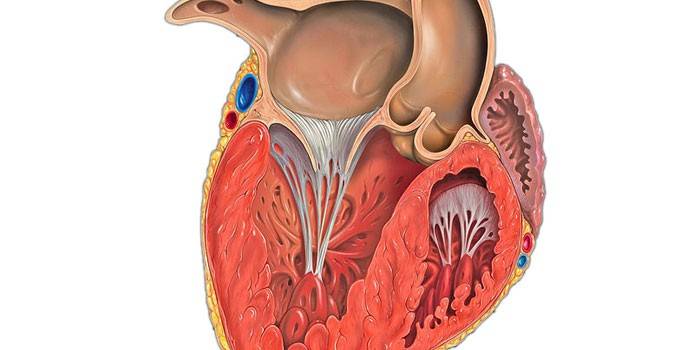 doi: 10.1161/HYPERTENSIONAHA.109.143164. Epub 2009 Nov 30.
doi: 10.1161/HYPERTENSIONAHA.109.143164. Epub 2009 Nov 30.
19. Чинкин А.С. Соотношения адреналин : норадреаналин и альфа — :бета – адренорецепторы в миокарде и адренергические хроно – и инотропные реакции при экстремальных состояниях и адаптации. Наука и спорт: современные тенденции. 2014; 4(3):10 – 18. [Chinkin A.S. The ratio of adrenaline : noradrenaline and alpha :beta – adrenergic receptors in the myocardium and adrenergic chronotropic and inotropic response in extreme conditions and adapt. Nauka i sport: sovremennye tendencii = Science and sport: current trends. 2014; 4 (3):10 – 18. In Russian].
20. Hamer M, Steptoe A. Cortisol responses to mental stress and incident hypertension in healthy men and women. J Clin Endocrinol Metab. 2012; 97(1): E29-34. doi: 10.1210/jc.2011-2132.
21. Dirnagl U, Meisel A. Endogenous neuroprotection: mitochondria as gateways to cerebral preconditioning? Neuropharmacology. 2008; 55 (3): 334 – 44.
Dirnagl U, Meisel A. Endogenous neuroprotection: mitochondria as gateways to cerebral preconditioning? Neuropharmacology. 2008; 55 (3): 334 – 44.
22. Шмонин А.А., Лазарева Н.М., Стукова Л.Н. Исследование системы инсулиноподобного фактора роста у пациентов с атеросклеротическии стенозами сонных артерий. Клинико – лабораторный консилиум. 2013; 46 (2 – 3): 45 – 49. [Shmonin A.A., Lazareva N.M., Stukova L.N. The system study insulin-like growth factor in patients with atherogenic stenosis of carotid arteries // Kliniko – laboratornyj konsilium = Clinical laboratory consilium. 2013; 46 (2-3): 45 – 49. In Russian].
23. Hua Y, Zhang Y, Ren J. IGF-1 deficiency resists cardiac hypertrophy and myocardial contractile dysfunction: role of microRNA-1 and microRNA-133a. J. Cell. Mol. Med. 2012; 16(1): 83 – 95. doi: 10.1111/j.1582-4934.2011.01307. x.
x.
24. Sesti G, Sciacqua A, Scozzafava A, Vatrano M, Angotti E, Ruberto C et al. Effects of growth hormone and insulin-like growth factor-1 on cardiac hypertrophy of hypertensive patients. J. Hypertens. 2007; 25(2):471 – 7.
Гипертрофия левого желудочка сердца — Free Floating
Гипертрофия левого желудочка сердца
В современном понимании, гипертрофия левого желудочка сердца — симптомокомплекс нескольких состояний, как патологических, так и физиологических. Он характеризуется наличием чрезмерного увеличения стенок левого желудочка, с сохранением нормального объёма его полости.
Нормальная анатомия и физиология левого желудочка
Объём полости левого желудочка здорового сердца колеблется от 140 до 210 кубических сантиметров. Это составляет 27-30% от всех сердечных камер. В состав стенки левого желудочка входят три ряда поперечно-полосатых мышечных волокон, с расположенными между ними соединительнотканными клетками и основным веществом. Соотношение мышц и соединительной ткани составляет 4 к 1. А толщина миокарда не превышает 14 мм на верхушке, 4 мм на межжелудочковой перегородке и 9-11 мм на боковой и задней стенках. Данные параметры (за исключением объёма полости) являются наибольшими по сравнению с другими отделами сердца. В первую очередь, это связано с исключительной ролью левого желудочка сердца — обеспечение тока крови по большому кругу кровообращения. Во время систолы его стенки, сокращаясь, выталкивают кровь в аорту и далее по большому кругу кровообращения. Когда наступает расслабление левого желудочка, кровь из левого предсердия поступает в него. Для желудочка больше всего характерен закон Франка-Старлинга: чем больше растягиваются стенки сердца, тем сильнее их сокращение.
Соотношение мышц и соединительной ткани составляет 4 к 1. А толщина миокарда не превышает 14 мм на верхушке, 4 мм на межжелудочковой перегородке и 9-11 мм на боковой и задней стенках. Данные параметры (за исключением объёма полости) являются наибольшими по сравнению с другими отделами сердца. В первую очередь, это связано с исключительной ролью левого желудочка сердца — обеспечение тока крови по большому кругу кровообращения. Во время систолы его стенки, сокращаясь, выталкивают кровь в аорту и далее по большому кругу кровообращения. Когда наступает расслабление левого желудочка, кровь из левого предсердия поступает в него. Для желудочка больше всего характерен закон Франка-Старлинга: чем больше растягиваются стенки сердца, тем сильнее их сокращение.
Механизмы гипертрофии
Для того, чтобы миокард начал во взрослом состоянии увеличиваться в размере, необходимо соблюдение одного из двух условий: перегрузка объёмом приводит к большему, чем обычно, расширению полости. Это значит, что во время систолы миокард должен сокращаться сильнее. Как известно, нагрузка на левый желудочек является максимальной. Перегрузка давлением означает, что для изгнания крови необходимо более сильное мышечное сокращение. Обе ситуации способствуют увеличению толщины миофибрилл кардиомиоцитов — сократительных волокон. Одновременно запускаются механизмы увеличения соединительной ткани. Только в первом случае, кроме наращивания мышечной массы, сердцу необходимо увеличение способности к большему расширению. Значит, развитие коллагена (основного белка соединительной ткани) идет быстрее. Вот и выходит, что гипертрофия практически всегда приводит к нарушению нормального строения миокарда. Увеличение соединительной ткани опережает гипертрофию кардиомиоцитов. В результате доля коллагена начинает превышать процент миоцитов. И чем быстрее идёт процесс гипертрофии, тем быстрее снижается их соотношение. Единственным исключением является медленный темп гипертрофии при адекватной физической тренировке организма.
Как известно, нагрузка на левый желудочек является максимальной. Перегрузка давлением означает, что для изгнания крови необходимо более сильное мышечное сокращение. Обе ситуации способствуют увеличению толщины миофибрилл кардиомиоцитов — сократительных волокон. Одновременно запускаются механизмы увеличения соединительной ткани. Только в первом случае, кроме наращивания мышечной массы, сердцу необходимо увеличение способности к большему расширению. Значит, развитие коллагена (основного белка соединительной ткани) идет быстрее. Вот и выходит, что гипертрофия практически всегда приводит к нарушению нормального строения миокарда. Увеличение соединительной ткани опережает гипертрофию кардиомиоцитов. В результате доля коллагена начинает превышать процент миоцитов. И чем быстрее идёт процесс гипертрофии, тем быстрее снижается их соотношение. Единственным исключением является медленный темп гипертрофии при адекватной физической тренировке организма.
Причины гипертрофии
Все причины, приводящие к такому состоянию, как гипертрофия левого желудочка сердца, можно разделить на физиологические и патологические. Физиологическими причинами являются активный образ жизни и тренировки. При этом они должны быть соизмеримы со способностями организма. Дело в том, что нагрузка на левый желудочек прямо пропорциональна физической активности. Патологические причины гипертрофии могут быть наследственными и приобретёнными. Врождённые патологии составляют небольшой процент от всех гипертрофий. Предположительно, они связаны с нарушением системы регуляции клеточного цикла и синтетического аппарата клеток миокарда. В результате кардиомиоциты теряют упорядоченность при увеличении их численности на единицу объёма, а количество коллагена возрастает на несколько порядков больше возрастных норм. Такая гипертрофия чаще всего затрагивает именно левый желудочек, как наиболее функционально активный. Появляется в раннем возрасте и в первые годы не дает клинических проявлений. Жалобы пациенты начинают предъявлять в пубертатном периоде или когда гипертрофия сменяется дилатацией за счёт потери способности миокарда к сокращению, при том, что нагрузка на левый желудочек сердца остается прежней.
Физиологическими причинами являются активный образ жизни и тренировки. При этом они должны быть соизмеримы со способностями организма. Дело в том, что нагрузка на левый желудочек прямо пропорциональна физической активности. Патологические причины гипертрофии могут быть наследственными и приобретёнными. Врождённые патологии составляют небольшой процент от всех гипертрофий. Предположительно, они связаны с нарушением системы регуляции клеточного цикла и синтетического аппарата клеток миокарда. В результате кардиомиоциты теряют упорядоченность при увеличении их численности на единицу объёма, а количество коллагена возрастает на несколько порядков больше возрастных норм. Такая гипертрофия чаще всего затрагивает именно левый желудочек, как наиболее функционально активный. Появляется в раннем возрасте и в первые годы не дает клинических проявлений. Жалобы пациенты начинают предъявлять в пубертатном периоде или когда гипертрофия сменяется дилатацией за счёт потери способности миокарда к сокращению, при том, что нагрузка на левый желудочек сердца остается прежней.
Симптоматика
МиокардВ зависимости от стадии заболевания, возраста пациента и функциональных способностей его организма увеличение левого желудочка сердца может никак не проявляться. Чаще всего это характерно для первых стадий, когда увеличение массы миокарда не превышает возможностей его кровообращения. В случае несоответствия кровоснабжения и размеров левого желудочка начинают появляться первые признаки. К ним относятся: кардиалгии (боли в грудной клетке), быстрая утомляемость, головокружения и обмороки. Нарушение в нервной системе приводит к аритмиям и блокадам. Присоединение недостаточности левого предсердия (она наступает как одно из самых частых осложнений гипертрофии) сопровождается одышкой, как при физической нагрузке, так и в покое. Это характерно для поздних стадий.
Лечение
В зависимости от причины, лечение гипертрофии левого желудочка сердца включает несколько основных принципов:
— Этиотропное. Воздействие на причину. Пока является возможным только при врожденных патологиях, и то в большинстве стран — на уровне экспериментов.
— Патогенетическое. Воздействие на патофизиологические механизмы, вызывающие увеличение левого желудочка сердца. В настоящее время это наиболее распространённые, доступные и общепризнанные методы. Они включают в себя как лечение заболеваний (нормализация артериального давления, борьба с ожирением, коррекция пороков и т. п.), так и назначение препаратов, замедляющих процессы гипертрофии. В первую очередь это ингибиторы ангиотензинпревращающего фермента: эналаприл, рамиприл и др. На сегодняшний день лечение гипертрофии левого желудочка сердца является одной из важнейших составляющих кардиологии.
По материалам сайта teamhelp.ru
что это и как можно лечить — Receptika Интернет аптека
ПРИЗНАКИ ГИПЕРТРОФИИ ЛЕВОГО ЖЕЛУДОЧКА
Гипертрофия левого желудочка сердца в большинстве случаев наблюдается у пациентов, имеющих диагноз гипертоническая болезнь. При гипертрофии наблюдается утолщение стенки мышц левого желудочка. В случае обнаружения данной патологии толщина органа увеличивается до 12 мм. При этом показатели нормы равны 7-11 мм. Примечательно, что это заболевание не зависит от возраста и встречается у людей всех поколений.
При этом показатели нормы равны 7-11 мм. Примечательно, что это заболевание не зависит от возраста и встречается у людей всех поколений.
Вылечить гипертрофию можно только при помощи проведения комплексного лечения и в некоторых случаях операции. Но чаще всего кардиологи назначают своим пациентам стандартную консервативную терапию, так как патология не считается настолько опасной, как может показаться многим на первый взгляд.
Признаки и причины заболевания
Выявить самостоятельно признаки этой патологии практически невозможно, ведь более чем у половины людей болезнь протекает бессимптомно. Остальные 50% пациентов могут почувствовать неладное лишь испытав физическую нагрузку или пережив стресс. Также ГЛЖ может проявляться во время беременности.
Основные видимые признаки гипертрофии левого желудочка — это:
- Аритмия.
- Головокружение.
- Одышка.
- Отечность.
- Общая слабость организма.
- Периодическая боль в сердце.

Стенка желудочка может быть увеличенной также из-за ряда перенесенных ранее заболеваний или чрезмерной нагрузки на сердце. Часто в числе тех, кто имеют указанную патологию находятся профессиональные спортсмены, чей организм особенно часто испытывает анаэробные нагрузки. Как результат, мышечная стенка «накачивается». Для обследования этой патологии стоит использовать ЭКГ. Гипертрофия левого желудочка может быть качественно выявлена лишь за счет такого медицинского исследования. Результаты осмотра для вашего лечащего врача станут отправной точкой для дальнейшего назначения лекарственных препаратов, рекомендации комплексного корпоративного лечения, а, возможно, и проведения последующей операции.
Гипертрофия левого желудочка, симптомы которой приведены выше, может быть врожденным заболеванием. Еще одна причина возникновения недуга – избыточный вес. При большой массе человека сердце работает интенсивнее, следовательно, нагрузка на орган увеличивается.
Диагностика гипертрофии
Обнаружить патологию в области левого желудочка можно только на медицинском исследовании. Как правило, плановый осмотр на УЗИ назначают пациентам, которые жалуются на одышку, головокружение, боль в грудной клетке, а также гипертоникам. Во время приема врач-кардиолог исследует все камеры сердца. Даже незначительная гипертрофия левого желудочка считается поводом для дополнительного обследования, на которой доктор сможет выявить причину патологии, чтобы потом назначить правильное лечение.
Как правило, плановый осмотр на УЗИ назначают пациентам, которые жалуются на одышку, головокружение, боль в грудной клетке, а также гипертоникам. Во время приема врач-кардиолог исследует все камеры сердца. Даже незначительная гипертрофия левого желудочка считается поводом для дополнительного обследования, на которой доктор сможет выявить причину патологии, чтобы потом назначить правильное лечение.
Среди других методов последующего осмотра могут быть:
- Дуплексное сканирование аорты.
- Измерение пульса и артериального давления.
- Доплеровская эхокардиография.
Лечение: гипертрофия левого желудочка как патология
Самый распространенный вариант лечения гипертрофии — консервативная терапия за счет назначения ряда препаратов. Способ предотвращения болезни, как и список медикаментов, подбирается врачом-кардиологом. В данном случае все зависит от особенностей протекания такого утолщения стенок внутренних органов, как гипертрофия левого желудочка. Признаки и возможные осложнения при этом тоже играют немаловажную роль. Рассмотрим несколько возможных вариантов назначения медикаментов в зависимости от заболеваний, которые стали фактором развития болезни.
Признаки и возможные осложнения при этом тоже играют немаловажную роль. Рассмотрим несколько возможных вариантов назначения медикаментов в зависимости от заболеваний, которые стали фактором развития болезни.
При гипертонии используются средства, направленные на замедление пульса и понижения давления. Как пример:
При атеросклерозе аорты рекомендуются препараты, которые препятствуют образованию тромбов и уменьшают уровень холестерина. Это могут быть:
При осложнениях кардиологи назначают лекарства более сильного способа действия. Задача препаратов – снять приступы аритмии, и купировать приступы боли в сердце. Среди средств:
Народные средства при лечении ГЛЖ
После того, как будет проведена рентгенограмма, гипертрофия левого желудочка может быть выявлена. После этого можно использовать народные средства борьбы с причиной заболевания – гипертонией. Но домашние методы лечения ГЛЖ ни в коем случае не должны быть единственным способом терапии. Важно перед применением народных методов проконсультироваться с профессиональным врачом-кардиологом.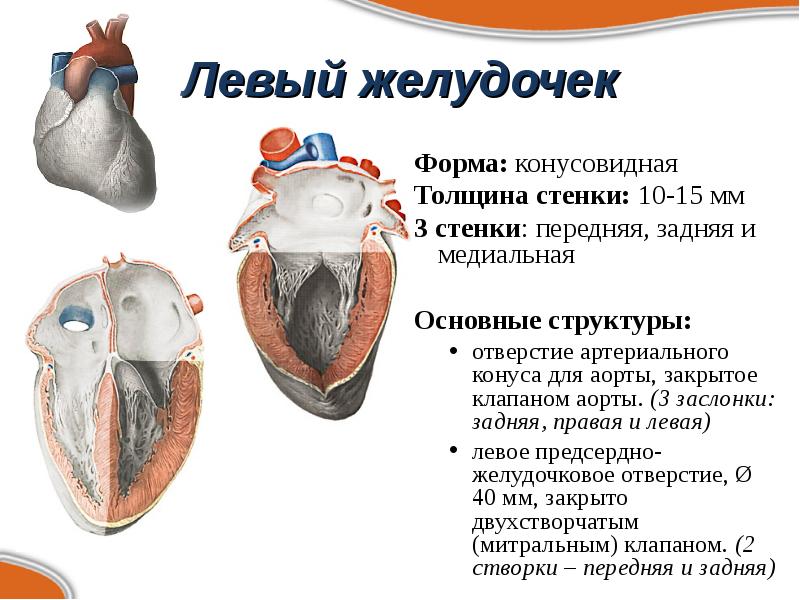 Помните, что даже начальная гипертрофия левого желудочка — не причина отказываться от медицинского способа лечения патологии.
Помните, что даже начальная гипертрофия левого желудочка — не причина отказываться от медицинского способа лечения патологии.
Среди самых популярных народных методов лечения гипертрофии стоит выделить такие рецепты:
- 50 г зверобоя заливаются 1 л воды. Настой нужно кипятить на среднем огне 30 минут. Далее: остудить, процедить и принимать треть стакана по три раза сутки.
- 15 мл побегов голубики разбавьте 200 мл воды и грейте около 10 минут. Готовый лекарственный раствор принимайте трижды в день не более одной столовой ложки.
- 15 мл цветков ландыша залейте водным раствором спирта. Получившийся раствор настаивайте две недели. После разбавьте 15 капель средства 500 мл воды. Вещество принимайте трижды в день.
Помните, что в случае своевременного обследования и благоприятного медицинского прогноза относительно наличия ГЛЖ, болезнь часто не нуждается в серьезном лечении. Смертность при диагностировании этого недуга составляет не более 4%.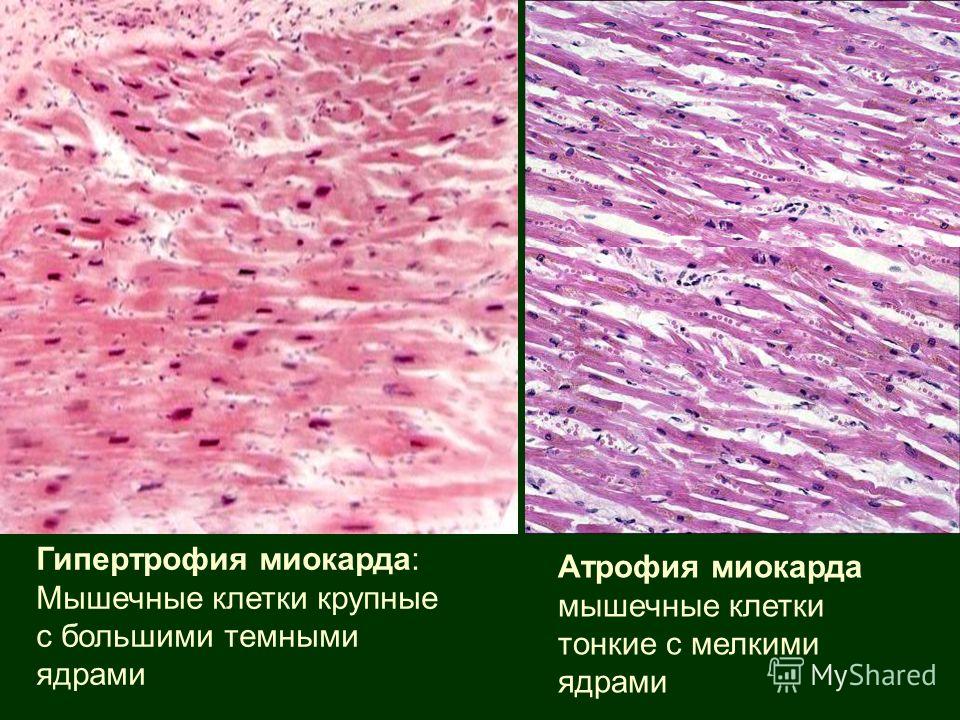 Поэтому гипертрофию сложно назвать опасной патологией и сложной формой порока сердца.
Поэтому гипертрофию сложно назвать опасной патологией и сложной формой порока сердца.
Данная статья информационная, при появлении схожих симптомов обязательно обратитесь к врачу.
Гипертрофия левого желудочка и возможности антигипертензивной терапии uMEDp
Гипертрофия (от греч. hyper – много и trophē – питание) миокарда – компенсаторный процесс, развивающийся вследствие изменения гемодинамических условий работы сердца. Длительное повышение нагрузки на миокард сопровождается его морфологическими, структурно-функциональными и цито-биохимическими изменениями, которые заключаются в увеличении размеров сердца вследствие возрастания объема и числа кардиомиоцитов, а также в значительном увеличении количества сократительных и вспомогательных белков. Формирование дополнительного количества и массы миокардиальных структур дают сердцу возможность адекватно функционировать в условиях повышенных гемодинамических нагрузок.
Рисунок 1.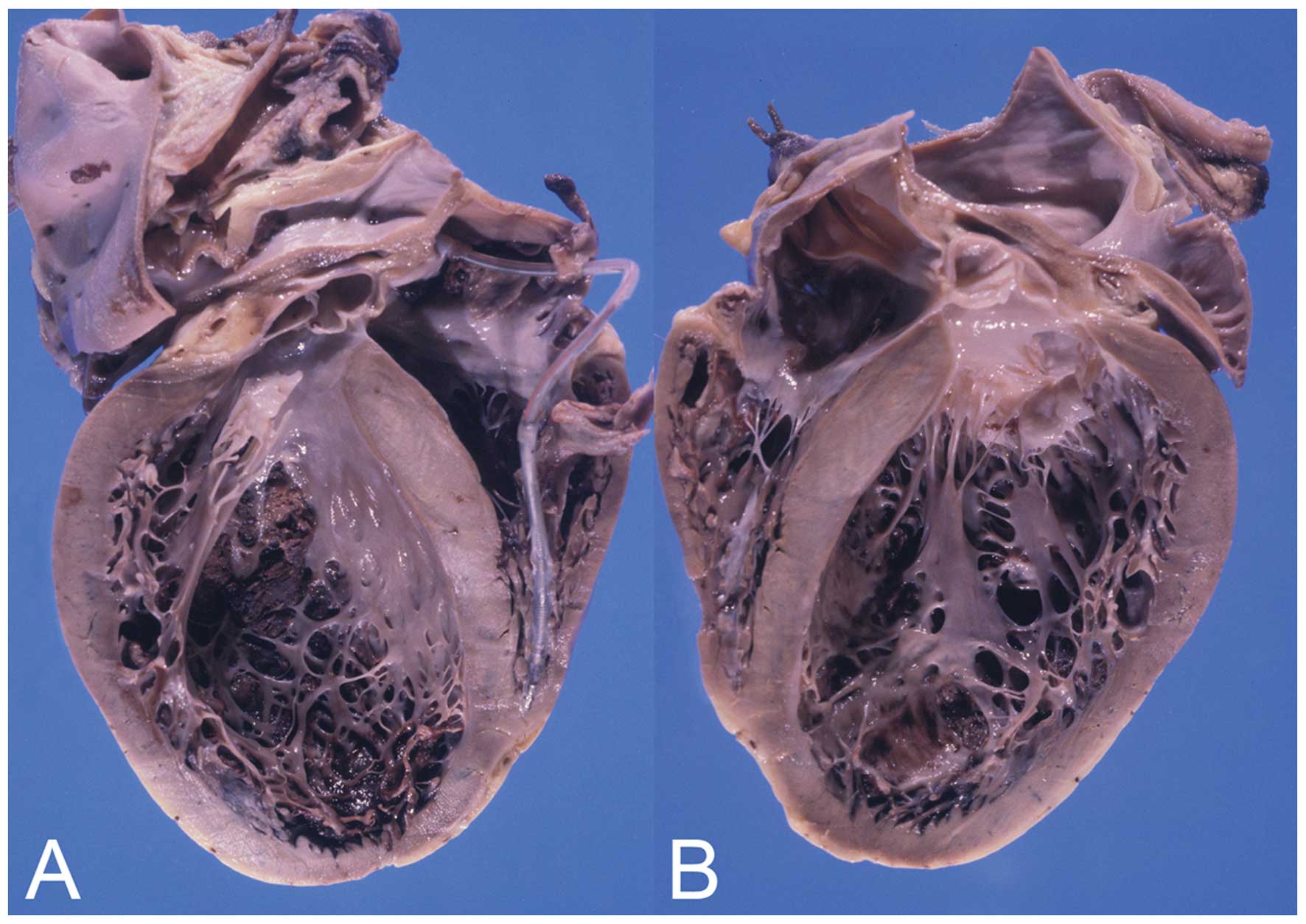 Различные типы геометрии левого желудочка: а – норма; б – концентрическая ГЛЖ; в – эксцентрическая ГЛЖ
Различные типы геометрии левого желудочка: а – норма; б – концентрическая ГЛЖ; в – эксцентрическая ГЛЖ
Рисунок 2. Сравнительное влияние рамиприла (а) и атенолола (б) на массу миокарда ЛЖ через 3 и 6 месяцев с момента начала лечения
Первое описание гипертрофии левого желудочка (ГЛЖ) было сделано еще в 1748 г., однако патогенетическое обоснование процесса формирования ГЛЖ как механизма адаптации к повышенной нагрузке было дано лишь во второй половине XX в. Тем не менее связь между ГЛЖ и высокой смертностью была замечена еще в начале XX в., однако в те годы эти данные не имели достаточного статистического обоснования.
Проведенные в дальнейшем крупные эпидемиологические исследования показали, что общая и сердечно-сосудистая смертность нарастают по мере увеличения выраженности ГЛЖ. Например, согласно результатам Корнельского и Фремингемского исследований, у лиц с признаками ГЛЖ общая смертность в 4 раза выше, а смертность от сердечно-сосудистых причин в 7-9 раз выше по сравнению с лицами без признаков ГЛЖ. У мужчин в возрасте до 65 лет ГЛЖ увеличивает риск смерти в 7 раз по сравнению с общей популяцией. Среди лиц без клинических симптомов сердечно-сосудистой патологии, но с признаками ГЛЖ на электрокардиограмме (ЭКГ) 33% мужчин и 21% женщин умирают в течение 5 лет (10, 14, 23, 28, 30).
У мужчин в возрасте до 65 лет ГЛЖ увеличивает риск смерти в 7 раз по сравнению с общей популяцией. Среди лиц без клинических симптомов сердечно-сосудистой патологии, но с признаками ГЛЖ на электрокардиограмме (ЭКГ) 33% мужчин и 21% женщин умирают в течение 5 лет (10, 14, 23, 28, 30).
Природа формирования ГЛЖ носит мультифакториальный характер. Важное значение в патогенезе ГЛЖ имеют пол, масса тела, повышенное потребление соли и алкоголя. По мере увеличения возраста отмечается рост частоты встречаемости ГЛЖ – за каждые 10 лет жизни риск развития ГЛЖ возрастает на 15%. Расовая принадлежность также имеет значение при определении распространенности ГЛЖ: исследование, проводившееся в США, показало практически четырехкратное увеличение встречаемости ГЛЖ у афроамериканского населения по сравнению с белым (13, 30).
В современных представлениях о патогенезе ГЛЖ важнейшую роль отводят многочисленным нейрогенным и гуморальным факторам, и в первую очередь – симпатоадреналовой (САС) и ренин-ангиотензин-альдостероновой (РААС) системам, активация которых способна как индуцировать гипертрофию, так и ускорять ее развитие (1, 11, 27).
Наконец, накопление новых данных по эпидемиологии сердечно-сосудистого ремоделирования и внедрение методов молекулярной кардиологии привели к формированию концепции существенной роли генетических факторов в развитии изменений в сердечно-сосудистой системе. Среди генов, структурный полиморфизм которых обсуждается как фактор развития гипертрофии миокарда и сосудистой стенки, на первом месте стоят гены белков РААС и гены других факторов роста и регуляторных пептидов, участвующих в передаче гипертрофических стимулов (39).
Имеется тесная связь между ГЛЖ и уровнем артериального давления (АД) – ГЛЖ выявляется примерно у половины больных с артериальной гипертензией (АГ). Доказано, что ГЛЖ при АГ является независимым фактором риска сердечно-сосудистой заболеваемости (ССЗ) и смертности, а также основным доклиническим проявлением поражения сердечно-сосудистой системы, которое повышает риск ишемической болезни сердца (ИБС) и инфаркта миокарда (ИМ), инсульта и застойной сердечной недостаточности, внезапной смерти и общей смертности (26). Термин «гипертоническое сердце», предложенный еще в середине XX в., определяет все многообразие функциональных и морфологических изменений в сердце как органе-мишени при АГ (4).
Термин «гипертоническое сердце», предложенный еще в середине XX в., определяет все многообразие функциональных и морфологических изменений в сердце как органе-мишени при АГ (4).
Сущность гипертрофии может быть определена как увеличение сердца вследствие увеличения объема и/или числа кардиомиоцитов. Этот процесс сопровождается увеличением количества сократительных и вспомогательных белков выше нормального уровня. До настоящего времени имеются противоречивые мнения о том, связан ли прирост массы миоцитов исключительно с гипертрофией (увеличением размера клеток) или в некоторых случаях также имеется элемент гиперплазии (деления клеток и увеличения их количества). Гипертрофированный миокард характеризуется значительным количеством электрофизиологических нарушений: во многих исследованиях показаны замедление реполяризации, нарушение распространения волны электрического возбуждения при ГЛЖ (8, 11, 18).
Традиционно выделяют два типа ГЛЖ (рисунок 1): концентрическую и эксцентрическую. Концентрическая ГЛЖ характеризуется утолщением стенки ЛЖ вследствие функциональной нагрузки давлением, при этом гипертрофия кардиомиоцитов развивается преимущественно за счет утолщения миофибриллярных пучков, в то время как длина кардиомиоцитов заметно не изменяется. Для этого типа ГЛЖ характерны высокое общее периферическое сосудистое сопротивление (ОПСС), субнормальный ударный объем и повышенное пульсовое АД, обусловленное значительной ригидностью артерий.
Концентрическая ГЛЖ характеризуется утолщением стенки ЛЖ вследствие функциональной нагрузки давлением, при этом гипертрофия кардиомиоцитов развивается преимущественно за счет утолщения миофибриллярных пучков, в то время как длина кардиомиоцитов заметно не изменяется. Для этого типа ГЛЖ характерны высокое общее периферическое сосудистое сопротивление (ОПСС), субнормальный ударный объем и повышенное пульсовое АД, обусловленное значительной ригидностью артерий.
Эксцентрическая ГЛЖ развивается вследствие нагрузки объемом и характеризуется увеличением объема полости левого желудочка (ЛЖ), при этом кардиомиоциты удлиняются за счет добавления новых саркомеров к предшествующим миофибриллам, а поперечные размеры сердечных миоцитов и длина саркомера в этом случае не изменяются. Для пациентов с эксцентрической гипертрофией свойственно увеличение полости левого желудочка, высокий ударный выброс, сравнительно низкое пульсовое АД, что обусловлено податливостью артериального сосудистого русла в отсутствие выраженных вазоспастических реакций (5).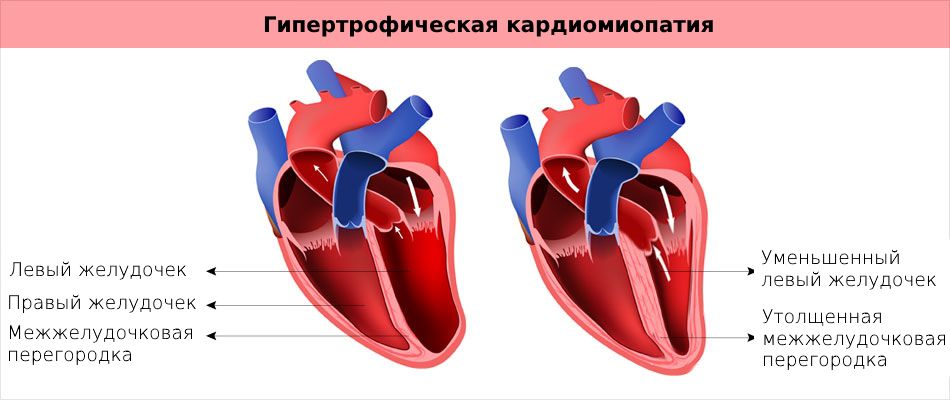
Геометрия ЛЖ является индикатором развития жизнеугрожающих нарушений ритма. Согласно данным J. Ghali (18, 19), концентрическая гипертрофия сопряжена с высоким риском желудочковых аритмий: при динамическом наблюдении в течение 9 лет за пациентами с ГЛЖ концентрическая гипертрофия сопровождалась более высоким риском смерти вследствие развития жизнеугрожающих аритмий, чем эксцентрическая, причем эта закономерность была выявлена как при наличии сопутствующей ИБС, так и без нее (12).
В Фремингемском исследовании был проведен анализ прогноза больных с различными типами геометрии ЛЖ, который показал, что наличие концентрической ГЛЖ является самостоятельным фактором риска неблагоприятного прогноза, прежде всего в плане развития ИБС и ее осложнений. В рекомендациях Европейского кардиологического общества по лечению АГ (2007) подчеркнута важность определения типа геометрии ЛЖ для стратификации риска больных с АГ (22).
ГЛЖ сопровождается снижением коронарного резерва вследствие уменьшения в гипертрофированном миокарде количества резистивных артериол. Такое несоответствие отражает нарушение способности артериолярной сети к росту адекватно увеличению количества кардиомиоцитов. В норме во время систолы происходит уменьшение коронарного кровотока из-за компрессии, обусловленной периваскулярными силами сжатия. В условиях гипертрофии действие сил сжатия на коронарный кровоток в систолу увеличивается, чему способствует и усиление напряженности стенки миокарда ЛЖ, связанное с повышением АД. Влияние этих неблагоприятных факторов приводит к тому, что гипертрофированный миокард в большей степени подвергается коротким эпизодам ишемии, причем максимальная степень снижения коронарного резерва выявляется при гипертензивной ГЛЖ концентрического типа (5).
Такое несоответствие отражает нарушение способности артериолярной сети к росту адекватно увеличению количества кардиомиоцитов. В норме во время систолы происходит уменьшение коронарного кровотока из-за компрессии, обусловленной периваскулярными силами сжатия. В условиях гипертрофии действие сил сжатия на коронарный кровоток в систолу увеличивается, чему способствует и усиление напряженности стенки миокарда ЛЖ, связанное с повышением АД. Влияние этих неблагоприятных факторов приводит к тому, что гипертрофированный миокард в большей степени подвергается коротким эпизодам ишемии, причем максимальная степень снижения коронарного резерва выявляется при гипертензивной ГЛЖ концентрического типа (5).
В настоящее время установлено, что изменение морфологии сердца одновременно сопровождается нарушением морфологии крупных сосудов: у больных с более выраженными гипертрофическими изменениями миокарда утолщение стенок крупных сосудов также выражено гораздо больше. Эта зависимость, скорее всего, является следствием общности регуляторных механизмов, лежащих в основе формирования и ГЛЖ, и утолщения сосудистой стенки (2, 5).
По мере нарастания гипертрофии стенок ЛЖ возникает и усугубляется его диастолическая дисфункция, усиливается внутримиокардиальное напряжение, повышается конечное диастолическое давление. Вслед за диастолической начинает страдать и систолическая функция, и при увеличении массы миокарда ЛЖ выше критического уровня (200 г) возникает латентная сердечная недостаточность.
Вследствие описанных патологических моментов развивается комплекс механизмов, приводящих в итоге к развитию сердечно-сосудистых осложнений и значительному ухудшению прогноза у больных с ГЛЖ. Так, ГЛЖ является независимым фактором риска ИБС и ИМ. У пациентов с ГЛЖ риск ИМ в 4 раза выше, чем у людей с нормальной геометрией сердца. Более того, у пациентов с ГЛЖ ИМ протекают тяжелее и характеризуются большим количеством осложнений. Столь значимая связь между ГЛЖ и риском ишемических событий объясняется прежде всего снижением коронарного резерва на фоне ГЛЖ и относительной ишемией гипертрофированного миокарда при недостаточном его кровоснабжении, а также сопутствующей эндотелиальной дисфункцией и микроангиопатией коронарных сосудов.
При наличии ГЛЖ в 6-12 раз увеличивается риск инсульта, что, скорее всего, обусловлено сопутствующими изменениями в системе мозговых сосудов, поскольку между ГЛЖ и поражением крупных сосудов имеется неразрывная связь. Согласно результатам исследования, проведенного в Японии K. Kohara и соавт. (25), концентрическая ГЛЖ является маркером доклинического поражения ЦНС. ГЛЖ ассоциирована также с риском развития атеросклероза сосудов нижних конечностей.
ГЛЖ в настоящее время рассматривается как основное звено в цепи сердечно-сосудистого континуума и в развитии сердечной недостаточности. Признаки гипертрофии на ЭКГ сопровождаются увеличением частоты развития синдрома ХСН в 14 раз. При этом такие клинические состояния, как ИМ и инсульт, успешно предотвращаются на фоне адекватного контроля АД, в то время как профилактика сердечной недостаточности требует более пристального внимания именно к поражению сердца.
Оригинальные исследования продемонстрировали, что ГЛЖ на ЭКГ является важным независимым фактором риска внезапной смерти как у мужчин (6-кратное увеличение риска), так и у женщин (3-кратное увеличение риска). Результаты проведенных исследований свидетельствуют в целом о большей частоте желудочковых аритмий у больных с ГЛЖ, чем без нее. Это справедливо и для желудочковой экстрасистолии, и для более сложных нарушений ритма по типу парных экстрасистол, ранних желудочковых экстрасистол и коротких пробежек желудочковой тахикардии (8).
Результаты проведенных исследований свидетельствуют в целом о большей частоте желудочковых аритмий у больных с ГЛЖ, чем без нее. Это справедливо и для желудочковой экстрасистолии, и для более сложных нарушений ритма по типу парных экстрасистол, ранних желудочковых экстрасистол и коротких пробежек желудочковой тахикардии (8).
Механизмы развития нарушений ритма при ГЛЖ включают в себя как непосредственные изменения электрофизиологических свойств сердечной мышцы вследствие ее гипертрофии и фиброза, так и снижение коронарного резерва, систолическую и диастолическую дисфункцию, активацию симпатической нервной системы и других нейрогуморальных систем. Данные оригинальных исследований подтверждены результатами Фремингемского исследования, которое продемонстрировало увеличение частоты фибрилляции предсердий в 1,5 раза при увеличении индекса массы ЛЖ на каждые 40 г/м2. ГЛЖ увеличивает риск фибрилляции предсердий (ФП) в 3-4 раза при одинаковом возрасте пациентов, и каждые 4 мм утолщения стенки ЛЖ приводят к увеличению ФП на 28% (40).
Исходя из всего вышеизложенного, ГЛЖ должна быть объектом лечения и профилактики, и современные принципы терапии ССЗ во многом направлены на то, чтобы остановить прогрессирующую ГЛЖ или уменьшить ее степень. Как было показано во многих клинических исследованиях, в ряде случаев удается не только затормозить, но и добиться определенной регрессии нарушений геометрии ЛЖ.
Способность благотворно влиять на процессы ремоделирования ЛЖ была продемонстрирована для ряда медикаментозных препаратов. При этом для снижения общей заболеваемости и смертности не менее важно корригировать модифицируемые факторы риска, влияющие на ГЛЖ и ее распространенность, такие как уровень АД, масса тела, количество потребляемой соли и алкоголя (3, 4, 7).
Антигипертензивные препараты оказывают различное влияние на обратное развитие ГЛЖ при равном гипотензивном эффекте, что может быть обусловлено их особым воздействием на САС, РААС и факторы роста. У больных АГ при наличии ГЛЖ необходимо отдавать предпочтение антигипертензивным препаратам, обладающим способностью вызывать обратное развитие ГЛЖ, так как препараты, снижающие АД без изменения массы миокарда ЛЖ, не уменьшают риска развития сердечно-сосудистых осложнений и внезапной смерти (34). Наиболее эффективны для лечения больных АГ с ГЛЖ ингибиторы АПФ (иАПФ) и/или блокаторы рецепторов к ангиотензину II (БРА), а также антагонисты кальция. Далее по убывающей – b-адреноблокаторы и диуретики (16, 41).
Наиболее эффективны для лечения больных АГ с ГЛЖ ингибиторы АПФ (иАПФ) и/или блокаторы рецепторов к ангиотензину II (БРА), а также антагонисты кальция. Далее по убывающей – b-адреноблокаторы и диуретики (16, 41).
Лидирующая роль иАПФ в снижении массы миокарда ЛЖ была выявлена B. Dahlof c соавт. (16) по результатам проведенного метаанализа 109 исследований и подтверждена метаанализами, выполненными Shmieder R.E. с соавт. (41) и Klingbeil A.U. с соавт. (24) и включившими в общей сложности 12142 пациента. Необходимо отметить, что все гипотензивные препараты примерно одинаково уменьшают механическую нагрузку на миокард путем снижения АД, в то время как иАПФ оказывают непосредственное действие на ангиотензин II. Причем в большей степени регрессу ГЛЖ способствуют иАПФ, имеющие повышенное сродство к тканевой РААС, – квинаприл, периндоприл, рамиприл и трандалоприл. Эти препараты, обладающие большей тканевой аффинностью, устраняют дисфункцию эндотелия, замедляя распад брадикинина – мощного вазодилататора, вызывающего образование простациклина, оксида азота и эндотелиального гиперполяризующего фактора. Они также уменьшают продукцию супероксидного аниона и деградацию оксида азота, препятствуют пролиферации гладкомышечного слоя сосудов, предупреждая таким образом действие ангиотензина II в тканях.
Они также уменьшают продукцию супероксидного аниона и деградацию оксида азота, препятствуют пролиферации гладкомышечного слоя сосудов, предупреждая таким образом действие ангиотензина II в тканях.
В исследованиях RACE (33) доказано, что при одинаковом влиянии на АД иАПФ рамиприл вызывает более выраженный регресс ГЛЖ, чем b-адреноблокатор атенолол (рисунок 2). В рандомизированном двойном слепом плацебо-контролируемом исследовании HYCAR (31), сравнивавшим применение рамиприла в дозах 1,25 мг/сут., 5 мг/сут. и плацебо, было установлено, что через 6 месяцев лечения масса миокарда ЛЖ (ММЛЖ) достоверно увеличивалась в группе плацебо и достоверно уменьшалась в группах рамиприла. Более выраженное снижение было получено в группе с большей (5 мг/сут.) дозой рамиприла.
В исследовании HEART (36) было доказано, что раннее применение рамиприла (с первых суток) в дозе 10 мг/сут. у больных острым инфарктом миокарда предупреждает ремоделирование ЛЖ и вызывает более значительное увеличение его фракции выброса по сравнению как с низкими дозами (0,625 мг/сут.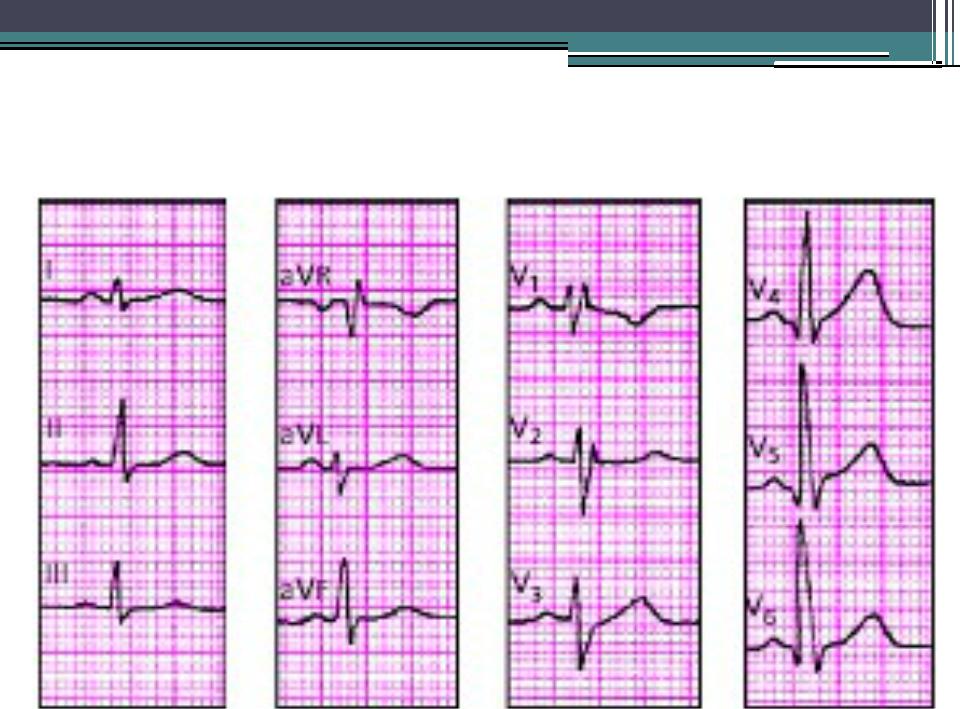 ), так и с отсроченным назначением препарата (на 14-е сутки).
), так и с отсроченным назначением препарата (на 14-е сутки).
Ряд российских исследований также подтвердил достоверное положительное действие иАПФ на структурно-функциональное состояние миокарда. Так, на базе Ростовского государственного медицинского университета (9) оценивалось влияние рамиприла (Хартил, EGIS) на процессы ремоделирования сердца у пациентов с сочетанным течением АГ и ИБС (n = 40). Дополнительное назначение этого препарата к аспирину, статину и b-адреноблокатору сопровождалось тенденцией к более выраженному уменьшению толщины задней стенки ЛЖ, снижению миокардиального стресса (на 12,2%, р = 0,001) и повышению фракции выброса (на 7,3%, p = 0,002) к концу 12-недельного периода наблюдения.
Сотрудники Московского государственного медико-стоматологического университета обследовали 60 женщин, страдающих ХСН неклапанной этиологии, находящихся в постменопаузе (6). Пациентки были рандомизированы в группы приема рамиприла (Хартил, EGIS) и эналаприла в дополнение к стандартной терапии. Исходно и через 6 месяцев у пациенток определяли тяжесть ХСН и морфо-функциональные изменения сердца. Терапия ХСН во всех группах привела к некоторому уменьшению толщины стенок и размеров левого желудочка. Однако в группе рамиприла к концу исследования отмечено достоверное уменьшение степени диастолической дисфункции (р = 0,062), а также улучшение переносимости физической нагрузки, снижение функционального класса ХСН, улучшение качества жизни и снижение степени эндотелиальной дисфункции. Применение рамиприла сопровождалось низкой частотой развития побочных эффектов, что повышало приверженность к лечению и его эффективность.
Исходно и через 6 месяцев у пациенток определяли тяжесть ХСН и морфо-функциональные изменения сердца. Терапия ХСН во всех группах привела к некоторому уменьшению толщины стенок и размеров левого желудочка. Однако в группе рамиприла к концу исследования отмечено достоверное уменьшение степени диастолической дисфункции (р = 0,062), а также улучшение переносимости физической нагрузки, снижение функционального класса ХСН, улучшение качества жизни и снижение степени эндотелиальной дисфункции. Применение рамиприла сопровождалось низкой частотой развития побочных эффектов, что повышало приверженность к лечению и его эффективность.
Антагонисты рецепторов ангиотензина также оказывают выраженное действие на тканевую РААС, что ассоциируется со значительным органопротективным эффектом. В настоящее время накоплен достаточный клинический опыт по оценке их влияния на гипертрофированный миокард ЛЖ.
В исследовании LIFE (15, 17) было показано достоверное преимущество лозартана перед атенололом в снижении массы миокарда ЛЖ.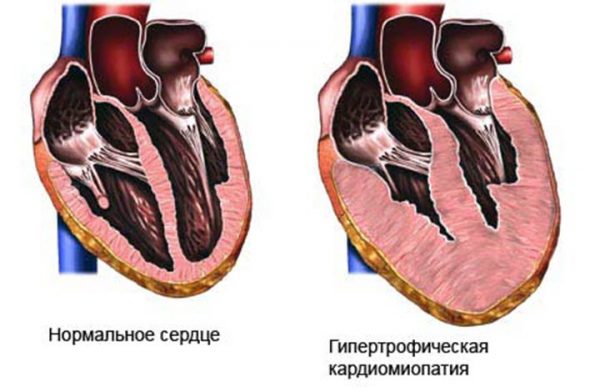 В этом исследовании принимали участие 9193 пациента в возрасте 55-80 лет с АГ и ЭКГ-признаками ГЛЖ. Лозартан по сравнению с атенололом приводил к уменьшению относительного риска смерти от сердечно-сосудистых причин на 11%, инсульта – на 25%, новых случаев сахарного диабета – на 25%. Назначение лозартана сопровождалось более выраженным, чем при использовании атенолола, уменьшением ГЛЖ – на 10,2% и 4,4% по Корнельскому индексу и на 15,3% и 9,0% по индексу Соколова–Лайона соответственно. Аналогичные результаты получены и при использовании телмисартана в сравнительных исследованиях с гидрохлортиазидом, эналаприлом и карведилолом.
В этом исследовании принимали участие 9193 пациента в возрасте 55-80 лет с АГ и ЭКГ-признаками ГЛЖ. Лозартан по сравнению с атенололом приводил к уменьшению относительного риска смерти от сердечно-сосудистых причин на 11%, инсульта – на 25%, новых случаев сахарного диабета – на 25%. Назначение лозартана сопровождалось более выраженным, чем при использовании атенолола, уменьшением ГЛЖ – на 10,2% и 4,4% по Корнельскому индексу и на 15,3% и 9,0% по индексу Соколова–Лайона соответственно. Аналогичные результаты получены и при использовании телмисартана в сравнительных исследованиях с гидрохлортиазидом, эналаприлом и карведилолом.
Антагонисты кальция также оказывают влияние на регресс ГЛЖ. Уменьшение гипертрофии миокарда на фоне их применения обусловлено ингибицией фосфориляции рецепторов эпидермального ростового фактора. Метаанализ, проведенный Dahlof с соавт. (16), показал, что антагонисты кальция (нифедипин) уменьшают массу ЛЖ на 10%, а иАПФ – на 16% (32, 37). Однако в большинстве проанализированных работ использовался нифедипин короткого действия, который, как известно, недостаточно эффективен при редукции ГЛЖ, что связывают с повторными эпизодами симпатической стимуляции.
В то же время при использовании нифедипина ультрадлительного действия ММЛЖ в течение года уменьшилась на 19%, что сопоставимо с эффектом иАПФ (37). Аналогичные данные получены Picca с соавт. (38), показавшими одинаковый гипотензивный эффект и достоверное снижение ММЛЖ в группах больных, принимавших амлодипин (10 мг/сут.) или эналаприл (20 мг/сут.).
Однако не все антагонисты кальция также эффективны в отношении влияния на ГЛЖ, как амлодипин. Например, фелодипин обладает гораздо более низкой активностью, скорее всего, вследствие повышения уровня норадреналина и увеличения ЧСС на фоне его приема (29).
Остальные группы гипотензивных препаратов (b-адреноблокаторы, антагонисты a-рецепторов, диуретики) вызывают менее выраженный регресс ГЛЖ, чем иАПФ, антагонисты рецепторов ангиотензина II или антагонисты кальция. Однако ряд исследований, оценивавших эффективность мочегонных препаратов (хлорталидон, индапамид-ретард, гидрохлортиазид) в сопоставлении с иАПФ (эналаприл) и β-адреноблокаторами (ацебутолол, атеналол) (TOMHS, 1993; Veterans Administration Study, 1997; LIVE, 2000) (20, 21, 35) по влиянию на регресс ГЛЖ, существенно усилили позиции диуретиков.
Следовательно, определенная коррекция геометрических изменений ЛЖ представляется возможной и реально достижимой. Уменьшение ГЛЖ сопровождается увеличением коронарного резерва, улучшением систолической и диастолической функций ЛЖ, а также уменьшением числа желудочковых нарушений ритма. Таким образом, снижение массы миокарда ЛЖ в результате лечения сопровождается улучшением прогноза и снижением риска смерти, и именно это доказанное свойство должно быть определяющим критерием в выборе медикаментозного препарата.
Гипертрофия левого желудочка — Диагностика и лечение
Диагноз
Ваш врач начнет с истории болезни, семейного анамнеза и тщательного медицинского осмотра, включая проверку вашего артериального давления и сердечной деятельности.
Ваш врач может порекомендовать скрининговые тесты:
- Электрокардиограмма (ЭКГ или ЭКГ). Электрические сигналы записываются, когда они проходят через ваше сердце.
 Ваш врач может найти образцы, которые указывают на нарушение функции сердца и увеличение мышечной ткани левого желудочка.
Ваш врач может найти образцы, которые указывают на нарушение функции сердца и увеличение мышечной ткани левого желудочка. - Эхокардиограмма. Звуковые волны создают живое изображение вашего сердца. Эхокардиограмма может выявить утолщение мышечной ткани в левом желудочке, кровоток через сердце с каждым ударом и аномалии сердца, связанные с гипертрофией левого желудочка, такие как стеноз аортального клапана.
- МРТ. Изображения вашего сердца можно использовать для диагностики гипертрофии левого желудочка.
Лечение
Лекарства от кровяного давления могут помочь предотвратить дальнейшее увеличение левого желудочка и даже уменьшить ваши гипертрофированные мышцы. Ваш врач может порекомендовать лекарства, в том числе:
Лекарства
Лекарства от кровяного давления могут помочь предотвратить дальнейшее увеличение левого желудочка и даже уменьшить ваши гипертрофированные мышцы. Ваш врач может порекомендовать лекарства, в том числе:
Ваш врач может порекомендовать лекарства, в том числе:
- Ингибиторы ангиотензинпревращающего фермента (АПФ). Эти лекарства расширяют кровеносные сосуды, снижая кровяное давление, улучшая кровоток и уменьшая нагрузку на сердце. Примеры включают каптоприл, эналаприл (Vasotec) и лизиноприл (Prinivil, Zestril, Zestoretic). Побочные эффекты могут включать раздражающий сухой кашель у небольшого процента людей.
- Блокаторы рецепторов ангиотензина II (БРА). Лекарства, такие как лозартан (Козаар), имеют такие же преимущества, как и ингибиторы АПФ , но не вызывают стойкого кашля.
- Блокаторы кальциевых каналов. Эти препараты предотвращают попадание кальция в клетки сердца и стенок кровеносных сосудов. Это расслабляет мышцы стенок сосудов, что позволяет кровеносным сосудам открываться шире и снижает кровяное давление. Примеры включают амлодипин (Норваск) и дилтиазем (Кардизем, Тиазак).

- Диуретики. Лекарства, известные как диуретики тиазидного типа, уменьшают количество жидкости в кровеносных сосудах, снижая кровяное давление. Примеры включают хлорталидон и гидрохлоротиазид (микрозид).
- Бета-блокаторы. Лекарства, такие как атенолол (тенормин), могут снизить частоту сердечных сокращений, снизить кровяное давление и предотвратить некоторые вредные эффекты гормонов стресса. Бета-адреноблокаторы обычно не назначают в качестве начального лечения гипертонии. Ваш врач может порекомендовать добавить бета-блокатор, если другой тип лекарства не эффективен сам по себе.
Хирургия или другие процедуры
Лечение стеноза аортального клапана
Гипертрофия левого желудочка, вызванная стенозом аортального клапана, может потребовать хирургического вмешательства для восстановления узкого клапана или его замены искусственным или тканевым клапаном.
Лечение других сопутствующих заболеваний
- Лечение гипертрофической кардиомиопатии.
 Гипертрофию левого желудочка, вызванную гипертрофической кардиомиопатией, можно лечить с помощью лекарств, нехирургических процедур, хирургии, имплантации устройств и изменения образа жизни.
Гипертрофию левого желудочка, вызванную гипертрофической кардиомиопатией, можно лечить с помощью лекарств, нехирургических процедур, хирургии, имплантации устройств и изменения образа жизни. - Амилоидоз. Лечение амилоидоза включает лекарства, химиотерапию и, возможно, трансплантацию стволовых клеток. Лечение амилоидоза доступно в специализированных клиниках.
Лечение апноэ во сне. Если вам уже поставили диагноз апноэ во сне, лечение этого расстройства сна может снизить ваше кровяное давление и помочь обратить вспять гипертрофию левого желудочка, если она вызвана высоким кровяным давлением.
Если вам не поставили диагноз апноэ во сне, но ваш партнер говорит вам, что вы храпите или на мгновение перестаете дышать во время сна, поговорите со своим врачом о том, чтобы пройти тест на апноэ во сне.
Для лечения апноэ во сне используется аппарат, обеспечивающий постоянное положительное давление в дыхательных путях (CPAP) во время сна.
 CPAP сохраняет дыхательные пути открытыми, позволяя получать кислород, необходимый для поддержания кровяного давления на нормальном уровне.
CPAP сохраняет дыхательные пути открытыми, позволяя получать кислород, необходимый для поддержания кровяного давления на нормальном уровне.
Образ жизни и домашние средства
Изменения образа жизни могут помочь снизить кровяное давление, укрепить здоровье сердца и улучшить симптомы гипертрофии левого желудочка, если они вызваны высоким кровяным давлением. Ваш врач, вероятно, порекомендует изменить образ жизни, полезный для сердца, в том числе следующее:
- Отказ от курения.
- Похудение. Гипертрофия левого желудочка часто встречается у людей, страдающих ожирением, независимо от артериального давления. Было показано, что похудание устраняет гипертрофию левого желудочка. Поддержание здорового веса или снижение веса, если у вас избыточный вес или ожирение, также может помочь контролировать ваше кровяное давление.

- Соблюдайте здоровую диету. Придерживайтесь диеты, богатой фруктами, овощами, цельнозерновыми продуктами, нежирными молочными продуктами и полезными жирами, такими как оливковое масло.Уменьшите количество рафинированных углеводов, натрия и насыщенных жиров в своем рационе.
- Ограничьте употребление соли в рационе. Слишком много соли может повысить кровяное давление. Выбирайте продукты с низким содержанием натрия или без добавления соли и не добавляйте соль в пищу.
- Употребление алкоголя в умеренных количествах, если вообще. Алкоголь также может повышать кровяное давление, особенно при употреблении в больших количествах.
- Регулярная физическая активность. Стремитесь к умеренной физической активности не менее 150 минут в неделю.Например, попробуйте быструю ходьбу в течение 30 минут большую часть дней в неделю. Даже меньшая активность принесет значительную пользу.
 Спросите своего врача, нужно ли вам ограничить определенные физические нагрузки, такие как тяжелая атлетика, которые могут временно повысить кровяное давление.
Спросите своего врача, нужно ли вам ограничить определенные физические нагрузки, такие как тяжелая атлетика, которые могут временно повысить кровяное давление. - Управление стрессом. Найдите способы справиться со стрессом, например методы релаксации.
Подготовка к приему
Вас могут направить к врачу, имеющему опыт лечения сердечных заболеваний (кардиологу).
Что вы можете сделать
- Запишите свои симптомы, включая те, которые могут показаться не связанными с причиной, по которой вы записались на прием.
- Составьте список всех ваших лекарств, витаминов и пищевых добавок.
- Запишите основную медицинскую информацию, включая другие состояния.
- Запишите ключевую личную информацию, включая любые недавние изменения или факторы стресса в вашей жизни.
- Запишите вопросы, которые задайте своему врачу.

- Узнайте, были ли в вашей семье сердечные заболевания.
- Попросите родственника или друга сопровождать вас, , чтобы помочь вам вспомнить, что говорит врач.
Вопросы, которые следует задать своему врачу
- Какая наиболее вероятная причина моих симптомов?
- Какие тесты мне нужны? Есть ли к ним особая подготовка?
- Какие виды лечения мне нужны?
- Стоит ли менять образ жизни?
- Следует ли мне ограничивать свои действия?
- У меня другие проблемы со здоровьем.Как мне вместе лучше всего справиться с этими условиями?
В дополнение к вопросам, которые вы готовы задать своему врачу, не стесняйтесь задавать другие вопросы во время приема.
Чего ожидать от врача
Ваш врач, скорее всего, задаст вам ряд вопросов. Если вы будете готовы ответить на них, у вас останется время, чтобы обсудить вопросы, на которые вы хотите потратить больше времени. Вас могут спросить:
Вас могут спросить:
- Каковы ваши симптомы и когда они появились?
- Ваши симптомы со временем ухудшились?
- Есть ли у вас боль в груди или учащенное, трепещущее или учащенное сердцебиение?
- У вас головокружение? Вы когда-нибудь падали в обморок?
- Были ли у вас проблемы с дыханием?
- Ухудшают ли симптомы упражнения или лежание?
- Вы когда-нибудь кашляли кровью?
- Были ли у вас в анамнезе высокое кровяное давление или ревматическая лихорадка?
- Были ли у вас в семье проблемы с сердцем?
- Вы курили или курили? Вы употребляете алкоголь или кофеин?
Ноябрь25, 2020
Показать ссылки- McCullough PA, et al. Определение и патогенез гипертрофии левого желудочка при артериальной гипертензии. https://www.uptodate.com/contents/search. Проверено 9 октября 2020 г.
- Podrid PJ. Гипертрофия левого желудочка и аритмия.
 https://www.uptodate.com/contents/search. Проверено 9 октября 2020 г.
https://www.uptodate.com/contents/search. Проверено 9 октября 2020 г. - Chatterjee S, et al. Мета-анализ гипертрофии левого желудочка и устойчивых аритмий. Американский журнал кардиологии.2014; DOI: 10.1016 / j.amjcard.2014.07.015.
- Lavie CJ, et al. Влияние эхокардиографической геометрии левого желудочка на клинический прогноз. Прогресс сердечно-сосудистых заболеваний. 2014; DOI: 10.1016 / j.pcad.2014.05.003.
- McCullough PA. Клинические последствия и лечение гипертрофии левого желудочка при артериальной гипертензии. https://www.uptodate.com/contents/search. Проверено 9 октября 2020 г.
- Goldberger AL. Гипертрофия левого желудочка: клинические данные и диагноз ЭКГ.https://www.uptodate.com/contents/search. Проверено 9 октября 2020 г.
- Что такое гипертрофия левого желудочка? Американская Ассоциация Сердца. https://www.heart.org/en/health-topics/heart-valve-problems-and-disease/heart-valve-problems-and-causes/what-is-left-ventricular-hypertrophy-lvh.
 Проверено 9 октября 2020 г.
Проверено 9 октября 2020 г. - Лопес-Хименес Ф (экспертное заключение). Клиника Майо. 1 марта 2018 г.
- Bonow RO, et al., Eds. Системная гипертензия: управление. В: Болезнь сердца Браунвальда: Учебник сердечно-сосудистой медицины.11 изд. Эльзевир; 2019. https://www.clinicalkey.com. Проверено 9 октября 2020 г.
- AskMayoExpert. Гипертрофическая кардиомиопатия. Клиника Майо; 2020.
- Yilmaz A, et al. Диагностический подход и дифференциальная диагностика у пациентов с гипертрофией левого желудочка. Сердце. 2014; DOI: 10.1136 / heartjnl-2011-301528.
- Джеймс П.А. и др. Основанные на фактах рекомендации 2014 года по лечению высокого кровяного давления у взрослых: отчет членов комиссии, назначенных в Восьмой объединенный национальный комитет (JNC 8).JAMA. 2014; DOI: 10.1001 / jama.2013.284427.
- Мехра Р. Обструктивное апноэ во сне и сердечно-сосудистые заболевания. https://www.uptodate.com/contents/search. Проверено 9 октября 2020 г.

- Велтон П.К. и др. Руководство ACC / AHA / AAPA / ABC / ACPM / AGS / APhA / ASH / ASPC / NMA / PCNA по профилактике, выявлению, оценке и лечению высокого кровяного давления у взрослых, 2017 г .: Резюме — отчет Американского колледжа Кардиология / Целевая группа Американской кардиологической ассоциации по клиническим рекомендациям.Гипертония. 2018; DOI: 10.1161 / HYP.0000000000000066.
- Cuspidi C, et al. Гипертрофия левого желудочка и ожирение: систематический обзор и метаанализ эхокардиографических исследований. Журнал гипертонии. 2014; DOI: 10.1097 / HJH.0b013e328364fb58.
- Gaasch WH. Показания к замене клапана при стенозе аорты у взрослых. https://www.uptodate.com/contents/search. Проверено 10 октября 2020 г.
- Изменения, которые вы можете внести, чтобы контролировать высокое кровяное давление. Американская Ассоциация Сердца.https://www.heart.org/en/health-topics/high-blood-pressure/changes-you-can-make-to-manage-high-blood-pressure#.
 Wo7ckOdG3cs. Проверено 9 октября 2020 г.
Wo7ckOdG3cs. Проверено 9 октября 2020 г. - Высокое кровяное давление. Национальный институт сердца, легких и крови. https://www.nhlbi.nih.gov/health-topics/high-blood-pressure. Проверено 9 октября 2020 г.
- Phillips SD (экспертное заключение). Клиника Майо. 22 октября 2020 г.
- Ferri FF. Амилоидоз. В: Клинический советник Ферри 2021. Эльзевир; 2021 г. https: //www.clinicalkey.com. Доступ 26 октября 2020 г.
Гипертрофия левого желудочка
Что такое гипертрофия левого желудочка (ГЛЖ)?
Гипертрофия левого желудочка или ГЛЖ — это термин, обозначающий левую насосную камеру сердца, которая утолщена и, возможно, не работает эффективно. Иногда такие проблемы, как стеноз аорты или высокое кровяное давление, перегружают сердечную мышцу.В ответ на эту перегрузку давлением внутренние стенки сердца могут стать толще.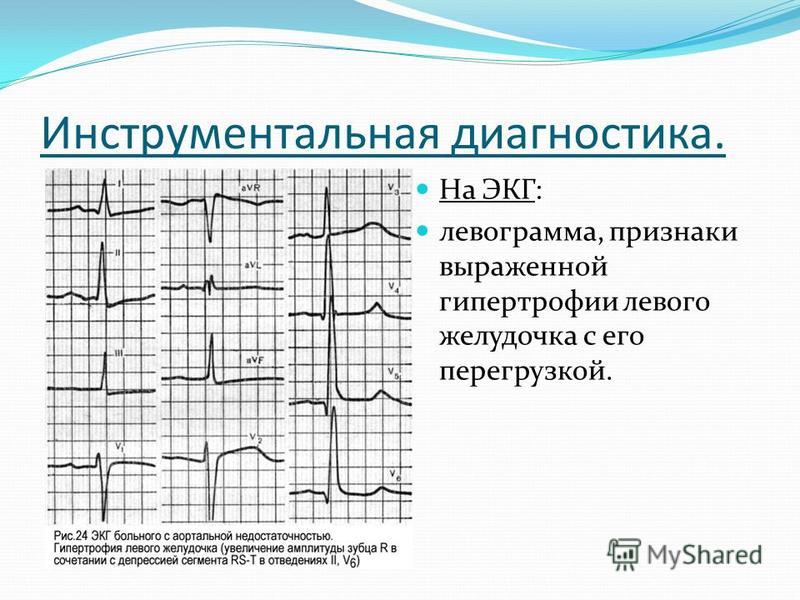 Эти утолщенные стенки могут привести к ослаблению, жесткости и потере эластичности левого желудочка, что может помешать нормальному кровотоку.
Эти утолщенные стенки могут привести к ослаблению, жесткости и потере эластичности левого желудочка, что может помешать нормальному кровотоку.
Каковы симптомы ГЛЖ?
ГЛЖ может присутствовать в течение многих лет без каких-либо заметных симптомов. По мере ухудшения состояния могут развиваться такие симптомы, как:
- Одышка
- Усталость
- Боль в груди (особенно при физической нагрузке)
- Учащенное сердцебиение
- Головокружение или обморок
Если вы испытываете какие-либо из этих симптомов, немедленно поговорите со своим лечащим врачом, чтобы можно было выявить и устранить проблему.
Как гипертрофия левого желудочка связана с другими сердечными заболеваниями?
ГЛЖ обычно возникает в результате других проблем с сердцем, таких как:
Важно лечить причины ГЛЖ на ранней стадии, поскольку это может привести к серьезным проблемам, таким как сердечная недостаточность, внезапная остановка сердца и ишемический инсульт.
Как диагностируется ГЛЖ?
Поскольку ГЛЖ может развиваться незаметно в течение нескольких лет без симптомов, ее может быть трудно диагностировать. Однако обычная электрокардиограмма или эхокардиограмма обычно может диагностировать ГЛЖ даже до того, как симптомы станут заметными.МРТ сердца также может диагностировать ГЛЖ.
Каковы варианты лечения ГЛЖ?
ГЛЖ часто можно исправить, решив основную проблему, из-за которой сердце работает слишком тяжело. В зависимости от типа нанесенного повреждения лечебные меры могут включать в себя прием лекарств и здоровые для сердца изменения в образе жизни, чтобы снизить давление в сердце. Если ГЛЖ вызвана проблемой сердечного клапана, может потребоваться операция для ремонта или замены клапана.
Можно ли вылечить ГЛЖ?
Ряд исследований указывают на улучшение результатов у людей, получающих лечение от ГЛЖ.
Посетите нашу сеть поддержки, чтобы поговорить с другими и связаться с нашими послами сердечных клапанов.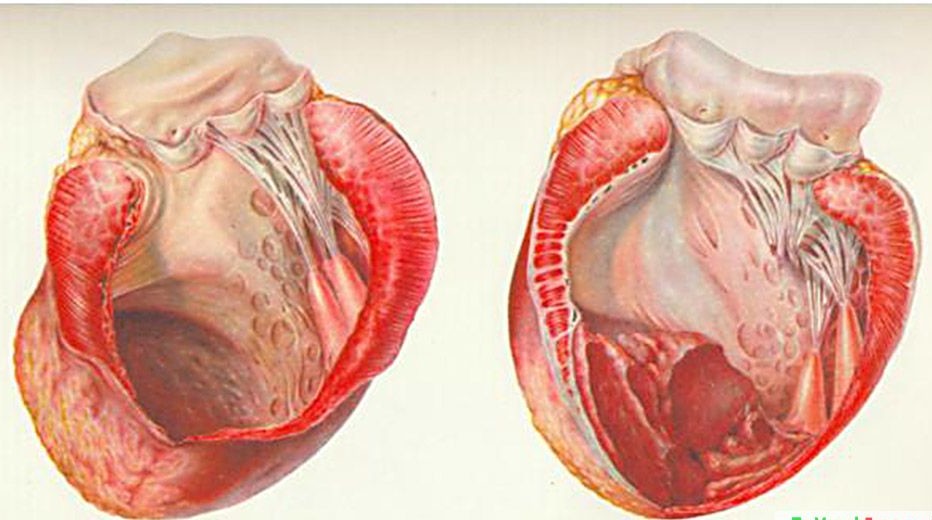 Мы здесь, чтобы помочь и воодушевить вас в достижении ваших целей лечения.
Мы здесь, чтобы помочь и воодушевить вас в достижении ваших целей лечения.
Последняя редакция: 8 мая 2020 г.
Понимание опасностей гипертрофии левого желудочка — Основы здоровья от клиники Кливленда
Во многих отношениях лучше. Нам нужен дом побольше, зарплата побольше или бицепсы побольше.Но когда дело касается сердца, больше не значит лучше. Увеличенное или утолщенное сердце — состояние, которое врачи называют гипертрофией левого желудочка (ЛЖ), — может привести к сердечной недостаточности. Это также может удвоить риск деменции и когнитивных нарушений.
Клиника Кливленда — некоммерческий академический медицинский центр. Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем продукты или услуги, не принадлежащие Cleveland Clinic. Политика
«Гипертрофия — это ненормально.Это может быть легкое или тяжелое заболевание, но оно определенно требует дальнейшего изучения », — говорит специалист по сердечной недостаточности Мария Маунтис, доктор медицинских наук.
Что такое гипертрофия ЛЖ?
Гипертрофия ЛЖ — это нормальная физиологическая реакция на перегрузку давлением и объемом. Как и любая мышца, сердце становится больше, когда ему приходится качать сильнее. При гипертрофии ЛЖ мышечные волокна в основной насосной камере сердца увеличиваются и со временем утолщаются.
Мы видим это у пациентов с длительной гипертонией или заболеванием клапана, таким как стеноз аорты или регургитация.Мы также видим эти изменения у элитных спортсменов, например, у тяжелоатлетов и бегунов на длинные дистанции.
Реже отложения избыточного железа или белка, называемого амилоидом, вызывают утолщение сердечной мышцы.
Некоторые люди генетически предрасположены к развитию гипертрофии с состоянием, называемым гипертрофической обструктивной кардиомиопатией. «Эти пациенты нередко сообщают о том, что у них есть член семьи, который был затронут этим заболеванием или слышал, что родственник внезапно умер по необъяснимым причинам», — говорит докторMountis.
Гипертрофия и сердечная недостаточность
У многих людей развивается сердечная недостаточность, особенно сердечная недостаточность с сохраненной фракцией выброса (HFpEF, также называемая диастолической сердечной недостаточностью). Такие сердца сжимаются нормально, но слишком жесткие, чтобы их можно было правильно наполнить.
«Классический пациент с HFpEF, которого я вижу, — это обычно женщина с избыточным весом в возрасте 60, 70 или 80 лет, у которой есть апноэ во сне и фибрилляция предсердий», — говорит д-р Маунтис.
Диагноз легко упустить, потому что сердце выглядит нормально при отображении на эхокардиографии (эхо).Чтобы сопоставить симптомы с потенциальным диагнозом, требуется проницательный кардиолог.
«Мы используем эхокардиографию для измерения перегородки, разделяющей два желудочка, а также задней стенки сердца. Это классические области, где мышцы утолщаются », — говорит доктор Маунтис.
Как лучше всего лечить гипертрофию ЛЖ?
Гипертрофия левого желудочка не является предметом лечения: устраняется основное заболевание. Это может потребовать приема лекарств от мерцательной аритмии или артериального давления, лечения апноэ во сне, соблюдения диеты с низким содержанием соли и ограничения потребления жидкости.
Это может потребовать приема лекарств от мерцательной аритмии или артериального давления, лечения апноэ во сне, соблюдения диеты с низким содержанием соли и ограничения потребления жидкости.
«Поскольку сердечную недостаточность в значительной степени можно предотвратить, вы должны предпринять необходимые шаги для сохранения здоровья сердца», — говорит доктор Маунтис.
Пациенты с гипертрофией ЛЖ находятся под тщательным наблюдением, чтобы убедиться, что сердечная недостаточность не развивается и не усугубляется.
Если есть подозрение на амилоидоз, вы должны быть осмотрены в специализированном центре амилоида, например, в клинике Кливленда, чтобы определить тип амилоида и исключить другие причины, по которым может присутствовать гипертрофия ЛЖ.
«У нас есть новые протоколы лечения этой болезни», — говорит доктор Маунтис.
Эта статья впервые появилась в Cleveland Clinic Heart Advisor .
Обновлениеи практическое клиническое применение
Гипертрофия левого желудочка — это неадаптивный ответ на хроническую перегрузку давлением и важный фактор риска фибрилляции предсердий, диастолической сердечной недостаточности, систолической сердечной недостаточности и внезапной смерти у пациентов с гипертонией. Поскольку не у всех пациентов с артериальной гипертензией развивается гипертрофия левого желудочка, следует помнить о клинических данных, которые могут предупредить врача о наличии гипертрофии левого желудочка, поэтому для более точной оценки можно провести эхокардиограмму или сердечно-сосудистый магнитный резонанс.Независимый контроль артериального давления, ограничения натрия и потери веса способствует регрессу гипертрофии левого желудочка. Выбор гипотензивных средств может иметь значение при лечении пациента с гипертонической гипертрофией левого желудочка. Ингибиторы ангиотензин-превращающего фермента или блокаторы рецепторов ангиотензина II, за которыми следуют антагонисты кальциевых каналов, наиболее быстро способствуют регрессу гипертрофии левого желудочка. При регрессе гипертрофии левого желудочка диастолическая функция и резерв коронарного кровотока обычно улучшаются, а сердечно-сосудистый риск снижается.
Поскольку не у всех пациентов с артериальной гипертензией развивается гипертрофия левого желудочка, следует помнить о клинических данных, которые могут предупредить врача о наличии гипертрофии левого желудочка, поэтому для более точной оценки можно провести эхокардиограмму или сердечно-сосудистый магнитный резонанс.Независимый контроль артериального давления, ограничения натрия и потери веса способствует регрессу гипертрофии левого желудочка. Выбор гипотензивных средств может иметь значение при лечении пациента с гипертонической гипертрофией левого желудочка. Ингибиторы ангиотензин-превращающего фермента или блокаторы рецепторов ангиотензина II, за которыми следуют антагонисты кальциевых каналов, наиболее быстро способствуют регрессу гипертрофии левого желудочка. При регрессе гипертрофии левого желудочка диастолическая функция и резерв коронарного кровотока обычно улучшаются, а сердечно-сосудистый риск снижается.
1. Введение
Хотя существует множество доказанных преимуществ успешного долгосрочного лечения гипертонии, включая снижение риска инсульта, почечной недостаточности и инфаркта миокарда, все более важной областью лечения гипертонии является выявление гипертрофии левого желудочка и назначение комбинация методов лечения, которая способствует регрессу для улучшения симптомов и прогноза пациентов. Гипертрофия левого желудочка является одновременно основным дезадаптирующим ответом на хроническую перегрузку давлением и важным фактором риска у пациентов с гипертонией.Развитие гипертрофии левого желудочка сильно коррелирует с систолической гипертензией. В исследовании Framingham Heart Study даже пограничная изолированная систолическая гипертензия в пожилом возрасте была связана с увеличением толщины стенки левого желудочка и нарушением диастолического наполнения [1]. Осложнения гипертрофии левого желудочка включают фибрилляцию предсердий, диастолическую сердечную недостаточность, систолическую сердечную недостаточность и внезапную смерть. Как более раннее распознавание, так и более глубокое понимание гипертрофии сердца могут привести к более эффективным терапевтическим стратегиям для этого фактора риска сердечно-сосудистых заболеваний.В этой статье основное внимание будет уделено концентрической гипертрофии левого желудочка и обсуждению дифференциальной диагностики, методов, доступных для выявления гипертрофии левого желудочка, а также методов лечения, снижающих риски для пациентов и способствующих регрессу для улучшения симптомов и прогноза.
Гипертрофия левого желудочка является одновременно основным дезадаптирующим ответом на хроническую перегрузку давлением и важным фактором риска у пациентов с гипертонией.Развитие гипертрофии левого желудочка сильно коррелирует с систолической гипертензией. В исследовании Framingham Heart Study даже пограничная изолированная систолическая гипертензия в пожилом возрасте была связана с увеличением толщины стенки левого желудочка и нарушением диастолического наполнения [1]. Осложнения гипертрофии левого желудочка включают фибрилляцию предсердий, диастолическую сердечную недостаточность, систолическую сердечную недостаточность и внезапную смерть. Как более раннее распознавание, так и более глубокое понимание гипертрофии сердца могут привести к более эффективным терапевтическим стратегиям для этого фактора риска сердечно-сосудистых заболеваний.В этой статье основное внимание будет уделено концентрической гипертрофии левого желудочка и обсуждению дифференциальной диагностики, методов, доступных для выявления гипертрофии левого желудочка, а также методов лечения, снижающих риски для пациентов и способствующих регрессу для улучшения симптомов и прогноза.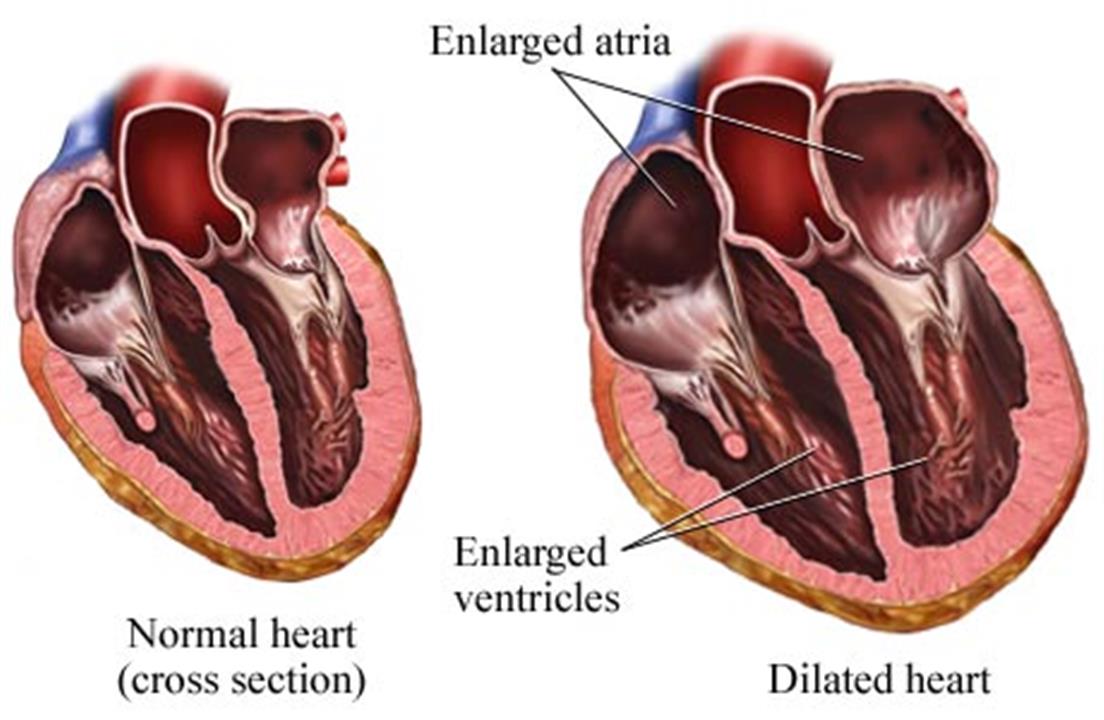 В этой статье также будут обсуждаться разрабатываемые новые методы лечения, которые могут оказать значительное влияние на эту проблему высокого риска в будущем.
В этой статье также будут обсуждаться разрабатываемые новые методы лечения, которые могут оказать значительное влияние на эту проблему высокого риска в будущем.
2. Факторы, способствующие гипертрофии левого желудочка
В настоящее время считается, что гипертрофия левого желудочка опосредуется не только механическим стрессом от перегрузки давлением, но также различными нейрогормональными веществами, которые независимо друг от друга оказывают трофическое воздействие на миоциты и немиоциты в сердце [ 2].Как показано в таблице 1, трофические факторы включают ангиотензин II, альдостерон, норэпинефрин и инсулин, которые непосредственно способствуют гипертрофии миоцитов и отложению матрикса, независимо от их влияния на системное артериальное давление [3, 4]. Эти трофины стимулируют выработку ряда цитокинов и факторов роста, включая трансформирующий фактор роста бета, фактор роста фибробластов и фактор роста инсулина, которые напрямую стимулируют синтез сердечного белка и гипертрофию.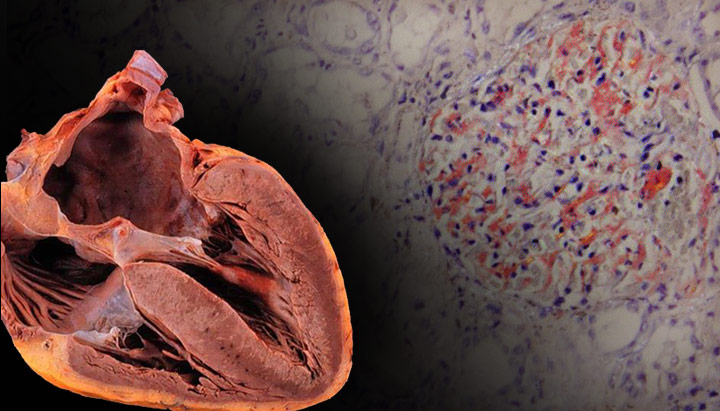 Хотя повышенное системное артериальное давление играет роль в патогенезе гипертрофии левого желудочка, степень сердечного роста и реакция на повышенную нагрузку давлением неодинаковы среди пациентов, что предполагает генетические механизмы гипертрофии сердца [5].Таким образом, пациенты с умеренной артериальной гипертензией имеют широкий диапазон массы левого желудочка, от нормального сердца до тяжелой гипертрофии. Кроме того, ремоделирование левого желудочка может принимать концентрическую или эксцентрическую форму независимо от степени повышения артериального давления.
Хотя повышенное системное артериальное давление играет роль в патогенезе гипертрофии левого желудочка, степень сердечного роста и реакция на повышенную нагрузку давлением неодинаковы среди пациентов, что предполагает генетические механизмы гипертрофии сердца [5].Таким образом, пациенты с умеренной артериальной гипертензией имеют широкий диапазон массы левого желудочка, от нормального сердца до тяжелой гипертрофии. Кроме того, ремоделирование левого желудочка может принимать концентрическую или эксцентрическую форму независимо от степени повышения артериального давления.
| ||||||||||||||||
3.
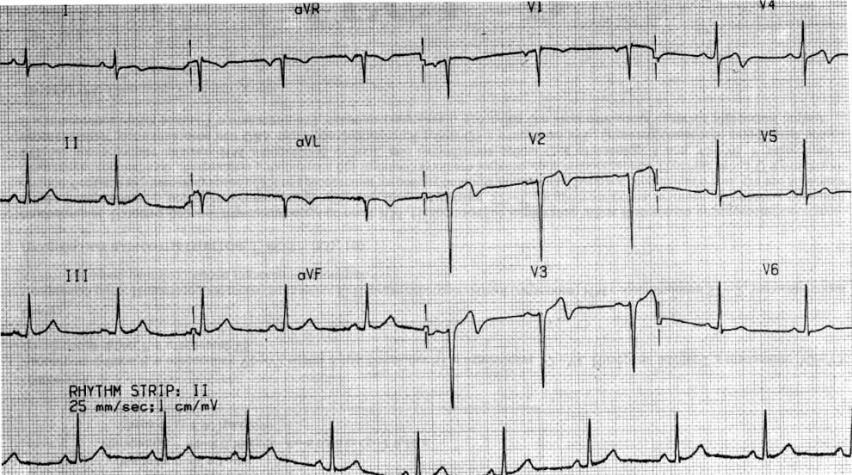 Клиническое подозрение на гипертрофию левого желудочка
Клиническое подозрение на гипертрофию левого желудочка Врач первичной медико-санитарной помощи встречается со многими пациентами с гипертонией. Электрокардиограмма (но не эхокардиограмма) предлагается при первоначальном обследовании пациентов с артериальной гипертензией для выявления аритмий, признаков ишемической болезни сердца и / или гипертрофии левого желудочка [6]. Поскольку не у всех пациентов с артериальной гипертензией развивается гипертрофия левого желудочка, следует помнить о клинических данных, которые могут предупредить врача о наличии гипертрофии левого желудочка, чтобы можно было провести более точную оценку.Обнаружение гипертрофии левого желудочка важно, потому что у этих пациентов риск сердечно-сосудистой заболеваемости и смертности в два-четыре раза выше по сравнению с пациентами с нормальной массой левого желудочка [7, 8]. Хотя эхокардиография является более чувствительным инструментом для выявления гипертрофии левого желудочка, стоимость не позволяет ей стать частью рутинной оценки неосложненного бессимптомного пациента с гипертензией. Если при физикальном обследовании выявляется галоп S4, следует учитывать раннюю диастолическую дисфункцию и возможную гипертрофию левого желудочка.Отклонения от нормы на электрокардиограмме включают увеличение левого предсердия, удлинение интервала QT и гипертрофию левого желудочка. Если проводится поэтапное тестирование с физической нагрузкой, часто можно заметить, что пациенты с гипертрофией левого желудочка демонстрируют гиперадренергический ответ с увеличением частоты сердечных сокращений до 150 ударов в минуту в течение первой минуты и чрезмерным повышением систолического артериального давления более чем на 200 мм рт. Гиперадренергическая реакция в виде частоты сердечных сокращений и артериального давления объясняет одышку у пациента при физической нагрузке, а также считается, что она отражает наличие гипертрофии левого желудочка [9].
Если при физикальном обследовании выявляется галоп S4, следует учитывать раннюю диастолическую дисфункцию и возможную гипертрофию левого желудочка.Отклонения от нормы на электрокардиограмме включают увеличение левого предсердия, удлинение интервала QT и гипертрофию левого желудочка. Если проводится поэтапное тестирование с физической нагрузкой, часто можно заметить, что пациенты с гипертрофией левого желудочка демонстрируют гиперадренергический ответ с увеличением частоты сердечных сокращений до 150 ударов в минуту в течение первой минуты и чрезмерным повышением систолического артериального давления более чем на 200 мм рт. Гиперадренергическая реакция в виде частоты сердечных сокращений и артериального давления объясняет одышку у пациента при физической нагрузке, а также считается, что она отражает наличие гипертрофии левого желудочка [9].
Существует ряд отличительных клинических признаков, которые, по-видимому, определяют определенные подгруппы пациентов с гипертонией, у которых есть гипертрофия левого желудочка.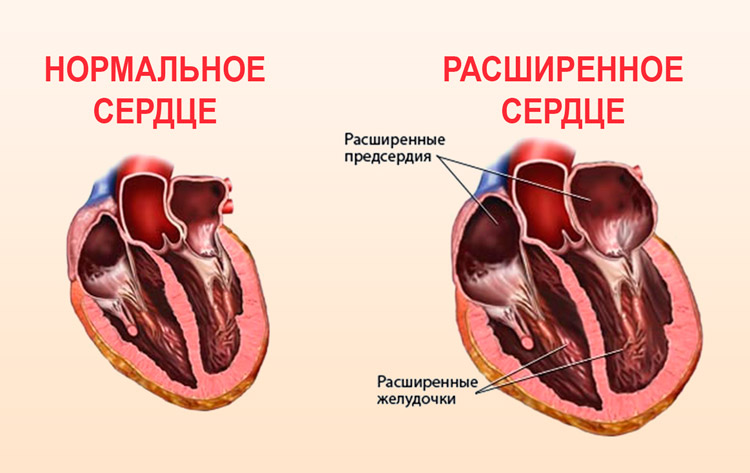 Было обнаружено, что среди пациентов с гипертрофией левого желудочка с симптомами, эквивалентными стенокардии, 85% этих пациентов составляли женщины со средним возрастом 63 года, а 83% имели экзогенное ожирение [10]. Таким образом, типичный гипертонический пациент, у которого следует подозревать гипертрофию левого желудочка, — это женщина среднего возраста в постменопаузе с избыточным весом, которая обращается к врачу с историей боли в груди при физической нагрузке, типичной для стенокардии.Пациент часто сообщает в анамнезе гипертонию, но, как правило, она не тяжелая. Кроме того, пациент обычно не курит, не переносит глюкозу и имеет пограничную дислипидемию. Эти результаты, наложенные на положительный результат теста с физической нагрузкой, свидетельствуют о гипертонической болезни сердца у женщин. То, что у них развилась концентрическая гипертрофия левого желудочка, непропорциональная артериальному давлению, и связанное с этим ожирение, предполагает генетическую основу этой проблемы. Гипертрофия левого желудочка у женщин в настоящее время считается сильным фактором риска сердечно-сосудистых заболеваний, не зависящим от артериального давления [11, 12].
Было обнаружено, что среди пациентов с гипертрофией левого желудочка с симптомами, эквивалентными стенокардии, 85% этих пациентов составляли женщины со средним возрастом 63 года, а 83% имели экзогенное ожирение [10]. Таким образом, типичный гипертонический пациент, у которого следует подозревать гипертрофию левого желудочка, — это женщина среднего возраста в постменопаузе с избыточным весом, которая обращается к врачу с историей боли в груди при физической нагрузке, типичной для стенокардии.Пациент часто сообщает в анамнезе гипертонию, но, как правило, она не тяжелая. Кроме того, пациент обычно не курит, не переносит глюкозу и имеет пограничную дислипидемию. Эти результаты, наложенные на положительный результат теста с физической нагрузкой, свидетельствуют о гипертонической болезни сердца у женщин. То, что у них развилась концентрическая гипертрофия левого желудочка, непропорциональная артериальному давлению, и связанное с этим ожирение, предполагает генетическую основу этой проблемы. Гипертрофия левого желудочка у женщин в настоящее время считается сильным фактором риска сердечно-сосудистых заболеваний, не зависящим от артериального давления [11, 12]. Исследования показывают повышенную заболеваемость фибрилляцией предсердий и внезапной смертью у женщин с гипертрофией левого желудочка. Кроме того, гипертоническая болезнь сердца — частая причина застойной сердечной недостаточности у женщин. Можно только догадываться, почему у женщин в постменопаузе с гипертрофией левого желудочка от легкой до умеренной чаще наблюдается стенокардия, чем у мужчин с такой же степенью гипертрофии левого желудочка. Предполагается, что женщины имеют меньшие коронарные артерии и / или более сильное восприятие боли из-за потери анальгетического действия эстрогена и / или потому, что потеря эстрогена приводит к меньшему производству эндотелиального оксида азота в коронарном сосудистом дереве [13, 14].
Исследования показывают повышенную заболеваемость фибрилляцией предсердий и внезапной смертью у женщин с гипертрофией левого желудочка. Кроме того, гипертоническая болезнь сердца — частая причина застойной сердечной недостаточности у женщин. Можно только догадываться, почему у женщин в постменопаузе с гипертрофией левого желудочка от легкой до умеренной чаще наблюдается стенокардия, чем у мужчин с такой же степенью гипертрофии левого желудочка. Предполагается, что женщины имеют меньшие коронарные артерии и / или более сильное восприятие боли из-за потери анальгетического действия эстрогена и / или потому, что потеря эстрогена приводит к меньшему производству эндотелиального оксида азота в коронарном сосудистом дереве [13, 14].
В недавних сообщениях метаболический синдром был связан с увеличением массы левого желудочка. Даже после учета возраста, пола и суточного систолического артериального давления у пациентов с метаболическим синдромом масса левого желудочка значительно выше [15]. Отсутствие связи между массой левого желудочка и артериальным давлением у пациентов с метаболическим синдромом предполагает другие факторы, такие как инсулинорезистентность и гиперинсулинемия, задержка натрия, активация симпатической нервной системы и пептиды жировой ткани, такие как лептин.Соответственно, лечащий врач должен знать о влиянии метаболического синдрома на массу левого желудочка у пациентов с избыточной массой тела и ожирением и гипертонией и проводить обследование этой группы высокого риска на предмет сердечно-сосудистых осложнений. Другими типами пациентов, о которых следует помнить, чтобы врач первичной медико-санитарной помощи был готов продолжить обследование на предмет гипертрофии левого желудочка, являются пациенты с ожирением, которых следует обследовать на предмет апноэ во сне. Пациенты, у которых наблюдается повышение артериального давления в течение ночи и у которых не наблюдается нормального ночного падения артериального давления, повышен риск развития гипертрофии левого желудочка [16].
Отсутствие связи между массой левого желудочка и артериальным давлением у пациентов с метаболическим синдромом предполагает другие факторы, такие как инсулинорезистентность и гиперинсулинемия, задержка натрия, активация симпатической нервной системы и пептиды жировой ткани, такие как лептин.Соответственно, лечащий врач должен знать о влиянии метаболического синдрома на массу левого желудочка у пациентов с избыточной массой тела и ожирением и гипертонией и проводить обследование этой группы высокого риска на предмет сердечно-сосудистых осложнений. Другими типами пациентов, о которых следует помнить, чтобы врач первичной медико-санитарной помощи был готов продолжить обследование на предмет гипертрофии левого желудочка, являются пациенты с ожирением, которых следует обследовать на предмет апноэ во сне. Пациенты, у которых наблюдается повышение артериального давления в течение ночи и у которых не наблюдается нормального ночного падения артериального давления, повышен риск развития гипертрофии левого желудочка [16]. Афроамериканцы, пациенты из стран Карибского бассейна и Мексики латиноамериканского происхождения с артериальной гипертензией также имеют более высокую частоту гипертрофии левого желудочка, поэтому врач должен иметь более высокий индекс подозрения и рассмотреть возможность скрининга на гипертрофию левого желудочка [17]. Большинство исследований показывают, что латиноамериканские пациенты афроамериканского и карибского происхождения и мексиканского происхождения имеют не только большую толщину стенки левого желудочка, но и большую массу левого желудочка, даже с эквивалентным артериальным давлением, чем у белых пациентов.Сложнее всего идентифицировать пациента с «замаскированной» гипертонией. Эта подгруппа пациентов противоположно реагирует на пациентов с гипертонией «белого халата» [18]. Вместо повышения артериального давления пациента, когда он сидит в кабинете врача, артериальное давление в норме. Однако, когда эти пациенты выполняют повседневную деятельность, включая упражнения, у них наблюдается чрезмерное повышение систолического артериального давления.
Афроамериканцы, пациенты из стран Карибского бассейна и Мексики латиноамериканского происхождения с артериальной гипертензией также имеют более высокую частоту гипертрофии левого желудочка, поэтому врач должен иметь более высокий индекс подозрения и рассмотреть возможность скрининга на гипертрофию левого желудочка [17]. Большинство исследований показывают, что латиноамериканские пациенты афроамериканского и карибского происхождения и мексиканского происхождения имеют не только большую толщину стенки левого желудочка, но и большую массу левого желудочка, даже с эквивалентным артериальным давлением, чем у белых пациентов.Сложнее всего идентифицировать пациента с «замаскированной» гипертонией. Эта подгруппа пациентов противоположно реагирует на пациентов с гипертонией «белого халата» [18]. Вместо повышения артериального давления пациента, когда он сидит в кабинете врача, артериальное давление в норме. Однако, когда эти пациенты выполняют повседневную деятельность, включая упражнения, у них наблюдается чрезмерное повышение систолического артериального давления. Таким образом, в течение дня на их сердце повышается постнагрузка, которая действует как стимул для гипертрофии при нормальной активности.Утолщение артериол при обследовании глазного дна, галопе S4, аномальной ЭКГ или тестах с физической нагрузкой может указывать на то, что у пациента «замаскированная» гипертензия, и амбулаторный мониторинг артериального давления может подтвердить эту подгруппу пациентов с гипертонией.
Таким образом, в течение дня на их сердце повышается постнагрузка, которая действует как стимул для гипертрофии при нормальной активности.Утолщение артериол при обследовании глазного дна, галопе S4, аномальной ЭКГ или тестах с физической нагрузкой может указывать на то, что у пациента «замаскированная» гипертензия, и амбулаторный мониторинг артериального давления может подтвердить эту подгруппу пациентов с гипертонией.
Гипертрофию левого желудочка также следует заподозрить у пациентов с гипертонической болезнью, у которых обнаружен односторонний стеноз почечной артерии [19, 20]. Имеются данные о том, что активация ренин-ангиотензин-альдостероновой системы может способствовать развитию гипертрофии левого желудочка независимо от воздействия артериального давления.Было показано, что гипертрофия левого желудочка в три раза чаще встречается у пациентов с функционально значимым односторонним стенозом почечной артерии, чем у пациентов с гипертонической болезнью.
Также, по-видимому, наблюдается увеличение массы левого желудочка сверх величины, необходимой для компенсации гемодинамической нагрузки, связанной с артериальным давлением, у пациентов с первичным альдостеронизмом [21]. Поскольку гипертония и ожирение увеличиваются с возрастом, распространенность гипертрофии левого желудочка может составлять 50 процентов у пациентов старше 65 лет [22].Наконец, у пациентов с почечной недостаточностью широко распространена гипертрофия левого желудочка. Гипертрофия левого желудочка присутствует примерно у 70% пациентов в начале диализа [23].
Поскольку гипертония и ожирение увеличиваются с возрастом, распространенность гипертрофии левого желудочка может составлять 50 процентов у пациентов старше 65 лет [22].Наконец, у пациентов с почечной недостаточностью широко распространена гипертрофия левого желудочка. Гипертрофия левого желудочка присутствует примерно у 70% пациентов в начале диализа [23].
4. Дифференциальная диагностика гипертрофии левого желудочка и методы визуализации для дифференциации физиологической гипертрофии от патологической
Взрослый миоцит — это терминально дифференцированная клетка, которая не делится в ответ на стресс [3, 4]. Таким образом, миоцит приспосабливается к перегрузке давлением путем репликации саркомеров и изменений изоформ ферментов, которые регулируют сократительную функцию и транспорт ионов, что приводит к более эффективному сокращению с сохранением энергии.Гипертрофия, вторичная по отношению к физической нагрузке или гипертиреоз, кажется подходящей в отношении ремоделирования левого желудочка с относительной дилатацией, которая представляет собой выгодное использование сил Франка-Старлинга для достижения большей эффективности использования энергии, и потому что резерв коронарного кровотока соответствует степени роста миокарда [24 , 25]. Напротив, гипертрофия левого желудочка, вторичная по отношению к эссенциальной гипертензии, является патологической, поскольку стимул к росту также активирует фибробласты, что приводит к интерстициальному фиброзу, который является еще одним признаком структурного ремоделирования миокарда, обнаруживаемого при гипертонической болезни сердца.Таким образом, при гипертрофии левого желудочка, вторичной по отношению к эссенциальной гипертензии, размер камеры левого желудочка меньше с повышенным диастолическим наполнением, что приводит к снижению способности сердца эффективно использовать энергию, и резерв коронарного кровотока остается ниже ожидаемого для степени гипертрофии [26]. .
Напротив, гипертрофия левого желудочка, вторичная по отношению к эссенциальной гипертензии, является патологической, поскольку стимул к росту также активирует фибробласты, что приводит к интерстициальному фиброзу, который является еще одним признаком структурного ремоделирования миокарда, обнаруживаемого при гипертонической болезни сердца.Таким образом, при гипертрофии левого желудочка, вторичной по отношению к эссенциальной гипертензии, размер камеры левого желудочка меньше с повышенным диастолическим наполнением, что приводит к снижению способности сердца эффективно использовать энергию, и резерв коронарного кровотока остается ниже ожидаемого для степени гипертрофии [26]. .
Если у пациента артериальная гипертензия, а также он участвует в регулярных интенсивных аэробных упражнениях, таких как бег трусцой или езда на велосипеде, дифференциация физиологического и патологического увеличения массы левого желудочка является важной и сложной задачей.Хронические аэробные упражнения могут вызывать электрокардиографические изменения, которые могут имитировать патологические состояния, а у людей с высокой подготовленностью может быть подозрение на сердечно-сосудистые заболевания, несмотря на отсутствие сердечных симптомов [27]. Различие между физиологическим атлетическим сердцем и патологической гипертрофией левого желудочка имеет важное значение для тренированных спортсменов или людей с активными занятиями. Патологическая гипертрофия левого желудочка может быть основанием для дисквалификации от интенсивных спортивных соревнований с целью снижения риска внезапной смерти [28].С другой стороны, чрезмерный диагноз может привести к ненужным ограничениям, лишив спортсменов и / или участников физических упражнений денежных и / или психологических преимуществ интенсивных аэробных видов спорта. Для клинициста, который решает, является ли это структурным заболеванием сердца или атлетическим сердцем, очень полезна эхокардиограмма [29]. Важны несколько соображений: (1) Систолическая и диастолическая функция левого желудочка у спортсмена нормальная. Помните, что фракция выброса в левом желудочке с физиологической диастолической дилатацией (полость ЛЖ более 55 мм) и низкой частотой сердечных сокращений будет находиться в низком нормальном диапазоне 50–55 процентов.
Различие между физиологическим атлетическим сердцем и патологической гипертрофией левого желудочка имеет важное значение для тренированных спортсменов или людей с активными занятиями. Патологическая гипертрофия левого желудочка может быть основанием для дисквалификации от интенсивных спортивных соревнований с целью снижения риска внезапной смерти [28].С другой стороны, чрезмерный диагноз может привести к ненужным ограничениям, лишив спортсменов и / или участников физических упражнений денежных и / или психологических преимуществ интенсивных аэробных видов спорта. Для клинициста, который решает, является ли это структурным заболеванием сердца или атлетическим сердцем, очень полезна эхокардиограмма [29]. Важны несколько соображений: (1) Систолическая и диастолическая функция левого желудочка у спортсмена нормальная. Помните, что фракция выброса в левом желудочке с физиологической диастолической дилатацией (полость ЛЖ более 55 мм) и низкой частотой сердечных сокращений будет находиться в низком нормальном диапазоне 50–55 процентов. (2) Толщина стенки левого желудочка обычно меньше, но не больше 12 мм. (3) Человек расскажет о тренировках и соревнованиях в видах спорта, сочетающих аэробную выносливость и силу. (4) У человека будет медленная частота сердечных сокращений в состоянии покоя из-за повышенной парасимпатической активности синусового узла, вызванной тренировкой [27]. Если у пациента конечный диастолический размер левого желудочка менее 45 мм и / или толщина стенки левого желудочка более 15 мм, следует заподозрить патологическую гипертрофию левого желудочка [27, 30].Такие тесты, как допплеровская эхокардиограмма или сердечно-сосудистый магнитный резонанс, становятся важными дополнительными инструментами в дифференциальной диагностике у некоторых пациентов. Например, около двух процентов высококвалифицированных взрослых спортсменов-мужчин демонстрируют увеличенную толщину стенки левого желудочка на 13–15 мм, что определяет «серую зону», где перекрываются крайние выражения сердца спортсмена и легкая патологическая гипертрофия левого желудочка [31].
(2) Толщина стенки левого желудочка обычно меньше, но не больше 12 мм. (3) Человек расскажет о тренировках и соревнованиях в видах спорта, сочетающих аэробную выносливость и силу. (4) У человека будет медленная частота сердечных сокращений в состоянии покоя из-за повышенной парасимпатической активности синусового узла, вызванной тренировкой [27]. Если у пациента конечный диастолический размер левого желудочка менее 45 мм и / или толщина стенки левого желудочка более 15 мм, следует заподозрить патологическую гипертрофию левого желудочка [27, 30].Такие тесты, как допплеровская эхокардиограмма или сердечно-сосудистый магнитный резонанс, становятся важными дополнительными инструментами в дифференциальной диагностике у некоторых пациентов. Например, около двух процентов высококвалифицированных взрослых спортсменов-мужчин демонстрируют увеличенную толщину стенки левого желудочка на 13–15 мм, что определяет «серую зону», где перекрываются крайние выражения сердца спортсмена и легкая патологическая гипертрофия левого желудочка [31]. Такую диагностическую неоднозначность часто можно устранить с помощью неинвазивного тестирования, такого как оценка диастолического наполнения с помощью допплеровской эхокардиографии.
Такую диагностическую неоднозначность часто можно устранить с помощью неинвазивного тестирования, такого как оценка диастолического наполнения с помощью допплеровской эхокардиографии.
Благодаря техническому прогрессу, сердечно-сосудистый магнитный резонанс прочно вошел в исследовательскую и клиническую практику сердечно-сосудистой медицины. Хотя эхокардиография является более быстрым и портативным методом, сердечно-сосудистый магнитный резонанс обычно обеспечивает превосходное воспроизводимое качество изображения. И эхокардиография, и магнитный резонанс являются неионизирующими технологиями, которые в современной обстановке безопасности имеют приоритет над методами рентгеновского и гамма-излучения при оценке и долгосрочном лечении пациентов с гипертрофией левого желудочка [32, 33].Изменения массы левого желудочка могут указывать на прогрессирование или регресс гипертонической болезни сердца. Сердечно-сосудистый магнитный резонанс превосходит эхокардиологию из-за отличной воспроизводимости и потому, что эхокардиографические методы зависят от симметрии формы левого желудочка [34].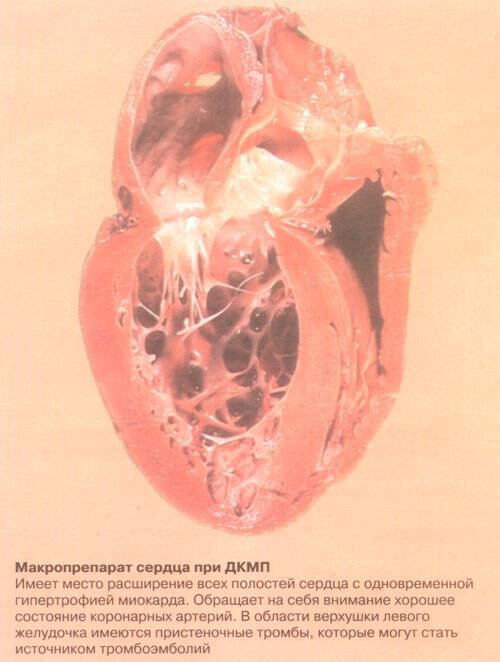 Из-за стоимости эхокардиология чаще используется для клинической оценки пациентов с гипертонией. Однако измерение изменений массы левого желудочка с помощью сердечно-сосудистого магнитного резонанса стало точным полезным инструментом исследования при проверке эффективности фармакологического лечения гипертонической гипертрофии левого желудочка [35].Хотя это не является предметом внимания данной статьи, пациенты могут иметь гипертонию, гипертрофию левого желудочка на электрокардиограмме и увеличенную массу левого желудочка, у которых наблюдается гипертрофическая кардиомиопатия, а не гипертоническая болезнь сердца. Магнитно-резонансная томография сердечно-сосудистой системы полезна для различения гипертонической и гипертрофической кардиомиопатии [36]. Недавние исследования указывают на наличие отличительных гипертрофических фенотипов, обнаруживаемых с помощью многопараметрической магнитно-резонансной томографии.При гипертензии нарушение деформации следует за распределением напряжения стенки левого желудочка.
Из-за стоимости эхокардиология чаще используется для клинической оценки пациентов с гипертонией. Однако измерение изменений массы левого желудочка с помощью сердечно-сосудистого магнитного резонанса стало точным полезным инструментом исследования при проверке эффективности фармакологического лечения гипертонической гипертрофии левого желудочка [35].Хотя это не является предметом внимания данной статьи, пациенты могут иметь гипертонию, гипертрофию левого желудочка на электрокардиограмме и увеличенную массу левого желудочка, у которых наблюдается гипертрофическая кардиомиопатия, а не гипертоническая болезнь сердца. Магнитно-резонансная томография сердечно-сосудистой системы полезна для различения гипертонической и гипертрофической кардиомиопатии [36]. Недавние исследования указывают на наличие отличительных гипертрофических фенотипов, обнаруживаемых с помощью многопараметрической магнитно-резонансной томографии.При гипертензии нарушение деформации следует за распределением напряжения стенки левого желудочка. Напротив, гипертрофическая кардиомиопатия характеризуется уменьшенной глобальной и региональной деформацией в сочетании с фиброзом.
Напротив, гипертрофическая кардиомиопатия характеризуется уменьшенной глобальной и региональной деформацией в сочетании с фиброзом.
5. Нефармакологические стратегии профилактики и регресса патологической гипертрофии
Этим пациентам показана эффективная долгосрочная антигипертензивная терапия, направленная на регресс гипертрофии левого желудочка и требующая специального нефармакологического и фармакологического рассмотрения и лечения.С регрессом гипертрофии левого желудочка диастолическая функция и резерв коронарного кровотока обычно улучшаются, а риск фибрилляции предсердий, застойной сердечной недостаточности и смертности от сердечно-сосудистых заболеваний снижается [37–42]. Целью терапии является артериальное давление 130/80 мм рт. Ст. И выше. Для регресса гипертрофии левого желудочка требуется эффективное снижение артериального давления 24 часа в сутки. У пациентов, которые, кажется, достигли цели, но не регрессируют, можно использовать круглосуточный амбулаторный мониторинг артериального давления, чтобы определить, действительно ли артериальное давление контролируется эффективно.
Помимо контроля артериального давления, ограничение натрия и потеря веса независимо друг от друга способствуют регрессу гипертрофии левого желудочка [43]. Если пациент даже теряет 10 фунтов, это усиливает антигипертензивный эффект лекарств, а связанная с этим потеря веса увеличивает вероятность регресса. Снижение веса, способствующее регрессу гипертрофии левого желудочка, достигалось за счет умеренного ограничения калорий в сочетании с регулярными упражнениями с низким сопротивлением, такими как ходьба 30 минут в день [44].Другие вмешательства для успешного лечения гипертонии, позволяющие регрессировать гипертрофию левого желудочка, включают минимизацию использования нестероидных противовоспалительных препаратов, которые подавляют синтез почечного простагландина, что приводит к сужению почек, задержке солей и воды и трудно поддающимся контролю высоким показателям. артериальное давление [24]. Важно распознать чрезмерное употребление алкоголя и ограничить его как корректируемый фактор для лечения гипертонии.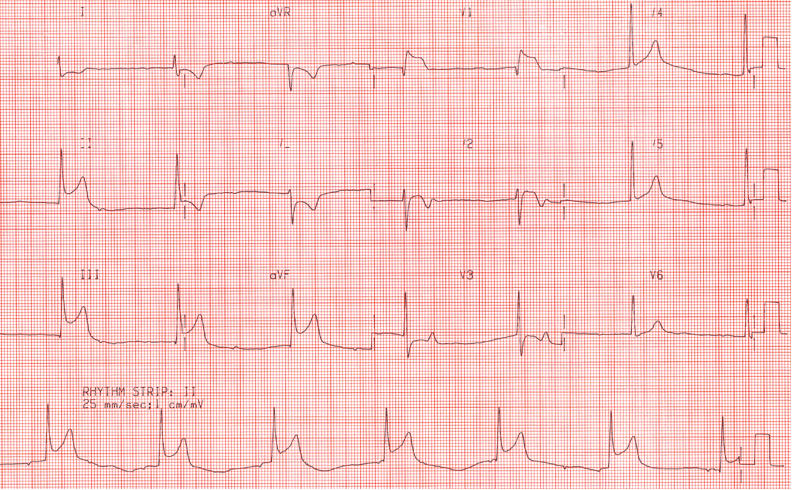 Также важно распознавать апноэ во сне и лечить это состояние, поскольку апноэ во сне может способствовать гипертензии и вызывать ее, а лечение апноэ во сне способствует регрессу гипертрофии левого желудочка [45].
Также важно распознавать апноэ во сне и лечить это состояние, поскольку апноэ во сне может способствовать гипертензии и вызывать ее, а лечение апноэ во сне способствует регрессу гипертрофии левого желудочка [45].
6. Фармакологические стратегии профилактики и регресса патологической гипертрофии
Выбор гипотензивных средств может быть важным при лечении пациентов с гипертонией и гипертрофией левого желудочка. Классы гипотензивных средств, которые наиболее быстро способствуют регрессу гипертрофии левого желудочка, — это ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II, за которыми следуют антагонисты кальциевых каналов [46–49]. Ингибиторы ангиотензин-превращающего фермента и блокаторы рецепторов ангиотензина II особенно эффективны, поскольку было обнаружено, что ангиотензин II оказывает прямое тропическое влияние на патогенез гипертрофии левого желудочка [42, 50, 51].Уменьшение массы левого желудочка может произойти всего за три-шесть месяцев. Прямой ингибитор ренина алискирен также эффективен в облегчении регрессии массы левого желудочка [52]. В настоящее время исследуется потенциальная польза от комбинации блокатора рецепторов ангиотензина II или ингибитора ангиотензинпревращающего фермента с прямым ингибитором ренина. Первоначальное исследование комбинации блокатора рецепторов ангиотензина II с прямым ингибитором ренина не показало аддитивного улучшения регрессии гипертрофии левого желудочка [52].
Прямой ингибитор ренина алискирен также эффективен в облегчении регрессии массы левого желудочка [52]. В настоящее время исследуется потенциальная польза от комбинации блокатора рецепторов ангиотензина II или ингибитора ангиотензинпревращающего фермента с прямым ингибитором ренина. Первоначальное исследование комбинации блокатора рецепторов ангиотензина II с прямым ингибитором ренина не показало аддитивного улучшения регрессии гипертрофии левого желудочка [52].
Ингибиторы ангиотензинпревращающего фермента, по-видимому, также полезны пациентам с гипертрофией левого желудочка, поскольку они улучшают коронарную эндотелиальную функцию за счет опосредованного брадикинином высвобождения оксида азота и снижают потребление кислорода миокардом за счет ингибирования оксидом азота митохондриального дыхания [53]. При назначении у пациентов ингибиторов ангиотензинпревращающего фермента важно предупредить пациентов об опасном для жизни побочном эффекте ангионевротического отека. Этот идиосинкразический побочный эффект наблюдается у небольшого числа пациентов.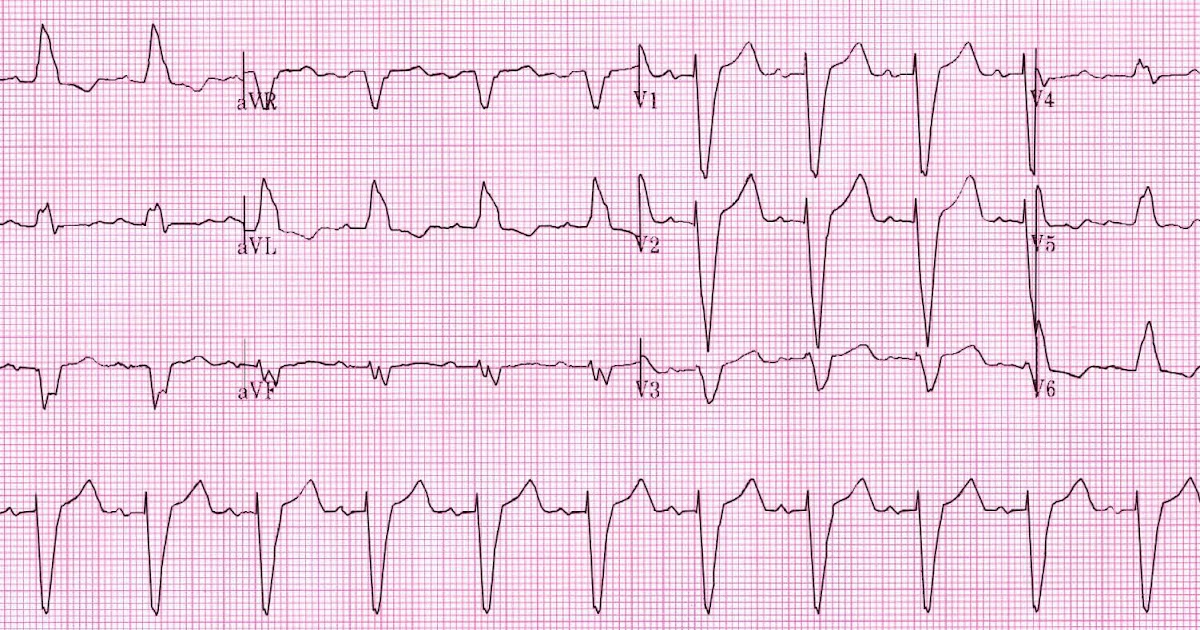 Во время терапии ангиотензинпревращающим ферментом пациенты должны быть предупреждены, если у них начнется одышка или отек горла и языка, им следует прекратить прием ингибитора ангиотензинпревращающего фермента и немедленно обратиться в отделение неотложной помощи, поскольку это потенциально опасно для жизни. угрожающий побочный эффект. При начале приема ингибитора ангиотензинпревращающего фермента, блокатора рецептора ангиотензина II или прямого ингибитора ренина также важно провести скрининг на изменение функции почек. У небольшого числа пациентов с нераспознанным стенозом почечной артерии, будь то заболевание крупных или мелких сосудов, будет наблюдаться снижение перфузионного давления почек из-за потери внутрипочечного ангиотензина II, поддерживающего баланс почечной перфузии между афферентными и эфферентными артериолами.У этих пациентов уровень креатинина в сыворотке повышается из-за снижения скорости клубочковой фильтрации. Это легко обнаружить, измерив базовый уровень креатинина в сыворотке, а затем снова проверив креатинин в течение недели.
Во время терапии ангиотензинпревращающим ферментом пациенты должны быть предупреждены, если у них начнется одышка или отек горла и языка, им следует прекратить прием ингибитора ангиотензинпревращающего фермента и немедленно обратиться в отделение неотложной помощи, поскольку это потенциально опасно для жизни. угрожающий побочный эффект. При начале приема ингибитора ангиотензинпревращающего фермента, блокатора рецептора ангиотензина II или прямого ингибитора ренина также важно провести скрининг на изменение функции почек. У небольшого числа пациентов с нераспознанным стенозом почечной артерии, будь то заболевание крупных или мелких сосудов, будет наблюдаться снижение перфузионного давления почек из-за потери внутрипочечного ангиотензина II, поддерживающего баланс почечной перфузии между афферентными и эфферентными артериолами.У этих пациентов уровень креатинина в сыворотке повышается из-за снижения скорости клубочковой фильтрации. Это легко обнаружить, измерив базовый уровень креатинина в сыворотке, а затем снова проверив креатинин в течение недели. Если креатинин сыворотки повышается более чем на 0,3 мг / дл от исходного уровня, следует прекратить прием ингибитора ангиотензинпревращающего фермента, блокатора рецепторов ангиотензина II или прямого ингибитора ренина, и это обратимое снижение скорости клубочковой фильтрации будет исправлено.
Если креатинин сыворотки повышается более чем на 0,3 мг / дл от исходного уровня, следует прекратить прием ингибитора ангиотензинпревращающего фермента, блокатора рецепторов ангиотензина II или прямого ингибитора ренина, и это обратимое снижение скорости клубочковой фильтрации будет исправлено.
На данный момент испытания ингибитора ангиотензинпревращающего фермента и блокатора рецепторов ангиотензина II предполагают лечение факторов риска, выходящих за рамки высокого кровяного давления, и поэтому должны использоваться у афроамериканских пациентов с гипертонией и гипертрофией левого желудочка независимо от эффектов снижения артериального давления [ 54].Однако контроль артериального давления имеет первостепенное значение для снижения сердечно-сосудистой заболеваемости и смертности у этих пациентов из группы высокого риска. Таким образом, другие классы антигипертензивных средств, таких как диуретики и блокаторы кальциевых каналов, обычно необходимы в сочетании с ингибитором ангиотензинпревращающего фермента или блокатором рецепторов ангиотензина II для достижения целевого артериального давления. Было обнаружено, что кашель с ингибиторами ангиотензинпревращающего фермента чаще встречается у афроамериканцев, чем у белых. Напротив, у блокаторов рецепторов ангиотензина II постоянно обнаружено, что профиль побочных эффектов не выше, чем у плацебо.Следовательно, блокатор рецепторов ангиотензина II может стать важным дополнением к антигипертензивному режиму афроамериканцев с гипертрофией левого желудочка.
Было обнаружено, что кашель с ингибиторами ангиотензинпревращающего фермента чаще встречается у афроамериканцев, чем у белых. Напротив, у блокаторов рецепторов ангиотензина II постоянно обнаружено, что профиль побочных эффектов не выше, чем у плацебо.Следовательно, блокатор рецепторов ангиотензина II может стать важным дополнением к антигипертензивному режиму афроамериканцев с гипертрофией левого желудочка.
Помимо облегчения регресса гипертрофии левого желудочка, антагонисты кальциевых каналов улучшают коронарный кровоток у пациентов с гипертрофией левого желудочка [55, 56]. Антагонисты кальциевых каналов длительного действия безопасны и подходят для лечения гипертоников с гипертрофией левого желудочка.Выбор антагонистов кальциевых каналов должен определяться частотой сердечных сокращений пациента в состоянии покоя и реакцией на упражнения. Если у пациента наблюдается гиперадренергический ответ на физическую нагрузку, верапамил или дилтиазем являются подходящими вариантами для облегчения симптомов, поскольку эти антагонисты кальциевых каналов снижают как частоту сердечных сокращений, так и реакцию артериального давления на упражнения. Напротив, традиционные агенты, блокирующие бета-адренорецепторы, только ослабляют реакцию сердечного ритма на физическую нагрузку и фактически могут (из-за беспрепятственного альфа-сужения) вызывать резкое повышение систолического артериального давления во время тренировки.Напротив, карведилол и лабеталол, которые обладают альфа-блокирующими свойствами, уменьшают как частоту сердечных сокращений, так и реакцию на физическую нагрузку, аналогично верапамилу и дилтиазему, таким образом, обеспечивая симптоматическое облегчение симптомов одышки или стенокардии, а также эти агенты способствуют снижению частоты сердечных сокращений, что позволяет улучшить диастолическое наполнение желудочка. У пожилых пациентов с заболеванием проводящей системы и более низкой частотой сердечных сокращений полезны дигидропиридины, а дигидропиридин, который, по-видимому, лучше всего способствует регрессу гипертрофии левого желудочка, — амлодипин [49].
Напротив, традиционные агенты, блокирующие бета-адренорецепторы, только ослабляют реакцию сердечного ритма на физическую нагрузку и фактически могут (из-за беспрепятственного альфа-сужения) вызывать резкое повышение систолического артериального давления во время тренировки.Напротив, карведилол и лабеталол, которые обладают альфа-блокирующими свойствами, уменьшают как частоту сердечных сокращений, так и реакцию на физическую нагрузку, аналогично верапамилу и дилтиазему, таким образом, обеспечивая симптоматическое облегчение симптомов одышки или стенокардии, а также эти агенты способствуют снижению частоты сердечных сокращений, что позволяет улучшить диастолическое наполнение желудочка. У пожилых пациентов с заболеванием проводящей системы и более низкой частотой сердечных сокращений полезны дигидропиридины, а дигидропиридин, который, по-видимому, лучше всего способствует регрессу гипертрофии левого желудочка, — амлодипин [49].
Несколько линий доказательств предполагают, что сочетание ингибитора ангиотензинпревращающего фермента или блокатора рецепторов ангиотензина II с амлодипином может иметь аддитивные эффекты не только в регуляции артериального давления, но и в облегчении регресса гипертрофии левого желудочка, а также в снижении смертности [49 ].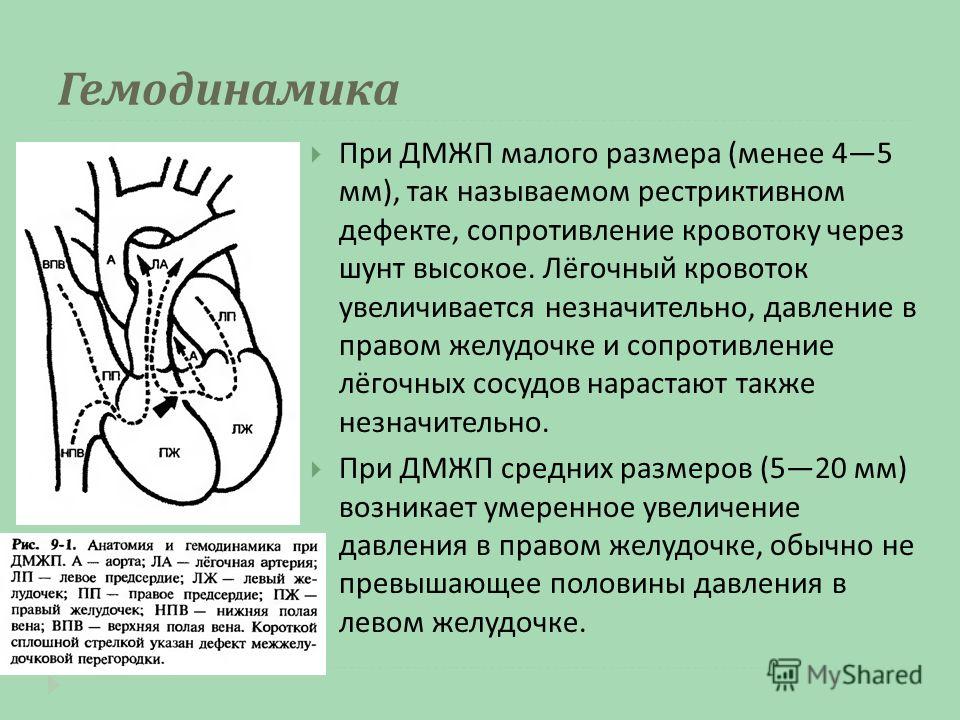 Периферические альфа-адреноблокаторы, диуретики тиазидного типа и даже традиционные агенты, блокирующие бета-адренорецепторы, также позволяют со временем регрессировать гипертрофией левого желудочка [24, 46].Альфа-агонисты центрального действия не были тщательно изучены на предмет их влияния на регресс гипертрофии левого желудочка. Прямые вазодилататоры, такие как миноксидил и гидралазин, которые дополнительно стимулируют ренин-ангиотензин-альдостероновую систему и активность симпатической нервной системы, хотя и эффективны в контроле артериального давления, но неэффективны в отношении регресса гипертрофии левого желудочка [24].
Периферические альфа-адреноблокаторы, диуретики тиазидного типа и даже традиционные агенты, блокирующие бета-адренорецепторы, также позволяют со временем регрессировать гипертрофией левого желудочка [24, 46].Альфа-агонисты центрального действия не были тщательно изучены на предмет их влияния на регресс гипертрофии левого желудочка. Прямые вазодилататоры, такие как миноксидил и гидралазин, которые дополнительно стимулируют ренин-ангиотензин-альдостероновую систему и активность симпатической нервной системы, хотя и эффективны в контроле артериального давления, но неэффективны в отношении регресса гипертрофии левого желудочка [24].
Текущие рекомендации по лечению гипертонических пациентов с гипертрофией левого желудочка основаны на снижении артериального давления и не рекомендуют специально выбирать один бета-блокатор по сравнению с другим, за исключением того, чтобы избегать бета-блокаторов с внутренней симпатомиметической активностью, которая может увеличивать массу левого желудочка и увеличиваться. риск внезапной смерти [24].Однако недавние исследования подчеркивают классовую неоднородность бета-адреноблокаторов и дают прочную основу для предпочтительного использования карведилола у этих пациентов из группы высокого риска. Карведилол — уникальная молекула, сочетающая в себе свойства неспецифического бета-блокатора и специфического альфа-1-блокатора в соотношении 2: 3. Карведилол также обладает антиоксидантными свойствами. Несколько исследований показали, что карведилол значительно снижает массу левого желудочка и фиброз миокарда как у животных, так и у людей [57, 58].У пациентов с гипертонической гипертрофией левого желудочка и сниженным резервом коронарного кровотока лечение карведилолом по сравнению с лечением метопрололом в течение шести месяцев показало большее снижение индекса массы левого желудочка и большее восстановление резерва коронарного кровотока [59].
риск внезапной смерти [24].Однако недавние исследования подчеркивают классовую неоднородность бета-адреноблокаторов и дают прочную основу для предпочтительного использования карведилола у этих пациентов из группы высокого риска. Карведилол — уникальная молекула, сочетающая в себе свойства неспецифического бета-блокатора и специфического альфа-1-блокатора в соотношении 2: 3. Карведилол также обладает антиоксидантными свойствами. Несколько исследований показали, что карведилол значительно снижает массу левого желудочка и фиброз миокарда как у животных, так и у людей [57, 58].У пациентов с гипертонической гипертрофией левого желудочка и сниженным резервом коронарного кровотока лечение карведилолом по сравнению с лечением метопрололом в течение шести месяцев показало большее снижение индекса массы левого желудочка и большее восстановление резерва коронарного кровотока [59].
Пациенты с гипертонической гипертрофией левого желудочка имеют повышенный риск прогрессирования сердечной недостаточности систолической дисфункции левого желудочка [60]. Исследования показали, что ингибиторы ангиотензинпревращающего фермента задерживают развитие застойной сердечной недостаточности [51].Исследования на животных указывают на роль окислительного стресса, вызывающего апоптоз миоцитов, в переходе гипертрофии в систолическую сердечную недостаточность [61]. Карведилол с его полной симпатической блокадой и антиоксидантными свойствами может быть подходящим выбором для профилактики сердечной недостаточности у этих пациентов. Эта концепция подкрепляется положительными эффектами карведилола в отношении снижения заболеваемости и смертности у пациентов после инфаркта миокарда и с систолической застойной сердечной недостаточностью [62, 63].
Исследования показали, что ингибиторы ангиотензинпревращающего фермента задерживают развитие застойной сердечной недостаточности [51].Исследования на животных указывают на роль окислительного стресса, вызывающего апоптоз миоцитов, в переходе гипертрофии в систолическую сердечную недостаточность [61]. Карведилол с его полной симпатической блокадой и антиоксидантными свойствами может быть подходящим выбором для профилактики сердечной недостаточности у этих пациентов. Эта концепция подкрепляется положительными эффектами карведилола в отношении снижения заболеваемости и смертности у пациентов после инфаркта миокарда и с систолической застойной сердечной недостаточностью [62, 63].
Гипертрофия левого желудочка и дислипидемия являются сильными и независимыми предикторами сердечно-сосудистой заболеваемости и смертности при гипертонии. Было показано, что традиционные бета-блокаторы ухудшают инсулинорезистентность, способствуют увеличению веса и повышают уровень триглицеридов [64]. Было обнаружено, что карведилол у гипертоников и диабетиков оказывает нейтральное влияние на инсулинорезистентность, вес и уровень триглицеридов [64]. Этот благоприятный метаболический профиль также предполагает, что карведилол является лучшим выбором по сравнению с традиционными бета-адреноблокаторами для этих пациентов с высоким риском.Аналогичным образом, другие антигипертензивные средства, указанные для лечения пациентов с гипертонией с гипертрофией левого желудочка, включая ингибиторы ангиотензин-превращающего фермента, блокаторы рецепторов ангиотензина II, блокаторы кальциевых каналов и центральные симпатолитики, являются липидно-нейтральными. Напротив, периферические альфа-адреноблокаторы повышают уровень холестерина ЛПВП, а также снижают общий холестерин и холестерин ЛПНП [24]. Диуретики тиазидного типа и в некоторой степени петлевые диуретики повышают общий холестерин.Диуретики тиазидного типа в дозах 6,25 или 12,5 мг в сутки оказывают лишь небольшое влияние на общий холестерин. Следует отметить, что индапамид является липидно-нейтральным и поэтому имеет несколько иное фармакологическое действие на липиды по сравнению с другими диуретиками [24].
Этот благоприятный метаболический профиль также предполагает, что карведилол является лучшим выбором по сравнению с традиционными бета-адреноблокаторами для этих пациентов с высоким риском.Аналогичным образом, другие антигипертензивные средства, указанные для лечения пациентов с гипертонией с гипертрофией левого желудочка, включая ингибиторы ангиотензин-превращающего фермента, блокаторы рецепторов ангиотензина II, блокаторы кальциевых каналов и центральные симпатолитики, являются липидно-нейтральными. Напротив, периферические альфа-адреноблокаторы повышают уровень холестерина ЛПВП, а также снижают общий холестерин и холестерин ЛПНП [24]. Диуретики тиазидного типа и в некоторой степени петлевые диуретики повышают общий холестерин.Диуретики тиазидного типа в дозах 6,25 или 12,5 мг в сутки оказывают лишь небольшое влияние на общий холестерин. Следует отметить, что индапамид является липидно-нейтральным и поэтому имеет несколько иное фармакологическое действие на липиды по сравнению с другими диуретиками [24].
Диуретики в низких дозах усиливают антигипертензивный эффект большинства антигипертензивных препаратов. Пожилые пациенты с жесткими сосудами обычно имеют гипертензию, чувствительную к объему, и низкая доза диуретиков тиазидного типа может быть очень эффективной терапией.Однако, когда клиренс креатинина у пациента составляет менее 50 мл / мин, большинство диуретиков тиазидного типа менее эффективны для контроля объема и гипотензивной терапии. Для этих пациентов альтернативой может быть хлорталидон или индапамид, которые эффективны, несмотря на снижение функции почек. Петлевые диуретики также можно использовать у пациентов с пониженной функцией почек, но для достижения антигипертензивного ответа петлевые диуретики, такие как фуросемид, необходимо назначать дважды в день. У пациентов с резистентной гипертензией диуретики тиазидного типа являются очень важным компонентом фармакологической антигипертензивной терапии.У пациентов с артериальной гипертензией и гипертрофией левого желудочка, нуждающихся в терапии диуретиками, важно поддерживать уровень калия в пределах 4–5 мэкв / л и магния на уровне 2 мэкв / л или выше, чтобы снизить риск желудочковых аритмий [65, 66]. Когда содержание внеклеточного калия меньше 4 мг-экв / л или больше 5 мг-экв / л, предсердные и желудочковые клетки деполяризованы и более склонны к предсердным и желудочковым аритмиям. Было также показано, что внеклеточная гипомагниемия деполяризует мышечные клетки предсердий и желудочков, делая их более склонными к предсердным и желудочковым аритмиям [67].Уровни калия и магния в сыворотке крови отражают внеклеточный калий и магний и, таким образом, являются точным ориентиром для заместительной терапии. Гипертрофия левого желудочка является субстратом для желудочковых аритмий, поскольку гипертрофия левого желудочка удлиняет интервал QT. Гипертрофия левого желудочка на фоне низкого содержания калия и / или магния увеличивает риск желудочковых аритмий и даже внезапной смерти.
Имеются данные, свидетельствующие о том, что блокаторы рецепторов альдостерона, спиронолактон или эплеренон эффективны в облегчении регресса гипертрофии левого желудочка [68].Было обнаружено, что высокие уровни альдостерона у экспериментальных животных усиливают фиброз интерстициального пространства сердца, а фиброз является частью процесса патологической гипертрофии левого желудочка. У экспериментальных животных с гипертрофией левого желудочка использование спиронолактона или эплеренона снижает развитие фиброза при патологической гипертрофии левого желудочка и даже, по-видимому, способствует его регрессу. Если требуется диуретик тиазидного типа, одновременное применение спиронолактона или эплеренона полезно для сохранения калия и магния, а также для облегчения регресса гипертрофии левого желудочка.Следует отметить, что агенты, блокирующие бета-адренорецепторы, ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II, имеют тенденцию нормализовать интервал QT у пациентов с гипертрофией левого желудочка. Используя вышеуказанные фармакологические агенты, важно не только достичь целевого уровня артериального давления 130/80 мм рт.ст. или выше, но и уменьшить вариабельность артериального давления. Выбор антигипертензивных средств с более длительным периодом полураспада оказывает сглаживающее действие на артериальное давление и может объяснить преимущества в отношении смертности ингибиторов ангиотензинпревращающего фермента длительного действия, блокаторов рецепторов ангиотензина II, амлодипина и хлорталидона [69].Ингибиторы ангиотензинпревращающего фермента, блокаторы рецепторов ангиотензина II и дигидропиридиновые блокаторы кальциевых каналов также могут быть эффективными в предотвращении или облегчении регресса гипертрофии левого желудочка, поскольку эти препараты уменьшают отраженные волны давления, тем самым снижая центральное (аортальное) артериальное давление [70]. Снижение центрального (аортального) артериального давления на 3-4 мм рт.ст. с течением времени должно привести к меньшей гипертрофии левого желудочка.
7. Новые подходы к лечению гипертрофии левого желудочка у пациентов с гипертонией
Потенциальная терапевтическая концепция будущего лечения гипертензии и облегчения регресса гипертрофии левого желудочка — ингибиторы 3-гидрокси-3-метилглутарил-кофермента Редуктаза (статины).Было показано, что статины способствуют регрессу гипертрофии левого желудочка на различных животных моделях патологического роста миокарда [71, 72]. В дополнение к уменьшению массы левого желудочка статины, как было показано, уменьшают фиброз миокарда, увеличивают плотность капиллярной сети и ослабляют электрическую нестабильность гипертрофированного сердца. Что наиболее важно, статины улучшили систолическую и диастолическую функцию левого желудочка и даже снизили смертность. Механизмы этих положительных эффектов все еще исследуются.По мере того как статины снижают уровень холестерина, улучшается функция эндотелия, а систолическое кровяное давление снижается на 2–4 мм рт. Подавление гипертрофического роста статинами лишь частично достигается за счет снижения гемодинамической перегрузки. Прямые механизмы, такие как ингибирование нейрогуморальной активации в ткани миокарда, снижение выработки факторов роста и маркеров воспаления, а также снижение окислительного стресса, также, по-видимому, участвуют. Таким образом, статины, по-видимому, обладают другими биологическими эффектами, помимо снижения уровня холестерина.Дополнительный защитный эффект статинов связан с ингибированием экспрессии и активацией небольших гуанозинтрифосфат-связывающих белков, таких как Ras и Rho, которые контролируют интенсивность окислительного стресса, производство и доступность оксида азота, а также экспрессию генов, участвующих в рост миокарда. Данные этих тщательно проведенных исследований на животных документально подтверждают новые эффекты статинов на гипертрофию левого желудочка и открывают потенциальную новую терапевтическую стратегию для пациентов с гипертрофией сердца.Клинические испытания эффективности статинов у пациентов из группы риска с гипертрофией левого желудочка продолжаются.
Другой потенциальной терапевтической мишенью для лечения гипертонии и облегчения регресса гипертрофии левого желудочка являются почечные симпатические эфферентные и афферентные нервы, которые лежат внутри и в непосредственной близости от стенки почечных артерий и способствуют поддержанию гипертонии. [73]. Поскольку причинные факторы гипертензии со временем меняются, денервация как эфферентных, так и афферентных почечных симпатических нервов должна привести к долгосрочному ослаблению гипертензии.Важность почечных нервов у пациентов с гипертонией теперь была определена с новой разработкой чрескожной, минимально инвазивной денервации почек изнутри почечной артерии с использованием радиочастотной энергии в качестве терапевтической стратегии. К настоящему времени исследования показывают, что катетерная денервация почек у пациентов с резистентной эссенциальной гипертензией снижает систолическое артериальное давление на 27 мм рт. Ст. На 12 месяцев, при этом расчетная скорость клубочковой фильтрации остается стабильной [74]. Снижение артериального давления после денервации почек связано со снижением активности периферической симпатической нервной системы, что позволяет предположить, что почка является источником значительного симпатического оттока через активность афферентных почечных нервов.Пациенты, гипертония которых опосредована важными факторами симпатической нервной системы и почек, представляют собой новую потенциальную терапевтическую мишень не только для лечения резистентной гипертензии, но также и для гипертрофии левого желудочка. Поскольку считается, что усиление центрального симпатического оттока способствует гипертрофии левого желудочка, снижение центрального симпатического оттока после почечной денервации может способствовать регрессу гипертрофии левого желудочка. Если это подтвердится в проспективных исследованиях, эта терапия может иметь уникальную ценность в обращении вспять гипертрофии левого желудочка.Эта концепция поддерживается до сих пор в недавнем отчете о 59-летнем пациенте с длительной эссенциальной гипертензией, устойчивой к лечению множественными лекарствами [75]. После денервации почек постепенное снижение систолического артериального давления на 30 мм рт. Ст. В течение 12 месяцев сопровождалось 8-процентным уменьшением массы левого желудочка, измеренной с помощью сердечно-сосудистого магнитного резонанса.
8. Выводы
Гипертоническая гипертрофия левого желудочка — это патологический ответ, приводящий к диастолической дисфункции и снижению резерва коронарного кровотока.Гипертрофия левого желудочка увеличивает риск фибрилляции предсердий, диастолической сердечной недостаточности, систолической сердечной недостаточности и внезапной смерти у пациентов с артериальной гипертензией. Эхокардиограмма и сердечно-сосудистый магнитный резонанс — полезные инструменты для доступа к массе левого желудочка. Независимый контроль артериального давления, ограничения натрия и потери веса способствует регрессу гипертрофии левого желудочка. Ингибиторы ангиотензин-превращающего фермента или блокаторы рецепторов ангиотензина II, за которыми следуют антагонисты кальциевых каналов, наиболее быстро способствуют регрессу гипертрофии левого желудочка.Все больше данных указывает на то, что блокаторы рецепторов альдостерона эффективны в облегчении регресса гипертрофии левого желудочка. Хлорталидон оказался наиболее эффективным диуретиком тиазидного типа для лечения гипертонии. Карведилол, по-видимому, является бета-блокатором выбора у пациентов с гипертонической гипертрофией левого желудочка. Будущие новые подходы к лечению гипертрофии левого желудочка у пациентов с артериальной гипертензией должны способствовать регрессу с помощью статинов и ослабить гипертензию с помощью симпатической почечной денервации почек.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов, имеющего отношение к данной статье.
Благодарность
Особая благодарность Марси Р. Эрвин и Сэнди Следж за подготовку рукописи и литературный поиск ссылок.
Гипертрофия левого желудочка после инсульта: история болезни | Journal of Medical Case Reports
83-летняя белая британская женщина, поступившая в отделение неотложной помощи с двухдневной историей одышки при физической нагрузке и стеснения в груди.Ее история болезни включала постоянную фибрилляцию предсердий, гипертонию, инсульт, остеоартрит и перенесенную ранее операцию на левом плече. В семейном анамнезе не было случаев внезапной смерти или сердечно-сосудистых заболеваний. При осмотре у нее была бибазальная крепитация с систолическим шумом, наиболее громким на верхушке.
Стационарные обследования включают ЭКГ, анализы крови и рентген грудной клетки. Она также прошла эхокардиограмму, контрастную эхокардиограмму, коронарную ангиограмму и МРТ сердечно-сосудистой системы.
Анамнез показал, что ранее она поступала 10 дней назад с головной болью, рвотой, невнятной речью и левосторонним опущением лица. В то время у нее также была одышка, гипертоническая болезнь, гипоксия с рассеянными хрипами и бибазальные крепитации. Ее записи показали, что прикроватная эхокардиограмма, выполненная во время этой госпитализации, показала низкую фракцию выброса (<20%). Кроме того, из ее записей было ясно, что ее лечили внутривенными диуретиками и вливанием тринитрата глицерина для лечения острого отека легких.Магнитно-резонансная томография (МРТ) ее головы, проведенная в том же госпитале, подтвердила острый инфаркт левого мозжечка. Пациент впоследствии лечился от ишемического инсульта мозжечка ударной дозой аспирина (300 мг) и 75 мг аспирина перорально через 2 недели. ЭКГ в то время не показала ГЛЖ. Ее предыдущая эхокардиограмма в 2015 году показала умеренно сниженную систолическую функцию левого желудочка (ЛЖ), утолщение аортального клапана, умеренную трикуспидальную регургитацию, легкую или умеренную митральную регургитацию и легкую легочную регургитацию с расширенными предсердиями.МРТ сердечно-сосудистой системы, проведенное в феврале 2017 года в региональном медицинском центре, показало серьезное нарушение функции бивентрикулов и признаки дилатации предсердий, а также умеренный или тяжелый рубец предсердий.
Диагностический фокус и оценка
ЭКГ, выполненная во время госпитализации, показала фибрилляцию предсердий с нижнебоковой инверсией зубца T (новая с февраля 2017 г.) и ГЛЖ (новая) (рис. 2).
Результаты анализа крови показали повышенный уровень тропонина I на уровне 95, 89 (норма <30 нг / л) при повторении и повышенный уровень натрийуретического пептида головного мозга (BNP) на уровне 1175 (норма <99 пг / мл).
Рентген грудной клетки (рис. 3) показал выступающие верхние доли легочных сосудов в соответствии с отводом легочных сосудов, с отмеченным утолщением интерстициального пространства вдоль правого основания в соответствии с отеком перегородки.
Рис. 3Рентген грудной клетки пациента при поступлении, показывающий признаки, соответствующие интерстициальному отеку
Эхокардиограмма и контрастная эхокардиограмма (рис. 4, 5 и 6) показали, что ее систолическая функция левого желудочка визуально выглядела нормальной и фракция двухплоскостного выброса (EF) 59% без контраста и 61% с контрастом.Важно отметить, что он показал выраженную гипертрофию среднего и апикального ЛЖ, внешний вид соответствовал апикальной гипертрофической кардиомиопатии. Размер межжелудочковой (IV) перегородки составлял 1,3 см (в норме 0,6–1,2 см), а у задней стенки — 1,0 см (в норме 0,6–1,2 см).
Рис. 4Апикальная четырехкамерная контрастная эхокардиография, показывающая апикальную гипертрофию левого желудочка
Рис. 5Апикальная четырехкамерная эхокардиография, показывающая апикальную гипертрофию левого желудочка
Рис.6Другой вид апикальной четырехкамерной эхокардиографии, показывающий апикальную гипертрофию левого желудочка
Коронарная ангиография показала (рис. 7), что на главном стволе левой коронарной артерии имеется эксцентрическая бляшка полочного типа со стенозом, не ограничивающим кровоток. Это обсуждалось с интервенционным кардиологом третичного центра, и было сочтено, что это не вызывает ишемии.
Рис.7Коронарная ангиография, показывающая, что левая основная ножка имеет эксцентрическую бляшку полочного типа со стенозом, не ограничивающим кровоток
МРТ сердечно-сосудистой системы (Рис.8 и 9) сообщили о результатах, которые сильно указывают на апикальную гипертрофическую кардиомиопатию. Размер верхушки ЛЖ составил 12,4 см. Наш пациент отказался от стрессового сканирования перфузии для оценки ишемической нагрузки.
Рис. 8Магнитно-резонансная томография сердечно-сосудистой системы, показывающая апикальную гипертрофию левого желудочка
Рис. 9Магнитно-резонансная томография сердечно-сосудистой системы, показывающая апикальную гипертрофию левого желудочка
Последующее наблюдение и исходы
Она была выписана на ривопарролоксабаз. аторвастатин.Также ее направили в поликлинику кардиомиопатии. Был рекомендован семейный скрининг.
Хронология
| Декабрь 2016 г. | Обращение в местную больницу с одышкой |
| Март 2017 г. | Обращение в другую больницу с головной болью, рвотой и невнятной речью. |
| Апрель 2017 г. | Обращается в районную больницу по поводу стеснения в груди и одышки при физической нагрузке. |
Атрофия сердца и ремоделирование сердца
Ремоделирование сердца после гемодинамической разгрузки
[Обратите внимание, эта страница больше не обновляется]
Введение
Влияние гемодинамической нагрузки на сердце
Животная модель сердечной атрофии, вызванной разгрузкой
Метаболические адаптации
Синтез и деградация белка
Выживание клеток и пути транскрипции гипертрофических генов
Изменения в экспрессии и экспрессии миокарда кальциевые регуляторные белки
Гемодинамическая разгрузка сердечной недостаточности
Ссылки
1.Введение
Поддерживающий жизнь динамический орган, который мы называем сердцем, регулируется балансом гемодинамических и нейрогормональных влияний, который точно поддерживает оптимальную структурную и функциональную стабильность. Изменения, вызывающие любое нарушение этого баланса, способствуют адаптивным реакциям в сердце, которые в совокупности определяются как «ремоделирование». Ремоделирование особенно заметно в левом желудочке (ЛЖ) и широко изучалось при сердечной недостаточности, когда ремоделирование ЛЖ может привести к постепенному ухудшению состояния миокарда.Развитие сердечной недостаточности часто провоцируется устойчивым увеличением гемодинамической нагрузки. В этом обзоре будет рассмотрена роль гемодинамической нагрузки в ремоделировании миокарда LV, чтобы выявить влияние гемодинамической разгрузки на нормальное и пораженное сердце.
2. Влияние гемодинамической нагрузки на сердце
Гемодинамическая нагрузка является важным регулятором целостности миокарда и сократительной функции. Изменения гемодинамической нагрузки вызывают немедленные реакции кардиомиоцитов, которые вызывают быструю адаптацию к изменяющейся среде.Адаптации включают сдвиги в метаболизме субстрата и скорости синтеза и распада белка. Эти сдвиги сопровождаются модуляцией молекулярных путей, регулирующих выживание клеток и экспрессию генов миокарда. Вместе эти адаптации приводят к обширному ремоделированию ЛЖ в ответ на изменение функциональной потребности. Большинство исследований посвящено ремоделированию ЛЖ в результате гемодинамической перегрузки в связи с его клинической значимостью для развития сердечной недостаточности (рис. 1).Гемодинамическая перегрузка вызывает гипертрофию сердца, ведущую к начальному увеличению мышечной массы, чтобы компенсировать увеличение функциональной потребности. Однако при патологических условиях гемодинамической перегрузки функциональная потребность преобладает над нормальными физиологическими компенсаторными механизмами, что приводит к нарушению сократительной способности и структурной целостности миокарда.
Было проведено множество исследований для характеристики ремоделирования желудочков, которое происходит при гипертрофии. Поскольку атрофия сердца не является основным фактором, способствующим сердечной недостаточности или другим сердечным заболеваниям, гораздо меньше исследований посвящено ремоделированию миокарда, которое происходит в ответ на гемодинамическую разгрузку (рис. 1).Атрофия сердца возникает в условиях микрогравитации, голода и потери мышечной массы при хронических болезненных состояниях и представляет собой вторичное последствие, являющееся результатом этих более крупных системных явлений (1). Исследования показали, что снижение гемодинамической нагрузки с помощью вспомогательных устройств для левого желудочка может фактически улучшить работу сердца у ряда пациентов с сердечной недостаточностью (2,3). Следовательно, очень важно понимать механизмы, регулирующие ремоделирование сердца во время атрофии миокарда, вызванной разгрузкой, в дополнение к механизмам, задействованным во время гипертрофии.
Рис. 1 Влияние гемодинамической нагрузки на сердце. Загрузите плакат пути.
3. Животная модель атрофии сердца, индуцированной разгрузкой
Модель гетеротопической трансплантации сердца крысы была надежно использована для изучения индуцированных разгрузкой атрофических изменений миокарда (4-11). Эта модель предполагает трансплантацию изогенного донорского сердца от одной крысы в брюшную полость крысы-реципиента. Это достигается за счет анастомизации восходящей легочной артерии восходящей аорты донора к брюшной аорте и нижней полой вене реципиента соответственно.Гемодинамическая нагрузка на пересаженное сердце значительно снижена по сравнению с родным сердцем. Таким образом, трансплантированное сердце демонстрирует значительно более низкое давление в левом желудочке и сниженную частоту сердечных сокращений, имитируя физиологическую адаптацию к гемодинамической разгрузке (11). Все данные, относящиеся к атрофии сердца, обсуждаемые в этом обзоре, получены в исследованиях, в которых использовалась эта модель.
4. Метаболические адаптации
Метаболические адаптации, которые происходят в ответ на гипертрофию и атрофию сердца, характеризуются снижением аэробного метаболизма в попытке повысить сердечную эффективность (12).На это указывает переход от окисления жирных кислот к метаболизму глюкозы в качестве основного источника энергии и представляет собой возврат к метаболическому состоянию плода (рис. 1,2) (10,12). Снижение аэробного метаболизма тесно связано со снижением сократимости и окислением митохондриальных жирных кислот. Доказательства пониженного окисления жирных кислот как при патологической гипертрофии, так и при атрофии включают снижение уровня транскрипта и активности киназы пируватдегидрогеназы 4 (PDK4), малонил-КоА декарбоксилазы (MCD) и разобщающего белка-3 (UCP-3) (10).Кроме того, уровни транскрипта мРНК PPARa, фактора ядерной транскрипции, регулирующего экспрессию генов PDK4, MCD и UCP-3, также снижаются (10).
5. Синтез и расщепление белка
Гемодинамическая нагрузка регулирует размер кардиомиоцитов, модулируя синтез и распад белка. Повышенный синтез белка во время гипертрофии сердца способствует увеличению размера кардиомиоцитов и массы миокарда. Во время сердечной атрофии скорость синтеза белка также увеличивается, о чем свидетельствует активация передачи сигналов PI3K / mTOR, которая регулирует синтез белка посредством активации p70S6K.Однако было показано, что во время атрофии скорость деградации белка превышает скорость синтеза, что приводит к общему уменьшению размера клеток и массы миокарда (рис. 1) (1,7).
Убиквитиновый протеосомный путь опосредует деградацию многих белков посредством АТФ-зависимого лигирования с убиквитином (рис. 1). Путь убиквитиновых протеосом играет важную роль в деградации белков во время сердечной атрофии, что характеризуется повышенными уровнями экспрессии убиквитина B, убиквитин-конъюгированного фермента Ubch3 и полиубиквитинированных белков (1,7).Убиквитин-лигазы, особенно Mafbx / Atrogin-1 и MuRF-1, являются основными регуляторами сердечной атрофии. Экспрессия этих лигаз регулируется факторами транскрипции FOXO, такими как FOXO3a (1,7). Mafbx / Атрогин-1 нацелен на кальциневрин для опосредованной убиквитином деградации, которая, в свою очередь, ингибирует опосредованную кальциневрином гипертрофическую передачу сигналов (1). С другой стороны, MuRF-1 способствует опосредованной убиквитином деградации протеинкиназы C-e — еще одного ключевого игрока в гипертрофических путях (1). Интересно, что уровни транскриптов Mafbx / Atrogin-1 и MuRF-1 снижаются во время атрофии сердца и повышаются во время гипертрофии.Это связано с повышенной экспрессией инсулиноподобного фактора роста-1 (IGF-1) во время сердечной атрофии, что подавляет активность FOXO3, что приводит к подавлению активности этих лигаз. Однако во время гипертрофии повышенные уровни транскриптов Mafbx / Atrogin-1 и MuRF-1, вероятно, могут служить адаптивным механизмом для ограничения увеличения массы миокарда (1,7).
6. Выживание клеток и пути транскрипции гипертрофических генов
Повышенная экспрессия IGF-1 и фактора роста фибробластов-2 (FGF-2) наблюдается как при гипертрофии, так и при атрофии.Обычно эти факторы роста запускают пути выживания клеток за счет последующей активации Akt (13,14). Повышенная активация Akt наблюдалась в ответ на гипертрофию, вызванную перегрузкой давлением, но не атрофию, вызванную разгрузкой. Это открытие предполагает, что атрофия, в отличие от гипертрофии, притупляет активацию mTOR, нижестоящей мишени Akt (Рисунок 1) (9). Это было подтверждено с использованием ингибитора mTOR, рапамицина, где введение рапамицина дополнительно усиливало атрофический ответ в хронически ненагруженных сердцах (9).Другие сигнальные пути, такие как MAP-киназа и JAK / STAT-пути, усиливаются во время сердечной гипертрофии (13). Атрофия, вызванная разгрузкой, привела к повышенной активации ERK1, но не ERK2, JNK или p38 MAP киназ (рис. 2) (9). Киназы Януса (JAK) регулируют транскрипцию генов посредством активации факторов транскрипции белка STAT (13). Атрофия также способствовала активации белков STAT через путь JAK / STAT (9).
7. Изменения экспрессии генов миокарда и белков, регулирующих кальций
Изменения экспрессии генов миокарда широко изучались при гипертрофии, вызванной перегрузкой давлением.Наблюдаются специфические изменения в экспрессии изоформ тяжелой цепи миозина (MHC) и предсердного натрийуретического фактора (ANF). Патологическая гипертрофия сердца вызывает повышенную регуляцию изоформы bMHC и экспрессии ANF (5,12,15). Этот паттерн экспрессии представляет собой сдвиг в сторону профиля гена миокарда плода и часто сопровождается снижением экспрессии или активности Са2 + АТФазы саркоплазматического ретикулума (SERCA2) (15,16). Вместе эти изменения способствуют нарушению сократительной способности, которое обычно наблюдается при патологической гипертрофии и сердечной недостаточности (рис. 1).Повышенная экспрессия bMHC по сравнению с aMHC снижает сократимость кардиомиоцитов независимо от кальция (17). ANF, который высвобождается кардиомиоцитами предсердий в ответ на стресс миокарда, вызванный перегрузкой давлением, снижает объем крови, что, в свою очередь, снижает сердечный выброс и системное кровяное давление. SERCA2 опосредует начало диастолы, управляя повторным захватом иона кальция саркоплазматическим ретикулумом. Снижение экспрессии и активности SERCA2 нарушает гомеостаз кальция, вызывая аномальные переходные процессы кальция во время систолы и продлевая релаксацию (Рисунок 1) (16).Снижение экспрессии SERCA2 сопровождается активацией натрий-кальциевого обменника (NCX), который пытается компенсировать снижение активности SERCA2 путем вытеснения избытка внутриклеточного кальция (Рисунок 1) (16).
Атрофия сердца, вызванная хронической разгрузкой, генерирует аналогичные сдвиги в сторону увеличения экспрессии bMHC и ANF (5). Снижение скорости снижения внутриклеточного кальция и увеличение времени релаксации были результатом продолжительной разгрузки (4). В отличие от патологической гипертрофии кардиомиоциты атрофированного сердца не демонстрируют аномальных переходных профилей кальция в базовых условиях (4).Однако атрофические кардиомиоциты демонстрировали пониженный сократительный резерв, тогда как стимуляция увеличением внеклеточного [Ca2 +] приводила к уменьшенному фракционному укорочению по сравнению с контрольными кардиомиоцитами (4). В отличие от гипертрофии, в атрофических сердцах не наблюдалось снижения экспрессии белка SERCA2 (4). Экспрессия фосфоламбана (PLB), регулятора активности SERCA2, увеличивается во время длительной разгрузки, способствуя снижению отношения SERCA2 к PLB (Рисунок 1) (4). Уровни экспрессии NCX в атрофическом сердце не изменяются (4).
8. Гемодинамическая разгрузка сердечной недостаточности
Из вышеупомянутых физиологических, метаболических и клеточных изменений очевидно, что ремоделирование миокарда во время сердечной атрофии имеет сходство с патологической гипертрофией. Оба состояния вызывают сдвиги в сторону эмбриональных режимов метаболизма субстратов и экспрессии генов миокарда. Повышенная деградация белка и снижение влияния на гомеостаз кальция миокарда отличают атрофическое ремоделирование от патологического гипертрофического ремоделирования (рис. 1).Тем не менее, эффекты гемодинамической разгрузки на нормальное сердце пагубно сказываются на общей сердечной деятельности. Напротив, гемодинамическая разгрузка, по-видимому, оказывает положительное влияние на сердечную недостаточность, когда индуцируется феномен «обратного ремоделирования» (рис. 1) (2,3).
Вспомогательные устройства левого желудочка (LVAD) работают за счет разгрузки левого желудочка. В частности, LVAD используется для перехода пациентов с сердечной недостаточностью в терминальной стадии к трансплантации сердца и, как было показано, улучшает работу сердца у ряда пациентов с сердечной недостаточностью (2,3).Повышенная скорость сокращения и расслабления, а также повышенная b-адренергическая реакция очевидны в кардиомиоцитах, выделенных из сердца с сердечной недостаточностью, поддерживаемой и не поддерживаемой, 2,3). Нормализация экспрессии SERCA2, NCX и других белков, регулирующих кальций, в сердце, поддерживаемом LVAD, указывает на некоторое восстановление гомеостаза кальция (рис. 2) (3). Хотя наблюдается уменьшение гипертрофии кардиомиоцитов и апоптоза при поддержке LVAD, сигнальный путь, способствующий выживанию, Akt / Gsk-3b не активируется (2,3).Сердца, поддерживаемые LVAD, демонстрируют нормализованную экспрессию UCP-3, но не нормализованную экспрессию других метаболических ферментов, что позволяет предположить, что возврат к окислению жирных кислот является неполным (Рисунок 1) (2). Ремоделирование внеклеточного матрикса за счет деградации коллагена способствует увеличению жесткости стенок при сердечной недостаточности. Несмотря на снижение скорости деградации коллагена, жесткость стенок не обязательно снижается при поддержке LVAD (2,3).
В заключение отметим, что гемодинамическая разгрузка вредна для нормального сердца, но полезна для сердечной недостаточности, улучшая сердечную деятельность за счет обратного ремоделирования.Хотя необходимы дальнейшие исследования для полного понимания множества сложных механизмов, регулирующих обратное ремоделирование, очевидно, что существует много параллельных явлений между атрофией сердца и гипертрофией. Модель трансплантации гетеротопического сердца у крыс дала важную информацию об атрофическом ремоделировании сердца, которую можно изучить при относительном отсутствии других системных влияний. Возможная адаптация модели гетеротопической трансплантации для включения трансплантации перегруженных донорских сердец может обеспечить эффективную экспериментальную установку для дальнейшего изучения роли обратного ремоделирования в клиническом лечении сердечной недостаточности человека.
9. Источники
- Разеги П. и Тэгтмейер Х. Энн. NY. Акад. Sci. Vol 1080: p110-119, 2006
- Burkhoff D., Klotz S., Mancini D.M. J. Сердечная недостаточность. Том 12: p227-239, 2006
- Klotz S., Danser J.A.H, Burkhoff D. Prog. Биофиз. Мол. Биол. Том 97: p479-496, 2008
- Ито К., Накаяма М., Хасан Ф., Ян X., Шнайдер М.Д., Лорелл Б.Х. Circulation Vol 107: p 1176-1182, 2003
- Depre C., Shipley G.L., Chen W., Han Q., Doenst T., Мур М.Л., Степковски С., Дэвис П.Дж., Таегтмайер Х. Nature Med. Том 11: p1269-1275, 1998
- Welsh D.C., Dipla K., McNulty P.H., Mu A., Ojamaa K.M., Klein I., Houser S.R., Margulies K.B. Являюсь. J. Physiol. Heart Circ. Physiol. Vol 281: p1131-1136, 2001
- Razeghi P., Baskin K.K., Sharma S., Young M.E., Stepkowski S., Essop M.F., Taegtmeyer H. Biochem. Биофиз. Res. Comm. Vol 342: p361-364, 2006
- Razeghi P., Sharma S., Ying J., Li Y., Stepkowski S., Reid M.B., Taegtmeyer H. Circulation Vol 108: p2536-2541, 2003
- Sharma S., Ying J., Razeghi P., Stepkowski S., Taegtmeyer H. Cardiology Vol 105: p128-136, 2006
- Taegtmeyer H., Razeghi П., Молодой М.Е. Клин. Exp. Pharm. Physiol. Vol 29: p346-350, 2002
- Geenen D.L., Malhotra A., Buttrick P.M., Scheuer J. Am. J. Physiol. Том 267: ph3149-h3154, 1994
- Rajabi M., Kassiotis C., Razeghi P., Taegtmeyer H. Heart Fail. Ред. Том 12: стр. 331-343, 2007 г.
- Хефти М.А., Хардер Б.A., Eppenberger H.M., Schaub M.C. J. Mol. Cell Cardiol. Vol 29: p2873-2892, 1997
- Ren J., Samson W. K., Sowers J.R. J. Mol Cell Cardiol. Vol 31: 2049-2061, 1999
- McMullen J.R. and Jennings G.L. Clin. Exp. Pharm. Physiol. Vol 34: 255-262, 2007
- Houser S.R., Placiento V., Weisser J. J. Mol. Cell Cardiol. Vol 32: p1595-1607, 2000
- Herron T.J., Vandenboom R., Formicheva E., Mundada L., Edwards T., Metzger J.M. Circulation Res. Том 100: p1182-1190, 2007
Гипертрофия правого желудочка: симптомы, причины, диагностика, лечение
Что такое гипертрофия правого желудочка?
Ваше сердце разделено на левую и правую части.Правая сторона сердца перекачивает кровь в легкие для получения кислорода. Левая сторона перекачивает насыщенную кислородом кровь к остальному телу.
Гипертрофия правого желудочка (также называемая увеличением правого желудочка) возникает, когда мышца в правой части сердца становится утолщенной и увеличенной.
Когда ваше сердце становится больше, оно более подвержено износу. Этот больший размер может повысить кровяное давление в вашем сердце, что увеличивает силу, действующую на артерии и кровеносные сосуды по всему остальному телу.Кроме того, большему сердцу труднее проводить электрические импульсы, которые заставляют его биться, что приводит к серьезным проблемам со здоровьем.
Гипертрофия правого желудочка обычно возникает из-за проблем с вашими легкими. У вас также может быть гипертрофия левого желудочка, но обычно это происходит из-за повышенного артериального давления или проблемы с аортальным клапаном в сердце.
Гипертрофия правого желудочка не всегда вызывает симптомы. Часто левый желудочек пытается компенсировать проблемы с правым желудочком.Это означает, что некоторые люди не знают, что у них гипертрофия правого желудочка, пока она не станет более прогрессивной.
Однако, если у вас гипертрофия правого желудочка из-за основного заболевания легких, такого как легочная артериальная гипертензия, вы можете заметить симптомы, в том числе
- боль / давление в груди
- головокружение
- обморок
- одышка
- отек в нижних конечностях, таких как лодыжки, ступни и ноги
Эти симптомы похожи на симптомы многих других состояний, включая застойную сердечную недостаточность, поэтому лучше обратиться к врачу как можно скорее, если у вас есть какие-либо из них симптомы.
Гипертрофия правого желудочка обычно вызвана заболеванием легких или проблемами со структурой или функцией сердца.
Заболевания легких, связанные с гипертрофией правого желудочка, обычно вызывают легочную артериальную гипертензию, которая приводит к сужению артерий, несущих кровь в легкие. Это могут быть следующие состояния:
Проблемы со структурой или функцией вашего сердца, которые могут вызвать гипертрофию правого желудочка, включают:
Ваш врач сначала спросит вас о вашей истории болезни, а также о любых факторах образа жизни, таких как курение, которые может повлиять на здоровье вашего сердца.
Затем они, вероятно, будут использовать один из трех тестов, чтобы лучше понять, как работает ваше сердце:
- Рентген грудной клетки . Это позволяет вашему врачу увидеть, выглядит ли правая сторона вашего сердца больше, чем обычно.
- Электрокардиограмма (ЭКГ или ЭКГ) . Он измеряет, насколько хорошо ваше сердце проводит электрические импульсы, вызывающие сердцебиение. Если правая сторона вашего сердца больше, вам будет труднее проводить эти импульсы.
- Эхокардиограмма .Эхокардиограмма — это ультразвуковое исследование камер и клапанов сердца. Ваш врач может использовать его, чтобы увидеть, являются ли эти структуры необычно большими.
Ваш врач может использовать комбинацию этих тестов, чтобы подтвердить, есть ли у вас гипертрофия правого желудочка.
Лечение гипертрофии правого желудочка зависит от основной причины. Если причиной является легочная предсердная гипертензия, вам могут потребоваться лекарства, которые помогут расслабить легочную артерию, например силденафил (Revatio).
К другим лекарствам, которые врач может прописать для улучшения сердечной деятельности, относятся:
Если из-за гипертрофии правого желудочка сердцу становится трудно постоянно биться, вам также может понадобиться кардиостимулятор. Это устройство, которое помогает вашему сердцу поддерживать регулярный ритм.
Вам также может потребоваться операция, если у вас есть проблемы со структурой или клапанами сердца, ни одна из которых не может быть решена с помощью одних лекарств.
Если не лечить, гипертрофия правого желудочка может увеличить риск застойной сердечной недостаточности.Если у вас действительно гипертрофия правого желудочка, обязательно строго следуйте плану лечения, рекомендованному врачом.
Вы также можете снизить риск сердечной недостаточности, избегая факторов образа жизни, которые создают дополнительную нагрузку на ваше сердце, например:
- употребление большого количества соленой пищи
- курение
- избыточный вес
- чрезмерное употребление алкоголя
Гипертрофия правого желудочка также может вызвать остановку сердца, из-за которой сердце внезапно перестает биться.Это обычно случается с молодыми спортсменами, которые не знают, что у них есть сердечное заболевание. По этой причине многие молодые спортсмены должны пройти ЭКГ перед тем, как присоединиться к спортивной команде.
Гипертрофия правого желудочка не всегда вызывает симптомы, а это означает, что ее часто не обнаруживают на более поздних стадиях.

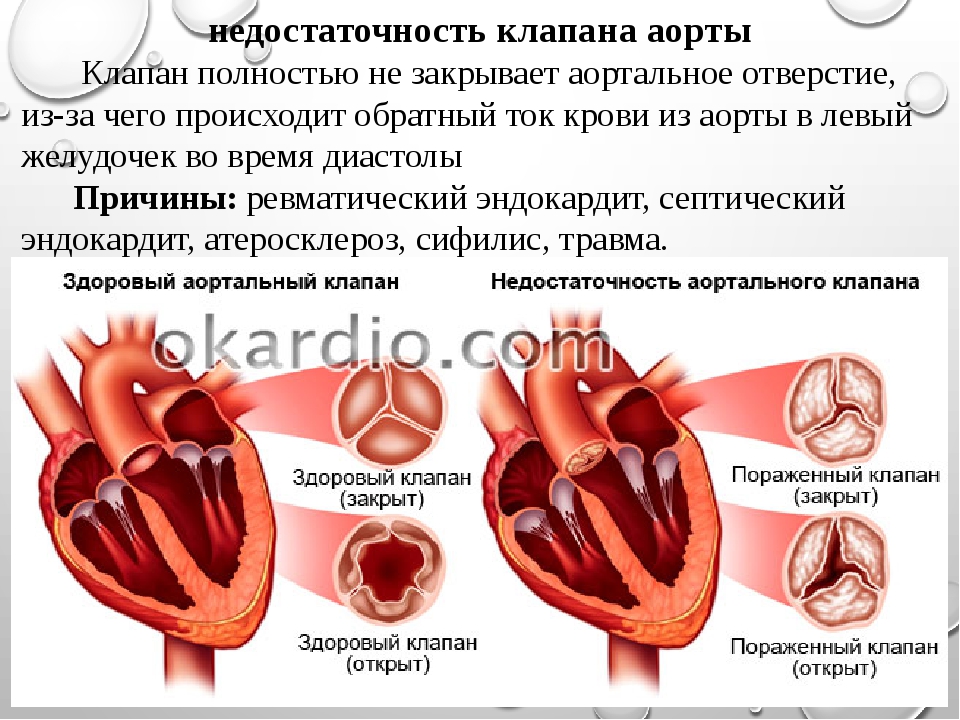
 Ваш врач может найти образцы, которые указывают на нарушение функции сердца и увеличение мышечной ткани левого желудочка.
Ваш врач может найти образцы, которые указывают на нарушение функции сердца и увеличение мышечной ткани левого желудочка.
 Гипертрофию левого желудочка, вызванную гипертрофической кардиомиопатией, можно лечить с помощью лекарств, нехирургических процедур, хирургии, имплантации устройств и изменения образа жизни.
Гипертрофию левого желудочка, вызванную гипертрофической кардиомиопатией, можно лечить с помощью лекарств, нехирургических процедур, хирургии, имплантации устройств и изменения образа жизни. CPAP сохраняет дыхательные пути открытыми, позволяя получать кислород, необходимый для поддержания кровяного давления на нормальном уровне.
CPAP сохраняет дыхательные пути открытыми, позволяя получать кислород, необходимый для поддержания кровяного давления на нормальном уровне.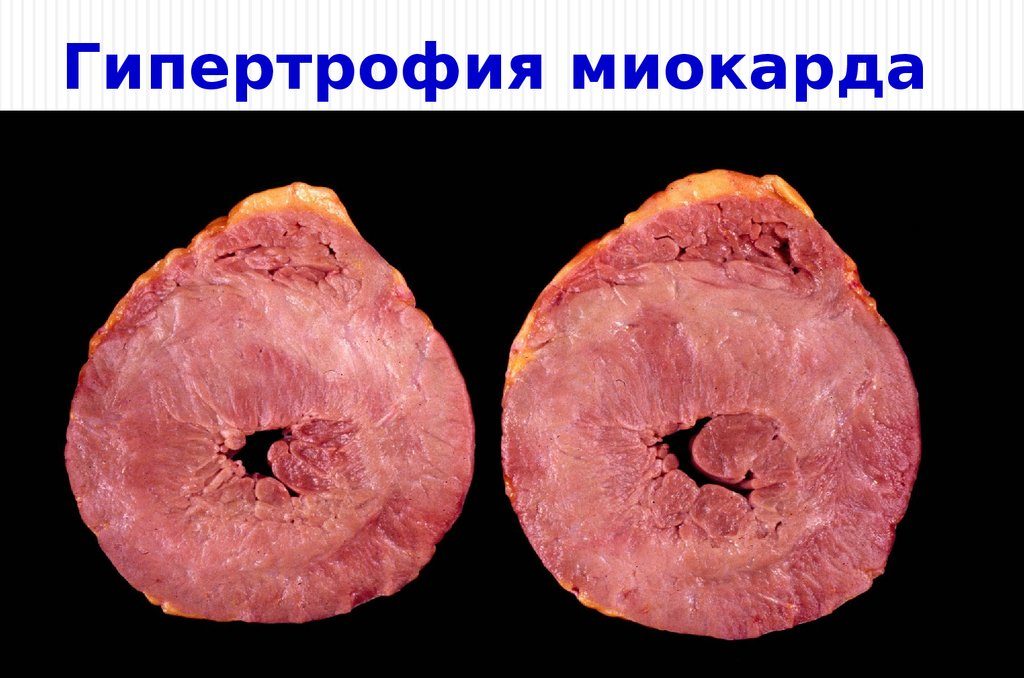 Спросите своего врача, нужно ли вам ограничить определенные физические нагрузки, такие как тяжелая атлетика, которые могут временно повысить кровяное давление.
Спросите своего врача, нужно ли вам ограничить определенные физические нагрузки, такие как тяжелая атлетика, которые могут временно повысить кровяное давление.
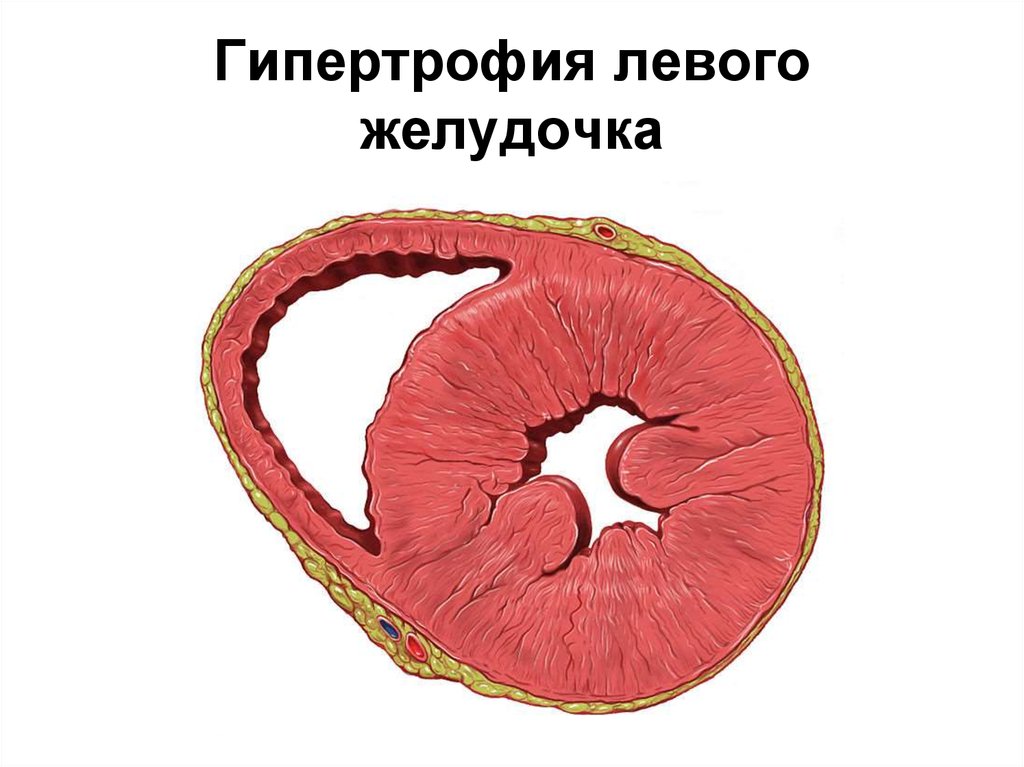 https://www.uptodate.com/contents/search. Проверено 9 октября 2020 г.
https://www.uptodate.com/contents/search. Проверено 9 октября 2020 г. Проверено 9 октября 2020 г.
Проверено 9 октября 2020 г.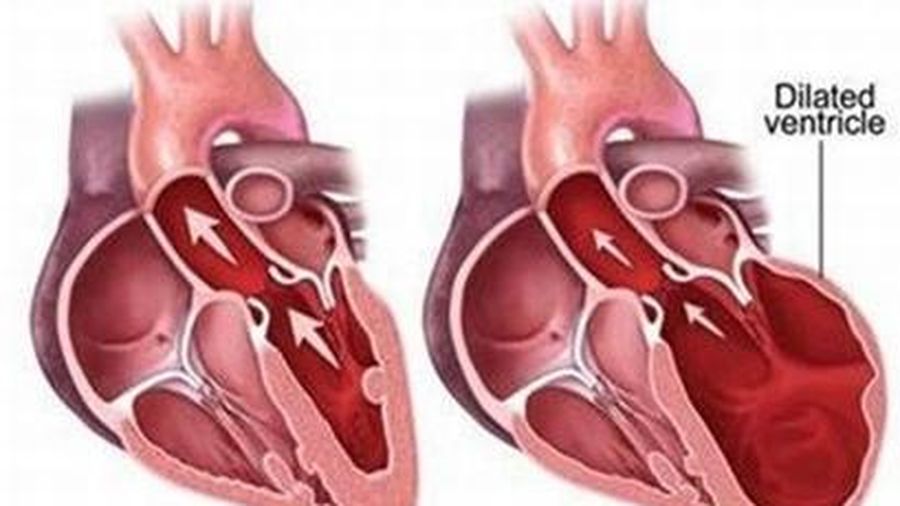
 Wo7ckOdG3cs. Проверено 9 октября 2020 г.
Wo7ckOdG3cs. Проверено 9 октября 2020 г.