Волокнистые астроциты выполняют разграничительные, трофические и опорные функции
В примитивном варианте нервная ткань и состоит только из нейронов и какого-то варианта протоэпендимоцитов.
Развитие прочих видов глии из эпендимной достаточно хорошо прослеживается по сравнительной гистологии хордовых. При общем плане строения, сходном в принципе с организацией нервной трубки ланцетника, отличия у обонятельной выстилки от протонервной ткани, давшей начало мозгу, имеются. Из них стоит отметить то, что вероятным филогенетическим предшественником обонятельных клеток является не ПИК, а реснично-микровиллярная клетка. Следы происхождения части чувствительных клеток от реснично-микровиллярной у турбеллярий несомненны, и у обонятельных клеток позвоночных такие связи прослеживаются: наличие ресничек на булаве. Первично чувствующие нервные клетки гистологи давно выделяют в качестве особой категории нейронов. До сих пор это делали по функциональным соображениям, но имеются и филогенетические основания.
Вследствие разнообразия глиоцитов у высших позвоночных из общих соображений следовало бы ожидать высокой специализации клеток каждого типа, но глиоциты, напротив, мультифункциональны. Вероятная причина этого — филогенетическая «молодость» этих цитотипов. Возникает вопрос, соответствует ли разным дифференцировкам глиоцитов разная детерминация? Или это фенотипы одной эпигеномной наследственности?
Такой вопрос, как увидим далее, будет еще возникать и в отношении клеток других тканей. Он является частным более общей проблемы соотношения детерминации и дифференцировки. Эпендимоциты выполняют разграничительные, гидрокинетические, опорные функции, иногда секретируют. Возможность их превращения в другие виды глиальных клеток описывалась неоднократно. Волокнистые астроциты выполняют разграничительные, трофические и опорные функции. Этому разнообразию функций соответствует и неспециализированный характер цитоскелета астроцитов: в его состав входят глиальный кислый белок, виментин и десмин.
Первый белок характерен лишь для астроцитов, а впментин свойствен для клеток мезенхимного происхождения. Десмин характерен для мышечных клеток. В свете этих данных сообщения о способности астроцитов к фагоцитозу вызывают больше доверия. Судя по характеру цитоскелета, астроциты должны обладать подвижностью. Олигодендроглиоциты, кроме изолирующих и трофических функций, также обладают способностью к фагоцитозу. Сообщения об участии леммоцитов в переваривании миелина дегенерирующих нервных волокон многочисленны. Сателлиты нейронов мозга, способные участвовать в нейронофагии, не все относятся к микроглии.
Еще интересные статьи по теме:
|
|
Isolation and Culture of Mouse Cortical Astrocytes
Методом, описанным здесь, основаны на астроциты подготовки культуру от грызунов новорожденных мозг, первоначально описанный Маккарти и де-Vellis в 1980 27. Модифицированный метод выделения и культуры корковых астроциты от послеродовой P1 до P4 мозга мыши, представленные здесь, быстро, дает чистую первичную астроциты и высокую воспроизводимость. Этот метод может быть легко перенесена, чтобы изолировать астроциты от других видов, таких как крысы или свиньи и из других областей мозга, таких как спинной мозг. В то время как астроциты изоляции клеток-предшественников из неонатального мозга Маккарти и deVellis метод генерирует высоко пролиферативных клеток, клеточной пролиферации и распространения изолированные астроциты постнатального P1-P4 щенков мыши ограничено. После разделения астроциты один раз в 7 дней в пробирке (DIV), они будут расти до слияния и зрелым. В естественных условиях, наиболее астроцитов распространение в основном завершена к P14 32. Онповторно, мы предлагаем использовать астроциты для экспериментов в день от 21 до 28 DIV (рис. 2F) для обеспечения зрелого фенотипа изолированные астроцитов. В связи с внутренней сдержанности, чтобы размножаться астроцитов культуры не должны быть разбиты более чем в 3 раза.
Модифицированный метод выделения и культуры корковых астроциты от послеродовой P1 до P4 мозга мыши, представленные здесь, быстро, дает чистую первичную астроциты и высокую воспроизводимость. Этот метод может быть легко перенесена, чтобы изолировать астроциты от других видов, таких как крысы или свиньи и из других областей мозга, таких как спинной мозг. В то время как астроциты изоляции клеток-предшественников из неонатального мозга Маккарти и deVellis метод генерирует высоко пролиферативных клеток, клеточной пролиферации и распространения изолированные астроциты постнатального P1-P4 щенков мыши ограничено. После разделения астроциты один раз в 7 дней в пробирке (DIV), они будут расти до слияния и зрелым. В естественных условиях, наиболее астроцитов распространение в основном завершена к P14 32. Онповторно, мы предлагаем использовать астроциты для экспериментов в день от 21 до 28 DIV (рис. 2F) для обеспечения зрелого фенотипа изолированные астроцитов. В связи с внутренней сдержанности, чтобы размножаться астроцитов культуры не должны быть разбиты более чем в 3 раза.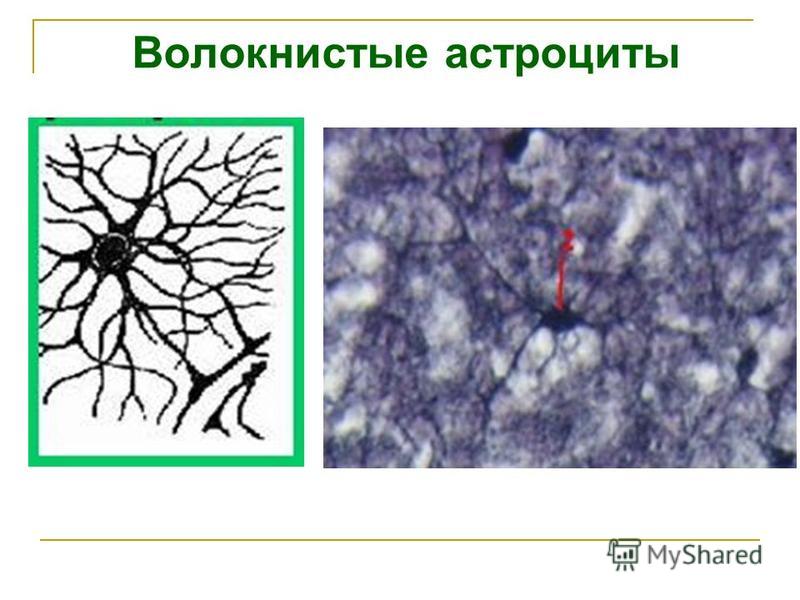
Критические шаги в описанной изоляции метода переваривания коры и следующие растирания переваривают ткани для получения суспензии отдельных клеток. Таким образом, необходимо оптимизировать трипсина концентрацию и время переваривания в целях получения суспензии отдельных клеток после растирания тканей коры головного мозга в течение 20-30 раз. Для того, чтобы свести к минимуму изменения трипсина должны быть аликвоты и циклов замораживания-оттаивания следует избегать. Описанная процедура опирается на посеве смешанных корковых клеток на PDL-покрытием колбы с культурой, которая обеспечивает связывание астроциты и способствует сливной астроцитов слой несколько дней после посева. В то время как PDL-покрытие не является необходимым для астроцитов мaintenance после их отделения от микроглии и олигодендроциты, она может быть выполнена для определенных ниже по течению приложений, таких как immunofluorescene окрашивания. Хорошо времени первого разделения клетки имеет важное значение для целостности клеток и выход. Если астроциты культивируют за пределами они достигли слияния, вы можете потерять большинство клеток из-за недостаточного отряда во время первого раскола клетки. Это не может быть преодолен за счет увеличения времени для отряда, так как обширные время инкубации с трипсином негативно влияет на целостность клеток. В отличие от обшивки корковых суспензии клеток тоже вряд ли приведет к недостаточному образованию сливной астроцитов слоя клеток. Самое лучшее время для первого раскола клетки от 7 до 8 дней после посева смешанной корковых клеток, когда астроциты сливной клеток микроглии и сидеть на верхнем положении астроцитов слоя.
Если астроциты культивируют за пределами они достигли слияния, вы можете потерять большинство клеток из-за недостаточного отряда во время первого раскола клетки. Это не может быть преодолен за счет увеличения времени для отряда, так как обширные время инкубации с трипсином негативно влияет на целостность клеток. В отличие от обшивки корковых суспензии клеток тоже вряд ли приведет к недостаточному образованию сливной астроцитов слоя клеток. Самое лучшее время для первого раскола клетки от 7 до 8 дней после посева смешанной корковых клеток, когда астроциты сливной клеток микроглии и сидеть на верхнем положении астроцитов слоя.
В описанных корковых культуры клеток, астроцитов показать сотовой неоднородности (<сильная> рис. 3), как это было описано для астроцитов в естественных 33,34. Тем не менее, определяющих разнообразные астроцитов морфологии и функциональности был затруднен ограниченным количеством маркеров, чтобы идентифицировать и отличать потенциально гетерогенных астроцитов подтипов.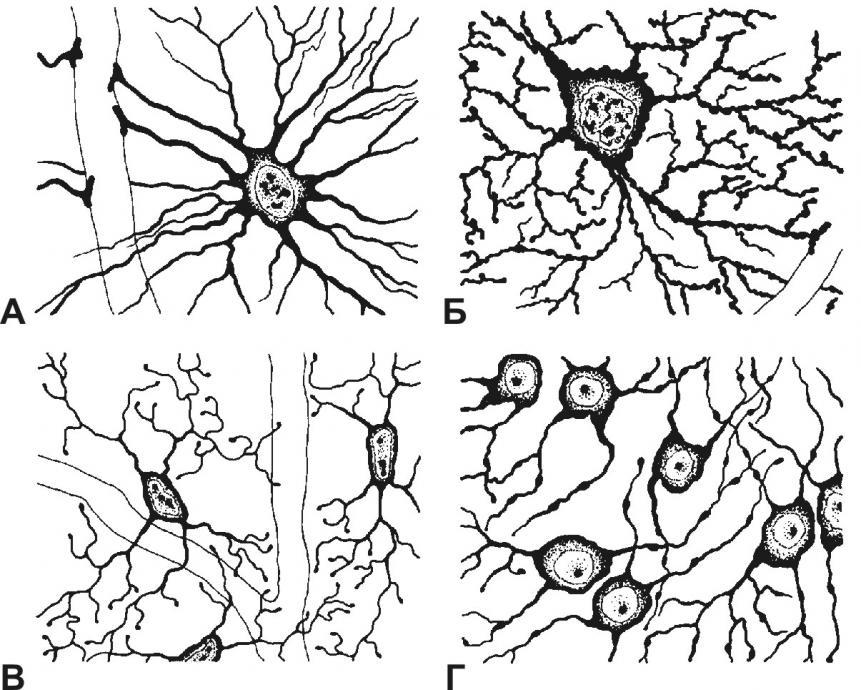 Также характеризуется маркер зрелых волокнистых и реактивных астроцитов является GFAP. Тем не менее, GFAP едва выраженные зрелые протоплазматических астроцитов, что ограничивает его использование в качестве маркера для всех астроцитов, и это выражается также RG клеток в процессе развития и В-клеток у взрослых, ограничивающих его использование в качестве стадии специфического маркера. Другие маркеры астроцитов, в том числе GLAST, ALDh2L1 или BLBP, также выразил незрелыми астроциты и, следовательно, не только отмечать зрелых астроцитов. И, наконец, зрелый астроцитов маркеров, таких как GFAP, аквапорин-4 и S100B (рис. 3) являются более до-регулируется во время послеродового созревания.
Также характеризуется маркер зрелых волокнистых и реактивных астроцитов является GFAP. Тем не менее, GFAP едва выраженные зрелые протоплазматических астроцитов, что ограничивает его использование в качестве маркера для всех астроцитов, и это выражается также RG клеток в процессе развития и В-клеток у взрослых, ограничивающих его использование в качестве стадии специфического маркера. Другие маркеры астроцитов, в том числе GLAST, ALDh2L1 или BLBP, также выразил незрелыми астроциты и, следовательно, не только отмечать зрелых астроцитов. И, наконец, зрелый астроцитов маркеров, таких как GFAP, аквапорин-4 и S100B (рис. 3) являются более до-регулируется во время послеродового созревания.
В наших руках, АСТrocyte культур в возрасте 4 недель имеют характеристики зрелых астроцитов в естественных условиях. Использование первичных культурах астроцитов мы могли бы определить молекулярный механизм, как кровь родился белка фибриногена индуцирует активации астроцитов 17. Наши исследования показали, что фибриноген является носителем скрытой TGF-β. Лечение первичного астроциты с фибриногеном привело к активному TGF-β формирования и активацию TGF-β/Smad сигнального пути в астроциты 17,26. Эти результаты были подтверждены с помощью инъекций фибриногена в естественных условиях. Кроме того, астроциты управлять другими типами клеток по выделению веществ, которые могут быть проанализированы по уборке астроцитов-кондиционированной среды и применения этой кондиционированной среды в другие типы клеток. Мы использовали астроцитов-кондиционированной среды для анализа в функциональном анализе как кондиционированной среды фибриногена обработанных астроциты влияет на рост аксонов. Реактивная астроциты экспресс и секретируютБелки CSPG семьи, которые ингибируют рост аксонов 16. Действительно, кондиционированной среды из фибриногена обработанных астроцитов значительно снизились как по длине аксонов и процент клеток с нейритов 17.
Наши исследования показали, что фибриноген является носителем скрытой TGF-β. Лечение первичного астроциты с фибриногеном привело к активному TGF-β формирования и активацию TGF-β/Smad сигнального пути в астроциты 17,26. Эти результаты были подтверждены с помощью инъекций фибриногена в естественных условиях. Кроме того, астроциты управлять другими типами клеток по выделению веществ, которые могут быть проанализированы по уборке астроцитов-кондиционированной среды и применения этой кондиционированной среды в другие типы клеток. Мы использовали астроцитов-кондиционированной среды для анализа в функциональном анализе как кондиционированной среды фибриногена обработанных астроциты влияет на рост аксонов. Реактивная астроциты экспресс и секретируютБелки CSPG семьи, которые ингибируют рост аксонов 16. Действительно, кондиционированной среды из фибриногена обработанных астроцитов значительно снизились как по длине аксонов и процент клеток с нейритов 17.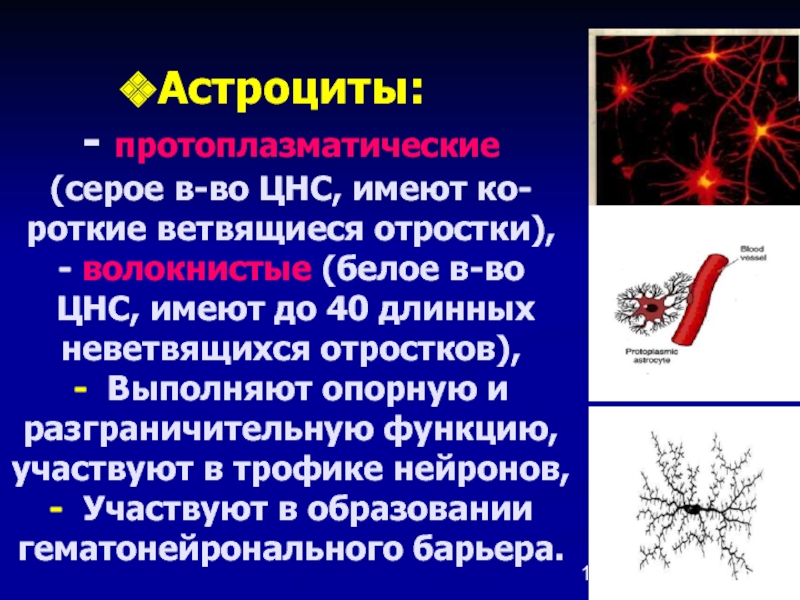
Изоляции и культуры корковых астроцитов, описанные в этой протокол представляет собой мощный инструмент для исследования астроцитов биологии, так как их управляемости в различных приложениях может значительно завершить расследование в естественных условиях. Следует, однако, иметь в виду, что полученные астроциты были культивировали в пробирке и в то время как они отражают многие астроцитов характеристик, они также отличаются от астроцитов в естественных условиях. Таким образом, другие методы прямого отбора и изоляции астроцитов по immunopanning 35 или на основе антител FACS изоляции 36 представляет новые возможности для дальнейшего изучения фундаментальных свойств астроцитов.
Subscription Required. Please recommend JoVE to your librarian.
Глия: окраска
МЕТОДЫ ОКРАШИВАНИЯ ГЛИИ
Методика Снесарева
(выявление волокнистой, астроцитарной глии и глиальных волокон)
Методика высокоизбирательна, позволяет выявить астроциты белого вещества ЦНС, глиальные волокна, а в нервных клетках — феномен центральной тинкториальной ацидофилии (ЦТА) и одновременно бета-зернистость [Снесарев П. Е., 1950]. Преимущество методики Снесарева перед методикой Рамон-и-Кахаля заключается в получении дифференцированной окраски органелл астроцитов (цитоплазма, ядро, отростки). Дополнительно выявляют эритроциты в сосудах и дренажную снесаревскую олигодендроглию.
Е., 1950]. Преимущество методики Снесарева перед методикой Рамон-и-Кахаля заключается в получении дифференцированной окраски органелл астроцитов (цитоплазма, ядро, отростки). Дополнительно выявляют эритроциты в сосудах и дренажную снесаревскую олигодендроглию.
Материал фиксируют в 10 % формалине.
Срезы толщиной 8— 10 мкм получают на замораживающем микротоме.
1. Ополаскивают срезы в 2 сменах дистиллированной воды и помещают в профильтрованный 1 % водный раствор эритрозина (1 г эритрозина на 100 мл дистиллированной воды) на 20 — 30 с (в зависимости от восприимчивости красителя).
2. Срезы тщательно промывают в 2 и более сменах дистиллированной воды до прекращения отхождения краски.
3. Переносят в 0,5 % раствор фосфорно-молибденовой кислоты на 35 —40 с.
4. Быстро промывают в дистиллированной воде, переносят на предметное стекло, смазанное смесью белка и глицерина, тщательно протирают мягкой тканью стекло вокруг среза, промокают сложенной в 4 раза фильтровальной бумагой, а затем смоченной метилхлороформом (1 часть метилового спирта + 2 части хлороформа).
5. Стекла со срезами помещают в раствор Мая—Грюнвальда на 3 — 5 с.
6. Промывают в водопроводной воде в течение 3 — 5 с до удаления излишка красителя, протирают стекло тканью и промокают фильтровальной бумагой.
7. Обезвоживают в ацетоне, просветляют в ксилоле и заключают в бальзам под покровное стекло.
Для приготовления 0,5 % раствора фосфорно-молибденовой кислоты на 200 мл дистиллированной воды берут 1 г фосфорно-молибденовой кислоты, взбалтывают. В полученном растворе имеется осадок. Раствор помещают на 2 — 3 ч в термостат при 37 — 40 °С, пока осадок не растворится (раствор должен быть абсолютно прозрачным).
Результат: на нежно-голубовато-синеватом фоне определяются такого же оттенка астроциты (ядро, цитоплазма, отростки). Вследствие патологических изменений астроцитарная клетка может настолько измениться, что патоморфоз в виде амебоидного астроцита бывает не всегда ясен. Ядра дренажной олигодендроглии в белом веществе также имеют светло-синеватую окраску, иногда с розоватым оттенком (метахромазия).
Следует иметь в виду, что фосфорно-молибденовая кислота и метилхлороформ могут пережечь ткань (появляется дырчатость), излишек эритрозина обусловливает появление розовых пятен, при излишке раствора Мая — Грюнвальда и чрезмерной толщине срезов (более 8—10 мкм) срез становится грубым и тонкая структура астроцитов плохо дифференцируется.
——————————————————————
Методика Рамон-и-Кахаля
(выявление волокнистой и астроцитарной глии)
Материал фиксируют в 10 % формалине.
Срезы толщиной 8 — 10 мкм получают на замораживающем микротоме, хранят в свежем 10 % кислом формалине.
1. Срезы промывают в 3 сменах дистиллированной воды и переносят на 2 сут в свежий бромистый фиксатор (14 мл нейтрального формалина, 2 г бромида аммония и 100 мл дистиллированной воды).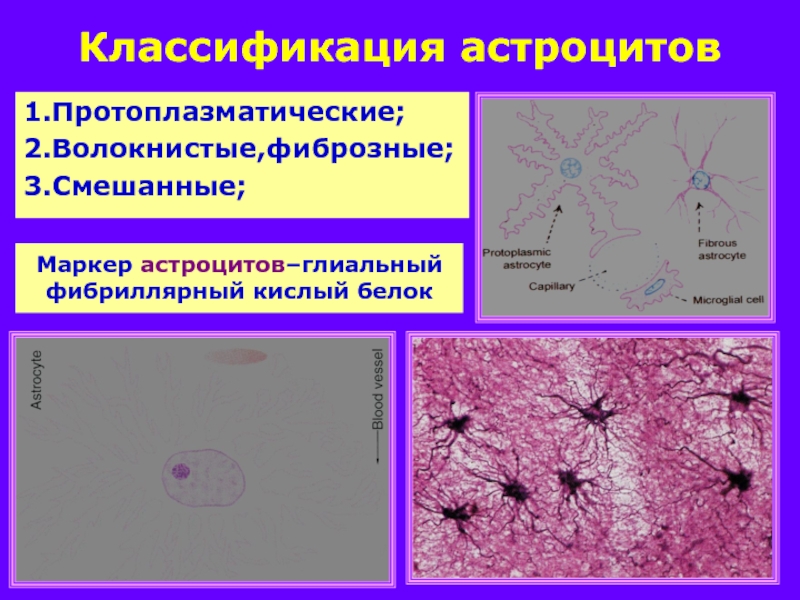
2. Тщательно промывают в 3 сменах дистиллированной воды и переносят в раствор трихлорида золота с сулемой (8 мл 5 % прозрачного раствора сулемы, 10 мл 1 % раствора трихлорида золота и 60 мл дистиллированной воды) на 1 сут в темное место.
3. Промывают в 3 сменах дистиллированной воды и помещают в 5 % раствор тиосульфата натрия на 1 мин.
4. Переносят в дистиллированную воду, затем наклеивают на предметное стекло, смазанное смесью белка с глицерином, подсушивают на воздухе до полного высыхания.
5. Просветляют в ксилоле и заключают в бальзам под покровное стекло.
Результат: в белом веществе на сиреневом фоне (разной интенсивности) четко определяются черновато-фиолетовые фиброзные астроциты, а в сером веществе — более светлые.
——————————————————————
Методика Мийагавы в модификации Александровской
(выявление мезенхимной глии)
Методику используют для выявления клеток микроглии, перицитов (гематогенных гистиоцитов), а также клеток олигодендроглии (плотных и дренажных). Одновременно обнаруживают зернистые шары и дельта-зернистость; в мягкой мозговой оболочке окрашиваются пигментные клетки (хроматофоры), могут выявляться фиброзные астроциты.
Одновременно обнаруживают зернистые шары и дельта-зернистость; в мягкой мозговой оболочке окрашиваются пигментные клетки (хроматофоры), могут выявляться фиброзные астроциты.
Материал фиксируют в 10 % формалине не менее 12 дней, затем промывают проточной водой в течение 2 сут и заливают в желатин. Вырезанные из желатина кусочки помещают в 10 % кислый формалин на 1 сут (в нем их можно длительно хранить). Перед резкой на замораживающем микротоме желательно промыть кусочки в проточной воде около 1 — 2 ч (материал лучше режется).
Толщина срезов 15-20 мкм.
Срезы хранят в 10 % кислом формалине.
1. Срезы промывают в 2 сменах дистиллированной воды и помещают в 10 % кислый формалин на 20 мин (можно до 3 ч).
2. Переносят без промывания в щелочной раствор (1 капля гидроокиси натрия на 10 мл дистиллированной воды) на 40 —60 с.
3. Промывают в 2 сменах дистиллированной воды.
4. Импрегнируют в растворе аммиачного серебра 1 —2 мин.
5. Переносят в горячий 10 % кислый формалин, который подогревают под вытяжкой на спиртовке. В случае помутнения формалина его следует заменить. В горячем формалине срезы приобретают золотистый цвет.
В случае помутнения формалина его следует заменить. В горячем формалине срезы приобретают золотистый цвет.
6. Помещают в холодный 10 % кислый формалин (в нем их можно оставить до следующего дня).
7. Промывают в 2 — 3 сменах водопроводной воды, наклеивают на предметное стекло, смазанное смесью белка с глицерином и дают просохнуть на воздухе.
8. Просветляют в ксилоле (если на препарате видны мутные пятна, то его опускают на 2 — 3 с в ацетон и вновь переносят в ксилол до просветления), заключают в бальзам под покровное стекло.
В случае недостаточного выявления микроглии, особенно олигодендроглии, желатиновые срезы следует перенести из формалина, в котором их хранят, в смесь Дубранского (срезы перед этим промывают в 2—3 сменах дистиллированной воды) на срок от 2—3 сут до 2—3 нед, обязательно меняя смесь через 2—3 дня.
Для приготовления смеси Дубранского в 100 мл нагретой до кипения дистиллированной воды осторожно всыпают 6 г гидрокарбоната натрия, еще раз доводят до кипения, охлаждают, фильтруют.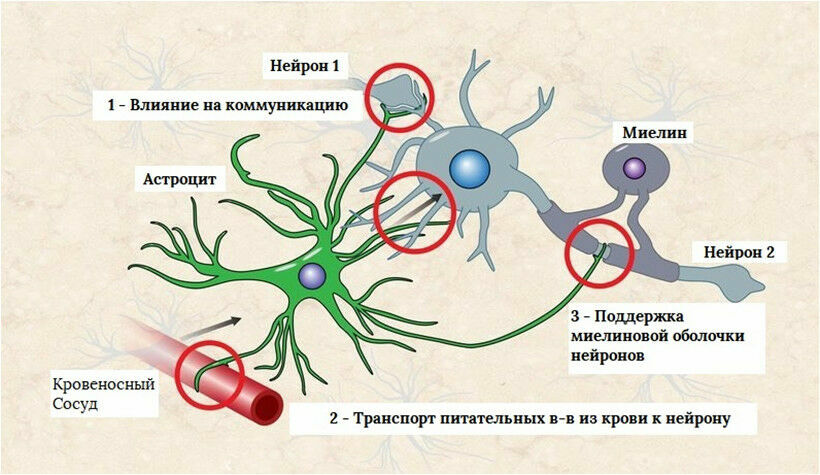 В полученный раствор добавляют 6 мл неразведенного нейтрального формалина и 6 капель 25 % аммиака.
В полученный раствор добавляют 6 мл неразведенного нейтрального формалина и 6 капель 25 % аммиака.
Результат: на светло-янтарном фоне видны ветвистые клетки микроглии, перициты, плотные и дренажные клетки олигодендроглии, имеющие цвет от светло-коричневого до темно-коричневого. Дренажные клетки в белом веществе ткани головного мозга светло-коричневые, часто светло-желтые. Хроматофоры в мягкой мозговой оболочке, изредка в сосудах вещества мозга — черного цвета. Иногда в белом веществе коры и подкорковых образованиях одновременно выявляют волокнистые астроциты светло-коричневого цвета. Старческие бляшки имеют цвет от светло- до темно-коричневого.
——————————————————————
Метод Хорнеца (выявление фиброзных астроцитов)
Материал фиксируют в 10 % кислом формалине, срезы получают на замораживающем микротоме. Хорошие результаты удается получить также на материале, заключенном в парафин.
1. Срезы переносят в дистиллированную воду, на 100 мл которой добавлено 15 капель раствора аммиака (недолго).
2. Помещают в 5 % раствор бромисто-водородной кислоты на 1 ч при температуре 37 °С.
3. Промывают в 3 сменах дистиллированной воды, а затем в дистиллированной воде, к которой добавлено несколько капель уксусной кислоты.
4. Переносят на 15—24 ч в раствор, состоящий из 1 г трихлорида золота в 75 мл дистиллированной воды +25 мл 2 % сулемы+18 мл дистиллированной воды + 15 капель уксусной кислоты, препараты приобретают темно-коричневую или красно-коричневую окраску.
5. Помещают в 5 % раствор щавелевой кислоты (до приобретения ими серой окраски).
6. Ополаскивают в дистиллированной воде, переносят в 5 % раствор тиосульфата натрия с несколькими каплями раствора аммиака; быстро ополаскивают и заключают.
Результат: на сиреневом фоне выявляются темно-синие фиброзные астроциты с отростками, видны капилляры и красные эритроциты в их просвете.
Возможные осложнения: при использовании старого раствора бромисто-водородной кислоты и передержке в ней препарата выпадают артефактные синие глыбки неправильной формы.
место глиальных клеток в гипотезах возникновения болезни Альцгеймера
1088 КУШНИРЁВА и др.
25. Guerreiro R., Wojtas A., Bras J., Carrasquillo M., Rogaeva E., Majounie E., Cruchaga C., Sassi C.,
Kauwe J.S., Younkin S., Hazrati L., Collinge J., Pocock J., Lashley T., Williams J., Lambert J.C.,
Amouyel P., Goate A., Rademakers R., Morgan K., Powell J., St George-Hyslop P., Singleton A.,
Hardy J.; Alzheimer Genetic Analysis Group. TREM2 variants in Alzheimer’s disease. N. Engl.
J. Med. 368(2): 117–127. 2012.
26. Celarain N., Sanchez-Ruiz de Gordoa J., Zelaya M.V., Roldán M., Larumbe R., Pulido L., Echa-
varri C., Mendioroz M. TREM2 upregulation correlates with 5-hydroxymethycytosine enrich-
ment in Alzheimer’s disease hippocampus. Clin. Epigenetics. 8: 37. 2016.
8: 37. 2016.
27. Korvatska O., Leverenz J.B., Jayadev S., McMillan P., Kurtz I., Guo X., Rumbaugh M., Matsu-
shi ta M., Girirajan S., Dorschner M.O., Kiianitsa K., Yu C.E., Brkanac Z., Garden G.A ., Raskind W.H.,
Bird T.D. R47H Variant of TREM2 Associated With Alzheimer Disease in a Large Late-Onset
Family: Clinical, Genetic, and Neuropathological Study. JAMA Neurol. 72(8): 920–927.
2015.
28. Baranowski J.B., Bott K.N., MacPherson R.E.K. Evaluation of neuropathological effects of a
high-fat high-sucrose diet in middle-aged male C57BL6/J mice. Physiol. Rep. 6(11): e13729.
2018.
29. Solomon A., Kivipelto M., Wolozin B., Zhou J., Whitmer R.A. Midlife serum cholesterol and in-
creased risk of Alzheimer’s and vascular dementia three decades later. Dement. Geriatr. Cogn.
Disord. 28(1): 75–80. 2009.
30. Yaffe K., Lindquist K., Schwartz A.V., Vitartas C., Vittinghoff E., Satterfield S., Simonsick E.M.,
Launer L., Rosano C. , Cauley J.A., Harris T. Advanced glycation end product level, diabetes,
, Cauley J.A., Harris T. Advanced glycation end product level, diabetes,
and accelerated cognitive aging. Neurology. 77(14): 1351–1356. 2011.
31. Rusanen M., Kivipelto M., Quesenberry C.P., Zhou J., Whitmer R.A. Heavy Smoking in Midlife
and Long-term Risk of Alzheimer Disease and Vascular Dementia. Arch. Intern. Med. 171(4):
333–339. 2011.
32. Scarmeas N., Luchsinger J.A., Brickman A.M., Cosentino S., Schupf N., Xin-Tang M., Gu Y.,
Stern Y. Physical activity and Alzheimer disease course. Am. J. Geriatr. Psychiatry. 19(5): 471–
481. 2011.
33. Masters C.L., Bateman R., Blennow K., Rowe C.C., Sperling R.A., Cummings J.L. Alzheimer’s
disease. Nature Rev. Disease Primers. 1: 15056. 2015.
34. Qiu C., Kivipelto M., von Strauss E. Epidemiology of Alzheimer’s disease: occurrence, deter-
minants, and strategies toward intervention. Di a l o gues C l i n. Neuro s ci. 11(2): 111 – 128. 200 9.
35. Alzheimer’s Association. 2012 Alzheimer’s disease facts and figures.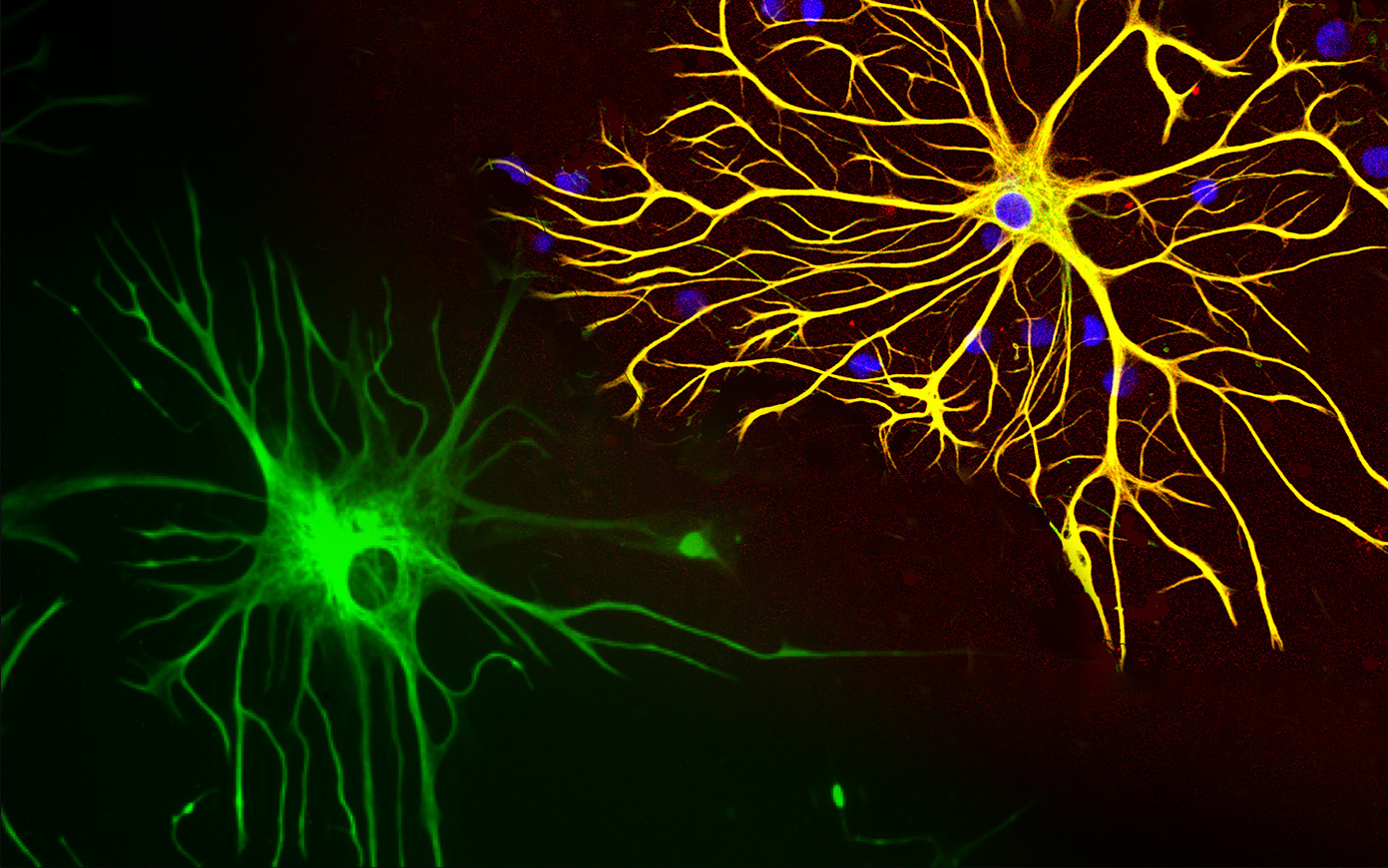 Alzheimer’s & Dementia.
Alzheimer’s & Dementia.
J. Alzheimer’s Assoc. 8(2): 131–168. 2012.
36. Alzheimer’s Association. 2016 Alzheimer’s disease facts and figures. Alzheimer’s & Dementia.
J. Alzheimer’s Assoc. 12(4): 459–509. 2016.
37. Chin A.L., Negash S., Hamilton R. Diversity and disparity in dementia: the impact of ethnora-
cial differences in Alzheimer disease. Alzheimer Dis. Assoc. Disord. 25(3): 187–195. 2011.
38. Hebert L.E., Weuve J., Scherr P.A., Evans D.A. Alzheimer disease in the United States (2010–
2050) estimated using the 2010 census. Neurology. 80(19): 1778–1783. 2013.
39. Altmann A., Tian L., Henderson V.W., Greicius M.D. Alzheimer’s Disease Neuroimaging Initiative
Investigators. Sex modifies the APOE-related risk of developing Alzheimer disease. Ann. Neu-
rol. 75(4): 563–573. 2014.
40. Mielke M.M., Vemuri P., Rocca W.A. Clinical epidemiology of Alzheimer’s disease: assessing
sex and gender differences. Clin. Epidemiol.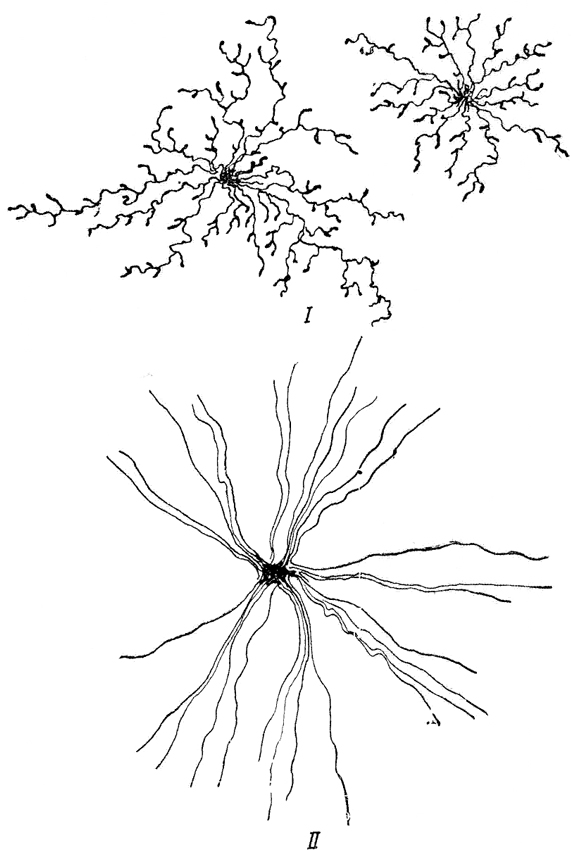 6: 37–48. 2014.
6: 37–48. 2014.
41. Mosconi L., Rahman A., Diaz I., Wu X., Scheyer O., Hristov H.W., Vallabhajosula S., Isaacson R.S.,
de Leon M.J., Brinton R.D. Increased Alzheimer’s risk during the menopause transition: A 3-year lon-
gitudinal brain imaging study. PLoS One. 13(12): e0207885. 2018.
42. Nelson P.T., Alafuzoff I., Bigio E.H., Bouras C., Braak H., Cairns N.J., Castellani R.J., Crain B.J., Da-
vies P., Del Tredici K., Duyckaerts C., Frosch M.P., Haroutunian V., Hof P.R., Hulette C.M., Hy-
man B.T., Iwatsubo T., Jellinger K.A., Jicha G.A., Kövari E., Kukull W.A., Leverenz J.B., Love S.,
Mackenzie I.R., Mann D.M., Masliah E., McKee A.C., Montine T.J., Morris J.C., Schneider J.A.,
Sonnen J.A., Thal D.R., Trojanowski J.Q., Troncoso J.C., Wisniewski T., Woltjer R.L., Beach T.G.
Correlation of Alzheimer disease neuropathologic changes with cognitive status: A review of
the literature. J. Neuropathol. Exp. Neurol. 71(5): 362–381. 2012.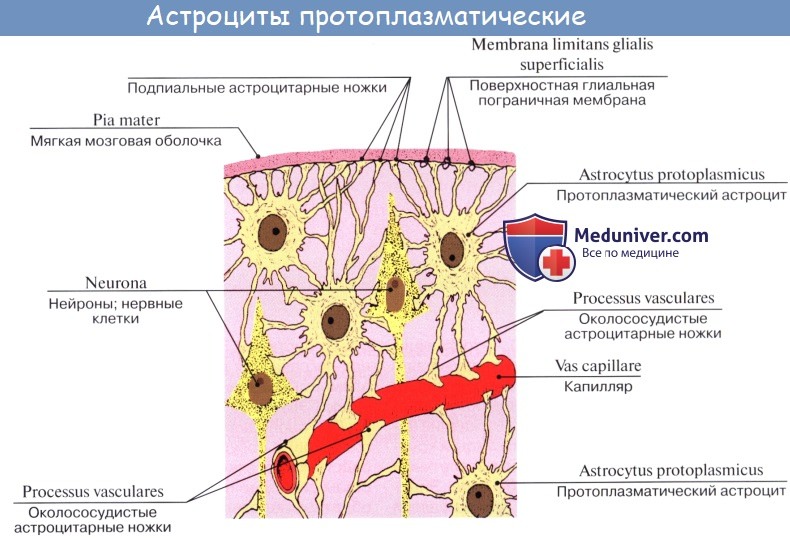
43. De Paula V.J., Radanovic M., Diniz B.S., Forlenza O.V. Alzheimer disease. Subcell. Biochem.
65: 329–352. 2012.
44. Roberts G.W., Gentleman S.M., Lynch A., Murray L., Landon M., Graham, D.I. Beta Amyloid
protein deposition in the brain after severe head injury: Implications for the pathogenesis of
Alzheimer’s disease. J. Neurol. Neurosurg. Psychiatry. 57(4): 419–425. 1994.
45. Rhein V., Eckert A. Effects of Alzheimer’s amyloid-beta and tau protein on mitochondrial
function – Role of glucose metabolism and insulin signaling. Arch. Physiol. Biochem. 113(3):
131–141. 2007.
Астроциты (лучистые глиоциты)
Астроциты (лучистые глиоциты)
Астроциты — один из видов глиальных клеток ЦНС позвоночных.
Макроглия подразделяется на астроциты, или лучистые глиоциты, и
олигодендроциты
(
рис. 2
). Астроциты — самые разнообразные глиальные клетки, имеющие звездчатую
или паукообразную форму.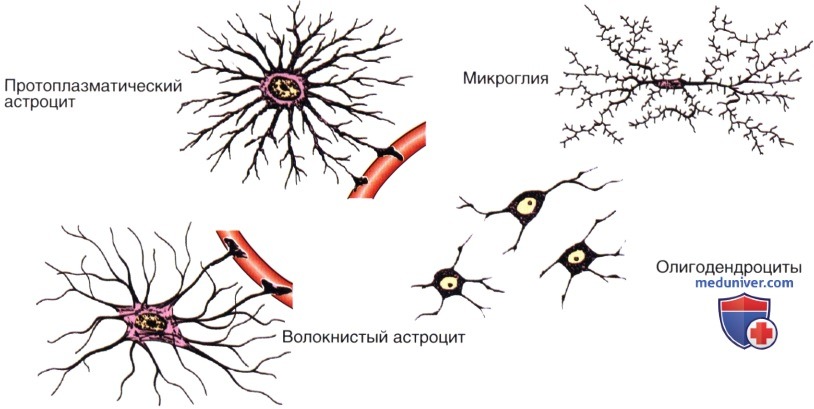 Астроцитарная глия состоит из протоплазматических
и фиброзных астроцитов (
рис. 1
,
рис. 3
).
Астроцитарная глия состоит из протоплазматических
и фиброзных астроцитов (
рис. 1
,
рис. 3
).
В сером веществе мозга встречаются преимущественно протоплазматические астроциты. Их тело имеет относительно крупные размеры (15-25 мкм) и многочисленные ветвистые отростки.
В белом веществе мозга располагаются волокнистые, или фиброзные, астроциты. У них небольшое тело (7-11 мкм) и длинные малоразветвленные отростки.
Астроциты — единственные клетки, располагающиеся между капиллярами и телами нейронов и участвующие в транспорте веществ из крови к нейронам и транспорте продуктов метаболизма нейронов обратно в кровь ( рис. 2 ). Астроциты формируют гематоэнцефалический барьер .
Протоплазматические
астроциты локализованы в сером
веществе ; от тела клетки, содержащей овальное ядро и большое
количество гликогена , отходят
сильно разветвленные короткие и толстые отростки.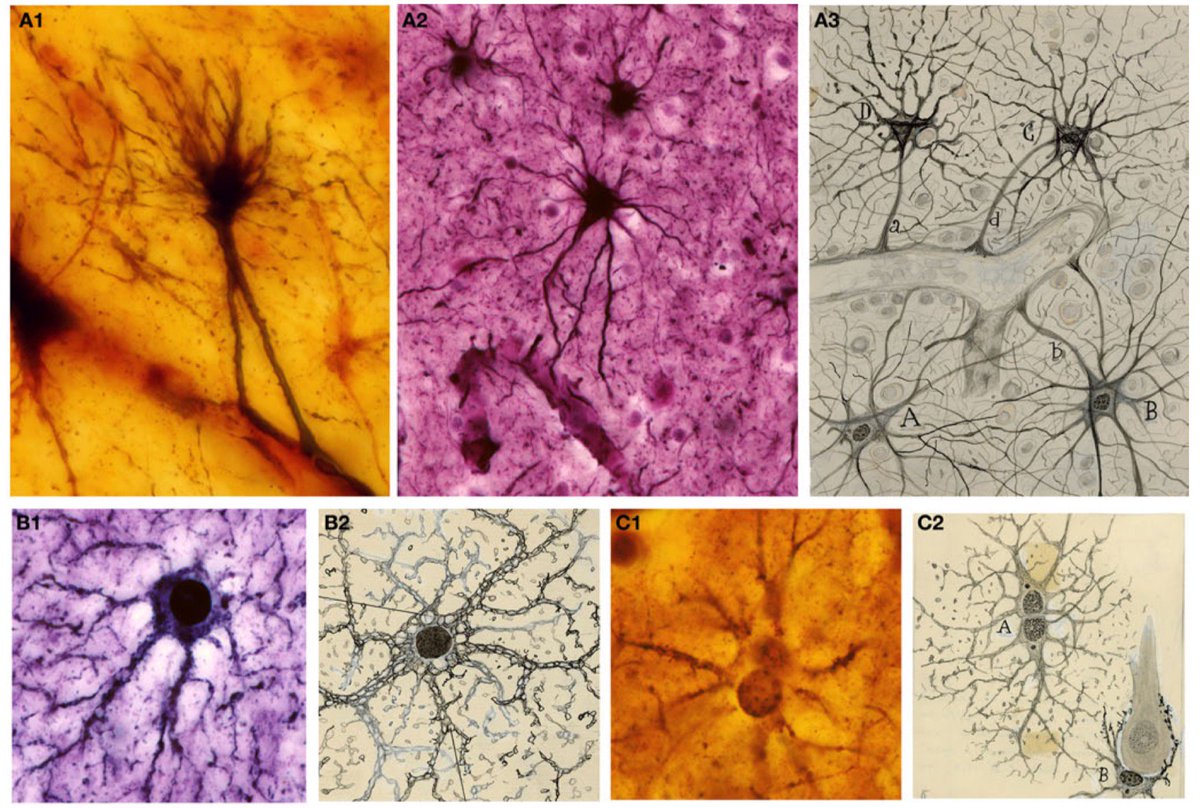
Фибриллярные астроциты локализованы в белом веществе . Ядро у них также овальное, и тело клетки содержит много гликогена , но отростки длинные и менее разветвленные, некоторые ветви буквально упираются в стенки кровеносных сосудов. Эти клетки переносят питательные вещества из крови в нейроны.
Астроциты двух типов взаимосвязаны и образуют обширное трехмерное пространство, в которое погружены нейроны. Они часто делятся, образуя в случае повреждений центральной нервной ситемы рубцовую ткань.
Показано, что астроциты не являются пассивными элементами нервной системы, а участвуют в обеспечении нейронов энергетическими субстратами в ответ на увеличение синаптической активности. Астроцитарные отростки расположены вокруг синаптических контактов , что позволяет им улавливать увеличение синаптической концентрации нейротрансмиттеров ( рис. 4.4 ).
Глиальные клетки поддерживают деятельность нейронов. В
ЦНС
к
нейроглии
относятся астроциты и
олигодендроциты
, а в периферической нервной системе —
шванновские клетки
и
клетки-сателлиты
. Кроме того, центральными глиальными клетками считаются клетки
микроглии
и
эпендимы
(
рис. 32.7
,
рис. 32.10
).
В
ЦНС
к
нейроглии
относятся астроциты и
олигодендроциты
, а в периферической нервной системе —
шванновские клетки
и
клетки-сателлиты
. Кроме того, центральными глиальными клетками считаются клетки
микроглии
и
эпендимы
(
рис. 32.7
,
рис. 32.10
).
Астроциты получили название благодаря своей звездчатой форме, регулируют
микросреду вокруг нейронов ЦНС, хотя контактируют только с частью
поверхности центральных нейронов (
рис. 32.7
). Однако их отростками окружены группы синаптических окончаний, которые в
результате изолированы от соседних
синапсов
. Особые отростки — «ножки» астроцитов — образуют контакты с
капиллярами и соединительной тканью на поверхности ЦНС —
мягкой мозговой оболочкой
(
рис. 32.7
). Ножки ограничивают свободную диффузию веществ в ЦНС. Астроциты могут
активно поглощать К+ и нейромедиаторные вещества, затем метаболизируя их.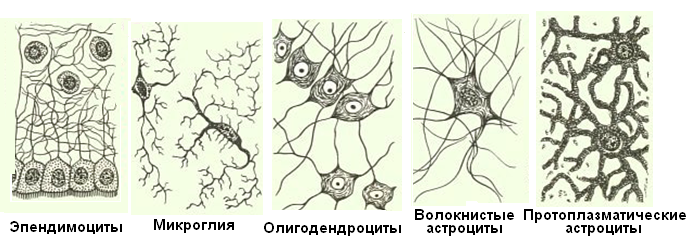 Таким образом, они играют буферную роль, перекрывая прямой доступ для ионов
и нейромедиаторов во внеклеточную среду вокруг нейронов. В цитоплазме
астроцитов находятся
глиальные филаменты
, выполняющие в ткани ЦНС механическую опорную функцию. При повреждении
отростки астроцитов, содержащие глиальные филаменты, подвергаются
гипертрофии и формируют
глиальный «рубец»
.
Таким образом, они играют буферную роль, перекрывая прямой доступ для ионов
и нейромедиаторов во внеклеточную среду вокруг нейронов. В цитоплазме
астроцитов находятся
глиальные филаменты
, выполняющие в ткани ЦНС механическую опорную функцию. При повреждении
отростки астроцитов, содержащие глиальные филаменты, подвергаются
гипертрофии и формируют
глиальный «рубец»
.
Астроциты типа 1
Астроциты типа 2 .
Белки глиальные фибриллярные кислые
Ссылки:
Все ссылкиСтраница не найдена |
Страница не найдена | 404.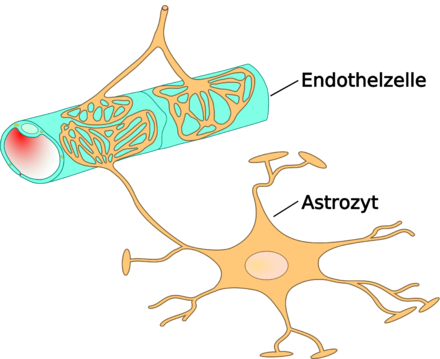 Страница не найдена
Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Мар
Апр
Май
Июн
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Frontiers | Различные подтипы астроцитов и их развитие в процессе кортикогенеза
Введение
Астроциты являются одними из наиболее распространенных типов глии, и было показано, что соотношение астроцитов к нейронам увеличивается с эволюцией приматов (Bass et al. , 1971). Недавние исследования показали, что астроциты не только поддерживают нейроны, но также активно регулируют физиологические функции мозга и что дисфункция астроцитов может приводить к нарушениям развития и / или психическим расстройствам (Molofsky et al., 2012; Бурда и Софронев, 2014; Слоан и Баррес, 2014). Несмотря на их большое количество и физиологическое значение, процессы, лежащие в основе развития астроцитов, в значительной степени неизвестны. Отчасти это связано с наличием различных подтипов астроцитов. Морфология и функции этих клеток различаются между участками мозга и видами. Кроме того, клетки имеют множественное происхождение, и их пролиферация сохраняется во взрослой жизни, что усложняет анализ судьбы этих клеток.Однако недавнее внедрение новых методов, включая мышей, экспрессирующих регион-специфическую рекомбиназу Cre, и электропорацию in utero транспозонных векторов, помогло выявить, по крайней мере частично, процесс нормального развития астроцитов в головном мозге.
, 1971). Недавние исследования показали, что астроциты не только поддерживают нейроны, но также активно регулируют физиологические функции мозга и что дисфункция астроцитов может приводить к нарушениям развития и / или психическим расстройствам (Molofsky et al., 2012; Бурда и Софронев, 2014; Слоан и Баррес, 2014). Несмотря на их большое количество и физиологическое значение, процессы, лежащие в основе развития астроцитов, в значительной степени неизвестны. Отчасти это связано с наличием различных подтипов астроцитов. Морфология и функции этих клеток различаются между участками мозга и видами. Кроме того, клетки имеют множественное происхождение, и их пролиферация сохраняется во взрослой жизни, что усложняет анализ судьбы этих клеток.Однако недавнее внедрение новых методов, включая мышей, экспрессирующих регион-специфическую рекомбиназу Cre, и электропорацию in utero транспозонных векторов, помогло выявить, по крайней мере частично, процесс нормального развития астроцитов в головном мозге. В этой краткой обзорной статье я сосредоточен на развитии астроцитов в коре головного мозга. Сначала я резюмирую подтипы астроцитов и их функции у грызунов и приматов. Затем я описываю миграцию этих подтипов из кортикальной зоны желудочков (VZ) и из других мест.Я также вкратце описываю процесс развития олигодендроцитов и сравниваю его с развитием астроцитов.
В этой краткой обзорной статье я сосредоточен на развитии астроцитов в коре головного мозга. Сначала я резюмирую подтипы астроцитов и их функции у грызунов и приматов. Затем я описываю миграцию этих подтипов из кортикальной зоны желудочков (VZ) и из других мест.Я также вкратце описываю процесс развития олигодендроцитов и сравниваю его с развитием астроцитов.
Неоднородность астроцитов
Несомненно установлено существование двух основных подтипов астроцитов у грызунов, протоплазматических и фиброзных астроцитов (Miller and Raff, 1984). Протоплазматические астроциты обладают сильно разветвленными кустистыми отростками и широко распространены в сером веществе. Они продвигаются концами к кровеносным сосудам и обволакивают их, образуя ограничивающую глиальную мембрану, которая является самой внешней стенкой гематоэнцефалического барьера (ГЭБ).Они также тесно связаны с синапсами с его процессами и играют разные роли, такие как клиренс глутамата (Rothstein et al., 1996; Oliet et al.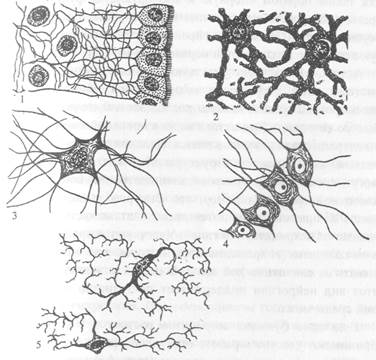 , 2001), модуляция синаптических функций (Henneberger et al., 2010; Uwechue et al., al., 2012) и регуляции местного кровотока в ответ на синаптическую активность (Simard et al., 2003; Takano et al., 2005). Также сообщалось, что протоплазматические астроциты участвуют в образовании и уничтожении синапсов (Pfrieger, 2010; Kucukdereli et al., 2011). Интересно, что отростки двух соседних протоплазматических астроцитов исключают друг друга и занимают неперекрывающиеся домены (Bushong et al., 2002; Ogata and Kosaka, 2002; Halassa et al., 2007). Домен одного астроцита покрывает около 100000 синапсов у мышей (Bushong et al., 2002), и эти синапсы могут одновременно регулироваться одним астроцитом как синаптическим островком (Halassa et al., 2007).
, 2001), модуляция синаптических функций (Henneberger et al., 2010; Uwechue et al., al., 2012) и регуляции местного кровотока в ответ на синаптическую активность (Simard et al., 2003; Takano et al., 2005). Также сообщалось, что протоплазматические астроциты участвуют в образовании и уничтожении синапсов (Pfrieger, 2010; Kucukdereli et al., 2011). Интересно, что отростки двух соседних протоплазматических астроцитов исключают друг друга и занимают неперекрывающиеся домены (Bushong et al., 2002; Ogata and Kosaka, 2002; Halassa et al., 2007). Домен одного астроцита покрывает около 100000 синапсов у мышей (Bushong et al., 2002), и эти синапсы могут одновременно регулироваться одним астроцитом как синаптическим островком (Halassa et al., 2007).
С другой стороны, фиброзные астроциты обладают прямыми и длинными отростками и в основном расположены в белом веществе.В этом типе клеток уровень экспрессии глиального фибриллярного кислого белка (GFAP), белка промежуточных филаментов, выше, чем в протоплазматическом астроците, в котором белок GFAP иногда обнаруживается только на концах кровеносных сосудов (Oberheim et al. др., 2009). Функции фиброзных астроцитов не ясны. По крайней мере, эти клетки связываются с кровеносными сосудами через свои отростки, как и протоплазматические астроциты (Marín-Padilla, 1995). В дополнение к этим основным типам клеток в слое 1 коры головного мозга мышей есть специализированные астроциты, которые демонстрируют пушистую морфологию, аналогичную морфологии протоплазматических астроцитов в сером веществе, но сильно экспрессируют GFAP, как волокнистые астроциты.Их отростки покрывают внешнюю поверхность паренхимы головного мозга прямо под мягкой мягкой мозговой оболочкой и образуют глиальную ограничивающую мембрану, которая продолжается в другую часть глиальной ограничивающей мембраны, образованной концами протоплазматических астроцитов, как описано выше (рис. Сообщалось, что GFAP-положительные фибробластоподобные клетки существуют на пиальной поверхности (García-Marques и López-Mascaraque, 2013; Martín-López et al., 2013). Эти клетки также покрывают внешнюю поверхность мозга своими клеточными телами, чтобы участвовать в формировании ограничивающей глиальную мембрану.
др., 2009). Функции фиброзных астроцитов не ясны. По крайней мере, эти клетки связываются с кровеносными сосудами через свои отростки, как и протоплазматические астроциты (Marín-Padilla, 1995). В дополнение к этим основным типам клеток в слое 1 коры головного мозга мышей есть специализированные астроциты, которые демонстрируют пушистую морфологию, аналогичную морфологии протоплазматических астроцитов в сером веществе, но сильно экспрессируют GFAP, как волокнистые астроциты.Их отростки покрывают внешнюю поверхность паренхимы головного мозга прямо под мягкой мягкой мозговой оболочкой и образуют глиальную ограничивающую мембрану, которая продолжается в другую часть глиальной ограничивающей мембраны, образованной концами протоплазматических астроцитов, как описано выше (рис. Сообщалось, что GFAP-положительные фибробластоподобные клетки существуют на пиальной поверхности (García-Marques и López-Mascaraque, 2013; Martín-López et al., 2013). Эти клетки также покрывают внешнюю поверхность мозга своими клеточными телами, чтобы участвовать в формировании ограничивающей глиальную мембрану.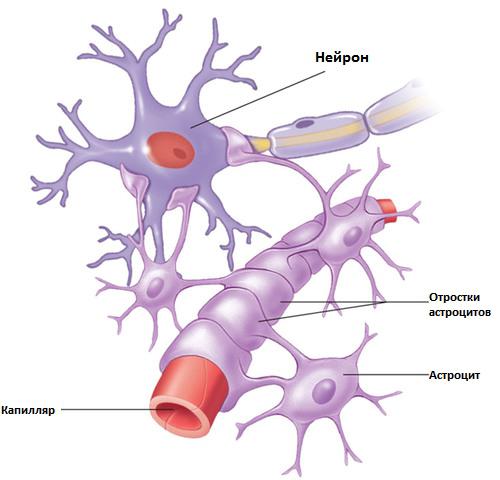 Хотя подтипы астроцитов, описанные выше, а именно фиброзные, протоплазматические астроциты и астроциты уровня 1, широко встречаются в мозге млекопитающих, существует по крайней мере два конкретных подтипа для человека или других приматов (Colombo and Reisin, 2004; Oberheim et al., 2009 ; Сосунов и др., 2014). В слое 1 коры головного мозга приматов находятся плотно упакованные астроциты GFAP + / CD44 + , называемые интерламинарными астроцитами (Colombo and Reisin, 2004). Эти клетки распространяют прямые и слабо разветвленные отростки длиной около миллиметра в корковое серое вещество, часто оканчиваясь на кровеносных сосудах в слоях 2–4 (Sosunov et al., 2014). Этот подтип появляется после рождения, и на стадии плода глиальные составляющие в слое 1 аналогичны таковым у грызунов, и, таким образом, было предложено преобразование астроцитов уровня 1 с короткими отростками в интерламинарные астроциты (Marín-Padilla, 1995; Коломбо и др., 1997). Второй подтип, специфичный для приматов, — это астроциты с варикозной проекцией, которые также относятся к GFAP + / CD44 + и расположены в основном в слоях 5 и 6.
Хотя подтипы астроцитов, описанные выше, а именно фиброзные, протоплазматические астроциты и астроциты уровня 1, широко встречаются в мозге млекопитающих, существует по крайней мере два конкретных подтипа для человека или других приматов (Colombo and Reisin, 2004; Oberheim et al., 2009 ; Сосунов и др., 2014). В слое 1 коры головного мозга приматов находятся плотно упакованные астроциты GFAP + / CD44 + , называемые интерламинарными астроцитами (Colombo and Reisin, 2004). Эти клетки распространяют прямые и слабо разветвленные отростки длиной около миллиметра в корковое серое вещество, часто оканчиваясь на кровеносных сосудах в слоях 2–4 (Sosunov et al., 2014). Этот подтип появляется после рождения, и на стадии плода глиальные составляющие в слое 1 аналогичны таковым у грызунов, и, таким образом, было предложено преобразование астроцитов уровня 1 с короткими отростками в интерламинарные астроциты (Marín-Padilla, 1995; Коломбо и др., 1997). Второй подтип, специфичный для приматов, — это астроциты с варикозной проекцией, которые также относятся к GFAP + / CD44 + и расположены в основном в слоях 5 и 6.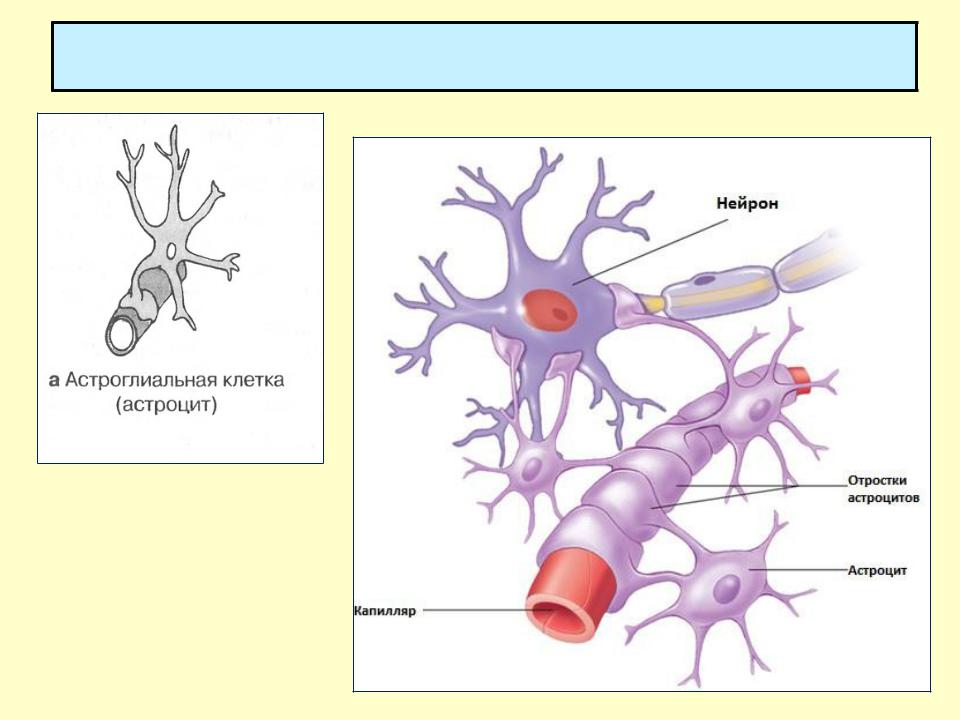 Этот тип клеток простирается на многие прямые отростки длиной 100 мкм и один до пять отростков длиной до 1 мм с множеством варикозных расширений (Oberheim et al., 2009; Сосунов и др., 2014), которые могут оканчиваться в нейропиле или сосудистой сети. У человека протоплазматические и фиброзные астроциты также обладают уникальной структурой. Сообщалось, что они в 2 ~ 2,5 раза больше в диаметре в коре головного мозга человека, чем в мыши (Oberheim et al., 2009). Протоплазматические астроциты человека также образуют эксклюзивные домены, подобные клеткам грызунов, и один домен покрывает около 2 000 000 синапсов. В более глубоких слоях коры головного мозга человека сосуществуют протоплазматические астроциты и астроциты с варикозной проекцией, и их процессы взаимосвязаны, что позволяет предположить, что они представляют собой разные подтипы клеток с разными функциями.
Этот тип клеток простирается на многие прямые отростки длиной 100 мкм и один до пять отростков длиной до 1 мм с множеством варикозных расширений (Oberheim et al., 2009; Сосунов и др., 2014), которые могут оканчиваться в нейропиле или сосудистой сети. У человека протоплазматические и фиброзные астроциты также обладают уникальной структурой. Сообщалось, что они в 2 ~ 2,5 раза больше в диаметре в коре головного мозга человека, чем в мыши (Oberheim et al., 2009). Протоплазматические астроциты человека также образуют эксклюзивные домены, подобные клеткам грызунов, и один домен покрывает около 2 000 000 синапсов. В более глубоких слоях коры головного мозга человека сосуществуют протоплазматические астроциты и астроциты с варикозной проекцией, и их процессы взаимосвязаны, что позволяет предположить, что они представляют собой разные подтипы клеток с разными функциями.
Рисунок 1. Неоднородность астроцитов и множественность их происхождения . Три изображения представляют производство и окончательное расположение астроцитов и олигодендроцитов на стадиях развития.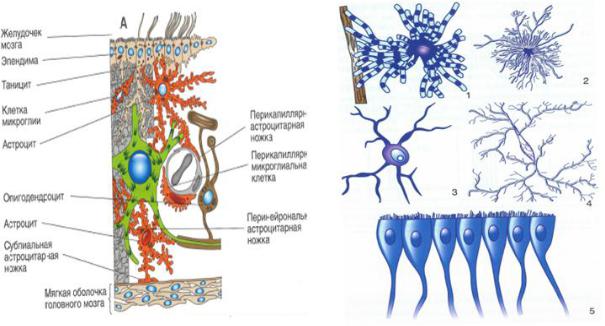 Стадии у мышей указаны над каждым изображением (E, эмбриональный день; P, постнатальный день). Стрелки со сплошными линиями указывают на клеточные линии, подтвержденные экспериментами по отслеживанию линий. Стрелки с пунктирными линиями показывают гипотетические клеточные клоны, полученные гистологическими исследованиями, но не подтвержденные точным отслеживанием клонов.Нейроны и OPC не показаны. GM — серое вещество; WM, белое вещество; М, мозговые оболочки или мягкая мозговая оболочка; PPL, первичный плексиформный слой; ВЗ, желудочковая зона; СВЗ, (эмбриональная или постнатальная) субвентрикулярная зона; ИЗ, промежуточная зона; ЦП — корковая пластинка; БВ, кровеносный сосуд.
Стадии у мышей указаны над каждым изображением (E, эмбриональный день; P, постнатальный день). Стрелки со сплошными линиями указывают на клеточные линии, подтвержденные экспериментами по отслеживанию линий. Стрелки с пунктирными линиями показывают гипотетические клеточные клоны, полученные гистологическими исследованиями, но не подтвержденные точным отслеживанием клонов.Нейроны и OPC не показаны. GM — серое вещество; WM, белое вещество; М, мозговые оболочки или мягкая мозговая оболочка; PPL, первичный плексиформный слой; ВЗ, желудочковая зона; СВЗ, (эмбриональная или постнатальная) субвентрикулярная зона; ИЗ, промежуточная зона; ЦП — корковая пластинка; БВ, кровеносный сосуд.
Производство глии в кортикальном слое VZ
Астроциты в коре головного мозга образуются из кортикальной зоны желудочков (VZ) или вентральной части переднего мозга. В корковой VZ эмбрионального / эмбрионального мозга млекопитающих есть клетки, называемые радиальной глией (RG), которые распространяют длинные восходящие отростки, называемые радиальными волокнами, к пиальной поверхности и действуют как каркас для нейронов, мигрирующих от VZ к пиальной поверхности.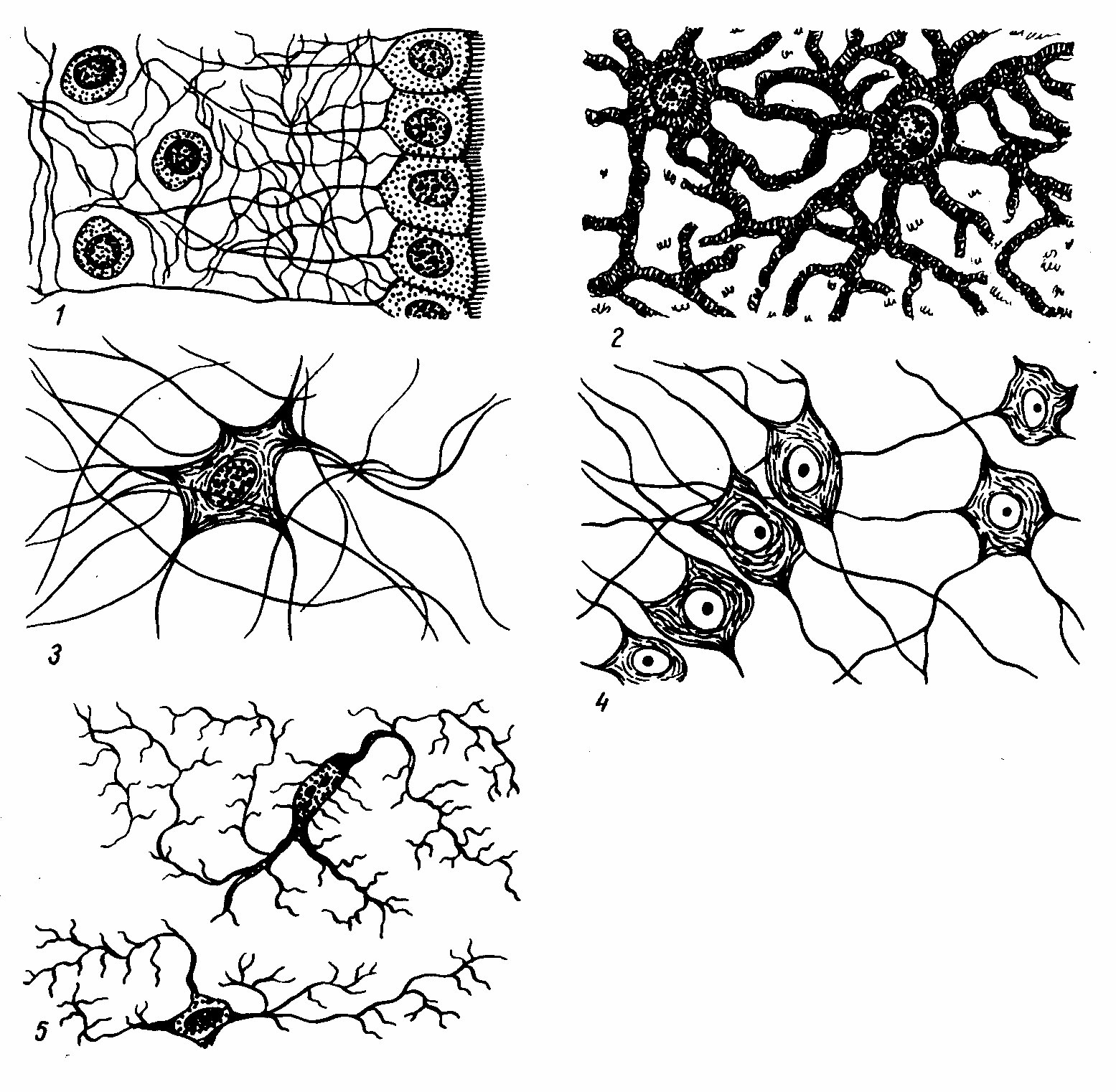 RG были обозначены как «глия», потому что они демонстрируют некоторые особенности астроцитов, такие как гранулы гликогена (Schmechel and Rakic, 1979; Gressens et al., 1992), и экспрессируют GFAP, особенно в организме плода человека (Levitt et al., 1981; Кэмерон и Ракич, 1991). Однако на самом деле это не дифференцированная глия, а нервные стволовые клетки, которые генерируют нейроны во время раннего и позднего кортикального развития, а затем и глии (Fujita, 1963; Miyata et al., 2001; Noctor et al., 2001). Существует давняя дискуссия о том, являются ли RG в кортикальной VZ однородной и изменяются ли их потенциальные изменения от продукции нейронов к продукции глии в ходе развития, или же популяция RG включает предшественники, ограниченные нейронами, и предшественники, ограниченные глией, даже с самого начала. стадия коркового развития и глиальные предшественники находятся в спящем состоянии до поздних стадий.Хотя несколько линий доказательств подтверждают последнее (Levitt et al., 1981; McCarthy et al.
RG были обозначены как «глия», потому что они демонстрируют некоторые особенности астроцитов, такие как гранулы гликогена (Schmechel and Rakic, 1979; Gressens et al., 1992), и экспрессируют GFAP, особенно в организме плода человека (Levitt et al., 1981; Кэмерон и Ракич, 1991). Однако на самом деле это не дифференцированная глия, а нервные стволовые клетки, которые генерируют нейроны во время раннего и позднего кортикального развития, а затем и глии (Fujita, 1963; Miyata et al., 2001; Noctor et al., 2001). Существует давняя дискуссия о том, являются ли RG в кортикальной VZ однородной и изменяются ли их потенциальные изменения от продукции нейронов к продукции глии в ходе развития, или же популяция RG включает предшественники, ограниченные нейронами, и предшественники, ограниченные глией, даже с самого начала. стадия коркового развития и глиальные предшественники находятся в спящем состоянии до поздних стадий.Хотя несколько линий доказательств подтверждают последнее (Levitt et al., 1981; McCarthy et al. , 2001), недавние эксперименты по отслеживанию клонов с использованием смешанных ретровирусов (Costa et al., 2009) и метод мозаичного анализа с двойными маркерами (MADM) (Gao et al., 2014) не показали значительного количества ограниченных глией предшественников на ранних стадиях. Недавно была создана новая система отслеживания глиальных клонов с использованием транспозонных плазмидных векторов, которые интегрируются в геном хозяина в присутствии транспозазы (Kawakami and Noda, 2004; Sato et al., 2007). Было продемонстрировано, что введение транспозонного вектора вместе с вектором экспрессии транспозазы посредством электропорации in utero (Fukuchi-Shimogori, 2001; Saito and Nakatsuji, 2001; Tabata and Nakajima, 2001) успешно метило глиальные клетки (Yoshida et al. , 2010). Используя эту технику, Siddiqi et al. продемонстрировали, что сначала RG были исключительно GLAST + / Nestin + и преимущественно продуцировали нейроны, а затем в популяции RG на более поздних стадиях появились предшественники GLAST + / Nestin —, которые преимущественно продуцировали астроциты (Siddiqi et al.
, 2001), недавние эксперименты по отслеживанию клонов с использованием смешанных ретровирусов (Costa et al., 2009) и метод мозаичного анализа с двойными маркерами (MADM) (Gao et al., 2014) не показали значительного количества ограниченных глией предшественников на ранних стадиях. Недавно была создана новая система отслеживания глиальных клонов с использованием транспозонных плазмидных векторов, которые интегрируются в геном хозяина в присутствии транспозазы (Kawakami and Noda, 2004; Sato et al., 2007). Было продемонстрировано, что введение транспозонного вектора вместе с вектором экспрессии транспозазы посредством электропорации in utero (Fukuchi-Shimogori, 2001; Saito and Nakatsuji, 2001; Tabata and Nakajima, 2001) успешно метило глиальные клетки (Yoshida et al. , 2010). Используя эту технику, Siddiqi et al. продемонстрировали, что сначала RG были исключительно GLAST + / Nestin + и преимущественно продуцировали нейроны, а затем в популяции RG на более поздних стадиях появились предшественники GLAST + / Nestin —, которые преимущественно продуцировали астроциты (Siddiqi et al. al., 2014), демонстрируя потенциальный переход от продукции нейронов к продукции глии от RG. Более того, Noctor et al. непосредственно наблюдали, что нервные стволовые клетки сначала продуцируют нейроны посредством асимметричных клеточных делений, а затем те же самые клетки дифференцируются в астроциты при долгосрочном живом изображении на культуре срезов (Noctor et al., 2004). Основываясь на вышеупомянутых доказательствах, первая гипотеза в настоящее время широко принята.
al., 2014), демонстрируя потенциальный переход от продукции нейронов к продукции глии от RG. Более того, Noctor et al. непосредственно наблюдали, что нервные стволовые клетки сначала продуцируют нейроны посредством асимметричных клеточных делений, а затем те же самые клетки дифференцируются в астроциты при долгосрочном живом изображении на культуре срезов (Noctor et al., 2004). Основываясь на вышеупомянутых доказательствах, первая гипотеза в настоящее время широко принята.
После спецификации глиального клона, глиальные предшественники мигрируют в кортикальное серое вещество и белое вещество и дифференцируются в протоплазматические и фиброзные астроциты, соответственно.Наиболее приемлемой моделью такой миграции глиальных предшественников является прямая трансформация RG (Figure 1, arrow-3, 6, 7), при которой радиальные волокна втягиваются, чтобы поднять клеточную сому из VZ. Это движение клеток аналогично тому, которое идентифицировано в процессе миграции нейронов, называемом «сомальная транслокация» (Nadarajah et al. , 2001), и клетки, подвергающиеся такой трансформации, называются трансформирующими RG (tRG). Морфология tRG неоднократно наблюдалась с помощью окрашивания по Гольджи, иммуноокрашивания на GFAP и окрашивания карбоцианиновым красителем (DiI) (Schmechel and Rakic, 1979; Voigt, 1989; Gressens et al., 1992; deAzevedo et al., 2003). Дифференцировка tRG клеток в астроциты была непосредственно показана с помощью живых изображений на культуре срезов (Noctor et al., 2004). С другой стороны, считается, что астроциты возникают из пролиферативных глиальных предшественников в субвентрикулярной зоне (SVZ; Рисунок 1, стрелка-2, 4, 5). Было бы интересно узнать, какие предшественники какие подтипы астроцитов продуцируют. Gressens et al. вводили [3H] -тимидин мышам E17 после завершения нейрогенеза и наблюдали, что меченные GFAP или RC2 [3H] -тимидином клетки (пролиферативные глиальные предшественники) сначала были обнаружены в SVZ или IZ и постепенно смещались в сторону пиальной поверхности и расположились в верхней корковой пластинке, но не в белом веществе.
, 2001), и клетки, подвергающиеся такой трансформации, называются трансформирующими RG (tRG). Морфология tRG неоднократно наблюдалась с помощью окрашивания по Гольджи, иммуноокрашивания на GFAP и окрашивания карбоцианиновым красителем (DiI) (Schmechel and Rakic, 1979; Voigt, 1989; Gressens et al., 1992; deAzevedo et al., 2003). Дифференцировка tRG клеток в астроциты была непосредственно показана с помощью живых изображений на культуре срезов (Noctor et al., 2004). С другой стороны, считается, что астроциты возникают из пролиферативных глиальных предшественников в субвентрикулярной зоне (SVZ; Рисунок 1, стрелка-2, 4, 5). Было бы интересно узнать, какие предшественники какие подтипы астроцитов продуцируют. Gressens et al. вводили [3H] -тимидин мышам E17 после завершения нейрогенеза и наблюдали, что меченные GFAP или RC2 [3H] -тимидином клетки (пролиферативные глиальные предшественники) сначала были обнаружены в SVZ или IZ и постепенно смещались в сторону пиальной поверхности и расположились в верхней корковой пластинке, но не в белом веществе. Кроме того, они вводили метилазоксиметанолацетат (МАМ), который устраняет пролиферативные клетки, мышам E17 и E18 и наблюдали значительно уменьшенное количество протоплазматических астроцитов в верхней кортикальной пластинке без значительного влияния на образование волокнистых астроцитов в белом цвете. материя (Gressens et al., 1992), предполагая, что пролиферативные глиальные предшественники в SVZ дифференцируются только в протоплазматические астроциты (Figure 1, arrow-5). С другой стороны, Cai et al. продемонстрировали, что постнатальная генетическая делеция Olig2, фактора транскрипции, который, как известно, важен для дифференцировки глии (Ono et al., 2008), что привело к серьезному дефициту образования фиброзных астроцитов, но не было значительной разницы в количестве протоплазматических астроцитов в верхней кортикальной пластинке (Cai et al., 2007), что указывает на то, что эти два классических подтипа образуются в разных способами. Недавно была разработана многоцветная система отслеживания происхождения астроцитов, названная методом «Звездный след», путем модификации системы транспозонных векторов (García-Marques и López-Mascaraque, 2013; Martín-López et al.
Кроме того, они вводили метилазоксиметанолацетат (МАМ), который устраняет пролиферативные клетки, мышам E17 и E18 и наблюдали значительно уменьшенное количество протоплазматических астроцитов в верхней кортикальной пластинке без значительного влияния на образование волокнистых астроцитов в белом цвете. материя (Gressens et al., 1992), предполагая, что пролиферативные глиальные предшественники в SVZ дифференцируются только в протоплазматические астроциты (Figure 1, arrow-5). С другой стороны, Cai et al. продемонстрировали, что постнатальная генетическая делеция Olig2, фактора транскрипции, который, как известно, важен для дифференцировки глии (Ono et al., 2008), что привело к серьезному дефициту образования фиброзных астроцитов, но не было значительной разницы в количестве протоплазматических астроцитов в верхней кортикальной пластинке (Cai et al., 2007), что указывает на то, что эти два классических подтипа образуются в разных способами. Недавно была разработана многоцветная система отслеживания происхождения астроцитов, названная методом «Звездный след», путем модификации системы транспозонных векторов (García-Marques и López-Mascaraque, 2013; Martín-López et al. , 2013).В соответствии с результатами традиционных экспериментов по отслеживанию клонов ретровирусов (Price and Thurlow, 1988; Levison et al., 1993), Star Track также продемонстрировал, что большинство клонов были либо исключительно протоплазматическими, либо исключительно волокнистыми астроцитами, что позволяет предположить, что эти два типа астроциты образуются из независимых предшественников, хотя остается неизвестным, какими предшественниками они могут быть.
, 2013).В соответствии с результатами традиционных экспериментов по отслеживанию клонов ретровирусов (Price and Thurlow, 1988; Levison et al., 1993), Star Track также продемонстрировал, что большинство клонов были либо исключительно протоплазматическими, либо исключительно волокнистыми астроцитами, что позволяет предположить, что эти два типа астроциты образуются из независимых предшественников, хотя остается неизвестным, какими предшественниками они могут быть.
Процесс генерации астроцитов Layer-1 также оказался уникальным.Путем интенсивных наблюдений с использованием окрашивания по Гольджи Марин-Падилла предположил, что астроциты Уровня-1 образуются двумя волнами (Marín-Padilla, 1995). На самой ранней стадии коркового развития первичный плексиформный слой (PPL), который также называют препластинкой, формируется сразу за пределами VZ. На этой стадии субпопуляция клеток, происходящих из VZ, перемещается на базальную пластинку, лежащую в основе мягкой мягкой мозговой оболочки, и дифференцируется в астроциты первого уровня-1 и формирует субпиальную глиальную ограничивающую мембрану (Рисунок 1, стрелка-1).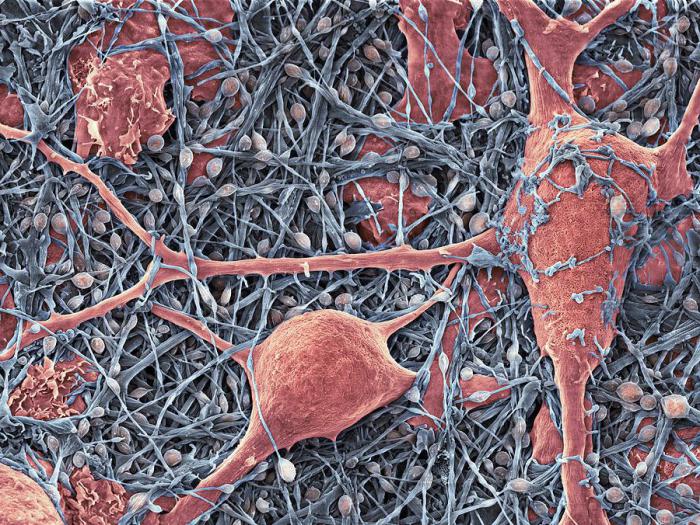 По мере развития популяция астроцитов Уровня-1 принимает вновь образованные астроциты, вероятно, происходящие из SVZ (Рисунок 1, стрелка 4). Неясно, соответствуют ли эти два разных происхождения астроцитов уровня 1 двум типам астроцитов уровня 1, а именно фибробластоподобным и протоплазматическим астроцитам. Тем не менее, анализ Star Track показал, что клоны этих подтипов астроцитов Layer-1 в значительной степени исключают друг друга (García-Marques and López-Mascaraque, 2013; Martín-López et al., 2013). Сообщалось, что подмножество протоплазматических астроцитов возникает из астроцитов уровня 1 или мультипотентных предшественников в слое 1 коры головного мозга (Marín-Padilla, 1995; Costa et al., 2007).
По мере развития популяция астроцитов Уровня-1 принимает вновь образованные астроциты, вероятно, происходящие из SVZ (Рисунок 1, стрелка 4). Неясно, соответствуют ли эти два разных происхождения астроцитов уровня 1 двум типам астроцитов уровня 1, а именно фибробластоподобным и протоплазматическим астроцитам. Тем не менее, анализ Star Track показал, что клоны этих подтипов астроцитов Layer-1 в значительной степени исключают друг друга (García-Marques and López-Mascaraque, 2013; Martín-López et al., 2013). Сообщалось, что подмножество протоплазматических астроцитов возникает из астроцитов уровня 1 или мультипотентных предшественников в слое 1 коры головного мозга (Marín-Padilla, 1995; Costa et al., 2007).
По мере увеличения размера мозга в течение первых 20 постнатальных дней у мышей количество глии резко возрастает (Bandeira et al., 2009). Однако прямая трансформация RG может приводить к образованию ограниченного числа астроцитов, и продукция астроцитов из пролиферативных глиальных предшественников в SVZ почти заканчивается на P14 (Levison et al. , 1993), предполагая дополнительную систему амплификации клеток. Используя двухфотонную микроскопию, Ge et al. наблюдали частые клеточные деления протоплазматических астроцитов у мышей P5 hGFAP-GFP с открытым черепом, но неповрежденной пиальной поверхностью (Ge et al., 2012) (Рисунок 1, стрелка-8). Делящиеся клетки не являлись мигрирующими глиальными предшественниками, а были дифференцированными протоплазматическими астроцитами, осевшими в корковом сером веществе. Эти делящиеся астроциты расширяли сильно разветвленные отростки, контактируя концами с кровеносными сосудами и соединяясь с окружающими зрелыми астроцитами с щелевыми контактами.Это местное производство было оценено как основной источник протоплазматических астроцитов во взрослом мозге.
, 1993), предполагая дополнительную систему амплификации клеток. Используя двухфотонную микроскопию, Ge et al. наблюдали частые клеточные деления протоплазматических астроцитов у мышей P5 hGFAP-GFP с открытым черепом, но неповрежденной пиальной поверхностью (Ge et al., 2012) (Рисунок 1, стрелка-8). Делящиеся клетки не являлись мигрирующими глиальными предшественниками, а были дифференцированными протоплазматическими астроцитами, осевшими в корковом сером веществе. Эти делящиеся астроциты расширяли сильно разветвленные отростки, контактируя концами с кровеносными сосудами и соединяясь с окружающими зрелыми астроцитами с щелевыми контактами.Это местное производство было оценено как основной источник протоплазматических астроцитов во взрослом мозге.
Множественное происхождение Глии
Глии коры головного мозга также продуцируются постнатальным SVZ, специализированным резервуаром глиальных и нейрональных предшественников. Постнатальный SVZ представлен клиновидной структурой между паллием и субпаллием и состоит из Zebrin II (альдолаза C) -положительных кортикальных VZ-производных клеток, в основном расположенных на периферии, и Dlx2-положительных клеток, происходящих из вентрального конечного мозга.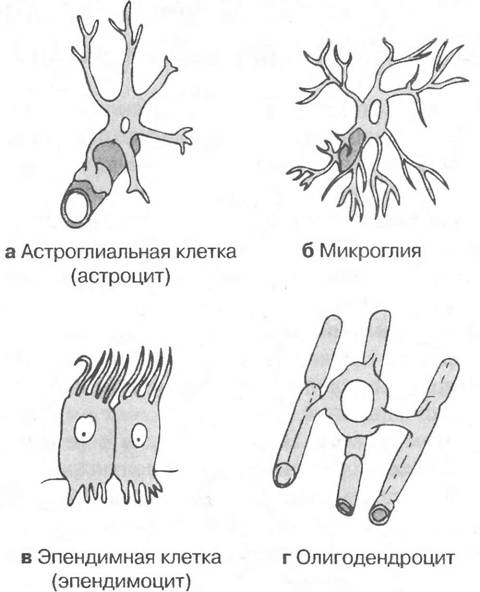 заселяет центр (Marshall and Goldman, 2002).Отслеживание клонов после прямой инъекции ретровируса в постнатальный SVZ показало, что, хотя нейроны мигрировали кпереди в обонятельную луковицу и дифференцировались в гранулярные и перигломерулярные интернейроны (Alvarez-Buylla and Garcia-Verdugo, 2002), глиальные предшественники мигрировали дорсально и дифференцировались в как астроциты, так и олигодендероциты в сером и белом веществе (Levison, Goldman, 1993; Parnavelas, 1999; Marshall and Goldman, 2002) (рис. 1, стрелка-9). Пропорции астроцитов и олигодендроцитов, образованных из этой структуры, показывают временные изменения.Глиальные предшественники P2 SVZ у новорожденных крыс давали астроциты в основном в корковом сером веществе, тогда как клетки P14 SVZ в основном дифференцировались в олигодендроциты в белом веществе (Levison et al., 1993). В популяции клеток, происходящих из MGE, Olig2 действует как детерминант глиальной судьбы. Сверхэкспрессия Olig2 дикого типа с использованием ретровируса увеличивала продукцию как астроцитов, так и олигодендроцитов, тогда как сверхэкспрессия доминантно-отрицательной формы Olig2 увеличивала продукцию нейронов (Marshall et al.
заселяет центр (Marshall and Goldman, 2002).Отслеживание клонов после прямой инъекции ретровируса в постнатальный SVZ показало, что, хотя нейроны мигрировали кпереди в обонятельную луковицу и дифференцировались в гранулярные и перигломерулярные интернейроны (Alvarez-Buylla and Garcia-Verdugo, 2002), глиальные предшественники мигрировали дорсально и дифференцировались в как астроциты, так и олигодендероциты в сером и белом веществе (Levison, Goldman, 1993; Parnavelas, 1999; Marshall and Goldman, 2002) (рис. 1, стрелка-9). Пропорции астроцитов и олигодендроцитов, образованных из этой структуры, показывают временные изменения.Глиальные предшественники P2 SVZ у новорожденных крыс давали астроциты в основном в корковом сером веществе, тогда как клетки P14 SVZ в основном дифференцировались в олигодендроциты в белом веществе (Levison et al., 1993). В популяции клеток, происходящих из MGE, Olig2 действует как детерминант глиальной судьбы. Сверхэкспрессия Olig2 дикого типа с использованием ретровируса увеличивала продукцию как астроцитов, так и олигодендроцитов, тогда как сверхэкспрессия доминантно-отрицательной формы Olig2 увеличивала продукцию нейронов (Marshall et al.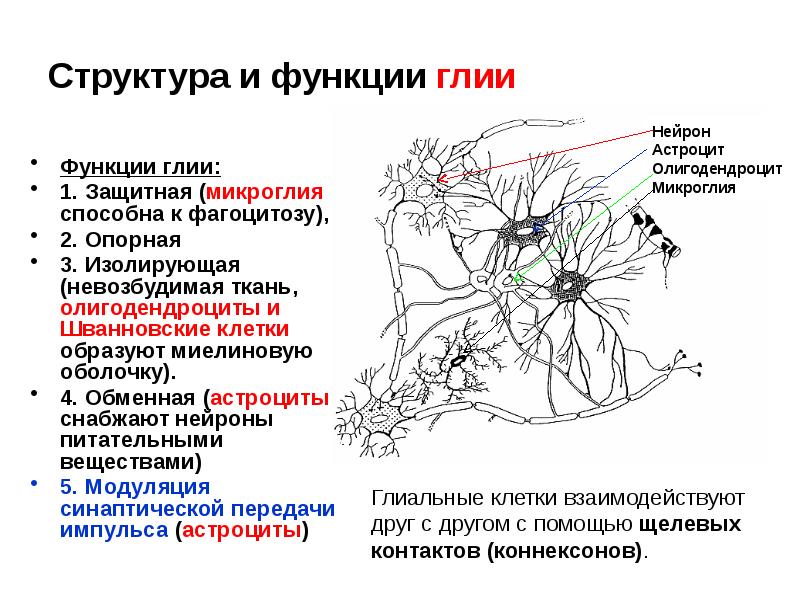 , 2005).
, 2005).
В качестве еще одного возможного источника астроцитов нельзя игнорировать предшественники олигодендроцитов (OPCs). OPC экспрессируют несколько специфических маркеров, таких как NG2 и рецептор тромбоцитарного фактора роста α (PDGFRA), и широко распространены в позднем эмбриональном и постнатальном мозге. Было показано, что OPC, собранные из зрительного нерва крысы с использованием мононклонального антитела A2B5, которое связывается с ранним OPC-специфическим ганглиозидом (Eisenbarth et al., 1979; Schnitzer and Schachner, 1982; Raff et al., 1983a), дифференцируются в GFAP + астроцитов в культуре в присутствии сывороточных факторов (Raff et al., 1983b). Образовавшиеся астроциты из OPC в культуре называются астроцитами 2 типа, а астроциты из кортикальной VZ называются астроцитами 1 типа, поскольку они имеют различную морфологию. Способность культивированных OPC продуцировать астроциты in vivo была показана трансплантацией. Когда человеческие клетки A2B5 + , PSA-NCAM —, взятые из 17–23-недельного переднего мозга, были размножены в культуре с фетальной бычьей сывороткой и трансплантированы новорожденным мышам на P0 или P1, они дали начало астроцитам, а также NG2. клетки и олигодендроциты (Windrem et al., 2004, 2008, 2014; Han et al., 2013). Эти наблюдения указывают на способность OPC продуцировать астроциты. Однако дифференцировка OPCs в астроциты в ходе нормального развития мозга кажется незначительной, если вообще существует. Когда OPCs культивировали в бессывороточной среде и трансплантировали крысам P5, OPCs дифференцировались только в олигодендроциты, но не в астроциты (de los Monteros et al., 1993). Более того, эксперименты по отслеживанию клонов с использованием трансгенных мышей, экспрессирующих рекомбиназу Cre в OPC (NG2-Cre и PDGFRA-CreERT2), показали, что OPC продуцируют олигодендроциты в сером и белом веществе, но не астроциты в неокортексе, хотя некоторые астроциты продуцируются в вентральный передний мозг (Zhu et al., 2007, 2012; Риверс и др., 2008).
клетки и олигодендроциты (Windrem et al., 2004, 2008, 2014; Han et al., 2013). Эти наблюдения указывают на способность OPC продуцировать астроциты. Однако дифференцировка OPCs в астроциты в ходе нормального развития мозга кажется незначительной, если вообще существует. Когда OPCs культивировали в бессывороточной среде и трансплантировали крысам P5, OPCs дифференцировались только в олигодендроциты, но не в астроциты (de los Monteros et al., 1993). Более того, эксперименты по отслеживанию клонов с использованием трансгенных мышей, экспрессирующих рекомбиназу Cre в OPC (NG2-Cre и PDGFRA-CreERT2), показали, что OPC продуцируют олигодендроциты в сером и белом веществе, но не астроциты в неокортексе, хотя некоторые астроциты продуцируются в вентральный передний мозг (Zhu et al., 2007, 2012; Риверс и др., 2008).
Как описано выше, астроциты в коре головного мозга имеют множественное происхождение и функционально и морфологически разнообразны. Это подняло вопрос о том, продуцируют ли предшественники в разных участках мозга функционально идентичные популяции астроцитов и компенсируют количество клеток или продуцируют разные подтипы астроцитов. Результаты эксперимента с использованием системы отслеживания клонов Cre-loxP показали, что олигодендроциты в коре головного мозга также образуются из разных мест в зависимости от стадий развития (Kessaris et al., 2006). Первая волна продукции начинается примерно на E12.5 из предшественников, экспрессирующих Nkx2.1 в MGE и передней энтопедункулярной области (AEP). Вторая волна начинается примерно на E15 от Gsh3-экспрессирующих LGE и возвышения каудальных ганглиев (CGE), и, наконец, локальная продукция начинается в Emx1-экспрессирующих кортикальных VZ вокруг рождения. Когда любой из этих сайтов продуцирования удаляется путем экспрессии фрагмента дифтерийного токсина A (DTA) под контролем тех же линий мыши-драйвера Cre, OPC из других сайтов покрывают дефицитную область (Kessaris et al., 2006). Более того, клетки линии олигодендроцитов, происходящие из предшественников Nkx2.1, уменьшились в течение постнатальной жизни и были заменены вновь образованными клетками, производными Gsh3 и Emx1.
Результаты эксперимента с использованием системы отслеживания клонов Cre-loxP показали, что олигодендроциты в коре головного мозга также образуются из разных мест в зависимости от стадий развития (Kessaris et al., 2006). Первая волна продукции начинается примерно на E12.5 из предшественников, экспрессирующих Nkx2.1 в MGE и передней энтопедункулярной области (AEP). Вторая волна начинается примерно на E15 от Gsh3-экспрессирующих LGE и возвышения каудальных ганглиев (CGE), и, наконец, локальная продукция начинается в Emx1-экспрессирующих кортикальных VZ вокруг рождения. Когда любой из этих сайтов продуцирования удаляется путем экспрессии фрагмента дифтерийного токсина A (DTA) под контролем тех же линий мыши-драйвера Cre, OPC из других сайтов покрывают дефицитную область (Kessaris et al., 2006). Более того, клетки линии олигодендроцитов, происходящие из предшественников Nkx2.1, уменьшились в течение постнатальной жизни и были заменены вновь образованными клетками, производными Gsh3 и Emx1.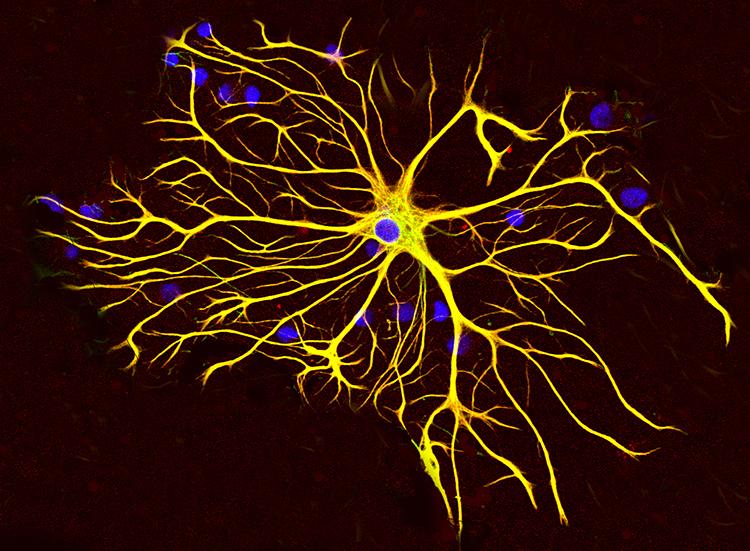 Следовательно, олигодендроциты, происходящие из трех разных доменов-предшественников, функционально заменяемы друг другом и конкурируют за заселение ограничивающего пространства в коре головного мозга. Эта ситуация называется «войной олигодендроцитов» (Richardson et al., 2006). Однако это не относится к астроцитам, особенно в спинном мозге.Астроциты в спинном мозге продуцируются из разных доменов-предшественников, расположенных по паттерну от дорсального до вентрального в VZ. Когда один из предшественников доменов элиминируется за счет специфической экспрессии DTA, соседние астроциты или их предшественники не входят в дефицитную область, чтобы покрыть свои функции (Tsai et al., 2012). В полушариях головного мозга, однако, значительные количества глиальных предшественников мигрируют из MGE и дифференцируются в астроциты, как упомянуто выше. Фактически, астроциты, происходящие из Dlx2-экспрессирующих предшественников в постнатальном SVZ, как сообщается, распространяются своими концами на кровеносные сосуды (Marshall and Goldman, 2002), указывая тем самым, что они функционально эквивалентны кортикальным VZ-производным астроцитам.
Следовательно, олигодендроциты, происходящие из трех разных доменов-предшественников, функционально заменяемы друг другом и конкурируют за заселение ограничивающего пространства в коре головного мозга. Эта ситуация называется «войной олигодендроцитов» (Richardson et al., 2006). Однако это не относится к астроцитам, особенно в спинном мозге.Астроциты в спинном мозге продуцируются из разных доменов-предшественников, расположенных по паттерну от дорсального до вентрального в VZ. Когда один из предшественников доменов элиминируется за счет специфической экспрессии DTA, соседние астроциты или их предшественники не входят в дефицитную область, чтобы покрыть свои функции (Tsai et al., 2012). В полушариях головного мозга, однако, значительные количества глиальных предшественников мигрируют из MGE и дифференцируются в астроциты, как упомянуто выше. Фактически, астроциты, происходящие из Dlx2-экспрессирующих предшественников в постнатальном SVZ, как сообщается, распространяются своими концами на кровеносные сосуды (Marshall and Goldman, 2002), указывая тем самым, что они функционально эквивалентны кортикальным VZ-производным астроцитам. Более того, в экспериментах по трансплантации предшественников глии человека A2B5 + / PSA-NCAM — астроциты в мозге мыши-хозяина постепенно заменялись астроцитами человека, полученными из донорских клеток (Han et al., 2013; Windrem et al. ., 2014), предполагая межклеточную конкуренцию между астроцитами за их эксклюзивные домены в ограниченном пространстве полушарий головного мозга. Эту ситуацию следует назвать «войной астроцитов». Интересно, что имплантированные предшественники глии человека развивались клеточно-автономным образом в мозге мышей-хозяев и генерировали протоплазматические астроциты большего диаметра, чем клетки-хозяева, а также астроциты с варикозной проекцией, имеющие несколько длинных неразветвленных отростков с множеством варикозов.Удивительно, но полученные в результате гуманизированные химерные мыши продемонстрировали более высокий LTP и более высокую способность к обучению, чем контрольные мыши (Han et al., 2013), предполагая, что более высокая интеллектуальная активность людей, по крайней мере, частично обусловлена астроцитами человеческого типа.
Более того, в экспериментах по трансплантации предшественников глии человека A2B5 + / PSA-NCAM — астроциты в мозге мыши-хозяина постепенно заменялись астроцитами человека, полученными из донорских клеток (Han et al., 2013; Windrem et al. ., 2014), предполагая межклеточную конкуренцию между астроцитами за их эксклюзивные домены в ограниченном пространстве полушарий головного мозга. Эту ситуацию следует назвать «войной астроцитов». Интересно, что имплантированные предшественники глии человека развивались клеточно-автономным образом в мозге мышей-хозяев и генерировали протоплазматические астроциты большего диаметра, чем клетки-хозяева, а также астроциты с варикозной проекцией, имеющие несколько длинных неразветвленных отростков с множеством варикозов.Удивительно, но полученные в результате гуманизированные химерные мыши продемонстрировали более высокий LTP и более высокую способность к обучению, чем контрольные мыши (Han et al., 2013), предполагая, что более высокая интеллектуальная активность людей, по крайней мере, частично обусловлена астроцитами человеческого типа.
Перспективы
В этой статье я описал гетерогенность астроцитов в разных участках коры головного мозга и у разных видов животных. Я также описал несколько различных источников происхождения астроцитов.В настоящее время отношения между происхождением и подтипами астроцитов еще полностью не выяснены. Например, развитие и спецификация протоплазматических и фиброзных астроцитов все еще не ясны, даже несмотря на то, что они являются самыми основными подтипами астроцитов. Недавние исследования выявили многие аспекты физиологической важности астроцитов, такие как регуляция функций синапсов и кровоток, что привлекло большое внимание к процессу развития, созревания и пластичности глии.Более того, новые методы отслеживания клонов и переноса генов для глиальных предшественников были разработаны с использованием транспозонов или систем Cre-loxP, и эти современные методы в настоящее время значительно ускоряют накопление знаний в этой области. Интересно, что многие гены, специфичные для глии, были идентифицированы как гены, связанные с нарушениями развития и / или психическими расстройствами.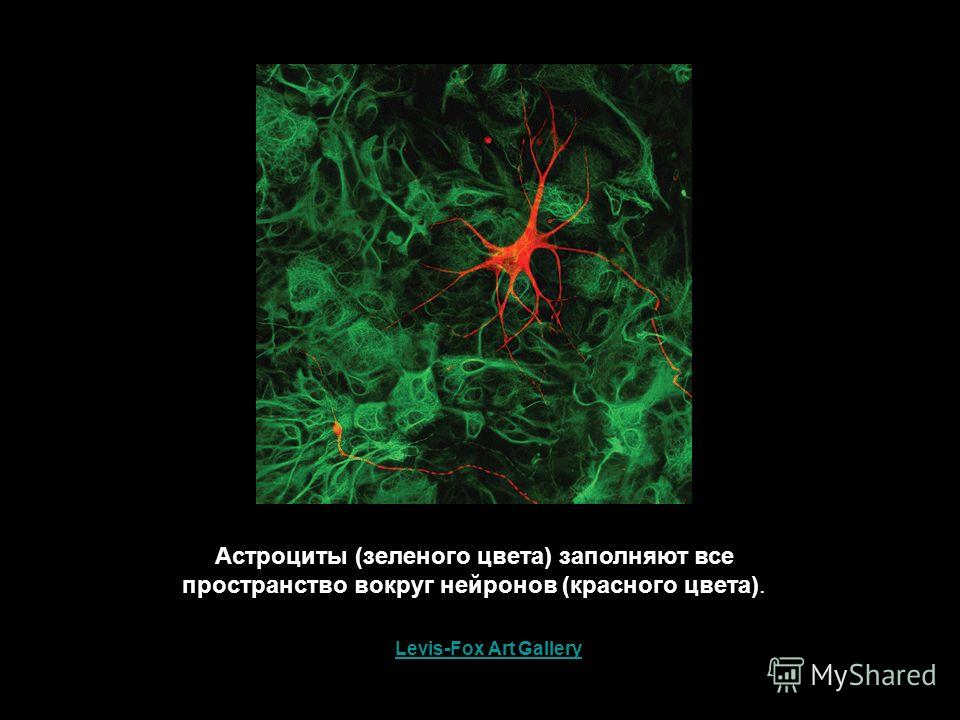 Для понимания механизмов, лежащих в основе развития этих заболеваний, и для разработки новых клинических методов лечения важны дальнейшие знания о развитии глии.
Для понимания механизмов, лежащих в основе развития этих заболеваний, и для разработки новых клинических методов лечения важны дальнейшие знания о развитии глии.
Заявление о конфликте интересов
Автор заявляет, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Я благодарю доктора Кох-ичи Нагату и всех сотрудников его лаборатории за их поддержку в подготовке этой рукописи. Работа поддержана грантами на научные исследования Министерства образования, культуры, спорта, науки и технологий Японии (25123727, 25430046) и Фондом NOVARTIS (Япония) по развитию науки.
Список литературы
Bandeira, F., Lent, R., and Herculano-Houzel, S. (2009). Изменение количества нейрональных и ненейрональных клеток лежит в основе постнатального роста мозга крысы. Proc. Natl. Акад. Sci. США . 106, 14108–14113. DOI: 10.1073 / pnas.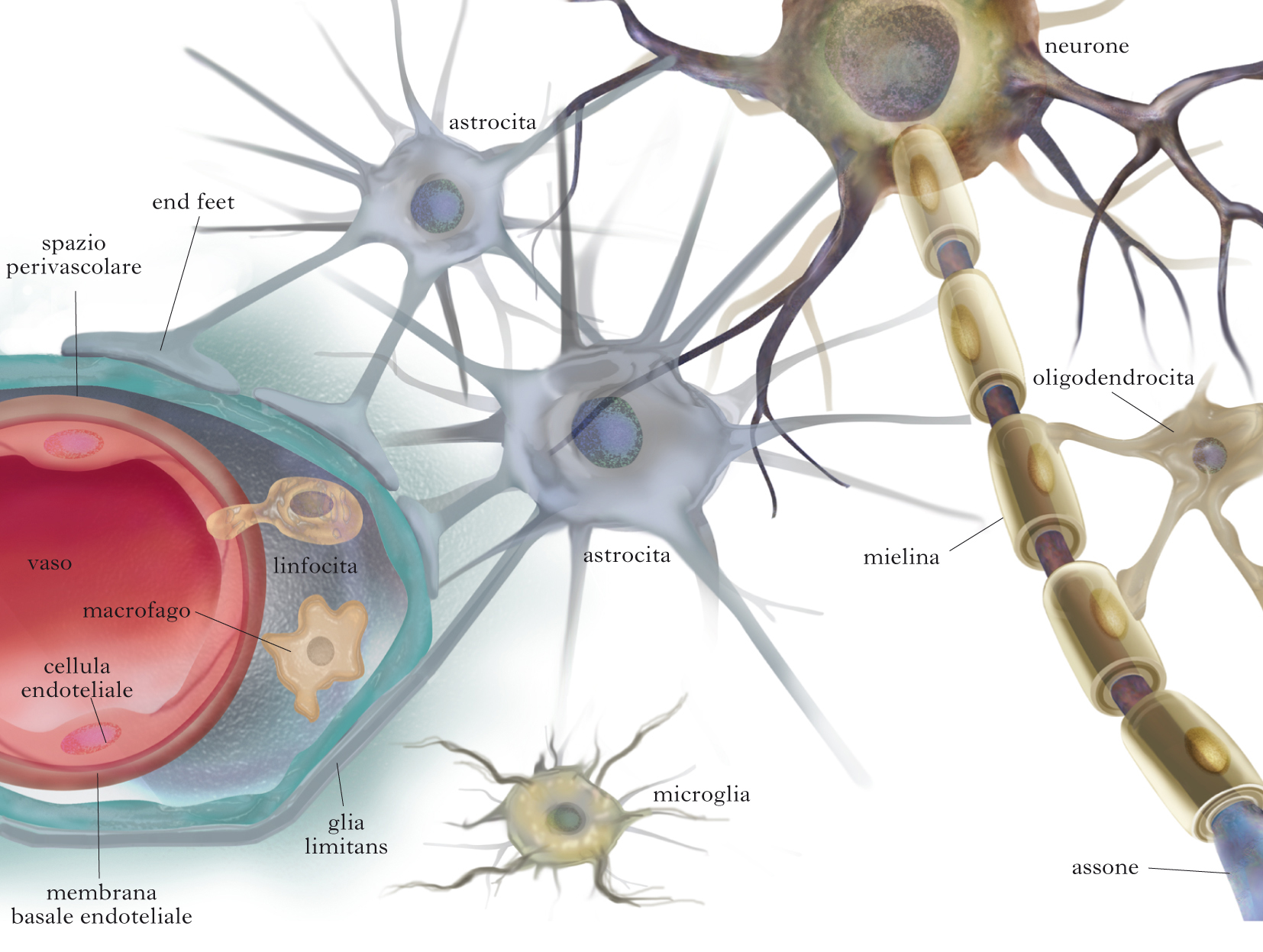 0804650106
0804650106
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Басс, Н. Х., Гесс, Х. Х., Поуп, А., и Тальхаймер, К. (1971). Количественное цитоархитектоническое распределение нейронов, глии и ДНК в коре головного мозга крыс. J. Comp. Neurol . 143, 481–490. DOI: 10.1002 / cne.
0405PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Бушонг, Э. А., Мартоне, М. Э., Джонс, Ю. З., и Эллисман, М. Х. (2002). Протоплазматические астроциты CA1 stratum radiatum занимают отдельные анатомические домены. Дж. Neurosci . 22, 183–192.
PubMed Аннотация | Полный текст | Google Scholar
Cai, J., Chen, Y., Cai, W.-H., Hurlock, E.C., Wu, H., Kernie, S.G., et al. (2007). Решающая роль Olig2 в развитии астроцитов белого вещества. Развитие 134, 1887–1899. DOI: 10.1242 / dev.02847
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Коломбо, Дж. А., Липина, С., Якез, А., и Пуассан, В. (1997). Постнатальное развитие интерламинарных астроглиальных процессов в коре головного мозга приматов. Внутр. J. Dev. Neurosci . 15, 823–833. DOI: 10.1016 / S0736-5748 (97) 00043-9
А., Липина, С., Якез, А., и Пуассан, В. (1997). Постнатальное развитие интерламинарных астроглиальных процессов в коре головного мозга приматов. Внутр. J. Dev. Neurosci . 15, 823–833. DOI: 10.1016 / S0736-5748 (97) 00043-9
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Коста, М.Р., Бухольц, О., Шредер, Т., и Гётц, М. (2009). Позднее происхождение ограниченных глией предшественников в развивающейся коре головного мозга мышей. Cereb. Cortex 19 (Приложение 1), i135 – i143. DOI: 10.1093 / cercor / bhp046
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Коста, М. Р., Кессарис, Н., Ричардсон, В. Д., Гетц, М., и Хедин-Перейра, К. (2007). Маргинальная зона / слой I как новая ниша нейрогенеза и глиогенеза в развивающейся коре головного мозга. Дж. Neurosci . 27, 11376–11388. DOI: 10.1523 / JNEUROSCI.2418-07.2007
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
de Azevedo, L. C., Fallet, C.R., Moura-Neto, V., Daumas-Duport, C.R., Hedin-Pereira, C., and Lent, R. (2003). Кортикальные радиальные глиальные клетки у плодов человека: коррелированная по глубине трансформация в астроциты. Дж. Нейробиол . 55, 288–298. DOI: 10.1002 / neu.10205
C., Fallet, C.R., Moura-Neto, V., Daumas-Duport, C.R., Hedin-Pereira, C., and Lent, R. (2003). Кортикальные радиальные глиальные клетки у плодов человека: коррелированная по глубине трансформация в астроциты. Дж. Нейробиол . 55, 288–298. DOI: 10.1002 / neu.10205
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
де лос Монтерос, А.Э., Чжан М. и Де Веллис Дж. (1993). Клетки-предшественники O2A, трансплантированные в мозг новорожденных крыс, развиваются в олигодендроциты, но не в астроциты. Proc. Natl. Акад. Sci. США . 90, 50–54.
PubMed Аннотация | Полный текст | Google Scholar
Эйзенбарт, Г.С., Уолш, Ф.С., и Ниренберг, М. (1979). Моноклональные антитела к антигену плазматической мембраны нейронов. Proc. Natl. Акад. Sci. США . 76, 4913–4917.
PubMed Аннотация | Полный текст | Google Scholar
Гао, П., Postiglione, M. P., Krieger, T. G., Hernandez, L., Wang, C., Han, Z., et al. (2014). Детерминированное поведение предшественников и унитарное производство нейронов в неокортексе. Cell 159, 775–788. DOI: 10.1016 / j.cell.2014.10.027
Детерминированное поведение предшественников и унитарное производство нейронов в неокортексе. Cell 159, 775–788. DOI: 10.1016 / j.cell.2014.10.027
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Ge, W.-P., Miyawaki, A., Gage, F.H., Jan, Y. N., and Jan, L.Y. (2012). Местное образование глии является основным источником астроцитов в постнатальной коре головного мозга. Природа 484, 376–380.DOI: 10.1038 / nature10959
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Грессенс П., Ришельм К., Кадхим Х. Дж., Гадиссе Дж. Ф. и Эврард П. (1992). Зона прорастания производит наибольшее количество кортикальных астроцитов после миграции нейронов в развивающемся мозге млекопитающих. Biol. Новорожденный 61, 4–24.
PubMed Аннотация | Полный текст | Google Scholar
Халасса, М. М., Феллин, Т., Такано, Х., Донг, Ж.-Х., и Хейдон, П.Г. (2007). Синаптические острова, определяемые территорией отдельного астроцита.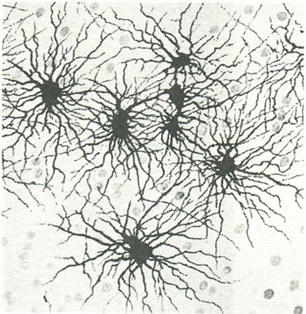 Дж. Neurosci . 27, 6473–6477. DOI: 10.1523 / JNEUROSCI.1419-07.2007
Дж. Neurosci . 27, 6473–6477. DOI: 10.1523 / JNEUROSCI.1419-07.2007
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Хан, X., Чен, М., Ван, Ф., Виндрем, М., Ван, С., Шанз, С., и др. (2013). Приживление переднего мозга глиальными клетками-предшественниками человека увеличивает синаптическую пластичность и способность к обучению у взрослых мышей. Стволовая клетка 12, 342–353. DOI: 10.1016 / j.stem.2012.12.015
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Каваками К. и Нода Т. (2004). Транспозиция элемента Tol2, Ac-подобного элемента из японской рыбы medaka Oryzias latipes, в эмбриональные стволовые клетки мыши. Генетика 166, 895–899. DOI: 10.1534 / genetics.166.2.895
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Кессарис, Н., Фогарти, М., Ианнарелли, П., Грист, М., Вегнер, М., и Ричардсон, В.Д. (2006). Конкурирующие волны олигодендроцитов в переднем мозге и постнатальная элиминация эмбрионального происхождения. Нац. Neurosci . 9, 173–179. DOI: 10.1038 / nn1620
Нац. Neurosci . 9, 173–179. DOI: 10.1038 / nn1620
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Кучукдерели, Х., Аллен, Н. Дж., Ли, А. Т., Фенг, А., Озлу, М. И., Конатсер, Л. М. и др. (2011). Контроль возбуждающего синаптогенеза ЦНС с помощью секретируемых астроцитами белков Hevin и SPARC. Proc. Natl. Акад. Sci. США .108, E440 – E449. DOI: 10.1073 / pnas.1104977108
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Левисон, С. В., Чуанг, К., Абрамсон, Б. Дж., И Голдман, Дж. Э. (1993). Паттерны миграции и судьба развития глиальных предшественников в субвентрикулярной зоне крыс регулируются во времени. Девелопмент 119, 611–622.
PubMed Аннотация | Полный текст | Google Scholar
Левисон, С. В., и Голдман, Дж. Э. (1993). И олигодендроциты, и астроциты развиваются из предшественников в субвентрикулярной зоне постнатального переднего мозга крысы. Neuron 10, 201–212.
PubMed Аннотация | Полный текст | Google Scholar
Левитт П., Купер М. Л. и Ракич П. (1981). Сосуществование нейрональных и глиальных клеток-предшественников в церебральной желудочковой зоне эмбриональной обезьяны: ультраструктурный иммунопероксидазный анализ. Дж. Neurosci . 1, 27–39.
PubMed Аннотация | Полный текст | Google Scholar
Марин-Падилья, М. (1995). Пренатальное развитие фиброзных (белое вещество), протоплазматических (серое вещество) и астроцитов слоя I в коре головного мозга человека: исследование Гольджи. J. Comp. Neurol . 357, 554–572. DOI: 10.1002 / cne.
0407PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Маршалл, К.А.Г., и Голдман, Дж. Э. (2002). Субпалиальные клетки, экспрессирующие dlx2, дают астроциты и олигодендроциты в коре головного мозга и белом веществе. Дж. Neurosci . 22, 9821–9830.
PubMed Аннотация | Полный текст | Google Scholar
Маршалл, К. А.Г., Нович, Б.Г., и Голдман, Дж.Э. (2005). Olig2 управляет образованием астроцитов и олигодендроцитов в клетках постнатальной субвентрикулярной зоны. Дж. Neurosci . 25, 7289–7298. DOI: 10.1523 / JNEUROSCI.1924-05.2005
А.Г., Нович, Б.Г., и Голдман, Дж.Э. (2005). Olig2 управляет образованием астроцитов и олигодендроцитов в клетках постнатальной субвентрикулярной зоны. Дж. Neurosci . 25, 7289–7298. DOI: 10.1523 / JNEUROSCI.1924-05.2005
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Маккарти М., Тернбулл Д. Х., Уолш К. А. и Фишелл Г. (2001). Телеэнцефальные нейральные предшественники, по-видимому, ограничены региональными и глиальными судьбами до начала нейрогенеза. Дж. Neurosci . 21, 6772–6781.
PubMed Аннотация | Полный текст | Google Scholar
Миллер Р. Х. и Рафф М. К. (1984). Фиброзные и протоплазматические астроциты биохимически и эволюционно различаются. Дж. Neurosci . 4, 585–592.
PubMed Аннотация | Полный текст | Google Scholar
Молофски, А. В., Креник, Р., Уллиан, Э., Цай, Х. Х., Денин, Б., Ричардсон, В. Д. и др. (2012). Астроциты и болезни: перспектива развития нервной системы. Genes Dev .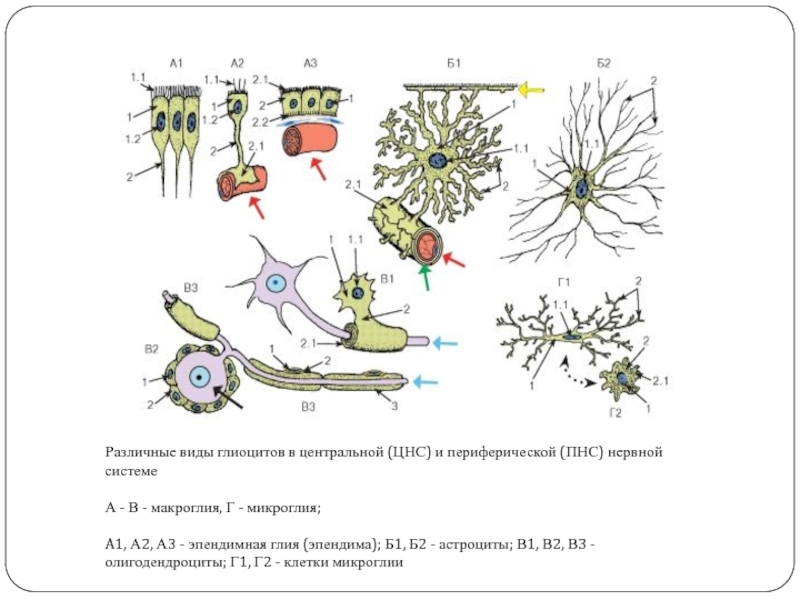 26, 891–907.DOI: 10.1101 / gad.188326.112
26, 891–907.DOI: 10.1101 / gad.188326.112
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Надараджа, Б., Брюнстрем, Дж. Э., Груцендлер, Дж., Вонг, Р. О., и Перлман, А. Л. (2001). Два режима радиальной миграции в раннем развитии коры головного мозга. Нац. Neurosci . 4, 143–150. DOI: 10.1038 / 83967
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Noctor, S.C., Flint, A.C., Weissman, T.A., Dammerman, R.С., Кригштейн А. Р. (2001). Нейроны, происходящие из радиальных глиальных клеток, образуют радиальные единицы в неокортексе. Природа 409, 714–720. DOI: 10.1038 / 35055553
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Ноктор, С. К., Мартинес-Серденьо, В., Ивич, Л., и Кригштейн, А. Р. (2004). Корковые нейроны возникают в симметричных и асимметричных зонах деления и мигрируют через определенные фазы. Нац. Neurosci . 7, 136–144. DOI: 10.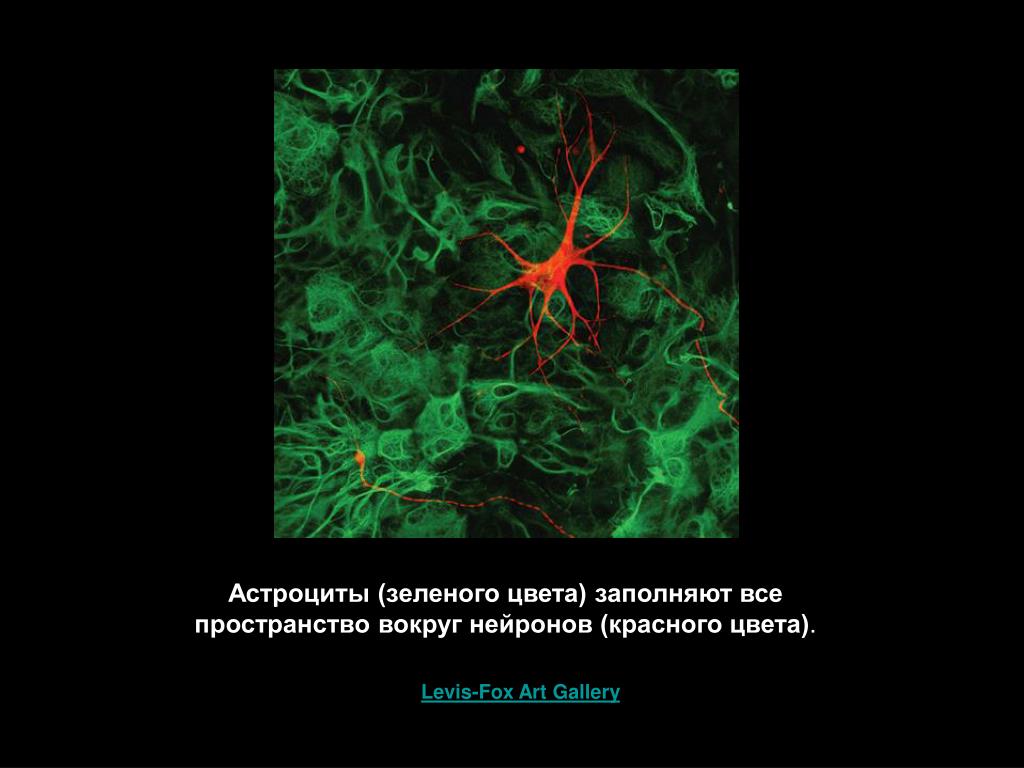 1038 / nn1172
1038 / nn1172
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Оберхейм, Н.A., Takano, T., Han, X., He, W., Lin, J. H. C., Wang, F., et al. (2009). Уникальные гоминидные черты астроцитов взрослого человека. Дж. Neurosci . 29, 3276–3287. DOI: 10.1523 / JNEUROSCI.4707-08.2009
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Оно, К., Такебаяси, Х., Икеда, К., Фурушо, М., Нисидзава, Т., Ватанабе, К., и др. (2008). Региональные и временные изменения в дифференцировке предшественников Olig2 в переднем мозге и влияние на развитие астроцитов в дорсальном паллии. Dev. Биол . 320, 456–468. DOI: 10.1016 / j.ydbio.2008.06.001
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Прайс, Дж., И Терлоу, Л. (1988). Клеточные линии коры головного мозга крысы: исследование с использованием передачи генов, опосредованной ретровирусами. Развитие 104, 473–482.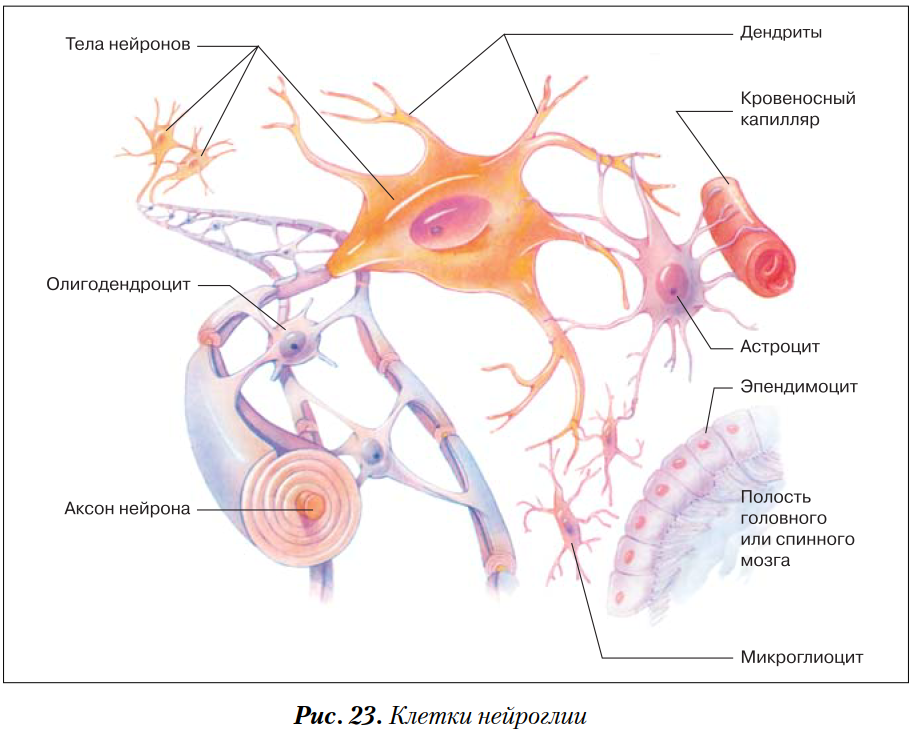
PubMed Аннотация | Полный текст | Google Scholar
Рафф, М. К., Эбни, Э. Р., Коэн, Дж., Линдси, Р., и Ноубл, М. (1983a). Два типа астроцитов в культурах развивающегося белого вещества крыс: различия в морфологии, поверхностные ганглиозиды и характеристики роста. Дж. Neurosci . 3, 1289–1300.
PubMed Аннотация | Полный текст | Google Scholar
Рафф, М. К., Миллер, Р. Х. и Нобл, М. (1983b). Глиальная клетка-предшественник, которая развивает in vitro в астроцит или олигодендроцит в зависимости от культуральной среды. Природа 303, 390–396.
PubMed Аннотация | Полный текст | Google Scholar
Риверс, Л. Е., Янг, К. М., Рицци, М., Джамен, Ф., Псачулиа, К., Уэйд, А. и др. (2008). Глия PDGFRA / NG2 генерирует миелинизирующие олигодендроциты и грушевидные проекционные нейроны у взрослых мышей. Нац. Neurosci . 11, 1392–1401. DOI: 10.1038 / nn.2220
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Ротштейн, Дж. Д., Дайкс-Хоберг, М., Пардо, К. А., Бристоль, Л. А., Джин, Л., Кункл, Р. В. и др. (1996). Нокаут переносчиков глутамата показывает важную роль астроглиального транспорта в эксайтотоксичности и клиренсе глутамата. Neuron 16, 675–686.
Д., Дайкс-Хоберг, М., Пардо, К. А., Бристоль, Л. А., Джин, Л., Кункл, Р. В. и др. (1996). Нокаут переносчиков глутамата показывает важную роль астроглиального транспорта в эксайтотоксичности и клиренсе глутамата. Neuron 16, 675–686.
PubMed Аннотация | Полный текст | Google Scholar
Сато, Ю., Kasai, T., Nakagawa, S., Tanabe, K., Watanabe, T., Kawakami, K., et al. (2007). Стабильная интеграция и условная экспрессия электропорированных трансгенов в куриных эмбрионах. Dev. Биол . 305, 616–624. DOI: 10.1016 / j.ydbio.2007.01.043
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Шмехель Д. Э. и Ракич П. (1979). Исследование Гольджи радиальных глиальных клеток в развивающемся конечном мозге обезьяны: морфогенез и превращение в астроциты. Анат. Эмбриол . 156, 115–152.
PubMed Аннотация | Полный текст | Google Scholar
Сиддики, Ф., Чен, Ф., Арон, А. В., Фионделла, К. Г., Патель, К., и Ло Турко, Дж. Дж. (2014). Картирование судьбы с помощью транспозазы PiggyBac показывает, что неокортикальные предшественники GLAST + генерируют больше астроцитов, чем предшественники нестин + в неокортексе крысы. Cereb. Cortex 24, 508–520. DOI: 10.1093 / cercor / bhs332.
Дж. (2014). Картирование судьбы с помощью транспозазы PiggyBac показывает, что неокортикальные предшественники GLAST + генерируют больше астроцитов, чем предшественники нестин + в неокортексе крысы. Cereb. Cortex 24, 508–520. DOI: 10.1093 / cercor / bhs332.
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Симард, М., Аркуино, Г., Такано, Т., Лю, К. С., и Недергаард, М. (2003). Передача сигналов на глиоваскулярном интерфейсе. Дж. Neurosci . 23, 9254–9262.
PubMed Аннотация | Полный текст | Google Scholar
Сосунов, А.А., Ву, X., Цанкова, Н.М., Гилфойл, Э., Маккханн, Г.М., и Голдман, Дж. Э. (2014). Фенотипическая гетерогенность и пластичность изокортикальных и гиппокампальных астроцитов головного мозга человека. Дж. Neurosci . 34, 2285–2298. DOI: 10.1523 / JNEUROSCI.4037-13.2014
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Табата, Х.и Накадзима К. (2001). Эффективная система переноса гена in utero в развивающийся мозг мыши с использованием электропорации: визуализация миграции нейронов в развивающейся коре головного мозга. Неврология 103, 865–872. DOI: 10.1016 / S0306-4522 (01) 00016-1
Эффективная система переноса гена in utero в развивающийся мозг мыши с использованием электропорации: визуализация миграции нейронов в развивающейся коре головного мозга. Неврология 103, 865–872. DOI: 10.1016 / S0306-4522 (01) 00016-1
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Takano, T., Tian, G.-F., Peng, W., Lou, N., Libionka, W., Han, X., et al. (2005). Астроцит-опосредованный контроль мозгового кровотока. Нац.Neurosci . 9, 260–267. DOI: 10.1038 / nn1623
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Цай, Х.-Х., Ли, Х., Фуэнтеалба, Л.С., Молофски, А.В., Тавейра-Маркес, Р., Чжуанг, Х. и др. (2012). Распределение астроцитов в регионах регулирует синаптогенез и восстановление ЦНС. Наука 337, 358–362. DOI: 10.1126 / science.1222381
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Увечуэ, Н. М., Маркс, М.-C., Chevy, Q.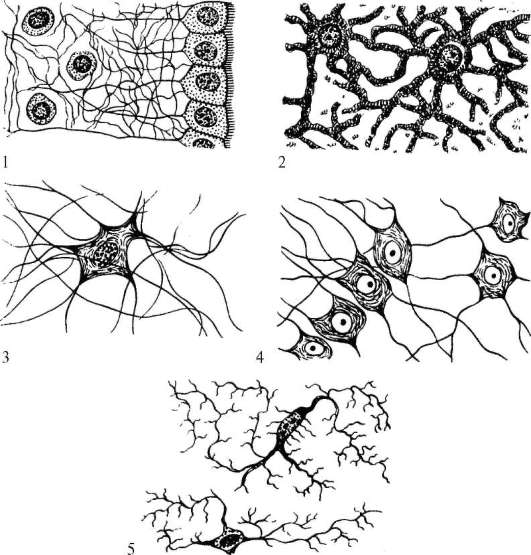 , и Billups, B. (2012). Активация транспорта глутамата вызывает быстрое высвобождение глутамина из перисинаптических астроцитов. J. Physiol . 590, 2317–2331. DOI: 10.1113 / jphysiol.2011.226605
, и Billups, B. (2012). Активация транспорта глутамата вызывает быстрое высвобождение глутамина из перисинаптических астроцитов. J. Physiol . 590, 2317–2331. DOI: 10.1113 / jphysiol.2011.226605
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Виндрем, М. С., Нуньес, М. К., Рашбаум, В. К., Шварц, Т. Х., Гудман, Р. А., Маккханн, Г., и др. (2004). Клетки-предшественники олигодендроцитов плода и взрослого человека изолируют миелинизированный мозг врожденно дисмиелинизированный. Нац. Мед . 10, 93–97. DOI: 10,1038 / нм974
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Windrem, M. S., Schanz, S.J., Guo, M., Tian, G.-F., Washco, V., Stanwood, N., et al. (2008). Неонатальная химеризация глиальными клетками-предшественниками человека может как ремиелинизировать, так и спасать мышей с гипомиелинизированной дрожью, которые иначе были бы смертельными. Cell Stem Cell 2, 553–565. DOI: 10. 1016 / j.stem.2008.03.020
1016 / j.stem.2008.03.020
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Виндрем, М.С., Шанц, С. Дж., Морроу, К., Мунир, Дж., Чандлер-Милителло, Д., Ван, С. и др. (2014). Конкурентное преимущество за счет привитых неонатально предшественников глии человека дает мышей, мозг которых химерен для глии человека. Дж. Neurosci . 34, 16153–16161. DOI: 10.1523 / JNEUROSCI.1510-14.2014
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Ёсида, А., Ямагути, Ю., Нономура, К., Каваками, К., Такахаши, Ю., и Миура, М. (2010). Одновременная экспрессия различных трансгенов в нейронах и глии путем комбинирования электропорации in utero с системой переноса генов, опосредованной транспозоном Tol2. Genes Cells 15, 501–512. DOI: 10.1111 / j.1365-2443.2010.01397.x
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Zhu, X., Zuo, H., Maher, B.J., Serwanski, D. R., LoTurco, J. J., Lu, Q. R., et al. (2012). Олиг2-зависимый переключатель судьбы онтогенетических клеток NG2. Развитие 139, 2299–2307. DOI: 10.1242 / dev.078873
R., LoTurco, J. J., Lu, Q. R., et al. (2012). Олиг2-зависимый переключатель судьбы онтогенетических клеток NG2. Развитие 139, 2299–2307. DOI: 10.1242 / dev.078873
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Структурное ремоделирование фиброзных астроцитов после травмы аксона
Реферат
Реактивные астроциты являются патологическим признаком многих повреждений ЦНС и нейродегенераций.Для них характерны гипертрофия сомы и отростков и повышение экспрессии глиального фибриллярного кислого белка. Поскольку клетки скрывают друг друга при иммуноокрашивании, мало что известно ни о поведении одного реактивного астроцита, ни о том, как отдельные астроциты объединяются, образуя глиальный рубец. Мы исследовали реакцию фиброзных астроцитов на дегенерацию аксонов с использованием линии трансгенных мышей, экспрессирующих усиленный зеленый флуоресцентный белок в небольших подгруппах астроцитов.Фиброзные астроциты зрительного нерва и мозолистого тела первоначально реагируют на повреждение гипертрофией сомы и отростков.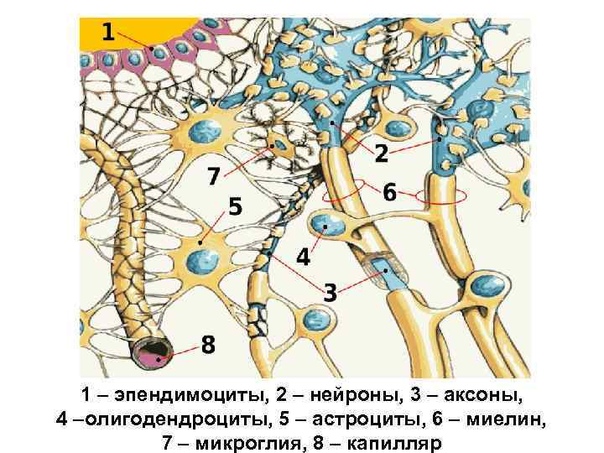 Они убирают свои первичные отростки, упрощая свою форму и резко сокращая пространственный охват. Через 3 дня после раздавливания количественный анализ показал почти двукратное увеличение толщины первичных отростков, уменьшение вдвое количества первичных отростков, выходящих из сомы, и восьмикратное уменьшение пространственного покрытия. На следующей неделе они частично повторно расширяют длинные отростки, возвращаясь к почти нормальной морфологии и обширному пространственному перекрытию.Образовавшийся глиальный рубец состоит из неравномерного набора отростков астроцитов, контрастирующих с их первоначальным упорядоченным расположением. Эти изменения резко контрастируют с теми, о которых сообщается для реактивных протоплазматических астроцитов серого вещества, в которых количество отростков и ветвлений увеличивается, но клетки продолжают сохранять неперекрывающиеся отдельные территории на протяжении всей своей реакции на повреждение.
Они убирают свои первичные отростки, упрощая свою форму и резко сокращая пространственный охват. Через 3 дня после раздавливания количественный анализ показал почти двукратное увеличение толщины первичных отростков, уменьшение вдвое количества первичных отростков, выходящих из сомы, и восьмикратное уменьшение пространственного покрытия. На следующей неделе они частично повторно расширяют длинные отростки, возвращаясь к почти нормальной морфологии и обширному пространственному перекрытию.Образовавшийся глиальный рубец состоит из неравномерного набора отростков астроцитов, контрастирующих с их первоначальным упорядоченным расположением. Эти изменения резко контрастируют с теми, о которых сообщается для реактивных протоплазматических астроцитов серого вещества, в которых количество отростков и ветвлений увеличивается, но клетки продолжают сохранять неперекрывающиеся отдельные территории на протяжении всей своей реакции на повреждение.
Введение
Астроциты реагируют на многие формы поражения ЦНС, становясь «реактивными».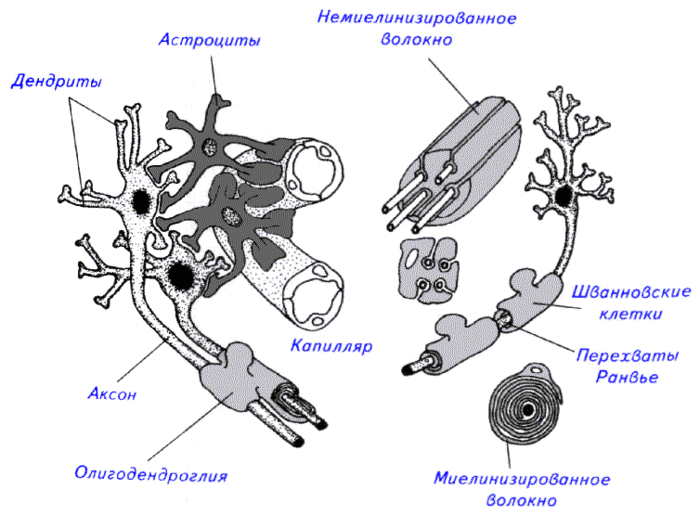 Они повышают экспрессию промежуточных филаментов [например, глиального фибриллярного кислого белка (GFAP), виментина], тела клетки и процессов гипертрофии, при этом клетки образуют глиальный рубец (Eddleston and Mucke, 1993; Ridet et al., 1997 ; Софронев, 2009; Софронев, Винтерс, 2010). Иммуноцитохимическое определение GFAP было стандартным маркером реактивных астроцитов. Однако GFAP определяет только ~ 15% от общего объема астроцита (Connor and Berkowitz, 1985; Bushong et al., 2002), оставляя истинную морфологию астроцита невидимой и затрудняя различение многих морфологических типов астроциты (Kettenmann, Ransom, 2005).Цитоплазматические маркеры могут выявить более тонкие отростки, но образуют рисунок маркировки с небольшим видимым разделением между соседними астроцитами. Следовательно, хотя реактивный глиоз является стереотипной реакцией астроцитов на стресс, для большинства типов астроцитов неизвестно, как на самом деле появляется отдельный реактивный астроцит и как популяция этих клеток ремоделируется, образуя глиальный рубец.
Они повышают экспрессию промежуточных филаментов [например, глиального фибриллярного кислого белка (GFAP), виментина], тела клетки и процессов гипертрофии, при этом клетки образуют глиальный рубец (Eddleston and Mucke, 1993; Ridet et al., 1997 ; Софронев, 2009; Софронев, Винтерс, 2010). Иммуноцитохимическое определение GFAP было стандартным маркером реактивных астроцитов. Однако GFAP определяет только ~ 15% от общего объема астроцита (Connor and Berkowitz, 1985; Bushong et al., 2002), оставляя истинную морфологию астроцита невидимой и затрудняя различение многих морфологических типов астроциты (Kettenmann, Ransom, 2005).Цитоплазматические маркеры могут выявить более тонкие отростки, но образуют рисунок маркировки с небольшим видимым разделением между соседними астроцитами. Следовательно, хотя реактивный глиоз является стереотипной реакцией астроцитов на стресс, для большинства типов астроцитов неизвестно, как на самом деле появляется отдельный реактивный астроцит и как популяция этих клеток ремоделируется, образуя глиальный рубец.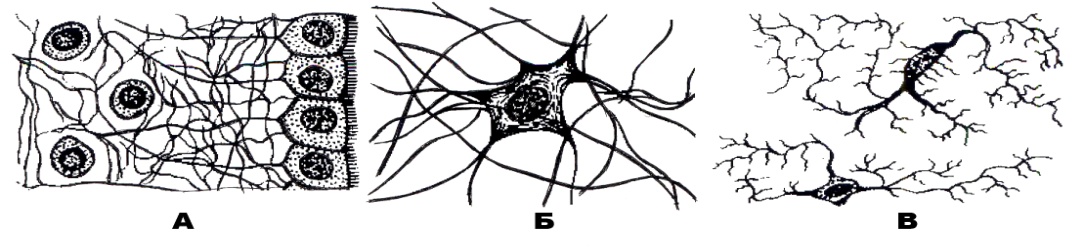
Наиболее изученными астроцитами с точки зрения морфологии и организации являются протоплазматические астроциты серого вещества.Эти астроциты были детально визуализированы с помощью микроинъекций и с использованием трансгенных животных. Они организованы в неперекрывающиеся пространственные домены с перекрытием только самых периферических отростков соседних астроцитов (Bushong et al., 2002; Ogata and Kosaka, 2002; Halassa et al., 2007; Oberheim et al., 2008, 2009). После травмы реактивные протоплазматические астроциты в гиппокампе и коре головного мозга сохраняют свои неперекрывающиеся пространственные домены и, следовательно, объем занимаемого ими нейропиля, но при этом происходит гипертрофия основных процессов и количество первичных отростков, выходящих из сомы, увеличивается.В целом это увеличивает плотность процессов, заполняющих этот объем (Wilhelmsson et al., 2006).
Волокнистые астроциты белого вещества не организованы в пространственные домены, а отростки соседних астроцитов широко пересекаются (Oberheim et al. , 2009). Помимо наблюдения, что экспрессия GFAP заметно повышается, мало что известно о том, как фиброзные астроциты реагируют на повреждение. Butt и Colquhoun (1996) использовали одноклеточные инъекции, чтобы продемонстрировать упрощение процессов отдельных астроцитов после перерезки собственно зрительного нерва незрелых крыс.Здесь мы использовали трансгенную линию мышей, которая экспрессирует усиленный зеленый флуоресцентный белок (EGFP) в подмножествах астроцитов, чтобы получить подробную визуализацию многих астроцитов (Nolte et al., 2001; Emsley and Macklis, 2006). Мы изучили полную морфологию и пространственное расположение реактивных фиброзных астроцитов в пределах трех структур ЦНС: глиальной пластинки в головке зрительного нерва, миелинизированной части зрительного нерва и мозолистого тела. Мы уделили особое внимание глиальной пластине, потому что при глаукоме эта область считается первичным местом повреждения, ведущего к дегенерации аксонов, и здесь наблюдаются обширные изменения в паттерне маркировки GFAP (Quigley, 1999; Howell et al.
, 2009). Помимо наблюдения, что экспрессия GFAP заметно повышается, мало что известно о том, как фиброзные астроциты реагируют на повреждение. Butt и Colquhoun (1996) использовали одноклеточные инъекции, чтобы продемонстрировать упрощение процессов отдельных астроцитов после перерезки собственно зрительного нерва незрелых крыс.Здесь мы использовали трансгенную линию мышей, которая экспрессирует усиленный зеленый флуоресцентный белок (EGFP) в подмножествах астроцитов, чтобы получить подробную визуализацию многих астроцитов (Nolte et al., 2001; Emsley and Macklis, 2006). Мы изучили полную морфологию и пространственное расположение реактивных фиброзных астроцитов в пределах трех структур ЦНС: глиальной пластинки в головке зрительного нерва, миелинизированной части зрительного нерва и мозолистого тела. Мы уделили особое внимание глиальной пластине, потому что при глаукоме эта область считается первичным местом повреждения, ведущего к дегенерации аксонов, и здесь наблюдаются обширные изменения в паттерне маркировки GFAP (Quigley, 1999; Howell et al.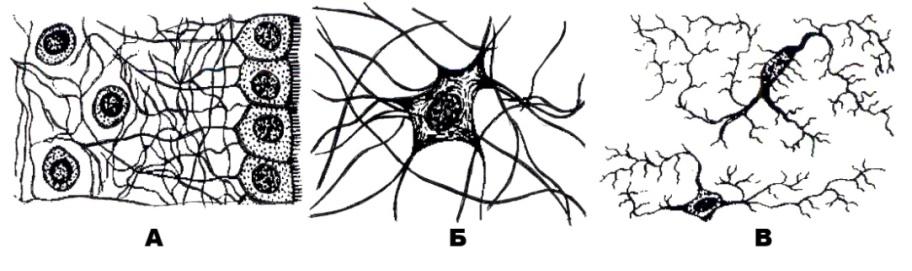 , 2007; Buckingham et al., 2008; Soto et al., 2008). Мы обнаружили, что фиброзные астроциты подвергаются сложному двухэтапному процессу ремоделирования, который отчетливо отличается от процесса в реактивных протоплазматических астроцитах.
, 2007; Buckingham et al., 2008; Soto et al., 2008). Мы обнаружили, что фиброзные астроциты подвергаются сложному двухэтапному процессу ремоделирования, который отчетливо отличается от процесса в реактивных протоплазматических астроцитах.
Результаты
Реактивные фиброзные астроциты в глиальной пластинке — маркировка GFAP
Головка нормального зрительного нерва мыши содержит специализированную область, называемую глиальной пластинкой, где отростки, меченные GFAP, особенно плотны и ориентированы поперечно относительно длинной оси зрительного нерва (рис.2 A , B ). На поперечном срезе эти отростки разделяют соседние аксоны ганглиозных клеток на пучки, образуя глиальные трубки и придавая глиальной архитектуре этой области вид сот (рис. 2). С , Д ). Типичное расположение глиальных трубок показано на вставке на рисунке 2. C , где многочисленные толстые отростки объединяются, образуя стенки глиальной трубки, тогда как короткие тонкие отростки переходят в центр глиальной трубки.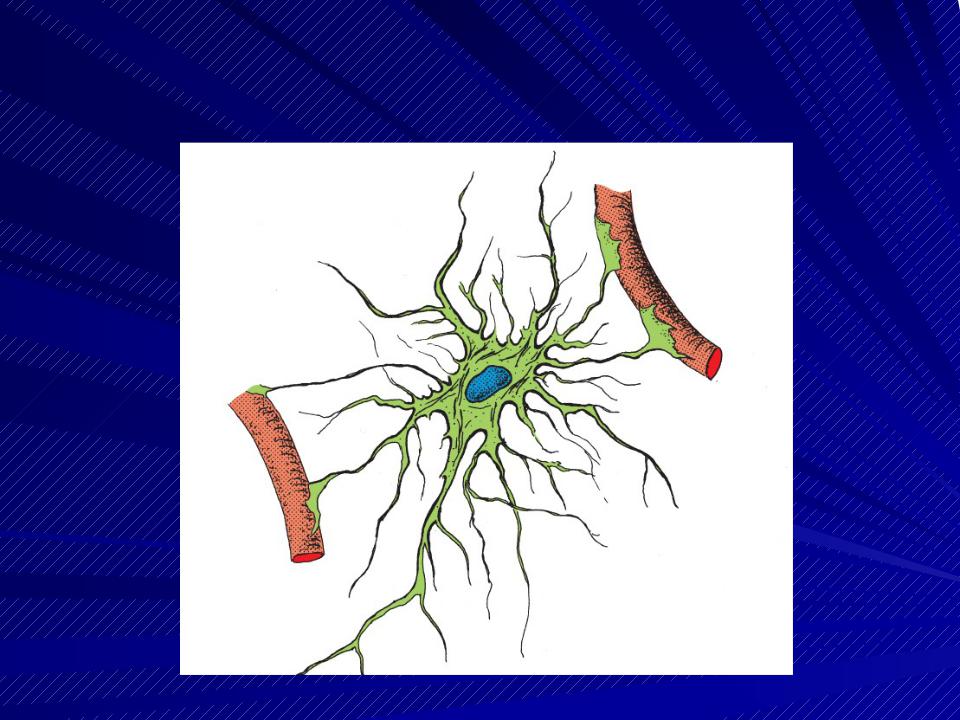 Средняя толщина основных отростков составила 1,10 ± 0,17 мкм (рис. M ) ( n = 46 процессов, 5 мышей). Глиальная пластинка не содержит олигодендроцитов или глиальных клеток NG2. Архитектура нормальной глиальной пластинки была подробно описана ранее (Howell et al., 2007; Sun et al., 2009).
Средняя толщина основных отростков составила 1,10 ± 0,17 мкм (рис. M ) ( n = 46 процессов, 5 мышей). Глиальная пластинка не содержит олигодендроцитов или глиальных клеток NG2. Архитектура нормальной глиальной пластинки была подробно описана ранее (Howell et al., 2007; Sun et al., 2009).
Продольный ( A , B , E , F , I , Дж ) и поперечный ( С , D , G , H , К , л ) срезы зрительного нерва, помеченные для GFAP (отростки астроцитов) и SMI32 (аксоны) в нормальном и раздавленном зрительном нерве. A – D , Внутри нормальной глиальной пластинки отростки астроцитов располагались поперечно ( A , B ) и разделяют соседние аксоны в пучки, образуя глиальные трубки ( С , D , штриховой квадрат) и придавая этой области вид сот ( С , D ).Вставка С — это увеличенный штриховой квадрат. E , F , Через 3 дня после раздавливания произошла потеря отростков в месте раздавливания (наконечники стрел) и аксонов, проксимальных к месту раздавливания; дезорганизация и гипертрофия отростков, особенно в центральной области глиальной пластинки; и аксонов ( F , стрелки).
A – D , Внутри нормальной глиальной пластинки отростки астроцитов располагались поперечно ( A , B ) и разделяют соседние аксоны в пучки, образуя глиальные трубки ( С , D , штриховой квадрат) и придавая этой области вид сот ( С , D ).Вставка С — это увеличенный штриховой квадрат. E , F , Через 3 дня после раздавливания произошла потеря отростков в месте раздавливания (наконечники стрел) и аксонов, проксимальных к месту раздавливания; дезорганизация и гипертрофия отростков, особенно в центральной области глиальной пластинки; и аксонов ( F , стрелки).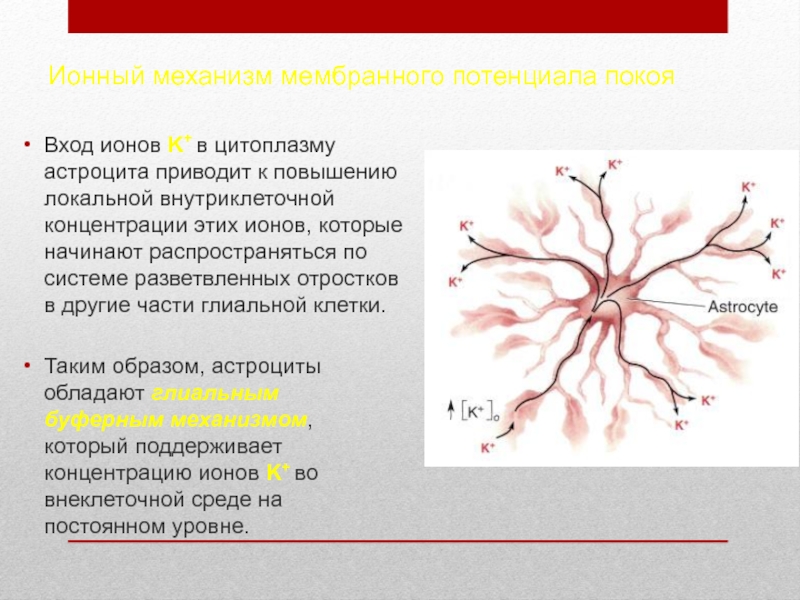 G , H , Были также кисты, заполненные жидкостью (звездочки). Дж , л , Через 2 недели после раздавливания была большая потеря аксонов. I , К . Отростки астроцитов были не такими толстыми, как через 3 дня после раздавливания, и области, лишенные аксонов, теперь заполнены плотным и неорганизованным набором отростков ( К ).Вставка К — это увеличенный штриховой квадрат. Образований глиальных трубок больше не было.
G , H , Были также кисты, заполненные жидкостью (звездочки). Дж , л , Через 2 недели после раздавливания была большая потеря аксонов. I , К . Отростки астроцитов были не такими толстыми, как через 3 дня после раздавливания, и области, лишенные аксонов, теперь заполнены плотным и неорганизованным набором отростков ( К ).Вставка К — это увеличенный штриховой квадрат. Образований глиальных трубок больше не было. M , Морфометрический анализ толщины отростков внутри глиальной пластинки на основе маркировки GFAP (среднее значение ± SEM; * p <0,05). N , На схеме изображено место раздавливания (удар молнии) и то, как был рассечен зрительный нерв (красные полосы).Двунаправленная стрела A , E и I указывает направление длинной оси зрительного нерва. Топор, аксоны; V, кровеносный сосуд. Масштабные линейки, 100 мкм.
M , Морфометрический анализ толщины отростков внутри глиальной пластинки на основе маркировки GFAP (среднее значение ± SEM; * p <0,05). N , На схеме изображено место раздавливания (удар молнии) и то, как был рассечен зрительный нерв (красные полосы).Двунаправленная стрела A , E и I указывает направление длинной оси зрительного нерва. Топор, аксоны; V, кровеносный сосуд. Масштабные линейки, 100 мкм.
Через три дня после раздавливания зрительный нерв показал потерю аксонов и ремоделирование отростков, меченных GFAP (рис.2 E – H ). Отростки внутри глиальной пластинки были дезорганизованы, гипертрофированы и больше не были организованы для образования глиальных трубок (рис. E – H ). В этом примере отростки были особенно толстыми в центральной области глиальной пластинки (рис. G ). Интересно, что отростки астроцитов присутствовали в областях, лишенных аксонов, и наоборот (рис. G , H ). Аксоны, расположенные дистальнее места сдавливания, погибли в результате валлеровской дегенерации и показали луковичные вздутия (рис.2 F , стрелки). В глиальной пластине также были обнаружены многочисленные кисты, заполненные жидкостью (рис. G , H , звездочки). Морфометрический анализ показывает, что отростки, меченные GFAP, были самыми толстыми через 3 и 7 дней после раздавливания (рис. M ) (3 d: 1,51 ± 0,24 мкм; n = 30 процессов, 5 мышей; 7 d: 1,52 ± 0,22 мкм; n = 38 процессов, 5 мышей). Не было существенной разницы в толщине отростков между 3 и 7 сутками после дробления.
E – H ). В этом примере отростки были особенно толстыми в центральной области глиальной пластинки (рис. G ). Интересно, что отростки астроцитов присутствовали в областях, лишенных аксонов, и наоборот (рис. G , H ). Аксоны, расположенные дистальнее места сдавливания, погибли в результате валлеровской дегенерации и показали луковичные вздутия (рис.2 F , стрелки). В глиальной пластине также были обнаружены многочисленные кисты, заполненные жидкостью (рис. G , H , звездочки). Морфометрический анализ показывает, что отростки, меченные GFAP, были самыми толстыми через 3 и 7 дней после раздавливания (рис. M ) (3 d: 1,51 ± 0,24 мкм; n = 30 процессов, 5 мышей; 7 d: 1,52 ± 0,22 мкм; n = 38 процессов, 5 мышей). Не было существенной разницы в толщине отростков между 3 и 7 сутками после дробления.
Через 2 недели зрительный нерв показал серьезную потерю аксонов и образование глиального рубца (рис.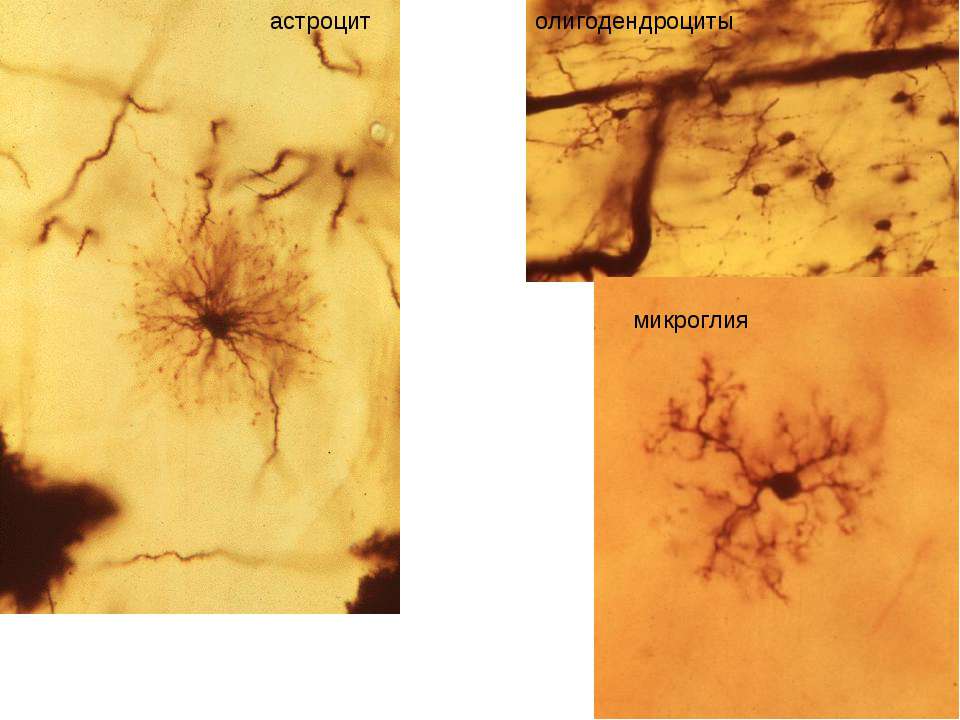 2). I – L ). Глиальная пластинка была полностью заполнена плотной, плотно упакованной сеткой неорганизованных отростков, так что не было областей, лишенных метки GFAP (рис. 2, сравните K , вставка, C, вставка). Сотовый вид этой области был нарушен (первоначально образован толстыми пучками GFAP-меченых отростков) (Sun et al., 2009), и оказалось, что существует большее количество коротких тонких отростков.Без аксонов отростки астроцитов больше не образовывали глиальных трубок (рис. К , L ). На этом этапе отростки уже не были такими толстыми, как через 3 дня после дробления (рис. K , M ) (1,20 ± 0,14 мкм; n = 40 процессов, 5 мышей).
2). I – L ). Глиальная пластинка была полностью заполнена плотной, плотно упакованной сеткой неорганизованных отростков, так что не было областей, лишенных метки GFAP (рис. 2, сравните K , вставка, C, вставка). Сотовый вид этой области был нарушен (первоначально образован толстыми пучками GFAP-меченых отростков) (Sun et al., 2009), и оказалось, что существует большее количество коротких тонких отростков.Без аксонов отростки астроцитов больше не образовывали глиальных трубок (рис. К , L ). На этом этапе отростки уже не были такими толстыми, как через 3 дня после дробления (рис. K , M ) (1,20 ± 0,14 мкм; n = 40 процессов, 5 мышей).
Реактивные фиброзные астроциты в ремоделировании глиальной пластинки отдельных астроцитов
Мечение GFAP не раскрывает полную морфологию отдельных астроцитов.Поэтому мы использовали трансгенных мышей (hGFAPpr-EGFP), которые экспрессируют EGFP в подмножествах астроцитов, чтобы выявить их полную морфологию в нормальном и поврежденном зрительном нерве (см. Рис. 4). А – I ′ ). Через семь дней после раздавливания совместная локализация EGFP-экспрессирующих клеток с антителами против MBP, CD11b и NG2 показала, что они были не олигодендроцитами, микроглией или клетками NG2, а астроцитами, поскольку они совместно локализовались с виментином, S100β и GFAP (рис. 3). A – F ) (данные для других временных точек не показаны).Согласно маркировке TUNEL, морфологические изменения после травмы раздавливания не были связаны с апоптозом (рис. 3). G ). Мечение BrdU продемонстрировало отсутствие значительной пролиферации клеток (рис. 3). H ) (также подтверждено окрашиванием PCNA; данные не представлены).
Рис. 4). А – I ′ ). Через семь дней после раздавливания совместная локализация EGFP-экспрессирующих клеток с антителами против MBP, CD11b и NG2 показала, что они были не олигодендроцитами, микроглией или клетками NG2, а астроцитами, поскольку они совместно локализовались с виментином, S100β и GFAP (рис. 3). A – F ) (данные для других временных точек не показаны).Согласно маркировке TUNEL, морфологические изменения после травмы раздавливания не были связаны с апоптозом (рис. 3). G ). Мечение BrdU продемонстрировало отсутствие значительной пролиферации клеток (рис. 3). H ) (также подтверждено окрашиванием PCNA; данные не представлены).
EGFP-экспрессирующие клетки в глиальной пластинке через 7 дней после раздавливания зрительного нерва не были олигодендроцитами, микроглией или клетками NG2. A – C .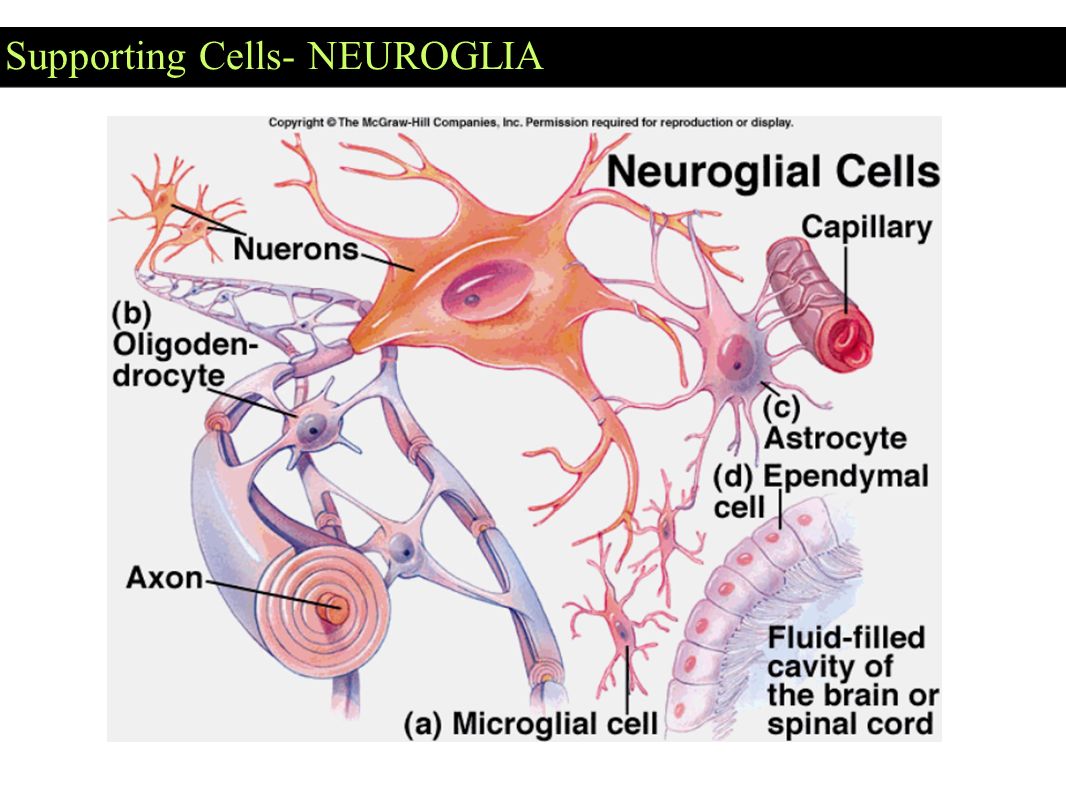 Не было совместной локализации EGFP-экспрессирующих клеток с иммуноцитохимическими маркерами олигодендроцитов (MBP; A ), микроглии (CD11b; B ) или клетки NG2 (NG2; С ). D – F . Однако клетки, экспрессирующие EGFP, колокализованы с S100β ( D ), виментин ( E ) и GFAP ( F ), три общих маркера астроцитов (колокализация <100%, потому что молекулы не присутствуют в ядре). G , H .
Не было совместной локализации EGFP-экспрессирующих клеток с иммуноцитохимическими маркерами олигодендроцитов (MBP; A ), микроглии (CD11b; B ) или клетки NG2 (NG2; С ). D – F . Однако клетки, экспрессирующие EGFP, колокализованы с S100β ( D ), виментин ( E ) и GFAP ( F ), три общих маркера астроцитов (колокализация <100%, потому что молекулы не присутствуют в ядре). G , H . Морфологические изменения, наблюдаемые в EGFP-экспрессирующих клетках после травмы раздавливанием, не были вызваны апоптотической гибелью клеток (по оценке с помощью окрашивания TUNEL; G ) или пролиферации клеток (по оценке окрашивания BrdU; H ).Масштабные линейки, 20 мкм.
Морфологические изменения, наблюдаемые в EGFP-экспрессирующих клетках после травмы раздавливанием, не были вызваны апоптотической гибелью клеток (по оценке с помощью окрашивания TUNEL; G ) или пролиферации клеток (по оценке окрашивания BrdU; H ).Масштабные линейки, 20 мкм.
В нормальной глиальной пластинке отдельные астроциты имеют толстые удлиненные клеточные тела и отростки, ориентированные преимущественно поперек длинной оси зрительного нерва (рис. 4). А ). Эти астроциты редко проецируют обширные продольные отростки и вместе они образуют листы, выровненные поперек зрительного нерва (рис. 4). А ). На поперечном срезе первичные отростки выглядят как плотные стволы, исходящие из цитоплазматического расширения сомы (рис.4 B , стрелка).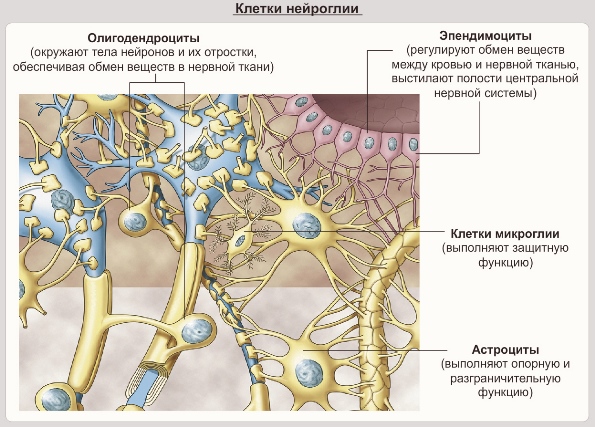 Эти отростки часто охватывают всю ширину зрительного нерва и контактируют со стенкой пиальной стенки или кровеносными сосудами. Кроме того, многие короткие тонкие процессы исходят непосредственно из сомы. Морфология этих астроцитов была подробно описана ранее (Sun et al., 2009). Количественно ширина самого толстого отростка составила 1,14 ± 0,17 мкм, что согласуется с измерениями, основанными на маркировке GFAP (рис. 2). М ). Количество первичных отростков, выходящих из сомы, составило 6.19 ± 1,08. Астроциты внутри глиальной пластинки представляют собой относительно плоские клетки (Sun et al., 2009), так что площадь, покрываемую одной клеткой, можно измерить по проекции ее отростков в поперечной плоскости. Выпуклая оболочка, определяемая здесь как область, окруженная выпуклым многоугольником, касающимся самых длинных отростков, составляла 15 023 ± 2563 мкм 2 (45 ячеек, 5 мышей). Пространственный охват (выпуклая оболочка как процент от общей площади поперечного сечения зрительного нерва) составлял 38,57 ± 12.
Эти отростки часто охватывают всю ширину зрительного нерва и контактируют со стенкой пиальной стенки или кровеносными сосудами. Кроме того, многие короткие тонкие процессы исходят непосредственно из сомы. Морфология этих астроцитов была подробно описана ранее (Sun et al., 2009). Количественно ширина самого толстого отростка составила 1,14 ± 0,17 мкм, что согласуется с измерениями, основанными на маркировке GFAP (рис. 2). М ). Количество первичных отростков, выходящих из сомы, составило 6.19 ± 1,08. Астроциты внутри глиальной пластинки представляют собой относительно плоские клетки (Sun et al., 2009), так что площадь, покрываемую одной клеткой, можно измерить по проекции ее отростков в поперечной плоскости. Выпуклая оболочка, определяемая здесь как область, окруженная выпуклым многоугольником, касающимся самых длинных отростков, составляла 15 023 ± 2563 мкм 2 (45 ячеек, 5 мышей). Пространственный охват (выпуклая оболочка как процент от общей площади поперечного сечения зрительного нерва) составлял 38,57 ± 12. 9%.
9%.
Нормальные и реактивные фиброзные астроциты в глиальной пластине мыши hGFAPpr-EGFP. A , B , D – I , изображения либо продольные ( A , D , F , H ) или поперечный ( B , E , G , I ) срезов глиальной пластинки и представляют собой проекции максимальной интенсивности. A , Нормальные астроциты в глиальной пластинке имеют отростки, которые расположены поперечно и образуют пластинчатую структуру. B . У них есть длинные первичные отростки, которые проходят по всей ширине зрительного нерва и контактируют с пиальной стенкой (наконечники стрелок). Отростки соседних астроцитов сильно перекрываются. Через 3 дня после раздавливания астроциты становятся реактивными и демонстрируют гипертрофию сомы и оставшихся отростков. D , E ′ , Они втягивают свои первичные и высшие отростки и теряют поперечную ориентацию (стрелки). Укорочение отростков снижает пространственное покрытие отдельных астроцитов. F – I , эти изменения сохраняются до 7 дней после разрушения ( F – G ″ ) и на 2 недели ( H – I ′ ) происходит прореживание и повторное расширение процессов, хотя они никогда не восстанавливают свою первоначальную длину.
A , Нормальные астроциты в глиальной пластинке имеют отростки, которые расположены поперечно и образуют пластинчатую структуру. B . У них есть длинные первичные отростки, которые проходят по всей ширине зрительного нерва и контактируют с пиальной стенкой (наконечники стрелок). Отростки соседних астроцитов сильно перекрываются. Через 3 дня после раздавливания астроциты становятся реактивными и демонстрируют гипертрофию сомы и оставшихся отростков. D , E ′ , Они втягивают свои первичные и высшие отростки и теряют поперечную ориентацию (стрелки). Укорочение отростков снижает пространственное покрытие отдельных астроцитов. F – I , эти изменения сохраняются до 7 дней после разрушения ( F – G ″ ) и на 2 недели ( H – I ′ ) происходит прореживание и повторное расширение процессов, хотя они никогда не восстанавливают свою первоначальную длину.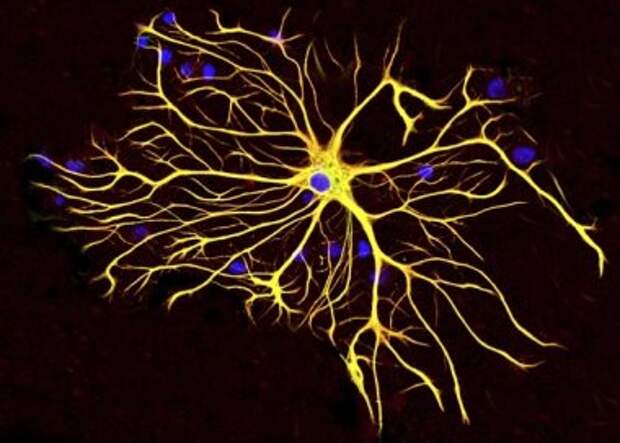 Эти процессы имеют извилистый путь и не образуют глиальных трубок. С , Морфометрический анализ показывает, что эти морфологические изменения наиболее серьезны через 3–7 дней после раздавливания, показывая постепенное восстановление через 2 недели и 1 месяц после раздавливания (среднее значение ± SEM; * p <0,05). Схема в A и B показывает, как был рассечен зрительный нерв (серые столбцы), и относится к их соответствующим столбцам.Двунаправленная стрела A , D , F и H указывает направление длинной оси зрительного нерва.
Эти процессы имеют извилистый путь и не образуют глиальных трубок. С , Морфометрический анализ показывает, что эти морфологические изменения наиболее серьезны через 3–7 дней после раздавливания, показывая постепенное восстановление через 2 недели и 1 месяц после раздавливания (среднее значение ± SEM; * p <0,05). Схема в A и B показывает, как был рассечен зрительный нерв (серые столбцы), и относится к их соответствующим столбцам.Двунаправленная стрела A , D , F и H указывает направление длинной оси зрительного нерва. Масштабные линейки, 20 мкм.
Масштабные линейки, 20 мкм.
Через 3 дня после раздавливания экспрессия EGFP выявила поразительные морфологические изменения в реактивных волокнистых астроцитах глиальной пластинки.Наблюдались гипертрофия отростков и тел клеток, втягивание первичных отростков (уменьшение количества отростков и разветвлений) и потеря их поперечной ориентации (рис. D – E ′ , стрелки). Многие мелкие тонкие отростки, особенно те, которые исходят непосредственно из сомы, также были потеряны. Количественно отростки этих реактивных астроцитов утолщены почти вдвое, а количество первичных отростков, выходящих из сомы, уменьшилось вдвое (рис. C ) (ширина самого толстого отростка составляла 1.74 ± 0,38 мкм; количество первичных отростков, выходящих из сомы, составило 3,38 ± 0,96; выпуклая оболочка 1398 ± 437 мкм 2 ). Пространственное покрытие отдельного реактивного астроцита уменьшилось почти в восемь раз до ~ 5% от общей площади поверхности глиальной пластинки (рис. C ) (пространственный охват составил 4,63 ± 1,9%; n = 50 клеток, 6 мышей). Глиальные трубки, через которые когда-то проходили пучки аксонов, исчезли. Вместо этого глиальная пластинка заполнена неорганизованным массивом гипертрофированных астроцитов (рис.4 E , E ‘).
C ) (пространственный охват составил 4,63 ± 1,9%; n = 50 клеток, 6 мышей). Глиальные трубки, через которые когда-то проходили пучки аксонов, исчезли. Вместо этого глиальная пластинка заполнена неорганизованным массивом гипертрофированных астроцитов (рис.4 E , E ‘).
Морфологические изменения сохранялись до 7 дней после раздавливания (рис. F – G ″ ). В это время толщина отростков астроцитов была максимальной, и многие астроциты повторно расширили некоторые отростки (рис. G ′ , G ″ ). Наблюдалось небольшое, но значительное увеличение количества первичных отростков, покидающих сому, по сравнению с 3 днями после раздавливания (рис. C ) (ширина самого толстого отростка составила 2.26 ± 0,44 мкм; количество первичных отростков, выходящих из сомы, составило 4,38 ± 0,96; выпуклый корпус 2337 ± 985 мкм 2 ; пространственный охват составил 5,15 ± 2,70%; n = 48 клеток, 5 мышей). Более того, пространственная организация реактивных астроцитов все еще была сильно нарушена (рис. G ).
Более того, пространственная организация реактивных астроцитов все еще была сильно нарушена (рис. G ).
Через 2 недели после раздавливания морфологический вид отдельных реактивных астроцитов восстановился. На продольном срезе общая форма этих астроцитов выглядела близкой к нормальной (рис.4 H ). Длина отростков увеличилась по сравнению с 7 сутками после раздавливания, толщина первичных отростков уменьшилась, а количество первичных отростков, выходящих из сомы, увеличилось (рис. C , I , I ‘). Однако восстановления мелких мелких процессов не произошло. Ширина самого толстого отростка составляла 1,77 ± 0,34 мкм, количество первичных отростков, выходящих из сомы, — 4,89 ± 1,27, выпуклая оболочка — 2923 ± 764 мкм, 2 , пространственное покрытие — 10.12 ± 3,11% ( n = 47 клеток, 6 мышей). Шаблон маркировки GFAP, показанный на рисунке 2. K состоит из этих более коротких, чем обычно, и тонких отростков, многие из которых следовали извилистым путем, нарушая ранее регулярную организацию глиальных трубок. Через месяц после раздавливания как толщина, так и количество отростков, покидающих сому, вернулись к почти нормальному уровню, хотя длина их отростков осталась несколько короче, чем обычно, что уменьшило пространственное покрытие (рис.4 С ). Ширина самого толстого отростка составила 1,45 ± 0,32 мкм, количество первичных отростков, выходящих из сомы, — 5,4 ± 1,52, выпуклая оболочка — 9473 ± 1254 мкм 2 , пространственное покрытие — 14,96 ± 4,42% ( n = 39 клеток, 5 мышей).
Через месяц после раздавливания как толщина, так и количество отростков, покидающих сому, вернулись к почти нормальному уровню, хотя длина их отростков осталась несколько короче, чем обычно, что уменьшило пространственное покрытие (рис.4 С ). Ширина самого толстого отростка составила 1,45 ± 0,32 мкм, количество первичных отростков, выходящих из сомы, — 5,4 ± 1,52, выпуклая оболочка — 9473 ± 1254 мкм 2 , пространственное покрытие — 14,96 ± 4,42% ( n = 39 клеток, 5 мышей).
Реактивные фиброзные астроциты в миелинизированном зрительном нерве и мозолистом теле
Глиальная пластинка — это специализированная область головки зрительного нерва, где аксоны ганглиозных клеток немиелинизированы.Чтобы определить, является ли реактивный фенотип астроцитов в глиальной пластине репрезентативным для фиброзных астроцитов в более общем плане, мы исследовали реактивные астроциты в миелинизированной части зрительного нерва и мозолистом теле (рис. 5). Нормальные астроциты миелинизированного зрительного нерва имеют широкий спектр форм, размеров и ориентации. Различные формы этих астроцитов были подробно описаны ранее (Butt et al., 1994a, b; Sun et al., 2009). Для простоты мы описываем здесь астроциты на крайних участках спектра ориентации, которые мы будем называть продольно и поперечно ориентированными астроцитами (рис.5 A – C ). У продольных астроцитов есть первичные отростки, которые проходят параллельно длинной оси зрительного нерва. Они, как правило, имеют «волосатый» вид с множеством мелких ответвлений (рис. 5). A , B ). Поперечно ориентированные астроциты имеют тонкие удлиненные клеточные тела; первичные отростки, которые проходят перпендикулярно длинной оси зрительного нерва и доходят до пиальной стенки; и имеют несколько ветвей более высокого порядка (рис. С ).Через три дня после раздавливания астроциты, ориентированные как в продольном, так и в поперечном направлении, оттягивают свои первичные отростки и отростки более высокого порядка, уменьшая количество отростков и разветвлений.
5). Нормальные астроциты миелинизированного зрительного нерва имеют широкий спектр форм, размеров и ориентации. Различные формы этих астроцитов были подробно описаны ранее (Butt et al., 1994a, b; Sun et al., 2009). Для простоты мы описываем здесь астроциты на крайних участках спектра ориентации, которые мы будем называть продольно и поперечно ориентированными астроцитами (рис.5 A – C ). У продольных астроцитов есть первичные отростки, которые проходят параллельно длинной оси зрительного нерва. Они, как правило, имеют «волосатый» вид с множеством мелких ответвлений (рис. 5). A , B ). Поперечно ориентированные астроциты имеют тонкие удлиненные клеточные тела; первичные отростки, которые проходят перпендикулярно длинной оси зрительного нерва и доходят до пиальной стенки; и имеют несколько ветвей более высокого порядка (рис. С ).Через три дня после раздавливания астроциты, ориентированные как в продольном, так и в поперечном направлении, оттягивают свои первичные отростки и отростки более высокого порядка, уменьшая количество отростков и разветвлений. Это было похоже на ремоделирование реактивных астроцитов в глиальной пластине. Однако у остальных отростков гипертрофия была меньше (рис. D – F ). К 7 дню первичные отростки частично расширились, но небольшие ответвления — нет (рис. G , H ).
Это было похоже на ремоделирование реактивных астроцитов в глиальной пластине. Однако у остальных отростков гипертрофия была меньше (рис. D – F ). К 7 дню первичные отростки частично расширились, но небольшие ответвления — нет (рис. G , H ).
Реактивные фиброзные астроциты в миелинизированном зрительном нерве мыши hGFAPpr-EGFP показали морфологические изменения, аналогичные тем, которые наблюдаются в глиальной пластинке. A – H , Отдельные фиброзные астроциты из нормального ( A – C ) и дробленый ( D – H ) миелинизированный зрительный нерв.Продольно ориентированные астроциты имели волосатый вид, с множеством мелких тонких отростков, выходящих из первичных отростков ( A , B ). Поперечно ориентированные астроциты имеют длинные тонкие тонкие первичные отростки, которые доходят до пиальной стенки ( С ). Через три дня после раздавливания в этих астроцитах наблюдались изменения, аналогичные изменениям для реактивных астроцитов глиальной пластинки: гипертрофия сомы и остальных отростков и ретракция их первичных отростков и отростков более высокого порядка ( D – F ).Через 7 дней после разрушения многие из основных процессов расширились. Мелкие тонкие процессы, исходящие из первичных процессов, не возвращаются ( G , H ). I , На схеме изображены место раздавливания (удар молнии), расположение отображаемых астроцитов (пунктирная рамка) и то, как был рассечен зрительный нерв (горизонтальная серая полоса).
Поперечно ориентированные астроциты имеют длинные тонкие тонкие первичные отростки, которые доходят до пиальной стенки ( С ). Через три дня после раздавливания в этих астроцитах наблюдались изменения, аналогичные изменениям для реактивных астроцитов глиальной пластинки: гипертрофия сомы и остальных отростков и ретракция их первичных отростков и отростков более высокого порядка ( D – F ).Через 7 дней после разрушения многие из основных процессов расширились. Мелкие тонкие процессы, исходящие из первичных процессов, не возвращаются ( G , H ). I , На схеме изображены место раздавливания (удар молнии), расположение отображаемых астроцитов (пунктирная рамка) и то, как был рассечен зрительный нерв (горизонтальная серая полоса).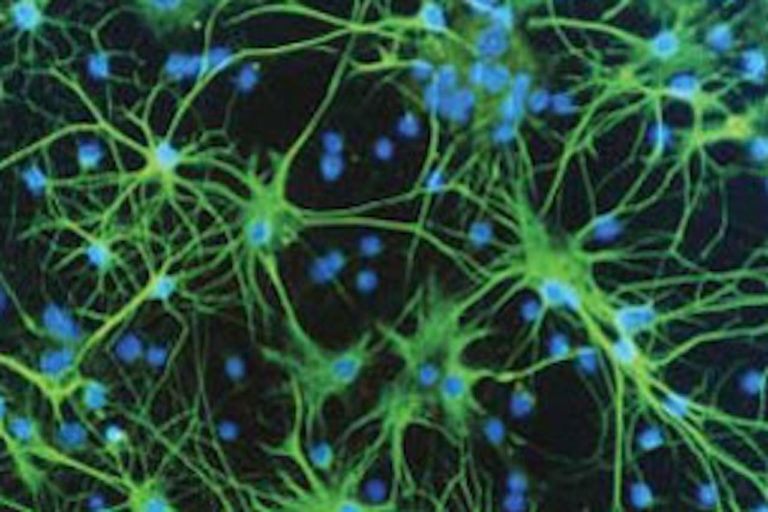 Двунаправленная стрелка на каждой панели указывает направление длинной оси зрительного нерва. Топор, аксоны; V, кровеносный сосуд. Масштабные линейки, 20 мкм.
Двунаправленная стрелка на каждой панели указывает направление длинной оси зрительного нерва. Топор, аксоны; V, кровеносный сосуд. Масштабные линейки, 20 мкм.
Фиброзные астроциты в нормальном мозолистом теле имеют внешний вид, аналогичный таковым в миелинизированном зрительном нерве, в том смысле, что отростки проходят параллельно пути нервных волокон; они имеют общий волосатый вид, а отростки соседних астроцитов сильно перекрываются (рис. 6). A – F ).Во многих случаях эти астроциты имеют толстый выступающий первичный отросток, который заканчивается большим концом стопы, контактирующим с кровеносным сосудом (рис. C , D , наконечники стрел). Через три дня после кортикального укола астроциты становятся реактивными и реагируют укорочением и утолщением своих отростков, подобно изменениям, наблюдаемым в реактивных астроцитах глиальной пластинки и миелинизированном зрительном нерве (рис. G – I ).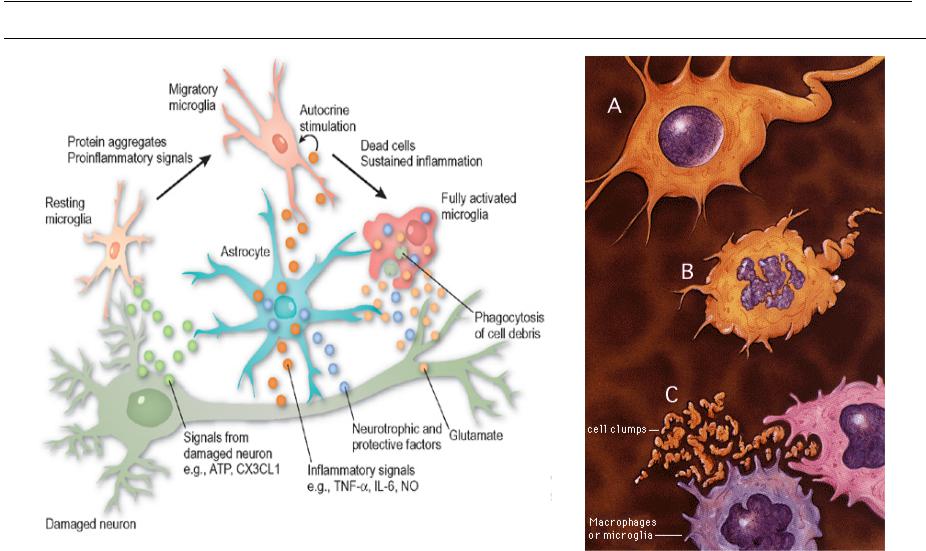 Однако клеточные тела этих астроцитов не обнаруживают значительной гипертрофии.Через 7 дней некоторые из этих процессов частично расширяются (рис. J , K ). Таким образом, общая картина ретракции и утолщения с последующим повторным растяжением аналогична для всех астроцитов в трактах волокон ЦНС, изученных здесь.
Однако клеточные тела этих астроцитов не обнаруживают значительной гипертрофии.Через 7 дней некоторые из этих процессов частично расширяются (рис. J , K ). Таким образом, общая картина ретракции и утолщения с последующим повторным растяжением аналогична для всех астроцитов в трактах волокон ЦНС, изученных здесь.
Реактивные фиброзные астроциты в мозолистом теле показали морфологические изменения, подобные тем, которые наблюдаются в глиальной пластинке и миелинизированном зрительном нерве. A , B , Обзорное изображение среза мозолистого тела показало много EGFP-экспрессирующих астроцитов в этой области мыши hGFAPpr-EGFP (стрелки).Астроциты в нормальном мозолистом теле были похожи по внешнему виду на астроциты в миелинизированном зрительном нерве. C – F , Их основные отростки идут параллельно нервным волокнам, они имеют множество коротких тонких отростков, а отростки соседних астроцитов широко перекрываются.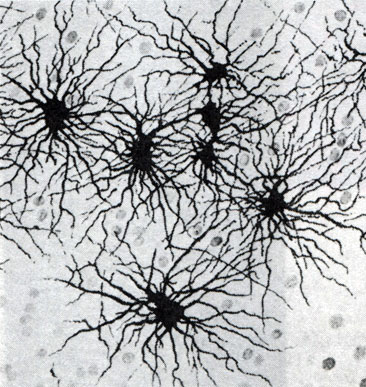 У них есть отросток, который заканчивается контактом большого конца стопы с кровеносным сосудом ( С , F , наконечники стрел). G – I , Через три дня после кортикального колотого поражения (длинная стрелка) реактивные астроциты втягивают многие из своих первичных отростков и отростков более высокого порядка ( H , I ). Дж , К , Некоторые первичные процессы частично расширились через 7 дней после дробления.C, Cortex; CC, мозолистое тело; ЦП, хвостатое — скорлупа. Масштабные линейки: B , 100 мкм; A , C – K , 20 мкм.
У них есть отросток, который заканчивается контактом большого конца стопы с кровеносным сосудом ( С , F , наконечники стрел). G – I , Через три дня после кортикального колотого поражения (длинная стрелка) реактивные астроциты втягивают многие из своих первичных отростков и отростков более высокого порядка ( H , I ). Дж , К , Некоторые первичные процессы частично расширились через 7 дней после дробления.C, Cortex; CC, мозолистое тело; ЦП, хвостатое — скорлупа. Масштабные линейки: B , 100 мкм; A , C – K , 20 мкм.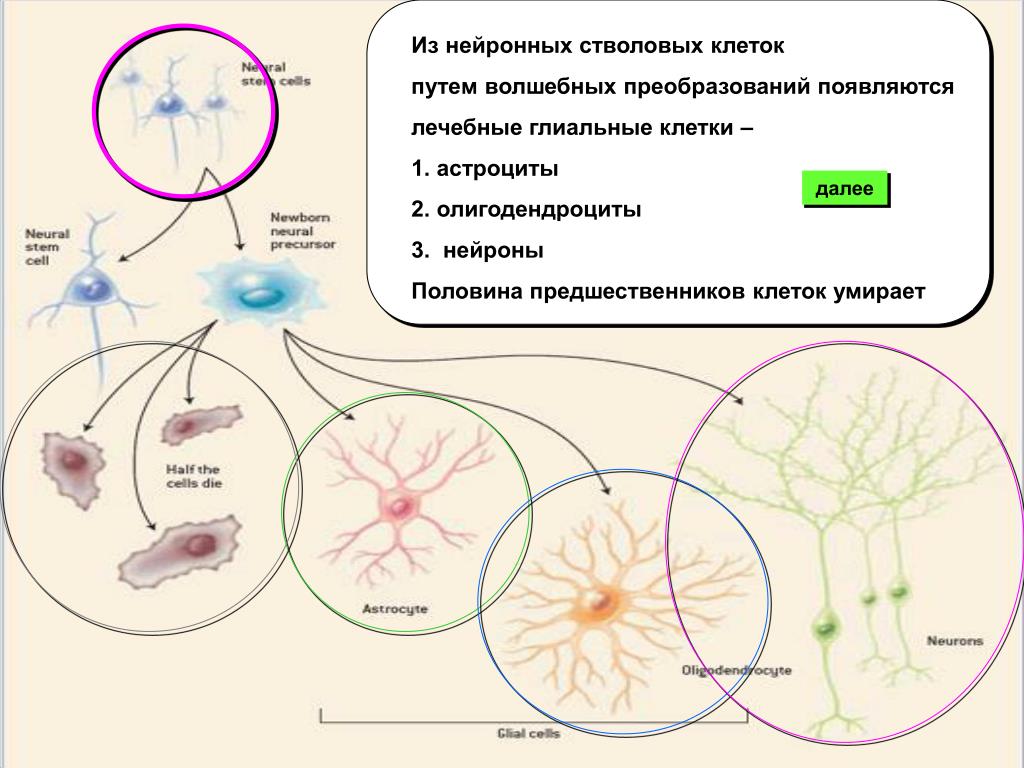
Фенотип реактивных астроцитов у мышей hGFAPpr-EGFP является репрезентативным для нативной популяции астроцитов
Мы провели два типа контрольных экспериментов, чтобы убедиться, что изменения, наблюдаемые в фиброзных астроцитах, не являются артефактами трансгенного штамма.Во-первых, мы исследовали реактивные протоплазматические астроциты в коре головного мозга мышей hGFAPpr-EGFP после колотого поражения. Ожидаемый ответ этих астроцитов был тщательно описан у мышей C57BL / 6, где астроциты были визуализированы с помощью инъекций одноклеточного красителя (Wilhelmsson et al., 2006). Мы обнаружили такую же картину изменений, когда клетки были визуализированы по экспрессии EGFP. Нормальные протоплазматические астроциты в коре головного мозга мышей hGFAPpr-EGFP имеют кустистую морфологию со многими тонкими отростками, отходящими от первичных отростков.Соседние протоплазматические астроциты поддерживают неперекрывающиеся пространственные домены (рис.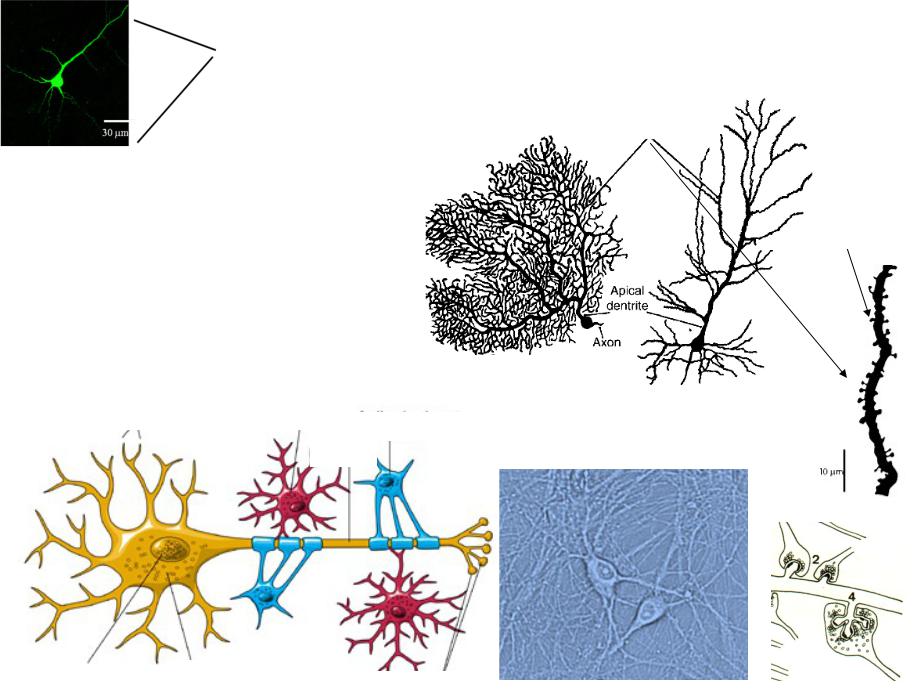 7). A ) (Bushong et al., 2002; Ogata, Kosaka, 2002; Wilhelmsson et al., 2006). Через 3 дня после раздавливания реактивные протоплазматические астроциты у мышей hGFAPpr-EGFP оказались идентичными описанным Wilhelmsson et al. (2006). Была гипертрофия первичных отростков (рис. 7). B , наконечники стрелок) и очевидное увеличение количества первичных отростков, выходящих из сомы и разветвлений (рис.7 В ). Поразительной особенностью реакции протоплазматических астроцитов на повреждение является то, что они сохраняют свое неперекрывающееся пространственное расположение после того, как становятся реактивными. Это также наблюдалось для реактивных протоплазматических астроцитов в коре головного мозга наших мышей hGFAPpr-EGFP (рис. B ), что подтверждает верность экспрессии EGFP как маркера астроцитов.
7). A ) (Bushong et al., 2002; Ogata, Kosaka, 2002; Wilhelmsson et al., 2006). Через 3 дня после раздавливания реактивные протоплазматические астроциты у мышей hGFAPpr-EGFP оказались идентичными описанным Wilhelmsson et al. (2006). Была гипертрофия первичных отростков (рис. 7). B , наконечники стрелок) и очевидное увеличение количества первичных отростков, выходящих из сомы и разветвлений (рис.7 В ). Поразительной особенностью реакции протоплазматических астроцитов на повреждение является то, что они сохраняют свое неперекрывающееся пространственное расположение после того, как становятся реактивными. Это также наблюдалось для реактивных протоплазматических астроцитов в коре головного мозга наших мышей hGFAPpr-EGFP (рис. B ), что подтверждает верность экспрессии EGFP как маркера астроцитов.
Нормальные и реактивные протоплазматические астроциты коры головного мозга.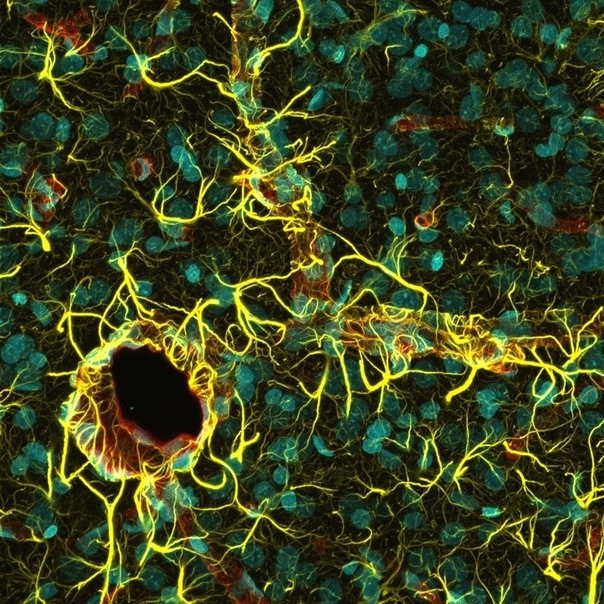 A , Протоплазматические астроциты имеют густую морфологию с множеством тонких отростков. Они поддерживают неперекрывающиеся пространственные домены: пунктирная линия разграничивает границу соседних астроцитов. B . Через три дня после колотого поражения реактивные протоплазматические астроциты подвергаются гипертрофии своих первичных отростков (стрелки), но сохраняют неперекрывающиеся пространственные домены.Масштабные линейки, 20 мкм.
A , Протоплазматические астроциты имеют густую морфологию с множеством тонких отростков. Они поддерживают неперекрывающиеся пространственные домены: пунктирная линия разграничивает границу соседних астроцитов. B . Через три дня после колотого поражения реактивные протоплазматические астроциты подвергаются гипертрофии своих первичных отростков (стрелки), но сохраняют неперекрывающиеся пространственные домены.Масштабные линейки, 20 мкм.
В качестве второго контроля использовали альтернативный метод визуализации морфологических изменений реактивных астроцитов. Астроциты в нормальных и раздробленных зрительных нервах мышей C57BL / 6 того же возраста метили с помощью опосредованного частицами переноса DiI (см. Материалы и методы). Меченые красителем астроциты из нормальной глиальной пластинки кажутся похожими на таковые у мышей hGFAPpr-EGFP. У них много длинных первичных отростков (рис. 8 A , наконечники стрелок), оканчивающиеся выпуклыми концами, которые соприкасаются с пиальной стенкой на другой стороне зрительного нерва (рис.8 B , наконечники стрел). Реактивные астроциты через 7 дней после раздавливания зрительного нерва показали гипертрофию и укорочение отростков (рис. C , стрелки), аналогично изменениям в реактивных астроцитах мышей hGFAPpr-EGFP.
У них много длинных первичных отростков (рис. 8 A , наконечники стрелок), оканчивающиеся выпуклыми концами, которые соприкасаются с пиальной стенкой на другой стороне зрительного нерва (рис.8 B , наконечники стрел). Реактивные астроциты через 7 дней после раздавливания зрительного нерва показали гипертрофию и укорочение отростков (рис. C , стрелки), аналогично изменениям в реактивных астроцитах мышей hGFAPpr-EGFP.
Нормальное мечение красителем, опосредованное частицами ( A , B ) и реактивный ( С ) астроцитов в глиальной пластинке мыши C57BL / 6.В качестве альтернативного метода подтверждения реактивных изменений, наблюдаемых у мышей hGFAPpr-EGFP, мы диолистически пометили астроциты в нормальной и раздавленной глиальной пластинке.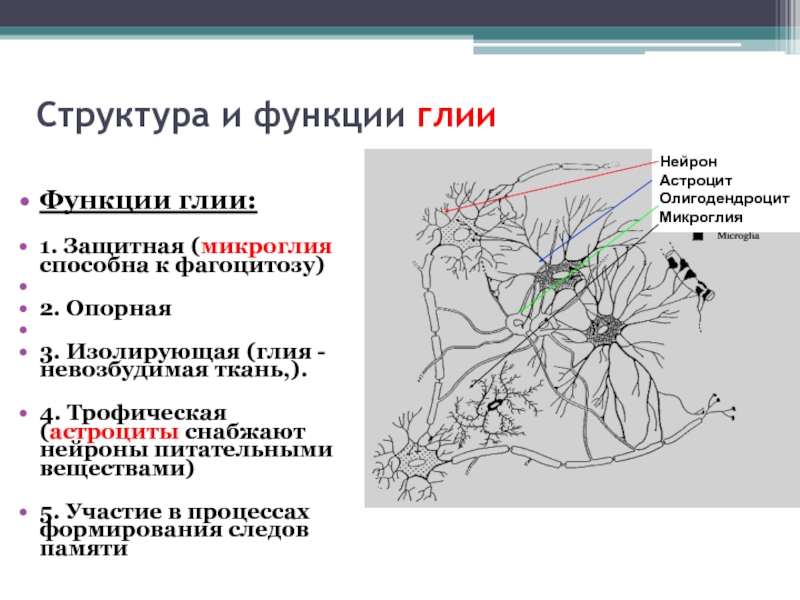 A , B , Астроциты, помеченные таким образом, имели морфологию, сходную с таковой, наблюдаемой у мышей hGFAPpr-EGFP; в поперечном срезе они имеют длинные тонкие тонкие отростки, часто пересекающие всю ширину зрительного нерва ( A , наконечники стрелок) и контактировали со стенкой пиала выпуклыми концами ( B , наконечники стрел). С , Через семь дней после раздавливания произошло втягивание первичных отростков и гипертрофия остальных отростков (стрелки). Этот метод мечения менее контрастен, потому что DiI распределяется в основном внутри плазматической мембраны, тогда как EGFP заполняет сому и отростки. Масштабные линейки, 20 мкм.
A , B , Астроциты, помеченные таким образом, имели морфологию, сходную с таковой, наблюдаемой у мышей hGFAPpr-EGFP; в поперечном срезе они имеют длинные тонкие тонкие отростки, часто пересекающие всю ширину зрительного нерва ( A , наконечники стрелок) и контактировали со стенкой пиала выпуклыми концами ( B , наконечники стрел). С , Через семь дней после раздавливания произошло втягивание первичных отростков и гипертрофия остальных отростков (стрелки). Этот метод мечения менее контрастен, потому что DiI распределяется в основном внутри плазматической мембраны, тогда как EGFP заполняет сому и отростки. Масштабные линейки, 20 мкм.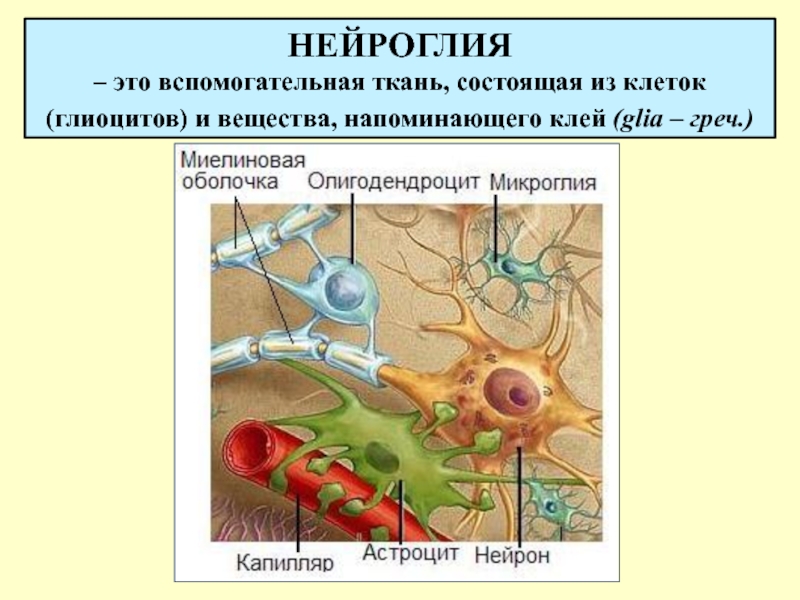
Обсуждение
Центральным вопросом этого исследования было разрешить структурные изменения, которым подвергаются фиброзные астроциты, когда они становятся «реактивными».«Мы использовали трансгенных мышей, которые экспрессируют EGFP в подмножествах астроцитов, чтобы изучить структуру реактивных фиброзных астроцитов в глиальной пластинке, миелинизированной части зрительного нерва и мозолистом теле. Отдельные фиброзные астроциты претерпевают двухэтапный процесс ремоделирования, сначала втягиваясь и упрощая, а затем частично повторно расширяя свои отростки. Напротив, реактивные протоплазматические астроциты увеличивают количество отростков и ветвей, сохраняя при этом свои индивидуальные пространственные домены на протяжении всего повреждения.Это увеличивает плотность процессов, заполняющих этот объем. Основной общей чертой между ответом фиброзных и протоплазматических астроцитов была гипертрофия сомы и остальных отростков.
Структурное ремоделирование фиброзных астроцитов
Упрощение архитектуры процесса, по-видимому, является обычной начальной реакцией фиброзных астроцитов на повреждение, что также наблюдали Butt и Colquhoun (1996). Здесь мы показываем, что морфологический ответ фиброзных астроцитов происходит в два этапа.На первой стадии многие первичные процессы и процессы более высокого порядка оттягиваются, упрощая общую форму астроцита, а через 3 дня после раздавливания резко сокращается их пространственное покрытие в целых восемь раз. Неизвестно, почему астроциты отреагируют таким образом. Ожидается, что начальное укорочение отростков вызовет потерю связи между щелевыми соединениями, отслоение их конечностей от пиальной стенки и кровеносных сосудов, а также процессов, которые могут быть связаны с выжившими аксонами.Кроме того, уменьшение их пространственной области, наряду с потерей аксонов, означает, что дегенерирующий нейропиль на некоторой стадии может содержать определенный объем, лишенный клеточных элементов.
На второй стадии (> 7 дней) процессы частично повторно расширяются и снова истончаются. Внутри глиальной пластинки отростки, которые повторно расширились, следуют извилистым путем и не организуются, чтобы сформировать сотовую структуру, как это видно в нормальной глиальной пластине. Это говорит о том, что присутствие аксонов необходимо для управления процессами астроцитов для формирования глиальных трубок.Астроциты, по-видимому, регенерируют по крайней мере ограниченное количество контактов с мягкой мозговой оболочкой и кровеносными сосудами, а также множество отростков, покрывающих значительную часть дегенерированного нерва. Следовательно, астроциты, по-видимому, содержат внутреннюю программу, которая заставляет их принимать более или менее нормальную морфологию и связываться с этими структурами-мишенями независимо от присутствия аксонов.
Как образуется глиальный рубец?
Внешний вид глиального рубца в белом веществе (e. g., зрительный нерв и спинной мозг) был хорошо задокументирован путем визуализации паттерна маркировки GFAP, который выявляет плотную и неорганизованную сеть утолщенных отростков (Blaugrund et al., 1992; Frank and Wolburg, 1996; Podhajsky et al., 1997 ; Sellés-Navarro et al., 2001; Ohlsson et al., 2004; Okada et al., 2006; Howell et al., 2007; Herrmann et al., 2008). Путем визуализации реактивных астроцитов, экспрессирующих EGFP, мы показываем морфологические изменения, которые остаются незамеченными, когда реактивность обнаруживается с помощью маркировки GFAP.Например, нельзя было увидеть, как эти астроциты так резко меняют форму и сокращают длину своих отростков.
g., зрительный нерв и спинной мозг) был хорошо задокументирован путем визуализации паттерна маркировки GFAP, который выявляет плотную и неорганизованную сеть утолщенных отростков (Blaugrund et al., 1992; Frank and Wolburg, 1996; Podhajsky et al., 1997 ; Sellés-Navarro et al., 2001; Ohlsson et al., 2004; Okada et al., 2006; Howell et al., 2007; Herrmann et al., 2008). Путем визуализации реактивных астроцитов, экспрессирующих EGFP, мы показываем морфологические изменения, которые остаются незамеченными, когда реактивность обнаруживается с помощью маркировки GFAP.Например, нельзя было увидеть, как эти астроциты так резко меняют форму и сокращают длину своих отростков.
Один вопрос, который возникает в результате ремоделирования этих отдельных астроцитов, заключается в том, что заполняет пространство, образованное потерей аксонов. Также при раздавливании зрительного нерва Wohl et al. (2009) обнаружили небольшое увеличение количества астроцитов, но одного вряд ли будет достаточно, чтобы полностью заполнить пространство, освободившееся из-за потери аксонов.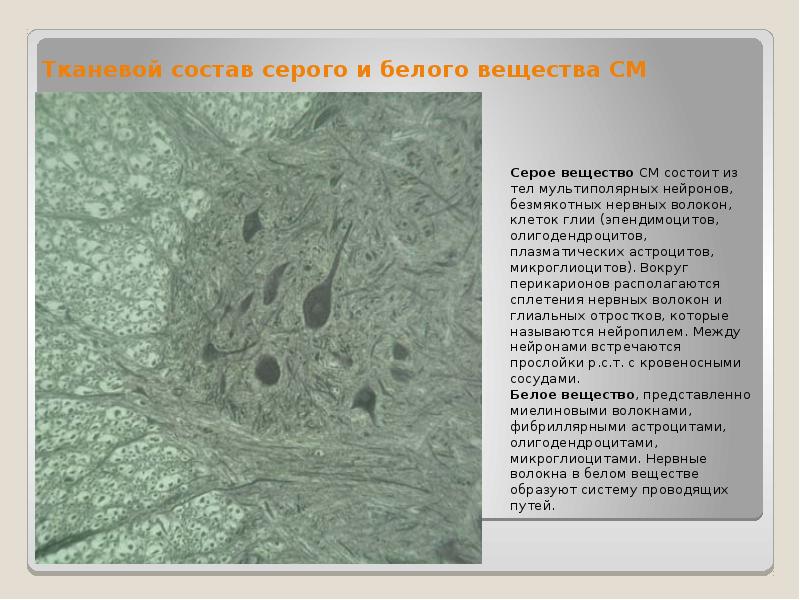 В головном мозге источник вновь разделенных рубцовых астроцитов точно не установлен, и существует несколько потенциальных возможностей.Одна линия доказательств состоит в том, что зрелые астроциты могут повторно входить в клеточный цикл и пролиферировать во время образования рубцов (Bush et al., 1999; Buffo et al., 2008; Gadea et al., 2008). Также были представлены доказательства того, что некоторые пролиферирующие реактивные астроциты могут происходить из клеток-предшественников NG2 в локальной паренхиме (Magnus et al., 2008) или из предшественников эпендимных клеток после травмы или инсульта (Meletis et al., 2008; Carlén et al., 2009 г.). Кроме того, мультипотентные предшественники, которые экспрессируют GFAP и находятся в субэпендимной ткани (Garcia et al., 2004) генерируют клетки-потомки, которые могут мигрировать к месту повреждения после травмы или инсульта (Ohab and Carmichael, 2008). В наших экспериментах гипертрофия отдельных астроцитов, по-видимому, не объясняет заполнение освободившегося пространства внутри зрительного нерва.
В головном мозге источник вновь разделенных рубцовых астроцитов точно не установлен, и существует несколько потенциальных возможностей.Одна линия доказательств состоит в том, что зрелые астроциты могут повторно входить в клеточный цикл и пролиферировать во время образования рубцов (Bush et al., 1999; Buffo et al., 2008; Gadea et al., 2008). Также были представлены доказательства того, что некоторые пролиферирующие реактивные астроциты могут происходить из клеток-предшественников NG2 в локальной паренхиме (Magnus et al., 2008) или из предшественников эпендимных клеток после травмы или инсульта (Meletis et al., 2008; Carlén et al., 2009 г.). Кроме того, мультипотентные предшественники, которые экспрессируют GFAP и находятся в субэпендимной ткани (Garcia et al., 2004) генерируют клетки-потомки, которые могут мигрировать к месту повреждения после травмы или инсульта (Ohab and Carmichael, 2008). В наших экспериментах гипертрофия отдельных астроцитов, по-видимому, не объясняет заполнение освободившегося пространства внутри зрительного нерва. Толщина и количество отростков возвращаются к нормальному уровню через 1 месяц после разрушения. Более того, пространственный домен отдельных астроцитов, фактически, меньше после дегенерации аксонов, чем раньше (Рис. 4). Мы не обнаружили значительной пролиферации клеток в глиальной пластине.Часть потери объема может быть объяснена общим сокращением дегенерированного нерва. Имеется ли миграция клеток из соседних регионов, невозможно определить из нашего материала.
Толщина и количество отростков возвращаются к нормальному уровню через 1 месяц после разрушения. Более того, пространственный домен отдельных астроцитов, фактически, меньше после дегенерации аксонов, чем раньше (Рис. 4). Мы не обнаружили значительной пролиферации клеток в глиальной пластине.Часть потери объема может быть объяснена общим сокращением дегенерированного нерва. Имеется ли миграция клеток из соседних регионов, невозможно определить из нашего материала.
Функции реактивных астроцитов
Реактивные астроциты и глиальный рубец могут иметь как положительные, так и отрицательные эффекты. Было высказано предположение, что образующие рубцы реактивные астроциты поглощают эксайтотоксический глутамат; обеспечивают защиту от окислительного стресса за счет выработки глутатиона; восстановить гематоэнцефалический барьер; минимизировать потерю нейронов, размер поражения и демиелинизацию; ограничить распространение воспалительной реакции; и, в долгосрочной перспективе, улучшить функциональное восстановление (Rothstein et al.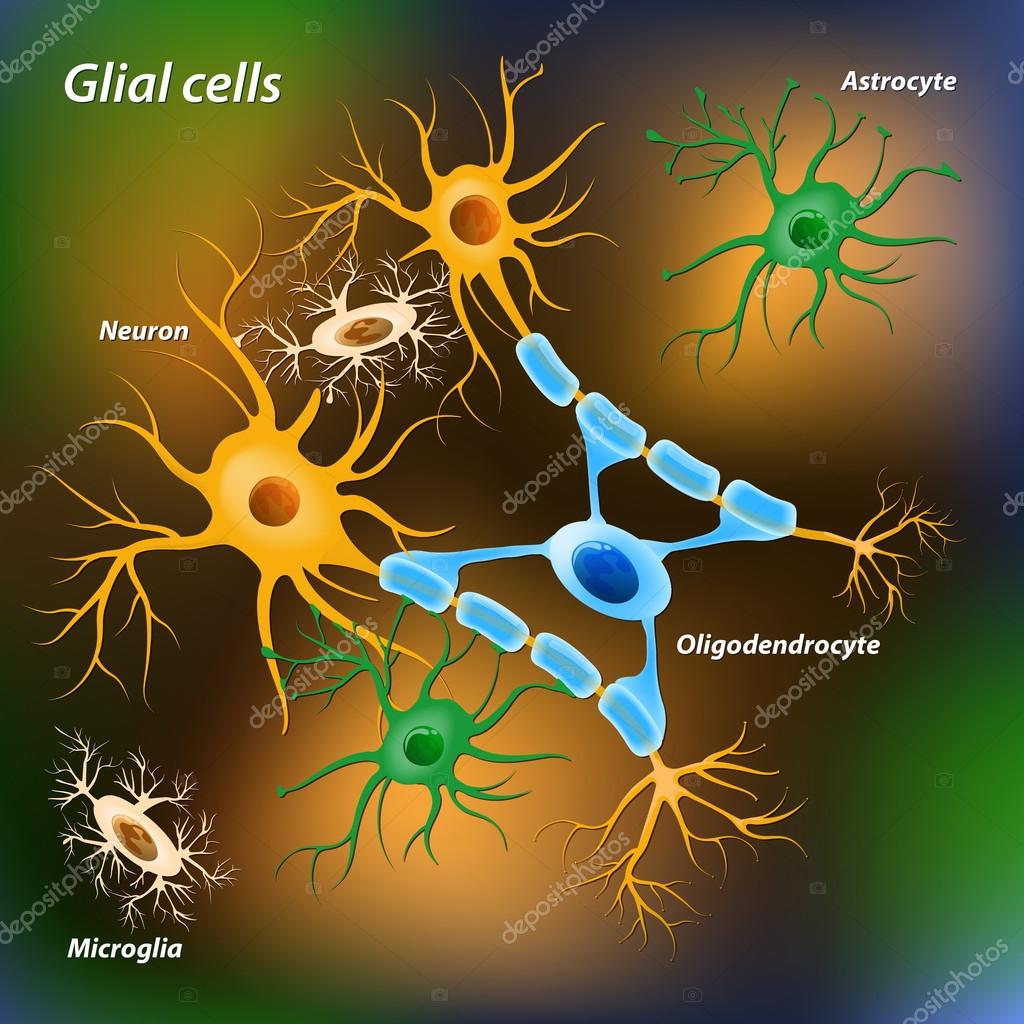 , 1996; Буш и др., 1999; Фолкнер и др., 2004; Swanson et al., 2004; Майер и др., 2006; Окада и др., 2006; Rolls et al., 2009; Софронев, 2009; Voskuhl et al., 2009).
, 1996; Буш и др., 1999; Фолкнер и др., 2004; Swanson et al., 2004; Майер и др., 2006; Окада и др., 2006; Rolls et al., 2009; Софронев, 2009; Voskuhl et al., 2009).
Также растет понимание того, что дисфункция или эффекты реактивных астроцитов могут способствовать или быть первичными источниками повреждения ЦНС либо из-за потери основных функций, выполняемых астроцитами или реактивными астроцитами, либо из-за увеличения вредных эффектов. Астроциты играют решающую роль в регуляции кровотока, гомеостазе ионов, внеклеточной жидкости и передатчиков, обеспечении энергии, а также синаптической функции и ремоделировании (Ullian et al., 2001; Симард и Недергаард, 2004; Кристоферсон и др., 2005; Паскуаль и др., 2005; Seifert et al., 2006; Иадекола и Недергаард, 2007; Пеллерин и др., 2007; Стивенс и др., 2007; Rouach et al., 2008). Нарушение любого из этих нормальных процессов может вызвать патологию. Астроциты могут иметь пагубные последствия. Они могут включать высвобождение эксайтотоксического глутамата; обострение воспаления из-за выработки цитокинов, нарушение гематоэнцефалического барьера из-за выработки фактора роста эндотелия сосудов; производство и выброс активных форм кислорода; и высвобождение ингибирующих компонентов внеклеточного матрикса, таких как протеогликаны хондроитинсульфата (Swanson et al.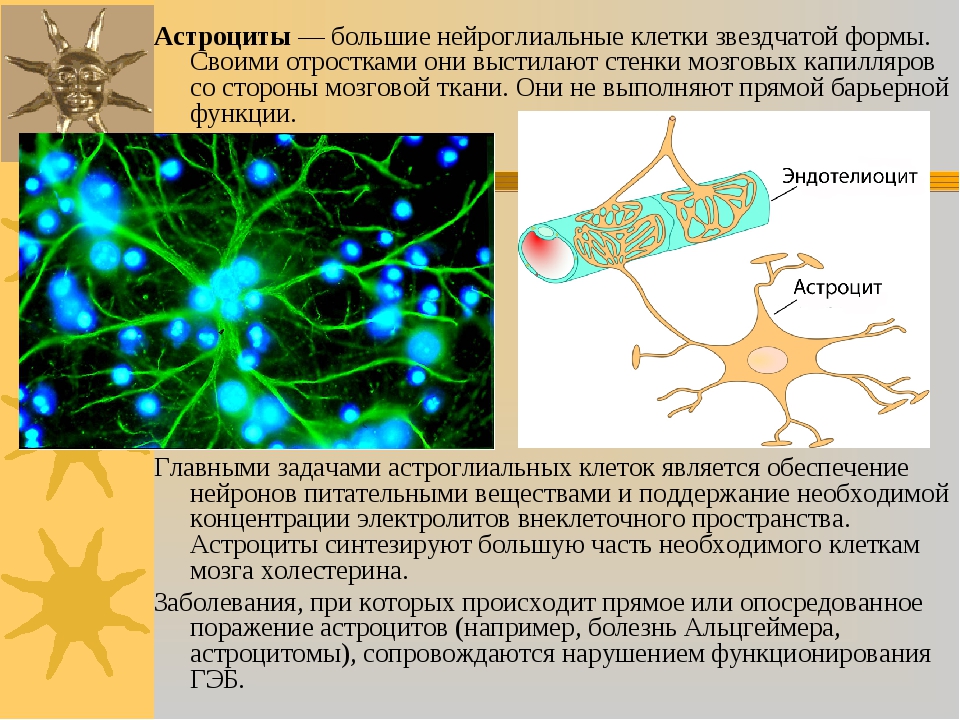 , 2004; Брамбилла и др., 2005, 2009; Такано и др., 2005; Hamby et al., 2006; Ю и Хэ, 2006; Fitch и Silver, 2008 г .; Argaw et al., 2009).
, 2004; Брамбилла и др., 2005, 2009; Такано и др., 2005; Hamby et al., 2006; Ю и Хэ, 2006; Fitch и Silver, 2008 г .; Argaw et al., 2009).
С чисто анатомической точки зрения глиальный рубец может обеспечить полезную структурную поддержку. Например, при частичном поражении рубец функционирует как каркас, заполняющий пространство, лишенное аксонов, предотвращая коллапс или сокращение ткани и, таким образом, вызывая деформацию выживших аксонов. С другой стороны, классическим пагубным эффектом глиального рубца является подавление регенерации аксонов.Традиционно считалось, что шрам представляет собой физический барьер для регенерации. Что касается глиальной пластинки, как только в этой области формируется рубец, трудно понять, как если бы аксоны регенерировали, они реорганизовались бы, чтобы сформировать пучки с топографической связью с сетчаткой (Рис. 9). При глаукоме область глиальной пластинки (аналогичная области решетчатой пластинки у человека) считается начальной точкой дегенерации аксонов (Quigley, 1999; Jakobs et al. , 2005; Howell et al., 2007; Buckingham et al., 2008; Soto et al., 2008). Здесь также происходит обширное ремоделирование паттерна маркировки GFAP (Howell et al., 2007), и поэтому структурные изменения, описанные в этом исследовании после раздавливания нерва, вероятно, отражают изменения при глаукоме.
, 2005; Howell et al., 2007; Buckingham et al., 2008; Soto et al., 2008). Здесь также происходит обширное ремоделирование паттерна маркировки GFAP (Howell et al., 2007), и поэтому структурные изменения, описанные в этом исследовании после раздавливания нерва, вероятно, отражают изменения при глаукоме.
Схематическое изображение двухэтапного процесса ремоделирования реактивных фиброзных астроцитов внутри глиальной пластинки. Первоначально астроциты отвечают гипертрофией сомы и проксимальных отростков и ретракцией дистальных.Это уменьшает их пространственную область и нарушает организацию глиальных трубок. Через 2 недели после раздавливания отростки снова расширяются, а их толщина уменьшается.
Морфологические изменения, наблюдаемые здесь, по-видимому, являются общей характеристикой фиброзных астроцитов в трактах волокон ЦНС. Почему необходим двухэтапный процесс ремоделирования? Отделение его отростков от окружающих структур противоречит интуиции, поскольку такие связи обычно требуются астроцитам для выполнения своих разнообразных функций.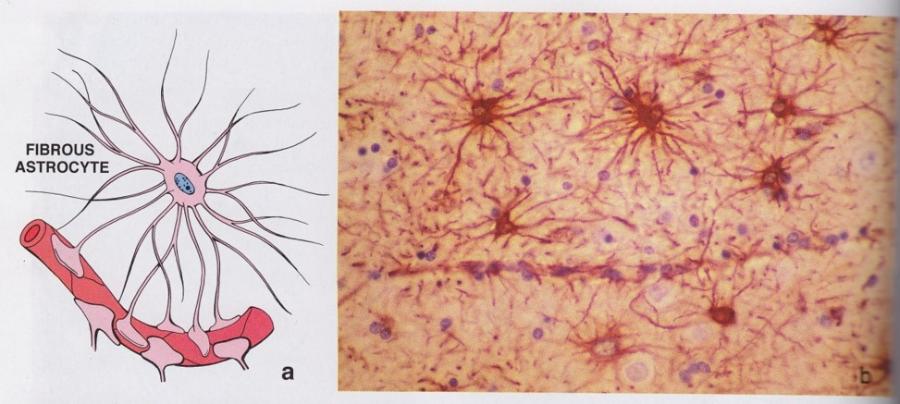 Казалось бы, более эффективным и вполне возможным для существующих процессов было бы просто сформировать новое устройство, заполняющее пространство, или для астроцитов — расширить больше процессов, вместо того, чтобы сначала упростить и сократить их процессы, а затем повторно расширить их. Возможно, изменения в экспрессии генов, происходящие на разных стадиях ремоделирования, дадут ключ к разгадке.
Казалось бы, более эффективным и вполне возможным для существующих процессов было бы просто сформировать новое устройство, заполняющее пространство, или для астроцитов — расширить больше процессов, вместо того, чтобы сначала упростить и сократить их процессы, а затем повторно расширить их. Возможно, изменения в экспрессии генов, происходящие на разных стадиях ремоделирования, дадут ключ к разгадке.
астроцитов | Сеть Glia
Неоднородность астроглииАстроциты (буквально «звездообразные клетки») — самые многочисленные и разнообразные нейроглиальные клетки в ЦНС.Хотя большинство нейробиологов думают, что они знают, что такое астроцит, единого и однозначного определения астроцита не существует. Не все астроциты являются звездообразными клетками, не все они экспрессируют специфический маркер глиального фибриллярного кислого белка (GFAP), не все контактируют с капиллярами головного мозга. Астроциты на самом деле представляют собой популяцию клеток в головном мозге, которые остаются после удаления нейронов, олигодендроцитов и микроглиальных клеток.
 Таким образом, астроциты демонстрируют поразительную гетерогенность по своей морфологии и функциям.Концептуально астроглиальные клетки столь же неоднородны, как нейроны и астроциты в разных областях мозга могут иметь очень разные физиологические свойства.
Таким образом, астроциты демонстрируют поразительную гетерогенность по своей морфологии и функциям.Концептуально астроглиальные клетки столь же неоднородны, как нейроны и астроциты в разных областях мозга могут иметь очень разные физиологические свойства. Морфология астроцитов
Морфология астроцитов весьма неоднородна. Некоторые астроциты действительно имеют звездообразный вид с несколькими первичными (также называемыми стволовыми) отростками, происходящими из сомы, хотя существует гораздо больше морфологических профилей. Архетипическим морфологическим признаком астроцитов является экспрессия промежуточных филаментов, образующих цитоскелет.Основными типами белков промежуточных филаментов астроглии являются глиальный фибриллярный кислый белок (GFAP) и виментин; Экспрессия GFAP обычно используется в качестве специфического маркера для идентификации астроцитов. Он хорошо работает в культивируемых астроцитах, но in situ уровни экспрессии GFAP довольно сильно различаются: например, GFAP экспрессируется практически каждой глиальной клеткой Бергмана в мозжечке, тогда как только около 15-20 процентов астроцитов в коре зрелого мозга животные экспрессируют GFAP.
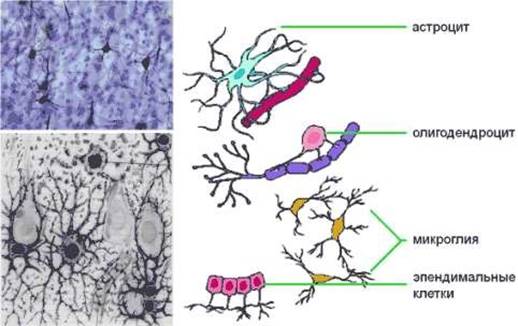
Протоплазматические астроциты присутствуют в сером веществе. У них много тонких процессов (длиной около 50 мкм), которые чрезвычайно сложны и сложны. Отростки протоплазматических астроцитов контактируют с кровеносными сосудами, образуя так называемые «периваскулярные» концы ножек, и образуют множественные контакты с нейронами. Некоторые протоплазматические астроциты также отправляют отростки на поверхность пиальной поверхности, где они образуют «субпиальные» концы ножек. Плотность протоплазматических астроцитов в коре головного мозга колеблется от 10 000 до 30 000 на мм 3 ; площадь их отростков (у грызунов) может достигать 60000 — 80 000 мкм 2 и покрывать большую часть мембран нейронов в пределах досягаемости.
Волокнистые астроциты присутствуют в белом веществе. Их отростки длинные (до 300 мкм), но гораздо менее сложные по сравнению с протоплазматической астроглией. Отростки фиброзных астроцитов образуют несколько периваскулярных или субпиальных концов.
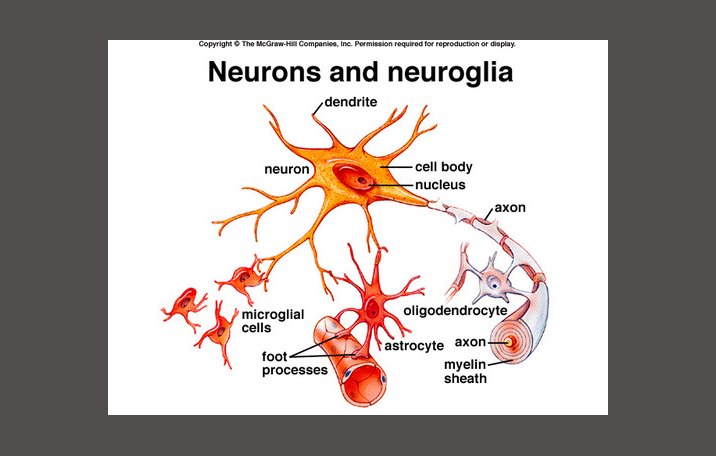 Волокнистые отростки астроцитов также отправляют многочисленные расширения («перинодальные» отростки), которые связываются с аксонами в узлах Ранвье. Плотность фиброзных астроцитов ~ 200 000 клеток на мм 3 .
Волокнистые отростки астроцитов также отправляют многочисленные расширения («перинодальные» отростки), которые связываются с аксонами в узлах Ранвье. Плотность фиброзных астроцитов ~ 200 000 клеток на мм 3 . Вторая большая группа астроглиальных клеток — это радиальная глия , представляющая собой биполярные клетки, каждая из которых имеет тело яйцевидной формы и удлиненные отростки.Радиальная глия обычно имеет два основных отростка, один из которых формирует концы на стенке желудочка, а другой — на пиальной поверхности. Радиальная глия — обычная черта развивающегося мозга, поскольку они являются первыми клетками, которые развиваются из нейральных предшественников; с самых ранних эмбриональных стадий радиальная глия также формирует каркас, который способствует миграции нейронов. После созревания радиальная глия исчезает из многих областей мозга и превращается в звездчатые астроциты, хотя радиальные глиальные клетки остаются в сетчатке ( Müller glia ) и у низших позвоночных, таких как черепаха.
Сетчатка содержит специализированную радиальную глию, называемую клетками Мюллера , которые имеют обширные контакты с нейронами сетчатки. Большинство глиальных клеток Мюллера имеют характерную морфологию, протягивая продольные отростки по линии палочек и колбочек. У человека глиальные клетки Мюллера занимают до 20 процентов от общего объема сетчатки, а плотность этих клеток приближается к 25 000 на 1 мм 2 площади поверхности сетчатки. Каждая клетка Мюллера образует контакты с четко определенной группой нейронов, организованных столбчатым образом; одна клетка Мюллера поддерживает ~ 16 нейронов в сетчатке человека и до 30 — у грызунов.
Мозжечок содержит специализированную полурадиальную глию, которая называется глия Бергмана . Они имеют относительно маленькие клеточные тела (~ 15 мкм в диаметре) и 3-6 отростков, которые проходят от слоя клеток Пуркинье до пиальной поверхности. На ранних этапах развития эти клетки контактируют с поверхностью желудочков и являются истинными радиальными глиальными клетками, но с развитием зернистого слоя они приобретают классическую морфологию глиальных клеток Бергмана.
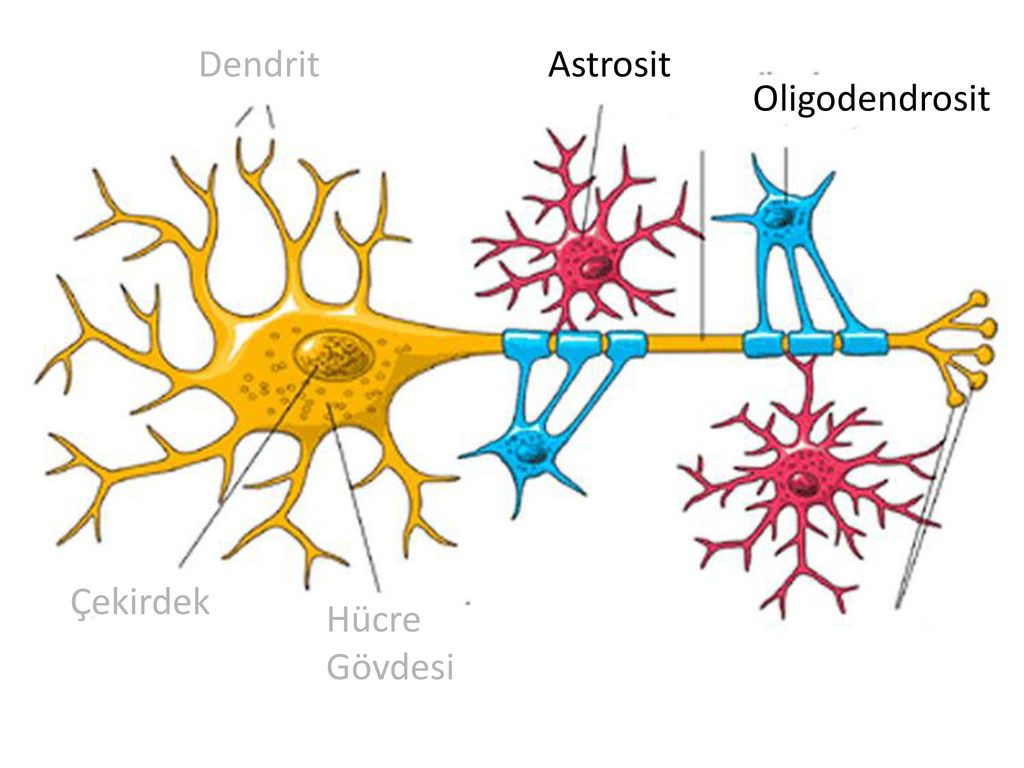 Обычно несколько (~ 8 у грызунов) глиальных клеток Бергмана окружают один нейрон Пуркинье, и их отростки образуют оболочку дендритов клеток Пуркинье.Отростки глиальных клеток Бергмана чрезвычайно развиты и образуют тесные контакты с синапсами, образованными параллельными волокнами на дендритах нейронов Пуркинье; каждая глиальная клетка Бергмана обеспечивает покрытие до 8000 таких синапсов.
Обычно несколько (~ 8 у грызунов) глиальных клеток Бергмана окружают один нейрон Пуркинье, и их отростки образуют оболочку дендритов клеток Пуркинье.Отростки глиальных клеток Бергмана чрезвычайно развиты и образуют тесные контакты с синапсами, образованными параллельными волокнами на дендритах нейронов Пуркинье; каждая глиальная клетка Бергмана обеспечивает покрытие до 8000 таких синапсов. Другие области ЦНС содержат множество различных популяций астроглиальных клеток. Велатные астроциты находятся в мозжечке, где они образуют оболочку, окружающую нейроны гранул; каждый клетчатый астроцит окружает одиночный гранульный нейрон.Подобный тип астроцитов также присутствует в обонятельной луковице. Интерламинарные астроциты специфичны для коры головного мозга высших приматов. Их характерная особенность — очень длинный одиночный отросток (до 1 мм), который простирается от сомы, расположенной в надгранулярном слое, до коркового слоя IV. Танициты — это специализированные астроциты, обнаруженные в перивентрикулярных органах, гипофизе и шовной части спинного мозга.
 Астроглиальные клетки нейрогипофиза известны как питуициты ; отростки этих клеток окружают нейросекреторные аксоны и аксональные окончания в условиях покоя. Периваскулярные и маргинальные астроциты расположены очень близко к мягкой мозговой оболочке, где они образуют многочисленные концы с кровеносными сосудами; они образуют пиальный и периваскулярный барьер глии, который помогает изолировать паренхиму мозга от сосудистого и субарахноидального отделов. Эпендимоциты, клетки сосудистого сплетения и клетки пигментного эпителия сетчатки выстилают желудочки или субретинальное пространство.
Астроглиальные клетки нейрогипофиза известны как питуициты ; отростки этих клеток окружают нейросекреторные аксоны и аксональные окончания в условиях покоя. Периваскулярные и маргинальные астроциты расположены очень близко к мягкой мозговой оболочке, где они образуют многочисленные концы с кровеносными сосудами; они образуют пиальный и периваскулярный барьер глии, который помогает изолировать паренхиму мозга от сосудистого и субарахноидального отделов. Эпендимоциты, клетки сосудистого сплетения и клетки пигментного эпителия сетчатки выстилают желудочки или субретинальное пространство. Функции астроцитов
У астроглиальных клеток много функций; астроциты создают среду мозга, создают микроархитектуру паренхимы мозга, поддерживают гомеостаз мозга, накапливают и распределяют энергетические субстраты, контролируют развитие нервных клеток, синаптогенез и поддержание синапсов, а также обеспечивают защиту мозга.
Представление о радиальных глиальных клетках как о стволовых клетках
И нейроны, и макроглия происходят из нейроэпителиальных клеток.
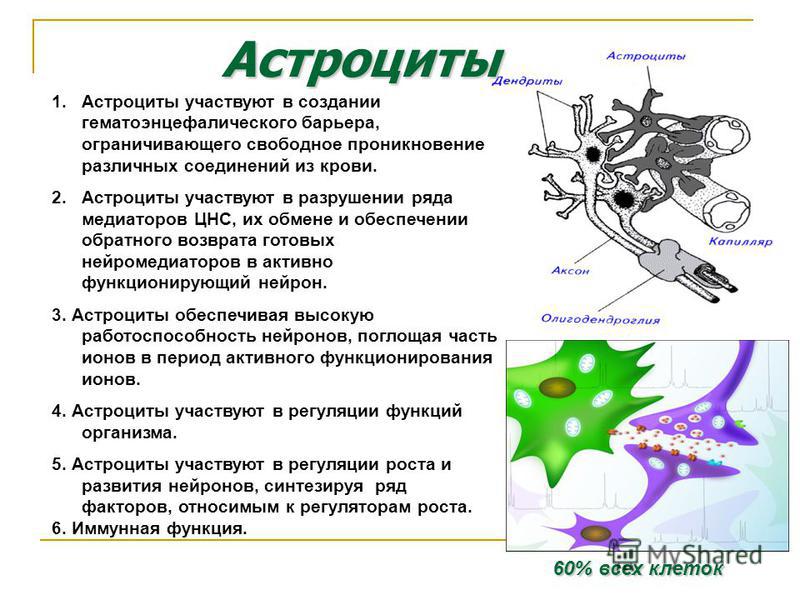 На раннем этапе развития нейроэпителиальные клетки трансформируются в радиальную глию, которая теперь признана клеткой-предшественником нервной системы. Асимметричное деление лучевой глии продуцирует нейрональные предшественники, которые мигрируют к месту назначения, используя отростки лучевой глии в качестве направляющей для каркаса. Радиальная глия также может выступать в качестве предшественников (через несколько переходных форм) как для астроцитов, так и для олигодендроцитов.Некоторые из астроцитов, локализованные в нейрогенных нишах взрослого мозга, сохраняют свойства стволовых клеток на протяжении всей жизни и являются источником взрослого нейро- и глиогенеза. Кроме того, нейроглиальные клетки способствуют выживанию нейронов на разных стадиях развития за счет высвобождения множества нейротрофических факторов (например, эпидермального фактора роста, EGF, нейротрофического фактора, происходящего из глиальных клеток, GDNF и т. Д.).
На раннем этапе развития нейроэпителиальные клетки трансформируются в радиальную глию, которая теперь признана клеткой-предшественником нервной системы. Асимметричное деление лучевой глии продуцирует нейрональные предшественники, которые мигрируют к месту назначения, используя отростки лучевой глии в качестве направляющей для каркаса. Радиальная глия также может выступать в качестве предшественников (через несколько переходных форм) как для астроцитов, так и для олигодендроцитов.Некоторые из астроцитов, локализованные в нейрогенных нишах взрослого мозга, сохраняют свойства стволовых клеток на протяжении всей жизни и являются источником взрослого нейро- и глиогенеза. Кроме того, нейроглиальные клетки способствуют выживанию нейронов на разных стадиях развития за счет высвобождения множества нейротрофических факторов (например, эпидермального фактора роста, EGF, нейротрофического фактора, происходящего из глиальных клеток, GDNF и т. Д.). Астроциты определяют микроархитектуру мозга
В мозге млекопитающих астроглиальные клетки определяют микроархитектуру паренхимы, разделяя серое вещество (посредством процесса, известного как «мозаика») на относительно независимые структурные единицы.
 Протоплазматические астроциты занимают свою территорию и создают микроанатомические домены в пределах своих отростков. В пределах этих анатомических доменов мембрана астроцита покрывает синапсы и нейрональные мембраны, а также посылает отростки, чтобы их кончиками штукатурить стенку соседнего кровеносного сосуда. Сложный астроцит-нейроны-кровеносный сосуд обычно называют нервно-сосудистой единицей.
Протоплазматические астроциты занимают свою территорию и создают микроанатомические домены в пределах своих отростков. В пределах этих анатомических доменов мембрана астроцита покрывает синапсы и нейрональные мембраны, а также посылает отростки, чтобы их кончиками штукатурить стенку соседнего кровеносного сосуда. Сложный астроцит-нейроны-кровеносный сосуд обычно называют нервно-сосудистой единицей. Отдельные астроглиальные домены интегрированы в надстройку астроглиальных синцитий через щелевые соединения, локализованные на периферических отростках астроглиальных клеток.Эти астроглиальные синцитии также анатомически сегрегированы и образуются внутри определенных анатомических структур, например, в отдельных стволах соматосенсорной коры.
Астроциты контролируют внеклеточный K + гомеостаз
Клетки астроглии могут контролировать внеклеточный гомеостаз в головном мозге. Благодаря множеству молекулярных каскадов астроциты контролируют концентрацию ионов, нейротрансмиттеров и метаболитов и регулируют движение воды.
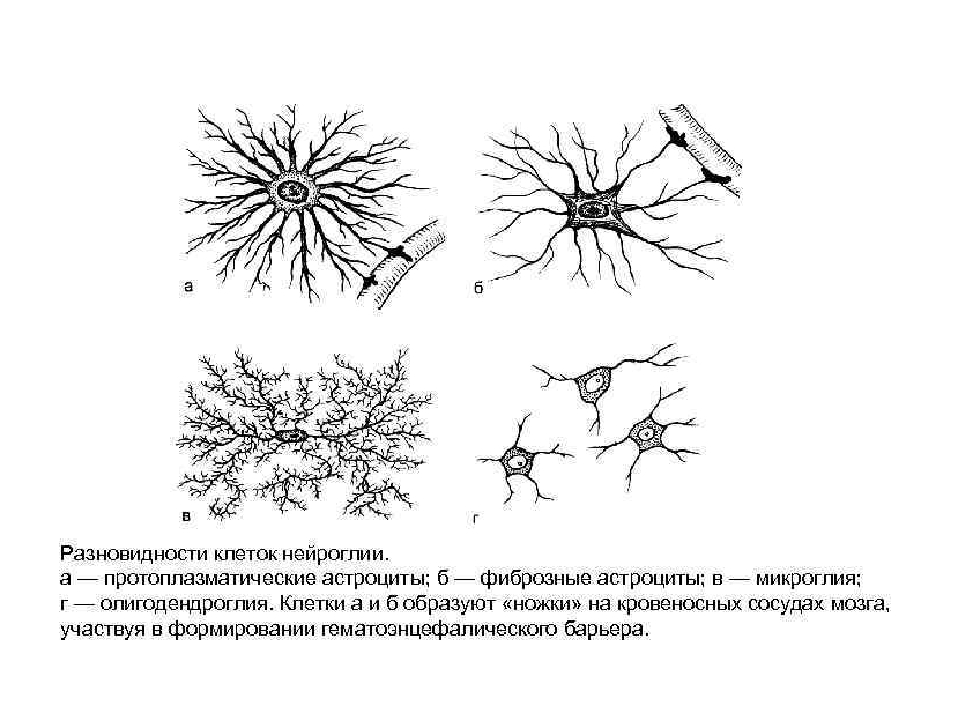 Ранняя распознаваемая функция астроцитов — это контроль уровней K + в головном мозге. Активность нейронов приводит к увеличению концентрации K + от уровня покоя примерно 3 мМ до максимума 10-12 мМ в физиологических условиях и до еще более высоких значений при патологических условиях. Более высокая концентрация K + во внеклеточном пространстве модулирует активность нейронов, и мозг имеет тенденцию поддерживать стабильные внеклеточные уровни K + на их уровне покоя.Астроциты удаляют избыток внеклеточного K + по крайней мере двумя различными механизмами. Так называемая «пространственная буферизация» — это пассивный механизм, с помощью которого K + захватывается в местах с более высокой концентрацией (чему способствуют каналы внутреннего выпрямителя K + ), перераспределяется в астроците или связанной сети астроцитов и высвобождается в местах где ниже. В клетках Мюллера сетчатки этот процесс называется сифонированием K + .
Ранняя распознаваемая функция астроцитов — это контроль уровней K + в головном мозге. Активность нейронов приводит к увеличению концентрации K + от уровня покоя примерно 3 мМ до максимума 10-12 мМ в физиологических условиях и до еще более высоких значений при патологических условиях. Более высокая концентрация K + во внеклеточном пространстве модулирует активность нейронов, и мозг имеет тенденцию поддерживать стабильные внеклеточные уровни K + на их уровне покоя.Астроциты удаляют избыток внеклеточного K + по крайней мере двумя различными механизмами. Так называемая «пространственная буферизация» — это пассивный механизм, с помощью которого K + захватывается в местах с более высокой концентрацией (чему способствуют каналы внутреннего выпрямителя K + ), перераспределяется в астроците или связанной сети астроцитов и высвобождается в местах где ниже. В клетках Мюллера сетчатки этот процесс называется сифонированием K + .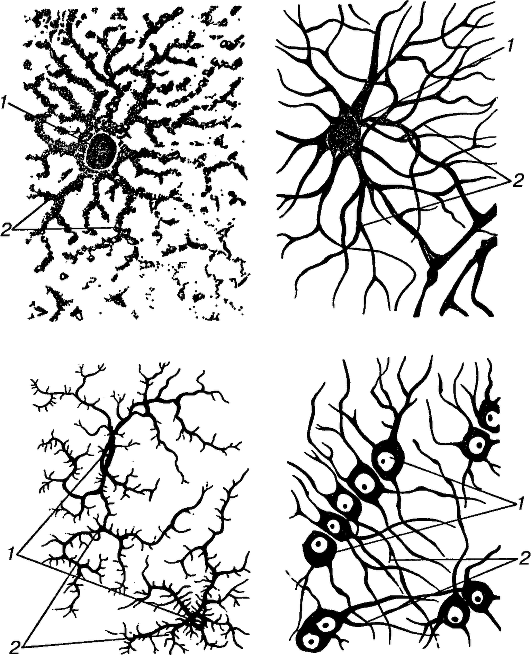 Во-вторых, они могут удалять внеклеточный K + за счет увеличения насосной активности, такой как активность Na + / K + -АТФазы, что приводит к увеличению внутриклеточного K + и воды.Глиальные синцитии и аквапориновые каналы, экспрессируемые в астроцитах, также играют роль в гомеостазе воды в головном мозге.
Во-вторых, они могут удалять внеклеточный K + за счет увеличения насосной активности, такой как активность Na + / K + -АТФазы, что приводит к увеличению внутриклеточного K + и воды.Глиальные синцитии и аквапориновые каналы, экспрессируемые в астроцитах, также играют роль в гомеостазе воды в головном мозге. Астроциты удаляют избыток глутамата
Глутамат является основным возбуждающим нейротрансмиттером в головном мозге позвоночных. При избытке или длительном высвобождении глутамат действует как мощный нейротоксин, который вызывает гибель нейрональных клеток при многих острых и хронических поражениях головного мозга. Функция глии по «химическому расщеплению или поглощению» передатчиков была предсказана итальянским психиатром Эрнесто Лугаро в 1907 году.Астроциты удаляют большую часть глутамата из внеклеточного пространства; они накапливают 80% высвободившегося глутамата, тогда как остальные 20% поглощаются нейронами.
 Астроциты удаляют внеклеточный глутамат с помощью возбуждающих переносчиков аминокислот (EAAT). В мозге человека присутствуют пять типов EAAT; EAAT1 и EAAT2 экспрессируются почти исключительно в астроцитах (аналоги грызунов известны как транспортер глутамата / аспартата, GLAST и транспортер глутамата-1, GLT-1). Переносчики глутамата являются ко-переносчиками, которые используют сэкономленную энергию в виде трансмембранного градиента Na + , так что для переноса одной молекулы глутамата требуется приток 3 ионов Na + и 1 иона H + в сочетании с истечение иона 1 К + .Существенное накопление натрия, сопровождающее накопление глутамата, уравновешивается оттоком Na + через обменник Na + / Ca 2+ , работающий в обратном режиме; как обменник Na + / Ca 2+ , так и переносчики глутамата совместно локализованы в перисинаптических астроглиальных процессах.
Астроциты удаляют внеклеточный глутамат с помощью возбуждающих переносчиков аминокислот (EAAT). В мозге человека присутствуют пять типов EAAT; EAAT1 и EAAT2 экспрессируются почти исключительно в астроцитах (аналоги грызунов известны как транспортер глутамата / аспартата, GLAST и транспортер глутамата-1, GLT-1). Переносчики глутамата являются ко-переносчиками, которые используют сэкономленную энергию в виде трансмембранного градиента Na + , так что для переноса одной молекулы глутамата требуется приток 3 ионов Na + и 1 иона H + в сочетании с истечение иона 1 К + .Существенное накопление натрия, сопровождающее накопление глутамата, уравновешивается оттоком Na + через обменник Na + / Ca 2+ , работающий в обратном режиме; как обменник Na + / Ca 2+ , так и переносчики глутамата совместно локализованы в перисинаптических астроглиальных процессах. Астроциты поставляют глутамин для поддержания глутаматергической нейротрансмиссии
Астроглиальный транспорт глутамата имеет решающее значение для нейрональной глутаматергической передачи за счет работы челнока глутамат-глутамин.
 Глутамат, накапливаемый астроцитами, ферментативно превращается в глутамин специфической для астроцитов глутамин синтетазой. Глютамин не воспринимается рецепторами нейротрансмиттеров, не токсичен и может безопасно транспортироваться к пресинаптическим терминалам через внеклеточное пространство; после попадания в нейрональный компартмент глутамин превращается в глутамат. Также важно, что астроциты обладают ферментом пируваткарбоксилазой и, таким образом, действуют как основной источник синтеза глутамата de novo .
Глутамат, накапливаемый астроцитами, ферментативно превращается в глутамин специфической для астроцитов глутамин синтетазой. Глютамин не воспринимается рецепторами нейротрансмиттеров, не токсичен и может безопасно транспортироваться к пресинаптическим терминалам через внеклеточное пространство; после попадания в нейрональный компартмент глутамин превращается в глутамат. Также важно, что астроциты обладают ферментом пируваткарбоксилазой и, таким образом, действуют как основной источник синтеза глутамата de novo .Астроциты контролируют местный кровоток и обеспечивают нейроны метаболической поддержкой
Клетки астроглии являются центральными элементами сосудисто-нервных единиц, которые объединяют нервную систему с местным кровотоком и метаболической поддержкой. Базальная пластинка кровеносных сосудов почти полностью покрыта концами астроцитов. Таким образом, астроцит занимает стратегическое положение: одно плечо находится у кровеносного сосуда, а другое — у нейрональной мембраны, синапса или аксона.Таким образом, его можно рассматривать как сосудисто-нервный мост. Повышенная активность нейронов запускает сигналы Ca 2+ в астроцитах, и это может быть интегрирующим сигналом для нервно-сосудистой единицы. Эта активность астроцитов приводит к высвобождению вазоактивных агентов, которые регулируют местный кровоток. Эта область все еще вызывает споры. Некоторые группы сообщили, что активность астроцитов приводит к сужению сосудов, в то время как другие наблюдали расширение сосудов. Но одна проблема не вызывает сомнений: астроциты являются важным связующим звеном между нейрональной активностью и кровотоком, который фактически является показанием магнитно-резонансной томографии.Более того, астроциты также отвечают за локальную метаболическую поддержку нейронов. Постулируемый глюкозно-лактатный челнок ввел концепцию, согласно которой астроциты забирают глюкозу из крови, превращают ее в лактат, высвобождают ее и, таким образом, обеспечивают энергетический субстрат для нейронов. Интересно, что астроциты — единственные клетки мозга, которые могут синтезировать гликоген и, таким образом, могут служить резервуаром энергии.
Астроглии контролируют синаптогенез и поддержание синапсов
Астроглия регулирует формирование, созревание, поддержание и стабильность синапсов, тем самым контролируя связь нейронных цепей.Астроциты секретируют множество факторов, необходимых для синаптогенеза, и без астроцитов образование синапсов было бы сильно подавлено. Формирование синапсов строго зависит от холестерина, вырабатываемого и секретируемого астроцитами (который, скорее всего, является строительным материалом для новых мембран). Кроме того, холестерин может локально превращаться в стероидные гормоны, которые, в свою очередь, могут действовать как синаптогенные сигналы. Глиальные клетки также влияют на синаптогенез посредством сигналов, влияющих на экспрессию специфического белка, агрина, необходимого для образования синапсов.Другой сигнал, с помощью которого астроциты контролируют синаптогенез, — это тромбин.
Впоследствии астроциты контролируют созревание синапсов через несколько сигнальных систем, которые влияют на постсинаптическую плотность, например, контролируя плотность постсинаптических рецепторов. Несколько различных растворимых факторов, выделяемых астроглией, влияют на созревание синапсов. К ним относятся, например, фактор некроза опухоли альфа (TNF-альфа), который регулирует внедрение рецепторов глутамата в постсинаптические мембраны, и зависимый от активности нейротрофический фактор (ADNF), который после секретирования астроцитами увеличивает плотность рецепторов NMDA в мембрана соседних постсинаптических нейронов.
Астроциты также могут ограничивать количество синапсов, поскольку мембраны астроцитов могут обволакивать нейронные процессы и, таким образом, конкурировать с синапсами. Астроглиальные клетки также могут участвовать в устранении синапсов в ЦНС, процессе, который лежит в основе окончательной настройки и пластичности нейронных входов. Этого можно достичь путем секреции определенных факторов или протеолитических ферментов, которые разрушают внеклеточный матрикс и снижают стабильность синаптического контакта. Впоследствии астроглиальные отростки могут войти в синаптическую щель и буквально закрыть и заменить синапс.Этот процесс характерен для патологии.
Нейронно-глиальная передача сигналов: концепция трехчастного синапса
В сером веществе астроциты тесно связаны с нейрональными мембранами и, в частности, с синаптическими областями, так что астроглиальные мембраны полностью или частично охватывают пресинаптические терминалы и постсинаптические структуры. Например, в гиппокампе около 60% всех аксон-дендритных синапсов окружены астроглиальными мембранами. Эти контакты астроцит-синапс демонстрируют особую специфичность; Астроглиальные мембраны охватывают около 80% больших перфорированных синапсов (которые, вероятно, наиболее функционально активны), тогда как только около половины маленьких (известных как макулярные) синапсы покрыты глиальными мембранами.В мозжечке глиально-синаптические отношения еще более тесные, поскольку почти все синапсы, образованные параллельными волокнами на дендритах нейрона Пуркинье, покрыты мембранами глиальных клеток Бергмана; каждая отдельная клетка Бергмана охватывает от 2000 до 6000 синаптических контактов.
Расстояние между концевыми структурами астроцитов и пре- и постсинаптическими мембранами нейронов составляет всего 1 мкм. Очень тесное морфологическое расположение астроцитов и синаптических структур позволяет первым подвергаться воздействию нейротрансмиттеров, высвобождаемых из синаптических окончаний.Функционально отростки астроглиальных клеток наделены рецепторами нейротрансмиттеров, и, что наиболее важно, модальности рецепторов, экспрессируемых астроглиальными мембранами, точно соответствуют нейротрансмиттерам, высвобождаемым в синапсах, которые они покрывают. В этом отношении астроциты имеют набор рецепторов, очень похожих на рецепторы их соседних нейронов. В мозжечке, например, пара нейрон Пуркинье / глия Бергмана получает несколько синаптических входов, которые используют в качестве нейротрансмиттеров глутамат, АТФ, норадреналин, гистамин и ГАМК; как нейроны, так и глиальные клетки экспрессируют рецепторы, специфичные для этих веществ.В коре как пирамидные нейроны, так и соседние астроглиальные клетки экспрессируют глутамат и пуринорецепторы, тогда как в базальных ганглиях нейроны и астроциты чувствительны к дофамину. Таким образом, по способности ощущать выброс нейромедиатора астроглиальная клетка очень похожа на постсинаптический нейрон.
Тесные морфологические отношения между астроцитами и синапсами, а также функциональная экспрессия соответствующих рецепторов в астроглиальных клетках подсказали концепцию «трехчастного синапса».Согласно этой концепции, синапсы состоят из трех одинаково важных частей: пресинаптического терминала, постсинаптической нейрональной мембраны и окружающего астроцита. Нейротрансмиттер, высвобождаемый из пресинаптического терминала, активирует рецепторы как в постсинаптической нейрональной мембране, так и в перисинаптических мембранах астроглии. Это приводит к генерации постсинаптического потенциала в нейроне и сигнала Ca 2+ в астроците. Последний может распространяться через тело астроглиальной клетки или через астроцитарный синцитий; этот сигнал Ca 2+ может также запускать высвобождение нейротрансмиттеров из астроцита, которые, в свою очередь, передают сигнал как пре-, так и постсинаптическим нейрональным мембранам.
Вопрос о том, активно ли астроциты участвуют в продолжающейся синаптической передаче, остается открытым. Астроглиальные сигналы имеют гораздо более медленную шкалу времени, скорее, во втором или даже минутном диапазоне по сравнению с быстрой передачей сигналов нейронов, которая происходит в пределах миллисекунд. Следовательно, астроциты можно рассматривать как интеграторы или модуляторы. В то же время интимное покрытие синаптических структур астроглиальными мембранами может иметь еще одну важную роль: астроглиальные мембраны могут эффективно изолировать синапсы и предотвращать распространение нейротрансмиттеров (например,грамм. глутамата и ГАМК), что увеличивает пространственную точность синаптической передачи.
Синаптическая передача на астроглию
Рецепторы, расположенные в перисинаптических процессах астроглии, активируются нейротрансмиттером, высвобождаемым из пресинаптических окончаний. В определенных областях мозга астроциты получают прямые синапсоподобные (синаптоидные) или даже классические синаптические связи. Например, стимуляция стебля гипофиза деполяризует звездчатую астроцитоподобную глию, питуициты, за счет прямого воздействия нейронов, формирующих синаптоидные контакты, где проекции аксонов заканчиваются на питуицитах.Точно так же терминалы норэпинефрина устанавливают синаптоидные контакты с астроцитами септогиппокампа. В коре головного мозга регистрировались спонтанные «мелкие» возбуждающие токи от астроцитов, что указывает на очень близкое расположение глиальных мембран к местам высвобождения нейротрансмиттеров.
Сигнализация в глиальной синцитии
Астроглиальные метаботропные рецепторы связаны с внутриклеточными сигнальными каскадами, которые обеспечивают глии специфические механизмы возбудимости. Глиальная возбудимость, как мы ее воспринимаем сегодня, основана на возбудимости мембраны эндоплазматического ретикулума, содержащей каналы высвобождения Ca 2+ , представленные рецепторами InsP 3 и рецепторами рианодина.Стимуляция астроглиальных метаботропных рецепторов индуцирует образование InsP 3 , который, в свою очередь, запускает высвобождение Ca 2+ из ER, производя таким образом сигналы Ca 2+ ; эти сигналы Ca 2+ обычно связаны с активацией глии и действуют как субстрат для возбудимости глии. Сигналы астроцитов Ca 2+ могут пересекать межклеточные границы и распространяться через астроглиальные синцитии. Механизмы генерации и поддержания межклеточных волн Ca 2+ сложны и включают диффузию InsP 3 через щелевые соединения, а также экзоцитотическое высвобождение АТФ из астроцитов.
Щелевые соединения могут также формировать пути передачи сигналов в астроглиальных синцитиях, которые могут включать различные вторичные мессенджеры, метаболические субстраты и другие молекулы. Мы очень мало знаем об этих альтернативных путях, и все же они могут быть важны для пластичности и обработки информации астроглией.
Понятие «глиотрансмиссии»
Астроциты и другие глиальные клетки могут выделять множество передатчиков во внеклеточное пространство.Эти передатчики в настоящее время классифицируются как глиотрансмиттеры, хотя на самом деле это те же молекулы, которые используются нейронами, такие как глутамат, АТФ, ГАМК и D-серин. Только таурин и, возможно, кинуреновая кислота могут представлять собой вещества, выделяемые только глией, являясь, таким образом, истинными глиотрансмиттерами. В высвобождение глиотрансмиттера вовлечено несколько различных механизмов. Эти механизмы включают: (i) диффузию через каналы с высокой проницаемостью (например, активируемые объемом Cl- каналы, непарные «гемиканалы» коннексина или порообразующие пуриноцепторы P2X 7 ; (ii) через транспортеры, e.грамм. путем обращения возбуждающих переносчиков аминокислот или обмена через цистин-глутаматный антипортер или переносчики органических анионов; и (iii) через Ca 2+ -зависимый экзоцитоз.
Первое задокументированное описание секреции астроцитов было сделано французским нейроанатомом Жаном Наджоттом, который в 1910 году предположил, что астроглиальные клетки могут выделять вещества в кровь, действуя как эндокринная железа. В последнее время высвобождение экзоцитоза из астроглиальных клеток было подтверждено в многочисленных экспериментах.Оказалось, что астроциты экспрессируют белки, важные для экзоцитоза, такие как синаптобревин 2, синтаксин 1, белок 23 кДа, связанный с синаптосомами. Кроме того, астроциты экспрессируют транспорты, необходимые для накопления нейротрансмиттеров в секреторных пузырьках. К ним относятся вакуолярный тип протонной АТФазы (V-АТФаза), которая направляет протоны в везикулярный просвет, создавая градиент концентрации протонов, необходимый для транспорта глутамата / АТФ в везикулы, и три известные изоформы везикулярных переносчиков глутамата (VGLUT) 1, 2 и 3 и переносчики везикулярных нуклеотидов (VNUT).Исследования с помощью иммуноэлектронной микроскопии показали, что VGLUT 1 или 2 в астроцитах in situ ассоциируют с небольшими прозрачными пузырьками со средним диаметром ~ 30 нм. Астроциты также имеют крупные гранулы с плотным ядром диаметром ~ 115 нм, содержащие секреторный пептид секретогранин II и АТФ. Функционально экзоцитозное высвобождение трансмиттеров для астроцитов было выведено из нескольких типов экспериментов in vitro и in situ. В частности, Ca 2+ -зависимое высвобождение экзоцитотического глутамата из астроцитов может запускать несколько нейронных ответов, включая повышение нейронального [Ca 2+ ] i и генерацию медленного нейронального входящего тока, опосредованного рецепторами NMDA.Кроме того, глутамат, выделяемый астроглией, может влиять на возбудимость нейронов, возможно, модулировать синаптическую передачу и синхронизировать синаптические события. Однако следует отметить, что роль и значение глиотрансмиссии для обработки информации в головном мозге остается спорным.
Астроциты в невропатологии
Патологический потенциал нейроглии был признан уже в конце 19 — начале 20 веков выдающимися невропатологами, такими как Карл Фромманн, Франц Ниссль, Алоис Альцгеймер и Пио дель Рио-Хортега.Тем не менее, подробные сведения о патологическом значении нейроглии в целом и астроглии в частности остаются фрагментарными из-за длительного преобладания нейроцентрических взглядов в неврологии и невропатологии. Тем не менее, астроциты не только являются фундаментальными для контроля гомеостаза мозга, они также представляют собой важную часть внутренней системы защиты мозга. Мозговые инсульты множественной этиологии запускают эволюционно консервативный астроглиальный защитный ответ, обычно называемый реактивным астроглиозом.Астроглиоз важен как для ограничения областей повреждения (образование рубцов в результате анизоморфного астроглиоза), так и для постинсультного ремоделирования и восстановления нервной функции (изоморфный астроглиоз).
Астроциты участвуют во всех типах патологий головного мозга от острых поражений (травма или инсульт) до хронических нейродегенеративных процессов (таких как болезнь Александра, болезнь Альцгеймера, болезнь Паркинсона, рассеянный склероз и многие другие) и психиатрических заболеваний.Патологически релевантных нейроглиальных процессов много, и они включают в себя различные программы активации, которые необходимы для ограничения областей повреждения, выработки нейроиммунных ответов и для постинсультного ремоделирования и восстановления нервной функции. Недавние исследования также подчеркнули роль дегенерации и атрофии астроглии на ранних стадиях различных нейродегенеративных расстройств, которые могут быть важны для когнитивных нарушений. В целом, астроглиальные клетки в очень большой степени определяют прогрессирование и исход неврологических заболеваний.
По материалам: Kettenmann H .; Верхратский А. (2011) Neuroglia — Living Nerve Glue, Fortschritte der Neurologie und Psychiatrie 79: 588-597
Реактивные протоплазматические и фиброзные астроциты содержат высокий уровень расщепленного кальпаином альфа-2-спектрина
Основные моменты
- 9134
- Протоплазматические и фиброзные астроциты показывают высокие уровни расщепленного кальпаином альфа-2-спектрина по данным двойного иммуногистохимического и иммунофлуоресцентного исследования. продемонстрированы иммуногистохимическим методом с использованием антител против продукта распада альфа-спектрина в фиксированной формалином и залитой парафином ткани.
- •
Исследование также показало доказательства трансформирующего появления реактивных фиброзных астроцитов из протоплазматических астроцитов.
РЕФЕРАТ
Кальпаин, семейство кальций-зависимых нейтральных протеаз, играет важную роль в нейрофизиологии и патологии посредством протеолитической модификации цитоскелетных белков, рецепторов и киназ. Альфа-2-спектрин (αII-спектрин) является основным субстратом для этого семейства протеаз, и присутствие продукта распада αII-спектрина (αΙΙ-спектрин BDP) в клетке свидетельствует об активности кальпаина, запускаемой повышенными внутрицитоплазматическими концентрациями Ca 2 + .Астроциты, наиболее динамичные клетки ЦНС, реагируют на изменения микросреды или вредные стимулы повышением внутрицитоплазматической концентрации Ca 2 + для активации. Чтобы определить, участвуют ли кальпаины в реактивной трансформации глии, мы исследовали парафиновые срезы коры головного мозга и белого вещества человека с помощью иммуногистохимии с антителом, специфичным для опосредованного кальпаином альфа-спектрина BDP. Мы также выполнили стандартную двойную иммуногистохимию, а также иммунофлуоресцентные исследования с использованием антител против αΙΙ-спектрина BDP, а также глиального фибриллярно-кислого белка (GFAP).Мы обнаружили сильную иммунопозитивность в отдельных протоплазматических и фиброзных астроцитах, а также в переходных формах, которые повышают вероятность появления некоторых фиброзных астроцитов из протоплазматических астроцитов. Иммунореактивные астроциты были многочисленны в срезах мозга пациентов с тяжелыми сердечными и / или респираторными заболеваниями в текущем исследовании, в отличие от нашего предыдущего исследования случаев без значительных клинических состояний, которые не смогли выявить такие заметные иммуногистохимические изменения. Наше исследование предполагает, что астроциты становятся иммунопозитивными к αΙΙ-спектрину BDP на различных стадиях активации, и что продукт расщепления спектрина сохраняется даже в полностью реактивных астроцитах.Таким образом, иммуногистохимия αΙΙ-спектрина BDP отмечает реактивные астроциты и подчеркивает вероятность того, что кальпаины и их протеолитический процессинг спектрина участвуют в морфологическом и физиологическом переходе от покоящихся протоплазматических астроцитов к реактивным фиброзным астроцитам.
Ключевые слова
Реактивные астроциты
Активированные астроциты
Протоплазматические астроциты
Волокнистые астроциты
Calpain
Spectrin
Продукт распада
Рекомендуемые статьи 9CitingВсе права защищены.
Рекомендуемые статьи
Ссылки на статьи
Астроциты по-разному реагируют на воспалительные аутоиммунные инсульты и дисбаланс нервной активности | Acta Neuropathologica Communications
Злокович Б.В.: Гематоэнцефалический барьер в здоровье и хронических нейродегенеративных расстройствах. Нейрон 2008, 57 (2): 178–201. 10.1016 / j.neuron.2008.01.003
CAS PubMed Google ученый
Quaegebeur A, Lange C, Carmeliet P: Сосудисто-нервная связь в здоровье и болезни: молекулярные механизмы и терапевтические последствия. Нейрон 2011, 71 (3): 406–424. 10.1016 / j.neuron.2011.07.013
CAS PubMed Google ученый
Ransohoff RM, Brown MA: Врожденный иммунитет в центральной нервной системе. J Clin Invest 2012, 122 (4): 1164–1171.10.1172 / JCI58644
PubMed Central CAS PubMed Google ученый
Недергаард М., Рэнсом Б., Гольдман С.А.: Новые роли астроцитов: новое определение функциональной архитектуры мозга. Trends Neurosci 2003, 26 (10): 523–530. 10.1016 / j.tins.2003.08.008
CAS PubMed Google ученый
Eroglu C, Barres BA: Регулирование синаптических связей с помощью глии. Природа 2010, 468 (7321): 223–231. 10.1038 / nature09612
PubMed Central CAS PubMed Google ученый
Sorensen A, et al .: Астроциты, но не обонятельные клетки или шванновские клетки, способствуют миелинизации аксонов ЦНС in vitro . Glia 2008, 56 (7): 750–763. 10.1002 / glia.20650
PubMed Google ученый
Нэш Б., и др. .: Функциональная двойственность астроцитов при миелинизации. J Neurosci 2011, 31 (37): 13028–13038. 10.1523 / JNEUROSCI.1449-11.2011
CAS PubMed Google ученый
Петцольд Г.С., Мурти В.Н.: Роль астроцитов в сосудисто-нервном взаимодействии. Neuron 2011, 71 (5): 782–797. 10.1016 / j.neuron.2011.08.009
CAS PubMed Google ученый
Barres BA: Тайна и магия глии: взгляд на их роль в здоровье и болезнях. Нейрон 2008, 60 (3): 430–440. 10.1016 / j.neuron.2008.10.013
CAS PubMed Google ученый
Данн К.М., Нельсон М.Т.: Калиевые каналы и нервно-сосудистая связь. Circ J 2010, 74 (4): 608–616. 10.1253 / circj.CJ-10-0174
PubMed Central CAS PubMed Google ученый
Lucchinetti CF, et al. .: Воспалительная корковая демиелинизация при раннем рассеянном склерозе. N Engl J Med 2011, 365 (23): 2188–2197. 10.1056 / NEJMoa1100648
PubMed Central CAS PubMed Google ученый
Броснан CR, Рейн CS: Повторный визит астроцитов при рассеянном склерозе. Glia 2013, 61: 453–465. 10.1002 / glia.22443
PubMed Google ученый
King IL, Dickendesher TL, Segal BM: Циркулирующие миелоидные предшественники Ly-6C + мигрируют в ЦНС и играют патогенную роль во время аутоиммунного демиелинизирующего заболевания. Кровь 2009, 113 (14): 3190–3197. 10.1182 / blood-2008-07-168575
PubMed Central CAS PubMed Google ученый
Young NP, et al. .: Перивенальная демиелинизация: связь с клинически определенным острым диссеминированным энцефаломиелитом и сравнение с патологически подтвержденным рассеянным склерозом. Brain 2010, 133 (Pt 2): 333–348.
PubMed Central PubMed Google ученый
Eng LF, et al. .: Кислый белок, выделенный из фиброзных астроцитов. Brain Res 1971, 28 (2): 351–354. 10.1016 / 0006-8993 (71) -8
CAS PubMed Google ученый
Леннон В.А., и др. .: Сывороточный маркер аутоантител оптического нейромиелита: отличие от рассеянного склероза. Lancet 2004, 364 (9451): 2106–2112. 10.1016 / S0140-6736 (04) 17551-X
CAS PubMed Google ученый
Hinson SR, et al .: Молекулярные исходы связывания невромиелита зрительного нерва (NMO) -IgG с аквапорином-4 в астроцитах. Proc Natl Acad Sci USA 2012, 109 (4): 1245–1250.10.1073 / pnas.1109980108
PubMed Central CAS PubMed Google ученый
Уотерс П., Винсент А: Обнаружение антител против аквапорина-4 при оптическом нейромиелите: текущее состояние анализов. Int Ms J 2008, 15 (3): 99–105.
CAS PubMed Google ученый
Barnett MH, Sutton I: Оптический нейромиелит: не вариант рассеянного склероза. Curr Opin Neurol 2012, 25 (3): 215–220. 10.1097 / WCO.0b013e3283533a3f
PubMed Google ученый
Яриус С., Вильдеманн B: Антитела AQP4 при оптическом нейромиелите: диагностическая и патогенетическая значимость. Nat Rev Neurol 2010, 6 (7): 383–392. 10.1038 / nrneurol.2010.72
CAS PubMed Google ученый
Higashimori H, Sontheimer H: Роль каналов Kir4.1 в контроле роста глии. GLIA 2007, 55 (16): 1668–1679. 10.1002 / glia.20574
PubMed Central PubMed Google ученый
Stephan J, et al. .: Kir4.1 каналы опосредуют деполяризацию астроцитов гиппокампа в условиях гипераммониемии in situ. GLIA 2012, 60 (6): 965–978.10.1002 / glia.22328
PubMed Google ученый
Bay V, Butt AM: Взаимосвязь между регуляцией глиального калия и возбудимостью аксонов: роль глиальных каналов Kir4.1. GLIA 2012, 60 (4): 651–660. 10.1002 / glia.22299
PubMed Google ученый
Шривастава Р., и др. .: Калиевый канал KIR4.1 как иммунная мишень при рассеянном склерозе. N Engl J Med 2012, 367 (2): 115–123. 10.1056 / NEJMoa1110740
CAS PubMed Google ученый
Юккола П.И., и др. .: Изменения K + каналов при прогрессировании экспериментального аутоиммунного энцефаломиелита. Neurobiol Dis 2012, 47 (2): 280–293. 10.1016 / j.nbd.2012.04.012
PubMed Central CAS PubMed Google ученый
Ishibashi T, et al. .: Астроциты способствуют миелинизации в ответ на электрические импульсы. Нейрон 2006, 49 (6): 823–832. 10.1016 / j.neuron.2006.02.006
PubMed Central CAS PubMed Google ученый
Watkins TA, et al. .: Четкие стадии миелинизации, регулируемые гамма-секретазой и астроцитами, в быстро миелинизирующей системе совместного культивирования ЦНС. Нейрон 2008, 60 (4): 555–569. 10.1016 / j.neuron.2008.09.011
PubMed Central CAS PubMed Google ученый
Schipke CG, Kettenmann H: Ответ астроцитов на активность нейронов. Glia 2004, 47 (3): 226–232. 10.1002 / glia.20029
PubMed Google ученый
Биндер Д.К., Штайнхаузер C: Функциональные изменения астроглиальных клеток при эпилепсии. Glia 2006, 54 (5): 358–368. 10.1002 / glia.20394
PubMed Google ученый
Eid T, et al .: Рецидивирующие припадки и патология мозга после ингибирования глутаминсинтетазы в гиппокампе у крыс. Brain 2008, 131 (Pt 8): 2061–2070.
PubMed Central PubMed Google ученый
Eid T, et al. .: Потеря глутаминсинтетазы в эпилептогенном гиппокампе человека: возможный механизм повышения внеклеточного глутамата при мезиальной височной эпилепсии. Lancet 2004, 363 (9402): 28–37. 10.1016 / S0140-6736 (03) 15166-5
CAS PubMed Google ученый
Alvestad S, et al .: Неверная локализация AQP4 предшествует хроническим припадкам в каинатной модели височной эпилепсии. Epilepsy Res 2013, 105 (1–2): 30–41.
CAS PubMed Google ученый
Custer SK, et al. .: Экспрессия глии Бергмана расширенного полиглутамином атаксина-7 вызывает нейродегенерацию за счет нарушения транспорта глутамата. Nat Neurosci 2006, 9 (10): 1302–1311. 10.1038 / nn1750
CAS PubMed Google ученый
Gu C, Gu Y: Кластеризация и настройка активности каналов kv1 в миелинизированных аксонах гиппокампа. J Biol Chem 2011, 286 (29): 25835–25847. 10.1074 / jbc.M111.219113
PubMed Central CAS PubMed Google ученый
Gu Y, Gu C: Динамика транспорта канала Kv1 в аксонах. PLoS One 2010, 5 (8): e11931. 10.1371 / journal.pone.0011931
PubMed Central PubMed Google ученый
Jenkins SM, Bennett V: Ankyrin-G координирует сборку мембранного скелета на основе спектрина, потенциал-управляемых натриевых каналов и L1 CAM в начальных сегментах нейрона Пуркинье. J Cell Biol 2001, 155 (5): 739–746. 10.1083 / jcb.200109026
PubMed Central CAS PubMed Google ученый
Ho CS, Grange RW, Joho RH: Плейотропные эффекты нарушенного гена K + канала: снижение веса тела, нарушение моторики и сокращения мышц, но без судорог. Proc Natl Acad Sci USA 1997, 94 (4): 1533–1538. 10.1073 / pnas.94.4.1533
PubMed Central CAS PubMed Google ученый
Hurlock EC, et al. .: Восстановление координации движений за счет нацеленного на клетки Пуркинье восстановления каналов Kv3.3 у мышей с нулевым Kcnc3 требует Kcnc1. J Neurosci 2009, 29 (50): 15735–15744. 10.1523 / JNEUROSCI.4048-09.2009
PubMed Central CAS PubMed Google ученый
Sanchez JA, et al. .: Дисфункция мышц и моторных навыков у мышей с дефицитом K + канала не является следствием измененной возбудимости мышц или типа волокна, а зависит от генетического фона. Pflugers Arch 2000, 440 (1): 34–41.
CAS PubMed Google ученый
Bignami A, Raju T, Dahl D: Локализация виментина, неспецифического белка промежуточных филаментов, в эмбриональной глии и в ранних дифференцирующихся нейронах. In vivo и in vitro иммунофлуоресцентное исследование эмбриона крысы с использованием антисыворотки к виментину и нейрофиламентам. Dev Biol 1982, 91 (2): 286–295. 10.1016 / 0012-1606 (82) -5
CAS PubMed Google ученый
Lazarides E: Промежуточные филаменты: химически гетерогенный класс белков, регулируемый развитием. Annu Rev Biochem 1982, 51: 219–250. 10.1146 / annurev.bi.51.070182.001251
CAS PubMed Google ученый
Eriksson JE, et al. .: Введение промежуточных волокон: от открытия к болезни. J Clin Invest 2009, 119 (7): 1763–1771. 10.1172 / JCI38339
PubMed Central CAS PubMed Google ученый
Stuart G, Schiller J, Sakmann B: Инициирование и распространение потенциала действия в пирамидных нейронах неокортекса крыс. J. Physiol 1997, 505 (Pt 3): 617–632.
PubMed Central CAS PubMed Google ученый
Clark BD, Goldberg EM, Rudy B: Электрогенная настройка начального сегмента аксона. Нейробиолог 2009, 15 (6): 651–668. 10.1177 / 1073858409341973
PubMed Central PubMed Google ученый
Zhou L, et al. .: Температурно-чувствительная нервно-мышечная передача у нулевых по Kv1.1 мышей: роль калиевых каналов под миелиновой оболочкой молодых нервов. J Neurosci 1998, 18 (18): 7200–7215.
CAS PubMed Google ученый
Salzer JL: Поляризованные домены миелинизированных аксонов. Нейрон 2003, 40 (2): 297–318. 10.1016 / S0896-6273 (03) 00628-7
CAS PubMed Google ученый
Bennett V, Baines AJ: Спектрин и пути на основе анкирина: изобретения многоклеточных животных для интеграции клеток в ткани. Physiol Rev 2001, 81 (3): 1353–1392.
CAS PubMed Google ученый
Pan Z, et al. .: Обычный механизм на основе анкирина-G сохраняет каналы KCNQ и NaV в электрически активных доменах аксона. J Neurosci 2006, 26 (10): 2599–2613.10.1523 / JNEUROSCI.4314-05.2006
CAS PubMed Google ученый
Song AH, et al. .: Селективный фильтр для цитоплазматического транспорта в начальном сегменте аксона. Cell 2009, 136 (6): 1148–1160. 10.1016 / j.cell.2009.01.016
CAS PubMed Google ученый
Соботзик Дж. М., и др. .: AnkyrinG необходим для поддержания аксо-дендритной полярности in vivo . Proc Natl Acad Sci USA 2009, 106 (41): 17564–17569. 10.1073 / pnas.07106
PubMed Central CAS PubMed Google ученый
Rudy B, McBain CJ: Каналы Kv3: управляемые по напряжению каналы K +, разработанные для высокочастотного повторяющегося срабатывания. Trends Neurosci 2001, 24 (9): 517–526.10.1016 / S0166-2236 (00) 01892-0
CAS PubMed Google ученый
Jonas P, et al. .: Серия Interneuron Diversity: Быстрая входящая, быстрая выходная временная и пространственная обработка сигналов в интернейронах гиппокампа. Trends Neurosci 2004, 27 (1): 30–40. 10.1016 / j.tins.2003.10.010
CAS PubMed Google ученый
Gu C, Barry J: Функция и механизм нацеливания на аксоны чувствительных к напряжению калиевых каналов. Prog Neurobiol 2011, 94 (2): 115–132. 10.1016 / j.pneurobio.2011.04.009
PubMed Central CAS PubMed Google ученый
Coetzee WA, et al .: Молекулярное разнообразие K + каналов. Ann N Y Acad Sci 1999, 868: 233–285.10.1111 / j.1749-6632.1999.tb11293.x
CAS PubMed Google ученый
Gu Y, et al. .: Альтернативный сплайсинг регулирует поляризованное нацеливание Kv3.1 для регулировки максимальной частоты пиков. J Biol Chem 2012, 287: 1755–1769. 10.1074 / jbc.M111.299305
PubMed Central CAS PubMed Google ученый
Gu Y, Barry J, Gu C: Сборка, перемещение и активность канала Kv3 регулируются цинком через разные сайты связывания. J Physiol 2013, 591: 2475–2490.
Google ученый
Xu M, et al. .: Нацеливание на аксон-дендрит каналов Kv3 (Shaw) определяется направленным мотивом, который ассоциируется с доменом T1 и анкирином G. J Neurosci 2007, 27 (51): 14158–14170.10.1523 / JNEUROSCI.3675-07.2007
CAS PubMed Google ученый
Xu M, et al. .: Кинезин I транспортирует тетрамеризованные каналы Kv3 через начальный сегмент аксона посредством прямого связывания. J Neurosci 2010, 30 (47): 15987–16001. 10.1523 / JNEUROSCI.3565-10.2010
PubMed Central CAS PubMed Google ученый
Barry J, Xu M, Gu Y, Dangel A, Jukkola P, Shrestha C, Gu C: Активация обычных кинезиновых моторов в кластерах с помощью управляемых напряжением K + каналов Шоу. J Cell Sci 2013, 126: 2027–2041. 10.1242 / jcs.122234
PubMed Central CAS PubMed Google ученый
Zagha E, Lang EJ, Rudy B: Каналы Kv3.3 в соме клеток Пуркинье необходимы для генерации классической сложной формы волны спайков. J Neurosci 2008, 28 (6): 1291–1300. 10.1523 / JNEUROSCI.4358-07.2008
PubMed Central CAS PubMed Google ученый
Hurlock EC, McMahon A, Joho RH: Ограниченное клетками Пуркинье восстановление функции Kv3.3 восстанавливает сложные спайки и спасает координацию движений у мутантов Kcnc3. J Neurosci 2008, 28 (18): 4640–4648. 10.1523 / JNEUROSCI.5486-07.2008
CAS PubMed Google ученый
Devaux J, et al. .: Kv3.1b — новый компонент узлов CNS. J Neurosci 2003, 23 (11): 4509–4518.
CAS PubMed Google ученый
Wu X, et al. .: Повышающая регуляция рецептора астроцитарного лептина у мышей с экспериментальным аутоиммунным энцефаломиелитом. J Mol Neurosci 2012, 49 (3): 446–456.
PubMed Central PubMed Google ученый
Kurkowska-Jastrzebska I, et al. .: Нейродегенерация и воспаление в гиппокампе при экспериментальном аутоиммунном энцефаломиелите, вызванном у крыс однократным введением энцефалитогенных Т-клеток. Neuroscience 2013, 248: 690–698.
CAS PubMed Google ученый
Ziehn MO, et al. .: Атрофия CA1 гиппокампа и потеря синапсов во время экспериментального аутоиммунного энцефаломиелита. EAE. Lab Invest 2010, 90 (5): 774–786. 10.1038 / labinvest.2010.6
PubMed Google ученый
Ziehn MO, et al. .: Терапевтическое введение тестостерона сохраняет возбуждающую синаптическую передачу в гиппокампе во время аутоиммунного демиелинизирующего заболевания. J Neurosci 2012, 32 (36): 12312–12324. 10.1523 / JNEUROSCI.2796-12.2012
PubMed Central CAS PubMed Google ученый
Ziehn MO, et al. .: Эстриол сохраняет синаптическую передачу в гиппокампе во время аутоиммунного демиелинизирующего заболевания. Lab Invest 2012, 92 (8): 1234–1245. 10.1038 / labinvest.2012.76
PubMed Central CAS PubMed Google ученый
Bardehle S, et al .: Живое изображение ответов астроцитов на острое повреждение выявляет избирательную юкставаскулярную пролиферацию. Nat Neurosci 2013, 16 (5): 580–586. 10.1038 / nn.3371
CAS PubMed Google ученый
Popko B, et al. .: Влияние гамма-интерферона на центральную нервную систему. Моль нейробиол 1997, 14 (1-2): 19-35.
CAS PubMed Google ученый
Yong VW, et al. .: Гамма-интерферон способствует пролиферации астроцитов взрослого человека in vitro и реактивному глиозу в мозге взрослой мыши in vivo . Proc Natl Acad Sci USA 1991, 88 (16): 7016–7020. 10.1073 / pnas.88.16.7016
PubMed Central CAS PubMed Google ученый
Iliff JJ, et al .: Параваскулярный путь способствует прохождению спинномозговой жидкости через паренхиму головного мозга и удалению интерстициальных растворенных веществ, включая бета-амилоид. Sci Transl Med 2012, 4 (147): 147ra111. 10.1126 / scitranslmed.3003748
PubMed Central PubMed Google ученый
Chan KH, et al. .: Аутоантитела к аквапорину-4 вызывают бессимптомную потерю аквапорина-4 и активируют астроциты у мышей. J Neuroimmunol 2012, 245 (1-2): 32-38.
CAS PubMed Google ученый
Kim JE, et al. .: Потеря астроглии и образование отека в грушевидной коре и гиппокампе крыс после вызванного пилокарпином эпилептического статуса. J Comp Neurol 2010, 518 (22): 4612–4628. 10.1002 / cne.22482
PubMed Google ученый
Миямото К., и др. .: Повышение регуляции водного канала аквапорина-4 при экспериментальном аутоиммунном энцефаломиерите. J Neurol Sci 2009, 276 (1–2): 103–107.
CAS PubMed Google ученый
Sinclair C, et al. .: Отсутствие экспрессии аквапорина-4 в очагах невромиелита зрительного нерва, но повышенная экспрессия в очагах рассеянного склероза и нормальном белом веществе. Acta Neuropathol 2007, 113 (2): 187–194. 10.1007 / s00401-006-0169-2
CAS PubMed Google ученый
Bennett JL, et al. .: Интратекальные патогенные антитела против аквапорина-4 при раннем оптическом невромиелите. Ann Neurol 2009, 66 (5): 617–629. 10.1002 / ana.21802
PubMed Central CAS PubMed Google ученый
Kinoshita M, Nakatsuji Y: Где антитела к AQP4 подходят для патогенеза NMO? . Multiple Sclerosis International; 2012: 862169. DOI: 10.1155/2012/862169
Google ученый
Мису Т., и др. .: Потеря аквапорина 4 при поражениях оптического нейромиелита: отличие от рассеянного склероза. Мозг 2007, 130 (Pt 5): 1224–1234.
CAS PubMed Google ученый
Matthews L, et al .: Различие серопозитивного расстройства спектра NMO и распределения поражений мозга при рассеянном склерозе. Неврология 2013, 80 (14): 1330–1337. 10.1212 / WNL.0b013e3182887957
PubMed Central PubMed Google ученый
Bukhari W., et al. .: Молекулярный патогенез оптического нейромиелита. Int J Mol Sci 2012, 13 (10): 12970–12993.
PubMed Central CAS PubMed Google ученый
Marignier R, et al. .: Олигодендроциты повреждаются иммуноглобулином G при невромиелите зрительного нерва через повреждение астроцитов. Мозг 2010, 133 (9): 2578–2591. 10.1093 / brain / awq177
PubMed Google ученый
Tomizawa Y, et al .: Нарушение гематоэнцефалического барьера при оптическом невромиелите более серьезное, чем при рассеянном склерозе, и коррелирует с клинической инвалидностью. J Int Med Res 2012, 40 (4): 1483–1491. 10.1177 / 147323001204000427
CAS PubMed Google ученый
Saadoun S, et al. .: Дефицит Т-клеток не снижает поражений у мышей, вызванных внутримозговыми инъекциями NMO-IgG и комплемента. J Neuroimmunol 2011, 235 (1-2): 27-32.
CAS PubMed Google ученый
Li L, и др. .: Провоспалительная роль аквапорина-4 в аутоиммунном нейровоспалении. Faseb J 2011, 25 (5): 1556–1566. 10.1096 / fj.10-177279
PubMed Central CAS PubMed Google ученый
Li L, Zhang H, Verkman AS: Значительно ослабленный экспериментальный аутоиммунный энцефаломиелит у мышей с нокаутом по аквапорину-4. BMC Neurosci 2009, 10: 94.10.1186 / 1471-2202-10-94
PubMed Central PubMed Google ученый
Кимура А., и др. .: Защитная роль водных каналов аквапорина-4 после контузионного повреждения спинного мозга. Ann Neurol 2010, 67 (6): 794–801.
PubMed Google ученый
Софронев М.В., Винтерс ХВ: Астроциты: биология и патология. Acta Neuropathol 2010, 119 (1): 7–35. 10.1007 / s00401-009-0619-8
PubMed Central PubMed Google ученый
Charles AC, et al. .: Межклеточная передача сигналов в глиальных клетках: волны и колебания кальция в ответ на механическую стимуляцию и глутамат. Neuron 1991, 6 (6): 983–992. 10.1016 / 0896-6273 (91) -У
CAS PubMed Google ученый
Cornell-Bell AH, et al. .: Глутамат индуцирует кальциевые волны в культивируемых астроцитах: передача глиальных сигналов на большие расстояния. Наука 1990, 247 (4941): 470–473. 10.1126 / science.1967852
CAS PubMed Google ученый
Shigetomi E, et al .: Две формы кальциевой возбудимости астроцитов имеют различные эффекты на медленные входящие токи в пирамидных нейронах, опосредованные рецептором NMDA. J Neurosci 2008, 28 (26): 6659–6663. 10.1523 / JNEUROSCI.1717-08.2008
PubMed Central CAS PubMed Google ученый
Халасса М.М., Феллин Т., Хейдон PG: Трехсторонний синапс: роль передачи глиотрансфера в здоровье и болезни. Trends Mol Med 2007, 13 (2): 54–63. 10.1016 / j.molmed.2006.12.005
CAS PubMed Google ученый
Perea G, Navarrete M, Araque A: Трехсторонние синапсы: астроциты обрабатывают и контролируют синаптическую информацию. Trends Neurosci 2009, 32 (8): 421–431. 10.1016 / j.tins.2009.05.001
CAS PubMed Google ученый
Volterra A, Meldolesi J: Астроциты, от мозгового клея до элементов коммуникации: революция продолжается. Nat Rev Neurosci 2005, 6 (8): 626–640.10.1038 / номер 1722
CAS PubMed Google ученый
Moore CS, et al. .: Как факторы, секретируемые астроцитами, влияют на восстановление миелина. J Neurosci Res 2011, 89 (1): 13–21. 10.1002 / jnr.22482
CAS PubMed Google ученый
Типы ячеек. Астроцит. Атлас гистологии растений и животных
Астроциты — это клетки центральной нервной системы: головного и спинного мозга.Вместе с олигодендроцитами микроглия и клетки Шванна образуют глиальные клетки. В течение очень долгого времени астроциты рассматривались как второстепенные клетки нервной системы по сравнению с нейронами. Оказалось, что астроциты выполняют функцию домработниц нейронов и создают барьеры на границах центральной нервной системы. Однако в настоящее время астроцитам приписывается множество разнообразных функций в нормальной нервной системе, в патологических процессах и во время развития. Они даже участвуют в модуляции информации, предварительно обработанной нейронами.Интересно, что в ходе эволюции приматов считалось, что соотношение астроцитов / нейронов в головном мозге увеличивалось.
1. Морфология
Глиальный фибриллярный кислый белок (GFAP) — это белок, который специфически обнаруживается как часть цитоскелета астроцитов. Название астроцит происходит из-за звездообразной морфологии промежуточных филаментов цитоскелета. Однако морфология клеток может быть различной. Например, те, которые расположены в сером веществе, известны как протоплазматические астроциты, а те, что в белом веществе, известны как фиброзные астроциты.Существуют также высокоспециализированные астроциты, такие как глия Бергмана в мозжечке и глия Мюллера в сетчатке (рис. 1).
Рисунок 1. Глиальные клетки. A, C и D. Астроциты в головном мозге. Б. Нейрон и глия различаются по размеру. А и С. Протоплазматические астроциты. D. Фиброзные астроциты. Глия Э. Бергмана в мозжечке.Протоплазматические астроциты имеют разрастания клеток, которые могут несколько раз ветвиться. Концевые концы этих выступов называются концевыми ножками, которые покрывают кровеносные сосуды, пиальные поверхности и синапсы (один астроцит может окружать тысячи синапсов).Фиброзные астроциты находятся в белом веществе и имеют более тонкие разрастания клеток с несколькими ветвями. Концы фиброзных астроцитов охватывают узлы Ранвье и кровеносные сосуды аксональных трактов.
2. Число
Астроциты — самый распространенный глиальный тип мозга (рис. 2). Количество астроцитов варьируется в зависимости от области мозга, но во многих областях мозга они составляют от 20 до 25% от объема. В мозге кошки и крысы астроцитов так же много, как и нейронов.
Фигура 2.Астроциты в корковых областях мозга крысы. Их визуализируют после иммуногистохимии на глиальный фибриллярный кислый белок (GFAP).Астроциты в основном образуются в перинатальном периоде, когда массовое производство нейронов прекращается. Такое поведение было обнаружено у людей и кошек. В этот период астроциты можно дифференцировать из нескольких источников. Например, в коре головного мозга астроциты могут происходить из радиальной глии, стенок желудочков и из недифференцированной глии NG2.Первоначально все эти клетки становятся астроцитами-предшественниками, которые дифференцируются непосредственно в астроциты или сначала проходят ряд делений, чтобы увеличить будущую локальную популяцию зрелых астроцитов. Астроциты также могут размножаться во взрослых тканях. Местное производство новых зрелых астроцитов во взрослые периоды может происходить из-за митотической активности некоторых предшественников, которые остаются неактивными и недифференцированными в течение длительного времени. В перинатальном периоде у кошек соотношение глия / нейрон составляет 0,86, тогда как у взрослых — 1.4. Это означает, что количество астроцитов увеличивается больше, чем нейронов.
3. Функции
Нейронная активность
По сравнению с нейронами астроцитам обычно отводится довольно пассивная функция. Считалось, что они участвуют в гомеостазе нейронов, механической поддержке и способствуют нормальному функционированию нервной ткани, изолируя синапсы (предотвращая вмешательство между близкими синапсами). Расширения клеток астроцитов происходят вокруг нейронов, синапсов и узелков Ранвье.Было обнаружено, что астроциты также очищают или инактивируют внеклеточные нейротрансмиттеры, такие как глутамат, и удаляют и перераспределяют внеклеточные ионы, такие как калий. Все это способствует правильному функционированию синапсов. Однако в настоящее время известно, что астроциты играют гораздо более активную роль в передаче нервных импульсов.
Астроциты реагируют на ряд нейромедиаторов, таких как моноамины, нейропептиды, ГАМК, ацетилхолин, оксид азота и эндоканнабиноиды. В плазматической мембране астроцитов есть рецепторы для этих нейротрансмиттеров.Они активируются не синаптически, а так называемой объемной передачей. Нейротрансмиттеры, высвобождаемые нейронами в синаптических участках, могут диффундировать из синаптической щели и достигать мембран астроцитов. Окружающие астроциты и активные синапсы способны реагировать на активность нейронов повышением внутренней концентрации кальция. После активации астроциты могут высвобождать молекулы, известные как глиотрансмиттеры, такие как глутамат, АТФ и аденозин. Рецепторы для глиотрансмиттеров можно найти в нейронах, и поэтому их активность можно модулировать.В настоящее время моделью синапса является трехсторонний синапс (рис. 3), который включает пресинаптический нейрон, постсинаптический нейрон и глию, которая окружает их два.
Рисунок 3. Трехсторонний синапс. Показаны пресинаптический, постсинаптический и глиальный компоненты синапса.Есть и другие активные действия астроцитов на нейроны. Они участвуют в дифференцировке синапсов и могут удалять синапсы путем фагоцитоза. Во время развития астроциты помогают устанавливать нейронные связи и облегчают миграцию аксонов.
Повышение внутренней концентрации кальция интересно тем, что астроциты связаны между собой щелевыми контактами. Таким образом, они образуют сеть связанных цитоплазм в виде синцития, который может синхронизировать активность больших популяций астроцитов. Активация астроцита может активировать множество связанных астроцитов. Хотя синхронизация популяций астроцитов может представлять интерес для контроля кровотока в некоторых областях мозга, еще не ясно, является ли это их реальной функцией.
Glia limitans
Астроциты покрывают внешнюю поверхность головного и спинного мозга (рис. 4). Концы астроцитов (обезьяны) или целые астроциты (мыши) образуют лист, который изолирует нейроны от менингеальных мембран и покрывает центральную нервную систему. Этот внешний слой, состоящий из астроцитов, называется глией лимитанс. Астроциты glia limitans прикреплены к базальной пластинке, а базальная пластинка — к внутренней пиальной мембране. Функция glia limitans неизвестна, кроме того, что это физический слой, который отделяет нейроны от других не нервных элементов.У мышей glia limitans состоит из тел астроцитов, которые покрывают поверхность центральной нервной системы, за исключением обонятельной луковицы и мозжечка. Некоторые авторы предполагают, что астроциты, участвующие в формировании лимита глии, отличаются от протоплазматических и фиброзных астроцитов.
Рисунок 4. Астроциты, иммуноокрашенные на GFAP, с клеточными отростками по направлению к поверхности мозга.Гематоэнцефалический барьер
П.Герлих заметил, что головной мозг и спинной мозг были особыми структурами, потому что, когда он вводил чернила в систему крови, окрашивались все органы, кроме центральной нервной системы.Было что-то, что мешало чернилам выходить из кровеносных сосудов в этих нервных структурах. Это происходит из-за так называемого гематоэнцефалического барьера, который состоит из эндотелия, перицитов, базальной пластинки и кончиков астроцитов (рисунки 5 и 6). В центральной нервной системе эндотелиальные клетки расположены очень близко друг к другу, больше, чем в любом другом органе, потому что у них много клеточных контактов: плотных контактов и щелевых контактов, которые закрывают межклеточное пространство. Таким образом, молекулы, которые хотят пересечь эндотелий, должны сделать это через эндотелиальные клетки.Похоже, что концы астроцитов, которые не образуют настоящего барьера, могут регулировать эти межклеточные соединения и влиять на молекулярный трафик через эндотелиальный слой.
Рисунок 5. Астроциты, помеченные иммуногистохимическим методом на GFAP в коре головного мозга мыши. Они направляют расширение клеток к кровеносным сосудам.Рис. 6. Чертеж, показывающий основные компоненты гематоэнцефалического барьера: эндотелий, базальную пластинку, перициты и концы астроцитов.
Термин «барьер» вводит в заблуждение, потому что это не строгое ограничение.Между кровью и внеклеточным матриксом нервной ткани происходит интенсивный и избирательный обмен молекулами. Иногда даже лимфоциты могут пересечь его. Гематоэнцефалический барьер могут пересекать молекулы с молекулярной массой менее 500 кДа, жирорастворимые молекулы и молекулы, имеющие определенный переносчик. Эта избирательность может быть препятствием для некоторых лекарств на пути к нейронам. Любопытно, что когда некоторая эндотелиальная клетка умирает и гематоэнцефалический барьер нарушается, олигодендроглия может залатать поврежденную область.
4. Патологии
Астроциты устойчивы к низкому уровню кислорода и глюкозы. Во время депривации они могут оставаться в живых дольше, чем нейроны, потому что они способны накапливать гликоген и производить АТФ с помощью анаэробных метаболических путей. Таким образом, они важны при экстремальных ситуациях и определенных патологиях. После повреждения головного мозга астроциты становятся реактивными (реактивные астроциты), что приводит к их гипертрофии или гиперплазии. Это называется реактивным глиозом. При реактивном глиозе можно выделить два типа астроцитов.Астроциты A2 в основном участвуют в восстановлении, тогда как астроциты A1 способствуют деградации тканей. Астроциты A2 важны для ангиогенеза (образования кровеносных сосудов). Реактивная глия наблюдается при хореях Паркинсона, Альцгеймера и Хантингтона. Кроме того, поскольку они могут делиться, астроциты несут ответственность за большинство опухолей головного мозга, известных как глиома.
5. Прочие
Астроциты снабжают нейроны нейротрофическими молекулами, являются источником внеклеточного матрикса, могут действовать как центры детоксикации; например, они хранят некоторые металлы и аммиак.
Библиография
Liddelow S, Barres B. 2015. SnapShot: Астроциты в здоровье и болезнях. Клетка. 162: 1170-1170.e1.
Рэнсом Б., Бехар Т., Недергаард М. 2003. Новые роли астроцитов (наконец-то звезды). Тенденции нейробиологии. 26: 520-522.
Табата, Х. 2015. Различные подтипы астроцитов и их развитие во время кортикогенеза. Границы нейробиологии. 9, 114.
Культура клеток астроцитов, протоколы, трансфекция
Астроциты, или астроглия, представляют собой звездообразные глиальные клетки, которые находятся в головном и спинном мозге.Это самые многочисленные клетки человеческого мозга, выполняющие множество задач. Задачи астроцитов включают поддержку клеток, составляющих гематоэнцефалический барьер, а также поддержание баланса внеклеточных ионов, доставку питательных веществ в нервную ткань и помощь в процессах посттравматического восстановления и рубцевания. Кроме того, астроциты выполняют сигнальные задачи, аналогичные нейронам, использующим ионы кальция и передающие молекулы.
Морфология астроцитовАстроциты можно разделить на три категории в зависимости от их клеточной морфологии и анатомического расположения: протоплазматические, фиброзные или радиальные.Протоплазматические астроциты демонстрируют мелко разветвленную морфологию, выраженную в однородном глобоидном распределении, и встречаются во всем сером веществе. Волокнистые астроциты имеют длинную волокнистую морфологию и встречаются во всем белом веществе. Исследования показывают, что как протоплазматические, так и фиброзные астроциты устанавливают обширные контакты с кровеносными сосудами, а также образуют щелевые соединения между дистальными отростками соседних астроцитов. Радиальные астроциты существуют на пересечении серого вещества и мягкой мозговой оболочки, которая является самым внутренним слоем мембран, окружающих головной и спинной мозг.Радиальные астроциты также обнаруживаются в глазу позвоночных (образуют клетки Мюллера сетчатки) и в виде глии Бергмана (эпителиальные клетки в мозжечке). Эти клетки биполярны, с удлиненными отростками и яйцевидным телом. Радиальные глиальные клетки — это начальные клетки, которые развиваются из ее нейральных предшественников и образуют основные каркасные структуры, которые помогают в миграции нейронов. В сетчатке клетки радиальной астроглии трансформируются в клетки Мюллера и составляют 23% от общего объема клеток сетчатки.
Первичные астроциты
Многие первичные астроциты экспрессируют GFAP, глиальный фибриллярный кислотный белок промежуточных филаментов, что является характерной чертой.
Роль астроцитов в центральной нервной системеАстроциты, или астроцитарные глиальные клетки, вместе образуют астроглию, звездообразные клетки, окружающие нейроны головного и спинного мозга. Количество астроцитов превышает число нейронов 50: 1, и они очень активны в центральной нервной системе, в отличие от предыдущей идеологии, согласно которой астроциты являются «клетками-наполнителями». Ненейрональные клетки нервной системы представляют собой глиальные клетки с астроцитами, составляющими подтип этой категории. Они служат для поддержания, поддержки и восстановления нервной ткани, которой они служат, и отвечают за пластичность нервной системы.Астроциты также модулируют синаптическую передачу, производя и высвобождая глутамат, главный возбуждающий нейротрансмиттер, и их многочисленные процессы часто охватывают нервные синапсы. Исследования показывают, что астроциты связываются с нейронами посредством высвобождения передатчиков, известных как глиотрансмиттеры, через механизм, зависимый от ионов кальция.
Рисунок : АстроцитыАстроциты играют важную роль в схемах и процессах мозга посредством большого разнообразия нейронных функций на клеточном уровне.Они контролируют нейронные цепи, регулируя формирование, созревание, устранение и поддержание синапсов. Передача синаптических сигналов основана на молекулах, секретируемых астроцитами, которые обычно представляют собой холестерин и тромбин. Астроциты также отвечают за ионный гомеостаз, клиренс нейротрансмиттеров и регуляцию объема внеклеточного пространства.
Астроциты реагируют на повреждение или заболевание центральной нервной системы (ЦНС) посредством процесса, называемого реактивным астроглиозом. Эта патология стала характерной особенностью структурных поражений нервной системы и является основным направлением современных исследований.Было установлено, что астроциты участвуют в патологиях болезни Хантингтона, болезни Альцгеймера, сотрясений мозга, инсульта и инфекций ЦНС. Текущие исследования показывают, что реактивный астроглиоз играет важную роль во многих расстройствах ЦНС.
Глиальные клетки выполняют множество функций, включая построение микроархитектуры паренхимы мозга, создание среды мозга, поддержание гомеостаза мозга, хранение энергии, контроль развития синаптогенеза, поддержание синапсов, нервные клетки и защиту мозга.
Модели на животных (особенно грызуны) сыграли значительную роль в определении характеристик и функций астроцитов. Однако исследования привели к гипотезе о том, что изменение характеристик астроцитов изменит их вклад в функции нейронов. Причины этой гипотезы включают доказательства того, что соотношение астроцитов и нейронов увеличивается с эволюционной стадией данного вида и что структура, морфология и разнообразие астроцитов человека значительно отличаются от таковых у грызунов.Ограниченный доступ к здоровым тканям человека представляет собой препятствие для получения дополнительной информации об астроцитах человека. Однако посмертные образцы и образцы плода внесли свой вклад в изучение астроцитарных свойств головного мозга человека.
Ссылки
Астроцитов (Википедия)
Доставка миРНК— Наборы для трансфекции in vivo
Услуги доклинических исследований ксенотрансплантатов: более 50 проверенных моделей ксенотрансплантатов: Ссылка
Генерация стабильно экспрессирующих клеточных линий за 28 дней
Генерация стабильной клеточной линии РНКи
Доставка миРНК in vivo: миРНК, нацеленная на ткань
Инкапсуляция белков, РНК, мРНК и молекул ДНК в липосомы
Статьи и ссылки по исследованию астроцитов
- Характеристика клеток астроцитов в ответ на стимулы. В этом исследовании был разработан протокол для приготовления астроцитов крыс в культуре, а затем измерена их реакция на химические стимулы.

