Добавочная почечная артерия — причины, симптомы, диагностика, лечение и профилактика
Добавочная почечная артерия – это порок развития почечных сосудов, связанный с образованием дополнительного кровеносного сосуда, питающего почку. Таким образом кровоснабжение этого органа происходит сразу из двух артериальных стволов. Данное нарушение возникает в период эмбрионального развития. Эта патология встречается в 8 из 10 случаев аномалий почек и мочевыводящих путей.
Как правило, добавочная артерия имеет меньший калибр, чем основная. Но иногда оба сосуда почти равноценны. Добавочная артерия может идти от брюшной, почечной, чревной, диафрагмальной или подвздошной аорты. Подобных сосудов может быть несколько.
Если добавочная артерия (или сплетение добавочных артерий) проходит рядом с мочеточником, она может сдавливать его, нарушая отток мочи. Подобное состояние чревато серьезными осложнениями, такими как пиелонефрит, гидронефроз и пр.
Важно своевременно выявить и устранить данную патологию.
В урологическом отделении ММЦ ОН КЛИНИК работают опытные врачи-урологи, которые помогут вам грамотно решить проблему добавочной почечной артерии и избежать грозных осложнений.
Симптомы
Добавочная почечная артерия может никак не заявлять о себе, и тогда патология протекает бессимптомно. О наличии данного нарушения могут свидетельствовать следующие признаки:
- Ноющие боли в пояснице
- Расширение или закупорка мочевыводящих путей
- Образование камней в почках
- Хронические воспалительные процессы в почках
- Увеличение размера почки и гидронефроз
- Хроническое повышение артериального давления
- Гематурия (кровь в моче)
- Нарушение мочеиспускания (задержка мочи)
Скидка на первичный прием врача до 30 апреляАкция -15%
Первичный прием врача, по специализации которого вы ещё ни разу не были, в том числе ОН КЛИНИК Бейби, со скидкой – от 2 125 ₽ вместо 2 500 ₽.
Подробнее
Вартанов В.А.: лечение воспалительных процессов в урологии в ОН КЛИНИК
Диагностика
Своевременная диагностика и лечение добавочной почечной артерии поможет избежать тяжелых последствий. Диагностикой и лечением данной патологии занимается врач-уролог. Диагноз устанавливается на основании жалоб пациента, физикального осмотра, инструментальных и лабораторных исследований.
Существуют следующие методы диагностики добавочной почечной артерии:
- Экскреторная урография (рентгенологическое исследование функции мочевыделительной системы, проводимое с помощью контрастного вещества)
- УЗИ-диагностика (неинвазивное исследование внутренних органов с помощью ультразвуковых волн)
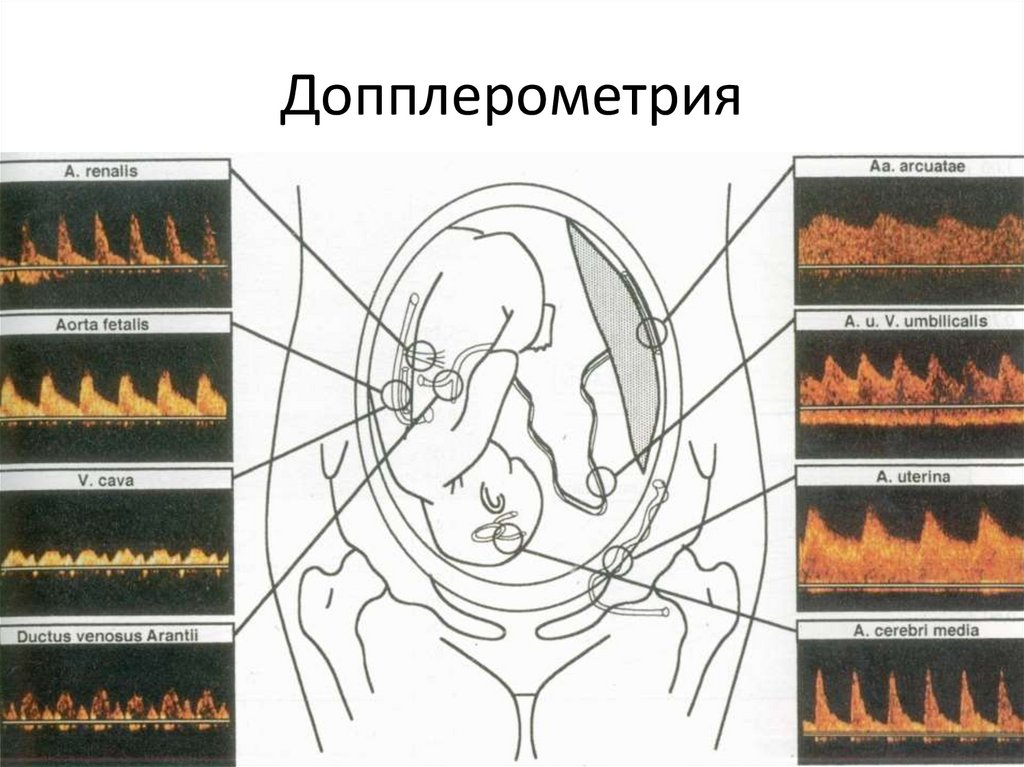
- Эходопплерография (неинвазивный метод исследования вен и артерий, демонстрирующий направление и скорость кровотока)
- Магнитно-резонансная томография (безопасное высокоинформативное исследование внутренних органов и тканей, использующее магнитное поле и радиоволны)
- Компьютерная томография (высокоинформативное рентгенологическое исследование)
Международный медицинский центр ОН КЛИНИК оснащен современным высокоточным оборудованием, которое поможет выявить и всесторонне исследовать данную патологию для достижения наилучшего результата лечения.
Добавочная почечная артерия является частой причиной различных заболеваний почек. Поэтому в диагностике важное значение имеют клинические анализы, позволяющие определить, как функционирует этот парный орган.
Основным методом лечения добавочной почечной артерии является операция по пресечению дополнительного сосуда. Перед оперативным вмешательством пациенту необходимо сдать следующие анализы:
- Общий анализ крови
- Общий анализ мочи
- Биохимическое исследование крови
- Коагулограмма
- Группа крови и резус-фактор
- Анализ на инфекционные болезни (гепатиты В и С, ВИЧ, сифилис)
Весь перечень исследований вы можете пройти в короткие сроки на базе современной и комфортабельной лаборатории нашей клиники.
Лечение
Клинический диагноз устанавливается после проведения всех необходимых исследований. Схема лечения подбирается индивидуально с учетом физиологических, генетических и психотипических особенностей пациента.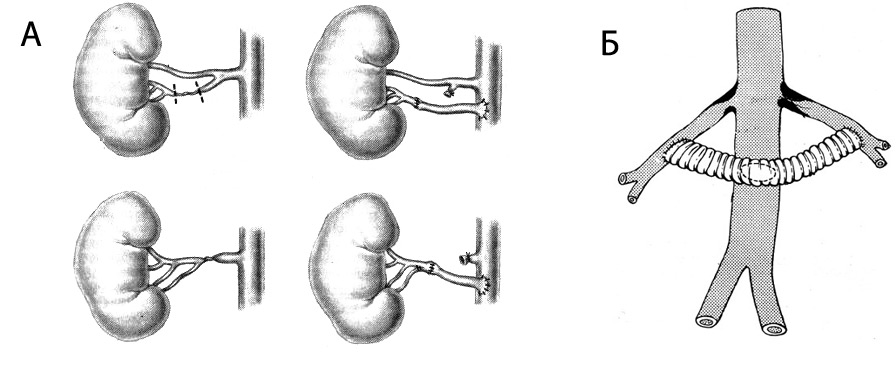
Все лечебные мероприятия направлены на решение важнейшей задачи – восстановить нормальный отток мочи из почки. Обычно для этого требуется резекция (пресечение) добавочного кровеносного сосуда. Если поражены ткани самой почки, они также могут быть удалены. Иссекаются и склеротически измененные участки мочевых путей. Если добавочный сосуд питает большую часть почки и резекция ее невозможна, производится резекция суженной части мочевых путей с последующей их пластикой.
Осложнения
Добавочная почечная артерия может стать причиной серьезных осложнений:
- Гидронефроз
- Мочекаменная болезнь
- Хроническая гипертензия
- Образование аневризм и их тромбозы
- Инфаркт почек
- Варикоцеле и пр.
Преимущества обращения в ОН КЛИНИК
- Опыт успешного лечения добавочной почечной артерии с 1993 года
- Высококвалифицированные врачи-урологи
- Современное высокоточное диагностическое и лечебное оборудование
- Высокотехнологичные и комфортабельные стационары
- Собственная клинико-диагностическая лаборатория, сертифицированная по европейским стандартам качества
- Многопрофильность, позволяющая привлекать врачей смежных специальностей
- Удобные расположение и график работы
- Гибкая система скидок
Случай диагностики и лечения внутрилегочной секвестрации у женщины 34 лет | Шулутко А.
 М., Ясногородский О.О., Талдыкин М.В., Качикин А.С., Гандыбина Е.Г., Винарская В.А., Мороз Н.Г., Катанэ Ю.А.К.
М., Ясногородский О.О., Талдыкин М.В., Качикин А.С., Гандыбина Е.Г., Винарская В.А., Мороз Н.Г., Катанэ Ю.А.К.Введение Секвестрация легкого – сравнительно редкий сложный порок развития. По данным различных авторов, он встречается у 0,8–2% больных с хроническими заболеваниями легких [1]. Среди всех аномалий развития легких частота секвестрации легких варьирует от 1,8 до 7,8% [2]. Впервые этот порок описал C. Rokitansky в 1856 г., сообщив о случае кистозно-измененной добавочной доли, расположенной у основания нормально развитого легкого. Pryce (1946) ввел в практику термин «секвестрация». Согласно Pryce, в эмбриональном периоде происходит врастание в легкое добавочной артерии, которая отделяет часть доли от других нормальных частей легкого. По данным литературы, до 1964 г. было описано 250 наблюдений пациентов с секвестрацией легкого [3–8].
Секвестрация легкого – сравнительно редкий сложный порок развития. По данным различных авторов, он встречается у 0,8–2% больных с хроническими заболеваниями легких [1]. Среди всех аномалий развития легких частота секвестрации легких варьирует от 1,8 до 7,8% [2]. Впервые этот порок описал C. Rokitansky в 1856 г., сообщив о случае кистозно-измененной добавочной доли, расположенной у основания нормально развитого легкого. Pryce (1946) ввел в практику термин «секвестрация». Согласно Pryce, в эмбриональном периоде происходит врастание в легкое добавочной артерии, которая отделяет часть доли от других нормальных частей легкого. По данным литературы, до 1964 г. было описано 250 наблюдений пациентов с секвестрацией легкого [3–8].
Среди всех аномалий развития легких частота секвестрации легких варьирует от 1,8 до 7,8% [2]. Впервые этот порок описал C. Rokitansky в 1856 г., сообщив о случае кистозно-измененной добавочной доли, расположенной у основания нормально развитого легкого. Pryce (1946) ввел в практику термин «секвестрация». Согласно Pryce, в эмбриональном периоде происходит врастание в легкое добавочной артерии, которая отделяет часть доли от других нормальных частей легкого. По данным литературы, до 1964 г. было описано 250 наблюдений пациентов с секвестрацией легкого [3–8].
В настоящее время внутрилегочная секвестрация определяется как порок развития, при котором часть легкого, отделившаяся на ранних стадиях эмбриогенеза от основного органа, развивается самостоятельно и имеет отдельное кровоснабжение из аорты или ее ветвей. В литературе встречаются различные названия этой патологии: «врожденная бронхопульмональная киста с аномальным сосудом», «бронхопульмональная диссоциация», «киста бронха в связи с аномальной артерией», «кистозный аденоматоз», «экстралобарное добавочное легкое», «сепарация легкого». Большинство авторов, описывающих этот порок развития, выделяют внутридолевую и внедолевую формы легочной секвестрации [9, 10]. В первом случае секвестрированная легочная ткань находится в нормальной легочной ткани, в то время как внелегочная секвестрация может располагаться как внутри плевральной полости, так и вне ее. По данным литературы, внутрилегочная секвестрация встречается в 6 раз чаще, нежели внелегочная.
Большинство авторов, описывающих этот порок развития, выделяют внутридолевую и внедолевую формы легочной секвестрации [9, 10]. В первом случае секвестрированная легочная ткань находится в нормальной легочной ткани, в то время как внелегочная секвестрация может располагаться как внутри плевральной полости, так и вне ее. По данным литературы, внутрилегочная секвестрация встречается в 6 раз чаще, нежели внелегочная.
Выделяют 2 типа внутрилегочной секвестрации: Pryce и Brigand-Dupres. При первом типе секвестрации отсутствуют долевой и сегментарный бронхи, а также соответствующие ветви легочной артерии. В легочной ткани определяется ограниченная кистозная масса с агенезией респираторных отделов. Аберрантный сосуд находится обычно в толще нижней легочной связки, возможно отхождение сосуда от грудного отдела аорты (60%), брюшного отдела аорты (30%), межреберной артерии (10%) [11]. Описаны случаи кровоснабжения секвестрированного участка легкого от межреберной артерии и a. mammaria [12]. Возможен более редкий вариант секвестрации по Pryce, характеризующийся сообщением кистозного участка с бронхиальным деревом. При типе секвестрации Brigand-Dupres бронхи и ветви легочной артерии сохранены, но сдвинуты кистозной массой, располагающейся, как правило, в толще нижней доли и питающейся от аорты через дополнительную артерию.
Возможен более редкий вариант секвестрации по Pryce, характеризующийся сообщением кистозного участка с бронхиальным деревом. При типе секвестрации Brigand-Dupres бронхи и ветви легочной артерии сохранены, но сдвинуты кистозной массой, располагающейся, как правило, в толще нижней доли и питающейся от аорты через дополнительную артерию.
Наиболее частая локализация внутрилегочной секвестрации – медиально-базальные отделы нижней доли правого легкого, хотя изредка встречаются и другие варианты.
Питающий аберрантный сосуд можно выявить при аортографии, томографии и компьютерной томографии. Иногда в виде случайной находки его обнаруживают во время операции. При сцинтиграфии легких отмечается уменьшение функционирующего капиллярного русла в секвестрированном участке легкого [11].
Длительное время заболевание может протекать бессимптомно (21,7%), впервые проявиться симптомами нагноения (74,1%), что часто расценивается как острое воспалительное заболевание, а последующие рецидивы – как проявление хронизации воспалительного процесса.
Сроки выявления пороков развития легких [13]:
– до 11 лет – 3,8%;
– 11–20 лет – 18,2%;
– 21–30 лет – 26,6%;
– 31–40 лет – 37,9%
– старше 40 лет –14%.
Наличие легочной секвестрации легкого (включая кистозную) при достаточном объеме функционирующей ткани легкого может не отражаться на общем состоянии и развитии ребенка. Недренирующиеся, заполненные секретом или другим содержимым образования (кисты), секвестрации легкого или плохо дренирующиеся полости (при кистозной гипоплазии и бронхоэктазии) являются фоном для развития в них воспалительных процессов. Осложнение порока нагноением обычно начинается как острое воспаление. Дальнейшее углубленное обследование, проводимое с настороженностью в отношении секвестрации, позволяет установить правильный диагноз.
Цель данной статьи – демонстрация поздней диагностики внутрилегочной секвестрации у женщины 34 лет.
Клинический случай
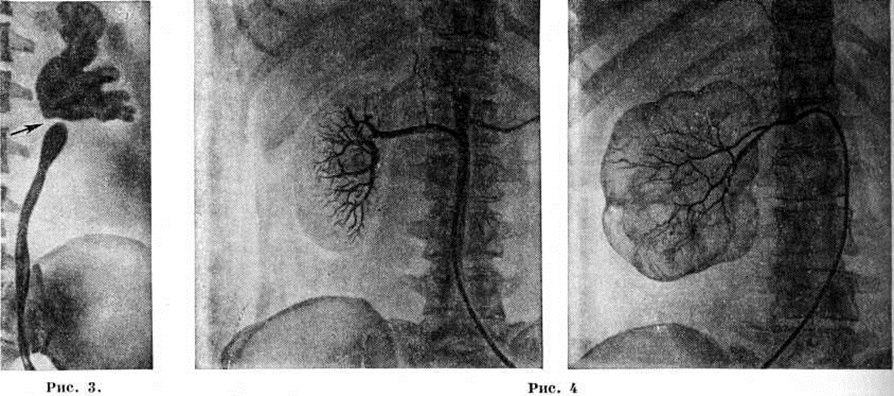
Больная П., 34 года, поступила в стационар 1 февраля 2012 г.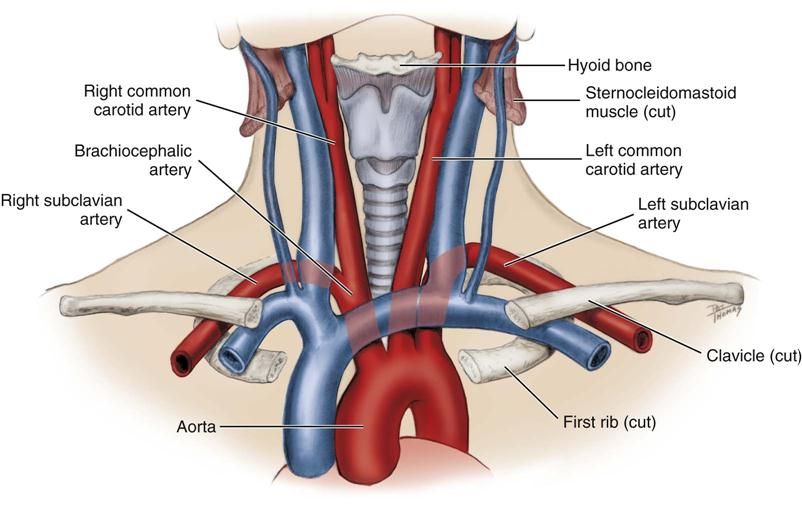 после приема торакальным хирургом на общегородской консультации. До того, с 9 января 2012 г. находилась на лечении в ГКБ № 71, где проводилась антибактериальная терапия по поводу левосторонней нижнедолевой пневмонии. Из анамнеза известно, что ухудшение состояния, проявившееся слабостью, лихорадкой до 38,5°С, малопродуктивным кашлем, появилось в начале января 2012 г. До 2012 г. из перенесенных заболеваний отмечает простудные, сообщила, что в возрасте 6 мес. перенесла пневмонию слева (выписки нет), в возрасте 5–6 лет проводилась плевральная пункция слева по поводу левостороннего плеврита (выписки также нет). Пациенткой предоставлены данные рентгенологического исследования грудной клетки (рис. 1, 2), компьютерной томографии (КТ) грудной клетки (рис. 3, 4).
после приема торакальным хирургом на общегородской консультации. До того, с 9 января 2012 г. находилась на лечении в ГКБ № 71, где проводилась антибактериальная терапия по поводу левосторонней нижнедолевой пневмонии. Из анамнеза известно, что ухудшение состояния, проявившееся слабостью, лихорадкой до 38,5°С, малопродуктивным кашлем, появилось в начале января 2012 г. До 2012 г. из перенесенных заболеваний отмечает простудные, сообщила, что в возрасте 6 мес. перенесла пневмонию слева (выписки нет), в возрасте 5–6 лет проводилась плевральная пункция слева по поводу левостороннего плеврита (выписки также нет). Пациенткой предоставлены данные рентгенологического исследования грудной клетки (рис. 1, 2), компьютерной томографии (КТ) грудной клетки (рис. 3, 4).
При поступлении в стационар состояние больной отмечалось как удовлетворительное. После курса проведенной антибактериальной терапии наблюдалось снижение температуры тела до 37,3°С в вечернее время, кашель редкий, непродуктивный, одышки нет. Дыхание аускультативно умеренно ослаблено в нижних отделах слева, там же единичные влажные мелкопузырчатые хрипы. Перкуторно звук легочный, умеренное притупление перкуторного звука в нижне-задних отделах слева. Прочие органы и системы органов – без патологии. АД – 110/65 мм рт. ст., частота сердечных сокращений – 76/мин, частота дыхания – 18/мин.
Дыхание аускультативно умеренно ослаблено в нижних отделах слева, там же единичные влажные мелкопузырчатые хрипы. Перкуторно звук легочный, умеренное притупление перкуторного звука в нижне-задних отделах слева. Прочие органы и системы органов – без патологии. АД – 110/65 мм рт. ст., частота сердечных сокращений – 76/мин, частота дыхания – 18/мин.
При рентгенографии грудной клетки (01.02.2012): в нижней доле левого легкого полостные образования с небольшими горизонтальными уровнями жидкости.
При рентгенологическом контроле (04.04.2012): очаговых и инфильтративных теней нет, определяется линия скобочного шва.
При КТ грудной клетки (07.02.2012): кистозные изменения нижней доли левого легкого с бронхоэктазами, по сравнению с КТ из ГКБ № 12 отмечена положительная динамика в виде уменьшения количества содержимого кист.
Сцинтиграфия легких (06.02.2012): снижение перфузии нижних отделов левого легкого.
Фибробронхоскопия (07.02.2012): эндообразований не выявлено, диффузный двусторонний бронхит, более выраженный в бронхах базальной пирамиды слева.
Фибробрамбиопсия: атипичные клетки, бациллы Коха – отрицательно, клетки бронхиального эпителия.
Эхо-КГ (10.02.2012): фракция выброса – более 60%, нарушений глобальной и локальной сократимости нет.
Функция внешнего дыхания (07.02.2012): нарушений вентиляционной функции легких нет.
УЗИ органов брюшной полости (06.02.2012): эхографических изменений не выявлено.
ЭКГ (динамика): ритм синусовый. Нормальное положение электрической оси сердца.
В клиническом анализе крови при поступлении: гемоглобин – 136 г/л, лейкоциты – 7,7, тромбоциты – 140, палочкоядерные – 1, сегментоядерные – 64, лимфоциты – 26, моноциты – 5, скорость оседания эритроцитов – 3 мм/ч.
Анализ крови на эхинококкоз – отрицательный.
Предоперационный диагноз: кистозная гипоплазия нижней доли левого легкого.
14 февраля 2012 г. больной в плановом порядке выполнено оперативное лечение – боковая торакотомия, нижняя лобэктомия слева.
Интраоперационно: плевральная полость облитерирована. Легкое выделено из спаек, нижняя доля – частично экстраплеврально. Верхняя доля воздушная, нижняя уменьшена в размерах, базальные сегменты ее плотные, инфильтрированы c внутрилегочными кистами различных размеров. В области нижней легочной связки – дополнительный артериальный сосуд в нижней доле, отходящий от грудной аорты над диафрагмой до 2 см в диаметре (внутрилегочная секвестрация). Ткань нижней доли отделена от верхней при помощи аппарата УДО-60. Дополнительный артериальный сосуд пересечен при помощи аппаратов УДО-20. Проведена нижняя лобэктомия с раздельной обработкой элементов корня доли. Бронх прошит УДО–60. Для уменьшения объема плевральной полости выполнена френикотрипсия (рис. 5).
Легкое выделено из спаек, нижняя доля – частично экстраплеврально. Верхняя доля воздушная, нижняя уменьшена в размерах, базальные сегменты ее плотные, инфильтрированы c внутрилегочными кистами различных размеров. В области нижней легочной связки – дополнительный артериальный сосуд в нижней доле, отходящий от грудной аорты над диафрагмой до 2 см в диаметре (внутрилегочная секвестрация). Ткань нижней доли отделена от верхней при помощи аппарата УДО-60. Дополнительный артериальный сосуд пересечен при помощи аппаратов УДО-20. Проведена нижняя лобэктомия с раздельной обработкой элементов корня доли. Бронх прошит УДО–60. Для уменьшения объема плевральной полости выполнена френикотрипсия (рис. 5).
Послеоперационный период протекал гладко. Проведен курс антибактериальной профилактики: цефепим 2 г периоперационно, далее по 2 г 2 р./сут в течение 7 дней. По дренажам из плевральной полости в первые сутки послеоперационного периода выделилось 400 мл серозно-геморрагической жидкости, в течение 6 дней количество отделяемого за сутки уменьшилось до 40 мл. Дренажи удалены на 6 сут после операции, осмотрены, целостность их не нарушена.
Дренажи удалены на 6 сут после операции, осмотрены, целостность их не нарушена.
Торакотомная рана зажила первичным натяжением.
Патогистологическое исследование № 435/22: внутридолевая секвестрация легкого, представленная участком аномально развитой легочной ткани с группами разновеликих кист бронхогенного типа. К описанному участку легкого подходит крупный артериальный сосуд. Плевра с плотными и рыхлыми фиброзными спайками, фибринозно-гнойными наложениями.
При контрольном осмотре через 1 мес.: жалобы на умеренные боли в области торакотомного разреза (рубец без признаков воспаления), температура тела в норме. Рентгенологически определяется линия скобочного шва, очаговых и инфильтративных теней нет.
При контрольном осмотре через 12 мес. жалоб нет. Рентгенологически определяется линия скобочного шва, очаговых и инфильтративных теней нет.
Приведенный пример свидетельствует о вариабельности сроков появления клинической картины, обусловливаемой наличием внутрилегочной секвестрации, а также о необходимости понимания того, что данная патология может впервые проявиться не только у детей, но и у пациентов старших возрастных групп. Остается актуальным положение о необходимости крайней аккуратности при вмешательстве у больных с поражением нижних отделов легкого, возможности прохождения аберрантного сосуда в легочной связке, от любой части диафрагмы, межреберной артерии [14].
Остается актуальным положение о необходимости крайней аккуратности при вмешательстве у больных с поражением нижних отделов легкого, возможности прохождения аберрантного сосуда в легочной связке, от любой части диафрагмы, межреберной артерии [14].
Литература
1. Исаков Ю.Ф., Степанов Э.А., Гераськин В.И. Руководство по торакальной хирургии у детей. М.: Медицина, 1978.
2. Марчук И.К. // Клиническая хирургия. 1981. № 10. С. 22–24.
3. Бородулин Б.Е., Гелашвили П.А., Бородулина Е.А., Подсевалова Н.В. // Пороки развития и наследственные заболевания легких: Учебное пособие. Самара, 2003.
4. Картавова В.А., Левашев Ю.Н., Некласов Ю.Ф. и соавт. // Грудная хирургия. 1984. № 5. С. 31–36.
5. Королев Б.А., Шахов Б.Е., Павлунин А.В. Аномалии и пороки развития легких. Н. Новгород: НГМА 2000.
6. Рокицкий М.Р., Гребнев П.Н., Осипов А.Ю. Секвестрация легкого // Детская хирургия. 1998. № 1. С. 54–57.
7. Феофилов Г. Л., Хроменков И.Х. // Сов. мед. 1970. № 8. С. 147–148.
Л., Хроменков И.Х. // Сов. мед. 1970. № 8. С. 147–148.
8. Феофилов Г.Л. // Грудная хирургия. 1977. № 3. С. 68–72.
9. Слепуха М.И., Горовенко Г.Г., Клименко В.И. // Грудная хирургия. 1980. № 5. С. 74–77.
10. Дужий И.Д., Тертышный Н.Г. О легочной секвестрации // Клиническая хирургия. 1989. № 10. С. 35–36.
11. Харитонов В.А. Кровоснабжение при внутридолевой секвестрации легкого // Грудная хирургия. 1990. № 3. С. 73–74.
12. Королев Б.А., Широкова А.П., Чернова Р.И. и др. Хирургическое лечение заболеваний легких и плевры // Хирургия. 1987. № 11. С. 110–116.
13. Сазонов А.М., Цуман В.Г., Романов Г.А. Аномалии развития легких и их лечение. М.: Медицина, 1981.
14. Харитонов В.А. Некоторые особенности интралобарной секвестрации // Врачебное дело. 1989. № 7. С. 58–59.
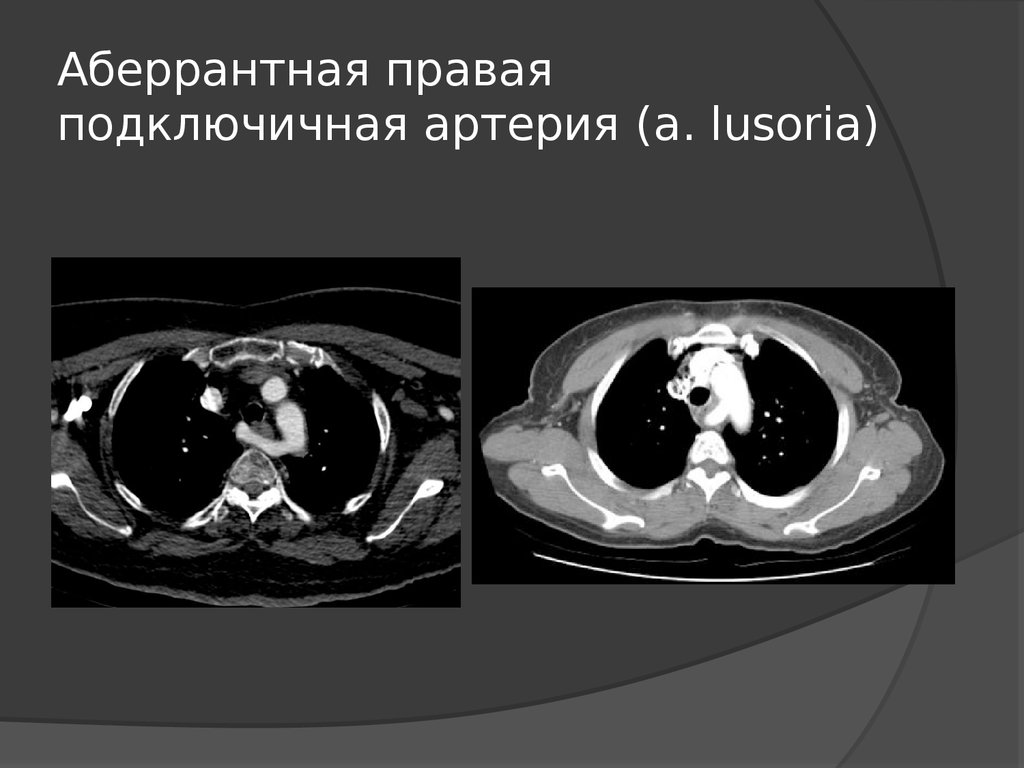
Аберрантная правая подключичная артерия (Arteria Lusoria): морфологические и клинические аспекты одного из наиболее важных вариантов — систематическое исследование 141 отчета
1. Molz G, Burri B. Аберрантная подключичная артерия ( Arteria lusoria ): половые различия в распространенности различных форм порока развития. Оценка 1378 наблюдений. Архив Вирхова A: Патологическая анатомия и гистология . 1978;380(4):303–315. [PubMed] [Google Scholar]
Molz G, Burri B. Аберрантная подключичная артерия ( Arteria lusoria ): половые различия в распространенности различных форм порока развития. Оценка 1378 наблюдений. Архив Вирхова A: Патологическая анатомия и гистология . 1978;380(4):303–315. [PubMed] [Google Scholar]
2. Hunauld PM. Examen de quelques party d’un singe. История Королевской академии наук . 1735; 2: 516–523. [Google Scholar]
3. Бэйфорд Д. Отчет об особом случае затрудненного глотания . Лондон, Великобритания: Мемуары Лондонского медицинского общества; 1787. [Google Scholar]
4. Kommerell B. Verlagerung des Osophagus durch eine abnorm verlaufende Arteria subclavia dextra (Arteria Lusoria) Fortschritte auf dem Gebiete der Röntgenstrahlen . 1936; 54: 590–595. [Академия Google]
5. Inami T, Seino Y, Mizuno K. Уникальный случай гигантского дивертикула Коммерелла с аберрантной левой подключичной артерией, отходящей от левой дуги аорты, связанной с обратным расположением. Международный журнал кардиологии . 2013;163(3):e47–e48. [PubMed] [Google Scholar]
Международный журнал кардиологии . 2013;163(3):e47–e48. [PubMed] [Google Scholar]
6. Kopp R, Wizgall I, Kreuzer E, et al. Хирургическое и эндоваскулярное лечение симптоматической аберрантной правой подключичной артерии (arteria lusoria) Сосудистая . 2007;15(2):84–91. [PubMed] [Академия Google]
7. Джайн К.К., Браз А.Дж., Шапиро М.А., Перес-Тамайо Р.А. Аберрантный правый подключичный артериально-пищеводный свищ и тяжелое желудочно-кишечное кровотечение после хирургической коррекции ятаганного синдрома. Журнал Техасского института сердца . 2012;39(4):571–574. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Delap TG, Jones SE, Johnson DR. Аневризма аберрантной правой подключичной артерии с проявлениями лузорической дисфагии. Анналы отологии, ринологии и ларингологии . 2000;109(2): 231–234. [PubMed] [Google Scholar]
9. Клинкхамер А.С. Беррант правой подключичной артерии. Клинические и рентгенологические аспекты. Американский журнал рентгенологии, радиевой терапии и ядерной медицины . 1966; 97 (2): 438–446. [PubMed] [Google Scholar]
Американский журнал рентгенологии, радиевой терапии и ядерной медицины . 1966; 97 (2): 438–446. [PubMed] [Google Scholar]
10. Hartyánszky IL, Lozsadi K, Marcsek P, Hüttl T, Sápi E, Kovács AB. Врожденные сосудистые кольца: хирургическое лечение 111 случаев. Европейский журнал кардио-торакальной хирургии . 1989;3(3):250–254. [PubMed] [Академия Google]
11. Эпштейн Д.А., Деборд Дж.Р. Аномалии, связанные с аберрантными правыми подключичными артериями: клинический случай. Сосудистая и эндоваскулярная хирургия . 2002;36(4):297–303. [PubMed] [Google Scholar]
12. Kieffer E, Bahnini A, Koskas F. Аберрантная подключичная артерия: хирургическое лечение тридцати трех взрослых пациентов. Журнал сосудистой хирургии . 1994;19(1):100–111. [PubMed] [Google Scholar]
13. Келли, доктор медицины. Эндоскопия и аберрантная правая подключичная артерия. Американский хирург . 2007;73(12):1259–1261. [PubMed] [Google Scholar]
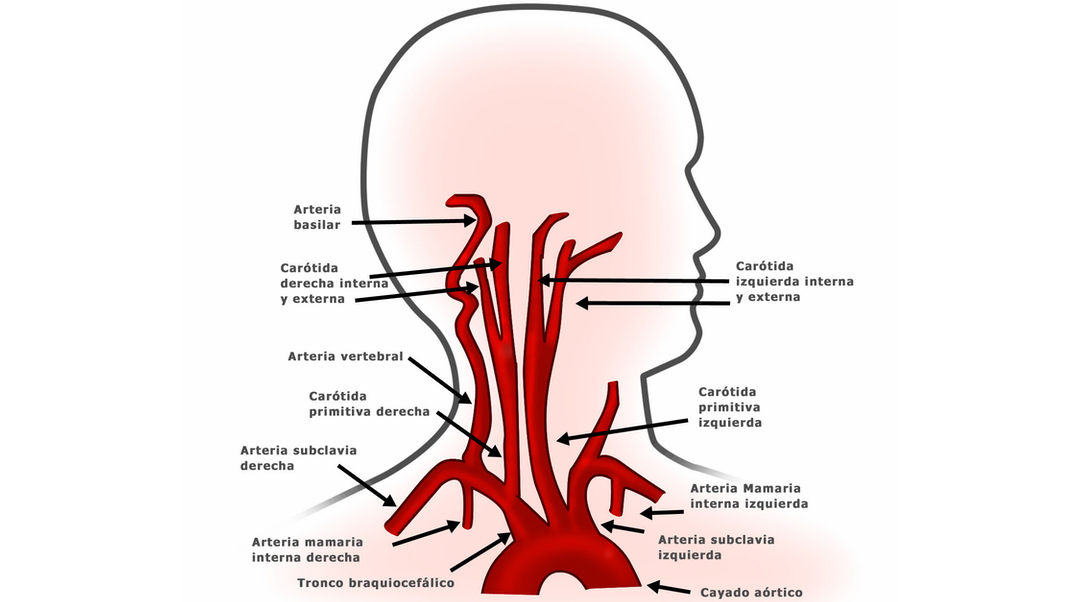
14. Нацис К.И., Цитуридис И.А., Дидагелос М.В., Филлипидис А.А., Власис К.Г., Цикарас П.Д. Анатомические вариации ветвей дуги аорты человека в 633 ангиографиях: клиническое значение и обзор литературы. Хирургическая и радиологическая анатомия . 2009;31(5):319–323. [PubMed] [Google Scholar]
Нацис К.И., Цитуридис И.А., Дидагелос М.В., Филлипидис А.А., Власис К.Г., Цикарас П.Д. Анатомические вариации ветвей дуги аорты человека в 633 ангиографиях: клиническое значение и обзор литературы. Хирургическая и радиологическая анатомия . 2009;31(5):319–323. [PubMed] [Google Scholar]
15. Abhaichand RK, Louvard Y, Gobeil JF, Loubeyre C, Lefvre T, Morice M. Проблема красной артерии при правосторонней трансрадиальной коронарной ангиографии и ангиопластике. Катетеризация и сердечно-сосудистые вмешательства . 2001;54(2):196–201. [PubMed] [Google Scholar]
16. de Luca L, Bergman JJGHM, Tytgat GNJ, Fockens P. EUS визуализация красной артерии: серия случаев и обзор. Эндоскопия желудочно-кишечного тракта . 2000;52(5):670–673. [PubMed] [Google Scholar]
17. Nie B, Zhou Y, Li G, Shi D, Wang J. Клиническое исследование артериальных анатомических вариаций при трансрадиальной коронарной операции у населения Китая. Китайский медицинский журнал .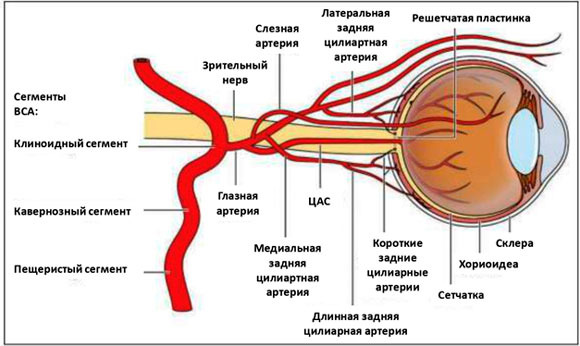 2009;122(18):2097–2102. [PubMed] [Google Scholar]
2009;122(18):2097–2102. [PubMed] [Google Scholar]
18. Saito T, Tamatsukuri Y, Hitosugi T, et al. Три случая ретроэзофагеальной правой подключичной артерии. Журнал Медицинской школы Японии . 2005;72(6):375–382. [PubMed] [Google Scholar]
19. Haesemeyer SW, Gavant ML. Визуализация острого травматического разрыва аорты у пациентов с аберрантной правой подключичной артерией. Американский журнал рентгенологии . 1999;172(1):117–120. [PubMed] [Академия Google]
20. Cainey J. Извитость шейного сегмента внутренней сонной артерии. Анатомический журнал . 1924; 59 (1): 87–96. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Singh S, Grewal PD, Symons J, Ahmed A, Khosla S, Arora R. Люзория дисфагии у взрослых, вторичная по отношению к расслаивающей аберрантной правой подключичной артерии, связанной с типом B острое расслоение аорты. Канадский журнал кардиологии . 2008;24(1):63–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Nakajima Y, Nishibatake M, Ikeda K, Momma K, Takao A, Terai M. Аномальное развитие производных четвертой дуги аорты в патогенезе тетрады Фалло. Детская кардиология . 1990;11(2):69–71. [PubMed] [Google Scholar]
Nakajima Y, Nishibatake M, Ikeda K, Momma K, Takao A, Terai M. Аномальное развитие производных четвертой дуги аорты в патогенезе тетрады Фалло. Детская кардиология . 1990;11(2):69–71. [PubMed] [Google Scholar]
23. Bergwerff M, DeRuiter MC, Hall S, Poelmann RE, Gittenberger-de Groot AC. Уникальная сосудистая морфология четвертой дуги аорты: возможное значение для патогенеза разрыва дуги аорты типа B и аномалии правой подключичной артерии. Сердечно-сосудистые исследования . 1999;44(1):185–196. [PubMed] [Google Scholar]
24. Lewin MB, Lindsay EA, Jurecic V, Goytia V, Towbin JA, Baldini A. Генетическая этиология разрыва дуги аорты типа B. American Journal of Cardiology . 1997;80(4):493–497. [PubMed] [Google Scholar]
25. Базиль А., Ломошиц Ф., Ламмер Дж. Трансбрахиальное стентирование критической устьевой артерии при люзориозном стенозе. Журнал эндоваскулярной терапии . 2003;10(4):829–832. [PubMed] [Google Scholar]
26. Schneider J, Baier R, Dinges C, Unger F. Ретроэзофагеальная правая подключичная артерия (лузория) как источник травматического разрыва аорты. Европейский журнал кардио-торакальной хирургии . 2007;32(2):385–387. [PubMed] [Google Scholar]
Schneider J, Baier R, Dinges C, Unger F. Ретроэзофагеальная правая подключичная артерия (лузория) как источник травматического разрыва аорты. Европейский журнал кардио-торакальной хирургии . 2007;32(2):385–387. [PubMed] [Google Scholar]
27. Пури С.К., Гуман С., Наранг П., Шарма А., Сингх С. КТ и МР-ангиография при люзориальной дисфагии у взрослых. Индийский журнал радиологии и визуализации . 2005;15(4):497–501. [Академия Google]
28. van Son JAM, Julsrud PR, Hagler DJ и др. Хирургическое лечение сосудистых колец: опыт клиники Майо. Материалы клиники Мэйо . 1993;68(11):1056–1063. [PubMed] [Google Scholar]
29. McNally PR, Rak KM. Люзорическая дисфагия, вызванная персистирующей правой дугой аорты с аберрантной левой подключичной артерией и дивертикулом Коммерелла. Болезни органов пищеварения и науки . 1992;37(1):144–149. [PubMed] [Google Scholar]
30. Ulger Z, Ozyurek AR, Levent E, Gurses D, Parlar A. Arteria lusoria как причина дисфагии.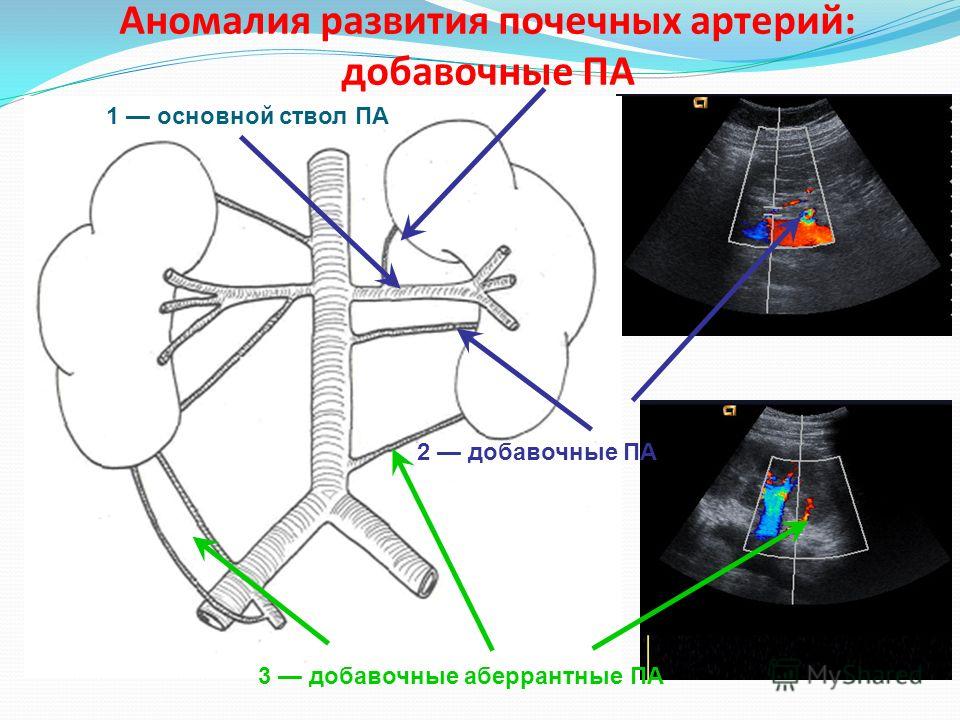 Acta Cardiologica . 2004;59(4):445–447. [PubMed] [Google Scholar]
Acta Cardiologica . 2004;59(4):445–447. [PubMed] [Google Scholar]
31. Левитт Б., Рихтер Дж. Э. Люзорическая дисфагия: всесторонний обзор. Болезни пищевода . 2007;20(6):455–460. [PubMed] [Google Scholar]
32. Janssen M, Baggen MGA, Veen HF, et al. Дисфагия люзория: клинические аспекты, манометрические данные, диагностика и терапия. Американский журнал гастроэнтерологии . 2000;95(6):1411–1416. [PubMed] [Google Scholar]
33. van Son JAM, Mierzwa M, Mohr FW. Резекция атеросклеротической аневризмы в месте отхождения аберрантной правой подключичной артерии. Европейский журнал кардио-торакальной хирургии . 1999;16(5):576–579. [PubMed] [Google Scholar]
34. Роджерс А.Д., Нел М., Элофф Э.П., Найду Н.Г. Дисфагия люзория: случай аберрантной правой подключичной артерии и бикаротидного ствола. ISRN Хирургия . 2011;2011:6 страниц.819295 [PMC free article] [PubMed] [Google Scholar]
35. Saeed G, Ganster G, Friedel N.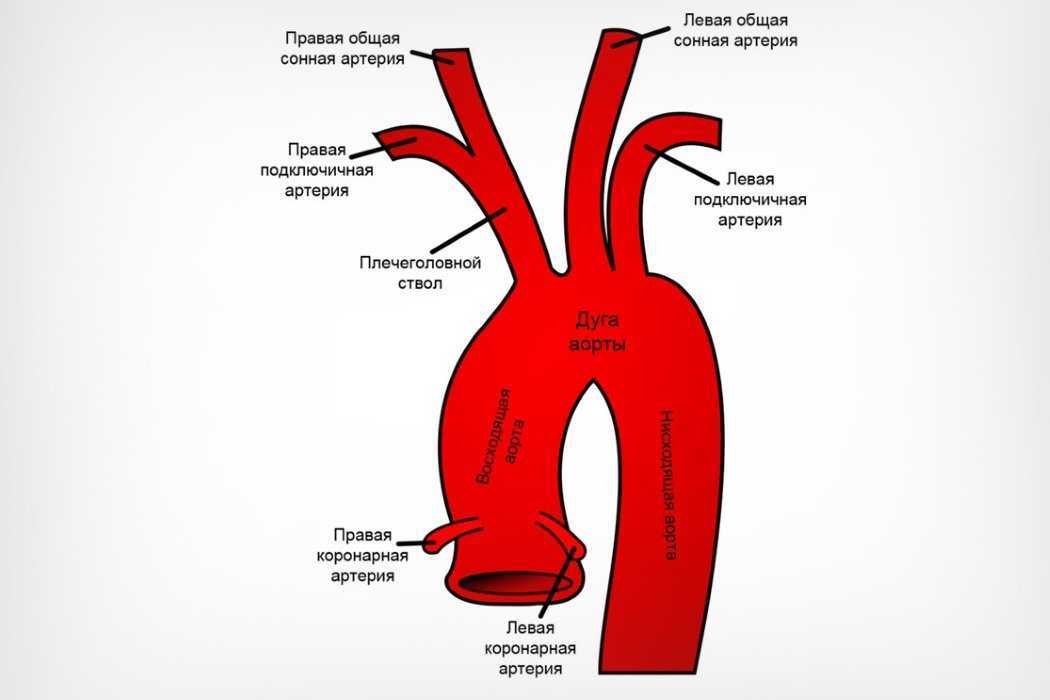 Аневризма просветной артерии с бикаротическим стволом: хирургическая резекция без восстановления кровоснабжения правой руки . Журнал Техасского института сердца . 2010;37(5):602–607. [PMC free article] [PubMed] [Google Scholar]
Аневризма просветной артерии с бикаротическим стволом: хирургическая резекция без восстановления кровоснабжения правой руки . Журнал Техасского института сердца . 2010;37(5):602–607. [PMC free article] [PubMed] [Google Scholar]
36. Илиевский Н., Ненезич Д., Попов П., Сагич Д., Радак Д. Изображения в сосудистой медицине: Гигантская аневризма аберрантной правой подключичной артерии (arteria lusoria) Сосудистая Медицина . 2011;16(2):157–158. [PubMed] [Google Scholar]
37. Yang M, Mo X, Jin J, et al. Диагностическая ценность 64-кратной мультиспиральной КТ при типировании врожденной аномалии аорты у новорожденных и детей грудного возраста. Чжунхуа И Сюэ За Чжи . 2010;90(31):2167–2171. [PubMed] [Google Scholar]
38. Chen X, Qu YJ, Peng ZY, Lu JG, Ma XJ. Диагностика врожденных аномалий дуги аорты у китайских детей с помощью мультидетекторной компьютерной томографической ангиографии. Журнал Хуачжунского университета науки и технологий: медицинские науки .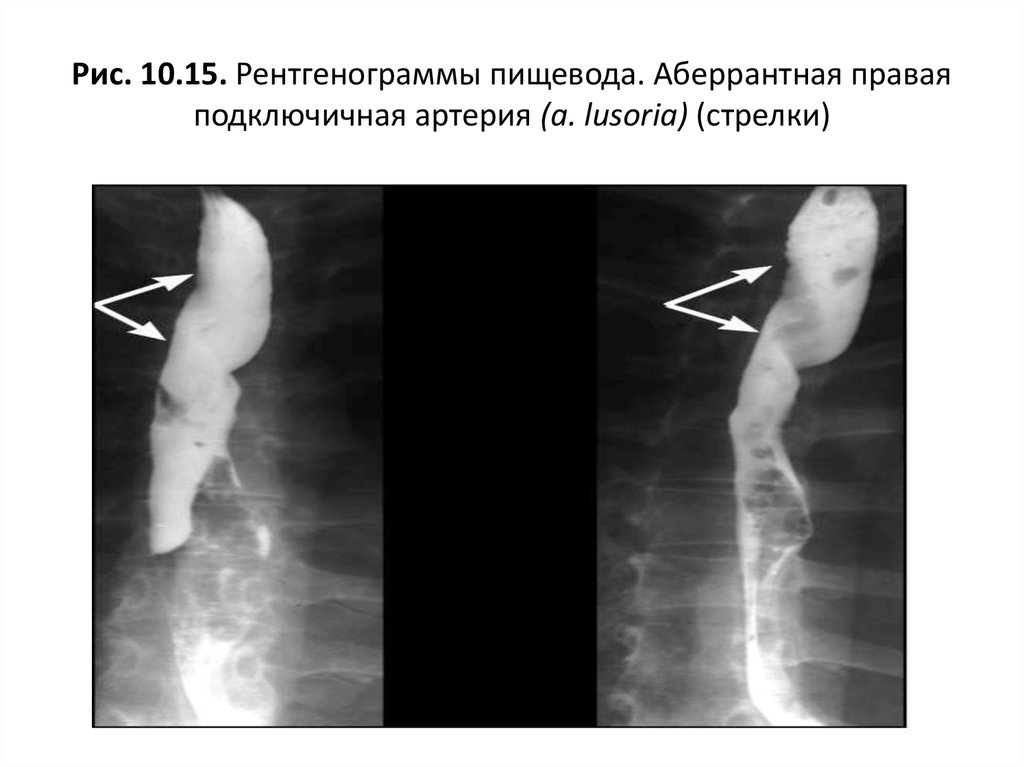 2013;33(3):447–451. [PubMed] [Google Scholar]
2013;33(3):447–451. [PubMed] [Google Scholar]
39. Branscom JJ, Austin JHM. Аберрантная правая подключичная артерия. Данные на обзорной рентгенограмме органов грудной клетки. Американский журнал рентгенологии . 1973;119(3):539–542. [PubMed] [Google Scholar]
40. Гросс RE. Хирургическое лечение люзорийной дисфагии. Анналы хирургии . 1946; 124: 532–534. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Fukuhara S, Patton B, Yun J, Bernik T. Новый метод лечения дисфагии lusoria из-за аберрантной правой подключичной артерии. Интерактивная сердечно-сосудистая и торакальная хирургия . 2013;16(3):408–410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Gafoor S, Stelter W, Bertog S, Sievert H. Полностью чрескожное лечение аберрантной правой подключичной артерии и аневризмы грудной аорты. Сосудистая медицина . 2013;18(3):139–144. [PubMed] [Google Scholar]
43. Southard NM, Seabrook GR, Tutton SM, et al. Уникальный гибридный подход к лечению аберрантной аневризмы правой подключичной артерии. Сосудистая и эндоваскулярная хирургия . 2013;47(2):128–130. [PubMed] [Google Scholar]
Уникальный гибридный подход к лечению аберрантной аневризмы правой подключичной артерии. Сосудистая и эндоваскулярная хирургия . 2013;47(2):128–130. [PubMed] [Google Scholar]
44. Lee CY, Moraca RJ, Benckart DH, Bailey SH, MaGovern GJ, Jr., Muluk S. Эндоваскулярное восстановление грудной аорты аберрантной правой подключичной артерии: техника и отдаленные результаты. Журнал кардиохирургии . 2010;25(4):390–393. [PubMed] [Google Scholar]
45. Folkmann S, Waldenberger F, Weiss G, et al. Гибридное лечение пациента с острым аортальным синдромом и аберрантной правой подключичной артерией. Сосудистая и эндоваскулярная хирургия . 2013;47(8):645–647. [PubMed] [Google Scholar]
46. Desvant C, Chevalier D, Mortuaire G. Трахеотомическое кровотечение из необычного трахео-артериального свища: вовлечение аберрантной правой подключичной артерии. Журнал ларингологии и отологии . 2010;124(12):1333–1336. [PubMed] [Google Scholar]
47. Valsecchi O, Vassileva A, Musumeci G, et al. Неэффективность трансрадиального доступа при коронарных вмешательствах: анатомические соображения. Катетеризация и сердечно-сосудистые вмешательства . 2006;67(6):870–878. [PubMed] [Google Scholar]
Valsecchi O, Vassileva A, Musumeci G, et al. Неэффективность трансрадиального доступа при коронарных вмешательствах: анатомические соображения. Катетеризация и сердечно-сосудистые вмешательства . 2006;67(6):870–878. [PubMed] [Google Scholar]
48. Huang I, Hwang H, Li S, Chen CKH, Liu C, Wu M. Диссекция красной артерии с помощью трансрадиальной коронарной катетеризации: редкое осложнение, оцениваемое с помощью мультидетекторной КТ. Журнал Китайской медицинской ассоциации . 2009;72(7):379–381. [PubMed] [Google Scholar]
49. Nakatani T, Tanaka S, Mizukami S, Okamoto K, Shiraishi T, Nakamura T. Ретроэзофагеальная правая подключичная артерия, отходящая от дуги аорты дистальнее и дорсальнее левой подключичной артерии. Анналы анатомии . 1996;178(3):269–271. [PubMed] [Google Scholar]
50. Kaidoh T, Inoué T. Одновременное возникновение аберрантной правой подключичной артерии и добавочной доли печени. Международная анатомическая наука .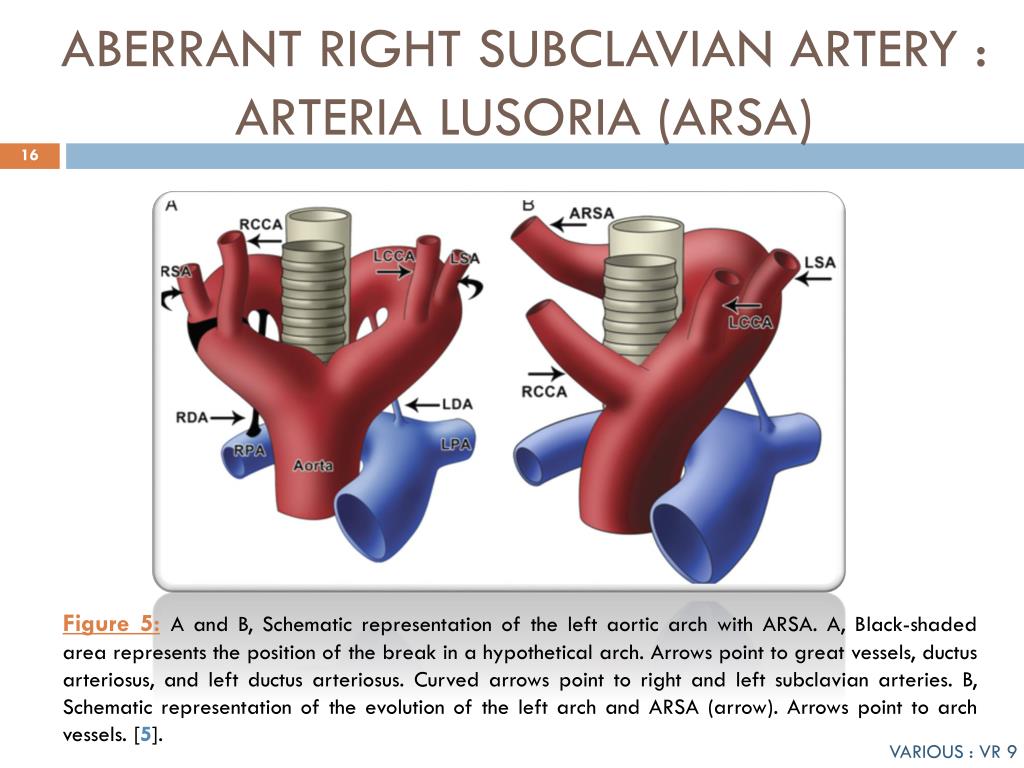 2011;86(3):171–174. [PubMed] [Google Scholar]
2011;86(3):171–174. [PubMed] [Google Scholar]
Когда лучше вмешаться? – Проконсультируйтесь с QD
Для пациентов с аберрантной правой подключичной артерией (ARSA) решение о вмешательстве лучше всего принимать индивидуально, основываясь на наличии или отсутствии симптомов и осложнений. Так завершается обзор недавнего опыта Кливлендской клиники с ARSA, в котором отмечается, что бессимптомные пациенты, у которых ARSA не является аневризматической, могут не нуждаться в вмешательстве и могут безопасно наблюдаться с помощью серийной визуализации. Исследование было опубликовано в Журнал сосудистой хирургии (2022; 75: 1343-1348).
«Ключевой проблемой лечения ARSA было отсутствие стандартизации в том, как измерять проявления эктатической или аневризмальной болезни, а также в показаниях для вмешательства у пациентов без симптомов», — говорит сосудистый хирург Cleveland Clinic Фрэнсис Капуто, доктор медицинских наук. «Ввиду нехватки исследований по лечению ARSA команда из нашего отделения сосудистой хирургии приступила к изучению нашего опыта лечения пациентов с этим заболеванием и показаний к хирургическому лечению».
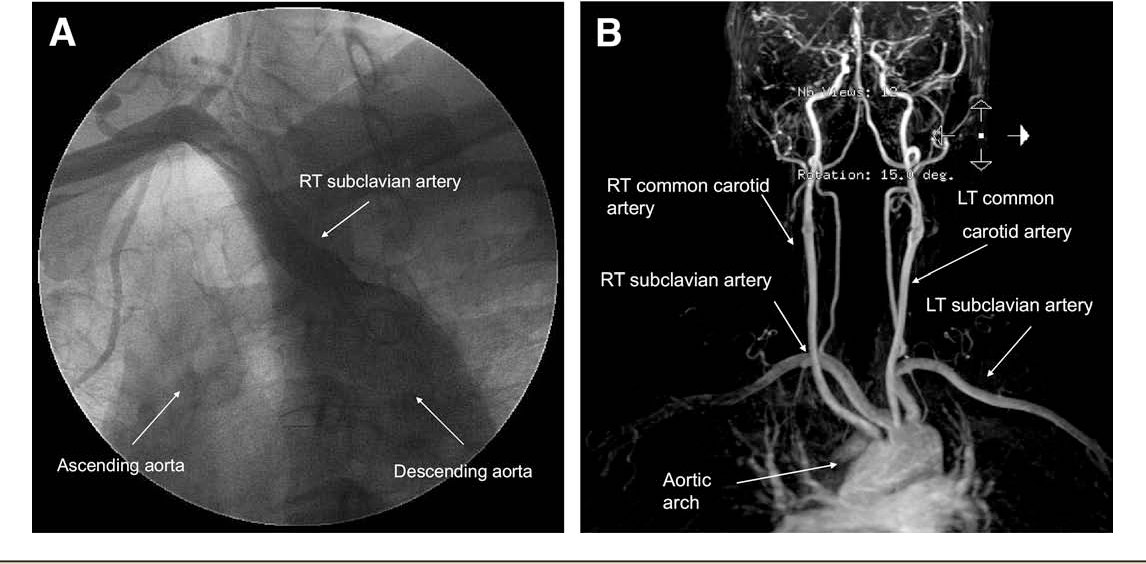
ARSA essentials
ARSA (изображенный на изображении выше) — это удивительно распространенная аномалия дуги аорты, встречающаяся примерно у 1% населения в целом. Это происходит в результате аномального запутывания анатомии аорты, из-за которого правая подключичная артерия отходит от нисходящей грудной аорты чуть дистальнее левой подключичной артерии. Различия в том, где заканчивается аберрантная артерия, могут привести к разнообразным клиническим проявлениям.
На сегодняшний день литература предполагает, что ARSA демонстрирует небольшое преобладание женского пола и протекает бессимптомно у большинства пациентов. Симптомы чаще всего появляются в возрасте около 50 лет, наиболее распространенными из которых являются дисфагия, одышка и боль в груди.
Когда АРСА имеет эктатическое или аневризматическое происхождение, он известен как дивертикул Коммерелла. Согласно литературным данным, от 20% до 43% случаев ОРСА связаны с дивертикулом Коммерелла, отмечают авторы исследования Кливлендской клиники.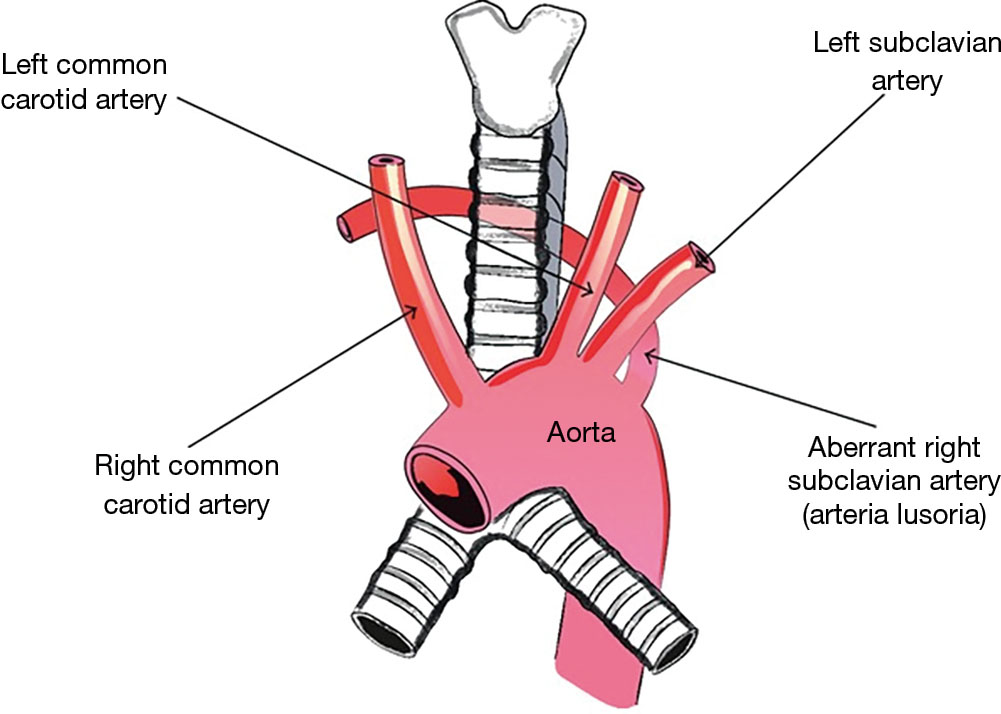
Рекламная политика
Краткое исследование
Исследователи изучили записи всех пациентов клиники Кливленда с диагнозом АРСА за последний 11-летний период (2009-2019). КТ пациентов были проанализированы ретроспективно, при этом диаметры аорты и ARSA были измерены в 10 различных сегментах. Были собраны демографические данные и информация о сопутствующих заболеваниях и оперативных вмешательствах.
Из 32 идентифицированных пациентов с ARSA у двух не было проведено недостаточно визуализирующих исследований, поэтому для включения в анализ осталось 30 пациентов. Эта группа состояла из 57% женщин и имела средний возраст 54,5 года.
Две трети когорты (20/30) подверглись хирургическому лечению при поступлении, остальные 10 пациентов первоначально лечились под наблюдением. Из этих 10 пациентов четырем позже потребовалось вмешательство, в результате чего в когорте было проведено в общей сложности 24 оперативных вмешательства. Тринадцать (54%) из этих вмешательств были гибридными вмешательствами, которые включали шунтирование или транспозицию правой сонной/подключичной артерий и эндоваскулярную пластику грудной аорты.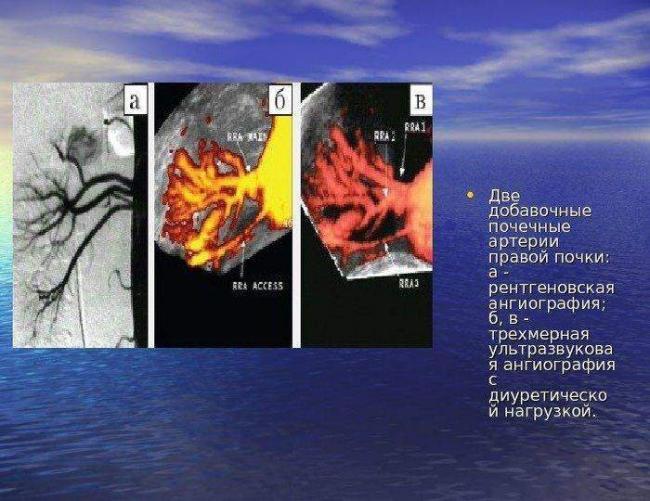 Средний срок наблюдения пациентов, находившихся под наблюдением, составил 4,1 ± 3,5 года.
Средний срок наблюдения пациентов, находившихся под наблюдением, составил 4,1 ± 3,5 года.
Ключевые результаты анализа включают следующее:
Рекламная политика
- Симптомами или находками, наиболее часто требующими процедурного вмешательства, были дисфагия, дивертикул Коммерелла или сопутствующее расслоение аорты или аневризматическая дегенерация при поступлении.
- Средний диаметр поперечного сечения в месте возникновения ARSA составлял 20,4 ± 5,7 мм и существенно не отличался между пациентами, перенесшими операцию при поступлении, и теми, кто наблюдался первоначально.
- Среди 10 пациентов, находившихся под наблюдением, наибольшее изменение диаметра сегмента аорты наблюдалось на 1 см дистальнее устья сосуда, при этом увеличение диаметра в этом месте было больше у тех, кому потребовалось последующее вмешательство, по сравнению с теми, кто продолжал наблюдение (3,05 мм). /год против 0,09 мм/год, P = 0,002). У пациентов, нуждающихся в вмешательстве, достоверных изменений диаметров поперечных сечений в других сегментах не наблюдалось.

- Статистически значимых изменений годовой скорости роста сегментов аорты или ARSA не наблюдалось в общей когорте или у пациентов, подвергшихся вмешательству.
Еще несколько идей, но вопросы остаются
Доктор Капуто отмечает, что у большинства пациентов, которые лечились под наблюдением, симптомы не развивались или не требовалось вмешательства в течение четырехлетнего периода наблюдения. «Это говорит о том, что пациенты с аберрантной подключичной правой артерией с нормальными контурами и отсутствием признаков эктазии или аневризматической дегенерации могут не нуждаться в вмешательстве при отсутствии симптомов, — отмечает он, — хотя, безусловно, показано ежегодное серийное визуализирующее наблюдение». Однако он добавляет, что для более точного определения этого необходимы проспективные данные.
Вывод о том, что диаметры поперечного сечения аорты и ARSA не отличались между группами вмешательства и группами наблюдения, поддерживает подход к вмешательству, основанный в первую очередь на симптомах или осложнениях, связанных с аортой, утверждают авторы исследования.